1.本发明属于微流控技术领域,具体涉及一种聚合物微流控通道及其制备方法与应用。
背景技术:
2.微流控(microfluidics)指的是使用微管道(尺寸为数十到数百微米)处理或操纵微小流体(体积为纳升到阿升)的系统所涉及的科学和技术,其可以实现将生物、化学、医学分析过程的样品制备、反应、分离、检测等基本操作单元集成到一块几平方厘米大小的芯片上,自动完成分析全过程。其中的流体通道特征尺寸在数十到数百微米。微流控具有样品/试剂消耗少、分析速度快、集成度高及可即用即弃等优点,已成为当今世界范围内广受关注的先进的分析系统之一。
3.微流控通道最显著的特征之一为比表面积大,不仅可以增强通道内反应的散热,还能够提高分析物与通道壁表面基团反应或接触的几率。因此,微通道表面性质对于微流控分析系统性能起着重要作用,通道表面亲疏水性、表面电荷、官能团、光学透明度、化学均匀性以及表面的机械光滑度都须经过细致调节以满足各种分析或合成的应用需求。微流控芯片制作的材质主要包括玻璃和高分子聚合物。高分子聚合物材料由于制作成本低,易于加工成型和批量生产等优点,在抛弃式芯片装置的应用中更受青睐。但通道内表面疏水且缺乏功能团限制了高分子聚合物芯片一些分析领域中的应用。通过表面修饰,可以改变聚合物通道的亲疏水性能,不仅能使液体更易进入并填充微通道,还能减少生物分子的非特异性吸附,提升微流控芯片的分析性能。除此之外,表面修饰还能调节聚合物通道内表面电荷,从而为其中的流体电驱动输送、电泳分离等提供稳定有效电渗流。已报道的微流控通道的亲水性修饰方法有等离子表面处理法、紫外线/臭氧表面处理法、沉积sio2法以及光化学聚合亲水分子修饰法等。然而,等离子表面处理法、紫外线/臭氧表面处理法需特种设备,光化学聚合聚合物分子层制备的过程复杂,易出现阻塞截面积小的微流控通道情况,需严格控制条件。
4.基于以上分析,提出一种亲水性能好且稳定性强的聚合物微流控通道具有重要意义。
5.本背景技术中所陈述内容并不代表承认其属于已公开的现有技术。
技术实现要素:
6.本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出一种聚合物微流控通道,该聚合物微流控通道亲水性能好且稳定性强。
7.本发明还提出上述聚合物微流控通道的制备方法。
8.本发明还提出上述微流控通道的应用。
9.根据本发明的一个方面,提出了一种聚合物微流控通道,所述聚合物微流控通道包括通道本体,所述通道本体的内壁上修饰有蛋白质。
10.根据本发明的一种优选的实施方式,至少具有以下有益效果:本发明方案以蛋白质作为微流控通道的静态修饰试剂,巧妙地利用蛋白质为具有双亲性的大分子这一特点,使得其可依靠疏水基团吸附到微流控通道的内壁;本发明方案采用蛋白质静态亲水修饰,相比于传统的动态修饰,修饰后的通道亲水性强且稳定性好,扩大了其应用范围,本发明方案的聚合物微流控通道可广泛应用于微芯片免泵免疫分析等多种场合。
11.在本发明的一些实施方式中,所述通道本体的特征尺寸在10μm~1000μm之间。
12.在本发明的一些实施方式中,所述聚合物包括环烯烃共聚物(coc)、聚碳酸酯(pc)、聚甲基丙烯酸甲酯(pmma)、聚苯乙烯(ps)和聚二甲基硅氧烷(pdms)中的至少一种。
13.在本发明的一些实施方式中,所述蛋白质包括牛血清白蛋白(bsa)、鸡血清白蛋白和脱脂奶粉中的至少一种。也可为其他蛋白,由于蛋白质均为两亲性大分子,因此,不同蛋白改性对静态修饰后亲水性能变化程度相近。
14.根据本发明的另一个方面,提出了一种聚合物微流控通道的制备方法,包括如下步骤:以蛋白质为原料对聚合物微流控通道本体的内壁进行修饰。
15.根据本发明的一种优选的实施方式,至少具有以下有益效果:本发明提供的微流控通道亲水性修饰方法不需要特殊设备,操作简便,且不会出现阻塞通道的情况;制得的聚合物微流控通道亲水性能好,稳定性强。
16.在本发明的一些实施方式中,所述聚合物包括环烯烃共聚物(coc)、聚碳酸酯(pc)、聚甲基丙烯酸甲酯(pmma)、聚苯乙烯(ps)和聚二甲基硅氧烷(pdms)中的至少一种。也可以为其他常规聚合物。
17.在本发明的一些实施方式中,所述方法包括如下步骤:将蛋白质溶液通过压力驱动注入聚合物微流控通道本体内部,孵育;优选地,孵育时间为30min以上;优选地,孵育30min~90min。
18.在本发明的一些实施方式中,所述蛋白质包括牛血清白蛋白、鸡血清白蛋白和脱脂奶粉中的至少一种。
19.在本发明的一些优选的实施方式中,所述蛋白质溶液的质量体积(m/v)百分比为0.1%~5%。
20.在本发明的一些优选实施方式中,所述方法还包括固定化处理步骤,所述固定化处理步骤包括加入固定试剂进行处理;优选地,处理时间为30min以上,更优选为30min~90min。为保证蛋白质稳定固载于微流控通道内壁上,加入蛋白质固定试剂,强化蛋白质的稳定性,保证微流控通道修饰后的使用寿命。
21.在本发明的一些优选实施方式中,所述固定化处理步骤还包括在加入固定试剂之前用水洗除去游离的蛋白质。
22.在本发明的一些优选实施方式中,所述固定试剂选自戊二醛、多聚甲醛、甲醛、乙醇中的至少一种。
23.在本发明的一些优选实施方式中,所述固定试剂以溶液的形式添加,优选地,所述固定试剂的溶液中浓度为0.1%~5%(v/v)。
24.在本发明的一些优选实施方式中,所述方法还包括封闭处理步骤,所述封闭处理步骤包括加入封闭剂进行封闭处理;优选地,封闭处理时间为30min以上,更优选为30min~90min。固定试剂通常为含有可以偶联蛋白质的活性基团,为双功能团分子,因此,为避免其
残留后与样品中的生物分子结合,影响检测效果,可通过封闭试剂将这些活性基团进行封闭。封闭后的聚合物微流控通道可保证通道使用更持久,更好地适用于生物免疫分析。
25.在本发明的一些优选实施方式中,所述封闭处理步骤还包括在加入封闭试剂之前用水洗除去游离的固定试剂。
26.在本发明的一些优选实施方式中,所述封闭试剂为含有能够封闭固定试剂中活性基团的试剂;优选地,包括乙二胺、乙醇胺、氨基酸、多肽、蛋白质、多聚赖氨酸和壳聚糖中的至少一种。
27.在本发明的一些优选实施方式中,所述封闭试剂以溶液的形式添加,优选地,所述封闭试剂的溶液中封闭试剂的浓度为10mmol/l~200mmol/l。
28.根据本发明的再一个方面,提出了上述聚合物微流控通道的应用,所述应用为一种微流控芯片,所述微流控芯片中设有上述聚合物微流控通道。
29.一种自动进样装置,所述自动进样装置中含有上述微流控芯片。修饰后的微通道可通过毛细作用实现微量样品的自动进样。应用于微量样品自动进样可简化操作,适于现场检测并提高稳定性。
30.一种免疫分析装置,所述免疫分析装置中含上述微流控芯片;优选地,所述免疫分析装置为免泵免疫分析。将聚合物微流控通道进行亲水修饰后,可逆粘贴在聚二甲基硅氧烷(polydimethylsiloxane,pdms)底片上,通过自动进样完成通道固定抗体、捕获抗原、标记酶、通入底物等一系列免泵操作,进行免疫检测。省去注射泵的使用,简化了微流控操作流程与仪器设备,适于现场快速检测;同时消除了注射泵压力差异及流体对固载分子冲刷作用带来的检测误差,提高稳定性。
31.上述聚合物微流控通道在自动进样或免疫分析中的应用。该微流控通道还可应用于其他场合,其具有较好的亲水性,具有良好的工业应用前景。
附图说明
32.下面结合附图和实施例对本发明做进一步的说明,其中:
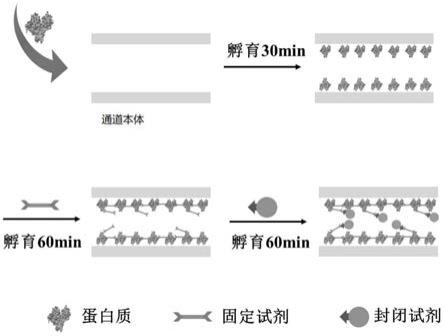
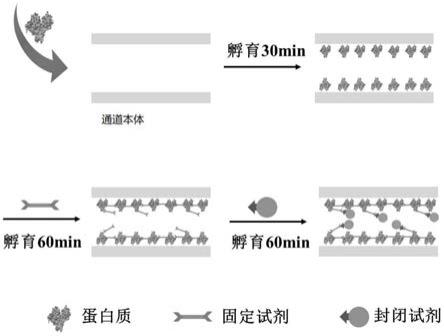
33.图1为本发明实施例的聚合物微流控通道静态亲水性修饰流程示意图;
34.图2为本发明实施例2~5中修饰前后聚合物微流控通道接触角的检测结果图;
35.图3为本发明实施例2~5中修饰前后聚合物微流控通道气液界面显微镜观测结果图;
36.图4为本发明实施例2~5中修饰前后聚合物微流控通道自动进样70s后的效果图;
37.图5为本发明应用例中亲水修饰微流控通道内流体随时间流动情况变化图;
38.图6为本发明应用例中亲水修饰微芯片免泵免疫检测流程图;
39.图7为本发明应用例中亲水修饰前后微芯片免泵免疫检测结果线性拟合图。
具体实施方式
40.以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。实施例中所使用的试验方法如无特
殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,均可从商业途径得到的试剂和材料。
41.实施例1
42.本实施例制备了一种聚合物微流控通道,该聚合物微流控通道包括修饰有bsa的通道本体。
43.其制备过程(静态亲水性修饰)如图1所示,具体过程为:
44.(1)在3cm
×
4cm的聚合物平板上雕刻若干个宽
×
深
×
长为100μm
×
100μm
×
30mm“一”字型微流控通道本体,并将其与pdms底片贴合,组成可逆键合的微流控通道本体;
45.(2)将含1%bsa(m/v)的磷酸盐缓冲液(pbs溶液,ph 7.4)通过压力驱动注满每个微流控通道本体,室温孵育30min,水洗,37℃烘干;
46.(3)将1.25%戊二醛水溶液(m/m)通过压力驱动注满每个微流控通道本体,室温孵育60min,水洗,37℃烘干;
47.(4)将0.2mol/l乙醇胺水溶液通过压力驱动注满每个微流控通道本体,室温孵育60min,封闭活性醛基。水洗,37℃烘干,4℃保存。
48.该通道的制备原理是利用蛋白质和封闭试剂的亲水基团为聚合物通道提供较好的亲水性。所述聚合物微流控通道亲水性修饰方法的实施步骤为先通过蛋白质的疏水基团固定在通道内壁上,再用固定试剂固定,最后用封闭试剂封闭剩余活性基团。具体地,亲水性修饰方法包含三个步骤:第一,将蛋白质溶液通过压力驱动注满微流控通道,利用微流控通道内壁与蛋白质间的疏水相互作用,将蛋白质固定到微流控通道内壁上,蛋白质的亲水基团为微流控通道提高亲水性;第二,为保证蛋白质稳定固载于微流控通道内壁上,加入蛋白质固定试剂,强化蛋白质的稳定性,保证微流控通道修饰后的使用寿命;第三,为避免蛋白固定试剂的活性基团与微流控通道应用时加入的生物分子偶联,加入封闭试剂,封闭活性基团,保证亲水修饰后微流控通道适用于生物分析。
49.实施例2
50.本实施例制备了一种聚合物微流控通道,其与实施例1的区别在于:聚合物平板为coc平板。
51.实施例3
52.本实施例制备了一种聚合物微流控通道,其与实施例1的区别在于:聚合物平板为pc平板。
53.实施例4
54.本实施例制备了一种聚合物微流控通道,其与实施例1的区别在于:聚合物平板为pmma平板。
55.实施例5
56.本实施例制备了一种聚合物微流控通道,其与实施例1的区别在于:聚合物平板为ps平板。
57.实施例6
58.本实施例制备了一种聚合物微流控通道,其与实施例1的区别在于:bsa替换为脱脂奶粉。
59.实施例7
60.本实施例制备了一种聚合物微流控通道,其与实施例1的区别在于:bsa替换为鸡血清白蛋白。
61.试验例
62.本试验例测试了实施例2~7制备的聚合物微流控通道的亲水性能,具体地,通过测试任一聚合物平板(通道)蛋白质修饰前后的接触角和气液界面变化来表征其亲水性能的变化。其中,部分接触角测试结果如图2所示,部分气液界面显微镜观察结果如图3所示。
63.1)接触角测试:
64.具体如下:用德国kruss dsa100光学接触角分析仪测定实施例2~7各步骤处理后的聚合物平板的接触角。其中,实施例2各步骤处理后的测试结果如图2(a)所示,实施例2~5中经步骤(1)和步骤(4)处理后的聚合物平板的接触角对比图如图2(b)所示。实施例3~7的变化趋势与实施例2相似,实施例6~7的变化程度基本与实施例2相当,为避免冗余,未一一列出。实施例图2中,修饰前、蛋白质、蛋白质 固定剂及蛋白质 固定剂 封闭剂对应于经步骤(1)、(2)、(3)和(4)处理后。
65.从图2(a)中可以看出,经步骤(2)修饰后,接触角下降最明显。继续进行(3)和(4)步骤处理后,接触角基本不再变化。由此可知,聚合物亲水性主要来自bsa的亲水基团。戊二醛处理的目的在于将通道壁固载的bsa偶联在一起,使其在微流控通道壁上形成稳定的蛋白膜层,维持亲水性的稳定,而乙醇胺处理的目的在于封闭少量残留的活性醛基,以免生物分析过程中非特异吸附分析物及抗体。
66.从图2(b)中可以看出,coc、pc、pmma和ps四种聚合物材料修饰后接触角均出现明显下降,表明亲水性增大,同时,也表明该亲水性修饰方法对聚合物材料种类具有普遍适用性。
67.2)气液界面测定:
68.具体如下:将修饰前后的聚合物微流控通道用显微镜观测修饰前后气液界面的变化,部分结果如图3所示。从图3中可以看出,聚合物通道在亲水性修饰前,气液界面呈平直状,水溶液对微流控通道没有浸润,当亲水性修饰后,气液界面呈平圆弧型,液体在通道内壁的浸润现象显著。说明通道内壁具有显著的亲水性。
69.应用例
70.本应用例具体为将实施例2~7制备的聚合物微流控通道应用于自动进样或免疫分析。
71.1)自动进样效果测试
72.具体如下:另取仅经过步骤(1)处理的同种材质的聚合物平板作为对照,在每一通道的样品池处加10μl 10mg/ml罗丹明b水溶液,观测水溶液自动进样的情况。70s后的测试结果如图4所示。从图4中可以看出,四种材质制备的微流控通道经过本发明实施例的亲水性修饰方法修饰后1
‑
2min内将微流控通道出口处注满。修饰前的微流控通道水溶液基本不能自动注入微流控通道,亲水修饰后微流控通道内流体随时间流动情况如图5所示。从图5中可以看出,溶液随着时间延长逐步自由进入微流控通道,在8s内均可自动注满四种材质的微流控通道。微流控通道修饰后自动进样的性能可用于免泵免疫检测,减少注射泵产生的液体压力流对偶联分子的影响,减少实验误差,同时也减少了机械设备,便于现场应用。
73.2)免泵免疫检测效果测试
74.在pmma板上用雕刻机雕刻宽
×
深
×
长为200μm
×
200μm
×
15mm的三条平行的“一”字型通道,将其与pdms底片贴合组成微流控通道。制备两块相同pmma微流控通道分别用于生物分子固载(固载通道)和底物注入(底物通道),均按照本发明实施例1方法进行亲水性修饰。揭开固载通道下pdms底片,更换新制的pdms底边,组成可逆键合微流控通道进行免泵免疫检测。
75.步骤如图6所示,具体包括:(1)将8μl 5μg/ml的crp鼠单抗加到进样口处,液体自动注满通道,室温孵育30min,抗体固载于pdms表面。吸水纸吸去抗体溶液,并用pbs溶液洗涤3次;然后加10μl封闭液到进样口,液体自动注满通道,室温孵育30min,吸水纸吸去封闭液(封闭液成分:含10%小鼠血清、1%bsa、0.1%吐温20的pbs溶液),不洗。
76.(2)加样品液8μl到进样口,液体自动注满通道,室温孵育15min,样品液中的待测抗原被抗体捕获。吸水纸吸去样品溶液,并用pbs溶液洗涤3次。
77.(3)加8μl稀释度1:10000的hrp酶标记的抗体溶液到进样口,液体自动注满通道,室温孵育15min,酶标抗体与抗原结合,实现对抗原的标记。吸水纸吸去样品溶液,并用pbs溶液洗涤3次。
78.(4)揭开pmma上层,垂直pdms上生物分子固载方向盖上底物通道,加10μl底物溶液(50μmol/l amplex red和500μmol/l h2o2)于进样口,液体自动注满通道。hrp酶催化amplex red转化为红色荧光物质试卤灵,及时荧光测定。
79.作为对照,未修饰的微流控通道也用于微芯片免疫检测,步骤与亲水修饰的微流控通道一样,只是需要泵将每步骤中的液体通过压力驱动以10μl/min的流速注入通道内。结果如图7所示。从图7中可以看出,修饰后微流控通道免泵免疫测定的crp的线性关系方程为y=0.86x 3.53,相关系数r2=0.9939,rsd<5.7%,而未修饰的微流控通道免疫测定crp的线性关系方程为y=0.61x 4.76,相关系数r2=0.9709,rsd<12.0%,很显然免泵测定稳定性更高。
80.此外,亲水修饰微流控通道获得的信号值较未修饰大,主要原因可能有两方面:一是亲水修饰的固载通道避免了抗体非特异结合于pmma通道内壁,增大了pdms底片的抗体固载量;二是底物自动注入过程消除泵产生的压力对固载分子冲刷的影响,减少实验误差,同时也减少了机械设备,便于现场应用。
81.针对目前以高分子聚合物制备的微流控通道亲水性差,不能自动进样及芯片电泳分离性能不佳等情况,本发明方案提供了一种简便的静态亲水性修饰方法,亲水性好,可以用于微量样品自动进样,简化操作,适于现场检测并提高稳定性;也用于微流控芯片电泳来提高分离性能,拓展聚合物芯片的应用范围。
82.本发明中所称室温为15~30℃;优选为20~25℃,实施例中为20℃。
83.上面结合附图对本发明实施例作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。