一种三七诱导型启动子r1及其应用
技术领域
1.本发明涉及分子生物学以及基因工程相关研究领域,具体涉及一种三七诱导型启动子r1及其应用。
背景技术:
2.启动子是位于基因上游区域的一段具有调控转录起始的dna序列,是重要的顺式调控元件之一。启动子序列主要包括核心启动子元件和上游启动子元件。其中,核心启动子元件包括转录起始位点、tata框和5'非翻译序列,主要控制着基因的转录起始。上游启动子元件包括caat框、gc框和一些组成型及特异型元件,这些元件可以与相应的反式作用因子结合,从而提高转录效率。在植物中,启动子按表达方式可分为组成型启动子、诱导型启动和组织特异型启动子。组成型启动子是指在大多数组织和细胞中都具有引发基因表达活性的启动子,其活性不受时间、空间或者外源因素影响。如花椰菜花叶病毒(camv)中的35s启动子、水稻act1启动子。诱导型启动子是指在某些外源信号的刺激下才具有引发基因表达活性的启动子,而在没有外源因素诱导的情况下,不具有活性或者活性很低的启动子。如:干旱诱导型启动子、温度诱导型启动子。组织特异型启动子是指在特定的组织或细胞中才具有引发基因表达活性的启动子。如根组织特异性启动子、花器官组织特异性启动子(贺飞燕, 闫建俊, 白云凤, 冯瑞云, 施俊凤. 启动子的类型及应用. 山西农业科学, 2017, 45(01): 115
‑
120)。
3.随着植物基因工程的发展,诱导型启动子的研究及应用越来越广泛。植物基因工程是指将目的基因导入受体细胞中,并使其整合到受体细胞的染色体上,从而改变受体植物遗传特性的技术过程。基因工程技术使物种之间克服生殖隔离,加快植物育种的进程。其次,在基因工程中,常需要使用外源启动子驱动目的基因的表达。在传统的基因工程中所使用的启动子大多是组成型启动子。然而,由于组成型启动子所诱发的基因表达在植物的整个生命周期中持续发生,因此常常导致基因产物累积过度,引发植物的代谢紊乱,甚至引发植株矮小、生长畸形。如果将诱导型启动子应用到基因工程中,那么将有利于减少外源基因表达所产生的异源蛋白等代谢产物对植物所产生的影响,从而减少植物体内的能量浪费,使转基因植物的代谢得以平衡。诱导型启动子不但可以避免因目的基因的持续表达而引起的植物能量的过度消耗,而且可以消除基因产物的积累对植物本身造成的伤害,成为近年来植物基因工程的研究热点(聂丽娜, 夏兰琴, 徐兆师, 高东尧, 李琳, 于卓, 陈明, 李连城, 马有志. 植物基因启动子的克隆及其功能研究进展. 植物遗传资源学报, 2008(03): 385
‑
391)。
4.诱导型启动子常常根据其诱导信号进行命名,如真菌诱导型启动子、生长素诱导型启动子、光诱导型启动子、热诱导型启动子、创伤诱导型启动子、激素诱导型启动子等。诱导型启动子驱动外源基因的表达受特定的物理或化学信号控制,该特点使外源基因的表达可以得到更为精细的控制,因此对诱导型启动子的研究一直是植物分子生物学和基因工程研究的热点之一(杨瑞娟, 白建荣, 李锐, 常利芳. 诱导型启动子在植物基因工程中的研
究进展. 山西农业科学, 2018, 46(02): 292
‑
298)。从岷江百合(lilium regale wilson)的pr10
‑
5基因末端中通过染色体步移技术扩增出1489 bp的启动子,并将其与gus报告基因相连接转入烟草(nicotiana tabacum)中。结果显示岷江百合pr10
‑
5启动子是一个多重应激诱导型启动子。盐胁迫和伤害胁迫等非生物胁迫处理后,转基因烟草的gus活性明显增强,表明盐胁迫和伤害胁迫可正向调控pr10
‑
5启动子的活性;赤霉素、脱落酸和乙烯利对pr10
‑
5启动子的活性也有正调控的功能,其中赤霉素对启动子的诱导作用最强;尖孢镰刀菌(fusarium oxysporum)、核盘菌(sclerotinia sclerotiorum)和灰葡萄孢(botrytis cinerea)侵染对pr10
‑
5启动子驱动的gus活性的诱导也十分显著(rui chen, hua he, ye yang, yuan qu, feng ge, diqiu liu. functional characterization of a pathogenesis
‑
related protein family 10 gene, lrpr10
‑
5 , from lilium regale wilson. australasian plant pathology, 2017, 46(3): 251
‑
259)。在大豆(glycine max)中克隆了gmprp2基因的启动子,并对其进行了顺式作用元件的预测,结果表明该启动子具有多个顺式作用元件,如根特异性元件。另外,将该启动子序列与gus基因相连接并转入到拟南芥(arabidopsi thaliana)中进行瞬时表达分析。结果表明,在nacl、水杨酸、脱落酸、赤霉素等外源因素处理后,gus的表达量显著上调,可见gmprp2启动子可以响应nacl、水杨酸、脱落酸、赤霉素等的诱导(li chen, bingjun jiang, cunxiang wu, shi sun, wensheng hou, tianfu han. gmprp2 promoter drives root
‑
preferential expression in transgenic arabidopsis and soybean hairy roots. biomed central, 2014, 14(1): 1471
‑
2229)。
技术实现要素:
5.本发明提供了一种诱导型启动子r1,来源于三七,其核苷酸序列如seq id no:1所示。
6.本发明另一目的是将该启动子应用在基因工程中,即在生物和非生物胁迫下作为诱导表达启动子调控外源基因在转基因受体植物中的特异高效表达。
7.本发明涉及分离诱导型启动子片段并鉴定其表达活性,本发明从三七中克隆获得诱导型启动子,该启动子长687 bp;将本发明分离克隆的诱导型启动子片段置换pbi121载体上的camv 35s启动子,由诱导型启动子驱动报告基因gus的表达框,通过根癌农杆菌(agrobacterium tumefaciens)介导将其转入模式植物烟草中表达,并通过进一步实验揭示诱导型启动子的表达特性,为后期利用该启动子调控外源基因在转基因植株中的高效特异表达奠定基础。发明人将这个启动子命名为r1。
8.将本发明中r1启动子驱动gus的表达框转入烟草中,采用几种植物激素、生物和非生物胁迫处理转基因烟草植株,并进行gus活性的荧光定量分析,检测结果表明,r1启动子可响应几种植物激素、生物和非生物胁迫的诱导,茄腐镰刀菌(f. solani)、尖孢镰刀菌(f. oxysporum)、链格孢(alternaria alternate)、氯化钠(nacl)、氯化铝(alcl3)、赤霉素(ga3)、茉莉酸甲酯(meja)、水杨酸(sa)、脱落酸(aba)、乙烯利(eth)能明显诱导启动子r1的活性。
9.上述启动子r1可以在基因工程中应用于外源基因的诱导表达,具体操作如下:(1)采用扩增r1的特异引物,从三七幼嫩组织中提取基因组dna,通过聚合酶链式
反应(polymerase chain reaction,pcr)扩增出r1,然后将其连接到pgem
‑
t载体上,经测序获得具有序列正确的克隆;(2)用限制性内切酶酶切pgem
‑
t
‑
r1载体,回收启动子片段;同时采用合适的限制性内切酶酶切去除植物表达载体上的组成型表达启动子,通过胶回收得到载体大片段;再将所获得r1片段与pbi121
‑
gus载体片段连接,构建植物诱导表达载体;之后将所构建的植物诱导表达载体通过根癌农杆菌介导转入受体植物中;转基因植株在遭受茄腐镰刀菌、尖孢镰刀菌、链格孢、nacl、alcl3的胁迫时,启动子r1驱动的目的基因会诱导并上调表达水平。此外,体内体外的赤霉素、茉莉酸甲酯、水杨酸、脱落酸、乙烯利也会诱导目的基因高水平表达。
10.本发明为植物基因工程应用提供了一个新的诱导表达的启动子,基因工程中植物超表达载体常用来自花椰菜花叶病毒的35s启动子,该启动子为组成型表达启动子,目的基因的表达大体恒定在一定水平上,在不同组织、部位表达水平没有明显差异,所以转入植物的外源基因的表达不受控制,导致蛋白大量积累且浪费能量。而诱导型启动子可以在植物受到外界胁迫或化学因素影响时提高基因的表达量,在去除胁迫或化学处理后即下调目的基因的表达,可保证在植物受到逆境胁迫时起到保护植物、抵抗外界刺激的效果,反之在适宜的环境中不浪费植物的能量。此外,在基因工程应用中诱导型启动子不但可以避免目的基因的持续表达对植物能量的过度消耗,而且可以消除基因产物积累对植物本身造成的伤害。几种激素(ga3、meja、sa、aba、eth)、非生物胁迫(nacl、alcl3)、生物胁迫(茄腐镰刀菌、尖孢镰刀菌、链格孢)明显诱导本发明中r1启动子的表达活性,因此本发明在抗生物或非生物胁迫的基因工程中具有广阔的应用前景。
附图说明
11.图1是本发明中启动子r1 (a图)和pbi121载体(b图)的胶回收产物检测结果;图2是本发明中pbi121
‑
r1
‑
gus转化大肠杆菌的阳性克隆检测结果,其中阳性对照是以pgem
‑
t
‑
r1质粒为模板的pcr反应,空白对照是以无菌水为模板的pcr反应;图3是本发明中部分pbi121
‑
r1
‑
gus转基因烟草的pcr筛选结果,其中阳性对照是以质粒pbi121
‑
r1
‑
gus为模板的pcr反应;wt:非转基因烟草(野生型)总dna为模板进行的pcr反应;空白对照是以无菌水为模板的pcr反应。
12.图4是本发明中gus酶活测定的标准曲线;图5是本发明中pbi121
‑
r1
‑
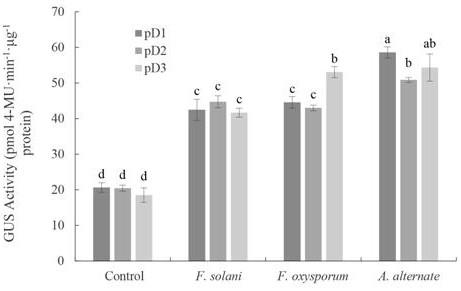
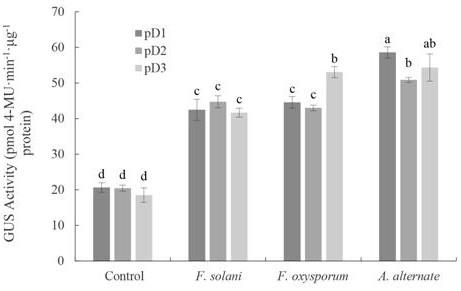
gus转基因烟草在茄腐镰刀菌、尖孢镰刀菌、链格孢接种后的gus活性,其中对照为正常生长的pbi121
‑
r1
‑
gus转基因烟草的gus活性;图6是本发明中pbi121
‑
r1
‑
gus转基因烟草在nacl、alcl3处理后的gus活性,其中对照为正常生长的pbi121
‑
r1
‑
gus转基因烟草的gus活性;图7是本发明中pbi121
‑
r1
‑
gus转基因烟草在ga3、meja、sa、aba、eth处理后的gus活性,其中对照为正常生长的pbi121
‑
r1
‑
gus转基因烟草的gus活性;图5
‑
图7中pd1、pd2、pd3为三株转基因烟草株系。
具体实施方式
13.下面通过附图和实施例对本发明进一步说明,但本发明保护范围不局限于所述内
容,本实施例中方法如无特殊说明的均按常规方法操作,所用试剂如无特殊说明的采用常规试剂或按常规方法配置的试剂。
14.实施例1:三七诱导型启动子r1的克隆以及序列分析以提取的三七根基因组dna为模板,用扩增启动子r1的特异引物(上游引物为5’tttttaggctttaggccaac3’,下游引物为5’aatttgctctagagcgagct3’,通过pcr克隆启动子r1的序列;反应体系(20μl)为三七基因组dna 0.5μg、2μl 10
×
advantage 2 pcr buffer、1.8μl dntp mix (10mm each)、0.2μl上游引物(10μm)、0.2μl引物(10μm)、0.2μl advantage 2 pcr polymerase mix、14.6μl pcr
‑
grade水。pcr反应条件:94℃ 5 min;94℃ 30s,58℃ 30s,72℃ 45s,32个循环;72℃ 5min。pcr结束后,取8μl进行琼脂糖凝胶电泳,用以检测扩增产物的特异性以及大小。
15.所得到pcr产物只有一条dna带,直接对pcr产物进行ta克隆,使用的试剂盒为pgem
‑
t vector system (promega),反应体系和操作过程为:取1.5μl pcr产物,依次加入1μl pgem
‑
t vector (50 ng/μl)和2.5μl 2
×
ligation solution i,混匀后置于16℃过夜反应。通过热激转化法将连接产物转入大肠杆菌dh5α感受态中。用含有氨苄青霉素的lb固体培养基筛选阳性克隆。挑选若干个单菌落,摇菌后用扩增r1的特异引物检测多克隆位点插入r1的克隆。将得到的阳性克隆进行测序,最终获得的启动子r1长687 bp。
16.实施例2:r1
‑
gus表达载体构建pbi121多克隆位点有hindⅲ和bamhⅰ酶切位点,因此在扩增启动子的特异引物分别添加hindⅲ和bamhⅰ的识别位点。采用sanprep柱式质粒dna小量抽提试剂盒(上海生工)从大肠杆菌中提取质粒pgem
‑
t
‑
r1以及pbi121,取1μl用于琼脂糖凝胶电泳以检测所提取质粒的完整性及浓度高低。用限制性内切酶hindⅲ和bamhⅰ分别对质粒pgem
‑
t
‑
r1和pbi121进行双酶切(50μl体系)。反应体系和操作过程为:分别取25μl pgem
‑
t
‑
r1和pbi121质粒于两个200μl的离心管中,而后,在每个离心管中分别加入5μl 10
×
h buffer、2.5μl bamhi、2.5μl hindiii、15μl ddh2o,混匀后短时离心,置于37℃过夜反应;将所有酶切产物进行琼脂糖凝胶电泳,然后使用sanprep柱式dna胶回收试剂盒(上海生工)对启动子片段和pbi121载体大片段分别进行胶回收,取1μl回收产物通过琼脂糖凝胶电泳检测回收片段的大小以及浓度,结果如图1所示。
17.利用t4 dna ligase (takara),将回收的启动子dna片段和pbi121载体片段连接起来,反应体系(20μl),操作过程为:取10μl r1 dna片段依次加入2μl pbi121载体dna、2μl 10
×
t4 dna ligase buffer、1μl t4 dna ligase、5μl ddh2o,混匀后短时离心,然后16℃水浴过夜反应。接着采用热激转化法将连接产物转入大肠杆菌dh5α中,用含有50mg/l卡那霉素的固体培养基筛选阳性克隆。挑选单菌落摇菌,以菌液为模板用扩增启动子r1的特异引物进行pcr,挑选出r1与pbi121成功连接的克隆,在得到的阳性菌株中加入甘油并置于
‑
80℃保存备用。
18.提取并纯化上述大肠杆菌dh5α中的pbi121
‑
r1
‑
gus质粒,随后用液氮冻融法将上述构建的植物表达载体pbi121
‑
r1
‑
gus转入所制备的根癌农杆菌lba4404感受态细胞中,操作步骤为:取0.2μg pbi121
‑
r1
‑
gus质粒加入含有200μl感受态细胞的离心管中,轻轻混匀后冰浴5min,随后转入液氮中冷冻1min,然后迅速置于37℃水浴5min,再冰浴2min,之后加入500μl lb液体培养基于28℃振荡培养4h,将活化后的农杆菌涂于含有50mg/l卡那霉素的
lb固体培养基上,28℃倒置培养。挑选单菌落摇菌,再用扩增r1的特异性引物进行pcr反应,检测pbi121
‑
r1
‑
gus是否转入农杆菌中;对于图2中所示的阳性克隆,加入甘油后置于
‑
80℃保存备用。
19.实施例3:农杆菌介导的植物遗传转化以及转基因植物筛选本实验的转基因受体是烟草,将烟草种子用75%的酒精浸泡30s,无菌水洗涤后用0.1%的hgcl2浸泡8min,然后再用无菌水洗涤若干次,播种于1/2 ms培养基上,28℃暗培养5
‑
8d,发芽后转至光照培养箱(25℃,16 h/d光照),以后每月用ms培养基继代一次。
20.将
‑
80℃冰箱中保存的含有pbi121
‑
r1
‑
gus质粒的农杆菌lba4404菌液取出,取10μl菌液接种于1ml含有20mg/l利福平和50mg/l卡那霉素的lb液体培养基中,28℃、200rpm振荡培养至浑浊。吸取500μl菌液均匀涂布于含有20mg/l利福平和50mg/l卡那霉素的lb固体培养基上,28℃倒置培养至长出菌苔。用接种环刮取3
‑
5环菌苔接种于40ml含25mg/ml乙酰丁香酮的mgl培养基中,28℃、220 rpm振荡培养直至od
600
约为0.6。将无菌烟草组培苗叶片剪成约1 cm2大小的叶盘,浸泡于含有悬浮农杆菌的mgl培养基中,25℃震荡培养15min。用无菌滤纸将叶盘表面的菌液吸干后转入烟草共培养培养基中,22℃暗培养2天。将共培养后的叶盘转接到烟草筛选培养基上,培养于光照培养箱(25℃,16 h/d光照)。培养约3周,将分化出来的烟草幼苗切下并继代于含有50mg/l卡那霉素和300mg/l头孢霉素的生根培养基上进行生根培养。
21.采用ctab法提取转基因烟草植株叶片的基因组dna,取1μl基因组dna进行琼脂糖凝胶电泳检测其完整性和浓度。以转基因植株的基因组dna为模板用扩增启动子r1的特异引物进行pcr反应,pcr结束后,取8μl产物用于琼脂糖凝胶电泳以检测阳性转基因植株,部分转基因烟草植株的扩增结果如图3所示,三七诱导型启动子r1转基因烟草共筛选到31棵阳性转基因植株。
22.实施例4:转基因烟草的gus荧光定量检测对转基因烟草叶片gus活性的荧光定量分析参考jefferson等(richard a. jefferson. assaying chimeric genes in plants: the gus gene fusion system. plant molecular biology reporter,1987,5(4): 387
–
405)的方法,其反应机理是:gus可与底物4
‑
mug反应,催化产生4
‑
mu,4
‑
mu在激发波长为365nm、发射波长为455nm条件下产生荧光,产生的荧光值可以通过荧光分光光度计进行定量测定。
23.将预先处理好的烟草叶片置于装有液氮的研钵中研磨成粉末,加入400μl gus提取缓冲液,将匀浆转移至1.5ml离心管中,于4℃、12000g离心10min;离心结束后,收集上清于新的离心管中。预先取1ml的4
‑
mug溶液(1mmol/l)于2.0 ml离心管中37℃预热10 min。取50μl上清液加入至预热的gus反应缓冲液中,迅速摇匀,并立即取200μl反应混合液置于1.8ml的终止缓冲液中(操作时间少于30s),作为酶促反应0点样(荧光测定时以此为空白对照),剩余液体继续37℃反应并开始计时。在反应15min、30min、45min时分别取200μl反应混合液,加入至1.8ml终止缓冲液中,用于荧光测定,使用荧光分光光度计在激发波长为365nm,发射波长为455nm的条件下测定各样品的荧光值。制作4
‑
mu标准曲线:将1mm 4
‑
mu母液用反应终止液分别稀释成100nm、300nm、500nm、700nm和900nm的不同梯度液,在激发波长为365nm,发射波长为455nm的条件下测定各梯度液的荧光值,以反应终止液为空白对照,用测得的荧光值和4
‑
mu的浓度绘制标准曲线(如图4所示)。取10μl上清液,采用改良的考马斯
亮蓝法测定样品的蛋白含量。以一分钟催化4
‑
mug生成1pmol 4
‑
mu的酶量为一个活力单位,gus酶活以每μg总蛋白的酶活力计算,即表示为4
‑
mu pmol/min/μg(蛋白)。通过标准曲线,计算出转基因烟草的gus活性。
24.为了检测三七启动子r1对植物激素、生物胁迫与非生物胁迫的响应,分别用几种植物激素、生物胁迫和非生物胁迫因子处理转基因烟草的叶片,并通过上述方法测定处理前后的gus活性,以正常生长未处理的转基因烟草叶片gus活性作为对照。如图5,在茄腐镰刀菌、尖孢镰刀菌、链格孢接种后,三七启动子r1转基因烟草叶片的gus活性明显上调,对启动子活性的诱导程度来看,链格孢(a. alternate)>尖孢镰刀菌(f. oxysporum)>茄腐镰刀菌(f. solani)。受nacl、alcl3胁迫后转基因烟草的gus活性如图6所示,nacl、alcl3可显著上调启动子r1的活性,其中alcl3的诱导程度大于nacl。用几种植物激素(赤霉素、茉莉酸甲酯、水杨酸、脱落酸、乙烯利)处理转基因烟草的叶片,均显著上调启动子r1的活性(图7),从诱导程度上来看,脱落酸(aba)>水杨酸(sa)>茉莉酸甲酯(meja)>赤霉素(ga3)>乙烯利(eth)。上述实验结果表明,三七启动子r1可响应几种植物激素、非生物胁迫及生物胁迫的处理,尖孢镰刀菌、茄腐镰刀菌、链格孢、氯化钠(nacl)、氯化铝(alcl3)、赤霉素、茉莉酸甲酯、水杨酸、脱落酸、乙烯利均能明显上调启动子r1驱动的gus活性。显然,三七启动子r1是一种植物激素、生物胁迫和非生物胁迫因子诱导型启动子,可应用于植物抗逆基因工程。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。