1.本发明涉及用于通过受约束的阻抗测量来监测组织消融的方法和系统。它在血管内心脏导管消融治疗的实时连续评估中具有特定应用,但是同样可以在各种其他医学治疗技术中找到应用。
背景技术:
2.诸如射频(rf)消融的心脏导管消融能够以微创方式治疗大范围的心律失常,并且构成介入心脏病学中快速增长的领域。涉及这些心律失常的心脏区域可以用配备有合适的消融装置(诸如rf辐射电极或其他合适的仪器)的导管经由从外周静脉或动脉进入来到达,并且可以通过施加消融能量以加热组织而被消融。
3.rf导管消融涉及通过一个或多个电极导管将高频交流电流(在350khz至1mhz的范围内)递送到心肌组织以产生热损伤。电流加热组织的机制是与电极直接接触的组织的窄边缘(<1mm)的电阻(欧姆)加热,其中较深的组织区域通过传导加热。热量通过进一步热传导到正常体温的组织中并通过经由循环血池的热对流而从该区域消散。
4.太小的损伤在治疗心律失常方面可能是无效的,而太大的损伤可能与不受欢迎的并发症相关联。该区域中的过热是一个主要问题,具有包括刺穿和填塞的潜在风险。因此,成功的导管消融不仅需要致心律失常基质的精确定位,而且需要该基质的完全和永久消除,而不产生附带伤害。
5.尽管需要在消融手术期间监测损伤发展,但是目前没有可靠的手段来在临床上实现这一点。替代测量(诸如导管尖端温度和阻抗变化、消融功率、持续时间、导管尖端压力和记录在消融导管上的心脏内心电图的减少)可以提供导管尖端相对于心脏壁适当定位并且消融正在发生的指示,但是通常不能提供损伤形成或发展的任何直接测量。mri可以以相对较小的误差提供损伤的高分辨率图像,但是图像重建时间很长(长达30分钟),因此该技术对于标准临床手术是不可行的。
6.用于确定损伤大小的先前系统包括使用电阻抗断层扫描(eit)。eit在其传统实施中受到影响,因为它是产生低空间分辨率结果的不适定方法。因此,eit实施的系统在整个治疗过程中严重依赖于ct成像或位置信息,除了实时导管位置知识之外eit实施的系统还利用了所述信息。
7.需要一种用于在没有eit的数值解的情况下或在不需要求助于ct信息的情况下,在导管消融期间监测损伤发展的更可靠的系统和方法。
8.对本说明书中的任何现有技术的引用不是承认或暗示该现有技术形成任何管辖区域中的公知常识的一部分,或者该现有技术可以合理地预期由熟练的读者与任何其他现有技术组合。
技术实现要素:
9.在导管消融手术中的电磁辐射的递送期间,由于电阻和传导加热而导致的心脏组
织中的温度变化会伴随有组织的电阻抗的变化。理论上,当温度升高时,阻抗下降。这允许通过测量组织体积的改变的阻抗来实时测量组织体积中的加热。
10.根据本发明,在第一方面,提供了一种用于在施加到患者的医学消融过程期间监测组织损伤发展的系统,所述系统包括:导管消融装置,具有至少一个导管电极;所述装置能够经由电馈线连接到电能量的源,并且被配置为施加消融能量以消融目标区域中的组织;多个外部电极,用于施加到患者的身体;测量电路,用于在没有施加所述消融能量的情况下确定至少一个导管电极与外部电极之间的电流路径的电特性;以及电控制器。
11.优选地,电特性是电流路径的阻抗。
12.在优选形式中,电控制器被布置为控制ac电流源在至少一个导管电极和多个外部电极的不同组合之间的施加,使得所得到的电压的测量结果能够提供对在各个电极之间通过患者的身体的不同电路径的阻抗的测量,并且电控制器还被配置为在施加所述ac电流源期间将导管消融装置从电能量的源断开或以其他方式暂停消融能量的所述施加。
13.所述系统可以包括虚拟电阻负载,所述虚拟电阻负载用于在所述测量电路的操作时段期间选择性地连接到电能量的源。在这种情况下,可以包括消融分流器(shunt),所述消融分流器被配置为将能量源从导管消融装置解耦并将其耦合到虚拟负载。
14.替代地,可以使用间歇性的电能量的源,所述间歇性的电能量的源可以在正在进行测量时的时段内快速关闭。
15.在优选形式中,测量电路包括开关矩阵,所述开关矩阵被布置为用于在电控制器的控制下在不同的电极组合之间切换。
16.优选地,测量电路被配置为进行四端子感测以测量所述电特性(例如,阻抗)。
17.电控制器可以包括pc。在优选形式中,测量电路包括一个或多个模数转换器(adc),以提供测得的电压的数字表示。在一个实施例中,包括多个adc,用于同时测量不同的电流路径,每个adc被布置为在电控制器的控制下在不同的所选的外部电极之间切换。
18.在一种形式中,电能量的源是rf发生器。本发明还可以应用于其他类型的消融过程,包括微波消融和电穿孔。
19.所述多个外部电极可以被设置为用于跨患者的身体的外部区域施加的电极点系带(dot harness)。
20.根据本发明,在第二方面,提供了一种对系统进行操作的方法,所述系统用于在施加到对象的组织的导管消融过程期间监测损伤的大小,所述方法包括:(a)执行涉及将消融能量递送到导管电极的消融阶段;(b)执行测量阶段,所述测量阶段涉及测量穿过由消融形成的损伤区域的电流路径的电特性;其中,顺序地重复步骤(a)和(b)。
21.在优选形式中,顺序地重复步骤(a)和(b),直到在步骤(b)中执行的测量结果指示规定的损伤大小。
22.在步骤(b)中,消融能量可以从导管电极转移到虚拟负载。
23.本发明的第二方面的所述方法可以包括使用本发明的第一方面的所述系统,其中,使用所述导管消融装置进行步骤(a),以及使用所述多个外部电极和所述测量电路进行步骤(b),在所述电控制器的控制下进行步骤(a)与(b)之间的切换。
24.因此,根据所述方法,测量阶段涉及在一个或多个导管电极与施加在患者身体外部的多个电极之间顺序地传递电流并测量电响应。对结果的分析提供了对最近消融阶段的效果的评估,并且对连续测量阶段的结果的分析允许关于获得的期望损伤大小的预测。
25.所述方法可以包括初始确定阶段,在所述初始确定阶段中,通过在一个或多个导管电极与施加到患者身体的多个外部电极之间顺序地施加电流并测量电响应来从多个电流路径中选择一个或多个电流路径,并且根据结果选择用于步骤(b)的电极。
26.优选地,在确定阶段中选择规定数量的电流路径,其中相关联的电极被用于步骤(b)的后续迭代。
27.在一个实施例中,电极被选择为与被测量的电流路径的最低阻抗相关联的那些电极。替代地,电极可以被选择为与对患者身体的局部状态变化最敏感的电流路径相关联的那些电极,所述局部状态变化诸如是将导电溶液注入到与损伤相邻的区域。
28.可以将阻抗的变化与先前确定的数据(例如,在查找表中)进行比较,以向医疗从业者提供损伤大小的测量。测试已表明,本发明的方法可以用于在仅约1mm深和3mm长的误差内跟踪损伤大小,这在大多数应用中被认为是临床上可接受的。
29.在一种优选形式中,所述方法包括将步骤(b)中进行的测量用于算法中以估算步骤(a)中形成的所述损伤的大小。
30.在一个实施例中,对于每个测量阶段,分析测量结果,并且选择在算法中使用哪些测量。
31.可以至少部分地基于自先前测量阶段以来相关电流路径的电特性的变化来进行该选择。例如,可以基于由介入的消融阶段引起的最大阻抗下降来进行选择。
32.在优选形式中,步骤(a)和/或步骤(b)可以受对象的呼吸循环和/或心跳门控(gated),以便在相对稳定的点处执行测量阶段。
33.在测量的分析中使用的算法可以包括回归分析算法。替代地或另外地,可以使用机器学习来解释结果。如将理解的,(特别地基于用于每次测量的外部电极的位置的)结果的分析可以被用于损伤尺寸、损伤形状和/或损伤定向的确定中。
34.因此,本发明涉及消融导管电极与多个外部电极之间的阻抗测量。在本说明书和权利要求书中,术语“外部电极”被用于指远离导管的次级电极组。在常见应用中,外部电极被放置在患者身体的外部并与患者身体接触。然而,将理解,它们可以被放置在身体的内部结构内,诸如食道、冠状窦或其他合适的部位。导管电极和外部电极用于快速且可靠地找到临床上最重要的电流路径,并用于在消融进行时获得阻抗变化的测量结果,这可以提供损伤生长的临床上有用的指示。
35.在患者身体上的不同位置中的多个电极之间使用多个阻抗测量当然在eit的一般领域中是已知的。然而,eit被用于医学成像,特别应用于诸如监测肺功能、癌区域的定位、脑活动和胃活动的定位的领域。相反,本发明不依赖于图像重建软件,而是取代地使用被包括在消融导管中的(一个或多个)电极与多个外部电极以及特殊配置的开关装置的组合,以
确定在持续监测消融导管的使用的有效性时使用(与特定的导电路径相对应的)哪个电极组,这些电流路径的测得的电特性中的响应提供了损伤形成进展的相对直接的实时指示。与eit一样,通常在本发明的方法中施加的电流相对较小并且处于适当高的频率,以避免身体内的显著神经刺激或欧姆加热。与使用eit来监测损伤形成不同,本发明不需要复杂的计算解决方案,并且也不需要求助于ct成像或位置信息。
36.(一个或多个)导管电极的接近度建立了将加热的体积包括在到一个或多个外部电极的所得到的电路径中,并且根据本发明,通过在多个电极上迭代地施加电流并执行电压测量来找到最合适的电流路径。规定的标准(诸如最低计算的阻抗测量结果)被认为是用于在消融治疗期间监测损伤形成的最适当路径的指示。
附图说明
37.根据通过示例并参考附图给出的以下描述,本发明的其他方面和前面段落中描述的方面的其他实施例将变得显而易见,其中:
38.图1是根据本发明的一个实施例的用于在患者的rf导管消融期间监测损伤发展的系统的概述。
39.图2描绘了连接到rf发生器的图1的系统的消融接口。
40.图3描绘了系统的替代接口。
41.图4是示出根据本发明的一个实施例的用于在导管消融期间监测损伤发展的方法的流程图。
42.图5是图4所示方法的测量阶段的流程图。
43.图6是示出根据本发明的替代实施例的用于在导管消融期间监测损伤发展的方法的流程图。
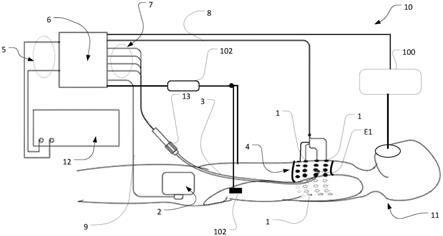
44.图7是图6所示方法的测量阶段的流程图。
45.图8示出了布置在16个的四带状物中的64个ecg电极(“点电极”)的实施例。
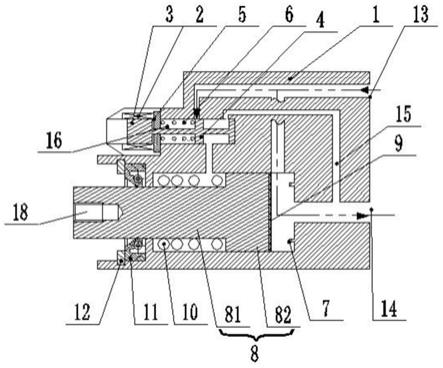
46.图9是导管装置和消融损伤的示意图。
具体实施方式
47.将理解的是,本说明书中公开和限定的本发明延伸到文本或附图中提到或显然的两个或更多个单独特征的所有替代组合。所有这些不同的组合构成本发明的各种替代方面。
48.图1所示的系统10提供在rf导管消融期间对损伤发展的监测,并且包括用于引入患者11的心脏室中的rf消融导管3(包括rf辐射器和rf电源线)。导管3设置有导管电极e1、e2、e3、e4,电极e1包括rf消融电极(参见图9),而患者返回电极2被附接到患者的大腿或其他合适的位置。如下面进一步讨论的,外表面电极1的带4缠绕在患者的胸部周围。外部电极1可以是传统的ecg点电极,在这种情况下被用于测量电压。
49.消融导管3可以是例如3.5mm fr thermocool导管(韦伯斯特生物官能公司(biosense webster inc.))、therapy cool flex消融导管或本领域技术人员已知的任何其他合适的装置。消融发生器12可以是例如stockert 70心脏消融射频发生器st4520(韦伯斯特生物官能公司)。
50.电接口模块6(关于本发明的实施例2也被标记为6a,下面进一步讨论)包括多个继电器和n路开关(例如开关矩阵16/16a,被包括在阻抗测量电路17/17a(参见图2和图3)中),所述电接口模块6被配置为管理患者11的治疗的消融阶段和测量阶段。
51.开关控制由运行定制计算机程序(未示出)的pc提供。rf发生器12的输出被称为接口模块6/6a的输入5。此外,接口模块6/6a通过引线9电连接到患者返回电极2,通过外部电极引线8电连接到电极带4的每个外部电极1,并且借助于电缆连接器13通过引线7电连接到导管3的每个内部电极e1、e2、e3、e4。
52.另外,系统还可以包括实时ecg/qrs(心跳)检测器102,该ecg/qrs(心跳)检测器102具有放置在患者的每个手腕上的ecg电极101。呼吸机100可以用于在消融手术期间对被麻醉的患者11进行供氧,在这种情况下,呼吸机100被配置为使得呼吸循环测量结果由计算机程序接收。替代地,如果患者11仅处于镇静状态,则可以使用从另一个源接收的指示呼吸功能的信号,例如胸壁阻抗的波动。实施例1
53.图2中示出了连接到rf发生器12的电接口模块6的电路的第一实施例。消融分流器24、继电器19和继电器组20、21、22(统称为继电器组23)中的继电器被示出为处于阻抗测量位置中。开关矩阵16的n路开关被示出为设置在任意位置处,然而在“测量阶段”期间,开关将循环通过多个位置,如下面详细描述的。
54.开关矩阵16由四个n路导引开关18a、18b、18c、18d组成。在示例配置中,开关18a和18b是4路开关,其中每个开关的掷提供与导管电极e1
‑
e4中的每个的连接。开关18c和18d是64路开关,但是为了易于描绘,仅示出了四个端子。开关18c和18d的掷提供与64个外表面电极1中的每一个的连接。这些n路导引开关18a、18b、18c、18d一起允许ac恒流源15和高精度电压表14的端子(具有经由adc的输出)选择性地连接在导管电极e1
‑
e4和外部电极1中的任何一个上。
55.如基于竞争因素所确定的,使用ac电流源15的适当操作频率。频率必须足够高以避免组织刺激并允许在短时间段内采集若干个测量循环,但频率也必须足够低以使导管内的寄生电容的影响最小化并使来自消融能量的施加频率的任何干扰最小化。在初始测试中,发明人发现50khz
‑
100khz范围内的频率是优选的。如由竞争因素所确定的,还适当地选择注入的电流的振幅。更高的电流提供更好的电压分辨率,尤其是对于低阻抗路径,然而电流不应太高以至于电极本身开始加热。在初始测试中,发明人发现2
‑
5ma范围内的电流是优选的。
56.因此,测量电路17被配置为执行顺序的四端子阻抗测量。为了执行每个测量,在第一导管电极e1/e2/e3/e4与第一外部电极1之间供应电流,并且在第二导管电极和与第一外部电极相邻的第二外部电极之间测量所得的电压。然后将所得的阻抗从adc电压表14的usb输出传递到外部pc(未示出)。
57.在图8所示的示例配置中,电极带4由四排16个外部“点(dot)”电极1组成。与电极“a”和“b”直接相邻的电极组分别由虚线轮廓和点线轮廓指示。如将注意到的,电极“a”(如上排或下排中的所有其他电极)具有五个直接邻近的电极,而电极“b”(如中心排中的所有其他电极)具有八个直接邻近的电极。电极带4在图8中被示出为平坦的,但是将理解的是,在使用中,它缠绕在患者的胸部周围,使得所描绘的最左侧和最右侧电极成为相互邻近的
电极。
58.作为示例四端子布置,通过将电流源15的正端子i 连接到导管电极e3,将电流源15的负端子i
‑
连接到外部电极“a”,将adc电压表14的正端子v 连接到导管电极e2,并且将adc电压表14的负端子v
‑
连接到与电极“a”邻近的五个外部电极1中的任何一个,实现在导管3与电极“a”之间的导电路径中获得阻抗测量。因此,五个测量中的任何一个可以提供到与电极“a”相关联的导管的电流路径的确定,并且本发明的方法使用所有五个测量来确定最合适的。这同样适用于电极带4的上排或下排中的任何电极。
59.类似地,对于电极“b”(或电极带4的中间排中的任一个中的任何其他电极),八个测量中的任何一个可以提供到与该电极相关联的导管的电流路径的确定,并且本发明的方法使用所有八个测量来确定最合适的。下面参考本发明的方法的校准阶段和测量阶段进一步讨论阻抗测量。
60.返回到图2,消融分流器24由两个spdt(单刀双掷)继电器19组成,它们同时操作,以便在正在执行测量的同时,将来自rf发生器12的电消融功率引导至导管电极e1和返回电极2上,或引导至虚拟负载25(例如10ω电阻器)上。spdt继电器19可以是例如g6ek
‑
134p
‑
st
‑
us
‑
dc5(欧姆龙电子组件)继电器。这种布置为测量电路17和其他组件提供了保护,使其免受高压和rf噪声的影响。
61.此外,消融隔离继电器组20、21、22(统称为继电器组23)被布置为与消融分流继电器19同步操作。在消融期间,接地继电器20将开关矩阵17的n路开关的掷连接到地。隔离继电器21隔离外部点电极1与导管电极e2至e4。继电器22将导管尖端电极e1和返回电极连接到消融分流继电器的相应掷。
62.在一种状态下(可以在其中进行阻抗测量),继电器组20和21一起允许从开关18a、18b的掷到每个导管电极e1
‑
e4的连接以及从开关18c、18d的掷到每个外部电极1的连接,而返回电极2从导管尖端电极e1断开(如图所示)。
63.因此,消融分流继电器19和继电器组23的消融隔离继电器使得系统能够在两种状态(即消融状态和测量状态)之间切换。本发明的方法涉及在这两种状态之间循环的迭代过程,下面参考图4讨论关于其的本实施例。
64.图4所示的过程涉及设置阶段,随后是确定阶段,随后是重复的消融阶段和测量阶段,其重复的消融阶段和测量阶段继续进行直到获得所需的损伤大小(如使用电压/阻抗测量确定的),此时停止治疗。设置阶段
65.该过程的第一步骤是设置阶段41,在所述设置阶段期间,ac电流源15和adc电压表14被用于使用导管3的两个电极和外部电极1中的每个来获得四端子内部到外部电压测量。设置阶段的目的是获取内部电极与外部电极之间的所有可能的电路径的测量,以允许确定对于正在进行的测量的最佳路径。如将理解的,对于已知电流的注入,所测得的电压提供对电流路径的阻抗的确定。
66.如上所讨论的,针对导管与外部电极之间的电路径获得由所施加的电流产生的电压测量结果。消融导管(例如韦伯斯特生物官能thermocool消融导管)通常具有四个导管电极,然而对于四端子电压测量来说仅需要两个内部电极。在所描述的示例中,e2和e3被用于执行测量,其中e1仅被用于消融并且e4不被使用。发明人认为e4离导管尖端太远,而测试表
明,在实践中,使用e1的阻抗测量结果往往是不期望的噪声,这可能是由于消融分流器24从rf信号到e1提供的隔离的限制。
67.再次返回到图2,为了获得四端子阻抗测量,i 连接到导管电极e3,v 连接到导管电极e2,i
‑
连接到第一外部电极1,并且v
‑
顺序地连接到与该第一外部电极相邻的每个电极。记录对于每一个的所得到的电压测量结果。然后切换i
‑
以连接到第二外部电极1,其中将v
‑
顺序地切换到与该第二外部电极邻近的电极。这一直持续到已经施加了电流,并且测量并记录所有外部电极的所得到的电压。
68.如上所述,对每个外部电极1进行多次四端子电压测量,这涉及与每个外部电极邻近的电极。在图8所示的配置中(带4由布置成四排、每排16个电极的64个电极组成),总共记录416个阻抗测量结果和路径(顶部带和底部带中的每个电极为五个,且中间带中的每个电极为八个)。确定消融测量路径
69.返回到图4,该过程然后进行到确定步骤42,在其中分析来自设置阶段的结果以做出关于10个最合适的导管到外部电极路径的决定。
70.由于较低的阻抗通常指示更直接的路径和相关联的较低噪声风险,因此“最佳”路径被认为是最低阻抗的路径。然而,将理解的是,在替代方法中,可以使用其他标准。
71.例如,可以选择对将合适的盐溶液引入导管部位表现出最高灵敏度的路径。
72.如下面进一步讨论的,不是选择单个内部到外部电极路径,而是步骤42涉及确定10个路径,使得如果发现路径不可靠(例如由于肺野的存在),则其他测量路径是可用的。如本领域读者将理解的,可以选择任何数量的内部到外部电极路径,发明人确定十个路径为本发明的方法提供适当且可行的数量的替代方案。如将理解的,选择更多的路径将涉及更长的监测时间,而选择更少的路径可能引入随机误差。
73.在下面关于本发明的实施例2讨论的替代方法中,不是在消融过程期间确定用于阻抗测量的有限数量的路径,而是可以在每个测量阶段测量所有路径阻抗,其中根据规定的标准确定在分析中使用哪些路径。消融阶段
74.一旦确定步骤42完成,rf消融治疗就开始(消融阶段43)。如上所讨论的,在该阶段期间,消融隔离继电器21,即在pc的控制下将导管电极和外部电极1从阻抗测量电路17断开。消融隔离接地继电器20将导管电极和n路开关18的外部电极端子连接到地。
75.消融分流继电器19和消融隔离继电器组22将来自rf发生器12的rf消融能量提供到导管尖端辐射器电极e1、患者返回电极2以提供电返回路径。将rf消融能量施加合适的时间由此加热组织以开始损伤形成。在实验测试中,根据包括患者的呼吸速率的各种因素来选择,以便选择5.2秒的消融持续时间,如下面更详细地讨论的。
76.在每个消融阶段之后,使用继电器电路将rf发生器12从导管尖端电极e1和患者返回电极2切换到虚拟负载25;当该切换发生时50ms的暂停为正发展的损伤周围的区域提供了热平衡的时间。在该时间期间,在消融阶段期间加热的外周静脉或动脉流体/血液远离导管尖端区域流动,使得任何热变化仅存在于损伤中。测量阶段
77.测量阶段44被用于在消融治疗进行时(即在连续的消融循环之间),在从选定路径
的内部电极到外部电极施加电流时测量所得的电压,从而提供损伤的大小的测量结果。在消融阶段结束时的50ms延迟之后,rf发生器12从导管尖端电极e1和患者返回电极2切换到虚拟负载25。
78.在pc的控制下,开关矩阵16形成连接,以使得能够对在确定阶段42中选择的10个测量路径进行连续的四端子电压测量。
79.图5的流程图提供了测量阶段44的进一步细节。因为由于组织内的消融而导致组织阻抗将随着温度的升高而下降,所以如果10个阻抗测量中的任何一个示出了现在的测量与最近测量(在设置阶段或最近测量阶段中)之间的阻抗增加,则应该忽略阻抗值。阻抗的增加可以指示路径具有低信噪比(snr),或者测量由意外事件或噪声主导。
80.参考图5,测量阶段过程关于第一测量路径(即路径i=1)开始(步骤50)。在pc的控制下,开关矩阵16被配置为对在决策步骤42中识别的第一路径进行单个四端子电压测量(步骤51),其被用于确定阻抗。然后在判定(decision)步骤52中将该值与存储的先前值进行比较。如果第一路径的该新阻抗测量结果低于先前值,则将使用该测量结果用作(步骤53)损伤的大小的指示。如果新阻抗测量结果高于先前值,则丢弃该值(步骤54)。
81.然后,通过递增计数(i=i 1;步骤58)并重复该过程,对下一路径进行阻抗的测量和确定。判定步骤59确定是否已经测量了所有10个路径,这时,过程移动到判定步骤57。如果确定10个阻抗值中没有一个低于其先前测量结果,则可以认为损伤与先前的循环具有相同的大小(步骤55)。这可以表明消融失败并且需要重复,然而在消融过程即将结束时,达到平衡状态并且损伤不再显著增长。当然,关于继续消融的判定将由心脏病专家/外科医生根据由阻抗测量结果的告知而做出。
82.如果确定(步骤57)至少一个阻抗测量结果已经被标记为使用(即该特定路径的阻抗已经减小,指示损伤大小的增加),则pc使用阻抗测量结果来使用预定义的一组阻抗深度曲线和宽度曲线进行损伤大小的确定(步骤56)。
83.为了排除可能的低估值和高估值,0.45至0.55的累积概率的深度和宽度组的分位数被用于约束结果。这些可以被扩展到0.35至0.65,然后最大为0.25至0.75,直到发现至少一个测量结果落在该范围内。因此,最终测量的损伤尺寸将表示平均深度和宽度。
84.图9提供了导管3的示意图,其中电极e1、e2、e3、e4靠近组织91内的损伤90,损伤宽度和高度由本发明的方法确定。
85.返回到图4,在测量阶段44之后,进行在最近的消融循环之后的损伤大小的确定。在判定步骤45处,如果确定损伤具有所需的大小,则消融治疗过程结束。如果尚未达到所需的损伤大小,则外科医生/心脏病专家可以决定开始下一次消融迭代,因此该过程返回到消融阶段43。
86.如将理解的,消融和阻抗测量循环的该重复交替提供了对治疗过程的实时连续监测,但是rf场不会干扰测量设备(或反之亦然)。实施例2
87.在该替代实施例中,图3中示出了连接到rf发生器12a的电接口模块6a的电路。消融分流继电器19a和继电器组31和32的继电器被示出为处于阻抗测量位置中。开关矩阵16a的n路开关被示出为设置到任意位置,然而在测量阶段期间,开关将再次循环通过多个位置。
88.开关矩阵16a由多个n路导引开关30和30a至30x组成。与实施例1的布置不同,电流源的i 不连接到四路开关,而是经由消融隔离继电器仅连接到电极e2,并且v 类似地经由消融隔离继电器仅连接到导管尖端电极e1。导引开关30的极连接到电流源的i
‑
端子,并且开关30a至30x的极连接到多个模数转换器(adc)14a
‑
14x的v
‑
端子。
89.在该实施例中,发明人对设备的改进(特别是在提供更可靠的快速切换以将rf发生器与导管隔离方面)意味着(与实施例1不同)导管尖端电极e1可以被用作阻抗测量电极。这是优选的,因为e1是离消融区域最近的导管电极。
90.为了易于描绘,仅示出了n路开关的三个端子。开关30至30x的掷连接到电极带4的外部点电极1至n。在本实施例中,测量电路17a的n路导引开关允许并行地进行四端子阻抗测量,从而减少了测量所有阻抗路径(在该实施例中,总共416个路径)所需的时间长度。
91.在测量阶段期间,电流源的i
‑
端子顺序地连接到每个外部点电极,而(一个或多个)v
‑
端子连接到电流源i
‑
端子位置的邻近点电极。例如,测量电路17a可以包括8个adc(adc1
‑
adc8),具有8个对应的n路开关30a至30h,并且因此在开关矩阵16a中总共有9个n路开关(包括开关30)。如将理解的,以这种方式,对于ac电流源15的每个i
‑
端子位置,可以同时测量所有8个邻近电极,因此显著缩短总采样时间。
92.消融分流继电器19a是spdt(单刀双掷)继电器,如在实施例1中所使用的,其再次同时操作,以在正执行测量的同时,将来自rf发生器12a的电消融功率引导至导管电极e1和返回电极2上,或引导至虚拟负载25(例如10ω电阻器)上。这种布置为测量电路17a和其他组件提供了保护,使其免受高压和rf噪声的影响。
93.此外,接地继电器31被布置为与消融分流继电器19a同步操作。因此,消融分流继电器19a和接地继电器31使得系统能够在两种状态(即消融状态和测量状态)之间切换。再次,所述方法涉及在这两种状态之间循环的迭代过程,如下面参考图6所讨论的。
94.为了在阻抗测量中避免来自rf发生器12a的噪声,继电器组32的继电器在测量阶段期间将导管电极e2至e4从rf发生器断开。然而,在消融阶段期间,医生可以使用来自e2、e3和e4的信号来确认导管位置,尽管位置确定不形成本发明的一部分。
95.上面参考实施例1描述的选择10个测量路径的过程旨在减少测量循环时间。如果阻抗测量可能受到电力线干扰的影响,并且必须选择测量持续时间以考虑这样的干扰,则这是特别相关的。例如,5个电力线循环的持续时间可以适合于减少干扰的影响。对于50hz市电频率,进行一次测量的时间(测量时段)因此可以是100ms(5
×
1/50hz)。在电力线干扰不显著的情况下,发明人已经确定2.5ms的测量持续时间是合适的。
96.因此,在本实施例中,更短的测量间隔与并行切换的使用相结合允许在每个测量阶段中使用所有n个电极,而不会不期望地中断消融过程。发生这种情况的具体连接模式可以由定序器布置,以便允许每个开关位置的最小数量的改变。为此,非常快速的固态开关被用于n路开关30a
‑
30x。
97.在本实施例中,由于在测量阶段中测量所有路径阻抗(而不是路径的预选子集),因此不需要执行单独的设置阶段。该过程在图6中示出,其描绘了测量阶段64与消融阶段63之间的循环,确定步骤65用于决定何时停止消融过程。测量阶段
98.在测量阶段64中,针对所选择的导管电极(在这种情况下为e1和e2)与所有外部电
极1之间的电路径获得并记录由所施加的电流产生的电压测量结果。
99.如上所述,关于所有邻近电极,对每个外部点电极1进行多次四端子电压测量。在图8的配置中(带4由布置成四排、每排16个电极的64个电极组成),总共记录416个阻抗测量结果和路径(顶部带和底部带中的每个电极为五个,且中间带中的每个电极为八个)。在使用八个adc的情况下,可以在单个循环中测量与外部点电极1邻近的所有八个电极。因此,对于2.5ms的单个测量持续时间,完整测量循环的持续时间将是160ms(2.5ms
×
64=160ms)。如将理解的,在这种情况下,八个adc中的三个将记录对于顶排电极和底排电极的空测量结果,这些空测量结果自动从记录/分析中排除。
100.图7的流程图提供了测量阶段64的进一步细节。如将理解的,该过程的多个步骤与上面参考图6描述的相同(并且这里将不再详细描述),然而在实施例2中,测量和处理所有阻抗路径,而不是路径的预选子集。
101.注意,虽然仅使用其中测量结果示出阻抗减小的电流路径的结果(步骤54a),但是也可以处理阻抗路径测量结果增加的电流路径的结果,以便提供附加信息。例如,这样的结果可以表示导管已经在连续测量之间移动。
102.在步骤71处,计算每个测量的先前z
istart
和当前z
icurrent
之间的差值δz
i
。在消融的前30秒内测量平均斜率(slope)δz/δt
30sec
(以欧姆/秒来测量)。在步骤72处,使用下式校准每个测量结果:
103.然后对结果进行进一步合适的处理(特别地,回归分析)以确定损伤大小(和其他特征)。特别地,然后在步骤73处使用经校准的测量结果中的一些或全部来确定损伤大小和定向。将来自每个循环的测量结果相对于时间进行回归,以提供用于确定损伤大小的对数热上升曲线。可以通过将损伤大小与外部点电极位置相关联来确定定向。该方法消除了对如上参考实施例1所述的已知阻抗与深度和阻抗与宽度曲线的需要。
104.如将理解的,在所进行的所有阻抗测量中,要处理的特定阻抗测量结果(以及要分析的特定经校准的测量结果)的选择将取决于各种不同的因素。该选择可以在计算机软件的控制下根据规定的标准进行(如果需要,在动态的基础上)。
105.如图6中示意性地示出的,一旦在最近的消融循环之后确定了损伤大小,则在判定步骤65处,消融治疗过程结束(如果损伤被确定为具有所需的大小),或者(如果不具有所需的大小)消融和测量的下一次迭代开始。如将理解的,可以在初始测量阶段之后、在已经施加任何消融治疗之前绕过确定步骤65。
106.一旦消融中断,就可以进行阻抗测量阶段的进一步循环,以便监测阻抗值的反弹。虽然由于组织组成和结构的变化而导致的阻抗变化是永久的,但是由于温度而导致的阻抗变化不是永久的。因此,该消融后监测允许阻抗恢复曲线的生成和分析,从而提供关于所执行的消融的机制和特性的有价值的信息。
107.本发明的上述示例涉及四端子阻抗测量技术,这是低阻抗感测中的方便方法,并且避免了由于接触和/或导线电阻而导致的测量误差。然而,本领域的读者将理解,本发明可以使用其他技术来实现,诸如2端子或3端子方法。
108.此外,在上述任一实施例中,阻抗测量可以由患者的呼吸循环和ecg来门控,以提
供在相对稳定的点处进行的测量。在这方面,稳定的点被认为是来自呼吸机100的“肺空”指示后的第一qrs之后200ms的时间点。特别地,在消融阶段之后,在下一个稳定的点处,发生器12与导管断开并切换到虚拟负载25,由此进行阻抗测量。典型消融阶段的持续时间可以是3
‑
5秒(在一个呼吸循环内)。在患者的呼吸率为约12/m(即,5s)并且典型的消融过程花费30秒与90秒之间的时间的情况下,这将涉及约6
‑
18个消融/测量循环。如本领域的读者将理解的,替代方法是可能的。例如,可以针对每个呼吸循环进行多次测量(针对所有阻抗路径),理想地受患者的ecg的门控。
109.如本说明书中其他地方所述,虽然所描述和示出的实施例方便地使用施加在患者身体外部的电极来提供电流传导端子,但是患者身体内部的其他部位也可以是合适的,只要它们足够远离导管电极并与患者接触即可。例如,这些“外部”电极可以适当地放置在食道和/或冠状窦内。在使用这样的方法时,电解剖标测系统可以与ct/mri成像集成,以准确地确定这些“外部电极”部位在解剖体积内的位置。
110.此外,以上描述涉及rf消融,但是所述方法也可以与其他导管消融技术(诸如微波辐射消融)一起使用。在这样的实施例中,微波辐射导管可以配备有一个或多个合适放置的电极,诸如盐水电极或传统金属电极。
111.如本文所使用的,除非上下文另有要求,否则术语“包括”和该术语的变型(诸如“包含”、“含有”和“具有”)并不旨在排除其他添加、组分、整数或步骤。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。