1.本发明属于药物化学领域,具体的说是涉及抗肿瘤药物的合成领域,更进一步具体说是涉及一种右丙亚胺的制备方法。
背景技术:
2.右丙亚胺(dexrazoxane)中文化学名:(s)-( )-4,4'-(1-甲基-1,2-联亚甲基)-双(2,6-哌嗪二酮),为心脏保护剂,临床用于预防蒽环类抗肿瘤药物造成的心脏毒性及白血病患儿因接受化疗而引发的心脏损伤,常作为癌症治疗中的辅助用药。该药是由美国chiron公司开发,1992年首先在意大利上市,随后陆续在美国、欧洲、亚洲、非洲等多国上市。最近研究表明,该药有望成为蒽环类抗肿瘤药物的标准配伍用药,且具有调节拓扑异构酶ⅱ的活性和细胞铁代谢等方面的潜力,在癌症治疗、免疫学、感染性疾病等方面的应用将可望成为重点药物。
3.右丙亚胺结构式:专利文献 us3941790及us4275063中描述了一种制备双哌啶二酮的方法,其中就包括右丙亚胺的合成。文献中丙二胺盐酸盐和氯乙酸反应形成四乙酸 ,在氮气保护下四乙酸与甲酰胺在较高温度下生成右丙亚胺。 以此路线合成四乙酸利用高温树脂柱纯化,费时耗力。
4.专利文献 gb978724中描述了丙二胺盐酸盐与甲醛及氰化氢反应形成 s-1,2
-ꢀ
丙二胺
ꢀ-
n, n, n’,n
’-
四乙腈,四乙腈经皂化反应制备四乙酸,该方法使用了剧毒原料氰化物,限制了这些方法在工业上的应用。专利文献 us4764614中公开了使用s-1,2
-ꢀ
丙二胺
ꢀ-
n, n, n’, n-四乙酰胺与氨基钠在二甲基亚砜中,通过加热、降温、过滤、加酸、加热、降温等复杂操作过程制备右丙亚胺。 同时由于反应在碱性条件下进行,为避免产物内酰胺的降解,操作过程需尽量密闭并采用氮气保护以减少水分的引入,操作条件严苛,不利于工业化生产。
5.专利文献us20100152447a 中公开了四乙酸在过量浓硫酸催化下形成四乙酸甲酯的方法,得到的s-1,2
-ꢀ
丙二胺
ꢀ-
n, n, n’,n
ꢀ-
四乙酸甲酯,首先在甲酰胺中于40-50℃和气态氨下反应12小时,接着150℃蒸馏,然后140-150℃反应 10-12小时,右丙亚胺收率为39-50%。 此工艺中四乙酸甲酯虽然由于酯化后降低了极性,可以采用溶剂萃取进行脱盐纯化,但四乙酸甲酯在水中溶解度低,合成中需要较多体积的甲基叔丁基醚萃取,同时该工艺需使用硅胶柱快速纯化s-1,2
-ꢀ
丙二胺
ꢀ-
n, n, n’,n
ꢀ-
四乙酸甲酯,环合反应需要使用气
态氨,对设备有额外的要求,这些都提高了此路线的成本,加上后期环合需要长时间的中、高温反应,降低了产品的品质。
6.专利文献cn201310192427.1,对以四乙酸甲酯为原料制备环合产物进行了优化,采用二氧六环做溶剂,氢化钠做碱,加入甲酰胺进行环合,但反应时间长,后处理操作复杂,且收率较低,收率范围仅为30-50%。
7.综上,目前制备右丙亚胺的方法主要分为两种,方法一是以甲酰胺为胺源,与(s)-1,2-二氨基丙烷-四乙酸或四乙酯进行环合,此方法收率低、成本高,不易于大生产。另外,此方法在分离中间体过程有采用柱层析,操作繁琐,也有在制备过程中用到了剧毒的氰化物,污染环境,不宜工业化生产。方法二是先分离中间体(s)-1,2-二氨基丙烷-四乙酰胺或其盐,再进行环合制备,后通过加热、降温、过滤、加酸、加热、降温等复杂操作过程制备右丙亚胺,也不利于工业化。
技术实现要素:
8.本发明提供了一种制备右丙亚胺的新方法,以1,2-丙二胺为起始原料,用d-酒石酸进行拆分,然后置换成(s)-1,2-丙二胺的盐酸盐,与溴乙酸酯缩合制备(s)-1,2-二氨基丙烷-四乙酸酯,以酰胺为氨源头,酯类化合物活化下,制备右丙亚胺,本发明收率高,反应条件温和,方便转移,对环境污染少,有利于大规模工业化生产。
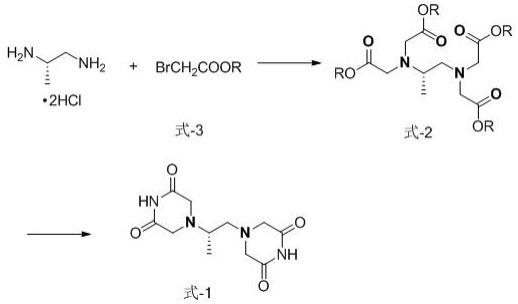
9.本发明得合成路线如下:本发明得具体技术方案如下:一种右丙亚胺的制备方法,该方法包括如下步骤:(1)将(s)-1,2-二氨基丙烷盐酸盐与化合物式-3在碱性条件下反应,采用乙腈为反应溶剂,在25~75℃下,反应3~20小时,经后处理获得化合物式-2;(2)在碱性溶剂中,步骤(1)中获得化合物式-2与酰胺、在酯类化合物的活化下,5-80℃的条件下,反应1-10h,反应产物经处理后得化合物式-1。
10.其中化合物式-2中r选自甲基、乙基、丙基、异丙基等,优选乙基。
11.其中步骤(1)中(s)-1,2
-ꢀ
二氨基丙烷盐酸盐与式-3化合物的摩尔比为1:5
-ꢀ
1:
10,(s)-1,2
-ꢀ
二氨基丙烷盐酸盐与碱的摩尔比为1 :5
-ꢀ
1:10。
12.其中步骤(1)中所述的碱为n,n,-二异丙基乙胺、三乙胺、碳酸钾或者碳酸钠。
13.其中本发明步骤(1)中的(s)-1,2-二氨基丙烷盐酸盐由1,2-丙二胺通过d-酒石酸拆分获得,该制备方法如下:1)1,2-丙二胺与d-酒石酸,水作溶剂,经重结晶制备(s)-1,2
-ꢀ
二氨基丙烷酒石酸盐;2)向反应容器中加入(s)-1,2
-ꢀ
二氨基丙烷酒石酸盐、加入盐酸溶液、有机溶剂,反应温度25-85℃,搅拌析晶,过滤得(s)-1,2
-ꢀ
二氨基丙烷盐酸盐。
14.本发明所用的拆分方法采用了特定浓度的盐酸溶液,物料方便易得,与目前常用的氯化氢气体相比,使用更安全,操作更简单。在某些实施例中本发明所用的盐酸溶液的浓度为6-12mol/l,(s)-1,2
-ꢀ
二氨基丙烷酒石酸盐与盐酸的摩尔比为1:2.1-1:2.5。
15.其中拆分过程中所用的有机溶剂选择甲醇、乙醇、异丙醇、丙酮、乙腈,四氢呋喃、二氧六环或者甲基叔丁基醚中的一种或几种混合物,优选二氧六环。
16.本发明所述的化合物式-2的处理方法为:首先将反应物浓缩,用酸化试剂酸化,调节ph=2-3,有机溶剂洗涤,再经碱化试剂碱化,调节ph至9-10,有机溶剂萃取,干燥,过滤,将滤液浓缩得式-2化合物。酸化试剂为6n hcl溶液或hbr溶液,所述有机溶剂为环己烷、正己烷、正庚烷、甲基叔丁基醚中的一种或几种混合溶剂,所述有机溶剂用量与式-2化合物的质量比为10:1-20:1,在某些实施例中所用的有机溶剂式环己烷,所述碱化试剂选自碳酸钾、碳酸钠、碳酸氢钠、碳酸氢钾或naoh溶液,优选碳酸钠。
17.步骤(1)中采用特定的有机溶剂对反应物进行后处理,经处理后的化合物式-2收率高于85%,其化合物式-2含量大于97%。
18.本发明所述的步骤(2)中所述的碱性溶剂所用的碱选自氢化钠、氢化钾、甲醇钠、甲醇钾、乙醇钠、乙醇钾、叔丁醇钠、叔丁醇钾中的一种或几种混合物;所用的溶剂选自甲醇、乙醇、异丙醇、丙酮、乙腈、四氢呋喃、二氧六环中的一种或几种混合溶剂;所用的酰胺选自甲酰胺、乙酰胺、丙酰胺、丁酰胺、异丁酰胺或者三氟乙酰胺,优选乙酰胺,其中化合物式-2与酰胺类化合物的用量比为1:2.5~1:5,;所用的酯类化合物选自甲酸甲酯、甲酸乙酯、甲酸丙酯、甲酸异丙酯、甲酸丁酯、甲酸异丁酯、乙酸甲酯、乙酸乙酯、乙酸丙酯、乙酸异丙酯、乙酸丁酯、乙酸异丁酯、丁酸甲酯、丁酸乙酯、丁酸丙酯、丁酸异丙酯、丁酸丁酯或者丁酸异丁酯,优选甲酸乙酯。其中化合物式-2与酯类化合物的摩尔比比为1:2~1:5。酯类化合物的加入改变了步骤(2)的反应机理,促进了反应的进行,有效提高了反应速率,极大的缩短了反应时间,某些实施例中步骤(2)的反应时间为1-3h。
19.其中步骤(2)中反应产物的处理方法为:先将产物酸化处理,将反应液ph调至5-8,脱溶,再加入含水溶剂,经过滤得化合物式-1。所述的酸为无机酸、有机酸或它们的混合酸,例如甲酸、乙酸、草酸、苯甲酸、乙二酸、丁二酸中的一种或它们的混合酸,优选乙酸。其中所述含水溶剂是 水、水-甲醇、水-乙醇、水-异丙醇、水-乙腈、水-丙酮、水-二氧六环或者水-四氢呋喃,优选水、水-乙醇。其特征在于化合物式-1与含水溶剂的质量比为1:5~1:15。
20.本发明对中间体化合物式-2采用特殊溶剂进行后处理,处理后的中间体化合物式-2不仅极大的提高了产物收率,同时也保障了产量的含量,中间体收率及纯度的提高,进一步保障了最终产品的收率及纯度,在步骤(2)中,本发明首次使用活化酯类化合物,有效提高了反应效率,经含水溶液的简单处理后,即可获得高产率、高纯度的产物式-3,使用本
发明的方法所制备化合物式-3的收率不低于78%,在某些实施例中其收率不低于80%,化合物式-3的纯度不低于99.5%。
附图说明
21.图1实施例1-2.1的hplc;图2实施例3-3.1的hplc。
具体实施方式
22.为了更好的说明本发明的技术方案,本发明提供了下述具体实施例来进行说明,但不用于限制本发明所保护的范围。
23.实施例1 :(s)-1,2
-ꢀ
二氨基丙烷盐酸盐的制备实施方案1.1将d-酒石酸(1133.16g,7.56mol),水2646ml加入到3l的单口瓶中,室温搅拌,冰水浴下,滴加丙二胺(280.00g,3.78mol),加热回流使其溶清,全溶后缓慢降温,45℃搅拌析晶12h,抽滤,滤饼45℃鼓风干燥,烘干得795.00g,(s)-1,2
-ꢀ
二氨基丙烷酒石酸盐,收率:56.3%,将(s)-1,2-二氨基丙烷酒石酸盐400g和浓盐酸250g加入到10l的反应釜中,搅拌溶解,加入二氧六环,室温反应4h,抽滤,滤饼45℃真空干燥,烘干得132.80g,收率:84.5%.实施方案1.2将d-酒石酸(5.26kg,35.08mol),水13l加入到50l的反应釜中,室温搅拌,冰水浴下,滴加丙二胺(1.30kg,17.54mol),加热回流使其溶清,全溶后缓慢降温,45℃搅拌析晶18h,抽滤,滤饼45℃鼓风干燥,烘干得3.30kg,(s)-1,2
-ꢀ
二氨基丙烷酒石酸盐,收率:50%。
24.将(s)-1,2
-ꢀ
二氨基丙烷酒石酸盐2.5kg和1.56kg浓盐酸加入到50l的反应釜中,搅拌溶解,加入乙腈,室温反应12h,抽滤,滤饼45℃真空干燥,烘干得0.85kg,收率:87%.实施例2:化合物式-2 (s)1,2-二氨基丙烷-四乙酸乙酯的制备实施方案2.1将(s)-1,2-二氨基丙烷盐酸盐(100.00g,0.68mol)、diea(879.18g,6.80mol)、乙腈2.5l,加入到5l的三口瓶中,滴加溴乙酸乙酯(567.80g,3.4mol),滴毕,内温50℃反应10h,将体系旋干,用6n的hcl调节ph调为3左右,用正庚烷萃,弃有机相,水相用饱和碳酸钠水溶液将ph调为9左右,用乙酸乙酯萃取,弃水相,合并有机相旋干得241.00g,收率85%,hplc检测,纯度96.54%。
25.实施方案2.2将(s)-1,2
-ꢀ
二氨基丙烷盐酸盐(0.8kg,5.44mol)、diea(5.27kg,40.80mol)、乙腈8l,加入到50l的反应釜中,滴加溴乙酸乙酯(9.08kg,54.40mol),滴毕,内温70℃反应4h,将体系旋干,用6n的hbr调节ph调为3左右,用环己烷萃取溴乙酸乙酯,弃有机相,水相用饱和碳酸钠水溶液将ph调为9左右,用二氯甲烷萃取,弃水相,合并有机相旋干得1.98kg,收率87%,hplc检测,纯度95.85%。
26.实施例3 :化合物式-3 右丙亚胺的制备实施方案3.1
将甲酰胺(84.34g,1.87mol),乙酸乙酯(159.12g,1.80mol),丙酮2.4l,乙醇钠(194.88g,2.87mol)加入到5l的三口瓶中,室温搅拌1h,加入式-2化合物(240.00g,0.57mol),内温70℃反应3h,反应完毕,滴加草酸调节ph,调节完毕,将体系旋干,加水,室温搅拌1h,抽滤,滤饼用水洗涤,60℃真空干燥4h,烘干得129.85g,收率:85% ,hplc检测,纯度99.71%。
27.实施方案3.2将甲酰胺(42.17g,0.94mol),甲酸乙酯(79.56g,1.08mol),无水乙醇3.0l,乙醇钠(97.44g,1.44mol)加入到5l的三口瓶中,室温搅拌2h,加入式-2化合物(120.00g,0.29mol),内温70℃反应6h,反应完毕,滴加乙酸调节ph,调节完毕,将体系旋干,加水/乙醇,室温搅拌1h,抽滤,滤饼用水洗涤,60℃真空干燥4h,烘干得61.11g,收率:80% ,hplc检测,纯度99.65%。
28.实施方案3.3将乙酰胺(126.51g,2.15mol),甲酸乙酯(238.68g,3.23mol),无水乙醇2.8l,乙醇钠(292.32g,4.31mol)加入到5l的三口瓶中,室温搅拌1h,加入式-2化合物(360.00g,0.86mol),内温70℃反应4h,反应完毕,滴加醋酸调节ph,调节完毕,将体系旋干,加水,室温搅拌1h,抽滤,滤饼用水洗涤,60℃真空干燥4h,烘干得178.73g,收率:78% ,hplc检测,纯度99.90%。
29.对比例1:化合物式-2 后处理溶剂使用cn201310192427.1专利所述的方法将(s)-1,2-二氨基丙烷盐酸盐(500mg,3.4mmol,1eq)、溴乙酸甲酯(5202mg,34mmol,10eq)、碳酸钾(4692mg,34mmol,10eq)、乙腈(34ml,0.1m),分别加入到100ml单口瓶中,25℃反应24h,反应结束,过滤掉无机盐,将滤液浓缩旋干,加入hcl(15ml,12%)溶液酸化,用石油醚(15mlx2,60-90℃)洗涤,用饱和碳酸钠溶液调节ph至10,再用二氯甲烷(15mlx3)萃取,干燥后浓缩干,得粗产品(s)-1,2-二氨基丙烷-四乙酸甲酯,粗产品收率55%。
30.对比例2右丙亚胺的制备将(s)-1,2-二氨基丙烷-四乙酸甲酯(2000mg,5.5mmol,1eq,0.1m)与甲酰胺(2475mg,55mmol,10eq)的二氧六环溶液(10ml)溶液,室温下缓慢滴加到溶有氢化钠(2640mg,66mmol,12eq,有效成分60%)的二氧六环溶液(37ml)中,在25℃氮气保护下反应24h,反应结束。过滤,用无水乙醚(20mlx2)洗涤,将滤饼加入到无水乙醚(55ml)中,用甲酸调节ph至7,过滤,将滤饼加入到二氧六环(100ml)中,50℃搅拌30min,过滤,将滤液浓缩至干,加入少量甲醇(2-3ml)静置,析出固体,过滤,抽干,得粗品右丙亚胺,为白色粉末,粗品收率为31%。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。