用于调节细胞内化的组合物和方法
关于联邦政府资助研发的声明
1.本发明是在通过美国国立卫生研究院授予的资助号r01 ca118919、r01 ca129491和r01 ca171315下由政府支持进行的。政府拥有本发明中的某些权利。相关申请的交叉引用
2.本技术要求2019年1月14日提交的美国临时专利申请序列号62/792,359的优先权,将该申请通过引用以其整体(包括任何附图)明确地并入本文。序列表的并入
3.本技术是与电子格式的序列表一起提交的。序列表以2019年12月23日创建的名为“sequence listing_048536
‑
628001wo.txt”的文件提供,其大小为约124kb。将在电子格式的序列表中的信息通过引用以其整体并入本文。
技术领域
4.本技术的各个方面涉及细胞生物学和免疫学领域。更特别地,本文提供了调节和/或扩大细胞类型特异性内化,例如将细胞类型选择性非内化表面抗原转化为细胞类型选择性内化表面抗原以及将细胞类型选择性内化表面抗原转化为细胞类型选择性非内化表面抗原的工程化抗体。本发明还提供了可用于产生此类工程化抗体的组合物和方法,以及用于治疗健康障碍或疾病(如与癌症相关的疾病,包括实体瘤和血液恶性肿瘤)的方法。
背景技术:
5.生物制药或包含用于治疗疾病、障碍或健康病症的治疗性蛋白质的药物组合物的用途是许多制药和生物技术公司的核心策略。例如,在癌症免疫疗法中,可靶向特定癌细胞以防止其增殖和/或杀死特定癌细胞的抗体和抗体
‑
药物缀合物(adc)的开发已成为补充现有治疗策略的有希望的治疗方法。
6.特别地,单克隆抗体的高特异性通常被用于靶向疗法开发。理想地,附接至细胞类型特异性抗体的有效的细胞毒性剂可以将所述细胞毒性剂导向靶细胞,并优先在靶组织中积累。靶向的治疗剂的另一个例子涉及抗体
‑
药物缀合物(adc),其在许多临床研究中显示出有希望的有效性。
7.尽管在概念上简单明了,但治疗性抗体和adc中的靶标选择受到以下发现的阻碍:很少发现所谓的肿瘤特异性抗原,并且甚至很少发现具有治疗剂靶向所需的特征(即由癌细胞以高水平均匀表达)且有效内化所需的特征的肿瘤特异性抗原。此外,通过质膜的移动是大分子细胞递送的主要限制步骤。因此,依赖于治疗剂的细胞内化的疗法的有效性取决于其在靶细胞表面的靶标的质量以及与其靶标复合的表面结合的治疗剂的细胞内化速率。此外,内化治疗性抗体通常是实现有效的细胞内有效载荷递送和肿瘤杀伤所需的,但这种要求对于可通过细胞膜扩散以引起旁观者效应的某些药物(如一甲基奥瑞他汀e(mmae))不是绝对的。在一些情况下,在需要细胞内有效载荷递送的靶向疗法中,许多肿瘤抗原高表达但内化不佳。在其他情况下,受体内化也用于关闭信号传导途径,从而导致脱敏,所述受体
内化是导致受体从质膜移动至细胞内部的受体介导的内吞过程。
8.因此,持续需要用于治疗疾病、障碍或健康病症(例如像炎性疾病、免疫疾病和癌症)的新方法和组合物。特别地,本领域存在对于通过改善治疗性抗体和adc的内化特性来治疗疾病、障碍或健康病症的更有效的组合物和方法的需要。
技术实现要素:
9.本节提供了本公开文本的一般性发明内容,但并不是其全部范围或其全部特征的全面内容。
10.本公开文本涉及用于通过引导物
‑
效应物双特异性抗体设计操纵细胞类型选择性抗体内化的组合物和方法。特别地,本文提供了能够共同接合在同一细胞的表面上表达的一对抗原(称为“引导物抗原”和“效应物抗原”)的工程化抗体。当由所述工程化抗体共同接合时,所述引导物抗原可以影响所述效应物抗原的细胞表面动力学和/或信号传导功能。在一些特定的设计中,所述效应物抗原是与靶信号传导途径相关的抗原,并且所述引导物抗原提供细胞类型特异性以重定向和增强对目标细胞的效应子功能。例如,通过使用能够结合(i)非内化效应物抗原和(ii)内化引导物抗原的引导物
‑
效应物双特异性抗体设计,可以将所述非内化效应物抗原转化为内化效应物抗原。类似地,通过使用能够结合(i)内化效应物抗原和(ii)非内化引导物抗原的引导物
‑
效应物双特异性抗体设计,可以将所述内化效应物抗原转化为非内化效应物抗原,如下文更详细描述的,在一些情况下,内化的调节直接影响细胞内有效载荷递送和受体信号传导。还提供了重组细胞、编码此类工程化抗体的重组核酸以及含有其的药物组合物。本公开文本还提供了可用于通过使用此类工程化抗体调节细胞或受试者中的细胞内化的组合物和方法,以及用于调节受试者中的细胞类型选择性信号传导和/或用于治疗健康障碍和疾病如与癌症(包括实体瘤和血液恶性肿瘤)相关的疾病的方法。
11.在一方面,本公开文本的一些实施方案涉及一种工程化抗体或其功能片段,所述工程化抗体或其功能片段包含:a)能够与具有第一细胞内化速率的细胞表面引导物抗原结合的第一抗原结合部分;和b)能够与具有第二细胞内化速率的细胞表面效应物抗原结合的第二抗原结合部分,其中所述工程化抗体或其功能片段的内化特性是由所述引导物抗原与所述效应物抗原的相对表面密度比率决定的,并且其中所述两个细胞内化速率中的一个比另一个速率大至少50%、至少70%、至少80%或至少90%。
12.本公开文本的工程化抗体的实施方案的实现可以包括以下特征中的一种或多种。在一些实施方案中,所述细胞表面引导物抗原是内化细胞表面抗原。在一些实施方案中,所述细胞表面效应物抗原是非内化细胞表面抗原。在一些实施方案中,所述引导物抗原与所述效应物抗原的相对表面密度比率大于阈值。在一些实施方案中,所述引导物抗原与所述效应物抗原的相对表面密度比率低于阈值。在一些实施方案中,所述阈值为约1:1、约1:2、约1:3、约1:4、约1:5、约1:10、约1:20或约1:30。在一些实施方案中,所述第一抗原结合部分和所述第二抗原结合部分独立地选自抗原结合片段(fab)、单链可变片段(scfv)、全长免疫球蛋白、纳米抗体、单结构域抗体(sdab)、可变新抗原受体(vnar)结构域和vhh结构域、多特异性抗体、双抗体或其功能片段。在一些实施方案中,所述引导物抗原和所述效应物抗原独立地选自激活的白细胞粘附分子(alcam)、神经细胞粘附分子(ncam)、钙激活的氯离子通道
2(cacc)、碳酸酐酶ix、癌胚抗原(cea)、组织蛋白酶g、cd19、cd20、cd22、cd30、cd33、cd38、cd44、cd44v6、cd46、cd52、cd71、cd73、cd272、cd276、b细胞成熟抗原(bcma)、上皮细胞粘附分子(epcam)、肝配蛋白a型受体2(epha2)、肝配蛋白a型受体3(epha3)、肝配蛋白a型受体4(epha4)、肝配蛋白b2、受体酪氨酸激酶样孤儿受体1(ror1)、叶酸受体、flt3(cd135)、kit(cd117)、cd213a2、il
‑
1ra、prss21、vegfr2、cd24、pdgfr
‑
β、ssea
‑
4、表皮生长因子受体(egfr)、erb
‑
b2受体酪氨酸激酶2(erbb2)、erb
‑
b2受体酪氨酸激酶3(erbb3)、erb
‑
b2受体酪氨酸激酶4(erbb4)、叶酸结合蛋白(叶酸受体)、神经节苷脂、神经节苷脂、gp100、gpa33、未成熟层粘连蛋白受体、细胞间粘附分子1(icam
‑
1)、路易斯
‑
y、间皮素、前列腺干细胞抗原(psca)、粘蛋白16(muc16或ca
‑
125)、细胞表面相关的粘蛋白1(muc1)、形成寡聚物粘液凝胶的粘蛋白2(muc2)、粘蛋白、前列腺膜特异性抗原(psma)、tem1/cd248、tem7r、cldn6、促甲状腺激素受体(tshr)、gprc5d、cd97、cd179a、间变性淋巴瘤激酶(alk或cd246)、免疫球蛋白λ样多肽1(igll1)、p选择素、c
‑
met、成纤维细胞生长因子受体(fgfr)、胰岛素样生长因子1受体(igf
‑
1r)、肿瘤相关钙信号转导子2(trop
‑
2)和肿瘤相关糖蛋白72(tag
‑
72)。
13.在一些实施方案中,所述引导物抗原是选自以下的癌症相关抗原:cd19、cd22、her2(erbb2/neu)、间皮素、psca、cd123、cd30、cd71、cd171、cs
‑
1、clecl1、cd33、egfrviii、gd2、gd3、bcma、psma、受体酪氨酸激酶样孤儿受体1(ror1)、叶酸受体、flt3(cd135)、tag72、cd38、cd44v6、cd46、cea、epcam、cd272、b7h3(cd276)、kit(cd117)、cd213a2、il
‑
1ra、prss21、vegfr2、cd24、pdgfr
‑
β、ssea
‑
4、cd20、muc1、muc16、egfr、erbb2、erbb3、erbb4、ncam、前列腺酸性磷酸酶(pap)、肝配蛋白b2、成纤维细胞激活蛋白(fap)、epha2、c
‑
met、成纤维细胞生长因子受体(fgfr)、胰岛素样生长因子1受体(igf
‑
1r)、gm3、tem1/cd248、tem7r、cldn6、促甲状腺激素受体(tshr)、gprc5d、cd97、cd179a、间变性淋巴瘤激酶(alk或cd246)和免疫球蛋白λ样多肽1(igll1)。
14.在一些实施方案中,所述效应物抗原选自alcam、epcam、叶酸结合蛋白、psma、psca、间皮素、cd19、cd20、cd22、cd30、cd33、cd38、cd44、cd46、icam
‑
1、cd55、cd59、cd70、cd71、cd73、cd97、bcma、cd272、cd276、muc1、muc16、ncam、cd24、epha2、epha3、epha4、肝配蛋白b2、cea、c
‑
met、fgfr、igf
‑
1r、vegfr、pdgfr、trop
‑
2、tag
‑
72、p选择素、egfr、erbb2、erbb3和erbb4。
15.在一些实施方案中,所述抗体或其功能片段与选自治疗部分、诊断剂和改善药代动力学的部分的至少一个目标部分(moi)缀合或共价结合。在一些实施方案中,所述至少一个moi选自抗癌剂、抗自身免疫性疾病药剂、抗炎剂、抗细菌剂、抗微生物剂、抗生素、抗感染性疾病药剂和抗病毒剂。在一些实施方案中,所述至少一个moi选自细胞毒性抗癌剂、dna螯合剂、微管抑制剂、拓扑异构酶抑制剂、翻译起始抑制剂、核糖体失活分子、核转运抑制剂、rna剪接抑制剂、rna聚合酶抑制剂和dna聚合酶抑制剂。
16.在一些实施方案中,所述细胞毒性抗癌剂选自奥瑞他汀、海兔毒素、微管溶素(tubulysin)、美登木素生物碱、紫杉烷、长春花生物碱、毒伞肽(amatoxin)、蒽环类、刺孢霉素、喜树碱、伊立替康、sn
‑
38、康普瑞汀、倍癌霉素、烯二炔类、埃博霉素、乙烯亚胺类、自力霉素、吡咯并苯二氮卓类(pbd)和卡奇霉素。
17.在一些实施方案中,所述至少一个目标部分(moi)与所述工程化抗体或其功能片段的恒定区缀合或共价结合。在一些实施方案中,所述至少一个目标部分(moi)与所述抗体
或其功能片段的重链恒定(例如,ch1、ch2或ch3)区缀合或共价结合。在一些实施方案中,所述至少一个目标部分(moi)与所述抗体或其功能片段的重链恒定(ch1)区缀合或共价结合。在一些实施方案中,所述至少一个目标部分(moi)与所述抗体或其功能片段的轻链恒定(cl)区缀合或共价结合。在一些实施方案中,每个抗体的平均moi数量(例如,平均药物与抗体比率,dar)的范围是1至20。在一些实施方案中,所述平均dar是约1至约5、约2至约6、约3至约7、约3至约8、约4至约9、约5至约10、约10至约15、约15至约20或约10至约20。
18.在一些实施方案中,本公开文本的工程化抗体或功能片段包含能够与在细胞表面上表达的epha2结合的第一抗原结合部分;和能够与在同一细胞的表面上表达的alcam结合的第二抗原结合部分。在一些实施方案中,epha2与alcam的表面密度比率大于约1:5的阈值。在一些实施方案中,如本文所述的工程化抗体或其功能片段包含与表4中鉴定的氨基酸序列中的任一个具有至少80%序列同一性的氨基酸序列。在一些实施方案中,所述第一抗原结合部分包含与表4中鉴定的vh序列具有至少80%序列同一性的重链可变(vh)区。在一些实施方案中,所述第一抗原结合部分包含与seq id no:81或seq id no:96具有至少80%序列同一性的vh区。在一些实施方案中,所述第一抗原结合部分的vh区包含如在序列表中鉴定的三个互补决定区(hcdr)。在一些实施方案中,所述第一抗原结合部分的vh区包含hcdr1、hcdr2和hcdr3,所述hcdr1、hcdr2和hcdr3分别含有seq id no:104、seq id no:105和seq id no:106;或分别含有seq id no:104、seq id no:105和seq id no:110。在一些实施方案中,所述第一抗原结合部分包含与表4中鉴定的vh序列具有至少80%序列同一性的轻链可变(vl)区。在一些实施方案中,所述第一抗原结合部分包含与seq id no:82或seq id no:97具有至少80%序列同一性的vl区。在一些实施方案中,所述第一抗原结合部分的vl区包含如在序列表中鉴定的三个lcdr。在一些实施方案中,所述第一抗原结合部分的vl区包含lcdr1、lcdr2和lcdr3,所述lcdr1、lcdr2和lcdr3分别含有seq id no:107、seq id no:108和seq id no:109。
19.在一些实施方案中,所述第二抗原结合部分包含与表4中鉴定的vh序列具有至少80%序列同一性的vh区。在一些实施方案中,所述第二抗原结合部分包含与seq id no:73或seq id no:75具有至少80%序列同一性的vh区。在一些实施方案中,所述第二抗原结合部分的vh区包含如在序列表中鉴定的三个hcdr。在一些实施方案中,所述第二抗原结合部分的vh区包含hcdr1、hcdr2和hcdr3,所述hcdr1、hcdr2和hcdr3分别含有seq id no:98、seq id no:99和seq id no:100。在一些实施方案中,所述第二抗原结合部分包含与表4中鉴定的vh序列具有至少80%序列同一性的vl区。在一些实施方案中,所述第二抗原结合部分包含与sec id no:74或seq id no:76具有至少80%序列同一性的vl区。在一些实施方案中,所述第二抗原结合部分的vl区包含如在序列表中鉴定的三个lcdr。在一些实施方案中,所述第二抗原结合部分的vl区包含lcdr1、lcdr2和lcdr3,所述lcdr1、lcdr2和lcdr3分别含有seq id no:101、seq id no:102和seq id no:103。
20.在一方面,本公开文本的一些实施方案涉及一种重组核酸分子,所述重组核酸分子包含编码如本文所公开的工程化抗体或其功能片段的核酸序列。在一些实施方案中,所述重组核酸分子与异源核酸序列可操作地连接。在一些实施方案中,所述重组核酸分子进一步被限定为表达盒或载体。
21.在一方面,本公开文本的一些实施方案涉及重组细胞,所述重组细胞包含(a)如本
文所公开的工程化抗体或其功能片段;和/或(b)如本文所公开的核酸分子。在一些实施方案中,所述重组细胞是原核细胞或真核细胞。在相关方面,本公开文本的一些实施方案涉及一种细胞培养物,所述细胞培养物包含至少一种如本文所公开的重组细胞和培养基。
22.在一方面,本公开文本的一些实施方案涉及一种药物组合物,所述药物组合物包含以下中的一种或多种:(a)如本文所公开的工程化抗体或其功能片段;(b)如本文所公开的核酸分子;和(c)如本文所公开的重组细胞以及药学上可接受的载体。
23.在另一方面,本公开文本的一些实施方案涉及一种用于调节细胞内化的方法,所述方法包括向细胞施用以下中的一种或多种:(a)如本文所公开的工程化抗体或其功能片段;(b)如本文所公开的核酸分子;和(c)如本文所公开的药物组合物。
24.在一方面,本公开文本的一些实施方案涉及一种用于调节细胞内化的方法,所述方法包括向细胞施用包含以下项的工程化抗体或其功能片段:(a)能够与具有第一细胞内化速率的细胞表面引导物抗原结合的第一抗原结合部分;和(b)能够与具有第二细胞内化速率的细胞表面效应物抗原结合的第二抗原结合部分,其中所述工程化抗体或其功能片段的内化特性是由所述引导物抗原与所述效应物抗原的相对表面密度比率决定的,并且其中所述两个细胞内化速率中的一个比另一个速率大至少50%、至少70%、至少80%或至少90%。
25.在又另一方面,本公开文本的一些实施方案涉及一种用于调节受试者中的细胞类型选择性信号传导的方法,所述方法包括向细胞施用包含以下项的工程化抗体或其功能片段:(a)能够与细胞表面引导物抗原结合的第一抗原结合部分,其中所述引导物抗原在所述受试者中以细胞类型选择性方式表达并且具有第一细胞内化速率;和(b)能够与细胞表面效应物抗原结合的第二抗原结合部分,其中所述工程化抗体或其功能片段的内化特性是由所述引导物抗原与所述效应物抗原的相对表面密度比率决定的,并且其中所述两个细胞内化速率中的一个比另一个速率大至少50%、至少70%、至少80%或至少90%。
26.在又另一方面,本公开文本的一些实施方案涉及一种用于治疗有需要的受试者的健康病症或疾病的方法,所述方法包括向所述受试者施用治疗有效量的如本文所公开的工程化抗体或其功能片段。在一些实施方案中,工程化抗体或其功能片段包含:(a)能够与具有第一细胞内化速率的细胞表面引导物抗原结合的第一抗原结合部分;和(b)能够与具有第二细胞内化速率的细胞表面效应物抗原结合的第二抗原结合部分,其中所述工程化抗体或其功能片段的内化特性是由所述引导物抗原与所述效应物抗原的相对表面密度比率决定的;并且其中所述两个细胞内化速率中的一个比另一个速率大至少50%、至少70%、至少80%或至少90%。在一些实施方案中,所述健康病症或疾病是癌症。
27.在又另一方面,本公开文本的一些实施方案涉及一种用于杀伤癌细胞的方法,所述方法包括向所述细胞施用如本文所公开的工程化抗体或其功能片段。在一些实施方案中,所述工程化抗体或其功能片段包含:(a)能够与具有第一细胞内化速率的细胞表面引导物抗原结合的第一抗原结合部分;和(b)能够与具有第二细胞内化速率的细胞表面效应物抗原结合的第二抗原结合部分。
28.在又另一方面,本公开文本的一些实施方案涉及一种用于杀伤肿瘤细胞的方法,所述方法包括向所述肿瘤细胞施用如本文所公开的工程化抗体或其功能片段。在所公开的方法的一些实施方案中,所述工程化抗体或其功能片段包含能够与在所述肿瘤细胞的表面
上表达的肝配蛋白受体a2(epha2)结合的第一抗原结合部分;和能够与在同一肿瘤细胞的表面上表达的alcam结合的第二抗原结合部分。在一些实施方案中,epha2与alcam的表面密度比率大于约1:5的阈值。
29.在所公开的方法的一些实施方案中,所述工程化抗体或其功能片段包含与表4中鉴定的氨基酸序列中的任一个具有至少80%序列同一性的氨基酸序列。在一些实施方案中,所述第一抗原结合部分包含与表4中鉴定的vh序列具有至少80%序列同一性的vh区。在一些实施方案中,所述第一抗原结合部分包含与seq id no:81或seq id no:96具有至少80%序列同一性的vh区。在一些实施方案中,所述第一抗原结合部分的vh区包含如在序列表中鉴定的三个hcdr。在一些实施方案中,所述第一抗原结合部分的vh区包含hcdr1、hcdr2和hcdr3,所述hcdr1、hcdr2和hcdr3分别含有:(a)seq id no:104、seq id no:105和seq id no:106;或分别含有:(b)seq id no:104、seq id no:105和seq id no:110。在一些实施方案中,所述第一抗原结合部分包含与表4中鉴定的vl序列具有至少80%序列同一性的vl区。在一些实施方案中,所述第一抗原结合部分包含与seq id no:82或seq id no:97具有至少80%序列同一性的vl区。在一些实施方案中,所述第一抗原结合部分的vl区包含如在序列表中鉴定的三个lcdr。在一些实施方案中,所述第一抗原结合部分的vl区包含lcdr1、lcdr2和lcdr3,所述lcdr1、lcdr2和lcdr3分别含有seq id no:107、seq id no:108和seq id no:109。
30.在所公开的方法的一些实施方案中,所述第二抗原结合部分包含与表4中鉴定的vh序列具有至少80%序列同一性的vh区。在一些实施方案中,所述第二抗原结合部分包含与seq id no:73或seq id no:75具有至少80%序列同一性的vh区。在一些实施方案中,所述第二抗原结合部分的vh区包含如在序列表中鉴定的三个hcdr。在一些实施方案中,所述第二抗原结合部分的vh区包含hcdr1、hcdr2和hcdr3,所述hcdr1、hcdr2和hcdr3分别含有seq id no:98、seq id no:99和seq id no:100。在一些实施方案中,所述第二抗原结合部分包含与表4中鉴定的vl序列具有至少80%序列同一性的vl区。在一些实施方案中,所述第二抗原结合部分包含与sec id no:74或seq id no:76具有至少80%序列同一性的vl区。在一些实施方案中,所述第二抗原结合部分的vl区包含如在序列表中鉴定的三个lcdr。在一些实施方案中,所述第二抗原结合部分的vl区包含lcdr1、lcdr2和lcdr3,所述lcdr1、lcdr2和lcdr3分别含有seq id no:101、seq id no:102和seq id no:103。
31.在一些实施方案中,所述癌症是胰腺癌、结肠癌、卵巢癌、前列腺癌、肺癌、间皮瘤、乳腺癌、尿路上皮癌、肝癌、头颈癌、肉瘤、宫颈癌、胃癌(stomach cancer)、胃部癌症(gastric cancer)、黑色素瘤、葡萄膜黑色素瘤、胆管癌、多发性骨髓瘤、白血病、淋巴瘤和胶质母细胞瘤。
32.在一些实施方案中,所述细胞表面引导物抗原是内化细胞表面抗原。在一些实施方案中,所述细胞表面效应物抗原是非内化细胞表面抗原。在一些实施方案中,所述引导物抗原与所述效应物抗原的相对表面密度比率大于阈值。在一些实施方案中,所述引导物抗原与所述效应物抗原的相对表面密度比率低于阈值。在一些实施方案中,所述阈值为约1:1、约1:2、约1:3、约1:4、约1:5、约1:10、约1:20或约1:30。在一些实施方案中,如本文所公开的方法还包括调节所述引导物抗原的细胞表面密度和/或所述效应物抗原的细胞表面密度。在一些实施方案中,如本文所公开的工程化抗体的内化特性是从内化转化为非内化。在
一些其他实施方案中,本文公开的工程化抗体的内化特性是从非内化转化为内化。在一些实施方案中,所述引导物抗原和/或所述效应物抗原的表达是细胞类型选择性的。
33.前述发明内容仅是说明性的,并不旨在以任何方式进行限制。除了本文所述的说明性实施方案和特征之外,本公开文本的其他方面、实施方案、目的和特征将从附图以及详细描述和权利要求变得更充分清楚。
附图说明
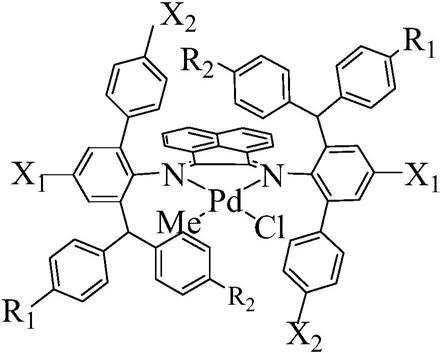
34.图1a
‑
图1g总结了用于阐明根据本公开文本的一些非限制性实施方案基于引导物
‑
效应物设计的双特异性抗体可以深刻地影响细胞表面抗原的内化动力学而进行的实验的结果。图1a是四价alcam
×
epha2 bsigg的图示。igg骨架基于非内化抗alcam抗体3f1。内化抗epha2 scfv融合至轻链c末端的末端。图1b显示了抗体内化的共聚焦显微镜检查研究。将hek293或hek293
‑
epha2#2细胞与指示的igg或bsigg(100nm)在37℃下一起孵育2小时。使用647标记的抗人igg二抗检测抗体(红色),并使用数字激光共聚焦显微镜分析细胞图像。比例尺:20μm。图1c描绘了双特异性抗体去除细胞表面alcam的动力学。将hek293
‑
epha2#2细胞与指示的igg或bsigg一起孵育1、4和24小时,并通过facs测定表面alcam水平。非内化alcam被双特异性(3f1/ryr)从细胞表面去除,而未被单克隆抗体去除。图1d描绘了表面抗原(alcam)去除效率与epha2/alcam(e/a)表达比率之间的相关性。将具有不同epha2/alcam比率的hek293细胞模型与3f1、3f1/ryr和c10/ryr(均在100nm下)一起孵育,并且通过与3f1结合不同表位的抗alcam抗体测定留在细胞表面的抗原。计算皮尔逊相关系数(r)(对于3f1、3f1/ryr和c10/ryr分别为0.3266、
‑
0.7550和
‑
0.1896),并根据线性回归分析描绘趋势线。数据表示平均值
±
sd(一式两份实验(duplicate))。图1e是描绘当引导物与效应物比率>阈值时双特异性物诱导的alcam内化的图示。cm:细胞膜。图1f显示了当引导物与效应物比率下降到低于阈值时,双特异性3f1/ryr对epha2内化的显著受阻。将具有低epha2/alcam比率(<0.2)的hek293细胞与指示的抗体(100nm)一起孵育,并通过facs测量表面epha2水平。使用双尾学生t检验确定p值。*p<0.05,并且***p<0.001。图1g是图1f中所示的现象的图示,其中当epha2与alcam(e/a)比率下降到低于阈值时,epha2内化受阻(例如,降低)。
35.图2a
‑
图2f总结了用于证明根据本公开文本的一些非限制性实施方案基于引导物
‑
效应物设计的双特异性抗体(3f1/ryr)有效地从胰腺癌细胞表面去除非内化抗原(alcam)而进行的实验的结果。图2a:抗体处理后的alcam细胞表面水平。将胰腺癌细胞系l3.6pl(x轴上的左侧条)、capan
‑
1(中间条)和panc
‑
1(右侧条)与3f1、3f1/ryr、c10/ryr或3f1和c10/ryr的混合物一起孵育。在处理后洗涤之后,使用与3f1结合alcam上的不同表位的647标记的igg测定细胞表面alcam水平。将mfi值针对未进行抗体处理的细胞进行归一化。**p<0.01,并且***p<0.001。一式两份实验。图2b:由双特异性抗体介导的细胞类型选择性内化的共聚焦显微镜检查研究。将l3.6pl(e/a比率>0.2)和panc
‑
1(e/a比率<0.2)细胞与3f1、3f1/ryr或c10/ryr一起孵育,并将内化抗体用fitc标记的抗人igg染色。比例尺:20μm。图2c:抗体和大胞饮泡(macropinocytotic vesicle)的共定位。将l3.6pl细胞与在100nm下的3f1、3f1/ryr或c10/ryr以及nd70
‑
tr(tr
‑
葡聚糖,红色)一起孵育2小时。通过fitc标记的抗人igg(绿色)检测抗体。将细胞核用hoechst 33342(蓝色)标记。比例尺:10μ
m。图2d:内化后的溶酶体运输。将l3.6pl细胞与指示的抗体(100nm)一起孵育2小时。如c)中所述对内化的抗体(绿色)和细胞核(蓝色)进行染色,并使用兔抗lamp1第一igg、接着使用647标记的抗兔igg(红色)检测溶酶体。比例尺:10μm。图2e:当被双特异性抗体靶向时,panc
‑
1细胞上的受阻的epha2内化。**p<0.01,并且***p<0.001。一式两份实验。图2f:在抗体处理后0.5、1和4小时从panc
‑
1细胞表面去除epha2的时间过程。
36.图3a
‑
图3e总结了用于证明根据本公开文本的一些非限制性实施方案的双特异性物诱导的细胞表面alcam去除具有针对胰腺肿瘤球的抗克隆形成作用而进行的实验的结果。图3a:与非球形肿瘤细胞相比,l3.6pl球形细胞上的显著alcam上调。将贴壁或球形培养的l3.6pl细胞分离为单个细胞,并使用3f1或ryr igg、接着使用647标记的抗人igg测量抗原表达。图3b:3f1/ryr从形成球的细胞的表面去除alcam。将l3.6pl的单细胞群体(200个细胞/孔)与指示的抗体(100nm)在超低吸附孔板中一起孵育2周。通过facs测定抗体处理后alcam的细胞表面水平。将mfi值针对对照(未进行抗体处理)进行归一化。**p<0.01。一式两份实验。图3c:抗体内化到l3.6pl球中。通过离心收集与指示的抗体一起孵育的肿瘤球,将其固定并透化以进行共聚焦显微镜检查分析。将抗体和细胞核分别用647标记的抗人igg(红色)和hoechst 33342(蓝绿色)染色。比例尺:10μm。细胞内抗体荧光强度通过image j进行定量,并显示在右侧小图中。***p<0.001。图3d:3f1/ryr抑制l3.6pl肿瘤球的形成—数量的减少。在抗体处理后14天计数肿瘤球数量(>100μm)(左),并示出代表性的孔图像(右)。误差条表示一式两份实验的sd。*p<0.05。图3e:3f1/ryr抑制l3.6pl肿瘤球的形成—大小的减小。**p<0.01。一式两份实验。比例尺:100μm。
37.图4a
‑
图4e示出了根据本公开文本的一些非限制性实施方案在具有不同的epha2/alcam比率的肿瘤细胞系上进行位点特异性缀合的示例性抗体
‑
药物缀合物(adc)的体外效力和选择性。研究了指示的adc或混合物对具有相对较高epha2/alcam比率的l3.6pl(图4a)和capan
‑
1(图4b)细胞系以及具有低epha2/alcam比率的panc
‑
1(图4c)细胞系的细胞毒性。mia paca2(图4d)和c4
‑
2b(图4e)细胞系分别用作alcam低/阴性和epha2低/阴性癌细胞模型。将细胞活力(%)针对未进行adc处理的对照组进行归一化。
38.图5a
‑
图5b示出了根据本公开文本的一些非限制性实施方案在胰腺癌异种移植物模型中示例性双特异性3f1/ryr抗体
‑
药物缀合物(adc)的抗肿瘤功效。图5a:对肿瘤生长的影响。对小鼠皮下接种1
×
106个capan
‑
1细胞,并将其随机分为平均肿瘤大小相似的4组(6只小鼠/组)。在指示的时间点(箭头)静脉内注射媒介物(pbs)或adc(3mg/kg)。绘制平均肿瘤体积
±
sem(mm3)。图5b:监测体重并绘图以评估adc处理的毒性。对于所研究的任何组,没有观察到显著的体重减轻(例如,>15%)。
39.图6a
‑
图6d以图形方式示出了来自噬菌体展示文库的抗alcam scfv的选择和表征。图6a:通过三轮选择富集alcam结合噬菌体。将alcam
‑
v结构域的重组fc融合物固定在磁珠上,并用于scfv噬菌体展示文库选择。通过噬菌体输出滴度除以输入噬菌体滴度来计算富集(左侧y轴)。从每轮输出扩增的多克隆噬菌体的结合活性被描述为针对未选择的噬菌体文库的结合的倍数(右侧y轴)。图6b:在三轮选择之后,进行facs以筛选出与alcam
高
du145细胞系结合的单克隆噬菌体。图6c:3f1 igg在表达alcam的活细胞上的表观k
d
。将du145细胞与不同浓度的3f1 igg在4℃下一起孵育过夜,并使用647缀合的抗人igg通过
facs进行分析。使用graphpad prism(graphpad software)通过曲线拟合估计k
d
值。图6d:抗alcam 3f1 igg的细胞定位的共聚焦显微镜检查研究。将肿瘤细胞系接种在室
‑
孔载玻片中,并与3f1 igg在37℃下一起孵育2小时。将抗体用647缀合的抗人抗体(红色)染色。将细胞核用hoechst染料(蓝绿色)染色。比例尺:20μm。使用3f1 igg测量的alcam表达显示在显微图像下方(下方小图)。
40.图7a
‑
图7b以图形方式示出了根据本公开文本的一些实施方案的示例性抗alcam
×
epha2双特异性物的表征。图7a:单克隆(3f1和c10)和双特异性(3f1/ryr和c10/ryr)抗体的还原性sds
‑
page分析。3f1或c10igg由重链(约50kda)和轻链(约25kda)组成。3f1/ryr或c10/ryr bsigg由两个大小相似的带(约50kda)即重链和与scfv融合的轻链组成。图7a:结合特异性的facs分析。将双特异性和单克隆抗体与稳定表达epha2的hek293
‑
epha2#2细胞系和亲本hek293(作为特异性对照)一起孵育,并通过facs进行分析。
41.图8a
‑
图8c以图形方式示出了根据本公开文本的一些实施方案的表面抗原的去除。图8a:在缺乏引导物抗原epha2的表达的hek293细胞上低效的表面alcam去除。将hek293细胞与指示的igg或bsigg在37℃下一起孵育1、4和24小时,洗涤并通过facs分析以测定抗体处理后的细胞表面alcam水平。图8b:在具有不同epha2与alcam比率的胰腺癌细胞系中的epha2细胞表面去除。抗alcam 3f1 igg如预期那样没有减少表面epha2,但是与epha2结合的3f1/ryr和对照c10/ryr从细胞表面有效地去除了epha2。双特异性3f1/ryr去除表面alcam的能力受epha2与alcam的比率(引导物抗原与效应物抗原的比率)的影响。图8c:抗体处理后从l3.6pl(左)和capan
‑
1(右)细胞的epha2表面去除。e/a比率:epha2与alcam比率。数据表示平均值
±
sd(一式两份实验)。*p<0.05,**p<0.01,并且***p<0.001。
42.图9以图形方式示出了根据本公开文本的一些实施方案在示例性抗体
‑
药物缀合物(adc)的细胞选择性细胞毒性中引导物抗原的重要性。在这些实验中,将不同浓度的指示的adc与hek293细胞(alcam
高
epha2
低
,其中存在不足的引导物抗原)在37℃下一起孵育96小时。细胞活力通过钙黄绿素
‑
am来测定,并针对未进行adc处理的对照组进行归一化。
43.图10a
‑
图10b以图形方式示出了来自酵母展示诱变文库的抗epha2 scfv的选择和表征。图10a:四种新epha2 scfv对人重组epha2蛋白的结合亲和力的表观k
d
测量。在该实验中,ryrgerm是ryr的种系形式。其余样品是具有高结合亲和力的ryrgerm衍生物。通过归一化mfi值的曲线拟合估计表观k
d
值。图10b:四种新epha2 scfv对小鼠重组epha2
‑
fc融合蛋白的结合亲和力的表观k
d
测量。通过归一化mfi值的曲线拟合估计表观k
d
值。
44.图11总结了用于评估在图10a
‑
图10b中描述的原始ryr与新改善的ryr结合scfv ryrgerm_102919_15之间的重组igg1的亲和力而在人前列腺癌细胞系du145中进行的实验的结果。
45.图12总结了用于评估图10a
‑
图10b中描述的igg1对重组人epha2的亲和力而进行的实验的结果。
具体实施方式
46.本公开文本总体上涉及细胞生物学和免疫学领域。更特别地,本文提供了用于调节细胞表面分子的内化特性,例如将非内化细胞表面抗原转化为内化细胞表面抗原以及将内化细胞表面抗原转化为非内化细胞表面抗原的组合物和方法。例如,在本公开文本的一
些实施方案中,通过引导物/效应物系统实现所述转化,其中当满足一组条件时,所述引导物抗原的内化特性被赋予到所述效应物抗原上。在本公开文本的一些实施方案中,提供了工程化抗体,其各自含有对细胞类型选择性抗原(引导物抗原)具有特异性的抗原结合部分和对效应物抗原具有特异性的另一抗原结合部分,其中所述工程化抗体或其功能片段的内化特性是由所述引导物抗原与所述效应物抗原的相对表面密度比率决定的。还提供了重组细胞、编码此类工程化抗体的重组核酸以及含有其的药物组合物。本公开文本还提供了可用于调节细胞或受试者中的细胞内化的方法,以及用于调节受试者中的细胞类型选择性信号传导和/或用于治疗健康障碍和疾病例如像与癌症(包括实体瘤和血液恶性肿瘤)相关的疾病的方法。
47.已经做出了巨大的努力来利用抗体将高毒性有效载荷携带至感染的细胞或癌细胞以将药物带到细胞内部并释放,从而像前药一样起作用。“抗体
‑
药物缀合物”或“adc”方法就是一个这样的例子。在这种情况下,对于基于抗体的靶向疗法开发需要细胞类型选择性细胞内有效载荷递送。然而,很少发现肿瘤特异性内化抗原,对于那些以均匀高水平表达的抗原甚至更为罕见。本文公开的组合物和方法解决了至少两个未满足的需求:(1)在需要细胞内有效载荷递送的靶向疗法中,许多肿瘤抗原高表达但内化不佳。通过将它们转化为内化抗原,可以开发出新的靶向疗法。(2)在一些情况下,受体内化也用于关闭信号传导途径,从而导致脱敏。通过将内化受体转化为非内化受体,信号传导途径可以持续激活。
48.如下面更详细描述的,已经构建了示例性双特异性抗体,其具有与肿瘤相关抗原epha2结合的快速内化抗体和与高表达的肿瘤相关抗原alcam结合的非内化抗体。已经观察到,双特异性物的整体内化特性受到epha2相比于alcam的相对表面表达水平(抗原密度比率)的深刻影响。当epha2与alcam比率大于阈值(例如,约1:5)时,进入肿瘤细胞的双特异性物的量超过单克隆内化抗体或这两种抗体的混合物所实现的量,从而显示出双特异性物依赖性扩大作用,其中少量的内化抗原epha2诱导更大量的非内化抗原alcam内化。当所述比率低于阈值时,epha2可以因在同一细胞表面上存在过量的alcam而变成非内化。在以下描述的一些说明性实验中,基于上述双特异性物设计构建了双特异性抗体
‑
药物缀合物(adc),并且发现双特异性adc在体外和体内的肿瘤细胞杀伤方面比单特异性adc更有效。因此,细胞表面抗原的内化特性可以由相邻抗原操纵成任一方向,并且这一现象可以用于治疗剂靶向。定义
49.除非另有定义,否则本文使用的所有技术术语、符号和其他科学术语或用辞旨在具有本公开文本所属领域的技术人员通常理解的含义。在一些情况下,为了清楚和/或为了便于引用而在本文中定义具有通常理解的含义的术语,并且本文中包含此类定义不一定应当被解释为代表与本领域通常所理解的含义有实质性差异。本文描述或提及的许多技术和程序是本领域技术人员熟知的并且通常由本领域技术人员使用常规方法加以采用。
50.除非上下文另外明确指出,否则单数形式“一个/一种(a)”、“一个/一种(an)”和“所述”包括复数指示物。例如,术语“细胞”包括一个或多个细胞,包括其混合物。本文使用“a和/或b”来包括所有以下替代方案:“a”、“b”、“a或b”以及“a和b”。在本公开文本中,除非另外陈述,否则“或”的使用意指“和/或”。此外,术语“包括(including)”以及其他形式如“包括(include)”、“包括(includes)”和“包括(included)”的使用是非限制性的。
51.如本文所使用的,术语“约”具有其近似的普通含义。如果上下文没有另外明确近似程度,在包括所提供的值的所有情况下,“约”表示在所提供的值的加或减10%内,或四舍五入到最接近的有效数字。在提供范围的情况下,所述范围包括边界值。
52.当与细胞、核酸、蛋白质或载体一起使用时,术语“工程化”或“重组”指示所述细胞、核酸、蛋白质或载体已经通过人干预而改变,例如像已被修饰或是实验室方法的结果。因此,例如,重组或工程化蛋白质和核酸包括通过实验室方法产生的蛋白质和核酸。重组或工程化蛋白质可以包含在天然(非重组或野生型)形式的蛋白质中未发现的氨基酸残基,或者可以包含已被修饰的(例如,标记的)氨基酸残基。所述术语可以包括对肽、蛋白质或核酸序列的任何修饰。此类修饰可以包括以下内容:肽、蛋白质或核酸序列的任何化学修饰,包括一种或多种氨基酸、脱氧核糖核苷酸或核糖核苷酸的任何化学修饰;肽或蛋白质中一种或多种氨基酸的添加、缺失和/或取代;以及核酸序列中一种或多种核酸的添加、缺失和/或取代。因此,工程化抗体是指如下重组多肽,所述重组多肽至少包含源自抗体的重链(vl)和/或轻链(vh)的可变结构域的含有抗原结合位点的抗体片段,并且可以任选地包含来自任何ig类别(iga、igd、ige、igg、igm和igy)的抗体的整个或部分可变和/或恒定结构域。术语“工程化”当关于细胞使用时不旨在包括天然存在的细胞,而是涵盖如下细胞,所述细胞已被修饰以包含或表达如果未工程化则在细胞中不存在的多肽或核酸。
53.如本文所用,术语“其功能片段”是指与所述片段或变体所来源的野生型分子共同具有定性生物学活性的分子。例如,抗体的功能片段是这样的功能片段,其保留与所述功能片段所来源的抗体基本上相同的结合至相同表位的能力。例如,能够与细胞表面抗原的表位结合的抗体可以在n末端和/或c末端处截短,并且使用本领域技术人员已知的测定(包括本文提供的示例性测定)评估其表位结合活性的保留。
54.如本文所用,术语“可操作地连接”表示两个或更多个元件(例如,多肽序列或多核苷酸序列)之间的物理或功能连接,其允许它们以其预期方式操作。例如,目标多核苷酸与调节序列(例如,启动子)之间的可操作连接是允许目标多核苷酸表达的功能连接。在这个意义上,术语“可操作地连接”是指调节区和待转录的编码序列的定位,使得调节区有效地调节目标编码序列的转录或翻译。在本文公开的一些实施方案中,术语“可操作地连接”表示这样的配置,其中调节序列被放置在相对于编码多肽或功能性rna的序列的适当位置,使得控制序列指导或调节编码多肽、多肽和/或功能性rna的mrna的表达或细胞定位。因此,如果启动子可以介导核酸序列的转录,则其与核酸序列可操作地连接。可操作地连接的元件可以是连续的或非连续的。此外,在多肽的上下文中,“可操作地连接”是指氨基酸序列(例如,不同的片段、区域、部分或结构域)之间的物理连接(例如,直接或间接连接)以提供多肽的所需活性。在本公开文本中,本公开文本的工程化抗体的各个区段、区域或结构域可以可操作地连接以保留细胞中工程化抗体的适当折叠、加工、靶向、表达、结合和其他功能特性。除非另有说明,否则本公开文本的工程化抗体的各个区域、结构域、片段和部分可操作地彼此连接。本公开文本的工程化抗体的可操作地连接的区域、结构域、片段和部分可以是连续的或非连续的(例如,通过接头彼此连接)。
55.在两个或更多个核酸或蛋白质的上下文中,术语“百分比同一性”是指相同的两个或更多个序列或子序列或具有指定百分比的相同核苷酸或氨基酸(例如,当在比较窗口或指定区域上比较和比对以获得最大对应时,约60%序列同一性、65%、70%、75%、80%、
85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高同一性)的两个或更多个序列或子序列,如使用采用如下所述的默认参数的blast或blast 2.0序列比较算法或通过手动比对和视觉检查所测量。参见例如,ncbi网址为ncbi.nlm.nih.gov/blast。然后,此类序列被称为“基本上相同”。此定义也指或可能应用于测试序列的互补体。此定义还包括具有缺失和/或添加的序列以及具有取代的序列。序列同一性通常存在于长度为至少约20个氨基酸或核苷酸的区域上,或存在于长度为10
‑
100个氨基酸或核苷酸的区域上,或存在于给定序列的整个长度上。
56.如有必要,可以使用已公布的技术和广泛可用的计算机程序来计算序列同一性,所述计算机程序如gcs程序包(devereux等人,nucleic acids res.12:387,1984)、blastp、blastn、fasta(atschul等人,j.molecular biol.215:403,1990)。可以使用序列分析软件以所述软件的默认参数来测量序列同一性,所述序列分析软件如university of wisconsin biotechnology center(威斯康星州麦迪逊,大学大道1710号,53705)的genetics computer group的序列分析软件包。
57.如本文所用,除非另有说明,否则治疗剂的“治疗有效量”是足以在治疗或管理疾病(例如癌症)方面提供治疗益处或者延迟或最小化与疾病相关的一种或多种症状的量。治疗有效量的化合物是指单独或与其他治疗剂组合的一定量的治疗剂,其在治疗或管理疾病方面提供治疗益处。术语“治疗有效量”可以涵盖改善疾病的整体疗法、减轻或避免疾病的症状或原因、或增强另一治疗剂的治疗功效的量。“有效量”的例子是足以有助于治疗、预防或减轻疾病的一种或多种症状的量,其也可以被称为“治疗有效量”。症状的“减轻”意指一种或多种症状的严重程度或频率的降低或一种或多种症状的消除。组合物的确切量(包括“治疗有效量”)将取决于治疗的目的,并且可由本领域技术人员使用已知技术来确定(参见例如,lieberman,pharmaceutical dosage forms(第1
‑
3卷,2010);lloyd,the art,science and technology of pharmaceutical compounding(2016);pickar,dosage calculations(2012);以及remington:the science and practice of pharmacy,第22版,2012,gennaro编辑,lippincott,williams&wilkins)。
58.如本文所用,“受试者”或“个体”包括动物,如人(例如,人个体)和非人动物。在一些实施方案中,“受试者”或“个体”是在医生的护理下的患者。因此,所述受试者可以是患有、有风险患上或怀疑患有目标疾病(例如癌症)和/或疾病的一种或多种症状的人患者或个体。所述受试者也可以是在诊断时或之后被诊断为具有目标病症的风险的个体。术语“非人动物”包括所有脊椎动物,例如哺乳动物(例如,啮齿动物,例如小鼠)和非哺乳动物,如非人灵长类动物、绵羊、狗、牛、鸡、两栖动物、爬行动物等。
59.术语“载体”在本文中用于指能够转移或转运另一种核酸分子的核酸分子或序列。转移的核酸分子通常与载体核酸分子连接,例如插入所述载体核酸分子中。通常,当与适当的控制元件缔合时,载体能够复制。术语“载体”包括克隆载体和表达载体以及病毒载体和整合载体。“表达载体”是包含调节区从而能够在体外和/或体内表达dna序列和片段的载体。载体可以包含引导细胞中自主复制的序列,或者可以包括足以允许整合到宿主细胞dna中的序列。有用的载体包括例如质粒(例如,dna质粒或rna质粒)、转座子、粘粒、细菌人工染色体和病毒载体。有用的病毒载体包括例如复制缺陷型逆转录病毒和慢病毒。在一些实施方案中,载体是基因递送载体。在一些实施方案中,载体用作基因递送媒介物以将基因转移
至细胞中。
60.在提供了一系列值时,应理解的是每个中间值,到下限的第十个单位(除非上下文清晰地另外指示),所述范围的上限与下限之间以及任何其他陈述的或在所述陈述范围内的中间值均被涵盖在本公开文本之内。这些更小范围的上限和下限可独立地被包括在更小范围之内,并且也被涵盖在本公开文本之内,服从于陈述的范围内的任何明确排除的界限。当陈述的范围包括一个或两个界限时,排除那些包括的界限中的任一个或两个的范围也包括在本公开文本中。
61.本文公开的所有范围还涵盖任何且所有可能的子范围及其子范围的组合。任何列出的范围都可以被认为充分描述和允许将相同的范围分解为至少相等的两份、三份、四份、五份、十份等。作为非限制性例子,本文所讨论的每个范围可以容易地分解为下三分之一、中间三分之一和上三分之一,等等。同样如本领域技术人员将理解的,如“最高”、“至少”、“大于”、“小于”等所有言辞都包括所列举的数字并且涉及随后可以分解为如上所讨论的子范围的范围。最后,本领域技术人员将理解,范围包括每个单独的成员。因此,例如,具有1
‑
3个制品的组是指具有1、2或3个制品的组。类似地,具有1
‑
5个制品的组是指具有1、2、3、4或5个制品的组等等。
62.应理解的是,本文描述的本公开文本的方面和实施方案包括“包含(comprising)”、“组成为(consisting)”方面和实施方案,以及“基本上由方面和实施方案组成(consisting essentially of)”。
63.呈现标题(例如,(a)、(b)、(i)等)只是为了便于阅读说明书和权利要求。说明书或权利要求中的标题的使用不要求步骤或元素按字母或数字顺序或它们呈现的顺序进行。
64.应了解,为明确起见在单独实施方案的上下文中描述的本公开文本的某些特征也可以在单个实施方案中组合提供。相反,为简洁起见在单个实施方案的上下文中描述的本公开文本的各种特征还可以分开地或以任何合适的子组合提供。属于本公开文本的实施方案的所有组合确切地涵盖在本公开文本中并且在本文中公开如同每个和每一种组合均单独地和明确地公开一样。此外,各种实施方案及其要素的所有子组合也确切地涵盖在本公开文本中并且在本文中公开如同每个和每一种这样的子组合均单独地和明确地在本文中公开一样。靶向疗法的细胞内化
65.单克隆抗体的高特异性通常被用于靶向疗法开发。理想地,附接至细胞类型选择性抗体的有效的细胞毒性剂可以将所述细胞毒性剂导向靶细胞,并优先在靶组织中积累。抗体
‑
药物缀合物(adc)是一类在临床上已显示出有效性的靶向治疗剂。内化抗体通常是实现有效的细胞内有效载荷递送和肿瘤杀伤所需的,但这种要求对于可通过细胞膜扩散以引起旁观者效应的某些药物(如mmae)不是绝对的。
66.尽管在概念上简单明了,但adc中的靶标选择受到以下事实的阻碍:很少发现所谓的肿瘤特异性抗原,并且甚至很少发现具有治疗剂靶向所需的特征(例如由癌细胞以高水平均匀表达)且有效内化所需的特征的肿瘤特异性抗原。已经开发了若干种方法来改善抗体内化和adc功效。例如,通过双互补位设计和随之而来的交联作用,her2抗原已被靶向用于改善的adc内化。在另一个例子中,构建了由适度内化抗体臂(抗her2)和内化诱导抗体臂(抗cd63、抗prlr或抗aplp2)组成的双特异性物,并将其用于改善adc摄取。然而,尽管做出
了这些努力,双特异性adc仅比亲本单特异性抗her2 adc展现出有限的改善,这表明有关该设计的关键参数仍有待界定。
67.一个重要的问题是,给定细胞表面抗原的内化倾向是否会受到其相邻表面抗原的影响,并且如果是的话,那么控制非内化抗原向内化抗原转化以及内化抗原向非内化抗原转化的参数是什么。先前已经报道了用于实现细胞类型特异性信号传导的引导物
‑
效应物双特异性系统。这些设计的关键是引导物与效应物比率和引导物抗原表达的阈值。假设可以通过基于引导物
‑
效应物的双特异性抗体方法来操纵内化。如下所述,已经开发了示例性双特异性抗体,其靶向epha2(快速内化抗原)和alcam(非内化或缓慢内化抗原)。发现当epha2与alcam的比率大于约1:5时,该双特异性抗体被内化。已经进一步显示,双特异性作用不同于两种单克隆抗体的简单混合物:递送至肿瘤细胞中的双特异性分子的数量大于抗体混合物的数量。因此,引导物
‑
效应物设计可以引起扩大作用,从少量种子内化抗原开始并将内化作用传播至更多的非内化抗原。值得注意的是,当epha2与alcam的比率低于阈值(1:5)时,内化epha2可以被alcam变成非内化或缓慢内化,这证明取决于引导物抗原与效应物抗原的比率,所述转化是相互的。因此,当被双特异性抗体靶向时,细胞表面抗原的内化可以很容易地被其相邻抗原操纵,从而导致取决于这两种抗原的相对丰度而扩大的细胞内摄取或极大受阻的内化,从而提供了治疗性利用由本文公开的基于引导物/效应物的双特异性物诱导的细胞膜动力学的机会。
68.如以下实施例中所阐明的,先前开发的引导物
‑
效应物双特异性抗体设计已被用于细胞类型选择性信号传导调节,以实现内化的细胞类型选择性调节。特别地,当引导物与效应物的比率超过阈值(例如,在epha2/alcam例子中1:5)时,非内化抗原(alcam)可以被双特异性抗体变成内化的。当引导物与效应物的比率下降到低于阈值时,内化抗原(epha2)可以被双特异性抗体变成非内化或缓慢内化。因此,在双特异性靶向的情况下,细胞表面抗原的内化行为受到其相邻抗原的显著影响,并且可以通过适当选择的引导物/效应物对的基于双特异性物的靶向而容易地操纵成任一方向。
69.本公开文本与治疗剂开发相关。在将非内化抗原转化为内化抗原的方向上,本公开文本与adc开发直接相关。adc是一类抗癌剂,其利用抗体的特异性将细胞毒性药物递送至肿瘤细胞。尽管在概念上有吸引力,但这类抗癌剂的临床开发却遇到了各种挑战。到目前为止,只有4种经fda批准用于临床使用的adc。诸如药物和接头稳定性等早期问题已经得到解决,但其他问题仍然存在。尽管非常有效的药物(如dna螯合剂)已用于产生adc,但这些药物引起累积毒性,从而限制了治疗窗口。与dna螯合剂相比,微管抑制剂(如奥瑞他汀衍生物)不那么有效,并且除周围神经损害外,其毒性不累积。由于奥瑞他汀的效力降低以及递送至肿瘤细胞中的药物量有限,因此治疗窗口仍然狭窄。增加的dar可以导致更多的药物分子在体外被递送至肿瘤细胞,但是具有高dar的体内adc迅速从循环清除,从而降低功效并增加毒性。位点特异性缀合实现了近似均匀的dar(n=2),改善了药代动力学(pk),但递送至肿瘤细胞中的药物分子总数仍然有限。原则上,改善adc的治疗窗口的方式包括:(1)增加细胞表面靶标密度;以及(2)改善靶标内化。两者都应导致更高数量的adc被细胞内递送至肿瘤细胞中。虽然先前报道了使用大胞吞抗体用于adc构建以改善内化,但是本公开文本提供了通过引导物
‑
效应物双特异性物设计来增加靶标密度的方法。
70.作为非限制性例子,快速内化大胞吞抗epha2(引导物)抗体和非内化/缓慢内化抗
alcam(效应物)抗体用作研究双特异性作用的模型系统。发现当epha2/alcam的抗原密度比率大于阈值(例如,在本文所述的实验系统中1:5)时,双特异性抗alcam
×
epha2抗体可以诱导epha2和alcam两者的内化。换句话说,双特异性物可以将非内化抗原(alcam)转变为内化抗原。发现双特异性adc在体外细胞毒性测定中比任何一种单特异性adc以及这些adc的混合物更有效,这与双特异性抗体递送的增加量的内化的adc一致。因此,存在双特异性而非单特异性抗体或它们的混合物所独有的扩大作用,其中在被双特异性抗体靶向时,少量内化抗原(引导物,epha2)可以诱导大量的非内化抗原(效应物,alcam)内化,从而导致与单克隆adc及其混合物相比,更大量的adc和药物分子被递送至肿瘤细胞。
71.除了通过扩大内化增强效力之外,本文公开的组合物和方法还涉及扩大adc的细胞表面靶标的范围和类型。当前adc面临的一个关键挑战是如何向靶细胞专门且大量递送有效载荷。在单克隆抗体环境中,靶抗原需要在肿瘤表面特异性地且以均匀高水平表达。然而,实际上,很少发现具有绝对特异性且均匀高水平表达的抗原。因此,由肿瘤所来源的组织表达的谱系标记物通常已用于肿瘤靶向。这些谱系标记物有两个局限:(1)它们倾向于在晚期癌症中显示降低的或异质表达,因为它们在功能上不是肿瘤存活必需的。例如,晚期前列腺癌中的psma表达是异质的,并且在雄激素信号传导抑制剂抗性的小细胞类型中下调;(2)它们通常在多于一种正常组织类型中表达。例如,尽管间皮素由许多肿瘤(如间皮瘤、卵巢癌和胰腺癌)表达,但它也由正常间皮表达。psma由前列腺肿瘤表达,但也由许多正常组织表达。同样,cd19由b细胞以外的正常组织表达。似乎通过单克隆抗体方法,靶标选择相当有限或是次优的。在adc的情境下,已经致力于提高有效载荷的效力,但是如上所述,治疗窗口仍然狭窄。另一种方法是鉴定这样的靶标,所述靶标扩大递送至肿瘤相比于正常细胞的有效载荷之间的差异。本公开文本与该方法特别相关,因为本文所述的引导物
‑
效应物双特异性物设计允许大量非内化肿瘤相关抗原被内化,从而有助于增加adc的细胞内递送。由于引导物抗原和效应物抗原的共表达,扩大作用是肿瘤细胞所独有的。
72.尽管先前已经报道了用于细胞类型选择性wnt信号传导途径调节的引导物
‑
效应物双特异性物设计(参见例如,lee nk等人,sci rep.2018年1月15日;8(1):766.),但本公开文本扩展了双特异性方法对抗原内化和adc的适用性。本文公开的引导物
‑
效应物双特异性系统的实质是,当引导物与效应物的比率超过阈值时,给定抗原(效应物)的行为可以由相邻抗原(引导物)来决定。在wnt信号传导研究中,当引导物/效应物比率超过5
‑
10:1时,双特异性物的效力比单克隆抗体增加了一千倍,并且所述增强是细胞类型选择性的。在本公开文本中,已经表明,当引导物/效应物比率超过1:5时,少量的引导物抗原(内化)可以将大量的效应物抗原(非内化)转化为内化抗原。
73.值得注意的是,尽管以下描述的一些实验集中在adc以及非内化抗体向内化抗体的转化上,但也显示出反之亦然:当内化与非内化抗原的比率低于阈值(例如,在本文所述的系统中1:5)时,内化抗原epha2因非内化alcam的存在而变成缓慢内化。这可用于其中希望抗原保留在细胞表面以防止降解和延长信号传导功能的应用。
74.最近有一些关于如下双特异性adc的报道,其内化臂与溶酶体蛋白或快速运输至溶酶体的抗原结合。在大多数情况下,观察结果是经验性的并且双特异性作用相当温和,这表明影响双特异性物诱导的内化的关键参数尚未被完全界定。例如,尚不清楚这种现象是否需要溶酶体抗原。也不清楚为什么双特异性物对一些细胞起作用,而对其他细胞却无效。
本公开文本显示双特异性物设计中的关键变量是引导物抗原与效应物抗原的比率,并且除了内化臂所需的内化之外,没有特殊特征。引导物抗原(内化臂)不必是用于诱导内化和溶酶体运输的溶酶体蛋白。例如,在本公开文本中,利用微胞吞作用来选择针对作为将双特异性物导向溶酶体隔室的引导物的细胞表面抗原epha2的大胞吞抗体。
75.总之,在本公开文本中阐明了在双特异性靶向的情境下,内化不再是给定抗原的内在特性。相反,抗原内化在很大程度上受到其相邻抗原的影响,并且可以使用适当选择的引导物/效应物对以细胞类型选择性方式容易地操纵为任一方向。这种双特异性物诱导的细胞表面动力学可塑性可以用于治疗剂开发。本公开文本的组合物工程化抗体
76.如以下更详细描述的,本公开文本提供了一类新抗体,其被工程化为调节细胞表面分子的内化特性,例如将非内化细胞表面抗原转化为内化细胞表面抗原以及将内化细胞表面抗原转化为非内化细胞表面抗原。例如,在本公开文本的一些实施方案中,通过引导/效应系统实现这种转化,其中当满足一组条件时,所述引导物抗原的内化特性被赋予到所述效应物抗原上。在本公开文本的一些实施方案中,如本文所公开的工程化抗体能够共同接合靶细胞上的细胞类型选择性内化抗原(例如,引导物抗原)和大量表达的受体(例如,效应物抗原)。
77.在一方面,本文公开的一些实施方案涉及一种工程化抗体或其功能片段,所述工程化抗体或其功能片段包含:a)能够与具有第一细胞内化速率的细胞表面引导物抗原结合的第一抗原结合部分;和b)能够与具有第二细胞内化速率的细胞表面效应物抗原结合的第二抗原结合部分,其中所述工程化抗体或其功能片段的内化特性是由所述引导物抗原与所述效应物抗原的相对表面密度比率决定的,并且其中所述两个细胞内化速率中的一个比另一个速率大至少50%、至少70%、至少80%或至少90%。术语“内化”是指将部分从细胞的外部转运至内部。内化的部分可以位于细胞内隔室中。“内化的”或“内化”的抗原或抗体是指能够从靶细胞的外部转运至内部的抗原或抗体。
78.在本文公开的工程化抗体中,具有较大细胞内化速率的抗原被定义为快速内化抗原,而具有较低细胞内化速率的抗原被定义为缓慢内化抗原。因此,在一些实施方案中,快速内化抗原的内化速率比缓慢内化抗原高至少50%、至少70%、至少80%或至少90%。在一些特定实施方案中,如果>50%的表面结合抗体在37℃下在4小时内被内化,则称所述抗体快速内化。在一些实施方案中,如果<30%的表面结合抗体在37℃下>24小时后被内化,则称所述抗体缓慢内化。在一些实施方案中,如果<10%的表面结合抗体在37℃下>24小时后被内化,则称所述抗体非内化。
79.技术人员将容易理解,细胞内化的过程通常是指细胞表面分子从细胞表面至细胞内部的跨质膜的移动。内化后,内体可以运输到溶酶体进行降解或再循环到细胞表面。给定细胞表面分子的细胞内化速率提供了所述分子从细胞表面穿过质膜移动到细胞内部的动力学的测量。抗原和抗体的内化速率可以通过本领域已知的多种技术来监测和/或测量,所述多种技术包括酸解离(li n.等人,methods mol.biol.,457:305
–
17,2008)和毒素杀伤测定(pahara j.等人exp cell res.,316:2237
–
50,2010;和mazor等人,j.immunol.methods,321:41
–
59,2007)。可用于定量和监测内化的许多抗体标记技术、染料和用于抗体标记的试
剂盒是可商购的(例如,由thermo fisher scientific销售的phrodo ifl抗体标记方法、试剂和试剂盒)。例如,本公开文本的抗原和工程化抗体的细胞内化动力学可以通过共聚焦显微镜或流式细胞术来评估和定量。例如,共聚焦激光扫描显微镜检查(clsm)已广泛用于验证细胞内化。其他合适的技术即提供细胞的量化facs数据和图像的成像流式细胞术(ifc)技术也可以用于定量细胞内化动力学。关于此的另外的信息可以在例如以下文献中找到:ha等人,mol cell proteomics,13(12):3320
‑
31,2014和vainshtein等人,pharm.res.32:286
‑
299,2015。在一些实施方案中,本公开文本的工程化抗体的细胞内化动力学可以通过使用先前由vainshtein等人(pharm res.2015,32:286
‑
299)描述的方法来定量,将所述文献通过引用并入本文,其中部署共聚焦显微镜成像技术以记录活细胞中荧光标记抗体的内化动力学,并且量化图像分析算法用于确定内化速率常数(k
int
)。在一些实施方案中,如本文所公开的工程化抗体的内化速率常数k
int
通过使用以下等式的数据曲线拟合从内化时间过程计算得到:s
cyt
(t)=s
0,cyt
(1
‑
e
‑
kint.t
).s
max,cyt
;其中s
cyt
(t)是时间t处的胞质荧光信号;s
0,cyt
和s
max,cyt
分别是初始胞质荧光信号和最大信号(参见,vainshtein等人2015)。
80.能够与细胞表面引导物抗原结合的抗原结合部分被指定为“第一”抗原结合部分以及能够与细胞表面效应物抗原结合的抗原结合部分被指定为“第二”抗原结合部分并不旨在暗示工程化抗体内“第一”和“第二”抗原结合部分的任何特定结构布置。通过非限制性例子的方式,在本公开文本的一些实施方案中,所述工程化抗体可以包含n末端部分和c末端部分,所述n末端部分包含能够与细胞表面引导物抗原结合的抗原结合部分,所述c末端部分包含能够与细胞表面效应物抗原结合的抗原结合部分。在其他实施方案中,所述工程化抗体可以包含n末端部分和c末端部分,所述n末端部分包含能够与细胞表面效应物抗原结合的抗原结合部分,所述c末端部分包含能够与细胞表面引导物抗原结合的抗原结合部分。
81.如以下更详细描述的,所述第一和/或第二抗原结合部分是多特异性的,例如能够与多于一种抗原,例如多于两种、多于三种、多于四种、多于五种或多于六种不同抗原结合。例如,在一些实施方案中,所述第一抗原结合部分可以被配置为具有双重特异性,即能够与两种引导物抗原结合。在一些实施方案中,所述第二抗原结合部分可以被配置为具有双重特异性,即能够与两种效应物抗原结合。关于这种二合一抗体设计的另外的信息可以在例如以下文献中找到:schaefer g.等人,cancer cell.2011年10月18日;20(4):472
‑
86;和lee cv等人,mabs.2014;6(3):622
–
627。
82.另外地或可替代地,所述工程化抗体可以包含能够与细胞表面引导物抗原结合的多于一个抗原结合部分,和/或能够与细胞表面效应物抗原结合的多于一个抗原结合部分。因此,在一些实施方案中,所述工程化抗体可以包含多个抗原结合部分,每个抗原结合部分能够与细胞表面引导物抗原结合。在一些实施方案中,所述工程化抗体可以包含多个抗原结合部分,每个抗原结合部分能够与细胞表面效应物抗原结合。在一些实施方案中,所述工程化抗体包含其中每一个能够与细胞表面引导物抗原结合的多个抗原结合部分和其中每一个能够与细胞表面效应物抗原结合的多个抗原结合部分。
83.根据本公开文本,通过将对这种缓慢内化抗原具有特异性的抗原结合部分与对快速内化抗原具有特异性的另一抗原结合部分可操作地连接,可以诱导缓慢内化抗原的快速内化。在一些实施方案中,通过将对这种快速内化抗原具有特异性的抗原结合部分与对缓
慢内化抗原具有特异性的另一抗原结合部分可操作地连接,可以诱导快速内化抗原的缓慢内化。
84.在一些实施方案中,如本文所公开的工程化抗体的内化特性是从内化转化为非内化。在一些实施方案中,引导物抗原和/或效应物抗原的内化特性是从内化转化为非内化。在一些实施方案中,通过使用如本文所公开的工程化抗体将内化抗原(例如,引导物抗原或效应物抗原)的内化特性从内化转化为非内化,所述工程化抗体包含对这种内化抗原具有特异性的抗原结合部分,所述抗原结合部分与对非内化抗原具有特异性的另一抗原结合部分可操作地连接。例如,在一些实施方案中,通过使用如本文所公开的工程化抗体将内化引导物抗原的内化特性从内化转化为非内化,所述工程化抗体包含对内化引导物抗原具有特异性的抗原结合部分,所述抗原结合部分与对非内化效应物抗原具有特异性的另一抗原结合部分可操作地连接。在一些实施方案中,通过使用如本文所公开的工程化抗体将内化效应物抗原的内化特性从内化转化为非内化,所述工程化抗体包含对内化效应物抗原具有特异性的抗原结合部分,所述抗原结合部分与对非内化引导物抗原具有特异性的另一抗原结合部分可操作地连接。
85.在一些其他实施方案中,本文公开的工程化抗体的内化特性是从非内化转化为内化。在一些实施方案中,非内化抗原(例如,引导物抗原或效应物抗原)的内化特性是从非内化转化为内化。在一些其他实施方案中,通过使用如本文所公开的工程化抗体,将非内化引导物抗原的内化特性从非内化转化为内化,所述工程化抗体包含对这种非内化引导物抗原具有特异性的抗原结合部分,所述抗原结合部分与对内化效应物抗原具有特异性的另一抗原结合部分可操作地连接。在一些其他实施方案中,通过使用如本文所公开的工程化抗体,将非内化效应物抗原的内化特性从非内化转化为内化,所述工程化抗体包含对这种非内化效应物抗原具有特异性的抗原结合部分,所述抗原结合部分与对内化引导物抗原具有特异性的另一抗原结合部分可操作地连接。
86.在一些实施方案中,引导物抗原的细胞内化速率大于效应物抗原的细胞内化速率,在这种情况下,引导物抗原是快速内化抗原并且效应物抗原是缓慢内化抗原。在一些实施方案中,引导物抗原的细胞内化速率比效应物抗原的细胞内化速率大至少约50%。在一些实施方案中,引导物抗原的细胞内化速率比效应物抗原的细胞内化速率大至少约50%、60%、70%、80%或90%。在一些实施方案中,与对照(例如,仅包含缓慢内化抗原的单特异性抗体)相比,通过将对缓慢内化抗原具有特异性的抗原结合部分与对快速内化抗原(例如,引导物抗原)具有特异性的另一抗原结合部分可操作地连接,本公开文本的工程化抗体将缓慢内化抗原(例如效应物抗原)的内化速率提高了至少10%、20%、30%、40%、50%、60%、70%、80%、90%、99%或99.9%。在一些实施方案中,与对照(例如,仅包含快速内化抗原的单特异性抗体)相比,通过将对快速内化抗原具有特异性的抗原结合部分与对缓慢内化抗原(例如,效应物抗原)具有特异性的另一抗原结合部分可操作地连接,本公开文本的工程化抗体将快速内化抗原(例如引导物抗原)的内化速率降低了至少10%、20%、30%、40%、50%、60%、70%、80%、90%、99%或99.9%。
87.在一些实施方案中,效应物抗原的细胞内化速率大于引导物抗原的细胞内化速率,在这种情况下,效应物抗原是快速内化抗原并且引导物抗原是缓慢内化抗原。在一些实施方案中,效应物抗原的细胞内化速率比引导物抗原的细胞内化速率大至少约50%。在一
些实施方案中,效应物抗原的细胞内化速率比引导物抗原的细胞内化速率大至少约50%、60%、70%、80%或90%。在一些实施方案中,与对照(例如,仅包含缓慢内化抗原的单特异性抗体)相比,通过将对缓慢内化抗原具有特异性的抗原结合部分与对快速内化抗原(例如,效应物抗原)具有特异性的另一抗原结合部分可操作地连接,本公开文本的工程化抗体将缓慢内化抗原(例如引导物抗原)的内化速率提高了至少10%、20%、30%、40%、50%、60%、70%、80%、90%、99%或99.9%。在一些实施方案中,与对照(例如,仅包含快速内化抗原的单特异性抗体)相比,通过将对快速内化抗原具有特异性的抗原结合部分与对缓慢内化抗原(例如,引导物抗原)具有特异性的另一抗原结合部分可操作地连接,本公开文本的工程化抗体将快速内化抗原(例如效应物抗原)的内化速率降低了至少10%、20%、30%、40%、50%、60%、70%、80%、90%、99%或99.9%。在一些实施方案中,所述细胞表面引导物抗原是内化细胞表面抗原。在一些实施方案中,所述细胞表面效应物抗原是非内化细胞表面抗原。
88.如本文所公开的工程化抗体或其功能片段的内化特性是由所述引导物抗原与所述效应物抗原的相对表面密度比率决定的。本领域技术人员将容易理解,给定分子(如抗原或多肽)的表面密度是指在给定表面积上测量和/或估计的抗原或多肽的数量。例如,细胞表面上存在的抗原密度可以表示为每个细胞约10,000个拷贝,这意味着细胞表面上存在的抗原分子的测量和/或估算数量为约10,000个。用于测定和/或测量存在于细胞表面上的分子的密度的许多技术、系统、测定和程序是本领域中是已知的。关于此的另外的信息可以在以下实施例12以及例如以下文献中找到:lee nk等人,sci.rep.1月15日;8(1):766,2018和sherbenou,dw等人,j.clin.invest.2016年11月14日。在本公开文本的一些实施方案中,测量引导物抗原和效应物抗原的表面密度。然后将结果汇编并解释为引导物抗原的表面密度与效应物抗原的表面密度之间的单一比率。决策规则可以陈述如下:高于给定阈值的任何得分指示工程化抗体的内化,而低于阈值的得分指示缺乏内化,例如,非内化。
89.在一些实施方案中,可以将这些得分与阈值进行比较,使得高于阈值的得分指示如通过工程化抗体所示的内化的增加或减少。每个引导物/效应物对的表面密度、比率和适当的阈值可以通过以下方法确定:收集来自内化和非内化抗原二者的一小组样品的数据,然后使用线性模型将它们分离。可以经由统计方法如逻辑回归或支持向量机用线性核函数来生成线性模型,或者可以通过检查来生成线性模型。
90.在一些实施方案中,所述引导物抗原与所述效应物抗原的相对表面密度比率大于阈值。在一些实施方案中,所述阈值为约1:1、约1:2、约1:3、约1:4、约1:5、约1:10、约1:20或约1:30。因此,在一些实施方案中,所述引导物抗原与所述效应物抗原的相对表面密度比率大于约1:1、约1:2、约1:3、约1:4、约1:5、约1:10、约1:20或约1:30。在一些实施方案中,所述阈值为约1:5。在一些实施方案中,所述引导物抗原与所述效应物抗原的相对表面密度比率低于阈值。在一些实施方案中,所述阈值为约1:1、约1:2、约1:3、约1:4、约1:5、约1:10、约1:20或约1:30。因此,在一些实施方案中,所述引导物抗原与所述效应物抗原的相对表面密度比率低于约1:1、约1:2、约1:3、约1:4、约1:5、约1:10、约1:20或约1:30。在一些实施方案中,所述阈值为约1:5。
91.在一些其他实施方案中,所述效应物抗原与所述引导物抗原的相对表面密度比率大于阈值。在一些实施方案中,所述阈值为约1:1、约1:2、约1:3、约1:4、约1:5、约1:10、约1:
20或约1:30。因此,在一些实施方案中,所述效应物抗原与所述引导物抗原的相对表面密度比率大于约1:1、约1:2、约1:3、约1:4、约1:5、约1:10、约1:20或约1:30。在一些实施方案中,所述阈值为约1:5。在一些其他实施方案中,所述效应物抗原与所述引导物抗原的相对表面密度比率低于阈值。在一些实施方案中,所述阈值为约1:1、约1:2、约1:3、约1:4、约1:5、约1:10、约1:20或约1:30。因此,在一些实施方案中,所述效应物抗原与所述引导物抗原的相对表面密度比率低于约1:1、约1:2、约1:3、约1:4、约1:5、约1:10、约1:20或约1:30。在一些实施方案中,所述阈值为约1:5。
92.如本文所用,术语“抗原结合部分”是指与抗原决定簇(例如抗原)特异性结合的多肽。在一些实施方案中,抗原结合部分能够将其所附接的实体(例如,包含第二抗原结合部分的工程化抗体)引导至靶位点,例如引导至特定细胞类型,如携带抗原决定簇的肿瘤细胞或肿瘤基质类型。例如,抗体、抗体片段、抗体衍生物、抗体样支架和替代性支架包含至少一个抗原结合部分。抗原结合部分也可以并入单结构域抗体、巨型抗体、微型抗体、胞内抗体,双抗体、三抗体、四抗体、v
‑
nar和scfv中。因此,在一些实施方案中,所述第一抗原结合部分和所述第二抗原结合部分独立地选自抗原结合片段(fab)、单链可变片段(scfv)、全长免疫球蛋白、纳米抗体、单结构域抗体(sdab)、vnar结构域、和vhh结构域、双抗体或其功能片段。在一些实施方案中,所述第一抗原结合部分和/或所述第二抗原结合部分是单价的。在一些实施方案中,所述第一抗原结合部分和/或所述第二抗原结合部分是多价的,例如,包括多于一个抗原结合位点。在一些实施方案中,所述第一抗原结合部分和/或所述第二抗原结合部分是单特异性的。在一些实施方案中,所述第一抗原结合部分和/或所述第二抗原结合部分是多特异性的,例如,包含对至少两种不同靶抗原(例如,至少两种、至少三种、至少四种、至少五种靶抗原)具有特异性结合活性的抗原结合位点。
93.如本文所用的术语“抗原结合位点”是指抗原结合部分中负责抗原结合部分与抗原决定簇之间的特异性结合的一部分。抗原结合位点可以是单个结构域,例如表位结合结构域,或者可以是在标准抗体上发现的成对vh/vl结构域。因此,在一些实施方案中,如本文所述的抗体或其片段的抗原结合位点由重链(vh)和轻链(vl)的n末端可变区的氨基酸残基形成。通常,vh和vl的可变区各自包含三个高变区,称为互补决定区(cdr)。vh的3个cdr(称为hcdr1、hcdr2和hcdr3)和vl的3个cdr(称为lcdr1、lcdr2和lcdr3)相对于彼此三维放置,以形成抗原结合表面。除非另有说明,否则对于免疫球蛋白的普遍接受的kabat氨基酸编号贯穿本公开文本使用(参见kabat等人(1991)sequences of protein of immunological interest,第5版,united states public health service,national institute of health,bethesda,md)。尽管可以使用任何合适的编号系统来指定cdr区,但是在没有任何其他指示的情况下,根据kabat定义系统的本公开文本的工程化抗体的cdr序列已经总结在以下表4和表5中。
94.所述第一和第二抗原结合部分与其各自的靶标的结合可以以与靶标的天然配体的竞争或非竞争性方式进行。因此,在本公开文本的一些实施方案中,所述第一和/或第二抗原结合部分与其各自靶标的结合可以是配体阻断的。在一些其他实施方案中,所述第一和/或第二抗原结合部分与其各自靶标的结合不阻断天然配体的结合。在本公开文本的一些实施方案中,所述工程化抗体包含编码所述第一抗原结合部分的第一氨基酸序列,所述第一氨基酸序列与编码所述第二抗原结合部分的第二氨基酸序列连接,所述第一氨基酸序
列与所述第二氨基酸序列在自然界中非天然连接。所述氨基酸序列通常可以存在于融合多肽中聚集在一起的单独的蛋白质中,或者它们通常可以存在于同一蛋白质中,但是以新的排列放置在融合多肽中。编码所述第一和第二抗原部分的氨基酸序列可以例如通过化学合成或通过产生和翻译如下多核苷酸来产生,在所述多核苷酸中以期望的关系编码肽区域。
95.在一些实施方案中,所述第一抗原结合部分与所述第二抗原结合部分直接连接。在一些实施方案中,所述第一抗原结合部分经由至少一个共价键与所述第二抗原结合部分直接连接。在一些实施方案中,所述第一抗原结合部分经由至少一个肽键与所述第二抗原结合部分直接连接。在一些实施方案中,所述第一抗原结合部分的c末端氨基酸可以与所述第二抗原结合部分的n末端氨基酸可操作地连接。可替代地,所述第一抗原结合部分的n末端氨基酸可以与所述第二抗原结合部分的c末端氨基酸可操作地连接。
96.在一些实施方案中,所述第一抗原结合部分经由接头与所述第二抗原结合部分可操作地连接。可用于本文所述的工程化抗体的接头没有特别限制。在一些实施方案中,所述接头是合成化合物接头,例如像化学交联剂。市场上可获得的合适的交联剂的非限制性例子包括n
‑
羟基琥珀酰亚胺(nhs)、二琥珀酰亚胺辛二酸酯(dss)、双(磺基琥珀酰亚胺基)辛二酸酯(bs3)、二硫代双(琥珀酰亚胺基丙酸酯)(dsp)、二硫代双(磺基琥珀酰亚胺基丙酸酯)(dtssp)、乙二醇双(琥珀酰亚胺基琥珀酸酯)(egs)、乙二醇双(磺基琥珀酰亚胺基琥珀酸酯)(磺基
‑
egs)、二琥珀酰亚胺酒石酸酯(dst)、二磺基琥珀酰亚胺酒石酸酯(磺基
‑
dst)、双[2
‑
(琥珀酰亚胺氧基羰基氧基)乙基]砜(bsocoes)和双[2
‑
(磺基琥珀酰亚胺氧基羰基氧基)乙基]砜(磺基
‑
bsocoes)。
[0097]
在一些实施方案中,所述第一抗原结合部分经由接头肽序列与所述第二抗原结合部分可操作地连接。原则上,所述接头肽序列的长度和/或氨基酸组成没有特别的限制。在一些实施方案中,包含约一至约100个氨基酸残基(例如,2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个等的氨基酸残基)的任何任意单链肽可以用作肽接头。在一些实施方案中,所述接头肽序列包含约5至约50、约10至约60、约20至约70、约30至约80、约40至约90、约50至约100、约60至约80、约70至约100、约30至约60个、约20至约80个、约30至约90个氨基酸残基。在一些实施方案中,所述接头肽序列包含约1至约10、约5至约15、约10至约20、约15至约25、约20至约40、约30至约50、约40至约60、约50至约70个氨基酸残基。在一些实施方案中,所述接头肽序列包含约40至约70、约50至约80、约60至约80、约70至约90、或约80至约100个氨基酸残基。在一些实施方案中,所述接头肽序列包含约1至约10个、约5至约15个、约10至约20个、约15至约25个氨基酸残基。
[0098]
在一些实施方案中,可以优化所述接头肽序列的长度和氨基酸组成,以改变所述第一和第二抗原结合部分彼此的取向和/或接近度,从而实现所述工程化抗体的所需活性。在一些实施方案中,所述第一和第二抗原结合部分彼此的取向和/或接近度可以作为“调节”工具来改变,以实现将增强或降低工程化抗体的一种或多种所需活性的调节效果。例如,在一些实施方案中,所述第一和第二抗原结合部分彼此的取向和/或接近度可以被优化以产生工程化抗体的竞争性、部分竞争性或非竞争性形式。在某些实施方案中,所述接头仅含有甘氨酸和/或丝氨酸残基(例如,甘氨酸
‑
丝氨酸接头)。抗原
[0099]
在一些实施方案中,本公开文本的工程化抗体(如双特异性抗体)可以具有对两种
单独的细胞表面抗原的结合特异性,其中一种具有比另一种更快的内化速率。双特异性抗体可以包含至少两种组分即第一组分和第二组分,它们各自分别与其各自的抗原(例如第一细胞类型相关抗原(引导物抗原)和与靶信号传导途径相关的第二抗原(效应物抗原))结合。所述第一组分可以包含对于所述第一抗原的第一抗原结合部分,并且所述第二组分可以包含对于所述第二抗原的第二抗原结合部分。与非靶向抗体(例如,对效应物抗原不具有结合特异性的抗体)相比,这种双特异性抗体允许抑制靶信号传导途径的增加的效力,并且重要的是允许细胞类型特异性抑制。
[0100]
适合于本公开文本的工程化抗体的细胞表面抗原的非限制性例子包括激活的白细胞粘附分子(alcam)、神经细胞粘附分子(ncam)、钙激活的氯离子通道2(cacc)、碳酸酐酶ix、癌胚抗原(cea)、组织蛋白酶g、cd19、cd20、cd22、cd30、cd33、cd38、cd44、cd44v6、cd46、cd52、cd71、cd73、cd272、cd276、b细胞成熟抗原(bcma)、上皮细胞粘附分子(epcam)、肝配蛋白a型受体2(epha2)、肝配蛋白a型受体3(epha3)、肝配蛋白a型受体4(epha4)、肝配蛋白b2、受体酪氨酸激酶样孤儿受体1(ror1)、叶酸受体、flt3(cd135)、kit(cd117)、cd213a2、il
‑
1ra、prss21、vegfr2、cd24、pdgfr
‑
β、ssea
‑
4、表皮生长因子受体(egfr)、erb
‑
b2受体酪氨酸激酶2(erbb2)、erb
‑
b2受体酪氨酸激酶3(erbb3)、erb
‑
b2受体酪氨酸激酶4(erbb4)、叶酸结合蛋白(叶酸受体)、神经节苷脂、神经节苷脂、gp100、gpa33、未成熟层粘连蛋白受体、细胞间粘附分子1(icam
‑
1)、路易斯
‑
y、间皮素、前列腺干细胞抗原(psca)、粘蛋白16(muc16或ca
‑
125)、细胞表面相关的粘蛋白1(muc1)、形成寡聚物粘液凝胶的粘蛋白2(muc2)、粘蛋白、前列腺膜特异性抗原(psma)、tem1/cd248、tem7r、cldn6、促甲状腺激素受体(tshr)、gprc5d、cd97、cd179a、间变性淋巴瘤激酶(alk或cd246)、免疫球蛋白λ样多肽1(igll1)、p选择素、c
‑
met、成纤维细胞生长因子受体(fgfr)、胰岛素样生长因子1受体(igf
‑
1r)、肿瘤相关钙信号转导子2(trop
‑
2)和肿瘤相关糖蛋白72(tag
‑
72)。在一些实施方案中,所述细胞表面抗原包括icam
‑
1、epha2和alcam。引导物抗原
[0101]
在一些实施方案中,由本公开文本的工程化抗体识别的引导物抗原是用作细胞类型相关抗原的分子。细胞类型相关抗原通常是指这样的分子,其中与一个或多个非靶细胞相比,在某种类型的一个或多个目标细胞(“一个或多个靶细胞”)中表达水平显著更高。在一些实施方案中,所述引导物抗原可以是在靶细胞上过表达的任何细胞表面抗原。例如,存在在癌细胞中过表达的分子,如细胞间粘附分子1(icam
‑
1)、epha2和激活的白细胞。在一些实施方案中,所述引导物抗原是细胞粘附分子(alcam),并且这些分子可以被认为是癌症相关抗原或肿瘤相关抗原。
[0102]
在一些实施方案中,所述引导物抗原是癌症相关抗原。适合于本公开文本的组合物和方法的癌症相关抗原的非限制性例子包括cd19、cd22、her2(erbb2/neu)、间皮素、psca、cd123、cd30、cd71、cd171、cs
‑
1、clecl1、cd33、egfrviii、gd2、gd3、bcma、psma、受体酪氨酸激酶样孤儿受体1(ror1)、叶酸受体、flt3(cd135)、tag72、cd38、cd44v6、cd46、cea、epcam、cd272、b7h3(cd276)、kit(cd117)、cd213a2、il
‑
1ra、prss21、vegfr2、cd24、pdgfr
‑
β、ssea
‑
4、cd20、muc1、muc16、egfr、erbb2、erbb3、erbb4、ncam、前列腺酸性磷酸酶(pap)、肝配蛋白b2、成纤维细胞激活蛋白(fap)、epha2、c
‑
met、成纤维细胞生长因子受体(fgfr)、胰岛素样生长因子1受体(igf
‑
1r)、gm3、tem1/cd248、tem7r、cldn6、促甲状腺激素受体(tshr)、
gprc5d、cd97、cd179a、间变性淋巴瘤激酶(alk或cd246)和免疫球蛋白λ样多肽1(igll1)。在一些实施方案中,本文公开的工程化抗体或功能片段包含能够与在细胞表面上表达的epha2结合的抗原结合部分。
[0103]
在一些实施方案中,通过特异性地识别和结合细胞类型相关抗原(例如,引导物抗原),可以将本公开文本的工程化抗体募集至与引导物抗原相关的靶细胞,从而导致例如靶细胞中信号传导途径的调节。在一些实施方案中,本公开文本的工程化抗体的引导物抗原不仅用作细胞类型选择剂,而且还用作效力增强剂,导致例如靶信号传导途径的有效和选择性抑制。在一些实施方案中,靶细胞表面上的引导物抗原的表达存在阈值,这导致(1)工程化抗体与靶细胞的结合亲和力的增强和(2)工程化抗体对效应物抗原的占用率的提高。效应物抗原
[0104]
在一些实施方案中,由本文所述的工程化抗体识别的效应物抗原是与细胞活性或功能(如信号传导途径)相关的分子。在一些实施方案中,效应物抗原在目标细胞的表面上表达。在一些实施方案中,由本文所述的工程化抗体识别的效应物抗原是与目标信号传导途径(例如,靶信号传导途径)相关的分子。在一些情况下,所述效应物抗原包括肿瘤抗原(例如,肿瘤相关抗原或肿瘤特异性抗原)。适合于本公开文本的工程化抗体的效应物抗原的非限制性例子包括alcam、epcam、叶酸结合蛋白、psma、psca、间皮素、cd19、cd20、cd22、cd30、cd33、cd38、cd44、cd46、icam
‑
1、cd55、cd59、cd70、cd71、cd73、cd97、bcma、cd272、cd276、muc1、muc16、ncam、cd24、epha2、epha3、epha4、肝配蛋白b2、cea、c
‑
met、fgfr、igf
‑
1r、vegfr、pdgfr、trop
‑
2、tag
‑
72、p选择素。以下进一步描述了合适的效应物抗原的其他例子,包括egfr、erbb2、erbb3和erbb4。在一些实施方案中,本文公开的工程化抗体或功能片段包含能够与在细胞表面上表达的alcam结合的抗原结合部分。
[0105]
在一些特定实施方案中,本公开文本的工程化抗体或功能片段包含能够与在细胞表面上表达的epha2结合的第一抗原结合部分;和能够与在同一细胞的表面上表达的alcam结合的第二抗原结合部分。在一些实施方案中,epha2与alcam的表面密度比率大于阈值。在一些实施方案中,epha2与alcam的表面密度比率大于约1:1、约1:2、约1:3、约1:4、约1:5、约1:10、约1:20或约1:30的阈值。在一些实施方案中,epha2与alcam的表面密度比率大于约1:5的阈值。
[0106]
在一些实施方案中,如本文所述的工程化抗体或其功能片段包含与本文公开的氨基酸序列中的任一个具有至少80%序列同一性的氨基酸序列。在一些实施方案中,如本文所述的工程化抗体或其功能片段包含与本文公开的氨基酸序列中的任一个具有至少80%、至少90%、至少95%、至少96%、至少97%、至少98%、或至少99%序列同一性的氨基酸序列。在一些实施方案中,如本文所述的工程化抗体或其功能片段包含与表4中鉴定的氨基酸序列中的任一个具有至少80%、至少90%、至少95%、至少96%、至少97%、至少98%、或至少99%序列同一性的氨基酸序列。在一些实施方案中,如本文所述的工程化抗体或其功能片段包含与表4中鉴定的氨基酸序列中的任一个具有100%序列同一性的氨基酸序列。在一些实施方案中,本文所述的工程化抗体或其功能片段包含对应于表4中鉴定的氨基酸序列中的任一个的氨基酸序列,其中所述氨基酸序列中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。第一抗原结合部分
[0107]
如上所述,本公开文本的各个实施方案和方面包括包含能够与细胞表面引导物抗原结合的第一抗原结合部分的工程化抗体。在一些实施方案中,所述第一抗原结合部分包含与表4中鉴定的vh序列具有至少80%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的重链可变(vh)区。在一些实施方案中,所述第一抗原结合部分包含与seq id no:81具有至少80%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的vh区。在一些实施方案中,所述第一抗原结合部分包含与seq id no:96具有至少80%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的vh区。在一些实施方案中,所述第一抗原结合部分包含含有与表4中鉴定的vh序列具有100%序列同一性的氨基酸序列的vh区。在一些实施方案中,所述第一抗原结合部分包含含有与seq id no:81具有100%序列同一性的氨基酸序列的vh区。在一些实施方案中,所述第一抗原结合部分包含含有与seq id no:96具有100%序列同一性的氨基酸序列的vh区。在一些实施方案中,所述第一抗原结合部分包含具有对应于表4中鉴定的vh序列中的任一个的氨基酸序列的vh区,其中所述氨基酸序列中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。在一些实施方案中,所述第一抗原结合部分包含具有对应于seq id no:81的氨基酸序列的vh区,其中seq id no:81的氨基酸序列中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。在一些实施方案中,所述第一抗原结合部分包含具有对应于seq id no:96的氨基酸序列的vh区,其中seq id no:96的氨基酸序列中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。
[0108]
在一些实施方案中,所述第一抗原结合部分的vh区包含如在序列表中公开的每个vh序列中鉴定的三个cdr(例如,hcdr1、hcdr2和hcdr3)。在一些实施方案中,所述第一抗原结合部分的hcdr1包含seq id no:104的序列。在一些实施方案中,所述第一抗原结合部分的hcdr2包含seq id no:105的序列。在一些实施方案中,所述第一抗原结合部分的hcdr3包含seq id no:106或seq id no:110的序列。在一些实施方案中,所述第一抗原结合部分的vh区的hcdr1、hcdr2和hcdr3分别包含seq id no:104、seq id no:105和seq id no:106的序列。在一些实施方案中,所述第一抗原结合部分的vh区的hcdr1、hcdr2和hcdr3分别包含seq id no:104、seq id no:105和seq id no:110的序列。在一些实施方案中,所述第一抗原结合部分的vh区包含如在序列表中公开的每个vh序列中鉴定的三个hcdr,其中至少一个所述hcdr中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。在一些实施方案中,所述第一抗原结合部分的hcdr1包含seq id no:104的序列,其中seq id no:104中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。在一些实施方案中,所述第一抗原结合部分的hcdr2包含seq id no:105的序列,其中seq id no:105中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。在一些实施方案中,所述第一抗原结合部分的hcdr3包含seq id no:106的序列,其中seq id no:106中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。在一些实施方案中,所述第一抗原结合部分的hcdr3包含seq id no:110的序列,其中seq id no:110中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。
[0109]
在一些实施方案中,所述第一抗原结合部分包含与表4中鉴定的vl序列具有至少80%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的轻链可变(vl)区。在一些实施方案中,所述第一抗原结合部分包含与seq id no:82具有至少80%、
至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的vl区。在一些实施方案中,所述第一抗原结合部分包含与seq id no:97具有至少80%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的vl区。在一些实施方案中,所述第一抗原结合部分包含含有与表4中鉴定的vl序列具有100%序列同一性的氨基酸序列的vl区。在一些实施方案中,所述第一抗原结合部分包含含有与seq id no:82具有100%序列同一性的氨基酸序列的vl区。在一些实施方案中,所述第一抗原结合部分包含含有与seq id no:97具有100%序列同一性的氨基酸序列的vl区。在一些实施方案中,所述第一抗原结合部分包含具有对应于表4中鉴定的vl序列中的任一个的氨基酸序列的vl区,其中所述氨基酸序列中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。在一些实施方案中,所述第一抗原结合部分包含具有对应于seq id no:82的氨基酸序列的vl区,其中seq id no:82的氨基酸序列中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。在一些实施方案中,所述第一抗原结合部分包含具有对应于seq id no:97的氨基酸序列的vl区,其中seq id no:97的氨基酸序列中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。
[0110]
在一些实施方案中,所述第一抗原结合部分的vl区包含如在序列表中公开的每个vl序列中鉴定的三个cdr(例如,lcdr1、lcdr2和lcdr3)。在一些实施方案中,所述第一抗原结合部分的lcdr1包含seq id no:107的序列。在一些实施方案中,所述第一抗原结合部分的lcdr2包含seq id no:108的序列。在一些实施方案中,所述第一抗原结合部分的lcdr3包含seq id no:109的序列。在一些实施方案中,所述第一抗原结合部分的vl区的lcdr1、lcdr2和lcdr3分别包含seq id no:107、seq id no:108和seq id no:109的序列。在一些实施方案中,所述第一抗原结合部分包含具有对应于表4中鉴定的vl序列中的任一个的氨基酸序列的vl区,其中所述氨基酸序列中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。在一些实施方案中,所述第一抗原结合部分包含具有对应于seq id no:82的氨基酸序列的vl区,其中seq id no:82的氨基酸序列中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。在一些实施方案中,所述第一抗原结合部分包含具有对应于seq id no:97的氨基酸序列的vl区,其中seq id no:97的氨基酸序列中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。
[0111]
在一些实施方案中,所述第一抗原结合部分的vl区包含如在所述序列表中公开的每个vl序列中鉴定的三个cdr(例如,lcdr1、lcdr2和lcdr3),其中至少一个所述lcdr中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。在一些实施方案中,所述第一抗原结合部分的lcdr1包含seq id no:107的序列,其中seq id no:107中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。在一些实施方案中,所述第一抗原结合部分的lcdr2包含seq id no:108的序列,其中seq id no:108中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。在一些实施方案中,所述第一抗原结合部分的lcdr3包含seq id no:109的序列,其中seq id no:109中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。第二抗原结合部分
[0112]
如上所述,本公开文本的各个实施方案和方面包括包含能够与细胞表面效应物抗原结合的第二抗原结合部分的工程化抗体。在一些实施方案中,所述第二抗原结合部分包
含与表4中鉴定的vh序列具有至少80%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的vh区。在一些实施方案中,所述第二抗原结合部分包含与seq id no:73具有至少80%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的vh区。在一些实施方案中,所述第二抗原结合部分包含与seq id no:75具有至少80%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的vh区。在一些实施方案中,所述第二抗原结合部分包含含有与表4中鉴定的vh序列具有100%序列同一性的氨基酸序列的vh区。在一些实施方案中,所述第二抗原结合部分包含含有与seq id no:73具有100%序列同一性的氨基酸序列的vh区。在一些实施方案中,所述第二抗原结合部分包含含有与seq id no:75具有100%序列同一性的氨基酸序列的vh区。在一些实施方案中,所述第二抗原结合部分包含具有对应于表4中鉴定的vh序列中的任一个的氨基酸序列的vh区,其中所述氨基酸序列中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。在一些实施方案中,所述第二抗原结合部分包含具有对应于seq id no:73的氨基酸序列的vh区,其中seq id no:73的氨基酸序列中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。在一些实施方案中,所述第二抗原结合部分包含具有对应于seq id no:75的氨基酸序列的vh区,其中seq id no:75的氨基酸序列中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。
[0113]
在一些实施方案中,所述第二抗原结合部分的vh区包含如在序列表中公开的每个vh序列中鉴定的三个cdr(例如,hcdr1、hcdr2和hcdr3)。在一些实施方案中,所述第二抗原结合部分的hcdr1包含seq id no:98的序列。在一些实施方案中,所述第二抗原结合部分的hcdr2包含seq id no:99的序列。在一些实施方案中,所述第二抗原结合部分的hcdr3包含seq id no:106或seq id no:100的序列。在一些实施方案中,所述第一抗原结合部分的vh区的hcdr1、hcdr2和hcdr3分别包含seq id no:98、seq id no:99和seq id no:100的序列。在一些实施方案中,所述第二抗原结合部分的vh区包含如在序列表中公开的每个vh序列中鉴定的三个hcdr,其中至少一个所述hcdr中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。在一些实施方案中,所述第二抗原结合部分的hcdr1包含seq id no:98的序列,其中seq id no:98中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。在一些实施方案中,所述第二抗原结合部分的hcdr2包含seq id no:99的序列,其中seq id no:99中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。在一些实施方案中,所述第二抗原结合部分的hcdr3包含seq id no:100的序列,其中seq id no:100中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。
[0114]
在一些实施方案中,所述第二抗原结合部分包含与表4中鉴定的vl序列具有至少80%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的vl区。在一些实施方案中,所述第二抗原结合部分包含与seq id no:74具有至少80%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的vl区。在一些实施方案中,所述第二抗原结合部分包含与seq id no:76具有至少80%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的vl区。在一些实施方案中,所述第二抗原结合部分包含含有与表4中鉴定的vl序列具有100%序列同一性的氨基酸序列的vl区。在一些实施方案中,所述第二抗原结合部分包含含有与seq id no:74具有100%序列同一性的氨基酸序列的vl区。在一些实施方案中,所述第二抗原结合部分包含含有与seq id no:
76具有100%序列同一性的氨基酸序列的vl区。在一些实施方案中,所述第二抗原结合部分包含具有对应于表4中鉴定的vl序列中的任一个的氨基酸序列的vl区,其中所述氨基酸序列中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。在一些实施方案中,所述第二抗原结合部分包含具有对应于seq id no:74的氨基酸序列的vl区,其中seq id no:74的氨基酸序列中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。在一些实施方案中,所述第二抗原结合部分包含具有对应于seq id no:76的氨基酸序列的vl区,其中seq id no:76的氨基酸序列中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。
[0115]
在一些实施方案中,所述第二抗原结合部分的vl区包含如在序列表中公开的每个vl序列中鉴定的三个cdr(例如,lcdr1、lcdr2和lcdr3)。在一些实施方案中,所述第二抗原结合部分的lcdr1包含seq id no:101的序列。在一些实施方案中,所述第二抗原结合部分的lcdr2包含seq id no:102的序列。在一些实施方案中,所述第二抗原结合部分的lcdr3包含seq id no:103的序列。在一些实施方案中,所述第二抗原结合部分的vl区的lcdr1、lcdr2和lcdr3分别包含seq id no:101、seq id no:102和seq id no:103的序列。在一些实施方案中,所述第二抗原结合部分的vl区包含如在序列表中鉴定的三个cdr,其中至少一个所述cdr中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。在一些实施方案中,所述第二抗原结合部分的lcdr1包含seq id no:101的序列,其中seq id no:101中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。在一些实施方案中,所述第二抗原结合部分的lcdr2包含seq id no:102的序列,其中seq id no:102中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。在一些实施方案中,所述第二抗原结合部分的lcdr3包含seq id no:103的序列,其中seq id no:103中的一、二、三、四或五个氨基酸残基被不同的氨基酸残基取代。目标部分
[0116]
在本公开文本的一些实施方案中,所述抗体或其功能片段与选自治疗部分、诊断剂和改善药代动力学的部分的至少一个目标部分(moi)缀合或共价结合。在一些实施方案中,所述至少一个moi选自抗癌剂、抗自身免疫性疾病药剂、抗炎剂、抗细菌剂、抗微生物剂、抗生素、抗感染性疾病药剂和抗病毒剂。在一些实施方案中,所述至少一个moi选自细胞毒性抗癌剂、dna螯合剂、微管抑制剂、拓扑异构酶抑制剂、翻译起始抑制剂、核糖体失活分子、核转运抑制剂、rna剪接抑制剂、rna聚合酶抑制剂和dna聚合酶抑制剂。
[0117]
在一些实施方案中,所述细胞毒性抗癌剂选自奥瑞他汀、海兔毒素、微管溶素、美登木素生物碱、紫杉烷、长春花生物碱、毒伞肽、蒽环类、刺孢霉素、喜树碱、伊立替康、sn
‑
38、康普瑞汀、倍癌霉素、烯二炔类、埃博霉素、乙烯亚胺类、自力霉素、吡咯并苯二氮卓类(pbd)和卡奇霉素。
[0118]
在一些实施方案中,所述至少一个目标部分(moi)与所述工程化抗体或其功能片段的恒定区缀合或共价结合。在一些实施方案中,所述至少一个目标部分(moi)与所述抗体或其功能片段的重链恒定(例如,ch1、ch2或ch3)区缀合或共价结合。在一些实施方案中,所述至少一个目标部分(moi)与所述抗体或其功能片段的ch1区缀合或共价结合。在一些实施方案中,所述至少一个目标部分(moi)与所述抗体或其功能片段的轻链恒定(cl)区缀合或共价结合。原则上,可以与本公开文本的工程化抗体缀合或共价结合的moi的数量没有特别
限制。在一些实施方案中,本公开文本的工程化抗体的每个抗体的平均moi数量(即,平均药物与抗体比率,dar)的范围是1至20。在一些实施方案中,本公开文本的工程化抗体的平均moi数量的范围是约1至约10。在一些实施方案中,所述平均dar是约1至约5、约2至约6、约3至约7、约3至约8、约4至约9、约5至约10、约10至约15、约15至约20或约10至约20。
[0119]
本领域技术人员将理解,如本文所公开的工程化抗体的完整氨基酸序列可以用于构建向回翻译(back
‑
translated)基因。例如,可以合成含有编码给定抗体的核苷酸序列的dna寡聚物。例如,可以合成编码所需抗体的各部分的几个小寡核苷酸,然后进行连接。单独寡核苷酸通常包含5'或3'突出端以进行互补装配。
[0120]
除了经由表达已经通过重组分子生物学技术改变的核酸分子来产生工程化抗体之外,还可以化学合成根据本公开文本的主题工程化抗体或其功能片段。化学合成的多肽由本领域技术人员常规地产生。
[0121]
组装(通过合成、定点诱变或其他方法)后,将编码如本文所公开的工程化抗体或其功能片段的dna序列插入表达载体中,并与适于在所需的转化宿主中表达所述工程化抗体或其功能片段的表达控制序列可操作地连接。正确的装配可以通过核苷酸测序、限制性酶切作图和生物活性多肽在合适宿主中的表达来确认。如本领域中已知的,为了获得转染基因在宿主中的高表达水平,必须将所述基因可操作地连接至在所选表达宿主中起作用的转录和翻译表达控制序列。
[0122]
本公开文本的工程化抗体或其功能片段的结合活性可以通过本领域已知的任何合适的方法来测定。与靶抗原或靶表位“优先结合”或“特异性结合”(在本文中可互换使用)的抗体或多肽是本领域熟知的术语,并且用于测定这种特异性或优先结合的方法也是本领域已知的。如果相比于抗体或多肽与替代抗原或表位反应或缔合的情况,所述抗体或多肽与特定抗原或表位更频繁更快速地以更长的持续时间和/或以更大的亲和力反应或缔合,则所述抗体或多肽被视为展现出“特异性结合”或“优先结合”。如果相比于抗体或多肽与其他物质结合的情况,所述抗体或多肽以更大的亲和力、亲合力更容易地和/或以更长的持续时间与靶标结合,则所述抗体或多肽与该靶标特异性结合或优先结合。此外,如果相比于抗体或多肽与样品中存在的其他物质结合的情况,所述抗体或多肽以更大亲和力、亲合力更容易地和/或以更长的持续时间与靶标结合,则所述抗体或多肽与该靶标“特异性结合”或“优先结合”。例如,与epha2表位特异性或优先结合的抗体或多肽是这样的抗体或多肽,相比于其与其他epha2表位或非epha2表位结合的情况,其以更大的亲和力、亲合力更容易地和/或以更长的持续时间结合该表位。通过阅读此定义还应理解,例如,特异性地或优先结合第一靶标的抗体或多肽(或部分或表位)可以或可以不特异性地或优先结合第二靶标。这样,“特异性结合”或“优先结合”并不一定需要(尽管可以包括)专一结合。
[0123]
可以使用多种测定形式来选择特异性结合目标分子的抗体或多肽。例如,固相elisa免疫测定、免疫沉淀、biacore
tm
(ge healthcare,新泽西州皮斯卡塔韦)、kinexa、荧光激活细胞分选(facs)、octet
tm
(fortebio,inc.,加利福尼亚州门洛帕克)和蛋白质印迹分析是可用于鉴定与抗原或其配体结合部分特异性反应的抗体的许多测定之一,所述抗原或其配体结合部分与同源配体或结合配偶体特异性结合。通常,特异性或选择性反应将是背景信号或噪声的至少两倍、更典型地是背景的多于10倍、甚至更典型地是背景的多于50倍、更典型地是背景的多于100倍、但更典型地是背景的多于500倍、甚至更典型地是背景的多于
1000倍、以及甚至更典型地是背景的多于10,000倍。此外,在一些实施方案中,当平衡解离常数(k
d
)<43nm、<25nm、<20nm、<15nm、<10nm或<7nm时,称抗体“特异性结合”抗原。
[0124]
术语“结合亲和力”在本文中用作两个分子(例如,抗体或其部分与抗原)之间非共价相互作用的强度的量度。术语“结合亲和力”用于描述单价相互作用(内在活性)。两个分子之间的结合亲和力可以通过测定解离常数(k
d
)来定量。反过来,可以通过使用例如表面等离子体共振(spr)方法(biacore)测量复合物形成和解离的动力学来测定k
d
。对应于单价复合物的缔合和解离的速率常数分别称为缔合速率常数k
a
(或k
on
)和解离速率常数k
d
(或k
off
)。k
d
通过等式k
d
=k
d
/k
a
与k
a
和k
d
相关联。解离常数的值可以通过熟知的方法直接测定,并且甚至可以通过caceci等人(1984,byte 9:340
‑
362)提出的方法计算复杂混合物的解离常数的值。例如,k
d
可以使用双滤膜硝酸纤维素滤膜结合测定(如wong和lohman(1993,proc.natl.acad.sci.usa 90:5428
‑
5432)所公开的测定)来建立。用于评价本公开文本的工程化抗体对靶抗原的结合能力的其他标准测定是本领域已知的,包括例如elisa、蛋白质印迹、ria和流式细胞术分析以及本文别处例示的其他测定。所述抗体的结合动力学和结合亲和力也可以通过本领域已知的标准测定如表面等离子体共振(spr)例如通过使用biacore
tm
系统或kinexa来评估。核酸分子
[0125]
在另一方面,本文提供了编码本公开文本的工程化抗体的各种重组核酸分子,包括含有这些核酸分子的表达盒和表达载体,所述这些核酸分子与异源核酸序列(例如像允许在宿主细胞或离体无细胞表达系统中表达工程化抗体的调节序列)可操作地连接。
[0126]
术语“核酸分子”和“多核苷酸”在本文中可互换使用,是指rna分子和dna分子两者,包括包含以下的核酸分子:cdna、基因组dna、合成dna,以及包含核酸类似物的dna或rna分子。核酸分子可以是双链或单链的(例如,有义链或反义链)。核酸分子可包含非常规或经修饰的核苷酸。如本文所用的术语“多核苷酸序列”和“核酸序列”可互换地指多核苷酸分子的序列。本文使用37cfr
§
1.822中所示的核苷酸碱基命名法。
[0127]
本公开文本的核酸分子可以是任何长度的核酸分子,包含通常在约0.5kb与约20kb之间,例如在约0.5kb与约20kb之间、在约1kb与约15kb之间、在约2kb与约10kb之间,或在约5kb与约25kb之间,例如在约10kb与15kb之间、约15kb与约20kb之间、约5kb与约20kb之间、约5kb与约10kb之间,或约10kb与约25kb之间的核酸分子。
[0128]
如本文所用,术语“重组”核酸分子是指已经通过人干预而改变的核酸分子。作为非限制性例子,cdna是重组dna分子,如已通过一个或多个体外聚合酶反应产生的或已与接头附接的或已整合至载体(如克隆载体或表达载体)中的任何核酸分子。作为非限制性例子,重组核酸分子:1)已经例如使用化学或酶技术或核酸分子的重组在体外合成或修饰;2)包含在自然界中不连接的连接的核苷酸序列,3)已经使用分子克隆技术进行工程化,使得其缺乏关于天然存在的核酸分子序列的一个或多个核苷酸,和/或4)已经使用分子克隆技术进行操纵,使得其具有关于天然存在的核酸序列的一个或多个序列变化或重排。
[0129]
在本文公开的一些实施方案中,本公开文本的核酸分子包含编码具有如下氨基酸序列的工程化抗体的核苷酸序列,所述氨基酸序列与如本文所公开的工程化抗体的氨基酸序列具有至少80%、90%、95%、96%、97%、98%、99%序列同一性。在一些实施方案中,本公开文本的核酸分子包含编码具有如下氨基酸序列的工程化抗体的核苷酸序列,所述氨基
酸序列与表4中鉴定的氨基酸序列中的任一个具有至少80%、90%、95%、96%、97%、98%、99%序列同一性。在一些实施方案中,本公开文本的核酸分子包含编码具有如下氨基酸序列的工程化抗体的核苷酸序列,所述氨基酸序列与表3中鉴定的vh氨基酸序列中的任一个具有至少80%、90%、95%、96%、97%、98%、99%序列同一性。在一些实施方案中,本公开文本的核酸分子包含编码具有如下氨基酸序列的工程化抗体的核苷酸序列,所述氨基酸序列与表4中鉴定的vl氨基酸序列中的任一个具有至少80%、90%、95%、96%、97%、98%、99%序列同一性。
[0130]
本文公开的一些实施方案涉及载体或表达盒,所述载体或表达盒包含编码如本文所公开的工程化抗体的重组核酸分子。如本文所用,术语“表达盒”是指遗传物质的构建体,其含有编码序列和足够的调节信息以引导编码序列在体内和/或离体的受体细胞中恰当转录和/或翻译。可以将所述表达盒插入用于靶向期望的宿主细胞的载体中和/或受试者中。因此,术语表达盒可以与术语“表达构建体”互换使用。如本文所用,术语“构建体”旨在意指源自能够进行基因组整合或自主复制的包含核酸分子的任何来源的任何重组核酸分子,如表达盒、质粒、粘粒、病毒、自主复制多核苷酸分子、噬菌体或者线性或环状、单链或双链dna或rna多核苷酸分子,其中一个或多个核酸序列已经以功能上操作性的方式连接,例如可操作地连接。
[0131]
本文还提供了含有编码本文公开的任何工程化抗体的核酸分子中的一个或多个核酸分子的载体、质粒或病毒。上述核酸分子可以包含在载体中,所述载体能够引导所述核酸分子在例如已用所述载体转化/转导的细胞中的表达。用于真核和原核细胞的合适载体是本领域已知的,并且是可商购的或容易由技术人员制备的。还可以在例如以下文献中发现另外的载体:ausubel,f.m.等人,current protocols in molecular biology,(current protocol,1994)和sambrook等人,“molecular cloning:a laboratory manual,”第2版(1989)。
[0132]
应当理解的是,并非所有的载体和表达控制序列都将同样好地作用于表达本文所述的dna序列。也并非所有宿主都将同样好地以相同表达系统发挥作用。然而,本领域技术人员可以在没有进行过多实验的情况下在这些载体、表达控制序列和宿主之中进行选择。例如,在选择载体时,必须考虑宿主,因为载体必须在宿主中复制。还应考虑载体的拷贝数、控制该拷贝数的能力以及由所述载体编码的任何其他蛋白质诸如抗生素标记的表达。例如,可以使用的载体包括允许编码本公开文本的工程化抗体的dna在拷贝数方面被扩增的载体。此类可扩增的载体是本领域已知的。
[0133]
因此,在一些实施方案中,如本文所述的工程化抗体可以由载体(例如表达载体)表达。载体可用于在宿主细胞中自主复制,或可在引入宿主细胞后整合到宿主细胞的基因组中,从而与宿主基因组一起复制(例如,非附加型哺乳动物载体)。表达载体能够引导与其可操作地连接的编码序列的表达。通常,在重组dna技术中有用的表达载体往往是质粒(载体)的形式。然而,还包括其他形式的表达载体,如病毒载体(例如,复制缺陷型逆转录病毒、腺病毒和腺相关病毒)。示例性重组表达载体可包含一个或多个调节序列,所述一个或多个调节序列是基于要用于表达的宿主细胞选择的,可操作地连接至待表达的核酸序列。
[0134]
可经由常规转化或转染技术将dna载体引入原核或真核细胞中。用于转化或转染宿主细胞的合适方法可以发现于以下文献中:sambrook等人(1989,同上)和其他标准分子
生物学实验室手册。
[0135]
编码本公开文本的工程化抗体的核酸序列可以进行优化以在目标宿主细胞中表达。例如,可以将序列的g
‑
c含量调节至给定细胞宿主的平均水平,如参照宿主细胞中表达的已知基因所计算的。用于密码子优化的方法是本领域已知的。可以优化本文公开的工程化抗体的编码序列内的密码子使用以增强在宿主细胞中的表达,使得编码序列内的密码子的约1%、约5%、约10%、约25%、约50%、约75%或至多100%已针对特定宿主细胞中的表达进行优化。
[0136]
适合使用的载体包括用于细菌中的基于t7的载体、用于哺乳动物细胞中的pmsxnd表达载体和用于昆虫细胞中的杆状病毒来源的载体。在一些实施方案中,可以将在此类载体中编码工程化抗体的核酸插入物与启动子可操作地连接,所述启动子基于例如寻求在其中表达的细胞的类型进行选择。
[0137]
在选择表达控制序列时,还应考虑多种因素。这些因素包括例如序列的相对强度、序列的可控制性,以及序列与编码主题多肽的实际dna序列的相容性,特别是关于潜在的二级结构。宿主的选择应考虑它们与所选载体的相容性、由本公开文本的dna序列编码的产物的毒性、所述宿主的分泌特征、所述宿主正确折叠多肽的能力、所述宿主的发酵或培养要求,以及由所述dna序列编码的产物的易纯化性。
[0138]
在这些参数内,本领域技术人员可以选择各种载体/表达控制序列/宿主组合,所述各种载体/表达控制序列/宿主组合将在进行发酵时或大规模动物培养(例如使用cho细胞或cos 7细胞)中表达期望的dna序列。
[0139]
在一些实施方案中,表达控制序列和表达载体的选择将取决于对宿主的选择。可以使用多种表达宿主/载体组合。用于真核宿主的有用的表达载体的非限制性例子包括例如具有来自sv40、牛乳头瘤病毒、腺病毒和巨细胞病毒的表达控制序列的载体。用于细菌宿主的有用表达载体的非限制性例子包括已知的细菌质粒,例如来自大肠杆菌的质粒,包括col el、pcri、per32z、pmb9以及它们的衍生物;更广泛的宿主范围质粒,诸如rp4;噬菌体dna,例如噬菌体λ的众多衍生物,例如nm989;以及其他dna噬菌体,诸如m13和丝状单链dna噬菌体。用于酵母细胞的有用表达载体的非限制性例子包括2μ质粒及其衍生物。用于昆虫细胞的有用载体的非限制性例子包括pvl 941和pfastbac
tm
1。
[0140]
除了促进插入的核酸分子转录的序列外,载体还可包含复制起点和编码选择性标记的其他基因。例如,新霉素抗性(neor)基因赋予表达它的细胞g418抗性,并且因此允许对经转染的细胞进行表型选择。本领域技术人员可以容易地确定给定的调节元件或选择性标记是否适合用于特定的实验环境。
[0141]
可以在本公开文本中使用的病毒载体包括例如逆转录病毒载体、腺病毒载体和腺相关病毒载体、慢病毒载体、疱疹病毒、猿猴病毒40(sv40)和牛乳头瘤病毒载体(参见例如,gluzman(编辑),eukaryotic viral vectors,csh laboratory press,cold spring harbor,n.y.)。在一些实施方案中,所述载体是慢病毒载体、腺相关病毒载体或逆转录病毒载体。在一些实施方案中,所述载体是慢病毒载体。
[0142]
含有如本文所公开的工程化抗体或其功能片段和/或含有并表达编码本文公开的工程化抗体或其功能片段中的任一种的核酸分子的重组原核或真核细胞也是本公开文本的特征。在一些实施方案中,本公开文本的重组细胞是转染的细胞,例如,通过重组方法和
技术已经将核酸分子(例如编码本文公开的工程化抗体的核酸分子)引入其中的细胞。这种细胞的子代也被认为在本公开文本的范围内。含有如本文所公开的至少一种重组细胞的细胞培养物也在本公开文本的范围内。如本文所用的术语“细胞”、“细胞培养物”、“细胞系”、“重组细胞”、“受体细胞”和“宿主细胞”包括原代主题细胞及其任何后代,而不考虑转移的数量。应当理解,并非所有后代都与亲本细胞完全相同(由于有意或无意的突变或环境差异);然而,只要后代保留与最初转化的细胞的功能相同的功能,这种改变的后代就包括在这些术语中。
[0143]
表达系统的精确组分并不重要。例如,如本文所公开的工程化抗体可以在原核宿主(例如细菌大肠杆菌)中或在真核宿主(例如昆虫细胞(例如,sf21细胞)或哺乳动物细胞(例如,cos细胞、nih 3t3细胞或hela细胞))中产生。这些细胞可从许多来源获得,包括美国典型培养物保藏中心(弗吉尼亚州马纳萨斯)。在选择表达系统时,重要的仅是组分彼此相容。技术人员或普通技术人员能够做出这样的决定。此外,如果在选择表达系统时需要指导,则技术人员可以咨询ausubel等人(current protocols in molecular biology,john wiley and sons,new york,n.y.,1993)和pouwels等人(cloning vectors:a laboratory manual,1985年增刊,1987)。
[0144]
如本文所述,可以使用常规的生化程序从表达系统纯化表达的抗体,并且可以将其用作例如治疗剂。
[0145]
在一些实施方案中,所获得的工程化抗体将是糖基化或非糖基化的,这取决于用于产生工程化抗体的宿主生物体。如果选择细菌作为宿主,则产生的工程化抗体将是非糖基化的。另一方面,真核细胞将使工程化抗体糖基化,但可能与天然多肽糖基化的方式不同。由转化的宿主产生的重组抗体可以根据本领域已知的任何合适的方法进行纯化。所产生的重组抗体可以从细菌(如大肠杆菌)中产生的包涵体分离,或者使用阳离子交换、凝胶过滤和/或反相液相色谱法从来自产生本公开文本的工程化抗体的哺乳动物或酵母培养物的条件培养基分离。
[0146]
另外地或可替代地,构建编码本公开文本的工程化抗体的dna序列的另一种示例性方法是通过化学合成。这包括通过编码展现出所述特性的工程化抗体的氨基酸序列的化学方法直接合成肽。该方法可以在影响工程化抗体与靶蛋白的结合亲和力的位置并入天然和非天然氨基酸。可替代地,可以使用寡核苷酸合成器通过化学方法合成编码所需工程化抗体的基因。此类寡核苷酸是基于所需工程化抗体的氨基酸序列设计的,并且通常选择在其中将产生本公开文本的工程化抗体的宿主细胞中有利的那些密码子。在这方面,本领域中公认遗传密码是简并的,因此一个氨基酸可以被多于一种密码子编码。例如,phe(f)由两种密码子tic或ttt编码,tyr(y)由tac或tat编码,而his(h)由cac或cat编码。trp(w)由单一密码子tgg编码。因此,本领域技术人员将理解,对于编码特定工程化抗体的给定dna序列,将存在许多编码该工程化抗体的dna简并序列。例如,应理解,除了本文提供的工程化抗体的dna序列之外,还将存在许多编码本文公开的工程化抗体的简并dna序列。这些简并dna序列被认为在本公开文本的范围内。因此,在本公开文本的情况下,“其简并变体”是指编码特定工程化抗体并由此使得能表达所述特定工程化抗体的所有dna序列。
[0147]
不管是通过定点诱变、化学合成还是其他方法制备,编码主题工程化抗体的dna序列都还可以包括编码信号序列的dna序列。这种信号序列如果存在,应该是由被选择用于表
达工程化抗体的细胞所识别的信号序列。它可以是原核的、真核的或这两者的组合。通常,信号序列的包含取决于是否需要从其中产生如本文所公开的工程化抗体的重组细胞分泌所述工程化抗体。如果所选择的细胞是原核的,则dna序列通常不编码信号序列。如果所选择的细胞是真核的,则通常包含信号序列。
[0148]
所提供的核酸分子可以含有天然存在的序列,或与天然存在的那些序列不同,但是由于遗传密码的简并性而编码相同多肽(例如抗体)的序列。这些核酸分子可以由rna或dna(例如,基因组dna、cdna,或合成dna(例如通过基于亚磷酰胺的合成产生的dna))或这些类型的核酸内的核苷酸的组合或修饰组成。此外,核酸分子可以是双链或单链的(例如,有义或反义链)。
[0149]
核酸分子不限于编码多肽(例如,抗体)的序列;也可以包含位于编码序列(例如,工程化抗体的编码序列)上游或下游的一些或全部非编码序列。分子生物学领域的普通技术人员熟悉分离核酸分子的常规程序。它们可以例如通过用限制性核酸内切酶处理基因组dna或通过进行聚合酶链式反应(pcr)来产生。在核酸分子是核糖核酸(rna)的情况下,分子可以例如通过体外转录产生。
[0150]
本公开文本的示例性分离的核酸分子可包括并非以天然状态下的原样被发现的片段。因此,本公开文本涵盖重组分子,例如其中将核酸序列(例如,编码本文公开的工程化抗体的序列)并入载体(例如,质粒或病毒载体)中或并入异源细胞的基因组(或同源细胞的基因组,在天然染色体部位以外的位置并入)中的重组分子。药物组合物
[0151]
在一些实施方案中,本公开文本的工程化抗体、核酸和/或重组细胞可并入组合物(包括药物组合物)中。此类组合物通常包括本公开文本的工程化抗体、核酸和/或重组细胞以及药学上可接受的载体。如本文所用,术语“药学上可接受的载体”包括但不限于与药物施用相容的盐水、溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂等。也可以将补充性活性化合物(例如,抗癌剂)并入组合物中。
[0152]
适于注射使用的药物组合物包括无菌水溶液(水溶性的)或分散液,以及用于临时制备无菌可注射溶液或分散液的无菌粉末。对于静脉内施用,合适的载体包括生理盐水、抑菌水、cremophor el
tm
.(basf,新泽西州帕西帕尼)或磷酸盐缓冲盐水(pbs)。在所有情况下,组合物应当是无菌的并且应当是易于注射的程度的流体。其在制造和储存条件下应当稳定并且必须抵抗微生物(如细菌和真菌)的污染作用而保存。所述载体可以是溶剂或分散介质,所述溶剂或分散介质含有例如水、乙醇、多元醇(例如,甘油、丙二醇和液体聚乙二醇等)及其合适的混合物。例如,可以通过使用包衣如卵磷脂、通过在分散液的情况下维持所需的粒度、以及通过使用表面活性剂(例如,十二烷基硫酸钠),维持适当的流动性。防止微生物的作用可以通过各种抗细菌剂和抗真菌剂(例如,对羟基苯甲酸酯、氯丁醇、苯酚、抗坏血酸、硫柳汞等)来实现。在许多情况下,所述组合物中包含一种或多种等渗剂,例如糖、多元醇如甘露醇、山梨醇、氯化钠。通过在所述组合物中包含延迟吸收的药剂例如单硬脂酸铝和明胶,可以实现可注射组合物的延长吸收。
[0153]
无菌可注射溶液可以通过以下方式制备:将活性化合物以所需量并入视需要具有上文所列举成分中的一种或组合的适当溶剂中,之后过滤灭菌。通常,分散液是通过将活性化合物并入无菌媒介物中来制备,所述无菌媒介物含有基础分散介质和来自以上列举的那
些的所需其他成分。在用于制备无菌可注射溶液的无菌粉末的情况下,示例性制备方法为真空干燥和冷冻干燥,所述真空干燥和冷冻干燥由先前无菌过滤的溶液产生活性成分和任何另外的所需成分的粉末。
[0154]
口服组合物(如果使用的话)通常包含惰性稀释剂或可食用的载体。出于口服治疗剂施用的目的,可以将活性化合物(例如,本公开文本的工程化抗体和/或核酸分子)与赋形剂一起并入,并以片剂、锭剂或胶囊(例如,明胶胶囊)的形式使用。也可以使用流体载体制备口服组合物以用作漱口水。可以包含药学上相容的结合剂和/或佐剂材料作为所述组合物的一部分。片剂、丸剂、胶囊、锭剂等可以含有任何以下成分或具有类似性质的化合物:粘合剂,如微晶纤维素、黄芪胶或明胶;赋形剂,如淀粉或乳糖,崩解剂,如藻酸、primogel
tm
或玉米淀粉;润滑剂,如硬脂酸镁或sterotes
tm
;助流剂,如胶体二氧化硅;甜味剂,如蔗糖或糖精;或调味剂,如薄荷、水杨酸甲酯或橙味剂。
[0155]
在通过吸入施用的情况下,从加压容器或分配器(其含有合适的推进剂,例如气体(如二氧化碳))或者喷雾器以气溶胶喷雾剂形式递送本公开文本的主题工程化抗体。此类方法包括在美国专利号6,468,798中描述的那些。
[0156]
本公开文本的主题工程化抗体的全身施用也可以通过经粘膜或透皮方式进行。对于经粘膜或透皮施用,在所述配制品中使用适于待渗透屏障的渗透剂。此类渗透剂在本领域通常是已知的,并且例如就经粘膜施用而言,包括洗涤剂、胆盐和梭链孢酸衍生物。经粘膜施用可以通过使用鼻喷雾剂或栓剂来完成。对于经皮施用,将活性化合物配制成如本领域通常已知的软膏、药膏、凝胶或乳膏。
[0157]
在一些实施方案中,本公开文本的工程化抗体也可以以栓剂(例如,使用常规栓剂基质,如可可脂和其他甘油酯)或保留灌肠剂的形式来制备以供直肠递送。
[0158]
在一些实施方案中,本公开文本的工程化抗体也可以通过转染或感染使用本领域已知的方法来施用,所述方法包括但不限于以下文献中描述的方法:mccaffrey等人(nature 418:6893,2002)、xia等人(nature biotechnol.20:1006
‑
1010,2002)或putnam(am.j.health syst.pharm.53:151
‑
160,1996,在am.j.health syst.pharm.53:325,1996处有勘误)。
[0159]
在一些实施方案中,本公开文本的主题工程化抗体是用保护所述工程化抗体免于从身体迅速消除的载体制备的,如控制释放配制品,包括植入物和微囊化递送系统。可以使用可生物降解的生物相容性聚合物,如乙烯乙酸乙烯酯、聚酸酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸。此类配制品可以使用标准技术来制备。所述材料也可以从alza corporation和nova pharmaceuticals,inc.商购获得。脂质体悬浮液(包括用针对病毒抗原的单克隆抗体靶向感染细胞的脂质体)也可用作药学上可接受的载体。这些可以根据本领域技术人员已知的方法来制备,例如如在美国专利号4,522,811中所述。
[0160]
在一些实施方案中,本公开文本的工程化抗体可以被进一步修饰以延长其体内和/或离体半衰期。适合于修饰本公开文本的工程化抗体的已知策略和方法的非限制性例子包括(1)用高度可溶的大分子如聚乙二醇(“peg”)对本文所述的工程化抗体进行化学修饰,从而防止所述工程化抗体与蛋白酶接触;和(2)将本文所述的工程化抗体与稳定的蛋白质(例如像白蛋白)共价连接或缀合。因此,在一些实施方案中,本公开文本的工程化抗体可以与稳定的蛋白质(如白蛋白)融合。例如,已知人白蛋白是用于增强与之融合的多肽的稳
定性的最有效的蛋白之一,并且已经报道了许多此类融合蛋白。
[0161]
在一些实施方案中,将本公开文本的工程化抗体用一个或多个聚乙二醇部分进行化学修饰,例如,peg化;或用类似的修饰进行修饰,例如pas化。在一些实施方案中,peg分子或pas分子缀合至干扰素的一个或多个氨基酸侧链。在一些实施方案中,peg化或pas化的抗体仅在一个氨基酸上含有peg或pas部分。在其他实施方案中,peg化或pas化的抗体在两个或更多个氨基酸上含有peg或pas部分,例如所述peg或pas部分附接至两个或更多个、五个或更多个、十个或更多个、十五个或更多个、或二十个或更多个不同的氨基酸残基。在一些实施方案中,peg或pas链为2000da、大于2000da、5000da、大于5,000da、10,000da、大于10,000da、大于10,000da、20,000da、大于20,000da和30,000da。所述工程化抗体可以通过氨基、巯基、羟基或羧基直接偶联至peg或pas(例如,不用连接基团)。
[0162]
在一些实施方案中,本公开文本的药物组合物包含一种或多种聚乙二醇化试剂。如本文所用,术语“peg化”意指并且是指通过将聚乙二醇(peg)共价附接至蛋白质来修饰蛋白质,而“peg化”是指附接有peg的蛋白质。可以使用多种化学物质将大小在从约10,000道尔顿至约40,000道尔顿的任选范围内的一系列peg或peg衍生物附接至本公开文本的工程化抗体。在一些实施方案中,所述聚乙二醇化试剂选自甲氧基聚乙二醇
‑
琥珀酰亚胺丙酸酯(mpeg
‑
spa)、mpeg
‑
琥珀酰亚胺丁酸酯(mpeg
‑
sba)、mpeg
‑
琥珀酰亚胺琥珀酸酯(mpeg
‑
ss)、mpeg
‑
琥珀酰亚胺碳酸酯(mpeg
‑
sc)、mpeg
‑
琥珀酰亚胺戊二酸酯(mpeg
‑
sg)、mpeg
‑
n
‑
羟基
‑
琥珀酰亚胺(mpeg
‑
nhs)、mpeg
‑
三氟乙基磺酸酯(mpeg
‑
tresylate)和mpeg
‑
醛。在一些实施方案中,所述聚乙二醇化试剂是甲氧基聚乙二醇
‑
琥珀酰亚胺丙酸酯;例如所述聚乙二醇化试剂是平均分子量为5,000道尔顿的甲氧基聚乙二醇
‑
琥珀酰亚胺丙酸酯5000。本公开文本的方法用于调节细胞内化和调节细胞类型选择性信号传导的方法
[0163]
在本公开文本的各个方面,如本文所公开的工程化抗体及其功能片段、编码此类工程化抗体的核酸和/或含有它们的药物组合物可以用于调节细胞表面分子的细胞内化。术语“调节”是指减少、降低、抑制、增加、诱导、激活或以其他方式影响细胞表面分子的细胞内化。
[0164]
在一方面,本公开文本的一些实施方案涉及一种用于调节细胞内化的方法,所述方法包括向细胞施用以下中的一种或多种:(a)如本文所公开的工程化抗体或其功能片段;(b)如本文所公开的核酸分子;和(c)如本文所公开的药物组合物。
[0165]
在一方面,本公开文本的一些实施方案涉及一种用于调节细胞内化的方法,所述方法包括向细胞施用包含以下项的工程化抗体或其功能片段:(a)能够与具有第一细胞内化速率的细胞表面引导物抗原结合的第一抗原结合部分;和(b)能够与具有第二细胞内化速率的细胞表面效应物抗原结合的第二抗原结合部分,其中所述工程化抗体或其功能片段的内化特性是由所述引导物抗原与所述效应物抗原的相对表面密度比率决定的,并且其中所述两个细胞内化速率中的一个比另一个速率大至少50%、至少70%、至少80%或至少90%。
[0166]
在又另一方面,如以下更详细讨论的,本公开文本的一些实施方案涉及使用如本文所公开的工程化抗体或其缀合物治疗受试者中的健康病症或疾病(例如癌症)的方法。
[0167]
根据本文公开的方法,通过将对这种缓慢内化抗原具有特异性的抗原结合部分与
对快速内化抗原具有特异性的另一抗原结合部分可操作地连接,可以诱导缓慢内化抗原的快速内化。在一些实施方案中,通过将对这种快速内化抗原具有特异性的抗原结合部分与对缓慢内化抗原具有特异性的另一抗原结合部分可操作地连接,可以诱导快速内化抗原的缓慢内化。在本文所述方法的一些实施方案中,所述工程化抗体的内化特性是从内化转化为非内化。在一些实施方案中,引导物抗原和/或效应物抗原的内化特性是从内化转化为非内化。在一些实施方案中,通过使用如本文所公开的工程化抗体将内化抗原(例如,引导物抗原或效应物抗原)的内化特性从内化转化为非内化,所述工程化抗体包含对这种内化抗原具有特异性的抗原结合部分,所述抗原结合部分与对非内化抗原具有特异性的另一抗原结合部分可操作地连接。例如,在所公开的方法的一些实施方案中,通过使用如本文所公开的工程化抗体将内化引导物抗原的内化特性从内化转化为非内化,所述工程化抗体包含对内化引导物抗原具有特异性的抗原结合部分,所述抗原结合部分与对非内化效应物抗原具有特异性的另一抗原结合部分可操作地连接。在一些实施方案中,通过使用如本文所公开的工程化抗体将内化效应物抗原的内化特性从内化转化为非内化,所述工程化抗体包含对内化效应物抗原具有特异性的抗原结合部分,所述抗原结合部分与对非内化引导物抗原具有特异性的另一抗原结合部分可操作地连接。在所公开的方法的一些实施方案中,所述工程化抗体的内化特性是从非内化转化为内化。在一些实施方案中,非内化抗原(例如,引导物抗原或效应物抗原)的内化特性是从非内化转化为内化。在一些其他实施方案中,通过使用如本文所公开的工程化抗体,将非内化引导物抗原的内化特性从非内化转化为内化,所述工程化抗体包含对这种非内化引导物抗原具有特异性的抗原结合部分,所述抗原结合部分与对内化效应物抗原具有特异性的另一抗原结合部分可操作地连接。在一些其他实施方案中,通过使用如本文所公开的工程化抗体,将非内化效应物抗原的内化特性从非内化转化为内化,所述工程化抗体包含对这种非内化效应物抗原具有特异性的抗原结合部分,所述抗原结合部分与对内化引导物抗原具有特异性的另一抗原结合部分可操作地连接。
[0168]
在一些实施方案中,引导物抗原的细胞内化速率大于效应物抗原的细胞内化速率,在这种情况下,引导物抗原是快速内化抗原并且效应物抗原是缓慢内化抗原。在一些实施方案中,引导物抗原的细胞内化速率比效应物抗原的细胞内化速率大至少约50%。在一些实施方案中,引导物抗原的细胞内化速率比效应物抗原的细胞内化速率大至少约50%、60%、70%、80%或90%。在一些实施方案中,与对照(例如,仅包含缓慢内化抗原的单特异性抗体)相比,通过将对缓慢内化抗原具有特异性的抗原结合部分与对快速内化抗原(例如,引导物抗原)具有特异性的另一抗原结合部分可操作地连接,本公开文本的工程化抗体将缓慢内化抗原(例如效应物抗原)的内化速率提高了至少10%、20%、30%、40%、50%、60%、70%、80%、90%、99%或99.9%。在一些实施方案中,与对照(例如,仅包含快速内化抗原的单特异性抗体)相比,通过将对快速内化抗原具有特异性的抗原结合部分与对缓慢内化抗原(例如,效应物抗原)具有特异性的另一抗原结合部分可操作地连接,本公开文本的工程化抗体将快速内化抗原(例如引导物抗原)的内化速率降低了至少10%、20%、30%、40%、50%、60%、70%、80%、90%、99%或99.9%。
[0169]
在一些实施方案中,效应物抗原的细胞内化速率大于引导物抗原的细胞内化速率,在这种情况下,效应物抗原是快速内化抗原并且引导物抗原是缓慢内化抗原。在一些实施方案中,效应物抗原的细胞内化速率比引导物抗原的细胞内化速率大至少约50%。在一
些实施方案中,效应物抗原的细胞内化速率比引导物抗原的细胞内化速率大至少约50%、60%、70%、80%或90%。在一些实施方案中,与对照(例如,仅包含缓慢内化抗原的单特异性抗体)相比,通过将对缓慢内化抗原具有特异性的抗原结合部分与对快速内化抗原(例如,效应物抗原)具有特异性的另一抗原结合部分可操作地连接,本公开文本的工程化抗体将缓慢内化抗原(例如引导物抗原)的内化速率提高了至少10%、20%、30%、40%、50%、60%、70%、80%、90%、99%或99.9%。在一些实施方案中,与对照(例如,仅包含快速内化抗原的单特异性抗体)相比,通过将对快速内化抗原具有特异性的抗原结合部分与对缓慢内化抗原(例如,引导物抗原)具有特异性的另一抗原结合部分可操作地连接,本公开文本的工程化抗体将快速内化抗原(例如效应物抗原)的内化速率降低了至少10%、20%、30%、40%、50%、60%、70%、80%、90%、99%或99.9%。
[0170]
在一些实施方案中,所述细胞表面引导物抗原是内化细胞表面抗原。在一些实施方案中,所述细胞表面效应物抗原是非内化细胞表面抗原。在一些实施方案中,所述引导物抗原与所述效应物抗原的相对表面密度比率大于阈值。在一些实施方案中,所述阈值为约1:1、约1:2、约1:3、约1:4、约1:5、约1:10、约1:20或约1:30。因此,在一些实施方案中,所述引导物抗原与所述效应物抗原的相对表面密度比率大于约1:1、约1:2、约1:3、约1:4、约1:5、约1:10、约1:20或约1:30。在一些特定实施方案中,所述引导物抗原与效应物抗原的相对表面密度比率大于约1:5。在一些实施方案中,所述引导物抗原与所述效应物抗原的相对表面密度比率低于阈值。在一些实施方案中,所述阈值为约1:1、约1:2、约1:3、约1:4、约1:5、约1:10、约1:20或约1:30。因此,在一些实施方案中,所述引导物抗原与所述效应物抗原的相对表面密度比率低于约1:1、约1:2、约1:3、约1:4、约1:5、约1:10、约1:20或约1:30。在一些特定实施方案中,所述引导物抗原与所述效应物抗原的相对表面密度比率低于约1:5。
[0171]
在一些其他实施方案中,所述效应物抗原与所述引导物抗原的相对表面密度比率大于阈值。在一些实施方案中,所述阈值为约1:1、约1:2、约1:3、约1:4、约1:5、约1:10、约1:20或约1:30。因此,在一些实施方案中,所述效应物抗原与所述引导物抗原的相对表面密度比率大于约1:1、约1:2、约1:3、约1:4、约1:5、约1:10、约1:20或约1:30。
[0172]
在一些实施方案中,本公开文本的方法还包括调节所述引导物抗原的细胞表面密度和/或所述效应物抗原的细胞表面密度。本领域技术人员将容易理解,通过使用本领域已知的用于调节靶基因或靶蛋白的表达和/或功能的技术,可以调节引导物与效应物比率。此类技术的非限制性例子包括基因抑制,小rna干扰,部分基因敲除,具有改变细胞代谢、增殖、迁移、死亡、衰老、分化和免疫调节的信号传导功能的小分子或蛋白质/肽。
[0173]
在又另一方面,本公开文本的一些实施方案涉及一种用于调节受试者中的细胞类型选择性信号传导的方法,所述方法包括向细胞施用包含以下项的工程化抗体或其功能片段:(a)能够与细胞表面引导物抗原结合的第一抗原结合部分,其中所述引导物抗原在所述受试者中以细胞类型选择性方式表达并且具有第一细胞内化速率;和(b)能够与细胞表面效应物抗原结合的第二抗原结合部分,其中所述工程化抗体或其功能片段的内化特性是由所述引导物抗原与所述效应物抗原的相对表面密度比率决定的,并且其中所述两个细胞内化速率中的一个比另一个速率大至少50%、至少70%、至少80%或至少90%。在一些实施方案中,本文所述的工程化抗体调节信号传导途径,其可以是这种信号传导途径的上调或下调。在一些实施方案中,本公开文本的工程化抗体可以充当激动剂并上调(增强、刺激、促
进、激活或增加)目标信号传导途径,即靶途径。在一些实施方案中,与对照(例如,无抗体或单特异性抗体)相比,本文所述的工程化抗体使靶途径的活性增加至少10%、20%、30%、40%、50%、60%、70%、80%、90%、99%或99.9%。在一些其他实施方案中,靶信号传导途径的上调包括开启或启动关闭的或基本上无活性的途径。在另一个例子中,本文所述的工程化抗体可以充当拮抗剂并下调(压制、抑制、减少、降低或消减)靶途径。在一些实施方案中,与对照(例如,无抗体或单特异性抗体)相比,本文公开的工程化抗体使靶途径的活性减少至少10%、20%、30%、40%、50%、60%、70%、80%、90%、99%或99.9%。在一些实施方案中,靶信号传导途径的下调包括关闭或基本上阻断开启的或基本上有活性的途径。治疗方法
[0174]
如上所述,本文呈现的实验结果证明,本文公开的引导物
‑
效应物双特异性抗体设计可以用于开发用于操纵细胞表面抗原的内化特性的新工具。特别地,本文呈现的实验结果阐明了给定细胞表面抗原的内化倾向可以被其一种或多种相邻抗原显著地影响,并且可以通过适当选择的引导物/效应物对的基于双特异性物的靶向而容易地操纵为任一方向,并且这种现象可以用于治疗剂靶向。
[0175]
本公开文本的一些实施方案涉及使用如本文所公开的工程化抗体或其缀合物治疗受试者中的健康病症或疾病(例如癌症)的方法。在一些实施方案中,所述方法包括向有需要的受试者单独(例如,作为单一疗法)或与一种或多种另外的药剂(例如药学上可接受的赋形剂)组合(例如,作为组合疗法)施用治疗有效量的本文公开的工程化抗体、其缀合物或包含它们的药物组合物。在某些方面,施用至受试者的工程化抗体或药物组合物特异性地靶向细胞,其中信号传导途径由于治疗而被调节。
[0176]
在一方面,本公开文本的一些实施方案涉及一种用于治疗有需要的受试者中的健康病症或疾病的方法,所述方法包括向所述受试者施用治疗有效量的包含以下项的工程化抗体或其功能片段:(a)能够与具有第一细胞内化速率的细胞表面引导物抗原结合的第一抗原结合部分;和(b)能够与具有第二细胞内化速率的细胞表面效应物抗原结合的第二抗原结合部分,其中所述工程化抗体或其功能片段的内化特性是由所述引导物抗原与所述效应物抗原的相对表面密度比率决定的,并且其中所述两个细胞内化速率中的一个比另一个速率大至少50%、至少70%、至少80%或至少90%。
[0177]
在另一方面,本公开文本的一些实施方案涉及一种用于杀伤癌细胞的方法,所述方法包括向所述细胞施用如本文所公开的工程化抗体或其功能片段。在一些实施方案中,所述工程化抗体或其功能片段包含:(a)能够与具有第一细胞内化速率的细胞表面引导物抗原结合的第一抗原结合部分;和(b)能够与具有第二细胞内化速率的细胞表面效应物抗原结合的第二抗原结合部分。
[0178]
在又另一方面,本公开文本的一些实施方案涉及一种用于杀伤肿瘤细胞的方法,所述方法包括向所述肿瘤细胞施用如本文所公开的工程化抗体或其功能片段。在所公开的方法的一些实施方案中,所述工程化抗体或其功能片段包含能够与在所述肿瘤细胞的表面上表达的肝配蛋白受体a2(epha2)结合的第一抗原结合部分;和能够与在同一肿瘤细胞的表面上表达的alcam结合的第二抗原结合部分。在一些实施方案中,epha2与alcam的表面密度比率大于约1:5的阈值。
[0179]
如本文所用,术语“施用(administration和administering)”是指通过如下施用
途径递送生物活性组合物或配制品:包括但不限于口服、静脉内、动脉内、肌内、腹膜内、皮下、肌内和局部施用或其组合。所述术语包括但不限于由医学专业人员进行的施用和自我施用。
[0180]
治疗的功效可以由熟练的临床医生来确定。然而,本领域技术人员将理解,如果疾病的任何一种或全部体征或症状或标记物得到改善或改进,则治疗被认为是有效的。还可以通过如由减少住院治疗或对医疗干预的需要(例如,疾病进展停止或至少减缓)所评估的个体恶化的失败来测量疗效。测量这些指示物的方法是本领域技术人员已知的和/或在本文中描述。治疗包括对个体或动物的疾病的任何治疗(一些非限制性例子包括人或哺乳动物)并且包括:(1)抑制疾病,例如,停止或减缓症状的进展;或(2)缓解疾病,例如,导致症状消退;(3)预防或减少症状发展的可能性。
[0181]
如上文所讨论的,治疗有效量的如本文所公开的组合物包括当施用于个体时足以促进特定有益效果的量,所述个体是例如患有、怀疑患有或有风险患上疾病的个体。在一些实施方案中,有效量包括足以预防或延迟疾病的症状的发展、改变疾病的症状的进程(例如但不限于,减缓疾病的症状的进展)或逆转疾病的症状的量。应理解,对于任何给定的病例,本领域普通技术人员使用常规实验可以确定适当的有效量。
[0182]
在一些实施方案中,所述健康病症或疾病是癌症。在一些实施方案中,将如本文所公开的工程化抗体、其缀合物及其功能片段、编码此类工程化抗体的核酸和/或含有它们的药物组合物施用至个体(例如人患者),以例如降低癌细胞的活力和/或浸润,例如以减少肿瘤大小或转移、降低肿瘤负荷、和/或改善患者的临床结果。在某些方面,抗体组合物可以用于破坏癌细胞的细胞周期,并促进细胞进入细胞凋亡,例如通过诱导癌细胞进入go前细胞周期阶段。本文考虑的与癌症有关的方法包括例如使用抗体疗法(单独地或与抗癌疫苗或疗法组合)、以及使用在抗癌疫苗(例如,通过被动免疫)或疗法中使用效应物抗原和/或引导物抗原产生的抗体。所述方法可用于治疗或预防多种多样的癌症的背景下。在一个方面,癌症是指包括原发性癌症和转移性癌症的通用术语。在一些实施方案中,原发性癌症可以意指这样一组肿瘤细胞,其已经获得癌细胞的至少一个特征,但是尚未侵入邻近组织并且在位于原发性起源位置的肿瘤中保持在一起。在一些其他实施方案中,转移性癌症可以意指这样一组肿瘤细胞,其源自原发性癌症的细胞,其已经侵入所述原发性癌症周围的组织、通过身体传播、粘附在新的远的位置并长成新的肿瘤。癌症的例子包括但不限于胰腺癌、结肠癌、卵巢癌、前列腺癌、肺癌、间皮瘤、乳腺癌、尿路上皮癌、肝癌、头颈癌、肉瘤、宫颈癌、胃癌、胃部癌症、黑色素瘤、葡萄膜黑色素瘤、胆管癌、多发性骨髓瘤、白血病、淋巴瘤和胶质母细胞瘤。
[0183]
在一些实施方案中,如本文所公开的工程化抗体、其缀合物及其功能片段、编码此类工程化抗体的核酸和/或含有它们的药物组合物用于抗癌疗法中,其中癌细胞呈递细胞特异性标记物,所述细胞特异性标记物可以在细胞外可接近的细胞表面上充当本公开文本的双特异性抗体的引导物抗原。特别适合使用本公开文本的双特异性抗体治疗的癌症包括通过与引导物抗原结合而被抗体靶向的那些。在一些实施方案中,与过表达引导物抗原的癌细胞相比,这种引导物抗原在正常人组织或细胞中的存在或表达水平可以是瞬时且低丰度的。引导物抗原可能主要存在于异常细胞(如癌细胞)中。由于高水平的引导物抗原的表达可能主要存在于癌细胞中,因此用本公开文本的双特异性抗体或包含所述抗体的组合物
治疗可以用于以高特异性或选择性治疗癌细胞,最小化对非癌细胞或健康细胞的非特异性细胞毒性。
[0184]
在一些实施方案中,治疗方式是使用本公开文本的工程化抗体调节信号传导途径。信号传导途径的调节异常通常与疾病或病症的发生和/或进展相关,因为这种信号传导途径的调节可以导致疾病或病症的有效治疗。在一些例子中,疾病或病症可能与一种或多种信号传导途径的调节异常有关,并且这种调节异常可以通过调节另一种信号传导途径来改善或消减。在这种情况下,使用可以抵消或降低调节异常的信号传导途径的活性的本公开文本的工程化抗体对信号传导途径的上调或下调可以提供有效的治疗手段。
[0185]
在一些实施方案中,使用本公开文本的工程化抗体或包含所述抗体的组合物进行处理的细胞不限于癌细胞,而是涵盖可能需要细胞内化和信号传导调节的任何细胞。此类细胞包括但不限于免疫效应细胞,如一个或多个自然杀伤细胞、一个或多个t细胞、一个或多个树突细胞和一个或多个巨噬细胞。剂量
[0186]
可以在细胞培养物或实验动物中通过用于例如测定ld50(对50%群体致死的剂量)和ed50(在50%的群体中治疗有效的剂量)的标准药学程序来确定本公开文本的工程化抗体的剂量、毒性和治疗功效。在毒性与治疗效果之间的剂量比率是治疗指数,并且其可以表示为比率ld50/ed50。例如,展现出高治疗指数的化合物通常是合适的。虽然可以使用展现出毒副作用的化合物,然而,应小心设计使此类化合物靶向受影响组织的部位的递送系统,以便使对未感染细胞的潜在损害最小化,并由此降低副作用。
[0187]
在本公开文本的方法中,将有效量的本公开文本的工程化抗体或包含所述抗体的组合物施用至有需要的个体。例如,在一些实施方案中,当以有效量施用所述工程化抗体或其组合物时,所述抗体抑制个体中一个或多个癌细胞的生长、转移和/或浸润。所施用的量根据施用的目标、待治疗个体的健康和身体状况、年龄、待治疗个体的分类群(例如,人、非人灵长类动物、灵长类动物等)、所需的分辨度、工程化抗体或组合物的配方、治疗临床医师对医疗状况的评估以及其他相关因素而变化。预期所述量将落入可以通过常规试验确定的相对宽的范围内。例如,用于抑制癌细胞生长、转移和/或浸润的工程化抗体或其组合物的量不大于约对受试者可能具有不可逆毒性的量(即,最大耐受剂量)。在其他情况下,所述量大约或甚至远低于毒性阈值,但仍处于免疫有效浓度范围内,或甚至低至阈值剂量。
[0188]
个体剂量通常不小于对个体产生可测量的效果所需的量,并且可以基于抗体吸收、分布、代谢和排泄(“adme”)的药代动力学和药理学来确定,并且因此基于组合物在个体中的处置来确定。这包括考虑施用途径以及剂量,其可以针对例如肠胃外(通过除消化道之外的途径施用以用于产生全身或局部效果)施用进行调整。例如,工程化抗体或其组合物的施用通常通过注射并且经常是静脉内、肌肉内、肿瘤内或其组合。
[0189]
工程化抗体或其组合物可以通过输注或通过局部注射施用,例如通过以约10mg/h至约200mg/h、约50mg/h至约400mg/h(包括约75mg/h至约375mg/h、约100mg/h至约350mg/h、约150mg/h至约350mg/h、约200mg/h至约300mg/h、约225mg/h至约275mg/h)的速率输注。示例性输注速率可以实现例如约0.5mg/m2/天至约10mg/m2/天(包括约1mg/m2/天至约9mg/m2/天、约2mg/m2/天至约8mg/m2/天、约3mg/m2/天至约7mg/m2/天、约4mg/m2/天至约6mg/m2/天、约4.5mg/m2/天至约5.5mg/m2/天)的所需治疗剂量。施用(例如,通过输注)可以在所需时间
段内重复,例如在约1天至约5天的时间段内重复或每隔几天(例如,约5天)重复一次,在约1个月、约2个月内重复等。其也可以在其他治疗性干预(如手术干预)时、之前或之后进行施用以去除癌细胞。工程化抗体或其组合物也可以作为组合疗法的一部分施用,其中向受试者施用免疫疗法、癌症化学疗法或放射疗法中的至少一种。施用途径
[0190]
在本公开文本的一些实施方案中,如本文所公开的工程化抗体、其缀合物及其功能片段、编码此类工程化抗体的核酸和/或含有它们的药物组合物可以被配制成与其预期施用途径相容。例如,如本文所公开的工程化抗体、其缀合物及其功能片段、编码此类工程化抗体的核酸和/或含有它们的药物组合物可以口服或通过吸入给予,但更有可能通过肠胃外途径施用。肠胃外施用途径的例子包括例如静脉内、皮内、皮下、透皮(局部)、经粘膜、和直肠施用。用于肠胃外应用的溶液或悬浮液可包括以下组分:无菌稀释剂,诸如注射用水、盐水溶液、固定油、聚乙二醇、甘油、丙二醇或其他合成溶剂;抗细菌剂,如苯甲醇或对羟基苯甲酸甲酯;抗氧化剂,如抗坏血酸或亚硫酸氢钠;螯合剂,如乙二胺四乙酸(edta);缓冲液,如乙酸盐、柠檬酸盐或磷酸盐,和用于调节张力的药剂(如氯化钠或右旋糖)。可以用酸或碱(如磷酸二氢钠和/或磷酸二钠、盐酸或氢氧化钠)来调节ph(例如,调节至约7.2
‑
7.8,例如7.5的ph)。可以将肠胃外制剂封装在由玻璃或塑料制成的安瓿、一次性注射器或多剂量小瓶中。
[0191]
在实施所述方法时,施用途径(如本文所公开的工程化抗体、其缀合物及其功能片段、编码此类工程化抗体的核酸和/或含有它们的药物组合物被带入个体或受试者的路径)可以变化。工程化抗体或其组合物可以全身施用(例如,通过肠胃外施用,例如通过静脉内途径)或者局部施用(例如,在局部肿瘤部位,例如通过肿瘤内施用(例如,施用至实体瘤中、施用至在淋巴瘤或白血病中累及的淋巴结中)、施用至为实体瘤提供补给的血管等)。
[0192]
在一些实施方案中,本文所述的工程化抗体被配制用于肠胃外施用。在一些情况下,所述工程化抗体被配制用于静脉内、皮下、肌内、动脉内、颅内、脑内、脑室内或鞘内施用。在一些情况下,将工程化抗体作为注射液施用受试者。在其他情况下,将工程化抗体作为输注液施用受试者。
[0193]
适用于肠胃外施用的配制品包括水性和非水性的等渗无菌注射溶液,其可以含有抗氧化剂、缓冲剂、抑菌剂和使配制品与预期接受者的血液等渗的溶质;以及水性和非水性的无菌悬浮液,其可以包含悬浮剂、增溶剂、增稠剂、稳定剂和防腐剂。配制品能以单位剂量或多剂量密封容器(如安瓿和小瓶)呈现,并且可以在冷冻干燥(冻干)条件下储存,仅需要在使用前立即添加无菌液体赋形剂(例如,水)以供注射。临时注射溶液和悬浮液可以由前述种类的无菌粉末、颗粒和片剂制备。
[0194]
如本文所用,术语“单位剂型”是指适合作为人和动物受试者的单位剂量的物理上离散的单位,每个单位含有经计算足以产生所需效果的量的预定量的本公开文本的化合物以及药学上可接受的稀释剂、载体或运载体。新型单位剂型的规格取决于所用的特定化合物和要实现的效果、连同与个体体内每种化合物相关的药效学以及个体的目标疾病或病症及其阶段。系统和试剂盒
[0195]
本文还提供了系统和试剂盒,所述系统和试剂盒包含本文提供和描述的工程化抗
体、重组核酸、重组细胞或药物组合物以及用于制备和使用它们的书面说明书。例如,在一些实施方案中,本文提供了包含以下中的一种或多种的系统和/或试剂盒:如本文所述的工程化抗体、如本文所述的重组核酸分子、如本文所述的重组细胞或如本文所述的药物组合物。在一些实施方案中,本公开文本的系统和/或试剂盒还包含用于向个体施用所提供的工程化抗体、重组核酸、重组细胞或药物组合物的一个或多个注射器(包括预填充注射器)和/或导管(包括预填充注射器)。在一些实施方案中,试剂盒可以具有一种或多种另外的治疗剂,所述一种或多种另外的治疗剂可以与其他试剂盒组分同时或依序施用以用于所需目的,例如用于调节细胞内化、调节受试者中的细胞类型选择性信号传导或治疗有需要的受试者中的疾病。
[0196]
任何上述系统和试剂盒还可以包含一种或多种另外的试剂,其中此类另外的试剂可以选自:稀释缓冲液、重构溶液、洗涤缓冲液、对照试剂、对照表达载体、阴性对照抗体、阳性对照抗体、用于体外产生所述工程化抗体的试剂。
[0197]
在一些实施方案中,系统或试剂盒还可以包含使用所述试剂盒的组分来实践所述方法的说明书。用于实践所述方法的说明书通常记录在合适的记录介质上。例如,所述说明书可以印刷在基材上,如纸或塑料等。所述说明书可以作为包装插入物存在于试剂盒中、试剂盒的容器或其组分的标签中(即,与包装或分包装相关联)等。所述说明书可以作为存在于合适的计算机可读存储介质(例如,cd
‑
rom、软盘、闪存驱动器等)上的电子存储数据文件而存在。在一些情形下,实际说明书不存在于所述试剂盒中,而是可以提供用于从远程源(例如,经由互联网)获得所述说明书的装置。这个实施方案的例子是包括网址的试剂盒,在其中可以查看说明书和/或可以从其下载说明书。与说明书一样,将这种用于获得说明书的手段可以记录在合适的基材上。
[0198]
本公开文本中所提到的所有出版物和专利申请都通过引用并入本文,并入程度如同明确且单独地指示每个单独出版物或专利申请通过引用并入一般。
[0199]
不承认本文引用的任何参考文献构成现有技术。参考文献的讨论陈述其著者的主张,并且发明人保留质疑所引用文献的准确性和相关性的权利。应当清楚地理解,尽管本文中提及许多信息源,包括科学期刊文章、专利文件和教科书;但是该提及并不意味着承认这些文件中的任何文件构成了本领域中公知常识的一部分。
[0200]
本文给出的一般方法的讨论仅旨在用于说明目的。在审阅本公开文本之后,其他替代方法和替代方案对于本领域技术人员而言将是清楚的,并且将被包括在本技术的精神和范围内。实施例
[0201]
在以下实施例中进一步详细公开了另外的实施方案,所述实施例仅以说明方式提供,而并非旨在以任何方式限制本公开文本或权利要求的范围。实施例1高亲和力alcam抗体的鉴定和alcam
×
epha2双特异性抗体的产生
[0202]
为了鉴定针对alcam的人抗体,针对alcam的n末端ig样v1
‑
v2结构域进行了scfv噬菌体展示文库选择(图6a)。鉴定了通过对alcam
高
du145前列腺癌细胞系进行facs筛选得到的一组结合噬菌体(图6b),并且进一步鉴定了如同igg1以高亲和力(表观k
d
=20.6pm)与du145细胞结合的抗体3f1(图6c)。通过共聚焦显微镜检查研究了3f1 igg在一组肿瘤细胞
系上的内化,并且发现该抗体是非内化或缓慢内化的(图6d)。
[0203]
构建了四价双特异性igg
‑
scfv(bsigg),并且其由非内化抗alcam 3f1 igg骨架和与3f1轻链的c末端融合的内化抗epha2 scfv(ryr)组成(图1a)。抗epha2 scfv(ryr)是从先前的研究中鉴定的,在所述研究中使用高含量分析来鉴定大胞吞抗体。对于对照,使用非结合c10 igg构建对照c10/ryr bsigg(仅与epha2结合)。sds
‑
page分析显示了单克隆和双特异性抗体的预期电泳图谱(图7a)。接下来使用表达alcam的hek293细胞系和稳定表达高水平epha2的工程化hek293细胞系(hek293
‑
epha2#2)研究了bsigg的结合特异性。如图7b所示,如预期的那样,抗alcam 3f1 igg与hek293和hek293
‑
epha2#2细胞二者结合。与hek293(alcam
高
epha2
低
)相比,3f1/ryr bsigg以更高的水平与hek293
‑
epha2#2(alcam
高
epha2
高
)结合。仅与epha2结合的对照c10/ryr bsigg显示出与hek293
‑
epha2#2细胞的特异性结合,而不与hek293细胞特异性结合。使用这两个细胞系模型,通过共聚焦显微镜检查研究了3f1/ryr bsigg的内化活性。如图1b所示,3f1/ryr bsigg以epha2依赖性的方式获得了有效的内化能力,其被hek293
‑
epha2#2细胞系内化,而未被hek293细胞系内化。对照c10/ryr bsigg被hek293
‑
epha2#2内化,而未被hek293内化。结果显示,在本文所述的引导物
‑
效应物双特异性物设计中,内化臂(epha2,引导物)可以对非内化臂(alcam,效应物)和作为整体的双特异性物赋予内化特性。实施例2非内化抗原可以被双特异性物在一定时间内并以引导物与效应物比率依赖性的方式变成内化的
[0204]
为了量化研究通过抗体诱导的抗原内化实现的细胞表面抗原去除,进行了定量facs分析以测量细胞表面的alcam和epha2拷贝数(本文称为抗原密度)。如图1c所示,与双特异性3f1/ryr一起孵育的hek293
‑
epha2#2细胞上的alcam水平在孵育的前4小时内减少约90%。用单克隆抗alcam 3f1、对照单克隆c10或对照双特异性c10/ryr处理后,表面alcam水平没有显著变化(图1c)。仅在hek293
‑
epha2#2(alcam
高
epha2
高
)中观察到通过3f1/ryr实现的从细胞表面的有效alcam去除,而在hek293(alcam
高
epha2
低
)中未观察到这样的情况(图8a)。进一步寻求确定抗原去除效率是否受引导物与效应物比率(epha2/alcam)的影响。为了产生具有不同epha2/alcam比率的基于hek293的细胞模型,通过三种方式操纵了epha2和/或alcam水平:1)epha2表达质粒的瞬时转染,2)epha2表达质粒和alcam
‑
sirna的瞬时共转染,和3)用于实现稳定的epha2表达的epha2基因的慢病毒转导。在双特异性3f1/ryr处理后,这些细胞显示出不同的epha2/alcam比率和不同的表面抗原去除模式。例如,单克隆抗alcam 3f1 igg或对照c10/ryr bsigg没有从细胞表面去除alcam,而3f1/ryr bsigg有效地去除了表面alcam(图1d)。通过皮尔逊相关系数分析,效果随着epha2/alcam比率的增加而显著增强(图1d)。关于epha2,抗alcam 3f1 igg如预期那样没有减少表面epha2,但是与epha2结合的3f1/ryr和对照c10/ryr从细胞表面有效地去除了epha2(图8b)。双特异性3f1/ryr去除表面alcam的能力受epha2与alcam的比率(引导物抗原与效应物抗原比率,如图1e中概述)的影响。如表1中总结的,当比率<1:5(0.2)时,仅去除小分数的alcam(20%
‑
35%)。当比率在0.9
‑
3.5之间时,去除45%
‑
65%表面alcam。当比率>3.5时,去除大于70%的表面alcam。实施例3
内化和非内化是双特异性物设计中的可相互转化的特性
[0205]
虽然已经显示,当epha2与alcam比率高于阈值时,可以通过抗epha2/alcam双特异性物诱导非内化抗原(alcam)内化,但该实验研究了在一定epha2与alcam比率下,alcam的存在是否可以使快速内化epha2变成缓慢内化或非内化。使用hek293细胞系(alcam
高
epha2
低
)作为模型,发现当epha2与alcam比率<0.2时,epha2内化极大地受阻,从而导致当被3f1/ryr bsigg而非对照c10/ryr靶向时,更高分数的表面结合的epha2(图1f),表明内化和非内化是可相互转化的特性,并且在被双特异性抗体靶向时,内化与非内化抗原的相对丰度深刻地影响细胞表面抗原翻转(如图1g中概述)。表1:在各种细胞系模型上的抗原密度、引导物与效应物比率和alcam翻转效率的总结。
实施例4扩展到模型细胞系之外:通过基于引导物/效应物的双特异性物调节肿瘤细胞中的内化动力学
[0206]
该实施例显示了在一组具有不同引导物与效应物比率的胰腺癌细胞系中双特异性物诱导的表面抗原动力学。首先通过量化facs测定了alcam和epha2的细胞表面抗原密度(表2)。发现这些细胞高度表达alcam,并且估计对于l3.6pl、capan
‑
1和panc
‑
1,引导物与效应物(epha2与alcam)比率分别为0.31、0.23和0.08。接下来进行了两组实验以确定(1)在epha2与alcam比率高于阈值(>0.2)的情况下,非内化alcam如何被双特异性物转化为内化抗原;以及(2)在epha2与alcam比率低于阈值(<0.2)的情况下,快速内化epha2如何被双特异性物变成缓慢内化。在抗体处理后通过facs测量表面抗原水平,研究了epha2和alcam的内化动力学。关于alcam,双特异性3f1/ryr有效地去除了引导物与效应物比率>0.2的l3.6pl和capan
‑
1细胞中的约60%的细胞表面alcam,但在所述比率为0.08的panc
‑
1细胞中是无效的,这表明了基于引导物与效应物比率的细胞类型选择性(图2a)。
[0207]
非内化单克隆抗alcam抗体3f1未从细胞表面去除任何alcam抗原。对照c10/ryr或3f1和c10/ryr的抗体混合物去除了约85%的表面epha2(图8c),但没有去除alcam(图2a),这表明alcam去除是寡克隆抗体混合物无法实现的双特异性物依赖性现象。还通过共聚焦显微镜检查研究了对抗原内化的上述双特异性作用。如图2b所示,在epha2/alcam比率>0.2(约0.31)的l3.6pl细胞中,抗alcam 3f1主要在细胞表面被检测到,而双特异性3f1/ryr主要在细胞质中被检测到,且细胞膜有一些染色。与epha2结合的对照c10/ryr主要在细胞质中被检测到,这与其诱导快速epha2内化的能力一致。相比之下,对于epha2/alcam比率<0.2(约0.08)的panc
‑
1细胞系,双特异性3f1/ryr主要在细胞表面被检测到(图2b),这再次表明双特异性物的内化取决于epha2/alcam比率。这些数据证实,在本文所述的引导物
‑
效应物双特异性物设计中,双特异性物将非内化效应物抗原转化为内化效应物抗原的能力取决于引导物
‑
效应物比率。表2:所研究的各种细胞系中的抗原密度和epha2/alcam比率的总结。
*
检测到alcam拷贝数与对照igg的一样低。nd:未测定(由于mia paca2上的低/无alcam表达)。
[0208]
为了评估内化和运输至溶酶体的途径,使用l3.6pl细胞进行了共聚焦显微镜检查研究。如图2c所示,双特异性3f1/ryr与大胞吞标记物70kda中性葡聚糖(nd70)共定位,这表明内化模式是大胞吞作用。内化后,3f1/ryr和对照c10/ryr与溶酶体标记物溶酶体相关膜蛋白1(lamp1)共定位(图2d),这表明抗epha2抗体引导的双特异性物运输至溶酶体。
[0209]
为了研究内化与非内化之间相互转化的另一个方向,即快速内化抗体转化为缓慢内化或非内化抗体,研究了在存在相邻非内化抗原alcam的情况下通过双特异性物实现的epha2表面去除。如图2e所示,在epha2与alcam比率<0.2(约0.08)的panc
‑
1细胞上,当被双特异性3f1/ryr靶向时,epha2主要保留在细胞表面。对照c10/ryr从细胞表面去除了epha2。c10/ryr加3f1混合物没有阻碍epha2内化,这表明所述现象取决于双特异性抗体。时间过程内化研究显示,3f1/ryr极大地阻碍了epha2内化动力学,而对照c10/ryr诱导了快速epha2内化(图2f)。这些研究证明,当alcam存在于同一细胞上且量超过epha2/alcam比率的阈值时,双特异性物可以显著阻碍epha2内化。实施例5双特异性3f1/ryr抑制胰腺肿瘤球的形成
[0210]
研究了抗epha2引导的bsigg(3f1/ryr)对胰腺肿瘤球的存活和扩大的影响,以评估表面抗原去除的功能后果。先前的研究显示,过表达alcam的癌细胞侵略性地形成肿瘤球,这表明alcam在肿瘤克隆形成中起作用。因此,在该实施例中,进行了实验以研究通过四价alcam
×
epha2bsigg实现的alcam去除是否可以抑制胰腺肿瘤球的形成。首先,在l3.6pl肿瘤球中评估了抗原表达,并且发现alcam在形成球的肿瘤细胞的表面上显著上调(图3a)。在单层相比于球状态下,l3.6pl细胞之间的epha2表面水平没有差异(图3a)。在l3.6pl肿瘤球与抗体一起孵育2周后,双特异性3f1/ryr使alcam表面密度降低70%,而仅与epha2结合的抗alcam mab3f1或对照c10/ryr对alcam表面水平没有影响(图3b)。接下来进行了共聚焦显微镜检查研究以确认抗体内化。如图3c所示,3f1/ryr在l3.6pl球形成细胞中被有效内化。相比之下,单克隆抗alcam抗体3f1主要显示出表面染色(图3c)。对照双特异性c10/ryr被内化,这与其与epha2的单特异性结合一致(图3c)。值得注意的是,基于每个细胞的荧光信号强度,与对照双特异性c10/ryr相比,肿瘤球形成细胞吸收了更大量的3f1/ryr(图3c,右侧小图),这表明了双特异性抗体所独有的扩大作用。关于对肿瘤克隆形成活性的功能作用,发现通过用3f1/ryr而非3f1或c10/ryr处理显著降低了l3.6pl球数量(图3d)和大小(图3e),这与先前关于alcam在肿瘤球形成和生长中的作用的研究一致。因此,其中一个臂与内化抗原epha2结合的双特异性抗体可以有效地从肿瘤细胞表面去除非内化抗原alcam,从而抑制胰腺肿瘤球的生长。实施例6通过双特异性adc实现的有效且具细胞类型选择性的体外肿瘤细胞杀伤
[0211]
为了探索双特异性物诱导的细胞内摄取扩大的治疗潜力,通过mc
‑
vc
‑
pab
‑
mmaf的位点特异性缀合产生了许多单特异性和双特异性adc,通过hic
‑
hplc分析了缀合产物,并确定了药物与抗体比率(约1.9)。在这些实验中,在一组展示不同水平的细胞表面epha2和alcam以及epha2与alcam比率的癌细胞系(参见例如表2)上测试了adc。3f1/ryr adc显示出
有效的细胞毒性,其中ec50对于l3.6pl为23pm且对于capan
‑
1细胞为22pm(图4a和图4b,以及表3)。这两种细胞系的epha2与alcam比率高于阈值(0.2,表2),从而导致更有效的内化。相比之下,3f1和c10/ryr adc二者均显示出较低的效力。3f1和c10/ryr adc对于l3.6pl的ec50值分别为2.37nm和0.35nm,并且对于capan
‑
1分别为0.87nm和0.18nm(图4a和图4b)。最值得注意的是,双特异性adc比单克隆adc的混合物(c10/ryr adc 3f1 adc,图4a和图4b)更有效,这再次表明这种增强的效力是双特异性抗体所独有的。还研究了adc对具有低引导物与效应物(epha2与alcam)比率的panc
‑
1细胞和没有效应物抗原(alcam)表达的mia paca2细胞的细胞毒性。在具有低epha2/alcam比率(0.08)的panc
‑
1细胞上,双特异性3f1/ryr adc显示出降低的效力(ec50=0.46nm),但仍然比3f1(ec50=9.3nm)和c10/ryr adc(ec50>100nm)更有效(图4c和表3)。同样,3f1/ryr adc的细胞毒性效力高于3f1和c10/ryr adc的混合物(ec50=0.46nm相比于对于所述混合物为7.14nm)(表3)。在alcam阴性mia paca2细胞系上,3f1 adc如预期那样几乎不显示细胞毒性(图4d)。3f1/ryr和c10/ryr adc由于缺乏alcam的表达和epha2的低表达水平而显示出类似的低细胞毒性(图4d)。为了进一步评价细胞类型选择性,研究了表达极低水平epha2的lncap
‑
c4
‑
2b和hek293细胞系。如图4e所示,在lncap
‑
c4
‑
2b上,由于缺乏引导物抗原epha2表达,双特异性3f1/ryr adc相比于单克隆3f1 adc没有显示出增强的细胞毒性(ec50=1.25nm相比于1.64nm,表3),这表明了引导物抗原依赖性细胞类型选择性。从使用缺乏引导物抗原表达的hek293细胞的研究中获得了类似的结果(图9)。总之,这些数据显示,双特异性adc比单特异性adc或它们的混合物更有效,并且取决于引导物抗原与效应物抗原比率,展现出细胞类型选择性效力增强。表3:adc或adc混合物对于具有不同epha2/alcam比率的肿瘤细胞系的体外效力。实施例7alcam
×
epha2双特异性adc的体内抗肿瘤功效
[0212]
该实施例总结了用于研究双特异性3f1/ryr adc以及对照adc对胰腺癌异种移植物的体内功效而进行的实验。将capan
‑
1细胞皮下植入nsg小鼠中。当肿瘤达到110mm3的平均体积时,每四天以3mg/kg注射3f1/ryr、3f1或c10/ryr adc,共四次。通过卡尺测量来监测肿瘤状态。通过体重减轻来监测明显的毒性。如图5a所示,双特异性3f1/ryr adc显著抑制肿瘤生长,而单克隆3f1 adc或对照双特异性c10/ryr adc对肿瘤大小减小仅具有温和作用。在研究过程中,对于所研究的任何adc,体重都没有显著变化(图5b)。这些数据证明,在本文所述的引导物
‑
效应物双特异性物设计中,快速内化抗引导物(epha2)scfv可以诱导原本非内化效应物抗原(alcam)的内化,从而导致与单特异性adc相比,更大量的双特异性adc被吸收至肿瘤细胞中,从而显示出增强的体内抗肿瘤功效。
实施例8细胞系和质粒
[0213]
人胚肾(hek)系hek293和hek293a;前列腺癌细胞系du145和pc3;以及胰腺癌细胞系capan
‑
1、panc
‑
1和mia paca2是从美国典型培养物保藏中心(american type culture collection,atcc)获得的。l3.6pl系是从isaiah fidler博士(md安德森癌症中心(md anderson cancer center),德克萨斯州休斯顿)获得的。lncap
‑
c4
‑
2b最初是从urocor inc.获得的,并在实验室中维持。将细胞在37℃、5%co2下维持在补充有10%fbs(fisher scientific)、100μg/ml青霉素/链霉素(axenia biologix)的dmem或rpmi1640中。克隆至pcmv
‑
entry(origene)或plv202(origene)中的全长人epha2cdna分别用于epha2的瞬时或稳定表达。实施例9抗alcam scfv抗体的产生
[0214]
初始()scfv
‑
噬菌体展示文库用于抗体选择。从hek293a细胞产生了与人igg2 fc融合的alcam的重组人igg样v1
‑
v2结构域(a
‑
v
‑
fc),并将其用作抗原。将a
‑
v
‑
fc包被在sphero
tm
聚苯乙烯磁性颗粒(spherotech)上在4℃下过夜。在pbs/2%乳中用未包被的珠粒耗尽噬菌体文库,并且使未结合的噬菌体与a
‑
v
‑
fc包被的珠粒结合。然后如先前所述洗涤、洗脱和繁殖珠粒。使用表达alcam的du145细胞系通过facs筛选了单独噬菌体结合物,并通过igat工具分析了scfv的dna序列。实施例10抗epha2 scfv的产生
[0215]
该实施例描述了用于鉴定具有改善的结合亲和力的新形式的epha2结合scfv抗体而进行的实验。先前在pct/us2015/039741中已经描述了原始epha2结合scfv ryr,在所述专利中epha2结合scfv ryr被命名为hca
‑
f1,并且ryr的种系形式被命名为ryrgerm。为了鉴定对epha2具有改善的结合亲和力的新形式的epha2结合scfv抗体,产生了基于ryrgerm的酵母展示诱变文库,并通过facs针对更高亲和力的结合物进行了选择。鉴定了四种对epha2具有高结合亲和力的新epha2 scfv,分别命名为ryrgerm_102019_14、ryrgerm_102919_15、ryrgerm_102919_22和ryrgerm_102919_33。这些新鉴定的epha2 scfv的vh和vl区以及cdr的氨基酸序列列于表4
‑
表5和序列表中。在这些实验中,选择使用人和小鼠重组epha2蛋白以维持跨物种结合。通过流式细胞术测量了与人和小鼠epha2二者结合的表观亲和力。如图10a所示,与原始epha2结合scfv ryr相比,在酵母展示诱变文库中鉴定的新形式的epha2结合scfv抗体显示出对人epha2的增强的结合亲和力,且结合亲和力增加约8倍至约70倍。人epha2结合亲和力的表观k
d
值为:ryrgerm:354.9nm(原始epha2 scfv);ryrgerm_102019_14:21.27nm;ryrgerm_102919_15:5.58nm;ryrgerm_102919_22:28.13nm;ryrgerm_102919_33:42.49nm。类似地,如图10b所示,与原始epha2结合scfv ryr相比,在酵母展示诱变文库中鉴定的新形式的epha2结合scfv抗体显示出对小鼠重组epha2
‑
fc的改善的结合亲和力,且结合亲和力增加约40倍至约80倍。小鼠epha2
‑
fc融合物结合亲和力的表观k
d
值为:ryrgerm(原始epha2 scfv):114.7nm;ryrgerm_102019_14:2.12nm;ryrgerm_102919_15:2.01nm;ryrgerm_102919_22:1.34nm;ryrgerm_102919_33:2.87nm。
[0216]
随后,为了超越对在酵母细胞中scfv结合活性的评估,用原始epha2 scfv(ryr)和
新改善的ryrgerm_102919_15设计并构建了另外的重组人igg1,并研究了其对活细胞和重组抗原的结合亲和力。图11总结了用于比较在图10a
‑
图10b中描述的原始ryr与新改善的ryr结合scfv ryrgerm_102919_15之间的重组igg1的亲和力而在人前列腺癌细胞系du145中进行的实验的结果。在这些实验中,评价了ryr igg1与ryrgerm_102919_15igg1对du145细胞的表观结合亲和力。在这些实验中,将du145细胞与在40pm至125nm的浓度范围内的ryr或ryrgerm_102919_15在25℃下一起孵育1h,洗涤,并用抗人alexa fluor 647检测结合。将mfi值进行曲线拟合以生成表观k
d
值。ryr igg1和ryrgerm_102919_15的k
d
值分别为23.7nm和0.23nm,这表明结合亲和力增加了约100倍。
[0217]
还进行了另外的实验以评价新epha2 scfv ryrgerm_102919_15对重组人epha2的结合亲和力(参见例如图12)。在这些实验中,使用probe life gator仪器进行无标记生物层干涉(biolayer interferometry,bli)分析。用ryr或ryrgerm_102919_15igg1加载抗人fc探针,并在25℃下使用100nm重组人epha2(r&d system)进行结合测定。ryr igg1的表观亲和力k
d
为约28nm(k
off
/k
on
=1.45e
‑
02/5.18e 05),而改善的ryrgerm_102919_15igg1的表观亲和力k
d
为约5.0nm(k
off
/k
on
=1.32e
‑
03/2.62e 05),这表明结合亲和力增加了约5倍。实施例11重组抗体的产生
[0218]
通过pcr从候选scfv噬菌体扩增了vh和vl抗体基因,并将其分别亚克隆至abvec ig
‑
γ和
‑
λ表达载体中。为了产生双特异性igg
‑
scfv,将抗alcam 3f1或非结合对照c10用作igg骨架,并通过与(gly4ser)3接头融合将内化scfv引入λ轻链恒定区(cl)的c末端。在opti
‑
mem(life technologies)中将hek293a细胞用与聚乙烯亚胺混合的抗体表达质粒(sigma aldrich)转染24小时。将转染培养基更换为freestyle
tm 293(gibco),并将细胞进一步培养长达8天。在蛋白a琼脂糖(thermo scientific)上从培养上清液纯化分泌的抗体,并将其在sds
‑
page梯度凝胶(4%
‑
20%)上分析。实施例12稳定hek293
‑
epha2细胞系的产生
[0219]
将hek293细胞用epah2表达慢病毒载体转导,并维持在含有g418的常规生长培养基(sigma)中。稳定的epha2表达克隆通过使用人抗epha2抗体、接着使用alexa647标记的山羊抗人igg(jackson immunoresearch)的facs来鉴定。通过facs进一步筛选了稳定的克隆以获得表达不同水平的epha2的克隆。实施例13细胞表面抗原拷贝数测量
[0220]
如先前所述测量了细胞表面抗原拷贝数(或抗原密度)。简而言之,将细胞通过0.25%胰蛋白酶消化分离,洗涤并重悬于facs测定缓冲液(pbs,1%fbs,ph 7.4)中,与通过单克隆抗体标记试剂盒(molecular probes)和alexa647缀合的抗epha2或alcam抗体一起孵育以分别检测epha2或alcam,并通过bd accuri c6(bd biosciences)分析。根据制造商的建议,使用quantum
tm alexa647mesf和quantum
tm simple抗人igg(bang’s laboratory)将中值荧光强度(mfi)转化为抗体结合能力(abc)。e/a(epha2/alcam)比率是通过将所研究的每个细胞模型的epha2的拷贝数除以alcam的拷贝数来计算的。
实施例14表观k
d
测定
[0221]
将解离的细胞(约2x105个)与不同浓度的人igg在4℃下一起孵育16小时。用冰冷的pbs洗涤三次后,通过alexa647标记的山羊抗人igg(jackson immunoresearch)检测细胞结合的igg,并通过facs进行分析。使用graphpad prism软件通过曲线拟合方法计算表观k
d
值。实施例15细胞表面抗原耗尽
[0222]
将单特异性或双特异性抗体(100nm)与在24孔板中培养的细胞(约80%汇合度)一起孵育24小时,并使用alexa647标记的l1a1抗epha2人igg或l50抗alcam小鼠igg(fisher scientific)分别测定留在细胞表面的epha2或alcam。使用上述方法计算细胞表面拷贝数,并针对未进行抗体处理的对照组进行归一化。实施例16免疫荧光共聚焦显微镜检查
[0223]
将抗体与接种在8孔培养室载玻片(fisher scientific)中的细胞一起孵育指定的时间量。为了评估内化途径(大胞吞作用),将细胞与texasred缀合的70kda中性葡聚糖(nd70
‑
tr,life technologies)(大胞吞作用的标记物)共同孵育。孵育后,将细胞用4%多聚甲醛(pfa)固定并用pbs/1%fbs/0.2%triton
‑
x100透化。将细胞相关抗体用alexa488或647标记的山羊抗人igg(jackson immunoresearch)在室温下染色1小时。通过兔抗溶酶体相关膜蛋白1(lamp1)抗体(cell signaling)检测溶酶体,接着与alexa647标记的山羊抗兔igg(jackson immunoresearch)一起孵育。为了分析肿瘤球中的抗体定位,通过以500x g离心5min收集球,将其洗涤,固定,透化并使用上述抗体进行免疫标记。使用cygel
tm
(abcam)将球固定在8孔室载玻片中以进行显微镜分析。为了成像,将细胞或球使用hoechst 33342(thermo scientific)复染,并通过具有olympus 60x相衬水浸物镜的fv10i激光共聚焦显微镜(olympus)成像。实施例17肿瘤球的形成
[0224]
通过在37℃/5%co2下在超低吸附24孔板(corning)中的含有dmem/f12(gibco)、20ng/ml egf、10ng/ml bfgf、10ng/ml igf和2%b27补充剂(gibco)的无血清培养基(sfm)中培养来自单层培养物的悬浮肿瘤细胞来产生肿瘤球。对于球繁殖测定,对第一代球进行胰蛋白酶化并通过40μm尼龙网细胞过滤器(fisher scientific)筛分,以获得单个细胞群体。将每孔200个细胞重悬于500μl sfm中,在37℃/5%co2下接种于超低吸附24孔板(corning)中持续24小时,并用指示的抗体处理2周。每3
‑
4天以100μl sfm饲喂细胞。使用biorevo数字显微镜(bz
‑
9000;keyence)对每个孔进行分段扫描,并合并以展示整个孔图像。对直径>100μm的球进行计数。实施例18位点特异性adc的产生
[0225]
将半胱氨酸残基引入igg或bsigg的重链位置116(t116c),并如先前所述产生了具
有修饰的位点特异性adc。简而言之,通过在37℃下与10倍摩尔过量的三(2
‑
羧乙基)膦盐酸盐(tcep)(thermo scientific)一起孵育2小时还原pbs中的抗体,通过zeba旋转脱盐柱(thermo scientific)纯化并在pbs/5mm edta中进行缓冲液交换。为了重新氧化链间二硫键,将还原的抗体与20倍摩尔过量的脱氢抗坏血酸(dhaa)(sigma)在25℃下一起孵育3小时。用pbs/5mm edta进行缓冲液交换后,将抗体与3倍摩尔过量的马来酰亚胺基己酰基
‑
缬氨酸
‑
瓜氨酸
‑
对氨基苯甲酰氧基羰基一甲基奥瑞他汀f(mc
‑
vc
‑
pab
‑
mmaf)在25℃下一起孵育1小时。经由通过zeba
tm
旋转脱盐柱(fisher scientific)运行两次纯化最终缀合产物,并使用infinity 1220lc系统(agilent)通过疏水相互作用色谱(hic)
‑
hplc进行分析。使用openlab cds软件(agilent)从面积积分估计药物与抗体比率(dar)。实施例19adc细胞毒性
[0226]
将细胞以2x103个/孔接种在96孔细胞培养板中过夜,并与不同浓度的adc一起孵育96小时。使用钙黄绿素
‑
am细胞活力测定试剂盒(biotium inc.)测定细胞活力。实施例20体内异种移植物研究
[0227]
所有动物研究均经过ucsf动物护理和使用委员会(ucsf animal care and use committee)(an092211)的批准,并遵守nih实验室动物护理和使用指南(nih guide for the care and use of laboratory animals)进行管理。向nod/scid/il
‑
2rγ
‑
/
‑
(nsg)雌性小鼠移植1x106个capan
‑
1细胞,在第5天随机分为4组(每组n=6)。每4天用3mg/kg的媒介物pbs或者单特异性或双特异性adc静脉内处理小鼠,共注射4次。通过卡尺测量肿瘤大小,并使用公式v=(宽度2x长度)/2计算肿瘤体积。在研究过程中监测体重。表4:根据本公开文本的一些非限制性实施方案的示例性工程化抗体的氨基酸序列。显示了vh和vl的氨基酸序列。序列表中分别指示了对应于cdr1、cdr2和cdr3的区域。
表5:根据本公开文本的一些非限制性实施方案的示例性工程化抗体的hcdr和lcdr的氨基酸序列。
[0228]
尽管已经公开了本公开文本的具体替代方案,但是应当理解的是,在所附权利要求的真实精神和范围内各种修改和组合是可以进行和设想的。因此,无意限制本文所呈现
light chain gene cassettes.methods mol biol 2018;1701:61
‑
82 doi 10.1007/978
‑1‑
4939
‑
7447
‑
4_4.12.rogosch t,kerzel s,hoi kh,zhang z,maier rf,ippolito gc,et al.immunoglobulin analysis tool:a novel tool for the analysis of human and mouse heavy and light chain transcripts.front immunol 2012;3:176 doi 10.3389/fimmu.2012.00176.13.smith k,garman l,wrammert j,zheng ny,capra jd,ahmed r,et al.rapid generation of fully human monoclonal antibodies specific to a vaccinating antigen.nat protoc 2009;4(3):372
‑
84 doi 10.1038/nprot.2009.3.14.sherbenou dw,aftab bt,su y,behrens cr,wiita a,logan ac,et al.antibody
‑
drug conjugate targeting cd46 eliminates multiple myeloma cells.j clin invest 2016;126(12):4640
‑
53 doi 10.1172/jci85856.15.orcutt kd,ackerman me,cieslewicz m,quiroz e,slusarczyk al,frangioni jv,et al.a modular igg
‑
scfv bispecific antibody topology.protein eng des sel 2010;23(4):221
‑
8 doi 10.1093/protein/gzp077.16.ha kd,bidlingmaier sm,zhang y,su y,liu b.high
‑
content analysis of antibody phage
‑
display library selection outputs identifies tumor selective macropinocytosis
‑
dependent rapidly internalizing antibodies.mol cell proteomics 2014;13(12):3320
‑
31 doi 10.1074/mcp.m114.039768.17.junutula jr,raab h,clark s,bhakta s,leipold dd,weir s,et al.site
‑
specific conjugation of a cytotoxic drug to an antibody improves the therapeutic index.nat biotechnol 2008;26(8):925
‑
32 doi 10.1038/nbt.1480.18.jiao j,hindoyan a,wang s,tran lm,goldstein as,lawson d,et al.identification of cd166 as a surface marker for enriching prostate stem/progenitor and cancer initiating cells.plos one 2012;7(8):e42564 doi 10.1371/journal.pone.0042564.19.yan m,yang x,wang l,clark d,zuo h,ye d,et al.plasma membrane proteomics of tumor spheres identify cd166 as a novel marker for cancer stem
‑
like cells in head and neck squamous cell carcinoma.mol cell proteomics 2013;12(11):3271
‑
84 doi 10.1074/mcp.m112.025460.20.moon bs,jeong wj,park j,kim ti,min do s,choi ky.role of oncogenic k
‑
ras in cancer stem cell activation by aberrant wnt/beta
‑
catenin signaling.j natl cancer inst 2014;106(2):djt373 doi 10.1093/jnci/djt373.21.behrens cr,liu b.methods for site
‑
specific drug conjugation to antibodies.mabs 2014;6(1):46
‑
53 doi 10.4161/mabs.26632.22.fu y,ho m.dna damaging agent
‑
based antibody
‑
drug conjugates for cancer therapy.antib ther 2018;1(2):33
‑
43 doi 10.1093/abt/tby007.23.panowski s,bhakta s,raab h,polakis p,junutula jr.site
‑
specific antibody drug conjugates for cancer therapy.mabs 2014;6(1):34
‑
45 doi 10.4161/
mabs.27022.24.ha kd,bidlingmaier sm,su y,lee nk,liu b.identification of novel macropinocytosing human antibodies by phage display and high
‑
content analysis.methods enzymol 2017;585:91
‑
110 doi 10.1016/bs.mie.2016.10.004.25.chang k,pastan i.molecular cloning of mesothelin,a differentiation antigen present on mesothelium,mesotheliomas,and ovarian cancers.proc natl acad sci u s a 1996;93(1):136
‑
40.26.silver da,pellicer i,fair wr,heston wd,cordon
‑
cardo c.prostate
‑
specific membrane antigen expression in normal and malignant human tissues.clin cancer res 1997;3(1):81
‑
5.27.kinoshita y,kuratsukuri k,landas s,imaida k,rovito pm,jr.,wang cy,et al.expression of prostate
‑
specific membrane antigen in normal and malignant human tissues.world j surg 2006;30(4):628
‑
36 doi 10.1007/s00268
‑
005
‑
0544
‑
5.28.wang k,wei g,liu d.cd19:a biomarker for b cell development,lymphoma diagnosis and therapy.exp hematol oncol 2012;1(1):36 doi 10.1186/2162
‑
3619
‑1‑
36.29.vainshtein i,roskos lk,cheng j,sleeman ma,wang b,liang m.quantitative measurement of the target
‑
mediated internalization kinetics of biopharmaceuticals.pharm res.2015 jan;32(1):286
‑
99.30.li n,hill ks,elferink la.analysis of receptor tyrosine kinase internalization using flow cytometry.methods mol biol.2008;457:305
–
17.31.pahara j,shi h,chen x,wang z.dimerization drives pdgf receptor endocytosis through a c
‑
terminal hydrophobicmotif shared by egf receptor.exp cell res.2010;316:2237
–
50.32.mazor y,barnea i,keydar i,benhar i.antibody internalization studied using a novel igg binding toxin fusion.j immunol methods.2007;321:41
–
59.33.schaefer g et al.a two
‑
in
‑
one antibody against her3 and egfr has superior inhibitory activity compared with monospecific antibodies.cancer cell.2011 oct 18;20(4):472
‑
86.doi:10.1016/j.ccr.2011.09.00334.lee cv,koenig p,fuh g.a two
‑
in
‑
one antibody engineered from a humanized interleukin 4 antibody through mutation in heavy chain complementarity
‑
determining regions.mabs.2014;6(3):622
–
627.doi:10.4161/mabs.28483).
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。