黑色素瘤相关的mirna在诊断和治疗黑色素瘤中的应用
技术领域
1.本发明属于生物医药技术领域,具体地,本发明涉及黑色素瘤相关的mirna在诊断和治疗黑色素瘤中的应用,更具体地,本发明涉及黑色素瘤相关的mirna包括mir
‑
1321、mir
‑
139
‑
5p。
背景技术:
2.黑色素瘤(melanoma)是黑色素细胞来源的一种高度恶性的肿瘤,简称恶黑,多发生于皮肤,也可见于黏膜和内脏,近年来,黑色素瘤在世界范围内的发病率与死亡率呈明显增加的趋势,占所有恶性肿瘤的1%
‑
3%,但以6%
‑
7%的增长速度逐年递增,且发病年龄呈年轻化的趋势,为发病率增长最快的恶性肿瘤之一。黑色素瘤发病率有较明显的种族差异,在白种人中发病率最高,黄种人和黑种人发病率相对较低(garbe c, leiter u. melanoma epidemiology and trends[j]. clin dermatol, 2009, 27(01): 3
‑
9),我国黑色素瘤的发病率为0.49/10万,与欧美等高发地区相比,处于相对较低的发病水平,但由于黑色素瘤的恶性程度高,易发生血液及淋巴转移,临床预后较差,且国内对黑色素瘤的分析研究相对较少,因此仍亟需对黑色素瘤的发病机制和治疗方法进行研究,进而为黑色素瘤的诊断和治疗提供新靶点。
[0003]
早期黑色素瘤通过以手术为主的治疗方法其存活率可以达到90%,但恶性黑色素瘤侵袭性非常强,十分容易出现早期转移,且一旦出现转移治愈率就会很低(russo a e, torrisi e, bevelacqua y, et al. melanoma: molecular pathogenesis and emerging target therapies[j]. international journal of oncology, 2009, 34(6): 1481
‑
1489.)。同时,黑色素瘤对化学治疗和放射治疗都不太敏感,晚期转移性黑色素瘤的生存率仅为10%左右,复发率更是高达60%。近年来出现了如促分裂原活化的蛋白激酶(mapk)通路抑制剂,抗细胞毒性t淋巴细胞相关抗原
‑
4(ctla
‑
4)和程序性细胞死亡蛋白1(pd
‑
1)/程序性细胞死亡配体1(pd
‑
l1)通路阻断剂等相关靶向治疗和生物免疫治疗,大大改善了黑色素瘤的治疗,但这些治疗有的出现治疗失败,或治疗效果不持久,或出现严重的副作用,整体的治疗效果仍不太理想,其发病机制也仍不清楚,因此,对黑色素瘤应进行进一步的研究,进一步探究黑色素瘤的发病机理和调控机制。发现与其发生和发展相关的新的靶点,能够为临床治疗黑色素瘤提供新的策略,从而可以寻找更有效、耐用和可个性化的治疗方案。
[0004]
mirna(microrna)又称微小rna,广泛存在于真核生物中,是一种小的内源性的、非编码rna,在哺乳动物60%的编码蛋白基因中表达,并发挥相应的生理作用,mirna的异常表达和异常功能与许多人类疾病的发展和进展有关,包括各种恶性肿瘤,黑色素瘤中也同样存在多种调控mirna,因此,筛选在黑色素瘤中差异表达、调控黑色素瘤细胞生长的mirna能为其诊断和治疗提供一种有效的方法。
技术实现要素:
[0005]
鉴于此,为了克服本领域目前存在的技术缺陷,本发明的目的在于提供黑色素瘤
相关的mirna在诊断和治疗黑色素瘤中的应用,所述黑色素瘤相关的mirna包括mir
‑
1321、mir
‑
139
‑
5p。
[0006]
本发明的上述目的通过以下技术方案得以实现:本发明的第一方面提供了检测生物标志物的试剂在制备用于早期诊断黑色素瘤的产品中的应用。
[0007]
进一步,所述生物标志物为mir
‑
1321和mir
‑
139
‑
5p。
[0008]
进一步,所述试剂选自:特异性识别所述生物标志物的探针;或特异性扩增所述生物标志物的引物。
[0009]
进一步,特异性扩增所述生物标志物mir
‑
1321和mir
‑
139
‑
5p的引物的序列分别如seq id no:7
‑
seq id no:8和seq id no:9
‑
seq id no:10所示。
[0010]
本发明中所述的生物标志物,是指在具有第二表型(例如没有疾病)的受试者和具有第一表型(例如患有疾病)的受试者之间差异表达的mirna,具体地,与来自具有第二表型(例如没有疾病)的受试者或一组受试者的生物样品相比,它在来自具有第一表型(例如患有疾病)的受试者或一组受试者的生物样品中显著差异性地存在(即增加或减少);生物标志物可以在任何水平上差异性地存在,但是一般以如下的水平存在,所述水平增加了至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少100%、至少110%、至少120%、至少130%、至少140%、至少150%、或更多;或一般以如下的水平存在,所述水平减少了至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、或100%(即不存在)。
[0011]
本发明所述的mir
‑
1321,包括mir
‑
1321及其同源物、突变体、同等型,该术语涵盖全长,未加工的mir
‑
1321,以及源自细胞中经加工的任何形式的mir
‑
1321,该术语涵盖mir
‑
1321的天然发生变体(例如剪接变体或等位变体),本发明所述的mir
‑
1321的具体序列可在mirbase数据库(http://microrna.sanger.ac.uk/)中查询得到,在本发明的具体实施例中,所述mir
‑
431的序列如seq id no:13所示;mir
‑
1321的序列:acauuaugaagcaaguauuauuaucccuguuuuacaaauaaggaaauaaacucagggaggugaaugugaucaaagauag(seq id no:13)本发明所述的mir
‑
139
‑
5p,包括mir
‑
139
‑
5p及其同源物、突变体、同等型,该术语涵盖全长,未加工的mir
‑
139
‑
5p,以及源自细胞中经加工的任何形式的mir
‑
139
‑
5p,该术语涵盖mir
‑
139
‑
5p的天然发生变体(例如剪接变体或等位变体),本发明所述的mir
‑
139
‑
5p的具体序列可在mirbase数据库(http://microrna.sanger.ac.uk/)中查询得到,在本发明的具体实施例中,所述mir
‑
139
‑
5p的序列如seq id no:14所示;mir
‑
139
‑
5p的序列:ucuacagugcacgugucuccagu(seq id no:14)本发明中mir
‑
1321、mir
‑
139
‑
5p、mir
‑
1321和mir
‑
139
‑
5p联合的诊断效能是通过受试者工作特征曲线(receiver operating characteristic curve,roc)进行验证的,曲
线下面积(area under the curve,auc)是指本领域技术人员所熟知的roc曲线下的面积,曲线下面积(auc)的测定有助于经由整体数据范围来比较分类器的准确性。具有更大的曲线下面积(auc)的分类器具有更大的能力以在两个感兴趣的组(例如,癌样本及正常或对照样本)之间准确分类未知物。在于区别两个群体(例如,具有黑色素瘤的组与不是黑色素瘤的对照组)方面上,受试者工作特征曲线(roc)有用于以图表形式来表现特定的特征(例如,本发明中所描述的生物标志物和/或额外的生物医学信息的任意项目)的性能。通常,基于单一特征值,经由整个群体(例如,患者组及对照组)的上述特征数据被升序排列。然后,针对上述特征的每个值,计算对于数据的真阳性率及假阳性率。通过计算高于针对其特性的值以上的病例数之后,除以总病例数来测定上述真阳性率。通过计算高于针对其特性的值以上的对照组数之后,除以总对照组数来测定上述假阳性率。尽管该定义是指患者组的特性相对于对照组高的情况,但该定义还适用于患者组的特性相对于对照组低的情况(在这种情况下,可计算出低于上述特性的值的样本的数)。受试者工作特征曲线(roc)可以针对其他单一计算,还可针对单一特性生成,为了提供单一和值(single sum value),例如,可数学性地组合两个以上的特性(例如,加、减、乘等),该单一和值可由受试者工作特征曲线(roc)来表示。附加地,能够以受试者工作特征曲线(roc)来画出可导出单一计算值的多重特性的组合。这些特性组合可构成测试。上述受试者工作特征曲线(roc)为表示相对于测试的假阳性率(1
‑
特异性)的测试的真阳性率(灵敏度)的图表。
[0012]
本发明的第二方面提供了一种用于早期诊断黑色素瘤的产品。
[0013]
进一步,所述产品包含检测待测样本中生物标志物的试剂,所述生物标志物为mir
‑
1321和mir
‑
139
‑
5p。
[0014]
进一步,所述产品包括试剂盒、芯片;优选地,所述试剂盒包括特异性结合mir
‑
1321和mir
‑
139
‑
5p的引物、探针或芯片;优选地,所述芯片包括固相载体、附着在固相载体上的特异性识别mir
‑
1321和mir
‑
139
‑
5p的探针。
[0015]
进一步,所述待测样本来源于受试者;本发明中所述的受试者,是指任何动物,还指人类和非人类的动物。术语“非人类的动物”包括所有脊椎动物,例如,哺乳动物,如非人灵长类动物(特别是高等灵长类动物)、绵羊、狗、啮齿类动物(如小鼠或大鼠)、豚鼠、山羊、猪、猫、兔、牛、和任何家畜或宠物;以及非哺乳动物,如鸡,两栖类,爬行动物等。在优选的实施方式中,所述受试者为人。
[0016]
本发明中所述的待测样本,是指包括任何细胞、组织或体液收集取样得到的样本,其中,包括(但不限于),组织或细胞样本的来源可以来自新鲜、冷冻和/或保存的器官或组织样本的固体组织,或者活组织检查或者抽吸物,血液或任何血液成分;体液如脑脊髓液、羊水、腹腔液或间质液。组织样本可以是初级或体外培养的细胞或细胞株。可选地,组织或细胞样本从疾病组织/器官获取。组织样本可能包含所述组织自然混合的化合物,诸如防腐剂、抗凝血剂、缓冲剂、固定剂、营养剂、抗生素、或类似化合物,优选地,所述待测样本为来源于受试者的血液或组织,更优选地,所述待测样本为来源于受试者的血液。
[0017]
进一步,本发明所述的试剂盒还包括:容器、使用说明书、阳性对照物、阴性对照物、缓冲剂、助剂或溶剂。例如用于混悬或固定细胞的溶液,可检测的标签或标记,使核酸易于杂交的溶液,用于裂解细胞的溶液,或用于核酸纯化的溶液。
[0018]
进一步,本发明所述的试剂盒中还可附有试剂盒的使用说明书,其中记载了如何采用试剂盒进行检测,和如何利用检测结果对是否患有黑色素瘤或患有黑色素瘤的风险进行判断。
[0019]
进一步,采用本发明所述的试剂盒,可通过选自下组的各种方法(包括但不限于)检测mir
‑
1321和mir
‑
139
‑
5p:实时定量反转录pcr、生物芯片检测法、dna印迹法、或rna印迹法或原位杂交法。本领域普通技术人员可根据实际条件和需要对检测方式进行调整和改变。
[0020]
进一步,制备本发明所述的芯片的固相载体,包括基因芯片领域的各种常用材料,例如(但不限于)尼龙膜、经活性基团(如醛基、氨基等)修饰的玻片或硅片、未修饰的玻片、塑料片等。
[0021]
进一步,所述芯片为mirna芯片,所述mirna芯片的制备可采用本领域已知的生物芯片的常规制造方法,例如,如果固相载体采用的是修饰玻片或硅片,探针的5’端含有氨基修饰的聚dt串,可将寡核苷酸探针配制成溶液,然后采用点样仪将其点在修饰玻片或硅片上,排列成预定的序列或阵列,然后通过放置过夜来固定,就可得到本发明所述的mirna芯片。如果核酸不含氨基修饰,则其制备方法也可参照如下文献:王申五主编的《基因诊断技术
‑
非放射性操作手册》;j.l.erisi, v.r.iyer, p.o.brown. exploring the metabolic and genetic control of gene expression on a genomic scale. science, 1997; 278: 680和马立人,蒋中华主编. 生物芯片. 北京:化学工业出版社,2000,1
‑
130。
[0022]
本发明还提供了生物标志物在构建预测黑色素瘤的计算模型中的应用。
[0023]
进一步,所述生物标志物为mir
‑
1321和mir
‑
139
‑
5p;优选地,所述计算模型以mir
‑
1321和mir
‑
139
‑
5p的表达水平作为输入变量构建而成。
[0024]
本发明的第三方面提供了生物标志物在筛选用于预防和/或治疗黑色素瘤的候选药物中的应用。
[0025]
进一步,所述生物标志物为mir
‑
1321和mir
‑
139
‑
5p。
[0026]
本发明的第四方面提供了一种筛选用于预防和/或治疗黑色素瘤的候选药物的方法。
[0027]
进一步,所述方法包括如下步骤:(1) 用待筛选物质处理表达或含有mir
‑
1321和mir
‑
139
‑
5p的体系;(2) 检测所述体系中mir
‑
1321和mir
‑
139
‑
5p的表达水平;(3) 若所述待筛选物质可降低mir
‑
1321的表达水平、升高mir
‑
139
‑
5p的表达水平,则表明该物质为预防和/或治疗黑色素瘤的候选药物。
[0028]
进一步,所述体系选自:细胞体系、亚细胞体系、溶液体系、组织体系、器官体系或动物体系。
[0029]
本发明的第五方面提供了生物标志物在制备治疗黑色素瘤的药物中的应用。
[0030]
进一步,所述生物标志物为mir
‑
1321和mir
‑
139
‑
5p。
[0031]
进一步,所述药物包括降低mir
‑
1321表达水平的抑制剂、升高mir
‑
139
‑
5p表达水平的促进剂。
[0032]
进一步,所述降低mir
‑
1321表达水平的抑制剂的序列如seq id no:1所示;
所述升高mir
‑
139
‑
5p表达水平的促进剂的序列如seq id no:2
‑
seq id no:3所示。
[0033]
本发明的第六方面提供了一种治疗黑色素瘤的药物。
[0034]
进一步,所述药物包括降低mir
‑
1321表达水平的抑制剂、升高mir
‑
139
‑
5p表达水平的促进剂;优选地,所述降低mir
‑
1321表达水平的抑制剂的序列如seq id no:1所示;优选地,所述升高mir
‑
139
‑
5p表达水平的促进剂的序列如seq id no:2
‑
seq id no:3所示。
[0035]
进一步,所述药物还包括药学上可接受的载体和/或辅料。
[0036]
进一步,所述药学上可接受的载体和/或辅料是指本领域认可的并且包括例如参与从身体的一个器官或部分携带或运输任何主题组合物至身体的另一个器官或部分的药学上可接受的材料、组合物或赋形剂,如液体或固体填充剂、稀释剂、溶剂或包囊材料。每种载体必须在与主题组合物的其他成分相容的意义上是“可接受的”并且对患者无害。在某些实施方案中,药学上可接受的载体和/或辅料是无热原的。可以用作药学上可接受的载体和/或辅料的材料的一些例子包括:(1) 糖,如乳糖、葡萄糖和蔗糖;(2) 淀粉,如玉米淀粉和马铃薯淀粉;(3) 纤维素及其衍生物,如羧甲基纤维素钠、乙基纤维素和乙酸纤维素;(4) 粉末状黄蓍胶;(5) 麦芽;(6) 明胶;(7) 滑石粉;(8) 可可脂和栓剂蜡;(9) 油,如花生油、棉籽油、葵花籽油、芝麻油、橄榄油、玉米油和大豆油;(10) 二醇,如丙二醇;(11) 多元醇,如甘油、山梨醇、甘露糖醇和聚乙二醇;(12) 酯,如油酸乙酯和月桂酸乙酯;(13) 琼脂;(14) 缓冲剂,如氢氧化镁和氢氧化铝;(15) 海藻酸;(16) 无热原的水;(17) 等渗盐水;(18) 林格氏溶液;(19) 乙醇;(20) 磷酸盐缓冲液;(21) 药物制剂中使用的其他无毒的相容物质。
[0037]
相对于现有技术,本发明具有的优点和有益效果:本发明首次发现mir
‑
1321和mir
‑
139
‑
5p联合可用于早期黑色素瘤的诊断和治疗中,经验证发现,所述mir
‑
1321和mir
‑
139
‑
5p联合具有较好的诊断效能,敏感性和特异性均较高,此外,本发明通过细胞增殖实验和细胞凋亡实验验证了mir
‑
1321和mir
‑
139
‑
5p联合治疗的效果为协同治疗,而非单纯的叠加,能够用于早期黑色素瘤的治疗中。
[0038]
附图说明
[0039]
以下,结合附图来详细说明本发明的实施方案,其中:图1显示mir
‑
1321、mir
‑
139
‑
5p在对照组和黑色素瘤组之间差异表达的结果图,其中,a图:mir
‑
1321,b图:mir
‑
139
‑
5p;图2显示mir
‑
1321、mir
‑
139
‑
5p对黑色素瘤的诊断效能验证的roc曲线结果图,其中,a图:mir
‑
1321,b图:mir
‑
139
‑
5p;图3显示mir
‑
1321 mir
‑
139
‑
5p联合对黑色素瘤的诊断效能验证的roc曲线结果图;图4显示mir
‑
1321、mir
‑
139
‑
5p的相对表达量的结果图,其中,a图:mir
‑
1321,b图:mir
‑
139
‑
5p;
图5显示mir
‑
1321 inhibitor、mir
‑
139
‑
5p mimics、mir
‑
1321 inhibitor mir
‑
139
‑
5p mimics联合对黑色素瘤细胞增殖率的影响的结果统计图;图6显示mir
‑
1321 inhibitor、mir
‑
139
‑
5p mimics、mir
‑
1321 inhibitor mir
‑
139
‑
5p mimics联合对黑色素瘤细胞凋亡率的影响的结果图,其中,a图:空白对照组,b图:阴性对照组,c图:mir
‑
1321 inhibitor组,d图:mir
‑
139
‑
5p mimics组,e图:mir
‑
1321 inhibitor mir
‑
139
‑
5p mimics组。
[0040]
具体实施方式
[0041]
下面结合具体实施例,进一步阐述本发明,仅用于解释本发明,而不能理解为对本发明的限制。本领域的普通技术人员可以理解为:在不脱离本发明的原理和宗旨的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由权利要求及其等同物限定。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照厂商所建议的条件实施检测。
[0042] 实施例1 筛选黑色素瘤中差异表达的基因1、数据来源和处理在基因表达综合数据库(gene expression omnibus,geo)中搜索公共基因表达数据和完整的临床注释,从geo数据库(http://www.ncbi.nlm.nih.gov/geo/)下载黑色素瘤(melanoma)基因表达数据集gse20994,所述数据集中包括健康对照者和黑色素瘤患者的血液样本数据,所述数据集的样本量为case:normal=35:22,并利用注释文件对其注释,多个探针对应同一个基因的取平均值作为其表达量,然后获得基因表达矩阵文件。
[0043]
2、差异表达分析使用r软件中的“limma”包对上述数据进行差异表达分析,其中,差异表达基因的筛选标准均为:|log2fc|>0.5,adj.p value<0.05。
[0044]
3、实验结果实验结果显示,筛选得到的差异表达的基因共有397个,其中,上调的差异表达基因有190个,下调的差异表达基因有207个,其中,本发明涉及的生物标志物mir
‑
1321在黑色素瘤患者的血液样本中的表达显著上调,本发明涉及的生物标志物mir
‑
139
‑
5p在黑色素瘤患者的血液样本中的表达显著下调,结果见表1和图1a、图1b。
[0045]
表1 mir
‑
1321、mir
‑
139
‑
5p的差异表达结果实施例2 mir
‑
1321、mir
‑
139
‑
5p诊断效能的验证1、实验方法使用r包“proc”执行接收器工作特性(roc)分析,绘制roc曲线,分别对实施例1中筛选得到的差异表达基因mir
‑
1321、mir
‑
139
‑
5p、mir
‑
1321 mir
‑
139
‑
5p作为检测变量的
auc值、敏感性和特异性进行分析,判断上述指标mir
‑
1321、mir
‑
139
‑
5p、mir
‑
1321 mir
‑
139
‑
5p对黑色素瘤的诊断效能,在判断单个mirna的诊断效能时,直接使用mirna的表达量进行分析。首先调用proc包,然后读入目的mirna构建的表达量矩阵,运行绘制roc曲线的命令,其中命令采用for循环,同时涉及添加auc、thres(阈值)、smooth(拟合曲线)的命令。在判断mirna联合的诊断效能时,首先是使用glmnet对mirna进行logistics回归分析,利用建立的logistic回归模型,使用predict函数观察某个预测变量在各个水平对结果概率的影响,计算预测概率,绘制预测结果的roc曲线,对mir
‑
1321、mir
‑
139
‑
5p、mir
‑
1321 mir
‑
139
‑
5p的诊断效能进行分析。
[0046]
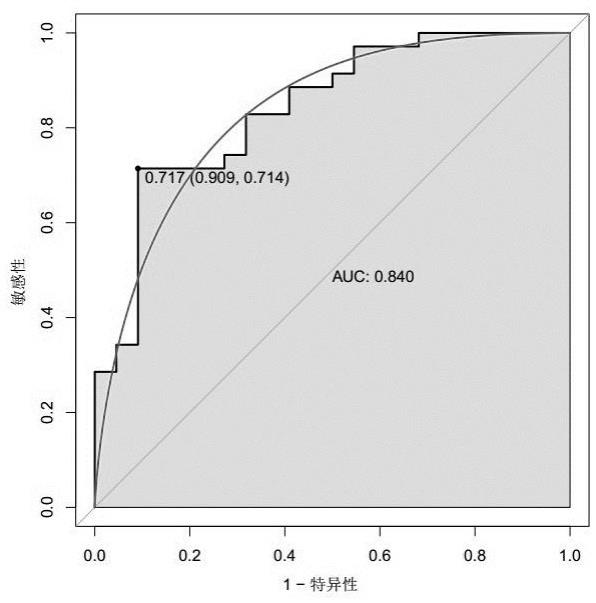
2、实验结果结果见表2和图2a、图2b、图3,从结果中可以看出mir
‑
1321、mir
‑
139
‑
5p两者联合应用于黑色素瘤的诊断中具有较高的准确性、敏感性以及特异性,auc值为0.840,显著优于单个基因mir
‑
1321、mir
‑
139
‑
5p的诊断效能,表明了mir
‑
1321、mir
‑
139
‑
5p两者联合具有更好的诊断效能。
[0047]
表2 mir
‑
1321、mir
‑
139
‑
5p、mir
‑
1321 mir
‑
139
‑
5p的诊断效能结果实施例3 mir
‑
1321、mir
‑
139
‑
5p的表达与黑色素瘤细胞的增殖和凋亡的关系研究1、实验材料实验中涉及到的主要实验器材和实验试剂及耗材见表3和表4。
[0048]
表3 实验中涉及的主要器材表4 实验中涉及的主要试剂2、细胞来源
黑色素瘤细胞a375购自于中国科学院上海细胞生物研究所,引进后在本实验室长期培养。a375培养基为以dmem 10% fbs 1% p/s solution,37℃、5% co2、95%空气、饱和湿度的条件下进行培养。
[0049]
3、细胞培养(1) a375黑色素瘤细胞复苏细胞复苏法使用的是水浴锅内快速融化的方法。实验之前进行防护,穿戴好手套及防护面具,从液氮中取出一支a375黑色素瘤细胞冻存管,注意观察标签名称、冻存日期等信息,确定是需要的细胞,然后快速放入已经备好的37℃的水浴锅中,整个过程一定要快速,最好在1 min时间内把冻存液完全融化,此时注意无菌操作防止感染,特别注意瓶盖处防护,完成融化后使用吸管把冻存的细胞转移到离心管中,加入pbs缓冲溶液均匀吹打,保证完全融入pbs缓冲溶液中,然后把离心管放入离心机中,调整转速1000 rpm/min,时间维持5 min左右,取出上清,保留离心管底层的物质,加入适量dmem完全培养基重新悬浮,按照1:2种植于t25培养瓶中,每个培养瓶中加入dmemf完全培养基5 ml,于镜下可见悬浮的圆形的细胞,代表已经把细胞转移成功,然后放入含有5% co2、37℃恒温的细胞孵育箱中进行培养;(2) a375黑色素瘤细胞换液a375黑色素瘤细胞开始贴壁的时间一般是大约4
‑
6 h左右,一般一天的时间就可以完全贴壁,贴壁后的细胞呈多边形,可以根据观察培养液的颜色及镜下观察情况进行换液,注意dmem完全培养基要在37℃恒温水浴锅中提前预热,可以用巴氏管吸取上面的陈旧培养液,尽可能不要接触培养皿的下部,防止底层细胞造成划痕,细胞生长不均匀。然后沿着侧壁慢慢加入37℃水浴预热的pbs缓冲溶液进行清洗,去除一些坏死的细胞,可以用37℃水浴预热的pbs冲洗三次,最后在培养皿中加入37℃水浴预热的5 ml dmem完全培养基,放入5% co2、37℃恒温孵育箱培养。整个过程注意无菌操作,巴氏管接触外界后要及时丢弃,过程干净利索,不宜过长时间;(3) a375黑色素瘤细胞传代约2
‑
3天,a375黑色素瘤细胞就可以达到80%
‑
100%的细胞融合,此时进行细胞传代。实验之前要进行个人防护,在提前消毒30 min的超净工作台中,使用巴氏管,吸弃陈旧的培养液,使用37℃水浴预热的pbs冲洗三次,加入1 ml浓度为0.25%胰蛋白酶,放入37℃恒温孵育箱中,计时1 min左右,为明确细胞是否完全被消化,可以在倒置显微镜下观察,如果见圆形的细胞大部分悬浮,就可停止胰蛋白酶消化,加入1
‑
2 ml的37℃水浴预热的5
‑
10 ml dmem/f
‑
12完全培养基,同时及时吹打细胞,使细胞完全悬浮溶液中,然后转移到离心管中,配平离心机,调整转速1000 rpm/min,离心时间5 min左右,按照1:3
‑
1:5的比例进行传代,培养皿放入5
‑
10 ml dmem/f
‑
12完全培养基,放入37℃、5% co2的细胞恒温孵育箱中进行培养。
[0050]
4、细胞转染(1) 取处于对数生长期的a375细胞,生长状态良好的细胞,用培养基将细胞密度调整到1
×
105/ml,接入6孔板,每孔2 ml细胞悬液,每组各两孔,37℃培养过夜;(2) 转染前2小时,换成无血清培养基;(3) 转染步骤,对于每个转染样品,均按如下所述的方法进行准备:
1) 转染前一天将细胞计数,取1 ml加入6孔板中,使得孔板的细胞密度不低于2
×
105个;2) 对于每孔细胞,用250 μl的无血清培养基稀释10 μl的100 nm的inhibitor或mimics,室温孵育5 min;3) 对于每孔细胞,用250 μl的无血清培养基稀释5 μl lipo2000,室温孵育5 min;4) 将步骤2)和步骤3)中的液体混合,室温孵育20 min;5) 将预先分好的贴壁细胞换成无血清培养基,加入上述复合物,在37℃,5% co2中培养6小时,再换成加血清的生长培养基,继续在37℃,5% co2中培养48小时。收集细胞样本,pbs洗两次,弃去液体,进行后续rna的提取;将实验设置为3个组:空白对照组(a375黑色素瘤细胞)、阴性对照组(inhibitor
‑
nc或mimics
‑
nc组)和实验组(inhibitor或mimics组)。
[0051]
其中,针对mir
‑
1321的inhibitor的序列信息如下:5
’‑
aucacauucaccucccug
‑3’
(seq id no:1)针对mir
‑
139
‑
5p的mimics的序列信息如下:正义链为5
’‑
ucuacagugcacgugucuccagu
‑3’
(seq id no:2)反义链为5
’‑
acuggagacacgugcacuguaga
‑3’
(seq id no:3)inhibitor
‑
nc的序列信息如下:5
’‑
caguacuuuuguguaguacaaa
‑3’
(seq id no:4)mimics
‑
nc的序列信息如下:正义链为5
’‑
uuuguacuacacaaaaguacug
‑3’
(seq id no:5)反义链为5
’‑
caguacuuuuguguaguacaaa
‑3’
(seq id no:6)5、qpcr检测细胞中mir
‑
1321、mir
‑
139
‑
5p的表达水平(1) 样本总rna的提取(trizol法)1) 取适量待测样本加入液氮后研磨粉碎;2) 用1 ml trizol将研磨样本转移到1.5 ml ep管中;3) 向1.5 ml ep管中加入500 μl酚氯,仿振荡混匀后,静止5分钟;4) 4℃ 12000 rpm离心10分钟,小心吸取上清于一新的1.5 ml ep管中;5) 向分离出的上清中加入700 μl异丙醇,充分混匀;6) 4℃ 12000 rpm离心10分钟,小心弃上清;7) 用75%乙醇洗涤沉淀一次,室温晾干;8) 50 μl depc水溶解rna沉淀;9) 琼脂糖凝胶电泳检测。
[0052]
(2) 总rna质量检测1) 使用核酸浓度测定仪测定rna浓度和纯度,测量前先用溶解rna用的depc水调零,操作方法如下:抬起样品臂,把样品加到检测基座上;放下样本臂,使用电脑上的软件开始吸光值检测。在上下两个光纤之间会自动拉出一个样品柱,然后进行检测;当检测完成后,抬起样品臂,并用干净的无尘纸把上下基座上的样品擦拭干净;2) 浓度测定:260 nm处读值为1表示40 ng rna/
µ
l。样品rna浓度计算公式为:
a260 x 40 ng/
µ
l;3) 纯度检测:rna溶液的a260/a280的比值是一种rna纯度检测方法,比值范围1.8到2.1。
[0053]
(3) 逆转录合成cdna逆转录使用invitrogen的逆转录试剂盒superscript iii;反应体系1的建立见表5,混匀,离心,65℃的条件下,5分钟,结束后置于冰上;表5 反应体系1的组成反应体系2的建立见表6;表6 反应体系2的组成混匀,离心,置于42℃,水浴60分钟;取出后置于85℃,反应10分钟,灭活逆转录酶,反应结束后将产物置于
‑
20℃待用。
[0054]
(4) 实时荧光定量检测首先设计qpcr的扩增引物,具体引物序列如下:mir
‑
1321:正向引物为5
’‑
cagggaggtgaatgtgat
‑3’
(seq id no:7);反向引物为5
’‑
ctcaactggtgtcgtg
‑3’
(seq id no:8);mir
‑
139
‑
5p:正向引物为5
’‑
tctacagtgcacgtgtctc
‑3’
(seq id no:9);反向引物为5
’‑
ctcaactggtgtcgtg
‑3’
(seq id no:10);u6内参引物:正向引物为5
’‑
gcttcggcagcacatatactaaaat
‑3’
(seq id no:11);反向引物为5
’‑
cgcttcacgaatttgcgtgtcat
‑3’
(seq id no:12);real time pcr反应体系建立见表7;表7 real time pcr反应体系
体系混匀后,瞬离,置于荧光定量pcr仪上,按照表8所述的条件反应;表8 realtime pcr反应条件对各组样本的相对定量结果进行分析,其中,mir
‑
1321、mir
‑
139
‑
5p相对表达量的计算公式如下:6、细胞增殖实验本实施例中采用cck
‑
8细胞增殖实验检测mir
‑
1321、mir
‑
139
‑
5p、mir
‑
1321 mir
‑
139
‑
5p的表达对a375黑色素瘤细胞增殖的影响,将未经处理的a375黑色素瘤细胞作为空白对照组、将转染inhibitor
‑
nc或mimics
‑
nc的a375黑色素瘤细胞作为阴性对照组,将转染inhibitor或mimics的a375黑色素瘤细胞作为实验组;制备上述各组的细胞悬液,并将细胞接种到96孔板中,每孔100 μl,每组设置3个复孔,培养12小时使其贴壁。每孔加入10 μl cck8检测溶液,继续培养1 h。用酶标仪测定在450 nm处的吸光度,吸光度值与细胞的增殖能力成正比。并记录相关的数据,根据检测的od值,分析各组细胞的增殖情况。
[0055]
7、细胞凋亡实验本实施例中采用流式细胞术检测mir
‑
1321、mir
‑
139
‑
5p、mir
‑
1321 mir
‑
139
‑
5p的表达对a375黑色素瘤细胞凋亡的影响,首先收集未经转染、转染mir
‑
1321 inhibitor、转染mir
‑
139
‑
5p mimics、同时转染mir
‑
1321 inhibitor和mir
‑
139
‑
5p mimics的a375黑色素瘤细胞,对细胞进行洗涤后用乙醇进行固定,并进行细胞的重悬和细胞过滤,并采用pi染液进行染色,之后采用流式细胞仪进行检测;其中,在细胞凋亡检测中,流式细胞术检测结果图中的不同象限代表不同的意义,q1
‑
1 (annexinv
‑
fitc)
‑
/pi 代表坏死细胞,q1
‑
2 (annexinv fitc) /pi 代表中晚期凋亡
的细胞,q1
‑
4 (annexinv
‑
fitc) /pi
‑
代表早期凋亡的细胞,q1
‑
3 (annexinv
‑
fitc)
‑
/pi
‑
代表正常的活细胞,各象限的百分数分别代表对应细胞所占的比例,细胞总凋亡率=中晚期凋亡率 早期凋亡率。
[0056]
8、实验结果转染的结果显示,以空白对照组mir
‑
1321的表达水平作为参比设为1,相比于空白对照组mir
‑
1321的表达量(相对表达量为1)与转染inhibitor
‑
nc的阴性对照组(nc组)mir
‑
1321的表达量,转染mir
‑
1321 inhibitor的实验组的mir
‑
1321的表达量显著下调,且差异具有统计学意义(p<0.05),而空白对照组和阴性对照组之间无显著差异(见图4a);转染的结果显示,以空白对照组mir
‑
139
‑
5p的表达水平作为参比设为1,相比于空白对照组mir
‑
139
‑
5p的表达量(相对表达量为1)与转染mimics
‑
nc的阴性对照组(nc组)mir
‑
139
‑
5p的表达量,转染mir
‑
139
‑
5p mimics的实验组的mir
‑
139
‑
5p的表达量显著上调,且差异具有统计学意义(p<0.05),而空白对照组和阴性对照组之间无显著差异(见图4b);细胞增殖实验的结果显示,转染mir
‑
1321 inhibitor的实验组的od450显著低于空白对照组和阴性对照组(见表9和图5),表明了mir
‑
1321能够影响黑色素瘤细胞的增殖活性,降低mir
‑
1321的表达水平可降低黑色素瘤细胞的增殖活性;细胞增殖实验的结果显示,转染mir
‑
139
‑
5p mimics的实验组的od450显著低于空白对照组和阴性对照组(见表9和图5),表明了mir
‑
139
‑
5p能够影响黑色素瘤细胞的增殖活性,升高mir
‑
139
‑
5p的表达水平可降低黑色素瘤细胞的增殖活性;此外,对各组的细胞增殖率和抑制率进行计算,计算得到的结果分别见表10和表11,结合图5可知,共同转染mir
‑
1321 inhibitor和mir
‑
139
‑
5p mimics的细胞的增殖率显著低于单独转染mir
‑
1321 inhibitor的细胞和单独转染mir
‑
139
‑
5p mimics的细胞的增殖率;利用金氏公式表达式q=e
a b
/(e
a
e
b
‑
e
a
×
e
b
)判断二者联合使用后的效果是否优于单独使用的效果,其中,e
a b
为mir
‑
1321 inhibitor mir
‑
139
‑
5p mimics对黑色素瘤细胞的抑制率,e
a
为mir
‑
1321 inhibitor对黑色素瘤细胞的抑制率,e
b
为mir
‑
139
‑
5p mimics对黑色素瘤细胞的抑制率;若q=0.85
‑
1.15之间为单纯叠加,1.15<q<20为协同,q>20为显著协同,q<0.85为拮抗,即q>1.15时即可判定mir
‑
1321 inhibitor和mir
‑
139
‑
5p mimics两者对黑色素瘤细胞增殖的抑制效果为协同效果,而非单纯叠加;根据表11计算得到的细胞抑制率的结果,利用金氏公式计算增效q值,评价mir
‑
1321 inhibitor和mir
‑
139
‑
5p mimics两者联用的效应是否强于单独的效应,代入计算得到的细胞抑制率的结果可知,q=e
a b
/(e
a
e
b
‑
e
a
×
e
b
)=[(0.772 0.786 0.781)/3]/{[(0.344 0.335 0.332)/3] [(0.346 0.334 0.337)/3]
‑
[(0.344 0.335 0.332)/3]
×
[(0.346 0.334 0.337)/3]}=1.387,即q=1.387,q>1.15,表明了mir
‑
1321 inhibitor和mir
‑
139
‑
5p mimics两者对黑色素瘤细胞增殖的抑制效果为协同效果,即两者联合表现为协同治疗。
[0057]
表9 细胞增殖实验的结果统计
表10 各组的细胞增殖率的计算结果表11 各组的细胞抑制率的计算结果细胞凋亡实验的结果显示,转染mir
‑
1321 inhibitor的实验组的细胞的总凋亡率(10.05%)显著高于空白对照组(3.05%)和阴性对照组(2.96%)(见表12和图6a、图6b、图6c),表明mir
‑
1321能够影响黑色素瘤细胞的凋亡能力,抑制mir
‑
1321的表达可促进黑色素瘤细胞的凋亡;细胞凋亡实验的结果显示,转染mir
‑
139
‑
5p mimics的实验组的细胞的总凋亡率(10.18%)显著高于空白对照组(3.05%)和阴性对照组(2.96%)(见表12和图6a、图6b、图6d),表明mir
‑
139
‑
5p能够影响黑色素瘤细胞的凋亡能力,升高mir
‑
139
‑
5p的表达水平可促进黑色素瘤细胞的凋亡;细胞凋亡实验的结果显示,共同转染mir
‑
1321 inhibitor和mir
‑
139
‑
5p mimics的实验组的细胞的总凋亡率(25.15%)显著高于单独转染mir
‑
1321 inhibitor的实验组(10.05%)和单独转染mir
‑
139
‑
5p mimics的实验组(10.18%)(见表12和图6c、图6d、图6e);此外,对各组的细胞抑制率进行计算,计算得到的结果见表13,利用金氏公式表达式q=e
a b
/(e
a
e
b
‑
e
a
×
e
b
)判断二者联合使用后的效果是否优于单独使用的效果,其中,e
a b
为mir
‑
1321 inhibitor mir
‑
139
‑
5p mimics对黑色素瘤细胞的抑制率,e
a
为mir
‑
1321 inhibitor对黑色素瘤细胞的抑制率,e
b
为mir
‑
139
‑
5p mimics对黑色素瘤细胞的抑制率;若q=0.85
‑
1.15之间为单纯叠加,1.15<q<20为协同,q>20为显著协同,q<0.85为拮抗,
即q>1.15时即可判定mir
‑
1321 inhibitor和mir
‑
139
‑
5p mimics两者对黑色素瘤细胞的凋亡促进作用为协同效果,而非单纯叠加;根据表13计算得到的细胞抑制率的结果,利用金氏公式计算增效q值,评价mir
‑
1321 inhibitor和mir
‑
139
‑
5p mimics两者联用的效应是否强于单独的效应,代入计算得到的细胞抑制率的结果可知,q=e
a b
/(e
a
e
b
‑
e
a
×
e
b
)=0.2210/(0.0700 0.0713
‑
0.0700
×
0.0713)=1.621,即q=1.621,q>1.15,表明了mir
‑
1321 inhibitor和mir
‑
139
‑
5p mimics两者对黑色素瘤细胞的凋亡促进作用为协同效果,进一步证明了mir
‑
1321 inhibitor和mir
‑
139
‑
5p mimics两者联合为协同治疗,而非单纯的叠加效果。
[0058]
表12 细胞凋亡实验的结果统计表13 各组的细胞抑制率的计算结果上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

