1.本发明涉及甲状腺球蛋白的测定方法和测定试剂。
背景技术:
2.甲状腺球蛋白(tg)是仅由甲状腺滤泡细胞制成的分子量66万的糖蛋白。生物合成的tg被释放至滤泡腔。该过程中,通过过氧化酶的作用,碘分子与tg分子中的酪氨酸基结合,进行甲状腺激素的合成。滤泡腔的tg再次被滤泡细胞摄入、在滤泡细胞内分解,引起甲状腺激素的释放。此外,该过程通过甲状腺激素(tsh)的作用而被激活。因此,在正常时,tg本身在血中的释放仅略微发生,tg的血中释放表示甲状腺的某种异常。因此,tg是器官特异性高、对甲状腺疾病极为有用的标记物。特别地,血中tg被用作甲状腺分化癌的手术评价、和知晓术后复发、转移的有无的标记物。另外,对格雷夫斯病中的治疗的效果、缓解的指标、先天性甲状腺功能低下症的病型的确定、鉴别、治疗监测等也是有用的。此外,还暗示了通过与图像诊断组合从而鉴别结节性甲状腺肿瘤的术前诊断、良性的甲状腺疾病与恶性肿瘤的可能性。
3.然而,在受试者为抗甲状腺球蛋白抗体(tgab)阳性的情况下,实际上即使是tg高值,也有时因在测定方面的问题而导致成为低值。例如,甲状腺癌中,患者的20~30%为tgab阳性,因此在tg测定时,需要同时测定tgab。此外,在tgab阳性的桥本病中,难以准确测定tg的量,同样地,在观察到tgab阳性的其他自身免疫性疾病(格雷夫斯病)中,也有可能无法准确测定tg的量。
4.为了解决该问题,本技术人首先发明了将试样用包含表面活性剂和酸化剂中任一者或两者的预处理液进行处理的方法,进行了专利申请(专利文献1)。专利文献1记载的方法是有效的,但作为免疫测定中使用的抗体,需要使用对酸化剂、表面活性剂具有耐性的物质。现有技术文献专利文献
5.专利文献1:wo 2018/047792
技术实现要素:
发明要解决的课题
6.即使是上述那样的tgab阳性的患者,如果能够准确测量tg的量,则也有可能能够广泛用于甲状腺疾病的治疗监测。本发明的目的在于,提供不受抗甲状腺球蛋白抗体的干扰的影响,在单独检查中能够更准确地测定甲状腺球蛋白量的甲状腺球蛋白的测定方法和测定试剂,上述测定方法和测定试剂能够将对酸化剂、表面活性剂耐性低的抗体用于免疫测定。用于解决问题的手段
7.本发明人等为了实现上述目的而深入研究的结果发现,在测定生物体试样中的甲
状腺球蛋白时,通过在将上述生物体试样供于免疫反应前,经由与包含碱性物质的预处理液混合的预处理工序,从而不受抗甲状腺球蛋白抗体的影响地能得到更准确的甲状腺球蛋白测定值,从而完成了本发明。
8.本发明提供了如下方案。(1)一种通过免疫测定来测定从生物体分离的试样中的甲状腺球蛋白的方法,其包括将从生物体分离的试样与包含碱性物质的预处理液混合的预处理工序。(2)根据(1)所述的方法,其中,预处理工序中的碱性物质的最终浓度为大于0.05n且0.5n以下。(3)根据(1)或(2)所述的方法,其中,所述预处理液进一步包含选自非离子型表面活性剂、两性离子型表面活性剂、阴离子型表面活性剂和脲中的至少1种。(4)一种甲状腺球蛋白的免疫测定用试剂,其具有包含碱性物质的预处理液。(5)根据(4)所述的试剂,其中,所述预处理液进一步包含选自非离子型表面活性剂、两性离子型表面活性剂、阴离子型表面活性剂和脲中的至少1种。(6)碱性物质在甲状腺球蛋白的免疫测定的预处理中的用途。(7)根据(6)所述的用途,其中,用于所述预处理的预处理液进一步包含选自非离子型表面活性剂、两性离子型表面活性剂、阴离子型表面活性剂和脲中的至少1种。(8)碱性物质在甲状腺球蛋白的免疫测定的预处理液的制造中的用途。(9)根据(8)所述的用途,其中,所述预处理液进一步包含选自非离子型表面活性剂、两性离子型表面活性剂、阴离子型表面活性剂和脲中的至少1种。发明效果
9.根据本发明,即使在含有抗甲状腺球蛋白抗体(tgab)的生物体试样中,通过使甲状腺球蛋白(tg)从tgab中游离,减少相互作用的影响,从而能够提供可以更准确地测定试样中包含的tg量的tg的测定方法和测定试剂。此外,还能够将对酸化剂、表面活性剂耐性低的抗体用于免疫测定。
具体实施方式
10.本说明书中记载的“%”的浓度在没有特别记载的情况下,是重量/体积(w/v、g/100ml)的浓度表示。
11.<甲状腺球蛋白的测定方法>本发明中测定的甲状腺球蛋白(tg)是任意的动物来源的tg,优选为哺乳动物(例如人、猴、猩猩等灵长类;小鼠、大鼠、兔等啮齿类;狗、猫等宠物动物;猪、牛等家畜;马、羊等畜力动物)来源的tg,更优选为灵长类来源的tg,特别优选为人来源的tg。
12.1.预处理工序本发明的方法是通过使生物体试样与抗体发生反应的免疫反应来测定在生物体试样中存在的tg的方法,其特征在于,在免疫反应(反应工序)前,包括基于将生物体试样与预处理液混合的预处理工序。通过预处理工序,能够设为从自身抗体(tgab)等中游离出tg的状态。预处理液包含碱性物质。
13.上述预处理工序中混合的生物体试样与预处理液的体积比优选设为1:10~10:1、特别优选是1:5~5:1、进一步优选1:3~3:1。本发明中使用的生物体试样如果是可以含有
tg的试样,则没有特别限定,可以举出例如血清、血浆、全血、尿、便、口腔粘膜、咽喉粘膜、肠道粘膜和活检试样(例如甲状腺细针穿刺抽吸细胞学检查(fine needle aspiration:fna)试样、肠道试样、肝脏试样)。优选生物体试样为血清或血浆。
14.作为上述预处理液中包含的碱性物质,可以适当使用氢氧化钠、氢氧化钾等碱金属氢氧化物、氢氧化镁等碱土金属氢氧化物等。预处理液的碱性物质的规定浓度以预处理时的最终浓度计,优选设为大于0.05n且0.5n以下、特别是0.1n以上且0.4n以下。通过将碱性物质的规定浓度设为大于0.05n且0.5n以下,可以充分得到预处理的效果,且将对后续的反应工序的影响最小化。
15.本发明中,在将包含碱性物质的预处理液与试样混合时的ph根据所添加的碱性物质而不同,例如为ph10.0以上、优选为ph11.0以上、更优选为ph12.0以上。此外,本发明中,在将包含碱性物质的预处理液与试样混合时的ph根据所添加的碱性物质而不同,例如为ph13.7以下、优选为ph13.5以下、更优选为ph13.3以下。具体而言,在将包含碱性物质的预处理液与试样混合时的ph例如为ph10.0~13.7、优选为ph11.0~13.5、更优选为ph12.0~13.3。通过将预处理工序中的ph设为这些范围,可以充分得到预处理的效果,且将对后续的反应工序的影响最小化。
16.预处理液中,可以进一步包含选自非离子型表面活性剂、两性离子型表面活性剂、阴离子型表面活性剂和脲中的至少1种,由此能够提高免疫测定的灵敏度。作为非离子表面活性剂的例子,可以举出聚氧乙烯烷基苯基醚(商品名triton x
‑
100等)和聚氧乙烯烷基醚(商品名brij 35等)等。作为两性离子型表面活性剂的例,可以举出3
‑
[(3
‑
胆酰胺丙基)二甲基氨基]丙磺酸盐(chaps)、n
‑
十二烷基
‑
n,n
‑
二甲基
‑3‑
铵
‑1‑
丙磺酸盐(c12aps)、n
‑
十四烷基
‑
n,n
‑
二甲基
‑3‑
铵
‑1‑
丙磺酸盐(c14aps)、n
‑
十六烷基
‑
n,n
‑
二甲基
‑3‑
铵
‑1‑
丙磺酸盐(c16aps)等。作为阴离子型表面活性剂,可以举出十二烷基硫酸钠(sds)、n
‑
月桂酰基肌氨酸钠(nls)、十二烷基硫酸锂、十二烷基苯磺酸钠、脱氧胆酸等。
[0017]
在预处理液包含上述表面活性剂或脲的情况下,从灵敏度提高的观点出发,非离子型表面活性剂的浓度以预处理时的最终浓度计,优选为0.01%~5%、进一步优选为0.05%~5%。两性离子型表面活性剂的最终浓度优选为0.01%~1%。阴离子表面活性剂的最终浓度优选为0.01%~2.5%。脲的最终浓度优选为0.01~0.1m。
[0018]
预处理液中,根据需要,可以包含硫脲等其他蛋白质变性剂。变性剂的浓度以处理时浓度计,优选为0.1m以上,进一步优选为0.5m以上且低于4m。此外,预处理液中,为了增强处理效果,可以添加单糖类、二糖类、柠檬酸、和柠檬酸盐类中任一者、或将它们组合添加。进一步,预处理液中,可以包含edta等螯合剂。
[0019]
预处理工序可以通过将生物体试样与预处理液仅混合,将混合液在室温下放置而进行。混合液可以加热(例如温度35℃~95℃),但在室温下进行是简便的且不耗费成本,是优选的。预处理时间优选设为1分钟以上、特别优选是3分钟以上、进一步优选为5分钟以上。预处理时间的上限并没有特别存在,可以为30分钟以下、特别是15分钟以下。预处理后,优选用盐酸等酸将碱性物质中和。
[0020]
2.反应工序本发明的方法的上述预处理工序中得到的生物体试样混合液接着供于免疫测定的反应工序。反应工序中,使生物体试样混合液与缓冲液混合,使混合液中的抗原与抗tg的
抗体反应。应予说明,对于tg的免疫测定本身,各种各样的方法是公知的,也可以采用能够定量tg的任一免疫测定。
[0021]
作为上述缓冲液,可以举出以例如mes缓冲液、磷酸盐缓冲液、tris缓冲液、碳酸缓冲液为基础的物质,特别是可以适当使用以磷酸盐缓冲液为基础的物质。在作为预处理液而使用含有表面活性剂的物质的情况下,为了吸收未反应的表面活性剂,以与预处理后的混合液混合时的最终浓度计,优选使用包含0.01~10.0%、特别是0.05~5.0%左右的例如bsa、聚乙烯基吡咯烷酮(pvp)、聚乙烯醇(pva)、葡聚糖硫酸钠等水溶性高分子的缓冲液。预处理工序的混合液与缓冲液的混合以体积比计,优选为1:10~10:1、特别是1:5~5:1、进一步1:3~3:1。
[0022]
本发明的方法中使用的抗tg的抗体是识别tg的氨基酸序列中的至少一部分作为表位的抗体。抗tg的抗体没有特别限定,可以使用识别已知的表位的抗体中任一者,优选抗tg的抗体是识别tg特异性表位(特别是人tg特异性表位)的抗体。
[0023]
抗tg的抗体可以是多克隆抗体或单克隆抗体中任一者。抗tg的抗体可以是免疫球蛋白(例如igg、igm、iga、igd、ige、igy)中的任一同型。此外,抗tg的抗体可以为全长抗体。全长抗体是指各自包含可变区和恒定区的包含重链和轻链的抗体(例如包含2个fab部分和fc部分的抗体)。此外,抗tg的抗体可以为源自这样的全长抗体的抗体片段。抗体片段是全长抗体中的一部分,可以举出例如恒定区缺失抗体(例如f(ab')2、fab'、fab、fv)。此外,抗tg的抗体也可以为单链抗体等改性抗体。
[0024]
抗tg的抗体可以使用以往公知的方法制作。例如,抗tg的抗体可以使用上述的表位作为抗原而制作。此外,识别上述那样的表位的抗tg的大量抗体是市售的,因此还可以使用这样的市售品。
[0025]
抗tg的抗体可以在固相上固相化。本说明书中,在固相上固相化的抗体有时简称为固相化抗体。作为固相,可以举出例如能够容纳或搭载液相的固相(例如板、膜、试管等支撑体、和孔板、微流路、玻璃毛细管、纳米柱、整体柱等容器)、以及能够在液相中悬浮或分散的固相(例如颗粒等固相载体)。作为固相的材料,可以举出例如玻璃、塑料、金属、和碳。作为固相的材料,此外,可以使用非磁性材料、或磁性材料,从操作的简便性等观点出发,优选为磁性材料。固相优选为固相载体,更优选为磁性固相载体,进一步更优选为磁性颗粒。作为抗体的固相化方法,可以利用以往公知的方法。作为这样的方法,可以举出例如物理吸附法、共价键法、使用亲和性物质(例如生物素、链霉亲和素)的方法、和离子键法。特定的实施方式中,抗tg的抗体是在固相上固相化的抗体,优选为在磁性的固相上固相化的抗体,更优选为在磁性颗粒上固相化的抗体。
[0026]
反应工序中,在将预处理工序的混合液与缓冲液混合后,可以使其与固相化的抗体接触,此外,也可以在缓冲液中预先加入例如在颗粒上固相化的抗体而制成颗粒液,使上述混合液与颗粒液混合。反应工序可以例如免疫凝集法、竞争法那样仅通过一次反应工序实施,也可以如夹心法那样设置二次反应工序。应予说明,在设置二次反应工序的情况下,在一次反应工序与二次反应工序之间,可以设置用于去除未反应成分的洗涤工序。
[0027]
抗tg的抗体可以被标记物质标记化。本说明书中,被标记物质标记化的抗体有时简称为标记化抗体。作为标记物质,可以举出例如酶(例如过氧化酶、碱性磷酸酶、荧光素酶、β
‑
半乳糖苷酶)、亲和性物质(例如链霉亲和素、生物素)、荧光物质或蛋白质(例如荧光
素、异硫氰酸荧光素、罗丹明、绿色荧光蛋白质、红色荧光蛋白质)、发光或吸光物质(例如虫荧光素、水母发光蛋白、吖啶鎓(
アクリジニウム
)、钌)、放射性物质(例如3h、
14
c、
32
p、
35
s、
125
i)。此外,本发明的方法中,在设为二次反应的情况下,二次反应中使用的抗体可以被这样的标记物质标记化。
[0028]
特定的实施方式中,本发明的方法中,作为二次反应中使用的抗体,包含识别与一次反应中使用的抗tg的抗体不同表位的抗tg的另一抗体。这样的另一抗体所识别的表位的详情与针对上述抗tg的抗体而详细描述的表位相同(但是,在组合使用的情况下,表位的种类不同)。通过抗tg的抗体识别的表位与通过抗tg的另一抗体识别的表位的组合没有特别限定。这样的另一抗体的使用在利用例如夹心法的情况下是优选的。
[0029]
3.检测工序本发明的方法可以进一步包括检测在反应工序中的抗tg的抗体与靶抗原(tg)的结合的工序。反应工序中,在一次反应或二次反应中使用的抗体中使用标记的情况下,可以通过适合于所使用的标记的方法、例如在使用酶标记的情况下添加酶的底物来进行检测。例如,在将碱性磷酸酶(alp)用于标记抗体的情况下,可以设为使用3
‑
(2'
‑
螺金刚烷)
‑4‑
甲氧基
‑4‑
(3'
‑
磷酰氧基)苯基
‑
1,2
‑
二氧杂环丁烷二钠盐(amppd)作为酶底物的化学发光酶免疫测定法(cleia)的体系。
[0030]
本发明的方法是使用抗tg的抗体的免疫测定。作为这样的免疫测定,可以举出例如直接竞争法、间接竞争法、和夹心法。此外,作为这样的免疫测定,可以举出例如化学发光酶免疫测定法(cleia)、化学发光免疫测定(clia)、免疫比浊法(tia)、酶免疫测定法(eia)(例如直接竞争elisa、间接竞争elisa、和夹心elisa)、放射免疫测定(ria)、胶乳凝集反应法、荧光免疫测定(fia)、和免疫色谱法。这些免疫测定本身是公知的,不需要在此详细描述,但会分别简要说明。
[0031]
直接竞争法是将针对要测定的靶抗原(本发明中为tg)的抗体在固相上固相化(针对固相和固相化,如上所述),进行用于防止非特异吸附的封闭处理(用血清白蛋白等蛋白质溶液处理固相)后,使该抗体、包含上述靶抗原的受试试样(本发明中,如上所述进行了预处理工序的生物体试样)、和一定量的标记了的抗原(标记如上所述)反应,洗涤后,对在固相上结合的标记进行定量的方法。受试试样中的抗原与标记抗原对抗体竞争性结合,因此受试试样中的抗原量越多,则在固相上结合的标记的量越少。制作各种各样的已知浓度的抗原标准液,针对各个抗原标准液,测定在固相上固定化的标记量(根据标记的性质,为吸光度、发光强度、荧光强度等,以下皆同),将抗原浓度作为横轴,将标记量作为纵轴,制作校准曲线。针对未知的受试试样,测定标记量,通过将所测定的标记量标识在校准曲线上,可以测定未知的受试试样中的抗原量。直接竞争法本身是本领域中公知的,例如在us20150166678a中所述。
[0032]
间接竞争法中,将靶抗原(本发明中为tg)在固相上固相化(针对固相和固相化,如上所述)。接着,固相的封闭处理后,将包含靶抗原的受试试样(本发明中,如上所述进行了预处理工序的生物体试样)与一定量的抗靶抗原抗体混合,使其与上述固相化抗原反应。洗涤后,对在固相上结合的上述抗靶抗原抗体进行定量。其可以通过使针对上述抗靶抗原抗体的标记了的二次抗体(标记如上所述)反应,洗涤后,测定标记量,从而进行。制作各种各样的已知浓度的抗原标准液,针对各个抗原标准液,在固相上固定化,测定标记量,制作校
准曲线。针对未知的受试试样,测定标记量,通过将所测定的标记量标识在校准曲线上,可以测定未知的受试试样中的抗原量。应予说明,也可以不使用标记二次抗体,而使用标记的一次抗体。间接竞争法本身是本领域中公知的,例如在上述us20150166678a中所述。
[0033]
夹心法之中,正向夹心法是在固相上将抗靶抗原抗体固相化(针对固相和固相化,如上所述),封闭处理后,使包含靶抗原的受试试样(本发明中,如上所述进行了预处理工序的生物体试样)反应,洗涤后,使针对靶抗原的标记了的二次抗体(标记如上所述)反应,洗涤后,对在固相上结合的标记进行定量的方法。夹心法之中,反向夹心法是使二次抗体与受试试样先反应,使通过二次抗体与靶抗原的结合而产生的抗原抗体复合物和固相化抗体(一次抗体)反应,洗涤后,对在固相上结合的标记进行定量的方法。进一步,还存在使固相化抗体、受试试样、和二次抗体同时反应的夹心法。制作各种各样的已知浓度的抗原标准液,针对各个抗原标准液,测定在固相上固定化的标记量,制作校准曲线。针对未知的受试试样,测定标记量,通过将所测定的标记量标识在校准曲线上,可以测定未知的受试试样中的抗原量。夹心法本身是本领域中公知的,例如在us 20150309016 a中所述。
[0034]
上述各种免疫测定之中,化学发光酶免疫测定法(cleia)、化学发光免疫测定(clia)、酶免疫测定法(eia)、放射免疫测定(ria)、荧光免疫测定(fia)是基于在进行上述直接竞争法、间接竞争法、夹心法等时使用的标记的种类而分类的免疫测定。化学发光酶免疫测定法(cleia)是使用酶(例如上述碱性磷酸酶)作为标记,使用产生化学发光性化合物的底物(例如上述amppd)作为底物的免疫测定。酶免疫测定法(eia)是使用酶(例如上述过氧化酶、碱性磷酸酶、荧光素酶、β
‑
半乳糖苷酶等)作为标记的免疫测定。作为各酶的底物,使用能够通过吸光度测定等而定量的化合物。例如,在过氧化酶的情况下,可以使用1,2
‑
苯二胺(opd)、3,3'5,5'
‑
四甲基联苯胺(tmb)等,在碱性磷酸酶的情况下,可以使用对硝基苯基磷酸酯(pnpp)等、在β
‑
半乳糖苷酶的情况下,可使用mg:4
‑
甲基伞形酮半乳糖苷、ng:硝基苯基半乳糖苷等,在荧光素酶的情况下,可以使用虫荧光素等。放射免疫测定(ria)是使用放射性物质作为标记的方法,作为放射性物质,如上所述可以举出3h、
14
c、
32
p、
35
s、
125
i等放射性元素。荧光免疫测定(fia)是使用荧光物质或荧光蛋白质作为标记的方法,作为荧光物质或荧光蛋白质,如上所述可以举出荧光素、异硫氰酸荧光素、罗丹明、绿色荧光蛋白质、红色荧光蛋白质等。这些使用标记的免疫测定本身是本领域中公知的,例如在us8039223b、us20150309016a中所述。
[0035]
免疫比浊法(tia)是利用通过要测定的靶抗原(本发明中为tg)与针对该抗原的抗体的抗原抗体反应而生成的抗原抗体复合物所导致的浊度增大现象的免疫测定。在抗靶抗原抗体溶液中,添加各种的已知浓度的抗原,各自测定浊度,制作校准曲线。针对未知的受试试样,同样测定浊度,通过将所测定的浊度标识在校准曲线上,可以测定未知的受试试样中的抗原量。免疫比浊法本身是公知的,例如在us20140186238a中所述。胶乳凝集法与免疫比浊法类似,是替代免疫比浊法中的抗体溶液,使用在表面上将抗靶抗原抗体固定化的胶乳颗粒的漂浮液的方法。免疫比浊法和胶乳凝集法本身是本领域中公知的,例如在us7820398b中所述。
[0036]
免疫色谱法是在滤纸、纤维素膜、玻璃纤维、无纺布等用多孔性材料形成的基体(也被称为基质、条带)上进行上述夹心法、竞争法的方法。例如,在利用夹心法的免疫色谱法的情况下,在上述基体上设置将抗靶抗原抗体固定化的检测区,将包含靶抗原的受试试
样(本发明中,如上所述进行了预处理工序的生物体试样)添加至基体上,从上游侧流动展开液,使靶抗原移动至检测区,在检测区中固定化。将经固定化的靶抗原用标记了的二次抗体进行夹心,检测在检测区中固定化的标记,从而检测受试试样中的靶抗原。通过与检测区相比在更上游侧预先形成包含标记二次抗体的标记区,靶抗原与标记二次抗体的结合体在检测区中固定化。在标记为酶的情况下,还在与检测区相比更上游侧设置包含酶的底物的底物区。在竞争法的情况下,可以例如在检测区中预先将靶抗原固定化,使受试试样中的靶抗原与在检测区中固定化的靶抗原竞争。通过在与检测区相比更靠近上游侧预先设置标记抗体区,使受试试样中的靶抗原与标记抗体反应,在检测区中固定化未反应的标记抗体,对标记进行检测或定量,从而可以对受试试样中的靶抗原进行检测或定量。免疫色谱法本身是本领域中公知的,例如在us6210898b中所述。
[0037]
<tg的测定试剂>本发明的tg的测定试剂是能够实现上述的tg的测定方法的测定试剂。本发明的测定试剂除了在通常的免疫测定中使用的构成之外,特征还在于,包含碱性物质。
[0038]
本发明的试剂在彼此隔离的形态或组合物的形态中包括各构成成分。具体而言,各构成成分可以以容纳在各自不同的容器(例如管、板)中的形态提供,也可以部分构成成分以组合物的形态(例如同一溶液中)提供。或者,本发明的试剂可以以设备的形态提供。具体而言,可以以构成成分的全部容纳在设备中的形态提供。或者,可以以构成成分中的一部分容纳在设备中的形态提供,剩余的以未容纳在设备中的形态(例如容纳在不同容器中的形态)提供。在该情况下,未容纳在设备中的构成成分在测定靶标物质时,可以通过注入设备中而使用。
[0039]
优选的实施方式中,本发明的试剂可以具有与要采用的免疫测定的种类相应的构成。例如,在采用夹心法的情况下,本发明的试剂作为必须的构成成分,可以包含i)预处理液、ii)抗tg的抗体、iii)缓冲液、以及作为任选的构成成分的、iv)抗tg的另一抗体、v)标记物质、vi)稀释液、和根据需要的、vii)与标记物质反应的底物。ii)和iii)的构成成分可以包含在同一溶液中。iv)的构成成分可以被v)标记物质标记化。优选抗tg的抗体可以在磁性颗粒上固相化。实施例
[0040]
<实施例1碱化预处理的效果确认试验>(1)抗甲状腺球蛋白抗体板的制作在聚苯乙烯制96穴微孔板(thermo f16 black maxisorp)中,分别以100μl/孔注入包含2μg/ml的小鼠抗人tg抗体64
‑
1(fujirebio公司制)的抗体稀释液(0.1m碳酸氢钠、0.1m氯化钠、ph9.6),在4℃下培育一晚。将微孔板用pbs洗涤3次,接着,以350μl/孔分别注入封闭液(1.0%bsa、3%蔗糖、pbs),在室温下进行3小时培育。去除封闭液后,使板真空干燥,制成抗tg的抗体板。
[0041]
(2)碱性磷酸酶标记小鼠抗人tg单克隆抗体的制作将小鼠抗人tg抗体5e6(abd serotec公司制)按照常规方法进行酶标记,制备碱性磷酸酶标记小鼠抗人tg单克隆抗体(标记抗体)。将标记抗体用抗体稀释液(0.02m kh2po4、0.076m k2po4、0.25m nacl、1%pvp、1%bsa、0.05%酪蛋白na、0.05%tween20(商品名、ph7.0))以达到0.5μl/ml的方式稀释,制备标记抗体液。
[0042]
(3)样本制备在购入正常人血清(tg浓度10ng/ml)中,以达到0μg/ml(阴性对照)、1.0μg/ml、10μg/ml的方式添加人tg(no.ab96518、abcam公司制),制成模型样本。向各模型样本中,以达到50μg/ml的方式添加抗tg的抗体64
‑
1,制成自身抗体阳性模型样本。针对未添加抗tg抗体的tg阳性样本,制成自身抗体阴性模型样本。
[0043]
(4)样本预处理将样本各30μl与预处理液(0.2m naoh)50μl混合,在室温下静置10分钟。接着,添加中和液(0.2m hcl 50μl)而中和(有预处理的样本)。同时,针对相同的样本各30μl,与0.2m nacl溶液50μl混合,在室温下静置10分钟后,与50μl的纯水混合(无预处理的样本)。
[0044]
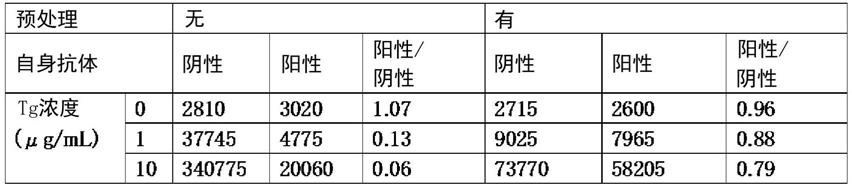
(5)tg测定向(1)中制备的抗tg抗体板的各孔中,分别注入一次反应液(0.02m kh2po4、0.076m k2hpo4、0.25m nacl、0.02m edta2na、1%pvp、1%bsa、0.05%酪蛋白na、0.05%tween20(商品名、ph7.3))各100μl,接着,向各孔中添加上述的有预处理的样本或无预处理样本100μl。在室温下静置60分钟后,用洗涤液(0.05%tween20(商品名)、pbs)洗涤5次。在各孔中分别注入标记抗体液各100μl,在室温下静置30分钟后,用洗涤液(0.05%tween20(商品名)、pbs)洗涤5次。在各孔中分别注入amppd底物液(lumipulse底物液(fujirebio公司制))各100μl,使其发光10分钟,通过酶标仪,测定波长477nm的发光量。将各条件下的发光量(计数)示于表1。
[0045]
【表1】
[0046]
将自身抗体阴性模型样本与阳性模型样本进行比较,如果在无预处理的条件下进行tg的检测,则阳性模型样本的计数为阴性模型样本的1成左右,确认到因自身抗体的影响而导致信号显著降低。另一方面,在有预处理的条件下,因碱的影响,整体的计数值降低,但阳性模型样本的计数恢复至阴性模型样本的8~9成左右,显示出即使在样本中存在自身抗体,也能够与无自身抗体的样本几乎同等地测定tg。
[0047]
<实施例2各种表面活性剂
·
变性剂添加效果试验>针对实施例1的自身抗体阳性模型样本,向预处理液中以预处理时的浓度达到表2中示出的浓度的方式添加各种表面活性剂(非离子型表面活性剂(triton x
‑
100、brij 35)、两性离子型表面活性剂(chaps、c12aps、c14aps)、阴离子型表面活性剂(sds、nls))或变性剂(脲),除此之外,通过与实施例1相同的方法,进行tg的测定。各条件下的测定时,也同时测定用不含表面活性剂
·
变性剂的预处理液进行预处理的样本。各条件下的测定计数示于表2。
[0048]
【表2
‑
1】
[0049]
【表2
‑
2】
[0050]
【表2
‑
3】
[0051]
【表2
‑
4】
[0052]
【表2
‑
5】
[0053]
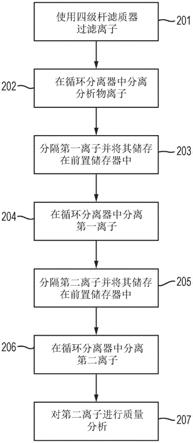
【表2
‑
6】
[0054]
【表2
‑
7】
[0055]
【表2
‑
8】
[0056]
根据表2,示出除了碱处理之外,还以适当浓度添加非离子型表面活性剂、两性离子型表面活性剂、阴离子型表面活性剂或脲,由此能够提高tg的信号。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。