脉络丛类器官及其产生方法
发明领域
1.本发明涉及脉络丛类器官,特别是包含紧密上皮屏障并且能够产生脑脊液样液体的脉络丛类器官。本发明还涉及产生脉络丛类器官的方法。
背景技术:
2.脉络丛是脑中高度保守且研究不足的分泌组织。这种组织在人体内与我们的脑部大小成比例地扩大,并在脑中显示出许多重要功能,如形成保护性上皮屏障和分泌脑脊液(csf)(1)。
3.在解剖学上,脉络丛位于每个相应腔中出现的侧脑室、第三脑室和第四脑室。成熟的脉络丛由如下构成:单个立方形上皮,其包围间质来源的基质组织核心和有孔毛细血管。上皮细胞通过紧密连接接近地连接,并且高度极化,其中顶端刷状边缘面向脑室腔,且基面位于基质侧上。
4.脉络丛的高度极化的分泌上皮在脑中显示出许多重要功能,如形成保护性上皮屏障和分泌csf。
5.csf对于维持脑中营养物质的生理水平、对于信号传导分子和生长因子的运输以及对于其在颅内压调节方面的保护作用非常重要。csf是一种透明、无色的流体,其通过脑室和蛛网膜下腔循环,然后通过蛛网膜粒部分地重吸收到血液循环中(2
–
4)。
6.csf是由脉络丛上皮细胞的活性分泌产生的,这使其顶端刷状边缘中的转运蛋白和泵的数量最大化;并且是由上皮细胞内紧密连接的存在所允许的血液过滤产生的。脉络丛在维持csf的产生和重吸收速率方面起着关键作用。这种平衡的失调会导致如脑积水的病状。
7.csf的产生涉及不同的机制。首先,位于脉络丛上皮细胞顶面上的na
‑
k
atp酶泵和胞质碳酸酐酶产生渗透梯度,所述渗透梯度主要由na
分泌到脑室腔中驱动。这种渗透力驱动跨细胞的水通过水通道蛋白通道流入。其次,atp结合盒(abc)蛋白和溶质载体转运蛋白(slc)分别允许在需要和不需要atp水解的情况下交换氨基酸、核苷和小肽。脉络丛上皮细胞也表达外排转运蛋白,如mrp1和mrp4。这些泵调节代谢物的清除,并防止药物和有毒化合物进入,由此减少它们在csf中的可用性。第三,脉络丛上皮细胞的高度特化和扩张的分泌系统使得能够分泌更复杂的蛋白质和激素。例如,甲状腺激素和视黄醇的载体甲状腺素转运蛋白(ttr)是由脉络丛合成和分泌的最丰富的蛋白质(li,x.和buxbaum,j.n.(2011)mol.neurodegener.6:1
‑
17;richardson,s.j.等人(2015)front.neurosci.9:1
‑
8;johnson,b.a.等人(2018)fluids barriers cns 15:22)。ttr介导的甲状腺激素向csf的递送显现在脑发育的调节方面具有重要作用。
8.脉络丛紧密密封的上皮也称为血液
‑
csf屏障(b
‑
csf
‑
b)。b
‑
csf
‑
b类似于血脑屏障(bbb),阻止循环中的有毒物质或信号到达脑部。然而,与bbb不同的是,b
‑
csf
‑
b是由单一细胞类型脉络丛上皮细胞形成的,并且它直接面对csf而不是脑实质(5,6)。然而,由于csf可以自由进入脑部,分子通过b
‑
csf
‑
b的运输是进入脑部的替代途径。
9.对人类脉络丛发育知之甚少。脉络丛的发育经历了一系列阶段,从假复层上皮到柱状上皮,再到最后阶段为高度折叠的立方形上皮,具有微绒毛和位于基底的细胞核。在背侧端脑中,妊娠7周左右,局部bmp信号传导梯度驱动脉络丛从神经上皮发育,所述神经上皮开始向脑室腔延伸。通过建立局部阈值,bmp分泌的信号逐渐确定脉络丛上皮和邻近的皮质边缘,所述皮质边缘是发育出海马原基的无翅基因相关(wnt)信号传导中心。
10.对脉络丛模式形成的研究已在体外进行。在过去的十年里,3d培养系统(如大脑类器官)的重大进展使得人类发育生物学有了根本性的发现(7
–
12)。
11.然而,迄今为止产生的诱导的脉络丛细胞没有显示出与体内脉络丛展现相同的复杂结构,也没有显示出它们在产生csf方面的功能。
12.因此,在本领域中仍非常需要建立脉络丛的功能模型。脉络丛是药物进入cns的重要入口;然而,人们对b
‑
csf
‑
b的调节和渗透性以及如何利用它作为工具来提高某些药物在脑中的可用性知之甚少。脉络丛功能模型的研究可能有助于这方面的理解,特别是用于测定候选药物穿过b
‑
csf
‑
b和/或bbb的能力。
技术实现要素:
13.诸位发明人已建立了一种使用信号传导分子的组合来产生脉络丛类器官的方案。
14.所述类器官(以下可以称为“chp类器官”)具有选择性上皮屏障,其在自含式隔室中分泌csf样流体,很像脑室的csf。由单细胞rna测序表征chp类器官揭示了上皮和基质chp群体的存在。对类器官csf样流体的蛋白质组分析揭示了人类特异性发育因子,以及疾病相关的生物标记物。最后,使用nmr,诸位发明人表明,这种体外屏障对小分子的选择性与体内屏障相同,并且chp
‑
csf类器官可以预测新化合物的cns渗透性。
15.因此,由诸位发明人的方案提供的类器官重演了脉络丛的基本功能,即分泌和形成紧密的上皮屏障。诸位发明人确定,由他们的方案提供的类器官可靠且可重现地发育具有极化细胞的脉络丛上皮,所述极化细胞在类器官内主动分泌具有非常类似于脑脊液(csf)特性的流体。
16.此外,诸位发明人使用组织学和电子显微镜(em)分析发现了位于脉络丛类器官上皮的顶端刷状边缘上的脉络丛特异性水通道和转运蛋白的存在。发现这些组织显示出形成上皮屏障的紧密连接,并且诸位发明人观察到从类器官突出的大的由流体填充的包囊形成,通过质谱分析,所述包囊的内容物高度类似于人胚胎csf。
17.本发明提供了一种工具来研究例如脉络丛功能,csf产生,以及化合物、肽和血清衍生蛋白通过csf进入人脑的渗透性。
18.因此,在一个方面,本发明提供了一种脉络丛类器官,其包含:(a)包含紧密上皮屏障的上皮;和/或(b)一个或多个被上皮包围的包囊。
19.在一些实施方案中,脉络丛类器官包含含有紧密上皮屏障的上皮。在一些实施方案中,脉络丛类器官包含一个或多个被上皮包围的包囊。在优选实施方案中,脉络丛类器官包含含有紧密上皮屏障的上皮,和一个或多个被上皮包围的包囊。
20.在优选实施方案中,上皮是立方形上皮。
21.在一些实施方案中,脉络丛类器官进一步包含(c)基质细胞群体。
22.在一些实施方案中,脉络丛类器官具有侧脑室特征。
23.在优选实施方案中,脉络丛类器官呈lum 、dcn 和dlk1 。
24.在一些实施方案中,脉络丛类器官呈ttr 、mrp1 、aqp1 和/或zo1 。在优选实施方案中,脉络丛类器官呈ttr 、mrp1 、aqp1 和zo1 。
25.在其他实施方案中,脉络丛类器官呈ttr 、mrp1 、mrp4 、aqp1 和/或zo1 。在其他实施方案中,脉络丛类器官呈ttr 、mrp1 、mrp4 、aqp1 和zo1 。
26.在一些实施方案中,脉络丛类器官包含至少50%的ttr 组织。在一些实施方案中,脉络丛类器官包含至少60%的ttr 组织。在一些实施方案中,脉络丛类器官包含至少70%的ttr 组织。在一些实施方案中,脉络丛类器官包含至少80%的ttr 组织。在一些实施方案中,脉络丛类器官包含至少90%的ttr 组织。
27.在一些实施方案中,上皮呈ttr 、mrp1 、aqp1 和/或zo1 。在优选实施方案中,上皮呈ttr 、mrp1 、aqp1 和zo1 。
28.在一些实施方案中,上皮呈mrp4 。
29.在一些实施方案中,ttr在上皮的顶面上富集。在一些实施方案中,aqp1在上皮的顶面上富集。在一些实施方案中,zo1在上皮的顶面上富集。
30.在一些实施方案中,ttr和aqp1在上皮的顶面上富集。在一些实施方案中,ttr、aqp1和zo1在上皮的顶面上富集。
31.在一些实施方案中,mrp1在上皮的顶面和基底面上富集。
32.在一些实施方案中,mrp4在上皮的顶面和基底面上富集。
33.标记物在某个区域(例如细胞)中的富集可能意味着与其他区域(例如所有其他区域)相比,所述标记物在该区域中存在的丰度更大。所述标记物可能在其他区域(例如所有其他区域)中基本上不存在。
34.在一些实施方案中,脉络丛类器官呈foxg1
‑
。
35.在一些实施方案中,上皮包含顶端微绒毛。
36.在一些实施方案中,上皮包含位于中央基底的细胞核。
37.在一些实施方案中,上皮是顶端
‑
基底极化的。
38.在一些实施方案中,上皮被极化,并且aqp1和zo1在上皮的腔侧上表达。
39.在一些实施方案中,lat
‑
1在上皮的顶面上表达。
40.在一些实施方案中,上皮富含参与营养物质转运的特定转运蛋白,例如slc23a2(维生素c)和/或slc46a2(叶酸)。在一些实施方案中,脉络丛类器官能够分泌包含一种或多种选自以下的蛋白质的液体:甲状腺素转运蛋白(ttr)、簇集素(clu)、载脂蛋白e(apoe)、载脂蛋白a4(apoa4)和基膜聚糖(lum)。
41.在一些实施方案中,液体包含磷脂转移蛋白(pltp)。
42.在一些实施方案中,液体包含甲胎蛋白(afp)。
43.在一些实施方案中,脉络丛类器官能够分泌脑脊液(csf)样流体。
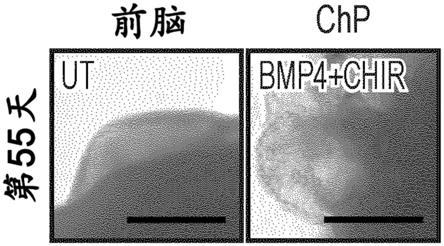
44.在一些实施方案中,脉络丛类器官能够分泌脑脊液(csf)。
45.在优选实施方案中,包囊包含液体。在优选实施方案中,液体包含一种或多种选自甲状腺素转运蛋白(ttr)、簇集素(clu)、载脂蛋白e(apoe)、载脂蛋白a4(apoa4)和基膜聚糖(lum)的蛋白质。在一些实施方案中,液体是csf。
46.在一些实施方案中,液体包含甲胎蛋白(afp)。
47.在一些实施方案中,液体包含发育特异性csf蛋白,例如胰岛素样生长因子2(igf2)、igfbp7和/或卵泡抑素样蛋白1(fstl1)。
48.在一些实施方案中,脉络丛类器官包含少于25%、20%、15%、10%、5%、4%、3%、2%或1%(v/v)的前脑神经元组织。在一些实施方案中,脉络丛类器官基本上不包含前脑神经元组织。
49.在一些实施方案中,脉络丛类器官包含少于25%、20%、15%、10%、5%、4%、3%、2%或1%(v/v)的foxg1 组织。在一些实施方案中,脉络丛类器官基本上不包含foxg1 组织。
50.在一些实施方案中,脉络丛类器官包含细胞外基质(ecm)。
51.在一些实施方案中,脉络丛类器官具有初级纤毛(例如具有位于顶部的微绒毛),细胞间的紧密连接、多囊体和细胞外囊泡。
52.在一些实施方案中,脉络丛类器官是人类或小鼠类器官,优选人类类器官。
53.在一些实施方案中,脉络丛类器官可通过本发明的方法获得。
54.在一些实施方案中,脉络丛类器官由干细胞(任选胚胎干细胞或诱导多能干细胞)产生。
55.在另一方面,本发明提供了wnt途径激活剂和骨形态发生蛋白(bmp)信号传导途径激活剂用于产生脉络丛类器官的用途,其中脉络丛类器官包含(a)包含紧密上皮屏障的上皮;和/或(b)一个或多个被上皮包围的包囊。
56.尽管先前有使用bmp4和/或chir的报道(参见(15)和(16)),但这些早期出版物没有产生具有本文所述真实特征的chp类器官。
57.在另一方面,本发明提供了一种用于产生脉络丛类器官的方法,其包括将神经上皮细胞群体与wnt途径激活剂和骨形态发生蛋白(bmp)信号传导途径激活剂接触,其中脉络丛类器官包含:(a)包含紧密上皮屏障的上皮;和/或(b)一个或多个被上皮包围的包囊。
58.所述方法可以在有或没有纤维微折叠的情况下进行。没有微折叠可能是优选的。
59.在另一方面,本发明提供了一种用于产生脉络丛类器官的方法,其包括从干细胞群体产生神经上皮细胞群体,并在wnt途径激活剂和骨形态发生蛋白(bmp)信号传导途径激活剂的存在下培养神经上皮细胞群体。
60.在优选实施方案中,神经上皮细胞群体是神经上皮细胞的聚集体。
61.在优选实施方案中,脉络丛类器官包含:(a)包含紧密上皮屏障的上皮;和/或(b)一个或多个被上皮包围的包囊。
62.在一些实施方案中,干细胞是胚胎干细胞。在一些实施方案中,干细胞是诱导多能干细胞。
63.在一些实施方案中,在开始培养干细胞群体后少于18天(例如在约8
‑
12天之间),开始在wnt途径激活剂和bmp信号传导途径激活剂的存在下培养神经上皮细胞群体。在一些实施方案中,在开始培养干细胞群体后约9
‑
11天,开始在wnt途径激活剂和bmp信号传导途径激活剂的存在下培养神经上皮细胞群体。在一些实施方案中,在开始培养干细胞群体后约9.5
‑
10.5天,开始在wnt途径激活剂和bmp信号传导途径激活剂的存在下培养神经上皮细胞群体。在一些实施方案中,在开始培养干细胞群体后约10天,开始在wnt途径激活剂和bmp信号传导途径激活剂的存在下培养神经上皮细胞群体。
64.在另一方面,本发明提供了一种用于产生脉络丛类器官的方法,其包括以下步骤:
65.(a)通过培养干细胞群体产生胚状体群体;
66.(b)在适合于神经诱导的条件下培养所述胚状体群体;
67.(c)将步骤(b)的产物包埋在三维基质中,优选细胞外基质(ecm);
68.(d)在wnt途径激活剂和骨形态发生蛋白(bmp)信号传导途径激活剂的存在下培养步骤(c)的产物,优选地其中步骤(d)在步骤(a)开始后约8
‑
12天开始。
69.在一些实施方案中,干细胞是胚胎干细胞。在一些实施方案中,干细胞是诱导多能干细胞。
70.在一些实施方案中,步骤(a)的培养持续约4
‑
6天,优选约4.5
‑
5.5天,优选约5天。
71.在优选实施方案中,进行步骤(b)的培养,直到存在神经上皮。在一些实施方案中,步骤(b)的培养持续约1
‑
3天,优选约1.5
‑
2.5天,优选约2天。
72.在一些实施方案中,ecm是聚合ecm。在一些实施方案中,ecm是聚合ecm凝胶。在一些实施方案中,ecm是基质胶(matrigel)。
73.因此,在一些实施方案中,在开始培养后约5
‑
9天,更优选6
‑
8天,最优选7天,使用基质胶进行步骤(c)。
74.在一些实施方案中,步骤(c)进一步包括培养包埋的胚状体。在一些实施方案中,步骤(c)的培养持续约2
‑
4天,优选约2.5
‑
3.5天,优选约3天。
75.在一些实施方案中,在开始步骤(a)后约9
‑
11天,优选约9.5
‑
10.5天,优选约10天开始步骤(d)。
76.在一些实施方案中,在wnt途径激活剂和bmp信号传导途径激活剂的存在下的培养持续约6
‑
8天,优选约6.5
‑
7.5天,优选约7天。
77.在优选实施方案中,步骤(d)的培养包括搅拌。
78.在一些实施方案中,在与wnt途径激活剂和bmp信号传导途径激活剂接触期间不施加搅拌。在一些实施方案中,搅拌在约第15天开始。
79.在一些实施方案中,所述方法包括从第15天开始每3
‑
4天用培养基向培养物进料,任选地其中从第30天开始向培养基中添加ecm。优选地,ecm是可溶性ecm
‑
例如溶解的基质胶。
80.在优选实施方案中,所述方法是体外方法。
81.在一些实施方案中,wnt途径激活剂选自chir99021、wnt1、wnt2、wnt3、wnt3a、wnt8a、wnt8b、wnt10a、wnt10b、bml
‑
284、6
‑
溴靛玉红
‑
3'
‑
肟(bio)、way
‑
316606、iq1、qs11、sb
‑
216763、ly2090314、dca、2
‑
氨基
‑4‑
[3,4
‑
(亚甲二氧基)苄基
‑
氨基]
‑6‑
(3
‑
甲氧基苯基)嘧啶和锂。
[0082]
在优选实施方案中,wnt途径激活剂是chir99021。
[0083]
在一些实施方案中,bmp信号传导途径激活剂选自bmp4、bmp2、bmp3、bmp5、bmp6、bmp7、bmp8a、bmp8b、bmp10、bmp11、bmp15、异甘草素、4'
‑
羟基查尔酮、芹菜素、香叶木素和ventromorphins(例如sj000291942、sj000063181和/或sj00037178)。
[0084]
在优选实施方案中,bmp信号传导途径激活剂是bmp4。
[0085]
在优选实施方案中,wnt途径激活剂是chir99021,并且bmp信号传导途径激活剂是bmp4。
[0086]
在一些实施方案中,所述方法或用途不包括使细胞与wnt途径抑制剂接触。
[0087]
在一些实施方案中,所述方法或用途不包括将细胞暴露于高氧分压,例如大于空气中氧分压(20%)的氧分压。在一些实施方案中,所述方法或用途包括仅在小于或等于20%的氧分压下进行培养。
[0088]
如上所解释,作为其选择性屏障功能的一部分,chp上皮对小分子(包括治疗剂)也具有高度选择性。本发明在研究和筛选cns活性药物方面具有特别的效用。
[0089]
新药常常在因缺乏疗效、无法进入cns或动物模型之间的可转化性有限而失败之前进入临床试验(52)。
[0090]
本发明的chp类器官在例如临床前测试和建模体内药物到cns中的渗透性中具有实用性,这与目前的cns渗透性临床前测定标准(例如犬类mdck或caco
‑
2细胞,或基于缺乏转运蛋白和载体蛋白的磷脂混合物的人工膜测定(53))相比可能具有益处。
[0091]
在另一方面,本发明提供了本发明的脉络丛类器官用于药物发现筛选或测定药物毒性的用途。所述药物可以是cns药物,例如如用于神经退行性疾病(如阿尔茨海默病)的小分子药物。
[0092]
在一些实施方案中,所述用途用于测试候选药剂穿过和/或选择性穿过血液
‑
脑脊液(csf)屏障的能力。在另一方面,本发明提供了一种用于测试候选药剂穿过血液
‑
脑脊液(csf)屏障的能力的方法,其包括使本发明的脉络丛类器官与候选药剂接触,并确定候选药剂是否穿过上皮。
附图说明
[0093]
图1.从人psc产生脉络丛类器官。(a)示出h9类器官生长阶段不同图像的方案时间线。在所述方案的第10天添加bmp4和wnt激活剂chir,以促进背化。比例尺:1000μm。(b)第55天h1处理的脉络丛(chp)类器官与未处理(ut)的前脑类器官的比较。比例尺:1mm。(c)第40天h1前脑和脉络丛类器官的h&e染色切片。比例尺:500μm。(d)e18.5小鼠胚胎脑的组织切片(h&e染色)、受孕后15周的人类胎儿chp(尼氏染色,取自allen brain map http://portal.brain
‑
map.org/)、第40天h1人chp类器官(h&e染色)。比例尺:500μm,放大:50μm。(e)、(f)在第28天(e)和第39天(f),经针对ttr(灰色,抗绵羊alexafluor 647)、zo1(绿色,抗小鼠alexafluor 488)和sox2(品红色,抗兔alexafluor 568)染色的imr90
‑
4 ipsc衍生前脑和chp类器官的代表性共聚焦图像。蓝色的细胞核是经dapi染色的。比例尺:100μm。(g)在n=4个独立的h9批次中,ttr阳性面积占总类器官面积百分比的定量(在第30、40、48天每批次收集3
‑
4个类器官)。
[0094]
图2.类器官再现了人脉络丛的组织学特征。(a)在第40天,对ttr(红色,抗绵羊alexafluor 568)、clic6(绿色,抗兔alexafluor 488)和zo1(灰色,抗小鼠alexafluor 647)染色呈阳性的h1类器官的chp上皮的代表性共聚焦图像。比例尺:50μm。(b)进行ttr、foxg1、clic6和内源性对照gapdh探测的未处理(ut)以及bmp4和chir处理的chp类器官的免疫印迹(在第75、73和68天收集的n=3个独立的h9批次)。(c)免疫印迹定量显示在chp处理的类器官中的ttr和clic6富集。(d)在第30天和第46天,经针对krt18(绿色,抗小鼠alexafluor 488)、5ht
‑
2c(品红色,抗兔alexafluor 568)、ph3(灰色,抗大鼠alexafluor 647)染色和dapi(蓝色)染色的h1类器官的代表性共聚焦图像。比例尺:50μm。(e)对ttr(品
红色)和dlk1(绿色,抗兔alexafluor 488)染色呈阳性的类器官的chp上皮和基质组织的共聚焦图像。比例尺:100μm。(f)示出由所有组合样品(在第55天收集的端脑类器官,在第27、46和53天收集的chp类器官)的scrnaseq鉴定的群体结构的umap。(g)与端脑类器官相比,示出在经处理的类器官中chp群体中逐渐富集的umap。(h)示出参与chp发育和成熟的基因(clic6、hrt2c、msx1、pax6)、皮质神经元标记物dcx和基质标记物col1a1在经鉴定的scrnaseq聚类中富集的umap。(i)示出由scrnaseq分析鉴定的chp未成熟/hem(otx2、rspo3、pax6)、成熟(ttr、krt18、ca2、nme5、kcnj13、ca12)和基质标记物(lum、dcn、dlk1)的表达水平的小提琴图。
[0095]
图3.脉络丛类器官发育特化的上皮特征,并密切地重演了人体内组织的遗传结构。(a)通过scrna
‑
seq得出的e18.5小鼠胚胎全chp和经分离的chp上皮细胞(ec)与类器官聚类的pca。(b)体内人样品与类器官聚类的pearson相关性分析。(c)示出类器官与体内人样品的无偏聚类的彩色编码热图。(d)小鼠、人和类器官样品的pearson相关性分析。(e)示出由scrnaseq鉴定的类器官细胞群体中dynlrb2、foxj1和aqp1表达的小提琴图。(f)分别在第40天和第46天,经针对ccdc67(绿色,抗兔alexafluor 488)、ttr(灰色,抗绵羊alexafuor 647)、foxj1(品红色,抗小鼠alexafluor 568)、arl13b(绿色,抗兔alexafluor 488)染色和dapi(蓝色)染色的h1 chp类器官的共聚焦图像。比例尺:50μm和100μm(放大:20μm)。(g)示出来自类器官的chp上皮顶面上的大量微绒毛的电子显微镜图像。箭头表示纤毛(c)、紧密连接(tj)、多囊体(mvb)和细胞外囊泡(ex)。比例尺:1μm。(h)在第40天,对aqp1(品红色,抗兔alexafluor 568)和ttr(绿色,抗绵羊alexafluor 488)染色呈阳性的h1 chp类器官以及来自小鼠胚胎(e18.5)的体内chp的共聚焦图像,蓝色的细胞核是经dapi染色的。比例尺:50μm。(i)示出由scrnaseq鉴定的类器官细胞聚类中apoe、clu、pltp表达水平的小提琴图。(j)在第30天和第46天,经针对脂滴(lipidtox,灰色)、ttr(品红色,抗绵羊alexafluor 568)、ph3(绿色,抗大鼠alexafluor 488)染色和dapi(蓝色)染色的h1类器官的代表性共聚焦图像。比例尺:50μm。(k)示出侧脑室(lv,ly6e)、第三脑室(3v,ins)和第四脑室(4v,penk)的局部chp标记物表达水平的小提琴图。
[0096]
图4.脉络丛类器官发育流体填充的隔室并形成紧密屏障。(a)示出由scrnaseq鉴定的类器官细胞聚类中密封蛋白(claudin)1、3和5表达水平的小提琴图。(b)示出不同类器官群体和在chp未成熟和成熟聚类中的紧密连接蛋白富集的umap。紧密连接蛋白tjp1和tjp2、闭合蛋白(ocln)、inadl和mpdz的可视化。(c)在第40天,对ttr(品红色,抗绵羊alexafluor 568)、密封蛋白1(绿色,抗兔alexafluor 488)(d),密封蛋白3(绿色,抗兔alexafluor 488)(e),密封蛋白4(红色,抗小鼠alexafluor 568)和密封蛋白5(绿色,抗兔alexafluor 488)(f)染色呈阳性的人h1 chp类器官的代表性图像。蓝色的细胞核用dapi标记。比例尺:50μm。(d)未处理的前脑类器官和发育流体填充的隔室的chp类器官的代表性明视场图像。比例尺:1cm。发育自含式流体隔室的chp类器官的放大明视场图像。比例尺:1mm。(e)对zo1(灰色,抗小鼠alexafluor 647)、ttr(绿色,抗绵羊488)、aqp1(红色,抗兔alexafluor 568)染色呈阳性的包围类器官流体填充隔室的上皮的共聚焦图像。细胞核用dapi标记为蓝色。比例尺:50μm。
[0097]
图5.人发育蛋白由脉络丛类器官分泌。(a)从至少2个类器官批次的icsf中检测到的蛋白质的gprofiler分析,其示出go类细胞组分(go:cc)、分子功能(go:mf)和生物过程
(“comprised of”)与“包括”(“including”或“includes”);或者“含有”(“containing”或“contains”)同义,并且是包含性的或开放式的,并且不排除额外的、未引用的构件、元件或步骤。术语“包含”(“comprising”、“comprises”)和“由
……
构成”(“comprised of”)也包括术语“由
……
组成”。
[0109]
类器官
[0110]
类器官是三维(3d)体外细胞培养物。类器官可以提供器官的小型化和简化版本,其并入了器官的一些关键特征。这些体外培养系统可以含有自我更新的干细胞群体,所述干细胞群体分化成多个器官特异性细胞类型,其空间组织类似于器官。
[0111]
脉络丛
[0112]
脉络丛是脑中高度保守的分泌组织,其显示出许多重要功能,如形成保护性上皮屏障和分泌脑脊液(csf)。
[0113]
在解剖学上,脉络丛位于每个相应腔中出现的侧脑室、第三脑室和第四脑室。成熟的脉络丛由如下构成:单个立方形上皮,其包围间质来源的基质组织核心和有孔毛细血管。上皮细胞通过紧密连接接近地连接,并且高度极化,其中顶端刷状边缘面向脑室腔,且基面位于基质侧上。
[0114]
csf的产生涉及不同的机制。首先,位于脉络丛上皮细胞顶面上的na
‑
k
atp酶泵和胞质碳酸酐酶产生渗透梯度,所述渗透梯度主要由na
分泌到脑室腔中驱动。这种渗透力驱动跨细胞的水通过水通道蛋白通道流入。其次,atp结合盒(abc)蛋白和溶质载体转运蛋白(slc)分别允许在需要和不需要atp水解的情况下交换氨基酸、核苷和小肽。脉络丛上皮细胞也表达外排转运蛋白,如mrp1和mrp4(redzic,z.(2011)fluids barriers cns 8:3;strazielle,n.和ghersi
‑
egea,j.f.(2013)mol.pharm.10:1473
‑
1491)。这些泵调节代谢物的清除,并防止药物和有毒化合物进入,由此减少它们在csf中的可用性。第三,脉络丛上皮细胞的高度特化和扩张的分泌系统使得能够分泌更复杂的蛋白质和激素。例如,甲状腺激素和视黄醇的载体甲状腺素转运蛋白(ttr)是由脉络丛合成和分泌的最丰富的蛋白质(li,x.和buxbaum,j.n.(2011)mol.neurodegener.6:1
‑
17;richardson,s.j.等人(2015)front.neurosci.9:1
‑
8;johnson,b.a.等人(2018)fluids barriers cns 15:22)。ttr介导的甲状腺激素向csf的递送显现在脑发育的调节方面具有重要作用。
[0115]
脉络丛组织可以由脉络丛标记物的表达和/或组织的结构特征来鉴定。
[0116]
脉络丛的特征可以是一种或多种选自甲状腺素转运蛋白(ttr)、mrp1、mrp4、水通道蛋白1(aqp1)和闭锁小带(zo1)的标记物的表达。
[0117]
脉络丛的特征可以是在某些类型的细胞中定位或富集的标记物的表达。例如,脉络丛的特征可以是一种或多种选自ttr、mrp1、mrp4、aqp1和zo1的标记物在上皮细胞中的表达。
[0118]
此外,标记物可以在某些细胞的某些区域中定位或富集。例如,ttr、aqp1和/或zo1可以在上皮的顶面上富集。mrp1和/或mrp4可以在上皮的顶面和基底面上富集。
[0119]
脉络丛的特征可以是foxg1的缺失或低表达。
[0120]
脉络丛的特征可以是上皮中存在顶端微绒毛。脉络丛上皮可以包含位于中央基底的细胞核。
[0121]
脉络丛上皮可以是顶端
‑
基底极化的。例如,上皮可以被极化,其中aqp1和zo1在上
皮的腔侧上表达。
[0122]
技术人员可以容易地确定此类标记物的存在、缺失和定位。例如,可以通过使用对标记物特异的抗体进行免疫染色来鉴定标记物,例如结合如共聚焦显微镜的可视化技术。此外,或者替代地,可以采用优选地结合到标记物核酸的特异性寡核苷酸探针。
[0123]
紧密上皮屏障
[0124]
紧密上皮屏障可以由上皮细胞之间的紧密连接形成。
[0125]
紧密连接(也称为闭合连接或闭锁小带)可以由多蛋白复合物形成,并且可以封闭细胞旁途径,并防止运输的溶质和水泄漏。
[0126]
脉络丛紧密密封的上皮也称为血液
‑
csf屏障(b
‑
csf
‑
b)。b
‑
csf
‑
b类似于血脑屏障(bbb),阻止循环中的有毒物质或信号到达脑部。然而,与bbb不同的是,b
‑
csf
‑
b是由单一细胞类型脉络丛上皮细胞形成的,并且它直接面对csf而不是脑实质。然而,由于csf可以自由进入脑部,分子通过b
‑
csf
‑
b的运输是进入脑部的替代途径。
[0127]
如在紧密上皮屏障中包含的紧密连接的特征可以是闭锁小带(zo1)的表达。
[0128]
脑脊液(csf)
[0129]
脑脊液(csf)是一种透明、无色的流体,其通过脑室和蛛网膜下腔循环,然后通过蛛网膜粒部分地重吸收到血液循环中。
[0130]
csf对于维持脑中营养物质的生理水平、对于信号传导分子和生长因子的运输以及对于其在颅内压调节方面的保护作用非常重要。
[0131]
csf是由脉络丛上皮细胞的活性分泌产生的,这使其顶端刷状边缘中的转运蛋白和泵的数量最大化;并且是由脉络丛上皮细胞内紧密连接的存在所允许的血液过滤产生的。脉络丛在维持csf的产生和重吸收速率方面起着关键作用。这种平衡的失调会导致如脑积水的病状。
[0132]
csf的特征可以是存在一种或多种选自ttr、簇集素(clu)、载脂蛋白e(apoe)、载脂蛋白a4(apoa4)和基膜聚糖(lum)的标记物。
[0133]
csf的特征可以是甲胎蛋白(afp)的存在。
[0134]
wnt途径激活剂
[0135]
可以用于产生本发明脉络丛类器官的wnt途径激活剂不受特别限制,只要它能够激活wnt信号传导途径即可。
[0136]
wnt途径激活剂包括但不限于如chir99021、wnt1、wnt2、wnt3、wnt3a、wnt8a、wnt8b、wnt10a、wnt10b、bml
‑
284、6
‑
溴靛玉红
‑
3'
‑
肟(bio)、way
‑
316606、iq1、qs11、sb
‑
216763、ly2090314、dca、2
‑
氨基
‑4‑
[3,4
‑
(亚甲二氧基)苄基
‑
氨基]
‑6‑
(3
‑
甲氧基苯基)嘧啶和锂的药剂。
[0137]
在优选实施方案中,wnt途径激活剂是chir99021(本文也称为“chir”)。
[0138]
chir99021是一种氨基嘧啶衍生物,其是gsk3的强效抑制剂,可抑制gsk3β(ic
50
=6.7nm)和gsk3α(ic
50
=10nm),并起wnt激活剂的作用。chir99021具有以下结构:
[0139][0140]
在一些实施方案中,chir99021以约1
‑
25、1
‑
20、1
‑
15、1
‑
10、1
‑
9、1
‑
8、1
‑
7、1
‑
6、1
‑
5、1
‑
4或1
‑
3μm的浓度使用。在一些实施方案中,chir99021以约1
‑
5μm的浓度使用。
[0141]
在一些实施方案中,chir99021以约2
‑
25、2
‑
20、2
‑
15、2
‑
10、2
‑
9、2
‑
8、2
‑
7、2
‑
6、2
‑
5或2
‑
4μm的浓度使用。在优选实施方案中,chir99021以约2
‑
4μm的浓度使用。
[0142]
在一些实施方案中,chir99021以约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25μm的浓度使用。在优选实施方案中,chir99021以约3μm的浓度使用。
[0143]
骨形态发生蛋白(bmp)信号传导途径激活剂
[0144]
可以用于产生本发明脉络丛类器官的骨形态发生蛋白(bmp)信号传导途径激活剂不受特别限制,只要它能够激活bmp信号传导途径即可。
[0145]
bmp信号传导途径激活剂包括但不限于如bmp4、bmp2、bmp3、bmp5、bmp6、bmp7、bmp8a、bmp8b、bmp10、bmp11、bmp15、异甘草素、4'
‑
羟基查尔酮、芹菜素、香叶木素和ventromorphins的药剂(例如sj000291942、sj000063181和/或sj00037178)。
[0146]
在优选实施方案中,bmp信号传导途径激活剂是bmp4。
[0147]
骨形态发生蛋白4(bmp4)是tgf
‑
β蛋白超家族的成员。其参与骨和软骨发育,例如牙齿和肢体发育以及骨折修复。
[0148]
在人胚胎发育中,bmp4是一种重要的信号传导分子,其参与胚胎的早期分化和背腹轴的建立。
[0149]
人bmp4的一个示例性氨基酸序列是以ncbi登录号np_001193.2保藏的序列。
[0150]
人bmp4的一个示例性氨基酸序列是:
[0151]
mipgnrmlmvvllcqvllggashaslipetgkkkvaeiqghaggrrsgqshellrdfeatllqmfglrrrpqpsksavipdymrdlyrlqsgeeeeeqihstgleyperpasrantvrsfhheehlenipgtsensafrflfnlssipenevissaelrlfreqvdqgpdwergfhriniyevmkppaevvpghlitrlldtrlvhhnvtrwetfdvspavlrwtrekqpnyglaievthlhqtrthqgqhvrisrslpqgsgnwaqlrpllvtfghdgrghaltrrrrakrspkhhsqrarkknkncrrhslyvdfsdvgwndwivappgyqafychgdcpfpladhlnstnhaivqtlvnsvnssipkaccvptelsaismlyldeydkvvlknyqemvvegcgcr
[0152]
(seq id no:1)
[0153]
在一些实施方案中,bmp4以约1
‑
40、5
‑
35、10
‑
30、15
‑
25、16
‑
24、17
‑
23、18
‑
22或19
‑
21ng/ml的浓度使用。在一些实施方案中,bmp4以约19
‑
21ng/ml的浓度使用。
[0154]
在一些实施方案中,bmp4以约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40ng/ml的
浓度使用。在优选实施方案中,bmp4以约20ng/ml的浓度使用。
[0155]
盐
[0156]
本发明的药剂(例如wnt途径激活剂和/或bmp信号传导途径激活剂)可以作为盐存在,特别是药学上可接受的盐,或作为酯存在。
[0157]
本发明药剂的药学上可接受的盐包括其合适的酸加成盐或碱盐。合适的药用盐的综述可见于berge.等人(1977)j.pharm.sci.66:1
‑
19中。盐是例如与以下形成:强无机酸,如矿物酸,例如硫酸、磷酸或氢卤酸;强有机羧酸,例如未取代或取代(例如被卤素取代)的1至4个碳原子的链烷羧酸,如乙酸;饱和或不饱和二羧酸,例如草酸、丙二酸、琥珀酸、马来酸、富马酸、邻苯二甲酸或四邻苯二甲酸;羟基羧酸,例如抗坏血酸、乙醇酸、乳酸、苹果酸、酒石酸或柠檬酸;氨基酸,例如天冬氨酸或谷氨酸;苯甲酸;或有机磺酸,如(c1‑
c4)
‑
烷基或芳基磺酸,其是未取代的或取代的(例如被卤素取代),如甲磺酸或对甲苯磺酸。
[0158]
对映异构体/互变异构体
[0159]
本发明还包括所述药剂的所有适当的对映异构体和互变异构体。相应的对映异构体和/或互变异构体可以通过本领域已知的方法分离/制备。
[0160]
立体异构体和几何异构体
[0161]
本发明的一些药剂可以作为立体异构体和/或几何异构体存在。例如,它们可以具有一个或多个不对称和/或几何中心,因此可以以两种或更多种立体异构和/或几何形式存在。本发明考虑使用这些药剂的所有单独的立体异构体和几何异构体,及其混合物。权利要求中使用的术语涵盖这些形式,只要所述形式保持适当的功能活性即可(尽管不一定达到相同的程度)。
[0162]
本发明还包括所述药剂或其药学上可接受的盐的所有合适的同位素变体。本发明药剂或其药学上可接受的盐的同位素变体被定义为其中至少一个原子被具有相同原子序数但原子质量不同于通常在自然界中发现的原子质量的原子所替代。可以掺入药剂及其药学上可接受的盐的同位素的例子包括氢、碳、氮、氧、磷、硫、氟和氯的同位素,分别如2h、3h、
13
c、
14
c、
15
n、
17
o、
18
o、
31
p、
32
p、
35
s、
18
f和
36
cl。药剂及其药学上可接受的盐的某些同位素变体,例如其中掺入了放射性同位素如3h或
14
c的那些,可用于药物和/或底物组织分布研究。氚化的(即3h)和碳
‑
14(即
14
c)同位素因其易于制备和可检测性而特别优选。此外,用同位素(如氘,即,2h)进行取代可以得到由更好的代谢稳定性引起的某些治疗优势(例如,增加的体内半衰期或降低的剂量需求),并且因此在某些情况下可能是优选的。本发明的药剂及其药学上可接受的盐的同位素变体通常可以通过使用了合适试剂的适当同位素变体的常规程序来制备。
[0163]
溶剂化物
[0164]
本发明还包括本发明药剂的溶剂化物形式。权利要求中使用的术语涵盖这些形式。
[0165]
多晶型物
[0166]
本发明还涉及呈其各种晶型、多晶型和(无水)含水形式的本发明药剂。制药工业中已充分确定,可以通过稍微改变从用于合成制备此类化合物的溶剂中纯化和或分离的方法,以任何此类形式分离化学化合物。
[0167]
干细胞
[0168]
本发明的脉络丛类器官可以由干细胞产生(例如在体外)。脉络丛类器官不是从动物的脑中分离的,这有利于组织的产生,而不需要从动物获得组织样品。
[0169]
干细胞是有能力分化成更特化细胞的细胞,并且还可以分裂产生更多的干细胞。
[0170]
随着分化能力的下降,干细胞按照以下顺序分化:多能、专能、单能。在本公开文本的类器官的发育过程中,干细胞可以分化,例如,从多能分化为专能神经干细胞,进一步分化为单能干细胞,随后分化为非干细胞性组织细胞。所述组织细胞可以是例如神经上皮细胞。
[0171]
本发明的方法可以包括使前体细胞群体(例如神经上皮细胞群体)与wnt途径激活剂和骨形态发生蛋白(bmp)信号传导途径激活剂接触,其中前体细胞群体本身已通过干细胞群体的分化而产生(例如在体外)。
[0172]
因此,本发明的方法可以包括从干细胞群体产生细胞群体(例如体外)的步骤。
[0173]
优选地,本发明的干细胞是多能干细胞。
[0174]
多能干细胞是可以无限繁殖的干细胞。多能干细胞不能生长成完整的生物体,但能够产生来源于所有三个胚层,即中胚层、内胚层和外胚层的细胞类型,并且可以能够分化成人体的所有细胞类型。这些干细胞有望提供单一的细胞来源,取代受损伤或疾病影响的细胞。
[0175]
多能干细胞可以通过多种技术产生,如诱导多能干细胞或胚胎干细胞的产生。
[0176]
在一些实施方案中,本发明的干细胞是诱导多能干细胞(ipsc)。
[0177]
ipsc是一种多能干细胞,其可以直接从成体细胞中产生。技术人员能够容易地制备ipsc,例如通过将特定的转录因子引入成体细胞或使成体细胞与特定的蛋白质组合接触。
[0178]
ipsc优于胚胎干细胞,因为它们克服了使用胚胎材料的需要,并且可以从它们(或由它们产生的细胞)随后被重新引入其中的受试者制备。这种自体细胞移植可以克服移植材料免疫排斥的风险。
[0179]
本发明的干细胞可以是胚胎干细胞,特别是不破坏胚胎而产生的那些胚胎干细胞。
[0180]
本领域已知在不破坏胚胎的情况下产生多能干细胞(如哺乳动物胚胎干细胞)的方法。特别是,已表明小鼠和人类胚胎干细胞可以从单个卵裂球产生,而胚胎保持完整。例如chung,y.等人(2006)nature 439:216
‑
219描述了从单个卵裂球制备小鼠胚胎干细胞的方法。这一程序的后期进展提供了不需要共培养卵裂球细胞系与其他esc的方法(chung,y.等人(2008)cell stem cell 2:113
‑
117)。
[0181]
在一些实施方案中,本发明的干细胞是哺乳动物干细胞,优选人干细胞。
[0182]
用于产生脉络丛类器官的方法
[0183]
本发明的脉络丛类器官可以使用wnt途径激活剂和骨形态发生蛋白(bmp)信号传导途径激活剂来产生。
[0184]
在一个方面,本发明提供了wnt途径激活剂和骨形态发生蛋白(bmp)信号传导途径激活剂用于产生脉络丛类器官的用途,其中脉络丛类器官包含(a)包含紧密上皮屏障的上皮;和/或(b)一个或多个被上皮包围的包囊。
[0185]
在另一方面,本发明提供了一种用于产生脉络丛类器官的方法,其包括将神经上
皮细胞群体与wnt途径激活剂和骨形态发生蛋白(bmp)信号传导途径激活剂接触,其中脉络丛类器官包含:(a)包含紧密上皮屏障的上皮;和/或(b)一个或多个被上皮包围的包囊。
[0186]
在另一方面,本发明提供了一种用于产生脉络丛类器官的方法,其包括从干细胞群体产生神经上皮细胞群体,并在wnt途径激活剂和骨形态发生蛋白(bmp)信号传导途径激活剂的存在下培养神经上皮细胞群体。在优选实施方案中,脉络丛类器官包含:(a)包含紧密上皮屏障的上皮;和/或(b)一个或多个被上皮包围的包囊。
[0187]
在一些实施方案中,干细胞是胚胎干细胞。在一些实施方案中,干细胞是诱导多能干细胞。
[0188]
在优选实施方案中,神经上皮细胞群体是神经上皮细胞的聚集体。
[0189]
在优选实施方案中,在与wnt途径激活剂和骨形态发生蛋白(bmp)信号传导途径激活剂接触之前,神经上皮细胞群体被包埋在三维基质中,优选细胞外基质(ecm)中。
[0190]
在一些实施方案中,在开始培养干细胞群体后约8
‑
12天,开始在wnt途径激活剂和bmp信号传导途径激活剂的存在下培养神经上皮细胞群体。在一些实施方案中,在开始培养干细胞群体后约9
‑
11天,开始在wnt途径激活剂和bmp信号传导途径激活剂的存在下培养神经上皮细胞群体。在一些实施方案中,在开始培养干细胞群体后约9.5
‑
10.5天,开始在wnt途径激活剂和bmp信号传导途径激活剂的存在下培养神经上皮细胞群体。在一些实施方案中,在开始培养干细胞群体后约10天,开始在wnt途径激活剂和bmp信号传导途径激活剂的存在下培养神经上皮细胞群体。
[0191]
在一些实施方案中,所述方法或用途包括搅拌,优选地在与wnt途径激活剂和bmp信号传导途径激活剂接触后。搅拌可以使用例如震荡器(如轨道式震荡器)来实现。
[0192]
在另一方面,本发明提供了一种用于产生脉络丛类器官的方法,其包括以下步骤:
[0193]
(a)通过培养干细胞群体产生胚状体群体;
[0194]
(b)在适合于神经诱导的条件下培养所述胚状体群体;
[0195]
(c)将步骤(b)的产物包埋在三维基质中,优选细胞外基质(ecm);
[0196]
(d)在wnt途径激活剂和骨形态发生蛋白(bmp)信号传导途径激活剂的存在下培养步骤(c)的产物,优选地其中步骤(d)在步骤(a)开始后约8
‑
12天开始。
[0197]
胚状体(eb)是经历自发或定向分化的多能干细胞的三维聚集体。
[0198]
本发明的方法和用途可以包括将细胞或细胞聚集体包埋在三维基质中,优选细胞外基质(ecm)。
[0199]
在一些实施方案中,ecm是聚合ecm。在一些实施方案中,ecm是聚合ecm凝胶。合适的三维基质可以包含胶原蛋白。优选地,三维基质包含由engelbreth
‑
holm
‑
swarm(ehs)小鼠肉瘤细胞分泌的ecm或其任何组分,如层粘连蛋白、胶原蛋白、4型胶原蛋白、巢蛋白、以及任选的另外的硫酸乙酰肝素蛋白聚糖,或其任何组合。在一些实施方案中,ecm是基质胶(matrigel)。基质胶描述于例如us4829000中。
[0200]
典型地,三维基质是生物相容性基质的三维结构。它优选地包含胶原蛋白、明胶、壳聚糖、透明质酸、甲基纤维素、层粘连蛋白和/或藻酸盐。所述基质可以是凝胶,特别是水凝胶。有机化学水凝胶可以包含聚乙烯醇、聚丙烯酸钠、丙烯酸酯聚合物和具有大量亲水基团的共聚物。水凝胶包含亲水的聚合物链网络,有时以其中水作为分散介质的胶体凝胶的形式存在。水凝胶是高吸收性(它们可以含有超过99%的水)的天然或合成聚合物。水凝胶
还具有一定程度的柔性,这与天然组织非常相似,因为它们的含水量很高。
[0201]
胚状体群体的产生可以通过在合适的培养基(本文称为胚状体(eb)培养基)中培养干细胞群体来进行。
[0202]
示例性eb培养基包含血清替代配制品、胎牛血清、谷氨酰胺、非必需氨基酸、2
‑
巯基乙醇和fgf(例如碱性fgf)(优选约4ng/ml bfgf)。优选地,eb培养基包含rock抑制剂。优选地,eb培养基仅在培养干细胞的前3天包含rock抑制剂。
[0203]
特别合适的培养基是实施例中使用的eb培养基或以下公开的eb培养基。
[0204]
神经诱导可以通过在合适的培养基(本文称为神经诱导培养基)中培养来进行。神经诱导培养基可以是耗尽的培养基,例如缺乏血清或血清替代品的培养基。非神经组织所需的此类营养物质的缺乏可能导致其他非神经特征的丧失和朝向神经特征的纯化。
[0205]
示例性神经诱导培养基包含n2补充剂(price和brewer(2001)protocols for neural cell culture 255
‑
264;例如invitrogen,目录号17502048)、谷氨酰胺、非必需氨基酸和肝素。
[0206]
特别合适的培养基是实施例中使用的神经诱导培养基或以下公开的神经诱导培养基。
[0207]
在优选实施方案中,单个胚状体被包埋在单独的三维基质液滴中。
[0208]
在三维基质中的包埋可以通过在合适的容器中将胚状体添加到可溶性基质中,随后在适合于基质聚合的条件下孵育来实现。例如,可以将胚状体一个接一个地转移到凹陷的石蜡膜上;在除去多余的培养基后,可以向每个胚状体中添加基质(例如基质胶)液滴;然后可以将混合物在适合于基质聚合的条件下孵育(例如在37℃下约20min)。
[0209]
在优选实施方案中,将包埋在三维基质中的胚状体在适合于扩增的条件下培养。扩增可以通过在合适的培养基(本文称为扩增培养基)中培养来进行。
[0210]
示例性扩增培养基包含n2补充剂(price和brewer(2001)protocols for neural cell culture 255
‑
264;例如invitrogen,目录号17502048)、缺乏维生素a的b27补充剂(price和brewer(2001)protocols for neural cell culture 255
‑
264;例如invitrogen,目录号12587010)、胰岛素、2
‑
巯基乙醇、谷氨酰胺和非必需氨基酸。
[0211]
特别合适的培养基是实施例中使用的扩增培养基或以下公开的扩增培养基。
[0212]
在wnt途径激活剂和骨形态发生蛋白(bmp)信号传导途径激活剂的存在下的培养以及随后在不存在wnt途径激活剂和骨形态发生蛋白(bmp)信号传导途径激活剂的情况下的培养可以在合适的培养基中进行,所述培养基在本文中可以称为成熟培养基。
[0213]
示例性成熟培养基包含n2补充剂(price和brewer(2001)protocols for neural cell culture 255
‑
264;例如invitrogen,目录号17502048)、包含维生素a的b27补充剂(price和brewer(2001)protocols for neural cell culture 255
‑
264;例如invitrogen,目录号17504044)、胰岛素、2
‑
巯基乙醇、谷氨酰胺和非必需氨基酸。
[0214]
特别合适的培养基是实施例中使用的成熟培养基或以下公开的成熟培养基。
[0215]
任何培养基均可以进一步包含营养物质和/或缓冲液。优选的营养物质包括碳水化合物,尤其是单己糖或单戊糖,如葡萄糖或果糖。
[0216]
用于本发明方法的合适培养条件包括,例如:
[0217]
(a)在约36℃
‑
39℃或36.5℃
‑
37.5℃,优选约37℃下培养;
[0218]
(b)在约4%
‑
6%或4.5%
‑
5.5%co2,优选约5%co2下培养;和/或
[0219]
(c)在至少约95%、96%、97%、98%或99%的湿度,优选约100%的湿度下培养。
[0220]
另一种示例性eb培养基是(每50ml):40ml dmem/f12(invitrogen目录号11330
‑
032);10ml敲除血清替代物(kosr;invitrogen目录号10828
‑
028);1.5ml胚胎干细胞
‑
品质fbs;0.5ml glutamax(invitrogen目录号35050
‑
038);0.5ml mem
‑
非必需氨基酸(mem
‑
neaa;sigma目录号m7145);100μl 50mm 2
‑
me(例如life technologies目录号31350
‑
010);4ng/ml bfgf(例如peprotech目录号100
‑
18b)(使用前立即添加;1:2500);以及1:100rock抑制剂(y27632;vwr目录号688000
‑
5)(使用前立即添加)。
[0221]
另一种示例性神经诱导培养基是(每100ml):100ml dmem/f12(invitrogen目录号11330
‑
032);1ml n2补充剂(invitrogen目录号17502048);1m glutamax补充剂(invitrogen目录号35050
‑
038);1ml mem
‑
neaa(sigma目录号m7145);以及100ul肝素溶液(sigma目录号h3149)。
[0222]
另一种示例性扩增培养基是(每250ml):125ml dmem/f12(invitrogen目录号11330
‑
032);125ml neurobasal培养基(invitrogen目录号21103049);1.25ml n2补充剂(invitrogen目录号17502048);5ml b27补充剂(invitrogen目录号12587010或17504044);62.5ul胰岛素(sigma目录号i9278);250ul 50mm 2
‑
me溶液(例如life technologies目录号31350
‑
010);2.5ml glutamax补充剂(invitrogen目录号35050
‑
038);1.25ml mem
‑
neaa(sigma目录号m7145);以及2.5ml青霉素/链霉素(sigma目录号p0781)。
[0223]
另一种示例性成熟培养基是(每250ml):125ml dmem/f12(invitrogen目录号11330
‑
032);125ml neurobasal培养基(invitrogen目录号21103049);1.25ml n2补充剂(invitrogen目录号17502048);5ml b27补充剂(invitrogen目录号12587010或17504044);62.5ul胰岛素(sigma目录号i9278);250ul 50mm 2
‑
me溶液(例如life technologies目录号31350
‑
010);2.5ml glutamax补充剂(invitrogen目录号35050
‑
038);1.25ml mem
‑
neaa(sigma目录号m7145);以及2.5ml青霉素/链霉素(sigma目录号p0781)。
[0224]
用于筛选和测定的方法
[0225]
在一方面,本发明提供了本发明的脉络丛类器官用于药物发现筛选或测定药物毒性的用途。
[0226]
在一些实施方案中,所述用途用于测试候选药剂穿过血液
‑
脑脊液(csf)屏障的能力。
[0227]
在另一方面,本发明提供了一种用于测试候选药剂穿过血液
‑
脑脊液(csf)屏障的能力的方法,其包括使本发明的脉络丛类器官与候选药剂接触,并确定候选药剂是否穿过上皮。
[0228]
例如,可以将候选药剂添加到包含脉络丛类器官的培养物的培养基中并孵育。随后,例如在一段合适的时间后,可以提取脉络丛类器官的一个或多个包囊中的液体,并分析候选药剂的存在。技术人员已知的任何合适的技术均可以用于测定候选药剂的存在。例如,药剂可以使用质谱方法来鉴定。
[0229]
技术人员将理解,在不脱离所公开的本发明范围的情况下,他们可以将本文公开的本发明的所有特征进行组合。
[0230]
现在将通过非限制性实施例来描述本发明的优选特征和实施方案。
[0231]
除非另外指明,否则本发明的实践将采用化学、生物化学、分子生物学、微生物学和免疫学的常规技术,这些技术在本领域普通技术人员的能力范围内此类技术在文献中得到解释。参见例如,sambrook,j.,fritsch,e.f.和maniatis,t.(1989)molecular cloning:a laboratory manual,第2版,cold spring harbor laboratory press;ausubel,f.m.等人(1995和定期补充)current protocols in molecular biology,第9、13和16章,john wiley&sons;roe,b.,crabtree,j.和kahn,a.(1996)dna isolation and sequencing:essential techniques,john wiley&sons;polak,j.m.和mcgee,j.o’d.(1990)in situ hybridization:principles and practice,oxford university press;gait,m.j.(1984)oligonucleotide synthesis:a practical approach,irl press;以及lilley,d.m.和dahlberg,j.e.(1992)methods in enzymology:dna structures part a:synthesis and physical analysis of dna,academic press。这些一般文本中的每一个均通过引用并入本文。
[0232]
实施例
[0233]
材料与方法
[0234]
干细胞培养
[0235]
人h9和h1 es细胞是从wicell获得的,并已被ukscb steering committee批准用于这些研究。ips细胞(imr90
‑
4)是从wicell获得的,并且所有细胞系均被证实是多能的并且不含支原体。将细胞保持在培养物中,并用stemflex培养基(gibco a3349401)培养。
[0236]
大脑和脉络丛类器官培养条件
[0237]
如前所述,由来自hes和ipsc的单细胞悬浮液制备胚状体(eb)(1)。将stem cell technologies的大脑类器官试剂盒(目录号08570、08571)试剂用于产生大脑和chp类器官。如先前所报道的,eb是使用纤维微折叠和18,000个hes或ips细胞产生的,或者在没有微折叠的情况下使用更少的细胞(2000
‑
4000个)来产生更小的eb,这两种情况均用于增加表面积和提高神经诱导效率(2)。将这些铺板到具有eb培养基和50μm y
‑
27632rock抑制剂的96孔u形底部低附着板中,保持3天,随后2天在仅eb培养基中培养。在第5天,在相同的96孔中用ni培养基替换培养基。在两天后,如前所述,使用凹陷的石蜡膜片材将eb包埋在20μl基质胶中,并在37℃下孵育20min(2)。然后将eb转移到6孔板中,其中每个孔具有3ml扩增培养基。对于chp模式形成,在第10天,用在成熟培养基中的3μm chir和20ng/ml bmp4进行处理,从而在每个5cm培养皿中保持6个eb的最大数量。将所述处理在成熟培养基中保持7天。在第15天,将类器官移至带有震荡器的培养箱中,并且每3
‑
4天进料成熟培养基。从第30天开始,将溶解的基质胶(1:50)添加到成熟培养基中。
[0238]
免疫染色和免疫印迹
[0239]
在4℃下将类器官固定在4%pfa中过夜,然后在pbs中洗涤三次,每次10min,然后在4℃下转移到30%蔗糖缓冲液中,保持至少24h。然后将类器官包埋在明胶中,并如前所述进行切片(1)。在用0.25%triton和1%驴血清缓冲液封闭和透化后,将切片与以下初级抗体孵育过夜:绵羊抗ttr(1:500,abcam,ab9015)、小鼠抗zo1(1:300,bd transduction,610966)、兔抗aqp1(1:200,abcam ab15080)、小鼠抗mrp1(1:200,abcam ab24102)、兔抗mrp4(1:200,cell signaling technology,12705)、兔抗sox2(1:300,abcam,ab97959)、兔抗clic6(1:500用于免疫染色,1:1000用于免疫印迹,abcam,ab204567)、兔抗foxg1(1:200
用于免疫染色,1:1000用于免疫印迹,abcam,ab18259)、小鼠抗gapdh(1:1000,abcam,ab8245)、兔抗igf2(1:200用于免疫染色,1:1000用于免疫印迹,abcam,ab9574)、大鼠抗磷酸化组蛋白h3(ph3,1:300,abcam ab10543)、小鼠抗角蛋白18(krt18,1:200,novus biologicals nbp2
‑
47985)、兔抗血清素(5ht2c,1:200,sigma s5545);兔抗ccdc67(1:200,abcam ab102688)、小鼠抗foxj1(1:100,thermo fisher 14
‑
9965
‑
82);兔抗arl13b(1:200,proteintech 17711
‑1‑
ap)、兔抗dlk1(1:200,abcam,ab21682)、绵羊抗tbr2(1:200,r&d systems,af6166)、小鼠抗huc/d(1:500,lifetech,a21271)、小鼠抗lat1(1:50,santa cruz,sc
‑
374232)、兔抗pgp/mdr1(1:200,cell signaling technology,12683)。在三次10min的pbs洗涤后,在室温下将用alexafluor 488、568、647标记的二抗施加1h。为了标记细胞核,将dapi添加到二抗孵育中。然后将载玻片在pbs中洗涤三次,然后用prolong diamond封片介质封片。为了进行组织学分析,随后将切片浸入苏木精和伊红中,用乙醇和二甲苯脱水,最后使用基于二甲苯的封片剂介质封片。图像是使用zeiss lsm 780共聚焦显微镜(carl zeiss)获取的,并使用fiji(nih)制备。
[0240]
为了进行免疫印迹,将类器官在液氮中快速冷冻,随后在ripa缓冲液中用1:100的halt蛋白酶抑制剂(thermo fisher)匀浆化,以产生组织提取物。为了收集icsf,将类器官在新鲜培养基中洗涤两次,并使用玻璃毛细管经由口移液收集流体。使用bradford测定法测量蛋白质浓度。然后用nupage lds样品缓冲液4x和dtt 1m制备含有大约10μg蛋白质的样品,然后在95℃下加热15min。将蛋白质样品和梯状标志加载到聚丙烯酰胺凝胶中,并在90mv下运行2h。在4℃下将样品转移到pvdf膜(immobilon)中3h。将膜在pbs
‑
t中的5%乳中封闭,并在4℃下与初级抗体孵育过夜。在pbs中洗涤3次后,在室温下添加与alexafluor缀合的二抗,保持1h。使用li
‑
cor odyssey clx红外成像系统对膜进行成像。
[0241]
单细胞rna测序和分析
[0242]
通过首先将针对每种情况的两种类器官汇集到15ml锥形管中来进行单细胞解离:55天的端脑类器官(样品1)、53天的脉络丛(样品2)、27天的脉络丛(样品3)和46天的脉络丛(样品4)。在温和搅拌下,将样品在具有400μg dnase i和15μm放线菌素d的1ml accumax(sigma,a7089)中在37℃下孵育20min。每隔5min,轻弹样品试管,并在最后用p1000吸头上下移液10次。使大块沉淀并收集上清液,向其中添加100μl fbs,之后在35μm过滤管(corning,352235)上过滤。然后将样品在300xg下旋转5min。然后使用死细胞去除试剂盒和macs柱(miltenyi,130
‑
090
‑
101)清除细胞沉淀中的死细胞,之后在300xg下另外旋转5min。将细胞重悬浮在适当体积的在pbs中的0.04%bsa中,以在10x铬体系(10x genomics)上加载16,000个细胞。
[0243]
使用10x genomics铬单细胞3'文库和凝胶珠试剂盒v3(10x genomics)工作流程,根据制造商的说明制备单细胞rna
‑
seq文库。根据在乳液混合物中产生单细胞凝胶珠的方案运行铬控制器。在c1000触摸式热循环仪(biorad)上进行逆转录酶反应和随后的扩增,并且使用2100生物分析仪(agilent)测试文库质量。将样品汇集在一起,并在novaseq测序仪(illumina)的s1流动池的两条泳道上进行测序。
[0244]
在通过还使用star与grch38人类参考基因组进行读段比对的cellranger count(3.1.0版,10x genomics)运行之前,通过bcl2fastq将原始测序输出转换为标准fastq格式。qc输出显示对于样品1为10,327个细胞,每个细胞的平均读段为39,973,并且每个细胞
的中值umi计数为4,660;对于样品2为8,573个细胞,每个细胞的平均读段为41,815,并且每个细胞的中值umi计数为11,899;对于样品3为5,347个细胞,每个细胞的平均读段为67,938,并且每个细胞的中值umi计数为16,252;对于样品4为8,603个细胞,每个细胞的平均读段为45,030,并且每个细胞的中值umi计数为9,927。然后通过以下方式用seurat v3 r包进一步分析每个样品的过滤特征条形码矩阵:首先合并矩阵,然后对跨细胞的读段深度进行归一化,缩放数据,并使用sctransform进行可变特征查找。在归一化过程中,线粒体图谱百分比和细胞周期两者均进行回归,以消除这些混杂的变异来源。使用elbowplot来指导维数的选择(4),随后进行findneighbors、findclusters和umap降维可视化,通过主成分分析(pca)来进行无偏聚类。基于每个聚类中的前10个差异表达基因以及对已知标记物基因的分析来鉴定聚类。
[0245]
为了与体内数据进行比较,首先生成每个单独聚类的子集。为了与人类发育中的脑的scrna
‑
seq进行比较,从ucsc细胞浏览器下载来自nowakowski等人(3)的表达矩阵和元数据,并通过seurat v3,使用细胞周期状态回归和pca聚类分析(采用umap可视化)进行处理,与上述类似,以产生基于顶级差异表达基因和已知标记物基因鉴定的12个聚类。然后为这些聚类中的每个生成子集。跨每个聚类内的单细胞平均化来自类器官和人类体内的每个聚类子集的归一化特征计数数据,随后计算跨矩阵的pearson相关系数,并使用采用manhattan方法的heatmap.2函数和ward.d2聚类进行无偏分层聚类分析。
[0246]
为了与小鼠胚胎大量rna
‑
seq数据进行比较,从ncbi geo(gse66312)(4)下载原始特征计数,并计算tpm,随后转换为人类基因名称,并去除重复项和人类中不存在的基因。在至少一个样品中设定为1的截止tpm,随后计算跨1)整个脉络丛样品和2)分选的上皮细胞样品的平均值。然后对数据进行对数转换,并与类器官子集聚类(如上进行平均化)合并。去除所有比较组中没有出现的基因,随后进行缩放和主成分分析。
[0247]
电子显微镜
[0248]
在4℃下,将类器官用0.1m卡可酸盐缓冲液,ph 7.4(cb)中的2.5%戊二醛和2%多聚甲醛(em级,agar scientific)固定在玻璃小瓶中过夜。第二天,用cb经一天历程将它们冲洗6次,并在4℃下储存过夜。然后再次冲洗样品,并用在冰上的cb中的1%四氧化锇在黑暗中后固定1小时,用蒸馏水经1小时洗涤5次,并在浓度渐升的乙醇系列(30%、50%、70%、90%、100%)、然后氧化丙烯中脱水10min(在每个步骤如此操作)。将脱水的样品浸入并包埋在cy212 araldite环氧树脂中。从包埋样品切下70nm的浅金切片,并与饱和水性乙酸铀酰形成对比。在80kv下,在fei tecnai spirit tem上记录电子显微照片。
[0249]
质谱数据分析
[0250]
使用pbs或新鲜培养基洗涤类器官,并用玻璃微毛细管通过口移液收集icsf样品。以500g将类器官流体和培养基离心5min,以去除死细胞和碎片,随后经由质谱进行分析。使用janus液体处理系统(perkinelmer,英国)制备含有纯化蛋白质的聚丙烯酰胺凝胶切片(1
‑
2mm)用于质谱分析。简而言之,将切下的蛋白质凝胶块置于96孔微量滴定板的孔中,用50%v/v乙腈和50mm碳酸氢铵脱色,用10mm dtt还原,并用55mm碘乙酰胺烷基化。在烷基化后,在37℃下用6ng/μl内切蛋白酶asp
‑
n(promega,英国)将蛋白质消化过夜。在2%v/v甲酸、2%v/v乙腈中提取所得肽。通过使用ultimate u3000 hplc(thermo scientific dionex,美国圣何塞)的纳米毛细管lc
‑
ms/ms(以提供大约300nl/min的流量)对消化物进行
分析。c18 acclaim pepmap100 5μm,100μm x 20mm nanoviper(thermo scientific dionex,美国圣何塞),在c18 acclaim pepmap100 3μm,75μm x 250mm nanoviper(thermo scientific dionex,美国圣何塞)上分离前捕获肽。用60min乙腈梯度(2%至80%)洗脱肽。分析柱出口经由纳米流电喷雾电离源与混合四极杆轨道阱质谱仪(q
‑
exactive plus orbitrap,thermoscientific,美国圣何塞)直接连接。对整个ms光谱,随后是10个ms/ms谱使用30,000的分辨率,进行数据依赖性分析。在300
–
2000的m/z范围内收集ms谱。使用用于高能碰撞离解(hcd)的为27的阈值能量收集ms/ms扫描。然后使用mascot搜索引擎程序(matrix science,英国)对照蛋白质数据库(uniprot kb)搜索lc
‑
ms/ms数据(5)。将数据库搜索参数设置为前体容限为10ppm,且碎片离子质量容限为0.8da。允许一个缺失的酶切割,并且包括氧化甲硫氨酸,脲甲基半胱氨酸,焦谷氨酸,磷酸化丝氨酸、苏氨酸和酪氨酸以及甲基精氨酸的可变修饰。使用scaffold程序(proteome software inc.,美国)验证ms/ms数据并计算empai值(6)。为了比较不同物种样品中的相应蛋白质,仅考虑最高的empai值作为每个样品中给定蛋白质的肽计数。因此,例如,对于人类样品(类器官和人类成人csf)仅取人类ttr empai值,而对于胎牛csf取牛ttr empai值,并且对于小鼠胚胎csf取小鼠ttr empai值。这使我们能够比较跨样品的相应同源蛋白质,尽管它们的登录号不同。
[0251]
nmr样品制备和分析
[0252]
对于nmr实验,将chp类器官在不含酚红和1:50geltrex的完全idm a培养基(gibco,a14132
‑
02)中孵育2h、12h、24h、48h或72h。收集类器官培养基和icsf,并以500g离心5min以去除碎片。使用在400.1mhz下操作的bruker ultrashield 400 plus获取1h
‑
nmr谱。使用hod抑制分析由h2o/d2o混合物组成的样品,以收集1h
‑
nmr数据。化学位移(δ)以ppm示出。通过1h
‑
nmr谱中信号的相对积分来确定转化产率。使用mestrenova(7.0版)和graphpad prism(7.0b版)进行数据分析。
[0253]
类似于先前所述的(7),为了比较csf中小分子的体外与体内水平,将体内未结合的csf与血浆的比率k
p,uu,csf
计算为csf中未结合药物(c
u,csf
)与血浆中未结合药物(c
u,p
)的比率(方程式a)。
[0254][0255]
csf和血浆中各自的未结合药物的量是总药物浓度(c
p
)或(c
csf
)与未结合药物分数(f
u,p
)或(f
u,csf
)的乘积(方程式b和c)。
[0256]
c
u,p
=c
p
f
u,p
ꢀꢀꢀ
(b)
[0257]
c
u,csf
=c
csf
f
u,csf
ꢀꢀꢀ
(c)
[0258]
c
p
、c
csf
和f
u,p
摘自文献(表s2)。然而,由于难以获得大量的csf,对于大多数药物f
u,csf
还未知。因此,由f
u,p
计算f
u,csf
,其中血浆和csf中的药物
‑
蛋白质解离是相同的(方程式d),通过将白蛋白csf与血浆的比率(q
alb
)取为0.005来校正csf的血浆蛋白质含量降低,如先前在人类中所报告。
[0259][0260]
因为体外流体的nmr测量检测到未结合的药物,因此比率(k
m,uu,icsf
)是体外csf中药物(c
u,icsf
)与培养基中药物(c
u,m
))比率的简单函数(方程式e)。
[0261][0262]
实施例1
[0263]
如先前所报告,大脑类器官的特征是内在的自组织性,其中最近的方案主要产生前脑特征(13,14),其还包括chp上皮(图7a)(9,13)。因此,为了研究人类chp的发育,我们建立了一个基于大脑类器官方法的方案,以可靠和可重现的方式产生chp。
[0264]
以前曾报道过仅使用背化因子bmp4(15)以及与wnt激活剂分子chir组合(16)来体外衍生chp细胞。
[0265]
因此,为了促进大脑类器官中的chp命运,在改进的大脑类器官方案的第10天开始,给予bmp4和chir作为脉冲(参见方法)(图1a、7b、7c)(7,9,13)。在第14天,非定向前脑类器官发育大的圆形神经上皮叶,而在经bmp4/chir处理的类器官中,我们观察到更细长的神经上皮组织(图7b)。这一观察结果与来自背侧中线神经上皮的chp的体内发育相一致,所述神经上皮在大脑室腔内逐渐变得更细长且扩张(1,17,18)。与主要发育具有背侧皮层特征的大神经上皮叶的前脑类器官相比(图1b,1c),chp类器官显现几乎完全富集在chp立方形上皮中(图1b,1c)。将第40天的chp类器官组织切片与受孕后15周的人类胚胎chp和来自e18.5的胚胎小鼠脑的chp进行比较,显示人类胚胎样品与类器官组织之间在复杂性和组织性方面非常相似(图1d)。
[0266]
在体内,chp上皮最初发育为假复层上皮,随后是中间柱状阶段,并成熟为高度折叠的立方形上皮(1,18,19)。为了证实组织特异性,我们在早期和晚期时间点对chp标记物ttr、神经干细胞标记物sox2和紧密连接标记物zo1进行染色(图1e,图1f)。用bmp4和chir处理的chp类器官到第28天发育成了具有ttr阳性面积的假复层神经上皮(图1e)。到第39天,经处理的类器官发育更柱状、极化的chp上皮,在ttr免疫染色中日益富集,在细胞
‑
细胞连接中具有相对强的zo1表达,以及稀疏的sox2免疫染色(图1f)。与未处理的对照相比,ttr阳性区域的定量显示在经处理的类器官中有可重现的富集(图1g)。总之,这些数据证明了从不同的人类多能干细胞系和用两种不同的接种方法在体外可靠且可重现地产生chp组织(图7c
‑
g)。
[0267]
chp在脑中表达最高水平的通道蛋白
‑
氯离子细胞内通道(clic6)(20)。通过免疫组织化学(图2a)并且通过与对照、未处理的类器官相比的免疫印迹(图2b
‑
c),我们都可以在chp类器官上皮中检测到clic6。平行地,与对照相比,在经处理的类器官中检测到较低水平的前脑标记物foxg1(图2b
‑
c)。与对照相比,皮质特异性tbr2阳性中间祖细胞和huc/d阳性神经元在早期chp类器官中也大大减少,并在成熟chp类器官中几乎完全缺失(图8a)。
[0268]
chp含有上皮和基质组分两者:极化的上皮顶部面对脑室腔并包围暴露于有孔毛细血管的基质核心。为了更好地表征存在于chp类器官中的不同细胞群体,我们进行了单细胞rna测序(scrna
‑
seq),所述测序是从处于不同成熟阶段的三个单独批次的chp类器官中取样两个类器官,并将两个未处理的端脑类器官作为对照(图2f,图2g)。组合分析鉴定了在未处理的类器官中表达神经元和神经元祖细胞的标记物的预期细胞聚类,而未成熟和成熟的chp特征在chp类器官中富集(图2f)。无偏分析显示,在经处理的类器官中,chp群体中的富集随着时间的推移是一致和渐进的(图2g)。与早期类器官和未处理的对照相比,较老的经处理的类器官显示出较大的chp成熟上皮细胞组分以及在基质细胞群体中的富集(图
2g)。与我们先前的染色一致,我们证实了clic6和其他特异性chp标记物(如血清素受体hrt2c)的表达(21)(图2h)。如所预期的,未成熟的chp/hem细胞聚类表达了更高水平的参与chp发育的早期调节因子,如同源盒蛋白msx1、otx2、r
‑
脊椎蛋白3(rspo3)和pax6(图2h,图2i)。成熟的chp细胞群体表达更高水平的ttr、碳酸酐酶2和12(ca2,ca12)、核苷二磷酸激酶同源物5(nme5)、内向整流钾通道13(kcnj13)和上皮标记物角蛋白18(krt18)(图2i)。先前曾报道过体内chp上皮的成熟梯度,其中更成熟的krt18阳性细胞位于侧脑室的远端(21)。与早期未成熟的chp类器官相比,krt18富集在更成熟的chp类器官中(图2d)。为了研究我们系统中chp的基质组分,我们通过免疫组织化学观察了dlk1(δ样非经典notch配体1)的表达,这是一种在chp间质中表达的基因(21)(图2e)。在包围chp的类器官区域中和上皮内检测到dlk1和其他chp基质蛋白(基膜聚糖lum和饰胶蛋白聚糖dcn)的表达(图2e,8b)。与这些结果一致,通过scrna
‑
seq检测的chp基质群体表达高水平的dcn、lum和dlk1(图2i),以及细胞外基质组分胶原蛋白α
‑
1链1(col1a1)(图2h)。这些数据表明,体外衍生的chp类器官发育上皮和基质组分两者。
[0269]
接下来我们试图鉴定我们的体外模型与体内chp组织之间的相似性。我们用公布的小鼠chp组织(1)和发育中的人脑(2)的数据集进行了无偏聚类和主成分分析(pca)(图3a
‑
d)。首先,我们在我们鉴定的类器官聚类与来自体内e18.5小鼠胚胎全chp和经分离的上皮chp细胞的rnaseq数据之间进行了pca(4)。我们可以观察到来自体内样品的chp和我们成熟的chp聚类与其他经鉴定的聚类相比最接近(图3a)。然后,我们进行了类器官聚类和体内人类发育中的脑之间的相关性分析(22),揭示了类器官和体内chp聚类之间以及类器官和体内基质聚类之间的高度相关性(图3b)。进一步的无偏分层聚类揭示了类器官成熟和未成熟chp连同体内chp的聚类,以及类器官chp基质与体内基质特征的聚类(图3c)。为了进一步研究我们的系统是否可以更好地专门模拟人类chp,然后我们将类器官成熟chp聚类与体内人类和小鼠两者进行了比较(图3d),揭示了与人类chp的相关性高于与小鼠的相关性(图3d)。最后,检查特定的区域性chp标记物(4,24)揭示脉络丛类器官具有侧脑室特征而不是第三或第四脑室(图3e),与其端脑起源一致。这些数据总体上证明,类器官的chp上皮和基质组成似乎重演了体内人类chp的细胞组成和遗传结构。
[0270]
为了检查chp类器官的成熟程度,我们观察了先前描述的chp成熟标记物。我们可以观察到纤毛标记物的存在,表明在chp上皮成熟期间表达(3);以及更成熟的chp上皮水通道蛋白1(aqp1)的标记物的存在。我们可以在成熟chp聚类中检测到纤毛基因(如dynlrb2和foxj1)的富集,以及aqp1的富集(图3f)。染色进一步揭示了ccdc67和foxj1的存在(两者均是纤毛形成的调节因子)以及纤毛蛋白arl13b的存在,其对chp上皮中的顶端纤毛簇进行染色(图3g)。aqp1的染色也证实了这种更成熟标记物的存在,从而显示定位在上皮的顶面上,类似于体内(图3h)。chp上皮是一种极其有效的分泌机构(23),具有顶面上的增加其表面积的许多微绒毛、运动纤毛和致密的胞质囊状网络。为了进一步研究chp类器官是否重演了这些基本的超微结构特征,我们进行了em成像。我们观察到初级纤毛、位于顶端的大量微绒毛、细胞间紧密连接、多囊体和大量细胞外囊泡(图3i;由箭头指示)。根据其在脑脂质代谢中的作用,我们还观察到脂滴和脂蛋白(apoe、簇集素/apoj和磷脂转移蛋白pltp)的富集(图3j)。这些特征以及呈细胞周期标记物磷酸化组蛋白h3(ph3)阳性的活性循环细胞的缺失(图3k,图2d)表明chp类器官中有相当成熟的分泌上皮。
[0271]
接下来,我们通过检查紧密连接标记物(如封闭了chp上皮屏障细胞之间的细胞间间隙的密封蛋白和闭合蛋白)的表达来询问chp类器官是否可以发育紧密屏障(25,26)。scrna
‑
seq揭示了几种密封蛋白(图4a)以及其他紧密连接组分闭合蛋白(ocln)、zo1(tjp1)、zo2(tjp2)和pdz蛋白patj(inadl)和mpdz(图4b)的存在。染色揭示chp类器官极化上皮中密封蛋白1、3、4和5的顶端定位,并验证它们的表达富集(图4c)。在chp类器官上皮中也观察到低水平的密封蛋白2(图11a)以及ocln的存在(图11b)。最后,为了直接评估chp上皮的屏障功能,我们应用了不同分子量(70、10和3
‑
5kda)的荧光标记葡聚糖,并检查了它们进入类器官的情况。在孵育2h后,在类器官内看不到10kda alexa
‑
647标记的葡聚糖的明显渗漏(图11c)。在用70kda、10kda和3
‑
5kda标记的葡聚糖孵育2h后收集的培养基和内部流体的荧光强度证实了这些分子完全从类器官中排除(图11d)。
[0272]
chp类器官的一个显著特征是后来发育了含有无色液体的大的由流体填充的隔室或包囊,这在前脑、未处理的类器官中很少存在或完全不存在(图4d,图9a
‑
b)。我们发现这些隔室与培养基完全隔离,并且可以通过继续向培养基中添加溶解的基质胶来维持。我们观察到相同的立方形上皮包围这些隔室,并显示出极化取向,其中腔侧上的顶端标记物aqp1和zo1朝向流体(图4d)。
[0273]
为了研究这种流体的组成,我们进行了质谱分析,以比较体外类器官csf样流体(icsf)(3个批次的h9,1个批次的h1和1个批次的ipsc imr
‑
90),与3种不同的体内样品(从3名健康供体汇集的成人端脑csf,e13.5的小鼠胚胎csf,和胎牛csf)以及培养基。我们在类器官icsf中总共检测到248种丰富的蛋白质,其中199种与体内csf样品相同(图10a)。基因本体分析揭示,go:cc类别“细胞外囊泡”和“细胞外间隙”,以及go:bp类别“从细胞输出”和“从细胞分泌”在类器官流体蛋白质组中富集(图5a)。胰岛素样生长因子,特别是igf2,由chp分泌,并调节发育性csf中的皮质祖细胞增殖(2)。与igf在发育性csf中的作用一致,reac类别“胰岛素样生长因子的调节”在类器官icsf中也显著富集。
[0274]
接下来,我们重点研究了在至少2个类器官icsf样品中检测到的蛋白质,以排除技术伪象,然后我们基于观察到的肽的数量,检查了报告的empai值为1的最丰富的蛋白质。在类器官icsf中检测到的这83种丰富蛋白质中,有80种也在体内样品中检测到,进一步表明了高度相似性(图5b,10c)。在这些蛋白质中,我们检测了几种生物标记物,如簇集素(clu)、磷脂转移蛋白(pltp)和载脂蛋白e(apoe)(图5b,补充表1)。在icsf中检测到的许多蛋白质,如胰岛素样生长因子结合蛋白7(igfbp7)、serpin家族f成员1(serpinf1)、尼曼
–
皮克病c2型蛋白(npc2)和视黄醇结合蛋白1,也可以在scrna
‑
seq chp聚类中检测到(图5c,图5d),进一步证实了它们的产生。蛋白质的一个子集仅存在于人类类器官和成人csf样品中,从而表明潜在的人类特异性分泌(图5e)。我们还检测到几种发育特异性csf蛋白,包括胰岛素样生长因子2(igf2)、igfbp7和卵泡抑素样蛋白1(fstl1),这些蛋白在成人样品中不存在,从而表明由chp类器官分泌的icsf保留了人类csf的至少一些发育特征(图5e)。通过免疫印迹证实了类器官流体中的igf2水平(图5g,图8c),并且免疫组织化学揭示其存在于chp上皮中(图5h)。与chp在叶酸和维生素c转运中的独特作用一致(叶酸和维生素c两者对脑稳态和功能均至关重要(27,28)),我们检测到参与这些营养物质转运的特定转运蛋白:slc23a2(维生素c)和slc46a2(叶酸)富集在chp上皮聚类中(图5d)。
[0275]
接下来,我们通过进一步与先前公布的人类胚胎卡内基阶段20 csf的蛋白质组数
据集进行比较,询问来自类器官的icsf最匹配哪个阶段(29)。我们可以观察到类器官icsf与成人csf有较大的重叠,共享121种蛋白质,而相比之下icsf和胚胎体内csf之间共享51种蛋白质(图5e),这表明icsf可能与成人csf更相似,但仍保留一些发育特征。
[0276]
总的来说,在体外和体内样品之间存在非常好的一致性;然而,为了完全确定与体内的相似性,我们进一步检查了具有异常分布的蛋白质。首先,尽管检测到的绝大多数蛋白质不存在于培养基中,这表明存在高度选择性的屏障,但蛋白质组分析揭示,在培养基中的14种丰富蛋白质中,13种也存在于类器官icsf中(图10d)。重要的是,其中大多数也在体内样品中检测到,并且包括如白蛋白(alb)和转铁蛋白(tf)的蛋白质,它们被主动转运穿过chp上皮。体内未检测到的那些是由基质胶提供的蛋白质,包括几种层粘连蛋白。第二,在体内样品中存在可重现检测到的几种蛋白质,但在类器官icsf中没有,这需要进一步检查,因为这些可能是类器官无法正常产生的因素。然而,我们发现仅在体内csf样品中检测到而在类器官icsf中未检测到的蛋白质在go:cc“血液微粒”、go:bp“血小板脱颗粒”和kegg:“补体和凝血级联”中显示出富集(图10b、10e、10f)。这可以通过以下事实来解释:腰椎穿刺(脊柱抽液)csf采集的侵入性程序经常导致外周血和骨髓的污染。因此,类器官系统的优点之一是chp类器官缺乏血管组分;因此,我们预计这种流体是专门的chp分泌蛋白质组。总之,这些发现表明:1.chp类器官发育成自含式隔室,通过紧密的上皮屏障与周围的培养基区分开来,2.chp类器官活跃地分泌富含人类发育特异性csf蛋白的csf样流体,不含血液污染物。
[0277]
作为其选择性屏障功能的一部分,chp上皮对小分子(包括治疗剂)也具有高度选择性。因此,为了测试这种对小分子的选择性渗透性,我们应用了各种治疗相关的小分子,并通过类器官icsf的nmr分析测定了它们的渗透性。作为原理验证,我们测试了多巴胺(多巴)及其前体左旋多巴(l
‑
多巴)对屏障的渗透性,因为它们是在体内具有非常不同的渗透性的高度相似分子,并且这种特异性先前在任何体外bbb模型中均没有被报道过。非常确定的是,多巴在体内不会进入脑,而l
‑
多巴经由lat
‑
1转运蛋白被主动转运到csf中(30
–
33),因此在患有帕金森病的患者中被用作多巴胺替代疗法中的治疗剂。在卡比多巴(一种阻止l
‑
多巴转化为多巴的小分子)(34,35)的存在下,我们用多巴和l
‑
多巴孵育类器官。在2h后,我们可以检测到培养基中l
‑
多巴和多巴两者的存在,但在icsf中仅可检测到l
‑
多巴,这与cns屏障的体内特性一致(图6a,图11e)。l
‑
多巴icsf/培养基比率一致高于多巴icsf/培养基比率,表明我们的模型对小分子展现出的选择性与体内相同(图6a)。
[0278]
这些发现表明,血液
‑
cns屏障中可能存在关键转运蛋白的适当表达。事实上,我们能够检测到转运蛋白lat
‑
1在chp类器官上皮顶面上的表达(图6d,图8c),这解释了在我们的渗透性测定中看到的l
‑
多巴的正确转运。我们还针对熟知的外排泵p
‑
糖蛋白1(pgp或多药耐药蛋白1,mdr1)进行了染色,所述p
‑
糖蛋白1经由atp依赖机制阻止药物进入脑(36,37)(图6d)。我们在chp上皮中检测到似乎定位于细胞内囊泡的pgp的顶端和近顶端表达(图6d)。pgp在chp中的定位尚未完全确定(38,39),然而,据报道它在将分子从csf泵入血液中起作用(38,40)。chp中其他重要的外排转运蛋白是mrp1和mrp4,它们阻止有毒化合物和不需要的信号到达csf(38,41)。在培养40天时,mrp1在顶端和基底均定位于chp上皮(图6d,图8c),而mrp4在chp上皮顶端表达(图6d)。这些结果表明,体外生成的chp上皮内源性表达转运和输出泵,这对b
‑
csf
‑
b在人脑中的正确功能至关重要。
[0279]
接下来我们测试了所述系统是否可以定量预测药物渗透性。为此,我们进行了类
似的渗透性实验,以测试安非他酮(一种已知容易穿过bbb的抗抑郁药)(42),和两种化疗化合物甲氨蝶呤和长春新碱(它们穿过bbb的能力很差)(43,44)。正如预测的那样,在2h后在icsf中容易地可检测到安非他酮,而甲氨蝶呤和长春新碱被完全排除在icsf之外(图6b)。最重要的是,我们发现文献中报道的相同药物的体外icsf/培养基比率和体内csf/血浆比率之间有非常高的相关性(r2=0.9921)。不仅如此,实际值也非常吻合(如斜率为1.004所指示),表明这种体外系统可以定性和定量地重演体内报告的药物渗透性(图6e)。
[0280]
这些结果表明chp类器官系统可以用于模拟和预测未知药物的cns渗透性。为了测试这一理论,我们转向蛋白磷酸酶1的调节亚单位ppp1r15a的新型抑制剂sephin 1,其已显示可穿过bbb,并在charcot
‑
marie tooth
‑
1b小鼠模型中对蛋白质错误折叠具有保护性cns作用(45)。这种分子在人体内的临床前或临床数据尚不可用,但i期临床试验正在进行中,因此任何另外的人体体外数据均将提供信息。使用与先前描述的相同的实验条件,在孵育2h后在icsf中可检测到sephin 1,表明这种化合物也可以穿过人类cns屏障(图6c)。然而,值得注意的是,人类类器官模型中的渗透性比小鼠模型中描述的低得多,这表明人类可能需要更高的剂量来实现相同的cns水平。
[0281]
与药物药代动力学特征相关的问题是大多数临床试验失败的原因(46,47)。一个极端的例子涉及化合物bia
‑
10
‑
2474(一种正在开发中的脂肪酸酰胺水解酶抑制剂),其用于治疗几种医学病症,如慢性疼痛和多发性硬化(48,49)。不幸的是,当六名试验参与者展现出严重神经毒性,其中一人死亡时,i期临床试验突然中止(49,50)。法国卫生部进行的调查提出了几种可能的解释,其中之一是毒性药物在脑中积累,这在所测试的任何动物模型中均不明显(49
–
51)。然而,由于进一步的研究被中止,确切的原因仍未知。鉴于在动物模型中未能检测到这种不良影响,我们试图测试人类chp类器官是否有可能更准确地预测人类cns渗透性,并测试积累理论。我们将bia
‑
10
‑
2474的药代动力学特征与一种安全的化合物安非他酮(其容易地穿过上皮屏障但没有显示出这种毒性积累)进行了比较。与安非他酮相似,bia
‑
10
‑
2474能够在孵育2h后穿过chp上皮屏障(图6f)。然而,与24h后稳定在基线水平的安非他酮相比,bia
‑
10
‑
2474继续在icsf中积累(图6g)。这些数据与bia
‑
10
‑
2474可能在试验参与者的脑中积累的理论相一致,表明了这种药物在临床试验中失败的潜在解释。总之,我们的发现表明,类器官系统可以用作人类体外临床前模型,从而不仅可以定量预测未知化合物的渗透性,还可以预测它们随时间推移的动力学(图6h)。
[0282]
总之,chp类器官可以以前所未有且可靠的方式用于研究人类chp的发育和功能。这种器官相对研究不足,但由于其在发育和疾病(如神经退化)中的重要作用,正受到越来越多的关注。
[0283]
补充表1.chp类器官分泌人类疾病相关生物标记物。表格示出在icsf中检测到的生物标记物(示出了50种最丰富的icsf蛋白中的31种),其中生物标记物水平发生改变的疾病或病症,以及相关文献。星号表示也在培养基中检测到的蛋白质(8
–
59)。
[0284]
补充表2.时间点渗透性实验。表格示出细胞系、批次数、在chp类器官上测试的相对药物(在图6中示出)的icsf收集日期(div)。
[0285]
补充表3.用于蛋白质组学的icsf时间点。表格示出细胞系、批次产生日期和用于蛋白质组分析(在图5中示出)的样品的icsf收集日期(div)。星号表示汇集在一起的样品。
[0286]
补充表4.用于蛋白质组学的体内csf时间点。表格示出用于蛋白质组分析(在图5
中示出)的体内样品的类型和大小。星号表示汇集在一起的样品。
[0287]
补充表5.药物csf水平的体内和体外数据。表格示出csf和血浆(体内)或培养基(体外)中未结合小分子的测量值和计算的比率(k)(60
‑
68)。
[0288]
补充表1
[0289][0290]
补充表2
[0291]
时间点渗透性实验
[0292]
补充表3
[0293]
用于蛋白质组学的icsf时间点
[0294][0295]
补充表4
[0296]
用于蛋白质组学的体内csf时间点
[0297][0298]
补充表5
[0299]
与体内的药物渗透性比较
[0300][0301]
总化合物脑与血浆比率
[0302]
^报告的未结合浓度,两次测量的平均值
[0303]
来自小鼠的体内数据
[0304]
标有~的值是根据相关参考文献中的图表估算的。
[0305]
以上说明书中提到的所有出版物通过引用并入本文。在不脱离本发明的范围和精神的情况下,本发明所公开的产品、用途和方法的各种修改和变化对于技术人员来说将是清楚的。尽管已结合特定优选实施方案公开了本发明,但应理解的是,要求保护的本发明不应不适当地局限于此类特定实施方案。事实上,对于技术人员来说显而易见的用于实现本发明的所公开模式的各种修改旨在落入以下权利要求的范围内。
[0306]
实施例1的参考文献
[0307]
1.lun,m.p.,monuki,e.s.and lehtinen,m.k.(2015)development and functions of the choroid plexus
‑
cerebrospinal fluid system.nat.rev.neurosci.,16,445
–
457.
[0308]
2.lehtinen,m.k.and walsh,c.a.(2011)neurogenesis at the brain
–
cerebrospinal fluid interface.annu.rev.cell dev.biol.,27,653
–
679.
[0309]
3.silva
‑
vargas,v.,maldonado
‑
soto,a.r.,mizrak,d.,codega,p.and doetsch,f.(2016)age
‑
dependent niche signals from the choroid plexus regulate adult neural stem cells.cell stem cell,19,643
–
652.
[0310]
4.lun,m.p.,johnson,m.b.,broadbelt,k.g.,watanabe,m.,kang,y.
‑
j.,chau,k.f.,springel,m.w.,malesz,a.,sousa,a.m.m.,pletikos,m.,et al.(2015)spatially heterogeneous choroid plexus transcriptomes encode positional identity and contribute to regional csf production.j.neurosci.,35,4903
–
4916.
[0311]
5.ghersi
‑
egea,j.f.,strazielle,n.,catala,m.,silva
‑
vargas,v.,doetsch,f.and engelhardt,b.(2018)molecular anatomy and functions of the choroidal blood
‑
cerebrospinal fluid barrier in health and disease.acta neuropathol.,135,337
–
361.
[0312]
6.redzic,z.(2011)molecular biology of the blood
‑
brain and the blood
‑
cerebrospinal fluid barriers:similarities and differences.fluids barriers cns,8,3.
[0313]
7.lancaster,m.and knoblich,j.a.(2014)generation of cerebral organoids from human pluripotent stem cells.nat.protoc.,9,2329
–
2340.
[0314]
8.camp,j.g.,badsha,f.,florio,m.,kanton,s.,gerber,t.,wilsch
‑
m.,lewitus,e.,sykes,a.,hevers,w.,lancaster,m.,et al.(2015)human cerebral organoids recapitulate gene expression programs of fetal neocortex development.proc.natl.acad.sci.u.s.a.,112,15672
–
7.
[0315]
9.lancaster,m.a.,renner,m.,martin,c.,wenzel,d.,bicknell,l.s.,hurles,m.e.,homfray,t.,penninger,j.m.,jackson,a.p.and knoblich,j.a.(2013)cerebral organoids model human brain development and microcephaly.nature,501,373
–
379.
[0316]
10.quadrato,g.,brown,j.and arlotta,p.(2016)the promises and challenges of human brain organoids as models of neuropsychiatric disease.nat.med.,22,1220
–
1228.
[0317]
11.quadrato,g.,nguyen,t.,macosko,e.z.,sherwood,j.l.,min yang,s.,berger,d.r.,maria,n.,scholvin,j.,goldman,m.,kinney,j.p.,et al.(2017)cell diversity and network dynamics in photosensitive human brain organoids.nature,545,48
–
53.
[0318]
12.evolution,h.b.,pollen,a.a.,bhaduri,a.,andrews,m.g.,haussler,d.,eichler,e.e.,kriegstein,a.r.,pollen,a.a.,bhaduri,a.,andrews,m.g.,et al.(2019)establishing cerebral organoids as models of article establishing cerebral organoids as models of human
‑
specific brain evolution.cell,176,743
‑
756.e17.
[0319]
13.lancaster,m.a.,corsini,n.s.,wolfinger,s.,gustafson,e.h.,phillips,a.w.,burkard,t.r.,otani,t.,livesey,f.j.and knoblich,j.a.(2017)guided self
‑
organization and cortical plate formation in human brain organoids.nat.biotechnol.,35,659
–
666.
[0320]
14.giandomenico,s.l.,mierau,s.b.,gibbons,g.m.,wenger,l.m.d.,masullo,l.,sit,t.,sutcliffe,m.,boulanger,j.,tripodi,m.,derivery,e.,et al.(2019)cerebral organoids at the air
–
liquid interface generate diverse nerve tracts with functional output.nat.neurosci.,22,669
–
679.
[0321]
15.watanabe,m.,kang,y.
‑
j.,davies,l.m.,meghpara,s.,lau,k.,chung,c.
‑
y.,kathiriya,j.,hadjantonakis,a.
‑
k.and monuki,e.s.(2012)bmp4 sufficiency to induce choroid plexus epithelial fate from embryonic stem cell
‑
derived neuroepithelial progenitors.j.neurosci.,32,15934
–
15945.
[0322]
16.sakaguchi,h.,kadoshima,t.,soen,m.,narii,n.,ishida,y.,ohgushi,m.,takahashi,j.,eiraku,m.and sasai,y.(2015)generation of functional hippocampal neurons from self
‑
organizing human embryonic stem cell
‑
derived dorsomedial telencephalic tissue.nat.commun.,6,1
–
11.
[0323]
17.currle,d.s.,cheng,x.,hsu,c.and monuki,e.s.(2005)direct and indirect roles of cns dorsal midline cells in choroid plexus epithelia formation.development,132,3549
–
3559.
[0324]
18.liddelow,s.a.(2015)development of the choroid plexus and blood
‑
csf barrier.front.neurosci.,9,1
–
13.
[0325]
19.lehtinen,m.k.,bjornsson,c.s.,dymecki,s.m.,gilbertson,r.j.,holtzman,d.m.and monuki,e.s.(2013)the choroid plexus and cerebrospinal fluid:emerging roles in development,disease,and therapy.j.neurosci.,33,17553
–
17559.
[0326]
20.sathyanesan,m.,girgenti,m.j.,banasr,m.,stone,k.,bruce,c.,guilchicek,e.,nairn,a.and williams,k.(2012)a molecular characterization of the choroid plexus and stress
‑
induced gene regulation.transl.psychiatry,2,e139
‑
9.
[0327]
21.dani,n.,mccabe,c.,cui,j.,shipley,f.b.and jang,a.(2019)a cellular and spatial map of the choroid plexus across brain ventricles and ages.biorxiv.
hierarchies of the human cortex.1323,1318
–
1323.
[0364]
4.lun,m.p.,johnson,m.b.,broadbelt,k.g.,watanabe,m.,kang,y.
‑
j.,chau,k.f.,springel,m.w.,malesz,a.,sousa,a.m.m.,pletikos,m.,et al.(2015)spatially heterogeneous choroid plexus transcriptomes encode positional identity and contribute to regional csf production.j.neurosci.,35,4903
–
4916.
[0365]
5.pappin,d.j.c.,creasy,d.m.,cottrell,j.s.and perkins,d.n.(1999)probability
‑
based protein identification by searching sequence databases using mass spectrometry data.electrophoresis,20,3551
–
67.
[0366]
6.keller,a.,nesvizhskii,a.i.,kolker,e.and aebersold,r.(2002)empirical statistical model to estimate the accuracy of peptide identifications made by ms/ms and database search.anal.chem.,74,5383
–
5392.
[0367]
7.frid
é
n,m.,winiwarter,s.,jerndal,g.,bengtsson,o.,hong,w.,bredberg,u.,hammarlund
‑
udenaes,m.and antonsson,m.(2009)structure
‑
brain exposure relationships in rat and human using a novel data set of unbound drug concentrations in brain interstitial and cerebrospinal fluids.j.med.chem.,52,6233
–
6243.
[0368]
8.costa,m.,horrillo,r.,ortiz,a.m.,perez,a.,mestre,a.,ruiz,a.,boada,m.and grancha,s.(2018)increased albumin oxidation in cerebrospinal fluid and plasma from alzheimer’s disease patients.j.alzheimer’s dis.,63,1395
–
1404.
[0369]
9.ghasemzadeh,n.,nyberg,f.and hjerten,s.(2008)original paper highly selective artificial gel antibodies for detection and quantification of biomarkers in clinical samples.ii.albumin in body fluids of patients with neurological disorders.j sep sci,31,3954
–
3958.
[0370]
10.bonham,l.w.,geier,e.g.,steele,n.z.r.,holland,d.,miller,b.l.,dale,a.m.,desikan,r.s.and yokoyama,j.s.(2018)insulin
‑
like growth factor binding protein 2 is associated with biomarkers of alzheimer’s disease pathology and shows differential expression in transgenic mice.front.neurosci.,12,1
–
10.
[0371]
11.d.,isgaard,j.,wallin,a.,johansson,j.
‑
o.,adreasson,u.,blennow,k.,zetterberg,h.,n.d.and svensson,j.(2015)increased cerebrospinal fluid level of insulin
‑
like growth factor
‑
ii in male patients with alzheimer’s disease.j.alzheimer’s dis.,48,637
–
646.
[0372]
12.huang,x.,xu,j.,shen,y.,zhang,l.,xu,m.,chen,m.and ren,j.(2019)protein profiling of cerebrospinal fluid from patients undergoing vestibular schwannoma surgery and clinical significance.biomed.pharmacother.,116,108985.
[0373]
13.wasik,n.,sokol,b.,m.,manko,w.,juszkat,r.,jagodzinski,p.p.and jankowski,r.(2017)clusterin,a new cerebrospinal fluid biomarker in severe subarachnoid hemorrhage:a pilot study.world neurosurg.,107,424
–
428.
[0374]
14.jongbloed,w.,dijk,k.d.van,mulder,s.d.and berg,w.d.j.van de(2015)
clusterin levels in plasma predict cognitive decline and progression to alzheimer’s disease.j.alzheimer’s dis.,46,1103
–
1110.
[0375]
15.morales,d.,hechavarria,r.,wojna,v.and acevedo,s.f.(2013)ywhae/14
‑3‑
3ε:a potential novel genetic risk factor and csf biomarker for hiv neurocognitive impairment.j.neurovirol,19,471
–
478.
[0376]
16.morales,d.,skoulakis,e.c.m.and acevedo,s.f.(2012)14
‑3‑
3s are potential biomarkers for hiv
‑
related neurodegeneration.j.neurovirol,18,341
–
353.
[0377]
17.lubieniecka,j.m.,streijger,f.,lee,j.h.t.,stoynov,n.,liu,j.,mottus,r.,pfeifer,t.,kwon,b.k.,coorssen,j.r.,foster,l.j.,et al.(2011)biomarkers for severity of spinal cord injury in the cerebrospinal fluid of rats.plos one,6,e19247.
[0378]
18.mart
í
nez
–
y
é
lamos,a.,saiz,a.,sanchez
–
valle,r.,casado,v.,ram
ó
n,j.m.,graus,f.,arbizu,t.and in(2001)14
‑3‑
3 protein in the csf as prognostic marker in early multiple sclerosis.neurology,57,722
–
725.
[0379]
19.vuletic,s.,kennedy,h.,albers,j.j.,killestein,j.,vrenken,h.,l
ü
tjohann,d.and teunissen,c.e.(2014)cerebrospinal fluid apolipoprotein e and phospholipid transfer protein activity are reduced in multiple sclerosis;relationships with the brain mri and csf lipid variables.mult.scler.relat.disord.,3,533
–
541.
[0380]
20.ranganathan,s.,williams,e.,ganchev,p.,gopalakrishnan,v.,urbinelli,l.,newhall,k.,cudkowicz,m.e.,jr,r.h.b.and bowser,r.(2005)proteomic profiling of cerebrospinal fluid identifies biomarkers for amyotrophic lateral sclerosis.j neurochem,95,1461
–
1471.
[0381]
21.vuletic,s.,peskind,e.r.,marcovina,s.m.,quinn,j.f.,cheung,m.c.,kennedy,h.,kaye,j.a.,jin,l.and albers,j.j.(2005)reduced csf pltp activity in alzheimer’s disease and other neurologic diseases;pltp induces apoe secretion in primary human astrocytes in vitro.j.neurosci.
[0382]
res.,80,406
–
413.
[0383]
22.batistaa.,hadley,s.,sanz,m.i.,quijano,t.a.and m.(2019)role of beta
‑2‑
microglobulin as a biomarker in very preterm and extremely preterm infants with cns inflammation.plos one.
[0384]
23.svato
ň
ov
á
,j.,boleck
á
,k.,adam,p.and l
á
nsk
á
,v.(2014)beta2
‑
microglobulin as a diagnostic marker in cerebrospinal fluid:a follow
‑
up study.dis.markers,2014,1
–
6.
[0385]
24.tsuji
‑
akimoto,s.,yabe,i.,niino,m.,kikuchi,s.and sasaki,h.(2009)cystatin c in cerebrospinal fluid as a biomarker of als.neurosci.lett.,452,52
–
55.
[0386]
25.ren,y.,zhu,w.,cui,f.,yang,f.,chen,z.,ling,l.and huang,x.(2015)
measurement of cystatin c levels in the cerebrospinal fluid of patients with amyotrophic lateral sclerosis.int j clin exp pathol,8,5419
–
5426.
[0387]
26.vafadar
‑
iisfahani,b.,ball,g.,coveney,c.,lemetre,c.,boocock,d.,minthonc,l.,hanssonc,o.,milesa,a.k.,janciauskienee,s.m.,wardend,d.,et al.(2012)identification of sparc
‑
like 1 protein as part of a biomarker panel for alzheimer’s disease in cerebrospinal fluid.j.alzheimer’s dis.,28,625
–
636.
[0388]
27.mo,f.,ma,x.,liu,x.,zhou,r.,zhao,y.and zhou,h.(2019)altered csf proteomic profiling of paediatric acute lymphocytic leukemia patients with cns infiltration.j.oncol.,2019,1
–
8.
[0389]
28.sathe,g.,na,c.h.,renuse,s.,madugundu,a.k.,moghekar,a.and pandey,a.(2018)quantitative proteomic profiling of cerebrospinal fluid to identify candidate biomarkers for alzheimer’s disease.proteomics clin appl,13,e1800105.
[0390]
29.dayon,l.,galindo,a.n.,wojcik,j.,cominetti,o.,corth
é
sy,j.,oikonomidi,a.,henry,h.,kussmann,m.,migliavacca,e.,bowman,g.l.,et al.(2018)alzheimer disease pathology and the cerebrospinal fluid proteome.alzheimers.res.ther.,10,1
–
12.
[0391]
30.chen,c.,xiao,d.,zhou,w.and shi,q.(2014)global protein differential expression profiling of cerebrospinal fluid samples pooled from chinese sporadic cjd and non
‑
cjd patients.mol neurobiol,49,290
–
302.
[0392]
31.schultz,k.,nilsson,k.,nielsen,j.e.,lindquist,s.g.,hjermind,l.e.and andersen,b.b.(2010)transthyretin as a potential csf biomarker for alzheimer’s disease and dementia with lewy bodies:effects of treatment with cholinesterase inhibitors.eur.j.neurol.,17,456
–
460.
[0393]
32.quaranta,a.,karlsson,i.,ndreu,l.,marini,f.,ingelsson,m.and thors
é
n,g.(2019)glycosylation profiling of selected proteins in cerebrospinal fluid from alzheimer’s disease and healthy subjects.anal.methods,11,3331
–
3340.
[0394]
33.yan,x.,mai,l.,lin,c.,he,w.and yin,g.(2017)csf
‑
based analysis for identification of potential serum biomarkers of neural tube defects.neurosci.bull.,33,436
–
444.
[0395]
34.orchard,p.j.,nascene,d.r.,gupta,a.,taisto,m.e.,higgins,l.,markowski,t.w.and lund,t.c.(2019)cerebral adrenoleukodystrophy is associated with loss of tolerance to profilin.eur j immunol,49,947
–
953.
[0396]
35.mclimans,k.e.and willette,a.a.(2016)novel csf biomarker of metabolic dysfunction predicts ad
‑
like associations across the alzheimer’s spectrum.faseb j.,30,lb304
–
lb304.
[0397]
36.mclimans,k.e.and willette,a.a.(2017)autotaxin is related to metabolic dysfunction and predicts alzheimer’s disease outcomes.j.alzheimer’s dis.,56,403
–
413.
[0398]
37.heywood,w.e.,galimberti,d.,bliss,e.,sirka,e.,paterson,r.w.,magdalinou,n.k.,carecchio,m.,reid,e.,heslegrave,a.,fenoglio,c.,et al.(2015)identification of novel csf biomarkers for neurodegeneration and their validation by a high
‑
throughput multiplexed targeted proteomic assay.mol.neurodegener.,10,1
–
16.
[0399]
38.n,k.,p,a.,m,k.,p,s.and k.,k.(2015)spinal fluid lactate dehydrogenase level differentiates between structural and metabolic etiologies of altered mental status in children.iran j child neurol,9,31
–
36.
[0400]
39.parkkila,a.
‑
k.,parkkila,s.,reunanen,m.,niemela,o.,tuisku,s.,rautakorpi,i.and rajaniemi,h.(1997)carbonic anhydrase ii in the cerebrospinal fluid:its value as a disease marker.eur.j.clin.invest.,27,392
–
397.
[0401]
40.guo,z.,zhang,y.,zou,l.,wang,d.,shao,c.and wang,y.(2015)a proteomic analysis of individual and gender variations in normal human urine and cerebrospinal fluid using itraq quantification.plos one,10,1
–
17.
[0402]
41.lewis,s.b.,wolper,r.,chi,y.,miralia,l.,wang,y.,yang,c.and shaw,g.(2010)identification and preliminary characterization of ubiquitin c terminal hydrolase 1(uchl1)as a biomarker of neuronal loss in aneurysmal subarachnoid hemorrhage.j.neurosci.res.,88,1475
–
1484.
[0403]
42.futakawa,s.,nara,k.,miyajima,m.,kuno,a.and ito,h.(2012)a unique n
‑
glycan on human transferrin in csf:a possible biomarker for inph.neurobiol.aging,33,1807
–
1815.
[0404]
43.dobson,r.,topping,j.,davis,a.,thompson,e.and giovannoni,g.(2013)cerebrospinal fluid and urinary biomarkers in multiple sclerosis.acta neurol.scand.,10.1111/ane.12119.
[0405]
44.streijger,f.,skinnider,m.a.,rogalski,j.c.,balshaw,r.,shannon,c.p.,prudova,a.,belanger,l.,ritchie,l.,tsang,a.,christie,s.,et al.(2017)a targeted proteomics analysis of cerebrospinal fluid after acute human spinal cord injury.j.neurotrauma,34,2054
–
2068.
[0406]
45.albayar,a.a.,roche,a.,swiatkowski,p.,antar,s.,ouda,n.,emara,e.,smith,d.h.,ozturk,a.k.and awad,b.i.(2019)biomarkers in spinal cord injury:prognostic insights and future potentials.front.neurol.,10,1
–
14.
[0407]
46.kessler,h.,pajonk,f.,meisser,p.,hoffmann,k.,supprian,t.,herrmann,w.,obeid,r.,multhaup,g.,falkai,p.and bayer,t.a.(2006)cerebrospinal fluid diagnostic markers correlate with lower plasma copper and ceruloplasmin in patients with alzheimer’s disease.j neural transm,113,1763
–
1769.
[0408]
47.kallianpur,a.r.,gittleman,h.,letendre,s.,ellis,r.,bush,w.s.and heaton,r.(2019)cerebrospinal fluid ceruloplasmin,haptoglobin,and vascular endothelial growth factor are associated with neurocognitive impairment in adults with hiv infection.mol.neurobiol.,56,3808
–
3818.
[0409]
48.saito,y.(2017)dj
‑
1 as a biomarker of parkinson’s disease.in 1037.pp.149
–
171.
[0410]
49.parnetti,l.,castrioto,a.,chiasserini,d.,persichetti,e.,tambasco,n.,el
‑
agnaf,o.and calabresi,p.(2013)cerebrospinal fluid biomarkers in parkinson disease.nat.publ.gr.,9,131
–
140.
[0411]
50.hong,z.,shi,m.,chung,k.a.,quinn,j.f.,peskind,e.r.,galasko,d.,jankovic,j.,zabetian,c.p.,leverenz,j.b.,baird,g.,et al.(2010)dj
‑
1 and a
‑
synuclein in human cerebrospinal fluid as biomarkers of parkinson’s disease.brain a j.neurol.,133,713
–
726.
[0412]
51.blennow,k.,wallin,a.,andreasson,u.,bjerke,m.and zetterberg,h.(2011)cerebrospinal fluid matrix metalloproteinases and tissue inhibitor of metalloproteinases in combination with subcortical and cortical biomarkers in vascular dementia and alzheimer’s disease.j.alzheimer’s dis.,27,665
–
676.
[0413]
52.duits,f.h.,hernandez
‑
guillamon,m.,montaner,j.,goos,j.d.c.,monta,a.,wattjes,m.p.,barkhof,f.,scheltens,p.and teunissen,c.e.(2015)matrix metalloproteinases in alzheimer’s disease and concurrent cerebral microbleeds.j.alzheimer’s dis.,48,711
–
720.
[0414]
53.singh,a.,beveridge,a.j.and singh,n.(2011)decreased csf transferrin in scjd:a potential pre
‑
mortem diagnostic test for prion disorders.plos one,6,e16804.
[0415]
54.ho,j.k.,lee,s.k.,yoo,y.c.,park,n.h.,park,d.b.,yoo,j.s.,an,h.j.,park,y.m.and gi,k.c.(2012)proteome analysis of human cerebrospinal fluid as a diagnostic biomarker in patients with meningioma.med sci monit,18,450
–
460.
[0416]
55.martins
‑
de
‑
souza,d.,wobrock,t.,zerr,i.,schmitt,a.,gawinecka,j.,schneider
‑
axmann,t.,falkai,p.and turck,c.w.(2010)different apolipoprotein e,apolipoprotein a1 and prostaglandin
‑
h2 d
‑
isomerase levels in cerebrospinal fl uid of schizophrenia patients.world j.biol.psychiatry,11,719
–
728.
[0417]
56.perrin,r.j.,craig
‑
schapiro,r.,malone,j.p.,shah,a.r.,gilmore,p.,quinn,j.f.,kaye,j.a.,morris,j.c.,holtzman,d.m.and reid,r.(2011)identification and validation of novel cerebrospinal fluid biomarkers for staging early alzheimer’s disease.plos one,6,e16032.
[0418]
57.nielsen,h.m.,minthon,l.and londos,e.(2013)plasma and csf serpins in alzheimer’s disease and dementia with plasma and csf serpins in alzheimer disease and dementia with lewy bodies.am.acad.neurol.,69,1569
–
1579.
[0419]
58.dzieciatkowska,m.,qi,g.,you,j.,bemis,k.g.,sahm,h.,lederman,h.m.,crawford,t.o.,gelbert,l.m.,rothblum
‑
oviatt,c.and wang,m.(2011)proteomic characterization of cerebrospinal fluid from ataxia
‑
telangiectasia(a
‑
t)patients using a lc/ms
‑
based label
‑
free protein quantification technology.int.j.proteomics,2011,1
–
13.
[0420]
59.poljak,a.,hill,m.,hall,r.j.,maclullich,a.m.,raftery,m.j.,tai,j.,yan,s.and caplan,g.a.(2014)quantitative proteomics of delirium cerebrospinal fl uid.transl.psychiatry,4,1
–
10.
[0421]
60.benetello,p.,furlanut,m.,zara,g.,massimo,b.and eid hassan(1993)plasma levels of levodopa and its main metabolites in parkinsonian patients after conventional and controlled
‑
release levodopa
‑
carbidopa associations.eur.neurol.,33,69
–
73.
[0422]
61.das,i.,krzyzosiak,a.,schneider,k.,wrabetz,l.,antonio,m.d.,barry,n.,sigurdardottir,a.and bertolotti,a.(2015)preventing proteostasis diseases by selective inhibition of a phosphatase regulatory subunit.348,239
–
243.
[0423]
62.evans,w.e.,hutson,p.r.,stewart,c.d.,cairnes,d.a.,bowman,p.w.,rivera,g.and crom,w.r.(1983)methotrexate cerebrospinal fluid and serum concentrations after intermediate
‑
dose methotrexate infusion.clin.pharmacol.ther.,33,301
–
307.
[0424]
63.golden,r.n.,rudorfer,m.v,sherer,m.a.,linnoila,m.and potter,w.z.(1988)bupropion in depression.arch gen psychiatry,45,139
–
143.
[0425]
64.onash,a.,tanzeen,a.,isgro,f.,d.and strobel,g.(2000)effect of intravenous dopamine infusion on plasma concentrations of dopamine and dopamine sulfate in men,during and up to 18 h after infusion.eur j clin pharmacol.,55,755
–
759.
[0426]
65.rizzo,n.,padoin,c.,palombo,s.,schermann,j.
‑
m.and girre,c.(1996)omeprazole and lansoprazole are not inducers of cytochrome p4501a2under conventional therapeutic conditions.eur j clin pharmacol.,49,491
–
495.
[0427]
66.seri,i.,tulassay,t.,kiszel,j.and machay,t.(1984)cardiovascular response to dopamine in hypotensive preterm neonates.
[0428]
67.jackson,d.v,sethi,v.s.,spurr,c.l.and mcwhorter,j.m.(1981)pharmacokinetics of vincristine in the cerebrospinal fluid of humans1.
[0429]
68.jackson,d.v,sethi,v.s.,long,t.r.,muss,h.b.and spurr,c.l.(1984)pharmacokinetics of vindesine bolus and infusion.cancer chemother.pharmacol.,0,114
–
119.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。