一种高效热启动taq酶的优化及制备方法
1.技术领域:本发明属于生物制剂技术领域,特别涉及一种高效热启动taq酶的优化及制备方法。
2.
背景技术:
pcr(聚合酶链式反应)是一种用于放大扩增特定dna片段的分子生物学技术,利用dna在体外95℃高温时变性会变成单链,低温(经常是60℃左右)时引物与单链按碱基互补配对的原则结合,再调温度至dna聚合酶最适反应温度(72℃左右),dna聚合酶沿着磷酸到五碳糖(5'
‑
3')的方向合成互补链。pcr技术被广泛运用于医学和生物学的实验室,例如用于判断体检中是否会表现某遗传疾病的图谱、传染病的诊断、基因诊断、基因复制以及亲子鉴定等。
3.pcr反应所必需的dna聚合酶目前广泛采用水生栖热菌 thermus aquaticus ( taq )中分离出的具有热稳定性的dna聚合酶,因此被称为taq酶。起作用是通过构建磷酸二酯键将脱氧核苷酸聚合形成脱氧核苷酸链,从而形成dna分子。taq酶对于pcr的应用有里程碑的意义,一般常用的taq酶可以分为rtaq酶和ltaq酶两类,ltaq酶的保真性更强,耐热性也比rtaq酶好。多数酶在高温时即变性失活,然而taq酶可以耐受90℃以上的高温而不失活,所以不需要每个循环加酶,使pcr技术变得非常简捷。同时也大大降低了成本,pcr技术得以大量应用,并逐步应用于临床。在广泛应用的pcr操作中,taq酶的缺点是缺少3到5校正外切酶活性,因此在复制dna时有时会出错,造成dna序列的错误。为了避免操作过程中产生非特异性序列的扩增,研究人员对pcr技术进行了改良,发明了热启动聚合酶链式反应(hot start pcr)。该技术将聚合酶与反应体系中的隔离,或是使用在高热状态下才会活化的聚合酶(热启动taq酶),该酶在90℃以上才能发挥很好的催化效果,以避免在未达到设定温度前就开始反应。
4.目前热启动pcr方式包括:(1)蜡隔绝法:是将除了聚合酶以外的反应物加入pcr反应管中,加入熔融的石蜡;待石蜡凝固后再加入聚合酶。放入pcr仪后在升温阶段石蜡融化浮至最上层,聚合酶才和pcr反应体系中的其他反应物接触混合,石蜡同时还具有防止蒸发的作用。(2)化学修饰热启动聚合酶:用甲醛,酸酐等化学分子修饰聚合酶,在高热下聚合酶结构改变而启动。(3)抗体修饰热启动聚合酶:用带有针对热启动聚合酶的免疫抗体封闭酶活性中心,在高热下聚合酶与抗体分离而启动。(4)共价键结合修饰热启动聚合酶:用小分子的化合物封闭酶的活性中心,在高热下聚合酶与抗体分离而启动。
5.公开于该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理 解,而不应当被视为承认或以任何形式暗示该信息构成已为本领域一般技术 人员所公知的现有技术。
6.
技术实现要素:
本发明的目的在于提供一种高效热启动taq酶的优化及制备方法,从而克服上述现有技术中的缺陷。
7.为实现上述目的,本发明提供了一种高效taq酶的冻干保护剂,由如下的一种或几
种组合形成:10mm ~50mm tris
‑
hcl(ph 8.0)、5%~30%海藻糖、1%~10%甘露醇、1mg/ml~10mg/ml牛血清白蛋白、5mm ~30mm叠氮化钠、0.01%~0.1%吐温20、5%~50%甘油、0.05%~0.5%se
‑
15、焦磷酸二乙酯处理过的水。对冻干所需的保护剂进行了优化,使冻干后的酶制剂成品性能更加稳定,存储时间更长。
8.一种酶贮存缓冲液,由如下的一种或几种组合形成:10mm ~50mm tris
‑
hcl(ph 8.0)、0.01 mm ~0.5mm edta、0.1 mm ~10mm dtt、50 mm ~500mm kcl、1~3%硫酸铵、1 mm ~5mm叠氮化钠、20mg/ml ~100mg/ml羟丙基
‑
beta
‑
环糊精、1~5m甜菜碱、0 .1~1%bsa、50~110mm pvp、1~5%柠檬酸钾、10%~70%甘油。对酶贮存缓冲液包含组分进行了优化,使液体状态的酶制剂性能可以更加稳定,存储时间更长。
9.一种适用于高效热启动taq酶的冻干方法,包括:预冻、升华干燥和解析干燥三个阶段;预冻设置为:第一阶段预冻温度在10min~40min内达到0 ℃ ~20℃,保持0.5~2 h;第二阶段预冻温度在10min~50min内达到
‑
20℃~
‑
50℃,保持1 h ~5 h;升华干燥设置为:第一阶段升华干燥温度在5min~40min内达到
‑
45℃ ~
ꢀ‑
30℃,保持1~3h,真空度为0 pa ~30pa;第二阶段升华干燥温度在5min ~ 40min内达到
‑
35℃~
ꢀ‑
20℃,保持5~20 h,真空度为0 pa ~30pa;解析干燥设置为:第一阶段解析干燥温度在10min~50min内达到10℃~20℃,保持1 h~3h,真空度为0 pa;第二阶段解析干燥温度在10min~50min内达到15℃~30℃,保持2 h~7 h,真空度为0 pa。
10.对冻干程序参数进行了优化,极大的提高了冻干制剂的性状,保证了冻干制剂的稳定性,同时使所得的冻干制剂具有美观的形态。高效热启动taq酶制剂通过通过冻干制备成冻干制剂后,其制备方法简单、特异性强,灵敏度高、重现性好,容易实现大规模生产,且更加方便客户使用和保存。
11.优选地,上述技术方案中,预冻结束后还设有退火操作,具体操作为在15min内退火温度达到
‑
30℃,并保持1.5h。退火能够改变冰晶颗粒的晶型及其尺寸大小,强化结晶,提高了制品的均匀性。退火可以提高非晶相冻结浓缩液的玻璃化转变温度,对升华干燥阶段以及和解析干燥阶段都有重大意义,使冻干制剂的性质更加稳定。退火也直接影响了冻干制品的质量外观等。
12.优选地,上述技术方案中,在冷冻干燥结束后,真空状态下冲入惰性气体,箱内压塞后出箱。
13.优选地,上述技术方案中,惰性气体为氮气、氩气、氦气、二氧化碳中的一种。
14.优选地,上述技术方案中,高效taq酶制剂通过真空冷冻干燥得到的冻干制剂成品的含水量为0.1%~5%。冻干制剂含水量低,可以延长核酸检测试剂的保质期。高效热启动taq酶制剂通过冻干制备成冻干制剂后,可以完全摆脱冷链运输的限制,实现常温条件下运输。
15.一种适用于高效热启动taq酶的冻干制剂制备方法,其特征在于,在高效热启动taq酶的真空冷冻干燥过程中加入1/3体积的冻干保护剂。
16.一种热启动taq酶的优化制备方法,使用单克隆抗体对taq酶的活性中心进行封闭获得。通过单克隆抗体修饰、适配体修饰和单链结合蛋白修饰方法对热启动taq酶进行热启动修饰,明显提高了荧光pcr的扩增效率(尤其对于低拷贝数模板),改善了扩增曲线的完美
度,其稳定性好、可重复性好、特异性强,使其性能更能适应市场的需求。
17.优选地,上述技术方案中,具体步骤如下:步骤1,获得taq酶;步骤2,将单克隆抗体与获得的taq酶按一定的摩尔比混合后,在预设温度下孵育,使之形成抗原抗体复合物,获得热启动taq酶。
18.一种热启动taq酶的优化制备方法,利用化学基团与酶的活性中心的化学基团进行化学反应,从而封闭酶的活性,获得热启动taq酶;当温度升到预定数值时,化学基团与酶的活性中心的化学键断裂,酶的活性得以释放,达到热启动的目的。
19.优选地,上述技术方案中,化学试剂是指乙酸酐、苯甲酸酐二甲基马来酸酐、邻苯二甲酸酐、丁二酸酐、二甲基马来酸酐、柠康酸酐中的一种或者其他具有等同效果的试剂。
20.一种热启动taq酶的优化制备方法,将单链结合蛋白基因序列连接在taq酶序列的5’端,利用大肠杆菌进行融合表达,制备获得单链结合蛋白
‑
taq酶重组蛋白。重组taq酶可以显著提高taq酶与扩增模板之间的结合能力,在较低循环数就能从低拷贝数的样本中检测、克隆到目的基因,在多重pcr检测中灵敏度高、特异性强。
21.一种高效热启动taq酶液体试剂的制备方法,在热启动taq酶的液体试剂中加入了如前文所述的的酶贮存缓冲液。使热启动taq酶的液体试剂性能更加稳定,储存时间更长。高效热启动taq酶,其稳定性好、重复性好、特异性强、制备方法简单,更能适应市场的需求。
22.与现有技术相比,本发明具有如下有益效果:我们提出了一种高效热启动taq酶的优化及制备方法,通过本发明制备的高效热启动taq聚合酶可以有效地避免非特异性序列的发生,提高了dna聚合酶的反应特异性、可靠性、均一性和灵敏性,提高了扩增效率,在较低循环数就能从低拷贝数的样本中检测、克隆到目的基因,可以很大程度上减少人为误差,用于常规pcr反应、复杂模板等的扩增和检测。最终获得的高效热启动taq酶,其稳定性好、重复性好、特异性强、制备方法简单,更能适应市场的需求。
23.附图说明:图1为本技术实施例中用优化筛选的酶贮存缓冲液贮存的taq酶和未用酶贮存缓冲液贮存的taq酶在室温条件下放置24小时的pcr扩增曲线图;图2为本技术实施例中用优化筛选的酶贮存缓冲液贮存的taq酶和未用酶贮存缓冲液贮存的taq酶在
‑
20℃条件下放置1年的pcr扩增曲线图;图3为本技术实施例中单克隆抗体修饰热启动taq酶比商业热启动taq酶在相同测试条件下的的pcr扩增曲线图;图4为本技术实施例中单克隆抗体修饰热启动taq酶比商业热启动taq酶放入
‑
20℃冰箱保存一年的pcr扩增曲线图;图5为本技术实施例中单克隆抗体修饰热启动taq酶和商业热启动taq酶分别冻融20次的pcr扩增曲线图;图6为本技术实施例中化学修饰热启动taq酶比商业热启动taq酶的在相同测试条件下的pcr扩增曲线图;图7.1多重pcr实验中fam通道的扩增曲线;图7.2多重pcr实验中vic通道的扩增曲线;
图7.3多重pcr实验中rox通道的扩增曲线;图7.4多重pcr实验中cy5通道的扩增曲线;图8为本技术实施例中的热启动taq酶西林瓶冻干制剂室温放置2个月和
‑
20℃放置的未进行冻冷冻干燥处理的热启动taq酶在相同测试条件下的pcr扩增曲线图;图9为本技术实施例中的热启动taq酶西林瓶冻干制剂45℃放置2个月和
‑
20℃存放的商业热启动taq酶在相同测试条件下的pcr扩增曲线图。
24.具体实施方式:下面对本发明的具体实施方式进行详细描述,但应当理解本发明的保护范围并不受具体实施方式的限制。
25.除非另有其它明确表示,否则在整个说明书和权利要求书中,术语“包括”或其变换如“包含”或“包括有”等等将被理解为包括所陈述的元件或组成部分,而并未排除其它元件或其它组成部分。
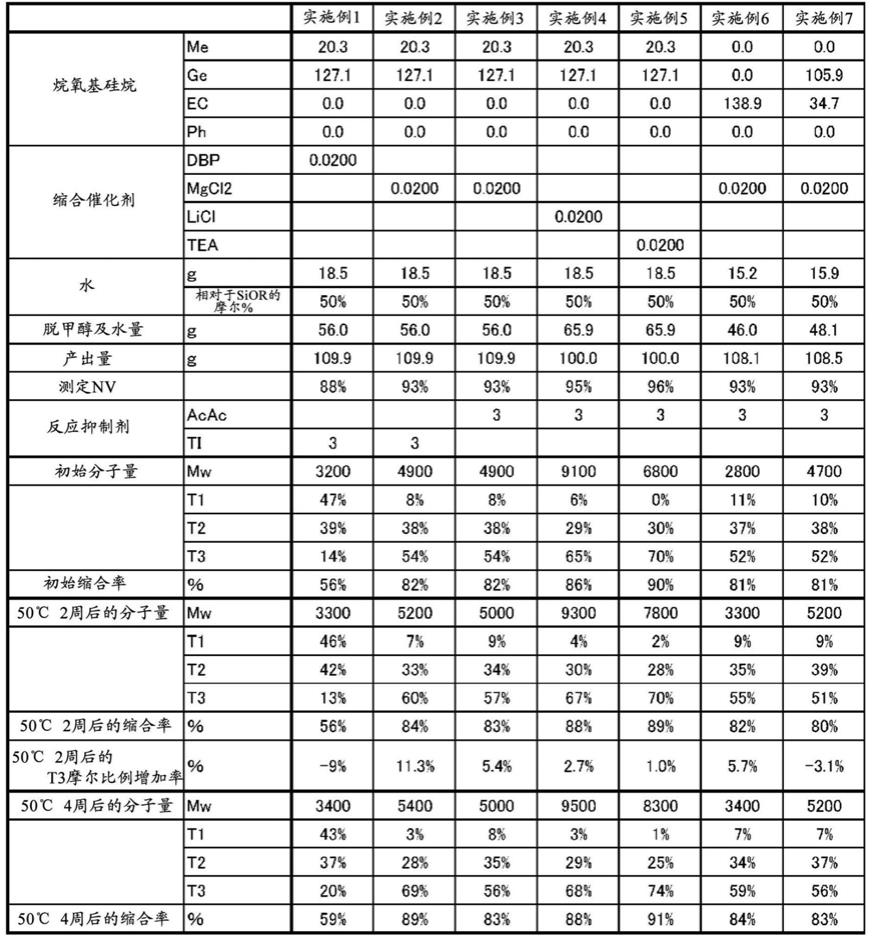
26.实施例1在本实施例中,提供了一种taq酶的表达和纯化方法。本实施例中用到的taq酶菌种为本公司自有。
27.具体步骤如下:(1)配制lb培养基,灭菌,备用。
28.(2)将40μl的taq酶菌种接种到40ml的lb培养基中,37℃,180r/min过夜培养活化taq酶菌种。第2天取活化后的taq酶菌种40ml接种到4l的lb培养基中进行扩大培养,待菌液od值为0.6~0.8时,加入终浓度为0.5mmol/liptg,37℃,180r/min振荡培养8小时,诱导taq酶的表达。离心去上清,收集菌体备用。
29.(3)taq酶纯化前处理:用100ml的a液(50mmol/ltris
‑
hcl(ph=8.0)、1mmol/ledta、50mmol/ldextrose、0.1mmol/ldtt)于冰上重悬沉淀,使用超声波细胞粉碎机进行细胞破碎,然后75℃水浴60min,8000rpm,4℃离心20min,去除沉淀,保留上清备用。
30.(4)taq酶的纯化:上清液利用0.22μm滤膜过滤,用a液平衡层析柱。将样品泵入平衡好的层析柱上。样品用b液(50mmol/ltris
‑
hcl(ph=8.8)、200mmol/l咪唑、50mmol/lnacl)进行洗脱,收集taq酶样品并放入透析袋中。用c液(50mmol/ltris
‑
hcl(ph=8.8)、100mmol/lkcl、0.5mmol/ledta(ph=8.0)、1mmol/ldtt)4℃冰箱内透析24h左右,透析完成后,将taq酶样品利用0.22μm滤膜过滤。从透析袋中取出taq酶样品,过离子柱脱盐后即得到纯化的taq酶。放入
‑
80℃贮存备用。
31.实施例2在本实施例中,提供了一种用于taq酶长期贮存的酶贮存缓冲液。
32.(1)获得taq酶。
33.(2)按下表1所示,配制不同组别的酶贮存缓冲液,从中筛选出优化的酶贮存缓冲液。
34.表1不同酶贮存缓冲液的配制
组号酶贮存缓冲液组分120mmtris
‑
hcl(ph8.0)、0.1mmedta、0.5mm dtt、50mm kcl、2mm叠氮化钠、30mg/ml羟丙基
‑
beta
‑
环糊精、3m甜菜碱、0.5%bsa 、50%甘油、焦磷酸二乙酯处理过的水。
220mmtris
‑
hcl(ph8.0)、0.1mmedta、0.5mm dtt、50mm kcl、2%硫酸铵、2mm叠氮化钠、3m甜菜碱、0.5%bsa 、60mmpvp、50%甘油、焦磷酸二乙酯处理过的水。320mmtris
‑
hcl(ph8.0)、0.1mmedta、1mm dtt、100mm kcl、2%硫酸铵、2mm叠氮化钠、30mg/ml羟丙基
‑
beta
‑
环糊精、3m甜菜碱、0.5%bsa 、50%甘油、焦磷酸二乙酯处理过的水。420mmtris
‑
hcl(ph8.0)、0.1mmedta、1mm dtt、100mm kcl、2%硫酸铵、2mm叠氮化钠、3m甜菜碱、0.5%bsa 、1.5%柠檬酸钾、50%甘油、焦磷酸二乙酯处理过的水。520mmtris
‑
hcl(ph8.0)、0.1mmedta、1mm dtt、100mm kcl、2%硫酸铵、2mm叠氮化钠、30mg/ml羟丙基
‑
beta
‑
环糊精、3m甜菜碱、0.5%bsa 、60mmpvp、1.5%柠檬酸钾、50%甘油、焦磷酸二乙酯处理过的水。640mmtris
‑
hcl(ph8.0)、0.1mmedta、0.5mm dtt、50mm kcl、2mm叠氮化钠、30mg/ml羟丙基
‑
beta
‑
环糊精、3m甜菜碱、0.5%bsa 、50%甘油、焦磷酸二乙酯处理过的水。740mmtris
‑
hcl(ph8.0)、0.1mmedta、0.5mm dtt、50mm kcl、1.5%硫酸铵、2mm叠氮化钠、3m甜菜碱、0.5%bsa 、60mmpvp、50%甘油、焦磷酸二乙酯处理过的水。840mmtris
‑
hcl(ph8.0)、0.1mmedta、1mm dtt、100mm kcl、1.5%硫酸铵、2mm叠氮化钠、30mg/ml羟丙基
‑
beta
‑
环糊精、3m甜菜碱、0.5%bsa 、50%甘油、焦磷酸二乙酯处理过的水。940mmtris
‑
hcl(ph8.0)、0.1mmedta、1mm dtt、100mm kcl、1.5%硫酸铵、2mm叠氮化钠、3m甜菜碱、0.5%bsa 、1%柠檬酸钾、50%甘油、焦磷酸二乙酯处理过的水。1040mmtris
‑
hcl(ph8.0)、0.1mmedta、1mm dtt、100mm kcl、1.5%硫酸铵、2mm叠氮化钠、30mg/ml羟丙基
‑
beta
‑
环糊精、3m甜菜碱、0.5%bsa 、60mmpvp、1%柠檬酸钾、50%甘油、焦磷酸二乙酯处理过的水。
35.(3)使用酶贮存缓冲液将taq酶稀释成终浓度为2.5u/μl,用无菌0.22μm的滤膜进行过滤处理,然后分装到无菌的洁净离心管中,
‑
20℃储存。
36.(4) 优化酶贮存缓冲液组分的筛选结果。
37.在同一实验条件下用实时荧光定量pcr实验进行测试,筛选出的优化酶贮存缓冲液组分为组别号4,包括:20mm tris
‑
hcl(ph 8.0)、0.1mm edta、1mm dtt、100mm kcl、2%硫酸铵、2mm叠氮化钠、3m甜菜碱、0.5%bsa 、1.5%柠檬酸钾、50%甘油。
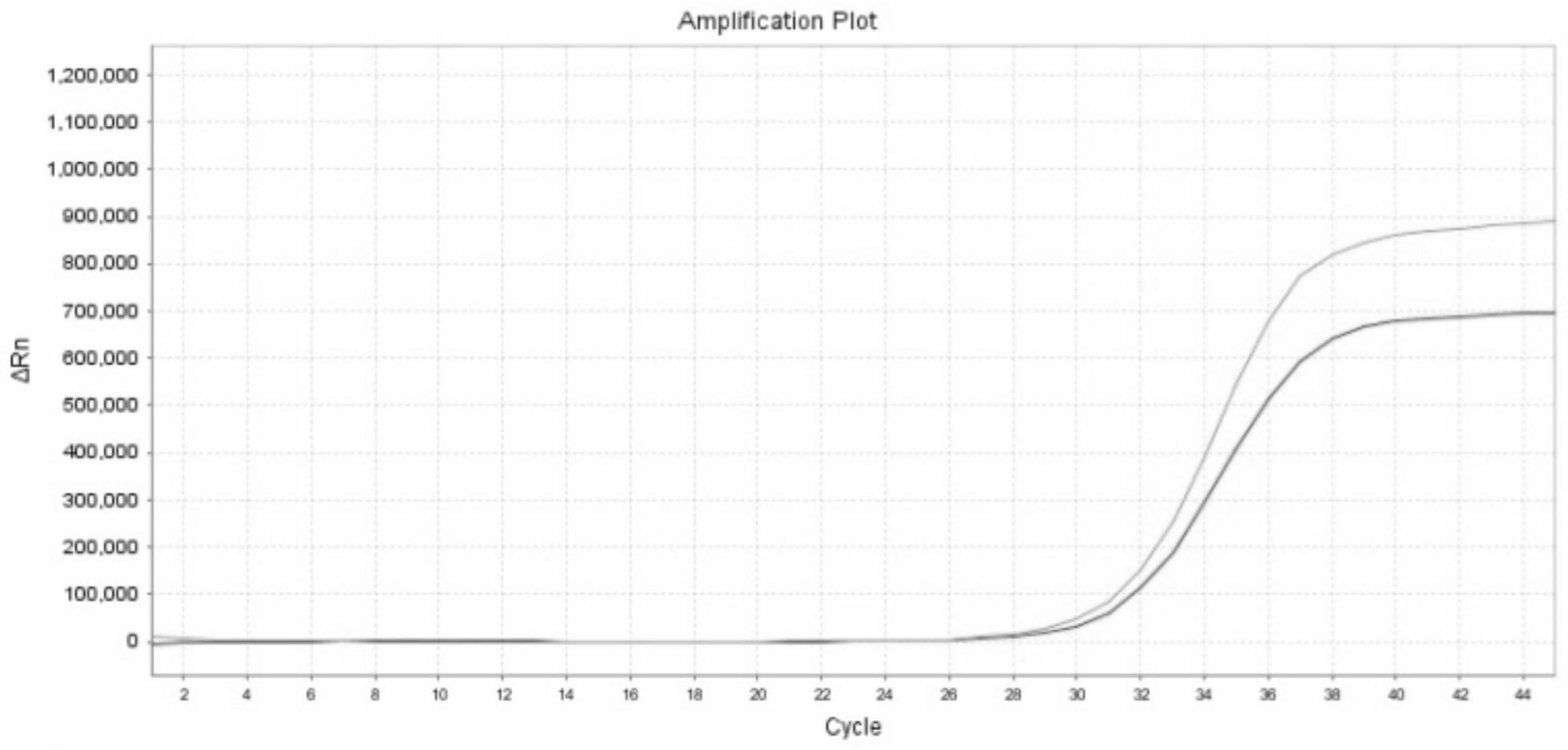
38.(5)酶贮存缓冲液长期贮存性能验证用优化筛选的酶贮存缓冲液贮存的taq酶和未用酶贮存缓冲液贮存的taq酶在4℃条件下放置2个月,在同一实验条件下用实时荧光定量pcr实验进行测试,pcr扩增结果表明在4℃条件下放置2个月,未用酶贮存缓冲液贮存的taq酶比用酶贮存缓冲液稀释的taq酶的pcr扩增曲线荧光值有明显的降低,结果如附图1所示。
39.用优化筛选的酶贮存缓冲液贮存的taq酶和未用酶贮存缓冲液贮存的taq酶在
‑
20℃条件下放置1年的时间,在同一实验条件下用实时荧光定量pcr实验进行测试,pcr扩增结果表明在
‑
20℃条件下放置1年的时间,未用酶贮存缓冲液贮存的taq酶比用酶贮存缓冲液稀释的taq酶的pcr扩增曲线荧光值有明显的降低,结果如附图2所示。
40.实施例3在本实施例中,提供了一种热启动taq酶的优化制备方法,使用单克隆抗体对taq酶的活性中心进行封闭获得。在本实施例中所用的单克隆抗体购至厦门市同仁心医药有限公司,taq酶实施例1制备。
41.具体步骤如下:(1)获得taq酶。
42.(2)将采购单克隆抗体与获得的taq酶按摩尔比1:1、1.2:1、1.5:1、1.7:1、2:1的比例混合后,分别在37℃或50℃条件下孵育1h,使之形成抗原抗体复合物,获得热启动taq酶。
43.(3)修饰过后的热启动taq酶和未修饰的taq酶用实时荧光定量pcr的方法进行酶
活测试:将修饰过后的热启动taq酶和未修饰的taq酶在同一实验条件下进行测试,具体还包括,将修饰过后的热启动taq酶和未修饰的taq酶在相同浓度模板条件下进行测试。
44.实时荧光定量pcr测试结果表明:当将单克隆抗体与taq酶按摩尔比1.5:1的比例混合后,50℃孵育1h,获得热启动taq酶的酶活较好,其ct值和荧光值较其他条件处理得到的热启动taq酶、未修饰的taq酶都有明显的改进。所以选择单克隆抗体与taq酶按摩尔比1.5:1的比例混合后,50℃孵育1h的方法制备热启动taq酶。
45.(4)本实施例的热启动taq酶与商业热启动taq酶(购至南京诺唯赞生物科技有限公司(货号p401))的性能测试,将本实施例的热启动taq酶和商业热启动taq酶在同一实验条件下进行测试,具体还包括,将本实施例的的热启动taq酶和商业热启动taq酶在相同浓度模板条件下进行测试。
46.实时荧光定量pcr测试结果表明:本实施例的热启动taq酶比商业热启动taq酶的ct值和荧光值都有明显的改进,扩增曲线更加完美,结果如附图3所示。
47.(5)对实施例的热启动taq酶进行冷冻保存稳定性测试。
48.将本实施例的热启动taq酶和商业热启动taq酶放入
‑
20℃冰箱,保存一年;一年后取出,在同一实验条件下通过实时荧光定量pcr的方法进行酶活测试,结果发现:本实施例的热启动taq酶冻存一年后的pcr扩增曲线比商业热启动taq酶的冻存一年后的pcr扩增曲线荧光值高、ct值小,结果如附图4所示。
49.(6)对热启动taq酶进行抗反复冻融稳定性测试。
50.将实施例的热启动taq酶和商业热启动taq酶在相同的测试条件下分别冻融20次,在同一实验条件下通过实时荧光定量pcr的方法进行酶活测试,结果发现:本实施例的热启动taq酶冻融20次后的pcr扩增曲线比商业热启动taq酶的冻融20次后的pcr扩增曲线荧光值高,pcr扩增曲线更加完美,结果如附图5所示。
51.实施例4在本实施例中,提供了一种热启动taq酶的优化制备方法,利用一些化学物质的基团与酶的活性中心的重要化学基团进行化学反应,从而封闭酶的活性,获得热启动taq酶。当温度升高时,化学基团与酶的活性中心的化学键断裂,酶的活性得以释放,达到热启动的目的。
52.具体步骤如下:(1)获得taq酶,taq酶为实施例1制备。
53.(2)按下表2不同的化学修饰方式,获得热启动taq酶。
54.表2不同的化学修饰方式
化学物质名称taq酶与化学修饰剂的比例反应温度反应时间乙酸酐(1m)1:50、1:100、125、1:500、1:750或1:10004℃、37℃、45℃或55℃1h、4h、8h、12h、18h或24h苯甲酸酐二甲基马来酸酐(1m)1:50、1:100、125、1:500、1:750或1:10004℃、37℃、45℃或55℃1h、4h、8h、12h、18h或24h邻苯二甲酸酐(1m)1:50、1:100、1250、1:500、1:750或1:10004℃、37℃、45℃或55℃1h、4h、8h、12h、18h或24h丁二酸酐(1m)1:50、1:100、125、1:500、1:750或1:10004℃、37℃、45℃或55℃1h、4h、8h、12h、18h或24h二甲基马来酸酐(1m)1:50、1:100、125、1:500、1:750或1:10004℃、37℃、45℃或55℃1h、4h、8h、12h、18h或24h柠康酸酐(1m)1:50、1:100、125、1:500、1:750或1:10004℃、37℃、45℃或55℃1h、4h、8h、12h、18h或24h
55.(3)修饰过后的热启动taq酶和未修饰的taq酶用实时荧光定量pcr的方法进行酶活测试:将上述表中修饰过后的热启动taq酶和未修饰的taq酶在同一实验条件下进行测试,具体还包括,将修饰过后的热启动taq酶和未修饰的taq酶在同一高浓度模板和低浓度
模板下进行测试。
56.实时荧光定量pcr测试结果表明:二甲基马来酸酐(1m)与taq酶按1:100的比例混匀,在4℃条件下反应24 h的pcr扩增效果较好。
57.(4)本实施例的热启动taq酶与商业热启动taq酶(购至以购自南京诺唯赞生物科技有限公司(货号p401))的性能测试,将本实施例的热启动taq酶和商业热启动taq酶在同一实验条件下进行测试,具体还包括,将本实施例的的热启动taq酶和商业热启动taq酶在相同浓度模板条件下进行测试。
58.实时荧光定量pcr测试结果表明:本实施例的热启动taq酶比商业热启动taq酶的ct值和荧光值都有明显的改进,扩增曲线更加完美,结果如附图6所示。
59.实施例5在本实施例中,提供了一种热启动taq酶的优化制备方法,将单链结合蛋白基因序列连接在taq酶序列的5’端,利用大肠杆菌进行融合表达,制备获得单链结合蛋白
‑
taq酶重组蛋白。重组taq酶可以显著提高taq酶与扩增模板之间的结合能力,在较低循环数就能从低拷贝数的样本中检测、克隆到目的基因,在多重pcr检测中灵敏度高、特异性强。
60.具体步骤如下:(1)从ncbi网站查询单链结合蛋白的基因序列,选取单链结合蛋白的1
‑
110氨基酸的基因序列作为目的基因,然后将目的基因序列交由生工生物工程(上海)股份有限公司进行基因合成。
61.(2)设计将合成的目的基因连接于taq酶基因序列的5’端,构建重组质粒,然后将重组质粒转入大肠杆菌感受态细胞中进行融合表达,通过菌落pcr实验获得正确表达的阳性单菌落。
62.(3)将获得的正确表达的阳性单菌落接种于液体lb培养基中进行扩大培养,参考上述实施例1中的方法纯化获得单链结合蛋白
‑
taq酶重组蛋白,放入
‑
80℃贮存备用。
63.(4)单链结合蛋白
‑
taq酶性能稳定性测试本实施例的单链结合蛋白
‑
taq酶和商业热启动taq酶(购至以购自南京诺唯赞生物科技有限公司(货号p401))在多重pcr实验中的性能测试,将本实施例的热启动taq酶和商业热启动taq酶在同一实验条件下进行测试,具体还包括,将本实施例的的热启动taq酶和商业热启动taq酶在相同浓度模板条件下进行测试。
64.多重pcr实验测试结果表明:本实施例的taq酶比商业热启动taq酶的ct值和荧光值都有明显的改进,扩增效率高,各引物之间的竞争较小,不同引物扩增产物生成水平比较均一,结果如附图7所示。
65.实施例6在本实施例中,提供了一种高效热启动taq酶的冻干试剂制备方法,通过真空冷冻干燥方法,制备得到taq酶西林瓶冻干制剂。
66.冻干保护剂混合液包括:10mm ~50mm tris
‑
hcl(ph 8.0)、5%~30%海藻糖、1%~10%甘露醇、1mg/ml~10mg/ml牛血清白蛋白、5mm ~30mm叠氮化钠、0.01%~0.1%吐温20、5%~50%甘油、0.05%~0.5%se
‑
15以及焦磷酸二乙酯处理过的水中的一种或几种。
67.具体步骤如下:(1)按下表3所示,配制不同组别的冻干保护剂混合液,通过真空冷冻干燥过程和
后期相关检测,从中筛选出优化的冻干保护剂组分。
68.表3不同组别的冻干保护剂混合液配制
组号 115mmtris
‑
hcl(ph8.0)、5%海藻糖、5%甘露醇、5mg/ml牛血清白蛋白、10mm叠氮化钠、0.05%吐温20、0.1%se
‑
15以及焦磷酸二乙酯处理过的水215mmtris
‑
hcl(ph8.0)、10%海藻糖、3.5%甘露醇、5mg/ml牛血清白蛋白、10mm叠氮化钠、0.05%吐温20、0.1%se
‑
15以及焦磷酸二乙酯处理过的水。315mmtris
‑
hcl(ph8.0)、10%海藻糖、3.5%甘露醇、5mg/ml牛血清白蛋白、10mm叠氮化钠、0.05%吐温20、10%甘油、0.1%se
‑
15以及焦磷酸二乙酯处理过的水。425mmtris
‑
hcl(ph8.0)、5%海藻糖、5%甘露醇、5mg/ml牛血清白蛋白、10mm叠氮化钠、0.05%吐温20、0.1%se
‑
15以及焦磷酸二乙酯处理过的水525mmtris
‑
hcl(ph8.0)、10%海藻糖、3.5%甘露醇、5mg/ml牛血清白蛋白、10mm叠氮化钠、0.05%吐温20、0.1%se
‑
15以及焦磷酸二乙酯处理过的水。625mmtris
‑
hcl(ph8.0)、10%海藻糖、3.5%甘露醇、5mg/ml牛血清白蛋白、10mm叠氮化钠、0.05%吐温20、10%甘油、0.1%se
‑
15以及焦磷酸二乙酯处理过的水。740mmtris
‑
hcl(ph8.0)、5%海藻糖、5%甘露醇、5mg/ml牛血清白蛋白、10mm叠氮化钠、0.05%吐温20、0.1%se
‑
15以及焦磷酸二乙酯处理过的水。840mmtris
‑
hcl(ph8.0)、10%海藻糖、3.5%甘露醇、5mg/ml牛血清白蛋白、10mm叠氮化钠、0.05%吐温20、0.1%se
‑
15以及焦磷酸二乙酯处理过的水。940mmtris
‑
hcl(ph8.0)、10%海藻糖、3.5%甘露醇、5mg/ml牛血清白蛋白、10mm叠氮化钠、0.05%吐温20、10%甘油、0.1%se
‑
15以及焦磷酸二乙酯处理过的水。
69.(2)将单克隆抗体修饰过的热启动taq酶和配制好的冻干保护剂混合液按2:1的比例混匀。
70.(3)将混匀后的液体试剂利用精确分液系统分装到西林瓶中。
71.(4)将西林瓶放入真空冷冻干燥机中冷冻干燥。
72.(5)冻干程序参数设定:预冻设置包括:第一阶段预冻温度在20min内达到0℃,保持0.5h;第二阶段预冻温度在30min内达到
‑
40℃,保持3h。
73.升华干燥设置包括:第一阶段升华干燥温度在10min内达到
‑
35℃,保持2h,真空度为12pa;第二阶段升华干燥温度在20min内达到
‑
30℃,保持16h,真空度为12pa。
74.解析干燥设置包括:第一阶段解析干燥温度在30min内达到15℃,保持1.5h,真空度为0pa;第二阶段解析干燥温度在20min内达到25℃,保持5h,真空度为0pa。
75.(6)冻干结束后,冲入氮气,箱内压塞,环境的温度和湿度达到要求后,打开冻干机箱门,取出热启动taq酶西林瓶冻干制剂。
76.(7)观察冻干试剂的外观,利用卡式水分测定仪测定冻干试剂的水分含量,并在同一实验条件下通过pcr扩增实验测试其性能,具体结果如下表3所示:表3冻干试剂的外观和水分含量测定组号外观水分含量测定pcr扩增结果
1冻干试剂塌陷2.51%扩增曲线荧光值低、ct值延后2冻干试剂略微塌陷2.42%扩增曲线荧光值低3冻干试剂塌陷2.47%扩增曲线荧光值低、ct值延后4冻干试剂塌陷2.58%扩增曲线荧光值低5外观美观、外形饱满2.36%扩增曲线s性完美、特异性强6冻干试剂略微塌陷2.45%扩增曲线荧光值低7冻干试剂底部塌陷2.52%扩增曲线荧光值低8冻干试剂分层2.54%扩增曲线荧光值低、ct值延后9冻干试剂分层2.63%扩增曲线荧光值低、ct值延后
77.(8)优化冻干赋形剂组分的筛选结果。
78.通过上述检测筛选出的优化冻干赋形剂组分为组别号5,包括:25mmtris
‑
hcl(ph8.0)、10%海藻糖、3.5%甘露醇、5mg/ml牛血清白蛋白、10mm叠氮化钠、0.05%吐温20、0.1%se
‑
15以及焦磷酸二乙酯处理过的水。
79.(9)将合格的热启动taq酶西林瓶冻干制剂进行密封处理。
80.(10)热启动taq酶西林瓶冻干制剂室温稳定性测试将热启动taq酶西林瓶冻干制剂室温放置3个月和未冻干的热启动taq酶在相同的实验条件下进行pcr扩增测试测试其室温稳定性,结果发现:本实施例中的热启动taq酶西林瓶冻干制剂室温放置3个月的pcr扩增曲线比
‑
20℃放置的未进行冻冷冻干燥处理的热启动taq酶的pcr扩增曲线荧光值稍有降低,但是整体性能差异不太明显,结果如附图8所示。
81.(11)热启动taq酶西林瓶冻干制剂45℃加速稳定性测试将热启动taq酶西林瓶冻干制剂45℃放置2个月和
‑
20℃存放的商业热启动taq酶(购至以购自南京诺唯赞生物科技有限公司(货号p401))在相同的实验条件下进行pcr扩增测试热启动taq酶西林瓶冻干制剂的高温加速稳定性,结果发现:本实施例中的热启动taq酶西林瓶冻干制剂45℃放置2个月的pcr扩增曲线比商业热启动taq酶的pcr扩增曲线荧光值差异不明显,结果如附图9所示。
82.实施例7在本实施例中,提供了一种高效热启动taq酶的冻干试剂制备方法,通过真空冷冻干燥方法,在预冻阶段加入退火操作,制备得到热启动taq酶西林瓶冻干制剂。所用的冻干保护剂混合液为实施例4筛选优化出,具体组分包括:包括:25mm tris
‑
hcl(ph 8.0)、10%海藻糖、3.5%甘露醇、 5mg/ml牛血清白蛋白、10mm叠氮化钠、0.05%吐温20、0.1%se
‑
15以及焦磷酸二乙酯处理过的水。
83.具体步骤如下:(1)配制优化后的冻干保护剂混合液。
84.(2)将单克隆抗体修饰过的热启动taq酶和配制好的冻干保护剂混合液按2:1的比例混匀。
85.(4)将混匀后的液体试剂利用精确分液系统分装到西林瓶中。
86.(5)将西林瓶放入真空冷冻干燥机中冷冻干燥。
87.(6)冻干程序参数设定:预冻设置为:
第一阶段预冻温度在20min内达到0℃,保持0.5 h;第二阶段预冻温度(退火操作)在15min内达到
‑
30℃,保持1.5h。
88.第三阶段预冻温度在30min内达到
‑
45℃,保持3h。
89.在预冻设置中也可以加入退火操作,退火能够改变冰晶颗粒的晶型及其尺寸大小,强化结晶,提高了制品的均匀性。退火可以提高非晶相冻结浓缩液的玻璃化转变温度,对升华干燥阶段以及和解析干燥阶段都有重大意义,使冻干制剂的性质更加稳定。退火也直接影响了冻干制品的质量外观等。
90.升华干燥包括:第一阶段升华干燥温度在10min内达到
‑
35℃,保持2 h,真空度为12 pa;第二阶段升华干燥温度在20min内达到
‑
30℃,保持16h,真空度为12pa。
91.解析干燥包括:第一阶段解析干燥温度在30min内达到15℃,保持1 .5h,真空度为0pa;第二阶段解析干燥温度在20min内达到25℃,保持5 h,真空度为0pa。
92.(7)冻干结束后,冲入氮气,箱内压塞,环境的温度和湿度达到要求后,打开冻干机箱门,取出热启动taq酶西林瓶冻干制剂。
93.(8)观察冻干制剂的外观是否合格。
94.(9)利用卡式水分测定仪测定冻干制剂的水分含量。(利用卡式水分测定仪测定冻干制剂的水分含量为2.24%)(10)将热启动taq酶西林瓶冻干制剂进行密封处理。
95.附图详解:图1为本技术实施例中用优化筛选的酶贮存缓冲液贮存的taq酶和未用酶贮存缓冲液贮存的taq酶在4℃条件下放置2个月的pcr扩增曲线图(蓝色曲线为优化筛选的酶贮存缓冲液贮存的taq酶的pcr扩增曲线,红色曲线为未用酶贮存缓冲液贮存的taq酶的pcr扩增曲线)。
96.图2为本技术实施例中用优化筛选的酶贮存缓冲液贮存的taq酶和未用酶贮存缓冲液贮存的taq酶在
‑
20℃条件下放置1年的pcr扩增曲线图(蓝色曲线为优化筛选的酶贮存缓冲液贮存的taq酶的pcr扩增曲线,红色曲线为未用酶贮存缓冲液贮存的taq酶的pcr扩增曲线)。
97.图3为本技术实施例中单克隆抗体修饰热启动taq酶比商业热启动taq酶的pcr扩增曲线图(蓝色曲线为本技术实施例中单克隆抗体修饰热启动taq酶的pcr扩增曲线,红色曲线为商业热启动taq酶的pcr扩增曲线)。
98.图4为本技术实施例中单克隆抗体修饰热启动taq酶比商业热启动taq酶放入
‑
20℃冰箱保存一年,在相同的测试条件下的pcr扩增曲线图(蓝色曲线为本技术实施例中单克隆抗体修饰热启动taq酶的pcr扩增曲线,红色曲线为商业热启动taq酶的pcr扩增曲线)。
99.图5为本技术实施例中单克隆抗体修饰热启动taq酶和商业热启动taq酶在相同的测试条件下分别冻融20次的pcr扩增曲线图(蓝色曲线为本技术实施例中单克隆抗体修饰热启动taq酶的pcr扩增曲线,红色曲线为商业热启动taq酶的pcr扩增曲线)。
100.图6为本技术实施例中化学修饰热启动taq酶比商业热启动taq酶的pcr扩增曲线图(蓝色曲线为本技术实施例中化学修饰热启动taq酶的pcr扩增曲线,红色曲线为商业热
启动taq酶的pcr扩增曲线)。
101.图7为本技术实施例中单链结合蛋白
‑
taq酶比商业热启动taq酶在多重pcr实验中的扩增曲线图(蓝色曲线为本技术实施例中单链结合蛋白
‑
taq酶的pcr扩增曲线,红色曲线为商业热启动taq酶的pcr扩增曲线)。
102.图8为本技术实施例中的热启动taq酶西林瓶冻干制剂室温放置3个月的pcr扩增曲线比
‑
20℃放置的未进行冻冷冻干燥处理的热启动taq酶的pcr扩增曲线图(蓝色曲线为本技术实施例中单克隆抗体修饰热启动taq酶的pcr扩增曲线,红色曲线为
‑
20℃放置的未进行冻冷冻干燥处理的热启动taq酶的pcr扩增曲线)。
103.图9为本技术实施例中的热启动taq酶西林瓶冻干制剂45℃放置2个月和
‑
20℃存放的商业热启动taq酶在相同测试条件下的pcr扩增曲线图(蓝色曲线为本技术实施例中热启动taq酶西林瓶冻干制剂45℃放置2个月的pcr扩增曲线,红色曲线为
‑
20℃存放的商业热启动taq酶的pcr扩增曲线)。
104.前述对本发明的具体示例性实施方案的描述是为了说明和例证的目的。这些描述并非想将本发明限定为所公开的精确形式,并且很显然,根据上述教导,可以进行很多改变和变化。对示例性实施例进行选择和描述的目的在于解释本发明的特定原理及其实际应用,从而使得本领域的技术人员能够实现并利用本发明的各种不同的示例性实施方案以及各种不同的选择和改变。本发明的范围意在由权利要求书及其等同形式所限定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。