一种提取血浆游离dna的试剂盒和方法
技术领域
1.本发明涉及血浆游离dna提取技术领域。更具体地,涉及一种提取血浆游离dna的试剂盒和方法。
背景技术:
2.血浆游离dna即cell
‑
free dna,是指血浆中游离于细胞外的已经发生部分降解的集体内源性dna,主要来源于细胞凋亡(snyder m w,kircher m,hill a j,et al.cell
‑
free dna comprises an in vivo nucleosome footprint that informs its tissues
‑
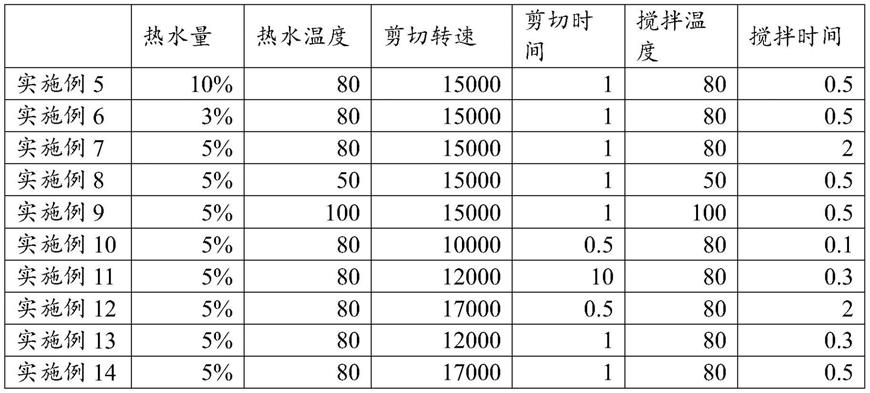
of
‑
origin[j].cell,2016,164(1
‑
2):57
‑
68.),片段大小集中在150
‑
200bp。随着对cfdna研究的深入,发现cfdna含有非常重要的遗传信息。由于能方便和无创地获取cfdna以及cfdna含有的重要的遗传信息(volik s,alcaide m,morin r d,et al.cell
‑
free dna(cfdna):clinical significance and utility in cancer shaped by emerging technologies[j].molecular cancer research,2016,14(10):898
‑
908.),以cfdna为代表的液体活检技术成为了分子诊断或者辅助诊断的非常重要的技术,被广泛地应用于产前筛查、癌症早筛、基因突变检测、癌症用药指导、癌症实时监控等领域。
[0003]
cfdna提取的方法,主要有硅胶柱法、磁珠法和酚氯仿抽提法。其中,酚氯仿抽提法由于用到的试剂有毒性,且操作不方便,已基本被淘汰。硅胶柱法和磁珠法是目前市面上提取血浆cfdna的主要方法。硅胶柱法提取的劣势在于提取大体积血浆时需要多次离心过柱,非常不方便,优势在于提取的质量高(无大片段残留)。磁珠法的优势在于可以适用于大体积血浆cfdna的提取,但缺点是常常存在质量低(大片段残留)的问题。
[0004]
目前,对cfdna进行文库构建、二代测序是主要的下游应用之一。然而,磁珠法提取cfdna质量低(有大片段dna残留),导致文库构建中普遍存在文库构建效率偏低的问题,测序数据质量低,这也限制了其在二代测序中的准确性和应用范围。
[0005]
因此,需要提供一种新的提取cfdna的试剂和方法,以解决上述问题。
技术实现要素:
[0006]
本发明的第一个目的在于提供一种提取血浆游离dna(cfdna)的试剂盒,该试剂盒提取的cfdna质量高,用于二代测序文库构建时可提高效率、测序数据质量和准确性。
[0007]
本发明的第二个目的在于提供利用上述试剂盒在提取血浆游离dna(cfdna)中的应用。
[0008]
本发明的第三个目的在于提供利用上述试剂盒提取血浆游离dna(cfdna)的方法。
[0009]
本发明的第四个目的在于提供利用上述方法提取得到的血浆游离dna及其应用。
[0010]
为达到上述目的,本发明首先提供了一种提取血浆游离dna的试剂盒,所述试剂盒包括裂解液(lysis buffer)、结合液(binding buffer)、清洗液(clean buffer)、洗涤液(wash buffer)、洗脱液(elution buffer)、磁珠和蛋白酶k;
[0011]
所述裂解液含有2
‑
6mol/l的盐酸胍、0.5
‑
1.2mol/l的异硫氰酸胍和0.5
‑
2.4mol/l
碘化钠中的至少两种,10
‑
100mmol/l的tris
‑
乙酸,10
‑
100mmol/l的edta,体积分数5%
‑
15%(v/v)的tween
‑
80和np
‑
40中的至少一种,以及400
‑
800mmol/l的nacl;
[0012]
所述结合液含有2
‑
6mol/l的盐酸胍、0.5
‑
1.6mol/l的异硫氰酸胍和0.5
‑
1.5mol/l的碘化钠中的至少两种,10
‑
100mmol/l的tris
‑
乙酸,10
‑
100mmol/l的edta,质量体积分数0.05%
‑
0.5%(w/v)的peg6000,体积分数10%
‑
15%(v/v)的tween
‑
80和np
‑
40中的至少一种,以及体积分数30%
‑
70%(v/v)的异丙醇;
[0013]
所述清洗液含有2
‑
6mol/l的盐酸胍、0.6
‑
0.8mol/l的异硫氰酸胍和0.6
‑
0.8mol/l的碘化钠中的至少两种,10
‑
100mmol/l的tris
‑
乙酸,10
‑
50mmol/l的edta,体积分数8%
‑
10%(v/v)的tween
‑
80和np
‑
40中的至少一种,以及体积分数30%
‑
50%(v/v)的异丙醇;
[0014]
所述洗涤液含有5
‑
20mmol/l的tris
‑
乙酸,体积分数0.01%
‑
0.05%(v/v)的triton x
‑
100或tween
‑
80,以及体积分数80%(v/v)的无水乙醇;
[0015]
所述洗脱液含有5
‑
10mmol/l的tris
‑
乙酸,0.05
‑
0.3mmol/l的edta,以及体积分数0.01%
‑
0.05%(v/v)的tween
‑
80或者triton x
‑
100;
[0016]
所述蛋白酶k的浓度为10
‑
30mg/ml。
[0017]
进一步,所述磁珠为硅羟基修饰磁珠,粒径为1
‑
2μm;优选的,所述粒径为2μm。
[0018]
优选的,所述裂解液由0.8mol/l异硫氰酸胍、4mol/l盐酸胍、1.4mol/l碘化钠、25mmol/l tris
‑
乙酸、25mmol/l edta、体积分数10%tween
‑
80、600mmol/l nacl组成。
[0019]
优选的,所述结合液由0.6mol/l异硫氰酸胍、4mol/l盐酸胍、1.2mol/l碘化钠、25mmol/l tris
‑
乙酸、25mmol/l edta、质量体积分数0.05%peg6000、体积分数10%tween
‑
80和体积分数45%异丙醇组成。
[0020]
优选的,所述清洗液由3mol/l盐酸胍、0.6mol/l碘化钠、25mmol/l tris
‑
乙酸、25mmol/l edta、体积分数8%tween
‑
80和体积分数40%异丙醇组成。
[0021]
优选的,所述洗涤液由5mmol/l tris
‑
hcl、体积分数0.05%triton x
‑
100、体积分数80%无水乙醇组成。
[0022]
优选的,所述洗脱液由5mmol/l tris
‑
hcl、0.05mmol/l edta、体积分数0.03%triton x
‑
100组成。
[0023]
优选的,所述蛋白酶k浓度为20mg/ml。
[0024]
上述试剂盒中的裂解液、结合液、清洗液、洗涤液和/或洗脱液也在本发明的保护范围之内。本发明试剂盒实际上对裂解液、结合液、清洗液、洗涤液、洗脱液都分别进行了优化,因此,本发明上述裂解液、结合液、清洗液、洗涤液、洗脱液都可以分别单独与现有的磁珠法提取血浆游离dna的试剂进行组合以提取血浆游离dna,以提高提取质量。
[0025]
本发明进一步提供了上述试剂盒或上述试剂盒中的裂解液、结合液、清洗液、洗涤液和/或洗脱液在提取血浆游离dna中的应用。
[0026]
本发明试剂盒是针对血浆中的cfdna提取而研发的,因此,试剂盒中的裂解液、结合液、清洗液、洗涤液、洗脱液可以独立地提取血浆游离dna。
[0027]
本发明还提供了一种提取血浆游离dna的方法,所述方法为利用上述试剂盒进行提取,具体包括以下步骤:
[0028]
将蛋白酶k、血浆和裂解液混匀后进行孵育得到裂解混合物;
[0029]
裂解混合物冰浴后加入结合液和磁珠,混匀后静置,得到结合混合物;
[0030]
结合混合物置于磁力架上磁吸后弃掉上清,加入清洗液混匀后,置于磁力架上磁吸后弃掉上清;
[0031]
加入洗涤液混匀后,置于磁力架上磁吸后弃掉上清;
[0032]
离心处理后晾干,加入洗脱液,震荡后离心,置于磁力架上磁吸后,吸取液体,得到血浆游离dna。
[0033]
进一步,所述血浆与裂解液、结合液、清洗液、洗涤液、洗脱液、磁珠和蛋白酶k的体积比为:1500
‑
2500:150
‑
250:2000
‑
2500:800
‑
120:800
‑
1000:30
‑
70:60
‑
100:30
‑
50;优选的,所述血浆与裂解液、结合液、清洗液、洗涤液、洗脱液、磁珠和蛋白酶k的体积比为2000:200:2500:1000:1000:50:80:40。
[0034]
进一步,所述加入清洗液混匀后,置于磁力架上磁吸后弃掉上清后继续重复该步骤然后再进行下一步。
[0035]
进一步,所述加入洗涤液混匀后,置于磁力架上磁吸后弃掉上清后继续重复该步骤然后再进行下一步。
[0036]
在本发明具体的实施方式中,所述提取血浆游离dna的方法,包括以下步骤:
[0037]
将蛋白酶k、血浆和裂解液涡旋混匀后置于60℃水浴锅中孵育20min,期间震荡混匀2
‑
3次,得到裂解混合物;
[0038]
裂解混合物冰浴5min,加入结合液和磁珠,震荡混匀后于室温静置10min,期间震荡混匀2
‑
3次,得到结合混合物:
[0039]
结合混合物置于磁力架上磁吸3min,弃掉上清,然后加入清洗液,涡旋混匀15s,一并移出后置于磁力架上磁吸1min,弃掉上清;
[0040]
再次加入清洗液,涡旋混匀15s,上磁力架磁吸1min,弃掉上清;
[0041]
加入洗涤液,涡旋混匀15s,上磁力架磁吸1min,弃掉上清;
[0042]
再次加入洗涤液,涡旋混匀15s,上磁力架磁吸1min,弃掉上清;
[0043]
离心,弃掉剩余液体,室温开盖静置10min以晾干,加入洗脱液,室温涡旋震荡5min,离心,上磁力架磁吸1min,吸取液体得到cfdna。
[0044]
在本发明更具体的实施方式中,所述提取血浆游离dna的方法,包括以下步骤:
[0045]
将80μl蛋白酶k、2ml血浆和200μl裂解液涡旋混匀后置于60℃水浴锅中孵育20min,期间震荡混匀2
‑
3次,得到裂解混合物;
[0046]
裂解混合物冰浴5min,加入2.5ml结合液和40μl磁珠,震荡混匀后于室温静置10min,期间震荡混匀2
‑
3次,得到结合混合物:
[0047]
结合混合物置于磁力架上磁吸3min,弃掉上清,然后加入1ml清洗液,涡旋混匀15s,一并移出后置于磁力架上磁吸1min,弃掉上清;
[0048]
再次加入1ml清洗液,涡旋混匀15s,上磁力架磁吸1min,弃掉上清;
[0049]
加入1ml洗涤液,涡旋混匀15s,上磁力架磁吸1min,弃掉上清;
[0050]
再次加入1ml洗涤液,涡旋混匀15s,上磁力架磁吸1min,弃掉上清;
[0051]
离心,弃掉剩余液体,室温开盖静置10min以晾干,加入50μl洗脱液,室温涡旋震荡5min,离心,上磁力架磁吸1min,吸取液体得到cfdna。
[0052]
上述方法提取得到的cfdna及其在文库构建中的应用也在本发明的保护范围之内。
[0053]
本发明的有益效果如下:
[0054]
本发明提供一种优化磁珠法从血浆中提取cfdna的试剂盒和方法,通过对试剂盒中裂解液、结合液、清洗液、洗涤液和洗脱液的优化,尤其是对裂解液、结合液、清洗液的中多种胍盐的组合以及去污剂与异丙醇浓度配比的优化,使该试剂盒最大程度结合cfdna,去除杂质,使提取得到的cfdna中无大片度残留,且具有更高的纯度,在下游文库构建实验中具有更高的文库构建效率,更高的测序数据质量,更高的准确性。
附图说明
[0055]
下面结合附图对本发明的具体实施方式作进一步详细的说明。
[0056]
图1示出利用agilent 2100检测实施例6得到的cfdna的峰型图;其中,a、b、c、d、e分别代表编号为1、2、3、4、5的cfdna的峰型图。
[0057]
图2示出利用agilent 2100检测对比例得到的cfdna的峰型图;其中,a、b、c、d、e分别代表编号为cq、a、b、c、d的cfdna的峰型图。
[0058]
图3示出利用agilent 2100检测实施例6得到的cfdna的文库峰型图;其中,a、b、c、d、e分别代表编号为1、2、3、4、5的cfdna的文库峰型图。
[0059]
图4示出利用agilent 2100检测对比例得到的cfdna的文库峰型图;其中,a、b、c、d、e分别代表编号为cq、a、b、c、d的cfdna的文库峰型图。
具体实施方式
[0060]
为了更清楚地说明本发明,下面结合优选实施例和附图对本发明做进一步的说明。附图中相似的部件以相同的附图标记进行表示。本领域技术人员应当理解,下面所具体描述的内容是说明性的而非限制性的,不应以此限制本发明的保护范围。
[0061]
实施例1一种提取血浆游离dna(cfdna)的试剂盒
[0062]
一种优化磁珠法从血浆中提取cfdna的试剂盒,包括裂解液(lysis buffer)、结合液(binding buffer)、清洗液(clean buffer)、洗涤液(wash buffer)、洗脱液(elution buffer)、磁珠和蛋白酶k;
[0063]
其中,lysis buffer由0.8mol/l异硫氰酸胍、4mol/l盐酸胍、1.4mol/lnai、25mmol/l tris
‑
乙酸、25mmol/l edta、体积分数10%(v/v)tween
‑
80、600mmol/l nacl组成;
[0064]
binding buffer由0.6mol/l异硫氰酸胍、4mol/l盐酸胍、1.2mol/l nai、25mmol/l tris
‑
乙酸、25mmol/l edta、质量体积分数0.05%(w/v)peg6000、体积分数10%(v/v)tween
‑
80和体积分数45%(v/v)异丙醇组成;
[0065]
clean buffer由3mol/l盐酸胍、0.6mol/l nai、25mmol/l tris
‑
乙酸、25mmol/l edta、体积分数8%(v/v)tween
‑
80和体积分数40%(v/v)异丙醇组成;
[0066]
wash buffer由5mmol/l tris
‑
hcl、体积分数0.05%(v/v)triton x
‑
100、体积分数80%(v/v)无水乙醇组成;
[0067]
elution buffer由5mmol/l tris
‑
hcl、0.05mmol/l edta、体积分数0.03%(v/v)triton x
‑
100组成;
[0068]
磁珠为硅羟基修饰磁珠,粒径为2μm;
[0069]
蛋白酶k浓度为20mg/ml。
[0070]
实施例2一种提取cfdna的试剂盒
[0071]
一种优化磁珠法从血浆中提取cfdna的试剂盒,包括裂解液(lysis buffer)、结合液(binding buffer)、清洗液(clean buffer)、洗涤液(wash buffer)、洗脱液(elution buffer)、磁珠和蛋白酶k;
[0072]
其中,lysis buffer由2mol/l盐酸胍、1.2mol/l异硫氰酸胍和2.4mol/lnai,100mmol/l tris
‑
乙酸,100mmol/l edta,15%(v/v)tween
‑
80,以及800mmol/l nacl组成;
[0073]
binding buffer由2mol/l盐酸胍、1.6mol/l异硫氰酸胍,1.5mol/l nai,100mmol/l tris
‑
乙酸,100mmol/l edta,0.5%(w/v)的peg6000,15%(v/v)的tween
‑
80,以及70%(v/v)的异丙醇组成;
[0074]
clean buffer由2mol/l盐酸胍、0.8mol/l异硫氰酸胍,100mmol/l tris
‑
乙酸,50mmol/l edta,10%(v/v)的tween
‑
80,以及50%(v/v)的异丙醇组成;
[0075]
wash buffer由20mmol/l tris
‑
乙酸,0.05%(v/v)的tween
‑
80,以及80%(v/v)的无水乙醇组成;
[0076]
elution buffer由10mmol/l tris
‑
乙酸,0.1mmol/l edta,以及0.01%(v/v)的tween
‑
80;
[0077]
磁珠为硅羟基修饰磁珠,粒径为2μm;
[0078]
蛋白酶k浓度为10mg/ml。
[0079]
实施例3一种提取cfdna的试剂盒
[0080]
一种优化磁珠法从血浆中提取cfdna的试剂盒,包括裂解液(lysis buffer)、结合液(binding buffer)、清洗液(clean buffer)、洗涤液(wash buffer)、洗脱液(elution buffer)、磁珠和蛋白酶k;
[0081]
其中,lysis buffer由6mol/l盐酸胍、0.5mol/l异硫氰酸胍,0.5mol/l nai,10mmol/l tris
‑
乙酸,10mmol/l edta,5%(v/v)的np
‑
40,以及400mmol/lnacl组成;
[0082]
binding buffer由6mol/l盐酸胍、0.5mol/l异硫氰酸胍,0.5mol/l nai,10mmol/l tris
‑
乙酸,10mmol/l edta,0.05%(w/v)的peg6000,10%(v/v)的np
‑
40,以及30%(v/v)的异丙醇组成;
[0083]
clean buffer由6mol/l盐酸胍、0.6mol/l nai,10mmol/l tris
‑
乙酸,10mmol/l edta,10%(v/v)的np
‑
40,以及30%(v/v)的异丙醇组成;
[0084]
wash buffer由5mmol/l tris
‑
乙酸,0.05%(v/v)的triton x
‑
100,以及80%(v/v)的无水乙醇组成;
[0085]
elution buffer由5mmol/l tris
‑
乙酸,0.3mmol/l edta,以及0.05%(v/v)的triton x
‑
100组成;
[0086]
磁珠为硅羟基修饰磁珠,粒径为1μm;
[0087]
蛋白酶k浓度为20mg/ml。
[0088]
实施例4一种提取cfdna的试剂盒
[0089]
一种优化磁珠法从血浆中提取cfdna的试剂盒,包括裂解液(lysis buffer)、结合液(binding buffer)、清洗液(clean buffer)、洗涤液(wash buffer)、洗脱液(elution buffer)、磁珠和蛋白酶k;
[0090]
其中,lysis buffer由4mol/l盐酸胍、1.4mol/l nai,50mmol/l tris
‑
乙酸,50mmol/l edta,10%(v/v)的tween
‑
80,以及600mmol/l nacl组成;
[0091]
binding buffer由4mol/l盐酸胍、1.6mol/l异硫氰酸胍,50mmol/l tris
‑
乙酸,50mmol/l edta,0.5%(w/v)的peg6000,15%(v/v)的tween
‑
80,以及70%(v/v)的异丙醇组成;
[0092]
clean buffer由3mol/l盐酸胍、0.6mol/l异硫氰酸胍,25mmol/l tris
‑
乙酸,25mmol/l edta,8%(v/v)的tween
‑
80,以及40%(v/v)的异丙醇组成;
[0093]
wash buffer由10mmol/l tris
‑
乙酸,0.01%(v/v)的tween
‑
80,以及80%(v/v)的无水乙醇组成;
[0094]
elution buffer由10mmol/l tris
‑
乙酸,0.1mmol/l edta,以及0.01%(v/v)的tween
‑
80组成;
[0095]
磁珠为硅羟基修饰磁珠,粒径为1μm;
[0096]
蛋白酶k浓度为30mg/ml。
[0097]
实施例5一种提取cfdna的试剂盒
[0098]
一种优化磁珠法从血浆中提取cfdna的试剂盒,包括裂解液(lysis buffer)、结合液(binding buffer)、清洗液(clean buffer)、洗涤液(wash buffer)、洗脱液(elution buffer)、磁珠和蛋白酶k;
[0099]
其中,lysis buffer由0.8mol/l异硫氰酸胍,2.4mol/l nai,50mmol/l tris
‑
乙酸,50mmol/l edta,10%(v/v)的tween
‑
80,以及600mmol/l nacl组成;
[0100]
binding buffer由4mol/l盐酸胍、1.5mol/l nai,50mmol/l tris
‑
乙酸,50mmol/l edta,0.5%(w/v)的peg6000,10%(v/v)的np
‑
40,以及70%(v/v)的异丙醇组成;
[0101]
clean buffer由3mol/l盐酸胍、0.8mol/l nai,25mmol/l tris
‑
乙酸,25mmol/l edta,8%(v/v)的np
‑
40,以及40%(v/v)的异丙醇组成;
[0102]
wash buffer由5mmol/l tris
‑
乙酸,0.01%(v/v)的tween
‑
80,以及80%(v/v)的无水乙醇组成;
[0103]
elution buffer由5mmol/l tris
‑
乙酸,0.1mmol/l edta,以及0.01%(v/v)的triton x
‑
100组成;
[0104]
磁珠为硅羟基修饰磁珠,粒径为2μm;
[0105]
蛋白酶k浓度为20mg/ml。
[0106]
实施例6利用实施例1
‑
5的试剂盒提取cfdna
[0107]
分别利用实施例1
‑
5的试剂盒对2ml的血浆进行cfdna的提取(各buffer用量一致),包括以下步骤:
[0108]
向15ml离心管中加入80μl蛋白酶k、2ml血浆、200μl lysis buffer,涡旋混匀后置于60℃水浴锅中孵育20min,期间震荡混匀3次,得到裂解混合物;
[0109]
裂解混合物冰浴5min,然后向离心管中加入2.5ml binding buffer和40μl磁珠,震荡混匀后于室温静置10min,期间震荡混匀3次,得到结合混合物;
[0110]
将离心管置于15ml磁力架上磁吸3min,弃掉上清,然后加入1ml clean buffer,涡旋混匀15s,一并移出到新的1.5ml离心管中,并置于磁力架上磁吸1min,弃掉上清;
[0111]
再次加入1ml clean buffer,涡旋混匀15s,上磁力架磁吸1min,弃掉上清;
[0112]
加入1ml wash buffer,涡旋混匀15s,上磁力架磁吸1min,弃掉上清;
[0113]
再次加入1ml wash buffer,涡旋混匀15s,上磁力架磁吸1min,弃掉上清;
[0114]
短暂离心(小于3s)后,弃掉剩余液体,室温开盖静置10min以晾干,加入40μl elution buffer,室温涡旋震荡5min,短暂离心(小于3s)后,上磁力架磁吸1min,吸取液体到新的1.5ml离心管中,得到cfdna。将实施例1
‑
5的试剂盒提取得到的cfdna分别编号为1、2、3、4和5,置于
‑
20℃保存或进行下游实验(浓度测定和文库构建)。
[0115]
对比例1 company q的cfdna提取试剂盒提取cfdna
[0116]
利用company q的cfdna提取试剂盒(目录号:55114)按照说明书步骤对2ml血浆进行cfdna的提取,得到cfdna,编号为cq。
[0117]
对比例2 实施例1的试剂盒搭配company q的硅胶柱提取cfdna
[0118]
将实施例1的试剂盒中的磁珠替换为company q的硅胶柱(目录号:55114)提取cfdna,包括如下步骤:
[0119]
向15ml离心管中加入80μl蛋白酶k、2ml血浆、200μl lysis buffer,涡旋混匀后置于60℃水浴锅中孵育20min,期间震荡混匀3次;
[0120]
裂解完成后冰浴3
‑
5min,然后向管中加入2.5ml binding buffer,震荡混匀后12,000g/min离心10min,将上清分多次加入q company硅胶柱中,5,000g/min离心5min,弃流穿:
[0121]
往硅胶柱加入1ml clean buffer,静置15s,5,000g/min离心1min,弃流穿;
[0122]
往硅胶柱再次加入1ml clean buffer,静置15s,5,000g/min离心1min,弃流穿;
[0123]
往硅胶柱加入1ml wash buffer,静置15s,5,000g/min离心1min,弃流穿;
[0124]
往硅胶柱再次加入1ml wash buffer,静置15s,5,000g/min离心1min,弃流穿;
[0125]
硅胶柱5000g/min离心2min,弃掉剩余液体和收集管,置于新的离心管中,硅胶柱室温开盖静置5
‑
10min以挥发乙醇,加入30
‑
50μl elution buffer到硅胶柱内柱膜上,室温静置5min,>12,000g/min离心1min,吸取液体到新的1.5ml离心管中,得到cfdna,编号为q,置于
‑
20℃保存或进行下游实验(浓度测定和文库构建)。
[0126]
对比例3 一种提取cfdna的试剂盒及方法
[0127]
一种提取cfdna的试剂盒,包括裂解液1、结合液1、清洗液1、洗涤液1、洗脱液1、磁珠和蛋白酶k;
[0128]
其中,裂解液1由4mol/l异硫氰酸胍、50mmol/l tris
‑
hcl、25mmol/ledta、12%(v/v)triton x
‑
100、300mmol/l nacl组成;
[0129]
结合液1由3.5mol/l异硫氰酸胍、50mmol/l tris
‑
hcl、25mmol/l edta、12%(v/v)triton x
‑
100和30%(v/v)异丙醇组成;
[0130]
清洗液1由2mol/l异硫氰酸胍胍、50mmol/l tris
‑
hcl、25mmol/l edta、5%(v/v)triton x
‑
100和30%(v/v)异丙醇组成;
[0131]
洗涤液1由:10mmol/l tris
‑
hcl、80%(v/v)无水乙醇组成;
[0132]
洗脱液1由nuclease
‑
free water组成;
[0133]
磁珠为硅羟基修饰磁珠,粒径为2μm;
[0134]
蛋白酶k浓度为20mg/ml。
[0135]
一种利用上述试剂盒提取cfdna的方法,包括如下步骤:
[0136]
1.1将80μl蛋白酶k、2ml血浆、200μl裂解液1依次加入到15ml bd管中,振荡混匀后于60℃孵育20min;
[0137]
1.2冰浴5min,加入2.5ml结合液1、40μl磁珠,震荡10min,期间振荡3次;
[0138]
1.3磁力架上放置3min,弃掉上清,加入1ml清洗液1,震荡15s;
[0139]
1.4将磁珠溶液完全转移至1.5ml离心管中,置于磁力架1min;
[0140]
1.5弃上清,再加入1ml清洗液1,震荡混匀15s,置于磁力架上1min;
[0141]
1.6弃上清,加入1ml洗涤液1,震荡混匀15s,置于磁力架上1min;
[0142]
1.7弃上清,再加入1ml洗涤液1,震荡混匀15s,置于磁力架上1min;
[0143]
1.8弃上清,室温晾干10min,加入40μl洗脱液1,室温振荡5min;
[0144]
1.9置于磁力架上1min,吸取液体到新的离心管中,得到cfdna,编号为a,
‑
20℃保存待检测(浓度测定和文库构建)。
[0145]
对比例4 一种提取cfdna的试剂盒及方法
[0146]
一种提取cfdna的试剂盒,包括裂解液2、结合液2、清洗液2、洗涤液2、洗脱液2、硅胶吸附柱和蛋白酶k;
[0147]
其中,裂解液2由6mol/l异硫氰酸胍、100mmol/l tris
‑
hcl、20mmol/ledta、10%(v/v)sds缓冲液、300mmol/l nacl、1%(v/v)dmso组成;
[0148]
结合液2由5mol/l异硫氰酸胍、3mol/l硫脲、1mol/l nacl、50mmol/ltris
‑
hcl、20%(w/v)peg6000、3.5%(w/v)柠檬酸钠、20mmol/l heps
‑
koh、1%(v/v)triton x
‑
100和20%(v/v)异丙醇(使用前加入)组成;
[0149]
清洗液2由100mmol/l tris
‑
hcl、6mol/l盐酸胍、1mol/l nacl、10mmol/ledta和60%(v/v)无水乙醇组成;
[0150]
洗涤液2由:100mmol/l tris
‑
hcl、80%(v/v)无水乙醇组成;
[0151]
洗脱液2由5mmol/l tris
‑
hcl组成;
[0152]
硅胶吸附柱来源于company q的55114产品中的硅胶吸附柱。
[0153]
蛋白酶k浓度为20mg/ml。
[0154]
一种利用上述试剂盒提取cfdna的方法,包括如下步骤:
[0155]
2.1将2.4ml血浆与4500g离心10min后,取上清,再于15000g离心10min,去上清共2ml;
[0156]
2.2将80μl蛋白酶k、200μl裂解液2加入上清中,震荡混匀30s,于60℃孵育30min;
[0157]
2.3将2.5ml结合液2加入到裂解产物中;震荡混匀30s;冰浴5min;分次将产物加入到硅胶吸附柱,10000g离心30s,弃流穿,直到所有产物流经硅胶柱;
[0158]
2.4向吸附柱中加入1ml清洗液2;10000g离心30s,弃流穿。
[0159]
2.5向吸附柱中加入1ml洗涤液2;10000g离心30s,弃流穿。
[0160]
2.6向吸附柱中加入1ml洗涤液2;10000g离心30s,弃流穿。
[0161]
2.7将吸附柱于10000g离心2min;将吸附柱转移至新的收集管中。
[0162]
2.8向吸附柱中加入40μl洗脱液2;室温放置3min。
[0163]
2.9将吸附柱于10000g离心2min,收集液体,得到cfdna,编号为b,
‑
20℃保存待检测(浓度测定和文库构建)。
[0164]
对比例5 一种提取cfdna的试剂盒及方法
[0165]
一种提取cfdna的试剂盒,包括实施例1中的裂解液、结合液、和对比例3中的清洗液1、洗涤液1、洗脱液1、磁珠和蛋白酶k;
[0166]
其中,裂解液由0.8mol/l异硫氰酸胍、4mol/l盐酸胍、1.4mol/l nai、25mmol/l tris
‑
乙酸、25mmol/l edta、10%(v/v)tween
‑
80、600mmol/lnacl组成;
[0167]
结合液由0.6mol/l异硫氰酸胍、4mol/l盐酸胍、1.2mol/l nai、25mmol/l tris
‑
乙酸、25mmol/l edta、0.05%(w/v)peg6000、10%(v/v)tween
‑
80和45%(v/v)异丙醇组成;
[0168]
清洗液1由2mol/l异硫氰酸胍胍、50mmol/l tris
‑
hcl、25mmol/l edta、5%(v/v)triton x
‑
100和30%(v/v)异丙醇组成;
[0169]
洗涤液1由10mmol/l tris
‑
hcl、80%(v/v)无水乙醇组成;
[0170]
洗脱液1由nuclease
‑
free water组成;
[0171]
磁珠为硅羟基修饰磁珠,粒径为2μm;
[0172]
蛋白酶k浓度为20mg/ml。
[0173]
一种利用上述试剂盒提取cfdna的方法,包括如下步骤:
[0174]
3.1将80μl蛋白酶k、2ml血浆、200μl裂解液依次加入到15ml bd管中,振荡混匀后于60℃孵育20min;
[0175]
3.2冰浴5min,加入2.5ml结合液、40μl磁珠,震荡10min,期间振荡3次;
[0176]
3.3磁力架上放置3min,弃掉上清,加入1ml清洗液1,震荡15s;
[0177]
3.4将磁珠溶液完全转移至1.5ml离心管中,置于磁力架1min;
[0178]
3.5弃上清,再加入1ml清洗液1,震荡混匀15s,置于磁力架上1min;
[0179]
3.6弃上清,加入1ml洗涤液1,震荡混匀15s,置于磁力架上1min;
[0180]
3.7弃上清,再加入1ml洗涤液1,震荡混匀15s,置于磁力架上1min;
[0181]
3.8弃上清,室温晾干10min,加入40μl洗脱液1,室温振荡5min;
[0182]
3.9置于磁力架上1min,吸取液体到新的离心管中,得到cfdna,编号为c,
‑
20℃保存待检测(浓度测定和文库构建)。
[0183]
对比例6 一种提取cfdna的试剂盒及方法
[0184]
一种提取cfdna的试剂盒,包括对比例3中的裂解液1、结合液1、和实施例1中的清洗液、洗涤液、洗脱液、磁珠和蛋白酶k;
[0185]
其中,裂解液1由4mol/l异硫氰酸胍、50mmol/l tris
‑
hcl、25mmol/ledta、12%(v/v)triton x
‑
100、300mmol/l nacl组成;
[0186]
结合液1由3.5mol/l异硫氰酸胍、50mmol/l tris
‑
hcl、25mmol/l edta、12%(v/v)triton x
‑
100和30%(v/v)异丙醇组成;
[0187]
清洗液由3mol/l盐酸胍、0.6mol/l nai、25mmol/l tris
‑
乙酸、25mmol/ledta、8%t(v/v)ween
‑
80和40%(v/v)异丙醇组成;
[0188]
洗涤液由5mmol/l tris
‑
hcl、0.05%(v/v)的triton x
‑
100、80%(v/v)无水乙醇组成;
[0189]
洗脱液由5mmol/l tris
‑
hcl、0.5mmol/l edta、0.03%(v/v)triton x
‑
100组成;
[0190]
磁珠为硅羟基修饰磁珠,粒径为2μm;
[0191]
蛋白酶k浓度为20mg/ml。
[0192]
一种利用上述试剂盒提取cfdna的方法,包括如下步骤:
[0193]
4.1将80μl蛋白酶k、2ml血浆、200μl裂解液依次加入到15ml bd管中,振荡混匀后于60℃孵育20min;
[0194]
4.2冰浴5min,加入2.5ml结合液、40μl磁珠,震荡10min,期间振荡3次;
[0195]
4.3磁力架上放置3min,弃掉上清,加入1ml清洗液1,震荡15s;
[0196]
4.4将磁珠溶液完全转移至1.5ml离心管中,置于磁力架1min;
[0197]
4.5弃上清,再加入1ml清洗液1,震荡混匀15s,置于磁力架上1min;
[0198]
4.6弃上清,加入1ml洗涤液1,震荡混匀15s,置于磁力架上1min;
[0199]
4.7弃上清,再加入1ml洗涤液1,震荡混匀15s,置于磁力架上1min;
[0200]
4.8弃上清,室温晾干10min,加入40μl洗脱液1,室温振荡5min;
[0201]
4.9置于磁力架上1min,吸取液体到新的离心管中,得到cfdna,编号为d,
‑
20℃保存待检测(浓度测定和文库构建)。
[0202]
试验例1 实施例6与对比例1
‑
6得到的cfdna的质量检测
[0203]
利用qubit 3.0检测实施例6提取得到的编号为1、2、3、4和5的cfdna(即利用实施例1
‑
5试剂盒提取得到的cfdna)和对比例1
‑
6得到的编号分别为cq、q、a、b、c和d的cfdna的质量,即浓度、总量和片段大小,结果如表1所示,显示编号分别为1、2、3、4和5的cfdna提取正常,而对比例1产量略低,将实施例1的试剂盒中的磁珠替换为company q的硅胶柱提取cfdna(对比例2)时,提取失败,说明本发明试剂盒不适用于硅胶柱的提取(agilent 2100检测图未展示),对比例3
‑
6皆能提取到cfdna,但效果不佳。利用agilent 2100检测cfdna的峰型图,结果如图1和2所示,具体结果为:
[0204]
利用agilent 2100检测利用实施例1试剂盒提取得到的cfdna的峰型图,结果如图1中a所示,显示峰型最为平滑,且无大片段残留,提取正常。
[0205]
利用agilent 2100检测利用实施例2试剂盒提取得到的cfdna的峰型图,结果如图1中b所示,显示无明显的大片段残留,提取正常。
[0206]
利用agilent 2100检测利用实施例3试剂盒提取得到的cfdna的峰型图,结果如图1中c所示,显示无明显的大片段残留,提取正常。
[0207]
利用agilent 2100检测利用实施例4试剂盒提取得到的cfdna的峰型图,结果如图1中d所示,显示无明显的大片段残留,提取正常,但是浓度偏低。
[0208]
利用agilent 2100检测利用实施例5试剂盒提取得到的cfdna的峰型图,结果如图1中e所示,显示无明显的大片段残留,提取正常,但是浓度偏低。
[0209]
利用agilent 2100检测对比例1得到的cfdna的峰型图,结果如图2中a所示,显示提取正常,但是有稍些大片段拖尾,产量略低。
[0210]
利用agilent 2100检测对比例3得到的cfdna的峰型图,结果如图2中b所示,显示提取正常,但是有轻微的大片段拖尾,效果不佳。
[0211]
利用agilent 2100检测对比例4得到的cfdna的峰型图,结果如图2中c所示,显示cfdna在主峰(170bp)提取正常,但是有严重的大片段拖尾,效果不佳。
[0212]
利用agilent 2100检测对比例5得到的cfdna的峰型图,结果如图2中d所示,显示cfdna在主峰(170bp)提取正常,但是有严重的大片段拖尾,效果不佳。
[0213]
利用agilent 2100检测对比例6得到的cfdna的峰型图,结果如图2中e所示,显示提取正常,但是浓度偏低。
[0214]
表1实施例6和对比例1
‑
6得到的cfdna的质量比较结果
[0215]
编号浓度(ng/μl)总量(ng)片段大小(bp)10.78831.5217621.14545.7917931.28151.2317740.63825.5217650.65126.04179cq0.61424.56178q几乎为零
‑‑
a0.25610.24175b1.51260.48176c1.87274.88179d0.56122.44178
[0216]
试验例2 利用实施例6和对比例1
‑
6得到的cfdna进行dna文库构建
[0217]
各取实施例6提取得到的编号为1、2、3、4和5的cfdna(即利用实施例1
‑
5试剂盒提取得到的cfdna)和对比例1、3、4、5、6得到的编号分别为cq、a、b、c和d的cfdna 10ng(10个cycle)进行dna文库构建;文库构建使用的试剂盒来自北京全式金生物技术有限公司(产品目录号:kp201),方法按照试剂盒说明书的要求进行操作。
[0218]
文库的产量结果如表2所示,agilent 2100检测cfdna文库峰型图如图3和图4所示,显示从产量上看,编号1、编号2和编号3的文库产量占据着优势,其峰型也都正常,而编号4与5、编号cq和编号a与d的浓度与产量次之;而编号b和c,产量虽高,但是其峰型上看,有大片段污染,具体峰型结果如下所述:
[0219]
利用agilent 2100检测利用实施例1试剂盒提取得到的cfdna的文库峰型图,结果如图3中a所示,显示提取正常,且主峰所占比例最高。
[0220]
利用agilent 2100检测利用实施例2试剂盒提取得到的cfdna的文库峰型图,结果如图3中b所示,显示提取正常,且主峰所占比例有优势,略低于实施例1。
[0221]
利用agilent 2100检测利用实施例3试剂盒提取得到的cfdna的文库峰型图,结果如图3中c所示,显示提取正常,但主峰所占比例低于实施例1。
[0222]
利用agilent 2100检测利用实施例4试剂盒提取得到的cfdna的文库峰型图,结果如图3中d所示,显示提取正常,但主峰所占比例低于实施例1。
[0223]
利用agilent 2100检测利用实施例5试剂盒提取得到的cfdna的文库峰型图,结果如图3中e所示,显示提取正常,但主峰所占比例低于实施例1。
[0224]
利用agilent 2100检测对比例1得到的cfdna的文库峰型图,结果如图4中a所示,显示提取正常,但主峰所占比例低于实施例1。
[0225]
利用agilent 2100检测对比例3得到的cfdna的文库峰型图,结果如图4中b所示,显示提取正常,但主峰所占比例低于实施例1。
[0226]
利用agilent 2100检测对比例4得到的cfdna的文库峰型图,结果如图4中c所示,显示提取正常,但主峰所占比例低于实施例1,且有大片段的非特异文库片段出现。
[0227]
利用agilent 2100检测对比例5得到的cfdna的文库峰型图,结果如图4中d所示,
显示提取正常,但主峰所占比例低于实施例1,且有大片段的非特异文库片段出现。
[0228]
利用agilent 2100检测对比例6得到的cfdna的文库峰型图,结果如图4中e所示,显示提取正常,但主峰所占比例低于实施例1。
[0229]
表2实施例6和对比例1
‑
6得到的cfdna的dna文库构建结果比较
[0230][0231]
显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定,对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动,这里无法对所有的实施方式予以穷举,凡是属于本发明的技术方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之列。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。