2002 9(3):203
‑
208)。此外,在胚胎发生中一些tgf
‑
β同种型的时间
‑
空间表达差异很大,指示了在整个发育中无补偿的非重叠功能(akhurst rj等人development 1990 110(2):445
‑
460)。
5.在癌症动物模型和癌症患者中,转化生长因子β(tgf
‑
β)的表达通常与肿瘤转移和不良预后相关(donkor mk等人,2012,oncoimmunology,1(2):162
‑
171)。tgf
‑
β家族的成员是有效力的调节性细胞因子,其影响免疫系统的介导促炎或抗炎反应的多种细胞类型。tgf
‑
β对t细胞的作用是非常多面的。与其他可溶性因子协作,它控制各种t细胞亚群的成熟、分化和活性,所述t细胞亚群预防或引发感染、移植物抗宿主反应、免疫疾病、和癌症形成(schon ht等人,2014,hepatobiliary surg nutr,2014,dec 3(6):386
‑
406)。若干项研究指示,tgf
‑
β可以经由作用于肿瘤微环境通过促进肿瘤细胞侵袭以及通过抑制免疫细胞的功能来促进癌症生长和转移(flavell等人,2010,nat rev imm aug;10(8):554
‑
67)。
6.研究已经证明,使用小鼠tgf
‑
β通用抗体1d11(其识别tgf
‑
β1、tgf
‑
β2和tgf
‑
β3)对tgf
‑
β的阻断会经由cd8
t细胞而在动物模型中协同地增强肿瘤疫苗(terabe m等人(2009)clin cancer res 15:6560
‑
6569;takaku s等人(2010)int j cancer 126(7):1666)。另外,由存在于肿瘤部位的肿瘤细胞、髓源性抑制细胞(mdsc)和基质细胞(诸如癌症相关的成纤维细胞(caf))引起的tgfβ产生以及在肿瘤部位的tgfβ免疫抑制活性意味着阻断tgfβ以增强抗原摄取、呈递、和由治疗性疫苗介导的抗肿瘤免疫反应的激活。还已指示tgf
‑
β会驱动各种肿瘤类型(例如,肝细胞癌)中免疫抑制浆细胞的出现(shalapour等人nature.2017年11月16日;551(7680):340
‑
345;shalapour等人nature.2015年5月7日;521(7550):94
‑
8)。将抗tgf
‑
β阻断与程序性细胞死亡蛋白1(pd1)阻断组合已显示在不同肿瘤模型中诱导抗肿瘤免疫和消退肿瘤(mariathasan等人,nature.2018年2月22日;554(7693):544
‑
548.tauriello等人nature.2018年2月22日;554(7693):538
‑
543)。
7.已显示在许多纤维化病症中tgf
‑
β配体被上调,并且许多tgf
‑
β配体是细胞外基质形成的有效力的驱动因子,细胞外基质形成是纤维化病症的标志(biernacka等人growth factors.2011年10月;29(5):196
‑
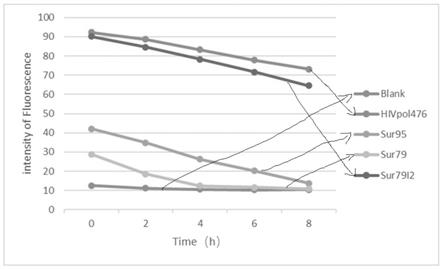
202)。这还包括许多类型的癌症,在所述癌症中在肿瘤生长和转移扩散中已指示存在纤维化病症(principe等人cancer res.2016年5月1日;76(9):2525
‑
39.;caja等人int j mol sci.2018年4月26日;19(5))。因此,提出了抗tgf
‑
β靶向性,并且目前正在测试其作为用于各种纤维化病症(包括肾、肺、心脏和皮肤)的治疗(walton等人front pharmacol.2017年7月14日;8:461)。其中牵涉tgf
‑
β的其他疾病尤其是过敏性疾病(tirado
‑
rodriguez等人j immunol res.2014;2014:318481)和范科尼贫血(fanconi anemia)(tummala和dokal,cell stem cell.2016年5月5日;18(5):567
‑
8)。
8.若干个出版物显示在各种组织、疾病、肿瘤和肿瘤微环境中tgf
‑
β同种型的表达方面的差异。例如,van belle等人表明,tgf
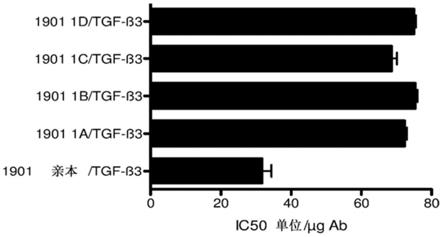
‑
β1由一些黑素细胞表达以及几乎一致地由痣和黑素瘤表达,而tgf
‑
β2和tgf
‑
β3在正常黑素细胞中未被检测到,但以肿瘤进展相关的方式发现于痣和所有形式的黑素瘤(早期和晚期原发性和转移性黑素瘤)中(p.van belle 1996american j.of pathology 148(6):1887
‑
1894)。关于显示出同种型的不同表达的地方,存在许多其他例子,尤其在胶质母细胞瘤、乳腺癌、伤口愈合和纤维化中(roy等人int j mol sci.2018年4月8日;19(4);hachim等人,tumour biol.2018年1月;40(1);lichtman等人,wound repair regen.2016年3月;24(2):215
‑
22)。
9.另外,据报道tgf
‑
β3而非tgf
‑
β1免疫染色在乳腺癌中与差的存活预后相关,并且当与淋巴结受累结合时,tgf
‑
β3对于存活是非常重要的预后因子(ghellal a1 2000 anticancer res 20:4413)。此外,与无淋巴结转移的乳腺癌患者相比,在具有阳性淋巴结的乳腺癌患者中tgf
‑
β3以及tgf
‑
β3及其受体cd105的复合物(tgf
‑
β3
‑
cd105)的血浆水平显著升高,并且其水平与淋巴结状态相关(li c1 1998 int.j.cancer 79:455)。在胶质瘤模型中,tgf
‑
β3已被提出作为控制下游信号传导的守门者,并且因此已被提出在胶质瘤中作为靶标(mol cancer ther.2017年6月;16(6):1177
‑
1186)。
10.特别地,研究已经证明tgf
‑
β3涉及以下项:促进上皮间质转化(emt);在乳腺癌和前列腺转移中tgf
‑
β3水平升高;以及在晚期肿瘤和侵袭性肿瘤(诸如乳腺、前列腺和肺)中检测到的tgf
‑
β3水平升高。
11.因此,明显的是,通过靶向tgf
‑
β的特定同种型,人们可以避免阻断tgf
‑
β的所有同种型的损害性炎性后果。此外,在不同癌症类型中tgf
‑
β同种型的差异性表达模式给予了研究人员独特的机会以更大的特异性并且以更大的功效靶向癌细胞。本领域中存在产生针对其同种型(包括特别是针对tgf
‑
β3)的治疗性tgf
‑
β抗体的未被满足的需求。另外,为识别不同tgf
‑
β同种型而开发的工具是强大的诊断和预后源。此外,靶向tgf
‑
β疗法需要针对特定tgf
‑
β同种型、特别是tgf
‑
β3的可用的有效的且中和性的人源化抗体,以提供临床上可应用的疗法,所述疗法降低免疫原性和患者的免疫反应,同时在人体中具有稳定性和长寿命。本发明解决了本领域中并且特别是关于tgf
‑
β3的这种未被满足的需求。
12.本文中对参考文献的引用不应解释为承认此类参考文献是本发明的现有技术。
技术实现要素:
13.在总体的方面,本发明提供了针对人tgf
‑
β3的新型转化生长因子βtgf
‑
β抗体,特别是人源化抗体。在一个方面,本发明的tgf
‑
β3抗体对tgf
‑
β3结合的特异性大于其与tgf
‑
β1或tgf
‑
β2的结合。在一个方面,本发明的tgf
‑
β3抗体不与tgf
‑
β家族的其他成员交叉反应或结合,并且特别是不与tgf
‑
β1或tgf
‑
β2交叉反应或结合。在一个方面,本发明提供了分离的特异性结合成员,特别是抗体或其片段,包括fab片段和单链或结构域抗体,所述分离的特异性结合成员特异性识别tgf
‑
β3。在一个特定的方面,所述抗体或其活性片段中和tgf
‑
β3活性。
14.本发明提供了用于诊断和治疗性目的的特异性针对tgfβ3的抗体。特别地,提供了对tgfβ3具有特异性的抗体,其中所述抗体是人源化的并且识别和能够结合和中和人(和小鼠)tgfβ3,并且不识别其他形式的tgf
‑
β(tgf
‑
β1或tgf
‑
β2)。
15.本发明的抗体具有在癌症和免疫调节方面的诊断和治疗性用途,包括调节对癌症和癌症疫苗的免疫反应。在进一步的方面,本发明的抗体具有在纤维化病症和纤维化疾病方面的诊断和治疗性用途。本发明的抗体可应用于表征和调节tgf
‑
β3的活性,特别是中和tgf
‑
β3活性。
16.在进一步的方面,本发明提供了抗体或其片段,特别是包括人源化抗体或其片段,其识别tgf
‑
β3并且选自包含重链序列lcr1901_vh_1g10m(seq id no:18)和轻链序列lcr1901_vk_glv1_03(f)(seq id no:22)的抗体1901
‑
1c;包含重链序列lcr1901_vh_1g10m(seq id no:18)和轻链序列lcr1901_vk_glv1_05(h)(seq id no:23)的抗体1901
‑
1a;包含
重链序列lcr1901_vh_1g10m_03(k)(seq id no:19)和轻链序列lcr1901_vk_glv1_03(f)(seq id no:22)的抗体1901
‑
1d;和包含重链序列lcr1901_vh_1g10m_03(k)(seq id no:19)和轻链序列lcr1901_vk_glv1_05(h)(seq id no:23)的抗体1901
‑
1b。在一个特定的方面,本发明提供了抗体或其活性片段,其特异性识别和中和tgf
‑
β3并且选自包含重链序列lcr1901_vh_1g10m(seq id no:18)和轻链序列lcr1901_vk_glv1_03(f)(seq id no:22)的抗体1901
‑
1c;包含重链序列lcr1901_vh_1g10m(seq id no:18)和轻链序列lcr1901_vk_glv1_05(h)(seq id no:23)的抗体1901
‑
1a;包含重链序列lcr1901_vh_1g10m_03(k)(seq id no:19)和轻链序列lcr1901_vk_glv1_03(f)(seq id no:22)的抗体1901
‑
1d;和包含重链序列lcr1901_vh_1g10m_03(k)(seq id no:19)和轻链序列lcr1901_vk_glv1_05(h)(seq id no:23)的抗体1901
‑
1b。
17.在另一个方面,本发明提供了抗体或其活性片段,其包含重链1901_vh_1g10m_02(j)(seq id no:36)。在一个这样的方面,所述抗体进一步包含轻链序列lcr1901_vk_glv1_03(f)(seq id no:22)。
18.抗体与其靶抗原的结合是通过其重链和轻链的互补决定区(cdr)介导的。因此,基于本发明的抗体(特别是抗体1901
‑
1a、1901
‑
1b、1901
‑
1c或1901
‑
1d中的任意)的重链或轻链或重链和轻链两者的cdr区的特异性结合成员将对于疗法和/或诊断是有用的特异性结合成员。在一个方面,本发明提供了能够结合和中和tgf
‑
β3的tgf
‑
β3抗体,其包含如本文所提供和图7和图8所列出的轻链和重链可变区cdr1、cdr2和cdr3序列。在一个特定的方面,本发明提供了能够特异性结合和中和tgf
‑
β3的tgf
‑
β3特异性抗体,其中所述抗体不结合或中和tgf
‑
β1或tgf
‑
β2,所述抗体包含如本文所提供和图7和图8所列出的轻链和重链可变区cdr1、cdr2和cdr3序列。在一个这样的方面,提供了抗体,所述抗体包含重链可变区cdr,所述重链可变区cdr包括cdr1序列sswih(seq id no:1)、cdr2序列riypgdgdtdysekfq(seq id no:34)和cdr3序列rmittqaaldy(seq id no:35)或arrmittqaal(seq id no:30)。在一个其他这样的方面,提供了抗体,所述抗体包含重链可变区cdr,所述重链可变区cdr包括cdr1序列sswih(seq id no:1)或gytfssswih(seq id no:28)、cdr2序列riypgdgdtdysekfq(seq id no:34)或wigriypgdgdtdysekfq(seq id no:29)、和cdr3序列rmittqaaldy(seq id no:35)或arrmittqaal(seq id no:30)。在进一步的方面,提供了抗体,所述抗体进一步包含轻链可变区cdr,所述轻链可变区cdr包括cdr1序列kasqsvinava(seq id no:4)、cdr2序列yasnryt(seq id no:5)和cdr3序列qqdysspy(seq id no:33)。在另进一步的方面,提供了抗体,所述抗体包含轻链可变区cdr,所述轻链可变区cdr包括cdr1序列kasqsvinava(seq id no:4)或kasqsvinavawy(seq id no:31)、cdr2序列yasnryt(seq id no:5)或lliyyasnryt(seq id no:32)和cdr3序列qqdysspy(seq id no:33)或qqdysspyt(seq id no:6)。
19.在一个方面,本发明提供了针对tgf
‑
β3的抗体,所述抗体包含重链可变区,所述重链可变区包含cdr,所述cdr包括cdr1序列sswih(seq id no:1)、cdr2序列riypgdgdtdysekfq(seq id no:34)、和包含序列rmittqaal(seq id no:37)的cdr3序列。在一个这样的方面,所述抗体包含重链可变区,所述重链可变区包含cdr1序列sswih(seq id no:1)、cdr2序列riypgdgdtdysekfq(seq id no:34)、和包含rmittqaal(seq id no:37)的cdr3序列。在一个方面,所述抗体包含重链可变区,所述重链可变区包含cdr1序列sswih
(seq id no:1)、cdr2序列riypgdgdtdysekfq(seq id no:34)、和cdr3序列rmittqaal(seq id no:37)。在进一步的方面,提供了抗体,所述抗体进一步包含轻链可变区cdr,所述轻链可变区cdr包括cdr1序列kasqsvinava(seq id no:4)、cdr2序列yasnryt(seq id no:5)和cdr3序列qqdysspy(seq id no:33)。在另进一步的方面,提供了抗体,所述抗体包含轻链可变区cdr,所述轻链可变区cdr包括cdr1序列kasqsvinava(seq id no:4)或kasqsvinavawy(seq id no:31)、cdr2序列yasnryt(seq id no:5)或lliyyasnryt(seq id no:32)和cdr3序列qqdysspy(seq id no:33)或qqdysspyt(seq id no:6)。在一个方面,所述抗体特异性结合和中和tgf
‑
β3而不结合和/或不中和tgf
‑
β1或tgf
‑
β2。本发明提供了针对tgf
‑
β3的抗体,所述抗体包含重链可变区序列,所述重链可变区序列包含cdr1序列sswih(seq id no:1)、cdr2序列riypgdgdtdysekfq(seq id no:34)和cdr3序列rmittqaaldy(seq id no:35);或cdr1序列gytfssswih(seq id no:28)、cdr2序列wigriypgdgdtdysekfq(seq id no:29)和cdr3序列arrmittqaal(seq id no:30)。在一个方面,本发明提供了抗体,所述抗体进一步包含轻链可变区序列,所述轻链可变区序列包含cdr1序列kasqsvinava(seq id no:4)、cdr2序列yasnryt(seq id no:5)和cdr3序列qqdysspy(seq id no:33)或qqdysspyt(seq id no:6);或cdr1序列kasqsvinavawy(seq id no:31)、cdr2序列lliyyasnryt(seq id no:32)和cdr3序列qqdysspy(seq id no:33)或qqdysspyt(seq id no:6)。在一个方面,所述抗体包含可变区序列,所述可变区序列是人源化的或经改变或修饰以增加其与人天然产生的抗体的相似性。在一个方面,所述抗体包含可变区序列,所述可变区序列是人源化的或在框架区中经改变或修饰以增加其与人天然产生的抗体的相似性。
20.在一个特定的方面,本发明的分离的抗体或片段中和tgf
‑
β3。在一个特定的方面,本发明的分离的抗体或片段不与tgf
‑
β1或tgf
‑
β2反应。在一个方面,本发明的分离的抗体或片段结合和中和tgf
‑
β3并且不与tgf
‑
β1或tgf
‑
β2反应或不与其结合。
21.在一个方面,本发明提供了特异性针对和中和tgf
‑
β3的抗体,其中所述抗体不结合或中和tgf
‑
β1或tgf
‑
β2,所述抗体包含重链可变区序列,所述重链可变区序列包含cdr1序列sswih(seq id no:1)、cdr2序列riypgdgdtdysekfq(seq id no:34)和cdr3序列rmittqaaldy(seq id no:35)或arrmittqaal(seq id no:30)。在进一步的方面,本发明提供了特异性针对和中和tgf
‑
β3的抗体,其中所述抗体不结合或中和tgf
‑
β1或tgf
‑
β2,所述抗体包含重链可变区序列和轻链可变区序列,所述重链可变区序列包含cdr1序列sswih(seq id no:1)、cdr2序列riypgdgdtdysekfq(seq id no:34)和cdr3序列rmittqaaldy(seq id no:35)或arrmittqaal(seq id no:30),所述轻链可变区序列包含cdr1序列kasqsvinava(seq id no:4)、cdr2序列yasnryt(seq id no:5)和cdr3序列qqdysspy(seq id no:33)。
22.在一个方面,本发明提供了特异性针对和中和tgf
‑
β3的抗体,其中所述抗体不结合或中和tgf
‑
β1或tgf
‑
β2,所述抗体包含重链可变区序列和轻链可变区序列,所述重链可变区序列包含cdr1序列sswih(seq id no:1)、cdr2序列riypgdgdtdysekfq(seq id no:34)和cdr3序列rmittqaaldy(seq id no:35)或arrmittqaal(seq id no:30),所述轻链可变区序列包含cdr1序列kasqsvinava(seq id no:4)、cdr2序列yasnryt(seq id no:5)和cdr3序列qqdysspy(seq id no:33)或qqdysspyt(seq id no:6);或cdr1序列kasqsvinavawy(seq id no:31)、cdr2序列lliyyasnryt(seq id no:32)和cdr3序列qqdysspy(seq id no:33)或
qqdysspyt(seq id no:6)。
23.在一个方面,本发明提供了特异性针对和中和tgf
‑
β3的抗体,其中所述抗体不结合或中和tgf
‑
β1或tgf
‑
β2,所述抗体包含重链可变区序列和轻链可变区序列,所述重链可变区序列包含cdr1序列sswih(seq id no:1)、cdr2序列riypgdgdtdysekfq(seq id no:34)和cdr3序列rmittqaaldy(seq id no:35);或cdr1序列gytfssswih(seq id no:28)、cdr2序列wigriypgdgdtdysekfq(seq id no:29)和cdr3序列arrmittqaal(seq id no:30),所述轻链可变区序列包含cdr1序列kasqsvinava(seq id no:4)、cdr2序列yasnryt(seq id no:5)和cdr3序列qqdysspy(seq id no:33)或qqdysspyt(seq id no:6);或cdr1序列kasqsvinavawy(seq id no:31)、cdr2序列lliyyasnryt(seq id no:32)和cdr3序列qqdysspy(seq id no:33)或qqdysspyt(seq id no:6)。
24.在一个方面,本发明提供了特异性针对和中和tgf
‑
β3的抗体,其中所述抗体不结合或中和tgf
‑
β1或tgf
‑
β2,所述抗体包含重链可变区序列和轻链可变区序列,所述重链可变区序列包含cdr1序列sswih(seq id no:1)或gytfssswih(seq id no:28)、cdr2序列riypgdgdtdysekfq(seq id no:34)或wigriypgdgdtdysekfq(seq id no:29)和cdr3序列rmittqaaldy(seq id no:35)或arrmittqaal(seq id no:30),所述轻链可变区序列包含cdr1序列kasqsvinava(seq id no:4)或kasqsvinavawy(seq id no:31)、cdr2序列yasnryt(seq id no:5)或lliyyasnryt(seq id no:32)和cdr3序列qqdysspy(seq id no:33)或qqdysspyt(seq id no:6)。
25.在进一步的方面,本发明提供了抗体,特别是人源化抗体,所述抗体包含重链可变区序列lcr1901_vh_1g10m(seq id no:18)或lcr1901_vh_1g10m_03(k)(seq id no:19)或其变体,所述变体与重链可变区序列lcr1901_vh_1g10m(seq id no:18)或lcr1901_vh_1g10m_03(k)(seq id no:19)具有至少90%氨基酸同一性或包含图7中的一个或多个重链cdr区中的1至3个氨基酸取代(seq id no:1、34和35或30,seq id no:28、29和30,或seq id no:1、34和35),其中所述变体保留tgf
‑
β3反应性和中和作用并且缺乏tgf
‑
β1和tgf
‑
β2反应性。在一个特定的方面,本发明提供了人源化抗体,所述人源化抗体包含重链可变区序列lcr1901_vh_1g10m(seq id no:18)或lcr1901_vh_1g10m_03(k)(seq id no:19)。
26.在进一步的方面,本发明提供了抗体,特别是人源化抗体,所述抗体包含重链可变区序列lcr1901_vh_1g10m_02(j)(seq id no:36)或其变体,所述变体与重链可变区序列lcr1901_vh_1g10m_02(j)(seq id no:36)具有至少90%氨基酸同一性或包含图7中的一个或多个重链cdr区中的1至3个氨基酸取代(seq id no:1、34和35或30,seq id no:28、29和30,或seq id no:1、34和35),其中所述变体保留tgf
‑
β3反应性和中和作用并且缺乏tgf
‑
β1和tgf
‑
β2反应性。在一个特定的方面,本发明提供了人源化抗体,所述人源化抗体包含重链可变区序列lcr1901_vh_1g10m_02(j)(seq id no:36)。
27.本发明的抗体可以包含重链可变区cdr结构域区序列:cdr1序列sswih(seq id no:1)、cdr2序列riypgdgdtdysekfq(seq id no:34)和cdr3序列rmittqaaldy(seq id no:35)或arrmittqaal(seq id no:30);cdr1序列sswih(seq id no:1)、cdr2序列riypgdgdtdysekfq(seq id no:34)和cdr3序列rmittqaaldy(seq id no:35);或cdr1序列gytfssswih(seq id no:28)、cdr2序列wigriypgdgdtdysekfq(seq id no:29)和cdr3序列arrmittqaal(seq id no:30),以及轻链可变区。本发明的抗体可以包含重链可变区cdr结
构域区序列:cdr1序列sswih(seq id no:1)或gytfssswih(seq id no:28)、cdr2序列riypgdgdtdysekfq(seq id no:34)或wigriypgdgdtdysekfq(seq id no:29)和cdr3序列rmittqaaldy(seq id no:35)或arrmittqaal(seq id no:30),以及轻链可变区。在一个方面,所述tgf
‑
β3抗体进一步包含轻链可变区cdr序列:cdr1序列kasqsvinava(seq id no:4)、cdr2序列yasnryt(seq id no:5)和cdr3序列qqdysspy(seq id no:33)或qqdysspyt(seq id no:6);或cdr1序列kasqsvinavawy(seq id no:31)、cdr2序列lliyyasnryt(seq id no:32)和cdr3序列qqdysspy(seq id no:33)或qqdysspyt(seq id no:6)。在本发明的一个方面,具有替代重链和轻链cdr序列的tgf
‑
β3特异性中和抗体彼此竞争tgf
‑
β3结合。
28.在一个方面,本发明的tgf
‑
β3特异性抗体包含重链可变氨基酸seq id no:18或seq id no:19。在一个方面,本发明的tgf
‑
β3特异性抗体包含重链可变氨基酸seq id no:18、seq id no:19或seq id no:36。在一个特定的方面,本发明的tgf
‑
β3抗体包含如图10(seq id no:18和22)、图11(seq id no:18和23)、图12(seq id no:19和22)或图13(seq id no:19和23)中任一个所列出的重链和轻链可变区氨基酸序列。本发明的tgf
‑
β3抗体可以包含与如图10、11、12或13(seq id no:18和22、18和23、19和22、19和23)所列出的重链可变区氨基酸序列和轻链可变区氨基酸序列具有至少80%、至少90%、至少95%、至少98%、至少99%氨基酸同一性的氨基酸序列。在一个方面,本发明的tgf
‑
β3抗体包含重链可变区seq id no:36。在进一步的方面,本发明的tgf
‑
β3抗体包含重链可变区seq id no:36和轻链可变区seq id no:22。在进一步的方面,本发明的tgf
‑
β3抗体包含重链可变区seq id no:36和轻链可变区seq id no:22或seq id no:23。能够特异性结合tgf
‑
β3并且不结合tgf
‑
β1或tgf
‑
β2的本发明tgf
‑
β3特异性抗体可以包含与重链可变区氨基酸序列seq id no:18或seq id no:19具有至少80%、至少90%、至少95%、至少98%、至少99%氨基酸同一性的氨基酸序列。能够特异性结合tgf
‑
β3并且不结合tgf
‑
β1或tgf
‑
β2的本发明tgf
‑
β3特异性抗体可以包含与重链可变区氨基酸序列seq id no:36具有至少80%、至少90%、至少95%、至少98%、至少99%氨基酸同一性的氨基酸序列。在进一步的方面,能够特异性结合tgf
‑
β3并且不结合tgf
‑
β1或tgf
‑
β2的本发明tgf
‑
β3特异性抗体可以包含与轻链可变区氨基酸序列seq id no:22或seq id no:23具有至少80%、至少90%、至少95%、至少98%、至少99%氨基酸同一性的氨基酸序列。
29.能够特异性结合tgf
‑
β3并且不结合tgf
‑
β1或tgf
‑
β2的本发明tgf
‑
β3特异性抗体可以包含与重链可变区氨基酸序列seq id no:18或seq id no:19具有至少80%、至少90%、至少95%、至少98%、至少99%氨基酸同一性并且进一步与轻链可变区氨基酸序列seq id no:22或seq id no:23具有至少80%、至少90%、至少95%、至少98%、至少99%氨基酸同一性的氨基酸序列。能够特异性结合tgf
‑
β3并且不结合tgf
‑
β1或tgf
‑
β2的本发明tgf
‑
β3特异性抗体可以包含与重链可变区氨基酸序列seq id no:18或seq id no:19或seq id no:36具有至少80%、至少90%、至少95%、至少98%、至少99%氨基酸同一性并且进一步与轻链可变区氨基酸序列seq id no:22或seq id no:23具有至少80%、至少90%、至少95%、至少98%、至少99%氨基酸同一性的氨基酸序列。
30.在一个特定的方面,本发明的抗体或其活性片段中和人和小鼠tgf
‑
β3。在一个方面,本发明的抗体在哺乳动物中,特别是在人或小鼠中,体内中和和阻断tgf
‑
β3介导的信号传导。在一个方面,本发明的抗体或其活性片段在哺乳动物中体内中和和阻断tgf
‑
β3介导
的信号传导,而不在哺乳动物中体内中和或阻断tgf
‑
β1或tgf
‑
β2信号传导。
31.因此,基于一种或多种抗体的cdr(特别是包括本文鉴定的重链cdr)的特异性结合蛋白(诸如抗体)将可用于在疾病或癌症中靶向tgf
‑
β3、特别是表达tgf
‑
β3的细胞、或免疫反应中的tgf
‑
β3活性。由于本发明抗体的靶标特异性地是tgf
‑
β3而非tgf
‑
β1和/或tgf
‑
β2,因此在本发明的一个方面,本发明的抗体不显著地结合至除tgf
‑
β3以外的tgf
‑
β形式或家族成员,并且预计本发明tgf
‑
β3特异性抗体在细胞靶标中或在动物中将存在较小的毒性和炎性反应或不良免疫反应或反应,特别是相比于更非特异性的tgf
‑
β抗体,诸如识别多于一种形式的tgf
‑
β或所有形式的tgf
‑
β的泛tgf
‑
β抗体。
32.在本发明的另一个方面,本文提供了一种或多种抗体或其一种或多种抗原结合片段,其与本文所述的抗体或其抗原结合片段竞争结合至tgf
‑
β3(例如,人tgf
‑
β3)。在一个具体的实施方案中,本文提供了一种或多种抗体或其一种或多种抗原结合片段,其与本文所述的抗体或其抗原结合片段竞争结合至tgf
‑
β3(例如,人tgf
‑
β3),其程度为本文所述的抗体或其抗原结合片段自身竞争结合至tgf
‑
β3(例如,人tgf
‑
β3)。
33.在另一个具体的实施方案中,本文提供了第一抗体或其抗原结合片段,其与本文所述的抗体或其抗原结合片段竞争结合至tgf
‑
β3(例如,人tgf
‑
β3),其中竞争展现为第一抗体或其抗原结合片段与tgf
‑
β3(例如,人tgf
‑
β3)的结合减少了多于60%(例如,65%、70%、75%、85%、90%、95%、或98%,或在60%至65%、65%至70%、70%至75%、75%至80%、80%至85%、85%至95%、或95%至100%之间)。在另一个具体的实施方案中,本文提供了第一抗体或其抗原结合片段,其与本文所述的抗体或其抗原结合片段竞争结合至tgf
‑
β3(例如,人tgf
‑
β3),其中竞争展现为在第一抗体或其抗原结合片段的存在下和/或在第一抗体或其抗原结合片段的结合之后,抗体1901
‑
1a、1901
‑
1b、1901
‑
1c或1901
‑
1d中的一种或多种抗体或抗原结合片段的结合减少了多于60%(例如,65%、70%、75%、85%、90%、95%、或98%,或在60%至65%、65%至70%、70%至75%、75%至80%、80%至85%、85%至95%、或95%至100%之间)。
34.在具体的方面,本文提供了抗体,其与包含(i)包含具有在图8或图10
‑
13中列出的抗体的vl cdr的氨基酸序列的vl cdr1、vl cdr2和vl cdr3的vl结构域;和(ii)包含具有在图7或图10
‑
13中列出的抗体的cdr的氨基酸序列的vh cdr1、vh cdr2和vh cdr3的vh结构域的抗体竞争(例如,以剂量依赖性方式)特异性结合至tgf
‑
β3(例如,人tgf
‑
β3)。在一个具体的方面,本文提供了抗体,其与包含vh结构域,任选地进一步包含或进一步包含vl结构域的抗体竞争(例如,以剂量依赖性方式)特异性结合至tgf
‑
β3(例如,人tgf
‑
β3),所述vh结构域包含cdr1序列sswih(seq id no:1)、cdr2序列riypgdgdtdysekfq(seq id no:34)和cdr3序列rmittqaaldy(seq id no:35)或arrmittqaal(seq id no:30),所述vl结构域包含cdr1 kasqsvinava(seq id no:4))、cdr2序列yasnryt(seq id no:5)和cdr3序列qqdysspy(seq id no:33)。
35.在一个特定的实施方案中,本文提供了抗体,其与包含1901
‑
1a、1901
‑
1b、1901
‑
1c或1901
‑
1d的vh cdr,特别是seq id no:1、34和35或30,seq id no:28
‑
30或seq id no:1、34和35的抗体竞争(例如,以剂量依赖性方式)特异性结合至tgf
‑
β3(例如,人tgf
‑
β3)。在一个特定的实施方案中,本文提供了抗体,其与包含1901
‑
1a、1901
‑
1b、1901
‑
1c或1901
‑
1d的vl cdr,特别是seq id no:4、5和33,seq id no:31
‑
33或seq id no:4
‑
6的抗体竞争(例如,
以剂量依赖性方式)特异性结合至tgf
‑
β3(例如,人tgf
‑
β3)。
36.在一个具体的实施方案中,本文所述的抗体是被包含具有氨基酸序列seq id no:18或seq id no:19的vh结构域的抗体竞争性阻断(例如,以剂量依赖性方式)特异性结合至tgf
‑
β3(例如,人tgf
‑
β3)的抗体。在一个具体的实施方案中,本文所述的抗体是被包含具有氨基酸序列seq id no:18或seq id no:19或seq id no:36的vh结构域的抗体竞争性阻断(例如,以剂量依赖性方式)特异性结合至tgf
‑
β3(例如,人tgf
‑
β3)的抗体。在一个具体的实施方案中,本文所述的抗体是被包含具有氨基酸序列seq id no:18或seq id no:19或seq id no:36的vh结构域和具有氨基酸序列seq id no:22或seq id no:23的vl结构域的抗体竞争性阻断(例如,以剂量依赖性方式)特异性结合至tgf
‑
β3(例如,人tgf
‑
β3)的抗体。
37.在其他方面,本发明提供了分离的核酸,所述分离的核酸包含编码如上或本文所定义的特异性结合成员或抗体的序列,以及制备本发明特异性结合成员或抗体的方法,所述方法包括在引起所述结合成员或抗体的表达的条件下表达所述核酸以及回收所述结合成员或抗体。在一个这样的方面,提供了编码具有如图10、11、12或13所列出的重链氨基酸序列的抗体可变区序列的核酸,或提供了具有如图7和seq id no:1、34、35、28、29、30或图10、11、12或13所列出的重链cdr结构域序列的抗体。在一个方面,提供了编码具有如图10、11、12或13所列出的轻链氨基酸序列的抗体轻链可变区的核酸,或提供了具有如图8和seq id no:4、5、6、31、32、33或图10、11、12或13所列出的轻链cdr结构域序列的抗体。本发明还涉及编码本发明抗体的重组dna分子或克隆基因或其简并变体;优选是编码抗体vh、特别是cdr区序列并且任选地另外编码vl、特别是cfr区序列的核酸分子,特别是重组dna分子或克隆基因,其能够编码重链序列seq id no:18或19或36和轻链序列seq id no:22或23、或此类重链和轻链可变区序列(包括如图10、11、12和13所列出的)的组合。
38.本发明的抗体和片段的独特特异性和亲和力提供了鉴定、表征和靶向与tgf
‑
β3表达、活性或激活相关的病症的诊断和治疗性用途。因此,根据本发明提供了方法及其方面。在一个方面,靶向tgf
‑
β3的本发明抗体可用于调节免疫反应,包括调节针对癌症、癌症细胞或肿瘤细胞以及癌症抗原或肿瘤抗原的免疫反应。在另一个方面,靶向tgf
‑
β3的本发明抗体可用于治疗性治疗或管理癌症,增强抗癌免疫反应和增强癌症疫苗。所述抗体可应用于增强一种或多种癌症疗法(包括传统的抗癌剂和化合物以及细胞疗法,包括靶向癌症的t细胞疗法)的治疗作用,包括抗癌和/或抗细胞作用。所述抗体可应用于增强一种或多种放射疗法的治疗作用,包括抗癌和/或抗细胞作用。在一个特定的方面,本发明的抗体可应用于治疗、管理和/或预防癌症,包括癌症的复发和转移。在一个方面,本发明的tgf
‑
β3抗体可应用于治疗或调节乳腺癌、黑素瘤、前列腺癌或肺癌。
39.根据本发明,本文提供了用于治疗、减轻或调节癌症的方法,所述方法包括施用本发明的抗体或其药物组合物。在进一步的方面,提供了用于刺激或增强哺乳动物中对疫苗或抗原的免疫反应或免疫调节性药剂或放射疗法的方法,所述方法包括施用本发明的抗体或其药物组合物。
40.在本发明的一个方面,一种或多种tgf
‑
β3抗体,特别是如本文提供的一种或多种tgf
‑
β3中和抗体,特别是人源化抗体可以与一种或多种癌症抗原和一种或多种佐剂的组合物结合或在其中施用,包括施用于患者以促进更稳健地启动和激活适应性抗肿瘤反应以增强针对癌症的免疫疗法。另外的针对tgfβ活性的抑制剂,诸如小分子、反义或适体,也可以
用于抑制tgfβ活性,包括或特别是tgf
‑
β3。
41.因此,在本发明的一方面,所述一种或多种抗tgf
‑
β3抗体可以单独地施用或与其他治疗、疗法或药剂或细胞疗法组合施用,同时或顺序地施用,取决于有待治疗的病症。免疫调节剂可以包含在具有一种或多种tgf
‑
β3抗体的组合物中或与一种或多种tgf
‑
β3抗体一起施用和/或在不同时间施用以增强免疫调节和/或癌症疗法,包括针对癌症的免疫疗法或细胞疗法。免疫调节剂可以是佐剂。在进一步的方面,本发明的tgf
‑
β3抗体还可以用作一种或多种免疫刺激剂或一种或多种佐剂,与诸如但不限于蛋白质、肽或核酸等抗原材料组合使用,以便产生保护性免疫反应,诸如针对所施用的抗原的t细胞或ctl反应。
42.本发明提供了用于改善、促进或增强嵌合抗原受体(car)t细胞疗法的方法,所述方法包括与一种或多种car t细胞同时施用或顺序地施用一种或多种抗tgf
‑
β3抗体或其片段。在所述方法的一个方面,在施用或输注之前,将所述一种或多种抗tgf
‑
β3抗体或其片段添加到car t细胞培养物中。在一个方面,所述一种或多种抗tgf
‑
β3抗体或其片段,诸如其scfv,是由一种或多种car t细胞表达或在其上表达的。在本发明的另一种方法中,将一种或多种抗tgf
‑
β3抗体或其片段与激活的t细胞或针对癌症抗原或细胞周期调节因子的t细胞组合施用。
43.根据本发明,本文提供了用于治疗、减轻或调节纤维化病症或纤维化疾病的方法,所述方法包括施用本发明的抗体或其药物组合物。在一个方面,本文提供了用于治疗、减轻或调节其中细胞外基质形成改变的病症或疾病的方法,所述方法包括施用本发明的抗体或其药物组合物。在这些方法的一个方面,本发明的抗体可以与一种或多种抗炎剂、免疫抑制剂、免疫反应调节剂、抗氧化剂或抗纤维化药物或药剂结合或组合施用。在一个这样的方面,将本发明的一种或多种抗体与针对纤维化的治疗组合或与其结合施用。在一个这样的方面,提供了用于治疗或调节肺纤维化的方法。在一个方面,将本发明的一种或多种抗体与纤维化治疗组合或与其结合施用,所述纤维化治疗特别地选自尼达尼布(nintedanib)和吡非尼酮(pirfenidone)
44.如已经显示的,tgf
‑
β3抗体(包括tgf
‑
β3特异性抗体)在体外和体内均有效。因此,本发明的一个方面涉及通过与或不与抗原分子一起施用本发明的一种或多种tgf
‑
β3抗体来刺激受试者的免疫反应,所述抗体的量足以刺激此类受试者的有利的免疫反应。
45.本发明包括组合物和或试剂盒,其包含本发明的一种或多种tgf
‑
β3抗体连同一种或多种免疫原性蛋白或肽。所述组合物包括药物组合物和免疫学组合物。本发明的抗体或组合物可以全身或以靶向方式施用,包括施用至受影响的器官或目标器官、施用至肿瘤、在肿瘤的区域或位置施用、或直接施用至肿瘤,诸如瘤内注射。
46.包含根据本发明的cdr结构域的抗体、其片段和重组抗体可以用于治疗或诊断人体或动物体的方法,诸如治疗人类患者的肿瘤的方法,所述方法包括向所述患者施用有效量的本发明的抗体、其片段和重组抗体。包含根据本发明的cdr结构域的抗体、其片段和重组抗体可以用于刺激或增强哺乳动物、特别是人类的癌症、肿瘤细胞或一种或多种癌症或肿瘤抗原的免疫反应的方法,所述方法包括向所述哺乳动物施用有效量的本发明的抗体、其片段和重组抗体。包含根据本发明的cdr结构域的抗体、其片段和重组抗体可以用于抑制或减少哺乳动物、特别是人类的癌症的复发或转移的方法,所述方法包括向所述哺乳动物施用有效量的本发明的抗体、其片段和重组抗体。包含根据本发明的cdr结构域的抗体、其
片段和重组抗体可以用于在哺乳动物、特别是人类中响应于放射或癌症疗法而抑制或阻断tgfβ、特别是tgfβ3的刺激的方法,所述方法包括向所述哺乳动物施用有效量的本发明的抗体、其片段和重组抗体。在所述方法的一个方面,将包含根据本发明的cdr结构域的tgf
‑
β3特异性抗体、其片段和重组抗体与放射疗法和/或癌症疗法组合或继放射疗法和/或癌症疗法之后施用于哺乳动物。
47.本发明的治疗性方法与癌症的预防或治疗、或对癌症的免疫反应的刺激或增强、或对免疫介导的癌细胞(包括黑素瘤、乳腺癌、前列腺癌和肺癌)保护的抑制相关。在所述方法的一个方面,本发明的特异性tgf
‑
β3中和抗体(包括其活性片段)用于刺激或增强对癌症(包括黑素瘤、乳腺癌、前列腺癌和肺癌)的免疫反应。在一个方面,本发明的一种或多种特异性中和tgf
‑
β3抗体或其活性片段刺激或增强经由癌症疫苗或癌症免疫疗法或经由诸如癌症靶向t细胞疗法的细胞疗法(包括放射疗法)的免疫反应。
48.本发明的抗体以及在一个特定的实施方案中具有图10、11、12或13中表示的序列的抗体、或其活性片段、以及由其衍生的单链、重组或合成抗体(特别是包含图7和8中描绘的重链cdr区序列和轻链cdr区序列的,包括包含重链cdr seq id no:1、34和35或30和轻链cdr seq id no:4、5和33的)可以在免疫细胞(包括淋巴样细胞,包括t细胞)中表达。在一个这样的方面,抗体、或其片段、以及由其衍生的单链、重组或合成抗体由淋巴样细胞(包括t细胞)表达和分泌。诸如t细胞的淋巴样细胞可以制备并且用于疗法,包括免疫调节,以及用于癌症疗法。在一个方面,表达本发明的一种或多种tgfβ3抗体的淋巴样细胞(诸如t细胞)可以经进一步工程改造以表达另一种/其他一种或多种蛋白质,诸如受体。在一个方面,可以将表达本发明的一种或多种tgfβ3抗体的淋巴样细胞(诸如t细胞)与经工程改造以表达另一种/其他一种或多种蛋白质(诸如受体)的淋巴样细胞(诸如t细胞)组合。在一个方面,受体是嵌合抗原受体(car)。在一个方面,受体是t细胞受体。在一个方面,所述另一种/其他一种或多种蛋白质是癌症抗原或肿瘤抗原或肿瘤抗原抗体或其片段或免疫调节性药剂。本发明提供了治疗方法,所述方法包括向哺乳动物施用表达本发明的一种或多种tgfβ3抗体的淋巴样细胞,诸如t细胞。在一个方面,所述方法涉及治疗癌症或预防癌症的复发或转移。在一个方面,所述方法涉及调节免疫反应,包括在癌症或癌症疗法中。
49.本发明的结合成员和抗体以及在一个特定的实施方案中具有图10、11、12或13中表示的序列的抗体、或其活性片段、以及由其衍生的单链、重组或合成抗体(特别是包含描绘在图7和8中的重链cdr区序列和轻链cdr区序列的,包括包含重链cdr seq id no:1、34和35或30和轻链cdr seq id no:4、5和33的)可以制备在药物组合物中,以用于施用,所述药物组合物包含合适的媒介物、载体或稀释剂或包含佐剂和/或免疫调节剂。此类药物组合物还可以包含通过本领域已知的方法(诸如聚乙二醇化)调节抗体或片段的半衰期的手段。
50.本发明的药物组合物或免疫原性组合物可以进一步包含另外的抗体或治疗剂。在一个方面,此类其他药剂或疗法可以选自抗癌剂或疗法、抗有丝分裂剂、凋亡剂或抗体、或免疫调节剂、或针对免疫调节剂的小分子抑制剂。更一般地,这些抗癌剂可以是酪氨酸激酶抑制剂或磷酸化级联抑制剂、翻译后调节剂、细胞生长或分裂抑制剂(例如,抗有丝分裂剂)、抑制剂或信号转导抑制剂。所述组合物可以与免疫调节剂(诸如佐剂)一起施用。所述组合物还可以与其他抗tgfβ抗体、其他免疫调节性抗体或其他抗肿瘤抗原抗体一起施用或可以包括与其一起的组合。
51.本发明的诊断效用扩展到本发明的抗体在表征肿瘤或细胞样品或筛选肿瘤或癌症的测定(包括体外和体内诊断性测定)中的用途。本发明的抗体可以携带可检测标记或功能性标记。特异性结合成员可以携带放射性标记,诸如同位素3h、
14
c、
32
p、
35
s、
36
cl、
51
cr、
57
co、
58
co、
59
fe、
90
y、
121
i、
124
i、
125
i、
131
i、
111
in、
117
lu、
211
at、
198
au、
67
cu、
225
ac、
213
bi、
99
tc和
186
re。在一个方面,标记可以是酶,包括其中检测可以通过本领域中已知的目前使用的比色技术、分光光度技术、荧光分光光度技术、电流测量技术或气体定量技术中的任何一种来完成。
52.本发明的免疫缀合物或抗体融合蛋白(其中本发明的特异性结合成员、特别是抗体及其片段与其他分子或药剂缀合或附接)进一步包括但不限于与化学消融剂、毒素、免疫调节剂、细胞因子、细胞毒性剂、化学治疗剂或药物缀合的结合成员。
53.本发明包括测定系统,所述测定系统可以制备成用于定量分析例如tgfβ3的存在的程度的测试试剂盒的形式。所述系统或测试试剂盒可以包含通过本文讨论的一种放射性技术和/或酶技术(将标记与抗体偶联)制备的标记组分以及一种或多种另外的免疫化学试剂,其中至少一种是有待确定的游离或固定组分或其一种或多种结合配偶体。
54.通过察看随后的详细描述和所附权利要求,其他目的和优点将对于本领域技术人员是显而易见的,所述详细描述参考以下说明性附图进行。
附图说明
55.图1描绘了克隆的杂交瘤鼠1901抗体亲本vh和vk核酸(表示为_genscript_dna)(seq id no:9和11)以及vh和vk氨基酸序列(表示为_genscript_aa)(seq id no:10和12)。带灰色阴影的xxxxxx是genscript序列中存在的天然信号肽。
56.图2绘制了lcr1901_噬菌体和lcr1901_可溶性scfv的elisa结果,证明了将鼠mab1901可变结构域重新转换(reformatting)为scfv保留了对tgfb3的结合和精细特异性识别,如通过elisa评估的。
57.图3描绘了移植鼠1901的氨基酸序列(seq id no:13)与lcr1901_glv1(seq id no:14)的氨基酸序列以及igkv1
‑
39*01/ighv1
‑
69*08的移植。鼠cdr核心呈粗体;韦尼耶(vernier)残基是带下划线的;scfv接头是灰色斜体的(clustal o(1.2.1)多序列比对)。同源性:(*)保守序列;(:)保守突变;(.)半保守突变;()非保守突变。
58.图4绘制了亲本可溶性scfv lcr1901_scfv和lcr1901_glv1_scfv的elisa结果,并且证明了将鼠cdr移植到人框架中保留了针对tgfb3的结合和精细特异性识别。
59.图5描绘了所指示的构建体1901_鼠、1901_嵌合、1901_glv1(移植)和13a1
‑
鼠(13a1是鼠抗tgfb1抗体)的针对tgfb1、tgfb2和tgfb3的elisa结果。将移植的可变结构域重新转换为完整huigg1支架保留了tgfb3结合和对tgfb3的精细特异性识别。
60.图6以表列出了基于竞争性结合测定,具有潜在序列不利因素(liability)的cdr/连接vh和vk残基、其建议的修正和最终选择的残基。对于氨基酸残基序列编号使用imgt编号。
61.图7提供了vh蛋白序列和关于vh链的lcr
‑
hu1901 cdr移植概述。以表列出的序列如下:鼠1901vh蛋白序列(seq id no:15)、lcr1901_glv1(移植到huighv1
‑
69*09框架上)(seq id no:16)、lcr1901 vh_1g10(seq id no:17)、lcr1901 vh_1g10m(seq id no:18)、lcr1901 vh_1g10m_glv1_03(seq id no:19)和lcr1901 vh_1g10m_02(j)(seq id no:36)。
x=相对于原始移植物的改变;x*=保持的小鼠残基;#=从人回复突变至原始小鼠。对于氨基酸残基序列编号使用imgt编号。cdr(呈粗体)和韦尼耶区是移植的;亲本ighj是保留的。
62.^^a29>t(主要的hu cdr1残基);i53(cdr2连接)>保留亲本;n66、t68、g69(cdr2n
‑
糖基(n
‑
glycon))>d66、s68、e69;k72(cdr2连接)>q72;m108、m115(cdr3亚砜风险)>m108(优选的)、l115
63.^^^s123>l123(修正为hu ighj4)
64.^^^^hufr2回复突变至小鼠fr2:r43
‑
>k43;a45
‑
>r45;q48
‑
>k48。
65.图8提供了vl(κ)蛋白序列和关于vk链的lcr
‑
hu1901 cdr移植概述。以表列出的序列如下:鼠1901vl(κ)蛋白序列(seq id no:20)、lcr1901_glv1(移植到huigkv1
‑
39*01框架上)(seq id no:21)、lcr1901 vk_glv1_03(f)(seq id no:22)和lcr1901vk_glv1_05(h)(seq id no:23)。x*=保持的小鼠残基;#=从人回复突变至原始小鼠。对于氨基酸残基序列编号使用imgt编号。
66.^移植到igkv1
‑
39*01框架区上的亲本cdr(呈粗体)/韦尼耶残基;l124>v124(修正为hu igkj4)
67.^^fr2:k48>q48;a49>s49;fr3:s74>d74;s83>y83;l89>f89;p96>a96;t101>v101;f99>v99(不是小鼠;小鼠=l)
68.^^^fr3:s74>d74;s83>y83;l89>f89;p96>a96;t101>v101;f99>v99(不是小鼠;小鼠=l)。
69.图9以表提供了v区可变结构域全局种系比对同源性(igkv元件;imgt)^%位置同一性(位置相似性);得分最高的3个功能等位基因的平均值。
70.图10提供了lcr_1901_vh_1g10m
‑
vk_glv1_03(f)(1901
‑
1c)的蛋白质序列。所述序列包含vh重链氨基酸lcr_1901_vh_1g10m(seq id no:18)和vlκ轻链氨基酸vk_glv1_03(f)(seq id no:22)。cdr呈粗体。示出了恒定区ch igg4(s228p)序列(seq id no:24)以及还有ck igkc*01(seq id no:25)。
71.图11提供了lcr1901_vh_1g10m
‑
vk_glv1_05(h)(1901
‑
1a)的蛋白质序列。所述序列包含vh重链氨基酸lcr_1901_vh_1g10m_03(k)(seq id no:19)和vlκ轻链氨基酸vk_glv1_03(f)(seq id no:22)。cdr呈粗体。示出了恒定区ch igg4(s228p)序列(seq id no:24)以及还有ck igkc*01(seq id no:25)。
72.图12提供了lcr1901_vh_1g10m_03(k)
‑
vk_glv1_03(f)(1901
‑
1d)的蛋白质序列。所述序列包含vh重链氨基酸lcr_1901_vh_1g10m(seq id no:18)和vlκ轻链氨基酸vk_glv1_05(h)(seq id no:23)。cdr呈粗体。示出了恒定区ch igg4(s228p)序列(seq id no:24)以及还有ck igkc*01(seq id no:25)。
73.图13提供了lcr1901_vh_1g10m_03(k)
‑
vk_glv1_05(h)(1901
‑
1b)的蛋白质序列。所述序列包含vh重链氨基酸lcr_1901_vh_1g10m_03(k)(seq id no:19)和vlκ轻链氨基酸vk_glv1_05(h)(seq id no:23)。cdr呈粗体。示出了恒定区ch igg4(s228p)序列(seq id no:24)以及还有ck igkc*01(seq id no:25)。
74.图14提供了预测的堆叠扭转角度(基于568pdb结构;paps,bioinf.org.uk/abs/paps/)。尽管预测的vh/vk扭转角度与鼠亲本显著不同,但实现了改善/重新获得的[k f]glv1反向突变体配对的效力。人源化vh和vk预测均有助于角度偏移。[k f]预测出相对于折
中的glv1原始移植物有细微的角度偏移
‑
表明了对在tmlec测定中中和效力的重新获得的可能解释。vh_1g10m与新设计的glv1_05(h)κ链的最小回复突变配对保持预测的[k f]角度。
[0075]
图15描绘了tgfb抗体对在tmlec中tgfb3诱导的萤光素酶表达的中和。所评价的抗体是(a)1901亲本、(b)1901 1a(lcr1901_vh_1g10m
‑
vk_glv1_05(h))、(c)1901 1b(lcr1901_vh_1g10m_03(k)
‑
vk_glv1_05(h))、(d)1901 1c(lcr_1901_vh_1g10m
‑
vk_glv1_03(f))和(e)1901 1d(lcr1901_vh_1g10m_03(k)
‑
vk_glv1_03(f))抗体。
[0076]
图16提供了在tmlec测定中对tgfb3信号传导的抑制(tgf
‑
β3抑制单位/μg)。与亲本鼠1901抗体相比,人源化lcr1901 igg4抗体具有改善的功能性中和。值是由在tmlec测定中50%tgf
‑
b3(500pg/ml)抑制的ab浓度计算的。
[0077]
图17描绘了人源化1901构建体(a和b)1901
‑
a、(c和d)1901
‑
b、(e和f)1901
‑
c和(g和h)1901d的tgf
‑
β特异性。左边一组图(a、c、e和g)示出了较高的抗体浓度,而右边一组图(b、d、f和h)描绘了最高600ng/ml的抗体浓度的较近距视图。
[0078]
图18描绘了lcr1901 igg4变体1a、1b、1c和1d与亲本小鼠1901抗体的竞争elisa结合曲线。
[0079]
图19描绘了单价人源化1901候选fab 1b、1c和1d针对tgfb1和tgfb3的对比elisa结合分析。
[0080]
图20提供了单价人源化1901候选fab与基准针对固定tgfb3的代表性biacore单周期动力学传感图。tgfb3直接固定;fab作为可溶性分析物(0
‑
2.5nm)。单循环动力学如下进行:接触:360s;解离:500s;流速:30μl/min。
[0081]
图21提供了纯化的人源化1901候选igg4抗体(a)vh_1g10m
‑
vk_glv1_05(1901
‑
1a)、(b)vh_1g10m_03
‑
vk_glv1_05(1901
‑
1b)、(c)vh_1g10m
‑
vk_glv1_03(1901
‑
1c)和(d)vh_1g10m_03
‑
vk_glv1_03(1901
‑
1d)的sec谱。
[0082]
图22示出了纯化的人源化1901候选igg4抗体(a)vh_1g10m
‑
vk_glv1_05(1901
‑
1a)、(b)vh_1g10m_03
‑
vk_glv1_05(1901
‑
1b)、(c)vh_1g10m
‑
vk_glv1_03(1901
‑
1c)和(d)vh_1g10m_03
‑
vk_glv1_03(1901
‑
1d)的代表性dsf熔解温度。
[0083]
图23以表列出了dsf去折叠(unfolding)转变和温度。
[0084]
^fab转变与ch2去折叠重叠
‑
没有离散的tm2。
[0085]
图24提供了(a)人源化1901候选igg4抗体的相对粗蛋白表达产率和(b)1901候选抗体1a、1b、1c和1d的sds
‑
page(变性)。一式三份地生长2ml转染培养物;负载10μl上清液。
[0086]
图25描绘了tgfb3特异性抗体mab 1901
‑
1b对tgfb3介导的对抗msln car
‑
t靶细胞杀伤的抑制的体外挽救。效应子:用抗间皮素car(hp4;us 2014301993 a1)转染的原代人t细胞。靶标:h
‑
226人肺癌(meso );e:t比率5:1,添加:tgfb3(1ng/ml),1901_1b tgfb3
‑
选择性huigg4,读数:incucyte:由死靶细胞引起的cytotox红积累(6
‑
20h杀伤斜率(kill slope);每个图像的总红色图像积分强度)。
[0087]
图26描绘了tgfb3特异性抗体mab 1901
‑
1b对tgfb3介导的对抗egfr car
‑
t靶细胞杀伤的抑制的体外挽救。效应子:用抗egfr car(经反向工程改造的scfv帕尼单抗)转染的原代人t细胞(cd3/cd28激活和扩增的pbmc)。靶标:mda
‑
mb
‑
231人乳腺癌(egfr );e:t比率5:1。添加:tgfb3(1ng/ml),1901_1b tgfb3选择性huigg4(500ng/ml)。读数:incucyte:预染
色(cytolightred)靶细胞的数量的时间依赖性变化。
[0088]
图27描绘了相对于固定tgfβ3的t细胞分泌的1901
‑
1b抗体。评价来自表达和分泌tgfβ3抗体的jurkat t细胞培养物的培养基上清液与tgfβ3的结合。iso ctrl是同种型对照抗体。在一个样品中添加1901
‑
1b抗体作为结合对照。添加来自1901
‑
1b转染的t细胞的上清液,并且还将其连续稀释至(diluted)最高50倍,并且证明了与固定tgfβ3的结合,所述结合是与添加的1901
‑
1b抗体对照可比较的。
具体实施方式
[0089]
根据本发明,可以使用本领域技术范围内常规的分子生物学、微生物学和重组dna技术。文献中充分解释了此类技术。参见例如,sambrook等人,“molecular cloning:a laboratory manual”(1989);“current protocols in molecular biology”第i
‑
iii卷[ausubel,r.m.编辑(1994)];“cell biology:a laboratory handbook”第i
‑
iii卷[j.e.celis编辑(1994))];“current protocols in immunology”第i
‑
iii卷[coligan,j.e.编辑(1994)];“oligonucleotide synthesis”(m.j.gait编辑1984);“nucleic acid hybridization”[b.d.hames&s.j.higgins编辑(1985)];“transcription and translation”[b.d.hames和s.j.higgins编辑(1984)];“animal cell culture”[r.i.freshney编辑(1986)];“immobilized cells and enzymes”[irl press,(1986)];b.perbal,“a practical guide to molecular cloning”(1984)。
[0090]
因此,如果在本文中出现,则以下术语应具有以下列出的定义。
[0091]
a.术语
[0092]
术语“tgf
‑
β3”、“tgfb3”和“tgf
‑
beta3”是指并且包括人和小鼠的转化生长因子β同种型3蛋白两者。本文提供了人和小鼠tgf
‑
β3的示例性全长氨基酸序列。
[0093]
抗体“1901
‑
1a”或“1a”也表示为lcr1901_vh_1g10m
‑
lcr1901_vk_glv1_05(h)。抗体1901
‑
1a包含重链序列lcr1901_vh_1g10m(seq id no:18)和轻链序列lcr1901_vk_glv1_05(h)(seq id no:23)
[0094]
抗体“1901
‑
1b”或“1b”也表示为lcr1901_vh_1g10m_03(k)
‑
lcr1901_vk_glv1_05(h)。抗体1901
‑
1b包含重链序列lcr1901_vh_1g10m_03(k)(seq id no:19)和轻链序列lcr1901_vk_glv1_05(h)(seq id no:23)。
[0095]
抗体“1901
‑
1c”或“1c”也表示为lcr1901_vh_1g10m
‑
lcr1901_vk_glv1_03(f)(1901
‑
1c)。抗体1901
‑
1c包含重链序列lcr1901_vh_1g10m(seq id no:18)和轻链序列lcr1901_vk_glv1_03(f)(seq id no:22)。
[0096]
抗体“1901
‑
1d”或“1d”也表示为lcr1901_vh_1g10m_03(k)
‑
lcr1901_vk_glv1_03(f)。抗体1901
‑
1d包含重链序列lcr1901_vh_1g10m_03(k)(seq id no:19)和轻链序列lcr1901_vk_glv1_03(f)(seq id no:22)。
[0097]
术语“特异性结合成员”描述了对彼此具有结合特异性的一对分子的成员。特异性结合对的成员可以是天然来源的或全部或部分地合成产生的。这对分子中的一个成员具有在其表面上的区域或空腔,所述区域或空腔与这对分子中的另一个成员的特定空间和极性组织特异性结合并且因此与其互补。因此,所述对的成员具有彼此特异性结合的特性。特异性结合对的类型的例子是抗原
‑
抗体、生物素
‑
亲和素、激素
‑
激素受体、受体
‑
配体、酶
‑
底
物。本技术涉及抗原
‑
抗体类型反应。
[0098]
术语“抗体”描述了无论是天然的还是部分或全部合成产生的免疫球蛋白。所述术语还涵盖具有作为抗体结合结构域或与抗体结合结构域同源的结合结构域的任何多肽或蛋白质。此术语还考虑了cdr移植的抗体。“抗体”是结合特异性表位的任何免疫球蛋白,包括抗体及其片段。所述术语涵盖多克隆、单克隆和嵌合抗体,最后提及的进一步详细描述在美国专利号4,816,397和4,816,567中。术语“一种或多种抗体”包括通常包含四条全长多肽链(两条重(h)链和两条轻(l)链)的野生型免疫球蛋白(ig)分子或其等效的ig同源物(例如,骆驼抗体,其仅包含重链);包括保留ig分子的必要表位结合特征的其全长功能突变体、变体或衍生物,并且包括双重特异性、双特异性、多特异性和双重可变结构域抗体;免疫球蛋白分子可以是任何类别的(例如,igg、ige、igm、igd、iga和igy)或子类的(例如,igg1、igg2、igg3、igg4、iga1和iga2)。术语“抗体”的含义中还包括任何“抗体片段”。
[0099]“抗体片段”意指包含至少一条非全长的多肽链的分子,包括(i)fab片段,其为由可变轻(vl)、可变重(vh)、恒定轻(cl)和恒定重1(ch1)结构域组成的单价片段;(ii)f(ab’)2片段,其为包含由二硫桥在铰链区连接的两个fab片段的二价片段;(iii)fab(fd)片段的重链部分,其由vh和ch1结构域组成;(iv)可变片段(fv),其由抗体单臂的vl和vh结构域组成;(v)结构域抗体(dab)片段,其包含单一可变结构域(ward,e.s.等人,nature 341,544
‑
546(1989));(vi)骆驼抗体;(vii)分离的互补决定区(cdr);(viii)单链fv片段,其中vh结构域和vl结构域通过肽接头连接,所述肽接头允许两个结构域缔合以形成抗原结合位点(bird等人,science,242,423
‑
426,1988;huston等人,pnas usa,85,5879
‑
5883,1988);(ix)双抗体,其为二价双特异性抗体,其中vh和vl结构域表达在单一多肽链上,但使用接头,所述接头太短而不允许在同一条链上的两个结构域之间配对,从而迫使所述结构域与另一条链的互补结构域配对并且形成两个抗原结合位点(wo 94/13804;p.holliger等人proc.natl.acad.sci.usa 90 6444
‑
6448,(1993));以及(x)线性抗体,其包含一对串联的fv区段(vh
‑
ch1
‑
vh
‑
ch1),其与互补轻链多肽一起形成一对抗原结合区;(xi)多价抗体片段(scfv二聚体、三聚体和/或四聚体(power和hudson,j immunol.methods 242:193
‑
204 9(2000));(xii)微抗体(minibody),其为由与恒定的免疫球蛋白结构域ch3或ch4融合的scfv构成的二价分子,其中恒定ch3或ch4结构域用作二聚化结构域(olafsen t等人(2004)prot eng des sel 17(4):315
‑
323;hollinger p和hudson pj(2005)nature biotech 23(9):1126
‑
1136);以及(xiii)重链和/或轻链的其他非全长部分或其突变体、变体或衍生物,单独地或以任何组合。
[0100]
由于抗体可以以多种方式修饰,术语“抗体”应解释为涵盖具有具备所需特异性的结合结构域的任何特异性结合成员或物质。因此,此术语涵盖抗体的抗体片段、衍生物、功能等效物和同源物,包括包含免疫球蛋白结合结构域的任何多肽,无论是天然的还是全部或部分合成的。因此,包括包含与另一种多肽融合的免疫球蛋白结合结构域或等效物的嵌合分子。嵌合抗体的克隆和表达描述在ep
‑
a
‑
0120694和ep
‑
a
‑
0125023以及美国专利号4,816,397和4,816,567中。
[0101]“抗体结合位点”是由轻链或重链以及轻链可变区和高变区构成的抗体分子的特异性结合抗原的结构部分。
[0102]
如本文所用的呈其各种语法形式的短语“抗体分子”考虑了完整的免疫球蛋白分
子和免疫球蛋白分子的免疫活性部分两者。
[0103]
示例性抗体分子是完整的免疫球蛋白分子、基本上完整的免疫球蛋白分子、以及免疫球蛋白分子的含有互补位的那些部分,包括本领域已知为fab、fab’、f(ab’)2和f(v)的那些部分,所述部分优选用于本文所述的治疗性方法。
[0104]
抗体也可以是双特异性的,其中抗体的一个结合结构域是本发明的特异性结合成员,并且另一个结合结构域具有不同的特异性,例如以募集效应子功能等等。本发明的双特异性抗体包括其中抗体的一个结合结构域是本发明的特异性结合成员,包括其片段,并且另一个结合结构域是不同的抗体或其片段,包括不同的抗癌或抗肿瘤特异性抗体的结合结构域。所述另一个结合结构域可以是识别或靶向特定细胞类型的抗体,如在神经或胶质细胞特异性抗体中。在本发明的双特异性抗体中,本发明抗体的一个结合结构域可以与识别特定细胞受体和/或以特定方式调节细胞的其他结合结构域或分子(如例如免疫调节剂(例如,一种或多种白介素)、生长调节剂或细胞因子或毒素(例如,蓖麻毒素)或抗有丝分裂或凋亡剂或因子)组合。因此,本发明的tgfβ
‑
3抗体可以用于在诸如伤口愈合、炎症、癌症或肿瘤的适应症中指导或靶向药剂、标记、其他分子或化合物或抗体。
[0105]
呈其各种语法形式的短语“单克隆抗体”是指仅具有能够与特定抗原免疫反应的抗体结合位点的抗体。因此,单克隆抗体典型地对与其免疫反应的任何抗原展示出单一结合亲和力。单克隆抗体还可以含有具有多个抗体结合位点的抗体分子,所述抗体结合位点各自对不同抗原具有免疫特异性;例如双特异性(嵌合)单克隆抗体。
[0106]
术语“抗原结合结构域”描述了抗体的一部分,所述部分包括与抗原的一部分或全部特异性结合和互补的区域。在抗原较大的情况下,抗体可以仅与抗原的特定部分结合,所述部分称为表位。抗原结合结构域可以由一个或多个抗体可变结构域提供。优选地,抗原结合结构域包含抗体轻链可变区(vl)和抗体重链可变区(vh)。
[0107]
本发明的免疫缀合物或抗体融合蛋白(其中用于本发明的抗体、抗体分子或其片段与其他分子或药剂缀合或附接)进一步包括但不限于与化学消融剂、毒素、免疫调节剂、细胞因子、细胞毒性剂、化学治疗剂、抗微生物剂或肽、细胞壁和/或细胞膜、或药物缀合的此类抗体、分子或片段。
[0108]
术语“一种或多种佐剂”描述了可用于改善免疫反应或免疫细胞或组分刺激的物质、化合物、药剂或材料,并且可以在一些情况下与任何特定抗原组合在免疫学组合物、药物组合物或疫苗组合物中。佐剂可以用于增加产生的抗体和效应t细胞的量以及减少抗原或免疫刺激剂或调节剂的数量和注射频率。尽管一些抗原是在没有佐剂的情况下施用的,但存在许多这样的抗原,其在不存在有效佐剂的情况下缺乏足够的免疫原性来刺激有用的免疫反应。佐剂还改善从“自足”抗原的免疫反应,因为可以增加所获得的免疫反应或可以减少所施用的抗原的量。佐剂可以用作缓慢释放抗原的组织储库,以及还用作非特异性增强免疫反应的淋巴样系统激活剂(hood等人,immunology,第二版,1984,benjamin/cummings:门洛帕克(menlo park),加利福尼亚州,第384页)。在一个优选的方面,佐剂是在哺乳动物、特别是人中生理上和/或药学上可接受的。用于实验动物的标准佐剂是弗氏(freund)佐剂。弗氏完全佐剂(fca)是含有在盐水中的矿物油和被杀死的分枝杆菌的乳液。弗氏不完全佐剂(fia)省去了分枝杆菌。fia和fca两者均诱导良好的体液(抗体)免疫,并且fca另外地诱导高水平的细胞介导的免疫。但是,由于副作用,fca和fia都不是临床用途可
接受的。特别地,矿物油已知会引起肉芽肿和脓肿,并且结核分枝杆菌(mycobacterium tuberculosis)是引起结核病的因子。先前已知和使用的佐剂包括但不限于完全弗氏佐剂、不完全弗氏佐剂、皂苷、矿物凝胶诸如氢氧化铝、表面活性物质诸如溶血卵磷脂、普朗尼克(pluronic)多元醇、聚阴离子、肽、油或烃乳液、钥孔戚血蓝蛋白、二硝基苯酚、以及潜在有用的人类佐剂诸如bcg(卡介苗(bacille calmette
‑
guerin))和短小棒状杆菌(corynebacterium parvum)。矿物盐佐剂包括但不限于:氢氧化铝、磷酸铝、磷酸钙、氢氧化锌和氢氧化钙。优选地,佐剂组合物进一步包括脂肪乳液的脂质,所述乳液包含约10%(按重量计)植物油和约1%
‑
2%(按重量计)磷脂。优选地,佐剂组合物进一步任选地包括乳液形式,其具有分散在连续水相中的油性颗粒,具有从约0.2%(按重量计)至约49%(按重量计)的量的形成乳液的多元醇、任选地最高15%(按重量计)的乳液形成量的可代谢油和任选地最高约5%(按重量计)的乳液稳定量的基于乙二醇醚的表面活性剂。已存在许多已尝试用作佐剂的物质,诸如革兰氏阴性细菌内毒素的脂质a部分和分枝杆菌的海藻糖二霉菌酸酯。磷脂溶血卵磷脂展现出佐剂活性(arnold等人,eur.j immunol.9:363
‑
366,1979)。一些合成表面活性剂展现出佐剂活性,包括二甲基双十八烷基溴化铵(dda)和某些线性聚氧丙烯聚氧乙烯(pop
‑
poe)嵌段聚合物(snippe等人,int.arch.allergy appl.immunol.65:390
‑
398,1981;和hunter等人,j.immunol.127:1244
‑
1250,1981)。
[0109]
术语“特异性”可以用于指这样的情况,其中特异性结合对的一个成员将不显示出与除其一种或多种特异性结合配偶体外的分子的任何显著结合。所述术语在例如抗原结合结构域对由许多抗原携带的特定表位具有特异性的情况下也是可适用的,在这种情况下,携带所述抗原结合结构域的特异性结合成员将能够与携带所述表位的各种抗原结合。
[0110]
术语“包括(comprise)”通常在包含(include)的意义上使用,也就是说,允许存在一种或多种特征或组分。
[0111]
术语“基本上由......组成”是指具有限定数目的残基的产物,特别是肽序列,其不与较大产物共价附接。在以上提及的本发明肽的情况下,本领域技术人员应理解,但是可以考虑对所述肽的n或c末端进行微小修饰,诸如对末端进行化学修饰以添加保护基团等,例如对c末端的酰胺化。
[0112]
术语“分离的”是指这样的状态,在所述状态下本发明的特异性结合成员或编码此类结合成员的核酸将是根据本发明的。成员和核酸将不含或基本上不含与它们天然缔合的材料,诸如在其天然环境或制备它们的环境(例如,细胞培养物)中与它们一起发现的其他多肽或核酸,其中此类制备是通过体外或体内实践的重组dna技术进行的。成员和核酸可以与稀释剂或佐剂一起配制并且仍然出于实践目的可以是分离的
‑
例如,所述成员如果用于包被微量滴定板以用于免疫测定,则将通常与明胶或其他载体混合,或者当用于诊断或疗法时,将与药学上可接受的载体或稀释剂混合。
[0113]
如本文所用,“pg”意指皮克,“ng”意指纳克,“ug”或“μg”意指微克,“mg”意指毫克,“ul”或“μl”意指微升,“ml”意指毫升,“l”意指升。
[0114]
术语“抗体”、“抗tgfβ3抗体”、“tgfβ3抗体”、“tgf
‑
β3抗体”、“人源化tgfβ3抗体”、“tgfb3抗体”和未具体列出的任何变体可以在本文中可互换使用,并且如在整个本技术和权利要求书中所用,是指包含单个或多个蛋白质的蛋白质材料,并且扩展为具有本文所述和图7、8、10、11、12和13中呈现的氨基酸序列数据以及本文和权利要求中阐述的活性概况
的那些蛋白质。本文提供的示例性的此类tgfβ3抗体包括如本文提供和表征的抗体1901
‑
1a、1901
‑
1b、1901
‑
1c和1901
‑
1d。本文提供的抗体扩展为具有本文所述和图7、8、10、11、12和13中呈现的氨基酸序列数据(包括cdr序列seq id no:1、34、35、28
‑
30以及4、5、6、31
‑
33,以及包括可变区重链序列seq id no:18和19和36和可变区轻链序列seq id no:22和23)以及本文和权利要求中阐述的活性概况的抗体或蛋白质,包括抗体片段。因此,同样考虑了展示出基本上等效或改变的活性的蛋白质。这些修饰可能是有意的,例如,诸如通过定点诱变获得的修饰,或者可以是偶然的,诸如在作为复合物或其命名的亚基的生产者的宿主中通过突变获得的那些。另外,术语“抗体”;“抗tgfβ3抗体”;“tgfβ3抗体”;“tgf
‑
β3抗体”;“人源化tgfβ3抗体”;以及示例性抗体1901
‑
1a、1901
‑
1b、1901
‑
1c和1901
‑
1d旨在在其范围内包括本文具体列举的蛋白质以及所有基本上同源的类似物和等位基因变异物。
[0115]
在本发明的一个方面,并且本文特别提供了对tgf
‑
β同种型tgf
‑
β3具有特异性的抗体。在一个特定的方面,本发明的抗体是人源化的,包括其中抗体已经修饰以增加其与人天然产生的抗体变体的相似性。此类特异性tgf
‑
β3抗体结合并且识别tgf
‑
β3同种型,并且不或不显著结合或识别替代tgf
‑
β同种型,特别是tgf
‑
β1和tgf
‑
β2。本发明的tgf
‑
β3特异性抗体例示为抗体1901
‑
1a、1901
‑
1b、1901
‑
1c和1901
‑
1d。
[0116]
本文所述的氨基酸残基优选呈“l”异构体形式。但是,可以用呈“d”异构体形式的残基取代任何l
‑
氨基酸残基,只要多肽保留了所希望的免疫球蛋白结合功能特性即可。nh2是指存在于多肽的氨基末端的游离氨基。cooh是指存在于多肽的羧基末端的游离羧基。与标准多肽命名法保持一致,j.biol.chem.,243:3552
‑
59(1969),以下对应表中示出了氨基酸残基的缩写:
[0117]
对应表
[0118][0119][0120]
应当注意,所有氨基酸残基序列在本文中均由其左和右取向在氨基末端至羧基末端的常规方向上的式表示。此外,应当注意,在氨基酸残基序列的开始或结束处的破折号指示连接到另外的一个或多个氨基酸残基的序列的肽键。呈现上表是为了关联可能在本文中交替出现的三字母和一字母记法。
[0121]“复制子”是在体内起自主dna复制单元功能(即,能够在其自身控制下复制)的任何基因元件(例如,质粒、染色体、病毒)。
[0122]“载体”是复制子,诸如质粒、噬菌体或粘粒,其上可以附接另一个dna区段以便引起所附接的区段的复制。
[0123]“dna分子”是指呈其单链形式或双链螺旋的脱氧核糖核苷酸(腺嘌呤、鸟嘌呤、胸
腺嘧啶或胞嘧啶)的聚合物形式。此术语仅指分子的一级结构和二级结构,并且不将其限于任何特定的三级形式。因此,此术语包括尤其在线性dna分子(例如,限制片段)、病毒、质粒和染色体中发现的双链dna。在讨论特定的双链dna分子的结构时,在本文中可以根据仅给出在5’至3’方向上沿着dna的非转录链(即,具有与mrna同源的序列的链)的序列的通常惯例来描述序列。
[0124]“复制的起点”是指参与dna合成的那些dna序列。
[0125]
dna“编码序列”是双链dna序列,所述双链dna序列当置于适当调节序列的控制下时在体内被转录并且翻译成多肽。编码序列的边界由在5’(氨基)末端的起始密码子和在3’(羧基)末端的翻译终止密码子来确定。编码序列可以包括但不限于原核序列、来自真核mrna的cdna、来自真核(例如,哺乳动物)dna的基因组dna序列、以及甚至合成dna序列。聚腺苷酸化信号和转录终止序列将通常位于编码序列的3’端。
[0126]
转录和翻译控制序列是dna调节序列,诸如启动子、增强子、聚腺苷酸化信号、终止子等,其提供了在宿主细胞中编码序列的表达。
[0127]“启动子序列”是dna调节区,其能够结合细胞中的rna聚合酶并且起始下游(3’方向)编码序列的转录。为了限定本发明的目的,启动子序列在其3’末端以转录起始位点为边界并且向上游(5’方向)延伸以包括在高于背景的可检测水平上起始转录所必需的最小数目的碱基或元件。在启动子序列中将发现转录起始位点(方便地通过用核酸酶s1作图来定义)以及负责结合rna聚合酶的蛋白质结合结构域(共有序列)。真核启动子将通常但不总是含有“tata”盒和“cat”盒。除
‑
10和
‑
35共有序列外,原核启动子还含有夏因
‑
达尔加诺(shine
‑
dalgarno)序列。
[0128]“表达控制序列”是控制和调节另一个dna序列的转录和翻译的dna序列。当rna聚合酶将编码序列转录成mrna时,编码序列处于细胞中转录和翻译控制序列的“控制下”,所述mrna然后被翻译成由编码序列编码的蛋白质。
[0129]
可以在编码序列之前包含“信号序列”。此序列编码位于多肽的n末端的信号肽,所述信号肽与宿主细胞通讯以将多肽引导到细胞表面或将多肽分泌到培养基中,并且此信号肽在蛋白质离开细胞之前被宿主细胞切除。可以发现信号序列与原核生物和真核生物的多种天然蛋白质相关。
[0130]
如本文中在提及本发明探针时所用的术语“寡核苷酸”被定义为由两个或更多个、优选多于三个核糖核苷酸构成的分子。其确切大小将取决于许多因素,所述因素进而取决于寡核苷酸的最终功能和用途。
[0131]
如本文所用的术语“引物”是指寡核苷酸(无论是如在纯化的限制性消化中天然存在的或合成产生的),所述寡核苷酸当置于诱导合成与核酸链互补的引物延伸产物的条件下(即,在核苷酸和诱导剂(诸如dna聚合酶)的存在下并且在合适的温度和ph下)时能够充当合成起始点。引物可以是单链的或双链的,并且必须足够长以在诱导剂的存在下引发所希望的延伸产物的合成。引物的确切长度将取决于许多因素,包括温度、引物来源和方法的使用。例如,对于诊断应用,取决于靶序列的复杂性,寡核苷酸引物典型地含有15
‑
25个或更多个核苷酸,尽管它可以含有更少核苷酸。
[0132]
本文的引物被选择为与特定靶dna序列的不同链“基本上”互补。这意味着引物必须是足够互补的以与其相应的链杂交。因此,引物序列不需要反映模板的确切序列。例如,
非互补核苷酸片段可以附接至引物的5’端,并且引物序列的其余部分与链互补。可替代地,非互补碱基或更长的序列可以散布在引物中,条件是引物序列与链的序列具有足够的互补性以与其杂交并且从而形成用于合成延伸产物的模板。
[0133]
如本文所用,术语“限制性内切核酸酶”和“限制性酶”是指细菌酶,所述细菌酶各自在特定核苷酸序列处或附近切割双链dna。
[0134]
当此类dna已被引入细胞内部时,所述细胞已被外源或异源dna“转化”。转化dna可以或可以不整合(共价连接)到构成细胞基因组的染色体dna中。例如,在原核生物、酵母和哺乳动物细胞中,转化dna可以保持在附加型元件(诸如质粒)上。对于真核细胞,稳定转化的细胞是这样的细胞,其中转化dna已经变为整合到染色体中,使得其通过子细胞经由染色体复制而遗传。真核细胞建立由含有转化dna的子细胞的群体构成的细胞系或克隆的能力证明了这种稳定性。“克隆”是通过有丝分裂源自单个细胞或共同祖先的细胞的群体。“细胞系”是能够在体外稳定生长许多代的原代细胞克隆。
[0135]
当至少约75%(优选至少约80%、并且最优选至少约90%或95%)的核苷酸在dna序列的限定长度上匹配时,两个dna序列是“基本上同源的”。通过使用序列数据库中可用的标准软件比较序列或在例如针对该特定系统限定的严格条件下的southern杂交实验中鉴定基本上同源的序列。限定适当的杂交条件在本领域技术范围内。
[0136]
应当理解,也在本发明范围内的是编码本发明特异性结合成员(抗体)的dna序列,所述dna序列编码例如具有如图10、11、12或13中提供的氨基酸序列或包含本文或图7、8、10、11、12或13中列出的cdr结构域区序列的抗体,但是与其简并的。“与......简并的(degenerate to)”意指使用不同的三字母密码子来指定特定的氨基酸。本领域众所周知,以下密码子可以互换使用,以编码每种特定的氨基酸:
[0137][0138][0139]
应当理解,以上指定的密码子是针对rna序列的。dna的对应密码子具有取代u的t。
[0140]
在编码图7、8、10、11、12和/或13中列出的氨基酸、抗体片段、cdr区序列(特别是cdr序列重链cdr seq id no:1、34、35、30、28、29和/或轻链cdr seq id no:4、5、6、33、31、32)的序列中可以进行突变,使得特定密码子变为编码不同氨基酸的密码子。通常通过进行可能的最少核苷酸改变来进行此类突变。可以进行这类取代突变,从而以非保守的方式(例如,通过将密码子从属于具有特定大小或特征的氨基酸的分组的氨基酸变为属于另一个分组的氨基酸)或以保守的方式(例如,通过将密码子从属于具有特定大小或特征的氨基酸的分组的氨基酸变为属于相同分组的氨基酸)改变所得蛋白质中的氨基酸。此类保守的改变通常导致所得蛋白质的结构和功能的较少改变。非保守变化更可能改变所得蛋白质的结构、活性或功能。本发明包括含有氨基酸改变和取代(包括保守改变)的序列,所述氨基酸改变和取代不显著改变所得蛋白质的活性或结合特征。
[0141]
以下是各种氨基酸分组的一个示例:
[0142]
具有非极性r基团的氨基酸
[0143]
丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、色氨酸、甲硫氨酸
[0144]
具有不带电荷的极性r基团的氨基酸
[0145]
甘氨酸、丝氨酸、苏氨酸、半胱氨酸、酪氨酸、天冬酰胺、谷氨酰胺
[0146]
具有带电荷的极性r基团的氨基酸(在ph 6.0下带负电荷)
[0147]
天冬氨酸、谷氨酸
[0148]
碱性氨基酸(在ph 6.0下带正电荷)
[0149]
赖氨酸、精氨酸、组氨酸(在ph 6.0下)
[0150]
另一个分组可以是具有苯基的那些氨基酸:
[0151]
苯丙氨酸、色氨酸、酪氨酸
[0152]
另一个分组可以根据分子量(即,r基团的大小):
[0153][0154][0155]
特别优选的取代是:
[0156]
‑
lys取代arg并且反之亦然,使得可以保持正电荷;
[0157]
‑
glu取代asp并且反之亦然,使得可以保持负电荷;
[0158]
‑
ser取代thr,使得可以保持游离的
‑
oh;以及
[0159]
‑
gln取代asn,使得可以保持游离的nh2。
[0160]
示例性和优选的保守氨基酸取代包括以下中的任意:
[0161]
谷氨酰胺(q)取代谷氨酸(e)并且反之亦然;亮氨酸(l)取代缬氨酸(v)并且反之亦然;丝氨酸(s)取代苏氨酸(t)并且反之亦然;异亮氨酸(i)取代缬氨酸(v)并且反之亦然;赖氨酸(k)取代谷氨酰胺(q)并且反之亦然;异亮氨酸(i)取代甲硫氨酸(m)并且反之亦然;丝氨酸(s)取代天冬酰胺(n)并且反之亦然;亮氨酸(l)取代甲硫氨酸(m)并且反之亦然;赖氨酸(l)取代谷氨酸(e)并且反之亦然;丙氨酸(a)取代丝氨酸(s)并且反之亦然;酪氨酸(y)取代苯丙氨酸(f)并且反之亦然;谷氨酸(e)取代天冬氨酸(d)并且反之亦然;亮氨酸(l)取代异亮氨酸(i)并且反之亦然;赖氨酸(k)取代精氨酸(r)并且反之亦然。
[0162]
还可以引入氨基酸取代以取代具有特别优选特性的氨基酸。例如,可以将cys引入
潜在位点以与另一个cys得到二硫桥。可以将his引入作为特别“催化的”位点(即,his可以充当酸或碱,并且是生化催化中最常见的氨基酸)。pro可能由于其特别平面的结构而被引入,所述结构诱导蛋白质结构中的β
‑
转角。
[0163]
当至少约70%的氨基酸残基(优选至少约80%、并且最优选至少约90%或95%或98%或99%)是相同的或表示保守的取代时,两个氨基酸序列是“高度同源的”或“基本上同源的”。当一个或多个或一个或几个、或一至三个、或一个或两个氨基酸被相似或保守的氨基酸取代进行取代时,两种抗体的cdr区是基本上同源的,并且其中一种抗体/多种抗体具有本文公开的抗体中的一种或多种,特别是抗体1901
‑
1a、1901
‑
1b、1901
‑
1c和/或1901
‑
1d中的一种或多种的结合和活性概况。抗体可以是基本上同源的,其中cdr结构域区中的一个、两个或三个氨基酸或者最高三个氨基酸,其中一个、两个、三个或四个或者最高四个氨基酸,被另一种氨基酸取代,并且其中抗体保留了抗体结合和活性概况。
[0164]
本文提供了示例性cdr结构域区氨基酸取代。因此,根据本发明,抗体cdr结构域序列、特别是1901鼠抗体cdr结构域序列已经被修饰,由此在本文的抗体中提供了其中的氨基酸取代和变体cdr结构域序列。根据本发明,包含来自鼠1901抗体的新的、变体的或改变的cdr结构域序列的本发明抗体显著地保留了tgfb
‑
3结合、特异性和中和作用,并且具有进一步改善的属性,包括具有与人天然产生的抗体变体具有增加的相似性的序列。因此,根据本发明,提供了tgf
‑
β3抗体,特别是tgf
‑
β3特异性抗体,其具有重链可变区,所述重链可变区包含cdr1序列sswih(seq id no:1)、cdr2序列riypgdgdtdysekfq(seq id no:34)和cdr3序列rmittqaaldy(seq id no:35)或arrmittqaal(seq id no:30);cdr1序列sswih(seq id no:1)、cdr2序列riypgdgdtdysekfq(seq id no:34)和cdr3序列rmittqaaldy(seq id no:35);或cdr1序列gytfssswih(seq id no:28)、cdr2序列wigriypgdgdtdysekfq(seq id no:29)和cdr3序列arrmittqaal(seq id no:30)。在进一步的方面,本发明的抗体可以包含轻链可变区序列,所述轻链可变区序列包含cdr1序列kasqsvinava(seq id no:4)、cdr2序列yasnryt(seq id no:5)和cdr3序列qqdysspy(seq id no:33);cdr1序列kasqsvinava(seq id no:4)、cdr2序列yasnryt(seq id no:5)和cdr3序列qqdysspy(seq id no:33)或qqdysspyt(seq id no:6);或cdr1序列kasqsvinavawy(seq id no:31)、cdr2序列lliyyasnryt(seq id no:32)和cdr3序列qqdysspy(seq id no:33)或qqdysspyt(seq id no:6)。
[0165]
在一个方面,提供了针对tgf
‑
β3的抗体,其包含重链可变区,所述重链可变区包含cdr,所述cdr包括cdr1序列sswih(seq id no:1)、cdr2序列riypgdgdtdysekfq(seq id no:34)和包含序列rmittqaal(seq id no:37)的cdr3序列。在一个这样的方面,所述抗体包含重链可变区,所述重链可变区包含cdr1序列sswih(seq id no:1)、cdr2序列riypgdgdtdysekfq(seq id no:34)、和包含rmittqaal(seq id no:37)的cdr3序列。在一个方面,所述抗体包含重链可变区,所述重链可变区包含cdr1序列sswih(seq id no:1)、cdr2序列riypgdgdtdysekfq(seq id no:34)、和cdr3序列rmittqaal(seq id no:37)。在进一步的方面,提供了抗体,所述抗体进一步包含轻链可变区cdr,所述轻链可变区cdr包括cdr1序列kasqsvinava(seq id no:4)、cdr2序列yasnryt(seq id no:5)和cdr3序列qqdysspy(seq id no:33)。在另进一步的方面,提供了抗体,所述抗体包含轻链可变区cdr,所述轻链可变区cdr包括cdr1序列kasqsvinava(seq id no:4)或kasqsvinavawy(seq id no:31)、cdr2序
列yasnryt(seq id no:5)或lliyyasnryt(seq id no:32)和cdr3序列qqdysspy(seq id no:33)或qqdysspyt(seq id no:6)。
[0166]
dna构建体的“异源”区是在较大dna分子内的可鉴定的dna区段,所述dna区段在自然界中未发现与所述较大分子缔合。因此,当异源区编码哺乳动物基因时,所述基因的侧翼通常将是在源生物体的基因组中不在哺乳动物基因组dna侧翼的dna。异源编码序列的另一个例子是其中编码序列本身在自然界中未发现的构建体(例如,其中基因组编码序列含有内含子的cdna,或具有不同于天然基因的密码子的合成序列)。等位基因变异或天然发生的突变事件不产生如本文所定义的dna的异源区。
[0167]
当表达控制序列控制和调节dna序列的转录和翻译时,所述dna序列“可操作地连接”至表达控制序列。术语“可操作地连接”包括在有待表达的dna序列前面具有适当的起始信号(例如,atg),并且保持正确的阅读框以允许在表达控制序列的控制下表达所述dna序列并且产生由所述dna序列编码的所希望的产物。如果人们希望插入重组dna分子中的基因不含适当的起始信号,则可以在所述基因的前面插入此类起始信号。
[0168]
术语“药剂”意指包括多肽、抗体、多核苷酸、化学化合物和小分子在内的任何分子。特别地,术语药剂包括诸如测试化合物或药物候选化合物的化合物。
[0169]
术语“激动剂”是指刺激受体配体在最广泛的意义上结合的配体。
[0170]
术语“测定(assay)”意指用于测量化合物的特定特性的任何方法。“筛选测定”意指用于从化合物集合中基于其活性来表征或选择化合物的方法。
[0171]
术语“预防(preventing)”或“预防(prevention)”是指降低受试者获得或发展疾病或障碍的风险(即,使疾病的至少一种临床症状不发展),所述受试者可能在疾病发作之前暴露于致病因子或易患所述疾病。
[0172]
术语“预防(prophylaxis)”与术语
‘
预防(prevention)’有关并且涵盖在术语
‘
预防(prevention)’中,并且是指以预防而非治疗或治愈疾病为目的的措施或程序。预防措施的非限制性例子可以包括施用疫苗;向例如由于固定而处于血栓形成风险中的住院患者施用低分子量肝素;以及在到访其中疟疾流行或招致疟疾的风险高的地理区域之前施用抗疟疾剂,诸如氯喹。
[0173]“治疗有效量”意指将引起医生或其他临床医师所寻求的受试者的生物反应或医学反应的药物、化合物、抗微生物剂、抗体或药物药剂的量。特别地,关于革兰氏阳性细菌感染和革兰氏阳性细菌的生长,术语“有效量”旨在包括化合物或药剂的有效量,其将引起生物学上有意义的肿瘤消退的量或程度的增加和或受试者的存活期或无病期或缓解期的长度的增加。本文所用的短语“治疗有效量”意指这样的量,其足以预防并且优选减少至少约30百分比、更优选至少50百分比、最优选至少90百分比,在肿瘤大小的生长或量方面临床上显著的改变,或存活期或无病期增强至少约30百分比、更优选至少50百分比、最优选至少90百分比。
[0174]
在一个实施方案中,任何疾病或感染的术语“治疗(treating)”或“治疗(treatment)”是指改善所述疾病或感染(即,阻止疾病或感染因子或细菌的生长或降低其至少一种临床症状的表现、程度或严重性)。在另一个实施方案中,“治疗(treating)”或“治疗(treatment)”是指改善受试者可能无法辨别的至少一种身体参数。在又另一个实施方案中,“治疗(treating)”或“治疗(treatment)”是指在身体上(例如,可辨别症状的稳定)、生
理上(例如,身体参数的稳定)或两者上调节疾病或感染。在一个其他实施方案中,“治疗(treating)”或“治疗(treatment)”涉及减慢疾病的进展或减少感染。
[0175]
如本文所用,术语“一种或多种纤维化病症”或“一种或多种纤维化疾病”是指并且包括以过度或持续的瘢痕形成(特别是由于细胞外基质的过度或异常产生、沉积)为特征的病症或疾病,并且是与细胞和/或纤连蛋白和/或胶原的异常积累和/或成纤维细胞募集的增加相关的病症或疾病,并且包括但不限于单独器官或组织(诸如心脏、肾、肝、关节、肺、胸膜组织、腹膜组织、皮肤、角膜、视网膜、肌肉骨骼和消化道)的纤维化。在特定方面,术语纤维化疾病是指特发性肺纤维化(ipf)、囊性纤维化、不同病因的其他弥散性实质性肺疾病(包括医源性药物诱导的纤维化、职业和/或环境诱导的纤维化)、肉芽肿性疾病(结节病、超敏性肺炎)、胶原血管疾病、肺泡蛋白沉着症、朗格汉斯细胞肉芽肿病(langerhans cell granulomatosis)、淋巴管平滑肌瘤病、遗传性疾病(赫尔曼斯基
‑
普德拉克(hermansky
‑
pudlak)综合征、结节性硬化症、神经纤维瘤病、代谢贮积障碍、家族性间质性肺病)、放射诱导的纤维化、慢性阻塞性肺病(copd)、硬皮病、博来霉素诱导的肺纤维化、慢性哮喘、矽肺、石棉诱导的肺纤维化、急性呼吸窘迫综合征(ards)、肾纤维化、肾小管间质纤维化、肾小球肾炎、局灶节段性肾小球硬化、iga肾病、高血压、奥尔波特(alport)综合征、肠道纤维化、肝纤维化、肝硬化、酒精诱导的肝纤维化、毒性/药物诱导的肝纤维化、血色素沉着症、非酒精性脂肪性肝炎(nash)、胆道损伤、原发性胆汁性肝硬化、感染诱导的肝纤维化、病毒诱导的肝纤维化、自身免疫性肝炎、角膜瘢痕形成、肥厚性瘢痕形成、掌腱膜孪缩症(dupuytren disease)、瘢痕瘤、皮肤纤维化、皮肤硬皮病、系统性硬化症、脊髓损伤/纤维化、骨髓纤维化、血管再狭窄、动脉粥样硬化、动脉硬化、韦格纳氏肉芽肿病(wegener's granulomatosis)和佩罗尼氏病(peyronie’s disease)。
[0176]
短语“药学上可接受的”是指当施用于人时是生理上可耐受的并且典型地不产生过敏反应或相似的不良反应(诸如胃不适、晕眩等)的分子实体和组合物。
[0177]
如本文所用,“pg”意指皮克,“ng”意指纳克,“ug”或“μg”意指微克,“mg”意指毫克,“ul”或“μl”意指微升,“ml”意指毫升,“l”意指升。
[0178]
b.详细公开内容。
[0179]
本发明提供了用于诊断和治疗性目的的针对转化生长因子β3(tgf
‑
β3)的抗体。特别地,提供了对tgf
‑
β3具有特异性的抗体,其中所述抗体识别并且能够结合人和小鼠tgf
‑
β3,并且不识别或结合其他tgfβ形式,特别地所述抗体不识别或结合tgf
‑
β1或tgf
‑
β2。特别地,本发明的抗体是人源化的,并且是经修饰的或包含氨基酸取代以增加其人天然产生的抗体变体的相似性,而保留或增强其tgf
‑
β3特异性和中和作用,包括以增强其在人体中和用于人类疾病和病症的适合性、可接受性和有效性。本文特别提供了示例性的此类tgf
‑
β3抗体。示例性抗体包括抗体1901
‑
1a、1901
‑
1b、1901
‑
1c和1901
‑
1d。示例性抗体包括包含重链序列seq id no:18或seq id no:19或seq id no:36的抗体。示例性抗体包括包含重链序列seq id no:18或seq id no:19的抗体。本发明特别提供了抗体或其活性片段,其识别和中和tgf
‑
β3,特别是其中所述抗体或活性片段不识别或中和tgf
‑
β1或tgf
‑
β2。
[0180]
在总体的方面,本发明提供了针对人和小鼠tgf
‑
β3的tgf
‑
β3抗体,其中和tgf
‑
β3活性。在一个方面,此类抗体包含重链可变区,所述重链可变区包含cdr1序列sswih(seq id no:1)、cdr2序列riypgdgdtdysekfq(seq id no:34)和cdr3序列rmittqaaldy(seq id no:
35)或arrmittqaal(seq id no:30);cdr1序列sswih(seq id no:1)、cdr2序列riypgdgdtdysekfq(seq id no:34)和cdr3序列rmittqaaldy(seq id no:35);或cdr1序列gytfssswih(seq id no:28)、cdr2序列wigriypgdgdtdysekfq(seq id no:29)和cdr3序列arrmittqaal(seq id no:30)。在进一步的方面,本发明的抗体可以包含轻链可变区序列,所述轻链可变区序列包含cdr1序列kasqsvinava(seq id no:4)、cdr2序列yasnryt(seq id no:5)和cdr3序列qqdysspy(seq id no:33);cdr1序列kasqsvinava(seq id no:4)、cdr2序列yasnryt(seq id no:5)和cdr3序列qqdysspy(seq id no:33)或qqdysspyt(seq id no:6);或cdr1序列kasqsvinavawy(seq id no:31)、cdr2序列lliyyasnryt(seq id no:32)和cdr3序列qqdysspy(seq id no:33)或qqdysspyt(seq id no:6)。在一个这样的方面,本发明提供了tgf
‑
β3抗体,其包含重链序列seq id no:18或seq id no:19或seq id no:36。在一个这样的方面,本发明提供了tgf
‑
β3抗体,其包含重链序列seq id no:18或seq id no:19。提供了示例性抗体,包括抗体1901
‑
1a、1901
‑
1b、1901
‑
1c和1901
‑
1d。本发明提供了针对人和小鼠tgf
‑
β3的tgf
‑
β3抗体,其不与tgf
‑
β1和/或tgf
‑
β3交叉反应或结合并且特异性中和tgf
‑
β3活性。在一个特定的方面,本发明的抗体阻断tgf
‑
β3介导的信号传导和/或tgf
‑
β3介导的细胞反应或细胞增殖。在一个特定的方面,本发明提供了抗tgf
‑
β3特异性抗体1901
‑
1a、1901
‑
1b、1901
‑
1c和1901
‑
1d。在一个其他特定方面,本发明提供了能够特异性结合和中和tgf
‑
β3的tgf
‑
β3特异性抗体,其包含如seq id no:18或19或36以及图10、11、12或13中列出的重链氨基酸序列。
[0181]
在另一个方面,本发明提供了针对tgf
‑
β3的抗体,所述抗体包含重链可变区序列和轻链可变区,所述重链可变区序列包含cdr1序列sswih(seq id no:1)、cdr2序列riypgdgdtdysekfq(seq id no:34)和cdr3序列rmittqaaldy(seq id no:35)或cdr1序列gytfssswih(seq id no:28)、cdr2序列wigriypgdgdtdysekfq(seq id no:29)和cdr3序列arrmittqaal(seq id no:30),所述轻链可变区包含cdr1序列kasqsvinava(seq id no:4)、cdr2序列yasnryt(seq id no:5)和cdr3序列qqdysspy(seq id no:33)或qqdysspyt(seq id no:6);或cdr1序列kasqsvinavawy(seq id no:31)、cdr2序列lliyyasnryt(seq id no:32)和cdr3序列qqdysspy(seq id no:33)或qqdysspyt(seq id no:6)。
[0182]
在一个方面,本发明提供了针对tgf
‑
β3的抗体,所述抗体包含重链可变区,所述重链可变区包含cdr,所述cdr包括cdr1序列sswih(seq id no:1)、cdr2序列riypgdgdtdysekfq(seq id no:34)、和包含序列rmittqaal(seq id no:37)的cdr3序列。在一个这样的方面,所述抗体包含重链可变区,所述重链可变区包含cdr1序列sswih(seq id no:1)、cdr2序列riypgdgdtdysekfq(seq id no:34)、和包含rmittqaal(seq id no:37)的cdr3序列。在一个方面,所述抗体包含重链可变区,所述重链可变区包含cdr1序列sswih(seq id no:1)、cdr2序列riypgdgdtdysekfq(seq id no:34)、和cdr3序列rmittqaal(seq id no:37)。在进一步的方面,提供了抗体,所述抗体进一步包含轻链可变区cdr,所述轻链可变区cdr包括cdr1序列kasqsvinava(seq id no:4)、cdr2序列yasnryt(seq id no:5)和cdr3序列qqdysspy(seq id no:33)。在另进一步的方面,提供了抗体,所述抗体包含轻链可变区cdr,所述轻链可变区cdr包括cdr1序列kasqsvinava(seq id no:4)或kasqsvinavawy(seq id no:31)、cdr2序列yasnryt(seq id no:5)或lliyyasnryt(seq id no:32)和cdr3序列qqdysspy(seq id no:33)或qqdysspyt(seq id no:6)。
[0183]
在本发明的另一个方面,本文提供了一种或多种抗体或其一种或多种片段,其结合至与本文所述的一种或多种抗体相同的tgf
‑
β3(诸如特别是人tgf
‑
β3)的表位。在另一个实施方案中,本文提供了一种或多种抗体或其一种或多种抗原结合片段,其与本文所述的抗体或其抗原结合片段竞争结合至tgf
‑
β3(例如,人tgf
‑
β3)。在一个具体的实施方案中,本文提供了一种或多种抗体或其一种或多种抗原结合片段,其与本文所述的抗体或其抗原结合片段竞争结合至tgf
‑
β3(例如,人tgf
‑
β3),其程度为本文所述的抗体或其抗原结合片段自身竞争结合至tgf
‑
β3(例如,人tgf
‑
β3)。
[0184]
本发明的抗体和片段的独特特异性和亲和力提供了鉴定、表征和靶向与tgf
‑
β3表达、活性或激活相关的病症的诊断和治疗性用途。特别地,靶向tgf
‑
β3的本发明抗体可用于调节免疫反应。在其一个方面,靶向tgf
‑
β3的本发明抗体可用于调节针对癌症、癌症细胞或肿瘤细胞以及癌症抗原或肿瘤抗原的免疫反应。所述抗体可应用于治疗性治疗或管理癌症。所述抗体可应用于增强抗癌免疫反应以及增强癌症疫苗。所述抗体可应用于增强一种或多种放射疗法的治疗作用,包括抗癌和/或抗细胞作用。在一个特定的方面,本发明的抗体可应用于治疗、管理和/或预防癌症,包括癌症的复发和转移。可适用的病症包括感染性疾病、癌症、宿主免疫反应(包括在移植中的)和免疫疾病或障碍(诸如自身免疫性疾病或炎性病症)。可适用的癌症包括肾上腺皮质癌、aids相关癌症、aids相关淋巴瘤、肛门癌、肛门直肠癌、肛管癌、阑尾癌、儿童小脑星形细胞瘤、基底细胞癌、皮肤癌(非黑素瘤)、胆道癌、肝外胆管癌、肝内胆管癌、膀胱癌、尿膀胱癌、骨和关节癌、骨肉瘤和恶性纤维组织细胞瘤、脑癌、脑瘤、脑干胶质瘤、小脑星形细胞瘤、脑星形细胞瘤/恶性胶质瘤、室管膜瘤、成神经管细胞瘤、幕上原始神经外胚层肿瘤、视觉通路和下丘脑胶质瘤、乳腺癌、支气管腺瘤/类癌、类癌瘤、胃肠癌、神经系统癌症、神经系统淋巴瘤、中枢神经系统癌症、中枢神经系统淋巴瘤、宫颈癌、儿童期癌症、慢性淋巴细胞性白血病、慢性髓细胞性白血病、慢性骨髓增殖性障碍、结肠癌、结直肠癌、皮肤t细胞淋巴瘤、淋巴样赘生物、蕈样真菌病(mycosis fungoides)、塞扎里(seziary)综合征、子宫内膜癌、食道癌、颅外生殖细胞瘤、性腺外生殖细胞瘤、肝外胆管癌、眼癌、眼内黑素瘤、成视网膜细胞瘤、胆囊癌、胃癌(gastric cancer)(胃癌(stomach cancer))、胃肠道类癌肿瘤、胃肠道间质瘤(gist)、生殖细胞瘤、卵巢生殖细胞瘤、妊娠滋养细胞肿瘤胶质瘤、头颈癌、肝细胞(肝)癌、霍奇金淋巴瘤(hodgkin lymphoma)、下咽癌、眼内黑素瘤、眼部癌症、胰岛细胞瘤(内分泌胰腺)、卡波西肉瘤(kaposi sarcoma)、肾癌(kidney cancer)、肾脏癌(renal cancer)、喉癌、急性淋巴细胞性白血病、急性骨髓性白血病、慢性淋巴细胞性白血病、慢性骨髓性白血病、毛细胞白血病、唇和口腔癌、肝癌、肺癌、非小细胞肺癌、小细胞肺癌、aids相关淋巴瘤、非霍奇金淋巴瘤、原发性中枢神经系统淋巴瘤、瓦尔登斯特伦(waldenstram)巨球蛋白血症、成神经管细胞瘤、黑素瘤、眼内(眼)黑素瘤、梅克尔(merkel)细胞癌、恶性间皮瘤、间皮瘤、转移性鳞状颈癌、口癌、舌癌、多发性内分泌瘤形成综合征、蕈样真菌病、骨髓增生异常综合征、骨髓增生异常/骨髓增殖性疾病、慢性骨髓性白血病、急性骨髓性白血病、多发性骨髓瘤、慢性骨髓增殖性障碍、鼻咽癌、成神经细胞瘤、口腔癌(oral cancer)、口腔癌(oral cavity cancer)、口咽癌、卵巢癌、卵巢上皮癌、卵巢低度恶性潜能肿瘤、胰腺癌、胰岛细胞胰腺癌、鼻旁窦和鼻腔癌、甲状旁腺癌、阴茎癌、咽癌、嗜铬细胞瘤、成松果体细胞瘤和幕上原始神经外胚层肿瘤、垂体瘤、浆细胞赘生物/多发性骨髓瘤、胸膜肺胚细胞瘤、前列腺癌、直肠癌、肾盂和输尿管、移行细胞癌、成视网膜细胞瘤、横
纹肌肉瘤、唾液腺癌、尤文氏家族肉瘤肿瘤、卡波西肉瘤、软组织肉瘤、子宫癌、子宫肉瘤、皮肤癌(非黑素瘤)、皮肤癌(黑素瘤)、梅克尔细胞皮肤癌、小肠癌、软组织肉瘤、鳞状细胞癌、胃癌(stomach cancer)(胃癌(gastric cancer))、幕上原始神经外胚层肿瘤、睾丸癌、喉癌、胸腺瘤、胸腺瘤和胸腺癌、甲状腺癌、肾盂和输尿管以及其他泌尿器官的移行细胞癌、妊娠滋养细胞肿瘤、尿道癌、子宫内膜子宫癌、子宫肉瘤、子宫体癌、阴道癌、外阴癌、和威尔姆氏肿瘤(wilm's tumor)。在一个方面,可适用的癌症包括或选自乳腺癌、黑素瘤、前列腺癌和肺癌。在一个方面,本发明的tgf
‑
β3抗体可应用于治疗或调节乳腺癌、黑素瘤、前列腺癌或肺癌。
[0185]
肿瘤细胞和髓源性抑制细胞产生tgfβ以及在肿瘤部位的tgfβ免疫抑制活性的证据支持,阻断tgfβ、特别是特异性阻断tgf
‑
β3可以增强抗原摄取、呈递、和抗肿瘤免疫反应的激活,包括其中抗肿瘤反应是由癌症抗原或其他抗原指导的t细胞介导的和/或由治疗性疫苗介导的。在本发明的一个方面,一种或多种tgf
‑
β3抗体,特别是一种或多种tgf
‑
β3中和抗体可以与一种或多种癌症抗原和一种或多种佐剂的组合物结合或在其中施用,包括施用于患者以促进更稳健地启动和激活适应性抗肿瘤反应以增强针对癌症的免疫疗法。另外的针对tgfβ活性的抑制剂,诸如小分子、反义或适体,也可以用于抑制tgfβ活性,包括或特别是tgf
‑
β3。
[0186]
有效力的抗肿瘤免疫需要调节多个臂的宿主免疫反应并且靶向有助于肿瘤细胞生长和存活的通路。调节免疫反应并且阻止肿瘤生长和进展的组合药剂可以产生抗癌免疫并且阻止肿瘤生长以改善临床结局(vanneman,m(2012)nature reviews cancer(12):237
‑
251)。因此,在本发明的一方面,所述一种或多种抗tgf
‑
β3抗体可以单独地施用或与其他治疗、疗法或药剂组合施用,同时或顺序地施用,取决于有待治疗的病症。免疫调节剂可以包含在具有一种或多种tgf
‑
β3抗体的组合物中或与一种或多种tgf
‑
β3抗体一起施用和/或在不同时间施用以增强免疫调节和/或癌症疗法,包括针对癌症的免疫疗法。免疫调节剂可以是佐剂。可适用的免疫调节剂包括ido、tdo(platten m(2012)cancer research 72(21):5435
‑
40)、α
‑
半乳糖基神经酰胺及其类似物(诸如苏糖醇神经酰胺(thrcer)和thrcer 6)、tlr配体(诸如聚i:c(tlr3)、mpl(tlr4)、咪喹莫特(tlr7)、r848(tlr8)或cpg(tlr9))、icos、ctla
‑
4、pd1、pd1配体、ox40和ox40配体、lag3、gitr、gitr配体白介素、肿瘤坏死因子(tnf)、或刺激免疫反应或者癌细胞或肿瘤的减少或消除的其他生长因子、集落刺激因子、t细胞调节剂(包括cd8
t细胞调节剂)、细胞因子或激素(mellman i(2011)nature(480):480
‑
489)。另外的免疫调节剂是小分子、拮抗剂抗体或激动剂抗体,其靶向可适用的免疫调节剂,包括ido、tdo、toll样受体家族或icos、ctla
‑
4、pd1、pd1配体、ox40和ox40配体、白介素、肿瘤坏死因子(tnf)、或刺激免疫反应或者癌细胞或肿瘤的减少或消除的其他生长因子、集落刺激因子、t细胞调节剂(包括cd8
t细胞调节剂)、细胞因子。
[0187]
另外的免疫调节剂(包括tlr配体(诸如聚i:c(tlr3)、mpl(tlr4)、咪喹莫特(imiquimod)(tlr7)、r848(tlr8)或cpg(tlr9)))可以与tgf
‑
β3特异性中和抗体组合使用以产生增强的免疫刺激以及产生保护免受其中希望免疫系统有效反应的病症(诸如感染性疾病或癌症)。
[0188]
一种或多种tgf
‑
β3特异性抗体还可以用作一种或多种免疫刺激剂或一种或多种佐剂,与诸如但不限于蛋白质、肽或核酸等抗原材料组合使用,以便产生保护性免疫反应,
诸如针对所施用的抗原的b细胞和igg抗体反应。一种或多种tgf
‑
β3特异性抗体还可以用作一种或多种免疫刺激剂或一种或多种佐剂,与诸如但不限于蛋白质、肽或核酸等抗原材料组合使用,以便产生保护性免疫反应,诸如针对所施用的抗原的t细胞或ctl反应。
[0189]
此类抗原材料可以是并且可以包括适用于预防或治疗一种/所述特定疾病的任何材料。具体地,关于癌症,可以施用以诱导或增强免疫反应的肿瘤相关肽和蛋白质抗原的例子源自肿瘤相关基因和编码的蛋白质,包括mage
‑
a1、mage
‑
a2、mage
‑
a3、mage
‑
a4、mage
‑
a5、mage
‑
a6、mage
‑
a7、mage
‑
a8、mage
‑
a9、mage
‑
a10、mage
‑
a11、mage
‑
a12、mage
‑
a13、gage
‑
1、gage
‑
2、gage
‑
3、gage
‑
4、gage
‑
5、gage
‑
6、gage
‑
7、gage
‑
8、bage
‑
1、rage
‑
1、lb33/mum
‑
1、prame、nag、mage
‑
xp2(mage
‑
b2)、mage
‑
xp3(mage
‑
b3)、mage
‑
xp4(mage
‑
b4)、酪氨酸酶、酪氨酸酶、黑色素
‑
a(melan
‑
a)、mage
‑
c1、mage
‑
c2、ny
‑
eso
‑
1、lage
‑
1、ssx
‑
1、ssx
‑
2(hom
‑
mel
‑
40)、ssx
‑
1、ssx
‑
4、ssx
‑
5、scp
‑
1和ct
‑
7。例如,肿瘤特征性的抗原肽包括在公开的pct申请wo 00/20581(pct/us99/21230)中列出的那些。
[0190]
将从用抗tgf
‑
β3抗体的治疗中受益的其他tgf
‑
β相关的,特别是tgf
‑
β3相关的障碍、疾病或病症包括以细胞外基质积累为特征的疾病、由在局部位点激活的tgf
‑
β3或tgf
‑
β3的循环引起的疾病、由因内源性tgf
‑
β3产生导致的免疫系统抑制而引起的病症、由严重损伤、烧伤和诸如病毒或细菌感染的病患导致的急性免疫缺陷、由于tgf
‑
β3产生或过度产生引起的多器官系统性病患、以及产生tgf
‑
β3的肿瘤。非限制性的具体例子包括神经元、胶质、星形细胞、下丘脑和其他腺体、巨噬细胞、上皮、基质和囊胚腔障碍;纤维化;瘢痕形成;诸如由放射引起的组织损害;和在伤口愈合期间的粘附;纤维化皮肤障碍(诸如硬皮病);cns病理瘢痕组织;真皮瘢痕;瘢痕瘤瘢痕形成;和神经瘢痕形成;腹膜腔、肺、肝和肾的纤维化疾病,诸如慢性肝纤维化、急性肝损伤、间质性肺和肾纤维化、和肝硬化;囊性纤维化;血管障碍,例如心肌纤维化;动脉损伤,诸如动脉粥样硬化和动脉硬化;血管病;血管病变;肾病;系统性硬化症;感染,诸如巨噬细胞病原体感染和病毒感染(诸如丙型肝炎和hiv);免疫学障碍、血管生成障碍和炎性障碍和缺陷(诸如类风湿性关节炎);眼部障碍,尤其是涉及眼部纤维化的那些,包括增殖性视网膜病变、视网膜脱离、和青光眼引流手术后的(诸如人眼的神经视网膜、视网膜色素上皮
‑
脉络膜和玻璃体)、和白内障;骨质疏松症;成人呼吸窘迫综合征;心肌梗塞后、血管成形术后再狭窄;肾小球肾炎;糖尿病相关病症,诸如高血糖症、糖尿病、糖尿病性肾疾病、糖尿病性肾病、糖尿病神经病或视网膜病;和巨噬细胞缺陷疾病。
[0191]
在另一个具体的实施方案中,本文提供了第一抗体或其抗原结合片段,其与本文所述的抗体或其抗原结合片段竞争结合至tgf
‑
β3(例如,人tgf
‑
β3),其中所述第一抗体或其抗原结合片段在测定中竞争结合,所述测定包括以下步骤:(a)将tgf
‑
β3包被的elisa板与用呈未标记形式的第一抗体或其抗原结合片段一起孵育;(b)将本文所述的标记的抗体或其抗原结合片段添加到tgf
‑
β3包被的elisa板中,并且孵育tgf
‑
β3包被的elisa板;以及(c)检测本文所述的抗体或其抗原结合片段与tgf
‑
β3的结合。在一个方面,在与第一抗体或其抗原结合片段一起孵育后检测抗体1901
‑
1a或其抗原结合片段、抗体1901
‑
1b或其抗原结合片段、抗体1901
‑
1c或其抗原结合片段、或抗体1901
‑
1d或其抗原结合片段的结合。在一个方面,在与第一抗体或其抗原结合片段一起孵育后检测包含重链可变区序列seq id no:18或seq id no:19或seq id no:36的抗体或其抗原结合片段的结合。在一个方面,本文提供了第一抗体或其抗原结合片段,其与本文所述的抗体或其抗原结合片段竞争结合至tgf
‑
β3
(例如,人tgf
‑
β3),其中所述第一抗体或其抗原结合片段在测定中竞争结合,所述测定包括以下步骤:(a)将tgf
‑
β3包被的elisa板与用呈未标记形式的第一抗体或其抗原结合片段一起孵育;(b)将本文所述的生物素化的抗体或其抗原结合片段添加到tgf
‑
β3包被的elisa板中,并且孵育tgf
‑
β3包被的elisa板;以及(c)检测本文所述的抗体或其抗原结合片段与tgf
‑
β3的结合。在此一个方面,标记的或生物素化的抗体或其抗原结合片段选自抗体1901
‑
1a或其抗原结合片段、抗体1901
‑
1b或其抗原结合片段、抗体1901
‑
1c或其抗原结合片段、或抗体1901
‑
1d或其抗原结合片段。在一个方面,在呈未标记形式的第一抗体或其抗原结合片段的存在下,1901
‑
1a、1901
‑
1b、1901
‑
1c或1901
‑
1d中的一种或多种抗体或抗原结合片段的结合减少,特别是显著减少。
[0192]
在另一个具体的实施方案中,本文提供了第一抗体或其抗原结合片段,其与本文所述的抗体或其抗原结合片段竞争结合至tgf
‑
β3(例如,人tgf
‑
β3),其中竞争展现为第一抗体或其抗原结合片段与tgf
‑
β3(例如,人tgf
‑
β3)的结合减少了多于60%(例如,65%、70%、75%、85%、90%、95%、或98%,或在60%至65%、65%至70%、70%至75%、75%至80%、80%至85%、85%至95%、或95%至100%之间)。在另一个具体的实施方案中,本文提供了第一抗体或其抗原结合片段,其与本文所述的抗体或其抗原结合片段竞争结合至tgf
‑
β3(例如,人tgf
‑
β3),其中竞争展现为在第一抗体或其抗原结合片段的存在下和/或在第一抗体或其抗原结合片段的结合之后,1901
‑
1a、1901
‑
1b、1901
‑
1c或1901
‑
1d中的一种或多种抗体或抗原结合片段的结合减少了多于60%(例如,65%、70%、75%、85%、90%、95%、或98%,或在60%至65%、65%至70%、70%至75%、75%至80%、80%至85%、85%至95%、或95%至100%之间)。
[0193]
在具体的方面,本文提供了抗体,所述抗体与包含(i)包含具有图10、11、12或13中提供的抗体的vl cdr的氨基酸序列的vl cdr1、vl cdr2和vl cdr3的vl结构域;和(ii)包含具有图10、11、12或13中提供的抗体的cdr的氨基酸序列的vh cdr1、vh cdr2和vh cdr3的vh结构域的抗体竞争(例如,以剂量依赖性方式)特异性结合至tgf
‑
β3(例如,人tgf
‑
β3)。
[0194]
在一个特定的实施方案中,本文提供了抗体,所述抗体与包含抗体1901
‑
1a、1901
‑
1b、1901
‑
1c或1901
‑
1d的vh cdr的抗体竞争(例如,以剂量依赖性方式)特异性结合至tgf
‑
β3(例如,人tgf
‑
β3)。在一个特定的实施方案中,本文提供了抗体,其与包含抗体1901
‑
1a、1901
‑
1b、1901
‑
1c或1901
‑
1d的vh和vl cdr的抗体竞争特异性结合至tgf
‑
β3(例如,人tgf
‑
β3)。
[0195]
在具体的方面,本文提供了抗体或其抗原结合片段,其免疫特异性结合至与包含本文所述的氨基酸序列(参见例如,图7、8、10、11、12、13)的抗体(例如,1901
‑
1a、1901
‑
1b、1901
‑
1c或1901
‑
1d)的特异性结合至tgf
‑
β3(例如,人tgf
‑
β3)的表位相同的表位。本领域技术人员已知的或本文所述的测定(例如,x射线晶体学、elisa测定等)可以用于确定两种抗体是否结合至相同的表位。
[0196]
可以针对各种特性(即同种型、表位、亲和力等)筛选识别人和鼠tgf
‑
β3的单克隆抗体的小组。特别感兴趣的是这样的抗体,所述抗体模仿示例性抗体1901
‑
1a、1901
‑
1b、1901
‑
1c或1901
‑
1d的活性,并且对人和小鼠tgf
‑
β3具有亲和力,不与tgf
‑
β1或tgf
‑
β2反应,并且直接影响tgf
‑
β3的活性,特别是中和tgf
‑
β3。
[0197]
本发明的单克隆抗体可以包含重链可变区,诸如seq id no:18或seq id no:19中
例示的,以及任选地轻链可变区。通常,包含基本上如图7和8的变体cdr区列出的氨基酸序列的cdr区,特别是seq id no:1、34、35、30、28、29的重链cdr,任选地具有轻链cdr seq id no:4、5、33、6、31、32,将被携带在结构中,所述结构允许所述cdr区与tgf
‑
β3并且特别是与人和小鼠tgf
‑
β3的结合。
[0198]“基本上如......列出的”意指本发明的可变区序列和/或特别是cdr序列将是与图7、8、10、11、12和/或13的指定区域相同的或高度同源的。“高度同源的”考虑了在可变区序列中和/或在cdr序列中仅可以进行很少取代,优选从1至8、优选从1至5、优选从1至4、或从1至3、或1或2个取代。术语基本上如......列出的包括特别保守的氨基酸取代,其不会实质性或显著地影响本发明抗体的特异性和/或活性。对于可变区序列以及还有对于cdr区序列,本文考虑了保守和非保守氨基酸取代。
[0199]
可以在cdr外部的可变区序列中进行取代以保留cdr序列。因此,可以引入或使用可变区序列或替代的非同源或镶饰的可变区序列中的变化,使得保持cdr序列并且可变区序列的其余部分可以被取代。
[0200]
可替代地,可以特别地在cdr中进行取代。用于本发明的抗体,特别是抗体1901
‑
1a、1901
‑
1b、1901
‑
1c和1901
‑
1d的示例性cdr序列是本文中(包括在图10、11、12和13中以及在seq id no:1、34、35、28、29、30、4、5、6、31、32和33中)列出和描述的。示例性cdr序列包括cdr序列中的取代,特别是其中鼠1901抗体的cdr区氨基酸已被改变或取代。选择具有如上所述和考虑的取代的本发明抗体以保持与示例性抗体(包括抗体1901
‑
1a、1901
‑
1b、1901
‑
1c和/或1901
‑
1d)相称的活性和特异性并且具有如本文和权利要求中列出的特征。
[0201]
存在若干种公认且已知的确定抗体中的cdr的方法和方式。目前最常用的cdr鉴定方法是kabat(wu tt,kabat ea(1970)j exp med 132:211
‑
250;kabat ea等人(1983)sequence of proteins of immunological interest.bethesda:national institute of health)、imgt(lefranc mp等人(2003)dev comp immunol 27:55
‑
77)和chothia(chothia c,lesk am(1987)j mol biol 196:901
‑
917;chothia c等人(1989)nature 342:877
‑
883;lefranc mp等人(2003)dev comp immunol 27:55
‑
77)。这些方法中的每一种都设计了独特的残基编号方案,根据所述编号方案其对高变区残基进行编号,并且然后根据某些关键位置确定六个cdr中的每一个的开始和结束。本发明研究中一般使用imgt。尽管这些不同的方式可以鉴定出略有偏移的cdr序列,但它们总体上提供重叠的序列和氨基酸,并且可以组合用于鉴定应保持或保守的氨基酸以及在保持结合的同时可能适用于变异或改变的氨基酸。
[0202]
免疫球蛋白可变结构域的实质部分将包含至少三个cdr区连同其间的框架区。优选地,所述部分还将包含至少约50%的第一框架区和第四框架区中的一者或两者,所述50%是c末端50%的第一框架区和n末端50%的第四框架区。在可变结构域的实质部分的n末端或c末端的另外残基可以是通常与天然存在的可变结构域区不相关的那些。例如,通过重组dna技术制造的本发明特异性结合成员的构建可以导致引入由为促进克隆或其他操纵步骤而引入的接头编码的n末端或c末端残基。其他操纵步骤包括引入接头以将本发明的可变结构域连接至如本文所提供和/或本领域技术人员已知的其他蛋白质序列,包括免疫球蛋白重链、其他可变结构域(例如,在双抗体的生产中)或蛋白质标记。
[0203]
尽管在本发明的一个优选方面,包含基于图7、8、10、11、12或13中基本上列出的序列的一对结合结构域的特异性结合成员是优选的,但基于这些序列的、特别是基于重链和
轻链cdr的单结合结构域形成本发明的其他方面。在基于图7、8、10、11、12或13中基本上列出的序列的结合结构域的情况下,此类结合结构域可以用作针对tgf
‑
β3的靶向剂,因为已知免疫球蛋白vh结构域能够以特异性方式结合靶抗原。
[0204]
考虑并且掺入了本发明抗体的部分或结构域,包括任何部分或结构域,包括修饰的或与试剂、标记或其他结构域或片段融合的那些,其中所述部分或结构域保留了在此的抗体的特征,包括tgf
‑
β3特异性结合,并且任选地包括tgf
‑
β3特异性中和作用,如本文的抗体1901
‑
1a、1901
‑
1b、1901
‑
1c和1901
‑
1d所例示的。本发明的抗体和抗体片段包括较小重组抗体片段(例如,经典单价抗体片段(fab、scfv)和经工程改造的变体(双抗体、三抗体、微抗体和单结构域抗体),其保留了整个抗体(mab)的靶向特异性(关于综述,参见hollinger p和hudson pj(2005)nature biotech 23(9):1126
‑
1136)。它们包括例如结构域抗体(dab)片段,其包含单可变结构域(ward,e.s.等人,nature 341,544
‑
546(1989));骆驼抗体;分离的互补决定区(cdr);单链fv片段,其中vh结构域和vl结构域通过肽接头连接,所述肽接头允许这两个结构域缔合以形成抗原结合位点(bird等人,science,242,423
‑
426,1988;huston等人,pnas usa,85,5879
‑
5883,1988);双抗体,所述双抗体是二价双特异性抗体,其中vh结构域和vl结构域表达在单链多肽链上,但使用了接头,所述接头太短而不允许在同一条链上的两个结构域之间配对,从而迫使所述结构域与另一条链的互补结构域配对并且产生两个抗原结合位点(wo 94/13804;p.holliger等人proc.natl.acad.sci.usa 90 6444
‑
6448,(1993));线性抗体,所述线性抗体包含一对串联的fv区段(vh
‑
ch1
‑
vh
‑
ch1),这对串联的fv区段与互补轻链多肽一起形成一对抗原结合区;多价抗体片段(scfv二聚体、三聚体和/或四聚体(power和hudson,j immunol.methods 242:193
‑
204 9(2000));以及微抗体,所述微抗体是由与恒定免疫球蛋白结构域ch3或ch4(例如,igg1(c
h
3)和ige(c
h
4))融合的scfv构成的二价分子,其中恒定ch3或ch4结构域用作二聚化结构域(olafsen t等人(2004)prot eng des sel 17(4):315
‑
323;hollinger p和hudson pj(2005)nature biotech 23(9):1126
‑
1136)。这些较小的抗体和经工程改造的变体或片段可以更经济地生产,并且可以具有用于一系列诊断和治疗性应用的其他独特和优越的特性。例如,scfv2
‑
fc可以在肿瘤或组织中以较高的丰度积累,并且微抗体是大约80kd并且由于在组织中较高的摄取而可以理想地用于疗法,具有比完整的免疫球蛋白(150kda)或fab’2(110kda)更快的清除率并且具有更好的组织与血液的比率。抗体片段可以被打造成多价和多特异性试剂,其与治疗性有效载荷(诸如放射性核素、毒素、酶、脂质体和病毒)连接并且经工程改造以增强治疗功效。近来,单抗体结构域已经被工程改造并且被选择作为针对迄今为止酶、受体和感染因子中的免疫静默腔的靶向试剂。
[0205]
本发明的特异性结合成员可以进一步包含抗体恒定区或其一部分。例如,基于图7、8、10、11、12或13的序列的特异性结合成员可以在其c末端附接至抗体轻链恒定结构域,包括人cκ或cλ链,优选cλ链。类似地,基于图7、8、10、11、12或13的序列的特异性结合成员可以在其c末端附接至源自任何抗体同种型(例如,igg、iga、ige、igd和igm)和任何同种型子类(特别是igg1、igg2b和igg4)的免疫球蛋白重链的全部或一部分。igg1是优选的。
[0206]
抗体或其任何片段可以与任何细胞毒素、细菌或其他(例如,假单胞菌(pseudomonas))外毒素、蓖麻毒素或白喉毒素缀合或重组融合。所使用的毒素部分可以是整个毒素或毒素的任何特定结构域。此类抗体
‑
毒素分子已被成功用于靶向和治疗不同种
类的癌症,参见例如,pastan,biochim biophys acta.1997年10月24日;1333(2):c1
‑
6;kreitman等人,n engl j med.2001年7月26日;345(4):241
‑
7;schnell等人,leukemia.2000年1月;14(1):129
‑
35;ghetie等人,mol biotechnol.2001年7月;18(3):251
‑
68。
[0207]
双特异性和三特异性多聚体可以通过缔合不同scfv分子来形成并且已被设计为用于将t细胞募集到肿瘤中(免疫疗法)的交联试剂、用于病毒重靶向(基因疗法)的交联试剂、以及作为血红蛋白凝集试剂(免疫诊断),参见例如,todorovska等人,j immunol methods.2001年2月1日;248(1
‑
2):47
‑
66;tomlinson等人,methods enzymol.2000;326:461
‑
79;mccall等人,j immunol.2001年5月15日;166(10):6112
‑
7。
[0208]
可以通过免疫携带人免疫球蛋白重链和轻链的大部分的转基因小鼠来制备完全人的抗体。这些小鼠是本领域中众所周知的,此类小鼠的例子是xenomouse
tm
(abgenix,inc.)(美国专利号6,075,181和6,150,584)、humab
‑
mouse
tm
(medarex,inc./genpharm)(美国专利5545806和5569825)、transchromo mouse
tm
(kirin)和km mouse
tm
(medarex/kirin)。然后可以通过例如标准杂交瘤技术或通过噬菌体展示来制备抗体。这些抗体然后将仅含有完全人的氨基酸序列。也可以使用噬菌体展示从文库产生完全人的抗体。噬菌体展示可以使用技术人员众所周知的以及如在本文中如在hoogenboom等人和marks等人(hoogenboom hr和winter g.(1992)j mol biol.227(2):381
‑
8;marks jd等人(1991)j mol biol.222(3):581
‑
97;以及还有美国专利5885793和5969108)中所提供的方法进行。
[0209]
本发明的抗体可以标记有可检测标记或功能性标记。可检测标记包括但不限于放射性标记,诸如同位素3h、
14
c、
32
p、
35
s、
36
cl、
51
cr、
57
co、
58
co、
59
fe、
90
y、
121
i、
124
i、
125
i、
131
i、
111
in、
117
lu、
211
at、
198
au、
67
cu、
225
ac、
213
bi、
99
tc和
186
re,可以使用抗体成像领域中已知的常规化学方法将所述放射性标记与本发明的抗体附接。标记还包括荧光标记(例如,荧光素、若丹明、德克萨斯红(texas red))和本领域常规用于mri
‑
ct成像的标记。它们还包括酶标记,诸如辣根过氧化物酶、β
‑
葡糖醛酸糖苷酶、β
‑
半乳糖苷酶、脲酶。标记进一步包括可以经由结合至特定同源可检测部分(例如,标记的亲和素)而被检测的化学部分,诸如生物素。功能性标记包括被设计为靶向肿瘤部位以引起肿瘤组织的破坏的物质。此类功能性标记包括细胞毒性药物,诸如5
‑
氟尿嘧啶或蓖麻毒素;和能够在肿瘤部位将前药转化为活性药物的酶,诸如细菌羧肽酶或硝基还原酶。
[0210]
如本文所用,“表位”是本领域中的术语并且是指抗体可以特异性结合的抗原局部区域。表位可以是例如,多肽的连续氨基酸(线性或连续表位),或者表位可以例如共同来自一种或多种多肽的两个或更多个非连续区域(构象、非线性、间断或非连续表位)。在某些实施方案中,抗体所结合的表位可以通过例如nmr波谱法、x射线衍射结晶学研究、elisa测定、与质谱法(例如,maldi质谱法)偶联的氢/氘交换、基于阵列的寡肽扫描测定、和/或诱变作图(例如,定点诱变作图)来确定。
[0211]
在某些方面,可以使用竞争结合测定来确定抗体是否例如以剂量依赖性方式被另一种抗体竞争性阻断,例如,当两种抗体在可以使用标记的抗原或标记的抗体以所有数目的不同形式配置的竞争结合测定(诸如竞争elisa测定)中识别相同或空间重叠的表位时,抗体与参考抗体结合基本上相同的表位或重叠表位。在一个特定的实施方案中,抗体可以在竞争结合测定中用本文所述的抗体(例如,1901
‑
1a、1901
‑
1b、1901
‑
1c、1901
‑
1d)来测试。
[0212]
另外,识别并且结合至tgf
‑
β3(例如,人tgf
‑
β3)的相同或重叠表位的抗体可以使用常规技术(诸如免疫测定)(例如通过显示出一种抗体阻断另一种抗体与靶抗原结合的能力,即竞争性结合测定)来鉴定。还可以使用竞争结合测定来确定两种抗体对抗原或表位(包括抗原或蛋白质靶标上的特定表位)是否具有相似的结合特异性。可以在测定中确定竞争性结合,其中测试的免疫球蛋白抑制另一种抗体与共同抗原或靶抗原的特异性结合。在一个方面,在竞争结合中,本发明的抗体或抗原结合片段(包括本文所述的tgfβ3抗体,例如包括1901
‑
1a、1901
‑
1b、1901
‑
1c或1901
‑
1d)的结合在测试的免疫球蛋白的存在下降低,并且因此评估和确定和/或确认竞争性结合。
[0213]
在某些方面,可以使用竞争结合测定来确定抗体是否例如以剂量依赖性方式被另一种抗体竞争性阻断,例如,当两种抗体在可以使用标记的抗原或标记的抗体以所有数目的不同形式配置的竞争结合测定(诸如竞争elisa测定)中识别相同或空间重叠的表位时,抗体与参考抗体结合基本上相同的表位或重叠表位。在一个特定的实施方案中,可以在竞争结合测定中用本文所述的tgf
‑
β3抗体(例如包括1901
‑
1a、1901
‑
1b、1901
‑
1c或1901
‑
1d)来测试抗体。竞争性结合测定是本领域中众所周知的。本文提供了示例性竞争性结合测定。例如,在本文的抗体之间证明竞争,包括如实施例和附图中所述的。
[0214]
在具体的方面,本文提供了抗体或其抗原结合片段,其结合至与包含本文所述的氨基酸序列(参见例如,图7、8、10、11、12或13)的抗体(例如,抗体1901
‑
1a、1901
‑
1b、1901
‑
1c或1901
‑
1d中的任何一种)的特异性结合至tgf
‑
β3(例如,人tgf
‑
β3)的表位相同的表位。在具体的方面,本文提供了抗体或其抗原结合片段,其结合至与包含本文所述的氨基酸序列(参见例如,图7、8、10、11、12或13)的抗体(例如,抗体1901
‑
1a、1901
‑
1b、1901
‑
1c或1901
‑
1d中的任何一种)的特异性结合至tgf
‑
β3(例如,人tgf
‑
β3)的表位重叠的表位。本领域技术人员已知的或本文所述的测定(例如,x射线晶体学、elisa测定等)可以用于确定两种抗体是否结合至相同的表位。可以使用biacore测定来评估和确定竞争性结合以及还有表位结合。可以使用biacore来确定不同抗体与单个抗原或表位相互作用的程度,以评估蛋白质
‑
蛋白质或抗体
‑
蛋白质相互作用以及确定结合亲和力。
[0215]
tgf
‑
β3在控制免疫系统中起重要作用,并且是肿瘤促进子和肿瘤抑制子。对癌症中tgf
‑
β3的研究提供了阻断人类癌症中的tgf
‑
β3信号传导的治疗作用的理据。在大多数癌症中(包括在对常规化学疗法有抗性的肿瘤中)已报告了tgf
‑
β配体的过表达,并且在肿瘤组织和/或血清中高的tgf
‑
β配体水平与早期转移性复发和/或差的患者结局相关(teicher,b.a.等人(1997)in vivo 11:463
‑
472;wojtowicz
‑
praga,s.(2003)invest new drugs 21:21
‑
32;ito,n.,等人(1995)cancer lett 89:45
‑
48;shariat,s.f.,等人(2001)cancer 92:2985
‑
2992;shariat,s.f.,等人(2001)j clin oncol 19:2856
‑
2864;tsushima,h.,等人(2001)clin cancer res 7:1258
‑
1262;rich,j.n.(2003)front biosci 8:e245
‑
e260)。用泛
‑
tgf
‑
β抗体的动物研究已显示出对纤维肉瘤、结肠癌和乳腺癌中的肿瘤复发或转移的抑制(terabe m等人(2003)j exp med 198:1741
‑
1752;nam j
‑
s等人(2008)cancer res 68(10):3835
‑
3843)以及降低了放射诱导的转移性乳腺癌加速(biswas s等人(2007)117:1305
‑
1313)。截至目前的证据强烈支持了,阻断tgfβ可以增强抗原摄取、呈递、和由治疗性疫苗介导的抗肿瘤免疫反应的激活。确实,最近的研究已证明,使用小鼠tgf
‑
β通用抗体id11(其识别tgf
‑
β1、tgf
‑
β2和tgf
‑
β3)对tgf
‑
β的阻断会经由cd8
t细胞而
在动物模型中协同地增强肿瘤疫苗(terabe m等人(2009)clin cancer res 15:6560
‑
6569;takaku s等人(2010)int j cancer 126(7):1666)。放射疗法具有将辐照的肿瘤转化为原位疫苗的潜力(formanti sc等人(2012)int j radiat oncol biol phys 84:870
‑
880)。在最近的研究中,在转移性乳腺癌的临床前模型中,在放射疗法期间施用的非特异性tgf
‑
β中和抗体(1d11)会增加所述疗法诱导对内源性肿瘤抗原的t细胞反应的能力(vanpoille
‑
box c等人(2015)cancer res 75(11):2232
‑
2242)。另外的pd
‑
1阻断会增强用tgf
‑
β抗体的放射疗法的有效性。
[0216]
已经产生了tgf
‑
β抗体,并且表示为1d11及其人源化对应物gc1008的特定例子已经在动物模型和早期人类临床试验中被评价并且提供和公开在专利申请中,包括在wo 2007076391、wo 2005097832、wo 2006086469和5,571,714中。但是,抗体1d11及其人源化对应物是识别所有tgf
‑
β形式(包括tgf
‑
β1、tgf
‑
β2和tgf
‑
β3)的通用tgf
‑
β抗体。因此,抗体1d11及其人源化对应物不提供对tgf
‑
β3的特异性和定向调节。
[0217]
通过杂交瘤技术从除人以外的另一种物种(诸如小鼠)得到的单克隆抗体可以人源化,这意味着非人抗体被基因工程改造为更具人性,以便在输注到人中时避免hama。用于将抗体人源化的方法是本领域中众所周知的,更常见的方法中是互补决定区(cdr)移植和镶饰(也称为表面重修)。这些方法已经广泛描述在文献和专利中,参见例如,king“applications and engineering of monoclonal antibodies”taylor和francis,1998;美国专利5,225,539、5,530,101、5,585,089、5,859,205和6,797,492,将每一个通过引用并入本文。另一种常见的方法是镶饰(v)技术(daugherty等人(1991).nucleic acids res.19(9),2471
‑
6;美国专利6,797,492;padlan,e.a.(1991)mol.immunol.28(4
‑
5),489
‑
98;欧洲专利号519596)。其中进行在框架区中的表面暴露的残基(与在人抗体中通常发现的那些不同)的替代,以便使抗体可变结构域的免疫原性最小化,而保留配体结合特性。
[0218]
抗体(包括其片段)可以具有某些诊断性应用,并且可以例如用于检测和/或测量诸如癌症的病症、癌前病变、与过度增殖的细胞生长等有关或由其导致的病症的目的。
[0219]
放射性标记的特异性结合成员,特别是抗体及其片段,可用于体外诊断技术和体内放射成像技术以及用于放射免疫疗法。在体内成像的情况下,本发明的特异性结合成员可以与除一种或多种放射性同位素以外的成像剂缀合,所述成像剂包括但不限于磁共振图像增强剂,其中例如,抗体分子通过螯合基团而负载有大量顺磁性离子。螯合基团的例子包括edta、卟啉、多胺冠醚和多肟。顺磁性离子的例子包括钆、铁、锰、铼、铕、镧、钬和镄。在本发明的进一步的方面,放射性标记的特异性结合成员,特别是抗体及其片段,特别是放射免疫缀合物可用于放射免疫疗法,特别是作为用于癌症疗法的放射性标记的抗体。在再进一步的方面,放射性标记的特异性结合成员,特别是抗体及其片段可用于放射免疫引导的手术技术,其中它们可以在去除癌细胞、癌前细胞、肿瘤细胞、和过度增殖的细胞的手术之前、之中或之后识别和指示此类细胞的存在和/或位置。
[0220]
本发明的免疫缀合物或抗体融合蛋白(其中本发明的特异性结合成员、特别是抗体及其片段与其他分子或药剂缀合或附接)进一步包括但不限于与化学消融剂、毒素、免疫调节剂、细胞因子、细胞毒性剂、化学治疗剂或药物缀合的结合成员。
[0221]
放射免疫疗法(rait)已进入临床并且证明了使用各种抗体免疫缀合物的功效。已在结直肠癌中评价了
131
i标记的人源化抗癌胚抗原(抗cea)抗体hmn
‑
14(behr tm等人
(2002)cancer 94(4suppl):1373
‑
81),并且已在甲状腺髓样癌中评估了具有
90
y标签的相同抗体(stein r等人(2002)cancer 94(1):51
‑
61)。已经对于非霍奇金淋巴瘤和胰腺癌评估和报道了使用单克隆抗体的放射免疫疗法(goldenberg dm(2001)crit rev oncol hematol 39(1
‑
2):195
‑
201;gold dv等人(2001)crit rev oncol hematol 39(1
‑
2)147
‑
54)。美国专利6,306,393和6,331,175中也描述了用特定抗体的放射免疫疗法方法。放射免疫引导手术(rigs)也已经进入临床并且证明了功效和有用性,包括使用抗cea抗体和针对肿瘤相关抗原的抗体(kim jc等人(2002)int j cancer 97(4):542
‑
7;schneebaum s等人(2001)world j surg 25(12):1495
‑
8;avital s等人(2000)cancer 89(8):1692
‑
8;mcintosh dg等人(1997)cancer biother radiopharm 12(4):287
‑
94)。
[0222]
基于收集和使用患者自身的免疫细胞来治疗癌症,过继性细胞转移(act)正在兴起作为癌症疗法的新支柱。存在若干种类型的act,包括til、tcr和car(haanen等人(2018)j immunother cancer 474:449
‑
461)。一种方式使用已渗透到肿瘤内及其周围的环境的免疫细胞,称为肿瘤浸润淋巴细胞(til)。act的另一种方式涉及工程改造患者的t细胞以表达特异性t细胞受体(tcr)以识别肿瘤细胞抗原(mackall等人(2019)nature medicine 25:1341
‑
1355)。嵌合抗原受体(car)使用合成抗体的针对特定表面细胞抗原的部分,并且car t细胞疗法在临床开发中已取得显著进展。在car疗法中,从患者中分离出t细胞,并且将其进行基因工程改造以产生car,因此t细胞识别并且附接至肿瘤细胞上的特异性抗原。针对b细胞抗原cd19的car t细胞疗法已经在患有all的儿童和年轻成年人中以及还有在淋巴瘤患者中证明是成功的。
[0223]
本发明的tgf
‑
β3抗体或其片段可以进一步用于构建嵌合抗原受体(car),其中所述car包含tgf
‑
β3抗体的抗原结合结构域、跨膜结构域、共刺激信号传导区、和信号传导结构域。在这些和其他实施方案中,抗原结合结构域可以是tgf
‑
β3抗体的fab或scfv。在又一个其他实施方案中,tgf
‑
β3存在于肿瘤微环境中或在肿瘤微环境中的细胞上。在又其他实施方案中,所述共刺激信号传导区包含共刺激分子的细胞内结构域,所述共刺激分子选自由以下项组成的组:cd27、cd28、4
‑
1bb、ox40、cd30、cd40、pd
‑
1、icos、淋巴细胞功能相关抗原
‑
1(lfa
‑
1)、cd2、cd7、light、nkg2c、b7
‑
h3、与cd83特异性结合的配体及其任何组合。
[0224]
经修饰以表达嵌合抗原受体(car)并且单独施用的t细胞在敌对的肿瘤微环境中受到抑制。作为非限制性例子的方式,对这些细胞的进一步修饰以表达可分泌scfv(例如,pd
‑
1、pdl
‑
1或ctla
‑
4)(称为装甲(armored)car)由于其调节肿瘤微环境和抵抗抑制因子的能力而改善抗肿瘤功能(例如,如美国专利10,124,023和brentjens等人(2018)nat biotechnol 36(9):847
‑
856中所述)。在一个此类实施方案中,考虑了表达本发明的一种或多种tgf
‑
β3抗体(包括其一种或多种scfv)的装甲car,其中所述tgf
‑
β3抗体增强car细胞活性并且阻断免疫抑制,包括诸如被内源性tgf
‑
β抑制。在另一个实施方案中,本发明的tgf
‑
β3抗体可以用于过继细胞疗法(act),其中所述tgf
‑
β3抗体或其片段将被遗传地引入从癌症患者中分离的t细胞(优选但不限于肿瘤浸润淋巴细胞(til))中,并且然后,将此类t细胞扩增并且递送回患者中,由此所述t细胞将靶向肿瘤并且在局部肿瘤微环境中表达和分泌tgf
‑
β抗体或其片段,以对抗那里的免疫抑制环境。在另一个实施方案中,当递送回患者体内以进行act时,可以将外源性tgf
‑
β3抗体或其片段添加到扩增的t细胞群体中。作为非限制性例子的方式,在递送回患者体内以进行act之前,可以将外源性tgf
‑
β3抗体或其片段添
加到如wo 2019/086711中所述扩增的t细胞群体中。
[0225]
本发明的tgf
‑
β3抗体还可以用于过继细胞疗法(act),其中所述tgf
‑
β3抗体或其片段将被遗传地导入从癌症患者中分离的t细胞中,并且然后,将此类t细胞扩增并且递送回患者中,由此所述t细胞将靶向肿瘤并且在局部肿瘤微环境中表达tgf
‑
β3抗体或其片段,以对抗那里的免疫抑制环境。优选地,所使用的t细胞将是肿瘤浸润淋巴细胞(til)。
[0226]
技术人员可以使用体内癌症动物模型或动物异种移植研究来进一步或另外筛选、评估和/或验证本发明的特异性结合成员和抗体或其片段,包括进一步评估体内tgf
‑
β3调节和抑制以及抑制肿瘤进展、复发、转移、或对肿瘤细胞的免疫反应或对抗原或疫苗(包括肿瘤或癌症抗原或疫苗)的反应。此类动物模型包括但不限于免疫反应、免疫调节、疫苗接种、癌症、癌症转移的模型。其复发或转移与升高的tgf
‑
β3水平相关的癌症的模型特别易感于本发明的抗体并且是本发明的抗体所靶向的。此类癌症包括黑素瘤、乳腺癌、肺癌和前列腺癌。示例性和合适的模型是技术人员已知的并且可容易获得的,并且包括本文中引用和/或描述的以及本领域中已知的那些。例如,本发明的抗体或其片段可以在乳腺癌模型中评价,包括人乳腺癌细胞在无胸腺小鼠中(arteaga cl等人(1993)cell growth diff 4:193
‑
201)或在neu诱导的乳腺肿瘤中(muraoka
‑
cok rs等人(2004)cancer res 64:2002
‑
2011)的致瘤性,或评价转基因乳腺肿瘤的转移(siegel pm等人(2003)proc natl acad sci usa 100:8430
‑
8435)。另外,例如,可以使用与由takaku等人(takaku s等人(2010)int j cancer 126(7):1666)报道的方法相似的方法对全细胞疫苗在针对同基因小鼠中注射的ct26结肠癌肿瘤的预防方面检查tgf
‑
β3抗体的抗肿瘤作用。
[0227]
可以经由任何合适的途径,包括通过注射(包括腹膜内、肌内、皮下、静脉内)到血流或csf中或直接注射到肿瘤部位中或者通过瘤内施用或瘤内注射,将本发明的抗体施用于需要治疗的患者。精确剂量将取决于许多因素,包括抗体是用于诊断还是用于治疗、肿瘤的大小和位置、抗体(无论整个抗体、片段、双抗体等)的精确性质、以及与抗体附接的可检测标记或功能性标记的性质。在疗法使用放射性核素的情况下,合适的单剂量可以是约45mci/m2至最大约250mci/m2。优选的剂量在15至40mci的范围内,并且进一步优选的剂量在20至30mci或10至30mci的范围内。此类疗法可能需要骨髓或干细胞替代。用于肿瘤成像或肿瘤治疗的典型抗体剂量将在从0.5至40mg、优选从1至4mg呈f(ab’)2形式的抗体的范围内。裸抗体优选以20至1000mg蛋白质/剂、或20至500mg蛋白质/剂、或20至100mg蛋白质/剂的剂量施用。这是用于成年患者的单次治疗的剂量,其可以针对儿童和婴儿按比例进行调节,并且也可以针对其他抗体形式例如与分子量成比例地进行调节。根据医生的判定,治疗可以按每天一次、每周两次、每周一次或每月一次的间隔进行重复。
[0228]
药物组合物和治疗性组合物
[0229]
本发明的抗体和片段通常将以药物组合物的形式施用,所述药物组合物除了特异性结合成员外还可以包含至少一种组分。因此,除了活性成分之外,根据本发明以及用于根据本发明使用的药物组合物还可以包含药学上可接受的赋形剂、载体、缓冲剂、稳定剂或本领域技术人员众所周知的其他材料。此类材料应是无毒的并且不应干扰活性成分的功效。载体或其他材料的确切性质将取决于施用途径,所述施用途径可以是口服、或通过注射(例如,静脉内)、或通过在肿瘤部位沉积。
[0230]
本发明的结合成员和抗体以及在一个特定的实施方案中具有图7、8、10、11、12中
表示的序列的抗体、或其片段、以及由其衍生的单链、重组或合成抗体,并且特别是包含图7和图8中或图10、11、12、13中或seq id no:1、34、35、28、29、30、37、4、5、6、31、32、33中描绘的重链cdr区序列和轻链cdr区序列的抗体,可以制备在药物组合物中,所述药物组合物包含合适的媒介物、载体或稀释剂,或包含佐剂和/或免疫调节剂,以用于在其中疗法是适当的实例中施用,诸如以治疗癌症或刺激或增强免疫反应,包括针对癌症的免疫反应。此药物组合物还可以包括通过本领域已知的方法(诸如聚乙二醇化)调节结合成员、抗体或片段的半衰期的手段。此类药物组合物可以进一步包含另外的抗体或治疗剂。
[0231]
本发明的组合物可以单独地施用或与其他治疗、疗法或药剂组合施用(同时或顺序地施用,取决于有待治疗的病症)。另外,本发明考虑了并且包括包含本文所述的结合成员(特别是抗体或其片段)以及其他药剂或疗法(诸如抗癌剂或疗法、抗有丝分裂剂、凋亡剂或抗体、或免疫调节剂、或针对免疫调节剂的小分子抑制剂)的组合物。更一般地,这些抗癌剂可以是酪氨酸激酶抑制剂或磷酸化级联抑制剂、翻译后调节剂、细胞生长或分裂抑制剂(例如,抗有丝分裂剂)、抑制剂或信号转导抑制剂。其他治疗或疗法可以包括施用合适剂量的疼痛缓解药物,诸如非甾体抗炎药(例如,阿司匹林、扑热息痛、布洛芬或酮洛芬)或鸦片制剂(诸如吗啡或止吐药)。另外,所述组合物可以与免疫调节剂一起施用,所述免疫调节剂诸如α
‑
半乳糖基神经酰胺、白介素、肿瘤坏死因子(tnf)、或刺激免疫反应以及癌细胞或肿瘤的减少或消除的其他生长因子、集落刺激因子、细胞因子或激素。所述组合物可以与免疫调节剂(诸如佐剂)一起施用。所述组合物还可以与其他抗tgfβ抗体、其他免疫调节性抗体或其他抗肿瘤抗原抗体一起施用或可以包括与其一起的组合。在一个方面,所述组合物与另一种抗体,特别是抗肿瘤抗原抗体组合施用。
[0232]
本发明还包括与其他分子或药剂共价附接或以其他方式缔合的抗体及其片段。这些其他分子或药剂包括但不限于具有不同识别特征的分子(包括抗体或抗体片段)、毒素、配体、和化学治疗剂。在一个另外的方面,本发明的抗体或片段可以用于靶向或指导治疗性分子或其他药剂,例如将分子或药剂靶向tgfβ表达细胞或tgfβ反应性细胞,特别是tgf
‑
β3表达或反应性细胞,例如在伤口部位、肿瘤部位、炎性区域或癌性病变处的细胞。
[0233]
用于口服施用的药物组合物可以呈片剂、胶囊、散剂或液体形式。片剂可以包含固体载体,诸如明胶或佐剂。液体药物组合物通常包含液体载体,诸如水、石油、动物或植物油、矿物油或合成油。可以包括生理盐水溶液、葡萄糖或其他糖溶液或者诸如乙二醇、丙二醇或聚乙二醇的二醇。
[0234]
对于静脉内注射或在患病部位的注射,活性成分可以呈肠胃外可接受的水溶液的形式,所述肠胃外可接受的水溶液是无热原的并且具有合适的ph、等渗性和稳定性。本领域相关技术人员能够很好地使用例如等渗媒介物(诸如氯化钠注射液、林格氏注射液(ringer's injection)、乳酸林格氏注射液)来制备合适的溶液。根据需要可以包括防腐剂、稳定剂、缓冲剂、抗氧化剂和/或其他添加剂。
[0235]
组合物可以单独地施用或与其他治疗、疗法或药剂组合施用(同时或顺序地施用,取决于有待治疗的病症)。另外,本发明考虑了并且包括包含本文所述的结合成员(特别是抗体或其片段)以及其他药剂或疗法(诸如抗癌剂或疗法、激素、抗有丝分裂剂、抗凋亡剂、抗体、或免疫调节剂)的组合物。更一般地,这些抗癌剂可以是但不限于酪氨酸激酶抑制剂或磷酸化级联抑制剂、翻译后调节剂、细胞生长或分裂抑制剂(例如,抗有丝分裂剂)、或信
号转导抑制剂。其他治疗或疗法可以包括施用合适剂量的疼痛缓解药物,诸如非甾体抗炎药(例如,阿司匹林(aspirin)、扑热息痛(paracetamol)、布洛芬(ibuprofen)或酮洛芬)或鸦片制剂(opiate)(诸如吗啡或止吐药)。所述组合物可以与酪氨酸激酶抑制剂(包括但不限于ag1478和zd1839、sti571、osi
‑
774、su
‑
6668)、阿霉素、替莫唑胺、顺铂、卡铂、亚硝基脲、甲基苄肼、长春新碱、羟基脲、5
‑
氟尿嘧啶、胞嘧啶阿拉伯糖苷、环磷酰胺、表鬼臼毒素(epipodophyllotoxin)、卡莫司汀、洛莫司汀和/或其他化学治疗剂组合(顺序地(即,在之前或之后)或同时)施用。因此,这些药剂可以是特异性抗癌剂或免疫细胞反应调节剂,或可以是更通用的抗癌和抗赘生物剂诸如阿霉素、顺铂、替莫唑胺、亚硝基脲、甲基苄肼、长春新碱、羟基脲、5
‑
氟尿嘧啶、胞嘧啶阿拉伯糖苷、环磷酰胺、表鬼臼毒素、卡莫司汀或洛莫司汀。另外,所述组合物可以与以下一起施用:激素(诸如地塞米松(dexamethasone)),免疫调节剂诸如白介素、肿瘤坏死因子(tnf)、或刺激、增强或抑制免疫反应以及癌细胞或肿瘤的减少或消除的其他生长因子、集落刺激因子、细胞因子、激动剂或拮抗剂抗体至免疫反应调节剂。所述组合物还可以与其他抗肿瘤抗原抗体一起施用或可以包含与其一起的组合。
[0236]
另外,本发明考虑了并且包括用于将一种或多种抗体或片段与常规放射疗法组合使用的治疗性组合物。
[0237]
本发明进一步考虑了可用于实践本发明的治疗性方法的治疗性组合物。主题治疗性组合物包含混合的药学上可接受的赋形剂(载体)以及如本文所述作为活性成分的特异性结合成员或抗体、其多肽类似物或其片段中的一种或多种。在一个实施方案中,所述组合物包含能够调节本发明结合成员/抗体与靶细胞的特异性结合的抗原。在一个实施方案中,所述组合物包含抗原或疫苗配制品,特别是肿瘤抗原或癌症疫苗。
[0238]
含有作为活性成分的多肽、类似物或活性片段的治疗性组合物的制备是本领域中熟知的。典型地,此类组合物可以制备为呈液体溶液或悬浮液的可注射剂。但是,也可以制备适用于在注射之前溶解或悬浮在液体中的固体形式。制剂也可以是乳化的。通常将活性治疗性成分与药学上可接受的并且与所述活性成分相容的赋形剂混合。合适的赋形剂是例如水、盐水、右旋糖、甘油、乙醇等及其组合。另外,如果希望,所述组合物可以含有微小量的辅助物质,诸如润湿剂或乳化剂、增强活性成分的有效性的ph缓冲剂。
[0239]
可以将多肽、类似物或活性片段以中和的药学上可接受的盐形式配制到治疗性组合物中。药学上可接受的盐包括酸加成盐(与多肽或抗体分子的游离氨基形成的),并且所述酸加成盐是与无机酸(例如像盐酸或磷酸)或有机酸(诸如乙酸、草酸、酒石酸、扁桃酸等)形成的。从游离羧基形成的盐也可以衍生自无机碱(例如像氢氧化钠、氢氧化钾、氢氧化铵、氢氧化钙或氢氧化铁)以及有机碱(诸如异丙胺、三甲胺、2
‑
乙基氨基乙醇、组氨酸、普鲁卡因等)。
[0240]
已经描述和综述了使用肿瘤内免疫调节和瘤内免疫进行癌症疗法的替代范例(marabelle a等人(2014)clin cancer res 20(7):1747
‑
1756)。这种范例对于被设计为与在免疫细胞的激活中起作用的分子相互作用以逆转癌症诱导的免疫耐受以及促进抗肿瘤免疫反应的药物疗法(包括免疫刺激剂单克隆抗体)是特别有效的(marabelle a等人(2014)clin cancer res 20(7):1747
‑
1756;mellman i等人(2011)nature 480:480
‑
489)。将此范例应用于本发明的抗体和活性片段是本发明的一个方面。将免疫刺激性单克隆抗体直接递送到肿瘤中以产生或促进全身性抗肿瘤免疫反应(包括引起更少自身免疫毒性或其
他副作用的更有效力的抗肿瘤反应)以及对比全身施用的药物或抗体更少的药物的需要、在已建立的肿瘤周围在佐剂中递送抗体(在结肠癌肿瘤周围在油包水乳液佐剂(montadine isa51)中递送抗ctla
‑
4ab)根除了局部肿瘤并且预防了明显的肿瘤发展(fransen mf等人(2013)cancer res 19:5381
‑
5389)。
[0241]
以与剂量配制品相容的方式并且以治疗有效量来施用所述组合物。有待施用的数量取决于有待治疗的受试者、受试者的免疫系统利用活性成分的能力、以及所希望的肽/mhc或肿瘤抗原结合能力的程度。需要施用的活性成分的精确量取决于从业者的判断并且是每位个体所特有的。用于初始施用和随后施用的合适方案也是可变的,并且可以包括初始施用,然后是以一个或多个小时的间隔通过随后的注射或其他施用的重复剂量。可替代地,考虑了足以在血液中或在所希望的治疗部位处保持适当且足够的浓度的连续静脉内输注。
[0242]
诊断性测定
[0243]
本发明还涉及多种诊断性应用,包括用于检测tgf
‑
β3的表达或存在升高、tgf
‑
β3介导的癌症、或更一般地癌症,通过参考其被本发明的一种或多种特异性结合成员识别的能力来评价tgf
‑
β3反应性细胞的存在或量的方法。可以在包括免疫细胞和/或肿瘤细胞的细胞上鉴定、靶向、标记和/或定量肽复合物。
[0244]
本发明的特异性结合成员,特别是抗体及其片段的诊断性应用包括对于技术人员是众所周知的和标准的并且基于本说明书的体外和体内应用。用于体外评估和评价肿瘤和癌症状态以及肿瘤反应或免疫反应的诊断性测定和试剂盒可以用于诊断、评价和监测患者样品,包括已知具有或怀疑具有癌症、癌前病症、与过度增殖的细胞生长有关的病症的或来自肿瘤样品的那些。癌症、肿瘤和转移性疾病状态的评估和评价还可用于确定患者对药物临床试验或对施用相对于不同的药剂或结合成员本发明的特定化学治疗剂或特异性结合成员、特别是抗体(包括其组合)的适合性。这种类型的诊断性监测和评估已处于使用针对乳腺癌中her2蛋白的抗体的实践中(hercep test,dako公司),其中所述测定还用于评价用于使用赫塞汀(herceptin)的抗体疗法的患者。体内应用包括肿瘤成像或评估个体的癌症状态,包括放射成像。
[0245]
优选地,用于本发明诊断性方法的抗体是小鼠抗体、人抗体、人源化抗体或重组抗体。优选地,抗体是单链链抗体或结构域抗体。另外,本文所用的抗体分子可以呈整个抗体分子的fab、fab’、f(ab’)2或f(v)部分,特别是fab的形式。
[0246]
在细胞中的tgf
‑
β3或tgf
‑
β3反应性细胞或tgf
‑
β3反应性基因或蛋白质的存在可以通过可应用于此类确定的通常的体外或体内免疫学程序来确定。已知许多有用的程序。所述程序及其应用都是本领域技术人员熟悉的,并且因此可以在本发明的范围内使用。
[0247]
在本发明的一个其他实施方案中,可以制备适用于医学专业人员使用的商业测试试剂盒以确定在怀疑的靶细胞中异常表达(包括但不限于扩增的tgf
‑
β3)的存在或不存在。根据以上讨论的测试技术,一类这样的试剂盒将至少含有标记的或其结合配偶体,例如对其具有特异性的抗体,当然以及指导说明书,取决于所选择的方法。试剂盒还可以含有外周试剂,诸如缓冲剂、稳定剂等。
[0248]
因此,可以制备用于证明tgf
‑
β3或tgf
‑
β3反应性元件或蛋白质的存在或水平升高的测试试剂盒,所述测试试剂盒包含:
[0249]
(a)预定量的通过将本发明的特异性结合成员或其特异性结合配偶体直接或间接附接至可检测标记而获得的至少一种标记的免疫化学反应性组分;
[0250]
(b)其他试剂;以及
[0251]
(c)使用所述试剂盒的指导说明书。
[0252]
可以制备用于证明tgf
‑
β3介导的癌症(特别是选自乳腺癌、肺癌、肝癌、前列腺癌、膀胱癌的)的存在的测试试剂盒,所述测试试剂盒包含:
[0253]
(a)预定量的通过将本发明的特异性结合成员或其特异性结合配偶体直接或间接附接至可检测标记而获得的至少一种标记的免疫化学反应性组分;
[0254]
(b)其他试剂;以及
[0255]
(c)使用所述试剂盒的指导说明书。
[0256]
根据以上内容,可以制备用于筛选有效调节tgf
‑
β3的存在或活性和/或本发明抗体的活性或结合的潜在药物的测定系统。可以将抗原肽或者结合成员或抗体引入测试系统中,并且还可以将预期药物引入所得细胞培养物中,并且检查之后的培养物以观察由于添加单独的预期药物或由于一种或多种已知药剂的添加数量的作用而导致的细胞活性的任何变化、抗体的结合、或tgf
‑
β3的量和程度。
[0257]
核酸
[0258]
本发明进一步提供了编码本发明特异性结合成员的分离的核酸。核酸包括dna和rna。在一个优选的方面,本发明提供了核酸,所述核酸编码如上所定义的本发明多肽,包括如图7、8、10、11、12和/或13所列出的多肽,包括seq id no:18、19、36、22和/或23的多肽;或能够编码其cdr区,包括seq id no:1、34、35、30、28、29、4、5、6、33、31和/或32。
[0259]
本发明还提供了呈质粒、载体、转录或表达盒的形式的构建体,其包含如上至少一种多核苷酸。本发明还提供了重组宿主细胞,其包含如上一种或多种构建体。编码如所提供的任何特异性结合成员的核酸本身形成本发明的一个方面,生产特异性结合成员的方法也是如此,所述方法包括从其编码核酸进行表达。表达可以方便地通过在适当条件下培养含有所述核酸的重组宿主细胞来实现。通过表达生产后,可以使用任何合适的技术分离和/或纯化特异性结合成员,然后视情况而定使用。
[0260]
可以提供根据本发明的特异性结合成员和编码核酸分子和载体,其为例如从其天然环境中以基本上纯的或均质的形式或者在核酸的情况下不含或基本上不含除编码具有所需功能的多肽的序列以外的核酸或基因起源的形式分离和/或纯化的。根据本发明的核酸可以包含dna或rna,并且可以是完全或部分合成的。
[0261]
在多种不同宿主细胞中克隆和表达多肽的系统是众所周知的。合适的宿主细胞包括细菌、哺乳动物细胞、酵母和杆状病毒系统。可以选择或构建合适的载体,其含有适当的调控序列,包括启动子序列、终止子序列、聚腺苷酸化序列、增强子序列、标记基因和视情况而定其他序列。视情况而定,载体可以是质粒(病毒的,例如噬菌体)或噬菌粒。
[0262]
因此,本发明的进一步的方面提供了一种含有如本文所公开的核酸的宿主细胞。仍进一步的方面提供了一种方法,所述方法包括将此类核酸引入宿主细胞中。引入可以采用任何可用的技术。在引入之后可以引起或允许从核酸的表达,例如通过在表达基因的条件下培养宿主细胞。本发明还提供了方法,所述方法包括在表达系统中使用如上所陈述的构建体,以便表达如上的特异性结合成员或多肽。
[0263]
本发明的另一个特征是本文公开的dna序列的表达。如本领域中众所周知的,可以通过将dna序列可操作地连接至在适当的表达载体中的表达控制序列并且使用该表达载体转化适当的单细胞宿主来表达dna序列。可以在表达本发明的dna序列中使用多种多样的宿主/表达载体组合。有用的表达载体,例如,可以由染色体、非染色体和合成dna序列的区段组成。合适的载体包括sv40和已知细菌质粒的衍生物,例如大肠杆菌(e.coli)质粒col el、pcr1、pbr322、pmb9及其衍生物,诸如rp4的质粒;噬菌体dna,例如噬菌体λ的众多衍生物,例如nm989,和其他噬菌体dna,例如m13和丝状单链噬菌体dna;酵母质粒,诸如2u质粒或其衍生物;可用于真核细胞的载体,诸如可用于昆虫或哺乳动物细胞的载体;衍生自质粒和噬菌体dna的组合的载体,诸如经修饰以使用噬菌体dna或其他表达控制序列的质粒;等等。
[0264]
多种多样的表达控制序列中的任何一种
‑‑
控制与其可操作地连接的dna序列的表达的序列
‑‑
可以用在这些载体中以表达本发明的dna序列。此类有用的表达控制序列包括,例如,sv40、cmv、牛痘、多瘤或腺病毒的早期或晚期启动子,lac系统,trp系统,tac系统,trc系统,ltr系统,噬菌体λ的主要操纵子和启动子区,fd外壳蛋白的控制区,3
‑
磷酸甘油酸激酶或其他糖酵解酶的启动子,酸性磷酸酶的启动子(例如,pho5),酵母α
‑
杂交因子的启动子,以及已知控制原核或真核细胞或其病毒的基因表达的其他序列,以及其各种组合。
[0265]
多种多样的单细胞宿主细胞也可用于表达本发明的dna序列。这些宿主可以包括众所周知的在组织培养物中的真核和原核宿主,诸如大肠杆菌、假单胞菌属(pseudomonas)、芽孢杆菌属(bacillus)、链霉菌属(streptomyces)的菌株;真菌,诸如酵母;和动物细胞,诸如cho、yb/20、nso、sp2/0、rl.l、b
‑
w和l
‑
m细胞、非洲绿猴肾细胞(例如,cos 1、cos 7、bsc1、bsc40和bmt10)、昆虫细胞(例如,sf9)、以及人细胞和植物细胞。
[0266]
应当理解,并非所有的载体、表达控制序列和宿主将同样好地发挥表达本发明dna序列的功能。在相同的表达系统的情况下,所有宿主均将不能同样好地发挥功能。但是,在不背离本发明的范围的情况下,本领域技术人员将能够在不进行过多实验的情况下选择适当的载体、表达控制序列和宿主以完成所希望的表达。
[0267]
如上所提及的,编码特异性结合成员的dna序列可以是合成制备的而不是克隆的。可以用针对特异性结合成员氨基酸序列的适当密码子来设计dna序列。通常,如果将序列用于表达,则人们将针对所期望的宿主来选择优选的密码子。完整序列是由通过标准方法制备的重叠寡核苷酸组装的,并且组装成完整编码序列。合成dna序列允许方便地构建将表达特异性结合成员类似物或“突变蛋白”的基因。可替代地,编码突变蛋白的dna可以通过天然特异性结合成员基因或cdna的定点诱变来制造,并且可以使用常规多肽合成来直接制备突变蛋白。
[0268]
通过参考以下非限制性实施例可以更好地理解本发明,所述实施例作为本发明的示例提供。呈现以下实施例以便更充分地说明本发明的优选实施方案,但是决不应解释为限制本发明的广泛范围。
[0269]
实施例1
[0270]
鼠tgfβ
‑
3抗体
[0271]
成熟小鼠和人tgf
‑
β3在蛋白质水平上共享100%的同源性,由于免疫耐受,这使得极难产生针对人和小鼠蛋白质两者的小鼠抗体。小鼠和人tgf
‑
β3氨基酸序列如下:
[0272]
小鼠
[0273]
ncbi参考序列:np_033394.2(seq id no:7)
[0274][0275]
人
[0276]
uniprotkb/swiss
‑
prot:p10600.1(seq id no:8)
[0277][0278]
先前使用自身疫苗接种方案在小鼠中成功产生tgf
‑
β3抗体。分离出一组小鼠抗tgf
‑
β3抗体:mtgf
‑
β3
‑
9/8(也表示为mtgf
‑
β3
‑
9)、mtgf
‑
β3
‑
1203/11(也表示为mtgf
‑
β3
‑
12)、mtgf
‑
β3
‑
1679/2(也表示为mtgf
‑
β3
‑
16)、mtgf
‑
β3
‑
1719/13(也表示为mtgf
‑
β3
‑
17)、mtgf
‑
β3
‑
1901/16(也表示为mtgf
‑
β3
‑
19)。所述抗体均为igg类抗体;mtgf
‑
β3
‑
19是igg1抗体,抗体mtgf
‑
β3
‑
9、mtgf
‑
β3
‑
16和mtgf
‑
β3
‑
17是igg2a抗体,并且抗体mtgf
‑
β3
‑
12是igg2b。所述抗体、其对tgf
‑
β3结合和中和的特异性、以及其序列描述和提供在pct/us2016/036965中,公开为wo 2016/201282和ussn 15/580,746,公开为us 2018
‑
0148501 a1,将所述专利通过引用并入本文。
[0279]
选择小鼠单克隆抗体mtgf
‑
β3
‑
1901/16(也表示为mtgf
‑
β3
‑
19)并且在本文中特别表示为抗体1901用于进一步开发以及嵌合和人源化,如以下实施例中所述。tgfβ3抗体1901(mtgf
‑
β3
‑
1901/16)具有重链可变区序列和轻链可变区,所述重链可变区序列包含cdr1序列sswih(seq id no:1)、cdr2序列riypgdgdtnytgkfkg(seq id no:2)和cdr3序列rmittqaamdy(seq id no:3),所述轻链可变区包含cdr1序列kasqsvinava(seq id no:4)、cdr2序列yasnryt(seq id no:5)和cdr3序列qqdysspt(seq id no:6)。
[0280]
实施例2
[0281]
肿瘤微环境中的tgfb信号传导,特别是tgf
‑
b3信号传导通过多种机制参与对癌症的有效免疫反应的负调控。tgfb阻断可以克服这种免疫抑制,尤其是当与其他检查点靶向药物组合时。这是免疫肿瘤学中一种新兴且有前途的治疗性方式。先前通过用重组鼠tgf蛋白同种型tgfb1、tgfb2和tgfb3免疫小鼠产生了一系列针对tgfb的小鼠单克隆抗体。基于其对人和小鼠tgfb3两者而不对tgfb1和tgfb2具有高度选择性特异性以及其在体外和体内效力测定中阻断tgfb3信号传导的能力(us 2018/0148501 a1)选择小鼠单克隆抗体克隆1901用于进一步开发。
[0282]
启动一个项目,以产生小鼠tgfb3抗体1901的人源化形式,其具有与原始小鼠mab相似或改善的功能性体外效力。人源化抗体在对人类的治疗性方式中可能更易接受和有用的。使用cdr/fr移植和功能性效力测定驱动的序列诱变技术,我们基于鼠mab1901工程改造出一系列人源化形式。简而言之,抗体首先在大肠杆菌中表达为scfv,以对与tgfb3的结合进行初步筛选,并且然后在瞬时哺乳动物细胞系统中表达为全长人igg1或igg4抗体。对于对鼠1901与tgfb3的结合的阻断以及其抑制在报告基因细胞系中的tgfb诱导的信号传导的体外效力(tmlec测定),通过elisa筛选纯化的抗体。在两个实验室中独立地进行功能性效力测定。从此筛选中,选择在功能上抑制tmlec中的tgfb3信号传导的效力显著较高的四种igg4抗体:lcr1901_vh_1g10m
‑
lcr1901_vk_glv1_03(f)(1901
‑
1c)、lcr1901_vh_1g10m
‑
lcr1901_vk_glv1_05(h)(1901
‑
1a)、lcr1901_vh_1g10m_03(k)
‑
lcr1901_vk_glv1_03(f)(1901
‑
1d)和lcr1901_vh_1g10m_03(k)
‑
lcr1901_vk_glv1_05(h)(1901
‑
1b)用于扩展的体外表征,包括结合特异性、结合动力学、结构和物理化学特征,诸如小规模表达产率、sec谱和热稳定性。值得注意地,这些抗体比原始小鼠1901抗体更有效力,并且还具有与小鼠1901抗体相比不同的cdr序列。因此,已经产生了新的抗体,所述抗体是人源化的并且具有新颖且独特的重链和轻链cdr,并且所述抗体对tgf
‑
β3具有特异性。基于表征概况,选择抗体lcr1901_vh_1g10m_03(k)
‑
lcr1901_vk_glv1_05(h)(lcr1901
‑
1b)和抗体lcr1901_vh_1g10m
‑
lcr1901_vk_glv1_03(f)(lcr1901
‑
1c)用于进一步开发。
[0283]
以下提供了本文中用于该实施例和以下实施例的详细材料和方法:
[0284]
材料和方法
[0285]
将lcr1901作为scfv克隆到pchv101噬菌体展示载体中
[0286]
将亲本小鼠lcr1901抗tgfb3 mab及其人源化的cdr移植的glv1变体的vh和vk链设计和合成为单开放阅读框scfv并且克隆到噬菌粒载体(pchv101)中。
[0287]
如下消化scfv宿主载体以释放scfv插入物:
[0288][0289]
类似地消化pchv101噬菌粒载体:
[0290][0291][0292]
将消化物在37℃下孵育1h,并且在1%琼脂糖凝胶上电泳。使用zymoclean凝胶dna回收试剂盒(zymo research,目录号d4002)将插入物条带(约770bp)和线性化的pchv101载体(约4830bp)凝胶提取到20μl稀释在pcr级h2o中的温热(在65℃下预热)0.2x试剂盒洗脱缓冲剂(eb)中。
[0293]
使用以下进行连接,其中插入物:载体比率为3:1:
[0294][0295]
将连接物在室温下孵育20分钟,然后将5μl连接物混合物转移到50μl e.cloni感受态细胞中。将细胞/dna混合物在冰上孵育10min,然后添加75μl 2xtyg并且将125μl稀释的细胞划线在固体2xtyag选择性琼脂板上。对于琼脂板,名称t是指添加的胰蛋白胨,y是指添加的酵母提取物,g是指添加的葡萄糖,并且a是指添加的氨苄青霉素抗生素,其使用标准技术配方。将板在37℃下孵育过夜。
[0296]
将菌落挑入3ml液体2xtyag培养基中并且在37℃下孵育。使用真空pureyield质粒小量制备型系统快速方案(vacuum pureyield plasmid miniprep system quick protocol)(普洛麦格(promega),目录号fb093)制备克隆载体dna,并且使用引物pchv101_seqfor1(5
’‑
ctgaaaggaaggatatagaatgtgc
‑3’
)(seq id no:38)和pd1
‑
2(5
’‑
gtcgtctttccagacgttag
‑3’
)(seq id no:39)进行测序。
[0297]
噬菌体/scfv elisa
[0298]
将含有正确scfv序列的小量制备(miniprep)克隆电穿孔到大肠杆菌tg1细胞(lucigen,目录号60502
‑
1)中,并且铺板在选择性的2xtyag板上,并且在30℃下孵育18
‑
20h。
[0299]
将氨苄青霉素抗性菌落挑入填充有200μl 2xtyag的96孔u型底板(greinerbio
‑
one,目录号650201)中并且在30℃、750rpm、70%湿度下孵育过夜。然后根据以下方案将培养物用于scfv和噬菌体elisa:
[0300]
可溶性scfv的表达
[0301]
从过夜板中,将4μl培养物/孔转移到含有170μl/孔的补充有0.1%葡萄糖和100μg/ml氨苄青霉素的tb培养基的96孔u型底板中。使细菌在30℃、750rpm、70%湿度下生长4h。通过以下方式诱导scfv表达:添加20μl iptg(在tb培养基中稀释至1mm),以获得100μm的终浓度。在30℃、750rpm、70%湿度下过夜进行可溶性scfv的表达,持续16
‑
18h。
[0302]
scfv
‑
噬菌体的挽救
[0303]
从过夜板中,将3.5μl培养物/孔转移到含有100μl/孔的2xtyag的96孔u型底板中。使细菌在30℃、750rpm、70%湿度下生长4小时。为了挽救噬菌体颗粒,将100μl 2xtyag/m13ko7辅助噬菌体(英杰公司(invitrogen),目录号18311019)(稀释到10ml 2xtyag中的200μl m13ko7)(英杰公司,目录号18311019)添加到每个孔中,并且将板在37℃下静置1h。将感染的培养物(5μl/孔)转移到填充有200μl/孔的补充有50μg/ml的卡那霉素和100μg/ml的氨苄青霉素的2xty培养基的新96孔u型底板中。在30℃、750rpm、70%湿度下过夜进行展示scfv的噬菌体的挽救,持续16
‑
18h。
[0304]
elisa
[0305]
为了进行elisa,将96孔maxisorp nunc
‑
immunoplate(赛默飞世尔科技公司
(thermo scientific),目录号2022
‑
10)用50μl/孔的在pbs中500ng/ml的人重组tgf
‑
b1(acrobiosystems,目录号tg1
‑
h4212)、tgf
‑
b2(r&d systems,目录号302
‑
b2
‑
010)和人重组tgf
‑
b3(谢南多厄河生物技术公司(shenandoah biotechnology),目录号100
‑
109)在4℃下包被过夜。通过在不首先洗涤板的情况下直接添加230μl封闭溶液(在pbs中的5%脱脂乳/0.05%tween 20)将孔封闭。在轻轻搅拌下进行封闭45min。同时,通过直接添加120μl封闭溶液将含有表达的scfv和挽救的噬菌体的细菌培养物封闭。将封闭的maxisorp板用pbst(pbs 0.1%tween 20)洗涤3次,然后将150μl封闭的scfv或噬菌体培养物应用于孔。在轻轻搅拌下在室温下进行孵育1h,然后将孔用4x pbst洗涤。
[0306]
对于scfv elisa,将100μl在pbs 1%bsa中1/1000稀释的一级小鼠9e10抗cmyc ab添加到孔中,然后在室温下在轻轻搅拌下孵育1h。将板用pbst洗涤4次,然后添加100μl在pbs 1%bsa中1/10000稀释的二级山羊抗小鼠igg(fab)2hrp缀合物(sigma,目录号a9917)。将板在室温下在轻轻搅拌下孵育1h。通过添加100μl/孔的tmb底物(赛默飞世尔科技公司,目录号34021)将elisa进行显色,用50μl/孔的终止溶液(2n硫酸)稳定,并且在450nm和620nm处读取吸光度信号。
[0307]
对于噬菌体elisa,将100μl在pbs 1%bsa中1/1000稀释的一级兔抗fd细菌噬菌体ab(sigma,目录号b7786)添加到孔中,然后在室温下在轻轻搅拌下孵育1h。将板用pbst洗涤4次,然后添加100μl在pbs 1%bsa中1/15000稀释的二级小鼠抗兔igg(γ
‑
链特异性的)hrp缀合物(sigma,目录号a1949)。将板在室温下在轻轻搅拌下孵育1h,然后用pbst洗涤5次,然后用pbs洗涤2次。如上对于scfv板那样将elisa进行显色。
[0308]
克隆变体竞争筛选(glv2 vh文库)
[0309]
基于对公开的种系和专有数据库同源性的分析,设计lcr1901_glv1 vh cdr变体的小dna文库。由商业供应商合成vh dna文库,并且在切除glv1 vh链后,全体克隆到pchv101 lcr1901_glv1载体中。将包含glv1 vk和突变的vh cdr库的所得文库(称为pchv101 lcr1901_glv2)与亲本pchv101 lcr1901_glv1移植物载体一起电穿孔到大肠杆菌tg1细胞中。将细胞铺板到2xtyag上,并且在30℃下孵育18
‑
20h。
[0310]
第二天,将含有pchv101
‑
lcr1901_glv2文库克隆的新鲜tg1菌落挑入填充有200μl/孔的2xtyag培养基的96孔u型底板(greinerbio
‑
one,目录号650201)的第2
‑
11列中。类似地,将含有移植物亲本pchv101
‑
lcr1901_glv1载体的tg1菌落挑入第1列(无竞争对照)。第12列(背景对照)仅含有200μl/孔的2xtyag培养基。将板在30℃、750rpm、70%湿度下孵育过夜,以产生克隆母板。
[0311]
第二天,使用96针复制器(replicator)孵育具有来自母板的细胞的96孔表达板。表达板含有170μl/孔的补充有0.1%葡萄糖和100μg/ml氨苄青霉素的tb。使培养物在30℃、750rpm、70%湿度下生长6小时,然后通过添加50μl iptg(在tb培养基中0.45mm)以获得100μm的终浓度来诱导scfv表达。允许在30℃、750rpm、70%湿度下使scfv的表达进行过夜。同时,将96孔maxisorp板(thermo scientific,目录号2022
‑
10)用50μl/孔的在pbs中250ng/ml浓度的人重组tgf
‑
b3(shenandoah biotechnology,目录号100
‑
109)在4℃下过夜包被。
[0312]
第二天,将scfv表达板离心以沉淀细胞,并且从每个孔中将75μl scfv上清液转移到新鲜的非结合聚丙烯96孔u型底板的对应孔中。向这些样品中添加75μl大约200ng/ml浓度(在含有0.2%tween 20和2%bsa的pbs中制备的)的lcr1901_glv1 mab(igg1)竞争者抗
体以给出具有100ng/ml的竞争者mab的150μl终体积。此板称为
‘
竞争者稀释板’。
[0313]
在15min平衡时间段后,将230μl封闭溶液(0.05%tween 20,5%脱脂乳)直接添加到孔中。允许在轻轻搅拌下进行封闭45min。
[0314]
将tgf
‑
b3包被的maxisorp elisa板用pbst(pbs 0.1%tween 20)洗涤3次,并且从竞争者稀释板中添加100μl/孔的scfv/glv1 mab混合物。允许在室温下孵育持续1h。
[0315]
将maxisorp elisa板用pbst洗涤5次,并且通过添加100μl/孔的1/5000稀释(在pbs 0.1%tween 20中的1%bsa)的二级山羊抗人igg
‑
fc
‑
hrp缀合物抗体(sino biological,目录号ssa001)将elisa板进行显色。在室温下在轻轻搅拌下孵育1h后,添加100μl/孔的tmb底物(赛默飞世尔科技公司,目录号34021)。通过添加50μl/孔的2n硫酸使显色停止,并且在450nm和620nm处读取吸光度。
[0316]
克隆变体竞争筛选(vk回复体框架文库)
[0317]
将包含与lcr1901_glv1 vk链配对的lcr1901_1g10m vh链的scfv克隆用作起始点。对于每条链,研究亲本lcr1901小鼠框架(fr)区的贡献。对于每条链,合成三种变体,其中fr1、fr2或fr3被鼠亲本区域替代。通过顺序分批克隆到pchv101中将这六条链随机组合以产生含有一个或两个鼠fr区的scfv dna克隆的小群体。在电穿孔到tg1中后,表达scfv,并且如上对从2xtyag板中随机选择的80个克隆进行竞争筛选,在这种情况下,使用作为elisa竞争者的lcr1901鼠亲本mab以及抗鼠fc
‑
hrp二级显色试剂。
[0318]
将scfv vh和vk链重新转换为igg1/igg4
[0319]
用以下pcr引物混合物(工作储备液为10μm总寡核苷酸)扩增容纳在pchv101 scfv载体中的vh链。
[0320]
nco1 for池*
[0321][0322]
sal1 rev池
[0323][0324]
用以下pcr引物混合物(工作储备液为10μm总寡核苷酸)扩增容纳在pchv101 scfv载体中的vk链。
[0325]
bssh11 for池*
[0326][0327]
not1 rev池(κ)
[0328][0329]
如下设置pcr反应:
[0330]
vh
–
每个反应(50μl)
[0331]
1μl scfv小量制备(20
‑
30ng/μl)
[0332]
2μl vh_switch_for池(10μm总寡核苷酸)
[0333]
2μl hjsal_rev池(10μm总寡核苷酸)
[0334]
20μl pcr级h2o
[0335]
25μl 2x longamp taq主混合物(neb;#m0287)
[0336]
vk pcr
‑
每个反应(50ul)
[0337]
1μl pchv101 scfv小量制备(20
‑
30ng/μl)
[0338]
2μl vlk_switch_for池(10μm总寡核苷酸)
[0339]
2μl kjnot_rev池(10μm总寡核苷酸)
[0340]
20μl pcr级h2o
[0341]
25μl 2x longamp taq主混合物(neb;#m0287)
[0342]
pcr条件:[94℃
‑
30s]初始变性,然后是25个[94℃
‑
30s]、[60℃
‑
30s]、[65℃
‑
1min]循环;以及[65℃
‑
5min]的最后延伸步骤。将pcr产物通过dna清洁&浓缩器
‑
5tm(dna clean&concentrator
‑
5tm)(zymo research;#d4003)纯化到12μl稀释在pcr级h2o中的温热(在65℃下预热)的0.2x试剂盒洗脱缓冲剂(eb)中。
[0343]
如下消化纯化的pcr:
[0344][0345][0346][0347]
如下消化igg表达载体:
[0348]
[0349][0350][0351]
在37℃下进行消化1
‑
2h。将纯化的pcr产物通过dna清洁&浓缩器
‑
5tm(试剂盒(zymo research;#d4003)纯化到20μl稀释在pcr级h2o中的温热(在65℃下预热)的0.2x试剂盒洗脱缓冲剂(eb)中。将消化的载体在0.9%琼脂糖凝胶上电泳分解,并且使用zymoclean凝胶dna回收试剂盒(zymo research,目录号d4002)将对应的线性化的载体条带凝胶提取到30μl稀释的eb中。
[0352]
以3:1的插入物:载体摩尔比率进行连接,
[0353][0354][0355]
在室温下2h并且在16℃下过夜进行连接。将连接混合物(2μl)与50μl e.cloni感受态细胞(在内部制备)组合,并且在冰上孵育10min。在75μl 2xtyg中稀释后,将转化的细胞划线到选择性2xtyag板上,并且在37℃下孵育过夜。典型地,将每种构建体的4个菌落挑入3ml 2xtyag培养基中,并且在37℃下生长过夜。使用真空pureyield质粒小量制备型系统快速方案(普洛麦格,目录号fb093)制备质粒小量制备,并且通过使用用于vh链的引物pd1
‑
5(5
’‑
gaggatttgatattcacctgg
‑3’
)(seq id no:54)和用于vk链的引物pd1
‑
91(5
’‑
gaattcgatcaggactgaacagag
‑3’
)(seq id no:55)测序来确定的插入物。对于正确的表达载体克隆链,使用50ml在2xtyag中在37℃下生长的过夜培养物和zymopure
tm
质粒中量制备(midiprep)试剂盒(普洛麦格,目录号d4201)制备用于hek细胞转染的载体中量制备。
[0356]
抗体表达
‑
通用
[0357]
使用hek293
‑
6e/ptt瞬时表达系统(加拿大国家研究委员会(national research council of canada);经许可获得)通过瞬时转染完成蛋白质表达。在无挡板振荡爱伦美氏培养瓶(triforest,目录号fpc0125s
‑
k)中在120rpm、37℃和5%co2下生长细胞。使用含有
4mm glutamax、0.1%f
‑
68和25μg/ml g418的f17培养基使用于转染的细胞生长至1
×
106个细胞/ml的细胞密度。
[0358]
转染程序如下:将45ml密度约1.0x 106个细胞/ml的hek293
‑
6e细胞(活力>97%)转移到250ml烧瓶中。对于每种所需的表达培养物,将25μg表达载体中量制备dna(对于每个vk和vh链配对为12.5μg)添加到15ml falcon管中。将一定体积的转染培养基(仅f17培养基)添加到管中以给出5ml终体积,并且通过移液将溶液轻轻混合。向单独的空的15ml falcon管中添加37.5μl纯的[纯净的]fectopro
tm
(sa,目录号116
‑
010)。将5ml稀释的dna小心地添加到fectopro
tm
试剂中,并且通过移液将溶液混合。在室温下孵育20min后,将dna
‑
fectopro
tm
混合物添加到含有细胞的250ml烧瓶中,并且轻轻旋转以进行混合。将烧瓶立即转移到含有5%co2的37℃加湿的振荡培养箱(120rpm)中。5天后,通过将细胞以2500g离心3min并且将澄清的培养基转移到新鲜的50ml falcon管中来收获表达上清液。
[0359]
igg抗体纯化
[0360]
在akta pure蛋白质纯化系统25l(通用电气医疗集团(ge healthcare))上使用5ml hitrap mab select蛋白质a柱(通用电气医疗集团,目录号11003494)纯化igg1和igg4抗体。将柱用pbs平衡。在以5ml/min的流速负载样品后,将柱用pbs洗涤以去除未结合的蛋白质。用0.1m柠檬酸盐ph 3.2以3ml/min的流速洗脱抗体,并且用tris中和,然后用pbs(15ml slide
‑
a
‑
lyzer g2透析盒,10k mwco;赛默飞世尔科技公司,目录号87731)进行过夜透析。然后通过离心(vivaspin 20,50kda mwco;通用电气医疗集团,目录号28932362)浓缩蛋白质。
[0361]
抗体表达
‑
2ml规模[产率分析]
[0362]
如下使用2ml转染培养物确定igg4抗体产率分析:将约1.0x106个细胞(活力>97%)转移到12孔板的每个孔中,并且添加f17完全培养基以给出1ml的终体积。对于每种表达培养物,将0.5μg表达载体中量制备dna(每条链0.25μg)转移到1.5ml eppendorf管中,然后转移100μl f17培养基。通过移液将溶液充分混合,并且将溶液立即转移到含有0.75μl纯的[纯净的]fectopro纯净的单独eppendorf管中。将转染混合物在室温下孵育20分钟,然后小心地添加到含有细胞的孔中。轻轻旋转样品以进行混合,并且将板立即转移到含有5%co2的37℃加湿的振荡培养箱(120rpm)中。5天后收获表达培养基。一式三份单独地转染每种抗体,以评估在系统中的对比粗表达产率。
[0363]
fab抗体纯化
[0364]
在akta pure蛋白质纯化系统25l(通用电气医疗集团)上使用5ml histrap excel柱(通用电气医疗集团,目录号17
‑
3712
‑
05)纯化带his标签的fab抗体。用imac洗涤缓冲剂ph 7.5(50mm tris、0.5mm nacl、10mm咪唑)将柱平衡。在以1ml/min的流速负载样品后,将柱首先用imac洗涤缓冲剂洗涤并且然后用imac洗脱缓冲剂ph 7.5(50mm tris、0.5mm nacl、300mm咪唑)洗涤。以1ml/min的流速洗脱蛋白质,并且然后用pbs(15ml slide
‑
a
‑
lyzer g2透析盒,10k mwco;赛默飞世尔科技公司,目录号87731)进行过夜透析。然后通过离心(vivaspin 20,10kda mwco;通用电气医疗集团,目录号28932360)浓缩蛋白质。
[0365]
尺寸排阻色谱法和sds
‑
page凝胶分析
[0366]
通过定性尺寸排阻色谱法(sec)使用superdex 200increase 5/150gl柱(通用电
气医疗集团,目录号28
‑
9909
‑
45)检查抗体的单分散性/聚集状态。将柱在pbs中平衡,然后以0.3ml/min的流速负载100μl样品。
[0367]
通过还原和非还原sds
‑
page使用4%
‑
12%bis
‑
tris蛋白凝胶(赛默飞世尔生命技术公司,目录号np0321box)检查抗体的大小和质量。使用mops缓冲剂作为运行缓冲剂(赛默飞世尔生命技术公司目录号)。将5μg每种抗体与5μl lds
‑
样品缓冲剂(赛默飞世尔生命技术公司目录号) /
‑
2μl样品还原缓冲剂混合。在负载之前,将样品在70℃下加热10分钟。通过用instantblue(expedeon,目录号isb1l)染色来显色凝胶。
[0368]
热移位测定
[0369]
使用蛋白质热移位测定使用7500型快速实时pcr仪器(应用生物系统公司(applied biosystem))评价抗tgf
‑
β3抗体的热稳定性。所述测定涉及将抗体与蛋白质热移位
tm
(protein thermal shift
tm
)染料混合,并且施加受控的加热斜坡。随着蛋白质开始变性,染料与暴露的疏水区相互作用并且发出更强的荧光,从而建立一个或多个转变温度。
[0370]
如下制备样品:
[0371][0372]
在7500型快速rt
‑
pcr机器上的实验设置:
[0373][0374]
通过7500型仪器软件使用一阶导数相对于温度的图计算出tm。
[0375]
tmlec功能中和
[0376]
本测定基于含有萤光素酶报告基因的tmlec细胞(转染的貂肺上皮细胞),如abe m等人analytical biochemistry 1994,216:276
‑
284所述。将细胞系在实验室中多次亚克隆,并且将亚克隆20用于这些测定中。在8%co2下在补充有10%fcs和aag(0.55mm l
‑
精氨酸、0.24mm l
‑
天冬酰胺、1.5mm l
‑
谷氨酰胺和400ug/ml g418)的dmem中培养细胞。
[0377]
将tgfb
±
抗体稀释液在96孔板中在37
°
下孵育4小时。然后将100ul此<<混合物>>转移到含有在100ul的以上培养基中的5x 10x 4tmlec细胞/孔)的适用于萤光素酶活性计数的96孔平底不透明elisa板中,并且在孔中培养至少1h。
[0378]
所有tgfβ同种型均以500pg/ml的终浓度使用。抗体稀释通常开始于30ug/ml。将板孵育20
‑
24h。然后将100ul孔内容物小心地移除并且用100ul稀释在perkin
‑
elmer ultra
‑
brite萤光素酶试剂盒的裂解缓冲剂中的萤光素酶底物替代。立即在生物发光elisa读取器中定量萤光素酶活性。
[0379]
igg4 mab的竞争性结合(相对于生物素化的鼠lcr1910亲本)
[0380]
将nunc maxisorb elisa板在8℃下用0.5μg/ml htgf
‑
β1(peter sun,nih)或htgf
‑
β3(shenandoah biotech)(在40mm甘氨酸缓冲剂ph 9中0.5μg/ml)过夜包被。将板洗
涤并且在37℃下用10%fcs封闭1h。在单独的低结合性greiner bio
‑
one elisa板中,将各种浓度的竞争ab与恒定浓度的生物素化的亲本13a1或1901(在pbs bsa(10mg/ml)中200ng/ml)混合并且然后转移到tgf
‑
β包被的nunc maxisorb elisa板上。在37℃下孵育2h后,将板洗涤,添加亲和素
‑
hrp,并且在37℃下孵育1h。将板再次洗涤,添加tmb底物,并且通过在elisa读取器中在450nm的波长处测量显色来定量结合的生物素化的抗体。
[0381]
实施例3
[0382]
将鼠1901抗体重新转换为scfv并且移植
[0383]
将鼠抗体1901vh和vl重新转换为scfv(lcr1901_scfv),在大肠杆菌中表达并且验证结合特异性
[0384]
合成如图1所描述的小鼠抗体1901vh和vl结构域核苷酸序列(分别为seq id no:9和11),以在大肠杆菌中表达为scfv。scfv转换为取向vk
‑
接头
‑
vh。在此阶段掺入微小点突变(vk:52
‑
54agg>cga和181
‑
183cgc>cgg;vh:118
‑
120agg>cgt和292
‑
297agaagg>cgtcgc),以便交换阅读框中的稀有arg密码子,从而潜在地改善在大肠杆菌中的表达。随后,将scfv克隆到专有的噬菌粒载体pchv101中,所述专有的噬菌粒载体允许所述分子从大肠杆菌中双重表达和分泌为游离的scfv(lcr1901_scfv)或与丝状细菌噬菌体(lcr1901_噬菌体)的piii外壳蛋白的融合体。两种表达方式在elisa中均保留了与表面固定的重组人tgfb3的强且特异性的结合(图2)。
[0385]
选择人vh用于移植
[0386]
从imgt参考目录(imgt.org)和内部igm/d序列数据库中选择ighv1
‑
69*08,作为最接近的全局人同源种系vh序列。
[0387]
选择人vl用于移植
[0388]
从imgt参考目录(imgt.org)和内部igm/d序列数据库中选择igkv1
‑
39*01,作为最接近的全局人同源种系vl序列。
[0389]
将鼠cdr移植到人vh和vl框架上,表达为scfv并且验证结合特异性
[0390]
将六个鼠cdr(轻链cdr:cdr1 kasqsvinava(seq id no:4)、cdr2 yasrnyt(seq id no:5)和cdr3 qqdysspyt(seq id no:6);和重链cdr:cdr1 ssswih(seq id no:26)、cdr2 riypgdgdtnytgkfk(seq id no:27)和cdr3 rmittqaamd(seq id no:3)移植到相应的人vh和vk框架和韦尼耶区上,并且最初表达为scfv。scfv转换为取向vk
‑
接头
‑
vh。通过geneart(赛默飞世尔科技公司)合成scfv核苷酸序列,并且克隆到pchv101噬菌粒中,然后在大肠杆菌中表达scfv(1901_glv1_scfv)。图3示出了鼠和移植的1901scfv构建体(分别为seq id no:13和14)的氨基酸序列比对。六个cdr以粗体表示。将鼠cdr区移植到选择的人vk和vh框架区保留了对tgfb3的结合特异性(图4)。
[0391]
从scfv重新转换为人igg1,在hek293细胞中表达并且验证结合特异性
[0392]
通过与容纳在离散的基于ptt5的哺乳动物表达载体中的其相应的重链和轻链人构建体结构域融合将人vk和vh链重新转换。使用小规模hek293
‑
6e悬浮细胞培养物通过瞬时共转染将所得igg1异二聚体表达到培养基中。使含有移植的抗体以及鼠嵌合体(与人igg1 fc融合的小鼠可变结构域)抗体的上清液与原始纯化的亲本鼠抗体1901一起经受tgfβ特异性elisa。嵌合的和移植的人igg1 1901抗体两者均保留了对tgfb3的结合特异性(图5)。
[0393]
实施例4
[0394]
序列分析和引入的突变
[0395]
通过诱变鉴定和修正lcr1901_glv1中潜在的cdr序列不利因素
[0396]
使vh和vk链两者的lcr1901_glv1 cdr序列经受相对于imgt可变结构域参考集合(imgt.org)和包含从健康供体的外周血中获得的约600万个翻译的igm/igd vh读段的专有数据库两者的blast同源性分析。鉴定一系列残基,所述残基可能包括潜在的理化发展风险或当与在得分最高的cdr/j同源性的比对中在相同位置的人残基(人共有残基)一起考虑时是错配/稀有的(图6)。构建用于建议的cdr vh变体的小排列文库,并且在elisa中测试scfv构建体与lcr1901_glv1的竞争性结合。另外,产生小的变换的vk突变体文库,并且与以上vh突变体文库的命中组合。图6总结了基于竞争性结合测定,具有潜在序列不利因素的建议的cdr和连接残基、其建议的人共有残基修正以及对最终选择的残基的验证。所得vh称为lcr1901_vh_1g10(seq id no:17)(图7)。lcr1901_vh_1g10中的cdr包含相对于原始1901抗体的改变,并且对应于以下vh cdr:cdr1 gytfssswih(seq id no:28)、cdr2 wigriypgdgdtdysekfq seq id no:29)和cdr3 arrmittqaal(seq id no:30)(相对于亲本1901抗体改变的在cdr中的氨基酸残基是带下划线的)。
[0397]
lcr1901_vh_1g10中的另外的突变
[0398]
fr4中连接区中的残基s123突变为l123,以修正为hu ighj4。所得vh称为lcr1901_vh_1g10m(seq id no:17)(图7)。lcr1901的vh链中的fr2被鉴定为对于保持抗体的中和效力至关重要。随后,fr2中的三个残基回复突变为原始鼠残基(r43>k43;a45>r45;和q48>k48),并且所得vh称为lcr1901_vh_1g10m_glv1_03(k)(seq id no:19)(图7)。在替代vh序列中,fr2区中仅一个残基回复突变为原始鼠残基(q48>k48),并且所得vh称为lcr1901_vh
‑
1g10m_02(j)(seq id no:36)。lcr1901_vh_1g10m和lcr1901_vh_1g10m_glv1_03(k)(以及还有lcr1901_vh
‑
1g10m_02(j))重链保留了lcr1901_vh_1g10的改变且变体的cdr(以上指出的seq id no:28
‑
30)。
[0399]
lcr1901_vk_glv1 fr区中的另外的突变
[0400]
fr4中连接区中的残基l124突变为v124,以修正为hu igkj4。所得vk称为lcr1901_vk_glv1(seq id no:21)(图8)。lcr1901的vk链中的fr3和在较低程度上fr2被鉴定为对于保持抗体的中和效力至关重要。fr反向点突变与vh
‑
vk链配对实验的组合鉴定了具有比lcr1901_vk_glv1更高的tgfb3中和效力的vk链(图8),其描述如下:
[0401]
lcr1901_vk_glv1_03(f)(seq id no:22)(图8)在fr2中具有两个向原始鼠残基的回复突变(k48>q48和a49>s49)并且在fr3中具有五个向原始鼠残基的回复突变(s74>d74;s83>y83;l89>f89;p96>a96和t101>v101)。另外,在fr3中,f99被调节为v99,以得到比“全局”igkv1
‑
39*01初始移植物更好的人“局部”匹配(igkv4
‑
1*01)。
[0402]
lcr1901_vk_glv1_05(h)(seq id no:23)(图8)在fr3中具有五个向原始鼠残基的回复突变(s74>d74;s83>y83;l89>f89;p96>a96和t101>v101)。另外,在fr3中,f99被调节为v99,以得到比“全局”igkv1
‑
39*01初始移植物更好的人局部匹配(igkv4
‑
1*01)。
[0403]
lcr1901_vk_glv1、lcr1901_vk_glv1_03(f)和lcr1901_vk_glv1_05(h)保留了在图8中以粗体表示的1901vl cdr:cdr1 kasqsvinavawy(seq id no:31)、cdr2 lliyyasnryt(seq id no:32)和cdr3 qqdysspy(seq id no:33)。
[0404]
lcr1901 vh vk变体的人种系同源性
[0405]
使用imgt数据库(imgt.org)对lcr1901 vh和vk进行全局比对分析,并且对每条链确定对应的人种系同源性。每条链的种系同源性均超过80%(范围为81%
‑
87%)(图9)。
[0406]
实施例5
[0407]
呈人igg4形式的抗体变体的表达
[0408]
将lcr1901抗体变体重新转换为人igg4(s228p)抗体,并且以人igg4形式表达。出于此目的,选择人ighg4*01作为人ig恒定重链,将其进一步修饰以调适s228p突变,所述突变在本领域中已被公认和显示会稳定潜在的fab
‑
臂交换的抗体(silva等人,j biol chem.2015年2月27日;290(9):5462
‑
9)。选择人ck*01作为人ig恒定轻链。使用小规模hek293
‑
6e悬浮细胞培养物通过重链和轻链载体的瞬时共转染将igg4异二聚体表达到培养基中,并且然后通过蛋白质a亲和色谱法进行纯化。
[0409]
四种lcr1901 igg4变体的蛋白质序列如下图10
‑
13所示:
[0410]
图10中提供了lcr1901_vh_1g10m
‑
lcr1901_vk_glv1_03(f),也表示为1901
‑
1c。1901
‑
1c抗体包含重链序列lcr1901_vh_1g10m(seq id no:18)和轻链序列lcr1901_vk_glv1_03(f)(seq id no:22)。
[0411]
图11中提供了lcr1901_vh_1g10m
‑
lcr1901_vk_glv1_05(h),也表示为1901
‑
1a。1901
‑
1a抗体包含重链序列lcr1901_vh_1g10m(seq id no:18)和轻链序列lcr1901_vk_glv1_05(h)(seq id no:23)。
[0412]
图12中提供了lcr1901_vh_1g10m_03(k)
‑
lcr1901_vk_glv1_03(f),也表示为1901
‑
1d。1901
‑
1d抗体包含重链序列lcr1901_vh_1g10m_03(k)(seq id no:19)和轻链序列lcr1901_vk_glv1_03(f)(seq id no:22)。
[0413]
并且图13中提供了lcr1901_vh_1g10m_03(k)
‑
lcr1901_vk_glv1_05(h),也表示为1901
‑
1b。1901
‑
1b抗体包含重链序列lcr1901_vh_1g10m_03(k)(seq id no:19)和轻链序列lcr1901_vk_glv1_05(h)(seq id no:23)。
[0414]
实施例6
[0415]
变体的预测堆叠角度
[0416]
通过计算机模拟使用paps(bioinf.org.uk/abs/paps)预测lcr1901 vh和vk变体中的每一种的相应抗体的堆叠扭转角度。初始cdr移植物(1901_vh_glv1/1901_vk_glv1)和随后的高活性突变体变体的预测值非常相似,并且与原始1901鼠抗体明显不同(图14)。
[0417]
实施例7
[0418]
抗体中和tgfb信号传导的效力
[0419]
使用tmlec报告基因细胞在tmlec报告基因细胞测定中通过评估tgfb同种型特异性信号传导的中和来确定lcr1901 igg4抗体中和tgfb信号传导的效力。四种igg4变体lcr1901_vh_1g10m
‑
lcr1901_vk_glv1_03(f)(1901
‑
1c)、lcr1901_vh_1g10m
‑
lcr1901_vk_glv1_05(h)(1901
‑
1a)、lcr1901_vh_1g10m_03(k)
‑
lcr1901_vk_glv1_03(f)(1901
‑
1d)和lcr1901_vh_1g10m_03(k)
‑
lcr1901_vk_glv1_05(h)(1901
‑
1b)在以剂量依赖性方式中和tgfb3诱导的萤光素酶报告基因产物表达方面是高度有效力的。所有四种lcr1901变体在中和tmlec细胞中的tgfb3信号传导方面都比亲本鼠抗体1901更有效力(图15和图16)。
[0420]
另外,产生具有vh序列lcr1901_vh_1g10m_02(j)(seq id no:36)和vl序列
lcr1901_vk_glv1_03(f)(seq id no:22)的lcr1901变体抗体,并且测试在tmlec细胞中的tgfb3信号传导并且发现在中和方面是有效的(数据未示出)。
[0421]
实施例8
[0422]
tgfb同种型特异性
[0423]
在tmlec报告基因测定中评估lcr1901 igg4变体的tgfb同种型特异性。测试四种igg4变体lcr1901_vh_1g10m
‑
lcr1901_vk_glv1_03(f)(1901
‑
1c)、lcr1901_vh_1g10m
‑
lcr1901_vk_glv1_05(h)(1901
‑
1a)、lcr1901_vh_1g10m_03(k)
‑
lcr1901_vk_glv1_03(f)(1901
‑
1d)和lcr1901_vh_1g10m_03(k)
‑
lcr1901_vk_glv1_05(h)(1901
‑
1b),并且显示高度选择性中和tgfb3同种型诱导的信号传导,但不中和tgfb1和tgfb2同种型诱导的萤光素酶报告基因产物的表达(图17)。
[0424]
实施例9
[0425]
竞争性结合和结合动力学
[0426]
通过elisa评估人源化lcr1901 igg4抗体变体与亲本鼠抗体竞争结合至tgfb3的效力。四种igg4变体lcr1901_vh_1g10m
‑
lcr1901_vk_glv1_03(f)(1901
‑
1c)、lcr1901_vh_1g10m
‑
lcr1901_vk_glv1_05(h)(1901
‑
1a)、lcr1901_vh_1g10m_03(k)
‑
lcr1901_vk_glv1_03(f)(1901
‑
1d)和lcr1901_vh_1g10m_03(k)
‑
lcr1901_vk_glv1_05(h)(1901
‑
1b)以剂量依赖性方式与亲本鼠1901抗体竞争结合至tgfb3(图18)。
[0427]
lcr1901单价fab抗体的特征和结合动力学
[0428]
四种igg4变体lcr1901_vh_1g10m
‑
lcr1901_vk_glv1_03(f)(1901
‑
1c)、lcr1901_vh_1g10m
‑
lcr1901_vk_glv1_05(h)(1901
‑
1a)、lcr1901_vh_1g10m_03(k)
‑
lcr1901_vk_glv1_03(f)(1901
‑
1d)和lcr1901_vh_1g10m_03(k)
‑
lcr1901_vk_glv1_05(h)(1901
‑
1b)表达为稳定的fab,并且使用等离振子表面共振(biacore)评估与tgfb的结合动力学。fab结合elisa数据总结在图19中,并且代表性biacore结合谱示出在图20中。fab的结合亲和力在pm范围内。
[0429]
实施例10
[0430]
人源化抗体的另外表征
[0431]
sec谱分析:使用分析型尺寸排阻色谱法(sec)评估四种igg4变体lcr1901_vh_1g10m
‑
lcr1901_vk_glv1_03(f)(1901
‑
1c)、lcr1901_vh_1g10m
‑
lcr1901_vk_glv1_05(h)(1901
‑
1a)、lcr1901_vh_1g10m_03(k)
‑
lcr1901_vk_glv1_03(f)(1901
‑
1d)和lcr1901_vh_1g10m_03(k)
‑
lcr1901_vk_glv1_05(h)(1901
‑
1b)的分子完整性(未表述)。四种lcr1901 igg4抗体展示出相似的洗脱行为。没有观察到片段化或峰扩散的迹象,并且聚集水平低,表明igg4抗体是稳定的并且是分子上均质的。典型的sec谱示出在图21中。
[0432]
热稳定性:使用差示扫描荧光测定法(dsf)评估四种igg4变体lcr1901_vh_1g10m
‑
lcr1901_vk_glv1_03(f)(1901
‑
1c)、lcr1901_vh_1g10m
‑
lcr1901_vk_glv1_05(h)(1901
‑
1a)、lcr1901_vh_1g10m_03(k)
‑
lcr1901_vk_glv1_03(f)(1901
‑
1d)和lcr1901_vh_1g10m_03(k)
‑
lcr1901_vk_glv1_05(h)(1901
‑
1b)对热应力的相对分子稳定性。四种lcr1901 igg4变体显示出2
‑
转变非合作结构域熔解曲线,具有特征性的较早igg4ch2结构域去折叠(tm1)。fab结构域的去折叠以转变2表示(图22和图23)。
[0433]
放大表达产率:使用在单一哺乳动物细胞系统(2ml规模)中的瞬时表达评估四种
igg4变体lcr1901_vh_1g10m
‑
lcr1901_vk_glv1_03(f)(1901
‑
1c)、lcr1901_vh_1g10m
‑
lcr1901_vk_glv1_05(h)(1901
‑
1a)、lcr1901_vh_1g10m_03(k)
‑
lcr1901_vk_glv1_03(f)(1901
‑
1d)和lcr1901_vh_1g10m_03(k)
‑
lcr1901_vk_glv1_05(h)(1901
‑
1b)对于潜在的更大规模表达的适合性。发现这四种lcr1901 igg4变体在瞬时单一哺乳动物细胞系统中高效地表达。表达产率总结在图24中。
[0434]
实施例11
[0435]
经基因工程改造的表达针对细胞表面蛋白的嵌合抗原受体(car)的t细胞在癌症疗法中的应用和用途为各种癌症提供了一种新的且改善的方式。在某些情况下,经修饰以仅表达嵌合抗原受体(car)的t细胞在敌对的肿瘤微环境中受到抑制,这可能限制car t细胞在一些临床适应症中的功效。例如,免疫抑制细胞因子(诸如il
‑
6、il
‑
10和tgf
‑
β)可以为肿瘤生长提供有利的环境,并且还抑制内源性t细胞以及car t细胞的杀肿瘤活性。研究显示,对tgfβ受体的抑制可以通过抑制tgfβ对微环境的免疫抑制作用来加强car t细胞活性(vong q等人(2017)blood 130:1791)。
[0436]
我们寻求评价tgfb3特异性抗体抵消tgfb3介导的对car t细胞活性的抑制的作用和功效。针对人肺癌细胞评估针对间皮素的car t细胞。评价针对表皮生长因子受体(egfr)的car t细胞对人乳腺癌细胞的杀伤。
[0437]
在肺癌研究中,用抗间皮素car(hp4;描述在us 2014301993 a1中)转染原代人t细胞。添加t细胞和tgfb3,并且评价对靶meso h
‑
226人肺癌细胞的杀伤。评估tgfb3抗体1901
‑
1b的添加对细胞杀伤的作用。单独的car t细胞会杀伤meso 肺靶细胞。在tgfb3的存在下,细胞杀伤被显著抑制。添加tgfb3特异性抗体后,tgfb3介导的对细胞杀伤的抑制消失。抗体1901
‑
1b即使在低浓度(≤50ng/ml)下也是高度有效力的。结果描绘在图25中,示出了通过人源化mab 1901
‑
1b体外挽救tgfb3介导的对抗msln car
‑
t靶细胞杀伤的抑制。
[0438]
用针对egfr和人乳腺癌细胞的car t细胞进行类似的研究。用抗egfr car(scfv帕尼单抗)转染原代人t细胞(cd3/cd28激活和扩增的外周血单核细胞(pbmc))。添加car t细胞和tgfb3,并且评价对靶egfr mda
‑
mb
‑
231人乳腺癌细胞的杀伤。评估tgfb3抗体1901
‑
1b的添加对细胞杀伤的作用。单独的car t细胞会杀伤egfr 乳腺癌靶细胞。在tgfb3的存在下,细胞杀伤被显著抑制。添加tgfb3特异性抗体1901
‑
1b后,tgfb3介导的对细胞杀伤的抑制消失。结果描绘在图26中,示出了通过人源化mab 1901
‑
1b体外挽救tgfb3介导的对抗egfr car
‑
t靶细胞杀伤的抑制。
[0439]
因此,已经在两种不同的癌细胞模型系统中证明,可以通过施用tgfb3同种型特异性mab 1901
‑
1b逆转tgfb3对原代car t细胞杀伤的抑制(表示预期的内源性tgfb3对细胞疗法的抑制)。
[0440]
方法
[0441]
靶细胞系和原代效应细胞:将人内源性抗原阳性靶细胞系h226(肺癌,msln
,crl
‑
5826
tm
)和mda
‑
mb
‑
231(乳腺癌,egfr
,htb
‑
26
tm
)保持在含有10%胎牛血清(fbs)和100iu/ml浓度的pen/strep的rpmi
‑
1640glutamax(gibco brl生命技术公司,inc.,盖瑟斯堡,马里兰州)中。将细胞保持在37℃的含有5%二氧化碳(co2)的加湿的气氛中。
[0442]
从(区域间输血(interregional blood transfusion)src,瑞士)血库获得来自健
康志愿者的血沉棕黄层。使用淋巴细胞分离剂(lymphoprep)(axonlab)通过密度离心从新鲜的血沉棕黄层中分离出外周血单核细胞(pbmc)。
[0443]
car修饰的t细胞的产生:将car表达盒容纳在prrl慢病毒载体骨架中。元件的组织是其中scfv附加至hcd28[细胞外间隔区、tm、和信号传导结构域]和hcd3ζ的第二代car的典型特征。在cd3ζ下游以直接融合掺入单体gfp以允许直接评估转染效率。基于专利us 2014301993 a1产生用于抗msln car的hp4 scfv。从公开的帕尼单抗序列(wo 2012138997)逆向工程改造抗egfr scfv。
[0444]
通过使用turbofect转染试剂(生命技术公司)用prrl
‑
car和包装质粒(pcmvr8.74和pmd2.g;didier trono实验室,epfl)瞬时共转染hek293t生产细胞来进行病毒生产。在48h后收获含有病毒的上清液,并且通过超速离心进行浓缩。
[0445]
将pbmc铺板(0.5x 106/孔)在已用cd3克隆okt3(1μg/ml;赛默飞世尔)和cd28克隆cd28.2(2μg/ml;赛默飞世尔)抗人抗体预包被的非组织培养处理的24孔板中。将细胞在补充有10%fbs和人重组人il2(50iu/ml,glaxo imb)的完全培养基rpmi
‑
1640 glutamax(赛默飞世尔)中培养2天。在第3天,使用新鲜制备的慢病毒上清液来转导cd3/cd28激活的pbmc,并且将它们保持在补充有人重组人il2(50iu/ml,glaxo imb)的完全培养基中持续另外2天。在第5天,向扩增的pbmc中补充含有10ng/ml的il
‑
7和il
‑
15(miltenyi biotec公司)的完全培养基,并且在37℃、5%co2下孵育1
‑
2周,直到它们被用于杀伤测定。随后,细胞分裂并且每2
‑
3天用新鲜培养基加il
‑
7/il
‑
15饲喂。基于gfp
细胞的比例确定约40%(抗msln car)和约50%(抗egfr car)的转染效率。
[0446]
动力学细胞毒性测定:将h226靶细胞(100μl/孔)以在完全培养基中0.015x106个细胞/ml的密度接种在96孔板中。第二天,细胞密度已达到0.02x106个细胞/孔。去除上清液,并且将50μl(500nm)的cytotoxred死细胞染色试剂(incucyte,essen bioscience)添加到每个孔中。将在完全培养基中的效应抗msln car细胞(2x106个细胞/ml)与1μl储备tgfβ3(milan analytica ag;500ng/ml)组合以给出2ng/ml的浓度或不处理。将经处理/未经处理的car细胞(50μl)添加到每个孔中,导致5:1e:t比率 /
‑
1ng/ml tgfβ3。通过其在500ng/ml的终浓度下的共包合(co
‑
inclusion)来确定higg4 1901_1b抗体的抗tgfβ3中和(逆转)潜力。将板返回培养箱中持续30min,以允许组合的细胞和染料沉降和平衡,然后转移至incucyte系统中持续3天。细胞死亡监测为红色荧光的增加,并且用综合分析软件(incucyte,zoom2016a)进行分析。使用每个图像数据的总红色图像积分强度来确定杀伤斜率。
[0447]
类似地确定针对mda
‑
mb
‑
231的抗egfr car介导的杀伤,但是,在这种情况下,在用1μm的cytolight rapidred细胞质染色染料(essen bioscience)铺板之前24h将靶细胞预染色。将染色的细胞以在完全培养基中0.015x106个细胞/ml的密度接种在96孔板中。第二天,细胞密度已达到0.02x106个细胞/孔。去除上清液,并且添加100μl/孔的效应抗egfr car细胞(2x106个细胞/ml) /
‑
1ng/ml tgfβ3以达到5:1e:t比率。通过其在500ng/ml的终浓度下的共包合来确定higg4 1901_1b抗体的抗tgfb3中和(逆转)潜力。将板返回培养箱中持续30min以进行平衡,然后转移至incucyte系统中持续3天。细胞死亡监测为降低的染色靶细胞红色荧光计数,并且用综合分析软件(incucyte,zoom2016a)进行分析。使用归一化的总红色对象面积(total red object area)(μm2/孔)数据确定动力学进程曲线。
[0448]
实施例12
[0449]
进行研究以证明变体tgf
‑
β3抗体可以被转导到t细胞中并且被分泌。用编码具有用于分泌的n末端信号序列的抗tgf
‑
β3抗体的载体转染t细胞。t细胞(jurkat)表达和分泌抗体,所述抗体是活性的并且结合靶tgf
‑
β3。
[0450]
方法
[0451]
用抗tgfβscfv
‑
fc融合物构建体转染jurkat:为了评价潜在的t细胞分泌,用含有具有n末端分泌通路信号序列的抗tgfβ3(1901_1b)scfv
‑
fc(higg4)开放阅读框的基于prrl的慢病毒载体(origin:didier trono实验室,epfl)转染jurkat t细胞。对照包括未转染的或无关的同种型对照转染的scfv
‑
fc。转染后一周,将细胞以2x 106个细胞/ml的密度铺板在6孔板中,并且在含有10%fbs的rpmi中在37℃、5%co2下培养24h。然后通过离心将细胞轻轻沉淀,并且收集上清液用于随后的elisa。
[0452]
酶联免疫吸附测定(elisa):将96孔板(nunc maxisorp,赛默飞世尔科技公司,#442404)用100μl在pbs中0.5μg/ml浓度的tgfβ3(milan analytica,#002003)在4℃下过夜包被。第二天,将板在轻轻搅拌下用230μl 5%脱脂乳/pbst(在pbs中的0.1%tween)直接封闭1h。在封闭后,将板用pbst洗涤3次,并且添加100μl jurkat上清液(用在pbst中的1%bsa稀释)以允许任何分泌的抗tgfβ3scfv
‑
fc与板结合的tgfβ3抗原结合。在室温下在轻轻搅拌下孵育1h。将孔用pbst洗涤3次,并且在轻轻搅拌1h下以0.2μg/ml的浓度添加100μl hrp缀合的二级抗体山羊抗人igg
‑
fc
‑
hrp(sino biological,#ssa001
‑
200)。然后,将板用pbst洗涤5次并且用pbs洗涤2次。在洗涤步骤后,用tmb底物试剂(biolegend,#34029)显色出比色读数,并且用2n硫酸稳定。在biotek synergy读板仪上在450nm和620nm处测量吸光度。
[0453]
jurkat分泌的抗tgfβ3抗体(1901_1b)相对于非固定tgfβ3的结果描绘在图27中。在同种型对照抗体的情况下未观察到结合。连续稀释的分泌的1901
‑
1b抗体结合tgf
‑
β3并且处于与添加的外源性1901
‑
1b抗体可比较的水平。这些结果证明,变体tgfβ3抗体可以在淋巴样细胞(包括t细胞)中表达并且被其分泌,并且所分泌的抗体有效结合tgfβ3。经过工程改造以表达本发明tgfβ3抗体的淋巴样细胞可用于多种应用,包括癌症疗法和免疫调节。
[0454]
在不脱离本发明的精神或必要特征的情况下,本发明可以以其他形式实施或以其他方式进行。因此,认为如在所有方面说明了本公开文本并且不是限制性的,本发明的范围由所附权利要求书指示,并且在等同含义和范围内的所有改变旨在包括于其中。
[0455]
在整个说明书中引用了各种参考文献,将每个参考文献均通过引用以其整体并入本文。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。