一种点突变birc5抗原表位肽筛选的方法
技术领域
1.本发明属于分子生物学技术领域,具体涉及一种点突变birc5抗原表位肽筛选的方法。
背景技术:
2.人类的birc5基因全长14.7kb,定位于17q25染色体上,含4个外显子及3个内含子,该基因在多种肿瘤组织中高表达,而在机体正常分化组织中表达量很低birc5是较为公认的具有潜在应用价值的肿瘤抗原靶点。
3.针对肿瘤抗原靶点,在特异性肿瘤免疫治疗中细胞毒t淋巴细胞通过识别与特定mhc
‑ⅰ
类分子结合的ctl表位肽,进而被活化发挥抗肿瘤效应。因此在众多抗肿瘤实验研究中,寻找与mhc分子结合稳定且能有效激活cd8
t细胞的ctl抗原表位十分有必要。mhc
‑ⅰ
类分子所结合的抗原表位肽通常为8
‑
10个氨基酸残基,以9残基多见,常规的ctl表位肽筛选方法包括ctl克隆筛选法、重组cdna文库血清学分析法和多肽洗脱法等。这些方法大都实验操作复杂,费时费力,对ctl表位肽的筛选效率低下。例如重组cdna文库血清学分析法需要至少1
×
106以上的库容量,在实际应用中构建一个高质量的cdna文库并不是一件容易的事。又例如多肽洗脱法虽可获得肿瘤抗原的天然抗原多肽,但其对仪器水平要求高,技术难度大,故应用范围较小。那么如何快速、精准、廉价的筛选出这种有应用价值的ctl抗原表位,在肿瘤疫苗的设计、t细胞识别功能、过继性细胞疗法等研究中都具有极为重要的意义。
4.随着生物信息学技术的发展及相应数据库的建立,利用计算机软件对已知蛋白(已知其氨基酸组成)的t细胞表位进行预测分析成为可能,再结合试验验证将大大提高ctl表位筛选效率,这种生物信息学分析法已成为极有潜力的ctl表位肽筛选法。目前,用于ctl表位预测的常用远程在线预测软件有netmhcpan 4.1(http://www.cbs.dtu.dk/services/netmhcpan/)和syfpeithi(http://www.syfpeithi.de/scripts/mhcserver.dll/epitopeprediction.htm)两大系统,而抗原递呈相关转运蛋白(transporter associated with antigen processing,tap)缺陷的b细胞瘤来源t2细胞则常用来进行表位肽与mhc分子结合稳定性的检测。但是,由于中枢性免疫耐受现象,该方法筛选出来的评分高的野生肽在绝大多数的临床试验中效果不佳。因为绝大部分taa都属于自身抗原,根据t淋巴细胞发育的经典理论,t淋巴细胞的发育经过阴性选择过程使识别这些抗原的高亲和力t细胞被克隆清处,所以在成人体内可能只存在着部分识别这些肿瘤抗原的低亲和力t细胞。由于通常情况下自身抗原与mhc分子的结合力较为低下,这些低亲和力t细胞上的tcr分子难以有效识别肿瘤抗原肽,就不能引起t细胞的有效活化扩增,这就形成了一种针对肿瘤抗原的免疫耐受现象。因此为了打破免疫耐受,激活低亲和力的taa特异性ctl是杀伤肿瘤细胞的关键。
5.本研究利用改良ctl表位肽生物信息学分析法,寻找评分较低但不能过低的野生birc5表位肽,然后通过点突变技术对野生型birc5表位肽进行改造,让其有助于活化体内的低亲和力t细胞,并结合相关试验进行检测。从而快速简便地筛选出与mhc分子结合稳定、且能有效激活ctl细胞并杀伤肿瘤的birc5抗原ctl表位。该技术操作简单,费用低廉,十分
适用于抗肿瘤表位肽的初筛,本技术候选肽中引入某些碱基的定点突变有利于大大提高突变肽与hla
‑
a2分子的亲和力,且能打破中枢性免疫耐受现象。
技术实现要素:
6.针对现有技术的不足,本发明提供一种筛选点突变birc5抗原表位的方法,旨在准确筛选出能诱导特异性抗肿瘤ctl的表位肽,同时该方法易于操作,鉴定快速,可用于肽疫苗的设计、t细胞识别功能、过继性细胞疗法等研究。
7.为解决上述问题,一方面,本发明在于提供一种筛选点突变birc5抗原表位的方法,具体步骤如下:
8.步骤1):利用netmhcpan 4.1和syfpeithi在线预测系统对birc5抗原9氨基酸残基的ctl表位肽进行全面预测,确定野生肽序列,同时通过点突变技术改变相应氨基酸残基种类筛选突变肽,提高在线预测的评分;
9.步骤2):根据步骤1)得到的氨基酸序列,人工合成birc5抗原野生表位肽和突变表位肽,同时合成一条阳性肽和一条阴性肽,相应表位肽与t2细胞共孵育后,检测表位肽与hla
‑
a2分子的实际结合能力;
10.步骤3):利用步骤2)筛选获得的突变表位肽与树突细胞(dc)在体外建立特异性ctls克隆,并利用钙黄绿素法鉴定ctls特异性识别杀伤靶细胞的免疫学活性;
11.所述步骤1)中得到的表位肽具有如seq id no:1所示的氨基酸序列,得到的突变肽具有如seq id no:2所示的氨基酸序列;
12.所述步骤2)中所用的阴性肽具有如seq id no:3所示的氨基酸序列,所用的阳性肽如seq id no:4所示的核苷酸序列。
13.进一步地,所述步骤1)中birc5抗原表位的生物信息学分析的过程如下:
14.步骤ⅰ)利用netmhcpan 4.1在线预测系统分析birc5抗原ctl表位,登录网址http://www.cbs.dtu.dk/services/netmhcpan/,在“submission”中,“input type”项目选择“fasta”,输入birc5氨基酸全序列,在“peptide length”项目选择“9mer peptides”,在“select species/loci”项目中选择“hla
‑
a*02:01”,点击“submit”运行远程预测程序;
15.步骤ⅱ)利用syfpeithi在线预测系统分析birc5抗原ctl表位,登录网址http://www.syfpeithi.de/scripts/mhcserver.dll/epitopeprediction.htm,在“1.select mhc type”项目中选择“hla
‑
a*02:01”,在“2.choose a mer”项目中选择“9aa”,然后将birc5抗原氨基酸全序列输入待预测序列框中,运行远程预测程序“4.choose run to start analysis”16.步骤ⅲ)按照一定筛选原则来筛选birc5野生表位肽,随后对其p2位氨基酸进行点突变改造,再用netmhcpan 4.1和syfpeithi两套评测系统对该突变肽进行评分。
17.进一步地,所述步骤1)中birc5野生表位肽的筛选原则和点突变改造原则为:
18.1)筛选原则:
19.野生表位肽的评分在netmhcpan 4.1评测中,21<%rank_el评分<30,同时满足在syfpeithi评测中,11<syfpeithi评分<20;
20.候选野生肽的p2位不能为v、l、i、m、t、a六种疏水性氨基酸之一,同时需满足p9位为l、m、i三种疏水性氨基酸之一。
21.2)点突变改造原则为:
22.把候选野生肽的p2位改造为v、l、i、m、t、a六种疏水性氨基酸之一,改造后突变肽在netmhcpan 4.1评测中,%rank_el评分<2,同时满足在syfpeithi评测中,syfpeithi评分>20;
23.3)候选点突变肽尚未有研究公开报道。
24.进一步地,所述步骤2)中检测表位肽与hla
‑
a2分子的实际结合能力的过程如下:
25.(1)检测表位肽与hla
‑
a2分子亲和力
26.步骤ⅰ)每组取1
×
106/ml的t2细胞,在含有20%fbs的dmem培养基中过夜培养,收集细胞后用无血清aim
‑
v培养基洗涤两次后重悬接种于24孔细胞培养板中,分别加入10μm不同种类的合成多肽和3μg/ml的β2
‑
mg,37℃孵育培养18h,用含有3%fbs的pbs洗涤两次。
27.步骤ⅱ)将上述所得的混合物在aim
‑
v培养基中重悬37℃放置2h,收集细胞,加入fitc标记的抗hla
‑
a2流式抗体,4℃避光孵育20min,染色后用pbs洗涤2次后重悬。
28.步骤ⅲ)上流式细胞仪检测t2细胞表面hla
‑
a2分子的平均荧光强度(mean fluorescence intensity,mfi),检测结果用软件expo32 v1.2分析。
29.(2)检测hla
‑
a2分子
‑
肽复合体稳定性
30.步骤ⅰ)每组取1
×
106/ml的t2细胞,在含有20%fbs的dmem培养基中培养过夜,收集细胞后用无血清aim
‑
v培养基洗涤两次后重悬,接种于24孔细胞培养板中,每组分别加入10μm不同种类的合成多肽和3μg/ml的β2
‑
mg,37℃孵育培养18h,用含有3%fbs的pbs洗涤两次去除多余的表位肽。
31.步骤ⅱ)将上述所得的混合物加入aim
‑
v培养基,以阻断新合成的hla
‑
a2分子在t2细胞表面的表达。37℃、5%co2条件下孵育1h,洗涤后重新置37℃、5%co2条件孵育,以2h为间隔,收集0、2、4、6、8h的细胞加入fitc标记的抗hla
‑
a2流式抗体,4℃避光孵育20min,pbs洗涤2次。
32.步骤ⅲ)上流式细胞仪,检测不同时间点hla
‑
a2分子表达阳性的t2细胞百分比变化情况,绘制hla
‑
a2分子
‑
肽复合体稳定性曲线。
33.进一步地,所述步骤3)中dc和突变表位肽体外诱导ctls克隆的建立过程如下:
34.(1)dc的体外诱导分化
35.首先配制dc体外诱导分化专用的培养液:在rpmi
‑
1640液体培养基中加入10%的fbs、150μg/ml的rhgm
‑
csf和50μg/ml的rhil
‑
4,混匀,4℃保存备用。
36.收集之前获得的贴壁单个核细胞,用dc专用培养液将细胞按照1
×
106/ml的密度后接种于48孔板中,0.5ml/孔。将细胞置于37℃,含5%co2饱和湿度的培养箱中培养6天。分别于第三天和第五天对半量换液。第8天加入400ng/ml的rhtnf
‑
α处理24小时刺激dc成熟,得到的dc为成熟dc(mdc),备用。用倒置相差显微镜观察dc生长情况,用荧光标记的抗人cd1α、抗人cd80和抗人cd83流式抗体检测成熟dc表面分子标志。
37.(2)dc 突变肽体外诱导ctls克隆的建立
38.肽反应性ctls的建立共需要经过两轮肽刺激反应,首先,收集健康人外周血来源的淋巴细胞,用含10%fbs的1640培养基重悬细胞,加入维持量的rhil
‑
2(20iu/ml),按2
×
106/ml的密度接种于24孔培养板中,按分组分别加入10mm的合成抗原肽,进行首轮刺激培养,共培养14d,中间换液一次。14d后,收集各组淋巴细胞,用pbs洗涤两次后进行第二轮刺
激,分别加入10mm的抗原肽、300iu/ml的重组人il
‑
2及诱导成熟的dc细胞(1
×
106/ml),继续培养12d,每4d换液一次,第13d时用pbs洗去多余的抗原肽及细胞碎片,诱导获得的ctls进行后续实验。
39.进一步地,所述步骤3)中elispot检测肽反应性t淋巴细胞数目的过程如下:
40.首先利用抗鼠人ifn
‑
γ抗体包被包含pvdf膜的96孔细胞培养板,用无血清aim
‑
v培养基封闭非特异性结合。将待检测各组淋巴细胞加入包被好的96孔培养板中,同时加入相应合成表位肽,37℃孵育过夜,其中以加入5μg/ml的cona的试验孔作为阳性对照,以加入hivpol
476
表位肽的试验孔为阴性对照。孵育后用洗涤液洗涤两次,加入生物素标记的抗人ifn
‑
γ抗体室温孵育1h,加入碱性磷酸酶标记的抗生物素抗体室温孵育1h,观察各试验孔中棕色斑点出现情况,待反应完毕加入终止液,上elispot斑点计数仪计算反应性斑点个数。
41.进一步地,所述步骤3)中钙黄绿素法检测突变肽诱导的ctl对负载肽t2细胞杀伤的过程如下:
42.将负载不同表位肽的t2细胞分组作为靶细胞,计数后1000rpm,离心5min,去上清,加入100μl pbs重悬,避光加入2μl钙黄绿素,充分混匀后置于37℃培养箱避光孵育30min。孵育结束后,加入1ml rpim
‑
1640培养基混匀1000rmp离心5min,加入pbs清洗两次,除去多余未染上的钙黄绿素。加入rpim
‑
1640完全培养基重悬细胞,调整t2细胞密度为1x104/孔,接种于96孔圆底板中。将突变肽诱导的ctl细胞从培养瓶中吸取效应细胞至离心管,250g离心10min。去上清,效应细胞按比例(效靶比1:25)加入96孔板中与各组靶细胞共培养。设置自释放组(仅有t2细胞)和最大释放组(2%triton x
‑
100处理的t2细胞)。每孔补足培养基至200μl,每组设三个复孔。37℃培养箱孵育4h,室温250g离心5min,取80ul/孔上清至另外的96孔平底板,避免产生气泡,上酶标仪测荧光值。设置程序为激发光485nm,发射光535nm,杀伤效率公式:杀伤效率=(实验组od值
‑
自释放组od值)/(最大释放组od值
‑
自释放组od值)x100%。
43.一方面,本发明还提供了一种具有潜在价值的birc5抗原ctl表位肽,所述野生肽sur79具有如seq id no:1所示的氨基酸序列;
44.另一方面,本发明还提供了一种筛选肿瘤免疫治疗的点突变birc5抗原ctl表位肽,所述突变肽sur79i2具有如seq id no:2所示的氨基酸序列;
45.本发明提供的方法在生物软件分析预测表位肽与相应mhc分子形成复合体解离半衰期长短(评分越高代表表位肽与mhc分子的亲和力越高)的基础上,筛选出hla
‑
a2限制性birc5抗原表位(该野生肽与mhc分子的亲和力低,但不过低),并引入碱基点突变技术对表位肽进行进一步优化,打破免疫耐受现象,再结合相关试验验证,大大提高了ctl表位筛选效率,最终通过诱导肽特异性ctl细胞并鉴定其杀伤靶细胞的免疫学活性,来判断筛选的有效性,从而建立起一套简单、快速、有效的筛选抗肿瘤点突变表位肽的方法,利用该技术,未来可进一步生产用开发针对birc5抗原的抗肿瘤肽疫苗,也可推广到针对其他taa的ctl点突变表位肽筛选中。
46.在ctl表位肽筛选法中,常规方法包括ctl克隆筛选法、重组cdna文库血清学分析法和多肽洗脱法。这些方法大都实验操作复杂,费时费力,对ctl表位肽的筛选效率低下。例如重组cdna文库血清学分析法需要至少1
×
106以上的库容量,在实际应用中构建一个高质
量的cdna文库并不是一件容易的事。又例如多肽洗脱法虽可获得肿瘤抗原的天然抗原多肽,但其对仪器水平要求高,技术难度大,故应用范围较小。而ctl表位肽生物信息学分析法则较为简便,利用计算机软件对已知蛋白(已知其氨基酸组成)的t细胞表位进行预测分析,再结合试验验证大大简化了实验步骤,从而提高ctl表位筛选效率。优点是简单易行,成本低。
47.本发明的氨基酸序列如下:
[0048][0049]
与现有技术相比,本发明具有如下有益效果:
[0050]
本发明通过ctl表位肽生物信息学分析法筛选出birc5抗原点突变肽,验证其与hla
‑
a2分子的结合稳定性,随后建立突变肽特异性ctls克隆,并鉴定ctls特异性识别杀伤靶细胞的免疫学活性。本发明建立了一套简单、快速、有效的筛选抗肿瘤点突变表位肽的方法,为进一步肿瘤肽疫苗的制备奠定了基础。
[0051]
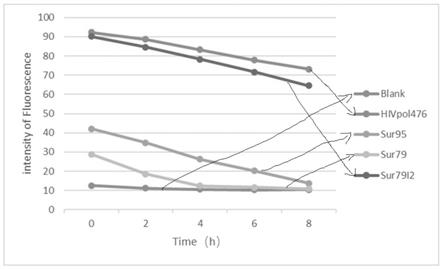
具有如下优势:(1)与常规的ctl表位肽鉴定方法(包括ctl克隆筛选法、重组cdna文库血清学分析法和多肽洗脱法等)相比,本发明的方法明显更经济、准确性高,且实验过程简便;(2)与ctl表位肽生物信息学分析法相比:由于中枢性免疫耐受现象,该方法筛选出来的表位肽在绝大多数的临床试验中效果不佳。本发明对筛选过程进行优化,并利用点突变技术对野生型birc5表位肽进行改造,寻找可能激活肿瘤患者体内taa低亲和力t细胞的点突变ctl表位肽,从而打破中枢性免疫耐受现象,提高临床试验效果。
附图说明
[0052]
图1为肽/hla
‑
a2分子复合体稳定性曲线图。
[0053]
图2为倒置相差显微镜观察dc分化情况图(200
×
),图中,a为诱导后第2天的变化情况,b为诱导后第5天的变化情况,c为诱导后第9天的变化情况。
[0054]
图3为流式细胞仪检测dc表面分子变化情况图,图中,a为dc细胞的cd1α 分子的变化情况,b为dc细胞的cd80
分子的变化情况,c为dc细胞的cd83
分子的变化情况。
[0055]
图4为表位肽刺激淋巴细胞产生的elispot斑点计数结果图。
[0056]
图5为点突变肽诱导的ctls对靶细胞的杀伤效率结果图
具体实施方式
[0057]
简要说明
[0058]
(1)人工合成多肽委托百奥泰(广州)生物科技有限公司,经质谱鉴定其纯度>95%。
[0059]
(2)野生型birc5基于及编码氨基酸全序列:
[0060]
从ncbi数据库中获得野生型birc5基因的编码dna全序列及编码氨基酸全序列(查询编号:ccds11755.1)
[0061]
nucleotidesequence(429nt):
[0062]
atgggtgccccgacgttgccccctgcctggcagccctttctcaaggaccaccgcatctctacattcaagaactggcccttcttggagggctgcgcctgcaccccggagcggatggccgaggctggcttcatccactgccccactgagaacgagccagacttggcccagtgtttcttctgcttcaaggagctggaaggctgggagccagatgacgaccccatagaggaacataaaaagcattcgtccggttgcgctttcctttctgtcaagaagcagtttgaagaattaacccttggtgaatttttgaaactggacagagaaagagccaagaacaaaattgcaaaggaaaccaacaataagaagaaagaatttgaggaaactgcggagaaagtgcgccgtgccatcgagcagctggctgccatggattga
[0063]
translation(142aa):
[0064]
mgaptlppawqpflkdhristfknwpflegcactpermaeagfihcptenepdlaqcffcfkelegwepdddpieehkkhssgcaflsvkkqfeeltlgeflkldreraknkiaketnnkkkefeetaekvrraieqlaamd
[0065]
(3)细胞株:
[0066]
tap缺陷的b细胞瘤来源t2细胞株(hla
‑
a2 ,atcc编号为:crl
‑
1992
tm
)为本实验室保藏。
[0067]
(4)健康人外周血样本:
[0068]
hla
‑
a2 健康人外周血样本来自本实验室一名45岁男性志愿者健康人志愿者签订了项目知情同意书。
[0069]
(5)主要溶液配制
[0070]
1.表位肽工作液:
[0071]
将每种10mg的人工合成肽分别用1mldmso溶解,配制成10g/l的肽储存液。在肽
‑
mhc分子亲和力及稳定性检测实验时,利用rpmi
‑
1640培养基将肽储存液配制成不同浓度的肽工作液。
[0072]
2.pbs(1000ml):
[0073]
nacl8gkcl0.2g
[0074]
na2hpo41.42gkh2po40.27g
[0075]
调至ph7.4加ddh2o定容到1l
[0076]
高温高压灭菌
[0077]
3.rhil
‑
2储存液(100iu/ml):
[0078]
取10万iu的rhil
‑
2,溶于1ml灭菌pbs
[0079]
4.cona储存液(0.5μg/ml):
[0080]
取5mgcona粉末溶于1ml灭菌pbs
[0081]
5.琼脂糖凝胶电泳tbe缓冲液(5
×
tbe):
[0082]
tris54g硼酸27.5g
[0083]
加ddh2o800ml
[0084]
0.5m的edta20ml加ddh2o定容到1l
[0085]
用时稀释10倍
[0086]
6.10mmpmsf储存液(工作液浓度为1mm):
[0087]
pmsf0.01742g异丙醇8ml
[0088]
最后定容至10ml
[0089]
7.细胞裂解液:
[0090]
1%tritonx
‑
10020mmtris
‑
hclph7.5
[0091]
150mmnacl1mmegta
[0092]
10%甘油1mmpmsfand1mg/mlleupeptin
[0093]
8.sds
‑
page电泳缓冲液(5
×
,1000ml):
[0094]
tris15.1g甘氨酸94g
[0095]
sds5g加ddh2o800ml
[0096]
加ddh2o定容到1l用时稀释5倍
[0097]
9.转印缓冲液(1500ml):
[0098]
tris8.7g甘氨酸4.35g
[0099]
sds0.555g加ddh2o1000ml
[0100]
甲醇300ml加ddh2o定容到1500ml
[0101]
10.tbs
‑
t漂洗液(10
×
,1000ml):
[0102]
tris24.2gnacl80g
[0103]
加ddh2o700ml
[0104]
1mhcl(约15ml)调节ph至7.6加ddh2o定容到1000ml
[0105]
用时稀释10倍,加入浓度为0.1%的tween
‑
20即为tbs
‑
t漂洗液
[0106]
11.5%bsa封闭液:
[0107]
称取5gbsa粉末溶于100mltbs
‑
t漂洗液中
[0108]
12.流式细胞检测固定液(1000ml):
[0109]
葡萄糖20g叠氮钠0.2g
[0110]
加ddh2o800ml甲醛20ml
[0111]
加ddh2o定容到1000ml
[0112]
(6)主要试剂:
[0113]
二甲基亚砜(dimethylsulfoxide,dmso)、β2微球蛋白(β2
‑
microglobulin,β2
‑
mg)为美国sigma公司产品,dmem液体培养基、aim
‑
v无血清液体培养基、胎牛血清(fetalbovineserum,fbs)、胰酶及双抗(青霉素和链霉素)购自美国gibco公司,ftic标记的鼠抗人hla
‑
a2流式抗体购自美国santacruz公司,rpmi
‑
1640培养基、重组人白细胞介素2(rhil
‑
2)、重组人粒细胞巨噬细胞集落刺激因子(rhgm
‑
csf)、重组人白细胞介素4(rhil
‑
4)及重组人干扰素α(rhtnf
‑
α)购自美国r&d生物技术公司,吐温20(tween
‑
20)、tritonx
‑
100、刀豆素a(concanavalin,cona)、pmsf(phenylmethylsulfonylfluo
‑
ride)及亮抑蛋白酶肽(leupeptin)购自美国sigma公司,荧光标记的鼠抗人cd1α、cd8、cd80、cd83单克隆抗体购自美国biolegend公司,人ifn
‑
γelisa试剂盒购自达科为生物公司,其余试剂皆为进口分装或国产分析纯。
[0114]
(7)主要实验仪器设备及型号:
[0115]
co2细胞培养箱,美国thermo;
[0116]
倒置相差显微镜,日本olympus;
[0117]
台式离心机,德国hettich;
[0118]
流式细胞仪,美国beckmancoulter;
[0119]
荧光酶标仪,美国thermo;
[0120]
凝胶成像系统,中国上海天能;
[0121]
下面结合实施例对本发明作进一步的说明,但并不局限于此。
[0122]
实施例1birc5抗原表位的生物信息学分析
[0123]
(1)netmhcpan 4.1在线预测系统:
[0124]
登录网址http://www.cbs.dtu.dk/services/netmhcpan/,在“submission”中,“input type”项目选择“fasta”,输入birc5氨基酸全序列,在“peptide length”项目选择“9mer peptides”,在“select species/loci”项目中选择“hla
‑
a*02:01”,点击“submit”运行远程预测程序。
[0125]
根据%rank_el评分结果进行排序,%rank_el评分越大说明表位肽与mhc分子的结合能力越弱,我们选取21<%rank_el评分<30的表位肽进行后续分析。21<%rank_el评分<30的表位肽列表如表1所示。
[0126]
表1 birc5抗原9氨基酸ctl表位的netmhcpan 4.1预测结果
[0127][0128]
(2)syfpeithi在线预测系统:
[0129]
登录网址http://www.syfpeithi.de/scripts/mhcserver.dll/epitopeprediction.htm,
[0130]
在“1.select mhc type”项目中选择“hla
‑
a*02:01”,
[0131]
在“2.choose a mer”项目中选择“9aa”,
[0132]
然后将birc5抗原氨基酸全序列输入待预测序列框中,运行远程预测程序;
[0133]
其中,评分越高代表表位肽与mhc分子的亲和力越高,选取11<syfpeithi评分<20的预测表位肽进行后续分析。11<syfpeithi评分<20的表位肽列表如表2所示。
[0134]
表2 birc5抗原9氨基酸ctl表位的syfpeithi预测结果
[0135][0136]
(3)生物信息学方法筛选点突变肽
[0137]
对表1和表2的分析结果按照以下原则进行筛选,
[0138]
筛选原则如下:
[0139]
选取野生表位肽的评分在netmhcpan 4.1评测中,21<%rank_el评分<30,同时满足在syfpeithi评测中,11<syfpeithi评分<20;候选野生肽的p2位不能为v、l、i、m、t、a六种疏水性氨基酸之一,同时需满足p9位为l、m、i三种疏水性氨基酸之一。
[0140]
把候选野生肽的p2位改造为v、l、i、m、t、a六种疏水性氨基酸之一,改造后突变肽在netmhcpan 4.1评测中,%rank_el评分<2,同时满足在syfpeithi评测中,syfpeithi评分>20;候选点突变肽尚未有研究公开报道。
[0141]
最终,筛选出的野生肽为sur79(khssgcafl),突变肽为sur79i2(kissgcafl),在
netmhcpan 4.1评测中,sur79i2的%rank_el评分为1.768,在syfpeithi评测中,sur79i2的syfpeithi评分为23,表明其与mhc分子的亲和力,较野生肽sur79有显著提高。
[0142]
实施例2检测表位肽与hla
‑
a2分子的实际结合能力
[0143]
人工合成候选肽有sur79、sur79i2(突变肽)、hivpol
476
(与hla
‑
a2分子有高亲和力的阴性肽)、sur95(阳性肽),共4组。
[0144]
(1)检测候选表位肽与hla
‑
a2分子的亲和力
[0145]
步骤ⅰ)每组取1
×
106/ml的t2细胞,在含有20%fbs的dmem培养基中过夜培养,收集细胞后用无血清aim
‑
v培养基洗涤两次后重悬接种于24孔细胞培养板中,分别加入10μm不同种类的合成多肽和3μg/ml的β2
‑
mg,37℃孵育培养18h,用含有3%fbs的pbs洗涤两次。
[0146]
步骤ⅱ)将上述所得的混合物在aim
‑
v培养基中重悬37℃放置2h,收集细胞,加入fitc标记的抗hla
‑
a2流式抗体,4℃避光孵育20min,染色后用pbs洗涤2次后重悬。
[0147]
步骤ⅲ)上流式细胞仪检测t2细胞表面hla
‑
a2分子的平均荧光强度(mean fluorescence intensity,mfi),检测结果用软件expo32 v1.2分析。用荧光系数(fluorescence index,fi)衡量亲和力,fi=(实验组mif
‑
阴性对照组mif)/阴性对照组mif,阴性对照组mif表示仅添加β2
‑
mg的t2细胞组,fi值≥2表示抗原肽与hla
‑
a2分子有较高亲和力;
[0148]
点突变后,sur79i2的结合效率显著提高,hla
‑
a2阳性t2细胞比例由突变前的18.4%分别提高到突变后的83.0%,计算fi值,也由突变前的0.46提高到突变后的5.59。hivpol
476
的fi为5.92,sur95的fi为1.63,sur95属于与hla
‑
a2分子中等亲和力表位肽,如表3。
[0149]
表3生物信息学预测birc5表位肽评分
[0150][0151][0152]
(2)检测hla
‑
a2分子
‑
肽复合体的稳定性
[0153]
步骤ⅰ)每组取1
×
106/ml的t2细胞,在含有20%fbs的dmem培养基中培养过夜,收集细胞后用无血清aim
‑
v培养基洗涤两次后重悬,接种于24孔细胞培养板中,每组分别加入10μm不同种类的合成多肽和3μg/ml的β2
‑
mg,37℃孵育培养18h,用含有3%fbs的pbs洗涤两次去除多余的表位肽。
[0154]
步骤ⅱ)将上述所得的混合物加入aim
‑
v培养基,以阻断新合成的hla
‑
a2分子在t2细胞表面的表达。37℃、5%co2条件下孵育1h,洗涤后重新置37℃、5%co2条件孵育,以2h为间隔,收集0、2、4、6、8h的细胞加入fitc标记的抗hla
‑
a2流式抗体,4℃避光孵育20min,pbs洗涤2次。
[0155]
步骤ⅲ)上流式细胞仪,检测不同时间点hla
‑
a2分子表达阳性的t2细胞百分比变
化情况,绘制hla
‑
a2分子
‑
肽复合体稳定性曲线。稳定性结果用dc50(dissociation complex50%)进行判断,从dc50表示每个肽在t=0时的荧光强度减弱到50%时所需的时间,即50%mhc
‑
肽复合物解离所需的时间。
[0156]
结果如图1,肽/hla
‑
a2分子复合体的稳定性曲线显示,hivpol
476
和sur79i2的dc50值都大于8h,提示这两种表位肽与hla
‑
a2分子有较强的亲和力,能形成稳定的肽/hla
‑
a2分子复合体;sur95的dc50值位于4h到6h之间,提示该表位肽是一个中等亲和力的抗原肽,与hla
‑
a2分子的亲和力较弱,但能形成稳定的肽/hla
‑
a2分子复合体;sur79的dc50值低于4h,提示表位肽sur79不能与hla
‑
a2分子形成稳定的肽/hla
‑
a2分子复合体。
[0157]
实施例3 dc和突变肽体外诱导ctls克隆的建立
[0158]
(1)dc的体外诱导分化
[0159]
首先配制dc体外诱导分化专用的培养液:在rpmi
‑
1640液体培养基中加入10%的fbs、150μg/ml的rhgm
‑
csf和50μg/ml的rhil
‑
4,混匀,4℃保存备用。
[0160]
收集之前获得的贴壁单个核细胞,用dc专用培养液将细胞按照1
×
106/ml的密度后接种于48孔板中,0.5ml/孔。将细胞置于37℃,含5%co2饱和湿度的培养箱中培养6天。分别于第三天和第五天对半量换液。第8天加入400ng/ml的rhtnf
‑
α(10ng/ml)处理24小时刺激dc成熟,得到的dc为成熟dc(mdc),备用。用倒置相差显微镜观察dc生长情况,用荧光标记的抗人cd1α、抗人cd80和抗人cd83流式抗体检测成熟dc表面分子标志。
[0161]
(2)dc 突变肽体外诱导ctls克隆的建立
[0162]
肽反应性ctls的建立共需要经过两轮肽刺激反应,首先,收集健康人外周血来源的淋巴细胞,用含10%fbs的1640培养基重悬细胞,加入维持量的rhil
‑
2(20iu/ml),按2
×
106/ml的密度接种于24孔培养板中,按分组分别加入10mm的合成抗原肽,进行首轮刺激培养,共培养14d,中间换液一次。14d后,收集各组淋巴细胞,用pbs洗涤两次后进行第二轮刺激,分别加入10mm的抗原肽、300iu/ml的重组人il
‑
2及诱导成熟的dc细胞(1
×
106/ml),继续培养12d,每4d换液一次,第13d时用pbs洗去多余的抗原肽及细胞碎片,诱导获得的ctls进行后续实验。
[0163]
结果如图2显示,经dc专用培养液诱导的单个核细胞,培养第2d倒置显微镜下可见部分细胞出现成簇聚团生长现象,培养第4
‑
6d时可见大部分细胞呈梭形及不规则形状,部分细胞表面呈毛刺状,培养至第9d,大部分细胞变圆或不规则,有明显的毛刺状突起(如图3)。流式细胞仪检测dc表面分子变化情况,如图3所示,成熟dc的cd1α、cd80及cd83分子表达水平都显著提高。
[0164]
实施例4 elispot检测肽反应性t淋巴细胞数目
[0165]
首先利用抗鼠人ifn
‑
γ抗体包被包含pvdf膜的96孔细胞培养板,用无血清aim
‑
v培养基封闭非特异性结合。将待检测各组淋巴细胞加入包被好的96孔培养板中,同时加入相应合成表位肽,37℃孵育过夜,其中以加入5μg/ml的cona的试验孔作为阳性对照,以加入hivpol
476
表位肽的试验孔为阴性对照。孵育后用洗涤液洗涤两次,加入生物素标记的抗人ifn
‑
γ抗体室温孵育1h,加入碱性磷酸酶标记的抗生物素抗体室温孵育1h,观察各试验孔中棕色斑点出现情况,待反应完毕加入终止液,上elispot斑点计数仪计算反应性斑点个数。
[0166]
结果如图4所示,np为阴性对照,每105个细胞的平均斑点数为9.6
±
1.14个。而在
作为阳性对照的cona中,每105个细胞的斑点数为174.4
±
14.24个。淋巴细胞在受到表位肽sur95刺激时能产生24.4
±
3.05个斑点/105细胞,活化的t细胞属于较低水平,受到sur79刺激时能产生35.2
±
4.32个斑点/105细胞,活化的t细胞属于中等水平,而受到突变肽sur79i2刺激后,能产生74.8
±
9.26个斑点/105细胞,反应出点突变肽能刺激较高水平的t细胞活化。
[0167]
实施例5钙黄绿素法检测突变肽诱导的t淋巴细胞对靶细胞的杀伤
[0168]
将负载不同表位肽的t2细胞分组作为靶细胞,计数后1000rpm,离心5min,去上清,加入100μl pbs重悬,避光加入2μl钙黄绿素,充分混匀后置于37℃培养箱避光孵育30min。孵育结束后,加入1ml rpim
‑
1640培养基混匀1000rmp离心5min,加入pbs清洗两次,除去多余未染上的钙黄绿素。加入rpim
‑
1640完全培养基重悬细胞,调整t2细胞密度为1x104/孔,接种于96孔圆底板中。将突变肽诱导的ctl细胞从培养瓶中吸取效应细胞至离心管,250g离心10min。去上清,效应细胞按比例(效靶比1:25)加入96孔板中与各组靶细胞共培养。设置自释放组(仅有t2细胞)和最大释放组(2%triton x
‑
100处理的t2细胞)。每孔补足培养基至200μl,每组设三个复孔。37℃培养箱孵育4h,室温250g离心5min,取80ul/孔上清至另外的96孔平底板,避免产生气泡,上酶标仪测荧光值。设置程序为激发光485nm,发射光535nm,杀伤效率公式:杀伤效率=(实验组od值
‑
自释放组od值)/(最大释放组od值
‑
自释放组od值)x100%。
[0169]
结果如图5显示,突变肽sur79i2诱导的ctls能有效杀伤负载突变肽sur79i2的t2细胞,杀伤效率达到56.16%,对负载野生肽sur79的t2细胞也具有较强的杀伤能力,杀伤效率达到43.53%。对负载hivpol
476
和sur95这两个肽的t2细胞杀伤能力较弱,杀伤效率分别为12.43%和10.13%。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。