使用poly(a)聚合酶对rna的尺寸选择
1.交叉引用
2.本技术要求2018年9月28日提交的美国专利申请序列号16/145,911的权益,该申请通过引用并入本文。
背景技术:
3.某些cdna文库制备方法包括将mrna片段化,然后将所得的mrna的片段逆转录以制备cdna。在这些方法中,切割通常发生在随机或半随机位置,并因此,通过这些方法制备的rna片段群体通常包含不同长度的rna片段,其中至少一些片段相对较小,即长度小于20个核苷酸。这些短片段是有问题的,因为它们的cdna拷贝得到非常有效地扩增,但是它们的序列(特别是长度为10
‑
15的片段)并不总是唯一地可映射到转录组。通过对cdna或扩增产物进行物理尺寸选择,可以潜在地避免该问题。然而,由于物理尺寸选择方法的不精确性,不可能消除较短rna的cdna拷贝而不消除许多较长rna的cdna拷贝。
4.因此需要一种更好的方法根据尺寸来选择rna分子。
技术实现要素:
5.本公开内容提供了一种处理rna样品的方法。在一些实施方案中,所述方法可包括:(a)将包含rna的样品(例如,可包含至少mrna,例如,至少mrna和lncrna的样品)片段化以产生不同长度的rna片段群体,其中rna片段群体包括较长rna片段和较短rna片段,(b)在其中polya聚合酶优先地将polya尾添加到较长rna片段而不是较短片段的条件下,将polya聚合酶与rna片段群体温育,以产生加尾的rna;(c)将加尾的rna与oligo(dt)寡核苷酸杂交;和(d)使用所述oligo(dt)寡核苷酸作为引物逆转录加尾的rna以产生cdna文库或通过洗掉未与oligo(dt)寡核苷酸杂交的rna分子来富集加尾的rna。
6.目前的方法部分基于polya聚合酶对较长rna底物的优先性的发现。这一发现可应用于体外聚腺苷酸化反应,以便仅对较长rna片段进行聚腺苷酸化,从而从将来的分析中消除较短rna片段。polya聚合酶对较短底物的优先性可以通过改变反应条件来调节。在许多情况下,限制聚腺苷酸化反应中酶的活性将导致仅对较长rna片段的优先聚腺苷酸化。这可以例如通过减少反应中酶的量、通过减少反应中游离mg
2
的量或通过改变其他反应条件来实现。可以调节反应条件,使得长度为至少20个核糖核苷酸的rna片段相对于长度为15个核苷酸或更短的较小rna片段得到优先聚腺苷酸化。
7.如下文将更详细地解释的,所述方法可在分析包含“长”rna(例如mrna、lncrna等)和小rna两者的样品中特别有用。在片段化之后,rna片段可以具有至少20个核苷酸的中值尺寸,小rna可以具有在20至40个核苷酸范围内的中值尺寸,并且较短、不需要的rna片段可以是15个核苷酸或更短。polya聚合酶对较长底物的优先性可用于优先聚腺苷酸化小rna和较长rna片段两者,而不是较小rna片段。所述方法可用于包含长度至少为40个核苷酸的rna的任何rna样品。例如,这样的样品中的rna分子可具有至少40个核苷酸或至少100个核苷酸的中值尺寸。
8.由于本方法能够区分长度仅相差5
‑
10个核苷酸的rna分子,因此与从样品中物理去除较小rna片段的其他方法(例如,通过尺寸排除色谱法和/或基于珠粒的尺寸选择)相比,本方法被认为提供了更高的分辨率。
附图说明
9.当结合附图阅读时,根据以下详细描述可以最好地理解本发明的一些方面。要强调的是,根据惯例,附图的各个特征不是按比例绘制。实际上,为了清楚起见,各种特征的尺寸被任意地扩大或缩小。附图中包括以下附图。
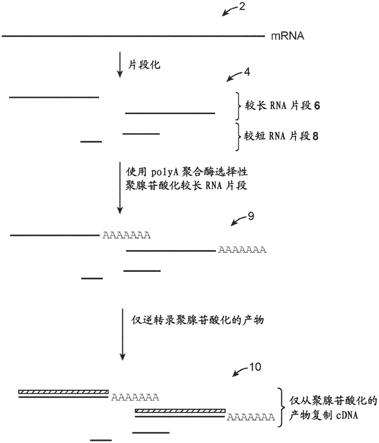
10.图1示意性地示例显示了本方法的实施方案的一些原理。
11.图2示意性地示例显示了如何通过rnaseh处理来实现对dna/rna杂交体的片段化。
12.图3示意性地示例显示了使用本发明的方法如何可以将较短rna片段从cdna文库中排除。
13.图4是条形图,其显示了来自第一实验的数据,如实例中所述。
14.图5是柱状图,其显示了来自第二实验的数据,如实例中所述。
15.定义
16.在更详细地描述示例性实施方案之前,阐述以下定义以示例说明和定义在说明书中使用的术语的含义和范围。
17.数字范围包括定义范围的数字。除非另有说明,分别地核酸以5’至3’方向从左至右书写;并且氨基酸序列以氨基至羧基的方向从左至右书写。
18.除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常所理解的相同含义。singleton等人,dictionary of microbiology and molecular biology,2d ed.,john wiley and sons,new york(1994),以及hale&markham,the harper collins dictionary of biology,harper perennial,n.y.(1991)为本领域技术人员提供了本文中使用的许多术语的一般含义。尽管如此,为了清楚和易于参考,在下面定义了某些术语。
19.必须注意的是,如本文和所附权利要求书中所使用的,单数形式的“一个”、“一种”和“该”包括复数指示物,除非上下文另外明确指出。例如,术语“引物”是指一个或多个引物,即单个引物和多个引物。还应注意的是,权利要求书可以撰写为排除任何可选要素。因此,本声明旨在作为与权利要求要素的叙述相关联地使用诸如“只”,“仅”等排他性术语,或使用“否定”限制的先行基础。
20.如本文所使用的术语“rna样品”涉及材料的混合物,通常(尽管不一定)以液体形式(例如以水溶液的形式)包含一个或多个rna分子。例如,可以从细胞(例如哺乳动物细胞)获得rna样品。rna样品可以包含任意数量的可区分的rna分子。例如,在一些实施方案中,rna样品可包含不同rna分子的群体,在这种情况下,其可包含超过1000个、超过10,000个、超过50,000个或超过100,000个多至1百万个或更多不同种类的rna,即不同序列的rna分子。rna样品可包含长rna分子,例如mrna分子,其长度通常为至少100nt(例如,长度为200nt至10kb),并且中值长度在500
‑
5000nt的范围内,以及例如长基因间非编码rna(lincrna)。rna样品可另外地包含各种小的非编码调节性rna,其在本文中可通称为“小rna”,例如,微rna、小的非编码rna、piwi
‑
相互作用的小rna(pirna)、小调节性rna和snorna等。小rna通常
是长度低于100nt,中值长度在20nt至40nt的范围内。rna样品可另外地包含rrna分子、trna分子、pre
‑
mirna分子和长的非编码rna分子,例如大的基因间rna(lincrna)分子。除非另有说明,“rna样品”可以具有任何类型的天然存在的rna,包括上面描述的那些和潜在的其他rna。
21.术语“核苷酸”旨在包括不仅含有已知嘌呤和嘧啶碱基,而且含有经修饰的其它杂环碱基的那些部分。这些修饰包括甲基化的嘌呤或嘧啶、酰化的嘌呤或嘧啶、烷基化的核糖或其它杂环。此外,术语“核苷酸”包括包含半抗原或荧光标记的那些部分,并且可以不仅包含常规核糖和脱氧核糖,还包含其他糖。经修饰的核苷或核苷酸还包括在糖部分上的修饰,例如其中一个或多个羟基被卤素原子或脂肪族基团取代,官能化为醚、胺等。核苷酸可以包括当掺入核酸的延伸链时能够持续延伸的核苷酸(非链终止核苷酸)和阻止随后延伸的核苷酸(例如链终止子)。
22.术语“核酸”和“多核苷酸”在本文中可互换地用于描述任何长度的聚合物,例如,大于约2个碱基、大于约10个碱基、大于约100个碱基、大于约500个碱基、大于1000个碱基、多至约10000个或更多个碱基,其由核苷酸,例如脱氧核糖核苷酸或核糖核苷酸组成,并且可以酶促或合成产生(例如,如美国专利号5,948,902和其中引用的参考文献中所述的pna),其可以以类似于两种天然存在的核酸的序列特异性方式与天然存在的核酸杂交,例如,可以参与沃森
‑
克里克碱基配对相互作用。天然存在的核苷酸包括鸟嘌呤、胞嘧啶、腺嘌呤、胸腺嘧啶和尿嘧啶(g、c、a、t和u)。
23.如本文所使用的术语“核糖核酸”和“rna”是指由核糖核苷酸组成的聚合物。
24.如本文所使用的术语“脱氧核糖核酸”和“dna”是指由脱氧核糖核苷酸组成的聚合物。
[0025]“分离的”或“纯化的”通常是指物质(化合物、多核苷酸、蛋白质、多肽、多肽组合物)的分离,使得该物质占其所存在的样品的显著百分比(例如,大于1%、大于2%、大于5%、大于10%、大于20%、大于50%或更多,通常多至约90%
‑
100%)。在一些情况下,分离的物质可溶解在液体,例如水溶液中。在某些实施方案中,基本上纯化的组分占样品的至少50%、80%
‑
85%或90
‑
95%。用于纯化感兴趣的多核苷酸和多肽的技术在本领域中是众所周知的,并且包括例如离子交换色谱法、亲和色谱法、根据密度的沉降、沉淀、溶剂萃取和使用柱或珠的固相纯化。一般来说,当一种物质存在于样品中的量相对于样品中的其他组分不是天然存在的时候,该物质是纯化的。
[0026]
如本文所使用的术语“寡核苷酸”表示约2至500个核苷酸(例如,2至200个核苷酸)的核苷酸单链多聚体。寡核苷酸可以是合成的或可以酶促制备,并且在一些实施方案中,长度为4至50个核苷酸。寡核苷酸可以包含核糖核苷酸单体(即,可以是rna寡核苷酸)或脱氧核糖核苷酸单体。寡核苷酸例如长度可以为5至20、11至30、31至40、41至50、51至60、61至70、71至80、80至100、100至150或150至200,多至500个核苷酸。如本文所使用的术语“双链体”、“杂交体”或“双链”是指具有通过碱基配对结合在一起的两条链的核酸。
[0027]
如本文所使用的术语“互补”是指核苷酸序列通过非共价键与感兴趣的靶核酸碱基配对。在经典的沃森
‑
克里克碱基配对中,dna中的腺嘌呤(a)与胸腺嘧啶(t)形成碱基对,鸟嘌呤(g)与胞嘧啶(c)形成碱基对。在rna中,胸腺嘧啶被尿嘧啶(u)取代。因此,a与t互补,g与c互补。在rna中,a与u互补,反之亦然。通常,“互补”是指核苷酸序列至少部分互补。术语
或“变体”蛋白质可以具有相对于野生型蛋白质的一个或多个氨基酸置换,并且可以包括“融合”蛋白。术语“融合蛋白”是指由多个多肽组分组成的蛋白质,这些多肽组分在其自然状态下不连接。融合蛋白可以是两种、三种或甚至四种或更多种不同蛋白质的组合。术语多肽包括融合蛋白,包括但不限于两个或更多个异源氨基酸序列的融合,多肽与:异源靶向序列、接头、表位标签、可检测的融合伴侣(例如荧光蛋白)、β
‑
半乳糖苷酶、萤光素酶等的融合。融合蛋白可具有添加到蛋白质的n末端、c末端和/或中间部分的一个或多个异源结构域。如果融合蛋白的两个部分是“异源的”,那么它们在其自然状态下就不是同一个蛋白质的部分。在核酸的上下文中,术语“非天然存在”是指包含以下的核酸:a)与处于其天然状态下的核酸不同的核苷酸序列(即,与天然存在的核酸序列具有小于100%的序列同一性),b)一个或多个非天然存在的核苷酸单体(其可导致非天然主链或不是g、a、t或c的糖)和/或c)可包含对核酸的5’末端、3’末端和/或5’末端和3’末端之间的一个或多个其他修饰(例如,添加的标签或其他部分)。
[0038]
在组合物的上下文中,术语“非天然存在”是指:a)天然未组合的组分(例如,因为它们位于不同的位置、在不同的细胞或不同的细胞区室中)的组合;b)具有在自然界中未发现的相对浓度的组分的组合;c)缺少通常与自然界中的一种组分相关联的物质的组合;d)以自然界中未发现的形式(例如,干燥的、冷冻干燥的、结晶的、水性)的组合;和/或e)包含自然界中未发现的组分的组合。例如,制备物可包含自然界中未发现的“非天然存在的”缓冲液(例如,tris、hepes、taps、mops、tricine或mes)、洗涤剂、染料、反应增强剂或抑制剂、氧化剂、还原剂、溶剂或防腐剂。
[0039]
术语“引物”是指天然或合成的寡核苷酸,其在与多核苷酸模板形成双链体时能够作为核酸合成的起始点,并且从其3’末端沿着模板延伸使得形成延伸的双链体。在延伸过程中添加的核苷酸序列由模板多核苷酸的序列决定。通常引物通过dna聚合酶或逆转录酶延伸。引物的长度通常与其在合成引物延伸产物中的用途相容,并且通常长度在6至100个核苷酸,例如,10至75、15至60、15至40、18至30、20至40、21至50、22至45、25至40等的范围内,更典型地在18至40、20至35、21至30个核苷酸长的范围内,以及所述范围内的任何长度。引物通常是单链的。引物具有3’羟基。
[0040]
术语“oligo
‑
dt引物”是指能够从polya尾引发cdna合成的引物。除了最后一个或两个核苷酸之外,oligo
‑
dt引物可以具有3’末端序列,其具有一串胸腺嘧啶。如图3所示,这种引物可以具有5’尾。在一些实施方案中,oligo
‑
dt引物可以被锚定并且可以具有以下序列:tttttttttttttttvn(seq id no:1),其中v是g、a或c或其类似物,并且n是任何核苷酸或其类似物。这种寡核苷酸中的t可以是t类似物,因为它能够与a特异性碱基配对。
[0041]
用于逆转录rna的术语“序列特异性引物”意指与mrna或靶rna中的独特序列杂交的引物。序列特异性引物没有随机序列,也不是由单个核苷酸组成的。随机引物和oligo(t)引物不是序列特异性引物。
[0042]
术语“cdna拷贝”是指具有rna分子的反向互补的dna分子(即第一链cdna)或具有与rna分子相同的序列但u是t的dna分子(即第二链cdna)。rna分子可以是任何类型的rna,例如小rna、片段或mrna、或lncrna的片段等。
[0043]
术语“反应条件”是指反应的温度、反应温育的时间长度和/或反应的组分(例如,盐的量、酶、ph、使用的二价阳离子、酶抑制剂等)。
[0044]
其他术语的定义可以出现在整个说明书中。
[0045]
发明详述
[0046]
在描述各种实施方案之前,应当理解,本公开内容的教导不限于所描述的特定实施方案,并因此当然可以改变。还应理解,本文中使用的术语仅用于描述特定实施方案的目的,而不是旨在限制,因为本教导的范围将仅由所附权利要求书限制。
[0047]
本文使用的章节标题仅用于组织目的,不得解释为以任何方式限制所描述的主题。虽然结合各种实施方案来描述本教导,但本教导并不打算限于这些实施方案。相反,如本领域技术人员将理解的,本发明的教导包括各种备选方案、修改和等效方案。
[0048]
除非另有定义,否则本文中使用的所有技术和科学术语具有与本公开内容所属领域的普通技术人员通常理解的相同含义。尽管与本文所描述的方法和材料类似或等效的任何方法和材料也可以用于本教导的实践或测试中,但是现在描述一些示例性方法和材料。
[0049]
引用任何出版物的目的在于其在申请日之前披露,不应被解释为承认本权利要求无权凭借在先发明而早于所述出版物。此外,所提供的公布日期可以不同于需要独立确认的实际公布日期。
[0050]
在阅读本公开内容后对本领域技术人员将显而易见的是本文所描述和示例说明的单个实施方案中的每一个具有离散的组件和特征,这些组件和特征可以容易地与任何其他几个实施方案的特征分离或组合,而不脱离本教导的范围或精神。任何所述的方法都可以按照所述的事件的顺序或逻辑上可能的任何其他顺序来执行。
[0051]
本文所提及的所有专利和出版物,包括在这些专利和出版物中公开的所有序列,均通过引用被明确地并入本文。
[0052]
图1示出了所述方法的实施方案的一些原理。参考图1,所述方法的一些实施方案可包括将包含mrna的样品例如mrna 2片段化以产生不同长度的rna片段群体4,其中rna片段群体4包括较长rna片段6和较短rna片段8。该片段化步骤可以多种不同方式进行。例如(并且如将在下面更详细地描述的),rna样品2可以含有cdna:mrna杂交体(即,可以包含使用例如oligo(dt)引物引发的逆转录产物),并且可以通过用rnaseh处理样品来完成mrna的片段化(参见2017年11月20日提交的美国申请序列号15/818,469,其通过引用并入本文)。也可以通过将dna寡核苷酸(例如其可以是序列特异性的或随机的)与rna杂交以产生dna:mrna杂交体,然后用rnaseh处理杂交体来完成片段化。可替代地,可通过在存在二价阳离子(例如mg
2
或zn
2
)的情况下将mrna加热(例如,加热到至少60℃的温度)至少5分钟的时间段或其他方法(参见,例如,leven等人,nat methods.2010 7:709
‑
715)来将mrna片段化。取决于所使用的片段化条件,片段化步骤可产生长度为至少20个核糖核苷酸的较长片段和长度为15个或更少的核糖核苷酸的较短片段。在制备片段后,使用polya聚合酶选择性地腺苷酸化较长片段6以产生加尾的rna 9。在其中polya聚合酶优先地将polya尾添加到较长rna片段而非较短片段的条件下,通过将rna片段4群体与polya聚合酶温育来完成优先地将polya尾添加到较长rna片段而非较短rna片段来产生加尾的rna 9。合适的反应条件限制了polya聚合酶在反应中的活性。仅对较长片段优先地加尾的有效活性通常比在聚腺苷酸化反应中通常使用的活性小得多(例如,至少1/10)。在这些条件下,认为反应不能完全进行,并且有限的酶活性选择较长底物。酶的活性可以以多种不同方式来限制。例如,在本方法中,在反应条件(即,聚腺苷酸化反应缓冲液)可以包含浓度小于0.02u/ul的polya聚合酶(例如,浓
度为0.002u/ul至0.02u/ul或0.003u/ul至0.015u/ul的polya)的本发明方法中,其中polya聚合酶的单位定义为使用sambrook和russell的方法(molecular cloning,v3,2001,pp.a8.25
‑
a8.26)分析的,在37℃,在包含酶、15
‑
mer rna寡核苷酸、1x反应缓冲液(50mm tris
‑
hcl、250mm nacl、10mm mgcl2、ph 7.9@25℃)、1mm atp、2.5mm mncl2和3h
‑
atp的反应中,10分钟内将1nmol atp掺入酸不溶性物质中的酶的量。典型的聚腺苷酸化反应使用浓度为0.333u/ul至0.5u/ul的polya聚合酶,并因此,本反应可使用少于常规反应的polya聚合酶浓度的1/20。例如,10ul至20ul的聚腺苷酸化反应可包含少于0.25单位的polya聚合酶(例如,0.05至0.15单位的polya聚合酶)。典型的聚腺苷酸化反应使用2
‑
5个单位的polya聚合酶。可替代地,可以使用反应缓冲液中减少量的二价阳离子来限制polya聚合酶的活性。polya聚合酶需要二价阳离子(通常为mg
2
)才能发挥活性,并且在二价阳离子(例如mg
2
)的量减少的反应中,其活性可能会减弱。因此,在一些实施方案中,反应条件(即,聚腺苷酸化反应缓冲液)可以包含0.6mm至1.2mm(0.75mm至1.0mm)的二价阳离子,例如,mg
2
,其中典型的polya加尾反应可以包含约10mm mg
2
(请参阅上述用于确定polya聚合酶单位的反应条件)。典型的反应包括温育少于1小时的时间段(例如,5分钟到30分钟,多至1小时)。通过改变其他反应条件,例如温育的时间或温度,或通过操纵反应的其他组分,可能产生相同的效果。典型的聚腺苷酸化反应可以具有1ng至1ug的片段化的rna,但这可以有所不同。例如,如果使用1ng的总rna作为靶向至polya rna的片段化反应的输入,则只有一小部分rna(例如低至10pg)可以被片段化。
[0053]
在产生加尾的rna 9之后,加尾的rna可以与oligo(dt)寡核苷酸杂交。在与oligo(dt)寡核苷酸杂交后,所述方法可包括使用oligo(dt)寡核苷酸作为引物逆转录加尾的rna以产生cdna文库,或通过洗去未与oligo(dt)寡核苷酸杂交的rna分子来富集加尾的rna。在后一实施方案中,如果需要,可以使用oligo(dt)柱对加尾的rna 9进行亲和力选择。如图1所示,在产生加尾的rna 9之后,可对加尾的rna 9进行逆转录以产生cdna文库10。在一些实施方案中并且如图1所示,可使用oligo(dt)引物(例如,可具有5’尾的锚定oligo(dt)引物)对加尾的rna 9进行逆转录。如图1所示,只有聚腺苷酸化的rna(即,聚腺苷酸化的rna而不是未聚腺苷酸化的rna)会被复制成cdna,因为oligo(dt)引物只会与聚腺苷酸化的rna杂交。因此,图1所示的方法提供了一种优先地从较长rna制备cdna的方法。如所示的,所述方法可在不存在物理尺寸选择步骤的情况下进行,物理尺寸选择步骤涉及将rna片段4与选择性结合到较短rna片段或较长rna片段的基质温育。然而,如果需要,可以采用物理尺寸选择步骤。
[0054]
图2示例说明了如何使用rnaseh产生rna的片段的实例。应该注意的是,图中所示的方法并不是可以用于制备rna的片段的唯一方法。图2中示例显示的方法可包括逆转录包含polya加尾的mrna的rna样品12以产生第一链cdna产物14。polya加尾的mrna可来自细胞(例如,真核细胞)或通过使用polya聚合酶将polya尾添加到非polya加尾的mrna群体中来制备。如所示的,第一链cdna产物14包含cdna:rna杂交体,其包含rna和rna的cdna拷贝。在图2所示的实施方案中,可使用oligo(dt)引物(例如,锚定的oligo(dt)引物)来引发逆转录。在其它实施方案中,可使用一个或多个序列特异性引物(例如,与rna中的独特序列杂交的引物)或随机引物来完成初始逆转录步骤。可替代地,可通过将序列特异性或随机寡核苷酸与rna样品杂交来制备dna:rna杂交体。例如,rna样品可包含例如总细胞rna、已耗尽一种
或多种类型的rna(例如,rrna和/或trna)的总rna、lncrna、尺寸选择的rna或mrna和小rna,尽管考虑了其它组合。在一些实施方案中,可通过“热启动”程序来完成逆转录,其中将两种互补混合物预热至温育温度,然后将它们混合在一起。在这些实施方案中,初始逆转录步骤可通过以下完成:(i)将包含引物和rna样品的第一混合物预热至40
‑
80度范围内的温度,(ii)将包含逆转录酶的第二混合物预热至40
‑
80度范围内的温度,(iii)混合第一和第二混合物以产生反应混合物;并且在40
‑
80℃的温度下将反应混合物温育足够的时间(例如,至少5分钟),以产生第一链cdna产物。如图2所示,所述方法可包括用rnaseh处理第一链cdna产物14以产生消化的样品16,其包含mrna的片段。在实践中,根据dna:mrna杂交体的长度和每个dna:mrna杂交体发生的切割事件的数量(即,rnaseh切刻dna:mrna杂交体的mrna分子的次数),每个dna:mrna杂交体的mrna的片段数可能有很大的不同。在一些实施方案中,至少90%的dna:mrna杂交体可以各自产生大约4至200个dna:mrna杂交。片段14的中值长度可以是至少20个核苷酸(例如,在20至100或20至50个核苷酸的范围内)。如前所述,可以使用另一种方法将rna片段化。一些替代方法产生具有5’羟基和3’磷酸的rna片段,并因此,在进入下一步之前可能需要磷酸酶和/或激酶处理。可以将mrna片段化至10至200个核苷酸的中值长度。在一些实施方案中,片段的中值长度为10
‑
25个核苷酸。在其它实施方案中,中值长度可为40
‑
150个核苷酸。在任一实施方案中,将存在大量长度为15个核苷酸或以下的分子,其可使用本方法消除。
[0055]
在一些实施方案中,所述方法的初始步骤所需的逆转录酶和rnaseh活性由不同的酶提供。在这些实施方案中,可使用rnaseh
‑
逆转录酶来完成逆转录步骤,且可使用单独的酶来完成rnaseh处理。在一些实施方案中,逆转录和/或rnaseh可以是热稳定的。在一些实施方案中,初始逆转录步骤可在40℃至80℃范围内的温度下进行。在一些实施方案中,rnaseh处理步骤可在40℃至80℃范围内的温度,例如,在60℃至80℃范围内的温度下进行。据认为,在高温下,由rnaseh切割产生的未完全消化的mrna片段(例如,具有15至50个核苷酸范围内的中值长度的片段)开始与它们所结合的cdna解离。rnaseh需要双链底物,并且因为它们的解离阻止了片段成为rnaseh的底物,所以在15至50个核苷酸范围内的mrna片段不应该被进一步消化,即使在长时间温育中也是如此。因此,在一些实施方案中,可调整反应条件(盐浓度和温度)以产生具有预定尺寸范围的片段。较高的盐和/或较高的温育温度理论上应导致具有较长中值长度的片段群体,并且较低的盐和/或较低的温育温度理论上应导致具有较短中值长度的片段群体。片段的长度还可以通过改变所用酶的量和/或温育条件和/或通过改变总rna输入浓度来定制。在一些实施方案中,为了避免mrna的完全消化并获得所需长度的mrna片段,在rnaseh处理中使用的rnaseh的量可小于用于其它反应的rnaseh的量的十分之一。例如,如果5个单位的rnaseh通常用于将mrna消化至完全,则在本方法中可使用0.1至0.5个单位的rnaseh(例如,在0.3至0.16单位范围内的量),其中1个单位的rnaseh是使用hillenbrand和saudenbauer的方法(nucleic acids res.,1982 10:833),在所使用的条件下,于37℃在20分钟内从[3h]poly(a)x poly(dt)产生1nmol酸溶性核糖核苷酸的酶的量。
[0056]
接下来并且如图2所示,所述方法可包括使用图1中所述的方法对mrna片段进行聚腺苷酸化以产生cdna文库18。
[0057]
可以使用任何合适的方法对通过图1和图2所示的方法产生的聚腺苷酸化的片段
进行逆转录。图3示出了这种方法的一个示例,但显而易见的是,可以使用其他方法。例如,可以通过模板转换而不是连接将5’衔接子序列添加到逆转录产物中。在图3所示的实例中,所述方法可以包括使用polya聚合酶将poly(a)尾添加到样品24的较长rna片段20而不是较短rna片段22的3’末端,如上所述,以产生加尾的rna 26。如所示的,在加尾的rna 26中,较长片段20有a尾,而较短片段22没有a尾。接下来,可以通过将5’衔接子28连接到加尾的片段(和未加尾的片段)对片段进行逆转录,以产生衔接子标记的样品30。在一些实施方案中,5’衔接子可以是长度在5至20nt范围内的单链寡核苷酸(例如,长度为6、7、8、9、10、11或12nt),但长度超出此范围的衔接子也可以采用。衔接子可以是rna寡核苷酸、dna寡核苷酸或包含dna和rna的寡核苷酸。可使用wang等人(rna 2007 13:151
‑
159)或lockhart等人(uspn 6,344,316)等中概述的任何方法,使用rna连接酶(例如,t4 rna连接酶),将衔接子连接至消化的样品的rna分子上。所述方法中使用的rna连接酶可以是任何合适的连接酶。在一些实施方案中,可以使用t4 rna连接酶,尽管可以使用对单链底物具有优先性的多种其他rna连接酶。在一些实施方案中,使用的rna连接酶可以是热稳定的。在这些实施方案中,连接反应可以在高温下进行,所述高温可以在40至80℃的范围内。
[0058]
可以使用oligo(dt)引物32(例如,锚定的oligo(dt)引物)逆转录a
‑
加尾的、衔接子连接的样品30中的较长片段,以产生cdna文库36。在所示的实施方案中,oligo(dt)引物32包含任选的5’尾34,其不与a
‑
加尾的、衔接子连接的rna 30杂交。如图3所示,可以通过pcr任选地扩增cdna文库36以产生扩增产物40。该步骤可以使用具有与5’衔接子中的序列相同的3’末端的第一引物38和具有与oligo(dt)引物的尾中的序列相同的3’末端的第二引物39来完成。如所示的,扩增产物40含有较长rna片段而不是较短rna片段的扩增子。在一些实施方案中,可以在分析之前对扩增产物进行尺寸选择步骤以除去未掺入的引物和/或不需要的种类,例如rrna片段或snorna。
[0059]
在使用rnaseh将rna片段化的一些实施方案中,在所述方法的第一步骤中制备的cdna本身不被分析,并因此在测序之前,在所述方法的初始步骤中制备的cdna分子可被降解(例如,使用dnase处理)、丢弃(例如,通过尺寸分离纯化文库中的cdna)和/或稀释(通过优先地扩增cdna文库中的cdna分子)。
[0060]
在一些实施方案中,除了mrna外,初始样品(在片段化之前)可包含长度在20至50个核苷酸范围内并且具有20nt至40nt范围内的中值长度的小rna。小rna包括微rna(mirna)分子、微小的非编码rna(tncrna)分子和小调节性rna(smrna)分子等。在这些实施方案中,初始片段化步骤可避免对小rna的片段化。例如,如果在二价阳离子存在的情况下通过加热使初始rna片段化(其主要切割较长rna,因为它们比短rna包含更多的切割位点),那么可以在小rna被显著片段化之前终止切割反应。在其他情况下,可以避免小rna的切割,因为它们不包含polya尾。具体而言,如果使用图2中示例显示的方法进行片段化,则小rna不应被片段化,因为它们不具有polya尾并且在最初的逆转录步骤中不会被复制成cdna。rnaseh需要dna:rna杂交体,并因此,只有已经被逆转录的rna(而不是小rna或没有被逆转录的其他类型的rna)应该被rnaseh切割。如果样品中存在小rna,则rna可被片段化成与小rna长度相似的中值长度。小rna长度可以在20
‑
29个核苷酸的范围内,并且许多小rna长度为约20
‑
25个核苷酸。因此,如果要分析小rna和较长rna(例如,mrna和lncrna),则rna可以被片段化成10至100个核苷酸(例如,15至50个核苷酸)的中值长度。因此,在一些实施方案中,所述方法可
包括将所述样品片段化以产生不同长度的rna片段群体,其中rna片段群体包括:i.较长rna,其包括未片段化的小rna和mrna的片段,和ii.较短rna,其包括mrna的片段,通过在合适的反应条件下(如上所述)用polya聚合酶温育rna片段群体,将polya尾添加到较长rna而不是较短rna,以产生加尾的rna,其包含加尾的rna片段和加尾的未片段化的小rna;(c)将加尾的rna与oligo(dt)寡核苷酸杂交;和(d)使用oligo(dt)寡核苷酸作为引物逆转录加尾的rna,以产生cdna文库或通过洗涤掉未与oligo(dt)寡核苷酸杂交的rna分子来富集加尾的rna。例如,在一些实施方案中,所述方法可包括逆转录加尾的rna以产生cdna文库,其包含:i.小rna的拷贝和ii.较长rna片段的拷贝。在这些实施方案中,小rna和rna片段都具有5’磷酸和3’羟基,并且因此可以聚腺苷酸化、连接到衔接子并在同一反应中一起逆转录(例如,如上所述,使用poly
‑
a聚合酶聚腺苷酸化任何较长rna的3’末端,例如,将5’衔接子连接到任何具有5’磷酸的rna分子上,并使用oligo(dt)引物逆转录任何已经加尾的分子)。cdna文库可以包含在所述方法的初始步骤中制备的第一链cdna,也可以不包含。在一些情况下,在所述方法的初始步骤中制备的第一链cdna可在制备cdna文库之前已被移除或降解。所述方法的该实施方案提供了在同一工作流程中分析小rna和mrna的方法。
[0061]
如上所述,在对cdna进行测序的实施方案中,可以使用一种或多种与添加的序列(或其互补序列)杂交的引物扩增cdna文库。在一些实施方案中,所使用的引物可以具有与所使用的测序平台兼容的序列(例如,p5和p7序列,所述序列与illumina的测序平台兼容),并且扩增产物将在其末端具有那些序列(例如,如果正在使用illumina测序平台,则p5序列在一个末端,并且p7序列在另一个末端)。
[0062]
测序步骤可以使用任何方便的下一代测序方法完成,并且可以产生至少10,000、至少50,000、至少100,000、至少500,000、至少1百万、至少1千万、至少1亿、10亿或至少100亿个序列读数。在一些情况下,读数是配对末端读数。显而易见的是,用于扩增的引物可以与其中使用引物延伸的任何下一代测序平台兼容,例如illumina的可逆终止子方法、roche的焦磷酸测序方法(454)、life technologies的连接测序(solid平台)、life technologies的ion torrent平台或pacific biosciences的荧光碱基切割方法。在以下参考文献中描述了这样的方法的实例:margulies等人(nature 2005437:376
‑
80);ronaghi等人(analytical biochemistry 1996 242:84
‑
9);shendure(science 2005 309:1728);imelfort等人(brief bioinform.2009 10:609
‑
18);fox等人(methods mol biol.2009;553:79
‑
108);appleby等人(methods mol biol.2009;513:19
‑
39)english(plos one.2012 7:e47768)和morozova(genomics.200892:255
‑
64),通过引用针对方法和方法的特定步骤的一般描述将其并入本文,包括每个步骤的所有起始产物、试剂和最终产物。
[0063]
在某些实施方案中,被测序的cdna可以包含由多个不同rna样品制成的cdna文库的集合(pool),其中不同的cdna文库具有分子条形码(在衔接子或pcr引物中)以指示其来源。在一些实施方案中,被分析的cdna可以源自单一来源(例如,单一生物、病毒、组织、细胞、受试者等),而在其他实施方案中,被测序的cdna可以是从多个来源中提取的核酸的集合(例如,来自多个生物、组织、细胞、受试者等的核酸的集合),其中“多个”是指两个或更多个。因此,在某些实施方案中,被测序的cdna可以含有来自2个或更多个来源,3个或更多个来源,5个或更多个来源,10个或更多个来源,50个或更多个来源,100个或更多个来源,500个或更多个来源,1000个或更多个来源,5000个或更多个来源,多至并且包括约10,000个或
更多个来源的核酸。分子条形码使得可以在其被分析后区分来自不同来源的序列。序列读数可以由计算机分析,并因此,可以将用于执行以下阐述的步骤的指令阐述为可以记录在合适的物理计算机可读存储介质中的程序。
[0064]
本文所述的方法可用于分析来自几乎任何生物和/或样品类型的mrna,和任选地小rna,所述生物和/或样品类型包括但不限于植物、动物(例如,爬行动物、哺乳动物、昆虫、蠕虫、鱼类等)、组织样品、尸体组织、考古/古代样品等。在某些实施方案中,所述方法中使用的rna样品可源自哺乳动物,其中在某些实施方案中,哺乳动物是人。在示例性实施方案中,rna样品可以含有来自哺乳动物细胞(例如,人、小鼠、大鼠或猴细胞)的rna。样品可以由培养的细胞或临床样品(例如,组织活检、刮擦或灌洗)的细胞或者法医样品的细胞(即在犯罪现场收集的样品的细胞)制成。在特定实施方案中,rna样品可以获自生物学样品,例如细胞、组织、体液和粪便。感兴趣的体液包括但不限于血液、血清、血浆、唾液、粘液、粘痰、脑脊液、胸膜液、泪液、乳导管液、淋巴液、痰、脑脊髓液、滑液、尿液、羊水和精液。在特定实施方案中,样品可以获自受试者,例如人。在一些实施方案中,分析的样品可以是从血液(例如从怀孕的女性或患者的血液)中获得的cfrna的样品。
[0065]
本方法可以用于各种诊断、药物发现和研究应用中,包括但不限于疾病或病况的诊断或监测(其中mrna和/或小rna的表达提供了疾病或病况的标志物),药物靶标的发现(其中mrna和/或小rna在疾病或病况中差异表达并且可成为药物治疗的靶标),药物筛选(其中通过评估mrna和/或小rna的水平来监测药物的效果),确定药物敏感性(其中药物敏感性与mrna和/或小rna的特定谱相关)和基础研究(其中需要鉴定样品中是否存在mrna和/或小rna,或在某些实施方案中,两个或更多个样品中的特定mrna和/或小rna的相对水平)。
[0066]
在某些实施方案中,可以使用上述方法获得两个或更多个不同小rna样品中的mrna和/或小rna的相对水平,并进行比较。在这些实施方案中,通常将从上述方法获得的结果标准化为样品中rna的总量或对照rna(例如组成型rna),并进行比较。这可以通过比较比率或通过任何其他方式来完成。在特定实施方案中,可以比较两个或更多个不同样品的mrna和/或小rna谱,以鉴定与特定疾病或病况相关的mrna和/或小rna(例如,由疾病或病况诱导的mrna和/或小rna,并因此可以是与该疾病或病况有关的信号转导途径的一部分)。
[0067]
不同的样品可以由“实验”样品(即感兴趣的样品)和可以与实验样品进行比较的“对照”样品组成。在许多实施方案中,不同样品是成对的细胞类型或其级分,一种细胞类型是感兴趣的细胞类型,例如,异常细胞,而另一种是对照,例如正常细胞。如果比较两个细胞级分,则这些级分通常是来自两个细胞中的每一个的相同级分。然而,在某些实施方案中,可以比较同一细胞的两个级分。示例性的细胞类型对包括,例如,从组织活检(例如,从患有诸如结肠癌、乳腺癌、前列腺癌、肺癌、皮肤癌的疾病或被病原体感染等的组织)中分离的细胞和来自同一组织、通常来自同一患者的正常细胞;在组织培养中生长的、永生的(例如,具有增殖突变或永生化转基因的细胞)、感染病原体的或经过处理的(例如,使用环境或化学制剂,例如肽、激素、温度变化、生长条件、物理应激、细胞转化等)细胞和正常细胞(例如,除了不是永生的、感染的或经处理的等而与实验细胞在其他方面相同的细胞);从患有癌症、疾病的哺乳动物、老年性哺乳动物或暴露于病况的哺乳动物中分离的细胞,以及来自相同的种、优选相同的科的健康或年轻哺乳动物的细胞;以及来自同一哺乳动物的分化细胞和未分化细胞(例如,一个细胞是哺乳动物中另一个细胞的祖细胞)。在一个实施方案中,可以
使用不同类型的细胞(例如神经元和非神经元细胞)或不同状态的细胞(例如在对细胞刺激之前和之后)。在本发明的另一个实施方案中,实验材料是易受病原体(例如病毒,例如人免疫缺陷病毒(hiv)等)感染的细胞,而对照材料是对病原体感染具有抗性的细胞。在本发明的另一个实施方案中,样品对由未分化的细胞(例如干细胞)和分化的细胞来代表。
[0068]
在一些实施方案中,可以分析序列读数以提供对样品中存在哪些序列的定量确定。这可以通过以下完成:例如,根据它们片段化断裂点和/或它们是否含有相同的索引序列(其例如可以存在于5’衔接子中),对序列读数进行计数或可替代地在扩增之前对原始起始分子的数量进行计数。将分子条形码与片段的其他特征(例如,片段的末端序列,其定义断裂点)结合使用以区分片段是已知的。用于计数单个分子的分子条形码和示例性方法在casbon(nucl.acids res.2011,22e81)和fu等人(proc natl acad sci u s a.2011 108:9026
‑
31)等中进行了描述。分子条形码在us 2015/0044687、us 2015/0024950、us 2014/0227705、us 8,835,358和us 7,537,897以及各种其他出版物中有所描述。
[0069]
还提供了用于鉴定与表型例如疾病、病况或临床结果等相关的模式的方法。在一些实施方案中,该方法可以包括(a)对多个rna样品进行上述方法,其中rna样品是从患有已知表型例如疾病、病况或临床结果的患者中分离的,从而确定来自每个患者的哪些rna;和(b)鉴定与表型相关的特征。
[0070]
在一些实施方案中,特征可以是诊断性的(例如,可以提供疾病或病况或者疾病或病况的类型或阶段的诊断等)、预后的(例如,指示临床结果,例如在一定时间范围内的存活或死亡)或治疗诊断的(例如,指示哪种治疗最有效)。
[0071]
还提供了用于分析患者样品的方法。在该实施方案中,所述方法可以包括:(a)使用上述方法鉴定在患者中表达不足和/或过表达的序列;(b)将所鉴定的序列与和表型例如疾病、病况或临床结果等相关的一组特征序列进行比较;和(c)提供指示与表型相关的报告。该实施方案可以进一步包括基于比较结果进行诊断、预后或治疗诊断。
[0072]
在一些实施方案中,所述方法可以涉及创建报告(其电子形式可以已经从远程位置发送)并将该报告发送给医生或其他医疗专业人员以确定患者是否具有表型(例如癌症等)或为患者鉴定合适的疗法。该报告可以用作诊断以确定受试者是否患有疾病或病况,例如癌症。在某些实施方案中,例如,所述方法可以用于确定癌症的分期或类型、鉴定转移的细胞或监测患者对治疗的反应。
[0073]
在任何实施方案中,报告可以被发送到“远程位置”,其中“远程位置”是指除了检查图像的位置以外的位置。例如,远程位置可以是同一城市中的另一位置(例如办公室、实验室等),不同城市中的另一位置,不同州的另一位置,不同国家的另一位置等。因此,当一个项目被指示为与另一项目“远程”时,意味着这两个项目可以在同一房间中但分开、或者至少在不同的房间或不同的建筑物中,并且可以相隔至少一英里、十英里、或至少一百英里。“通信”信息指的是通过适当的通信信道(例如,专用或公共网络)将表示该信息的数据作为电信号传输。“发送”项目是指通过物理运输该项目或以其他方式(在可能的情况下)将该项目从一个位置移至另一位置的任何方式,并且至少在数据的情况下物理运输携带数据的介质或通信数据。通信介质的实例包括无线电或红外线传输信道以及连接到另一台计算机或联网设备的网络,以及互联网或包括电子邮件传输和记录在网站等上的信息。在某些实施方案中,报告可以由医学博士或其他合格的医学专业人员进行分析,并且可以将基于
图像分析结果的报告发送给从其获得样品的患者。
[0074]
因此,除其他外,本发明方法可以用于将某些基因的表达与某些生理事件联系起来。
[0075]
实施方案
[0076]
实施方案1.一种用于处理rna样品的方法,其包括:
[0077]
(a)将包含rna的样品片段化以产生不同长度的rna片段群体,其中所述rna片段群体包括较长rna片段和较短rna片段,
[0078]
(b)在其中polya聚合酶优先地将polya尾添加到所述较长rna片段而不是所述较短片段的条件下,将所述polya聚合酶与所述rna片段群体温育,以产生加尾的rna;
[0079]
(c)将所述加尾的rna与oligo(dt)寡核苷酸杂交;和
[0080]
(d)(i)使用所述oligo(dt)寡核苷酸作为引物逆转录所述加尾的rna,以产生cdna文库,或(ii)通过洗去未与所述oligo(dt)寡核苷酸杂交的rna分子来富集所述加尾的rna。
[0081]
实施方案2.实施方案1所述的方法,其中所述rna样品包含至少mrna。
[0082]
实施方案3.任何前述实施方案所述的方法,其中所述较长片段长度为至少20个核糖核苷酸,而所述较短片段长度为至多15个核糖核苷酸。
[0083]
实施方案4.任何前述实施方案所述的方法,其中步骤(b)的条件包含0.6mm至1.2mm的二价阳离子。
[0084]
实施方案5.任何前述实施方案所述的方法,其中步骤(b)的条件包含0.75mm至1.0mm的二价阳离子。
[0085]
实施方案6.实施方案4或5所述的方法,其中所述二价阳离子为mg
2
。
[0086]
实施方案7.实施方案1
‑
3中任一项所述的方法,其中步骤(b)的条件包含浓度小于0.02u/ul的polya聚合酶。
[0087]
实施方案8.实施方案1
‑
3中任一项所述的方法,其中步骤(b)的条件包含浓度在0.002u/ul至0.02u/ul范围内的polya聚合酶。
[0088]
实施方案9.任何前述实施方案所述的方法,其中步骤(a)的样品包含dna:rna杂交体,并且所述方法包括用rnaseh处理所述样品。
[0089]
实施方案10.实施方案1
‑
8中任一项所述的方法,其中步骤(a)通过在二价阳离子存在的情况下加热所述rna来完成。
[0090]
实施方案11a.任何前述实施方案所述的方法,其中步骤(a)的样品还包含小rna,其中:步骤(a)的rna片段群体包括:i.较长rna,其包括未片段化的小rna和rna的片段,以及ii.较短rna,其包括rna的片段,步骤(b)的加尾的rna包括加尾的rna片段和加尾的未片段化的小rna。
[0091]
实施方案11b.任何前述实施方案所述的方法,其中步骤(a)的样品还包含小rna,其中所述方法包括:
[0092]
(a)将所述样品片段化以产生不同长度的rna片段群体,其中所述rna片段群体包括:i.较长rna,其包括未片段化的小rna和rna的片段,以及ii.较短rna,其包括rna的片段,
[0093]
(b)在其中polya聚合酶优先地将polya尾添加到较长rna而非较短rna的条件下,将所述polya聚合酶与所述rna片段群体温育,以产生加尾的rna,其包含加尾的rna片段和加尾的未片段化的小rna;和
[0094]
(c)将所述加尾的rna与oligo(dt)寡核苷酸杂交;和
[0095]
(d)使用所述oligo(dt)寡核苷酸作为引物逆转录所述加尾的rna,以产生cdna文库或通过洗去未与所述oligo(dt)寡核苷酸杂交的rna分子来富集所述加尾的rna。
[0096]
实施方案12.实施方案11所述的方法,其中所述小rna包括微rna(mirna)分子、微小非编码rna(tncrna)分子、小调节性rna(smrna)分子、piwi
‑
相互作用rna(prna)分子和snorna分子。
[0097]
实施方案13.任何前述实施方案所述的方法,其还包括对所述cdna文库或富集的加尾的rna进行测序。
[0098]
实施方案14.实施方案13所述的方法,其中所述方法包括在测序之前通过pcr扩增所述cdna文库。
[0099]
实施方案15.任何前述实施方案所述的方法,其中所述方法还包括向(a)的rna片段群体或(b)的加尾的rna的5’末端添加衔接子序列。
实施例
[0100]
尽管为了清楚地理解,已经通过图示和示例的方式对上述发明进行了一些详细的描述,根据本发明的教导,对于本领域的普通技术人员显而易见的是,在不脱离所附权利要求的精神或范围的情况下,可以对其进行某些改变和修改。
[0101]
实施例1
[0102]
除了改变聚腺苷酸化步骤外,总共20ng mcf7总rna被片段化、聚腺苷酸化、连接到衔接子、逆转录和扩增,基本上如2017年11月20日提交的美国专利申请序列号15/818,469所述,并通过引用并入本文中。在illumina miseq上对文库进行测序。生成fastq文件,并使用cutadapt修剪读数,然后与人类转录组参考进行比对。samtools用于计数以每个插入长度的mrna比对的读数。
[0103]
在第一个实验中,将不同量的poly(a)聚合酶添加到聚腺苷酸化反应中。在本实验中,条件a(15ul)的聚腺苷酸化反应在1x缓冲液中含有1ul未稀释的poly(a)聚合酶(5u/ul)和10mm mgcl2,而条件b(15ul)中的聚腺苷酸化反应在1x缓冲液中含有1ul的1/48稀释的poly(a)聚合酶(5u/ul,在其酶存储缓冲液中稀释)和10mm mgcl2。条件a中酶的最终浓度为约0.33u/ul,而条件b中酶的最终浓度为约0.007u/ul。总共,条件a使用5u酶,而条件b使用约0.10u酶。
[0104]
第一个实验的结果如图4所示。这些结果表明,如果使用1/48稀释的poly(a)聚合酶,则对较短序列读数(即,较短片段的读数)的偏偏倚要小得多。
[0105]
在第二个实验中,使用不同量的mgcl2进行聚腺苷酸化反应。poly(a)聚合酶需要mgcl2,减少mgcl2的量降低酶的活性。在该实验中,条件c中的聚腺苷酸化反应在1x反应中包含1ul未稀释的poly(a)聚合酶和10mm mgcl2,而条件d中的聚腺苷酸化反应在1x反应中包含1ul未稀释的poly(a)聚合酶和1mm mgcl2。
[0106]
第二个实验的结果如图5所示。这些结果表明,如果在含有1mm mgcl2的反应缓冲液中进行聚腺苷酸化反应,则对较短序列读数(即,较短片段的读数)的偏倚要小得多。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
