从ffpe样本中快速提取核酸的试剂、试剂盒及其应用
技术领域
1.本发明属于分子生物学技术领域,具体涉及一种从ffpe样本中快速提取核酸的试剂、试剂盒及其应用。
背景技术:
2.随着精准医疗对病理科的影响渗透以及研究手段的不断升级,病理医生除了关注传统组织形态外,对ffpe(formalin fixation and paraffin embedding,福尔马林固定石蜡包埋)样本在分子层面的研究也越来越多。ffpe样本大部分与肿瘤相关,所以研究这些组织样本为探讨新的肿瘤分类、诊断和预后标准,开发肿瘤早期检测的实验技术、转化医学和个体化医学提供了有利的依据。
3.ffpe样本虽然使组织得以长期保存,但其特殊的制作方法和保存方式也会对核酸分子造成多方面的影响。首先,福尔马林固定液中含有的甲醛具有较高的反应活性,可以与带有
‑
oh、
‑
sh、
‑
nh2的分子发生亲核加成反应,并最终成为
‑
ch2‑
的提供者。当甲醛与上述基团中的两个发生反应后,自由的分子链也被交联起来,从而发挥对组织的固定作用,该过程也会对核酸分子产生不利的影响,watford等(1998)的研究发现,核酸对甲醛的反应性最初表现为核酸分子呈可逆性亚氨基和氨基的羟甲基化,随着固定时间的延长,生物大分子之间缓慢形成广泛的亚甲基交联桥,这也使核酸链的脆性增加,在受到剪切力作用时更容易发生随机断裂。一般而言,甲醛介导的dna损伤在固定3h后已经发生,固定时间越长,dna损伤越严重,越不易获得大片段dna。其次,用于组织包埋的固体石蜡为多种烷烃的混合物,其熔点为50
‑
65℃,化学性质稳定,在通常条件下不与酸性或碱性溶液发生反应,且目前尚无石蜡能直接导致包埋组织中dna降解的报道。但是有文献记载,在石蜡包埋过程中dna更容易发生降解,其原因可能是组织浸蜡与包埋时需要加热到62℃左右,此温度下dna部分解链,组织内残留的痕量甲醛对解链后的dna单链进行甲基化修饰,修饰后的dna单链在冷却后不易复性而发生降解。另外,石蜡会阻碍消化液对组织的渗透,减少蛋白酶k(pk)与组织内蛋白的接触,从而影响组织消化和dna释放。
4.为了解除甲醛固定所致dna
‑
蛋白质、rna
‑
蛋白质、蛋白质
‑
蛋白质之间的交联,美国专利us2005014203a1(expression pathology)公开了一种解交联方法,先将固定的生物样品加热(如95℃加热1.5h),以便部分断开生物分子之间的交联,然后将处理过的样品与蛋白水解酶如蛋白酶k一起孵育,分解组织和细胞结构。由于该方法需要在相对较高的温度下解交联,且在中等温度下解交联速度非常缓慢,因此,美国专利us20090202998a1(qiagen)公开了一种能在相对较低的温度下解交联的方法,包括:使固定的生物样品与亲核试剂(选自乙醇胺、二乙醇胺、三乙醇胺、2
‑
氨基
‑
1,3
‑
丙二醇、氨基胍等)接触,在65
‑
85℃下孵育一段时间,快速断开交联。此外,由于交联可通过加热的方式逆转,样品中过量的甲醛将阻碍任何涉及氨基的功能蛋白质、核酸等的加工或分析。为防止过量的甲醛再次形成交联、阻止有效的交联逆转,中国专利cn102803490b(qiagen)公开了一种核酸提取方法,将生物样品与包含清除剂(如己二酸二酰肼、琥珀酸二酰肼)的溶液接触,通过与甲醛反应将
其去除。
5.为了消除石蜡对dna提取和pcr扩增的不利影响,必须保证在不增加外源性pcr抑制因子和尽量减少dna损伤的前提下对组织进行彻底地脱蜡。目前,脱蜡通常使用芳族溶剂,如甲苯、二甲苯等。脱蜡时将ffpe样本浸入二甲苯浴中直至石蜡溶解,之后用一系列醇浓度降低的醇水溶液洗涤样本以除去二甲苯,最后用水洗涤,以使样本可用于含水反应物或试剂溶液。但是二甲苯是一种易燃易挥发且有毒的有机溶剂,容易使核酸片段化降低得率,并会对操作人员产生一定的危害。并且当组织切片的厚度超过10μm时,二甲苯等芳族溶剂难以渗透,会导致脱蜡不彻底,从而影响后续蛋白酶的消化效果。为此,中国专利cn102939381b(qiagen)公开了一种脱蜡技术,使蜡增溶剂(选自直链、支链或环状的c10
‑
c16烷烃或其混合物)与样本接触,室温孵育一段时间后加入水性裂解缓冲液,裂解得到包含水相和有机相的混合物,其中水相含有核酸,有机相含有溶蜡和蜡增溶剂。蜡增溶剂的沸点优选高于150℃,以确保在与样本接触时为液态,这样石蜡一旦液化便可保持液态,且不会因为蜡增溶剂的非有意挥发而再度硬化。然而直链烷烃的沸点与运动粘度有关,沸点越高、运动粘度也越高,因此用纯的直链烷烃无法获得与水相当的运动粘度,从而不利于其递送和去除。为便于自动化分离,美国专利us9097628b2(qiagen)公开了一种在室温下具有相对较低的运动粘度、但具有相对较高的沸点的聚有机硅氧烷脱蜡剂,包括聚二甲基硅氧烷、聚二乙基硅氧烷、聚甲基氢硅氧烷、聚甲基烷基硅氧烷、聚甲基芳基硅氧烷等,该脱蜡剂适用于自动化样品处理如移液机器人。除此以外,甲苯、二甲苯等芳族溶剂的替代物还包括萜烯油(如d
‑
柠檬烯)、矿物油等,或者可以参照美国专利us9243241b2(invitrogen)公开的方法采用加热的方式熔化石蜡,离心后待石蜡重新凝固漂浮在液面上方或者沉积在管壁上,再分离水相与石蜡相。
6.除上述脱蜡、解交联外,从ffpe样本中提取核酸的操作还包括裂解/消化、结合、洗涤和洗脱。通常情况下,从ffpe样本中分离出的dna呈高度降解状态,平均片段大小在60
‑
200bp之间(byers r等,2004),而扩增片段越小,越难针对限制区域设计引物,因此核酸提取方法也是影响基因分析的重要因素。在现有技术中,核酸提取方法包括蛋白酶k
‑
酚氯仿抽提法、chelex抽提法、固相载体吸附法等。其中,蛋白酶k
‑
酚氯仿抽提法需要使用有毒有害的有机溶剂,操作复杂且容易丢失大量dna,不适用于高度降解的样本。chelex抽提法操作快速,但容易残留扩增抑制物,不利于下游pcr分析。固相载体吸附法以固相吸附载体为基础,包括旋转离心柱提取法、玻璃珠吸附法、二氧化硅基质法、阴离子交换法和纳米磁珠提取法。这类方法的操作步骤主要分为四个部分:(1)利用裂解/消化缓冲液促使组织细胞破裂,使核酸释放于液相中;(2)利用固相吸附载体对核酸具有较强亲和力、吸附力的特性,将释放出来的核酸特异性地结合在固相吸附载体上,而蛋白质、多糖、脂质等杂质仍然保留在液相中,并随着上清液的移除而被去除;(3)使用一种或多种洗涤缓冲液多次洗涤固相吸附载体,彻底去除影响核酸分析的杂质;(4)使用洗脱缓冲液,通过调节离子强度和ph值,将结合在固相吸附载体上的核酸洗脱下来,从而得到纯化的核酸。在上述方法中,旋转离心柱提取法以其低廉的价格和相对便捷的操作,在市面上得到广泛应用。但是随着样本量的增多,离心柱法的缺陷也日益凸显,一是对样本的需求量大,提取损失多,二是提取过程需要反复离心,不便于高通量、自动化操作。相较之,纳米磁珠提取法明显具有以下优势:
①
样本需求量低,微量样本也能提取得到高浓度的核酸;
②
操作简单、快速,整个流程基本分为四
步:裂解、结合、洗涤、洗脱,全程无需离心操作;
③
提取质量稳定可靠,游离磁珠与核酸的结合量大,同时特异性结合使核酸的提取纯度更高,并且通过控制磁珠表面的修饰基团可以调节核酸的收率;
④
可实现自动化操作,提取通量高;
⑤
安全无毒害,提取试剂中不含酚、氯仿等有毒有害试剂,符合现代化环保理念。
7.为了快速提取ffpe样本中的核酸,中国专利申请cn108841920a公开了一种从ffpe样本中自动化提取核酸的方法,包括以下步骤:1)取1
‑
5片ffpe样本至离心管中,加入200
‑
1000μl的脱蜡剂;2)在室温或加热下混匀5
‑
10min,加热温度范围为30
‑
80℃,进行ffpe样本的脱蜡;3)加入20
‑
100μl的磁珠;4)加入磁珠后,在室温下充分混匀1
‑
5min,使磁珠与细胞组织充分接触,将离心管放在磁力架上或者在离心管中放入磁力棒,静置1
‑
5min待磁珠完全转移至磁力架或磁力棒一侧后,用移液装置将脱蜡剂全部移走;5)向离心管中加入500
‑
1000μl有机溶剂,在室温下充分混匀1
‑
5min,之后将离心管放在磁力架上或者在离心管中放入磁力棒,静置1
‑
5min,待磁珠完全转移至磁力架或磁力棒一侧后,用移液装置将有机溶剂全部移走;6)室温静置或加热5
‑
10min,加热温度范围为30
‑
80℃,使磁珠和细胞组织表面的有机溶剂残留量降低;7)在离心管中加入10
‑
50μl蛋白酶k及100
‑
400μl裂解液buffer dtl(80
‑
150mm的tris
·
cl,40
‑
70mm的edta,80
‑
150mm的二硫苏糖醇,3
‑
10%(v/v)十二烷基硫酸钠,10
‑
25%(v/v)的tween20)),置于一定的加热温度下(加热温度范围是30
‑
80℃,50
‑
65℃效果更好)将细胞组织裂解,使dna释放于溶液中;8)消化裂解1
‑
2h后,待溶液温度降至室温,加入100
‑
400μl结合液buffer dtb(80
‑
150mm的tris
·
cl,40
‑
70mm的edta,0.6
‑
1.2m的kcl,4
‑
6m的异硫氰酸胍))及50
‑
80%乙醇,充分混匀,在结合环境中使dna吸附在磁珠表面;9)室温下静置1
‑
5min后,将离心管放在磁力架上或者在离心管中放入磁力棒,静置1
‑
5min,待磁珠完全转移至磁力架或磁力棒一侧后,用移液装置将管内的溶液全部移走;10)向离心管中加入500
‑
1000μl洗涤液buffer dw1(50
‑
400mm的tris
·
cl,40
‑
100mm的edta,2
‑
5m的异硫氰酸胍,40
‑
70%乙醇);11)室温下充分混匀1
‑
5min,将离心管放在磁力架上或者在离心管中放入磁力棒,静置1
‑
5min,待磁珠完全转移至磁力架或磁力棒一侧后,用移液装置将管内的溶液全部移走;12)向离心管中加入500
‑
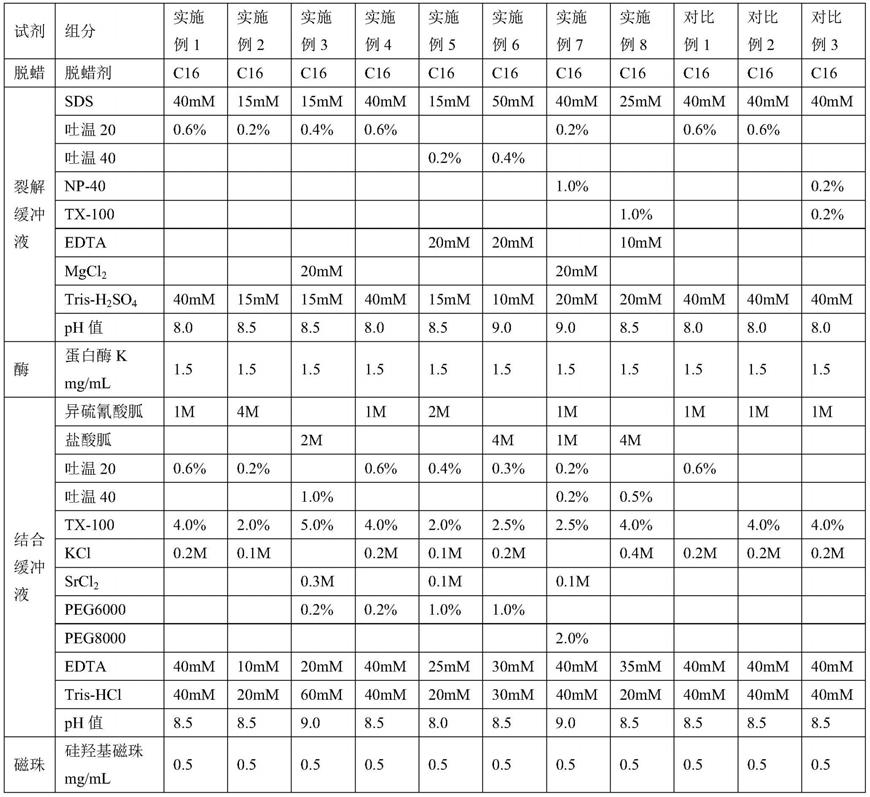
1000μl洗涤液buffer dw2(300
‑
700mm的tris
·
cl,0.8
‑
1.2m的nacl,70
‑
90%乙醇);13)室温下充分混匀1
‑
5min,将离心管放在磁力架上或者在离心管中放入磁力棒,静置1
‑
5min,待磁珠完全转移至磁力架或磁力棒一侧后,用移液装置将管内的溶液全部移走;14)向离心管内加入30
‑
200μl洗脱液buffer dte(10
‑
20mm的tris
·
cl,5
‑
10mm的edta)),室温下与吸附有核酸的磁珠充分混匀1
‑
5min,核酸逐渐从磁珠表面转移至溶液中;15)将离心管放在磁力架上或者在离心管中放入磁力棒,静置1
‑
5min,待磁珠完全转移至磁力架或磁力棒一侧后,用移液装置将管内的溶液全部移走,所得的溶液即为从ffpe样本中提取出的dna。然而,上述方法中使用的结合缓冲液的结合效果仍不够理想,与裂解、洗涤、洗脱缓冲液配合所得核酸的收率和纯度较低。因此,亟需一种能够高效、快速提取ffpe样本中核酸的试剂及方法。
技术实现要素:
8.本发明的目的是提供一种从ffpe样本中快速提取核酸的试剂,以缩短核酸提取时间,提高核酸得率。
9.其次,本发明还提供一种从ffpe样本中快速提取核酸的试剂盒。
10.最后,本发明还提供一种上述试剂或试剂盒在核酸提取中的应用。
11.为了实现以上目的,本发明所采用的技术方案是:
12.一种从ffpe样本中快速提取核酸的试剂,包括结合缓冲液,所述结合缓冲液包括以下组分:胍盐1
‑
5m,吐温系列表面活性剂0.1
‑
2%(v/v),聚乙二醇辛基苯基醚(triton x
‑
100)1
‑
5%(v/v),乙二胺四乙酸(edta)10
‑
40mm,tris
‑
hcl 20
‑
60mm,ph值为8.0
‑
9.5;余量为水。
13.作为一种优选的实施方式,所述胍盐为盐酸胍、硝酸胍、异硫氰酸胍中的一种或多种。进一步优选地,所述胍盐为盐酸胍或异硫氰酸胍。
14.作为一种优选的实施方式,所述吐温系列表面活性剂选自吐温20、吐温40、吐温60、吐温80中的一种或多种。进一步优选地,所述吐温系列表面活性剂为吐温20或吐温40。
15.作为一种优选的实施方式,所述结合缓冲液中还可以包括聚乙二醇(peg)。所述聚乙二醇的分子量为2000
‑
10000,浓度为0.1
‑
2%(w/v)。进一步优选地,所述聚乙二醇的分子量为6000
‑
8000。
16.作为一种优选的实施方式,当裂解缓冲液(水性)中包括十二烷基硫酸根离子源的阴离子型表面活性剂(如十二烷基硫酸钠、十二烷基硫酸铵、十二烷基硫酸锂)时,由于其浓度过高会严重抑制pcr反应,在裂解完成后应选择性去除裂解物中的十二烷基硫酸根离子。因此,在结合缓冲液中还应包括适量的十二烷基硫酸根离子沉淀剂,选自可溶性钾盐(k
)、铷盐(rb
)、铯盐(cs
)、钙盐(ca
2
)、锶盐(sr
2
)、钡盐(ba
2
)中的一种或多种。进一步优选为钾盐或锶盐;所述钾盐为氯化钾、硫酸钾、乙酸钾中的一种或多种,优选为氯化钾或乙酸钾。所述锶盐为氯化锶、乙酸锶中的一种或多种,优选为氯化锶。所述十二烷基硫酸根离子沉淀剂的浓度为0.1
‑
2m,应相较十二烷基硫酸根离子的浓度过量。
17.作为一种优选的实施方式,所述结合缓冲液包括以下组分:盐酸胍或异硫氰酸胍1
‑
4m,氯化钾或氯化锶0.1
‑
0.5m,吐温20或吐温40 0.1
‑
1%(v/v),聚乙二醇辛基苯基醚1
‑
4%(v/v),乙二胺四乙酸10
‑
40mm,聚乙二醇6000
‑
8000 0.1
‑
2%,氯化钾或氯化锶0.1
‑
2m,tris
‑
hcl20
‑
60mm,ph值为8.5
‑
9.5,余量为水。
18.作为一种优选的实施方式,所述结合缓冲液包括以下组分:盐酸胍或异硫氰酸胍1
‑
4m,氯化锶0.1
‑
0.5m,吐温20 0.1
‑
1%(v/v),聚乙二醇辛基苯基醚1
‑
4%(v/v),乙二胺四乙酸10
‑
40mm,聚乙二醇6000或聚乙二醇8000 0.1
‑
2%,氯化锶0.1
‑
2m,tris
‑
hcl 20
‑
60mm,ph值为8.5
‑
9.5,余量为水。
19.本发明的(磁珠)结合缓冲液配方简单,成本低廉,在胍盐存在下吐温系列表面活性剂(尤其是吐温20或吐温40)与聚乙二醇辛基苯基醚(tx
‑
100)的联合使用可以显著提高核酸与磁珠的特异性结合效果,增加核酸的结合量,并减弱杂质如蛋白质、脂质等的吸附,从而提高核酸得率和提取纯度。尤其是在聚乙二醇6000
‑
8000存在下进行结合,所得核酸的得率和纯度最佳。
20.作为一种优选的实施方案,所述从ffpe样本中快速提取核酸的试剂还包括磁珠。所述磁珠选自硅羟基磁珠、羧基修饰磁珠中的任意一种。所述磁珠可以为表面无孔或多孔的磁珠,如参照专利cn1974781b/cn1267447c(roche)、专利申请wo0171732a2(qiagen)中公开的方法制备,也可以采用市售商品。市售磁珠的粒径、用量等可以遵循厂家指导。
21.作为一种优选的实施方案,所述从ffpe样本中快速提取核酸的试剂还可以包括核
酸助沉剂。所述核酸助沉剂选自c1
‑
c5的一元醇、c1
‑
c9的多元醇中的一种或多种。所述c1
‑
c5的一元醇选自甲醇、乙醇、丙醇、异丙醇、丁醇、戊醇中的一种或多种,优选为乙醇或异丙醇。所述c1
‑
c9的多元醇选自2
‑
甲基
‑
1,3
‑
丙二醇、2,3
‑
丁二醇、1,2
‑
丙二醇、三丙二醇中的一种或多种,优选为2
‑
甲基
‑
1,3
‑
丙二醇(参见专利us9708645b2)。所述核酸助沉剂的使用浓度为5
‑
70%,优选为10
‑
60%,更优选为15
‑
50%。
22.作为一种优选的实施方案,所述从ffpe样本中快速提取核酸的试剂还可以包括脱蜡剂、裂解缓冲液(水性)、蛋白酶、甲醛清除剂、解交联试剂、漂洗缓冲液、洗脱缓冲液中的一种或多种。
23.作为一种优选的实施方式,所述脱蜡剂选自萜烯油(如d
‑
柠檬烯)、矿物油、c7
‑
c10的直链/支链烷烃或其混合物、柠檬精油、6
‑
溴己基乙酸酯(参见专利申请cn104232616a)、c10
‑
c16的直链/支链、环状烷烃或其混合物(如正十四烷、正十五烷、正十六烷,参见专利cn102939381b)、聚有机硅氧烷脱蜡剂(如聚二甲基硅氧烷、聚二乙基硅氧烷、聚甲基氢硅氧烷、聚甲基烷基硅氧烷、聚甲基芳基硅氧烷,参见专利us9097628b2)中的一种或多种。
24.作为一种优选的实施方式,所述裂解缓冲液(水性)包括以下组分:十二烷基硫酸根离子源的阴离子型表面活性剂、缓冲物质和硫酸(h2so4),所述硫酸用于调节裂解缓冲液的ph值为7.5
‑
10.0。所述十二烷基硫酸根离子源的阴离子型表面活性剂选自十二烷基硫酸钠(sds)、十二烷基硫酸铵、十二烷基硫酸锂中的一种或多种,优选为十二烷基硫酸钠。所述十二烷基硫酸钠的浓度为10
‑
50mm,优选为25mm。所述缓冲物质为tris、hepes、hpps、mops、mes中的任意一种,优选为tris。所述tris的浓度为10
‑
50mm,优选为25mm。所述裂解缓冲液中tris、十二烷基硫酸根的分子比例为2:1
‑
1:2,优选为1:1。所述裂解缓冲液的ph值进一步优选为8.0
‑
9.0,最优选为8.5。
25.作为一种优选的实施方式,所述裂解缓冲液的总离子浓度低于待裂解细胞内的总离子浓度。例如,当裂解缓冲液中存在nacl时,nacl的浓度应低于0.9wt%(约155mm)。
26.作为一种优选的实施方式,所述裂解缓冲液中还可以包括离液盐。所述离液盐为胍盐、碘化物、高氯酸盐、三氯乙酸盐中的一种或多种。所述胍盐选自盐酸胍、硝酸胍、异硫氰酸胍中的一种或多种。所述碘化物可以为碘化钠。所述高氯酸盐可以为高氯酸钠。所述三氯乙酸盐可以为三氯乙酸钠。进一步优选地,所述离液盐为胍盐,更优选为盐酸胍或异硫氰酸胍。
27.作为一种优选的实施方式,所述裂解缓冲液中还可以包括吐温系列表面活性剂、np系列表面活性剂、聚乙二醇辛基苯基醚(triton x
‑
100)中的一种或多种。所述吐温系列表面活性剂选自吐温20、吐温40、吐温60、吐温80中的一种或多种,浓度为0.1
‑
5%(v/v);进一步优选为吐温20或吐温40。所述np系列表面活性剂选自np
‑
30、np
‑
40、np
‑
50中的一种或多种,浓度为0.1
‑
5%(w/v);进一步优选为np
‑
40。所述聚乙二醇辛基苯基醚的浓度为0.1
‑
5(v/v)。
28.作为一种优选的实施方式,所述裂解缓冲液中还可以包括至少两种胺的组合物。所述至少一种胺选自甲胺、二甲胺、三甲胺、二乙胺、三乙胺、一乙醇胺、二乙醇胺、三乙醇胺、乙二胺、二乙烯三胺、六亚甲基四胺或苯胺(参见专利us9410146b2)。
29.作为一种优选的实施方式,所述裂解缓冲液可以包括或不包括螯合剂或络合剂。所述螯合剂或络合剂选自乙二胺四乙酸(edta)、乙二醇二乙醚二胺四乙酸(egta)、乙二胺
二琥珀酸(edds)、氨基三乙酸(nta)、葡萄糖酸、异抗坏血酸、酒石酸、柠檬酸、亚氨基二琥珀酸、三乙醇胺中的一种或多种;优选为乙二胺四乙酸。当考虑将裂解物直接用于下游pcr时,所述裂解缓冲液中优选不包括螯合剂或络合剂。
30.作为一种优选的实施方式,所述裂解缓冲液可以包括或不包括镁盐。所述镁盐选自氯化镁、硫酸镁、乙酸镁中的一种或多种;优选为氯化镁。进一步优选地,所述裂解缓冲液中不包括镁盐。
31.作为一种优选的实施方式,所述裂解缓冲液包括以下组分:十二烷基硫酸钠(sds)10
‑
50mm,吐温20或吐温40 0.1
‑
1%(v/v),tris
‑
h2so
4 10
‑
50mm,ph值为7.5
‑
10.0,余量为水。
32.本发明的裂解缓冲液适用于ffpe样本的裂解处理,尤其是在脱蜡剂存在下,可以与蛋白酶配合,快速破裂组织细胞、消化蛋白,将核酸释放出来。该裂解缓冲液与结合缓冲液的相容性较好,裂解物去除石蜡后可以直接加入结合缓冲液、磁珠和助沉剂,实现核酸与磁珠的特异性结合,去除蛋白质、脂质等杂质以及其他影响扩增的抑制因子,增加核酸的结合量,最终提高核酸的收率和纯度。
33.作为一种优选的实施方式,所述裂解缓冲液与蛋白酶联用。所述蛋白酶是一种催化水解切割多肽链中肽键的酶,也称作蛋白水解酶;优选为蛋白酶k。
34.作为一种优选的实施方式,所述甲醛清除剂选自己二酸二酰肼、琥珀酸二酰肼中的一种或多种。用量和使用方法参见专利cn102803490b。
35.作为一种优选的实施方式,所述解交联试剂选自乙醇胺、二乙醇胺、三乙醇胺、2
‑
氨基
‑
1,3
‑
丙二醇、氨基胍中的一种或多种。用量和使用方法参见专利us20090202998a1。
36.作为一种优选的实施方式,所述洗涤缓冲液中可以包括胍盐和有机溶剂。所述胍盐选自盐酸胍、硝酸胍、异硫氰酸胍中的一种或多种,进一步优选为盐酸胍或异硫氰酸胍。所述胍盐的浓度(足够高)需要确保核酸不会从磁珠上洗脱下来。所述有机溶剂选自c1
‑
c5的一元醇、c1
‑
c9的多元醇中的一种或多种。所述c1
‑
c5的一元醇选自甲醇、乙醇、丙醇、异丙醇、丁醇、戊醇中的一种或多种,优选为乙醇或异丙醇。所述c1
‑
c9的多元醇选自2
‑
甲基
‑
1,3
‑
丙二醇、2,3
‑
丁二醇、1,2
‑
丙二醇、三丙二醇中的一种或多种,优选为2
‑
甲基
‑
1,3
‑
丙二醇。所述有机溶剂的使用浓度为40
‑
99%,优选为50
‑
90%。
37.作为一种优选的实施方式,所述洗涤缓冲液中还可以包括缓冲物质。所述缓冲物质为tris、hepes、hpps、mops、mes中的任意一种,优选为tris。所述tris的浓度为10
‑
60mm,优选为20
‑
40mm。所述洗涤缓冲液用盐酸(hcl)调节ph值为4.0
‑
10.0。
38.作为一种优选的实施方式,所述洗涤缓冲液中还可以包括螯合剂或络合剂。所述螯合剂或络合剂同上,选自乙二胺四乙酸(edta)、乙二醇二乙醚二胺四乙酸(egta)、乙二胺二琥珀酸(edds)、氨基三乙酸(nta)、葡萄糖酸、异抗坏血酸、酒石酸、柠檬酸、亚氨基二琥珀酸、三乙醇胺中的一种或多种;优选为乙二胺四乙酸。所述乙二胺四乙酸的浓度为1mm
‑
1m,优选为10mm
‑
0.5m,更优选为10
‑
200mm。
39.作为一种优选的实施方式,所述洗涤缓冲液包括洗涤缓冲液i和洗涤缓冲液ii。所述洗涤缓冲液i中包括胍盐、缓冲物质和有机溶剂,所述有机溶剂的浓度小于洗涤缓冲液ii。所述洗涤缓冲液ii中仅包括缓冲物质和有机溶剂。
40.作为一种优选的实施方式,所述洗涤缓冲液i包括以下组分:胍盐1mm
‑
5m,tris
‑
hcl10
‑
60mm,乙醇或异丙醇40
‑
80%(v/v),ph值为4.0
‑
8.0,余量为水。
41.作为一种优选的实施方式,所述洗涤缓冲液ii包括以下组分:tris
‑
hcl 10
‑
60mm,乙醇或异丙醇60
‑
90%(v/v),ph值为7.0
‑
10.0,余量为水。
42.作为一种优选的实施方式,所述洗脱缓冲液为低盐缓冲液,主要包括缓冲物质。所述缓冲物质为tris、hepes、hpps、mops、mes中的任意一种,优选为tris。所述tris的浓度为1
‑
50mm,优选为1
‑
20mm,更优选为10mm。所述洗脱缓冲液用盐酸(hcl)调节ph值为8.0
‑
10.0。
43.作为一种优选的实施方式,所述洗脱缓冲液中还可以包括螯合剂或络合剂。所述螯合剂或络合剂同上,选自乙二胺四乙酸(edta)、乙二醇二乙醚二胺四乙酸(egta)、乙二胺二琥珀酸(edds)、氨基三乙酸(nta)、葡萄糖酸、异抗坏血酸、酒石酸、柠檬酸、亚氨基二琥珀酸、三乙醇胺中的一种或多种;优选为乙二胺四乙酸。所述乙二胺四乙酸的浓度为0.1
‑
10mm,优选为0.1
‑
5mm,更优选为1mm。
44.作为一种优选的实施方式,所述洗脱缓冲液为te缓冲液,组成为:tris
‑
hcl 10mm,乙二胺四乙酸1mm,ph值为8.0
‑
9.5。
45.本发明的洗涤缓冲液可以尽可能多地保留磁珠上结合的核酸,避免在洗涤时大量损失。由于裂解/消化、结合、洗涤、洗脱是ffpe样本核酸提取的关键步骤,本发明优选将上述裂解缓冲液、结合缓冲液和洗涤缓冲液组合使用,一方面充分裂解组织细胞,消化与核酸结合的蛋白质,在解交联后完全释放出核酸,另一方面将释放出的核酸特异性地结合到磁珠上,增大核酸的结合量,实现核酸与其他裂解物的有效分离,之后多次洗涤结合有核酸的磁珠,彻底去除蛋白质、脂质等杂质,最后从磁珠上洗脱核酸,得到纯的、高收率的核酸。
46.一种从ffpe样本中快速提取核酸的试剂盒,包括至少一个容器,所述容器中包含上述的结合缓冲液。
47.作为一种优选的实施方式,所述从ffpe样本中快速提取核酸的试剂盒还包括上述的磁珠和/或核酸助沉剂。进一步优选地,所述试剂盒还包括上述的脱蜡剂、裂解缓冲液、蛋白酶、洗涤缓冲液、洗脱缓冲液中的一种或多种。
48.作为一种优选的实施方式,所述试剂盒还包括以下一个或多个容器:
49.(a)包含磁珠的容器;
50.(b)包含核酸助沉剂的容器;
51.(c)包含脱蜡剂的容器;
52.(d)包含裂解缓冲液的容器;
53.(e)包含蛋白酶的容器;
54.(f)包含甲醛清除剂的容器;
55.(g)包含解交联试剂的容器;
56.(h)包含洗涤缓冲液的容器;
57.(i)包含洗脱缓冲液的容器。
58.本发明的试剂盒组成简单,成本低廉,便于核酸提取操作,可以缩短提取时间。由于试剂盒中不含甲苯、二甲苯、酚、氯仿等有毒有害试剂,对环境和操作人员的危害较小,更符合现代化环保理念。
59.一种从ffpe样本中快速提取核酸的试剂或试剂盒在核酸提取中的应用。具体的,所述应用包括:在上述的结合缓冲液、核酸助沉剂存在下,使包含核酸的生物材料与磁珠接
触,将核酸结合在磁珠上,之后磁分离出结合有核酸的磁珠。
60.作为一种优选的实施方式,所述结合在10
‑
75℃下进行,优选为36
‑
75℃,更优选为50
‑
65℃,最优选为56℃。所述结合的时间为10s
‑
30min,优选为5
‑
15min,更优选为10min。
61.作为一种优选的实施方式,所述结合的过程中进行一次或多次震荡混匀,结合后放置在磁力架上,磁吸一段时间(1
‑
10min,优选为5min),分离出结合有核酸的磁珠。
62.作为一种优选的实施方式,所述包含核酸的生物材料在与磁珠结合之前,需要进行脱蜡、裂解/消化、和/或解交联处理。
63.作为一种优选的实施方式,所述脱蜡处理为:使ffpe样本与脱蜡剂接触,孵育后得到含有脱蜡剂的混合物。
64.作为一种优选的实施方式,当脱蜡剂为c10
‑
c16的直链、支链或环状烷烃或其混合物时,所述孵育在25
‑
85℃下进行,孵育的时间为10s
‑
30min。
65.作为一种优选的实施方式,所述裂解/消化处理为:在上述含有脱蜡剂的混合物中加入裂解缓冲液、蛋白酶进行孵育,得到多相混合物。
66.作为一种优选的实施方式,所述裂解/消化时的孵育在45
‑
70℃下进行,优选为50
‑
68℃,更优选为56
‑
62℃。所述孵育的时间为10
‑
80min,优选为30
‑
80min,更优选为40
‑
60min。
67.作为一种优选的实施方式,可以在孵育之前、孵育的同时或孵育后,加入甲醛清除剂进行处理。
68.作为一种优选的实施方式,所述孵育得到多相混合物后,再进行解交联处理。所述解交联处理为:将孵育得到的多相混合物加热到85
‑
95℃处理0.5
‑
2h。进一步优选地,加热到90
‑
95℃处理1h。或者,在上述的解交联试剂存在下,将多相混合物加热到65
‑
85℃处理一段时间。
69.作为一种优选的实施方式,所述包含核酸的生物材料在与磁珠结合之后,需要进行洗涤、和/或洗脱处理。
70.作为一种优选的实施方式,所述洗涤处理为:在结合有核酸的磁珠中加入洗涤缓冲液,重悬磁珠,之后磁分离出结合有核酸的磁珠。
71.作为一种优选的实施方式,所述洗涤的过程中进行一次或多次震荡混匀以重悬磁珠,重悬后放置在磁力架上,磁吸一段时间(10s
‑
5min,优选为1min),分离出结合有核酸的磁珠。进一步优选地,所述洗涤的步骤至少重复1
‑
2次。进一步优选地,依次采用洗涤缓冲液i、洗涤缓冲液ii进行洗涤,洗涤缓冲液ii的洗涤操作至少重复1次。
72.作为一种优选的实施方式,在洗涤之后、洗脱处理之前,将最后一次洗涤得到的结合有核酸的磁珠在开放环境中晾干,如在常温下晾干1
‑
15min,优选5
‑
10min,以彻底去除有机溶剂等。
73.作为一种优选的实施方式,所述洗脱处理为:在洗涤得到的结合有核酸的磁珠中加入洗脱缓冲液,重悬磁珠并孵育一段时间,使磁珠上结合的核酸释放到洗脱缓冲液中,再磁分离磁珠,得到包含核酸的溶液。
74.作为一种优选的实施方式,所述洗脱时的孵育在20
‑
80℃下进行,优选为50
‑
80℃,更优选为55
‑
70℃。所述孵育的时间为1
‑
20min,优选为5
‑
15min。
75.作为一种优选的实施方式,所述洗脱时的磁分离进行至少2次,优选为2
‑
3次。
76.本发明的有益效果:
77.本发明的试剂适用于ffpe样本的核酸提取,其中结合缓冲液的配方简单,成本低廉,可以显著提高核酸与磁珠的结合效果,增加核酸的结合量。裂解缓冲液可以在脱蜡剂、蛋白酶存在下快速破裂组织细胞、消化蛋白,将核酸释放出来。由于裂解缓冲液与结合缓冲液的相容性较好,裂解物去除石蜡后可以直接加入结合缓冲液、磁珠和助沉剂,实现核酸与磁珠的特异性结合,去除蛋白质、脂质等杂质以及其他影响扩增的抑制因子。由于裂解/消化、结合、洗涤、洗脱是ffpe样本核酸提取的关键步骤,本发明优选将裂解缓冲液、结合缓冲液和洗涤缓冲液组合使用,先充分裂解组织细胞,消化与核酸结合的蛋白质,完全释放出核酸,再将释放出的核酸特异性地结合到磁珠上,增大核酸的结合量,实现核酸与其他裂解物的有效分离,之后多次洗涤结合有核酸的磁珠,彻底去除蛋白质、脂质等杂质,最后从磁珠上洗脱核酸,得到纯的、高收率的核酸。
78.本发明的试剂/试剂盒组成简单,成本低廉,便于核酸提取操作,可以大幅度缩短提取时间。由于试剂盒中不含甲苯、二甲苯、酚、氯仿等有毒有害试剂,对环境和操作人员的危害较小,更符合现代化环保理念。
附图说明
79.图1为本发明实施例1提取的dna的定性分析结果。
80.为了更清楚地说明本发明实施例的技术方案,以上对实验例中得到的附图进行简单地介绍。应当理解,上述附图仅示出了本发明的某些实验例,不应看作是对权利要求保护范围的任何限制。对于本领域的普通技术人员而言,在不付出创造性劳动的前提下,还可以根据这些附图得到其他相关的附图。
具体实施方式
81.下述实施例仅对本发明作进一步详细说明,但不构成对本发明的任何限制。
82.为了方便理解本发明的技术方案,以下定义一些术语。
83.术语“核酸”指的是任何多核苷酸,包括但不限于dna、rna或pna,可以是天然存在的或合成的、带修饰的,或其组合物。在某些情况下,核酸片段指的是dna片段,可以是单链、双链或三链,并且可以呈任何形式,如线性或环状。核酸可以与任何其他生物分子分离,这些生物分子包括但不限于蛋白质、单糖、多糖、脂质及其他细胞组分。
84.术语“沉淀”是“溶解”的逆反应,溶解包括溶质(如核酸)的溶解,溶剂作为连续相促使溶质分子在溶剂中分散开。沉淀包括去除溶剂以及溶质分子形成固体与溶剂分离。
85.术语“裂解缓冲液”指的是能够有效裂解生物样品以释放核酸、有效抑制核酸酶活性的溶液。该溶液还能破坏蛋白质的二级、三级和四级结构,促使蛋白质与核酸分子分离。
86.术语“结合缓冲液”指的是能够使核酸分子脱水并促使核酸与固相支持物(如磁珠)有效结合的溶液。
87.术语“洗涤缓冲液”指的是洗涤与核酸结合的固相支持物以去除非核酸污染物或杂质(如蛋白质、脂质),并保持核酸与固相支持物结合的溶液。
88.术语“洗脱缓冲液”指的是将与固相支持物结合的核酸洗脱的溶液。
89.在发明中,涉及分子生物学和核酸化学的常规技术均为现有技术,在文献中都有
详细介绍,参见《basic methods in molecular biology》,elsevier;《current protocols in molecular biology》,john wiley等;《molecular biology of the gene》,james d.watson。
90.下面结合实施例对本发明的具体实施方式做进一步地详细描述。需要说明的是:以下实施例的详细描述仅用于示例性地说明本发明的技术方案,不用于限制本发明的保护范围,即本发明不限于实施例所描述的具体实施方式,尤其在不脱离本发明精神的前提下覆盖原料、手段的任何修改、替换和改进。在不冲突的情况下,实施例及实施例中的特征可以相互组合。以下实施例、对比例和实验例中所用原料、仪器等均为市售商品。
91.实施例1
92.本实施例的从ffpe样本中快速提取核酸的试剂,包括脱蜡剂、裂解缓冲液、蛋白酶k、结合缓冲液、磁珠、核酸助沉剂、洗涤缓冲液和洗脱缓冲液;
93.所述脱蜡剂为正十六烷;
94.所述裂解缓冲液包括以下组分:sds 40mm,吐温20 0.6%(v/v),tris
‑
h2so
4 40mm,ph值为8.0,余量为水;
95.所述蛋白酶k为市售商品,使用浓度为1.5mg/ml;
96.所述结合缓冲液包括以下组分:异硫氰酸胍1m,吐温20 0.6%(v/v),triton x
‑
100 4%(v/v),edta 40mm,kcl 0.2m,tris
‑
hcl 40mm,ph值为8.5,余量为水;
97.所述磁珠为市售的硅羟基磁珠,使用浓度为0.5mg/ml;
98.所述核酸助沉剂为乙醇,使用浓度为25%(v/v);
99.所述洗涤缓冲液包括洗涤缓冲液i和洗涤缓冲液ii,所述洗涤缓冲液i包括以下组分:盐酸胍20mm,tris
‑
hcl 60mm,乙醇50%(v/v),ph值为4.5,余量为水;所述洗涤缓冲液ii包括以下组分:tris
‑
hcl 60mm,乙醇90%(v/v),ph值为8.5,余量为水;
100.所述洗脱缓冲液为te缓冲液,组成为:tris
‑
hcl 10mm,edta 1mm,ph值为8.5,余量为水。
101.本实施例的从ffpe样本中快速提取核酸的试剂盒,包括以下多个容器:
102.(a)包含脱蜡剂的容器;
103.(b)包含裂解缓冲液的容器;
104.(c)包含蛋白酶k的容器;
105.(d)包含结合缓冲液的容器;
106.(e)包含磁珠的容器;
107.(f)包含核酸助沉剂的容器;
108.(g)包含洗涤缓冲液i的容器;
109.(h)包含洗涤缓冲液ii的容器;
110.(i)包含洗脱缓冲液的容器。
111.本实施例的从ffpe样本中快速提取核酸的试剂或试剂盒在核酸提取中的应用,包括以下步骤:
112.(1)脱蜡
113.将ffpe样本(2片5mm切片)放入1.5ml离心管中,加入300μl脱蜡剂,涡旋混均,离心,之后将离心管放入预热至50℃的恒温混匀仪中孵育2min,取出离心管。
114.(2)裂解/消化
115.取250μl裂解缓冲液和20μl蛋白酶k(20mg/ml)加入离心管中,涡旋混均,离心,之后将离心管放入预热至50℃的恒温混匀仪中孵育40min,取出离心管。
116.(3)解交联
117.将离心管放入预热至95℃的金属浴中,孵育1h后取出,离心,将下层水相转移到新的离心管中。
118.(4)结合
119.取300μl结合缓冲液和200μl乙醇加入离心管中,再加入充分重悬的20μl磁珠(20mg/ml),涡旋混匀,在室温条件下结合10min,期间每2min涡旋10s确保磁珠重悬以便于结合,之后将离心管放置到磁力架上,静置至溶液完全澄清,用移液器小心移去上清,取下离心管。
120.(5)洗涤
121.取300μl洗涤缓冲液i加入离心管中,涡旋,使磁珠重悬1min,之后将离心管放置到磁力架上,静置至溶液完全澄清,用移液器小心移去上清。
122.再取500μl洗涤缓冲液ii加入离心管中,涡旋,使磁珠重悬1min,之后将离心管放置到磁力架上,静置至溶液完全澄清,用移液器小心移去上清;重复上述操作一次。
123.(6)洗脱
124.使用移液器移去离心管中的残留液体,开盖晾干6min,之后将离心管从磁力架上取下,加入50μl洗脱缓冲液,用移液器吹吸数次以确保磁珠重悬,再将离心管放入预热至60℃的金属浴中,孵育10min,最后将离心管放置到磁力架上,静置2min,用移液器将洗脱的包含核酸的溶液转移至新的无核酸酶的离心管中,备用。
125.实施例2
126.本实施例的从ffpe样本中快速提取核酸的试剂,包括脱蜡剂、裂解缓冲液、蛋白酶k、结合缓冲液、磁珠、核酸助沉剂、洗涤缓冲液和洗脱缓冲液;
127.所述脱蜡剂为正十六烷;
128.所述裂解缓冲液包括以下组分:sds 15mm,吐温20 0.2%(v/v),tris
‑
h2so
4 15mm,ph值为8.5,余量为水;
129.所述蛋白酶k为市售商品,使用浓度为1.5mg/ml;
130.所述结合缓冲液包括以下组分:异硫氰酸胍4m,吐温20 0.2%(v/v),triton x
‑
100 2%(v/v),edta 10mm,kcl 0.1m,tris
‑
hcl 20mm,ph值为8.5,余量为水;
131.所述磁珠为市售的硅羟基磁珠,使用浓度为0.5mg/ml;
132.所述核酸助沉剂为乙醇,使用浓度为20%(v/v);
133.所述洗涤缓冲液包括洗涤缓冲液i和洗涤缓冲液ii,所述洗涤缓冲液i包括以下组分:盐酸胍10mm,tris
‑
hcl 40mm,乙醇60%(v/v),ph值为6.0,余量为水;所述洗涤缓冲液ii包括以下组分:tris
‑
hcl 20mm,乙醇80%(v/v),ph值为8.5,余量为水;
134.所述洗脱缓冲液为te缓冲液,组成为:tris
‑
hcl 10mm,edta1mm,ph值为9.0,余量为水。
135.本实施例的从ffpe样本中快速提取核酸的试剂盒,除试剂外,其他均同实施例1。
136.本实施例的从ffpe样本中快速提取核酸的试剂或试剂盒在核酸提取中的应用,除
试剂外,其他操作均同实施例1。
137.实施例3
‑
8及对比例1
‑
3的试剂组成如表1所示。
138.表1实施例及对比例中核酸提取试剂的组成
[0139][0140][0141]
上述实施例3
‑
8的试剂在核酸提取中的应用同实施例1。
[0142]
在本发明的其他实施例中,所述从ffpe样本中快速提取核酸的试剂还包括甲醛清除剂,所述甲醛清除剂为己二酸二酰肼,使用浓度为0.2m。
[0143]
在本发明的其他实施例中,所述从ffpe样本中快速提取核酸的试剂还包括解交联试剂,所述解交联试剂为二乙醇胺,使用浓度为0.5m;所述解交联的温度为80℃。
[0144]
对比例4
[0145]
市售ffpe核酸提取试剂盒,购自biobase,操作说明参见试剂盒说明书。
[0146]
实验例
[0147]
采用分光光度计nanodrop one对实施例1
‑
8及对比例1
‑
4中提取的dna进行含量及od260/280、od260/230值检测,结果如表2所示。
[0148]
表2 dna含量及od260/280、od260/230检测值:
[0149][0150][0151]
采用安捷伦2100生物分析仪对实施例1提取的dna进行定性分析,结果如图1所示。从图1可以看出,实施例1提取的dna片段分布主要在2400
‑
34000bp之间。
[0152]
通过以上实验结果可以看出,本发明的结合缓冲液通过联合使用吐温系列表面活性剂(如吐温20或吐温40)与聚乙二醇辛基苯基醚(triton x
‑
100),与其他组分相互配合,显著提高了核酸与磁珠的结合效果,一方面增大了核酸的结合量,另一方面减弱了杂质如蛋白质、脂质等的吸附,从而有效提高了核酸得率和提取纯度。尤其是在聚乙二醇存在下进行结合,所得核酸的得率和纯度最佳。
[0153]
本发明的裂解缓冲液与结合缓冲液的相容性较好,裂解物去除石蜡后可以直接加入结合缓冲液、磁珠和助沉剂,实现核酸与磁珠的特异性结合,去除蛋白质、脂质等杂质以及其他影响扩增的抑制因子。由于裂解/消化、结合、洗涤、洗脱是ffpe样本核酸提取的关键
步骤,本发明将上述裂解缓冲液、结合缓冲液和洗涤缓冲液组合使用,先充分裂解组织细胞,消化与核酸结合的蛋白质,完全释放出核酸,再将释放出的核酸特异性地结合到磁珠上,增大核酸的结合量,实现核酸与其他裂解物的有效分离,之后多次洗涤结合有核酸的磁珠,彻底去除杂质,最后对磁珠进行洗脱处理,得到高纯度、高收率的核酸。
[0154]
本发明的试剂/试剂盒组成简单,成本低廉,便于核酸提取操作,可以大幅度缩短提取时间。由于试剂盒中不含甲苯、二甲苯、酚、氯仿等有毒有害试剂,对环境和操作人员的危害较小,更符合现代化环保理念。
[0155]
以上仅为本发明的具体实施例,并不限制本发明的保护范围。在不脱离本发明的技术构思的前提下,对本领域的技术人员来说,本发明的实施方式可以有多种更改和变化。凡在本发明的精神和原理之内所作的任何修改、等同替换、改进等均应包含在本发明的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。