抑制长链非编码rna malat1表达的shrna慢病毒及其应用
技术领域
1.本发明属于生物技术领域,具体涉及一种抑制长链非编码rna malat1表达的shrna慢病毒及其应用。
背景技术:
2.随着现代社会生活节奏的加快和社会竞争的加剧,多数人都处在不同程度的应激负荷之下,长期过度应激已被确认为人类多种重大致死性疾病的重要推动因素,人类约70%的疾病的发生发展与机体应激损伤密切相关。大脑是机体感应和应对应激的调控中枢,同时也是应激易损伤的靶器官,尤其是涉及高级脑活动的认知功能在面对应激时显得尤为脆弱。流行病学调查显示,长期处于应激状态的人群其轻度认知障碍和痴呆的患病率是同年龄非应激人群的两倍以上。在确诊的认知功能障碍患者当中,超过70%伴随有hpa轴的功能紊乱。海马是调控学习、记忆等认知功能的重要脑区,慢性应激可导致海马的结构和功能改变,包括引起海马体积缩小、树突棘数量减少、突触密度降低、突触可塑性异常、抑制齿状回神经发生等。应激已经被证明是认知功能损伤甚至痴呆的重要风险因素。应激反应以下丘脑
‑
垂体
‑
肾上腺(hypothalamic
‑
pituitary
‑
adrenal,hpa)轴功能亢进和糖皮质激素(glucocorticoid,gc)大量分泌为主要特征,高浓度gc对神经元的损伤作用是应激诱导认知功能障碍发病的重要机制之一,但临床上尚缺乏针对应激性认知功能障碍的有效防治药物。
3.长链非编码rna(long noncoding rna,lncrna)是指长度大于200nt,不能编码产生蛋白的一类表观遗传调控分子,其含量占到非编码rna的80%以上,与发育、细胞增殖与凋亡、代谢、免疫调节、各种疾病发生等几乎所有的生理病理过程的调控密切相关。肺癌转移相关转录本1(metastasis
‑
associated lung adenocarcinoma transcript 1,malat1),于2003年在非小细胞肺癌组织中被首次鉴定发现,是发现较早且迄今研究最为深入的lncrna之一。malat1在生物体内具有较高的表达水平且表达相对普遍,在哺乳动物进化中具有高度保守性。早期对malat1的研究主要集中在肿瘤领域,发现malat1参与了细胞增殖、凋亡、耐药、转移等细胞行为的调控作用,与多种肿瘤的发生发展密切相关。近年来越来越多的证据表明malat1在学习、记忆等脑认知功能及相关疾病的调控中发挥了重要生物学作用。有研究发现在(parkinson’s disease,pd)患者、pd动物模型以及阿尔茨海默病(alzheimer’s disease,ad)大鼠脑组织中malat1的表达水平发生了不同程度的变化,且malat1可通过调节染色质表观修饰、控制基因转录、调节蛋白质功能、竞争结合microrna等多种分子机制发挥多种生物学功能。还有研究提示,在神经细胞中干扰malat1可影响细胞对gc刺激的应答,提示malat1有可能参与调控应激反应。但malat1在应激性认知功能障碍中的作用迄今未见报道,目前也并没有靶向malat1治疗应激性认知功能障碍的相关技术。
4.基因治疗是指将特定的遗传物质转入患者特定的靶细胞,以最终达到预防或改变特殊疾病状态的治疗方法。慢病毒(lentivirus,lv)载体是基因治疗中最常用的病毒载体,可以感染分裂和非分裂期的细胞,还具有容纳外源性目的基因片段大、免疫反应小、产物可
稳定长期表达等优点,其独特的优势使其在基因治疗中具有广泛的应用前景。目前已有研究证实,以慢病毒为载体的基因治疗方法在重症联合免疫缺陷病、法布里病、肾上腺脑白质失养症等多种疾病的治疗中安全且有效。
技术实现要素:
5.一方面,本技术提供了一种抑制长链非编码rna malat1表达的shrna,其特征在于,其针对genbank中malat1转录本序列nr_002847.3的286、743、1048、4807位点或其他转录本序列中的对应位点设计。
6.进一步地,所述抑制长链非编码rna malat1表达的shrna针对genbank中malat1转录本序列nr_002847.3的743位点或其他转录本序列中的对应位点设计。
7.进一步地,所述述抑制长链非编码rna malat1表达的shrna序列为seq id no.5
‑
12所述。
8.进一步地,所述述抑制长链非编码rna malat1表达的shrna序列为seq id no.5、6所示。
9.另一方面,本技术提供了一种质粒,其携带上述抑制长链非编码rna malat1表达的shrna。
10.另一方面,本技术提供了一种慢病毒,其携带上述抑制长链非编码rna malat1表达的shrna或者质粒。
11.另一方面,本技术提供了上述抑制长链非编码rna malat1表达的shrna、质粒或者慢病毒在制备治疗认知功能障碍中的应用。
12.进一步地,所述认知功能障碍为应激诱导的认知功能障碍。
13.进一步地,所述治疗认知功能障碍包括保护海马神经元。
14.另一方面,本技术提供了一种治疗认知功能障碍的药物,其包含上述抑制长链非编码rna malat1表达的shrna、质粒或者慢病毒。
15.本技术中所述的“其他转录本序列中的对应位点”本领域技术人员可以根据序列比对,结构分析等方式从非nr_002847.3的其他转录本序列中常规获得。
16.本技术中所述的“保护海马神经元”包括但不限于促进海马神经元细胞周期、抑制海马神经元细胞凋亡、抑制海马神经元细胞凋亡关键蛋白parp剪切体和caspase3剪切体的表达。有益效果:
17.本发明的malat1
‑
shrna干扰质粒能显著特异性抑制海马神经元内malat1的表达;应激诱导海马神经元malat1表达升高,导致认知功能降低。malat1
‑
shrna慢病毒能够促进神经元细胞周期的进程,抑制神经元凋亡和凋亡关键蛋白的表达,从而起到抵抗应激诱导的神经元细胞损伤的作用,在治疗各种应激压力所致的认知功能下降方面具有潜在应用价值。
附图说明
18.图1为慢病毒载体的质粒结构;
19.图2为malat1
‑
shrna慢病毒载体对malat1表达的影响,*p<0.05,**p<0.01;
20.图3为相差与荧光显微镜下malat1
‑
shrna慢病毒(10μl)感染293t细胞的结果,放
大倍数:200倍;
21.图4为应激小鼠血浆gc的含量较对照小鼠的变化,**p<0.01;
22.图5为应激小鼠脑内海马组织中malat1的表达水平变化,**p<0.01;
23.图6为应激特异性诱导神经元malat1升高,**p<0.01;
24.图7为应激诱导小鼠认知功能损伤,*p<0.05,**p<0.01;
25.图8为malat1
‑
shrna慢病毒对神经元细胞周期分布的影响,*p<0.05,**p<0.01;
26.图9为malat1
‑
shrna慢病毒抑制神经元凋亡,**p<0.01;
27.图10为malat1
‑
shrna慢病毒抑制凋亡关键蛋白的表达。
具体实施方式
28.以下实施例中的方法中如无特别说明,所用的生化试剂均为市售试剂,所有的方法均为常规方法。
29.实施例1malat1
‑
shrna慢病毒载体构建及鉴定
30.从ncbi获得malat1(nr_002847.3)的转录本序列,设计针对malat1的shrna干扰位点,筛选出评分最高的4个位点,化学合成malat1
‑
shrna oligo及阴性对照shrna oligo(上海吉凯生物有限公司),退火形成双链,克隆至慢病毒表达载体中,获得重组质粒。
31.(一)malat1的干扰靶点的设计
32.从ncbi获得malat1(nr_002847.3)的转录本序列,设计针对malat1的shrna干扰位点,筛选出评分最高的4个位点,靶点序列如下:
33.286位点:5
’‑
gcagtttaggagattgtaaag
‑3’
(seq id no.1)
34.743位点:5
’‑
ggaagtgaaagacgaagaaga
‑3’
(seq id no.2)
35.1048位点:5
’‑
gcagtttagaagagtctttag
‑3’
(seq id no.3)
36.4807位点:5
’‑
gctcaggactttgcatataag
‑3’
(seq id no.4)
37.(二)malat1
‑
shrna慢病毒表达载体的构建
38.1、化学合成malat1
‑
shrna oligo及阴性对照shrna oligo(上海吉凯生物有限公司),序列如下:
39.286位点shrna
40.top strand 5'
‑
ccgg gcagtttaggagattgtaaag ctcgag tcttcttcgtctttcacttcctttttg
‑
3'(seq id no.5)
41.bottom strand 5'
‑
aattcaaaaa gcagtttaggagattgtaaag ctcgagtcttcttcgtctttcacttcc
‑
3'(seq id no.6)
42.743位点shrna
43.top strand 5'
‑
ccgg ggaagtgaaagacgaagaaga ctcgag tcttcttcgtctttcacttcctttttg
‑
3'(seq id no.7)
44.bottom strand 5'
‑
aattcaaaaa ggaagtgaaagacgaagaaga ctcgagtcttcttcgtctttcacttcc
‑
3'(seq id no.8)
45.1048位点shrna
46.top strand 5'
‑
ccgg gcagtttagaagagtctttag ctcgag tcttcttcgtctttcacttcctttttg
‑
3'(seq id no.9)
47.bottom strand 5'
‑
aattcaaaaa gcagtttagaagagtctttag ctcgagtcttcttcgtctttcacttcc
‑
3'(seq id no.10)
48.4807位点
49.shrna top strand 5'
‑
ccgg gctcaggactttgcatataag ctcgagtcttcttcgtctttcacttcc tttttg
‑
3'(seq id no.11)
50.bottom strand 5'
‑
aattcaaaaa gctcaggactttgcatataag ctcgagtcttcttcgtctttcacttcc
‑
3'(seq id no.12)
51.阴性对照shrna
52.top strand 5'
‑
ccgg ttctccgaacgtgtcacgt ctcgag tcttcttcgtctttcacttcctttttg
‑
3'(seq id no.13)
53.bottom strand 5'
‑
aattcaaaaa ttctccgaacgtgtcacgt ctcgagtcttcttcgtctttcacttcc
‑
3'(seq id no.14)
54.2、将上述合成的dna干粉溶解于退火缓冲液中,90℃水浴15min,自然冷却至室温形成双链。
55.3、载体酶切及回收
56.(1)所用慢病毒表达载体为gv493;元件顺序为hu6
‑
mcs
‑
cbh
‑
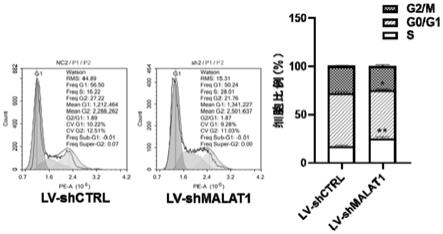
gcgfp
‑
ires
‑
puromycin;克隆位点:age i与ecor i。(图1)
57.(2)用限制性内切酶age i与ecor i(neb公司)对载体进行切割。按如下体系配制反应溶液,混匀后37℃水浴锅中酶切过夜。
[0058][0059]
(3)向载体的酶切产物中加入10μl 6
×
loading buffer,进行琼脂糖凝胶电泳,将目的条带在紫外灯下切下,并依据胶回收试剂盒(天根生物有限公司)说明书进行回收。
[0060]
4、连接
[0061]
通过t4 dna连接酶将线性化的载体和退火双链dna进行连接反应,按如下体系配制反应溶液,混匀后室温放置1~2hr。
[0062][0063]
5、转化
[0064]
(1)取一只e.coli dh5 感受态细胞(takara公司),置于冰上自然融化。将10μl连接产物加到感受态细胞中,冰上静置20min。42℃水浴锅中热休克90sec,立即插到冰上,放置2min。加入700μl lb培养基,37℃摇床摇菌45min。
[0065]
(2)将菌液均匀涂到含氨苄青霉素的琼脂平板上。先在37℃烘箱里正置30min,后倒置培养12~16hr。
[0066]
(3)挑取多个单克隆分别放入摇菌管,加3ml含氨苄青霉素的lb培养基中,37℃摇床摇菌12~16hr。
[0067]
6、阳性重组子的鉴定
[0068]
(1)设计并合成鉴定pcr用引物,序列如下:
[0069]
p1(5
’‑3’
):ccatgattccttcatatttgc;p2(5
’‑3’
):gtaatacggttatccacgcg
[0070]
(2)以菌液为模板,进行菌液pcr鉴定实验,反应体系如下:
[0071][0072]
在pcr仪中按如下程序进行pcr反应:95℃预变性5min;95℃变性30sec,60℃退火30sec,72℃延伸1min,共进行35个循环;最后72℃反应10min。
[0073]
(3)对pcr初步鉴定出的阳性菌群进行测序(上海吉凯生物有限公司),测序结果正确,与合成的序列一致。
[0074]
(4)将测序正确的菌液加入10ml含氨苄抗生素的lb培养基中,37℃摇床摇菌12~16hr。用质粒小提中量试剂盒(天根生物有限公司)根据说明书提取重组质粒。
[0075]
实施例2malat1
‑
shrna质粒干扰效果检测
[0076]
将鉴定出的阳性重组质粒转染ht22细胞,收集细胞提取rna并反转录获得cdna,通过real
‑
time pcr实验检测重组质粒对malat表达的影响,选择干扰效果最为显著的质粒进一步进行慢病毒包装。
[0077]
(一)细胞转染
[0078]
(1)取对数生长期的ht22细胞,按50%的密度接种至6孔培养板中,置于5%co2、37℃孵箱内培养至细胞密度达到约80%。
[0079]
(2)根据jetpei转染试剂(polyplus公司)使用说明书,配制质粒与转染试剂的混合物,逐滴加入细胞。
[0080]
(3)24hr后观察细胞状态,更换为新鲜的完全培养基。48hr后收集细胞提取rna进行real
‑
time pcr实验。
[0081]
(二)rna抽提
[0082]
(1)生理盐水洗涤两次,加入1ml trizol(invitrogen),室温裂解5min,移入1.5ml eppendorf管中。
[0083]
(2)加入200μl三氯甲烷,用力摇晃15sec,静置3min。
[0084]
(3)离心,4℃,12,000g
×
15min。
[0085]
(4)轻轻吸取最上层至新的1.5ml eppendorf管中,加入等体积异丙醇,轻轻摇晃,静置10min。
[0086]
(5)离心,4℃,12,000g
×
10min。
[0087]
(6)吸去上清,加入1ml 75%乙醇洗涤,将沉淀轻轻吹起,勿吹散。
[0088]
(7)离心,4℃,12,000g
×
5min。
[0089]
(8)吸去上清,干燥rna 5~10min至沉淀透明,加入适量depc水。
[0090]
(9)待rna完全溶解后,取1μl于nanodrop微量紫外分光光度计(thermo),检测rna的浓度和纯度。
[0091]
(三)反转录pcr
[0092]
(1)取2μg rna,在pcr管中配置以下反应体系:
[0093][0094]
(2)在水浴锅或pcr仪中70℃反应5min,立即取出pcr管冰浴至少2min
[0095]
(3)向每管中加入下述试剂,轻轻混匀。
[0096][0097]
(4)37℃反应60min,70℃反应10min,获得cdna。
[0098]
(四)实时荧光定量pcr(real
‑
time pcr)
[0099]
(1)设计并合成检测malat1表达水平所用的real
‑
time pcr引物,序列如下:
[0100]
forward primer(5
′
‑3′
):ccatgattccttcatatttgc;
[0101]
reverse primer(5
′
‑3′
):gtaatacggttatccacgcg
[0102]
(2)按如下体系配置反应溶液,设置3个复孔:
[0103]
[0104]
在real
‑
time pcr仪中按如下程序进行反应:95℃预变性10min;95℃变性5sec,60℃退火30sec,72℃延伸35sec,共进行40个循环;最后72℃反应10min。
[0105]
(3)β
‑
actin作为内参,对检测结果进行分析,如图2所示,286、743、1048位点的质粒均对malat1表达有抑制作用,其中743位点的质粒干扰效果最为显著,于是选择该质粒进一步进行慢病毒包装。
[0106]
实施例3慢病毒包装与质量检测
[0107]
将malat1
‑
shrna干扰质粒和vsvg、pspax2质粒共转染293t细胞,培养48hr后收集细胞上清,通过超速离心进行慢病毒的浓缩与纯化,最后利用荧光法测定病毒滴度。
[0108]
(一)293t细胞的培养
[0109]
1、复苏293t细胞
[0110]
(1)配置含10%fbs的dmem培养基(称为完全培养基),用于293t细胞的培养。
[0111]
(2)将3ml完全培养基加入10ml玻璃离心管中。
[0112]
(3)将细胞从液氮罐或
‑
80℃冰箱取出,迅速放入37℃水浴锅中,轻轻摇动1~2min使之完全融化。
[0113]
(4)将冻存管拿至超净台中,用酒精棉球擦拭表面进行消毒。将细胞悬液加至提前准备好的离心管中。
[0114]
(5)离心800g
×
3min,弃上清,加入2ml新的完全培养基,用滴管轻轻吹打使细胞悬浮,接种至10cm含有8ml新鲜完全培养基的培养皿中,置于37℃、5%co2孵箱中培养。
[0115]
2、293t细胞传代
[0116]
(1)每天观察绅胞生长状态及密度,当细胞密度达到80%时进行传代。
[0117]
(2)吸去原培养基,用10ml生理盐水清洗细胞两次,加1ml 0.5%胰蛋白酶溶液,放入37℃孵箱中消化1~3min至细胞刚从培养皿脱落。
[0118]
(3)加入3ml完全培养基终止消化,将细胞悬液转移至10ml玻璃离心管。
[0119]
(4)离心800g
×
3min,弃上清。加入5ml新的完全培养基,用滴管轻轻吹打使细胞悬浮,取1ml接种至10cm含有8ml新鲜完全培养基的培养皿中,共接种5瓶,置于37℃、5%co2孵箱中培养。
[0120]
3、冻存293t细胞
[0121]
(1)取对数生长期的293t细胞,吸去原培养基,用10ml生理盐水清洗细胞两次,加1ml0.5%胰蛋白酶溶液,放入37℃孵箱中消化1~3min至细胞刚从培养皿脱落。
[0122]
(2)加入3ml完全培养基终止消化,将细胞悬液转移至10ml玻璃离心管。
[0123]
(3)离心800g
×
3min,弃上清。加入3ml细胞冻存液(苏州新赛美有限公司)重悬细胞,分装至冻存管,1ml/管,放入
‑
80℃冰箱,第二天放入液氮罐中长期保存。
[0124]
(二)质粒转染
[0125]
(1)将293t细胞种至10cm培养皿中,待细胞密度达到70~80%时进行转染。
[0126]
(2)取1个1.5ml eppendorf管,加入500μl 0.9%氯化钠溶液,分别加入2μg vsvg、6μg pspax2和8μg上述malat1
‑
shrna质粒,振荡混匀,瞬时离心。
[0127]
(3)在1.5ml eppendorf管中加入500μl 0.9%氯化钠溶液,加入64μl转染试剂jetpei,振荡混匀,瞬时离心。
[0128]
(4)将脂质体稀释液逐滴加入质粒稀释液中,振荡10sec混匀,瞬时离心,室温放置
20min。
[0129]
(5)细胞换新鲜培养基,7ml/盘。
[0130]
(6)将含有dna
‑
脂质体复合物的溶液滴加至细胞表面,置于5%co2,37℃孵箱内培养,12hr后换液,加10ml新鲜培养基。
[0131]
(三)慢病毒的收获、浓缩与纯化、
[0132]
(1)培养48hr后,收集细胞上清,过0.45μm滤器后加至40ml超速离心管中,放入至beck满超速离心机内,4℃离心,25000rpm
×
2hr。
[0133]
(2)离心结束后,弃区上清,尽量去除残留在管壁上的液体,加入病毒保存液,轻轻反复吹打重悬。
[0134]
(3)经充分溶解后,高速离心10000rpm
×
5min,取上清分装。
[0135]
(四)慢病毒滴度检测
[0136]
1、荧光法测定病毒滴度
[0137]
(1)测定前一天,将293t细胞接种至96孔板中,每孔4
×
104个细胞,体积100μl。
[0138]
(2)根据病毒预期滴度,准备7
‑
10个无菌的ep管,每管中加入90μl无血清培养基;
[0139]
(3)取待测定的病毒原液10μl加入到第一个管中,混匀后,取10μl加入到第二个管中,继续相同的操作直到最后一管;
[0140]
(4)选取所需的细胞孔,弃去90μl培养基,加入90μl稀释好的病毒溶液,置于培养箱中培养;
[0141]
(5)24h后,加入完全培养基100μl,
[0142]
(6)培养4天后,观察荧光表达情况,荧光细胞数随稀释倍数的增加而减少。
[0143]
2、病毒滴度计算方法
[0144]
计算公式为病毒滴度=荧光细胞数/病毒原液量(tu/ml)
[0145]
根据荧光图片中gfp表达情况(图3),在10
‑6μl病毒原液感染孔中观察到2个荧光细胞,得到病毒滴度为2
×
109(tu/ml)。
[0146]
实施例4应激对malat1表达和认知功能的影响
[0147]
在应激条件下,体内gc分泌增加,高浓度gc诱导的神经元损伤是认知功能障碍发生的重要病理机制。因此我们建立了慢性应激小鼠动物模型,检测小鼠血浆gc含量及脑内海马组织malat1表达水平;进一步分离海马神经元和非神经元细胞,检测应激对神经元malat1表达的影响;并通过动物行为学实验检测小鼠认知能力的改变。
[0148]
1、通过给予balb/c小鼠慢性不可预见性温和刺激,建立应激动物模型。取小鼠血浆,利用gc检测试剂盒检测应激对小鼠gc的影响,结果显示应激小鼠血浆gc水平显著升高(图4)。
[0149]
2、取海马组织,提取rna,通过real
‑
time pcr实验检测应激对海马组织内malat1表达水平的影响。结果显示应激小鼠海马内malat1表达水平升高(图5)。
[0150]
3、利用磁分选技术(美天旎公司)分离应激小鼠和对照小鼠的海马神经元和非神经元细胞,提取rna,通过real
‑
time pcr实验检测应激对海马组织内malat1表达水平的影响。结果显示应激特异性诱导神经元malat1表达水平升高(图6)。
[0151]
4、通过旷场实验和水迷宫实验检测应激对小鼠认知能力的影响。结果显示与对照组相比,应激组小鼠的旷场得分降低,水迷宫寻台时间增加、穿台次数减少,表明应激可导
致小鼠发生认知能力障碍(图7)。
[0152]
实施例5malat1
‑
shrna慢病毒对海马神经元的保护作用
[0153]
为进一步观察malat1
‑
shrna慢病毒(lv
‑
shmalat1)对神经元的调控作用,我们建立了稳定干扰malat1表达的海马神经元细胞系,检测抑制malat1表达对神经元细胞周期和凋亡的影响。
[0154]
1、建立malat1稳定干扰细胞系
[0155]
(1)取对数生长期的ht22细胞,用完全培养基制备单细胞悬液,取3
‑5×
105个细胞种至6孔板。
[0156]
(2)待细胞贴壁后吸去原培养基,加入1ml新鲜培养基和40μl感染增强液,将上述慢病毒以moi=50加入细胞培养液中,12hr换液。
[0157]
(3)将细胞扩大培养至10cm培养盘,收集细胞,利用流式分选出gfp
的细胞,建立malat1稳定干扰细胞系。
[0158]
2、检测抑制malat1表达对海马神经元的影响
[0159]
(1)将malat1干扰细胞接种至6孔板,24h后收集细胞,利用70%冰乙醇固定过夜后用pi染色液进行染色,通过流式细胞术检测lv
‑
shmalat1对海马神经元细胞周期分布的影响,结果显示,利用lv
‑
shmalat1抑制malat1表达后g0/g1期细胞比例减少、s期细胞比例增加,表明lv
‑
shmalat1能够促进细胞周期的进程(图8)。
[0160]
(2)将malat1干扰细胞接种至6孔板,24h后收集细胞,利用annex v
‑
apc/pi细胞凋亡检测试剂盒(thermo公司)染色后,通过流式细胞术检测lv
‑
shmalat1对海马神经元细胞凋亡水平的影响,结果显示lv
‑
shmalat1可抑制海马神经元凋亡(图9)。
[0161]
(3)提取细胞蛋白,利用数字化wes全自动蛋白表达分析仪(proteinsimple公司)进行western blot实验检测凋亡关键蛋白的表达水平,结果显示,lv
‑
shmalat1可显著抑制凋亡关键蛋白parp剪切体和caspase3剪切体的表达(图10)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。