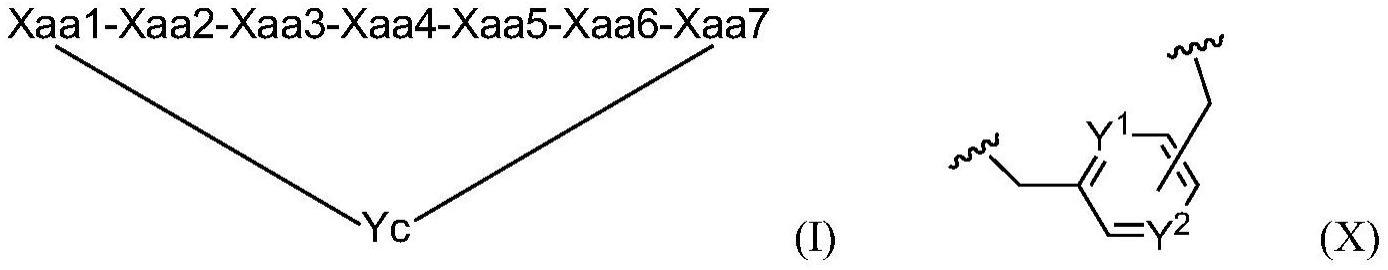
1.本发明涉及化合物;成纤维细胞活化蛋白(fap)抑制剂;分别包含所述化合物和抑制剂的组合物;分别用于疾病诊断方法的所述化合物、所述抑制剂和所述组合物;分别用于疾病治疗方法的所述化合物、所述抑制剂和所述组合物;分别用于疾病的诊断和治疗(也称作“治疗诊断(thera(g)nosis)”或“治疗诊断学(thera(g)nostics)”)方法的所述化合物、所述抑制剂和所述组合物;分别用于将效应物递送至表达fap的组织的方法中的所述化合物、所述抑制剂和所述组合物;分别使用所述化合物、所述抑制剂和所述组合物诊断疾病的方法;分别使用所述化合物、所述抑制剂和所述组合物治疗疾病的方法;分别使用所述化合物、所述抑制剂和所述组合物诊断和治疗疾病(也称作“治疗诊断”或“治疗诊断学”)的方法;分别使用所述化合物、所述抑制剂和所述组合物将效应物递送至表达fap的组织的方法。
背景技术:
2.尽管治疗选择越来越多,但癌症仍然是全球第二大死亡原因。治疗策略主要集中在靶向恶性癌细胞本身,而忽略了限制癌细胞治疗剂进入的始终存在的围绕肿瘤的微环境(tme)(valkenburg,et al.,nat rev clin oncol,2018,15:366)。tme是肿瘤团块的一部分,不仅包含异质的癌细胞群,还包含各种驻留和浸润的宿主细胞、分泌的因子和细胞外基质蛋白(quail,et al.,nat med,2013,19:1423)。在tme中发现的主要细胞类型是癌症相关成纤维细胞(caf)(kalluri,nat rev cancer,2016,16:582)。许多不同的细胞类型已被描述为caf的来源和起源,例如成纤维细胞、间充质干细胞、平滑肌细胞、上皮来源的细胞或内皮细胞(madar,et al.,trends mol med,2013,19:447)。caf表现出间充质样特征,并且通常是实体瘤团块中的主要细胞类型。caf作为肿瘤进展和体内平衡的参与者受到越来越多的关注(gascard,et al.,genes dev,2016,30:1002;lebleu,et al.,dis model mech,2018,11)。
3.近年来,成纤维细胞活化蛋白(fap)作为caf的标志物而广为人知(shiga,et al.,cancers(basel),2015,7:2443;pure,et al.,oncogene,2018,37:4343;jacob,et al.,curr mol med,2012,12:1220)。由于肿瘤内caf和间质的无所不在,fap被发现是放射性药物诊断的合适标志物和放射性药物治疗的合适靶点(siveke,j nucl med,2018,59:1412)。
4.成纤维细胞活化蛋白α(fap)是ii型跨膜丝氨酸蛋白酶和s9脯氨酰寡肽酶家族的成员(park,et al.,j biol chem,1999,274:36505)。最接近的家庭成员dpp4与fap有53%的同源性。与其它dpp酶(dpp4、dpp7、dpp8、dpp9)一样,fap具有后脯氨酸外肽酶活性。此外,fap具有内肽酶活性,类似于脯氨酰寡肽酶/内肽酶(pop/prep)。fap基因在不同物种中高度保守。人fap的胞外域与小鼠和大鼠fap具有90%的氨基酸序列相同性。小鼠fap与大鼠fap具有97%的序列相同性。
5.在结构上,fap是一种760个氨基酸的跨膜蛋白,包含一个短的n末端胞质尾区(6个氨基酸)、一个单一的跨膜结构域(20个氨基酸)和一个734个氨基酸的胞外域(aertgeerts,
et al.,j biol chem,2005,280:19441)。这个胞外域由一个八叶β-螺旋(eight-bladedβ-propeller)和一个α/β水解酶结构域组成。催化三联体由ser624、asp702和his734组成,位于β-螺旋和水解酶结构域的界面。可通过β-螺旋域的中心孔或通过β-螺旋与水解酶结构域之间的狭窄空腔接近活性位点。fap单体没有活性,但与dpp4形成活性同二聚体以及异二聚体(ghersi,et al.,cancer res,2006,66:4652)。还有人描述了可溶的同二聚体fap(keane,et al.,febs open bio,2013,4:43;lee,et al.,blood,2006,107:1397)。
6.fap具有双重酶活性(hamson,et al.,proteomics clin appl,2014,8:454)。其二肽基肽酶活性允许裂解在脯氨酸残基后的n末端的两个氨基酸。通过其二肽基肽酶活性快速裂解的fap底物是神经肽y、肽yy、p物质和b型利钠肽。已表明胶原蛋白i和iii、成纤维细胞生长因子(fgf21)和α
2-抗纤溶酶被fap的内肽酶活性裂解。虽然fap无法裂解天然胶原蛋白,但通过其它蛋白酶如基质金属蛋白酶的预消化促进fap进一步裂解胶原蛋白。胶原蛋白的加工可能影响癌细胞的迁移能力。除了通过细胞外基质的重塑增加癌细胞的侵润性外,还提出了其它几种fap介导的肿瘤促进作用,包括增殖和增加血管生成。此外,fap的间质表达与各种癌症的免疫监视脱逃有关,表明其在抗肿瘤免疫中的作用(pure,et al.,oncogene,2018,37:4343)。
7.fap在正常发育过程中短暂表达,但很少在健康的成年组织中表达。在转基因小鼠中,已证明fap由脂肪组织、骨骼肌、皮肤、骨骼和胰腺表达(pure,et al.,oncogene,2018,37:4343;roberts,et al.,j exp med,2013,210:1137)。然而,fap敲除小鼠具有健康的表型,表明在正常条件下具有多余的作用(niedermeyer,et al.,mol cell biol,2000,20:1089)。在活跃的组织重塑部位,包括伤口愈合、纤维化、关节炎、动脉粥样硬化和癌症,fap在间质细胞中高度上调(pure,et al.,oncogene,2018,37:4343)。
8.在单克隆抗体f19的使用下,于1990年首次报道了fap在90%的上皮癌的肿瘤间质中的表达(garin-chesa,et al.,proc natl acad sci u s a,1990,87:7235;rettig,et al.,cancer res,1993,53:3327)。表达fap的间质细胞被进一步鉴定为癌症相关成纤维细胞(caf)和癌症相关周细胞(cremasco,et al.,cancer immunol res,2018,6:1472)。恶性上皮细胞上的fap表达也有报道,但其意义仍有待确定(pure,et al.,oncogene,2018,37:4343)。下表1摘自busek et al.(busek,et al.,front biosci(landmark ed),2018,23:1933),总结了fap在各种恶性肿瘤中的表达,指示了肿瘤类型和细胞表达。
9.表1:在人恶性肿瘤中的fap表达(来自busek et al.)
10.11.[0012][0013]
几乎所有癌和肉瘤都显示了fap在caf中的表达(pure,et al.,oncogene,2018,37:4343;busek,et al.,front biosci(landmark ed),2018,23:1933)。此外,caf存在于血液系统恶性肿瘤中(raffaghello,et al.,oncotarget,2015,6:2589)。因此,将fap用作治疗靶标不限于某些肿瘤实体。
[0014]
许多表达fap的caf被描述为与不良预后相关。在广泛的人肿瘤适应症中,fap表达被描述为与较高的肿瘤等级和较差的总生存率相关(pure,et al.,oncogene,2018,37:4343)。
[0015]
如上所述,表明存在于肿瘤微环境中的fap以及表达fap的细胞显著影响肿瘤进展(hanahan,etal.,cancer cell,2012,21:309)。此外,如下所述,由于其在肿瘤中的相对选择性表达,fap被视为治疗和诊断剂的合适靶标(siveke,j nucl med,2018,59:1412;christiansen,et al.,neoplasia,2013,15:348;zi,et al.,mol med rep,2015,11:3203)。
[0016]
在发现后不久,fap就被用作癌症的治疗靶标。直到今天,已经探索了各种策略,包括例如fap酶活性的抑制、fap阳性细胞的消融或细胞毒性化合物的靶向递送。
[0017]
在2007年,point therapeutics开发了fap和dpp4抑制剂talabostat(val-boro-pro,pt-100)(例如美国专利号6,890,904或公开的国际专利申请wo9916864中所述)。pennisi等人(pennisi,et al.,br jhaematol,2009,145:775)在多发性骨髓瘤动物模型以及癌症同源小鼠模型中观察到肿瘤生长减少。此外,已经开发并报道了几种其它的脯氨酰硼酸衍生物作为fap的推定选择性抑制剂。这些衍生物在生理ph值的水相环境中表现出不稳定性(coutts,et al.,j med chem,1996,39:2087)并且与其它酶具有非特异性反应性。
[0018]
wo 2008/116054公开了六肽衍生物,其中化合物包含c-末端双氨基或硼酸官能团。
[0019]
us2017/0066800公开了对fap有效的假肽抑制剂,例如m83。这些抑制剂在免疫缺陷小鼠的肺癌和结肠癌异种移植物中进行了评估。观察到肿瘤生长的抑制(jackson,et al.,neoplasia,2015,17:43)。这些假肽抑制脯氨酰寡肽酶(pop/prep)和fap的活性,因此排除了其作为特异性治疗性fap抑制剂的应用。
[0020]
us2008/280856公开了一种基于纳摩尔硼酸的抑制剂。所述抑制剂显示出对fap和prep的双特异性抑制,从而排除了其作为特异性治疗性fap抑制剂的应用。
[0021]
基于环状肽的fap抑制剂公开于例如wo 2016/146174和wo 2006/042282中。wo 2016/146174公开了用于诊断和治疗表达fap的肿瘤的肽,显示出对fap的特异性,由此所述肽不识别密切相关的同源物dpp4。wo 2006/042282公开了治疗黑色素瘤的多肽。在裸鼠中,
显示出对黑色素瘤生长和黑色素瘤转移的抑制作用。
[0022]
wo 99/75151和wo 01/68708公开了人源化fap单克隆抗体f19(sibrotuzumab)。此外,wo 99/57151和wo 01/68708中公开了抗fap抗体f19及其人源化形式。开发方法涉及例如产生转化为二价衍生物的高亲和力、物种交叉反应性、fap特异性的scfv(brocks,et al.,mol med,2001,7:461)。在i期和ii期临床试验中,sibrotuzumab在转移性结直肠癌患者中显示出特异性肿瘤富集,但未能证明可测量的治疗活性,17名患者中只有2名病情稳定(hofheinz,et al.,onkologie,2003,26:44)。该f19抗体并未显示出阻断fap的任何细胞或蛋白酶功能,这可能解释了没有治疗效果的原因(hofheinz,et al.,onkologie,2003,26:44;scott,et al.,clin cancer res,2003,9:1639)。
[0023]
us2018/022822公开了与人fap及其表位特异性结合的新分子,作为人源抗体和嵌合抗原受体(car),可用于治疗由fap诱发的疾病和病症。用抗fap抗体治疗携带常位同基因mc38结肠直肠肿瘤的小鼠降低肿瘤直径和转移数目。wo 2012/020006公开了在fc区带有修饰寡糖的糖工程化(glycoengineered)抗体。随后,根据wo 2014/161845,开发了对fap和dr5具有特异性的双特异性抗体。这些抗体在具有fap阳性间质的体外和体内临床前肿瘤模型中引起肿瘤细胞凋亡(brunker,etal.,mol cancer ther,2016,15:946)。wo 2015/118030中描述了靶向fap的抗体药物缀合物和免疫毒素。在应用抗hu/mofap hu36:溶细胞素adc候选物后,显示出体外毒性以及体内肿瘤生长抑制作用。目前尚不清楚这些抗体是否能够抑制fap活性。
[0024]
jansen等人(jansen,et al.,j med chem,2014,57:3053;jansen,et al.,acs med chem lett,2013,4:491)描述了基于(4-喹啉酰)甘氨酰-2-氰基吡咯烷的((4-quinolinoyl)glycyl-2-cyanopyrrolidine)小分子fap抑制剂,其显示出对相关的dpp和prep具有低纳摩尔抑制效力和高选择性,并在wo 2013/107820中公开。然而,这些化合物在结构上与本发明的化合物无关并且包括导致与fap共价结合的弹头。
[0025]
近年来,开发了一些靶向fap的放射性药物方法,这些方法在本文中进行了示例性描述。
[0026]
wo 2010/036814公开了通过抑制fap酶活性用作治疗剂或通过与fap结合用作放射性药物的fap小分子抑制剂。
[0027]
wo 2019/083990公开了基于jansen等人(jansen,et al.,j med chem,2014,57:3053;jansen,et al.,acs med chem lett,2013,4:491)描述的小分子fap抑制剂的成像和放疗剂。此外,几位作者描述了基于jansen等人(jansen,et al.,j med chem,2014,57:3053;jansen,et al.,acs med chem lett,2013,4:491)描述的fap抑制剂的成像和放疗剂在癌症患者肿瘤中的选择性摄取(lindner,et al.,j nucl med,2018,59:1415;loktev,et al.,j nucl med,2018,59:1423;giesel,et al.,j nucl med,2019,60:386;loktev,et al.,j nucl med,2019,mar 8(epub ahead of print);giesel,et al.,eur j nucl med mol imaging,2019,46:1754;kratochwil,et al.,j nucl med,2019,60:801)。
[0028]
对
131
i标记的人源化形式的f19抗体(sibrotuzumab)的临床评估显示了在结直肠癌或非小细胞肺癌患者中被肿瘤而不是被正常组织选择性摄取(scott,et al.,clin cancer res,2003,9:1639)。这可能是由于抗体的循环时间长,使其不适用于涉及放射性核素的诊断、治疗或治疗诊断方法。
[0029]
wo 2011/040972公开了识别人和鼠fap抗原的高亲和力抗体作为强力的放射免疫缀合物。esc11 igg1诱导表面fap的下调和内在化(fischer,et al.,clin cancer res,2012,18:6208)。wo 2017/211809公开了组织靶向性钍-227络合物,其中靶向部分对fap具有特异性。然而,抗体的长循环时间使其不适合涉及放射性核素的诊断、治疗或治疗诊断方法。
[0030]
fap还被描述为涉及除肿瘤学适应症以外的其它疾病,其示例如下。
[0031]
患者类风湿性关节炎关节中的成纤维细胞样滑膜细胞显示fap的表达显著增加(bauer,et al.,arthritis res ther,2006,8:r171;milner,et al.,arthritis res ther,2006,8:r23)。在类风湿性关节炎中,间质细胞通过产生细胞外基质成分、募集浸润性免疫细胞和分泌炎症介质,在关节滑膜组织结构的组构中发挥重要作用。存在大量证据支持这些细胞在驱动炎症和关节损伤持续存在方面的作用(bartok,et al.,immunol rev,2010,233:233;turner,et al.,curr opin rheumatol,2015,27:175)。在类风湿性关节炎中,至少通过促进蛋白多糖损失和随后的软骨降解,fap在软骨转换中具有病理学作用(bauer,et al.,arthritis res ther,2006,8:r171;waldele,et al.,arthritis res ther,2015,17:12)。因此,其可以作为患者分层的标志,用于对治疗成功进行评估和随访,或作为治疗靶标(bauer,et al.,arthritis res ther,2006,8:r171)。在小鼠中,使用
99m
tc标记的抗fap抗体的spect/ct成像证明了治疗反应(van der geest,et al.,rheumatology(oxford),2018,57:737;laverman,et al.,j nucl med,2015,56:778;van der geest,et al.,j nucl med,2017,58:151)。
[0032]
此外,fap不仅被认为是损伤反应中活化的成纤维细胞的标志物(tillmanns,et al.,int j cardiol,2013,168:3926),而且还是伤口愈合过程中的重要参与者(ramirez-montagut,et al.,oncogene,2004,23:5435)。jing等人证明了大鼠烧伤后fap表达变化的时间依赖性过程(jing,et al.,nan fang yi ke da xue xue bao,2013,33:615)。在瘢痕疙瘩疤痕(常见的良性纤维增生性网状真皮病变)中抑制反应性创伤成纤维细胞中的fap活性可能提供预防疾病进展的治疗选择(dienus,et al.,arch dermatol res,2010,302:725)。
[0033]
在纤维化疾病中,观察到fap表达上调,例如在特发性肺纤维化、克罗恩病和肝纤维化中。在克罗恩病(一种特征在于过度的、失衡的细胞外基质(ecm)沉积的慢性肠道炎性疾病)的离体模型中,观察到fap表达上调。fap抑制重建了细胞外基质稳态(truffi,et al.,inflamm bowel dis,2018,24:332)。egger等人(egger,et al.,eur j pharmacol,2017,809:64)使用肺纤维化鼠模型也进行了类似的观察。fap的抑制导致纤维化病理减少。fap也在慢性损伤肝脏的组织重塑区表达(wang,et al.,front biosci,2008,13:3168),肝星状细胞的fap表达与肝病的组织学严重程度相关(gorrell,et al.,adv exp med biol,2003,524:235)。因此,fap也是治疗肝纤维化的一个很有前景的靶标(lay,et al.,front biosci(landmark ed),2019,24:1)。
[0034]
fap在动脉硬化病变中表达并在活化的血管平滑肌细胞中上调(monslow,et al.,circulation,2013,128:a17597)。monslow等人表明在动脉硬化病变中靶向抑制fap可以降低整体病变负担,抑制炎症细胞归巢,并经由其通过有利于富含基质的病变而非炎症来改变病变结构的能力来增加病变稳定性。更重要的是,大多数动脉硬化病变具有共同的致病
特征:动脉粥样硬化斑块破裂引起动脉硬化病变(davies,et al.,br heart j,1985,53:363;falk,am j cardiol,1989,63:114e)。晚期动脉粥样硬化斑块中纤维帽的破裂是急性冠状动脉综合征的关键触发因素,可以导致心肌梗塞和心源性猝死。促进斑块不稳定的关键事件之一是纤维帽的降解,这将潜在的血栓形成斑块核心暴露于血流,从而导致血栓形成和随后的血管闭塞(farb,et al.,circulation,1996,93:1354;virmani,et al.,j am coll cardiol,2006,47:c13)。brokopp等人表明fap有助于纤维帽中i型胶原蛋白分解(brokopp,et al.,eur heart j,2011,32:2713)。开发了放射性标记的示踪剂,并显示了其对动脉粥样硬化成像的适用性(meletta,et al.,molecules,2015,20:2081)。
技术实现要素:
[0035]
本发明所基于的问题是提供适合作为诊断剂和/或药剂的化合物,特别是如果与诊断和/或治疗活性效应物缀合的话。本发明所基于的另一个问题是提供适合作为诊断剂和/或药剂的化合物,特别是如果与诊断和/或治疗活性效应物缀合的话,从而所述化合物是fap活性的有力抑制剂;优选所述化合物的pic50等于或大于6.0。本发明所基于的另一个问题是提供在疾病诊断和/或治疗中适合作为诊断剂和/或药剂的化合物,特别是如果与诊断和/或治疗活性效应物缀合的话,其中病变细胞和/或病变组织表达fap。本发明所基于的再一个问题是提供一种化合物,所述化合物适于分别将诊断和/或治疗有效药剂递送至病变细胞和/或病变组织,更特别地是表达fap的病变细胞和/或病变组织,优选所述病变组织包含或含有癌症相关的成纤维细胞。另外,本发明所基于的问题是提供用于诊断疾病的方法、用于治疗和/或预防疾病的方法,以及用于组合地诊断与治疗疾病的方法;优选地,这种疾病是涉及表达fap的细胞和/或组织,更特别是表达fap的病变细胞和/或病变组织的疾病,优选所述病变组织包含或含有癌症相关的成纤维细胞。本发明所基于的另一个问题是提供用于鉴定个体的方法,其中所述个体对疾病的治疗可能有反应或可能没有反应;用于从一组个体选择个体的方法,其中所述个体对疾病的治疗可能有反应或可能没有反应。此外,本发明所基于的问题是提供含有具有上述特征的化合物的药物组合物。进一步地,本发明所基于的问题是提供适用于任何上述方法的药剂盒。
[0036]
需要适合作为诊断剂和/或药剂的化合物,特别是如果与诊断和/或治疗活性效应物缀合的话。此外,需要适合作为诊断剂和/或药剂的化合物,特别是如果与诊断和/或治疗活性效应物缀合的话,从而所述化合物是fap活性的有力抑制剂;优选所述化合物的pic50等于或大于6.0。此外,需要在疾病诊断和/或治疗中适合作为诊断剂和/或药剂的化合物,特别是如果与诊断和/或治疗活性效应物缀合的话,其中病变细胞和/或病变组织表达fap。此外,需要一种化合物,其适于分别将诊断和/或治疗有效药剂递送至病变细胞和/或病变组织,更特别地是表达fap的病变细胞和/或病变组织,优选所述病变组织包含或含有癌症相关的成纤维细胞。另外,需要用于诊断疾病的方法、用于治疗和/或预防疾病的方法,以及组合地诊断和治疗疾病的方法;优选地,这种疾病是涉及表达fap的细胞和/或组织、更特别是表达fap的病变细胞和/或病变组织的疾病,优选所述病变组织包含或含有癌症相关的成纤维细胞。进一步地,需要用于鉴定个体的方法,其中所述个体对疾病的治疗可能有反应或可能没有反应;用于从一组个体选择个体的方法,其中所述个体对疾病的治疗可能有反应或可能没有反应。此外,需要含有具有上述特征的化合物的药物组合物。此外,需要适用于
任何上述方法的药剂盒。本发明满足了这些需要。
[0037]
这些和其它问题由所附权利要求的主题解决。
[0038]
本发明所基于的这些和其它问题也由以下实施方案解决。
[0039]
实施方案1:化合物,其包含式(i)的环状肽和连接于xaa1的n末端修饰基团a,
[0040][0041]
其中:
[0042]
所述肽序列是从左至右以n末端至c末端的方向绘制的,
[0043]
xaa1是式(ii)的氨基酸残基,
[0044][0045]
其中:
[0046]r1a
是-nh-,
[0047]r1b
是h或ch3,
[0048]
n=0或1,
[0049]
所述n末端修饰基团a共价连接于xaa1的氮原子,
[0050]
xaa1的羰基共价连接于xaa2的氮,
[0051]
并且xaa1的硫原子作为硫醚共价连接于yc;
[0052]
xaa2是式(iii)、(iv)或(xx)的氨基酸残基,
[0053][0054]
其中:
[0055]r2a
、r
2b
和r
2c
各自且独立地选自(c
1-c2)烷基和h,其中所述(c
1-c2)烷基可以由选自oh、nh2、卤素、(c
5-c7)环烷基的取代基取代,
[0056]
p=0、1或2
[0057]
v=1或2
[0058]
w=1、2或3,以及
[0059]
所述式(iv)的氨基酸在所示的环位置3和4处可以由选自甲基、oh、nh2和f的一个或两个取代基取代;
[0060]
xaa3是式(v)或(xx)的氨基酸残基,
[0061]
[0062]
其中:
[0063]
x3选自ch2、cf2、ch-r
3b
、s、o和nh,
[0064]
p=1或2
[0065]
v=1或2
[0066]
w=1、2或3,
[0067]r3a
是h、甲基、oh、nh2或f,
[0068]r3b
是甲基、oh、nh2或f;
[0069]
xaa4是式(vi)的氨基酸残基,
[0070][0071]
其中:
[0072]r4a
选自h、oh、cooh、conh2、x4和-nh-co-x4,其中x4选自(c
1-c6)烷基、(c
5-c6)芳基和(c
5-c6)杂芳基,并且x4可以由选自甲基、conh2、卤素、nh2和oh的一个或两个取代基取代;
[0073]
q=1、2或3,其中任选地,所述1个、2个或3个ch2基团的一个或两个氢各自且独立地由甲基、乙基、(c
5-c6)芳基或(c
5-c6)杂芳基取代,
[0074]r4b
是甲基或h;
[0075]
xaa5是结构(vii)的氨基酸残基,
[0076][0077]
其中:
[0078]
r5选自oh和nh2,以及
[0079]
r=1、2或3;
[0080]
xaa6是选自芳族l-α-氨基酸和杂芳族l-α-氨基酸的氨基酸;
[0081]
xaa7是式(ix)的氨基硫醇或氨基酸残基,
[0082][0083]
其中:
[0084]r7a
是-co-、-cooh、-conh2、-ch
2-oh、-(co)-nh-r
7b
、-(co)-(nr
7c
)-r
7b
或h,其中r
7b
和r
7c
各自且独立地是(c
1-c4)烷基,以及
[0085]
t是1或2;
[0086]
yc是式(x)的结构,
[0087]
[0088]
其在形成两个硫醚键的情况下连接xaa1的s原子和xaa7的s原子,由此形成式(xxi)的环状结构,
[0089][0090]
其中:
[0091]
式(x)中芳族基团的取代模式是邻位、间位或对位,
[0092]
n=0或1,
[0093]
t=1或2,
[0094]
y1是c-h或n,y2是n或c-r
c1
,
[0095]rc1
是h或ch
2-r
c2
,以及
[0096]rc2
是式(xi)、(xii)或(xxii)的结构,
[0097][0098]
其中:
[0099]rc3
和r
c4
各自且独立地选自h和(c
1-c4)烷基,以及
[0100]
u=1、2、3、4、5或6,
[0101]
x和y各自且独立地选自1、2或3,以及
[0102]
x=o或s,
[0103]
其中在式(xi)和(xxii)中,氮原子之一连接于r
c1
的-ch
2-,以及在式(xii)中,-x-连接于r
c1
的-ch
2-;以及
[0104]
其中所述n末端修饰基团a是保护基abl,其中保护基abl是r
a1-nh-c(o)-;其中r
a1
选自c3烷基、c4烷基或c5烷基,各自且独立地任选被至多两个取代基取代,所述取代基各自且独立地选自oh、f、cooh、(c
3-c8)环烷基、芳基、杂芳基和(c
3-c8)杂环,并且其中在(c
1-c8)烷基中,一个-ch
2-基团任选被-s-或-o-置换。
[0105]
实施方案2:根据实施方案1的化合物,其中r
a1
选自c3烷基、c4烷基或c5烷基。
[0106]
实施方案3:根据实施方案1和2中任一项的化合物,其中r
a1
是c4烷基。
[0107]
实施方案4:根据实施方案3的化合物,其中r
a1
是正丁基。
[0108]
实施方案5:根据实施方案1至4中任一项的化合物,其中xaa1是选自cys、hcy和pen的d-氨基酸残基,或者xaa1是选自cys、hcy和pen的l-氨基酸残基。
[0109]
实施方案6:根据实施方案5的化合物,其中xaa1是cys。
[0110]
实施方案7:根据实施方案1、2、3、4、5和6中任一项的化合物,其中xaa2是选自pro、gly、nmg及其衍生物的氨基酸残基。
[0111]
实施方案8:根据实施方案7的化合物,其中xaa2是选自pro和nmg的氨基酸残基。
[0112]
实施方案9:实施方案7和8中任一项的化合物,其中xaa2是pro的氨基酸残基。
[0113]
实施方案10:根据实施方案1、2、3、4、5、6、7、8和9中任一项的化合物,其中xaa3是选自pro、hyp、tfp、cfp、dmp、aze和pip及其衍生物的氨基酸残基。
[0114]
实施方案11:根据实施方案10的化合物,其中xaa3是pro的氨基酸残基。
[0115]
实施方案12:根据实施方案1、2、3、4、5、6、7、8、9、10和11中任一项的化合物,其中xaa4是选自thr、hse、asn、gln和ser以及其衍生物的氨基酸残基。
[0116]
实施方案13:根据实施方案12的化合物,其中xaa4是thr。
[0117]
实施方案14:根据实施方案1、2、3、4、5、6、7、8、9、10、11、12和13中任一项的化合物,其中xaa5是选自gln和glu及其衍生物的氨基酸残基。
[0118]
实施方案15:根据实施方案14的化合物,其中xaa5是选自gln和glu的氨基酸残基。
[0119]
实施方案16:根据实施方案15的化合物,其中xaa5是gln的氨基酸残基。
[0120]
实施方案17:根据实施方案15的化合物,其中xaa5是glu的氨基酸残基。
[0121]
实施方案18:根据实施方案1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16和17中任一项的化合物,其中xaa6是下式(viiia)、(viiib)、(viiic)和(viiid)中任一式的氨基酸残基:
[0122][0123]
其中:
[0124]r6a
和r
6b
各自且独立地选自h、甲基、乙基、丙基和异丙基,
[0125]r6c
表示0至3个取代基,每个所述取代基各自且独立地选自cl、f、br、no2、nh2、cn、cf3、oh、or
6d
和c
1-c4烷基,
[0126]r6d
选自甲基、乙基、丙基和异丙基,以及
[0127]
s是0或1。
[0128]
实施方案19:根据实施方案18的化合物,其中xaa6是式(viiia)、(viiib)、(viiic)和(viiid)中任一式的氨基酸残基:
[0129][0130]
其中:
[0131]r6a
和r
6b
各自是h,
[0132]r6c
表示0至2个取代基,每个所述取代基各自且独立地选自cl、f、br、no2、nh2、cn、cf3、oh、or
6d
和甲基,
[0133]r6d
选自甲基、乙基、丙基和异丙基,以及
[0134]
s是0。
[0135]
实施方案20.根据实施方案18至19中任一项的化合物,其中xaa6是选自phe、ocf、ppa、thi、1ni、otf和mpa及其衍生物的氨基酸残基。
[0136]
实施方案21:根据实施方案20的化合物,其中xaa6是phe的氨基酸残基。
[0137]
实施方案22:根据实施方案1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20和21中任一项的化合物,其中xaa7是选自cys、cys-oh、cys-nh2、cysol、aet、hcy、cys、cys-oh、cys-nh2和hcy的氨基硫醇残基。
[0138]
实施方案23:根据实施方案22的化合物,其中xaa7是选自cys、cys-oh、cys-nh2、cysol和aet的氨基硫醇残基。
[0139]
实施方案24:根据实施方案23的化合物,其中xaa7是cys、cys-oh或cys-nh2的氨基硫醇残基,优选cys-oh的氨基硫醇残基。
[0140]
实施方案25:根据实施方案1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23和24中任一项的化合物,优选实施方案1、2、3和4中任一项的化合物,其中:
[0141]
xaa1是cys的氨基酸残基,
[0142]
xaa2是pro或nmg的氨基酸残基,优选pro的氨基酸残基,
[0143]
xaa3是pro的氨基酸残基,
[0144]
xaa4是thr的氨基酸残基,
[0145]
xaa5是gln或glu的氨基酸残基,优选gln的氨基酸残基,
[0146]
xaa6是phe的氨基酸残基,并且
[0147]
xaa7是cys的氨基酸残基。
[0148]
实施方案26:根据实施方案1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23和24中任一项的化合物,优选实施方案1、2、3和4中任一项的化合物,其中:
[0149]
xaa1是cys的氨基酸残基,
[0150]
xaa2是pro的氨基酸残基,
[0151]
xaa3是pro的氨基酸残基,
[0152]
xaa4是thr的氨基酸残基,
[0153]
xaa5是gln的氨基酸残基,
[0154]
xaa6是phe的氨基酸残基,并且
[0155]
xaa7是cys的氨基酸残基。
[0156]
实施方案27:根据实施方案1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23和24中任一项的化合物,优选实施方案1、2、3和4中任一项的化合物,其中:
[0157]
xaa1是cys的氨基酸残基,
[0158]
xaa2是pro的氨基酸残基,
[0159]
xaa3是pro的氨基酸残基,
[0160]
xaa4是thr的氨基酸残基,
[0161]
xaa5是glu的氨基酸残基,
[0162]
xaa6是phe的氨基酸残基,并且
[0163]
xaa7是cys的氨基酸残基。
[0164]
实施方案28:根据实施方案1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、
19、20、21、22、23和24中任一项的化合物,优选实施方案1、2、3和4中任一项的化合物,其中:
[0165]
xaa1是cys的氨基酸残基,
[0166]
xaa2是nmg的氨基酸残基,
[0167]
xaa3是pro的氨基酸残基,
[0168]
xaa4是thr的氨基酸残基,
[0169]
xaa5是gln的氨基酸残基,
[0170]
xaa6是phe的氨基酸残基,并且
[0171]
xaa7是cys的氨基酸残基。
[0172]
实施方案29:根据实施方案1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27和28中任一项的化合物,其中yc是下式(xiii)的结构:
[0173][0174]
其中:
[0175]rc1
是ch
2-r
c2
或h,
[0176]
ch
2-r
c2
是式(xiid)或式(xxiib)的结构:
[0177][0178]
其中:
[0179]
z是任选包含接头的螯合剂,
[0180]rc4
是h或甲基,并且
[0181]
u=1、2、3、4或5。
[0182]
实施方案30:根据实施方案29的化合物,其中r
c2
是式(xiid)的结构:
[0183][0184]
实施方案31:根据实施方案29和30中任一项的化合物,其中r
c2
是式(xiid)的结构:
[0185][0186]
其中:
[0187]
u=1,并且
[0188]rc4
是h。
[0189]
实施方案32:根据实施方案29的化合物,其中r
c2
是式(xxiic)的结构:
[0190][0191]
实施方案33:根据实施方案29、30、31和32中任一项的化合物,其中z是没有接头的螯合剂。
[0192]
实施方案34:根据实施方案29、30、31和32中任一项的化合物,其中z是包含接头的螯合剂。
[0193]
实施方案35:根据实施方案34的化合物,其中所述接头共价连接至螯合剂并且共价连接至式(xiid)结构的n-原子:
[0194][0195]
实施方案36:根据实施方案34的化合物,其中所述接头共价连接至螯合剂并且共价连接至式(xxiic)结构的n-原子:
[0196][0197]
实施方案37:根据实施方案34、35和36中任一项的化合物,其中所述接头选自ttds和o2oc。
[0198]
实施方案38:根据实施方案37的化合物,其中所述接头是ttds。
[0199]
实施方案39:根据实施方案37的化合物,其中所述接头是o2oc。
[0200]
实施方案39:根据实施方案29的化合物,其中r
c1
是h。
[0201]
实施方案40:根据实施方案1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38和39中任一项的化合物,其中氨基酸或肽连接至xaa7,其中该肽的大多数氨基酸是带电荷或极性的,并且所述肽的净电荷为-2、-1、0、 1或 2。
[0202]
实施方案41:根据实施方案40的化合物,其中氨基酸连接至xaa7。
[0203]
实施方案42:根据实施方案41的化合物,其中所述与xaa7连接的氨基酸选自asp、asp、bal、gly、gab、ser、nmg、bhf、lys、ape、ttds和bhk。
[0204]
实施方案43:根据实施方案42的化合物,其中所述与xaa7连接的氨基酸选自bhk、ape和lys。
[0205]
实施方案44:根据实施方案43的化合物,其中所述与xaa7连接的氨基酸是bhk。
[0206]
实施方案45:根据实施方案41、42、43和44中任一项的化合物,其中螯合剂z共价连接至所述与xaa7连接的氨基酸。
[0207]
实施方案46:根据实施方案45的化合物,其中r
c1
是h。
[0208]
实施方案47:根据实施方案29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45和46中任一项的化合物,其中z是选自下组的螯合剂:
99m
tc(co)
3-螯合剂,cb-te2a,
chx-a"-dtpa,dtpa,data,dfo,hbed,crown,dotaga,dotam(也称作tcmc),fsc,h4octapa,macropa,heha,hopo,hynic,pcta,psc,neta,dota,noda-mpaa,nodaga,notp,n
xs4-x
(n4,n2s2,n3s),nopo,nota,pycup,resca,sarcophagine,teta,thp,和trap。
[0209]
实施方案48:根据实施方案47的化合物,其中z是选自dotam、macropa、pcta、dota、n4ac、nodaga、nopo和nota的螯合剂。
[0210]
实施方案49:根据实施方案1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47和48中任一项的化合物,其中所述化合物选自以下组中:
[0211]
下式的化合物nbu-cayl-[cys(tmebn(dota-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-3940):
[0212][0213]
下式的化合物nbu-cayl-[cys(tmebn(n4ac-pp))-pro-pro-thr-gln-phe-cys]-oh(3bp-4533):
[0214][0215]
下式的化合物nbu-cayl-[cys(tmebn(n4ac-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-4534):
[0216][0217]
下式的化合物nbu-cayl-[cys(tmebn(dota-aet))-pro-pro-thr-gln-phe-cys]-nh2(3bp-4560):
[0218][0219]
下式的化合物nbu-cayl-[cys(tmebn(dota-pp))-pro-pro-thr-gln-phe-cys]-oh(3bp-4564):
[0220][0221]
下式的化合物nbu-cayl-[cys(tmebn(dota-pp))-pro-pro-thr-gln-phe-cys]-nh2(3bp-4565):
[0222][0223]
下式的化合物nbu-cayl-[cys(3mebn)-pro-pro-thr-gln-phe-cys]-bhk(n4ac)-oh(3bp-4589):
[0224][0225]
下式的化合物nbu-cayl-[cys(tmebn(dota-aet))-nmg-pro-thr-gln-phe-cys]-oh(3bp-4607):
oh(3bp-4768):
[0234][0235]
下式的化合物nbu-cayl-[cys(tmebn(nopo-aet))-pro-pro-thr-glu-phe-cys]-oh(3bp-4778):
[0236][0237]
以及下式的化合物nbu-cayl-[cys(tmebn(nota-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-5210):
[0238][0239]
实施方案50:根据实施方案49的化合物,其中所述化合物选自以下组中:
[0240]
下式的化合物nbu-cayl-[cys(tmebn(dota-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-3940):
[0241][0242]
下式的化合物nbu-cayl-[cys(tmebn(dota-aet))-pro-pro-thr-gln-phe-cys]-nh2(3bp-4560):
[0243][0244]
下式的化合物nbu-cayl-[cys(tmebn(nopo-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-4768):
[0245][0246]
实施方案51:根据实施方案29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49和50中任一项的化合物,其中所述螯合剂包含核素,优选该核素被螯合剂配位结合。
[0247]
实施方案52:根据实施方案51的化合物,其中所述核素是诊断活性核素或治疗活性核素。
[0248]
实施方案53:根据实施方案52的化合物,其中所述诊断活性核素是诊断活性放射性核素。
[0249]
实施方案54:根据实施方案53的化合物,其中所述诊断活性放射性核素选自以下组:
18
f,
43
sc,
44
sc,
51
mn,
52
mn,
64
cu,
67
ga,
68
ga,
76
br,
77
br,
86
y,
89
zr,
94m
tc,
99m
tc,
111
in,
123
i,
124
i,
125
i,
152
tb,
155
tb,
177
lu,
201
tl,和
203
pb。
[0250]
实施方案55:根据实施方案54的化合物,其中所述诊断活性放射性核素选自
18
f、
68
ga、
99m
tc、
111
in和
203
pb。
[0251]
实施方案56:根据实施方案52的化合物,其中所述治疗活性核素是治疗活性放射性核素。
[0252]
实施方案57:根据实施方案56的化合物,其中所述治疗活性放射性核素选自以下组:
47
sc,
67
cu,
89
sr,
90
y,
131
i,
111
in,
153
sm,
149
tb,
161
tb,
177
lu,
186
re,
188
re,
211
at,
212
pb,
213
bi,
223
ra,
224
ra,
225
ac,
226
th,和
227
th。
[0253]
实施方案58:根据实施方案57的化合物,其中所述治疗活性放射性核素是
90
y、
177
lu、
212
pb和
225
ac。
[0254]
实施方案59:化合物,其包含式(i)的环状肽和连接于xaa1的n末端修饰基团a,
[0255][0256]
其中:
[0257]
所述肽序列是从左至右以n末端至c末端的方向绘制的,
[0258]
xaa1是式(ii)的氨基酸残基,
[0259][0260]
其中:
[0261]r1a
是-nh-,
[0262]r1b
是h或ch3,
[0263]
n=0或1,
[0264]
所述n末端修饰基团a共价连接于xaa1的氮原子,
[0265]
xaa1的羰基共价连接于xaa2的氮,
[0266]
并且xaa1的硫原子作为硫醚共价连接于yc;
[0267]
xaa2是式(iii)、(iv)或(xx)的氨基酸残基:
[0268][0269]
其中:
[0270]r2a
、r
2b
、r
2c
各自且独立地选自(c
1-c2)烷基和h,其中所述(c
1-c2)烷基可以由选自oh、nh2、卤素、(c
5-c7)环烷基的取代基取代,
[0271]
p=0、1或2
[0272]
v=1或2
[0273]
w=1、2或3,以及
[0274]
所述式(iv)的氨基酸在所示的环位置3和4处可以由选自甲基、oh、nh2和f的一个或两个取代基取代;
[0275]
xaa3是式(v)或(xx)的氨基酸残基:
[0276][0277]
其中:
[0278]
x3选自ch2、cf2、ch-r
3b
、s、o和nh,
[0279]
p=1或2
[0280]
v=1或2
[0281]
w=1、2或3,
[0282]r3a
是h、甲基、oh、nh2或f,
[0283]r3b
是甲基、oh、nh2或f;
[0284]
xaa4是式(vi)的氨基酸残基:
[0285][0286]
其中:
[0287]r4a
选自h、oh、cooh、conh2、x4和-nh-co-x4,其中x4选自(c
1-c6)烷基、(c
5-c6)芳基和(c
5-c6)杂芳基,并且x4可以由选自甲基、conh2、卤素、nh2和oh的一个或两个取代基取代;
[0288]
q=1、2或3,其中任选地,所述1个、2个或3个ch2基团的一个或两个氢各自且独立地由甲基、乙基、(c
5-c6)芳基或(c
5-c6)杂芳基取代,
[0289]r4b
是甲基或h;
[0290]
xaa5是结构(vii)的氨基酸残基:
[0291][0292]
其中:
[0293]
r5选自oh和nh2,以及
[0294]
r=1、2或3;
[0295]
xaa6是选自芳族l-α-氨基酸和杂芳族l-α-氨基酸的氨基酸;
[0296]
xaa7是式(ix)的氨基硫醇或氨基酸残基,
[0297][0298]
其中:
[0299]r7a
是
–
co-、-cooh、-conh2、-ch
2-oh、-(co)-nh-r
7b
、-(co)-(nr
7c
)-r
7b
或h,其中r
7b
和r
7c
各自且独立地是(c
1-c4)烷基,以及
[0300]
t是1或2;
[0301]
yc是式(x)的结构,
[0302][0303]
其在形成两个硫醚键的情况下连接xaa1的s原子和xaa7的s原子,由此形成式(xxi)的环状结构,
[0304][0305]
其中:
[0306]
式(x)中芳族基团的取代模式是邻位、间位或对位,优选间位,
[0307]
n=0或1,
[0308]
t=1或2,
[0309]
y1是c-h,
[0310]
y2是c-r
c1
,
[0311]rc1
是ch
2-r
c2
或h,以及
[0312]rc2
是式(xiid)或(xxiic)的结构,
[0313][0314]
其中:
[0315]
u=1,
[0316]rc4
是h,
[0317]
z是任选包含接头的螯合剂;并且
[0318]
其中n末端修饰基团a是保护基abl,其中保护基abl是r
a1-nh-c(o)-;其中r
a1
是任选被至多两个取代基取代的(c
1-c8)烷基,所述取代基各自且独立地选自oh、f、cooh、(c
3-c8)环烷基、芳基、杂芳基和(c
3-c8)杂环,并且其中在(c
1-c8)烷基中,一个-ch
2-基团任选被-s-或-o-置换。
[0319]
实施方案60:根据实施方案59的化合物,其中r
c2
是式(xiid)的结构:
[0320][0321]
其中:
[0322]
u=1,
[0323]rc4
是h,以及
[0324]
z是任选包含接头的螯合剂。
[0325]
实施方案61:根据实施方案60的化合物,其中z是没有接头的螯合剂。
[0326]
实施方案62:根据实施方案60的化合物,其中z包含接头。
[0327]
实施方案63:根据实施方案62的化合物,其中所述接头将螯合剂共价连接至式(xiid)结构的n-原子。
[0328]
实施方案64:根据实施方案62至63中任一项的化合物,其中所述接头选自ttds、
o2oc和peg6,优选选自ttds和o2oc。
[0329]
实施方案65:根据实施方案59的化合物,其中r
c2
是式(xxiic)的结构:
[0330][0331]
其中z是任选包含接头的螯合剂。
[0332]
实施方案66:根据实施方案65的化合物,其中z是没有接头的螯合剂。
[0333]
实施方案67:根据实施方案65的化合物,其中z包含接头。
[0334]
实施方案68:根据实施方案67的化合物,其中所述接头将螯合剂共价连接至式(xxiic)结构的n-原子。
[0335]
实施方案69:根据实施方案67至68中任一项的化合物,其中所述接头选自ttds、o2oc和peg6,优选选自ttds和o2oc。
[0336]
实施方案70:根据实施方案59的化合物,其中r
c1
是h。
[0337]
实施方案71:根据实施方案59、60、61、62、63、64、65、66、67、68、69和70中任一项的化合物,其中r
a1
选自c3烷基、c4烷基或c5烷基,其各自且独立地任选被至多两个取代基取代,所述取代基各自且独立地选自oh、f、cooh、(c
3-c8)环烷基、芳基、杂芳基和(c
3-c8)杂环,并且其中在(c
1-c8)烷基中,一个-ch2-基团任选被-s-或-o-置换。
[0338]
实施方案72:根据实施方案71的化合物,其中r
a1
选自c3烷基、c4烷基或c5烷基。
[0339]
实施方案73:根据实施方案71和72中任一项的化合物,其中r
a1
是c4烷基。
[0340]
实施方案74:根据实施方案73的化合物,其中r
a1
是正丁基。
[0341]
实施方案75:根据实施方案59、60、61、62、63、64、65、66、67、68、69、70、71、72、73和74中任一项的化合物,其中xaa1是选自cys、hcy和pen的d-氨基酸残基,或xaa1是选自cys、hcy和pen的l-氨基酸残基。
[0342]
实施方案76:根据实施方案75的化合物,其中xaa1是cys。
[0343]
实施方案77:根据实施方案59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75和76中任一项的化合物,其中xaa2是选自pro、gly、nmg及其衍生物的氨基酸残基。
[0344]
实施方案78:根据实施方案77的化合物,其中xa2是选自pro和nmg的氨基酸残基。
[0345]
实施方案79:根据实施方案77和78中任一项的化合物,其中xaa2是pro的氨基酸残基。
[0346]
实施方案80:根据实施方案59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78和79中任一项的化合物,其中xaa3是选自pro、hyp、tfp、cfp、dmp、aze和pip及其衍生物的氨基酸残基。
[0347]
实施方案81:根据实施方案80的化合物,其中xaa3是pro的氨基酸残基。
[0348]
实施方案82:根据实施方案59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80和81中任一项的化合物,其中xaa4是选自thr、hse、asn、gln和ser及其衍生物的氨基酸残基。
[0349]
实施方案83:根据实施方案82的化合物,其中xaa4是thr。
[0350]
实施方案84:根据实施方案59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、
74、75、76、77、78、79、80、81、82和83中任一项的化合物,其中xaa5是选自gln和glu及其衍生物的氨基酸残基。
[0351]
实施方案85:根据实施方案84的化合物,其中xaa5是选自gln和glu的氨基酸残基。
[0352]
实施方案86:根据实施方案85的化合物,其中xaa5是gln的氨基酸残基。
[0353]
实施方案87:根据实施方案85的化合物,其中xaa5是glu的氨基酸残基。
[0354]
实施方案88:根据实施方案59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85和86中任一项的化合物,其中xaa6是式(viiia)、(viiib)、(viiic)和(viiid)中任一式的氨基酸残基:
[0355][0356]
其中:
[0357]r6a
和r
6b
各自且独立地选自h、甲基、乙基、丙基和异丙基,
[0358]r6c
表示0至3个取代基,每个所述取代基各自且独立地选自cl、f、br、no2、nh2、cn、cf3、oh、or
6d
和c
1-c4烷基,
[0359]r6d
选自甲基、乙基、丙基和异丙基,以及
[0360]
s是0或1。
[0361]
实施方案89:根据实施方案88的化合物,其中xaa6是式(viiia)、(viiib)、(viiic)和(viiid)中任一式的氨基酸残基:
[0362][0363]
其中:
[0364]r6a
和r
6b
均是h,
[0365]r6c
表示0至2个取代基,每个所述取代基各自且独立地选自cl、f、br、no2、nh2、cn、cf3、oh、or
6d
和甲基,
[0366]r6d
选自甲基、乙基、丙基和异丙基,以及
[0367]
s是0。
[0368]
实施方案90:根据实施方案88至89中任一项的化合物,其中xaa6是选自phe、ocf、ppa、thi、1ni、otf和mpa及其衍生物的氨基酸残基。
[0369]
实施方案91:根据实施方案90的化合物,其中xaa6是phe的氨基酸残基。
[0370]
实施方案92:根据实施方案59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80和81中任一项的化合物,其中xaa7是选自cys、cys-oh、cys-nh2、cysol、aet、hcy、cys、cys-oh、cys-nh2和hcy的氨基硫醇残基。
[0371]
实施方案93:根据实施方案92的化合物,其中xaa7是选自cys、cys-oh、cys-nh2、cysol和aet的氨基硫醇残基。
[0372]
实施方案94:根据实施方案93的化合物,其中xaa7是cys、cys-oh或cys-nh2的氨基硫醇残基,优选是cys-oh的氨基硫醇残基。
[0373]
实施方案95:根据实施方案59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93和94中任一项的化合物,其中:
[0374]
xaa1是cys的氨基酸残基,
[0375]
xaa2是pro或nmg的氨基酸残基,优选pro的氨基酸残基,
[0376]
xaa3是pro的氨基酸残基,
[0377]
xaa4是thr的氨基酸残基,
[0378]
xaa5是gln或glu的氨基酸残基,优选gln的氨基酸残基,
[0379]
xaa6是phe的氨基酸残基,并且
[0380]
xaa7是cys的氨基酸残基。
[0381]
实施方案96:根据实施方案59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93和94中任一项的化合物,其中:
[0382]
xaa1是cys的氨基酸残基,
[0383]
xaa2是pro的氨基酸残基,
[0384]
xaa3是pro的氨基酸残基,
[0385]
xaa4是thr的氨基酸残基,
[0386]
xaa5是gln的氨基酸残基,
[0387]
xaa6是phe的氨基酸残基,并且
[0388]
xaa7是cys的氨基酸残基。
[0389]
实施方案97:根据实施方案59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93和94中任一项的化合物,其中:
[0390]
xaa1是cys的氨基酸残基,
[0391]
xaa2是pro的氨基酸残基,
[0392]
xaa3是pro的氨基酸残基,
[0393]
xaa4是thr的氨基酸残基,
[0394]
xaa5是glu的氨基酸残基,
[0395]
xaa6是phe的氨基酸残基,并且
[0396]
xaa7是cys的氨基酸残基。
[0397]
实施方案98:根据实施方案59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93和94中任一项的化合物,其中:
[0398]
xaa1是cys的氨基酸残基,
[0399]
xaa2是nmg的氨基酸残基,
[0400]
xaa3是pro的氨基酸残基,
[0401]
xaa4是thr的氨基酸残基,
[0402]
xaa5是gln的氨基酸残基,
[0403]
xaa6是phe的氨基酸残基,并且
[0404]
xaa7是cys的氨基酸残基。
[0405]
实施方案99:根据实施方案59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97和98中任一项的化合物,其中氨基酸或肽连接至xaa7,其中该肽的大部分氨基酸是荷电的或极性的,并且所述肽的净电荷是-2、-1、0、 1或 2。
[0406]
实施方案100:根据实施方案99的化合物,其中氨基酸连接至xaa7。
[0407]
实施方案101:根据实施方案100的化合物,其中所述连接至xaa7的氨基酸选自asp、asp、bal、gly、gab、ser、nmg、bhf、lys、ape、ttds和bhk。
[0408]
实施方案102:根据实施方案101的化合物,其中所述连接至xaa7的氨基酸选自bhk、ape和lys。
[0409]
实施方案103:根据实施方案102的化合物,其中所述连接至xaa7的氨基酸是bhk。
[0410]
实施方案104:根据实施方案100、101、192和103中任一项的化合物,其中螯合剂z共价连接至所述与xaa7连接的氨基酸。
[0411]
实施方案105:根据实施方案104的化合物,其中r
c1
是h。
[0412]
实施方案106:根据实施方案59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104和105中任一项的化合物,其中z是选自以下组的螯合剂:
99m
tc(co)
3-螯合剂,cb-te2a,chx-a"-dtpa,dtpa,data,dfo,hbed,crown,dotaga,dotam(也称作tcmc),fsc,h4octapa,macropa,heha,hopo,hynic,pcta,psc,neta,dota,noda-mpaa,nodaga,notp,n
xs4-x
(n4,n2s2,n3s),nopo,nota,pycup,resca,sarcophagine,teta,thp,和trap。
[0413]
实施方案107:根据实施方案106的化合物,其中z是选自dotam、macropa、pcta、dota、n4ac、nodaga、nopo和nota的螯合剂。
[0414]
实施方案108:根据实施方案59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106和107中任一项的化合物,其中所述化合物选自以下组中:
[0415]
下式的化合物nbu-cayl-[cys(tmebn(dota-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-3940):
nh2(3bp-4565):
[0423]
下式的化合物nbu-cayl-[cys(3mebn)-pro-pro-thr-gln-phe-cys]-bhk(n4ac)-oh(3bp-4589):
[0424][0425]
下式的化合物nbu-cayl-[cys(tmebn(dota-aet))-nmg-pro-thr-gln-phe-cys]-oh(3bp-4607):
[0426][0427]
以及下式的化合物nbu-cayl-[cys(tmebn(dota-aet))-nmg-pro-thr-gln-phe-cys]-nh2(3bp-4621):
[0428][0429]
下式的化合物nbu-cayl-[cys(tmebn(nodaga-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-4723):
[0430][0431]
下式的化合物nbu-cayl-[cys(tmebn(nodaga-aet))-pro-pro-thr-glu-phe-cys]-oh(3bp-4724):
[0432][0433]
下式的化合物nbu-cayl-[cys(tmebn(nopo-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-4768):
[0434][0435]
下式的化合物nbu-cayl-[cys(tmebn(nopo-aet))-pro-pro-thr-glu-phe-cys]-oh(3bp-4778):
[0436][0437]
以及下式的化合物nbu-cayl-[cys(tmebn(nota-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-5210):
[0438][0439]
实施方案109:根据实施方案108的化合物,其中所述化合物选自以下组中:
[0440]
下式的化合物nbu-cayl-[cys(tmebn(dota-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-3940):
[0441][0442]
下式的化合物nbu-cayl-[cys(tmebn(dota-aet))-pro-pro-thr-gln-phe-cys]-nh2(3bp-4560):
[0443][0444]
以及下式的化合物nbu-cayl-[cys(tmebn(nopo-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-4768):
[0445][0446]
实施方案110:根据实施方案59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108和109中任一项的化合物,其中所述螯合剂包含核素,优选该核素与螯合剂配位结合。
[0447]
实施方案111:根据实施方案110的化合物,其中所述核素是诊断活性核素或治疗活性核素。
[0448]
实施方案112:根据实施方案111的化合物,其中所述诊断活性核素是诊断活性放射性核素。
[0449]
实施方案113:根据实施方案112的化合物,其中所述诊断活性放射性核素选自以下组:
18
f,
43
sc,
44
sc,
51
mn,
52
mn,
64
cu,
67
ga,
68
ga,
76
br,
77
br,
86
y,
89
zr,
94m
tc,
99m
tc,
111
in,
123
i,
124
i,
125
i,
152
tb,
155
tb,
177
lu,
201
tl,和
203
pb。
[0450]
实施方案114:根据实施方案113的化合物,其中所述诊断活性放射性核素选自以下一组:
18
f、
68
ga、
99m
tc、
111
in和
203
pb。
[0451]
实施方案115:根据实施方案111的化合物,其中所述治疗活性核素是治疗活性放射性核素。
[0452]
实施方案116:根据实施方案115的化合物,其中所述治疗活性放射性核素选自以下组:
47
sc,
67
cu,
89
sr,
90
y,
131
i,
111
in,
153
sm,
149
tb,
161
tb,
177
lu,
186
re,
188
re,
211
at,
212
pb,
213
bi,
223
ra,
224
ra,
225
ac,
226th
和
227
th。
[0453]
实施方案117:根据实施方案116的化合物,其中所述治疗活性放射性核素是
90
y,
177
lu、
212
pb和
225
ac。
[0454]
实施方案118:化合物,其包含式(i)的环状肽和连接于xaa1的n末端修饰基团:
[0455][0456]
其中:
[0457]
所述肽序列是从左至右以n末端至c末端的方向绘制的,
[0458]
xaa1是式(ii)的氨基酸残基,
[0459]
[0460]
其中:
[0461]r1a
是-nh-,
[0462]r1b
是h或ch3,
[0463]
n=0或1,
[0464]
所述n末端修饰基团a共价连接于xaa1的氮原子,
[0465]
xaa1的羰基共价连接于xaa2的氮,
[0466]
并且xaa1的硫原子作为硫醚共价连接于yc;
[0467]
xaa2是式(iii)、(iv)或(xx)的氨基酸残基,
[0468][0469]
其中:
[0470]r2a
、r
2b
、r
2c
各自且独立地选自(c
1-c2)烷基和h,其中所述(c
1-c2)烷基可以由选自oh、nh2、卤素、(c
5-c7)环烷基的取代基取代,
[0471]
p=0、1或2
[0472]
v=1或2
[0473]
w=1、2或3,以及
[0474]
所述式(iv)的氨基酸在所示的环位置3和4处可以由选自甲基、oh、nh2和f的一个或两个取代基取代;
[0475]
xaa3是式(v)或(xx)的氨基酸残基,
[0476][0477]
其中:
[0478]
x3选自ch2、cf2、ch-r
3b
、s、o和nh,
[0479]
p=1或2
[0480]
v=1或2
[0481]
w=1、2或3,
[0482]r3a
是h、甲基、oh、nh2或f,
[0483]r3b
是甲基、oh、nh2或f;
[0484]
xaa4是式(vi)的氨基酸残基,
[0485][0486]
其中:
[0487]r4a
选自h、oh、cooh、conh2、x4和-nh-co-x4,其中x4选自(c
1-c6)烷基、(c
5-c6)芳基和(c
5-c6)杂芳基,并且x4可以由选自甲基、conh2、卤素、nh2和oh的一个或两个取代基取代;
[0488]
q=1、2或3,其中任选地,所述1个、2个或3个ch2基团的一个或两个氢各自且独立
地由甲基、乙基、(c
5-c6)芳基或(c
5-c6)杂芳基取代,
[0489]r4b
是甲基或h;
[0490]
xaa5是结构(vii)的氨基酸残基,
[0491][0492]
其中:
[0493]
r5选自oh和nh2,以及
[0494]
r=1、2或3;
[0495]
xaa6是选自芳族l-α-氨基酸和杂芳族l-α-氨基酸的氨基酸;
[0496]
xaa7是式(ix)的氨基硫醇或氨基酸残基,
[0497][0498]
其中:
[0499]r7a
是-co-、-cooh、-conh2、-ch
2-oh、-(co)-nh-r
7b
、-(co)-(nr
7c
)-r
7b
或h,其中r
7b
和r
7c
各自且独立地是(c
1-c4)烷基,以及
[0500]
t是1或2;
[0501]
yc是式(x)的结构,
[0502][0503]
其在形成两个硫醚键的情况下连接xaa1的s原子和xaa7的s原子,由此形成式(xxi)的环状结构,
[0504][0505]
其中:
[0506]
式(x)中芳族基团的取代模式是间位,
[0507]
n=0或1,
[0508]
t=1或2,
[0509]
y1是c-h或n,
[0510]
y2是c-r
c1
,
[0511]rc1
是h;
[0512]
其中n末端修饰基团a是氨基酸aaa,
[0513]
其中
[0514]
氨基酸aaa是结构(xiv)的l-氨基酸残基:
[0515][0516]
其中:
[0517]ra2
选自(c
1-c6)烷基、修饰的(c
1-c6)烷基,
[0518]
其中在修饰的(c
1-c6)烷基中,1个-ch
2-基团由-s-或-o-置换,
[0519]
氨基酸aaa共价连接至接头,其中所述接头共价连接至螯合剂z,其中所述接头(a)由第一接头组成或(b)由第一接头和第二接头组成,其中:
[0520]
如果所述接头由第一接头组成,则该第一接头与所述螯合剂和氨基酸aaa共价连接,并且
[0521]
如果所述接头由第一接头和第二接头组成,则所述第一接头共价连接至所述氨基酸aaa和第二接头,并且所述第二接头共价连接至所述螯合剂,
[0522]
所述第一接头选自ttds和peg6,优选第一接头是ttds,
[0523]
所述第二接头选自ppac和peg6,优选第二接头是ppac。
[0524]
实施方案119:根据实施方案118的化合物,其中r
a2
是c4烷基。
[0525]
实施方案120:根据实施方案118和119中任一项的化合物,其中氨基酸aaa是nle的残基。
[0526]
实施方案121:根据实施方案118、119和120中任一项的化合物,其中y1是c-h。
[0527]
实施方案122:根据实施方案118、119和120中任一项的化合物,其中y1是n。
[0528]
实施方案123:根据实施方案118、119、120、121和122中任一项、优选实施方案120至122中任一项的化合物,其中所述接头由第一接头组成,其中所述第一接头选自ttds和peg6。
[0529]
实施方案124:根据实施方案123的化合物,其中第一接头是ttds,并且优选氨基酸aaa是nle残基。
[0530]
实施方案125:根据实施方案123的化合物,其中第一接头是peg6,并且优选氨基酸aaa是nle残基。
[0531]
实施方案126:根据实施方案118、119、120、121和122中任一项、优选实施方案120、121和122中任一项的化合物,其中所述接头由第一接头和第二接头组成,其中第一接头选自ttds和peg6,并且第二接头选自ppac和peg6,优选ppac。
[0532]
实施方案127:根据实施方案126的化合物,其中第一接头是ttds并且第二接头是ppac,优选氨基酸aaa是nle残基。
[0533]
实施方案128:根据实施方案126的化合物,其中第一接头是ttds并且第二接头是peg6,优选氨基酸aaa是nle残基。
[0534]
实施方案129:根据实施方案118、119、120、121、122、123、124、125、126、127和128中任一项的化合物,其中xaa1是选自cys、hcy和pen的d-氨基酸残基,或xaa1是选自cys、hcy和pen的l-氨基酸残基。
[0535]
实施方案130:根据实施方案129的化合物,其中xaa1是cys。
[0536]
实施方案131:根据实施方案118、119、120、121、122、123、124、125、126、127、128、129和130中任一项的化合物,其中xaa2是选自pro、gly、nmg及其衍生物的氨基酸残基。
[0537]
实施方案132:根据实施方案131的化合物,其中xaa2是选自pro和nmg的氨基酸残基。
[0538]
实施方案133:根据实施方案131和132中任一项的化合物,其中xaa2是pro的氨基酸残基。
[0539]
实施方案134:根据实施方案118、119、120、121、122、123、124、125、126、127、128、129、130、131、132和133中任一项的化合物,其中xaa3是选自pro、hyp、tfp、cfp、dmp、aze和pip及其衍生物的氨基酸残基。
[0540]
实施方案135:根据实施方案134的化合物,其中xaa3是pro的氨基酸残基。
[0541]
实施方案136:根据实施方案118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134和135中任一项的化合物,其中xaa4是选自thr、hse、asn、gln和ser及其衍生物的氨基酸残基。
[0542]
实施方案137:根据实施方案136的化合物,其中xaa4是thr。
[0543]
实施方案138:根据实施方案118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136和137中任一项的化合物,其中xaa5是选自gln和glu及其衍生物的氨基酸残基。
[0544]
实施方案139:根据实施方案138的化合物,其中xaa5是选自gln和glu的氨基酸残基。
[0545]
实施方案140:根据实施方案139的化合物,其中xaa5是gln的氨基酸残基。
[0546]
实施方案141:根据实施方案140的化合物,其中xaa5是glu的氨基酸残基。
[0547]
实施方案142:根据实施方案118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140和141中任一项的化合物,其中xaa6是式(viiia)、(viiib)、(viiic)和(viiid)中任一式的氨基酸残基:
[0548][0549]
其中:
[0550]r6a
和r
6b
各自且独立地选自h、甲基、乙基、丙基和异丙基,
[0551]r6c
表示0至3个取代基,每个所述取代基各自且独立地选自cl、f、br、no2、nh2、cn、cf3、oh、or
6d
和c
1-c4烷基,
[0552]r6d
选自甲基、乙基、丙基和异丙基,以及
[0553]
s是0或1。
[0554]
实施方案143:根据实施方案142的化合物,其中xaa6是式(viiia)、(viiib)、(viiic)和(viiid)中任一式的氨基酸残基:
[0555][0556]
其中:
[0557]r6a
和r
6b
均是h,
[0558]r6c
表示0至2个取代基,每个所述取代基各自且独立地选自cl、f、br、no2、nh2、cn、cf3、oh、or
6d
和甲基,
[0559]r6d
选自甲基、乙基、丙基和异丙基,以及
[0560]
s是0。
[0561]
实施方案144:根据实施方案142至143中任一项的化合物,其中xaa6是选自phe、ocf、ppa、thi、1ni、otf和mpa及其衍生物的氨基酸残基。
[0562]
实施方案145:根据实施方案144的化合物,其中xaa6是phe的氨基酸残基。
[0563]
实施方案146:根据实施方案118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144和145中任一项的化合物,其中xaa7是选自cys、cys-oh、cys-nh2、cysol、aet、hcy、cys、cys-oh、cys-nh2和hcy的氨基硫醇残基。
[0564]
实施方案147:根据实施方案146的化合物,其中xaa7是选自cys、cys-oh、cys-nh2、cysol和aet的氨基硫醇残基。
[0565]
实施方案148:根据实施方案147的化合物,其中xaa7是cys、cys-oh或cys-nh2的氨基硫醇残基,优选是cys-oh的氨基硫醇残基。
[0566]
实施方案149:根据实施方案118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147和148中任一项的化合物,其中:
[0567]
xaa1是cys的氨基酸残基,
[0568]
xaa2是pro或nmg的氨基酸残基,优选pro的氨基酸残基,
[0569]
xaa3是pro的氨基酸残基,
[0570]
xaa4是thr的氨基酸残基,
[0571]
xaa5是gln或glu的氨基酸残基,优选gln的氨基酸残基,
[0572]
xaa6是phe的氨基酸残基,并且
[0573]
xaa7是cys的氨基酸残基。
[0574]
实施方案150:根据实施方案118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147和148中任一项的化合物,其中:
[0575]
xaa1是cys的氨基酸残基,
[0576]
xaa2是pro的氨基酸残基,
[0577]
xaa3是pro的氨基酸残基,
[0578]
xaa4是thr的氨基酸残基,
[0579]
xaa5是gln的氨基酸残基,
[0580]
xaa6是phe的氨基酸残基,并且
[0581]
xaa7是cys的氨基酸残基。
[0582]
实施方案151:根据实施方案118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147和148中任一项的化合物,其中:
[0583]
xaa1是cys的氨基酸残基,
[0584]
xaa2是pro的氨基酸残基,
[0585]
xaa3是pro的氨基酸残基,
[0586]
xaa4是thr的氨基酸残基,
[0587]
xaa5是glu的氨基酸残基,
[0588]
xaa6是phe的氨基酸残基,并且
[0589]
xaa7是cys的氨基酸残基。
[0590]
实施方案152:根据实施方案118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147和148中任一项的化合物,其中:
[0591]
xaa1是cys的氨基酸残基,
[0592]
xaa2是nmg的氨基酸残基,
[0593]
xaa3是pro的氨基酸残基,
[0594]
xaa4是thr的氨基酸残基,
[0595]
xaa5是gln的氨基酸残基,
[0596]
xaa6是phe的氨基酸残基,并且
[0597]
xaa7是cys的氨基酸残基。
[0598]
实施方案153:根据实施方案118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151和152中任一项的化合物,其中氨基酸或肽连接至xaa7,其中该肽的大多数氨基酸是带电荷或极性的,并且所述肽的净电荷为-2、-1、0、 1或 2。
[0599]
实施方案154:根据实施方案153的化合物,其中氨基酸连接至xaa7。
[0600]
实施方案155:根据实施方案154的化合物,其中所述连接至xaa7的氨基酸选自asp、asp、bal、gly、gab、ser、nmg、bhf、lys、ape、ttds和bhk。
[0601]
实施方案156:根据实施方案155的化合物,其中所述连接至xaa7的氨基酸是bal或asp。
[0602]
实施方案157:根据实施方案118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156中任一项的化合物,其中z是选自下组的螯合剂:
99m
tc(co)
3-螯合剂,cb-te2a,chx-a"-dtpa,dtpa,data,dfo,hbed,crown,dotaga,dotam(也称作tcmc),fsc,h4octapa,macropa,heha,hopo,hynic,pcta,psc,neta,dota,noda-mpaa,nodaga,notp,n
xs4-x
(n4,n2s2,n3s),nopo,nota,pycup,resca,sarcophagine,teta,thp,和trap。
[0603]
实施方案158:根据实施方案157的化合物,其中z是选自dotam、macropa、pcta、dota、n4ac、nodaga、nopo和nota的螯合剂。
[0604]
实施方案159:根据实施方案105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157和158中任一项的化合物,其中所述化合物选自以下组中:
[0605]
下式的化合物n4ac-ppac-ttds-nle-[cys(3mebn)-pro-pro-thr-gln-phe-cys]-oh(3bp-4541):
[0606][0607]
下式的化合物n4ac-ttds-nle-[cys(3lut)-pro-pro-thr-gln-phe-cys]-oh(3bp-4549):
[0608][0609]
下式的化合物n4ac-peg6-nle-[cys(3lut)-pro-pro-thr-gln-phe-cys]-oh(3bp-4550):
[0610][0611]
下式的化合物n4ac-peg6-nle-[cys(3mebn)-pro-pro-thr-gln-phe-cys]-oh
(3bp-4743):
[0616]
下式的化合物n4ac-peg6-nle-[cys(3lut)-pro-pro-thr-glu-phe-cys]-oh(3bp-4773):
[0617]
下式的化合物n4ac-ppac-ttds-nle-[cys(3lut)-pro-pro-thr-gln-phe-cys]-oh(3bp-4774):
[0618]
下式的化合物n4ac-ppac-ttds-nle-[cys(3lut)-pro-pro-thr-glu-phe-cys]-oh(3bp-4775):
[0619]
下式的化合物n4ac-peg6-ttds-nle-[cys(3mebn)-pro-pro-thr-glu-phe-cys]-oh(3bp-4780):
[0620]
下式的化合物n4ac-ppac-peg6-nle-[cys(3mebn)-pro-pro-thr-glu-phe-cys]-oh(3bp-4781):
[0621]
下式的化合物n4ac-ppac-ttds-nle-[cys(3mebn)-pro-pro-thr-glu-phe-cys]-oh(3bp-4782):
[0622]
下式的化合物n4ac-ppac-ttds-nle-[cys(3mebn)-pro-pro-thr-glu-phe-cys]-bal-oh(3bp-4784):
[0623]
下式的化合物n4ac-ppac-ttds-nle-[cys(3mebn)-pro-pro-thr-glu-phe-cys]-asp-oh(3bp-4785):
[0624]
下式的化合物n4ac-ppac-ttds-nle-[cys(3mebn)-pro-pro-thr-gln-phe-cys]-bal-oh(3bp-4960):
[0625]
下式的化合物n4ac-ppac-ttds-nle-[cys(3lut)-pro-pro-thr-gln-phe-cys]-bal-oh(3bp-4961):
[0626]
以及下式的化合物nota-ttds-nle-[cys(3mebn)-pro-pro-thr-gln-phe-cys]-oh(3bp-5201):
[0627][0628]
实施方案160:根据实施方案159的化合物,其中所述化合物选自以下组中:
[0629]
下式的化合物n4ac-ppac-ttds-nle-[cys(3mebn)-pro-pro-thr-gln-phe-cys]-oh(3bp-4541):
[0630][0631]
下式的化合物nodaga-ttds-nle-[cys(3mebn)-pro-pro-thr-gln-phe-cys]-oh(3bp-4713):
[0632][0633]
下式的化合物n4ac-ppac-ttds-nle-[cys(3lut)-pro-pro-thr-gln-phe-cys]-bal-oh(3bp-4961):
[0634][0635]
以及下式的化合物nota-ttds-nle-[cys(3mebn)-pro-pro-thr-gln-phe-cys]-oh(3bp-5201):
[0636][0637]
实施方案161:根据实施方案118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159和160中任一项的化合物,其中所述螯合剂包含核素,优选该核素与所述螯合剂配位结合。
[0638]
实施方案162:根据实施方案161的化合物,其中所述核素是诊断活性核素或治疗活性核素。
[0639]
实施方案163:根据实施方案162的化合物,其中所述诊断活性核素是诊断活性放射性核素。
[0640]
实施方案164:根据实施方案163的化合物,其中所述诊断活性放射性核素选自以下组:
18
f,
43
sc,
44
sc,
51
mn,
52
mn,
64
cu,
67
ga,
68
ga,
76
br,
77
br,
86
y,
89
zr,
94m
tc,
99m
tc,
111
in,
123
i,
124
i,
125
i,
152
tb,
155
tb,
177
lu,
201
tl,和
203
pb。
[0641]
实施方案165:根据实施方案164的化合物,其中所述诊断活性放射性核素选自以下组:
18
f、
68
ga、
99m
tc、
111
in和
203
pb。
[0642]
实施方案166:根据实施方案162的化合物,其中所述治疗活性核素是治疗活性放射性核素。
[0643]
实施方案167:根据实施方案166的化合物,其中所述治疗活性放射性核素选自以下组:
47
sc,
67
cu,
89
sr,
90
y,
131
i,
111
in,
153
sm,
149
tb,
161
tb,
177
lu,
186
re,
188
re,
211
at,
212
pb,
213
bi,
223
ra,
224
ra,
225
ac,
226
th,和
227
th。
[0644]
实施方案168:根据实施方案167的化合物,其中所述治疗活性放射性核素是
90
y、
177
lu、
212
pb和
225
ac。
[0645]
实施方案169:化合物,其包含式(i)的环状肽和连接于xaa1的n末端修饰基团a,
[0646][0647]
其中:
[0648]
所述肽序列是从左至右以n末端至c末端的方向绘制的,
[0649]
xaa1是式(ii)的氨基酸残基,
[0650][0651]
其中:
[0652]r1a
是-nh-,
[0653]r1b
是h或ch3,
[0654]
n=0或1,
[0655]
所述n末端修饰基团a共价连接于xaa1的氮原子,
[0656]
xaa1的羰基共价连接于xaa2的氮,
[0657]
并且xaa1的硫原子作为硫醚共价连接于yc;
[0658]
xaa2是式(iii)、(iv)或(xx)的氨基酸残基,
[0659][0660]
其中:
[0661]r2a
、r
2b
、r
2c
各自且独立地选自(c
1-c2)烷基和h,其中所述(c
1-c2)烷基可以由选自oh、nh2、卤素、(c
5-c7)环烷基的取代基取代,
[0662]
p=0、1或2
[0663]
v=1或2
[0664]
w=1、2或3,以及
[0665]
所述式(iv)的氨基酸在所示的环位置3和4处可以由选自甲基、oh、nh2和f的一个或两个取代基取代;
[0666]
xaa3是式(v)或(xx)的氨基酸残基,
[0667][0668]
其中:
[0669]
x3选自ch2、cf2、ch-r
3b
、s、o和nh,
[0670]
p=1或2
[0671]
v=1或2
[0672]
w=1、2或3,
[0673]r3a
是h、甲基、oh、nh2或f,
[0674]r3b
是甲基、oh、nh2或f;
[0675]
xaa4是式(vi)的氨基酸残基,
[0676]
[0677]
其中:
[0678]r4a
选自h、oh、cooh、conh2、x4和-nh-co-x4,其中x4选自(c
1-c6)烷基、(c
5-c6)芳基和(c
5-c6)杂芳基,并且x4可以由选自甲基、conh2、卤素、nh2和oh的一个或两个取代基取代;
[0679]
q=1、2或3,其中任选地,所述1个、2个或3个ch2基团的一个或两个氢各自且独立地由甲基、乙基、(c
5-c6)芳基或(c
5-c6)杂芳基取代,
[0680]r4b
是甲基或h;
[0681]
xaa5是结构(vii)的氨基酸残基,
[0682][0683]
其中:
[0684]
r5选自oh和nh2,以及
[0685]
r=1、2或3;
[0686]
xaa6是选自芳族l-α-氨基酸和杂芳族l-α-氨基酸的氨基酸;
[0687]
xaa7是式(ix)的氨基硫醇或氨基酸残基,
[0688][0689]
其中:
[0690]r7a
是-co-、-cooh、-conh2、-ch
2-oh、-(co)-nh-r
7b
、-(co)-(nr
7c
)-r
7b
或h,其中r
7b
和r
7c
各自且独立地是(c
1-c4)烷基,以及
[0691]
t是1或2;
[0692]
yc是式(x)的结构,
[0693][0694]
其在形成两个硫醚键的情况下连接xaa1的s原子和xaa7的s原子,由此形成式(xxi)的环状结构,
[0695][0696]
其中:
[0697]
式(x)中芳族基团的取代模式是间位,
[0698]
n=0或1,
[0699]
t=1或2,
[0700]
y1是c-h,
[0701]
y2是c-r
c1
,
[0702]rc1
是ch
2-r
c2
,以及
[0703]rc2
是式(xiid)的结构,
[0704][0705]
其中
[0706]
u=1、2、3、4、5或6,优选u=1,
[0707]rc4
是h或甲基,
[0708]
z是任选包含接头的螯合剂,并且
[0709]
其中所述n末端修饰基团a是保护基abl,其中保护基abl选自r
a11-c(o)-,其中r
a11
是c4烷基或c5烷基,其中各自且独立地,c4烷基和c5烷基之每个和任一个之中,-ch
2-基团之一任选被-o-或-s-置换。
[0710]
实施方案170:根据实施方案169的化合物,其中r
a11
是c5烷基。
[0711]
实施方案171:根据实施方案170的化合物,其中r
a11
是正戊基。
[0712]
实施方案172:根据实施方案170的化合物,其中r
a11
具有结构(xxx):
[0713][0714]
实施方案173:根据实施方案169的化合物,其中r
a11
是c4烷基。
[0715]
实施方案174:根据实施方案173的化合物,其中r
a11
是正丁基。
[0716]
实施方案175:根据实施方案169的化合物,其中r
a11
具有结构(xxxi):
[0717][0718]
实施方案176:根据实施方案169的化合物,其中r
a11
具有结构(xxxii):
[0719][0720]
实施方案177:根据实施方案169的化合物,其中r
a11
具有结构(xxxiii):
[0721][0722]
实施方案178:根据实施方案169至177中任一项的化合物,其中所述螯合剂z共价连接至式(xiid)结构的n原子:
[0723][0724]
实施方案179:根据实施方案170的化合物,其中u=1。
[0725]
实施方案180:根据实施方案178和179中任一项的化合物,其中r
c4
是h。
[0726]
实施方案181:根据实施方案169、170、171、172、173、174、175、176和177中任一项的化合物,其中所述螯合剂z包含接头。
[0727]
实施方案182:根据实施方案181的化合物,其中所述接头共价连接至螯合剂并且共价连接至式(xiid)结构的n原子:
[0728][0729]
实施方案183:根据实施方案182的化合物,其中u=1。
[0730]
实施方案184:根据实施方案182和183中任一项的化合物,其中r
c4
是h。
[0731]
实施方案185:根据实施方案181、182、183和184中任一项的化合物,其中所述接头选自ttds和o20c。
[0732]
实施方案186:根据实施方案181、182、183和184中任一项的化合物,其中所述接头是ttds。
[0733]
实施方案187:根据实施方案181、182、183和184中任一项的化合物,其中所述接头是o2oc。
[0734]
实施方案188:根据实施方案169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185和187中任一项的化合物,其中xaa1是选自cys、hcy和pen的d-氨基酸残基,或xaa1是选自cys、hcy和pen的l-氨基酸残基。
[0735]
实施方案189:根据实施方案188的化合物,其中xaa1是cys。
[0736]
实施方案190:根据实施方案169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、187、188和189中任一项的化合物,其中xaa2是选自pro、gly、nmg及其衍生物的氨基酸残基。
[0737]
实施方案191:根据实施方案190的化合物,其中xaa2是选自pro和nmg的氨基酸残基。
[0738]
实施方案192:根据实施方案190和191中任一项的化合物,其中xaa2是pro的氨基酸残基。
[0739]
实施方案193:根据实施方案169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、187、188、189、190、191和192中任一项的化合物,其中xaa3是选自pro、hyp、tfp、cfp、dmp、aze和pip及其衍生物的氨基酸残基。
[0740]
实施方案194:根据实施方案193的化合物,其中xaa3是pro的氨基酸残基。
[0741]
实施方案195:根据实施方案169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、187、188、189、190、191、192、193和194中任一项的化合物,其中xaa4是选自thr、hse、asn、gln和ser及其衍生物的氨基酸残基。
[0742]
实施方案196:根据实施方案195的化合物,其中xaa4是thr。
[0743]
实施方案197:根据实施方案169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、187、188、189、190、191、192、193、194、195和196中任一项的化合物,其中xaa5是选自gln和glu及其衍生物的氨基酸残基。
[0744]
实施方案198:根据实施方案197的化合物,其中xaa5是选自gln和glu的氨基酸残基。
[0745]
实施方案199:根据实施方案198的化合物,其中xaa5是gln的氨基酸残基。
[0746]
实施方案200:根据实施方案199的化合物,其中xaa5是glu的氨基酸残基。
[0747]
实施方案201:根据实施方案169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、187、188、189、190、191、192、193、194、195、196、197、198、199和200中任一项的化合物,其中xaa6是式(viiia)、(viiib)、(viiic)和(viiid)中任一式的氨基酸残基:
[0748][0749]
其中:
[0750]r6a
和r
6b
各自且独立地选自h、甲基、乙基、丙基和异丙基,
[0751]r6c
表示0至3个取代基,每个所述取代基各自且独立地选自cl、f、br、no2、nh2、cn、cf3、oh、or
6d
和c
1-c4烷基,
[0752]r6d
选自甲基、乙基、丙基和异丙基,以及
[0753]
s是0或1。
[0754]
实施方案202:根据实施方案201的化合物,其中xaa6是式(viiia)、(viiib)、(viiic)和(viiid)中任一式的氨基酸残基:
[0755][0756]
其中:
[0757]r6a
和r
6b
均是h,
[0758]r6c
表示0至2个取代基,每个所述取代基各自且独立地选自cl、f、br、no2、nh2、cn、cf3、oh、or
6d
和甲基,
[0759]r6d
选自甲基、乙基、丙基和异丙基,以及
[0760]
s是0。
[0761]
实施方案203:根据实施方案201至202中任一项的化合物,其中xaa6是选自phe、ocf、ppa、thi、1ni、otf和mpa及其衍生物的氨基酸残基。
[0762]
实施方案204:根据实施方案203的化合物,其中xaa6是phe的氨基酸残基。
[0763]
实施方案205:根据实施方案169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203和204中任一项的化合物,其中xaa7是选自cys、cys-oh、cys-nh2、cysol、aet、hcy、cys、cys-oh、cys-nh2和hcy的氨基硫醇残基。
[0764]
实施方案206:根据实施方案205的化合物,其中xaa7是选自cys、cys-oh、cys-nh2、cysol和aet的氨基硫醇残基。
[0765]
实施方案207:根据实施方案206的化合物,其中xaa7是cys或cys-nh2的氨基硫醇
残基,优选cys-oh的氨基硫醇残基。
[0766]
实施方案208:根据实施方案169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206和207中任一项的化合物,其中:
[0767]
xaa1是cys的氨基酸残基,
[0768]
xaa2是pro或nmg的氨基酸残基,优选pro的氨基酸残基,
[0769]
xaa3是pro的氨基酸残基,
[0770]
xaa4是thr的氨基酸残基,
[0771]
xaa5是gln或glu的氨基酸残基,优选gln的氨基酸残基,
[0772]
xaa6是phe的氨基酸残基,并且
[0773]
xaa7是cys的氨基酸残基。
[0774]
实施方案209:根据实施方案169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206和207中任一项的化合物,其中:
[0775]
xaa1是cys的氨基酸残基,
[0776]
xaa2是pro的氨基酸残基,
[0777]
xaa3是pro的氨基酸残基,
[0778]
xaa4是thr的氨基酸残基,
[0779]
xaa5是gln的氨基酸残基,
[0780]
xaa6是phe的氨基酸残基,并且
[0781]
xaa7是cys的氨基酸残基。
[0782]
实施方案210:根据实施方案169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206和207中任一项的化合物,其中:
[0783]
xaa1是cys的氨基酸残基,
[0784]
xaa2是pro的氨基酸残基,
[0785]
xaa3是pro的氨基酸残基,
[0786]
xaa4是thr的氨基酸残基,
[0787]
xaa5是glu的氨基酸残基,
[0788]
xaa6是phe的氨基酸残基,并且
[0789]
xaa7是cys的氨基酸残基。
[0790]
实施方案211:根据实施方案169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206和207中任一项的化合物,其中:
[0791]
xaa1是cys的氨基酸残基,
[0792]
xaa2是nmg的氨基酸残基,
[0793]
xaa3是pro的氨基酸残基,
[0794]
xaa4是thr的氨基酸残基,
[0795]
xaa5是gln的氨基酸残基,
[0796]
xaa6是phe的氨基酸残基,并且
[0797]
xaa7是cys的氨基酸残基。
[0798]
实施方案212:根据实施方案169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210和211中任一项的化合物,其中z是选自以下组的螯合剂:
99m
tc(co)
3-chelators,cb-te2a,chx-a"-dtpa,dtpa,data,dfo,hbed,crown,dotaga,dotam(也称作tcmc),fsc,h4octapa,macropa,heha,hopo,hynic,pcta,psc,neta,dota,noda-mpaa,nodaga,notp,n
xs4-x
(n4,n2s2,n3s),nopo,nota,pycup,resca,sarcophagine,teta,thp,和trap。
[0799]
实施方案213:根据实施方案212的化合物,其中z是选自dotam、macropa、pcta、dota、n4ac、nodaga、nopo和nota的螯合剂。
[0800]
实施方案214:根据实施方案169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、187、188、189、190、191、192、193、194、195、197、197、198、199、200、202、202、203、204、205、205、206、207、208、209、210、210、211、211、212和213中任一项的化合物,其中所述化合物选自以下组中:
[0801]
下式的化合物ihex-[cys(tmebn(dota-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-3907):
[0802][0803]
下式的化合物pent-[cys(tmebn(dota-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-3910):
[0804][0805]
下式的化合物etopr-[cys(tmebn(dota-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-3918):
[0806][0807]
下式的化合物meobut-[cys(tmebn(dota-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-3937):
[0808]
下式的化合物proac-[cys(tmebn(dota-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-3938):
[0809]
下式的化合物nbu-coyl-[cys(tmebn(dota-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-3941):
[0810]
下式的化合物hex-[cys(tmebn(data-ttds-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-4384):
[0811]
下式的化合物hex-[cys(tmebn(nodaga-aet))-pro-pro-thr-glu-phe-cys]-oh(3bp-4695):
[0812][0813]
下式的化合物hex-[cys(tmebn(nodaga-o2oc-aet))-pro-pro-thr-gln-phe-cys]-nh2(3bp-4708):
[0814][0815]
下式的化合物hex-[cys(tmebn(nopo-aet))-pro-pro-thr-gln-phe-cys]-nh2(3bp-4729):
[0816][0817]
下式的化合物hex-[cys(tmebn(nopo-aet))-pro-pro-thr-glu-phe-cys]-oh(3bp-4818):
[0818][0819]
下式的化合物hex-[cys(tmebn(acpcta-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-5273):
[0820][0821]
下式的化合物hex-[cys(tmebn(lsc-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-5288):
[0822][0823]
以及下式的化合物hex-[cys(tmebn(dotam-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-5323):
[0824][0825]
实施方案215:根据实施方案169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、187、188、189、190、191、192、193、194、195、196、197、198、199、
200、201、202、203、204、205、206、207、208、209、210、211、212、213和214中任一项的化合物,其中所述螯合剂包含核素,优选所述核素与所述螯合剂配位结合。
[0826]
实施方案216:根据实施方案215的化合物,其中所述核素是诊断活性核素或治疗活性核素。
[0827]
实施方案217:根据实施方案216的化合物,其中所述诊断活性核素是诊断活性放射性核素。
[0828]
实施方案218:根据实施方案217的化合物,其中所述诊断活性放射性核素选自以下组:
18
f,
43
sc,
44
sc,
51
mn,
52
mn,
64
cu,
67
ga,
68
ga,
76
br,
77
br,
86
y,
89
zr,
94m
tc,
99m
tc,
111
in,
123
i,
124
i,
125
i,
152
tb,
155
tb,
177
lu,
201
tl,和
203
pb。
[0829]
实施方案219:根据实施方案218的化合物,其中所述诊断活性放射性核素选自
18
f、
68
ga、
99m
tc、
111
in和
203
pb。
[0830]
实施方案220:根据实施方案216的化合物,其中所述治疗活性核素是治疗活性放射性核素。
[0831]
实施方案221:根据实施方案220的化合物,其中所述治疗活性放射性核素选自以下组:
47
sc,
67
cu,
89
sr,
90
y,
131
i,
111
in,
153
sm,
149
tb,
161
tb,
177
lu,
186
re,
188
re,
211
at,
212
pb,
213
bi,
223
ra,
224
ra,
225
ac,
226
th,和
227
th。
[0832]
实施方案222:根据实施方案221的化合物,其中所述治疗活性放射性核素是
90
y、
177
lu、
212
pb和
225
ac。
[0833]
实施方案223:根据实施方案1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221和222中任一项的化合物,其中所述化合物与成纤维细胞活化蛋白(fap)相互作用,优选与具有seq id no:1的氨基酸序列或其同系物的人fap相互作用,其中所述同系物的氨基酸序列与seq id no:1的氨基酸序列具有至少85%的相同性。
[0834]
实施方案224:根据实施方案223的化合物,其中所述化合物是成纤维细胞活化蛋白(fap)的抑制剂。
[0835]
实施方案225:根据实施方案1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、
114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223和224中任一项的化合物,其中所述化合物对于seq id no:1的人fap的pic50值为≥6.0、优选≥7.0、最优选≥8.0。
[0836]
实施方案226:根据实施方案1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224和225中任一项的化合物,优选实施方案5-55、110-114、161-165和215-219中任一项的化合物,其是用于诊断疾病的方法中。
[0837]
实施方案227:根据实施方案226使用的化合物,其中所述疾病是涉及成纤维细胞活化蛋白(fap)、优选成纤维细胞活化蛋白(fap)表达上调的疾病。
[0838]
实施方案228:根据实施方案216、217、218、219、220、221、222、223、224、225、226和227中任一项使用的化合物,其中所述疾病涉及显示纤维细胞活化蛋白(fap)表达上调的细胞,优选含有显示成纤维细胞活化蛋白(fap)表达上调的细胞的病变组织,更优选涉及肿瘤相关成纤维细胞的疾病。
[0839]
实施方案229:根据实施方案226、227和228中任一项使用的化合物,其中所述疾病是瘤,优选癌症或肿瘤。
[0840]
实施方案230:根据实施方案229使用的化合物,其中所述瘤、癌症和肿瘤各自且独立地选自以下组中:实体瘤,上皮瘤,膀胱癌,乳腺癌,宫颈癌,结直肠癌,胆管癌,子宫内膜癌,食管癌,胃癌,胃肠道间质瘤,头颈癌,肝癌,肺癌,黑色素瘤,间皮瘤,神经内分泌肿瘤和癌,卵巢癌,胰腺癌,前列腺癌,肾细胞癌,涎腺癌,肉瘤,鳞状细胞癌和甲状腺癌。
[0841]
实施方案231:根据实施方案230使用的化合物,其中所述瘤、癌症和肿瘤各自且独立地选自以下组中:乳腺癌,结直肠癌,胆管癌,头颈癌,肺癌,间皮瘤,神经内分泌肿瘤和癌,卵巢癌,胰腺癌,前列腺癌,肉瘤和鳞状细胞癌。
[0842]
实施方案232:根据实施方案226、227和228中任一项使用的化合物,其中所述疾病选自炎性疾病、心血管疾病、自身免疫性疾病和纤维化疾病的组。
[0843]
实施方案233:根据实施方案232使用的化合物,其中所述疾病是炎性疾病。
[0844]
实施方案234:根据实施方案233使用的化合物,其中所述疾病是动脉粥样硬化、关
节炎或类风湿性关节炎。
[0845]
实施方案235:根据实施方案232使用的化合物,其中所述疾病是心血管疾病。
[0846]
实施方案236:根据实施方案235使用的化合物,其中所述疾病是涉及动脉粥样硬化斑块的心血管疾病。
[0847]
实施方案237:根据实施方案236使用的化合物,其中所述疾病是由于斑块破裂、急性冠脉综合征、心肌梗塞、血栓形成或血管闭塞所致的动脉粥样硬化病变。
[0848]
实施方案238:根据实施方案232使用的化合物,其中所述疾病是纤维化疾病。
[0849]
实施方案239:根据实施方案238使用的化合物,其中所述疾病选自特发性肺纤维化、克罗恩病和肝纤维化。
[0850]
实施方案240:根据实施方案226、227、228、229、230、231、232、233、234、235、236、237、238和239中任一项使用的化合物,其中所述化合物包含诊断活性核素,优选诊断活性的放射性核素。
[0851]
实施方案241:根据实施方案240使用的化合物,其中所述诊断活性核素选自以下组:
18
f,
43
sc,
44
sc,
51
mn,
52
mn,
64
cu,
67
ga,
68
ga,
76
br,
77
br,
86
y,
89
zr,
94m
tc,
99m
tc,
111
in,
123
i,
124
i,
125
i,
152
tb,
155
tb,
177
lu,
201
tl,and 203
pb,优选
18
f,
68
ga,
99m
tc,
111
in,和
203
pb。
[0852]
实施方案242:根据实施方案226、227、228、229、230、231、232、233、234、235、236、237、238、239、240和241中任一项使用的化合物,其中用于诊断的方法是成像方法。
[0853]
实施方案243:根据实施方案242使用的化合物,其中所述成像方法选自闪烁成像、单光子发射计算机断层显像(spect)和正电子发射断层显像(pet)。
[0854]
实施方案244:根据实施方案226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242和243中任一项使用的化合物,其中所述方法包括向个体、优选哺乳动物施用诊断有效量的所述化合物,其中所述哺乳动物选自人、伴侣动物、宠物和家畜,更优选所述个体选自人、狗、猫、马和牛,最优选所述个体是人。
[0855]
实施方案245:实施方案1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224and 225中任一项的化合物,优选实施方案51、52、56-58、110、111、115-117、161、162、166-168、215、216和220-222中任一项的化合物,其是用于治疗疾病的方法中。
[0856]
实施方案246:根据实施方案245使用的化合物,其中所述疾病是涉及成纤维细胞活化蛋白(fap)、优选成纤维细胞活化蛋白(fap)表达上调的疾病。
[0857]
实施方案247:根据实施方案245至246中任一项使用的化合物,其中所述疾病涉及
显示成纤维细胞活化蛋白(fap)表达上调的细胞,优选含有显示成纤维细胞活化蛋白(fap)表达上调的细胞的病变组织,更优选涉及肿瘤相关成纤维细胞的疾病。
[0858]
实施方案248:根据实施方案245、246和247中任一项使用的化合物,其中所述疾病是瘤,优选癌症或肿瘤。
[0859]
实施方案249:根据实施方案248使用的化合物,其中所述瘤、癌症和肿瘤各自且独立地选自实体瘤、上皮瘤、膀胱癌、乳腺癌、宫颈癌、结直肠癌、胆管癌、子宫内膜癌、食管癌、胃癌、胃肠道间质瘤、头颈癌、肝癌、肺癌、黑色素瘤、间皮瘤、神经内分泌肿瘤和癌、卵巢癌、胰腺癌、前列腺癌、肾细胞癌、涎腺癌、肉瘤、鳞状细胞癌和甲状腺癌。
[0860]
实施方案250:根据实施方案249使用的化合物,其中所述瘤、癌症和肿瘤各自且独立地选自乳腺癌、结直肠癌、胆管癌、头颈癌、肺癌、间皮瘤、神经内分泌肿瘤和癌、卵巢癌、胰腺癌、前列腺癌、肉瘤和鳞状细胞癌。
[0861]
实施方案251:根据实施方案245、246和247中任一项使用的化合物,其中所述疾病选自炎症性疾病、心血管疾病、自身免疫疾病和纤维化疾病。
[0862]
实施方案252:根据实施方案251使用的化合物,其中所述疾病是炎性疾病。
[0863]
实施方案253:根据实施方案252使用的化合物,其中所述疾病是动脉粥样硬化、关节炎或类风湿性关节炎。
[0864]
实施方案254:根据实施方案251使用的化合物,其中所述疾病是心血管疾病。
[0865]
实施方案255:根据实施方案254使用的化合物,其中所述疾病是涉及动脉粥样硬化斑块的心血管疾病。
[0866]
实施方案256:根据实施方案255使用的化合物,其中所述疾病是由斑块破裂、急性冠脉综合征、心肌梗塞、血栓形成或血管闭塞引起的动脉粥样硬化病变。
[0867]
实施方案257:根据实施方案251使用的化合物,其中所述疾病是纤维化疾病。
[0868]
实施方案258:根据实施方案257使用的化合物,其中所述疾病选自特发性肺纤维化、克罗恩病和肝纤维化。
[0869]
实施方案259:根据实施方案245、246、247和248中任一项使用的化合物,其中所述化合物包含治疗活性核素,优选治疗活性放射性核素。
[0870]
实施方案260:根据实施方案259使用的化合物,其中所述治疗活性核素选自以下组:
47
sc,
67
cu,
89
sr,
90
y,
131
i,
111
in,
153
sm,
149
tb,
161
tb,
177
lu,
186
re,
188
re,
211
at,
212
pb,
213
bi,
223
ra,
224
ra,
225
ac,
226
th,和
227
th,优选
90
y、
177
lu、
212
pb和
225
ac。
[0871]
实施方案261:根据实施方案245、246、247、248、249、250、251、252、253、254、255、256、257、258、259和260中任一项使用的化合物,其中所述方法包括向个体、优选哺乳动物施用治疗有效量的所述化合物,其中所述哺乳动物选自人、伴侣动物、宠物和家畜,更优选所述个体选自人、狗、猫、马和牛,最优选所述个体是人。
[0872]
实施方案262:根据实施方案1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、
133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224和225中任一项的化合物,其是用于鉴定个体的方法中,其中所述个体对疾病的治疗可能有反应或可能无反应,其中所述用于鉴定个体的方法包括使用实施方案中任一项的化合物进行诊断方法,优选实施方案226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243和244中任一项中所述的疾病诊断方法。
[0873]
实施方案263:根据实施方案1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224和225中任一项的化合物,其是用于从一组个体中选择个体的方法中,其中所述个体对疾病治疗可能有反应或可能没有反应,其中用于从一组个体中选择个体的方法包括使用实施方案1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224和225中任一项的化合物进行诊断方法,优选是实施方案226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243和244中任一项所述的疾病诊断方法。
[0874]
实施方案264:根据实施方案1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、
94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224和225中任一项的化合物,其是用于将一组个体分层为对疾病的治疗可能有反应和对疾病的治疗可能无反应的个体的方法中,其中所述分层一组个体的方法包括使用实施方案1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224和225中任一项的化合物进行诊断方法,优选实施方案226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243和244中任一项所述的疾病诊断方法。
[0875]
实施方案265:根据实施方案262、263和264中任一项使用的化合物,其中所述疾病是涉及成纤维细胞活化蛋白(fap)、优选成纤维细胞活化蛋白(fap)表达上调的疾病。
[0876]
实施方案266:根据实施方案262、263、264和265中任一项使用的化合物,其中所述疾病涉及显示成纤维细胞活化蛋白(fap)表达上调的细胞,优选含有显示成纤维细胞活化蛋白(fap)表达上调的细胞的病变组织,更优选涉及肿瘤相关成纤维细胞的疾病。
[0877]
实施方案267:根据实施方案262、263、264、265和266中任一项使用的化合物,其中所述疾病是瘤,优选癌症或肿瘤。
[0878]
实施方案268:根据实施方案267使用的化合物,其中所述瘤、癌症或肿瘤各自且独立地选自实体瘤、上皮瘤、膀胱癌、乳腺癌、宫颈癌、结直肠癌、胆管癌、子宫内膜癌、食管癌、胃癌、胃肠道间质瘤、头颈癌、肝癌、肺癌、黑色素瘤、间皮瘤、神经内分泌肿瘤和癌、卵巢癌、胰腺癌、前列腺癌、肾细胞癌、涎腺癌、肉瘤、鳞状细胞癌和甲状腺癌。
[0879]
实施方案269:根据实施方案268使用的化合物,其中所述瘤、癌症和肿瘤各自且独立地选自乳腺癌、结直肠癌、胆管癌、头颈癌、肺癌、间皮瘤、神经内分泌肿瘤和癌、卵巢癌、胰腺癌、前列腺癌、肉瘤和鳞状细胞癌。
[0880]
实施方案270:根据实施方案262、263、264、265和266中任一项使用的化合物,其中所述疾病选自炎性疾病、心血管疾病、自身免疫性疾病和纤维化疾病。
[0881]
实施方案271:根据实施方案270使用的化合物,其中所述疾病是炎性疾病。
[0882]
实施方案272:根据实施方案271使用的化合物,其中所述疾病是动脉粥样硬化、关节炎或类风湿性关节炎。
[0883]
实施方案273:根据实施方案272使用的化合物,其中所述疾病是心血管疾病。
[0884]
实施方案274:根据实施方案273使用的化合物,其中所述疾病是涉及动脉粥样硬化斑块的心血管疾病。
[0885]
实施方案275:根据实施方案274使用的化合物,其中所述疾病是由斑块破裂、急性冠脉综合征、心肌梗塞、血栓形成或血管闭塞引起的动脉粥样硬化病变。
[0886]
实施方案276:根据实施方案270使用的化合物,其中所述疾病是纤维化疾病。
[0887]
实施方案277:根据实施方案276使用的化合物,其中所述疾病选自特发性肺纤维化、克罗恩病和肝纤维化。
[0888]
实施方案278:根据实施方案262、263、264、265、266、267、268、269、270、271、272、273、274、275、276和277中任一项使用的化合物,其中所述诊断方法是成像方法。
[0889]
实施方案279:根据实施方案278使用的化合物,其中所述成像方法选自闪烁成像、单光子发射计算机断层显像(spect)和正电子发射断层显像(pet)。
[0890]
实施方案280:根据实施方案262、263、264、265、266、267、268、269、270、271、272、273、274、275、276、277、278和279中任一项使用的化合物,其中所述化合物包含诊断活性核素,优选诊断活性放射性核素。
[0891]
实施方案281:根据实施方案280使用的化合物,其中所述诊断活性核素选自以下组:
18
f,
43
sc,
44
sc,
51
mn,
52
mn,
64
cu,
67
ga,
68
ga,
76
br,
77
br,
86
y,
89
zr,
94m
tc,
99m
tc,
111
in,
123
i,
124
i,
125
i,
152
tb,
155
tb,
177
lu,
201
tl,和
203
pb,优选
18
f、
68
ga、
99m
tc、
111
in和
203
pb。
[0892]
实施方案282:根据实施方案1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224和225中任一项的化合物,其是用于将效应物递送至成纤维细胞活化蛋白(fap)、优选人成纤维细胞活化蛋白(fap)的方法中,其中所述效应物选自诊断活性剂和治疗活性剂。
[0893]
实施方案283:根据实施方案282使用的化合物,其中所述效应物选自诊断活性核素和治疗活性核素。
[0894]
实施方案284:根据实施方案283使用的化合物,其中所述诊断活性核素是诊断活性放射性核素。
[0895]
实施方案285:根据实施方案284使用的化合物,其中所述诊断活性放射性核素选自以下组:
18
f,
43
sc,
44
sc,
51
mn,
52
mn,
64
cu,
67
ga,
68
ga,
76
br,
77
br,
86
y,
89
zr,
94m
tc,
99m
tc,
111
in,
123
i,
124
i,
125
i,
152
tb,
155
tb,
177
lu,
201
tl,和
203
pb,优选
18
f、
68
ga、
99m
tc、
111
in和
203
pb。
[0896]
实施方案286:根据实施方案282、283、284和285中任一项使用的化合物,其中所述成纤维细胞活化蛋白(fap)由细胞表达,优选由成纤维细胞、间充质干细胞、平滑肌细胞、上皮来源的细胞、或内皮细胞表达,更优选由人成纤维细胞、间充质干细胞、平滑肌细胞、上皮来源的细胞、或内皮细胞表达,最优选由显示成纤维细胞活化蛋白(fap)表达上调的人成纤维细胞、间充质干细胞、平滑肌细胞、上皮来源的细胞、或内皮细胞表达。
[0897]
实施方案287:根据实施方案286使用的化合物,其中所述细胞包含于组织中或者是组织的一部分,所述组织优选是患病个体的病变组织。
[0898]
实施方案288:根据实施方案287使用的化合物,其中所述疾病涉及显示成纤维细胞活化蛋白(fap)表达上调的细胞,优选含有显示成纤维细胞活化蛋白(fap)表达上调的细胞的病变组织,更优选涉及肿瘤相关成纤维细胞的疾病。
[0899]
实施方案289:根据实施方案287至288中任一项施用的化合物,其中所述疾病是瘤,优选癌症或肿瘤。
[0900]
实施方案290:根据实施方案289使用的化合物,其中所述瘤、癌症和肿瘤各自且独立地选自实体瘤、上皮瘤、膀胱癌、乳腺癌、宫颈癌、结直肠癌、胆管癌、子宫内膜癌、食管癌、胃癌、胃肠道间质瘤、头颈癌、肝癌、肺癌、黑色素瘤、间皮瘤、神经内分泌肿瘤和癌、卵巢癌、胰腺癌、前列腺癌、肾细胞癌、涎腺癌、肉瘤、鳞状细胞癌和甲状腺癌。
[0901]
实施方案291:根据实施方案290使用的化合物,其中所述瘤、癌症和肿瘤各自且独立地选自乳腺癌、结直肠癌、胆管癌、头颈癌、肺癌、间皮瘤、神经内分泌肿瘤和癌、卵巢癌、胰腺癌、前列腺癌、肉瘤和鳞状细胞癌。
[0902]
实施方案292:根据实施方案287至288中任一项使用的化合物,其中所述疾病选自炎性疾病、心血管疾病、自身免疫性疾病和纤维化疾病。
[0903]
实施方案293:根据实施方案292使用的化合物,其中所述疾病是炎性疾病。
[0904]
实施方案294:根据实施方案293使用的化合物,其中所述疾病是动脉粥样硬化、关节炎或类风湿性关节炎。
[0905]
实施方案295:根据实施方案292使用的化合物,其中所述疾病是心血管疾病。
[0906]
实施方案296:根据实施方案295使用的化合物,其中所述疾病是涉及动脉粥样硬化斑块的心血管疾病。
[0907]
实施方案297:根据实施方案296使用的化合物,其中所述疾病是由斑块破裂、急性冠状动脉综合征、心肌梗塞、血栓形成或血管闭塞引起的动脉粥样硬化病变。
[0908]
实施方案298:根据实施方案292使用的化合物,其中所述疾病是纤维化疾病。
[0909]
实施方案299:根据实施方案298使用的化合物,其中所述疾病选自特发性肺纤维化、克罗恩病和肝纤维化。
[0910]
实施方案300:根据实施方案283使用的化合物,其中所述治疗活性核素是治疗活性放射性核素。
[0911]
实施方案301:根据实施方案300使用的化合物,其中所述治疗活性放射性核素选自以下组:
47
sc,
67
cu,
89
sr,
90
y,
131
i,
111
in,
153
sm,
149
tb,
161
tb,
177
lu,
186
re,
188
re,
211
at,
212
pb,
213
bi,
223
ra,
224
ra,
225
ac,
226
th,and 227
th,优选
90
y、
177
lu、
212
pb和
225
ac。
[0912]
实施方案302:根据实施方案300至301中任一项使用的化合物,其中所述成纤维细
胞活化蛋白(fap)由细胞表达,优选由成纤维细胞、间充质干细胞、平滑肌细胞、上皮来源的细胞、或内皮细胞表达,更优选由人成纤维细胞、间充质干细胞、平滑肌细胞、上皮来源的细胞、或内皮细胞表达,最优选由示出成纤维细胞活化蛋白(fap)表达上调的人成纤维细胞、间充质干细胞、平滑肌细胞、上皮来源的细胞、或内皮细胞表达。
[0913]
实施方案303:根据实施方案302使用的化合物,其中所述细胞包含于组织中或者是组织的一部分,所述组织优选是患病个体的病变组织。
[0914]
实施方案304:根据实施方案303使用的化合物,其中所述疾病涉及显示成纤维细胞活化蛋白(fap)表达上调的细胞,优选含有显示成纤维细胞活化蛋白(fap)表达上调的细胞的病变组织,更优选涉及肿瘤相关成纤维细胞的疾病。
[0915]
实施方案305:根据实施方案302、303和304中任一项使用的化合物,其中所述疾病是瘤,优选癌症或肿瘤。
[0916]
实施方案306:根据实施方案305使用的化合物,其中所述瘤、癌症和肿瘤各自且独立地选自实体瘤、上皮瘤、膀胱癌、乳腺癌、宫颈癌、结直肠癌、胆管癌、子宫内膜癌、食管癌、胃癌、胃肠道间质瘤、头颈癌、肝癌、肺癌、黑色素瘤、间皮瘤、神经内分泌肿瘤和癌、卵巢癌、胰腺癌、前列腺癌、肾细胞癌、涎腺癌、肉瘤、鳞状细胞癌和甲状腺癌。
[0917]
实施方案307:组合物,优选药物组合物,其中所述组合物包含根据实施方案1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224和225中任一项的化合物及药物可接受赋形剂。
[0918]
实施方案308:根据实施方案307的组合物,其是用于前述权利要求中任一项所定义的任何方法中。
[0919]
实施方案309:用于诊断个体疾病的方法,其中所述方法包括向个体施用诊断有效量的根据实施方案1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、187、188、189、190、191、192、193、194、
195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224和225中任一项的化合物。
[0920]
实施方案310:根据实施方案309的方法,其中所述化合物包含诊断活性剂,其中所述诊断活性剂优选是放射性核素。
[0921]
实施方案311:用于治疗个体疾病的方法,其中所述方法包括向个体施用治疗有效量的实施方案1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224和225中任一项的化合物。
[0922]
实施方案312:根据实施方案311的方法,其中所述化合物包含治疗活性剂,其中所述治疗活性剂优选是放射性核素。
[0923]
实施方案313:根据实施方案309、310、311和312中任一项的方法,其中所述疾病是涉及成纤维细胞活化蛋白(fap)、优选成纤维细胞活化蛋白(fap)表达上调的疾病。
[0924]
实施方案314:根据实施方案309、310、311、312和313中任一项的方法,其中所述疾病涉及显示纤维细胞活化蛋白(fap)表达上调的细胞,优选含有显示成纤维细胞活化蛋白(fap)表达上调的细胞的病变组织,更优选涉及肿瘤相关成纤维细胞的疾病。
[0925]
实施方案315:根据实施方案309、310、311、312、313和314中任一项的方法,其中所述疾病选自瘤,优选癌症或肿瘤,以及炎症性疾病、心血管疾病、自身免疫疾病和纤维化疾病。
[0926]
实施方案316:药剂盒,其包含根据实施方案1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224和225中任一项的化合物、一种或多种任选的赋形剂和任选存在的一种或多种装置,其中所述装置选自标记装置、纯化装置、操作装置、放射防护装置、分析装置或施用装置。
[0927]
实施方案317:根据实施方案316的药剂盒,其用于前述权利要求中任一项所定义的任何方法中。
[0928]
更具体地,本发明所基于的问题在第一方面通过一种化合物得以解决,所述化合物包含式(i)的环状肽和连接于xaa1的n末端修饰基团a,
[0929][0930]
其中:
[0931]
所述肽序列是从左至右以n末端至c末端方向绘制的,
[0932]
xaa1是式(ii)的氨基酸残基,
[0933][0934]
其中:
[0935]r1a
是-nh-,
[0936]r1b
是h或ch3,
[0937]
n=0或1,
[0938]
所述n末端修饰基团a共价连接于xaa1的氮原子,
[0939]
xaa1的羰基共价连接于xaa2的氮,
[0940]
并且xaa1的硫原子作为硫醚共价连接于yc;
[0941]
xaa2是式(iii)、(iv)或(xx)的氨基酸残基,
[0942][0943]
其中:
[0944]r2a
、r
2b
和r
2c
各自且独立地选自(c
1-c2)烷基和h,其中所述(c
1-c2)烷基可以由选自oh、nh2、卤素、(c
5-c7)环烷基的取代基取代,
[0945]
p=0、1或2
[0946]
v=1或2
[0947]
w=1、2或3,以及
[0948]
所述式(iv)的氨基酸在所示的环位置3和4可以由选自甲基、oh、nh2和f的一个或两个取代基取代;
[0949]
xaa3是式(v)或(xx)的氨基酸残基,
[0950]
[0951]
其中:
[0952]
x3选自ch2、cf2、ch-r
3b
、s、o和nh,
[0953]
p=1或2
[0954]
v=1或2
[0955]
w=1、2或3,
[0956]r3a
是h、甲基、oh、nh2或f,
[0957]r3b
是甲基、oh、nh2或f;
[0958]
xaa4是式(vi)的氨基酸残基,
[0959][0960]
其中:
[0961]r4a
选自h、oh、cooh、conh2、x4和-nh-co-x4,其中x4选自(c
1-c6)烷基、(c
5-c6)芳基和(c
5-c6)杂芳基,并且x4可以由选自甲基、conh2、卤素、nh2和oh的一个或两个取代基取代;
[0962]
q=1、2或3,其中任选地,所述1个、2个或3个ch2基团的一个或两个氢各自且独立地由甲基、乙基、(c
5-c6)芳基或(c
5-c6)杂芳基取代,
[0963]r4b
是甲基或h;
[0964]
xaa5是结构(vii)的氨基酸残基,
[0965][0966]
其中:
[0967]
r5选自oh和nh2,以及
[0968]
r=1、2或3;
[0969]
xaa6是选自芳族l-α-氨基酸和杂芳族l-α-氨基酸的氨基酸;
[0970]
xaa7是式(ix)的氨基硫醇或氨基酸残基,
[0971][0972]
其中:
[0973]r7a
是
–
co-、-cooh、-conh2、-ch
2-oh、-(co)-nh-r
7b
、-(co)-(nr
7c
)-r
7b
或h,其中r
7b
和r
7c
各自且独立地是(c
1-c4)烷基,以及
[0974]
t是1或2;
[0975]
yc是式(x)的结构,
[0976]
[0977]
其在形成两个硫醚键的情况下连接xaa1的s原子和xaa7的s原子,由此形成式(xxi)的环状结构,
[0978][0979]
其中:
[0980]
式(x)中芳族基团的取代模式是邻位、间位或对位,
[0981]
n=0或1,
[0982]
t=1或2,
[0983]
y1是c-h或n,
[0984]
y2是n或c-r
c1
,
[0985]rc1
是h或ch
2-r
c2
,以及
[0986]rc2
是式(xi)、(xii)或(xxii)的结构,
[0987][0988]
其中:
[0989]rc3
和r
c4
各自且独立地选自h和(c
1-c4)烷基,以及
[0990]
u=1、2、3、4、5或6,
[0991]
x和y各自且独立地是1、2或3,以及
[0992]
x=o或s,
[0993]
其中在式(xi)和(xxii)中,氮原子之一连接于r
c1
的-ch
2-,以及在式(xii)中,-x-连接于r
c1
的-ch
2-;以及
[0994]
其中所述n末端修饰基团a是保护基abl,其中保护基abl是r
a1-nh-c(o)-;其中r
a1
选自c3烷基、c4烷基或c5烷基,各自且独立地任选被至多两个取代基取代,所述取代基各自且独立地选自oh、f、cooh、(c
3-c8)环烷基、芳基、杂芳基和(c
3-c8)杂环,并且其中在(c
1-c8)烷基中,一个-ch
2-基团任选被-s-或-o-置换。
[0995]
更具体地,本发明所基于的问题在第二方面通过一种化合物得以解决,所述化合物包含式(i)的环状肽和连接于xaa1的n末端修饰基团a,
[0996][0997]
其中:
[0998]
所述肽序列是从左至右以n末端至c末端方向绘制的,
[0999]
xaa1是式(ii)的氨基酸残基,
[1000][1001]
其中:
[1002]r1a
是-nh-,
[1003]r1b
是h或ch3,
[1004]
n=0或1,
[1005]
所述n末端修饰基团a共价连接于xaa1的氮原子,
[1006]
xaa1的羰基共价连接于xaa2的氮,
[1007]
并且xaa1的硫原子作为硫醚共价连接于yc;
[1008]
xaa2是式(iii)、(iv)或(xx)的氨基酸残基,
[1009][1010]
其中:
[1011]r2a
、r
2b
和r
2c
各自且独立地选自(c
1-c2)烷基和h,其中所述(c
1-c2)烷基可以由选自oh、nh2、卤素、(c
5-c7)环烷基的取代基取代,
[1012]
p=0、1或2
[1013]
v=1或2
[1014]
w=1、2或3,以及
[1015]
所述式(iv)的氨基酸在所示的环位置3和4可以由选自甲基、oh、nh2和f的一个或两个取代基取代;
[1016]
xaa3是式(v)或(xx)的氨基酸残基,
[1017][1018]
其中:
[1019]
x3选自ch2、cf2、ch-r
3b
、s、o和nh,
[1020]
p=1或2
[1021]
v=1或2
[1022]
w=1、2或3,
[1023]r3a
是h、甲基、oh、nh2或f,
[1024]r3b
是甲基、oh、nh2或f;
[1025]
xaa4是式(vi)的氨基酸残基,
[1026][1027]
其中:
[1028]r4a
选自h、oh、cooh、conh2、x4和-nh-co-x4,其中x4选自(c
1-c6)烷基、(c
5-c6)芳基和(c
5-c6)杂芳基,并且x4可以由选自甲基、conh2、卤素、nh2和oh的一个或两个取代基取代;
[1029]
q=1、2或3,其中任选地,所述1个、2个或3个ch2基团的一个或两个氢各自且独立地由甲基、乙基、(c
5-c6)芳基或(c
5-c6)杂芳基取代,
[1030]r4b
是甲基或h;
[1031]
xaa5是结构(vii)的氨基酸残基,
[1032][1033]
其中:
[1034]
r5选自oh和nh2,以及
[1035]
r=1、2或3;
[1036]
xaa6是选自芳族l-α-氨基酸和杂芳族l-α-氨基酸的氨基酸;
[1037]
xaa7是式(ix)的氨基硫醇或氨基酸残基,
[1038][1039]
其中:
[1040]r7a
是
–
co-、-cooh、-conh2、-ch
2-oh、-(co)-nh-r
7b
、-(co)-(nr
7c
)-r
7b
或h,其中r
7b
和r
7c
各自且独立地是(c
1-c4)烷基,以及
[1041]
t是1或2;
[1042]
yc是式(x)的结构,
[1043][1044]
其在形成两个硫醚键的情况下连接xaa1的s原子和xaa7的s原子,由此形成式(xxi)的环状结构,
[1045]
[1046]
其中:
[1047]
式(x)中芳族基团的取代模式是邻位、间位或对位,优选间位,
[1048]
n=0或1,
[1049]
t=1或2,
[1050]
y1是c-h,
[1051]
y2是c-r
c1
,
[1052]rc1
是ch
2-r
c2
或h,以及
[1053]rc2
是式(xiid)或(xxiic)的结构,
[1054][1055]
其中:
[1056]
u=1,
[1057]rc4
是h,
[1058]
z是任选包含接头的螯合剂;及
[1059]
其中所述n末端修饰基团a是保护基abl,其中保护基abl是r
a1-nh-c(o)-;其中r
a1
是任选被至多两个取代基取代的(c
1-c8)烷基,所述取代基各自且独立地选自oh、f、cooh、(c
3-c8)环烷基、芳基、杂芳基和(c
3-c8)杂环,并且其中在(c
1-c8)烷基中,一个-ch
2-基团任选被-s-或-o-置换。
[1060]
更具体地,本发明所基于的问题在第三方面通过一种化合物得以解决,所述化合物包含式(i)的环状肽和连接于xaa1的n末端修饰基团a,
[1061][1062]
其中:
[1063]
所述肽序列是从左至右以n末端至c末端方向绘制的,
[1064]
xaa1是式(ii)的氨基酸残基,
[1065][1066]
其中:
[1067]r1a
是-nh-,
[1068]r1b
是h或ch3,
[1069]
n=0或1,
[1070]
所述n末端修饰基团a共价连接于xaa1的氮原子,
[1071]
xaa1的羰基共价连接于xaa2的氮,
[1072]
并且xaa1的硫原子作为硫醚共价连接于yc;
[1073]
xaa2是式(iii)、(iv)或(xx)的氨基酸残基,
[1074][1075]
其中:
[1076]r2a
、r
2b
和r
2c
各自且独立地选自(c
1-c2)烷基和h,其中所述(c
1-c2)烷基可以由选自oh、nh2、卤素、(c
5-c7)环烷基的取代基取代,
[1077]
p=0、1或2
[1078]
v=1或2
[1079]
w=1、2或3,以及
[1080]
所述式(iv)的氨基酸在所示的环位置3和4可以由选自甲基、oh、nh2和f的一个或两个取代基取代;
[1081]
xaa3是式(v)或(xx)的氨基酸残基,
[1082][1083]
其中:
[1084]
x3选自ch2、cf2、ch-r
3b
、s、o和nh,
[1085]
p=1或2
[1086]
v=1或2
[1087]
w=1、2或3,
[1088]r3a
是h、甲基、oh、nh2或f,
[1089]r3b
是甲基、oh、nh2或f;
[1090]
xaa4是式(vi)的氨基酸残基,
[1091][1092]
其中:
[1093]r4a
选自h、oh、cooh、conh2、x4和-nh-co-x4,其中x4选自(c
1-c6)烷基、(c
5-c6)芳基和(c
5-c6)杂芳基,并且x4可以由选自甲基、conh2、卤素、nh2和oh的一个或两个取代基取代;
[1094]
q=1、2或3,其中任选地,所述1个、2个或3个ch2基团的一个或两个氢各自且独立地由甲基、乙基、(c
5-c6)芳基或(c
5-c6)杂芳基取代,
[1095]r4b
是甲基或h;
[1096]
xaa5是结构(vii)的氨基酸残基,
[1097]
ch
2-基团被-s-或-o-置换,
[1123]
所述氨基酸aaa共价连接至接头,其中所述接头共价连接至螯合剂z,其中所述接头(a)由第一接头或(b)由第一接头和第二接头组成,其中:
[1124]
如果所述接头由第一接头组成,则第一接头与所述螯合剂和氨基酸aaa共价连接,并且
[1125]
如果所述接头由第一接头和第二接头组成,则所述第一接头共价连接至氨基酸aaa和第二接头,并且第二接头共价连接至所述螯合剂,
[1126]
所述第一接头选自ttds和peg6,优选第一接头是ttds,
[1127]
所述第二接头选自ppac和peg6,优选第二接头是ppac。
[1128]
更具体地,本发明所基于的问题在第四方面通过一种化合物得以解决,所述化合物包含式(i)的环状肽和连接于xaa1的n末端修饰基团a,
[1129][1130]
其中:
[1131]
所述肽序列是从左至右以n末端至c末端方向绘制的,
[1132]
xaa1是式(ii)的氨基酸残基,
[1133][1134]
其中:
[1135]r1a
是-nh-,
[1136]r1b
是h或ch3,
[1137]
n=0或1,
[1138]
所述n末端修饰基团a共价连接于xaa1的氮原子,
[1139]
xaa1的羰基共价连接于xaa2的氮,
[1140]
并且xaa1的硫原子作为硫醚共价连接于yc;
[1141]
xaa2是式(iii)、(iv)或(xx)的氨基酸残基,
[1142][1143]
其中:
[1144]r2a
、r
2b
和r
2c
各自且独立地选自(c
1-c2)烷基和h,其中所述(c
1-c2)烷基可以由选自oh、nh2、卤素、(c
5-c7)环烷基的取代基取代,
[1145]
p=0、1或2
[1146]
v=1或2
[1147]
w=1、2或3,以及
[1148]
所述式(iv)的氨基酸在所示的环位置3和4处可以由选自甲基、oh、nh2和f的一个或两个取代基取代;
[1149]
xaa3是式(v)或(xx)的氨基酸残基,
[1150][1151]
其中:
[1152]
x3选自ch2、cf2、ch-r
3b
、s、o和nh,
[1153]
p=1或2
[1154]
v=1或2
[1155]
w=1、2或3,
[1156]r3a
是h、甲基、oh、nh2或f,
[1157]r3b
是甲基、oh、nh2或f;
[1158]
xaa4是式(vi)的氨基酸残基,
[1159][1160]
其中:
[1161]r4a
选自h、oh、cooh、conh2、x4和
–
nh-co-x4,其中x4选自(c
1-c6)烷基、(c
5-c6)芳基和(c
5-c6)杂芳基,并且x4可以由选自甲基、conh2、卤素、nh2和oh的一个或两个取代基取代;
[1162]
q=1、2或3,其中任选地,所述1个、2个或3个ch2基团的一个或两个氢各自且独立地由甲基、乙基、(c
5-c6)芳基或(c
5-c6)杂芳基取代,
[1163]r4b
是甲基或h;
[1164]
xaa5是结构(vii)的氨基酸残基,
[1165][1166]
其中:
[1167]
r5选自oh和nh2,以及
[1168]
r=1、2或3;
[1169]
xaa6是选自芳族l-α-氨基酸和杂芳族l-α-氨基酸的氨基酸;
[1170]
xaa7是式(ix)的氨基硫醇或氨基酸残基,
[1171][1172]
其中:
[1173]r7a
是
–
co-、-cooh、-conh2、-ch
2-oh、-(co)-nh-r
7b
、-(co)-(nr
7c
)-r
7b
或h,其中r
7b
和r7c
各自且独立地是(c
1-c4)烷基,以及
[1174]
t是1或2;
[1175]
yc是式(x)的结构,
[1176][1177]
其在形成两个硫醚键的情况下连接xaa1的s原子和xaa7的s原子,由此形成式(xxi)的环状结构,
[1178][1179]
其中:
[1180]
式(x)中芳族基团的取代模式是间位,
[1181]
n=0或1,
[1182]
t=1或2,
[1183]
y1是c-h,
[1184]
y2是c-r
c1
,
[1185]rc1
是ch
2-r
c2
,以及
[1186]rc2
是式(xiid)的结构,
[1187][1188]
其中:
[1189]
u=1、2、3、4、5或6,优选u=1,
[1190]rc4
是h或甲基,
[1191]
z是任选包含接头的螯合剂,以及
[1192]
其中所述n末端修饰基团a是保护基abl,其中保护基abl选自r
a11-c(o)-,其中r
a11
是c4烷基或c5烷基,其中各自且独立地,c4烷基和c5烷基之每个和任一个之中,-ch
2-基团之一任选被-o-或-s-置换。
[1193]
更具体地,本发明所基于的问题在第五方面通过根据第一方面、第二方面、第三方面和第四方面、包括其任何实施方案的化合物在用于诊断疾病的方法中而得以解决。
[1194]
更具体地,本发明所基于的问题在第六方面通过根据第一方面、第二方面、第三方面和第四方面、包括其任何实施方案的化合物在用于治疗疾病的方法中而得以解决。
[1195]
更具体地,本发明所基于的问题在第七方面通过根据第一方面、第二方面、第三方面和第四方面、包括其任何实施方案的化合物在用于鉴定个体的方法中而得以解决,其中
所述个体对于疾病的治疗可能有反应或可能没有反应,其中所述鉴定个体的方法包括使用根据第一方面、第二方面、第三方面和第四方面、包括其任何实施方案的化合物进行诊断方法。
[1196]
更具体地,本发明所基于的问题在第八方面通过根据第一方面、第二方面、第三方面和第四方面、包括其任何实施方案的化合物在用于从一组个体选择个体的方法中而得以解决,其中所述个体对于疾病的治疗可能有反应或可能无反应,其中所述从一组个体选择个体的方法包括使用根据第一方面、第二方面、第三方面和第四方面、包括任何实施方案的化合物进行诊断方法。
[1197]
更具体地,本发明所基于的问题在第九方面通过根据第一方面、第二方面、第三方面和第四方面、包括其任何实施方案的化合物在用于将一组个体分层为对于疾病的治疗可能有反应的个体以及分层为对于疾病的治疗可能无反应的个体的方法中而得以解决,其中所述对一组个体进行分层的方法包括使用根据第一方面、第二方面、第三方面和第四方面、包括其任何实施方案的化合物进行诊断方法。
[1198]
更具体地,本发明所基于的问题在第十方面通过组合物、优选药物组合物而得以解决,其中所述组合物包含根据第一方面、第二方面、第三方面和第四方面、包括其任何实施方案的化合物以及药学上可接受的赋形剂。
[1199]
更具体地,本发明所基于的问题在第十一方面通过用于诊断个体的疾病的方法而得以解决,其中所述方法包括向所述个体施用诊断有效量的根据第一方面、第二方面、第三方面和第四方面、包括其任何实施方案的化合物。
[1200]
更具体地,本发明所基于的问题在第十二方面通过治疗个体的疾病的方法而得以解决,其中所述方法包括向所述个体施用治疗有效量的根据第一方面、第二方面、第三方面和第四方面、包括任何其实施方案的化合物。
[1201]
更具体地,本发明所基于的问题在第十三方面通过包含根据第一方面、第二方面、第三方面和第四方面、包括其任何实施方案的化合物、一种或多种任选的赋形剂和任选存在的一种或多种装置的药剂盒而得以解决,其中所述装置选自以下组:标记装置、纯化装置、操作装置、放射防护装置、分析装置或施用装置。
[1202]
本领域技术人员将认识到本发明的一种或所述化合物是本文公开的任何化合物,包括但不限于任何上述实施方案和任何以下实施方案中描述的任何化合物。
[1203]
本领域技术人员将认识到本发明的一种或所述方法是本文公开的任何方法,包括但不限于任何上述实施方案和任何以下实施方案中描述的任何方法。
[1204]
本领域技术人员将认识到本发明的一种或所述组合物是本文公开的任何组合物,包括但不限于任何上述实施方案和任何以下实施方案中描述的任何组合物。
[1205]
本领域技术人员将认识到本发明的一种或所述药剂盒是本文公开的任何试剂盒,包括但不限于任何上述实施方案和任何以下实施方案中描述的任何药剂盒。
[1206]
本领域技术人员将认识到对于本发明,本发明的任何方面的任何实施方案也可以是本发明的任何其它方面的实施方案,包括其任何实施方案。
[1207]
本发明是基于本发明人的惊人发现,即本发明的化合物、更特别是其环状肽提供包含这种环状肽的化合物与成纤维细胞活化蛋白(fap)的高度特异性结合,因为迄今为止还没有描述具有纳摩尔亲和性的基于fap特异性环状肽的抑制剂。
甲基-己基、3-甲基-己基、4-甲基-己基、5-甲基-己基、3-庚基、2-乙基-戊基、3-乙基-戊基、4-庚基、2-甲基-己-2-基、2,2-二甲基-戊基、3,3-二甲基-戊基、4,4-二甲基-戊基、3-甲基-己-2-基、4-甲基-己-2-基、5-甲基-己-2-基、2,3-二甲基-戊基、2,4-二甲基-戊基、3,4-二甲基-戊基、3-甲基-己-3-基、2-乙基-2-甲基-丁基、4-甲基-己-3-基、5-甲基-己-3-基、2-乙基-3-甲基-丁基、2,3-二甲基-戊-2-基、2,4-二甲基-戊-2-基、3,3-二甲基-戊-2-基、4,4-二甲基-戊-2-基、2,2,3-三甲基-丁基、2,3,3-三甲基-丁基、2,3,3-三甲基-丁-2-基、正辛基、2-辛基、2-甲基-庚基、3-甲基-庚基、4-甲基-庚基、5-甲基-庚基、6-甲基-庚基、3-辛基、2-乙基-己基、3-乙基-己基、4-乙基-己基、4-辛基、2-丙基-戊基、2-甲基-庚-2-基、2,2-二甲基-己基、3,3-二甲基-己基、4,4-二甲基-己基、5,5-二甲基-己基、3-甲基-庚-2-基、4-甲基-庚-2-基、5-甲基-庚-2-基、6-甲基-庚-2-基、2,3-二甲基-己-1-基、2,4-二甲基-己-1-基、2,5-二甲基-己-1-基、3,4-二甲基-己-1-基、3,5-二甲基-己-1-基、3,5-二甲基-己-1-基、3-甲基-庚-3-基、2-乙基-2-甲基-1-基、3-乙基-3-甲基-1-基、4-甲基-庚-3-基、5-甲基-庚-3-基、6-甲基-庚-3-基、2-乙基-3-甲基-戊基、2-乙基-4-甲基-戊基、3-乙基-4-甲基-戊基、2,3-二甲基-己-2-基、2,4-二甲基-己-2-基、2,5-二甲基-己-2-基、3,3-二甲基-己-2-基、3,4-二甲基-己-2-基、3,5-二甲基-己-2-基、4,4-二甲基-己-2-基、4,5-二甲基-己-2-基、5,5-二甲基-己-2-基、2,2,3-三甲基-戊基、2,2,4-三甲基-戊基、2,3,3-三甲基-戊基、2,3,4-三甲基-戊基、2,4,4-三甲基-戊基、3,3,4-三甲基-戊基、3,4,4-三甲基-戊基、2,3,3-三甲基-戊-2-基、2,3,4-三甲基-戊-2-基、2,4,4-三甲基-戊-2-基、3,4,4-三甲基-戊-2-基、2,2,3,3-四甲基-丁基、3,4-二甲基-己-3-基、3,5-二甲基-己-3-基、4,4-二甲基-己-3-基、4,5-二甲基-己-3-基、5,5-二甲基-己-3-基、3-乙基-3-甲基-戊-2-基、3-乙基-4-甲基-戊-2-基、3-乙基-己-3-基、2,2-二乙基-丁基、3-乙基-3-甲基-戊基、4-乙基-己-3-基、5-甲基-庚-3-基、2-乙基-3-甲基-戊基、4-甲基-庚-4-基、3-甲基-庚-4-基、2-甲基-庚-4-基、3-乙基-己-2-基、2-乙基-2-甲基-戊基、2-异丙基-戊基、2,2-二甲基-己-3-基、2,2,4-三甲基-戊-3-基和2-乙基-3-甲基-戊基。(c
1-c8)烷基可以是未取代的,或者由一个或多个基团取代,所述基团包括但不限于(c
1-c8)烷基、-o-[(c
1-c8)烷基]、-芳基、-co-r’、-o-co-r’、-co-or’、-co-nh2、-co-nhr’、-co-nr
’2、-nh-co-r’、-so
2-r’、-so-r’、-oh、-卤素、-n3、-nh2、-nhr’、-nr
’2和-cn;其中每个r’独立地选自-(c
1-c8)烷基和芳基。
[1216]
如本文优选使用的表述亚烷基是指饱和的直链或支链烃基,其中规定了两个取代点。其中两个取代点彼此相距最大的简单烷基链如甲烷-1,1-二基、乙烷-1,2-二基、丙烷-1,3-二基、丁烷-1,4-二基和戊烷-1,5-二基,也称为亚甲基(其也称为甲烷-1,1-二基)、亚乙基(其也称为乙烷-1,2-二基)、亚丙基(其也称为丙烷-1,3-二基)、亚丁基(其也称为丁烷-1,4-二基)和亚戊基(其也称为戊烷-1,5-二基)。
[1217]
在一个实施方案中以及如本文优选使用的,(c
1-c
10
)亚烷基各自且独立地指以下任一者:亚甲基、乙烷-1,2-二基、丙烷-1,3-二基、丙烷-1,2-二基、丁烷-1,4-二基、丁烷-1,3-二基、丁烷-1,2-二基、2-甲基-丙烷-1,2-二基、2-甲基-丙烷-1,3-二基、戊烷-1,5-二基、戊烷-1,4-二基、戊烷-1,3-二基、戊烷-1,2-二基、戊烷-2,3-二基、戊烷-2,4-二基、具有5个碳原子的任何其它异构体、己烷-1,6-二基、具有6个碳原子的任何其它异构体、庚烷-1,7-二基、具有7个碳原子的任何其它异构体、辛烷-1,8-二基、具有8个碳原子的任何其它异构体、壬烷-1,9-二基、具有9个碳原子的任何其它异构体、癸烷-1,10-二基和具有10个碳原子
nhr’、-nr
’2和-cn;其中每个r’独立地选自-(c
1-c8)烷基和芳基。
[1227]
在一个实施方案中以及如本文优选使用的,亚芳基是指具有两个共价键的芳基基团并且可以是如以下结构所示的邻位、间位或对位构型:
[1228][1229]
其中苯基可以是未取代的,或由四个基团取代,所述基团包括但不限于(c
1-c8)烷基、-o-[(c
1-c8)烷基]、-芳基、-co-r’、-o-co-r’、-co-or’、-co-nh2、-co-nhr’、-co-nr
’2、-nh-co-r’、-so
2-r’、-so-r’、-oh、-卤素、-n3、-nh2、-nhr’、-nr
’2和-cn;其中每个r’独立地选自-(c
1-c8)烷基和芳基。
[1230]
在每个和任一方面的实施方案、包括其任何实施方案中,可以被氧化的任何s原子、优选硫醚基团的s原子以-s-、-s(o)-或-s(o2)-或其混合物形式存在。
[1231]
在一个实施方案中以及如本文优选使用的,在本说明书书、包括权利要求书中的任何结构式或任何段落中未指定原子质量数的原子是未指定的同位素组合物、天然存在的同位素混合物或各个同位素。这特别适用于碳、氧、氮、硫、磷、卤素和金属原子,包括但不限于c、o、n、s、f、p、cl、br、at、sc、cr、mn、co、fe、cu、ga、sr、zr、y、mo、tc、ru、rh、pd、pt、ag、in、sb、sn、te、i、pr、pm、dy、sm、gd、tb、ho、dy、er、yb、tm、lu、sn、re、rd、os、ir、au、pb、bi、po、fr、ra、ac、th和fm。
[1232]
在一个实施方案中以及如本文优选使用的,螯合剂(chelator)是能形成螯合物(chelate)的化合物,其中螯合物是化合物,优选其中金属或具有电子间隙或孤对电子的部分参与环形成的环状化合物。更优选地,螯合剂是这类其中单个配体在中心原子处占据多于一个配位位点的化合物。
[1233]
在一个实施方案中以及如本文优选使用的,诊断活性化合物是适于或可用于诊断疾病的化合物。
[1234]
在一个实施方案中以及如本文优选使用的,诊断剂或诊断活性剂是适于或可用于诊断疾病的化合物。
[1235]
在一个实施方案中以及如本文优选使用的,治疗活性化合物适于或可用于治疗疾病的化合物。
[1236]
在一个实施方案中以及如本文优选使用的,治疗剂或治疗活性剂是适于或可用于治疗疾病的化合物。
[1237]
在一个实施方案中以及如本文优选使用的,治疗诊断活性化合物是适于或可用于诊断和治疗疾病的化合物。
[1238]
在一个实施方案中以及如本文优选使用的,治疗诊断剂或治疗诊断活性剂是适于或可用于诊断和治疗疾病的化合物。
[1239]
在一个实施方案中以及如本文优选使用的,治疗诊断法是用于组合诊断和治疗疾病的方法;优选地,用于治疗诊断法中的组合诊断和治疗活性化合物是放射性标记的。
[1240]
在一个实施方案中以及如本文优选使用的,疾病的治疗是疾病的治疗和/或预防。
[1241]
在一个实施方案中以及如本文优选使用的,涉及fap的疾病是这样的疾病,其中优选以上调方式表达fap的细胞包括但不限于成纤维细胞以及表达fap的组织或者含有或包
含优选以上调方式表达fap的细胞例如成纤维细胞的组织是疾病和/或疾病症状的原因或一个原因,或者是疾病潜在病理的一部分。优选的表达fap的细胞是癌症相关成纤维细胞(caf)。在所述疾病的一个实施方案中,优选当与疾病的治疗(treatment)、正在治疗(treating)和/或疗法(therapy)结合使用时,分别影响所述细胞、所述组织和病理导致疾病和/或疾病症状的治愈、治疗或改善。在所述疾病的一个实施方案中,优选当与疾病的诊断(diagnosis)和/或正在诊断(diagnosing)结合使用时,对表达fap的细胞和/或表达fap的组织进行标记使得能将所述细胞和/或所述组织与健康的或不表达fap的细胞和/或健康的或不表达fap的组织加以区别或区分。更优选地,这种区别或区分分别形成所述诊断和正在诊断的基础。在其一个实施方案中,标记是指可检测标记与表达fap的细胞和/或表达fap的组织或含有这种表达fap的细胞的组织直接或间接的相互作用;更优选地,这种相互作用涉及或基于所述标记或携带这种标记的化合物与fap的相互作用。
[1242]
在一个实施方案中以及如本文优选使用的,靶细胞是这样的细胞,其表达fap并且是疾病和/或疾病症状的原因或一个原因,或者是疾病潜在病理的一部分。
[1243]
在一个实施方案中以及如本文优选使用的,非靶细胞是指这样的细胞,其不表达fap和/或不是疾病和/或疾病症状的原因或一个原因,或不是疾病潜在病理的一部分。
[1244]
在一个实施方案中以及如本文优选使用的,瘤(neoplasm)是细胞的异常新生长。瘤中的细胞比正常细胞更快生长,如果不治疗则会继续生长。瘤可以是良性的或恶性的。
[1245]
在一个实施方案中以及如本文优选使用的,肿瘤是团块病变,其可以是良性的或恶性的。
[1246]
在一个实施方案中以及如本文优选使用的,癌症是恶性瘤。
[1247]
在一个实施方案中以及如本文优选使用的,键连(linkage)是两个独立部分的两个原子的连接。优选的键连是一个化学键或多个化学键。更优选地,化学键是一个共价键或多个化学键。最优选地,键连是共价键或配位键。如本文优选使用的,配位键的一个实施方案是当金属被螯合剂结合时实现的键或一组键。根据连接的原子类型及其原子环境,产生不同类型的键连。这些键连类型由所述键连产生的原子排列类型定义。例如,包含胺的部分与包含羧酸的部分的连接导致称为酰胺的键连(其也称为酰胺键连,-co-n-,-n-co-)。本领域技术人员会认识到,产生键连的这个和以下实例仅是典型实例,决不是限制本技术的范围。本领域技术人员会认识到,包含异硫氰酸酯的部分与包含胺的部分的连接产生硫脲(其也称为硫脲键连,-n-cs-n-),包含c原子的部分与包含硫醇基团(-c-sh)的部分的连接产生硫醚(其也称为硫醚键连,-csc-)。优选与本发明的螯合剂和接头组合使用的键连及其原子排列的特征类型的非限制性列表见表2。
[1248]
表2
[1249][1250]
在本发明的一些实施方案中,用于在螯合剂和接头之间或者直接在螯合剂与本发明的化合物之间形成键连的反应性基团的实例总结在表3中。然而,本领域技术人员会理解,在用于形成本发明缀合物的实施方案中可被实现的键连既不限于表3中的键连之一,也不限于形成这种键连的反应基团。
[1251]
表3
[1252]
第一反应性基团第二反应性基团键连(类型)氨基羧酸酰胺氨基活化的羧酸酰胺羧酸氨基酰胺巯基michael受体(例如马来酰亚胺)硫醚
溴巯基硫醚异硫氰酸酯氨基硫脲羟基羧酸酯叠氮化物炔烃三唑巯基巯基二硫化物巯基2-吡啶-二硫化物二硫化物异氰酸酯氨基氨基甲酸酯溴羟基醚
[1253]
以下是用于或适于在本发明缀合物的实施方案中使用的部分或结构之间形成键连的反应性基团和官能度:伯氨基或仲氨基、羧酸、活化的羧酸、氯、溴、碘、巯基、羟基、磺酸、活化的磺酸、磺酸酯如甲磺酸酯或甲苯磺酸酯、michael受体、应变烯烃(strained alkene)如反式环辛烯、异氰酸酯、异硫氰酸酯、叠氮化物、炔烃和四嗪。
[1254]
如本文优选使用的,术语“活化的羧酸”是指具有通式-co-x的羧酸基团,其中x是离去基团。例如,羧酸基团的活化形式可包括但不限于酰氯、对称或不对称酸酐、和酯。在一些实施方案中,活化的羧酸基团是具有五氟苯酚、硝基苯酚、苯并三唑、氮杂苯并三唑、硫酚或n-羟基琥珀酰亚胺(nhs)作为离去基团的酯。
[1255]
如本文优选使用的,术语“活化的磺酸”是指具有通式-so
2-x的磺酸基团,其中x是离去基团。例如,磺酸的活化形式可包括但不限于磺酰氯或磺酸酐。在一些实施方案中,活化的磺酸基团是具有氯作为离去基团的磺酰氯。
[1256]
在一个实施方案中以及如本文优选使用的,术语“介导键连”是指建立一个键连或一种类型的键连,优选两个部分之间的键连。在优选的实施方案中,所述键连和键连的类型如本文所定义。
[1257]
在本技术中提到由较低整数和较高整数表示的范围(例如1至4),此类范围表示所述较低整数、所述较高整数以及所述较低整数和所述较高整数之间的任何整数。到这种程度上,所述范围实际上是所述整数的个体化公开。在所述实例中,1至4的范围因此意味着1、2、3和4。
[1258]
本发明的化合物通常含有如本文所提供的氨基酸序列。常规的氨基酸(也称为天然氨基酸)是根据其标准的三字母代码和一个字母缩写进行识别,如表4所示。
[1259]
表4:常规氨基酸及其缩写
[1260][1261][1262]
非常规氨基酸(也称为非天然氨基酸)是包含氨基和羧基而且不是常规氨基酸的任何类型的非低聚化合物。
[1263]
用于构建本发明化合物的非常规氨基酸和其它构件的实例根据表5中其缩写或名称进行识别。一些构件的结构用将所述构件引入肽的示例性反应物(例如羧酸样)描绘,或者这些构件以完全连接到另一结构例如肽或氨基酸的残基示出。氨基酸的结构显示为明确的氨基酸,而不是氨基酸残基(它们以此方式在执行后呈现在肽序列中)。为清楚起见,还示出了由多于一个部分组成的一些较大的化学部分。
[1264]
表5:非天然氨基酸及其它构件和化学部分的缩写、名称和结构
[1265]
[1266]
[1267]
[1268]
[1269]
[1270]
[1271]
[1272]
[1273]
[1274]
[1275]
[1276]
[1277]
[1278]
[1279]
[1280][1281][1282]
本领域技术人员会理解,本文提供的肽的氨基酸序列以典型的肽序列格式描述。例如,常规氨基酸的三个字母代码、或非常规氨基酸的代码、或其它构件的缩写表示所述氨
基酸或构件在肽序列中的特定位置存在。每个氨基酸或构件的代码通过连字符(通常代表酰胺键)连接于序列中下一个和/或前一个氨基酸或构件的代码。
[1283]
在氨基酸含有多于一个氨基和/或羧基的情况中,这个氨基酸的所有方向原则上都是可能的,但在α-氨基酸中,优选利用α-氨基和α-羧基,其它优选方向是明确指定的。
[1284]
对于氨基酸,在其缩写中,第一个字母表示c-α-原子的立体化学(如果适用)。例如,大写的首字母表示肽序列中存在l型氨基酸,而小写的首字母表示肽序列中存在d型的相应氨基酸。
[1285]
在一个实施方案中以及如本文优选使用的,芳族l-α-氨基酸是包含芳基基团的任何种类的l-α-氨基酸。
[1286]
在一个实施方案中以及如本文优选使用的,杂芳族l-α-氨基酸是包含杂芳基的任何种类的l-α-氨基酸。
[1287]
本领域技术人员会认识到,如果本文公开的化合物中存在立体中心,则不论这种立体中心是氨基酸基团的一部分还是本发明化合物的任何其它部分或基团。因此,本发明包括两种可能的立体异构体而且不仅包括外消旋化合物,还包括单独的对映异构体和/或非对映异构体。当希望化合物是单一对映体或非对映体时,其可以通过立体定向合成或通过拆分最终产物或任何方便的中间体来获得。最终产物、中间体或起始材料的拆分均可以通过本领域已知的任何合适的方法进行。参见例如e.l.eliel、s.h.wilen和l.n.mander的“stereochemistry of organic compounds”(wiley-lnterscience,1994)。
[1288]
在本技术中,为了方便起见,在某些情况下,化合物的结构式表示某种异构体,但本发明包括所有异构体,如几何异构体、基于不对称碳的旋光异构体、立体异构体、互变异构体等。在本技术说明书中,为了方便起见,在某些情况下,化合物的结构式表示某种异构体,但本发明包括所有异构体,如几何异构体、基于不对称碳的旋光异构体、立体异构体、互变异构体等。
[1289]
除非有相反说明,否则氨基酸序列在本文中以n末端至c末端方向呈现。
[1290]
构成本发明的肽的氨基酸的衍生物可以如表6所示。在任何实施方案中,本发明的化合物的一个或多个氨基酸被相应的优选氨基酸的衍生物取代。
[1291]
表6:本发明化合物中包含的优选氨基酸的衍生物示例
[1292]
[1293][1294]
线性肽
[1295]
一般的线性肽通常如下所示从n末端至c末端方向书写:
[1296]
nt-xaa1-xaa2-xaa3-xaa4
‑……
xaan-ct;
[1297]
其中:
[1298]
1.xaax是如表5所示的、在特定序列位置x处的氨基酸或构件的缩写、描述符或符号,
[1299]
2.nt是n末端基团,例如“h”(游离n末端氨基的氢),或特定终止羧酸的缩写(如“ac”表示乙酸),或通过连字符连接于n末端氨基酸代码(xaa1)的其它化学基团或化学基团的结构式,以及
[1300]
3.ct是c末端基团,其通常是“oh”或“nh
2”(作为末端羧酸或酰胺)或通过连字符连接于c末端氨基酸代码(xaan)的特定终止胺的缩写。
[1301]
具有由特定构件或肽修饰的侧链的支链肽
[1302]
一般的线性支链肽是如下所示从n末端至c末端方向书写的:
[1303]
nt-xaa1-xaa2-xaa3(nt-xab1-xab2
‑……
xabn)
‑……
xaan-ct;
[1304]
其中线性肽的描述中的陈述1至3适用于说明该支链肽主链中xaax、nt和ct。
[1305]
分支的位置由xaax缩写后面的括号指定。分支通常出现在赖氨酸(lys)残基(或类似物)处,这意味着分支是通过酰胺键连接于赖氨酸的侧链ε-氨基官能团。
[1306]
括号中的内容描述了肽分支“nt-xab1-xab2
‑……
xabn”的序列/结构。其中:
[1307]
1.xabx是表3所示的、在分支的特定序列位置x处的氨基酸或构件的缩写、描述符或符号,
[1308]
2.nt是n末端基团,例如特定终止羧酸的缩写(如“ac”表示乙酸),或通过连字符连接于n末端氨基酸代码(xab1)的其它化学基团或化学基团的结构式,以及
[1309]
3.分支xabn的最后构件,其通过其自身羧基官能团与这个赖氨酸的侧链氨基官能团(或类似残基)形成酰胺键,将分支与主链连接。
[1310]
环状肽
[1311]
示例性的一般的环状肽是如下所示从n末端至c末端书写的:
[1312]
nt-xaa1-[xaa2-xaa3-xaa4
‑……
xaan]-ct;
[1313]
其中线性肽的描述中的陈述1至3适用于说明所述环状肽主链中xaax、nt和ct。肽环的特征由方括号指定。
[1314]
1.左方括号表示在其侧链处环开始的构件(环起始残基),以及
[1315]
2.右方括号表示在其侧链出环终止的构件(环终止残基)。
[1316]
这两个残基之间连接的化学性质是:
[1317]
1.酰胺键,其中在那些所示的残基中,一个残基在其侧链中含有氨基官能团(例如lys),而另一个残基在其侧链中含有羧基官能团(例如glu),或
[1318]
2.二硫键,其中那些所示的残基/氨基酸含有巯基部分(例如cys)。
[1319]
含有其它环化元件(yc)的环状肽
[1320]
从n末端至c末端书写的一般的扩展的环状肽如下所示:
[1321]
nt-xaa1-[xaa2(yc)-xaa3-xaa4
‑……
xaan]-ct;
[1322]
其中线性肽的描述中的陈述1至3适用于说明该环状肽主链中的xaax、nt和ct。此外,yc是环化元件。如在环状肽的情况中,环的特征由方括号指定,方括号表示环起始残基和环终止残基。
[1323]
与环起始残基相邻的括号内容指定了在扩展的肽环内的环化元件yc。yc元件与所述残基的侧链相连。此外,yc元件与环终止残基的侧链相连。这些残基中的任一个与yc元件之间的键连的化学性质取决于相应氨基酸xaan的侧链官能团。如果xaan的侧链包含巯基(例如cys),则所述键是硫醚。
[1324]
作为非限制实例,ac-[cys(tmebn(dota-pp))-pro-pro-thr-gln-phe-cys]-oh的结构如下所示:
[1325][1326]
其中:
[1327]
1.ac对应通式中的nt。
[1328]
2.cys、pro、pro、thr、gln、phe和cys对应通式中的xaa1至xaa7。
[1329]
3.oh对应通式中的ct。
[1330]
4.与序列中n末端半胱氨酸相邻的左方括号(,[
‘
)表示环在这个残基处开始(环起始残基)。
[1331]
5.与序列中n末端半胱氨酸相邻的右方括号(,]
‘
)表示环在这个残基处终止(环终止残基)。
[1332]
6.与表示为起始残基的cys相邻的括号内的tmebn是指环化元件yc。其进一步结合于表示为环终止残基的cys。yc元件通过硫醚键连接于所述残基。
[1333]
7.dota螯合剂通过pp接头连接于tmebn残基的剩余连接点。为清楚起见,术语如“cys(tmebn(dota-pp))”包括在表2中的化学结构列表中。
[1334]
在本发明的一个实施方案中,氨基酸或肽连接于xaa7,其中这个肽的大部分氨基
酸是荷电的或极性的,所述肽的净电荷为-2、-1、0、 1或 2。
[1335]
对于肽净电荷的计算,带负电荷的氨基酸是在其侧链中带有如-cooh或-so3h的酸性基团的氨基酸,其净电荷对应于酸性基团的数目,例如asp或glu的净电荷为-1。
[1336]
对于这种计算,带正电荷的氨基酸是在其侧链中带有如氨基或-胍基的碱性基团的氨基酸,其净电荷对应于碱性基团的数目,例如lys或arg的净电荷为 1。
[1337]
极性氨基酸是在其侧链中带有极性基团的氨基酸。极性基团例如是conh2、oh、f、cl、cn和杂环,例如组氨酸中的咪唑。
[1338]
极性氨基酸的净电荷为0。对于一些含氮杂环,在我们的计算中净电荷被认为是0,但公认的是根据环境的ph值,其可能会在平衡中质子化,因此在一定程度上带正电荷。
[1339]
这个肽的大多数(50%或更多)氨基酸是荷电的或极性的。
[1340]
优选地,正电荷或负电荷有时被极性或非极性氨基酸隔开。
[1341]
在一些实施方案中,带负电荷的氨基酸的存在优选是在xaa10。
[1342]
在一些实施方案中,带正电荷的氨基酸的存在优选是在xaa13,优选arg和arg。
[1343]
根据本发明,本发明的化合物可包含z基团。z基团包含螯合剂和任选存在的接头。如优选使用的接头是将分子的两个部分分开的元件、部分或结构。在本发明中,接头基团与螯合剂基团以及z所连接的本发明化合物的相应部分二者形成共价键。接头基团原则上可以是能与螯合剂基团和本发明化合物的一部分在指定位置形成键的任何化学基团。
[1344]
接头的一个重要性质或特征是其将螯合剂和本发明化合物的环状肽部分隔开。这在环状肽的靶结合能力被螯合剂的紧密接近损害的情况下尤其重要。然而,其最扩展的构象异构体中的总接头长度不应超过优选不超过最优选不超过
[1345]
在优选的实施方案中,接头是-[x]a-,其中a是1至10的整数,每个x是单独的构件,其通过选自以下的官能团独立地连接于其在序列中的相邻基团:酰胺键、脲键、氨基甲酸酯键、酯键、醚键、硫醚键、磺酰胺键、三唑和二硫键。
[1346]
x1与螯合剂连接以及与x2(如果存在)连接,或在指定位置与本发明化合物连接。xa与x
a-1
(如果存在)连接,以及在指定位置与本发明化合物连接。
[1347]
更优选的接头基团类型由-[x]
a-表示,其中a是1至10的整数,优选a是1至8、1至6、1至5、1至4或1至3的整数,每个x是单独的构件,其通过选自以下的官能团独立地连接于其在序列中的相邻基团:酰胺键、脲键、氨基甲酸酯键、酯键、醚键、硫醚键、磺酰胺键、三唑键和二硫键。
[1348]
在一个实施方案中,所述构件x具有通式(8),
[1349][1350]
其中:
[1351]
片段lin2(如果存在)和片段lin3(如果存在)各自且独立地选自-co-、-nr
10-、-s-、-co-nr
10-、-cs-nr
10-、-o-、-琥珀酰亚胺-和-ch
2-co-nr
10-;条件是lin2或lin3中至少之一通过碳原子与r9连接,以及所有含氮片段的氮原子与r9连接;
[1352]
其中r
10
选自氢和(c
1-c4)烷基;
[1353]
以及其中r9选自-(c
1-c
10
)亚烷基-、-(c
3-c8)碳环-、-亚芳基-、-(c
1-c
10
)亚烷基-亚芳基-、-亚芳基-(c
1-c
10
)亚烷基-、-(c
1-c
10
)亚烷基-亚芳基-(c
1-c
10
)亚烷基-、-(c
1-c
10
)亚
烷基-(c
3-c8)碳环-、-(c
3-c8)碳环-(c
1-c
10
)亚烷基-、-(c
1-c
10
)亚烷基-(c
3-c8)碳环-(c
1-c
10
)亚烷基-、-(c
3-c8)杂环-、(c
1-c
10
)亚烷基-(c
3-c8)杂环-、-(c
3-c8)杂环-(c
1-c
10
)亚烷基-、-(c
1-c
10
)亚烷基-(c
3-c8)杂环-(c
1-c
10
)亚烷基-、-(ch2ch2o)
r-和-(ch2)
s-(ch2ch2o)
r-(ch2)
t-;
[1354]
以及其中:
[1355]
r是来自1、2、3、4、5、6、7、8、9和10的任何整数;
[1356]
s是来自0、1、2、3和4的任何整数;以及
[1357]
t是来自0、1、2、3和4的任何整数。
[1358]
优选地,除了x1和螯合剂之间的键连之外,所述键连是酰胺键。更优选地,构件x2至xa独立地选自氨基酸、二羧酸和二胺,各自的键连是酰胺。
[1359]
在一个实施方案中,构件x2至xa优选是氨基酸,其中所述氨基酸选自常规和非常规氨基酸。在一个实施方案中,氨基酸选自β-氨基酸、γ-氨基酸、δ-氨基酸、ε-氨基酸和ω-氨基酸之一。在进一步的实施方案中,氨基酸是环状氨基酸或线性氨基酸。本领域技术人员会理解,在具有立体中心的氨基酸的情况下,所有立体异构形式均可用于构件x中。
[1360]
在一个实施方案中,构件x2至xa优选是氨基酸,其中所述氨基酸选自在氨基与羧基的间距方面不同的氨基酸。这种氨基酸一般可以表示如下:
[1361][1362]
在本发明范围内,此类氨基酸不被进一步取代。然而,此类氨基酸被进一步取代也在本发明范围内;优选地,所述取代是co-nh2和/或ac-nh-。
[1363]
可用作构件x的这种氨基酸(结构32)的代表是甘氨酸(gly)、β-丙氨酸(bal)、γ-氨基丁酸(gaba)、氨基戊酸、氨基己酸以及具有至多10个ch2基团的同系物。
[1364]
更优选用作构件x的此类氨基酸(结构33)的代表是3-氨基甲基-苯甲酸、4-氨基甲基-苯甲酸、邻氨基苯甲酸、3-氨基苯甲酸和4-氨基苯甲酸。
[1365]
相关构件是通过用cooh替代nh2而衍生自氨基酸(结构32 33)的二胺,优选用作构件x的是二氨基乙烷、1,3-二氨基丙烷、1,4-二氨基丁烷、1,5-二氨基戊烷、3-氨基甲基苯胺、4-氨基甲基苯胺、1,2-二氨基苯、1,3-二氨基苯和1,4-二氨基苯。
[1366]
相关构件是通过用nh2替代cooh而衍生自氨基酸(结构32 33)的二羧酸,更优选用作构件x的是丙二酸、琥珀酸、戊二酸、己二酸、邻苯二甲酸、对苯二甲酸、间苯二甲酸以及2-、3-或4-羧基苯乙酸。
[1367]
在进一步的实施方案中,所述氨基酸是含有聚醚(优选作为主链)的氨基酸。优选地,所述聚醚是聚乙二醇并且由最多30个单体单元组成。优选地,与不包含所述聚醚的氨基酸相比,包含所述聚醚的氨基酸显示亲水性增加。如果并入构件x中并最终并入接头基团[x]a中,则结果通常是亲水性增加。这种氨基酸的优选实施方案描述如下,其中应认识到此类氨基酸可包含0、1、2、3、4、5、6、7、8、9、10、11或12个氧化乙烯部分:
pphe-ncs,dfo-hopo,dfc,二膦,dota,dotaga,dota-mfco,dotam-一元酸,硝基-dota,硝基-pa-dota,p-ncs-bz-dota,pa-dota,dota-ncs,dota-nhs,cb-do2a,pcta,p-nh2-bn-pcta,p-scn-bn-pcta,p-scn-bn-dota,dotma,nb-dota,h4nb-dota,h4tce-dota,3,4,3-(li-1,2-hopo),tren(me-3,2-hopo),tce-dota,dotp,doxp,p-ncs-dota,p-ncs-trita,trita,teta,3p-c-depa,3p-c-depa-ncs,p-nh2-bn-oxo-do3a,p-scn-bn-tcmc,tcmc,4-氨基丁基-dota,叠氮基-单酰胺-dota,bcn-dota,丁炔-dota,bcn-dota-ga,doa3p,do2a2p,do2a(反式-h2do2a),do3a,do3a-硫醇,do3atbu-n-(2-氨基乙基)乙酰胺,do2ap,cb-do2a,c3b-do2a,hp-do3a,dota-nhs-酯,马来酰亚胺-dota-ga,马来酰亚胺-单-酰胺-dota,马来酰亚胺-dota,nh2-dota-ga,nh2-peg4-dota-ga,p-nh
2-bn-dota,p-no2-bn-dota,p-scn-bn-dota,p-scn-bz-dota,ta-dota,ta-dota-ga,otta,doxp,tsc,dtc,dtcbp,ptsm,atsm,fsc,h2atsm,h2ptsm,dp44mt,dpc,bp44mt,qt,混合的缩氨基硫脲-苯并噻唑,缩氨基硫脲-苯乙烯基吡啶四配位基配体h2l2-4,hbed,hbed-cc,dmhbed,dmehpg,hbed-nn,shbed,br-me2hbed,bpca,heha,bf-heha,去铁酮,thp,hopo,hynic(2-肼基烟酰胺),nhs-hynic,hynic-kp-dppb,hynic-ko-dppb,(hynic)(tricine)2,(hynic)(edda)cl,p-eddha,aim,aim a,iam b,mama,mama-dgal,mama-mgal,mama-da,mama-had,macropa,macropaquin,macroquin-so3,nxs4-x,n2s2,n3s,n4,mag3b,nota,nodaga,scn-bz-nota-r,not-p(notmp),notam,p-ncs-nota,tacn,tacn-tm,neta,neta-单胺,pscn-phpr-ne3ta,c-ne3ta-ncs,c-neta-ncs,3p-c-neta,nodasa,nopo,noda,no2a,n-苄基-noda,noda-mpaa,c-nota,bcnot-单胺,马来酰亚胺基-单-酰胺-nota,no2a-叠氮化物,no2a-丁炔,no2ap,no3ap,n-nota,oxo-do3a,p-nh2-bn-nota,p-nh
2-bn-氧代-do3a,p-no2-bn-环烯,psc,p-scn-bn-nota,notp,p-scn-bn-氧代-do3a,trap,pepa,bf-pepa,pycup,pycup2a,pycup1a1bn,pycup2bn,resca,sarar-r,diamsar,ambasar-r,siamsar,sar,tachpyr,tachpyr-(6-me),tam a,tam b,tame,tame-hex,thp-ph-ncs,thp-ncs,thp-tate,ntp,h3thp,thpn,cb-te2a,pcb-te1a1p,teta-nhs,cpta,cpta-nhs,cb-te1k1p,cb-te2a,te2a,h2cb-te2a,te2p,cb-te2p,mm-te2a,dm-te2a,,2c-teta,6c-teta,bat,bat-6,nhs-bat酯,ssbat,scn-chx-a-dtpa-p,scn-teta,tmt-胺,p-bz-htcpp。
[1377]
hynic、dtpa、edta、dota、teta、基于双氨基双硫醇(bat)的螯合剂在us 5,720,934中公开;去铁胺(dfo)在(doulias,et al.,free radic biol med,2003,35:719)中公开,四吡啶和n3s、n2s2和n4螯合剂在us 5,367,080 a、us 5,364,613 a、us 5,021,556 a、us 5,075,099 a、us 5,886,142 a中公开,其中所有参考文献均以其整体通过引用并入本文。6-氨基-6-甲基全氢-1,4-二氮杂环庚烷-n,n’,n
″
,n
″‑
四乙酸(aazta)在pfister等人(pfister,et al.,ejnmmi res,2015,5:74)中公开,去铁酮,即1,2-二甲基-3,4-羟基吡啶酮,以及六齿三(3,4-羟基吡啶酮)(thp)在cusnir等人(cusnir,et al.,int jmol sci,2017,18)中公开,基于单胺-单酰胺二硫醇(mama)的螯合剂在demoin等人(demoin,et al.,nucl med biol,2016,43:802)中公开,macropa及类似物在thiele等人(thiele,et al.,angew chem int ed engl,2017,56:14712)中公开,1,4,7,10,13,16-六氮杂环十六烷-n,n’,n”,n
”’
,n
””
,n
””’‑
六乙酸(heha)和pepa类似物在price和orvig(price,et al.,chem soc rev,2014,43:260)中公开,pycup及类似物在boros等人(boros,et al.,mol pharm,2014,11:617)中公开,n,n-双(2-羟基苄基)乙二胺-n,n-二乙酸(hbed)、1,4,7,10-四(氨基
甲酰基甲基)-l,4,7,10-四氮杂环十二烷(tcm)、2-[(羧甲基)]-[5-(4-硝基苯基-1-[4,7,10-三-(羧甲基)-1,4,7,10-四氮杂环十二烷-1-基]戊-2-基)-氨基]乙酸(3p-c-depa)、cb-te2a、te2a、te1a1p、diamsar、1-n-(4-氨基苄基)-3,6,10,13,16,19-六氮杂二环[6.6.6]-二十烷-1,8-二胺(sarar)、neta、n,n0,n00三(2-巯乙基)-1,4,7-三氮杂环壬烷(tacn-tm)、{4-[2-(双-羧甲基-氨基)-乙基]-7-羧甲基-[1,4,7]三氮杂壬-1-基}-乙酸(neta)、二亚乙基三胺五乙酸(dtp)、3-({4,7-二-[(2-羧基-乙基)-羟基-磷酰基甲基]-[1,4,7]三氮杂壬-1-基甲基}-羟基-磷酰基)-丙酸(trap)、nopo、h4octapa、shbed、bpca、3,6,9,15-四氮杂双环[9.3.1]-十五烷-1(15),11,13-三烯-3,6,9,-三乙酸(pcta)及1,4,7,10,13-五氮杂环十五烷-n,n’,n”,n
”’
,n
””‑
五乙酸(pepa)在price和orvig(price,et al.,chem soc rev,2014,43:260)中公开,1-羟基-2-吡啶酮配体(hopo)在allott等人(allott,et al.,chem commun(camb),2017,53:8529)中公开,[4-羧甲基-6-(羧甲基-甲基-氨基)-6-甲基-[1,4]二氮杂环庚烷-1-基]-乙酸(data)在tornesello等人(tornesello,et al.,molecules,2017,22:1282)中公开,四(氨甲基)甲烷(tam)及类似物在mcauley 1988(mcauley,et al.,canadian journal of chemistry,1989,67:1657)中公开,六齿三(3,4-羟基吡啶酮)(thp)及类似物在ma等人(ma,et al.,dalton trans,2015,44:4884)中公开。
[1378]
现有技术中描述了一些上述螯合剂的诊断和/或治疗性应用。例如,2-肼基烟酰胺(hynic)已广泛用于在共配体存在下掺入
99m
tc和
186,188
re(schwartz,et al.,bioconjug chem,1991,2:333;babich,et al.,j nucl med,1993,34:1964;babich,et al.,nucl med biol,1995,22:25);dtpa用于中以络合
111
in,而且一些修饰描述在文献中(li,et al.,nucl med biol,2001,28:145;brechbiel,et al.,bioconjug chem,1991,2:187);dota型螯合剂在放射治疗中的应用由tweedle等人(us pat 4,885,363)描述;螯合三价同位素金属的其它多氮杂(polyaza)大环由eisenwiener等人(eisenwiener,et al.,bioconjug chem,2002,13:530)描述;n
4-螯合剂例如
99m
tc-n
4-螯合剂在靶向cck-2受体的小促胃液素(minigastrin)情况中已经用于肽标记(nock,et al.,j nucl med,2005,46:1727)。
[1379]
在一个实施方案中,金属螯合剂选自但不限于dota、dotaga、nota、nodaga、noda-mpaa、hbed、teta、cb-te2a、dtpa、dfo、macropa、hopo、trap、thp、data、notp、sarcophagine、fsc、neta、h4octapa、pycup、n
xs4-x
(n4、n2s2、n3s)、hynic、
99m
tc(co)3‑‑
螯合剂及其类似物,其中:
[1380]
dota表示1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸,
[1381]
dotaga表示1,4,7,10-四氮杂环十二烷,1-(戊二酸)-4,7,10-三乙酸,
[1382]
nota表示1,4,7-三氮杂环壬烷三乙酸,
[1383]
nodaga表示1,4,7-三氮杂环壬烷-n-戊二酸-n',n"-二乙酸,
[1384]
noda-mpaa表示1,4,7-三氮杂环壬烷-1,4-二乙酸-甲基苯基乙酸,
[1385]
hbed表示双(2-羟基苄基)乙二胺二乙酸,
[1386]
teta表示1,4,8,11-四氮杂环十二烷-1,4,8,11-四乙酸,
[1387]
cb-te2a表示4,11-双-(羧甲基甲基)-1,4,8,11-四氮杂二环[6.6.2]-十六烷,
[1388]
dtpa表示二亚乙基三胺五乙酸,
[1389]
dfo表示除铁灵(desferal)或去铁胺(desferrioxamine)型螯合剂组,非限制性实
例的化学名称是n-[5-({3-[5-(乙酰基-羟基-氨基)-戊基氨基甲酰基]-丙酰基}-羟基-氨基)-戊基]-n'-(5-氨基-戊基)-n'-羟基-琥珀酰胺,
[1390]
macropa表示n,n
’‑
双[(6-羧基-2-吡啶基)甲基]-4,13-二氮杂-18-冠,
[1391]
hopo表示十八烷羟基吡啶酮类型螯合剂组,非限制性实例的结构在下文示出,
[1392]
trap表示3-({4,7-双-[(2-羧基-乙基)-羟基-磷酰基甲基]-[1,4,7]三氮杂壬-1-基甲基}-羟基-磷酰基)-丙酸,
[1393]
thp表示六齿三(3,4-羟基吡啶酮),
[1394]
data表示[4-羧甲基-6-(羧甲基-甲基-氨基)-6-甲基-[1,4]二氮杂环庚烷-1-基]-乙酸,
[1395]
notp表示1,4,7-三氮杂环壬烷-n,n’,n
”‑
三(亚甲基膦)酸),
[1396]
sarcophagine表示3,6,10,13,16,19-六氮杂二环[6.6.6]二十烷,
[1397]
fsc表示3,15,27-三氨基-7,19,31-三羟基-10,22,34-三甲基-1,13,25-三氧杂-7,19,31-三氮杂-环三十六烷-9,21,33-三烯-2,8,14,20,26,32-六酮,
[1398]
neta表示{4-[2-(双-羧甲基-氨基)-乙基]-7-羧甲基-[1,4,7]三氮杂壬-1-基}-乙酸
[1399]
h4octapa表示n,n
’‑
(6-羧基-2-吡啶基甲基)-n,n
’‑
二乙酸-1,2-乙二胺,
[1400]
pycup表示1,8-(2,6-吡啶二亚甲基)-1,4,8,11-四氮杂环十四烷,
[1401]nxs4-x
(n4,n2s2,n3s)表示一组具有n原子(碱性胺或非碱性酰胺)和硫醇为供体的四齿螯合剂,其稳定tc-配合物,尤其是tc(v)-氧代配合物。一个代表性的非限制性实例mag3的结构如下所示,以及
[1402]
mag3表示{2-[2-(3-巯基-丙酰氨基)-乙酰基氨基]-乙酰基氨基}-乙酸,
[1403]
hynic表示6-肼基-烟酸,
[1404]
99m
tc(co)
3-螯合剂表示二齿或三齿螯合剂,其能与锝三羰基片段形成稳定络合物,
[1405]
其化学结构如下所示:
[1406]
[1407][1408]
[1409]
在一个优选的实施方案中,所述金属螯合剂选自dota、dotaga、nota、nodaga、noda-mpaa、hbed、cb-te2a、dfo、thp、n4及其类似物。
[1410]
在一个更优选的实施方案中,所述金属螯合剂选自dota、dotaga、nota、n4ac和nodaga及其类似物。
[1411]
本领域技术人员意识到,理论上可以使用所述螯合剂,不论本发明的化合物是否用于或适合用于诊断或治疗。这个理论在国际专利申请wo 2009/109332 a1中概述。
[1412]
本领域技术人员会进一步意识到,如果没有另外说明,则所述螯合剂在本发明化合物中的存在包括所述螯合剂与任何金属络合物配偶体(即理论上可以被所述螯合剂络合的任何金属)络合的可能。明确提及的本发明化合物的螯合剂或与本发明化合物相关的通用术语螯合剂是指未络合的螯合剂本身,或是指结合任何金属络合物配偶体的螯合剂,其中所述金属络合物配偶体是任何放射性或非放射性金属络合物配偶体。优选所述螯合剂金属络合物,即金属络合物配偶体所结合的螯合剂,其是稳定的螯合剂金属络合物。
[1413]
非放射性螯合剂金属络合物有多种应用,例如用于评估如稳定性或活性等难以确定的性质。一个方面是金属络合物配偶体的放射性形式的冷变体(例如实施例中描述的非放射性镓、镥或铟络合物)可以充当放射性化合物的替代物。此外,它们是在体外或体内鉴定代谢物以及评估本发明化合物的毒性性质的有价值的工具。此外,螯合剂金属络合物可用于结合测定中,利用一些具有不同配体的金属络合物(例如铕盐)荧光特性。
[1414]
螯合剂可以是合成的或商购的,具有多种(可能已经被激活的)与肽或氨基酸缀合的基团。螯合剂与本发明相应化合物的氨基氮的直接缀合对于选自以下的螯合剂是完全可能的:dota,dotaga,nota,nodaga,noda-mpaa,hbed,teta,cb-te2a,dtpa,dfo,data,sarcophagine,n4,mag3和hynic,优选dota,dotaga,nota,nodaga,noda-mpaa,cb-te2a,和n4。在这方面优选的键连是酰胺键。
[1415]
本领域技术人员已知螯合剂的官能团,所述官能团是螯合剂与氨基氮直接缀合的理想前体,包括但不限于羧酸,活化的羧酸,例如活性酯,如nhs-酯、五氟苯酚-酯、hobt-酯和hoat-酯、异硫氰酸酯。
[1416]
本领域技术人员已知螯合剂的官能团,所述官能团是螯合剂与肽的羧基直接缀合的理想前体,包括但不限于烷基氨基和芳基氨基氮。相应的螯合剂试剂是用于可商购的一些螯合剂,例如用于具有烷基氨基或芳基氨基氮的dota。
[1417]
本领域技术人员意识到,要分别考虑待治疗的疾病和/或待诊断的疾病和/或分别考虑待治疗和待诊断的患者和患者组的特性,来选择与或者待与本发明的化合物连接的放射性核素。
[1418]
在本发明的一个实施方案中,所述放射活性核素也称为放射性核素。放射性衰变是不稳定原子的原子核通过发射电离粒子(电离辐射)而失去能量的过程。有不同类型的放射性衰变。当具有一种类型原子核的原子(称为母体放射性核素)转变为具有不同状态的原子核或包含不同数量的质子和中子的原子核时,导致能量衰减或损失。这些产物中的任何一个都被命名为子体核素。在某些衰变中,母体和子体是不同的化学元素,因此衰变过程会导致核嬗变(产生新元素的原子)。例如,放射性衰变可以是α衰变、β衰变和γ衰变。当原子核喷射出一个α粒子(氦核)时,发生α衰变。这是最常见的发射核子的过程,但在更罕见的衰变类型中,原子核可以喷射质子,或其它元素的特定核子(在这个过程中称为簇衰变)。在质子
变成中子的过程中或者相反,在原子核发射电子(β-‑
衰变)或正电子(β
-衰变)和一种类型中微子时,发生β衰变。相比之下,存在不会导致嬗变的放射性衰变过程。受激核的能量可以在γ衰变中以γ射线的形式发射,或用于通过与受激核在称为内部转换的过程中相互作用而喷射轨道电子,或用于从电子壳层吸收内部原子电子,从而核质子转变为中子导致为电子俘获(ec)的过程中发射电子中微子,或者在称为同质异能跃迁(it)的过程中可以在不改变质子和中子数量的情况下发射。一种形式的放射性衰变,即自发裂变(sf),仅在非常重的化学元素中发现,导致自发分解成较小的原子核和一些孤立的核粒子。
[1419]
在本发明的优选实施方案中,所述放射性核素可用于标记本发明的化合物。
[1420]
在本发明的一个实施方案中,所述放射性核素适合与螯合剂络合,形成放射性核素螯合物络合物。
[1421]
在另一个实施方案中,本发明化合物的一个或多个原子具有非天然同位素组成,优选这些原子是放射性核素;更优选碳、氧、氮、硫、磷和卤素的放射性核素:这些放射性原子通常是本发明化合物的氨基酸(在某些情况下是含卤素的氨基酸)和/或构件(以及在某些情况下是卤化构件)的一部分。
[1422]
在本发明的一个优选实施方案中,所述放射性核素具有允许诊断和/或治疗性医学用途的半衰期。具体来说,所述半衰期为1分钟至100天。
[1423]
在本发明的优选实施方案中,所述放射性核素具有允许诊断和/或治疗性医学用途的衰变能。具体地,对于γ发射同位素,对于诊断用途而言,衰变能为0.004至10mev,优选0.05至4mev。对于正电子发射同位素,对于诊断用途而言,衰变能为0.6至13.2mev,优选1至6mev。对于粒子发射同位素,对于治疗用途而言,衰变能为0.039至10mev,优选0.4至6.5mev。
[1424]
在本发明的优选实施方案中,所述放射性核素是工业生产以用于医学用途。具体来说,所述放射性核素可达到gmp质量认证。
[1425]
在本发明的优选实施方案中,放射性核素的放射性衰变后的子体核素与诊断和/或治疗性医学用途相容。此外,子体核素是稳定的,或以不干扰或甚至支持诊断和/或治疗性医学用途的方式进一步衰变。可结合本发明使用的代表性放射性核素总结在表7中。
[1426]
表7:相关放射性核素的关键性质-半衰期、衰变类型和衰变能
[1427]
[1428]
[1429]
[1430]
[1431]
[1432]
[1433]
[1434]
[1435]
[1436]
[1437]
[1438]
[1439]
[1440]
[1441]
[1442]
[1443]
[1444]
[1445]
[1446]
[1447]
[1448]
[1449]
[1450]
[1451]
[1452]
[1453]
[1454]
[1455]
[1456]
[1457]
[1458]
[1459][1460]
在本发明的一个实施方案中,所述放射性核素用于诊断。优选地,所述放射性同位素选自但不限于
43
sc、
44
sc、
51
mn、
52
mn、
64
cu、
67
ga、
68
ga、
86
y、
89
zr、
94m
tc、
99m
tc、
111
in、
152
tb、
155
tb、
177
lu、
201
tl、
203
pb、
18
f、
76
br、
77
br、
123
i、
124
i、
125
i。更优选地,所述放射性核素选自
43
sc、
44
sc、
64
cu、
67
ga、
68
ga、
86
y、
89
zr、
99m
tc、
111
in、
152
tb、
155
tb、
203
pb、
18
f、
76
br、
77
br、
123
i、
124
i、
125
i。甚至更
优选地,所述放射性核素选自
64
cu、
68
ga、
89
zr、
99m
tc、
111
in、
18
f、
123
i和
124
i。然而,本领域技术人员意识到,所述放射性核素的用途不限于诊断目的,而是包括在与本发明的化合物缀合时在治疗和治疗诊断中的用途。
[1461]
在本发明的一个实施方案中,所述放射性核素用于治疗。优选地,所述放射性同位素选自
47
sc、
67
cu、
89
sr、
90
y、
111
in、
153
sm、
149
tb、
161
tb、
177
lu、
186
re、
188
re、
212
pb、
213
bi、
223
ra、
225
ac、
226
th、
227
th、
131
i、
211
at。更优选地,所述放射性同位素选自
47
sc、
67
cu、
90
y、
177
lu、
188
re、
212
pb、
213
bi、
225
ac、
227
th、
131
i、
211
at。甚至更优选地,所述放射性核素选自
90
y、
177
lu、
225
ac、
227
th、
131
i和
211
at。然而,本领域技术人员意识到,所述放射性核素的用途不限于治疗目的,而是包括在与本发明的化合物缀合时在诊断和治疗诊断中的用途。
[1462]
在一个实施方案中,本发明的化合物以药学可接受的盐的形式呈现。
[1463]
本发明化合物的“药学可接受的盐”优选是酸盐或碱盐,其被本领域普遍认为适用于与人或动物组织接触而无过度毒性或致癌性,并且优选没有刺激性、过敏反应或者其它问题或并发症。此类盐包括碱性残基如胺的无机酸盐和有机酸盐,以及酸性残基如羧酸的碱金属盐或有机盐。本发明的化合物能够形成内盐,其也是药学上可接受的盐。
[1464]
合适的药学上可接受的盐包括但不限于酸的盐,例如盐酸、磷酸、氢溴酸、苹果酸、乙醇酸、富马酸、硫酸、氨基磺酸、磺胺酸、甲酸、甲苯磺酸、甲磺酸、苯磺酸、乙二磺酸、2-羟基乙基磺酸、硝酸、苯甲酸、2-乙酰氧基苯甲酸、柠檬酸、酒石酸、乳酸、硬脂酸、水杨酸、戊二酸、抗坏血酸、双羟萘酸、琥珀酸、富马酸、马来酸、丙酸、羟基马来酸、氢碘酸、苯乙酸、链烷酸如乙酸、hooc-(ch2)
n-cooh,其中n是0至4的任何整数,即0、1、2、3、或4等。类似地,药学上可接受的阳离子包括但不限于钠、钾、钙、铝、锂和铵。本领域普通技术人员将认识到本文提供的化合物的其它药学上可接受的盐。一般而言,可通过任何常规化学方法从含有碱性或酸性部分的母体化合物合成药学上可接受的酸或碱盐。简而言之,可以通过使这些化合物的游离酸或碱形式与化学计算量的合适碱或酸在水中、在有机溶剂中或在两者的混合物中反应来制备这种盐。一般来说,优选使用非水介质,如乙醚、乙酸乙酯、乙醇、异丙醇或乙腈。
[1465]
本发明化合物的“药学上可接受的溶剂化物”优选是通过一种或多种溶剂分子与本发明化合物的一个或多个分子缔合形成的本发明化合物的溶剂化物。优选地,所述溶剂是本领域通常认为适合用于与人或动物的组织接触而没有过度毒性或致癌性,并且优选没有刺激性、过敏反应或者其它问题或并发症的溶剂。此类溶剂包括有机溶剂,如醇、醚、酯和胺。
[1466]
本发明化合物的“水合物”是通过一个或多个水分子与本发明化合物的一个或多个分子缔合而形成。这种水合物包括但不限于半水合物、一水合物、二水合物、三水合物和四水合物。与水合物组成无关,所有水合物通常被认为是药学上可接受的。
[1467]
本发明化合物对fap具有高结合亲和性,以及对fap具有高抑制活性。由于这种高结合亲和性,本发明的化合物作为靶向剂以及如果与另一部分缀合时作为靶向部分是有效的、有用的和/或适合的。如本文优选使用的,靶向剂是与靶分子相互作用的制剂,所述靶分子在此情况中是所述fap。就本发明的化合物由此靶向的细胞和组织而言,表达所述fap的任何细胞和组织分别被靶向或可以被靶向。
[1468]
在一实施方案中,所述化合物与成纤维细胞活化蛋白(fap)相互作用,优选与具有seq id no:1的氨基酸序列的人fap或其同系物相互作用,其中所述同系物的氨基酸序列与
fap具有相同性,所述相同性为seq id no:1的氨基酸序列的至少85%。在优选的实施方案中,所述相同性为90%,优选95%、96%、97%、98%或99%。
[1469]
可以如本领域技术人员已知的那样确定两个核酸分子之间的相同性。更具体地,基于指定的程序参数,可以使用序列比较算法来计算测试序列相对于参考序列的序列同源性百分比。测试序列优选是这样的序列或蛋白质或多肽,其相对于不同的蛋白质或多肽,被称为是相同的,或被测试是否相同以及如果相同,在多大程度上相同,其中这种不同的蛋白质或多肽也被称为参考序列并且优选是野生型的蛋白质或多肽,更优选是seq id no:1的人fap。
[1470]
用于比较的序列的最佳比对可以例如通过smith&waterman的局部同源算法(smith,et al.,advances in applied mathematics,1981,2:482)、通过needleman&wunsch的同源比对算法(needleman,et al.,j mol biol,1970,48:443)、通过pearson&lipman的相似性搜索方法(pearson,et al.,proc natl acad sci u s a,1988,85:2444)、通过这些算法的计算机化执行程序(gap,bestfit,fasta和tfasta,在wisconsin genetics软件包中,genetics computer group,575science dr.,madison,wis.),或通过目视检查而进行。
[1471]
适用于确定序列相同性百分比的算法的一个实例是在局部序列比对检索基本工具中使用的算法(以下称为“blast”),见例如altschul等人,1990(altschul,et al.,j mol biol,1990,215:403)和altschul et al.,1997(altschul,et al.,nucleic acids res,1997,25:3389)。用于执行blast分析的软件可通过国家生物技术信息中心(以下简称ncbi)公开获得。mcginnis等人(mcginnis,et al.,nucleic acids res,2004,32:w20)描述了使用得自ncbi的软件确定序列相同性的默认参数,所述软件例如是blastn(用于核苷酸序列)和blastp(用于氨基酸序列)。
[1472]
在本发明的范围内,本发明的化合物用于或供用于治疗如本文公开的疾病的方法。这种方法优选包括向有需要的个体施用治疗有效量的本发明化合物的步骤。这种方法包括但不限于治愈性或辅助性癌症治疗。其在不可能治愈且以局部疾病控制或症状缓解为目的的情况中用作姑息治疗,或在治疗具有生存获益的情况中用作治疗性治疗且其可以是治愈性的。
[1473]
治疗本文公开的疾病的方法包括治疗本文公开的疾病,包括肿瘤和癌症,并且可以用作主要疗法或用作二线、三线、四线或最终疗法。将本发明的化合物与其它治疗方法联合使用也在本发明范围内。本领域技术人员众所周知,包括治愈性、辅助性、新辅助性、治疗性或姑息性治疗等的精确治疗意图将取决于肿瘤类型、位置和阶段以及患者的总体健康状况。
[1474]
在本发明的一实施方案中,所述疾病选自:瘤nos,良性瘤,不确定良性还是恶性的瘤,恶性瘤,转移性瘤,不确定原发还是转移的恶性瘤,良性肿瘤细胞,不确定良性或恶性的肿瘤细胞,恶性肿瘤细胞,小细胞型恶性肿瘤,巨细胞型恶性肿瘤,梭形细胞型恶性肿瘤,上皮瘤nos,良性上皮肿瘤,原位癌nos,癌nos,癌转移nos,癌扩散,良性上皮瘤,恶性上皮瘤,大细胞癌nos,未分化型癌nos,间变型癌nos,多形性癌,巨细胞和梭形细胞癌,巨细胞癌,梭形细胞癌,假肉瘤,多角细胞癌,球状细胞癌,微小瘤,小细胞癌nos,燕麦形细胞癌,小细胞癌,梭形细胞型、乳头状和鳞状细胞瘤,乳头状瘤nos,原位乳头状癌,乳头状癌nos,疣状乳
头状瘤,疣状癌nos,鳞状细胞乳头状瘤,乳头状鳞状细胞癌,倒置乳头状瘤,乳头状瘤病nos,原位鳞状细胞癌nos,鳞状细胞癌nos,鳞状细胞癌转移nos,角化型鳞状细胞癌nos,大细胞非角化型鳞状细胞癌,小细胞非角化型鳞状细胞癌,梭形细胞型鳞状细胞癌,腺样鳞状细胞癌,不确定基质侵袭的原位鳞状细胞癌,微浸润型鳞状细胞癌,queyrat增殖性红斑,bowen病,淋巴上皮癌,基底细胞瘤,基底细胞肿瘤,基底细胞癌nos,多中心基底细胞癌,硬斑病型基底细胞癌,纤维上皮型基底细胞癌,基底鳞状癌,异型癌,jadassohn表皮内上皮瘤,毛上皮瘤,毛囊瘤,外毛根鞘瘤,毛母质瘤,移行细胞乳头状瘤和癌,移行细胞乳头状瘤nos,尿路上皮乳头状瘤,原位移行细胞癌,移行细胞癌nos,施奈德乳头状瘤,倒置型移行细胞乳头状瘤,施奈德癌,梭形细胞型移行细胞癌,基底细胞样癌,泄殖腔癌,乳头状移行细胞癌,腺瘤和腺癌,腺瘤nos,支气管腺瘤nos,原位腺癌,腺癌nos,转移性腺癌nos,硬腺癌,皮革状囊胃,表浅扩散性腺癌,肠型腺癌,扩散型癌,单形性腺瘤,基底细胞腺瘤,胰岛细胞腺瘤,胰岛细胞癌,胰岛瘤nos,恶性胰岛瘤,胰高血糖素瘤,恶性胰高血糖素瘤nos,胃泌素瘤nos,恶性胃泌素瘤,混合型胰岛细胞和外分泌腺癌,胆管腺瘤,胆管癌,胆管囊腺瘤,胆管囊腺癌,肝细胞腺瘤,肝细胞癌nos,良性肝胆管瘤,肝细胞癌合并胆管癌,小梁腺瘤,小梁腺癌,胚胎性腺瘤,外分泌腺真皮圆柱瘤,腺样囊性癌,筛状癌,腺瘤性息肉nos,腺瘤性息肉中的腺癌,管状腺瘤nos,管状腺癌,腺瘤性结肠息肉病,腺瘤性结肠息肉病中的腺癌,多发性腺瘤性息肉,实体癌nos,单纯癌,类癌瘤nos,恶性类癌瘤,类癌瘤银质瘤nos,恶性类癌瘤银质瘤,类癌瘤非银质瘤nos,恶性类癌瘤非银质瘤,恶性黏液类癌,复合类癌,肺腺瘤病,细支气管-肺泡腺癌,肺泡腺瘤,肺泡腺癌,乳头状腺瘤nos,乳头状腺癌nos,绒毛状腺瘤nos,绒毛状腺瘤中腺癌,绒毛状腺癌,管状绒毛状腺瘤,嫌色细胞腺瘤,嫌色细胞癌,嗜酸细胞腺瘤,嗜酸细胞癌,混合型嗜酸细胞-嗜碱细胞腺瘤,混合型嗜酸细胞-嗜碱细胞癌,亲氧性腺瘤,亲氧性腺癌,嗜碱细胞腺瘤,嗜碱细胞癌,透明细胞腺瘤,透明细胞腺癌nos,肾性肿瘤,肾细胞癌,透明细胞腺纤维瘤,颗粒细胞癌,主细胞腺瘤,水透明细胞腺瘤,水透明细胞腺癌,混合细胞腺瘤,混合细胞腺癌,脂肪腺瘤,滤泡状腺瘤,滤泡状腺癌nos,高分化型滤泡状腺癌,小梁型滤泡状腺癌,微滤泡腺瘤,大滤泡腺瘤,乳头状和滤泡状腺癌,无包膜硬化型癌,多发性内分泌腺瘤,肾小球旁肿瘤,肾上腺皮质腺瘤nos,肾上腺皮质癌,紧凑细胞型肾上腺皮质腺瘤,重度色素变异型肾上腺皮质腺瘤,透明细胞型肾上腺皮质腺瘤,肾小球细胞型肾上腺皮质腺瘤,混合细胞型肾上腺皮质腺瘤,子宫内膜样腺瘤nos,子宫内膜样腺瘤,交界性恶性肿瘤,子宫内膜样癌,子宫内膜样腺纤维瘤nos,子宫内膜样腺纤维瘤交界性恶性肿瘤,恶性子宫内膜样腺纤维瘤,附件和皮肤附属器肿瘤,皮肤附属器腺瘤,皮肤附属器癌,汗腺腺瘤,汗腺肿瘤nos,汗腺腺癌,顶泌腺瘤,顶泌腺癌,小汗腺顶螺旋体瘤,小汗腺螺旋腺瘤,汗腺囊瘤,乳头状汗腺囊瘤,乳头状汗腺腺瘤,汗管瘤nos,皮脂腺瘤,皮脂腺癌,蜡样腺瘤,蜡样腺癌,粘液表皮样肿瘤赘生物,粘液表皮样肿瘤,粘液表皮样囊性癌,粘液性和浆液性肿瘤,囊腺瘤nos,囊腺癌nos,浆液性囊腺瘤nos,浆液性囊腺瘤交界性恶性肿瘤,浆液性囊腺癌nos,乳头状囊腺瘤nos,乳头状囊腺瘤交界性恶性肿瘤,乳头状囊腺癌nos,乳头状浆液性囊腺瘤nos,乳头状浆液性囊腺瘤交界性恶性肿瘤,乳头状浆液性囊腺癌,浆液性表面乳头状瘤nos,浆液性表面乳头状瘤交界性恶性肿瘤,浆液性表面乳头状癌,粘液性囊腺瘤nos,粘液性囊腺瘤交界性恶性肿瘤,粘液性囊腺癌nos,乳头状粘液性囊腺瘤nos,乳头状粘液性囊腺瘤交界性恶性肿瘤,乳头状粘液性囊腺癌,粘液性腺瘤,粘液性腺癌,腹膜假粘液
瘤,产生粘蛋白的腺癌,印戒细胞癌,转移的印戒细胞癌,导管,小叶和髓质肿瘤,非浸润性导管内癌nos,浸润性导管癌,粉刺性癌,非浸润性粉刺性癌nos,青少年乳腺癌,导管内乳头状瘤,非浸润性导管内乳头状腺癌,囊内乳头状腺瘤,非浸润性囊内癌,导管内乳头状瘤病nos,乳晕下导管乳头瘤病,髓样癌nos,髓样癌伴淀粉样基质,髓样癌伴淋巴样基质,原位小叶癌,小叶癌nos,浸润性导管癌,炎性癌,乳腺佩吉特病,佩吉特病和乳腺浸润性导管癌,乳腺外佩吉特病,腺泡细胞肿瘤赘生物,腺泡细胞腺瘤,腺泡细胞肿瘤,腺泡细胞癌,复杂上皮肿瘤,腺鳞癌,腺淋巴瘤,腺癌伴鳞状上皮化生,腺癌伴软骨和骨化生,腺癌伴梭形细胞化生,腺癌伴大汗腺化生,良性胸腺瘤,恶性胸腺瘤,特化性腺瘤,性索间质瘤,泡膜细胞瘤nos,膜细胞癌,黄体瘤nos,颗粒细胞瘤nos,恶性颗粒细胞瘤,颗粒细胞膜细胞瘤,良性雄性细胞瘤,男性母细胞瘤nos,恶性男性母细胞瘤,间质细胞瘤,男性细胞瘤,管状男性母细胞瘤nos,支持细胞癌,具有脂质储存的管状男性母细胞瘤,良性支持细胞瘤,支持细胞瘤nos,恶性支持细胞瘤,门细胞瘤,卵巢脂质细胞瘤,肾上腺剩余肿瘤,副神经节瘤和血管球瘤,副神经节瘤nos,恶性副神经节瘤,交感神经副神经节瘤,副交感神经节瘤,颈静脉球瘤,主动脉体瘤,颈动脉体瘤,肾上腺外副神经节瘤nos,恶性肾上腺外副神经节瘤,嗜铬细胞瘤nos,恶性嗜铬细胞瘤,血管球肉瘤,血管球肿瘤,血管球瘤,痣和黑色素瘤,色素痣nos,恶性黑色素瘤nos,结节性黑色素瘤,气球状细胞痣,气球细胞黑色素瘤,晕痣,鼻部纤维性丘疹,真皮内痣,巨细胞痣,无色素痣,无黑素性黑素瘤,交界痣,交界痣恶性黑色素瘤,癌前黑色素沉着病nos,恶性癌前黑色素沉着病,哈金森黑色素雀斑,哈金森黑色素雀斑中恶性黑色素瘤,浅表扩散性黑色素瘤,皮内痣,复合痣,巨大色素痣,巨大色素痣中恶性黑色素瘤,上皮样和梭形细胞痣,上皮样细胞黑色素瘤,梭形细胞黑色素瘤nos,梭形细胞黑色素瘤a型,梭形细胞黑色素瘤b型,混合上皮样和梭形细胞黑色素瘤,蓝色痣nos,恶性蓝色痣,细胞蓝痣,软组织肿瘤和肉瘤nos,软组织肿瘤,良性肉瘤nos,肉瘤病nos,梭形细胞肉瘤,巨细胞肉瘤,小细胞肉瘤,上皮样细胞肉瘤,纤维瘤性肿瘤,纤维瘤nos,纤维肉瘤nos,纤维粘液瘤,纤维粘液肉瘤,骨膜纤维瘤,骨膜纤维肉瘤,筋膜纤维瘤,筋膜纤维肉瘤,婴儿纤维肉瘤,弹性纤维瘤,侵袭性纤维瘤病,腹部纤维瘤病,成纤维性纤维瘤,纤维性组织细胞瘤nos,非典型纤维性组织细胞瘤,恶性纤维性组织细胞瘤,纤维黄瘤nos,非典型纤维黄瘤,恶性纤维黄瘤,皮肤纤维瘤nos,隆突性皮肤纤维瘤,皮肤纤维肉瘤nos,粘液瘤,粘液瘤nos,粘液肉瘤,脂肪瘤,脂肪瘤nos,脂肪肉瘤nos,纤维脂肪瘤,高分化型脂肪肉瘤,纤维粘液脂肪瘤,粘液样脂肪肉瘤,圆细胞脂肪肉瘤,多形脂肪肉瘤,混合型脂肪肉瘤,肌内脂肪瘤,梭形细胞脂肪瘤,血管平滑肌脂肪瘤,血管平滑肌脂肪肉瘤,血管脂肪瘤nos,浸润性血管脂肪瘤,骨髓脂肪瘤,蛰伏脂瘤,成脂细胞瘤病,肌瘤性肿瘤,平滑肌瘤nos,血管内平滑肌瘤,平滑肌肉瘤nos,上皮样平滑肌瘤,上皮样平滑肌肉瘤,细胞平滑肌瘤,奇异型平滑肌瘤,血管肌瘤,血管肌肉瘤,肌瘤,肌肉瘤,横纹肌瘤nos,横纹肌肉瘤nos,多形性横纹肌肉瘤,混合型横纹肌肉瘤,胎儿横纹肌瘤,成人横纹肌瘤,胚胎性横纹肌肉瘤,腺泡横纹肌肉瘤,复杂的混合和间质肿瘤,子宫内膜间质肉瘤,淋巴管内间质肌病,腺肌瘤,多形性腺瘤,混合瘤,恶性mullerian混合瘤nos,中胚层混合瘤,中胚层肾瘤,肾母细胞瘤nos,上皮性肾母细胞瘤,间叶性肾母细胞瘤,肝母细胞瘤,癌肉瘤nos,胚胎型癌肉瘤,肌上皮瘤,良性间质瘤,间质瘤nos,恶性间充质瘤,胚胎肉瘤,纤维上皮肿瘤,布伦纳瘤nos,布伦纳瘤,交界性恶性肿瘤,恶性布伦纳瘤,纤维腺瘤nos,管内型纤维腺瘤nos,管周型纤维腺瘤,腺纤维瘤nos,浆液性腺纤维瘤,粘液性腺纤
维瘤,细胞管内纤维腺瘤,叶状囊肉瘤nos,恶性叶状囊肉瘤,幼年纤维腺瘤,滑膜肿瘤,良性滑膜瘤,滑膜肉瘤nos,梭形细胞型滑膜肉瘤,上皮细胞型滑膜肉瘤,双相型滑膜肉瘤,透明细胞肌腱和腱膜肉瘤,间皮瘤,良性间皮瘤,恶性间皮瘤,良性纤维间皮瘤,恶性纤维间皮瘤,良性上皮样间皮瘤,恶性上皮样间皮瘤,双相型良性间皮瘤,双相型恶性间皮瘤,腺瘤样肿瘤nos,生殖细胞肿瘤,无性细胞瘤,精原细胞瘤nos,未分化型精原细胞瘤,精母细胞性精原细胞瘤,生殖细胞瘤,胚胎癌nos,内胚窦瘤,多胚瘤,性腺胚细胞瘤,良性畸胎瘤,畸胎瘤nos,恶性畸胎瘤nos,畸胎癌,未分化型恶性畸胎瘤,中间型恶性畸胎瘤,皮样囊肿,恶性转化的皮样囊肿,甲状腺肿样卵巢瘤,恶性甲状腺肿样卵巢瘤,间质类癌,滋养细胞肿瘤,葡萄胎nos,侵袭性葡萄胎,绒毛膜癌,绒毛膜癌合并畸胎瘤,恶性滋养细胞畸胎瘤,中肾瘤,良性中肾瘤,中肾肿瘤,恶性中肾瘤,输卵管内膜瘤,血管肿瘤,血管瘤nos,血管肉瘤,海绵状血管瘤,静脉血管瘤,蔓状血管瘤,枯否细胞肉瘤,良性血管内皮瘤,血管内皮瘤nos,恶性血管内皮瘤,毛细血管瘤,肌内血管瘤,卡波西肉瘤,血管角质瘤,疣状角化性血管瘤,良性血管外皮细胞瘤,血管外皮细胞瘤nos,恶性血管外皮细胞瘤,血管纤维瘤nos,成血管细胞瘤,淋巴管肿瘤,淋巴管瘤nos,淋巴管肉瘤,毛细淋巴管瘤,海绵状淋巴管瘤,囊性淋巴管瘤,淋巴管肌瘤,淋巴管肌瘤增生,血管淋巴管瘤,骨瘤和骨肉瘤,骨瘤nos,骨肉瘤nos,成软骨细胞型骨肉瘤,成纤维细胞型骨肉瘤,毛细血管扩张型骨肉瘤,佩吉特骨病中的骨肉瘤,近皮质骨肉瘤,骨样骨瘤nos,成骨细胞瘤,软骨肿瘤,骨软骨瘤,骨软骨瘤病nos,软骨瘤nos,软骨瘤病nos,软骨肉瘤nos,近皮质软骨瘤,近皮质软骨肉瘤,成软骨细胞瘤nos,恶性成软骨细胞瘤,间叶性软骨肉瘤,软骨粘液样纤维瘤,巨细胞肿瘤,骨巨细胞肿瘤nos,恶性骨巨细胞瘤,软组织巨细胞瘤nos,软组织恶性巨细胞瘤,各种骨肿瘤,尤文氏肉瘤,长骨釉质瘤,骨化纤维瘤,牙源性肿瘤,良性牙源性肿瘤,牙源性肿瘤nos,恶性牙源性肿瘤,牙质瘤,牙骨质瘤nos,良性成牙骨质细胞瘤,牙骨质化纤维瘤,巨大牙骨质瘤,牙瘤nos,组合性牙瘤,混合性牙瘤,成釉细胞纤维性牙瘤,成釉细胞性牙肉瘤,腺瘤样牙源性肿瘤,钙化性牙源性囊肿,成釉细胞瘤nos,恶性成釉细胞瘤,牙成釉细胞瘤,牙源性鳞状细胞肿瘤,牙源性粘液瘤,牙源性纤维瘤nos,成釉细胞纤维瘤,成釉细胞纤维肉瘤,钙化上皮牙源性肿瘤,其它肿瘤,颅咽管瘤,松果体瘤,松果体细胞瘤,松果体母细胞瘤,黑色素神经外胚层肿瘤,脊索瘤,胶质瘤,恶性胶质瘤,脑胶质瘤病,混合性胶质瘤,室管膜下血管内膜样胶质细胞瘤,室管膜下巨细胞星形细胞瘤,脉络丛乳头状瘤nos,恶性脉络丛乳头状瘤,室管膜瘤nos,变性型室管膜瘤间,乳头状室管膜瘤,粘液乳头状室管膜瘤,星形细胞瘤nos,间变性型星形细胞瘤,原生质星形细胞瘤,肥胖型星形胶质细胞瘤,纤维状星形细胞瘤,毛细胞型星形细胞瘤,成胶质细胞瘤nos,极性海绵状母细胞瘤,星形母细胞瘤,成胶质细胞瘤nos,巨细胞成胶质细胞瘤,具有肉瘤成分的成胶质细胞瘤,原始极性成胶质细胞瘤,少突神经胶质细胞瘤nos,间变型少突神经胶质细胞瘤,成少突神经胶质细胞瘤,成神经管细胞瘤nos,促结缔组织增生性髓母细胞瘤,髓成肌细胞瘤,小脑肉瘤nos,怪细胞肉瘤,神经上皮瘤样肿瘤,神经节瘤,成神经节细胞瘤,神经节瘤病,成神经细胞瘤nos,髓质上皮瘤nos,畸胎样髓上皮瘤,神经上皮瘤nos,海绵状神经母细胞瘤,神经节神经胶质瘤,神经节神经胶质瘤,pacinian肿瘤,视网膜母细胞瘤nos,分化型视网膜母细胞瘤,未分化型视网膜母细胞瘤,嗅觉神经源性肿瘤,感觉神经细胞瘤,嗅神经母细胞瘤,感觉神经上皮瘤,脑膜瘤,脑膜瘤nos,脑膜瘤病nos,恶性脑膜瘤,脑膜瘤性脑膜瘤,纤维性脑膜瘤,砂粒体型脑膜瘤,血管瘤性脑膜瘤,成血管细胞性脑膜瘤,
血管外皮细胞性脑膜瘤,过渡型脑膜瘤,乳头状脑膜瘤,脑膜的肉瘤病,神经鞘肿瘤,神经纤维瘤nos,神经纤维瘤病nos,神经纤维肉瘤,黑色素型神经纤维瘤,丛状神经纤维瘤,神经鞘膜瘤nos,神经鞘瘤病,恶性神经鞘膜瘤,神经瘤nos,颗粒细胞肿瘤和腺泡状软组织肉瘤,颗粒细胞肿瘤nos,恶性颗粒细胞肿瘤,腺泡状软组织肉瘤,淋巴瘤nos或弥漫型、良性淋巴瘤肿瘤,恶性淋巴瘤nos,非霍奇金型恶性淋巴瘤,未分化细胞型恶性淋巴瘤nos,干细胞型恶性淋巴瘤,曲核细胞型恶性淋巴瘤nos,淋巴肉瘤nos,淋巴浆细胞型恶性淋巴瘤,免疫母细胞型恶性淋巴瘤,混合淋巴细胞-组织细胞型恶性淋巴瘤nos,中心母细胞-中心细胞弥漫型恶性淋巴瘤,恶性淋巴瘤滤泡中心细胞nos,淋巴细胞高分化型恶性淋巴瘤nos,淋巴细胞中等分化型恶性淋巴瘤nos,中心细胞型恶性淋巴瘤,滤泡中心细胞分裂型恶性淋巴瘤nos,淋巴细胞低分化型恶性淋巴瘤nos,幼淋巴细胞淋巴肉瘤,恶性淋巴瘤中心母细胞型nos,滤泡中心细胞非裂型恶性淋巴瘤,网状细胞肉瘤,网状细胞肉瘤nos,多形性细胞型网状肉瘤,结节型网状肉瘤,霍奇金病,霍奇金病nos,淋巴细胞优势型霍奇金病,混合细胞型霍奇金病,淋巴细胞耗竭型霍奇金病nos,淋巴细胞耗竭弥漫性纤维化型霍奇金病,淋巴细胞耗竭网状型霍奇金病,结节硬化型症霍奇金病,结节硬化型霍奇金病细胞期,霍奇金病副肉芽肿,霍奇金病肉芽肿,霍奇金肉瘤,结节或滤泡型淋巴瘤,结节型恶性淋巴瘤nos,混合淋巴细胞-组织细胞结节型恶性淋巴瘤,中心母细胞型-中心细胞滤泡型恶性淋巴瘤,淋巴细胞高分化结节型恶性淋巴瘤,淋巴细胞中等分化结节型恶性淋巴瘤,滤泡中心细胞分裂滤泡型恶性淋巴瘤,淋巴细胞低分化结节型恶性淋巴瘤,中心母细胞型滤泡型恶性淋巴瘤,滤泡中心细胞非分裂滤泡型恶性淋巴瘤,蕈样真菌病,蕈样真菌病,sezary病,各种网状内皮组织瘤,小神经胶质细胞瘤,恶性组织细胞增多病,组织细胞性髓性网状细胞增生症,letterer-siwe病,浆细胞肿瘤,浆细胞骨髓瘤,良性浆细胞瘤,浆细胞瘤nos,恶性浆细胞瘤,肥大细胞肿瘤,肥大细胞瘤nos,肥大细胞肉瘤,恶性肥大细胞增多症,burkitt肿瘤,burkitt肿瘤,白血病,白血病nos,急性白血病nos,亚急性白血病nos,慢性白血病nos,非白血性白血病nos,复合型白血病,复合白血病,淋巴性白血病,淋巴性白血病nos,急性淋巴性白血病,亚急性淋巴性白血病,慢性淋巴性白血病,非白血性淋巴性白血病,幼淋巴细胞性白血病,浆细胞性白血病,浆细胞白血病,红白血病,红白血病,急性红细胞增多症,慢性红细胞增多症,淋巴肉瘤细胞性白血病,淋巴肉瘤细胞白血病,髓系白血病,髓系白血病nos,急性髓系白血病,亚急性髓系白血病,慢性髓系白血病,非白血性髓系白血病,中性粒细胞性白血病,急性早幼粒细胞白血病,嗜碱性粒细胞性白血病,嗜碱性粒细胞白血病,嗜酸性粒细胞性白血病,嗜酸性粒细胞白血病,单核细胞白血病,单核细胞白血病nos,急性单核细胞白血病,亚急性单核细胞白血病,慢性单核细胞白血病,非白血性单核细胞白血病,其它白血病,肥大细胞白血病,巨核细胞白血病,巨核细胞骨髓组织增生病,骨髓性肉瘤,毛细胞白血病,各种骨髓增生和淋巴增生性疾病,真性红细胞增多症,急性全髓白血病,慢性骨髓增生性疾病,骨髓硬化伴髓样化生,特发性血小板增多症,慢性淋巴增生性疾病。
[1475]
在本发明的一实施方案中,所述疾病选自胰腺肿瘤,胰腺腺癌,胰头肿瘤,胰体肿瘤,胰尾肿瘤,胰管肿瘤,胰岛肿瘤,胰颈肿瘤,前列腺肿瘤,前列腺腺癌,前列腺腺体,神经内分泌肿瘤,乳腺癌,乳房中央部分肿瘤,乳房内上象限,乳房内下象限,乳房外上象限,乳房外下象限,乳房腋尾,乳房的重叠病变,青少年乳腺癌,甲状旁腺肿瘤,骨髓瘤,肺癌,小细胞肺癌,非小细胞肺癌,主支气管肿瘤,肺上叶肿瘤,肺中叶肿瘤,肺下叶肿瘤,结直肠癌,升
结肠肿瘤,结肠肝曲肿瘤,横结肠肿瘤,结肠脾曲肿瘤,降结肠肿瘤,乙状结肠肿瘤,结肠的重叠病变,小肠肿瘤,肝脏肿瘤,肝细胞腺瘤,肝细胞癌,肝胆管瘤,联合的肝细胞癌和胆管癌,肝母细胞瘤,卵巢癌,肉瘤,骨肉瘤,纤维肉瘤,胃肠道间质瘤,胃肠道,胃癌,甲状腺癌,甲状腺髓样癌,甲状腺,肾细胞癌,肾盂肿瘤,膀胱肿瘤,膀胱癌,膀胱三角的肿瘤,膀胱顶肿瘤,膀胱侧壁肿瘤,膀胱后壁肿瘤,输尿管口肿瘤,脐尿管肿瘤,膀胱的重叠病变,基底细胞癌,基底细胞肿瘤赘生物,基底细胞肿瘤,基底细胞癌,多中心基底细胞癌,基底细胞样癌,基底细胞腺瘤,鳞状细胞癌,口腔鳞状细胞癌,喉鳞状细胞癌,宫颈癌,外子宫颈肿瘤,子宫颈的重叠病变,子宫颈治肿瘤,子宫峡部肿瘤,子宫肿瘤,卵巢肿瘤,食管肿瘤,食管胸段肿瘤,食管腹段肿瘤,食管上三分之一肿瘤,食管中三分之一肿瘤,食管下三分之一肿瘤,食管的重叠病变,子宫内膜癌,头颈癌,淋巴瘤,恶性间皮瘤,间皮肿瘤,间皮瘤,纤维间皮瘤,纤维间皮瘤,上皮样间皮瘤,上皮样间皮瘤,十二指肠癌,神经内分泌肿瘤,肺神经内分泌肿瘤,胰腺神经内分泌肿瘤,前肠神经内分泌肿瘤,中肠神经内分泌肿瘤,后肠神经内分泌肿瘤,胃肠胰神经内分泌肿瘤神经内分泌肿癌,乳腺神经内分泌肿瘤,卵巢神经内分泌肿瘤,睾丸癌,胸腺癌,胃肿瘤,胃底肿瘤,胃体肿瘤,胃窦肿瘤,幽门肿瘤,胃小弯肿瘤,胃大弯肿瘤,胃重叠病变,副神经节瘤,神经节瘤,黑色素瘤,恶性黑色素瘤,结节性黑色素瘤,无色素性黑色素瘤,浅表扩散性黑色素瘤,上皮样细胞黑色素瘤,梭形细胞黑色素瘤,混合上皮样和梭形细胞黑色素瘤。
[1476]
在又一实施方案中,前述适应症可以出现在选自以下的器官和组织:外上唇,外下唇,外唇nos,上唇粘膜,下唇粘膜,唇粘膜nos,唇连合处,唇重叠病变,舌底nos,舌背侧面nos,舌边缘,舌腹侧面nos,舌前2/3nos,舌扁桃体,舌重叠病变,舌nos,上牙龈,下牙龈,牙龈nos,口前底,口侧底,口底重叠病变,口底nos,硬腭,软腭nos,悬雍垂,腭重叠病变,腭nos,颊粘膜,口腔前庭,磨牙后区,口其它和非特定部分的重叠病变,口nos,腮腺,颌下腺,舌下腺,大唾液腺重叠病变,大唾液腺nos,扁桃体窝,扁桃体柱,扁桃体重叠病变,扁桃体nos,会厌谷,会厌前面,侧壁口咽,口咽后壁,鳃裂,口咽的重叠病变,口咽nos,鼻咽上壁,鼻咽后壁,鼻咽侧壁,鼻咽前壁,鼻咽的重叠病变,鼻咽nos,梨状隐窝,环状软骨后区,杓状会厌皱襞喉咽面,喉咽后壁,喉咽的重叠病变,喉咽nos,咽nos,咽喉,咽部淋巴环,唇口腔和咽部重叠病变,食管颈段,食管胸段,食管腹段,食管上三分之一,食管中三分之一,食管下三分之一,食管的重叠病变,食管nos,贲门,胃底,胃体,胃窦,幽门,胃小弯nos,胃大弯nos,胃的重叠病变,胃nos,十二指肠,空肠,回肠,麦克尔憩室,小肠的重叠病变,小肠nos,盲肠,阑尾,升结肠,结肠肝曲,横结肠,结肠脾曲,降结肠,乙状结肠,结肠的重叠病变,结肠nos,直肠乙状结肠交界处,直肠nos,肛门nos,肛管,泄殖腔源性区,直肠肛门和肛管的重叠病变,肝脏,肝内胆管,胆囊,肝外胆管,肝胰管壶腹,胆道的重叠病变,胆道nos,胰头,胰体,胰尾,胰管,胰岛,胰颈,胰腺的重叠病变,胰腺nos,肠道nos,消化系统的重叠病变,胃肠道nos,鼻腔,中耳,上颌窦,筛窦,额窦,蝶窦,副鼻窦的重叠病变,副鼻窦nos,声门,声门上,声门下,喉软骨,喉的重叠病变,喉nos,气管,主支气管,肺上叶,肺中叶,肺下叶,肺的重叠病变,肺nos,胸腺,心脏,前纵隔,后纵隔,纵隔nos,胸膜nos,心脏纵隔和胸膜的重叠病变,上呼吸道nos,呼吸系统和胸内器官的重叠病变,呼吸道nos,上肢长骨关节,上肢短骨关节,下肢长骨关节,下肢短骨关节,四肢骨关节和关节软骨的重叠病变,四肢骨nos,颅面骨,下颌骨,脊柱,肋骨胸骨锁骨,盆骨,骨关节和关节软骨的重叠病变,骨nos,血液,骨髓,脾脏,网状内皮
系统nos,造血系统,唇部皮肤nos,眼睑nos,外耳,面部皮肤,头皮颈部皮肤,躯干皮肤,上肢皮肤,下肢皮肤,头颈部周围神经,肩臂部周围神经,腿部周围神经,胸部周围神经,腹部周围神经,盆部周围神经,周围神经干,周围神经和自主神经系统的重叠病变,自主神经系统nos,腹膜后腔,腹膜,腹膜nos,腹膜后腔和腹膜的重叠病变,头部结缔组织,臂部结缔组织,腿部结缔组织,胸部结缔组织,腹部结缔组织,盆部结缔组织,躯干结缔组织nos,皮下结缔组织和其它软组织的重叠病变,结缔组织nos,乳头,乳房中央部分,乳房内上象限,乳房内下象限,乳房外上象限,乳房外下象限,乳房腋尾,乳房的重叠病变,乳房nos,大阴唇,小阴唇,阴蒂,外阴的重叠病变,外阴nos,阴道nos,子宫颈内膜,子宫颈外膜,子宫颈的重叠病变,子宫颈,子宫峡部,子宫内膜,子宫肌层,子宫底,子宫体的重叠病变,子宫体,子宫nos,卵巢,输卵管,阔韧带,圆韧带,子宫旁组织,子宫附件,沃尔夫氏体,女性生殖器官的重叠病变,女性生殖道nos,包皮,阴茎,阴茎体,阴茎的重叠病变,阴茎nos,前列腺,隐睾,下降睾丸,睾丸nos,附睾,精索,阴囊nos,鞘膜,男性生殖器官的重叠病变,男性生殖器官nos,肾nos,肾盂,输尿管,膀胱三角区,膀胱顶,膀胱侧壁,膀胱后壁,输尿管口,脐尿管,膀胱的重叠病变,膀胱nos,尿道,尿道旁腺,泌尿器官的重叠病变,泌尿系统nos,结膜,角膜,视网膜,脉络膜,睫状体,泪腺,眼眶nos,眼和附属器的重叠病变,眼nos,脑膜,脊膜,脑膜nos,大脑,额叶,颞叶,顶叶,枕叶,脑室,小脑nos,脑干,脑的重叠病变,脑nos,脊髓,马尾神经,嗅神经,视神经,听神经,颅神经nos,脑和中枢神经系统重叠病变,神经系统nos,甲状腺,肾上腺皮质,肾上腺髓质,肾上腺nos,甲状旁腺,脑垂体,颅咽管,松果体,颈动脉体,主动脉体,内分泌腺及相关结构的重叠病变,内分泌腺nos,头面部或颈部nos,胸部nos,腹部nos,盆部nos,上肢nos,下肢nos,其它不明确的部位,不明确部位的重叠病变,头面颈部淋巴结,胸腔内淋巴结,腹内淋巴结,腋下淋巴结,腿部淋巴结,腹股沟区淋巴结,盆腔淋巴结,多区域淋巴结,淋巴结nos,原发部位不明。
[1477]
用本技术公开和要求保护的化合物治疗的个体可以联合其它非手术抗增殖(例如抗癌)药物疗法进行治疗。在一个实施方案中,所述化合物可以与抗癌化合物例如细胞生长抑制化合物联合施用。细胞抑制化合物是抑制细胞生长和/或增殖的化合物(例如,小分子、核酸或蛋白质)。在一些实施方案中,细胞抑制化合物针对肿瘤的恶性细胞。在其它实施方案中,细胞抑制化合物是抑制血管平滑肌细胞或成纤维细胞生长和/或增殖的化合物。
[1478]
与本技术公开和权利要求的化合物联合使用的合适的抗增殖药物或细胞抑制化合物包括抗癌药。许多可以使用的抗癌药物是公知的,包括但不限于:阿西维辛(acivicin);阿柔比星(aclarubicin);盐酸阿考达唑(acodazole hydrochloride);阿克罗宁(acronine);阿多来新(adozelesin);阿地白介素(aldesleukin);六甲蜜胺(altretamine);安波霉素(ambomycin);乙酸阿美蒽醌(ametantrone acetate);氨鲁米特(aminoglutethimide);安吖啶(amsacrine);阿那曲唑(anastrozole);氨茴霉素(anthramycin);天冬酰胺酶(asparaginase);曲林菌素(asperlin);阿扎胞苷(azacitidine);阿扎替派(azetepa);阿佐霉素(azotomycin);巴马司他(batimastat);苄替哌(benzodepa);比卡鲁胺(bicalutamide);盐酸比生群(bisantrene hydrochloride);二甲磺酸双奈法德(bisnafide dimesylate);比折来新(bizelesin);硫酸博来霉素(bleomycin sulfate);布喹那钠(brequinar sodium);溴匹立明(bropirimine);白消安(busulfan);放线菌素c(cactinomycin);卡普睾酮(calusterone);卡醋胺(caracemide);
卡贝替姆(carbetimer);卡铂(carboplatin);卡莫司汀(carmustine);盐酸卡柔比星(carubicin hydrochloride);卡折来新(carzelesin);西地芬戈(cedefingol);苯丁酸氮芥(chlorambucil);西罗霉素(cirolemycin);顺铂(cisplatin);克拉屈滨(cladribine);crisnatol mesylate;环磷酰胺(cyclophosphamide);阿糖孢苷(cytarabine);达卡巴嗪(dacarbazine);放线菌素d(dactinomycin);盐酸柔红霉素(daunorubicin hydrochloride);地西他滨(decitabine);右奥马铂(dexormaplatin);地扎胍宁(dezaguanine);甲磺酸地扎胍宁(dezaguanine mesylate);地吖醌(diaziquone);多西他赛(docetaxel);阿霉素(doxorubicin);盐酸阿霉素(doxorubicin hydrochloride);屈洛昔芬(droloxifene);柠檬酸屈洛昔芬(droloxifene citrate);丙酸屈他雄酮(dromostanolone propionate);达佐霉素(duazomycin);依达曲沙(edatrexate);盐酸依氟鸟氨酸(eflornithine hydrochloride);依沙芦星(elsamitrucin);恩洛铂(enloplatin);恩普氨酯(enpromate);依匹哌啶(epipropidine);盐酸表阿霉素(epirubicin hydrochloride);厄布洛唑(erbulozole);盐酸依索比星(esorubicin hydrochloride);雌莫司汀(estramustine);雌莫司汀磷酸钠(estramustine phosphate sodium);依他硝唑(etanidazole);依托泊苷(etoposide);磷酸依托泊苷(etoposide phosphate);艾托卜宁(etoprine);盐酸法倔唑(fadrozole hydrochloride);法扎拉滨(fazarabine);芬维a胺(fenretinide);氟尿苷(floxuridine);磷酸氟达拉滨(fludarabine phosphate);氟尿嘧啶(fluorouracil);氟西他宾(fluorocitabine);磷喹酮(fosquidone);福司曲星钠(fostriecin sodium);吉西他滨(gemcitabine);盐酸吉西他滨(gemcitabine hydrochloride);羟基脲(hydroxyurea);盐酸伊达比星(idarubicin hydrochloride);异环磷酰胺(ifosfamide);伊莫福新(ilmofosine);干扰素α-2a;干扰素α-2b;干扰素α-n1;干扰素α-n3;干扰素β-i a;干扰素γ-i b;异丙铂(iproplatin);盐酸伊立替康(irinotecan hydrochloride);醋酸兰瑞肽(lanreotide acetate);来曲唑(letrozole);醋酸亮丙瑞林(leuprolide acetate);盐酸利阿唑(liarozole hydrochloride);洛美曲索钠(lometrexol sodium);洛莫司汀(lomustine);盐酸洛索蒽醌(losoxantrone hydrochloride);马索罗酚(masoprocol);美登素(maytansine);盐酸氮芥(mechlorethamine hydrochloride);醋酸甲地孕酮(megestrol acetate);醋酸美伦孕酮(melengestrol acetate);美法仑(melphalan);美诺立尔(menogaril);巯嘌呤(mercaptopurine);甲氨蝶呤(methotrexate);甲氨蝶呤钠(methotrexate sodium);氯苯氨啶(metoprine);美妥替哌(meturedepa);米丁度胺(mitindomide);米托卡星(mitocarcin);mitocromin;米托洁林(mitogillin);米托马星(mitomalcin);丝裂霉素(mitomycin);米托司培(mitosper);米托坦(mitotane);盐酸米托蒽醌(mitoxantrone hydrochloride);霉酚酸(mycophenolic acid);尼拉帕利(niraparib);诺考达唑(nocodazole);诺加霉素(nogalamycin);奥拉帕利(olaparib);奥马铂(ormaplatin);奥昔舒仑(oxisuran);紫杉醇(paclitaxel);培门冬酶(pegaspargase);培利霉素(peliomycin);戊氮芥(pentamustine);硫酸培洛霉素(peplomycin sulfate);培磷酰胺(perfosfamide);哌泊溴烷(pipobroman);哌泊舒凡(piposulfan);盐酸吡罗蒽醌(piroxantrone hydrochloride);普卡霉素(plicamycin);普洛美坦(plomestane);卟吩姆钠(porfimer sodium);泊非霉素(porfiromycin);泼尼莫司汀(prednimustine);盐酸丙卡
巴肼(procarbazine hydrochloride);嘌呤霉素(puromycin);盐酸嘌呤霉素(puromycin hydrochloride);吡唑呋喃菌素(pyrazofurin);利波腺苷(riboprine);罗谷亚胺(rogletimide);卢卡帕利(rucaparib);沙芬戈(safingol);盐酸沙芬戈(safingol hydrochloride);司莫司汀(semustine);辛曲秦(simtrazene);sparfosate sodium;司帕霉素(sparsomycin);盐酸锗螺胺(spirogermanium hydrochloride);螺莫司汀(spiromustine);螺铂(spiroplatin);链霉黑素(streptonigrin);链脲佐菌素(streptozocin);磺氯苯脲(sulofenur);他拉唑帕利(talazoparib);他利霉素(talisomycin);紫杉醇;泰索帝(taxotere);替可加兰钠(tecogalan sodium);喃氟啶(tegafur);盐酸替洛蒽醌(teloxantrone hydrochloride);替莫卟吩(temoporfin);替尼泊苷(teniposide);替罗昔隆(teroxirone);睾内酯(testolactone);硫咪嘌呤(thiamiprine);硫鸟嘌呤(thioguanine);噻替派(thiotepa);噻唑呋林(tiazofurin);替拉扎明(tirapazamine);盐酸拓扑替康(topotecan hydrochloride);柠檬酸托瑞米芬(toremifene citrate);乙酸曲托龙(trestolone acetate);磷酸曲西立滨(triciribine phosphate);三甲曲沙(trimetrexate);三甲曲沙葡糖醛酸酯(trimetrexate glucuronate);盐酸妥布氯唑(tubulozole hydrochloride);乌拉莫司汀(uracil mustard);乌瑞替派(uredepa);伐普肽(vapreotide);维利帕尼(velaparib);维替泊芬(verteporfin);硫酸长春花碱(vinblastine sulfate);硫酸长春新碱(vincristine sulfate);长春地辛(vindesine);硫酸长春地辛(vindesine sulfate);硫酸长春匹定(vinepidine sulfate);硫酸长春甘酯(vinglycinate sulfate);硫酸长春罗新(vinleurosine sulfate);酒石酸长春瑞滨(vinorelbine tartrate);硫酸长春罗定(vinrosidine sulfate);硫酸长春利定(vinzolidine sulfate);伏氯唑(vorozole);折尼铂(zeniplatin);净司他丁(zinostatin);和盐酸佐柔比星(zorubicin hydrochloride)。
[1479]
其它抗癌药物包括但不限于:20-epi-1,25二羟基维生素d3;5-乙炔基尿嘧啶;阿比特龙(abiraterone);酰基富烯;腺环戊醇(adecypenol);阿多来新(adozelesin);all-tk拮抗剂;氨莫司汀(ambamustine);amidox;氨磷汀(amifostine);氨基乙酰丙酸(aminolevulinic acid);氨柔比星(amrubicin);阿那格雷(anagrelide);穿心莲内酯(andrographolide);血管生成抑制剂;拮抗剂d;拮抗剂g;antarelix;抗背化形态发生蛋白-1(anti-dorsalizing morphogenetic protein-1);抗雌激素;抗瘤酮(antineoplaston);反义寡核苷酸;甘氨酸阿非迪霉素(aphidicolin glycinate);凋亡基因调节剂;凋亡调节剂;无嘌呤酸;ara-cdp-dl-ptba;精氨酸脱氨酶;asulacrine;阿他美坦(atamestane);阿莫司汀(atrimustine);axinastatin 1;axinastatin 2;axinastatin 3;阿扎司琼(azasetron);阿扎毒素(azatoxin);重氮酪氨酸(azatyrosine);浆果赤霉素(baccatin)iii衍生物;balanol;巴马司他(batimastat);bcr/abl拮抗剂;benzochlorins;苯甲酰星形孢菌素(benzoylstaurosporine);β-内酰胺衍生物;β-alethine;betaclamycin b;桦木酸;bfgf抑制剂;双吖丙啶基精胺(bisaziridinylspermine);双奈法德(bisnafide);bistratene a;breflate;布朵替坦(budotitane);丁硫氨酸亚砜胺(buthionine sulfoximine);钙泊三醇(calcipotriol);钙磷酸蛋白(calphostin)c;喜树碱衍生物;canarypox il-2;卡培他滨(capecitabine);甲酰胺-氨基-三唑;羧基酰胺三唑;carest m3;carn 700;软骨衍生的抑制剂;酪蛋白激酶抑制剂(icos);粟树精胺
(castanospermine);cecropin b;西曲瑞克(cetrorelix);二氢卟吩(chlorins);氯代喹喔啉磺酰胺(chloroquinoxaline sulfonamide);西卡前列素(cicaprost);顺式卟啉;氯米芬(clomifene)类似物;克霉唑(clotrimazole);collismycin a;collismycin b;康普瑞汀(combretastatin)a4;康普瑞汀类似物;conagenin;crambescidin 816;crisnatol;cryptophycin 8;cryptophycin a衍生物;curacin a;cyclopentanthraquinones;cycloplatam;cypemycin;阿糖胞苷ocfosfate;溶细胞因子;细胞抑素(cytostatin);达昔单抗(dacliximab);脱氢膜海鞘素b(dehydrodidemnin b);德舍瑞林(deslorelin);dexifosfamide;右雷佐生(dexrazoxane);右维拉帕米(dexverapamil);膜海鞘素b(didemnin b);didox;diethylnorspermin;二氢-5-氮杂胞苷;9-二氢紫杉醇(dihydrotaxol,9-);dioxamycin;二苯基螺莫司汀(spiromustine);二十二醇(docosanol);多拉司琼(dolasetron);去氧氟尿苷(doxifluridine);屈大麻酚(dronabinol);倍癌霉素(duocarmycin)sa;依布硒啉(ebselen);依考莫司汀(ecomustine);依地福新(edelfosine);依决洛单抗(edrecolomab);eflomithine;榄香烯(elemene);乙嘧替氟(emitefur);表阿霉素(epirubicin);依立雄胺(epristeride);雌莫司汀类似物;雌激素激动剂;雌激素拮抗剂;依他硝唑(etanidazole);磷酸依托泊苷(etoposide);依西美坦(exemestane);非格司亭(filgrastim);非那雄胺(finasteride);夫拉平度(flavopiridol);氟卓斯汀(flezelastine);氟甾酮(fluasterone);氟达拉滨(fludarabine);fluorodaunorunicin hydrochloride;福酚美克(forfenimex);福美司坦(formestane);福莫司汀(fotemustine);gadolinium texaphyrin;硝酸镓;加洛他滨(galocitabine);加尼瑞克(ganirelix);明胶酶抑制剂;谷胱甘肽抑制剂;hepsulfam;heregulin;六亚甲基二乙酰胺;金丝桃素(hypericin);伊班膦酸(ibandronic acid);艾多昔芬(idoxifene);伊决孟酮(idramantone);伊莫福新(ilmofosine);伊洛马司他(ilomastat);咪唑并吖啶酮类(imidazoacridones);咪喹莫特(imiquimod);免疫刺激肽;胰岛素样生长因子-i受体抑制剂;干扰素激动剂;干扰素;白介素;碘苄胍(iobenguane);碘阿霉素(iododoxorubicin);甘薯苦醇(ipomeanol),4-;伊立替康(irinotecan);伊罗普拉(iroplact);伊索拉定(irsogladine);isobengazole;isohomohalicondrin b;伊他司琼(itasetron);jasplakinolide;kahalalide f;片螺素-n三醋酸酯;兰瑞肽(lanreotide);雷拉霉素(leinamycin);来格司亭(lenograstim);硫酸香菇多糖(lentinan sulfate);来普他汀(leptolstatin);白血病抑制因子;白细胞α干扰素;亮丙瑞林(leuprolide) 雌激素 黄体酮;亮丙瑞林(leuprorelin);左旋咪唑(levamisole);利阿唑(liarozole);线性聚胺类似物;亲脂性二糖肽;亲脂性铂化合物;lissoclinamide 7;洛铂(lobaplatin);蚯蚓磷脂(lombricine);洛美曲索(lometrexol);氯尼达明(lonidamine);洛索蒽醌(losoxantrone);洛伐他汀(lovastatin);洛索立宾(loxoribine);勒托替康(lurtotecan);lutetium texaphyrin;lysofylline;裂解肽;美坦辛(maitansine);mannostatin a;马立马司他(marimastat);马索罗酚(masoprocol);乳腺丝抑蛋白(maspin);基质溶素(matrilysin)抑制剂;基质金属蛋白酶抑制剂;merbarone;meterelin;蛋氨酸酶(methioninase);甲氧氯普胺(metoclopramide);mif抑制剂;米非司酮(mifepristone);米替福新(miltefosine);米立司亭(mirimostim);错配的双链rna;米托胍腙(mitoguazone);二溴卫矛醇(mitolactol);丝裂霉素(mitomycin)类似物;米托萘胺
(mitonafide);mitotoxin成纤维细胞生长因子-皂草素;莫法罗汀(mofarotene);molgramostim;单克隆抗体,人绒毛膜促性腺激素;单磷酰脂a 分支杆菌细胞壁sk;莫哌达醇(mopidamol);多药耐药基因抑制剂;基于多肿瘤阻抑物1的疗法;氮芥抗癌化合物;mycaperoxide b;分支杆菌细胞壁提取物;myriaporone;n-乙酰地那林(dinaline);n-取代的苯甲酰胺;那法瑞林(nafarelin);nagrestip;纳洛酮 喷他佐辛;napavin;naphterpin;那托司亭(nartograstim);奈达铂(nedaplatin);奈莫柔比星(nemorubicin);奈立膦酸(neridronic acid);中性肽链内切酶;尼鲁米特(nilutamide);二左霉素(nisamycin);氮氧化物调节剂;硝基氧抗氧化剂;nitrullyn;o6-苄基鸟嘌呤;奥曲肽(octreotide);okicenone;寡核苷酸;奥那司酮(onapristone);昂丹司琼(ondansetron);昂丹司琼(ondansetron);oracin;口服细胞因子诱导剂;奥沙特隆(osaterone);奥沙利铂(oxaliplatin);oxaunomycin;紫杉醇(paclitaxel)类似物;紫杉醇衍生物;palauamine;棕榈酰根瘤菌素(palmitoylrhizoxin);帕米膦酸(pamidronic acid);人参炔三醇(panaxytriol);帕诺米芬(panomifene);parabactin;帕折普汀(pazelliptine);培门冬酶(pegaspargase);peldesine;戊聚糖聚硫酸钠;喷司他丁(pentostatin);pentrozole;全氟溴烷(perflubron);培磷酰胺(perfosfamide);紫苏醇(perillyl alcohol);phenazinomycin;乙酸苯酯;磷酸酶抑制剂;沙培林(picibanil);盐酸毛果芸香碱(pilocarpine hydrochloride);吡柔比星(pirarubicin);吡曲克辛(piritrexim);placetin a;placetin b;纤溶酶原激活物抑制剂;铂络合物;铂化合物;铂-三胺络合物;卟吩姆钠(porfimer sodium);甲基丝裂霉素(porfiromycin);丙基双-吖啶酮;前列腺素j2;蛋白酶体抑制剂;基于蛋白a的免疫调节剂;蛋白质激酶c抑制剂;蛋白质激酶c抑制剂,microalgal;蛋白质酪氨酸磷酸酶抑制剂;嘌呤核苷磷酸化酶抑制剂;羟基茜草素(purpurins);吡唑并吖啶(pyrazoloacridine);pyridoxylated血红蛋白聚氧乙烯缀合物;raf拮抗剂;雷替曲塞(raltitrexed);雷莫司琼(ramosetron);ras法尼基蛋白转移酶抑制剂;ras抑制剂;ras-gap抑制剂;脱甲基化瑞替普汀(retelliptine);re 186依替膦酸铼;利索新(rhizoxin);核酶;rii retinamide;罗希吐碱(rohitukine);罗莫肽(romurtide);罗喹美克(roquinimex);rubiginone b1;ruboxyl;saintopin;sarcnu;sarcophytol a;沙格司亭(sargramostim);sdi 1模拟物;衰老衍生的抑制剂1;有义寡核苷酸;信号转导抑制剂;信号转导调节剂;单链抗原结合蛋白;sizofuran;索布佐生(sobuzoxane);硼卡钠;苯乙酸钠;solverol;生长调节素结合蛋白;索纳明(sonermin);sparfosic acid;spicamycin d;螺莫司汀(spiromustine);斯耐潘定(splenopentin);海绵抑制素(spongistatin)1;角鲨胺(squalamine);干细胞抑制剂;干细胞分裂抑制剂;stipiamide;溶基质素抑制剂;sulfinosine;强效血管内皮肽拮抗剂;suradista;苏拉明(suramin);苦马豆素(swainsonine);合成的葡糖氨基葡聚糖;他莫司汀(tallimustine);他莫昔芬甲碘化物(tamoxifen methiodide);牛磺莫司汀(tauromustine);他扎罗汀(tazarotene);替可加兰钠(tecogalan sodium);替加氟(tegafur);tellurapyrylium;端粒酶抑制剂;替莫唑胺(temozolomide);四氯十氧化物(tetrachlorodecaoxide);tetrazomine;thaliblastine;沙利度胺(thalidomide);thiocoraline;血小板生成素;血小板生成素模拟物;胸腺法新(thymalfasin);促胸腺生成素受体激动剂;胸腺曲南(thymotrinan);甲状腺刺激激素;tin ethyl etiopurpurin;二氯二茂钛(titanocene dichloride);topsentin;托瑞米芬
(toremifene);全能干细胞因子;翻译抑制剂;维甲酸(tretinoin);三乙酰尿苷;曲西立滨(triciribine);托烷司琼(tropisetron);妥罗雄脲(turosteride);酪氨酸激酶抑制剂;tyrphostins;ubc抑制剂;乌苯美司(ubenimex);泌尿生殖窦衍生生长抑制因子;尿激酶受体拮抗剂;variolin b;载体系统,红细胞基因治疗;维拉雷琐(velaresol);藜芦胺(veramine);verdins;长春瑞滨(vinorelbine);vinxaltine;vitaxin;扎诺特隆(zanoterone);亚苄维c(zilascorb);以及净司他丁斯酯(zinostatin stimalamer)。
[1480]
本技术公开和权利要求的化合物还可以与以下任何治疗联合使用:
[1481]
联合聚(adp-核糖)聚合酶(parp)抑制剂的治疗,所述抑制剂是一类针对靶向具有缺陷的dna损伤修复的癌症的化疗剂(yuan,et al.,expert opin ther pat,2017,27:363)。这种parp抑制剂包括但不限于奥拉帕尼(olaparib)、rupacarib、velaparib、尼拉帕尼(niraparib)、talazoparib、pamiparib、iniparib、e7449和a-966492。
[1482]
联合导致dna单链和双链断裂修复的信号传导途径和机制如核因子-κb信号传导的抑制剂(pilie,et al.,nat rev clin oncol,2019,16:81;zhang,et al.,chin j cancer,2012,31:359)的治疗。这种抑制剂包括但不限于atm和atr激酶、检查点激酶1和2、dna依赖性蛋白激酶和wee1激酶的抑制剂(pilie,et al.,nat rev clin oncol,2019,16:81)。
[1483]
联合免疫调节剂(khalil,et al.,nat rev clin oncol,2016,13:394)、癌症疫苗(hollingsworth,et al.,npj vaccines,2019,4:7)、免疫检查点抑制剂(例如pd-1、pd-l1、ctla-4抑制剂)(wei,et al.,cancer discov,2018,8:1069)、细胞周期蛋白-d-激酶4/6抑制剂(goel,et al.,trends cell biol,2018,28:911)、能结合肿瘤细胞和/或转移瘤并能诱导抗体依赖性细胞毒性(adcc)的抗体(kellner,et al.,transfus med hemother,2017,44:327)、t细胞或nk细胞结合剂(例如双特异性抗体)(yu,et al.,j cancer res clin oncol,2019,145:941)、使用扩增的自体或同种异体免疫细胞(例如嵌合抗原受体t(car-t)细胞)的细胞疗法(khalil,et al.,nat rev clin oncol,2016,13:394)的治疗。免疫检查点抑制剂包括但不限于纳武单抗(nivolumab)、伊匹单抗(ipilimumab)、派姆单抗(pembrolizumab)、阿特珠单抗(atezolizumab)、阿维鲁单抗(avelumab)、德瓦鲁单抗(durvalumab)和西米普利单抗(cemiplimab)。
[1484]
根据本发明,所述化合物可以在其它抗癌化合物之前、同时或之后施用。施用时间表可以涉及以交替方式施用不同的药剂。在其它实施方案中,可以在用其它疗法治疗之前和期间、或期间和之后、或之前和之后递送所述化合物。在一些情况下,在施用其它抗增殖治疗之前超过24小时施用所述化合物。在其它实施方案中,可以向个体施用多于一种抗增殖疗法。例如,个体可以接受本发明化合物,组合手术和至少一种其它抗增殖化合物。或者,所述化合物可以与多于一种抗癌药物组合施用。
[1485]
在一个实施方案中,本发明的化合物用于检测过表达fap的细胞和组织,由此通过将可检测标记、优选可检测放射性核素缀合于本发明化合物来实现此类检测。在优选的实施方案中,检测到的细胞和组织是患病细胞和组织和/或是疾病的原因和/或疾病的症状,或者是疾病基础病理的一部分。在进一步优选的实施方案中,患病细胞和组织引起肿瘤学指征(例如赘生物、肿瘤和癌症)或非肿瘤学指征(例如炎性疾病、心血管疾病、自身免疫性疾病和纤维化疾病)和/或是其一部分。
[1486]
在另一个实施方案中,本发明的化合物用于治疗过表达fap的细胞和组织。在一个优选的实施方案中,所治疗的细胞和组织是患病细胞和组织和/或是疾病的原因和/或疾病症状,或者是疾病基础病理的一部分。在进一步优选的实施方案中,患病细胞和组织引起肿瘤学指征(例如赘生物、肿瘤和癌症)和/或是肿瘤学指征的一部分,并且治疗活性是通过将治疗活性效应物与本发明的化合物、优选治疗活性放射性核素缀合来实现。在进一步优选的实施方案中,患病细胞和组织引起非肿瘤学指征(例如,炎性疾病、心血管疾病、自身免疫性疾病和纤维化疾病)和/或是非肿瘤学指征的一部分,并且治疗活性通过抑制fap的酶促活性来实现。
[1487]
在进一步的实施方案中,特别是如果所述疾病是非肿瘤疾病或非肿瘤学指征(例如炎性疾病、心血管疾病、自身免疫疾病和纤维化疾病),则以治疗有效量施用本发明的化合物;优选地,本发明的化合物不包含治疗活性核素。有效量是足以在施用该化合物的个体中提供治疗或医学上期望的结果或效果的化合物剂量。有效量将随所治疗的具体病症、所治疗个体的年龄和身体状况、病症的严重程度、治疗的持续时间、同时或联合治疗的性质(如果有的话)、具体的施用途径以及卫生从业者知识和专业知识范围内的类似因素而变化。例如,就针对治疗患有以异常细胞增殖为特征的病症的个体的方法而言,抑制增殖的有效量将是足以减少或完全停止异常细胞增殖、从而减缓或停止细胞团例如肿瘤的发生或进展的量。如实施方案中所使用的,“抑制”涵盖所有前述内容。
[1488]
在其它实施方案中,治疗有效量将是在手术或药物治疗后延长微转移的休眠或稳定任何残余原发肿瘤细胞所需的量。
[1489]
一般而言,当使用不含治疗活性放射性核素的未缀合化合物时,治疗有效量将随着个体的年龄、状况和性别以及个体疾病的性质和程度而变化,所有这些都可以由本领域普通技术人员之一确定。剂量可由医生或兽医调整,特别是在发生任何并发症的情况下。治疗有效量通常为但不限于0.1μg/kg至约2000mg/kg、或1.0μg/kg至约1000mg/kg、或约0.1mg/kg至约500mg/kg、或约1.0mg/kg至约100mg/kg的范围,每日一剂或多剂施用,持续一天或多天。如果需要,活性化合物的有效日剂量可以分为两个、三个、四个、五个、六个或更多个亚剂量的形式施用,例如全天以适当的间隔分开施用,任选以单位剂型施用。在一些实施方案中,施用所述化合物超过7天、超过10天、超过14天和超过20天。在其它实施方案中,所述化合物在数周或数月的时间内施用。在其它实施方案中,所述化合物隔日递送。例如,每两天、或每三天、或每四天、或每五天、或每六天、或每周、或每月递送药剂。
[1490]
在一个优选的实施方案中,本发明的化合物用于治疗和/或预防疾病,其中这种治疗是放射性核素疗法。
[1491]
优选地,放射性核素治疗利用或基于由放射性核素发射的不同形式的辐射。这种辐射可以例如是光子辐射、电子辐射(包括但不限于β-粒子和auger电子)、质子辐射、中子辐射、正电子辐射、α-粒子或离子束辐射。根据所述放射性核素发射的粒子或辐射的种类,放射性核素治疗可以例如区分为光子放射性核素治疗、电子放射性核素治疗、质子放射性核素治疗、中子放射性核素治疗、正电子放射性核素治疗、α-粒子放射性核素治疗或离子束放射性核素治疗。所有这些形式的放射性核素治疗都包括在本发明中,并且所有这些形式的放射性核素治疗都可以通过本发明的化合物来实现,优选条件是放射性核素连接于本发明的化合物上,更优选作为效应物提供这种辐射。
[1492]
放射性核素疗法优选通过破坏细胞的dna来起作用。这种损伤是由光子、电子、质子、中子、正电子、α粒子或离子束直接或间接电离构成dna链的原子引起的。间接电离是水电离的结果,形成自由基,特别是羟基自由基,然后破坏dna。
[1493]
在最常见的放射性核素治疗形式中,大部分辐射效应是通过自由基产生的。由于细胞具有修复dna损伤的机制,因此断裂双链dna被证明是改变细胞特性的最重要技术。由于癌细胞通常是未分化的并且类似于干细胞,因此与大多数健康的分化细胞相比,癌细胞繁殖更多,并且修复亚致死损伤的能力减弱。所述dna损伤是通过细胞分裂遗传的,对癌细胞的损伤不断累积,导致其死亡或繁殖速度减慢。
[1494]
氧是一种有效的放射增敏剂,通过形成损伤dna的自由基来提高给定剂量辐射的效力。因此,可以使用高压氧气瓶,携带增氧的血液代用品,诸如米索硝唑(misonidazole)和甲硝唑(metronidazole)的缺氧细胞放射增敏剂,以及诸如替拉扎明(tirapazamine)的缺氧细胞毒素。
[1495]
选择放射性剂量时要考虑的其它因素包括患者是否正在接受化疗、是否在手术前或手术后进行放射治疗、以及手术的成功程度。
[1496]
出于几个重要原因,总放射性剂量可以被分成几部分,即随着时间的推移分散在一次或多次治疗中。分成几部分可以使正常细胞有时间恢复,而肿瘤细胞在分部之间的修复效率通常较低。分成几部分还允许在一次治疗期间处于细胞周期的相对放射抗性阶段的肿瘤细胞在给予下一次分部之前循环进入周期的敏感阶段。类似地,长期或急性缺氧且因此具有更强抗辐射能力的肿瘤细胞可能会在各分部分之间重新充氧,从而提高对肿瘤细胞的杀伤力。
[1497]
众所周知,不同的癌症对放射治疗的反应不同。癌症对辐射的反应通过其辐射敏感性来描述。对辐射高度敏感的癌细胞会被适度剂量的辐射迅速杀死。这些包括白血病、大多数淋巴瘤和生殖细胞肿瘤。
[1498]
区分具体肿瘤的放射敏感性(在某种程度上是实验室测量)与实际临床实践中通过内部递送的放射性剂量对癌症的“治愈性”是很重要的。例如,白血病通常无法通过放射疗法治愈,因为其是全是传播的。如果淋巴瘤局限于身体的某一部位,那么它可能是可以根治的。同样,许多常见的、中等放射反应性的肿瘤如果处于早期阶段,可以用治疗剂量的放射性治疗。例如,这适用于非黑色素瘤皮肤癌、头颈癌、非小细胞肺癌、宫颈癌、肛门癌、前列腺癌。
[1499]
肿瘤对放射治疗的反应也与其大小有关。由于复杂的原因,非常大的肿瘤对放射的反应不如较小的肿瘤或微观疾病。人们使用各种策略来克服这种影响。最常见的技术是放射治疗前的手术切除。这种情况最常见于采用广泛局部切除或乳房切除术随后进行辅助放疗的乳腺癌治疗中。另一种方法是在根治性放射性核素治疗之前通过新辅助化疗缩小肿瘤。第三种技术是通过在放射治疗过程中给予某些药物来增强癌症的放射敏感性。放射增敏药物的实例包括但不限于顺铂、尼莫唑(nimorazole)和西妥昔单抗(cetuximab)。
[1500]
术中放疗是一种特殊类型的放疗,其是在手术切除癌症后立即进行。这种方法已应用于乳腺癌(靶向术中放射治疗)、脑肿瘤和直肠癌。
[1501]
放射性核素治疗本身是无痛的。许多低剂量姑息治疗的副作用很小或没有副作用。较高剂量的治疗可能会在治疗期间(急性副作用)、治疗后数月或数年内(长期副作用)
或重新治疗后(累积副作用)引起不同的副作用。副作用的性质、严重程度和持续时间取决于接受放射的器官、治疗本身(放射性核素的类型、剂量、分级、同步化疗)和患者。
[1502]
在本发明的范围内,本发明的用于治疗疾病的方法可以实现本领域已知的上述策略中的每一个和任何策略,并且其构成本发明的进一步的实施方案。
[1503]
本发明的化合物用于诊断本文公开的疾病的方法中也在本发明的范围内。此类方法优选包括向有需要的个体施用诊断有效量的本发明化合物的步骤。
[1504]
根据本发明,成像方法选自闪烁扫描、单光子发射计算机断层显像(spect)和正电子发射断层显像(pet)。
[1505]
在本发明的优选实施方案中,包含来自n4螯合剂家族的螯合剂、更优选螯合tc放射性核素的根据本发明的化合物特别适合用于使用spect的方法和程序中。在其一个实施方案中,来自n4螯合剂家族的螯合剂是n4ac。
[1506]
在本发明的优选实施方案中,包含螯合剂nodaga、更优选螯合ga放射性核素的根据本发明的化合物特别适合用于使用pet的方法和程序中。
[1507]
闪烁扫描是核医学中使用的诊断测试或方法的一种形式,其中放射性药物被细胞、组织和/或器官内化,优选在体内内化,并且由所述内化的放射性药物发射的辐射被外部检测仪(γ相机)捕获以形成并显示二维图像。与此相反,spect和pet形成并显示三维图像。因此,spect和pet被归类为与闪烁扫描不同的技术,尽管它们也使用γ相机来检测内部辐射。闪烁扫描不同于外部辐射穿过身体形成图像的诊断性x射线扫描。
[1508]
单光子发射断层显像(spect)是一种使用γ射线的核成像技术。它们与使用γ相机的常规核医学平面成像非常相似。在spect扫描之前,患者会被注射放射性标记的发射γ射线的化学物质,扫描仪可以检测到这种射线。计算机从γ相机收集信息并将其转换为二维横截面。这些横截面可以重新加在一起以形成器官或组织的三维图像。spect涉及检测由放射性标记化学物质提供的放射性核素单独和连续发射的γ射线。为了获取spect图像,使γ相机围绕患者旋转。在旋转期间的定义点获取投影,通常每3至6度获取一次。在大多数情况下,使用完整的360度旋转来获得最佳重建。获得每个投影所需的时间也各不相同,但通常为15至20秒。总扫描时间为15至20分钟。多头γ相机速度更快。由于spect采集与平面γ相机成像非常相似,因此可以使用相同的放射性药物。
[1509]
正电子发射断层显像(pet)是一种非侵入性诊断成像技术,用于测量人体内细胞的生化状态或代谢活动。pet的独特之处在于它可以生成人体基本生物化学或功能的图像。x射线、ct扫描或mri等传统诊断技术可生成身体解剖或结构的图像。这些技术的前提是可以看到与疾病相关的任何结构或解剖学变化。生化过程也会因疾病而改变,并且可能发生在解剖学发生任何重大变化之前。pet是一种成像技术,可以可视化其中一些早期生化变化。pet扫描仪依靠患者发出的辐射来创建图像。每位患者都会服用微量的放射性药物,这种药物要么与人体使用的天然物质非常相似,要么与受体或分子结构特异性结合。随着放射性同位素经历正电子发射衰变(也称为正β衰变)时,会发射正电子,即电子的反粒子对应物。在行进几毫米后,正电子遇到电子并湮灭,产生一对沿相反方向移动的湮灭(γ)光子。当它们到达扫描装置中的闪烁材料时,会被检测到,产生一束光,并被光电倍增管或硅雪崩光电二极管检测到。该技术依赖于对光子对的同时或同步检测。不成对到达(即在几纳秒内到达)的光子将被忽略。所有重合都被转发到图像处理单元,在此使用图像重建程序生成最终
图像数据。
[1510]
spect/ct和pet/ct是spect和pet与计算机断层显像(ct)的组合。组合这些方式的关键益处是提高读者的信心和准确性。对于传统的pet和spect,从异常区域发射的光子数量有限,产生的背景水平非常低,因此很难在解剖学上定位该区域。添加ct有助于从解剖学角度确定异常区域的位置,并对这代表疾病的可能性进行分类。
[1511]
在本发明的范围内,本发明的诊断疾病的方法可以实现本领域已知的上述策略中的每一个和任何策略,并且其构成本发明的进一步的实施方案。
[1512]
本发明的化合物可用于对患者进行分层,即在患者群体内创建子集,提供关于患者将如何响应给定药物的更详细信息。通过鉴定最有可能对新疗法产生反应的患者群子集,分层可以是将临床试验从阴性或中性结果转变为阳性结果的关键组成部分。
[1513]
分层包括识别一组具有共同“生物学”特征的患者,为患者选择最佳治疗方案,并在风险评估、风险预防和实现最佳治疗结果方面实现最佳可能结果。
[1514]
本发明的化合物可用于尽早评估或检测特定疾病(这是诊断性用途)、发生疾病的风险(这是易感性/风险性用途)、疾病的演变包括惰性与侵袭性(这是预后用途),并且可以用于预测对给定治疗的反应和毒性(这是预测用途)。
[1515]
本发明的化合物用于治疗诊断方法中也在本发明的范围内。治疗诊断学的概念是将治疗剂与相应的诊断测试相结合,可增加治疗药物的临床应用。治疗诊断学的概念变得越来越有吸引力,并被广泛认为是通过帮助医生识别可能从特定治疗中受益的患者来提高药物治疗效率的关键,从而避免不必要的治疗。
[1516]
治疗诊断学的概念是将治疗剂与诊断测试相结合,使医生能够识别那些将从给定的治疗中受益最多的患者。在一个实施方案中并且如本文优选使用的,本发明的化合物用于患者的诊断,即原发性肿瘤团块以及潜在的局部和远处转移的鉴定和定位。此外,可以确定肿瘤体积,特别是利用三维诊断方式,例如spect或pet。仅选择那些具有fap阳性肿瘤团块并因此可能受益于给定治疗的患者进行特定治疗,从而避免不必要的治疗。优选地,此类疗法是使用本发明的化合物的fap靶向疗法。在一种特定实施方案中,应用化学上相同的肿瘤靶向诊断,优选地用于闪烁扫描的成像诊断、pet或spect以及放射治疗。此类化合物仅在放射性核素上有所不同,因此通常具有非常相似(即使不相同)的药代动力学特征。这可以使用螯合剂和诊断或治疗放射性金属来实现。或者,这可以使用用于放射性标记的前体和用诊断或治疗放射性核素进行放射性标记来实现。在一种实施方案中,优选通过本领域技术人员已知的诊断性放射性核素的辐射量化和随后的剂量测定以及与易受副作用影响的器官相比在肿瘤中药物浓度的预测来使用诊断性成像。因此,实现了对患者真正个体化的药物剂量治疗。
[1517]
在一个实施方案中并且如本文优选使用的,所述治疗诊断方法仅用一种治疗诊断活性化合物来实现,例如用发射诊断可检测的辐射(例如正电子或伽马射线)以及治疗有效辐射(例如电子或α粒子)的放射性核素标记的本发明化合物。
[1518]
本发明还考虑了一种在术中鉴定/公开个体中表达fap的患病组织的方法。此类方法使用本发明的化合物,其中此类本发明化合物优选包含诊断活性剂作为效应物。
[1519]
根据本发明的另一个实施方案,本发明的化合物、特别是如果与放射性核素络合,可以用作任何其它肿瘤治疗的辅助剂或佐剂,所述其它肿瘤治疗包括作为大多数孤立的实
体癌的主要治疗方法的手术、涉及使用电离辐射以试图治愈或改善癌症症状的放射治疗,使用近距离放射治疗形式的密封内部源或外部源、化疗例如烷化剂、抗代谢物、蒽环类药物、植物生物碱、拓扑异构酶抑制剂,以及其它抗肿瘤药物、调节肿瘤细胞行为而不直接攻击这些细胞的激素治疗、直接靶向某些类型癌症的分子异常的靶向药物,包括单克隆抗体和酪氨酸激酶抑制剂、血管生成抑制剂、免疫疗法、癌症疫苗接种、姑息治疗(包括行动)以减少身体、情感、精神和社会心理困扰,改善患者的生活质量,以及替代治疗,包括不属于常规医学的多样化的医疗保健系统、实践和产品。
[1520]
在本发明方法的一个实施方案中,所述个体是患者。在一个实施方案中,患者是已被诊断为患有或疑似患有疾病或处于患有或发生疾病风险中的个体,其中所述疾病是如本文所述的疾病,并且优选是涉及fap的疾病。
[1521]
在实施其中使用放射性核素并且更特别地连接到本发明化合物或其一部分的治疗和诊断方法时分别使用的剂量,将根据例如待治疗的特定病症而变化,例如肿瘤类型的已知放射敏感性、肿瘤的体积和所需的治疗。一般来说,所述剂量是基于每个器官的放射性分布和观察到的靶标吸收来计算的。可以一次或多次施用γ发射复合物以进行诊断成像。在动物中,指定的剂量范围可以是与例如1-200mbq的
111
in或
89
zr络合的0.1μg/kg至5mg/kg的本发明化合物。本发明化合物的β-发射络合物可以在几个时间点施用,例如持续1至3周或更长时间。在动物中,指定的剂量范围可以是与例如1-200mbq 90
y或
177
lu络合的0.1μg/kg至5mg/kg的本发明化合物。在较大的哺乳动物例如人中,指定的剂量范围是与例如10-400mbq 111
in或
89
zr络合的0.1-100μg/kg本发明化合物。在较大的哺乳动物例如人中,指定的剂量范围是与例如10-5000mbq 90
y或
177
lu络合的0.1-100μg/kg本发明化合物。
[1522]
另一方面,本发明涉及包含本发明化合物的组合物,特别是药物组合物。
[1523]
本发明的药物组合物包含至少一种本发明的化合物和任选一种或多种的载体物质、赋形剂和/或佐剂。所述药物组合物可另外包含例如水、缓冲剂如中性缓冲盐水或磷酸盐缓冲盐水、乙醇、矿物油、植物油、二甲亚砜、碳水化合物如葡萄糖、甘露糖、蔗糖或葡聚糖、甘露醇、蛋白质、佐剂、多肽或氨基酸如甘氨酸、抗氧化剂、螯合剂如edta或谷胱甘肽和/或防腐剂中的一种或多种制剂。此外,一种或多种其它活性成分可以但非必需包含在本发明的药物组合物中。
[1524]
本发明的药物组合物可以配制用于任何合适的施用途径,包括例如局部施用,例如透皮或经眼、口服、含服、鼻、阴道、直肠或肠胃外施用。本文使用的术语胃肠外包括皮下、皮内、血管内例如静脉内、肌内、鞘内和腹膜内注射,以及任何类似的注射或输注技术。优选的施用途径是静脉内施用。
[1525]
在本发明的一个实施方案中,包含放射性核素的本发明化合物通过任何常规途径施用,特别是静脉内施用,例如以注射溶液或悬浮液的形式静脉内施用。本发明的化合物还可以有利地通过输注施用,例如通过输注30至60分钟。
[1526]
根据肿瘤的部位,本发明的化合物可以在尽可能靠近肿瘤部位的位置施用,例如通过导管施用。这种施用可以直接施用于肿瘤组织或周围组织或进入血管中。本发明的化合物还可以按剂量、优选以分开的剂量重复施用。
[1527]
根据本发明的优选实施方案,本发明的药物组合物包含稳定剂,例如自由基清除剂,其抑制本发明化合物的自放射分解。合适的稳定剂包括例如血清白蛋白、抗坏血酸、视
黄醇、龙胆酸或其衍生物,或氨基酸输注溶液,例如用于肠胃外蛋白质喂养,优选不含电解质和葡萄糖,例如可商购的氨基酸输注液,如ke nephro。优选抗坏血酸和龙胆酸。
[1528]
本发明的药物组合物可以包含另外的添加剂,例如将ph值调节到7.2至7.4之间的制剂,例如乙酸钠或乙酸铵或na2hpo4。优选地,将稳定剂进入到本发明的非放射性化合物中,并且在稳定剂的存在下在室温下或优选在40至120℃的温度下进行放射性核素的引入,例如与放射性核素的络合。所述络合可以方便地在无空气条件下进行,例如在在n2或ar下进行。络合后可向所述组合物中进入另外的稳定剂。
[1529]
本发明化合物的排泄,特别是当效应物是放射性核素时,基本上通过肾脏进行。进一步保护肾脏免受放射性蓄积可以通过施用赖氨酸或精氨酸或具有高含量赖氨酸和/或精氨酸的氨基酸溶液来实现,例如可商购的氨基酸溶液例如或-10,在注射本发明的化合物之前或与本发明的化合物一起施用,特别是如果效应物是放射性核素的话。还可以通过施用血浆扩张剂例如佳乐施(gelofusine)来实现对肾脏的保护,代替或补充氨基酸输注。还可以通过施用利尿剂来保护肾脏,利尿剂提供强制利尿的手段,从而提高排尿率。此类利尿剂包括高效髓袢利尿剂、噻嗪类、碳酸酐酶抑制剂、保钾利尿剂、保钙利尿剂、渗透性利尿剂和低效能利尿剂。除了本发明的化合物之外,本发明的药物组合物还可以包含至少一种这些另外的化合物,其旨在或适合于肾脏保护,优选对施用了本发明的化合物的个体的肾脏保护。
[1530]
本领域技术人员应当理解,本文公开的本发明的化合物用于各种方法中。本领域技术人员还应当理解,本发明的组合物和本发明的药物组合物可以同等地用于所述各种方法中。本领域技术人员还应当理解,本文公开的本发明的组合物和药物组合物用于各种方法中。本领域技术人员同样应当理解,本发明的化合物可以同等地用于所述各种方法中。
[1531]
本领域技术人员将认识到,本发明的组合物和本发明的药物组合物除了本发明的化合物之外还含有一种或多种其它化合物。就本文公开的这种一种或多种另外的化合物作为本发明的组合物和/或本发明的药物组合物的一部分而言,应当理解这种一种或多种另外的化合物可以与本发明的化合物分开施用给暴露于本发明方法的个体或本发明方法的个体。所述一种或多种另外的化合物的这种施用可以在施用本发明的化合物之前、同时或之后进行。本领域技术人员还应当认识到,在本发明的方法中,除了本发明的化合物之外,还可以为个体施用一种或多种另外的化合物。所述一种或多种另外的化合物的这种施用可以在施用本发明的化合物之前、同时或之后进行。就本文公开的这种一种或多种另外的化合物作为本发明方法的一部分施用而言,应当理解这种一种或多种另外的化合物是本发明的组合物和/或药物组合物的一部分。本发明的化合物和一种或多种另外的化合物可以包含在相同或不同的制剂中,这也在本发明的范围内。本发明的化合物和一种或多种另外的化合物不包含在同一制剂中,而是包含在含有包含本发明化合物的第一制剂和包含一种或多种另外的化合物的第二制剂的同一包装中,其中制剂的类型可以相同或可以不同。
[1532]
在本发明的范围内,本发明的组合物和/或本发明的药物组合物中包含多于一种类型的本发明的化合物。在本发明的方法中使用、优选施用多于一种类型的本发明化合物也在本发明的范围内。
[1533]
应当意识到,本发明的组合物和本发明的药物组合物可以以常规方式制备。
[1534]
由于放射性衰变,放射性药物的放射性含量随着时间推移而减少。对于放射性药物诊断而言,放射性核素的物理半衰期通常很短。在这些情况下,最终的制备必须在施用于患者之前不久完成。用于断层显像的正电子发射放射性药物(pet放射性药物)尤其如此。这通常导致使用半成品,例如放射性核素发生器、放射性前体和试剂盒。
[1535]
优选地,本发明的试剂盒除了包含一种或多于一种本发明的化合物之外,通常还包含以下至少一项:使用说明,最终制备和/或质量控制,一种或多种任选的赋形剂,一种或多种用于标记程序的可选试剂,任选具有或不具有屏蔽容器的一种或多种放射性核素,以及任选一种或多种装置,其中所述装置选自包括标记装置、纯化装置、分析装置、处理装置、辐射防护装置或施用装置等。
[1536]
用于一般处理和运输放射性药物容器的被称为“pigs”的屏蔽容器具有多种用于保持放射性药物容器的构造,例如瓶子、小瓶、注射器等。一种形式通常包括允许接近持有的放射性药物容器的可移除盖。当容器盖就位时,辐射暴露是可以接受的。
[1537]
标记装置选自开放反应器、封闭反应器、微流体系统、纳米反应器、小柱、压力容器、小瓶、温度可控反应器、混合或摇动反应器及其组合。
[1538]
纯化装置优选选自离子交换色谱柱或装置、尺寸排阻色谱柱或装置、亲和色谱柱或装置、气相或液相色谱柱或装置、固相萃取柱或装置、过滤装置、离心瓶柱或装置。
[1539]
分析装置优选选自测试装置,以确定所述放射性标记的化合物的身份、放射化学纯度、放射性核素纯度、放射性含量和比放射性。
[1540]
处理装置优选选自用于混合、稀释、分配、标记、注射和施用放射性药物于个体的装置。
[1541]
使用辐射防护装置是为了保护医生和其它人员在使用治疗或诊断放射性核素时免受辐射。辐射防护装置优选选自具有辐射吸收材料的防护屏障的装置,所述辐射吸收材料选自铝、塑料、木材、铅、铁、铅玻璃、水、橡胶、塑料、布,确保与辐射源保持适当距离的装置,减少放射性核素暴露时间的装置,限制放射性物质被吸入、摄入或以其它方式进入体内的装置以及提供这些措施组合的装置。
[1542]
施用装置优选选自注射器、屏蔽注射器、针头、泵和输注装置。注射器护罩通常是中空的圆柱形结构,其容纳注射器的圆柱形主体,并由铅或钨制成,具有铅玻璃窗,允许操作者观察注射器柱塞和注射器内的液体体积。
[1543]
现在参考以下附图和实施例进一步示例说明本发明,从这些附图和实施例中可以得到本发明的进一步的特征、实施方案和优点,其中:
[1544]
图1显示了合成后立即分析的
177
lu-3bp-3407在含有100mg/ml抗坏血酸和5mg/ml l-甲硫氨酸的配制缓冲液中的放射色谱图;
[1545]
图2显示了合成后六天分析的
177
lu-3bp-3407在含有100mg/ml抗坏血酸和5mg/ml l-甲硫氨酸的配制缓冲液中的放射色谱图;
[1546]
图3显示了合成后立即分析的
177
lu-3bp-3554在含有100mg/ml抗坏血酸和5mg/ml l-甲硫氨酸的配制缓冲液中的放射色谱图;
[1547]
图4显示了合成后六天分析的
177
lu-3bp-3554在含有100mg/ml抗坏血酸和5mg/ml l-甲硫氨酸的配制缓冲液中的放射色谱图;
[1548]
图5显示了在注射至小鼠模型后1小时、3小时、6小时和24小时通过spect成像测定
的
111
in-3bp-3105(a)和
111
in-3bp-3168(b)在肾、肝、血池和hek-fap肿瘤中每克组织的注射剂量百分比(%id/g)摄取;
[1549]
图6显示了在注射至小鼠模型后1小时、3小时、6小时和24小时通过spect成像测定的
111
in-3bp-3320(a)和
111
in-3bp-3321(b)在肾、肝、血池和hek-fap肿瘤中每克组织的注射剂量百分比(%id/g)摄取;
[1550]
图7显示了在注射至小鼠模型后1小时、3小时、6小时和24小时通过spect成像测定的
111
in-3bp-3275(a)和
111
in-3bp-3397(b)在肾、肝、血池和hek-fap肿瘤中每克组织的注射剂量百分比(%id/g)摄取;
[1551]
图8显示了注射至小鼠模型后1小时、3小时、6小时和24小时通过spect成像测定的
111
in-3bp-3398(a)和
111
in-3bp-3407(b)在肾、肝、血池和hek-fap肿瘤中每克组织的注射剂量百分比(%id/g)摄取;
[1552]
图9显示了在注射至小鼠模型后1小时、3小时、6小时和24小时通过spect成像测定的
111
in-3bp-3554(a)和
111
in-3bp-3652(b)在肾、肝、血池和hek-fap肿瘤中每克组织的注射剂量百分比(%id/g)摄取;
[1553]
图10显示了在注射至小鼠模型后1小时、3小时、6小时和24小时通过spect成像测定的
111
in-3bp-3654(a)和
111
in-3bp-3656(b)在肾、肝、血池和hek-fap肿瘤中每克组织的注射剂量百分比(%id/g)摄取;
[1554]
图11显示了在注射至小鼠模型后1小时、3小时、6小时和24小时通过spect成像测定的
111
in-3bp-3659(a)和
111
in-3bp-3678(b)在肾、肝、血池和hek-fap肿瘤中每克组织的注射剂量百分比(%id/g)摄取;
[1555]
图12显示了在注射至小鼠模型后1小时、3小时、6小时和24小时通过spect成像测定的
111
in-3bp-3692(a)和
111
in-3bp-3767(b)在肾、肝、血池和hek-fap肿瘤中每克组织的注射剂量百分比(%id/g)摄取;
[1556]
图13显示了
111
in-3bp-3554在注射至具有hek-fap肿瘤的小鼠后1小时、3小时、6小时、24小时和48小时的spect图像;
[1557]
图14显示了
111
in-3bp-3767在注射至具有hek-fap肿瘤的小鼠后1小时、3小时、6小时、24小时和48小时的spect图像;
[1558]
图15a显示了用载体、冷化合物
nat
lu-3bp-3554、30mbq(低剂量)
177
lu-3bp-3554和60mbq(高剂量)
177
lu-3bp-3554治疗的具有hekfap肿瘤的小鼠中随着时间推移的肿瘤生长;
[1559]
图15b显示了用载体、冷化合物
nat
lu-3bp-3554、30mbq(低剂量)
177
lu-3bp-3554和60mbq(高剂量)
177
lu-3bp-3554治疗的具有hek-fap肿瘤的小鼠随着时间推移的体重变化百分比;
[1560]
图16a显示了具有hek-fap肿瘤的小鼠中60mbq 177
lu-3bp-3554随着时间推移的生物分布的代表性spect/ct图像;
[1561]
图16b显示了具有hek-fap肿瘤的小鼠中30mbq 177
lu-3bp-3554随着时间推移的生物分布的代表性spect/ct图像;
[1562]
图17a显示了在四种不同肉瘤pdx模型中施用
111
in-3bp-3554后3小时的代表性spect/ct图像;
[1563]
图17b显示了在四种不同肉瘤pdx模型中注射
111
in-3bp-3554后3小时的%id/g摄
取;
[1564]
图18a显示了用载体、冷化合物
nat
lu-3bp-3554、30mbq 177
lu-3bp-3554或60mbq
177
lu-3bp-3554治疗的具有sarc4809 pdx肿瘤的小鼠随着时间推移的肿瘤生长;
[1565]
图18b显示了用载体、冷化合物
nat
lu-3bp-3554、30mbq 177
lu-3bp-3554或60mbq
177
lu-3bp-3554治疗的具有肉瘤sarc4809 pdx肿瘤的小鼠体重随着时间推移的变化;
[1566]
图19显示了人成纤维细胞活化蛋白(fap)(seq id no:1)、人二肽基肽酶4(ddp4)(seq id no:2)和人脯氨酰内肽酶(prep)(seq id no:3)的氨基酸序列;
[1567]
图20显示了在注射至小鼠模型后1小时、3小时、6小时和24小时通过spect成像测定的
111
in-3bp-3940在肾、肝、血池和hek-fap肿瘤中每克组织的注射剂量百分比(%id/g)摄取;
[1568]
图21显示了
111
in-3bp-3940在注射至具有hek-fap肿瘤的小鼠后1小时、3小时、6小时、24小时和48小时的spect图像;
[1569]
图22显示了
99m
tc-3bp-4219在注射至具有hek-fap肿瘤的小鼠后1小时、3小时和6小时的生物分布的代表性spect/ct图像;
[1570]
图23显示了
99m
tc-3bp-4221在注射至具有hek-fap肿瘤的小鼠后1小时、3小时和6小时的生物分布的代表性spect/ct图像;
[1571]
图24显示了
99m
tc-3bp-4541在注射至具有hek-fap肿瘤的小鼠后1小时、3小时和6小时的生物分布的代表性spect/ct图像;
[1572]
图25显示了
99m
tc-3bp-4961在注射至具有hek-fap肿瘤的小鼠后1小时、3小时和6小时的生物分布的代表性spect/ct图像;
[1573]
图26显示了
68
ga-3bp-4768在注射至具有hek-fap肿瘤的小鼠后0.25小时、1小时和3小时的生物分布的代表性pet/ct图像;
[1574]
图27显示了
68
ga-3bp-5201在注射至具有hek-fap肿瘤的小鼠后0.25小时、1小时和3小时的生物分布的代表性pet/ct图像;以及
[1575]
图28显示了
111
in-3bp-4560在注射至具有hek-fap肿瘤的小鼠后1小时、3小时、6小时、24小时和48小时的生物分布的代表性spect/ct图像。
[1576]
包括以下实施例以为本领域普通技术人员提供实践本公开主题的代表性实施方案的指导。根据本公开和本领域技术人员的一般水平,本领域技术人员可以理解以下实施例仅是示例性的,并且可以在不脱离本发明的范围的情况下对目前公开的主题进行多种改变、修改和变更。下面的综合描述和具体实施例仅用于示例说明的目的,并且不应被解释为以任何方式限制通过其它方法制备本公开的化合物。
实施例
[1577]
本技术中以及具体的以下实施例使用的缩写如下:
[1578]
[1579]
[1580]
[1581][1582]
实施例1:材料和方法
[1583]
通过以下实施例进一步示例说明材料和方法以及一般方法。
[1584]
溶剂:
[1585]
溶剂按指定质量使用,无需进一步纯化。乙腈(超级,hplc,vwr-用于分析目的;prepsolv,merck-用于制备目的);二氯甲烷(合成级,roth);乙酸乙酯(合成级,roth);n,n-二甲基甲酰胺(肽合成级,biosolve);1-甲基-2-吡咯烷酮(肽级,iris biotech),1,4-二烷(特纯级,roth);甲醇(p.a.,merck)。
[1586]
水:milli-q plus,millipore,脱矿物质。
[1587]
化学品:
[1588]
化学品根据或类似于文献程序合成或购自sigma-aldrich-merck(deisenhofen,germany)、bachem(bubendorf,switzerland)、vwr(darmstadt,germany)、novabiochem(merck group,darmstadt,germany)、acros organics(分销公司fisher scientific gmbh,schwerte,germany)、iris biotech(marktredwitz,germany)、amatek chemical(jiangsu,china)、roth(karlsruhe,deutschland)、molecular devices(chicago,usa)、biochrom(berlin,germany)、peptech(cambridge,ma,usa)、synthetech(albany,or,usa)、pharmacore(high point,nc,usa)、pcas biomatrix inc(saint-jean-sur-richelieu,
quebec,canada)、alfa aesar(karlsruhe,germany)、tianjin nankai hecheng s&t co.、ltd(tianjin,china)、chematech(dijon,france)和anaspec(san jose,ca,usa)或其它公司,并按指定质量使用,无需进一步纯化。
[1589]
boc4n4ac-oh根据文献程序合成(maecke et al.chem.eur.j.,2010,16,7,2115)。
[1590][1591]
细胞:
[1592]
ht29(ecacc目录号91072201)和wi-38(ecacc目录号90020107)购自ecacc,表达人fap的hek293细胞(q12884)由inscreenex gmbh(braunschweig,germany)使用重组酶介导的盒式交换(rmce)生产。nehlsen等人描述了rmce程序(nehlsen,et al.,bmc biotechnol,2009,9:100)。
[1593]
hplc/ms分析
[1594]
通过注射5μl样品溶液进行hplc/ms分析,对所有色谱图使用2步梯度(12分钟内5-65%的b,随后0.5分钟内65-90%,a:在水中0.1%tfa,b:在acn中0.1%tfa)。rp柱来自agilent(poroshell 120型,2.7μm,ec-c18,50
×
3.00mm,流量0.8ml,室温hplc);质谱仪:agilent 6230lc/tof-ms,esi电离。masshunter qualitative analysis b.07.00sp2用作软件。在λ=230nm进行uv检测。保留时间(r
t
)以十进制表示(例如1.9分钟=1分钟54秒),指的是在uv光谱仪中的检测。为了评估观察到的化合物质量,使用了“通过分子式查找化合物(find compounds by formula)”功能。特别是,使用单个“化合物的中性质量(以道尔顿为单位)(neutral mass of a compound(in units of daltons))”值和相应的同位素分布模式来确认化合物的身份。质谱仪的准确度约为
±
5ppm。
[1595]
制备型hplc:
[1596]
使用反相色谱柱(来自phenomenex的kinetex 5μxb-c18 150
×
30mm或rlrp-s 8μ,150
×
25mm)作为固定相进行制备型hplc分离。使用在水中0.1%tfa(a)和在acn中0.1%tfa(b)作为流动相,将其以线性二元梯度混合。梯度描述为:“30分钟内10至40%的b”,这意味着在30分钟内运行从10%b(相应的90%a)到40%b(相应的60%a)的线性梯度。流速在30-50ml/min的范围内。用于纯化本发明化合物的典型梯度从5-25%b开始,30分钟后在35-50%b结束,并且结束时和开始时的b百分比之间的差异为至少10%。常用的梯度是“30分钟内15%至40%b”。
[1597]
自动/半自动固相合成的一般程序:
[1598]
在tetras肽合成仪(advanced chemtech)上以50μmol和100μmol规模进行肽和聚酰胺的自动固相分析。手动步骤在配备玻璃料的塑料注射器中进行(材料pe,roland vetter laborbedarf ohg,ammerbuch,germany)。除非另有说明,所述方案中的试剂量对应于100μmol规模。
[1599]
在聚苯乙烯(与1,4-二乙烯基苯(ps)或二(乙二醇)二甲基丙烯酸酯(deg)交联)、chemmatrix(cm)或tentagel(tg)树脂上进行固相合成。树脂接头是三苯甲基、wang和rink酰胺。
[1600]
树脂加载:
[1601]
在三苯甲基接头的情况下,如下进行第一构建块的连接(树脂加载)。将树脂(聚苯乙烯(ps)三苯甲基氯,初始加载:1.8mmol/g)在dcm(5ml)中溶胀30分钟,随后用dcm(3ml,1分钟)洗涤。然后将树脂用相应构建块(0.5mmol,5eq.)和dipea(350μl,3.5mmol,35eq.)在dcm(4ml)中的混合物处理1小时。然后将树脂用甲醇(5ml,5分钟)和dmf(3ml,2
×
1分钟)洗涤。
[1602]
在wang接头的情况下,使用预加载的树脂(聚苯乙烯(ps)和tentagel(tg))。
[1603]
在rink酰胺接头的情况下,第一残基与树脂(cm,deg)的连接采用与链组装相同的程序进行,如下所述。
[1604]
alloc/allyl-脱保护:
[1605]
在dmf中溶胀后,树脂用dmf和dcm洗涤。通过使氮气流穿过搅拌的溶剂来使dcm脱氧。用无氧溶剂洗涤树脂三次。然后将在无氧dcm中2ml 2m巴比妥酸溶液和在无氧dcm中1ml 25μm四(三苯基膦)钯(0)溶液添加到树脂中。将树脂搅拌1小时,然后用dcm、meoh、dmf、在dmf中5%dipea、在dmf中5%二硫代氨基甲酸盐、dmf和dcm洗涤(每个洗涤步骤重复3次,每次用3ml洗涤1分钟)。
[1606]
fmoc-脱保护:
[1607]
在dmf中溶胀后,树脂用dmf洗涤,然后用哌啶/dmf(1:4,3ml,2和20分钟)处理,随后用dmf(3ml,5
×
1分钟)洗涤。
[1608]
dde-脱保护:
[1609]
在dmf中溶胀后,树脂用dmf洗涤,然后用水合肼/dmf(2/98,3ml 2
×
10分钟)处理,随后用dmf(3ml,5
×
1分钟)洗涤。
[1610]
mtt-脱保护:
[1611]
在dcm中溶胀后,树脂用dcm洗涤,然后用hfip/dcm(7/3,4-6ml,4小时)处理,随后用dcm(3ml,3
×
1分钟)、dmf(3ml,3
×
1ml)和dipea(在dmf中0.9m,3ml,1分钟)洗涤。
[1612]
试剂溶液:
[1613]
构建块(在dmf或nmp中0.3m),dipea(在dmf中0.9m),hatu(在dmf中0.4m),乙酸酐(在dmf中0.75m)
[1614]
偶联:构建块/氨基酸的偶联(链组装):
[1615]
除非另有说明,否则构建块结构单元的偶联如下进行:随后添加相应构建块的溶液(1.7ml,5eq.)、dipea溶液(1.15ml,10eq.)和hatu溶液(1.25ml,5eq.)后,将树脂摇动45分钟。如果需要,用dmf(3ml,1分钟)洗涤树脂并重复偶联步骤。
[1616]
末端乙酰化:
[1617]
添加dipea溶液(1.75ml,16eq.)和乙酸酐溶液(1.75ml,13eq.)后,将树脂摇动10分钟。然后用dmf(3ml,6
×
1分钟)洗涤树脂。
[1618]
裂解方法a:从高酸不稳定树脂中裂解受保护的片段
[1619]
序列组装完成后,树脂最后用dcm(3ml,4
×
1分钟)洗涤,然后真空干燥。然后用hfip/dcm(7/1,4ml,4小时)处理树脂并将收集的溶液蒸发至干燥。将残余物用制备型hplc纯化或不经进一步纯化而使用。
[1620]
裂解方法b:未保护片段的裂解(完全树脂裂解)
[1621]
序列组装完成后,树脂最后用dcm(3ml,4
×
1分钟)洗涤,真空干燥过夜并用tfa、edt、水和tips(94/2.5/2.5/1)处理2小时(除非另有说明)。然后将裂解溶液倒入mtbe和环己烷的冷冻混合物中(1/1,与裂解溶液体积相比过量10倍),在4℃下离心5分钟,收集沉淀并在真空中干燥。在纯化或进一步改性之前,将残余物从水/乙腈中冻干。
[1622]
裂解方法c:溶液中肽保护基团的裂解
[1623]
将受保护/部分受保护的化合物溶解在tfa、水和tips(95/2.5/2.5)中2小时(除非另有说明)。然后将裂解溶液倒入mtbe和环己烷的冷冻混合物中(1/1,与裂解溶液体积相比过量10倍),在4℃下离心5分钟,收集沉淀并在真空中干燥。在纯化或进一步改性之前,将残余物从水/乙腈中冻干。
[1624]
更多相关的fmoc固相肽合成方法在“fmoc solid phase peptide synthesis”editors w.chan,p.white,oxford university press,usa,2000中详细描述。化合物名称适当地使用mestrenova version 12mnova iupac name plugin(mestrelab research,s.l.)或autonom version 2.2(beilstein informationssysteme1988-1998,beilstein institut f
ü
r literatur der organischen chemie licensed to beilstein chemiedaten and software gmbh命名。
[1625]
化合物的制备:
[1626]
以下实施例中提供了制备本发明化合物的具体实施方案。除非另有说明,所有起始材料和试剂均为标准商业级,并且无需进一步纯化即可使用,或者通过常规方法由此类材料容易地制备。有机合成领域的技术人员根据本公开内容将认识到起始材料和反应条件可以变化,包括用于产生本发明所涵盖的化合物的附加步骤。
[1627]
本发明化合物的一种通用合成路线包括:
[1628]
1.具有两个硫醇部分的线性肽前体的固相肽合成(spps)。
[1629]
2.这个线性肽前体与以下化合物的硫醇-位点特异性环化:
[1630]
a.二(溴甲基)苯衍生物,或
[1631]
b.三(溴甲基)苯衍生物。
[1632]
3.在与三(溴甲基)苯衍生物环化的情况下,使环化反应中形成的中间体进一步与接头反应,使得可以与螯合剂连接。
[1633]
实施例2:ac-met-[cys(3mebn)-pro-pro-thr-glu-phe-cys]-asp-his-nmf-arg-asp-nh2(3bp-3188)的合成
[1634]
肽的序列(ac-met-cys-pro-pro-thr-glu-phe-cys-asp-his-nmf-arg-asp-nh2)是根据“自动化/半自动化固相合成的通用程序”以50μmol规模在rink酰胺树脂上组装。执行“裂解方法b”的步骤后,将冻干的粗制肽残余物溶解在60ml碳酸氢铵溶液(50mm,ph=8.5)和乙腈的1:1混合物中。向这个混合物中加入在0.5ml乙腈中14.5mg的α,α
’‑
二溴间二甲苯(55μmol,与初始树脂加载相比为1.1eq.)溶液。环化反应完成后,加入50μl tfa,并通过冻干除去溶剂。对剩余物进行hplc纯化(30分钟内15%至45%b,kinetex),得到8.61mg纯标题化合物(9.8%)。hplc:r
t
=5.87分钟。lc/tof-ms:精确质量1753.716(计算值1753.705)。c
79h107n19o21
s3(mw=1755.011)。
[1635]
实施例3:dota-ttds-leu-[cys(3mebn)-pro-pro-thr-glu-phe-cys]-asp-his-phe-arg-asp-nh2(3bp-3172)的合成
nh2(3bp-3692)的合成
[1642]
肽的序列(h-cys-pro-pro-thr-gln-phe-cys-asp-nh2)根据“自动化/半自动化固相合成通用程序”以50μmol规模在rink酰胺树脂上组装。通过用正戊基磺酰氯(42.7μl,300μmol,6eq)和2,4,6-三甲基吡啶(29.7μl,225μmol,4.5eq)溶液处理树脂结合的肽来连接n末端磺酰胺。搅拌过夜后,彻底清洗树脂并进行“裂解方法b”方案。将冻干的剩余物(线性肽戊基-so2-cys-pro-pro-thr-gln-phe-cys-asp-nh2)溶解在60ml的碳酸氢铵溶液(50mm,ph=8.5)和乙腈的1:1混合物中。向这个混合物中加入在0.5ml乙腈中26.8mg的1,3,5-三(溴甲基)苯(75μmol,与初始树脂加载相比为1.5eq)溶液。将溶液搅拌1小时后,加入43mg哌嗪(500μmol,与初始树脂加载相比为10eq)。2小时后,添加50μl tfa并通过冻干除去溶剂。对剩余物进行hplc纯化(30分钟内15%至45%b,kinetex),得到9.15mg(7.4μmol)肽中间体戊基-so
2-[cys(tmebn(h-pp))-pro-pro-thr-gln-phe-cys]-asp-nh2(14.7%)。向后者溶液中加入在150μldmso中2.5μl dipea,以将ph值调节至约7.5-8。然后加入在100μl dmso中8.4mg的dota-nhs(11μmol,与肽中间体相比为1.5eq)。在lc/tof-ms监测反应期间,添加3次2.5μldipea,以将ph值重新调整至起始值。反应完成后,对溶液进行hplc纯化(30分钟内15%至45%b,kinetex),得到7.09mg纯标题化合物(总收率8.7%)。hplc:r
t
=6.0分钟。lc/tof-ms:精确质量1628.706(计算值1628.704)。c
72h108n16o21
s3(mw=1629.924)。
[1643]
实施例7:hex-[cys(tmebn(h-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-4089)的合成
[1644]
实施例7a:通过两种不同的方法合成hex-[cys(tmebn(h-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-4089)
[1645]
标题化合物的合成通过首先在固相上合成线性肽前体并随后进行溶液相环化(在非水溶液中(方法a)或在水溶液中(方法b))或通过在固相上进行所有步骤而合成。后一种方法(实施例7b)作为进一步衍生化的起点。
[1646]
对于第一种方法(实施例7a),将fmoc-cys(trt)-oh按照“自动化/半自动化固相合成通用程序”中所述以50μmol规模加载到三苯甲基树脂上。根据“自动化/半自动化固相合成通用程序”将肽的序列(hex-cys-pro-pro-thr-gln-phe-cys-oh)组装到这个树脂上。在执行“裂解方法b”的步骤后,将粗制肽冻干并通过两种替代方法在溶液中环化。
[1647]
环化方法a:
[1648]
将粗制肽(基于50μmol树脂加载量)溶解在10ml乙醇和乙腈的1:1混合物中。首先向这个混合物中加入35μl dipea,然后加入23.7mg的1,3,5-三(溴甲基)苯(66.6μmol,与初始树脂加载相比为1.3eq)。将溶液搅拌1小时,然后加入42.8mg半胱胺(555μmol,与初始树脂加载相比为11eq)。1小时后,真空除去溶剂并加入25ml乙腈和水的1:1混合物(含有50μl tfa)。通过冻干除去溶剂。对剩余物进行hplc纯化(30分钟内15%至45%b,kinetex),得到17.8mg(16.4μmol)中间体hex-[cys(tmebn(h-aet))-pro-pro-thr-gln-phe-cys]-oh(32.8%)。
[1649]
环化方法b:
[1650]
将粗制肽(基于50μmol树脂加载量)溶解在60ml碳酸氢铵溶液(50mm,ph=8.5)和乙腈的1:1混合物中。向这个混合物中加入在0.5ml乙腈中26.8mg的1,3,5-三(溴甲基)苯(75μmol,与初始树脂加载相比为1.5eq)溶液。将溶液搅拌1小时,然后加入38.6mg半胱胺
(500μmol,与初始树脂加载相比为10eq)。2小时后,加入50μl tfa并通过冻干除去溶剂。对剩余物进行hplc纯化(30分钟内15%至45%b,kinetex),得到19.47mg(18μmol)hex-[cys(tmebn(h-aet))-pro-pro-thr-gln-phe-cys]-oh(35.9%)。
[1651]
这两种基于溶液的环化方法表现相似,并达到相当的产率和相似的纯度。
[1652]
实施例7b:合成hex-[cys(tmebn(h-aet))-pro-pro-thr(tbu)-gln(trt)-phe-cys]-o-wang-tentagel(结合在肽树脂上的3bp-4089)
[1653]
为了合成树脂结合的标题化合物,使用fmoc-cys(trt)-wang tentagel树脂为起始材料。根据“自动化/半自动化固相合成通用程序”,以1mmol规模将肽的序列(hex-cys(trt)-pro-pro-thr(tbu)-gln(trt)-phe-cys-oh)在后者所述树脂上组装。序列组装完成后,用dcm洗涤树脂(3
×
1分钟)。然后,用tfa、tips和dcm的溶液(5/5/90,5
×
5分钟)处理树脂,从树脂上选择性除去三苯甲基保护基团。将树脂用dcm、dmf、在dmf中0.9m dipea溶液、dmf、dcm(3/3/2/3/3)洗涤并真空干燥。以200μmol份进行以下环化。为此,将树脂在dmf中溶胀,然后用在2ml dmf中1,3,5-三(溴甲基)苯(86mg,240μmol,1.2eq)、dipea(235μl,1mmol,5eq)溶液在50℃处理90分钟。除去溶液,用dmf洗涤树脂,然后将半胱胺(154.3mg,2mmol,10eq)溶液加入树脂中。将树脂在50℃下再搅拌90分钟。在用dmf和dcm(3/3)洗涤树脂后,使肽树脂(hex-[cys(tmebn(h-aet))-pro-pro-thr(tbu)-gln(trt)-phe-cys]-o-wang-tentagel)干燥并保存用于进一步衍生化。通过该过程,谷氨酰胺上的三苯甲基可能部分或完全脱保护。无论如何,这不会干扰aet游离氨基的任选衍生化。
[1654]
实施例8a):合成hex-[cys(tmebn(dota-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-3554)
[1655]
向hex-[cys(tmebn(h-aet))-pro-pro-thr-gln-phe-cys]-oh(19.5mg,18μmol,3bp-4089,实施例7a中所述)在300μl dmso中的溶液内加入5μl dipea,以将ph值调节至约7.5-8。然后加入在200μl dmso中的20.5mg dota-nhs(27μmol,与肽中间体相比为1.5eq)。在lc/tof-ms监测反应期间,加入3次5μl dipea,以将ph值重新调整至起始值。反应完成后,对溶液进行hplc纯化(30分钟15%至45%b,kinetex),得到20.44mg纯标题化合物(产率77.4%)。hplc:r
t
=5.9分钟。lc/tof-ms:精确质量1469.640(计算值1469.639)。c
67h99n13o18
s3(mw=1470.780)。
[1656]
实施例8b):合成nbu-cayl-[cys(tmebn(dota-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-3940)
[1657]
使用与合成3bp-3554类似的方法(实施例7a,环化方法a和实施例8a))来合成标题化合物。唯一的区别是,在组装线性肽序列后,通过在dmf中的异氰酸丁酯(5eq)和dipea(10eq)在室温下过夜反应引入末端脲部分。环化步骤和dota引入通过相同的方法进行。
[1658]
在hplc纯化后(30分钟内15%至40%b,kinetex),分离出28.28mg纯标题化合物(25.6%产率)。hplc:r
t
=5.8分钟。lc/tof-ms:精确质量1470.644(计算值1470.635)。c
66h98n14o18
s3(mw=1471.768)。
[1659]
实施例9:合成hex-[cys-(tmebn(nodaga-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-4162)
[1660]
将(r)-noda-ga(tbu)
3-oh(50mg,92μmol,1eq)、hatu(35mg,92μmol,1eq)和dipea(32μl,184μmol,2eq)溶解于0.4ml dmf中。将混合物搅拌2分钟以确保螯合剂构建块的预活
thr-gln-phe-cys]-oh(3bp-4170)
[1668]
根据“自动化/半自动化固相合成通用程序”所述,以100μmol规模将fmoc-ttds-oh加载到三苯甲基树脂上。根据“自动化/半自动化固相合成通用程序”将序列(bio-ttds-ttds-ttds-ttds-oh)在这个树脂上组装。执行“裂解方法b”的步骤后,将剩余物冻干并进行hplc纯化,得到116.8mg(80%)纯化的中间产物。将bio-ttds-ttds-ttds-ttds-oh(86mg,59μmol,1eq)、hatu(22.4mg,59μmol,1eq)和dipea(20.5μl,120μmol,2eq)溶解于1ml dmf中。将混合物搅拌2分钟以确保生物素-接头缀合物构建块的预活化。然后将这个混合物加入hex-[cys(tmebn(h-aet))-pro-pro-thr-gln-phe-cys]-oh(64mg,59μmol,3bp-4089-如实施例7a)所述)在2ml dmf中的溶液内,加入20μl dipea以将肽溶液的ph值调节至大约7.5-8。120分钟后,在真空中除去所有挥发物,并对剩余物进行冻干。对剩余物进行hplc纯化(30分钟内20%至45%b,kinetex),得到27.46mg纯标题化合物(18%产率)。hplc:r
t
=7.3分钟。lc/tof-ms:精确质量2518.274(计算值2518.273)。c
117h191n19o33
s4(mw=2520.145)。
[1669]
实施例14:合成hex-[cys-(tmebn(dtpa-o2oc-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-4224)
[1670]
将boc-o2oc-oh(二环己胺盐)(20.5mg,46μmol,1eq)、oxyma(9.8mg,69μmol,1.5eq)和dic(10.7μl,69μmol)溶解在dmf中,并搅拌5分钟以确保接头构建块的预活化。然后将这个混合物加入hex-[cys(tmebn(h-aet))-pro-pro-thr-gln-phe-cys]-oh(50mg,46μmol,3bp-4089-如实施例7a)所述)在2ml dmf中的溶液内,加入20μl dipea以将肽溶液的ph值调节至约7.5-8。4小时后,预活化另一部分boc-o2oc-oh(与上述等量)并添加到肽反应溶液中。将这个混合物搅拌过夜。然后真空除去所有挥发物并将剩余物从水/乙腈中冻干。对冷冻干燥的粗产物进行“裂解方法c”以除去boc保护基团,随后通过制备型hplc纯化(30分钟内15%至45%b,kinetex),得到16.25mg纯中间肽hex-[cys(tmebn(h-o2oc-aet))-pro-pro-thr-gln-phe-cys]-oh(29%产率)。对于下一步,将dtpa(tbu)
4-oh(二乙烯三胺-n,n,n”,n
”‑
乙酸四叔丁酯-n
’‑
乙酸)(8.2mg,13.2μmol,1eq)、hatu(5mg,13.2μmol,1eq)和dipea(4.6μl,26.4μmol,2eq)溶解在100μl dmf中。在搅拌2分钟以确保螯合剂构建块预活化后,将这个混合物添加到16.25mg中间肽(13.2μmol)的溶液中,该溶液的ph值已通过加入5μl dipea调节至约7.5-8。180分钟后,真空除去所有挥发物,并对剩余物进行hplc纯化(30分钟内35%至75%b,kinetex),得到12.76mg(7μmol)纯保护的中间肽hex-[cys(tmebn(dtpa(tbu)
4-o2oc-aet))-pro-pro-thr-gln-phe-cys]-oh(53%产率)。对后者中间肽进行“裂解方法c”,真空除去所有挥发物,并对剩余物进行hplc纯化(30分钟内15%至45%b,kinetex),得到5.9mg(3.7μmol)纯标题化合物(53%产率,总产率:8%)。hplc:r
t
=6.6分钟。lc/tof-ms:精确质量1603.661(计算值1603.661)。c
71h105n13o23
s3(mw=1604.868)。
[1671]
实施例15:合成hex-[cys-(tmebn(h-hynic-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-4342)
[1672]
将boc-hynic-oh(9.2mg,36μmol,1.3eq)、hatu(13.7mg,36μmol,1.3eq)和dipea(12.2μl,72μmol,2.6eq)溶解于250μl dmf中。将混合物搅拌2分钟以确保螯合剂-接头构建块的预活化。然后将该混合物添加至hex-[cys(tmebn(h-aet))-pro-pro-thr-gln-phe-cys]-oh(30mg,27.8μmol,1eq,3bp-4089-如实施例7a)所述)在400μl dmf中的溶液内,加入10μl dipea以将肽溶液的ph值调节至大约7.5-8。60分钟后,在真空中除去所有挥发物,将
剩余物重新溶解在dmso中,并将该溶液进行hplc纯化(30分钟内25%至55%b,kinetex),得到17.8mg(13.5μmol,48.5%)的中间保护的肽。通过用hcl(37%,40μl)处理所述肽以去除boc保护基团。将所得混合物用乙酸钠缓冲液(ph 4.5,1.8ml)和乙腈(0.2ml)溶解,并将溶液进行hplc纯化(在30分钟内20%至50%b(0.02%甲酸代替0.1%tfa),kinetex),得到1.15mg(0.9μmol)纯标题化合物(7%产率,总产率:3.4%)。hplc:r
t
=6.9分钟。lc/tof-ms:精确质量1218.505(计算值1218.502)。c
57h78n12o12
s3(mw=1219.503)。
[1673]
实施例16:合成hex-[cys-(tmebn(nota-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-4310)
[1674]
合成标题化合物的起点是来自实施例7b的3bp-4089肽树脂(hex-[cys(tmebn(h-aet))-pro-pro-thr(tbu)-gln(trt)-phe-cys]-o-wang-tentagel),以100μmol规模使用。根据“自动化/半自动化固相合成通用程序”,偶联nota(tbu)
2-oh(2-(4,7-二(2-(叔丁氧基)-2-氧代乙基)-1,4,7-三氮杂环壬烷-1-基)乙酸)。干燥后,对树脂进行“裂解方法b”。将粗制肽冻干,随后通过制备型hplc(30分钟内20%至45%b,kinetex)纯化,得到5.6mg(4.1μmol)纯标题化合物(4%)。hplc:r
t
=6.8分钟。lc/tof-ms:精确质量1368.592(计算值1368.592)。c
63h92n12o16
s3(mw=1369.676)。
[1675]
实施例17:合成hex-[cys-(tmebn(dtpa2-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-4309)
[1676]
合成标题化合物的起点是来自实施例7b的3bp-4089肽树脂(hex-[cys(tmebn(h-aet))-pro-pro-thr(tbu)-gln(trt)-phe-cys]-o-wang-tentagel),以100μmol规模使用。根据“自动化/半自动化固相合成通用程序”,偶联dtpa2(tbu)
4-oh(3,6,9-三(2-(叔丁氧基)-2-氧代乙基)-13,13-二甲基-11-氧代-12-氧杂-3,6,9-三氮杂十四烷-1-酸)。干燥后,对树脂进行“裂解方法b”。将粗制肽冻干,随后通过制备型hplc(30分钟内20%至45%b,kinetex)纯化,得到5.8mg(3.9μmol)纯标题化合物(3.9%)。hplc:r
t
=6.5分钟。lc/tof-ms:精确质量1458.587(计算值1458.587)。c
65h94n12o20
s3(mw=1459.711)。
[1677]
实施例18:hex-[cys-(tmebn(nodaga-o2oc-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-4251)的合成
[1678]
合成标题化合物的起点是来自实施例7b的3bp-4089肽树脂(hex-[cys(tmebn(h-aet))-pro-pro-thr(tbu)-gln(trt)-phe-cys]-o-wang-tentagel),以50μmol规模使用。根据“自动化/半自动化固相合成通用程序”,连续偶联fmoc-o2oc-oh和(r)-noda-ga(tbu)
3-oh。干燥后,对树脂进行“裂解方法b”。将粗制肽冻干,随后通过制备型hplc(30分钟内15%至45%b,kinetex)纯化,得到4.31mg(2.7μmol)纯标题化合物(5.4%)。hplc:r
t
=6.7分钟。lc/tof-ms:精确质量1585.687(计算值1585.687)。c
72h107n13o21
s3(mw=1586.896)。
[1679]
实施例19:合成hex-[cys-(tmebn(nota-ttds-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-4344)
[1680]
合成标题化合物的起点是来自实施例7b的3bp-4089肽树脂(hex-[cys(tmebn(h-aet))-pro-pro-thr(tbu)-gln(trt)-phe-cys]-o-wang-tentagel),以100μmol规模使用。根据“自动化/半自动化固相合成通用程序”连续偶联fmoc-ttds-oh和nota(tbu)
2-oh(2-(4,7-二(2-(叔丁氧基)-2-氧代乙基)-1,4,7-三氮杂环壬烷-1-基)乙酸)。干燥后,对树脂进行“裂解方法b”。将粗制肽冻干,随后通过制备型hplc(30分钟内20%至45%b,kinetex)
纯化,得到10.1mg(6.0μmol)纯标题化合物(6%)。hplc:r
t
=6.8分钟。lc/tof-ms:精确质量1670.776(计算值1670.776)。c
77h118n14o21
s3(mw=1672.043)。
[1681]
实施例20:合成hex-[cys-(tmebn(dtpa2-ttds-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-4352)
[1682]
合成标题化合物的起始点是来自实施例7b的3bp-4089肽树脂(hex-[cys(tmebn(h-aet))-pro-pro-thr(tbu)-gln(trt)-phe-cys]-o-wang-tentagel),以100μmol规模使用。根据“自动化/半自动化固相合成通用程序”,偶联fmoc-ttds-oh和dtpa2(tbu)
4-oh(3,6,9-三(2-(叔丁氧基)-2-氧代乙基)-13,13-二甲基-11-氧代-12-氧杂-3,6,9-三氮杂十四烷-1-酸)。干燥后,对树脂进行“裂解方法b”。将粗制肽冻干,随后通过制备型hplc(30分钟内20%至45%b,kinetex)纯化,得到6.87mg(3.9μmol)纯标题化合物(3.9%)。hplc:r
t
=6.7分钟。lc/tof-ms:精确质量1760.771(计算值1760.771)。c
79h120n14o25
s3(mw=1762.078)。
[1683]
实施例21:hex-[cys-(tmebn(h-sac-ser-ser-ser-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-4301)的合成
[1684]
合成标题化合物的起点是来自实施例7b的3bp-4089肽树脂(hex-[cys(tmebn(h-aet))-pro-pro-thr(tbu)-gln(trt)-phe-cys]-o-wang-tentagel),以100μmol规模使用。根据“自动化/半自动化固相合成通用程序”,偶联3次fmoc-ser(tbu)-oh,然后偶联三苯甲基巯基乙酸。干燥后,对树脂进行“裂解方法b”。将粗制肽冻干,随后通过制备型hplc(30分钟内20%至45%b,kinetex)纯化,得到5.25mg(3.7μmol)纯标题化合物(3.7%)。hplc:r
t
=6.8分钟。lc/tof-ms:精确质量1418.553(计算值1418.538)。c
62h90n12o18
s4(mw=1419.714)。
[1685]
实施例22:hex-[cys-(tmebn(h-asp-asp-cys-ttds-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-4302)的合成
[1686]
合成标题化合物的起始点是来自实施例7b的3bp-4089肽树脂(hex-[cys(tmebn(h-aet))-pro-pro-thr(tbu)-gln(trt)-phe-cys]-o-wang-tentagel),以100μmol规模使用。根据“自动化/半自动化固相合成通用程序”,偶联fmoc-ttds-oh、fmoc-cys(trt)-oh和偶联两次fmoc-asp(otbu)-oh。干燥后,对树脂进行“裂解方法b”。将粗制肽冻干,随后通过制备型hplc(30分钟内20%至45%b,kinetex)纯化,得到5.52mg(3.2μmol)纯标题化合物(3.2%)。hplc:r
t
=6.8分钟。lc/tof-ms:精确质量1718.705(计算值1718.706)。c
76h114n14o23
s4(mw=1720.066)。
[1687]
实施例23:hex-[cys-(tmebn(dtpabzl-glutar-aet))-pro-pro-thr-gln-phe-cys]-oh(3bp-4366)的合成
[1688]
合成标题化合物的起点是来自实施例7b的3bp-4089肽树脂(hex-[cys(tmebn(h-aet))-pro-pro-thr(tbu)-gln(trt)-phe-cys]-o-wang-tentagel),以100μmol规模使用。将戊二酸酐(57mg,0.5mmol,5eq)和dipea(165μl,1mmol,10eq)溶解在dmf(3ml)中,将溶液添加到树脂中并将后者搅拌1小时。将p-nh2-bn-dtpa(otbu)5(s-2-(4-氨基苄基)-二乙烯三胺乙酸五叔丁酯,155mg,200μmol,2eq.)、oxyma(27.2mg,200μmol,2eq.)、dipea(70μl,400μmol,4eq.)和dic(31μl,200μmol,2eq.)溶解于dmf(1.7ml)中,将溶液添加到树脂中,并将后者在50℃搅拌90分钟。重复添加dic并在50℃下重复搅拌树脂另外90分钟。此后加入另一部分dic并将树脂在室温下搅拌过夜。接下来,再重复3次添加dic并随后在50℃下搅拌。
然后洗涤树脂并进行“裂解方法b”。将粗制肽冻干,随后通过制备型hplc(30分钟内20%至40%b,kinetex)纯化,得到10.53mg(6.3μmol)纯标题化合物(6.3%)。hplc:r
t
=7.0分钟。lc/tof-ms:精确质量1677.688(计算值1677.676)。c
77h107n13o23
s3(mw=1678.948)。
[1689]
实施例24:合成hex-[cys(tmebn(dota-aet))-pro-pro-thr-gln-phe-aet](3bp-3654)
[1690]
这个合成按照实施例7a中描述的合成3bp-3554进行,不同的是使用可商购的预加载的氨基乙硫醇三苯甲基树脂来组装线性肽前体hex-cys-pro-pro-thr-gln-phe-aet。进行实施例7中描述的所有步骤后,hplc纯化(30分钟内15%至45%b,kinetex)最终产生21.25mg纯标题化合物(总产率29.8%)。hplc:r
t
=6.2分钟。lc/tof-ms:精确质量1425.661(计算值1425.649)。c
66h99n13o16
s3(mw=1426.771)。
[1691]
实施例25:合成hex-[cys(tmebn(dota-aet))-pro-pro-thr-gln-phe-cysol](3bp-3762)
[1692]
这个合成按照实施例7a中描述的合成3bp-3554进行,不同之处在于将fmoc-半胱氨醇(trt)-oh加载到三苯甲基树脂上。与“自动化/半自动化固相合成通用程序”中的描述不同,这是通过以下方式实现的:将50μmol三苯甲基树脂在thf中溶胀,然后用无水thf洗涤(3次)。然后用在无水thf(1ml)中fmoc-半胱氨醇(trt)-oh(57mg,100μmol,2eq)和吡啶(16.1μl,200μmol,4eq)的溶液在60℃下处理树脂20小时。彻底洗涤树脂后(thf、meoh、dcm、dmf,3ml,3
×
1分钟),如“自动化/半自动化固相合成通用程序”所述组装线性肽前体hex-cys-pro-pro-thr-gln-phe-cysol。在进行实施例7中描述的所有步骤后,hplc纯化(30分钟内15%至45%b,kinetex)最终产生7.8mg纯标题化合物(10.7%总产率)。hplc:r
t
=5.9分钟。lc/tof-ms:精确质量1455.666(计算值1455.660)。c
67h101n13o17
s3(mw=1456.797)。
[1693]
实施例26:合成hex-[cys(tmebn(dota-pp))-pro-pro-thr-gln-phe-cys]-asp-nh2(3bp-3407)
[1694]
a)通过两种不同环化方法合成中间体hex-[cys(tmebn(h-pp))-pro-pro-thr-gln-phe-cys]-asp-nh2[1695]
肽的序列(hex-cys-pro-pro-thr-gln-phe-cys-asp-nh2)根据“自动化/半自动化固相合成通用程序”以50μmol规模在rink酰胺树脂上组装。执行“裂解方法b”的步骤后,将粗制肽冻干并通过两种替代方法环化。
[1696]
环化方法a:
[1697]
将粗制肽(基于50μmol树脂加载量)溶解在10ml乙醇和乙腈的1:1混合物中。首先向该混合物中添加30μl dipea,然后添加26.8mg的1,3,5-三(溴甲基)苯(75μmol,与初始树脂加载相比为1.5eq)。将溶液搅拌45分钟后,加入在200μl乙醇/乙腈的1:1混合物中的43mg哌嗪(500μmol,与初始树脂加载相比为10eq)溶液。1小时后,真空除去溶剂,加入25ml乙腈和水的1:1混合物(含有50μltfa),并通过冻干除去溶剂。对剩余物进行hplc纯化(30分钟内15%至40%b,kinetex),得到15.3mg(12.7μmol)肽中间体hex-cys(tmebn(h-pp))-pro-pro-thr-gln-phe-cys]-asp-nh2(25.3%)。
[1698]
环化方法b:
[1699]
将粗制肽(基于50μmol树脂加载量)溶解于60ml碳酸氢铵溶液(50mm,ph=8.5)和乙腈的1:1混合物中。向该混合物中添加26.8mg的1,3,5-三(溴甲基)苯(75μmol,与初始树
脂加载相比为1.5eq)。将溶液搅拌1小时并加入43mg哌嗪(500μmol,与初始树脂加载相比为10eq)。6小时后,加入100μl tfa并通过冻干除去溶剂。对剩余物进行hplc纯化(30分钟内15%至40%b,kinetex),得到17.2mg(14.2μmol)肽中间体hex-cys(tmebn(h-pp))-pro-pro-thr-gln-phe-cys]-asp-nh2(28.4%)。
[1700]
两种环化方法表现相似,并达到相当的产率和相似的纯度。
[1701]
b)合成hex-[cys(tmebn(dota-pp))-pro-pro-thr-gln-phe-cys]-asp-nh2(3bp-3407)的最终步骤:dota-偶联和纯化
[1702]
向在200μl dmso中的中间体(通过环化方法b获得)溶液中加入2.5μl dipea,将ph值调节至约7.5-8。然后加入在100μl dmso中的16.3mg的dota-nhs(21.4μmol,与肽中间体相比为1.5eq)。在lc/tof-ms监测反应期间,添加5次2.5μl dipea,以将ph值重新调整至起始值。反应完成后,对溶液进行hplc纯化(30分钟内15%至40%b,kinetex),得到19.1mg(12.0μmol)纯标题化合物(85%)。hplc:r
t
=5.70分钟。lc/tof-ms:精确质量1592.737(计算值1592.737)。c
73h108n16o20
s2(mw=1593.866)。
[1703]
实施例27:合成hex-[cys(3mebn)-pro-pro-thr-gln-phe-cys]-asp-nh2(3bp-3476)
[1704]
肽的序列(hex-cys-pro-pro-thr-gln-phe-cys-asp-nh2)根据“自动化/半自动化固相合成通用程序”以50μmol规模在rink酰胺树脂上组装。执行“裂解方法b”的步骤后,将粗制肽冻干并通过两种替代方法环化。
[1705]
环化方法a:
[1706]
将粗制肽(基于50μmol树脂加载量)溶解在10ml乙醇和乙腈的1:1混合物中。首先向该混合物中添加25μl dipea,然后添加在60μl乙腈/乙醇1:1混合物中的15.9mg的1,3,5-三(溴甲基)苯(60μmol,与初始树脂加载相比为1.2eq)溶液。将溶液搅拌90分钟,然后添加77mg二硫苏糖醇(500μmol,与初始树脂加载相比为10eq)。搅拌过夜后,真空除去溶剂并加入30ml乙腈和水的1:1混合物(含有50μl tfa)。通过冻干除去溶剂。对剩余物进行hplc纯化(30分钟内15%至40%b,kinetex),得到16.0mg(14.4μmol)纯标题化合物(28.8%)。hplc:r
t
=7.36分钟。lc/tof-ms:精确质量1108.476(计算值1108.472)。c
52h72n10o13
s2(mw=1109.320)。
[1707]
环化方法b:
[1708]
将冻干的粗制肽(基于50μmol树脂加载量)溶解在60ml碳酸氢铵溶液(50mm,ph=8.5)和乙腈的1:1混合物中。向该混合物中添加在0.5ml乙腈中15.8mg的α,α
’‑
二溴间二甲苯(60μmol,与初始树脂加载量相比为1.2eq)溶液。环化反应完成后,加入50μl tfa,并通过冻干除去溶剂。对剩余物进行hplc纯化(30分钟内25%至45%b,kinetex),得到16.9mg(15.2μmol)纯标题化合物(30.4%)。hplc:r
t
=7.24分钟。lc/tof-ms:精确质量1108.476(计算值1108.472)。c
52h72n10o13
s2(mw=1109.320)。
[1709]
两种环化方法(a和b)在产率和纯度方面效果相似,因此均可应用。
[1710]
实施例28:制备本发明化合物的dota-过渡金属络合物
[1711]
a.由包含未络合的dota的相应肽制备包含dota-过渡金属络合物的肽的通用程序
[1712]
将由在以下溶液中的未络合的dota包含的0.1mm肽溶液
[1713]
·
0.4m乙酸钠,ph=5(缓冲液a)(在cu(ii)、zn(ii)、in(iii)、lu(iii)或ga(iii)
络合物的情况中),或
[1714]
·
0.1m醋酸铵,ph=8(缓冲液b)(在eu(iii)络合物的情况中)
[1715]
用0.1mm相应金属盐的水溶液稀释,由此将肽与金属的摩尔比调节至1:3。在以下条件下搅拌溶液:
[1716]
·
在50℃下持续20分钟(本文也称为条件a)(在in(iii)、lu(iii)、ga(iii)、zn(ii)或cu(ii)络合物的情况下),或
[1717]
·
在室温下过夜(本文也称为条件b)(在eu(iii)络合物的情况下)。
[1718]
然后将所述溶液应用于:
[1719]
·
hplc纯化(本文也称为纯化a),或
[1720]
·
固相萃取(本文也称为纯化b)。
[1721]
在固相萃取的情况下,将250mg的varian bondesil-env置入15ml聚苯乙烯注射器中,用甲醇(1
×
5ml)和水(2
×
5ml)预洗涤。然后将反应溶液施加于柱。此后用水(2
×
5ml-以去除多余的盐)、5ml50%acn水溶液作为第一级分进行洗脱,接下来的每个级分均用5ml 50%acn水溶液(含0.1%tfa)进行洗脱。
[1722]
在任一情况下(hplc纯化或固相萃取),将含有纯产物的级分合并并冷冻干燥。
[1723]
b.hex-[cys(tmebn(dota-pp))-pro-pro-thr-gln-phe-cys]-asp-nh2的铟络合物(3bp-3590)
[1724]
所述络合物的制备起自将25mg肽3bp-3407(15.7μmol)溶解在缓冲液a中,用incl3×
4h2o溶液稀释,并用条件a处理。在纯化步骤中,采用“纯化a”(30分钟内15%至40%b,rlrp-s),得到18.24mg纯标题化合物(产率68.1%)。hplc:r
t
=5.6分钟。lc/tof-ms:精确质量1702.622(计算值1702.617)。c
73h105
inn
16o20
s2(mw=1705.663)。
[1725]
c.hex-[cys(tmebn(dota-pp))-pro-pro-thr-gln-phe-cys]-asp-nh2的镓络合物(3bp-3592)
[1726]
所述络合物的制备起自将25mg肽3bp-3407(15.7μmol)溶解在缓冲液a中,用ga(no3)3×
h2o溶液稀释并用条件a处理。在纯化步骤中,采用“纯化a”(30分钟内15%至40%b,rlrp-s),得到16.78mg纯标题化合物(产率69.3%)。hplc:r
t
=5.7分钟。lc/tof-ms:精确质量1658.664(计算值1658.639)。c
73h105
gan
16o20
s2(mw=1660.568)。
[1727]
d.hex-[cys(tmebn(dota-pp))-pro-pro-thr-gln-phe-cys]-asp-nh2的镥络合物(3bp-3591)
[1728]
所述络合物的制备起自将25mg肽3bp-3407(15.7μmol)溶解在缓冲液a中,用lucl3溶液稀释并用条件a处理。在纯化步骤中,采用“纯化a”(30分钟内15%至40%b),rlrp-s),得到16.66mg纯标题化合物(产率60.1%)。hplc:r
t
=5.6分钟。lc/tof-ms:精确质量1764.654(计算值1764.654)。c
73h105
lun
16o20
s2(mw=1765.812)。
[1729]
e.hex-[cys(tmebn(dota-pp))-pro-pro-thr-gln-phe-cys]-asp-nh2的铕络合物(3bp-3661)
[1730]
所述络合物的制备起自将9.5mg肽(6μmol)3bp-3407溶解在缓冲液b中,用eucl3×
6h2o溶液稀释并用条件b处理。在纯化步骤中,采用“纯化b”,得到8.24mg纯标题化合物(产率79.3%)。hplc:r
t
=5.7分钟。lc/tof-ms:精确质量1740.636(计算值1740.633)。c
73h105
eun
16o20
s2(mw=1742.809)。
[1731]
f.hex-[cys(tmebn(dota-aet))-pro-pro-thr-gln-phe-cys]-oh的铟络合物(3bp-3623)
[1732]
所述络合物的制备起自将6mg肽3bp-3554(4.1μmol)溶解在缓冲液a中,用incl3×
4h2o溶液稀释并用条件a处理。在纯化步骤中,采用“纯化b”,得到5.26mg纯标题化合物(产率81%)。hplc:r
t
=5.8分钟。lc/tof-ms:精确质量1579.524(计算值1579.520)。c
67h96
inn
13o18
s3(mw=1582.574)。
[1733]
g.hex-[cys(tmebn(dota-aet))-pro-pro-thr-gln-phe-cys]-oh的镥络合物(3bp-3624)
[1734]
所述络合物的制备起自将6mg肽3bp-3554(4.1μmol)溶解在缓冲液a中,用lucl3溶液稀释并用条件a处理。在纯化步骤中,采用“纯化b”,得到5.5mg纯标题化合物(产率82%)。hplc:r
t
=5.9分钟。lc/tof-ms:精确质量1641.560(计算值1641.557)。c
67h96
lun
13o18
s3(mw=1642.723)。
[1735]
h.hex-[cys(tmebn(dota-aet))-pro-pro-thr-gln-phe-cys]-oh的镓络合物(3bp-3949)
[1736]
所述络合物的制备起自将7.9mg肽3bp-3554(5.4μmol)溶解在缓冲液a中,用ga(no3)3×
h2o溶液稀释并用条件a处理。在纯化步骤中,采用“纯化b”,得到4.2mg纯标题化合物(产率51%)。hplc:r
t
=6.6分钟。lc/tof-ms:精确质量1535.543(计算值1535.541)。c
67h96
gan
13o18
s3(mw=1537.479)。
[1737]
i.hex-[cys(tmebn(dota-aet))-pro-pro-thr-gln-phe-cys]-oh的铕络合物(3bp-3662)
[1738]
所述络合物的制备起自将3.4mg肽3bp-3554(2.3μmol)溶解在缓冲液b中,用eucl3×
6h2o溶液稀释并用条件b处理。在纯化步骤中,采用“纯化b”,得到3.1mg纯标题化合物(产率83%)。hplc:r
t
=5.9分钟。lc/tof-ms:精确质量1617.541(计算值1617.536)。c
67h96
eun
13o18
s3(mw=1619.721)。
[1739]
j.hex-[cys(tmebn(dota-aet))-pro-pro-thr-gln-phe-cys]-oh的铜(ii)络合物(3bp-4293)
[1740]
所述络合物的制备起自将18mg肽3bp-3554(12.2μmol)溶解在缓冲液a中,用cu(oac)2溶液稀释并用条件a处理。在纯化步骤中,采用“纯化b”,得到16.5mg纯标题化合物(产率88%)。hplc:r
t
=6.5分钟。lc/tof-ms:精确质量1530.553(计算值1530.553)。c
67h97
cun
13o18
s3(mw=1532.310)。
[1741]
k.hex-[cys(tmebn(dota-aet))-pro-pro-thr-gln-phe-cys]-oh的锌络合物(3bp-4343)
[1742]
所述络合物的制备起自将20mg肽3bp-3554(13.6μmol)溶解在缓冲液a中,用zncl2溶液稀释并用条件a处理。在纯化步骤中,采用“纯化b”,得到16.1mg纯标题化合物(产率77%)。hplc:r
t
=6.4分钟。lc/tof-ms:精确质量1531.553(计算值1531.553)。c
67h97n13o18
s3zn(mw=1534.160)。
[1743]
l.hex-[cys(tmebn(nodaga-aet))-pro-pro-thr-gln-phe-cys]-oh的镓络合物(3bp-4184)
[1744]
所述络合物的制备起自将7.4mg肽3bp-4162(5.1μmol)溶解在缓冲液a中,用ga
(no3)3×
h2o溶液稀释并用条件a处理。在纯化步骤中,采用“纯化b”,得到6.3mg纯标题化合物(产率80%)。hplc:r
t
=6.5分钟。lc/tof-ms:精确质量1506.515(计算值1506.515)。c
66h93
gan
12o18
s3(mw=1508.438)。
[1745]
实施例29:血浆稳定性测定
[1746]
为了测定选择的本发明化合物在人和小鼠血浆中的稳定性,进行了血浆稳定性测定。这种血浆稳定性测定测量了血浆中本发明化合物的降解。这是化合物的一个重要特征,除外的是在血浆中快速降解的前药,通常表现出较差的体内功效。结果表明,这些化合物在人和小鼠血浆中高度稳定。所述稳定性足以用于根据本发明的这些化合物的诊断、治疗和诊断用途。
[1747]
通过在50μl等份血浆(均为k2edta)中加入1μl在dmso中的0.5mm化合物原液溶液来制备血浆稳定性样品。涡旋后,将样品在thermomixer中于37℃下温育0、4和24小时。温育后,将样品储存在冰上直至进一步处理。所有样品均一式两份制备。
[1748]
将合适的内标添加到每个样品中(1μl在dmso中的0.5mm原液溶液)。根据表8所示的化合物条件,使用两种不同的方法进行蛋白质沉淀。
[1749]
a)加入250μl含有1%三氟乙酸的乙腈。室温温育30分钟后,通过离心分离沉淀物,并用150μl的1%甲酸水溶液稀释150μl上清液。
[1750]
b)加入150μl含有78%0.1m硫酸锌和22%乙腈的硫酸锌沉淀剂。在室温下温育30分钟后,通过离心分离沉淀物。如果化合物含有游离dota部分,则向100μl上清液中加入10μl 1%甲酸,然后在60℃进一步温育10分钟以完成锌螯合物的形成。
[1751]
在与agilent 6530q-tof质谱仪联用的agilent 1290uhplc系统上对洁净样品溶液中的分析物进行测定。色谱分离在phenomenex biozen xb-c18 hplc柱(50
×
2mm,1.7μm粒径)上进行,梯度洗脱使用0.1%甲酸水溶液作为洗脱液a,乙腈作为洗脱液b(7分钟内2%至41%b,800μl/min,40℃)。质谱检测采用正离子esi模式,以2/sec的采样率扫描m/z 50至3000的质量范围。
[1752]
从质谱原始数据中提取化合物和内标的双电荷或三电荷单同位素信号的离子电流。
[1753]
使用集成的分析物信号通过具有内标的外部矩阵校准进行定量。
[1754]
此外,通过在用一定量的化合物处理后掺入仅含有内标的纯血浆样品来确定恢复情况。
[1755]
通过分析最高校准样品后的空白样品(20%乙腈)来评估残留。
[1756]
对根据本发明的一些化合物进行这个测定的结果在下表8中给出。结果表示为“4小时或24小时后剩余的完整化合物百分比%”并且是指通过lc-ms定量检测的在实验结束时未变化的材料与实验开始时的材料量的百分比。由于所有化合物在至少4小时后都保持超过50%的完整性,因此它们被认为对于诊断和治疗应用来说足够稳定。
[1757]
表8:血浆稳定性测定结果
[1758]
[1759][1760]
实施例30:facs结合测定
[1761]
为了确定根据本发明的化合物与表达fap的细胞的结合,建立了竞争性facs结合测定法。
[1762]
将表达fap的人wi-38成纤维细胞(ecacc)在包含15%胎牛血清、2mm l-谷氨酰胺和1%非必需氨基酸的emem中培养。用accutase(biolegend,#bld-423201)分离细胞并在facs缓冲液(含1%fbs的pbs)中洗涤。将细胞在facs缓冲液中稀释至终浓度为100,000个细胞/ml,并将200μl细胞悬浮液转移至u形非结合96孔板(greiner)中。将细胞在冰冷的facs缓冲液中洗涤,并与3nm cy5标记的化合物(h-met-[cys(3mebn)-pro-pro-thr-glu-phe-cys]-asp-his-phe-arg-asp-ttds-lys(cy5so3)-nh2)在肽浓度增加的情况下在4℃反应1小时。将细胞用facs缓冲液洗涤两次,并重悬于200μl facs缓冲液中。在attune nxt流式细胞仪中分析细胞。通过attune nxt软件计算中值荧光强度(cy5通道)并针对肽浓度绘图。使用activitybase软件进行四参数logistic(4pl)曲线拟合和pic50计算。对根据本发明的每种化合物进行这个测定的结果以及进行实施例31的fap蛋白酶活性测定的结果呈现在表9中(实施例31中示出)。pic50类别a代表pic50值》8.0,类别b代表pic50值在7.1至8.0之间,类别c代表pic50值在6.1至7.0之间,类别d代表pic50值≤6.0。
[1763]
实施例31:fap蛋白酶活性测定
[1764]
为了确定根据本发明的化合物对表达fap的细胞的抑制活性,建立了基于fret的fap蛋白酶活性测定法。
[1765]
将重组人fap(r&d systems,#3715-se)在测定缓冲液(50mm tris、1m nacl、1mg/ml bsa,ph 7.5)中稀释至浓度为3.6nm。将25μl fap溶液与25μl 3倍连续稀释的测试化合物混合,并在白色96孔proxiplate(perkin elmer)中温育5分钟。使用fret肽hilytefluor
tm
488-vs(d-)p sqg k(520)-nh2作为特异性fap底物(bainbridge,et al.,sci rep,2017,7:12524)。加入25μl在测定缓冲液中稀释的30μm底物溶液。所有溶液在使用前均在37℃平衡。在spectramax m5酶标仪中以动力学模式在37℃测量5分钟底物裂解和荧光增加(在485nm激发,在538nm发射)。通过softmax pro软件计算rfu/sec并针对肽浓度绘图。使用activitybase软件进行四参数logistic(4pl)曲线拟合和pic50计算。表9给出了本发明每种化合物的这个测定结果。pic50类别a代表pic50值》8.0,类别b代表pic50值在7.1至8.0之间,类别c代表pic50值在6.1至7.0之间,类别d代表pic50值≤6.0。
[1766]
从表9可以明显看出,本发明的化合物在facs结合测定和fap蛋白酶活性测定中均显示出令人惊讶的优异结果。
[1767]
除此之外,可以很容易地发现sar数据,该数据表明具有缀合的螯合剂的化合物与不具有螯合剂但具有相似肽序列的化合物具有非常相似的活性。例如,3bp-3168和3bp-3169在c末端具有螯合剂和接头(dota-ttds-nle/met),并且属于pic
50
》8的最高活性类别。在n末端没有螯合剂和接头的相应化合物(具有n末端hex-的3bp-2974、具有n末端ac-met的3bp-2975和具有n末端h-met的3bp-2976)与包含螯合剂的化合物3bp-3168和3bp-3169相比均呈现相似活性。
[1768]
这意味着来自不含螯合剂的化合物的活性数据可预测包含螯合剂的化合物的活性。如果根据其它两种特定的可能性,螯合剂与本发明的化合物缀合,则还另外观察到这个现象。与不具有螯合剂的相应化合物相比,c末端连接螯合剂的示例显示出相同的趋势,这些示例是3bp-3105相对于3bp-2974,3bp-3395或3bp-3397相对于3bp-3476,以及螯合剂连接于yc相对于不具有螯合剂的相应化合物的示例是3bp-3407相对于3bp-3476或3bp-3426相对于3bp-3476。
[1769]
表9:通过hplc及facs结合和fap活性测定的pic50类别确定的化合物id、序列、精确的计算质量、精确的实测质量、以分钟为单位的保留时间
[1770]
[1771]
[1772]
[1773]
[1774]
[1775]
[1776]
[1777]
[1778]
[1779]
[1780]
[1781]
[1782][1783]
实施例32:表面等离子共振测定
[1784]
使用biacoretm t200 spr系统进行表面等离子共振研究。简而言之,将偏振光射向金标记的传感器表面,并检测最小强度的反射光。反射光的角度随着分子结合和解离而变化。金标记的传感器表面载有携带fap靶蛋白的fap抗体,因此抗体结合不会发生在fap的底物结合位点。使测试化合物与加载的表面接触,并在传感图中记录与fap配体的实时相互作用图示。实时测量结合相互作用的缔合与解离,从而能够计算缔合率和解离率常数以及相应的亲和力常数。重要的是,由于运行缓冲液和样品缓冲液的折射率差异,以及测试化合物与流动池表面的非特异性结合,会产生背景响应。在不存在固定的fap的情况下,通过在相同密度捕获抗体包被的对照流动池上运行样品来测量和减去这个背景。此外,还对结合数据进行基线漂移校正,这是由捕获的fap从固定化抗体缓慢解离所致。这种漂移是通过将运行缓冲液注入流动池(其中抗体和fap固定在传感器表面)来测量。
[1785]
使用biacore
tm cm5传感器芯片。将人抗fap抗体(mab3715,r&d systems)在10mm乙酸盐缓冲液(ph 4.5)中稀释至终浓度为50μg/ml。将150μl等分试样转移至塑料瓶中并置入biacore
tm t200仪器的样品架中。将胺偶联试剂盒试剂溶液转移至塑料瓶中并置入样品架中:90μl的0.4m 1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(edc)和90μl的0.1m n-羟基琥珀酰亚胺(nhs)。将130μl的1m乙醇胺-hcl(ph 8.5)等分试样转移至塑料瓶中并置入样品架
中。biacoretm液体系统设置如下:将含有蒸馏水(1l)、运行缓冲液(500ml)的单独瓶子以及用于废物的空瓶子放置在缓冲液托盘上。使用预装的固定程序,固定水平为7000ru。固定化在25℃下进行。如表10中所述进行抗fap抗体的固定程序。
[1786]
表10:cm5传感器芯片上使用的抗fap抗体的固定方案
[1787][1788]
将人重组fap在运行缓冲液中稀释至终浓度为20μg/ml。将100μl等份的人fap工作溶液转移到塑料瓶中并置入样品架中。通过将每种化合物溶解在dmso中制备0.5mm化合物-原液-溶液。对于每种测试化合物,将化合物-原液-溶液在500nm运行缓冲液(hbst)中稀释,并用hbst-dmso缓冲液(0.1%dmso)进一步稀释。二元复合物的spr结合分析在25℃以sck模式进行。表11描述了捕获和评估结合动力学的方案。进行3次sck测量后,通过运行缓冲液注入流动池来评估基线漂移,抗体和fap固定在传感器表面。
[1789]
表11:评估结合动力学的方案
[1790][1791]
对于每种测试化合物,使用biacore
tm t200控制软件将共振单位(ru)形式的spr原始数据绘制为传感图。从测试化合物传感图中减去空白传感图中的信号(空白校正)。通过减去不含测试化合物(仅运行缓冲液)的sck运行的传感图,对空白校正的传感图进行基线漂移校正。使用biacore
tm t200评估软件中的1:1langmuir结合模型,根据空白归一化spr数据计算结合率(k
on
)、解离率(k
off
)、解离常数(kd)和t
1/2
。原始数据和拟合结果作为文本文件导入idbs中。pkd值(解离常数的负十进制对数)在idbs excel模板中计算。
[1792]
选择根据本发明的化合物的这个测定的结果呈现在表12中。类别a代表pkd值》8.0,类别b代表pkd值在7.1至8.0之间,类别c代表pkd值在6.1至7.0之间。
[1793]
表12:biacore测定的化合物id、序列和pkd类别
[1794]
[1795]
[1796][1797]
实施例33:prep和dpp4蛋白酶活性测定
[1798]
为了测试fap结合肽对prep和dpp4的选择性,与上述fap活性测定类似地进行蛋白酶活性测定,但有以下例外。
[1799]
使用重组人prep(r&d systems,#4308-se)测量prep活性。使用50μm z-gp-amc(bachem,#4002518)作为底物。dpp4活性测定在dpp测定缓冲液(25mm tris,ph 8.0)中进行。重组人dpp4购自r&d systems(#9168-se)。使用20μm gp-amc(santa cruz biotechnology,#115035-46-6)作为底物。
[1800]
在spectramax m5酶标仪中,在37℃以动力学模式测量5分钟裂解后amc的荧光(在380nm激发,在460nm发射)。通过softmax pro软件计算rfu/sec并针对肽浓度绘图。使用activitybase软件进行四参数logistic(4pl)曲线拟合和pic50计算。下表13中给出了一些本发明化合物的这个测定结果。
[1801]
表13:prep和dpp4活性测定的结果(pic50值)
[1802]
idpic50(prep)pic50(dpp4)3bp-2881《6《63bp-3105《6《63bp-3168《6《63bp-3275《6《63bp-3287《6《63bp-33196.2《63bp-3320《6《63bp-3321《6《63bp-3349《6《63bp-3397《6《63bp-3398《6《63bp-3407《6《63bp-3419《6《63bp-3426《6《63bp-3476《6《63bp-3554《6《6
[1803]
实施例34:特异性筛选
[1804]
进行特异性筛选是为了及早鉴定本发明化合物的显著脱靶相互作用。使用由
bowes et al.(bowes,et al.,nat rev drug discov,2012,11:909)推荐的标准测定组(safetyscreen44
tm
panel)测试特异性,所述标准测定组包含44个选择的靶标和与其结合的化合物(称为“参考化合物”,ref.compounds)。所述参考化合物用作各个测定的阳性对照,因此预计用这些参考化合物可以检测到抑制作用。然而,预计本发明的化合物在这些测定中不会表现出抑制作用。这些结合和酶抑制测定由eurofins cerep sa(celle l’evescault,france)进行。
[1805]
3bp-3407和3bp-3554在10μm进行测试。化合物结合计算为特异于每个靶标的放射性标记配体的结合抑制百分比%((3bp-3407)或(3bp-3554)分别的“特异性结合抑制百分比%”)。化合物酶抑制效应计算为对照酶活性的抑制百分比%。
[1806]
显示高于50%的抑制或刺激的结果被认为代表测试化合物的显著效应。在下表14中列出的所研究的任何受体中均未观察到此类效应。这个测定的结果总结于下表14中。
[1807]
表14:针对10μm 3bp-3407和10μm 3bp-3554的特异性筛选结果(safetyscreen44
tm
panel)
[1808]
[1809]
[1810]
[1811][1812]
另外,由bps biosciences进行了蛋白酶的特异性筛选,以进一步确定本发明化合物的特异性(turk,nat rev drug discov,2006,5:785;overall,et al.,nat rev cancer,2006,6:227;anderson,et al.,handb exp pharmacol,2009,189:85)。
[1813]
在1μm和10μm下一式两份测试3bp-3407和3bp-3554。在不存在所述化合物的情况下,每个数据集中的荧光强度(ft)被定义为100%活性。在不存在所述酶的情况下,每个数据集中的背景荧光强度(fb)被定义为0%活性。根据以下公式计算存在每种化合物下的活性百分比:%活性=(f-fb)/(ft-fb),其中f=化合物存在下的荧光强度。根据以下公式计算抑制百分比:%抑制=100%-%活性。示出抑制率高于50%的结果被认为代表测试化合物的显著效果。这个测定的结果在下表15中给出。
[1814]
表15:1μm和10μm 3bp-3407以及1μm和10μm 3bp-3554的特异性蛋白酶筛选结果
[1815]
[1816][1817]
[1818]
实施例35:选择的化合物的
111
in-和
177
lu-标记
[1819]
为了充当诊断、治疗或治疗诊断活性剂,化合物需要用放射性同位素标记。所述标记程序需要适当以确保本发明的放射性标记化合物的高放射化学产率和纯度。这个实施例表明本发明的化合物适合于放射性标记并且可以以高放射化学产率和纯度进行标记。
[1820]
将30-100mbq的
111
incl3(在0.02m hcl中)与1nmol化合物(在0.1m hepes ph 7中的200μm原液溶液)/30mbq和缓冲液(1m乙酸钠缓冲液ph 5或1m乙酸钠/抗坏血酸缓冲液ph 5,含有25mg/ml甲硫氨酸)混合,最终缓冲液浓度为0.1-0.2m。将混合物加热至80℃,保持20至30分钟。冷却后,加入dtpa和tween-20,终浓度分别为0.2mm和0.1%。
[1821]
将0.2-2.0gbq 177
lucl3(在0.04m hcl中)与1nmol化合物(在0.1m hepes ph 7中的200μm原液溶液)/45mbq和缓冲液(1m乙酸钠/抗坏血酸缓冲液ph 5,含有25mg/ml甲硫氨酸)混合,最终缓冲液浓度约为0.4m。将混合物加热至90℃,保持20分钟。冷却后,加入dtpa和tween-20,终浓度分别为0.2mm和0.1%。
[1822]
为了评估适合人类使用的制剂中
177
lu标记的化合物的长期稳定性,冷却后将反应混合物用9体积的含有合适稳定剂(例如抗坏血酸、甲硫氨酸)的配制缓冲液稀释并随着时间的推移监测放射化学纯度。
[1823]
通过薄层色谱(tlc)和hplc分析标记效率。对于tlc分析,将1-2μl稀释的标记溶液施用于一条itlc-sg色谱纸(agilent,7.6
×
2.3mm)上,并在柠檬酸盐-葡萄糖溶液(sigma)中生色。然后将itlc条切成3块,并用伽马计数器测量相关的放射性。在溶剂前沿测量的放射性代表游离放射性核素和胶体,而在原点测量的放射性代表放射性标记的化合物。对于hplc,使用poroshell sb-c18 2.7μm(agilent)分析5μl稀释的标记溶液。洗脱液a:mecn,洗脱液b:h2o,0.1%tfa,梯度为15分钟内从5%b至70%b,流速0.5ml/min;检测仪:nai(raytest),dad 230nm。用死体积洗脱的峰代表游离放射性核素,用未标记样品测定的肽特异性保留时间洗脱的峰代表放射性标记的化合物。
[1824]
合成结束时放射性核素掺入率≥90%,放射化学纯度≥76%。
111
in标记化合物的示例性放射化学纯度如表16所示。适合人类使用的制剂中的
177
lu标记化合物在合成后直至6天保持≥90%的放射化学纯度(表17)。选择的化合物的放射色谱图如图1至4所示,其中图1显示了合成后立即分析的在含有100mg/ml抗坏血酸和5mg/ml l-甲硫氨酸的配制缓冲液中
177
lu-3bp-3407的放射色谱图,图2显示了合成后六天分析的在含有100mg/ml抗坏血酸和5mg/ml l-甲硫氨酸的配制缓冲液中
177
lu-3bp-3407的放射色谱图,图3显示了合成后立即分析的在含有100mg/ml抗坏血酸和5mg/ml l-甲硫氨酸的配制缓冲液中
177
lu-3bp-3554的放射色谱图,以及图4显示了合成后六天分析的在含有100mg/ml抗坏血酸和5mg/ml l-甲硫氨酸的配制缓冲液中
177
lu-3bp-3554的放射色谱图。
[1825]
表16:通过hplc测定
111
in标记的化合物的放射化学纯度
[1826][1827][1828]
表17:通过hplc在合成结束后第0天和第6天分析的在含有100mg/ml抗坏血酸和5mg/ml l-甲硫氨酸的配制缓冲液中
177
lu标记的化合物的放射化学纯度。
[1829] hplc保留时间[min]第0天hplc面积%第6天hplc面积%
177
lu-3bp-34077.595.794.0
177
lu-3bp-35547.697.295.6
[1830]
实施例36:成像和生物分布研究
[1831]
放射性标记的化合物可以通过spect和pet等成像方法进行检测。此外,通过这些技术获得的数据可以通过直接测量由注射有放射性标记的本发明化合物的动物制备的各个器官中所含的放射性来确认。因此,可以确定和分析放射性标记化合物的生物分布(测量各个器官中的放射性)。这个实施例表明本发明的化合物显示出适合于肿瘤的诊断成像和治疗性处理的生物分布。
[1832]
所有动物实验均按照德国动物保护法进行。为雄性scid beige小鼠(6至8周龄,charles river,sulzfeld,germany)在一侧肩臂部接种5
×
106个hek-fap(经过基因工程改造以表达高水平fap的人胚胎肾293细胞)细胞。当肿瘤达到》150mm3的尺寸时,小鼠接受经由尾静脉静脉内施用的约30mbq本发明
111
in标记的化合物(用pbs稀释至100μl)。在nanospect/ct系统(mediso medical imaging systems,budapest,hungary)上使用示例性的以下采集和重建参数获得图像(表18)。
[1833]
表18:nanospect/ct成像的采集和重建参数
[1834][1835]
成像数据保存为dicom文件并使用vivoquant
tm
软件(invicro,boston,usa)进行分析。结果表示为每克组织注射剂量的百分比(%id/g)。对于生物分布研究,在注射后24小时或48小时通过颈脱位处死动物,然后解剖。收集不同的器官和组织并称重,并通过γ计数测定放射性。每个时间点使用两只动物。结果表示为每克组织注射剂量的百分比(%id/g)。
[1836]
选择的化合物的成像和生物分布研究结果如图5至14、20和21所示。
[1837]
实施例37:效力研究-hek-fap
[1838]
放射性标记的化合物可用于各种疾病、特别是癌症的治疗和诊断应用。这个实施例表明本发明的化合物具有适合于肿瘤治疗的抗肿瘤活性。
[1839]
所有动物实验均按照德国动物保护法进行。为雌性swiss裸鼠(7至8周龄,charles river laboratories,france)一侧肩膀部接种5
×
106个hek-fap细胞,当肿瘤平均肿瘤体积达到160
±
44mm3时进行治疗。将小鼠分为4个不同组,每组10只动物:第1组,载体对照;第2组,冷化合物
nat
lu-3bp-3554;第3组,30mbq 177
lu-3bp-3554(低剂量)和第4组,60mbq 177
lu-fap-3554(高剂量)。第0天通过尾静脉静脉注射4ml/kg(100μl/小鼠)进行治疗。在第0天(即施用放射性示踪剂的第一天)测量肿瘤体积和体重,然后每周测量三次,直到研究完成。
[1840]
在三组给药小鼠中通过spect成像测定注射
177
lu标记的3bp-3554的小鼠中的示踪剂分布。随后,在spect之后,进行ct扫描以获取解剖信息。注射后3小时、24小时、48小时和120小时用nanospect/ct系统(mediso medical imaging systems,budapest,hungary)使用示例性的以下采集和重建参数进行成像(表19)。
[1841]
表19:nanospect/ct成像的采集和重建参数
[1842][1843]
成像数据保存为dicom文件并使用vivoquant
tm
软件(invicro,boston,usa)进行分析。结果表示为每克组织注射剂量的百分比(%id/g)。
[1844]
载体和冷化合物
nat
lu-3bp-3554处理的小鼠中的肿瘤在第14天分别达到1338
±
670mm3和1392
±
420mm3的平均肿瘤体积(mtv)(图15a)。两个治疗组的小鼠均观察到具有统计学意义(p《0.01)的抗肿瘤活性。相对于载体治疗组,用单剂量30或60mbq的
177
lu-3bp-3554治疗的小鼠在第14天的肿瘤生长抑制(tgi)分别为111%和113%。所有接受
177
lu-3bp-3554治疗的小鼠的mtv在第14天均降至≤70mm3。在第42天(代表研究结束)监测肿瘤的再生长情况,用30或60mbq的
177
lu-3bp-3554治疗的10只小鼠中分别有3只和9只小鼠是无肿瘤的(《10mm3),表明这个模型中潜在的剂量反应。在整个研究过程中没有观察到与治疗相关的体重减轻(图15b)。在第2天观察到所有组的体重下降3-5%后,动物的体重随着时间的推移而增加。
[1845]
两个
177
lu标记的治疗组的3只动物的spect/ct成像在所有检查时间点(注射后(p.i.)3-120小时)均显示出较高的肿瘤-背景对比度。观察到高达120小时的高肿瘤保留。非靶标摄取最高的器官是肾脏,用30或60mbq的
177
lu-3bp3554治疗的小鼠在注射后3小时的肿瘤-肾脏的比率分别为8.6
±
0.6和8.0
±
1.6。这些比率随着时间的推移而增加,在用30或60mbq的
177
lu-3bp3554治疗的小鼠中,在120小时时达到最高值,肿瘤-肾脏的比率分别为40
±
7.9和32
±
7.4。图16a中显示了作为高剂量动物的小鼠5的示例性spect/ct图像组,并且在图16b中显示了作为低剂量动物的小鼠1的示例性spect/ct图像组。
[1846]
实施例38:成像研究-肉瘤pdx模型
[1847]
据报道,肉瘤肿瘤表达fap,并对四种不同的肉瘤患者来源的异种移植(pdx)肿瘤模型进行成像以评估3bp-3554的摄取。sarc4183、sarc4605、sarc4809和sarc12616 pdx模型分别源自横纹肌肉瘤、骨肉瘤、未分化肉瘤和未分化多形性肉瘤患者(experimental pharmacology&oncology berlin-buch,germany)。将肿瘤碎片皮下移植到8周龄nmri nu/nu小鼠(janvier labs,france)的左侧腹部。所有动物实验均按照德国动物保护法进行。移植后47天(sarc4183、sarc4809)或46天(sarc4605、sarc12616),对每个模型2-3只小鼠在单
次静脉注射30mbq的
111
in-3bp-3554后3小时进行成像。如实施例36中所述进行成像。
[1848]
111
in-3bp-3554的成像结果显示在注射后3小时肿瘤摄取量较高,及肿瘤-背景的高对比度。代表性spect/ct图像显示于图17a中。分别对两只(sarc4605、sarc12616)或三只(sarc4183、sarc4809)携带pdx的小鼠的肿瘤摄取进行定量,显示%id/g值为4.9
±
1.7(sarc4183)、5.2
±
0.8(sarc4605)、4.4
±
0.7(sarc4809)和6.1
±
0.6(sarc12616),如图17b中所示。这些结果表明在所有4个肉瘤模型中均有
111
in-3bp-3554摄取。肿瘤-肾脏的比率为4.7
±
1.2(sarc4183)、3.2
±
0.4(sarc4605)、4.1
±
0.7(sarc4809)和4.3
±
1.2(sarc12616)。
[1849]
实施例39:功效研究-肉瘤sarc4809 pdx模型
[1850]
在人肉瘤pdx肿瘤模型sarc4809中研究了
177
lu-3bp-3554的功效。这个未分化肉瘤模型证明了
111
in-3bp-3554摄取(实施例38)并且还通过免疫组织化学显示表达fap。
[1851]
所有动物实验均按照德国动物保护法进行。将sarc4809肿瘤碎片皮下移植到8周龄nmri nu/nu小鼠(janvier labs,france)的左侧腹部。移植后23天开始治疗,平均肿瘤体积为187.08
±
123.8mm3。将小鼠分为四组,每组10只动物:第1组,载体对照;第2组,冷化合物
nat
lu-fap-3554;第3组,30mbq 177
lu-3bp-3554;第4组,60mbq 177
lu-fap-3554。第0天通过尾静脉静脉注射4ml/kg(100μl/小鼠)进行治疗。在第0天(即施用放射性示踪剂的第一天)测定肿瘤体积和体重,然后每周测定三次直至研究完成。
[1852]
所有肿瘤在研究的整个随访期间持续生长,直至第42天。载体和
nat
lu-3bp-3554治疗的小鼠(对照组)中的肿瘤在第31天(每组至少50%的小鼠仍然存活的最后一天)分别达到894
±
610mm3和1225
±
775mm3的mtv。用单剂量30或60mbq 177
lu-3bp-3554治疗的小鼠中的肿瘤在第31天分别达到635
±
462和723
±
391mm3的mtv(图18a)。在两个治疗组的小鼠中均观察到具有统计学意义(p《0.05)的抗肿瘤活性。相对于载体治疗组,用单剂量30或60mbq的
177
lu-3bp-3554治疗的小鼠在第31天的肿瘤生长抑制(tgi)分别为61%和73%。在整个研究过程中没有观察到与治疗相关的体重减轻(bwl)。在所有组中,体重在研究随访期间均增加(图18b)。
[1853]
实施例40:药代动力学研究
[1854]
在小鼠和大鼠中评估了所选化合物的药代动力学行为。化合物药代动力学行为的这种表征使人们能够对化合物的分布和消除以及暴露的计算有新的了解。
[1855]
将不同量的化合物在pbs中稳定配制。将制剂静脉内施用,施用于小鼠的剂量为4nmol/kg、40nmol/kg和400nmol/kg,施用于大鼠的剂量为2nmol/kg、20nmol/kg和200nmol/kg(3bp-3554)或40nmol/kg和400mol/kg(3bp-3623)。假设从人到小鼠的异速换算系数(allometric translation factor)为12.3,从人到大鼠的异速换算系数为6.2(nair ab,jacob s.journal of basic and clinical pharmacy,2016,7(2):27-31),所应用的剂量代表施用于人体剂量范围为0.325nmol/kg至32.5nmol/kg。
[1856]
在不同时间(5分钟、15分钟、30分钟、1小时、2小时、4小时、6小时、8小时)后从尾静脉(大鼠)或球后静脉(小鼠)采集血样。
[1857]
通过离心从血浆中分离血细胞后,对制备的血浆样品中的化合物进行定量,然后进行蛋白质沉淀程序。加入150μl含有78%0.1m硫酸锌和22%乙腈的硫酸锌沉淀剂。在室温下温育30分钟后,通过离心分离沉淀物。如果化合物含有游离dota部分,则向100μl上清液
中加入10μl 1%甲酸,然后在60℃进一步温育10分钟以完成锌螯合物的形成。
[1858]
在与agilent 6470三重四极杆质谱仪联用的agilent 1290uhplc系统上测定洁净样品溶液中的分析物。色谱分离在phenomenex biozen peptide xb-c18 hplc柱(50
×
2mm,粒径1.7μm)上于40℃进行梯度洗脱,使用0.1%甲酸水溶液作为洗脱剂a,乙腈作为洗脱剂b(5%b等度1分钟,然后在4分钟内线性梯度至43%b,500μl/min)。
[1859]
通过多反应监测(mrm)以正离子esi模式进行质谱检测,检测参数如表20中所述。
[1860]
表20:质谱检测参数
[1861]
化合物裂解电压 前体产物碰撞能3bp-4343190vquantifier767.0683.224v
ꢀꢀ
qualifier767.0542.938v3bp-3623110vquantifier791.8777.621v
ꢀꢀ
qualifier791.8708.219v
[1862]
使用agilent masshunter软件套件的定量分析软件完成测试项目的定量。使用1/
×
的加权因数进行二次回归。
[1863]
对血浆水平进行非房室型分析(nca),结果如下:化合物的初始浓度(c0)、稳态分布体积(v
ss
)、终末期分布体积(vz)、末端半衰期(t
1/2
)、清除率(cl)和外推至无穷大的曲线下面积(auc
inf
)。表21中列出了小鼠血浆中3bp-3554的nca参数和表22中列出了大鼠血浆中3bp-3554的nca参数,表23中列出了小鼠血浆中3bp-3623的nca参数,表24中列出了大鼠血浆中3bp-3623的nca参数。
[1864]
表21:小鼠血浆中3bp-3554的nca参数汇总
[1865]
pk参数4nmol/kg40nmol/kg400nmol/kgc025.6nm177nm4970nmv
ss
0.21l/kg0.32l/kg0.10l/kgvz0.26l/kg1.02l/kg0.21l/kgauc
inf
8.3nm h56nm h961nm ht
1/2
23min59min40mincl0.482l/kg h0.711l/kg h0.482l/kg h
[1866]
表22:大鼠血浆中3bp-3554的nca参数汇总
[1867]
pk参数2nmol/kg20nmol/kg200nmol/kgc010.3nm111nm1480nmv
ss
0.28l/kg0.30l/kg0.17l/kgvz0.32l/kg0.35l/kg0.42l/kgauc
inf
8.1nm h69nm h726nm ht
1/2
54min50min63mincl0.248l/kg h0.291l/kg h0.275l/kg h
[1868]
表23:小鼠血浆中3bp-3623的nca参数汇总
[1869]
pk参数4nmol/kg40nmol/kg400nmol/kgc017.6nm228nm2134nm
cys]-asp-his-phe-arg-asp-ttds-lys(cy5so3)-nh2)在肽浓度增加的情况下在4℃温育1小时。将细胞用facs缓冲液洗涤两次,并重悬于200μl facs缓冲液中。在attune nxt流式细胞仪中分析细胞。通过attune nxt软件计算中值荧光强度(cy5通道)并针对肽浓度进行绘图。使用activitybase软件进行四参数logistic(4pl)曲线拟合和pic50计算。对根据本发明的每种化合物进行的这个测定以及实施例43的fap蛋白酶活性测定的结果呈现在表25中(实施例43中示出)。pic50类别a代表pic50值》8.0,类别b代表pic50值在7.1与8.0之间,类别c代表pic50值在6.1与7.0之间,类别d代表pic50值≤6.0。
[1880]
实施例43:fap蛋白酶活性测定
[1881]
为了确定根据本发明的化合物对表达fap的细胞的抑制活性,建立了基于fret的fap蛋白酶活性测定法。
[1882]
将重组人fap(r&d systems,#3715-se)在测定缓冲液(50mm tris、1m nacl、1mg/ml bsa,ph 7.5)中稀释至浓度为3.6nm。将25μl fap溶液与25μl的3倍连续稀释的测试化合物混合,并在白色96孔proxiplate(perkin elmer)中温育5分钟。使用fret肽hilytefluor
tm
488-vs(d-)p sqg k(520)-nh2作为特异性fap底物(bainbridge,et al.,sci rep,2017,7:12524)。加入25μl在测定缓冲液中稀释的30μm底物溶液。所有溶液在使用前均在37℃下平衡。在spectramax m5酶标仪中以动力学模式在37℃下5分钟测量底物裂解和荧光增加(在485nm激发,在538nm发射)。rfu/sec通过softmax pro软件计算并针对肽浓度绘图。使用activitybase软件进行四参数logistic(4pl)曲线拟合和pic50计算。表9和表25中给出了本发明每种化合物的这个测定结果。pic50类别a代表pic50值》8.0,类别b代表pic50值在7.1和8.0之间,类别c代表pic50值在6.1和7.0之间,类别d代表pic50值≤6.0。
[1883]
从表25可以明显看出,本发明的化合物在facs结合测定和fap蛋白酶活性测定中均显示出令人惊讶的优异结果。
[1884]
表25:通过hplc和facs结合和fap活性测定的pic50类别确定的化合物id、序列、精确的计算质量、精确的实测质量、以分钟为单位的保留时间
[1885]
[1886][1887]
n.d.-未确定
[1888]
实施例44:表面等离子共振测定
[1889]
使用biacore
tm t200 spr系统进行表面等离子共振研究。简而言之,将偏振光射向金标记的传感器表面,并检测最小强度的反射光。反射光的角度随着分子结合和解离而变化。金标记的传感器表面载有携带fap靶蛋白的fap抗体,因此抗体结合不会发生在fap的底物结合位点。使测试化合物与加载的表面接触,并在传感图中记录与fap配体的实时相互作用图示。实时测量结合相互作用的缔合与解离,从而能够计算缔合率和解离率常数以及相应的亲和力常数。重要的是,由于运行缓冲液和样品缓冲液的折射率差异,以及测试化合物与流动池表面的非特异性结合,会产生背景响应。在不存在固定的fap的情况下,通过在相同密度捕获抗体包被的对照流动池上运行样品来测量和减去这个背景。此外,还对结合数据进行基线漂移校正,这是由捕获的fap从固定化抗体缓慢解离所致。这种漂移是通过将运行缓冲液注入流动池(其中抗体和fap固定在传感器表面)来测量。
[1890]
使用biacore
tm cm5传感器芯片。将人抗fap抗体(mab3715,r&d systems)在10mm乙酸盐缓冲液(ph 4.5)中稀释至终浓度为50μg/ml。将150μl等分试样转移至塑料瓶中并置入biacore
tm t200仪器的样品架中。将胺偶联试剂盒试剂溶液转移至塑料瓶中并置入样品架中:90μl的0.4m 1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(edc)和90μl的0.1m n-羟基琥珀酰亚胺(nhs)。将130μl的1m乙醇胺-hcl(ph 8.5)等分试样转移至塑料瓶中并置入样品架中。biacore
tm
液体系统设置如下:将含有蒸馏水(1l)、运行缓冲液(500ml)的单独瓶子以及用于废物的空瓶子放置在缓冲液托盘上。使用预装的固定程序,固定水平为7000ru。固定化在25℃下进行。如表26中所述进行抗fap抗体的固定程序。
[1891]
表26:cm5传感器芯片上使用的抗fap抗体的固定方案
[1892][1893]
将人重组fap在运行缓冲液中稀释至终浓度为20μg/ml。将100μl等份的人fap工作溶液转移到塑料瓶中并置入样品架中。通过将每种化合物溶解在dmso中制备0.5mm化合物-原液-溶液。对于每种测试化合物,将化合物-原液-溶液在500nm运行缓冲液(hbst)中稀释,并用hbst-dmso缓冲液(0.1%dmso)进一步稀释。二元复合物的spr结合分析在25℃以sck模式进行。表27描述了捕获和评估结合动力学的方案。进行3次sck测量后,通过运行缓冲液注入流动池来评估基线漂移,抗体和fap固定在传感器表面。
[1894]
表27:评估结合动力学的方案
[1895][1896]
对于每种测试化合物,使用biacore
tm t200控制软件将共振单位(ru)形式的spr原始数据绘制为传感图。从测试化合物传感图中减去空白传感图中的信号(空白校正)。通过减去不含测试化合物(仅运行缓冲液)的sck运行的传感图,对空白校正的传感图进行基线漂移校正。使用biacore
tm t200评估软件中的1:1langmuir结合模型,根据空白归一化spr数据计算结合率(k
on
)、解离率(k
off
)、解离常数(kd)和t
1/2
。原始数据和拟合结果作为文本文件导入idbs中。pkd值(解离常数的负十进制对数)在idbs excel模板中计算。
[1897]
选择根据本发明的化合物的这个测定的结果呈现在表28中。类别a代表pkd值》8.0,类别b代表pkd值在7.1与8.0之间,类别c代表pkd值在6.1与7.0之间。
[1898]
表28:biacore测定的化合物id、序列和pkd类别
[1899]
id序列pkd类别3bp-3907ihex
‑‑
[c(tmebn(dota
‑‑
aet))-pptqfc]-oha3bp-3910pent
‑‑
[c(tmebn(dota
‑‑
aet))-pptqfc]-oha3bp-3918etopr
‑‑
[c(tmebn(dota
‑‑
aet))-pptqfc]-oha3bp-3940nbu
‑‑
cayl
‑‑
[c(tmebn(dota
‑‑
aet))-pptqfc]-oha3bp-3941nbu
‑‑
coyl
‑‑
[c(tmebn(dota
‑‑
aet))-pptqfc]-oha3bp-4425nbu
‑‑
cayl
‑‑
[c(tmebn(ludota
‑‑
aet))-pptqfc]-oha3bp-4426nbu
‑‑
cayl
‑‑
[c(tmebn(indota
‑‑
aet))-pptqfc]-oha3bp-4541n4ac
‑‑
ppac
‑‑
ttds
‑‑
nle
‑‑
[c(3mebn)-pptqfc]-ohb3bp-4549n4ac
‑‑
ttds
‑‑
nle
‑‑
[c(3lut)-pptqfc]-ohb3bp-4550n4ac
‑‑
peg6
‑‑
nle
‑‑
[c(3lut)-pptqfc]-ohb3bp-4551n4ac
‑‑
peg6
‑‑
nle
‑‑
[c(3mebn)-pptqfc]-ohb3bp-4560nbu
‑‑
cayl
‑‑
[c(tmebn(dota
‑‑
aet))-pptqfc]-nh2a3bp-4564nbu
‑‑
cayl
‑‑
[c(tmebn(dota
‑‑
pp))-pptqfc]-oha3bp-4565nbu
‑‑
cayl
‑‑
[c(tmebn(dota
‑‑
pp))-pptqfc]-nh2a3bp-4607nbu
‑‑
cayl
‑‑
[c(tmebn(dota
‑‑
aet))
‑‑
nmg-ptqfc]-oha3bp-4621nbu
‑‑
cayl
‑‑
[c(tmebn(dota
‑‑
aet))
‑‑
nmg-ptqfc]-nh2a3bp-4744nbu
‑‑
cayl
‑‑
[c(tmebn(indota
‑‑
aet))-pptqfc]-nh2a3bp-4745nbu
‑‑
cayl
‑‑
[c(tmebn(ludota
‑‑
aet))-pptqfc]-nh2a3bp-4768nbu
‑‑
cayl
‑‑
[c(tmebn(nopo
‑‑
aet))-pptqfc]-oha3bp-4769nbu
‑‑
cayl
‑‑
[c(tmebn(gadota
‑‑
aet))-pptqfc]-oha3bp-4773n4ac
‑‑
peg6
‑‑
nle
‑‑
[c(3lut)-pptefc]-ohb3bp-4775n4ac
‑‑
ppac
‑‑
ttds
‑‑
nle
‑‑
[c(3lut)-pptefc]-ohb3bp-4778nbu
‑‑
cayl
‑‑
[c(tmebn(nopo
‑‑
aet))-pptefc]-oha3bp-4784n4ac
‑‑
ppac
‑‑
ttds
‑‑
nle
‑‑
[c(3mebn)-pptefc]-bal-oha3bp-4844nbu
‑‑
cayl
‑‑
[c(tmebn(ludota
‑‑
pp))-pptqfc]-nh2a3bp-4960n4ac
‑‑
ppac
‑‑
ttds
‑‑
nle
‑‑
[c(3mebn)-pptqfc]-bal-oha3bp-4961n4ac
‑‑
ppac
‑‑
ttds
‑‑
nle
‑‑
[c(3lut)-pptqfc]-bal-oha3bp-5201nota
‑‑
ttds
‑‑
nle
‑‑
[c(3mebn)-pptqfc]-oha3bp-5210nbu
‑‑
cayl
‑‑
[c(tmebn(nota
‑‑
aet))-pptqfc]-oha
[1900]
实施例45:选择的化合物的
111
in标记
[1901]
为了充当诊断性、治疗性或治疗诊断性活性物质,化合物需要用放射性同位素标记。标记程序需要适当以确保本发明的放射性标记化合物的高放射化学产率和纯度。这个实施例表明本发明的化合物适合于放射性标记并且可以以高放射化学产率和纯度进行标记。
[1902]
将20-100mbq的
111
incl3(在0.02m hcl中)与1nmol化合物(在0.1m hepes ph 7中
的200μm原液)/30mbq和含有25mg/ml甲硫氨酸的1m乙酸钠缓冲液ph 5混合,最终缓冲液浓度为0.1m。将混合物加热至80℃维持20至30分钟。冷却后,加入抗坏血酸、dtpa和tween-20,终浓度分别为25mg/ml、0.2mm和0.1%。
[1903]
为了通过hplc分析放射化学纯度,使用poroshell sb-c18 2.7μm(agilent)分析5μl稀释的标记溶液。洗脱液a:h2o,0.1%tfa,洗脱液b:mecn,梯度为15分钟内从5%b到70%b,流速0.5ml/min;检测仪:nai(raytest),dad 230nm。用死体积洗脱的峰代表游离放射性核素,用未标记样品测定的肽特异性保留时间洗脱的峰代表放射性标记的化合物。合成结束时放射化学纯度≥85%。
111
in标记的化合物的示例性放射化学纯度如表29所示。
[1904]
表29:通过hplc测定的
111
in标记的化合物的放射化学纯度
[1905][1906]
实施例46:选择的化合物的
99m
tc标记
[1907]
将100-500mbq 99m
tco4(在盐水中)与11μl的0.5m磷酸盐缓冲液(ph 11.5-12.0)和1.1μl的0.1m柠檬酸三钠/100μl放射性核素溶液混合。加入1nmol化合物(200μm原液水溶液)/45mbq,然后加入3.0μl的1.1mg/ml氯化锡二水合物(在氮气吹扫的无水乙醇中)/100μl放射性核素溶液。将混合物在25至50℃下温育30分钟。温育时间结束时,将混合物用3.0μl的1m hcl/10μl磷酸盐缓冲液用中和,并添加tween-20,终浓度为0.1%。
[1908]
为了通过hplc分析放射化学纯度,使用poroshell sb-c18 2.7μm(agilent)分析5μl稀释的标记溶液。洗脱液a:h2o,0.1%tfa,洗脱液b:mecn,梯度为15分钟内从5%b到70%b,流速0.5ml/min;检测仪:nai(raytest),dad 230nm。用死体积洗脱的峰代表游离放射性核素,用未标记样品测定的肽特异性保留时间洗脱的峰代表放射性标记的化合物。合成结束时放射化学纯度≥85%。
99m
tc标记化合物的示例性放射化学纯度如表30所示。
[1909]
表30:通过hplc测定的
99m
tc标记的化合物的放射化学纯度
[1910][1911]
n/a=不可得
[1912]
实施例47:选择的化合物的
68
ga标记
medical imaging systems,budapest,hungary)上获取图像。
[1920]
成像数据保存为dicom文件,并使用vivoquant
tm
(invicro,boston,usa)进行spect/ct或interview
tm fusion(mediso,budapest,hungary)软件进行pet/ct分析。结果表示为每克组织注射剂量的百分比(%id/g)。
[1921]
spect/ct的成像研究结果示于表34中,pet/ct的成像研究结果示于表35中;所选化合物的采集扫描结果显示于图22至28中。
[1922]
令人惊讶的是,对连接有n4ac-螯合剂的n末端接头进行修饰,极大地改善了示踪剂的生物分布。在图22至25中,显示了四种
99m
tc标记的化合物随着时间推移(注射后1至6小时)的代表性生物分布。与具有不同接头例如ttds或peg6的化合物(3bp-4219和3bp-4221)相比,具有在n4ac和正亮氨酸之间的ppac-ttds接头的化合物(3bp-4541和-4961)呈现出随着时间的推移在健康组织中的摄取会减少,尤其是在胃肠道和肾脏中。
[1923]
此外,还发现包含n末端脲基序的示踪剂的生物分布明显改善。在图21和28中,显示了
111
in标记的3bp-3940和3bp-4560随时间的推移(注射后0.25至3小时)的代表性生物分布。示踪剂在健康组织中的吸收率非常低,尤其是在肾脏中。
[1924]
表32:spect/ct成像的采集和重建参数
[1925][1926]
表33:pet/ct成像的采集和重建参数
[1927][1928]
表34:示出在hek-fap肿瘤、肾和bps(血池替代物)中每克组织的注射剂量百分比(%id/g)摄取,在示踪剂注射后1小时、3小时和6小时通过
99m
tc标记的化合物的spect/ct成像测定。
[1929][1930][1931]
表35:示出在hek-fap肿瘤、肾和bps(血池替代物)中每克组织注射剂量的百分比(%id/g)摄取,在示踪剂注射后0.25小时、1小时和3小时通过
68
ga标记的化合物的pet/ct成像测定。
[1932][1933]
参考文献
[1934]
本文引用的每个文件和任何文件的公开内容均通过引用并入。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。