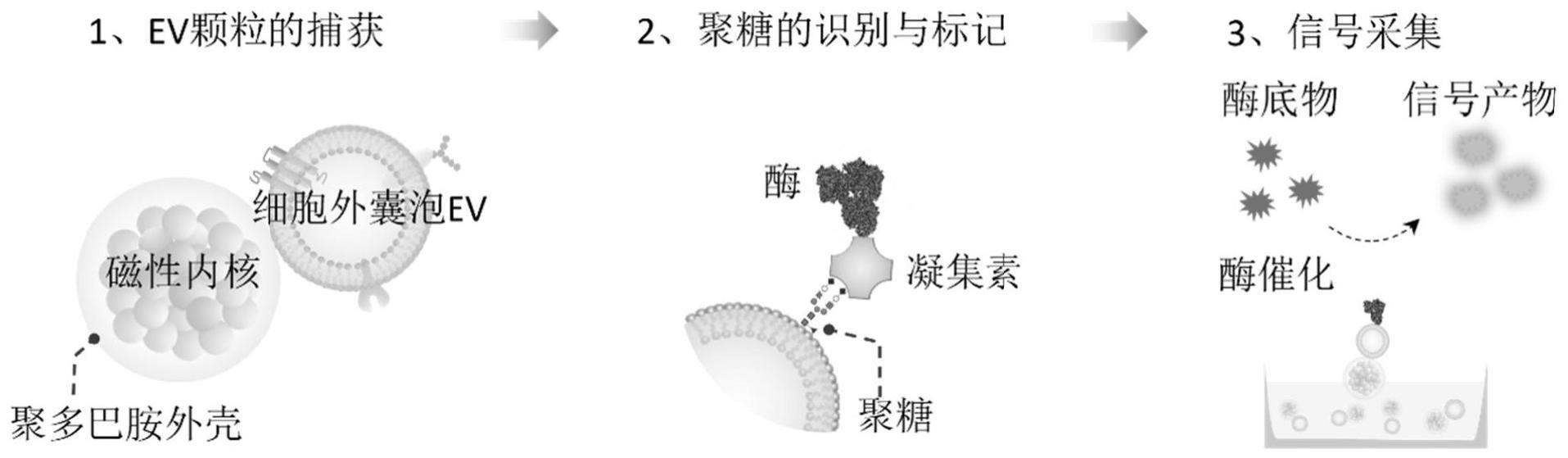
1.本发明涉及分子生物学和生物技术技术领域,特别涉及一种分析流体样本细胞外囊泡聚糖的方法及其装置和应用。
背景技术:
2.细胞外囊泡(extracellular vesicle,ev)是一类由细胞释放到细胞外空间的具有封闭脂质双层膜结构、且不能复制的囊泡样颗粒物的统称。由于母细胞来源及生成方式等多个方面的差异,ev颗粒之间具有较为明显的异质性。当前尚无统一标准(如通用直径大小和标志物)来区分不同种类的ev,不过依据生物发生的不同,ev可大体分为外泌体(exosome,由多囊泡体和两性体的胞吐作用释放)和胞外体(ectosome,由质膜出芽和起泡产生)两种类型。依据尺寸差异,ev可粗略分为小细胞外囊泡(small ev,《200nm)和中/大细胞外囊泡(medium/large ev,》200nm)。ev来源广泛,几乎所有的活细胞都可以分泌ev,其广泛地存在于血液、尿液、泪液、唾液等各种体液及细胞培养上清中,已被公认为是细胞通讯、细胞迁移、血管新生、免疫调节及肿瘤细胞生长等诸多生理病理过程的重要参与者。ev作为一种膜结构性囊泡可稳定存在于体液中,而其先天的生物性来源使其具有良好的生物相容性,而且其携带来源细胞的多种内容物,可反映来源细胞的多种生物学信息,这些特点使其在疾病诊断、药物递送、肿瘤免疫治疗等多个领域展现出极具潜力的临床应用价值。
3.ev虽尺寸较小(一般在亚微米级),但却携带丰富的活性组分,主要包括蛋白质、核酸、脂质、聚糖、代谢小分子等。这些生物活性分子不但是组成ev生物学结构的基本分子单元,同时也作为重要的信号分子在ev参与的不同的生理过程中发挥作用,是ev发挥生物学功能的分子基础。因此,对ev内这些多样的生物活性分子进行全面有效的解析不但是开展ev生成机制的揭示、ev生物学功能的认知等基础生物医学研究的先决条件,同时也是充分挖掘ev应用潜力的重要前提,为以ev作为生物标志物进行疾病诊断、开发ev作为药物载体平台等多种医学临床应用场景提供有效指引,对推动ev领域的持续发展具有重要意义。
4.对于ev内的多种活性成分,现有研究大多将研究靶标聚焦于蛋白质和核酸两类分子,对二者的种类、功能、检测、改造等方面进行了较为全面的研究。而随着研究的深入,人们发现除了蛋白质和核酸两类分子,聚糖(glycan)也是构成ev结构的重要功能组分之一。聚糖产生于糖基化这一细胞内重要的生化修饰反应,而ev上已被证实修饰有多种聚糖结构,并作为重要分子媒介在发挥ev生物学功能上扮演重要角色。如西北大学关锋教授团队发现乳腺癌细胞来源细胞外囊泡对受体细胞迁移能力的调控依赖于囊泡膜表面整合蛋白(integrinβ1)的平分型n-乙酰氨基葡萄糖(glcnac)修饰水平。而且,ev聚糖作为新型标志物在癌症诊断领域的应用潜力也在逐渐显现。如raghu kalluri教授团队2015年发表于nature上的工作表明血浆细胞外囊泡上的蛋白聚糖glypican-1有潜力作为一种靶标工具用于胰腺癌的早期诊断和监测;邵慧琳教授等近期发表于nature communications和matter上的两项工作也初步证实了ev聚糖在判断胃癌、结直肠癌患者预后方面的良好应用前景。
5.尽管当前已对ev聚糖的组成、功能及应用潜力进行了初步揭示,但ev聚糖的研究尚处于起步阶段,明显滞后于ev内蛋白质和核酸两种活性成分的研究。聚糖本身种类繁多、结构复杂多变,不同的生化修饰过程可产生多种多样的聚糖结构,而且聚糖不像蛋白质和核酸具有可测序行,也没有核酸结构所具备的可复制扩增性,这些因素使得对ev聚糖的深入全面解析面临较大的技术瓶颈。现有ev聚糖的分析鉴定策略主要借助质谱、液相色谱、凝集素阵列芯片等技术手段,这些技术虽各具特点,但在ev聚糖的分析上仍面临诸多不足。如液相色谱、质谱等方法需通过裂解处理对细胞外囊泡结构进行破坏并通过过夜的n-糖苷酶(pngase f)酶切处理以收集聚糖链用于后续分析,凝集素微阵列法则需要先借助特殊仪器制备微阵列芯片同时对ev样品进行荧光标记再进行后续分析。这些方法需要复杂的样品预处理,整个分析流程耗时长,而且多依赖昂贵仪器(如质谱仪),需专业性仪器操作技能,通用性和可及性差且成本高昂,还面临分析通量偏低、分析对象不够全面(如质谱主要针对ev蛋白上的聚糖)等不足。
6.具体来说,质谱(mass spectrometry,ms)对ev糖基的分析主要经过ev收集、ev裂解、ev裂解物的酶切处理获取聚糖糖链、质谱上样对聚糖进行鉴定分析等几个步骤。在此过程中,为获得聚糖的糖链结构,需对ev的结构进行破坏以获取分析目标物。该法需要消耗较高的样品量(至少微克级别)才可有效获取较为全面的信号。该法往往需要复杂的样品预处理以对样品进行有效分析,并且依赖昂贵的质谱仪,需要专业性仪器操作技能才能得到较好的分析结果,因而该方法通用性和可及性较差且成本高昂。同时,该方法整个分析流程耗时长(整个流程至少24h),而且分析通量偏低。此外,质谱目前适用于ev蛋白上的聚糖,对于ev脂质分子及其他粘附性聚糖的相关信息的分析还有所欠缺,尚不能全面反映ev内的不同的聚糖信息,而且质谱对聚糖结构的鉴定不具有特异识别性,需借助数据库或聚糖标准样品作为参考才能确定样品中包含哪些聚糖结构。液相色谱技术(liquid chromatography,lc)面临的问题与质谱类似,除了lc使用液相色谱仪以外,lc技术同样需对ev进行结构破坏并对聚糖进行酶切纯化,需要专业的仪器操作技能、较为昂贵的液相色谱仪,分析流程复杂,需要标准品才能确定糖链结构,分析通量低,对样品的分析分辨率相较于ms还要更差一些。gmr磁学分析方法的信号源自磁性纳米颗粒对巨磁阻传感器电阻的影响,即巨磁阻效应。该方法中,聚糖识别基础也源于凝集素与聚糖的特异性亲和。该方法的重点在于利用凝集素的多价态结合作用诱导被磁性纳米颗粒标记的ev颗粒进行聚集,通过外界磁场移除大尺寸的磁性颗粒聚集体后,对残留有小尺寸磁性颗粒的上清进行巨磁阻信号检测,通过信号差异来反映不同ev聚糖结构的表达情况。该方法的前提条件是需要具备专业知识制造巨磁阻传感器并搭建巨磁阻信号检测系统,应用门槛高,通用性较差,需充分掌握相应的信号分析方法,整个分析流程需在微流控芯片上操作,操作较复杂。凝集素微阵列法是当前糖组学应用较为广泛的方法。凝集素微阵列法需要事先制备好涂敷有多种凝集素分子的芯片,而凝集素芯片的制备涉及芯片基底的选择、基底表面的预处理、凝集素的固定嫁接等诸多步骤,并且依赖特殊的仪器(如微阵列芯片点样系统)及熟练的操作技能以保证芯片质量和分析性能的稳定性。虽然已有一些商用凝集素芯片出现,但价格昂贵,使用成本较高。此外,该方法通常需要匹配合适的微阵列芯片扫描仪等特定仪器以获取有效的信号。同时,使用凝集素芯片对ev聚糖进行分析需事先对ev样品进行荧光标记并在标记后进行纯化,这增加了样品的处理难度,对ev稳定性可能带来影响,而且处理过程中增大了样品的损失概率。酶
联免疫吸附测定法(elisa)作为分析领域的经典方法亦可以用于对ev聚糖的分析,elisa方法中酶标板对ev样品的吸附是不可控的,样品的吸附效率较低,而且不同的商用酶标板材质可能偏好吸附ev样品中某些特定成分,从而无法全面准确反映ev聚糖的信息特征。同时,由于操作步骤中涉及的吸附过程主要依赖溶液中内容物(如ev颗粒、凝集素分子、酶分子)的无规扩散作用,吸附速率偏慢,为了获得有效的信号强度,整个操作流程耗时较长,依据研究目标,通常需要4到16个小时。而且,受限于elisa孔板的固定设计,样品的上样量自由度较低(如96孔酶标板每孔上样量至少50微升),样品消耗量较高。
7.因此,简便高效、通用性好的ev聚糖解析方法亟待开发,以为ev聚糖的全面深度解析提供新型有效的技术策略,进而对ev聚糖的功能揭示等基础研究的有效开展提供重要的技术支撑,为后续ev聚糖在医学临床上的应用打下坚实的基础。
技术实现要素:
8.本发明旨在至少解决现有技术中存在的上述技术问题之一。为此,本发明的目的在于提供一种分析流体样本细胞外囊泡聚糖的方法及其装置和应用。
9.为了实现上述目的,本发明所采取的技术方案是:
10.本发明的第一个方面,提供了一种分析流体样本细胞外囊泡聚糖的方法,包括以下步骤:
11.s1:将含ev颗粒的流体样本与功能化磁性纳米颗粒(mnp@poly)混合,得mnp@poly-ev复合体,磁分离后进行封闭处理,得封闭处理mnp@poly-ev复合体;
12.s2:将封闭处理mnp@poly-ev复合体与生物素修饰的凝集素混合,磁分离后再与链酶亲和素偶联的酶分子混合,得酶标记的mnp@poly-ev复合体;
13.s3:将酶标记的mnp@poly-ev复合体与酶分子对应底物混合反应后,进行光学信号检测。
14.本发明中,功能化磁性纳米颗粒充当载体媒介对流体样本中的ev进行便捷的捕获与操纵,生物素化的凝集素可对ev上的聚糖进行特异性识别并结合,链酶亲和素偶联的酶分子对ev聚糖所结合的凝集素分子进行标记,最终在酶底物存在的前提下,ev聚糖上所标记的酶催化底物产生光学信号分子,进而信号分子发出的光学信号强度可定量反映ev聚糖的表达量。
15.在本发明的一些实施方式中,所述的分析流体样本细胞外囊泡聚糖的方法,包括以下步骤:
16.s1:将含ev颗粒的流体样本与功能化磁性纳米颗粒混合,磁分离后得mnp@poly-ev复合体,进行封闭处理,磁分离后得封闭处理mnp@poly-ev复合体;
17.s2:将封闭处理mnp@poly-ev复合体与生物素修饰的凝集素混合,磁分离后得生物素化ev,再与链酶亲和素偶联的酶分子混合,磁分离后洗涤得酶标记的mnp@poly-ev复合体;
18.s3:将酶标记的mnp@poly-ev复合体与酶分子对应底物混合反应后,磁分离后,对上清液进行光学信号检测。
19.在本发明的一些实施方式中,s1中,所述含ev颗粒的流体样本与所述功能化磁性纳米颗粒的混合时间为至少10min;优选为10min~20min。
20.在本发明的一些实施方式中,s1中,所述封闭处理的时间为至少25min,优选为25min。
21.在本发明的一些实施方式中,s2中,所述封闭处理mnp@poly-ev复合体与生物素修饰的凝集素的混合时间为至少10min;优选为10min~20min。
22.在本发明的一些实施方式中,s2中,所述生物素化ev与所述链酶亲和素偶联的酶分子的混合时间为至少10min;优选为10min~20min。
23.在本发明的一些实施方式中,s3中,所述混合反应的时间为至少5min;优选为5min~10min。
24.本发明的第二个方面,提供了一种分析流体样本细胞外囊泡聚糖的装置,包括:
25.功能化磁性纳米颗粒,其用于捕获含ev颗粒的流体样本中的细胞外囊泡,得mnp@poly-ev复合体;
26.封闭液,其用于封闭处理所述mnp@poly-ev复合体,得封闭处理mnp@poly-ev复合体;
27.生物素修饰的凝集素,其用于对所述封闭处理mnp@poly-ev复合体进行亲和标记,得生物素化ev;
28.链酶亲和素偶联的酶分子,其用于与所述生物素化ev进行特异性结合,得酶标记磁性复合体;
29.酶分子对应底物,其用于与所述酶标记磁性复合体反应。
30.在本发明的一些实施方式中,所述的分析流体样本细胞外囊泡聚糖的装置,包括:
31.入口单元,所述入口单元被配置为接收含ev颗粒的流体样本;
32.混合单元,所述混合单元被配置有:
33.功能化磁性纳米颗粒,其用于捕获所述含ev颗粒的流体样本中的细胞外囊泡,得mnp@poly-ev复合体;
34.封闭液,其用于封闭处理所述mnp@poly-ev复合体,得封闭处理mnp@poly-ev复合体;
35.生物素修饰的凝集素,其用于对所述封闭mnp@poly-ev复合体进行亲和标记,得生物素化ev;
36.链酶亲和素偶联的酶分子,其用于与所述生物素化ev进行特异性结合,得酶标记磁性复合体;
37.酶分子对应底物,其用于与所述酶标记磁性复合体反应;
38.磁分离单元,所述磁分离单元被配置为依序磁分离获得mnp@poly-ev复合体、生物素化ev、酶标记磁性复合体;
39.检测单元,所述检测单元被配置为在所述含ev颗粒的流体样本通过所述磁分离单元后测量所述含ev颗粒的流体样本的荧光信号。
40.在本发明的一些实施方式中,所述入口单元、混合单元、磁分离单元为同一单元。
41.在本发明的一些实施方式中,所述混合单元的流体联接至所述入口单元;所述磁分离单元的流体联接至所述混合单元。
42.在本发明的一些实施方式中,所述磁分离单元流体联接至所述混合单元并且被配置为从所述含ev颗粒的流体样本分离mnp@poly-ev复合体;从所述含生物素修饰的凝集素
的溶液中分离生物素化ev,避免游离凝集素分子对后续分析的干扰;从所述含链酶亲和素偶联的酶分子的溶液中分离酶标记磁性复合体,避免游离酶分子对后续分析的干扰。
43.在本发明的一些实施方式中,所述含ev颗粒的流体样本包括含ev颗粒的体液、组织或细胞培养上清液;优选的,体液包括但不限于不限于血液、唾液、尿液、脑脊液、腹腔积液、胸腔积液、汗液、精液、淋巴液中的一种或多种;体液来源包括但不局限于人、猴、小鼠、大鼠、兔、猪、猴、狗等动物。
44.在本发明的一些实施方式中,所述含ev颗粒的流体样本包括细胞分泌而来或通过包括细胞碎片、活细胞的至少一种超声破碎而来。
45.在本发明的一些实施方式中,所述含ev颗粒的流体样本包括对含ev颗粒的溶液经差速冷冻离心、密度梯度离心、基于聚合物的沉淀、超滤、尺寸排阻色谱、免疫分离等方法获得;优选的,所述含ev颗粒的流体样本包括对含ev颗粒的溶液经差速冷冻离心法获得,所述差速冷冻离心法的离心力为2000g~150000g,时间为30min~200min;优选的,所述差速冷冻离心法的离心力为15000g~150000g,时间为30min~150min。
46.在本发明的一些实施方式中,所述含ev颗粒的流体样本中ev颗粒的质量浓度为0.5μg/ml~40μg/ml。
47.在本发明的一些实施方式中,所述含ev颗粒的流体样本中ev颗粒与功能化磁性纳米颗粒的用量比为0.005~0.1:1。
48.在本发明的一些实施方式中,所述功能化磁性纳米颗粒包括核壳结构的磁性纳米颗粒,内核为磁性纳米颗粒,外壳为聚合物层;优选的,所述聚合物层包括聚多巴胺层、、聚乙二胺层、聚4-乙烯基苯硼酸层、聚甲基丙烯酸层的至少一种;优选的,所述功能化磁性纳米颗粒包括聚多巴胺包覆的磁性纳米颗粒。
49.在本发明的一些实施方式中,所述功能化磁性纳米颗粒的直径为20nm~1000nm;优选为100nm~500nm。
50.在本发明的一些实施方式中,所述封闭液为商用快速封闭液或牛血清白蛋白(bsa)溶液;优选的,所述牛血清白蛋白溶液的质量分数为1%~5%。
51.在本发明的一些实施方式中,所述封闭液的用量为100μl~300μl。
52.在本发明的一些实施方式中,所述生物素修饰的凝集素中凝集素包括伴刀豆凝集素a(cona)、小扁豆凝集素(lca)、豌豆凝集素(psa)、橙黄网胞盘菌凝集素(aal)、荆豆凝集素i(uea-i)、小麦胚芽凝集素(wga)、番茄凝集素(lel)、马铃薯凝集素(stl)、曼陀罗凝集素(dsl)、琥珀酸小麦胚凝集素(succinylated wga,s*wga)、加纳籽凝集素ii(gsl-ii)、红细胞凝集素(pha-e)、白细胞凝集素(pha-l)、蓖麻凝集素i(rca-i)、刺桐凝集素(ecl)、木菠萝素凝集素(jacalin)、花生凝集素(pna)、双花扁豆凝集素(dba)、大豆凝集素(sba)、绒毛蚕豆凝集素(vvl)、加纳籽凝集素i(gsl-i)、黑接骨木凝集素(snl)的至少一种。不同的凝集素可靶向亲和不同的聚糖结构,除上述凝集素,所有被生物素修饰的凝集素均可应用本发明方法。
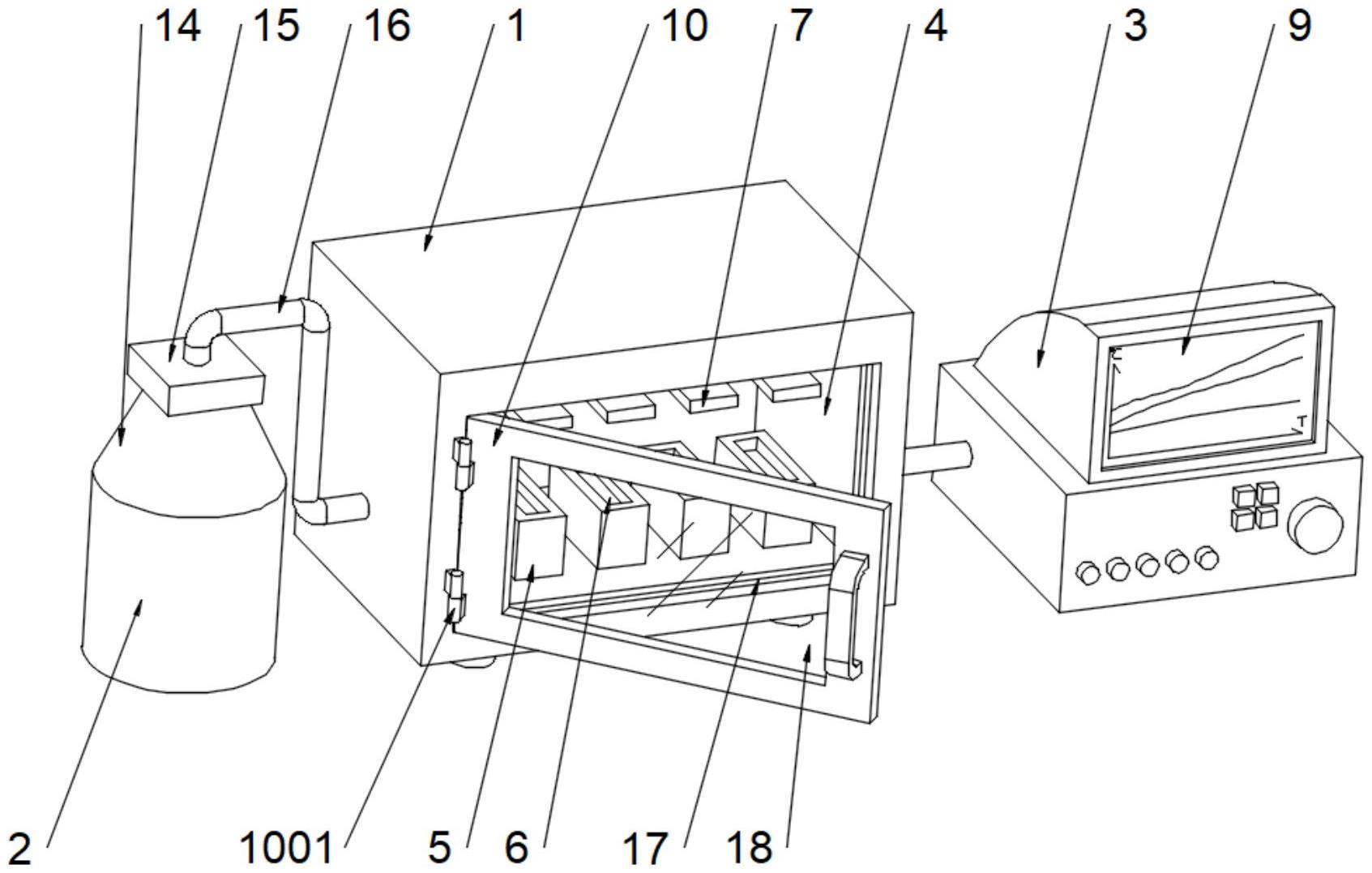
53.在本发明的一些实施方式中,所述生物素修饰的凝集素的溶液浓度为2.5μg/ml~15μg/ml,上样量为50μl~100μl。
54.在本发明的一些实施方式中,所述链酶亲和素偶联的酶分子中酶分子的种类是无限制的,如β-半乳糖苷酶、辣根过氧化物酶、碱性磷酸酶、葡萄糖氧化酶等;同理,所述酶分
子对应底物只要与酶分子对应即可,如当所述链酶亲和素偶联的酶分子中酶分子为β-半乳糖苷酶时,对应底物为荧光素二-β-d-吡喃半乳糖苷或硝基酚半乳糖苷;当所述链酶亲和素偶联的酶分子中酶分子为辣根过氧化物酶时,底物为商用化学发光底物或3,3’,5,5
’‑
四甲基联苯胺;当所述链酶亲和素偶联的酶分子中酶分子为碱性磷酸酶时,底物为4-甲基伞形酮磷酸酯或4-硝基酚磷酸盐;当所述链酶亲和素偶联的酶分子中酶分子为葡萄糖氧化酶时,底物为(葡萄糖 辣根过氧化物酶 2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐)或(葡萄糖 甲硫酚嗪 噻唑兰)。
55.在本发明的一些实施方式中,所述链酶亲和素偶联的酶分子的溶液浓度为1μg/ml~10μg/ml,上样量为50μl~100μl。
56.在本发明的一些实施方式中,所述分析流体样本细胞外囊泡聚糖的装置包括检测试剂盒、配备磁铁的离心管、检测系统等。
57.本发明的第三个方面,提供了一种所述的分析流体样本细胞外囊泡聚糖的方法或所述的分析流体样本细胞外囊泡聚糖的装置在分析流体样本细胞外囊泡聚糖中的应用。
58.本发明的有益效果是:
59.1、本发明提出的方法是针对ev聚糖分析的一种简便快速的分析策略。
60.2、本发明以聚多巴胺包覆的磁性纳米颗粒为操纵媒介,磁性内核外界磁场具有优异响应性,便于ev颗粒进行操纵,聚多巴胺组成的功能性外壳可对ev颗粒进行有效捕获。
61.3、本发明的整个操作流程在离心管中进行,借助常规商用小磁铁即可完成,无需特殊仪器,操作过程简便,只需简单练习即可对ev聚糖进行测试分析。
62.4、本发明中使用的磁性颗粒对于ev具有良好的捕获能力,可对ev进行快速捕获(小于10分钟),而且该捕获过程温和,不影响ev颗粒的结构稳定性,一旦被捕获,ev颗粒可稳定存在于磁性纳米颗粒表面而不会脱落,便于后续操作。
63.5、本发明提出的方法简便,耗时短,在优化条件下,单次操作时间不超过1小时,相对于elsia等方法大大缩短。
64.6、本发明提出的方法通用性好,可检测不同形式的ev样品。本发明主要以八种细胞系为例,通过分析细胞分泌的大小ev囊泡以及细胞碎片/活细胞等超声破碎后形成的ev样品对本方法的适用性进行了佐证,样品可来自但不限于细胞培养上清、血液、尿液、唾液、泪液等体液,理论上,所有形式的ev样品乃至所有可被磁性纳米颗粒吸附的样品(不止ev样品)均可用该方法进行分析。
65.7、本发明中调节好ev颗粒与磁性纳米颗粒的比例,可实现样品中ev颗粒的全捕获,避免了捕获偏好性,能更全面准确的反映ev样品的聚糖特征。
附图说明
66.图1为本发明基于功能化磁性纳米颗粒的用于ev聚糖的便捷检测方法的流程示意图。
67.图2为本发明实施例2对mnp@pda颗粒的制备优化结果图;其中,(a)为功能化磁性纳米颗粒mnp@pda制备示意图;(b)为磁性纳米内核颗粒(mnp)和功能化磁性纳米颗粒mnp@pda的扫描电镜图;(c)为mnp@pda颗粒对外界磁场的响应图;(d)为mnp和mnp@pda两种颗粒的尺寸分布(左侧图)及zeta电势图(右侧图)。
68.图3为本发明实施例3对ev样品制备优化结果图;其中,(a)为四种样品的制备条件和对应的样品图像;(b)为四种样品的ev颗粒尺寸分布图。
69.图4为本发明实施例4中mnp@pda颗粒对ev颗粒捕获优化结果图;其中,(a)为mnp@pda颗粒捕获ev颗粒后所得mnp@pda-ev复合体的扫描电镜图片;(b)为mnp@pda颗粒对不同ev样品的捕获效率图;(c)为mnp@pda颗粒对不同ev样品捕获稳定性图。
70.图5为本发明实施例5中各步骤操作优化结果图;其中,(a)为mnp@pda颗粒对ev样品的捕获量图;(b)为不同凝集素孵育时间下的相对信号强度图;(c)为不同酶孵育时间下的相对信号强度图;(d)为不同封闭孵育时间下的相对信号强度图。
71.图6为本发明实施例6中本发明方法与elisa检测能力对比图。
72.图7为本发明实施例7中八种细胞系的活细胞(cell)、细胞碎片(debris)、l-ev和s-ev四种样品的聚糖图谱。
具体实施方式
73.以下通过具体的实施例对本发明的内容作进一步详细的说明。实施例和对比例中所用的原料、试剂或装置如无特殊说明,均可从常规商业途径得到,或者可以通过现有技术方法得到。除非特别说明,试验或测试方法均为本领域的常规方法。
74.实施例1
75.图1示出了本发明基于功能化磁性纳米颗粒的用于ev聚糖的便捷检测方法的流程示意图。本实施例中以肺癌a549细胞系的小细胞外囊泡(s-ev)样品为分析对象、伴刀豆凝集素a(cona)为代表性凝集素,酶分子为偶联有链霉亲和素的β-半乳糖苷酶,酶底物为荧光素二-β-d-吡喃半乳糖苷(fdg)。具体分析方法为:
76.取10微升mnp@pda颗粒(聚多巴胺包覆的磁性纳米颗粒)母液(1毫克/毫升)置于0.6毫升规格的离心管中,加入商用pbs溶液50微升洗涤一次,磁分离后,去除上清。而后加入50微升a549 s-ev样品(浓度为7.5微克/毫升),分散后孵育10分钟以使mnp@pda颗粒对ev颗粒进行有效捕获。磁分离后加入100微升质量分数为1%的bsa溶液对mnp@pda颗粒表面进行封闭,封闭时间25分钟。封闭结束后磁分离,移除上清,而后加入50微升浓度为2.5微克/毫升的修饰有生物素的cona溶液,孵育10分钟,以使cona分子靶向结合于ev上的聚糖结构。磁分离后,去掉cona上清液,加入50微升浓度为4微克/毫升的偶联有链霉亲和素的β-半乳糖苷酶溶液,孵育10分钟,借助链霉亲和素与生物素的特异性亲和作用使酶分子结合到凝集素cona分子上。磁分离后移除上清液,用100微升pbs溶液洗涤颗粒以去除未结合到cona分子上的游离酶分子,磁分离后去除pbs洗液,而后加入50微升底物溶液(浓度为50微摩尔/毫升的荧光素二-β-d-吡喃半乳糖苷溶液),反应5分钟后,磁分离纳米颗粒,取上清溶液置于黑色酶标板中,用酶标仪对荧光信号进行采集。
77.实施例2
78.本实施例对实施例1中的mnp@pda颗粒的制备进行优化,采用溶剂热法制备(参照rsc adv.,2016,6,62550
–
62555),具体过程为:
79.如图2(a)所示的功能化磁性纳米颗粒mnp@pda制备示意图,将醋酸钠(6克)、柠檬酸钠(1.3克)、三氯化铁(3.25克)、水(2毫升)溶于乙二醇(100毫升),混合后200℃加热10小时后,分离纯化获得磁性纳米内核颗粒(mnp);
80.磁性纳米内核颗粒(3毫克)分散于多巴胺溶液中(水50毫升、多巴胺50毫克、28%氨水400微升),室温静置反应4小时后,分离纯化得到核壳结构的mnp@pda颗粒。
81.磁性纳米内核颗粒(mnp)和功能化磁性纳米颗粒mnp@pda的扫描电镜图如2(b)所示。可看出,mnp颗粒表面较为粗糙,多巴胺聚合反应后,颗粒表面的光滑度提升,佐证了功能性聚多巴胺已成功包覆到mnp颗粒的表面。
82.采用商用小磁铁对溶液中的mnp@pda颗粒进行分离,结果如图2(c)所示。可看出,mnp@pda颗粒对外界磁场具有优异的快速响应性,采用商用小磁铁在20秒内即可对溶液中的mnp@pda颗粒进行有效分离,操作过程简单快捷。
83.mnp和mnp@pda两种颗粒的尺寸分布(左侧图)及zeta电势图(右侧图)如图2(d)所示。可看出,pda包覆后,颗粒zeta电势变低,说明pda已成功包覆到mnp颗粒的表面。
84.实施例3
85.本实施例对细胞外囊泡(ev)样品的制备方法进行优化,采用差速冷冻离心法收集,具体过程为:
86.如图3(a)所示,对含有ev颗粒的溶液进行差速离心,设置离心力2500g、60分钟;18000g、30分钟;120000g、120分钟,所得样品分别命名为碎片(debris)、大细胞外囊泡(large ev,l-ev)、小细胞外囊泡(small ev,s-ev),对应样品图形中,s-ev、l-ev图像为透射显微镜图片;碎片和细胞图像为普通光学显微镜图片。其中l-ev、s-ev样品直接用于后续聚糖分析,碎片样品和活细胞样品先进行超声破碎再进行后续分析。四种样品中ev颗粒尺寸分布使用zetaview纳米颗粒追踪分析仪(zetaview pmx120)进行表征,数据示例见图3(b)。
87.从图3可看出,通过不同速度的差速离心分离可成功获得不同尺寸的生物样品,四种样品具有不同的形貌特征。l-ev和s-ev为典型的膜囊泡结构。而大尺寸的细胞和碎片样本则可通过超声处理将其分裂为尺寸与l-ev和s-ev相似的颗粒样本,便于mnp@pda颗粒对其进行捕获与操纵以进行后续分析。
88.实施例4
89.本实施例对mnp@pda颗粒对ev颗粒的捕获进行优化,mnp@pda颗粒对ev颗粒的捕获效率及捕获后复合体的稳定性(即ev是否可以牢牢固定于磁性颗粒上)是进行后续分析的首要前提,具体过程为:
90.采用bca蛋白定量法对ev样品的蛋白浓度进行确定;
91.设置mnp@pda颗粒上样量为10微克,ev上样量为50微升,浓度为7.5微克/毫升,采用活细胞、细胞碎片、s-ev、l-ev作为样品进行上样;
92.用pbs对mnp@pda-ev复合体洗涤4次,并采用bca蛋白定量法测量洗涤上清液中的ev含量,进而计算洗涤后mnp@pda颗粒上的ev残留量,以确定mnp@pda颗粒对ev颗粒的捕获稳定性。
93.图4(a)为mnp@pda颗粒捕获ev颗粒后所得mnp@pda-ev复合体的扫描电镜图片。白色箭头所指为mnp@pda颗粒,红色箭头所指为不同尺寸大小的ev颗粒。图4(b)为mnp@pda颗粒对不同ev样品的捕获效率图。图4(c)为mnp@pda颗粒对不同ev样品捕获稳定性图。
94.从图4可看出,mnp@pda颗粒对不同ev样品均可有效捕获。在mnp@pda颗粒量为10微克,ev上样量浓度为7.5微克/毫升的条件下,几乎所有的ev颗粒均被捕获(捕获效率接近
100%)。表明pbs洗涤4次后,mnp@pda颗粒上不同ev样品的残留率仍在95%以上,说明一旦被mnp@pda颗粒捕获,不同类型的ev颗粒均可被牢牢固定于mnp@pda颗粒的表面,利于后续进一步的分析。
95.实施例5
96.本实施例对实施例1中各步骤的操作进行优化,具体过程为:
97.设置mnp@pda用量为10微克,ev样品的浓度分别为5μg/ml、10μg/ml、20μg/ml,ev样品上样量为50微升。将mnp@pda与ev样品混合反应。mnp@pda颗粒对ev样品的捕获量如图5(a)所示。可看出,mnp@pda颗粒对ev样品的捕获量随着ev样品的上样量增高而增高,在mnp@pda颗粒用量固定的前提下,mnp@pda颗粒对ev颗粒捕获率在降低,这是因为对于一定量的mnp@pda颗粒,其可用于捕获ev的表面积是固定的,当磁性颗粒表面达到饱和捕获时,即使再增加ev的上样量,mnp@pda颗粒也无法继续对ev进行捕获。图中数据显示在mnp@pda用量为10微克的前提下,ev上样量≤10μg/ml时,mnp@pda可捕获溶液中几乎所有的ev颗粒。
98.以下测试中,参照实施例1的方法,凝集素均选用cona,酶均选用β-半乳糖苷酶,封闭液均为新赛美ncmblot blocking buffer,酶底物均为荧光素二-β-d-吡喃半乳糖苷。信号均为荧光信号,所有信号归一化至信号最大值。
99.以cona为例,考察不同凝集素孵育时间下的相对信号强度,结果如图5(b)所示。结果表明凝集素的孵育时间10分钟时凝集素分子与ev聚糖的结合即以达到平衡。
100.以β-半乳糖苷酶为例,考察不同酶孵育时间下的相对信号强度,结果如图5(c)所示。结果表明酶的孵育时间10分钟时酶分子与凝集素分子的结合即以达到平衡。
101.以商用快速封闭液(新赛美ncmblot blocking buffer)作为封闭液为例,考察不同封闭孵育时间下的相对信号强度,结果如图5(d)所示。结果表明孵育时间20-30分钟时封闭即以达到平衡。
102.实施例6
103.本实施例本发明方法的检测能力进行评价,并与酶联免疫吸附法(elisa)进行对比,具体过程为:
104.以肺癌a549细胞系的小细胞外囊泡(s-ev)样品为分析对象、伴刀豆凝集素a(cona)为代表性凝集素,酶分子为偶联有链霉亲和素的β-半乳糖苷酶,酶底物为荧光素二-β-d-吡喃半乳糖苷(fdg)。具体过程为:
105.采用bca蛋白定量法对ev样品的蛋白浓度进行确定;
106.ev样品的上样浓度为0.0μg/ml、0.5μg/ml、1.25μg/ml、2.5μg/ml、5.0μg/ml、7.5μg/ml、10μg/ml、15μg/ml、20μg/ml、30μg/ml、40μg/ml;
107.除ev上样量浓度外,本实施例方法的操作流程参照实施例1;
108.elisa方法操作流程如下:取50微升ev样品置于96孔酶标板中。孵育2小时后,移除ev溶液,加入100微升质量分数为1%的bsa溶液对酶标板进行封闭。封闭1小时后,移走封闭液,加入50微升浓度为2.5微克/毫升的修饰有生物素的cona溶液。孵育1小时以使cona分子靶向结合于ev上的聚糖结构。而后去掉cona上清液,加入50微升浓度为4微克/毫升的偶联有链霉亲和素的β-半乳糖苷酶溶液,孵育1小时,借助链霉亲和素与生物素的特异性亲和作用使酶分子结合到凝集素cona分子上。磁分离后移除上清液,用100微升pbs溶液洗涤酶标板以去除未结合到cona分子上的游离酶分子。最后加入50微升底物溶液(浓度为50微摩尔/
毫升的荧光素二-β-d-吡喃半乳糖苷溶液),反应5分钟后,用酶标仪对荧光信号进行采集。
109.如图6显示,本发明方法与elisa相比,在相同ev样品浓度下,本发明方法的信号强度要明显高于elisa。如样品上样浓度为10微克/毫升时,本发明方法的相对信号强度约为5.0,而elisa则仅为1.5。因此,本发明方法能更为明显的揭示ev聚糖的表达情况,特别是有利于检测一些表达量较低的聚糖结构。更为重要的是,elisa整体操作流程需要至少5小时,而本发明方法总体检测时间仅为1小时,操作时间大大缩短。图6结果表明本发明方法具有比elisa更优异的检测能力,整个操作流程要更为简便快捷。
110.实施例7
111.本实施例对不同细胞系进行分析测试,参照实施例1的方法,对a549、h1975、pc9、h1299、h460、h520等六种肺癌细胞系和beas-2b、16hbe等两种永生化的正常肺部组织细胞系的活细胞(cell)、细胞碎片(debris)、l-ev和s-ev等四种样品进行了分析测试,结果如图7所示。
112.从图7可看出,本发明方法可对不同细胞系进行聚糖分析,方法具备通用性。此外,通过本发明方法所获得的不同细胞系样品的聚糖图谱可知,一方面,总体上看,不同凝集素靶向的聚糖结构表达量是有差异的,cona、jacalin、snl三种凝集素靶向的聚糖表达量较高,dsl、rca-i、stl、lel、aal、wga、pha-e、psa、lca等凝集素靶向的聚糖表达量中等,其他凝集素靶向的聚糖表达量较低;另一方面,不同细胞系样品的糖基图谱具有差异性,如就小细胞外囊泡(s-ev)样品来说,与其他细胞s-ev样品相比,a549和beas-2b两种细胞的s-ev样品上dsl、rca-i、stl、lel、aal、wga等凝集素所靶向的聚糖结构的表达量要明显偏低。因此,本发明方法能有效挖掘不同样品间聚糖表达的差异性,在新型聚糖生物标志物的开发、癌症诊断等方面具有良好的应用前景。
113.上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。