一种taq dna聚合酶突变体及其应用
1.本技术是申请号为202210764015.x专利申请的分案申请(原申请的申请日为2022年06月29日,发明名称为一种taq dna聚合酶突变体及其应用)。
技术领域
2.本发明属于基因工程技术领域,涉及一种taq dna聚合酶突变体及其应用。
背景技术:
3.实时rt-pcr是一种用于检测样品中rna的方法,通过在qpcr反应中产生扩增子时检测随时间增加的荧光信号。目前,rt-pcr最广为人知的应用是在诊断实验室检测期间检测患者样本中的病毒遗传物质,例如sars-cov2(covid-19)的存在。rt-pcr是用于分子生物学、医学和法医学研究的rna靶标的检测标准。
4.taq dna聚合酶通常在分子生物学中用于在聚合酶链式反应(pcr)中扩展核酸扩增子。在pcr中,指定的dna片段(扩增子)通过三个步骤的重复循环进行扩增:变性、退火和扩增子的延伸/扩展。使用定性实时pcr(qpcr),通过染料或探针产生的荧光信号能够在pcr循环期间收集数据,从而可以测量和记录目标扩增。基于探针的化学方法利用荧光标记的靶标特异性探针,这些探针仅在与靶标序列结合时释放报告染料,从而可以在荧光信号强度增加时实时检测靶标扩增。
5.rt-pcr允许检测和扩增rna底物。当qpcr反应中包含逆转录酶时,可以通过额外的初始循环步骤检测rna,其中逆转录酶生成与rna底物互补的dna(cdna);然后可以通过dna聚合酶扩增该cdna以进行定量。当前的rt-pcr方案依赖于逆转录酶和dna聚合酶的的组合来产生数据,在大多数情况下,taq聚合酶仅限于对dna底物的扩增;能够从rna底物生成cdna的少数实例通常依赖于非常特定的缓冲液和方案,或者依赖于732位氨基酸的天冬氨酸突变,总体而言,这些情况下的taq活性通常不如逆转录酶强。
6.综上所述,如何提供一种具有高逆转录酶活性的taq dna聚合酶,对于rna检测领域具有重要意义。
技术实现要素:
7.针对现有技术的不足和实际需求,本发明提供一种taq dna聚合酶突变体及其应用,本发明使用定点诱变获得taq dna聚合酶突变体,有效提高了taq dna聚合酶的逆转录活性,所述taq dna聚合酶突变体能够高效地将rna底物转化为dna产物。
8.为达上述目的,本发明采用以下技术方案:
9.第一方面,本发明提供一种taq dna聚合酶突变体,所述taq dna聚合酶突变体在氨基酸序列seq id no.1的基础上发生如下突变:
10.e9k、l15s、d18r、h20e、h21e、k31e、r37d、f66a、k82e、a83f、r85d、p87g、p89g、e90k、f92a、i99s、e101k、l102s、l108s、a109f、r110d、g115p、s124i、i138s、v155s、l156s、h157e、t164i、l168s、r183d、g187p、e189a、e189i、e189k、e189s、k202e、e230a、e230c、e230m、
e230q、e230v、l233s、h235e、m236s、d237r、d244r、k247e、l281s、p291g、l294s、v310s、k314e、r349d、l379s、s383i、y394a、g395p、a442f、e507g、e507i、e507l、e537w、t544i、p550g、d578f、d578r、d578t、d578y、d732a、d732f、d732g、d732i、d732p、d732q、d732s、e742a、e742g、e742h、e742i、e742m、e742p、e742s、e39k和e189k的的组合、e39k和e230k的组合、e39k和e520k的组合、e39k和e537k的组合、e39k和d578r的组合、e39k和d732r的组合、e39k和e742k的组合、g46d和e189k的组合、g46d和e230k的组合、g46d和n384r的组合、g46d和d578r的组合、e189k和e230k的组合、e189k和e520k的组合、e189k和e537k的组合、e189k和d578r的组合、e189k和d732r的组合、e189k和e742k的组合、e230k和e520k的组合、e230k和e537k的组合、e230k和d578r的组合、e230k和d732r的组合、e230k和e742k的组合、e520k和e537k的组合、e520k和d578r的组合、e520k和d732r的组合、e520k和e742k的组合、e537k和d578r的组合、e537k和d732r的组合、e537k和e742k的组合、d578r和d732r的组合、d578r和e742k的组合、d732r和e742k的组合、e39k和e230k和e742k的组合、g46d和e189k和e230k的组合、g46d和e189k和d578r的组合、g46d和e189k和f667y的组合、g46d和e189k和d732r的组合、g46d和e230k和f667y的组合、g46d和e230k和d732r的组合、g46d和n384r和f667y的组合、g46d和d578r和f667y的组合、e189k和e230k和e520k的组合、e189k和e230k和e537k的组合、e189k和e230k和d578r的组合、e189k和e230k和d732r的组合、e189k和e230k和e742k的组合、e189k和e520k和e537k的组合、e189k和e520k和d578r的组合、e189k和e520k/d732r的组合、e189k/e520k/e742k的组合、e189k/e537k/d578r的组合、e189k和e537k和d732r的组合、e189k和e537k和e742k的组合、e189k和d578r和d732r的组合、e189k和d578r和e742k的组合、e189k和d732r和e742k的组合、e230k和e520k和e537k的组合、e230k和e520k和d578r的组合、e230k和e520k和d732r的组合、e230k和e520k和e742k的组合、e230k和e537k和d578r的组合、e230k和e537k和d732r的组合、e230k和d578r和d732r的组合、e230k和d732r和e742k的组合、e230k和d578r和e742k的组合、e230k和d732r和e742k的组合、e520k和e537k和d578r的组合、e520k和e537k和d732r的组合、e520k和d578r和d732r的组合、e520k和d732r和e742k的组合、e537k和d578r和d732r的组合、e537k和d578r和e742k的组合、e537k和d732r和e742k的组合、d578r和d732r和e742k的组合、g46d和e189k和e230k和f667y的组合、g46d和e189k和d578r和f667y的组合。
11.本发明中,通过点诱变获得taq dna聚合酶突变体,与野生型taq dna聚合酶不同,野生型taq dna聚合酶仅在非常严格的反应条件下表现有限的逆转录酶活性,本发明的taq dna聚合酶突变体能够以rna为底物高效转化cdna,并在标准反应条件下扩增该cdna,无需额外添加逆转录酶,能够显著提高实时荧光定量pcr检测目标核糖核酸(rna)的效率,同时还能够简化方案,利于方案优化,如将缓冲液组成调整为对单种酶最有效的组分。
12.seq id no.1:
13.mrgmlplfepkgrvllvdghhlayrtfhalkglttsrgepvqavygfaksllkalkedgdavivvfdakapsfrheayggykagraptpedfprqlalikelvdllglarlevpgyeaddvlaslakkaekegyevriltadkdlyqllsdrihvlhpegylitpawlwekyglrpdqwadyraltgdesdnlpgvkgigektarklleewgsleallknldrlkpairekilahmddlklswdlakvrtdlplevdfakrrepdrerlraflerlefgsllhefgllespkaleeapwpppegafvgfvlsrkepmwadllalaaarggrvhrapepykalrdlkeargllakdlsvlalreglglppgddpmllaylldpsnttpegvarryggewteeageraalserlfanlwgrlegeerllwlyreverplsavlahmeatg
vrldvaylralslevaeeiarleaevfrlaghpfnlnsrdqlervlfdelglpaigktektgkrstsaavlealreahpivekilqyreltklkstyidplpdlihprtgrlhtrfnqtatatgrlsssdpnlqnipvrtplgqrirrafiaeegwllvaldysqielrvlahlsgdenlirvfqegrdihtetaswmfgvpreavdplmrraaktinfgvlygmsahrlsqelaipyeeaqafieryfqsfpkvrawiektleegrrrgyvetlfgrrryvpdlearvksvreaaermafnmpvqgtaadlmklamvklfprleemgarmllqvhdelvleapkeraeavarlakevmegvyplavplevevgigedwlsakegsgssghhhhhh。
14.第二方面,本发明提供一种核酸分子,所述核酸分子含有编码第一方面所述的taq dna聚合酶突变体的核酸序列。
15.第三方面,本发明提供一种表达载体,所述表达载体含有第二方面所述的核酸分子。
16.优选地,所述表达载体包括质粒载体或病毒载体。
17.第四方面,本发明提供一种重组细胞,所述重组细胞含有第二方面所述的核酸分子或第三方面所述的表达载体。
18.第五方面,本发明提供第一方面所述的taq dna聚合酶突变体在制备逆转录反应试剂中的应用。
19.本发明获得的taq dna聚合酶突变体具备高效、稳定的逆转录活性,能够有效应用于制备逆转录反应试剂中。
20.第六方面,本发明提供一种逆转录试剂盒,所述逆转录试剂盒包第一方面所述的taq dna聚合酶突变体。
21.优选地,所述试剂盒还包括pcr反应液。
22.第七方面,本发明提供第一方面所述的taq dna聚合酶突变体在逆转录反应中的应用。
23.第八方面,本发明提供一种逆转录pcr方法,所述逆转录pcr方法包括:
24.以rna为模板,利用第一方面所述的taq dna聚合酶突变体进行逆转录pcr。
25.第九方面,本发明提供第一方面所述的taq dna聚合酶突变体在rna检测中的应用。
26.第十方面,本发明提供一种rna检测方法,所述rna检测方法包括:
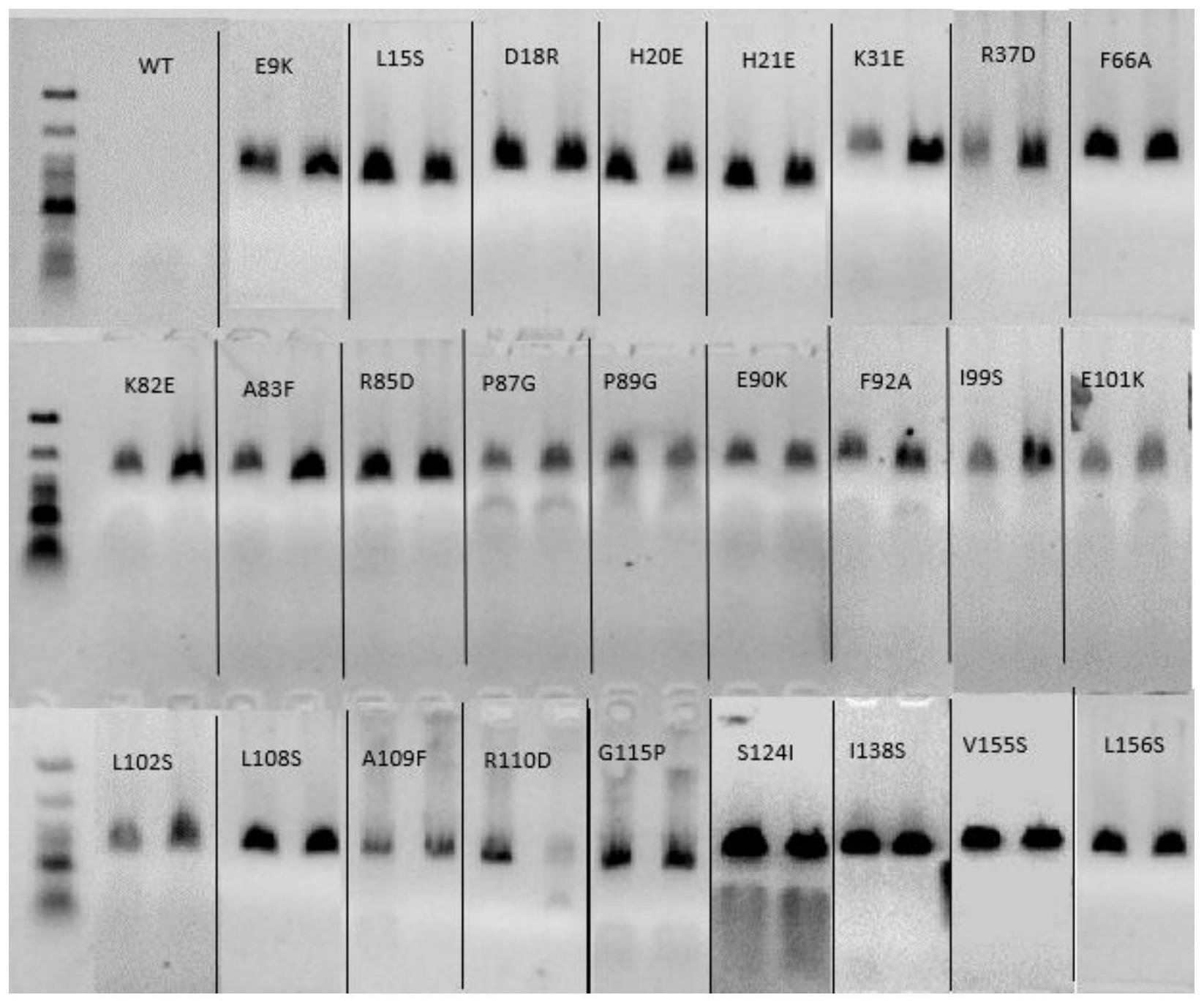
27.以待测rna为模板,利用第一方面所述的taq dna聚合酶突变体进行实时荧光定量pcr,分析荧光结果。
28.本发明中,根据嵌入染料或标记的靶探针切割产生的荧光信号的量,量化实时荧光定量pcr混合物中待测rna的量。
29.优选地,所述嵌入染料包括sybrgreen或evagreen。
30.与现有技术相比,本发明具有以下有益效果:
31.本发明通过点诱变获得taq dna聚合酶突变体,与野生型taq dna聚合酶不同,具备高效、稳定的逆转录酶活性,能够以rna为底物高效转化cdna,并在标准反应条件下扩增该cdna,无需额外添加逆转录酶,能够显著提高实时荧光定量pcr检测目标核糖核酸(rna)的效率,同时还能够简化方案,便于方案优化。
附图说明
32.图1为琼脂糖凝胶电泳图,其表明了野生型(wt)taq dna聚合酶和分别具有如下突变位点的taq dna聚合酶突变体的活性比较结果,e9k、l15s、d18r、h20e、h21e、k31e、r37d、f66a、k82e、a83f、r85d、p87g、p89g、e90k、f92a、i99s、e101k、l102s、l108s、a109f、r110d、g115p、s124i、i138s、v155s、l156s;
33.图2为琼脂糖凝胶电泳图,其表明了野生型(wt)taq dna聚合酶和分别具有如下突变位点的taq dna聚合酶突变体的活性比较结果,h157e、t164i、l168s、r183d、g187p、e189a、e189i、e189k、e189s、k202e、e230a、e230c、e230m、e230q、e230v、l233s、h235e、m236s、d237r、d244r、k247e、l281s、p291g、l294s、v310s、k314e、r349d、l379s、s383i、y394a、g395p、a442f;
34.图3为琼脂糖凝胶电泳图,其表明了野生型(wt)taq dna聚合酶和分别具有如下突变位点的taq dna聚合酶突变体的活性比较结果,e507g、e507i、e507l、e537w、t544i、p550g、d578f、d578r、d578t、d578y、d732a、d732f、d732g、d732i、d732p、d732q、d732s、e742a、e742g、e742h、e742i、e742m、e742p、e742s、e39k/e189k(本发明中“/”表示相应突变位点的组合,如e39k/e189k,表示e39k和e189k的组合)、e39k/e230k、e39k/e520k、e39k/e537k、e39k/d578r、e39k/d732r、e39k/e742k、g46d/e189k、g46d/e230k;
35.图4为琼脂糖凝胶电泳图,其表明了野生型(wt)taq dna聚合酶和分别具有如下突变位点的taq dna聚合酶突变体的活性比较结果,g46d/n384r、g46d/d578r、e189k/e230k、e189k/e520k、e189k/e537k、e189k/d578r、e189k/d732r、e189k/e742k、e230k/e520k、e230k/e537k、e230k/d578r、e230k/d732r、e230k/e742k、e520k/e537k、e520k/d578r、e520k/d732r、e520k/e742k、e537k/d578r、e537k/d732r、e537k/e742k、d578r/d732r、d578r/e742k、d732r/e742k、e39k/e230k/e742k、g46d/e189k/e230k、g46d/e189k/d578r、g46d/e189k/f667y、g46d/e189k/d732r、g46d/e230k/f667y、g46d/e230k/d732r、g46d/n384r/f667y、g46d/d578r/f667y、e189k/e230k/e520k、e189k/e230k/e537k、e189k/e230k/d578r、e189k/e230k/d732r、e189k/e230k/e742k、e189k/e520k/e537k、e189k/e520k/d578r、e189k/e520k/d732r、e189k/e520k/e742k、e189k/e537k/d578r、e189k/e537k/d732r、e189k/e537k/e742k、e189k/d578r/d732r;
36.图5为琼脂糖凝胶电泳图,其表明了野生型(wt)taq dna聚合酶和分别具有如下突变位点的taq dna聚合酶突变体的活性比较结果,e189k/d578r/e742k、e189k/d732r/e742k、e230k/e520k/e537k、e230k/e520k/d578r、e230k/e520k/d732r、e230k/e520k/e742k、e230k/e537k/d578r、e230k/e537k/d732r、e230k/d578r/d732r、e230k/d732r/e742ke230k/d578r/e742k、e230k/d732r/e742k、e520k/e537k/d578r、e520k/e537k/d732r、e520k/d578r/d732r、e520k/d732r/e742k、e537k/d578r/d732r、e537k/d578r/e742k、e537k/d732r/e742k、d578r/d732r/e742k、g46d/e189k/e230k/f667y或、g46d/e189k/d578r/f667y。
具体实施方式
37.为进一步阐述本发明所采取的技术手段及其效果,以下结合实施例和附图对本发明作进一步地说明。可以理解的是,此处所描述的具体实施方式仅仅用于解释本发明,而非
对本发明的限定。
38.实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购获得的常规产品。
39.术语“生物活性片段”指taq dna聚合酶或其突变体序列的任何片段、衍生物、同源物或类似物,其具有生物分子特有的体内或体外逆转录酶活性。在一些实施方案中,taq dna聚合酶突变体的生物活性片段、衍生物、同源物或类似物在任何体内或体外试验中都具有taq dna聚合酶突变体的任何程度的生物活性。
40.在一些实施方案中,生物活性片段可以任选地包括任意数量的taq dna聚合酶突变体序列的连续氨基酸残基。本发明还包括编码任何这种生物活性片段和/或简并核酸序列的多核苷酸。
41.生物活性片段可来自转录后处理或来自选择性剪接rna的翻译,或者可通过工程改造、批量合成或其他合适的操作产生。生物活性片段包括在天然或内源细胞中表达的片段,以及在表达系统如细菌、酵母、植物、昆虫或哺乳动物细胞中产生的片段。
42.短语“保守氨基酸取代”或“保守突变”是指一种氨基酸被具有共同性质的另一种氨基酸取代。定义单个氨基酸之间的共同性质的一种功能性方法是分析同源生物的相应蛋白质之间氨基酸变化的标准化频率(schulz(1979)principles of protein structure,springer-verlag)。根据这样的分析,可以定义氨基酸组,其中组内的氨基酸优先彼此交换,因此在它们对整体蛋白质结构的影响方面彼此最相似(schulz(1979)同上)。以这种方式定义的氨基酸组的实例可以包括:“带电/极性组”,包括glu、asp、asn、gln、lys、arg和his;“芳香族或环状组”,包括pro、phe、tyr和trp;和“脂肪族组”,包括gly、ala、val、leu、ile、met、ser、thr和cys。在每一组中,还可以确定亚组。例如,带电荷/极性氨基酸组可以被细分为亚组,包括:“带正电荷的亚组”,包括lys、arg和his;“带负电荷的亚组”,包括glu和asp;以及“极性亚组”,包括asn和gln。在另一个实例中,芳香族或环状组可以被细分为亚组,包括:“氮环亚组”,包括pro、his和trp;以及“苯基亚组”,包括phe和tyr。在另一个进一步的实例中,脂肪族组可以被细分为亚组,包括:“大脂肪族非极性亚组”,包括val、leu和ile;“脂肪族微极性亚组”包括met、ser、thr和cys;以及“小残基亚组”包括gly和ala。保守突变的实例包括上述亚组内氨基酸的氨基酸取代,例如但不限于:lys取代arg,反之亦然,这样可以保持正电荷;glu取代asp,反之亦然,这样可以保持负电荷;ser取代thr,反之亦然,这样可以保持一个游离的
‑‑
oh;以及gln取代asn,反之亦然,这样可以保持游离的
‑‑
nh2。“保守变体”是包含一个或多个氨基酸的多肽,所述一个或多个氨基酸已被取代,以用具有共同性质的氨基酸替换参考多肽(例如,其序列在出版物或序列数据库中公开的多肽,或其序列已通过核酸测序确定的多肽)的一个或多个氨基酸,例如,属于如上所述的相同氨基酸组或亚组。
43.当提及基因时,“突变体”是指该基因相对于天然或野生型基因具有至少一个碱基(核苷酸)改变、缺失或插入。所述突变(一个或多个核苷酸的改变、缺失和/或插入)可以在基因的编码区或可以在内含子、3’utr、5’utr或启动子区。作为非限制性实例,突变基因可以是在启动子区域内插入可以增加或减少基因表达的基因;可以是具有缺失的基因,导致产生非功能性蛋白质、截短蛋白质、显性失活蛋白质或无蛋白质;或者,可以是具有一个或
多个点突变的基因,导致编码蛋白质的氨基酸发生变化或导致基因转录物的异常剪接。
44.当在本具体实施方式部分中使用术语“本发明的taq dna聚合酶突变体”和“taq dna聚合酶突变体”时,根据上下文,共同或单独地指代经测试并表现出增强的逆转录酶活性的taq dna聚合酶突变体多肽。术语“本发明的taq dna聚合酶突变体”和“taq dna聚合酶突变体”还包括变体序列和/或简并核酸序列。
[0045]“天然存在的”或“野生型”是指在自然界中发现的形式。例如,天然存在的或野生型多肽或多核苷酸序列是生物体中存在的序列,其未被人为操作故意修饰。
[0046]
在一些实施方案中,本发明涉及用于进行连接反应的方法(以及相关试剂盒、系统、装置和组合物),所述连接反应包括或由以下步骤组成:在一个或多个核苷酸存在的情况下,使taq dna聚合酶突变体或其生物活性片段与核酸模板接触,并使用所述taq dna聚合酶突变体或其生物活性片段连接所述一个或多个核苷酸中的至少一个。
[0047]
在一些实施方案中,所述进行连接反应的方法可以包括将双链rna或dna多核苷酸链连接到环状分子中。在一些实施方案中,所述方法还可以包括使用传感器检测指示连接的信号。在一些实施方案中,所述传感器是isfet。在一些实施方案中,所述传感器可以包括连接反应中的可检测标签或可检测试剂。
[0048]
本发明所述的taq dna聚合酶突变体可在任何合适的宿主系统中表达,包括细菌、酵母、真菌、杆状病毒、植物或哺乳动物宿主细胞。
[0049]
对于细菌宿主细胞,可用于taq dna聚合酶突变体转录的启动子包括从以下来源获得的启动子:大肠杆菌lac操纵子、天蓝色链霉菌琼脂酶基因(daga)、枯草芽孢杆菌左聚糖鹿糖酶基因(sacb)、地衣芽孢杆菌α-淀粉酶基因(amyl)、嗜热脂肪芽孢杆菌麦芽糖淀粉酶基因(amym)、解淀粉芽孢杆菌α-淀粉酶基因(amyq)、地衣芽孢杆菌青霉素酶基因(penp)、枯草芽孢杆菌xyla和xylb基因和原核β-内酰胺酶基因(villa-kamaroffetal.,1978,proc.natl acad.sci.usa75:3727-3731),以及tac启动子(deboeretal.,1983,proc.natlacad.sci.usa80:21-25)。
[0050]
对于丝状真菌宿主细胞,可用于taq dna聚合酶突变体转录的启动子包括从以下来源的基因获得的启动子:米曲霉taka淀粉酶、米黑根毛霉天冬氨酸蛋白酶、黑曲霉中性α-淀粉酶、黑曲霉酸稳定α-淀粉酶、黑曲霉或泡盛曲霉葡糖淀粉酶(glaa)、米黑根毛霉脂肪酶、米曲霉碱性蛋白酶、米曲霉磷酸丙糖异构酶、构巢曲霉乙酰胺酶和尖孢镰刀菌胰蛋白酶样蛋白酶(wo96/00787),以及na2-tpi启动子(来自黑曲霉中性α-淀粉酶和米曲霉磷酸丙糖异构酶基因的启动子的杂交体),及其突变、截短和杂交启动子。
[0051]
在酵母宿主中,可用于taq dna聚合酶突变体转录的启动子可以来自酿酒酵母烯醇酶(eno-1)、酿酒酵母半乳糖激酶(gal1)、酿酒酵母乙醇脱氢酶/甘油醛-3-磷酸脱氢酶(adh2/gap)和酿酒酵母3-磷酸甘油酸激酶的基因。其它对酵母宿主细胞有用的启动子描述参见romanosetal.,1992,yeast8:423-488。
[0052]
对于杆状病毒的表达,可用于taq dna聚合酶突变体转录的启动子可来源于鳞翅目(蛾类和蝴蝶类)的昆虫细胞系,如草地贪夜蛾,被用作宿主。基因表达受强启动子的控制,例如ppolh。
[0053]
植物表达载体基于根癌农杆菌的ti质粒,或基于烟草花叶病毒(tmv)、马铃薯病毒x或豇豆花叶病毒。植物表达载体中常用的组成型启动子是花椰菜花叶病毒(camv)35s启动
子。
[0054]
对于哺乳动物表达,培养的哺乳动物细胞系如中国仓鼠卵巢(cho)、cos(包括人细胞系如hek和hela)可用于产生taq dna聚合酶突变体。哺乳动物表达载体包括腺病毒载体、psv和pcmv系列质粒载体、痘苗病毒和逆转录病毒载体以及杆状病毒。巨细胞病毒(cmv)和sv40启动子通常用于哺乳动物表达载体中,以驱动基因表达。非病毒启动子,例如延伸因子(ef)-1启动子也是已知的。
[0055]
用于表达的控制序列可以是合适的转录终止子序列,即被宿主细胞识别以终止转录的序列。所述终止子序列可操作地连接到编码多肽的核酸序列的3’端。可以使用在所选宿主细胞中起作用的任何终止子。
[0056]
例如,丝状真菌宿主细胞的示例性转录终止子可以从米曲霉taka淀粉酶、黑曲霉葡糖淀粉酶、构巢曲霉邻氨基苯甲酸合酶、黑曲霉α-葡糖苷酶和尖孢镰刀菌胰蛋白酶样蛋白酶的基因获得。
[0057]
酵母宿主细胞的示例性终止子可以从酿酒酵母烯醇酶、酿酒酵母细胞色素c(cyc1)和酿酒酵母甘油醛-3-磷酸脱氢酶的基因获得。
[0058]
所述控制序列也可以是合适的前导序列,即对宿主细胞翻译很重要的mrna的非翻译区。前导序列可操作地连接到编码多肽的核酸序列的5’端。可以使用在所选宿主细胞中有功能的任何前导序列。丝状真菌宿主细胞的示例性前导序列从米曲霉taka淀粉酶和构巢曲霉磷酸丙糖异构酶的基因中获得。从酿酒酵母烯醇酶(eno-1)、酿酒酵母3-磷酸甘油酸激酶、酿酒酵母α-因子和酿酒酵母醇脱氢酶/甘油醛-3-磷酸脱氢酶(adh2/gap)的基因中获得适合酵母宿主细胞的前导序列。
[0059]
所述控制序列也可以是多聚腺苷酸化序列,该序列可操作地连接到核酸序列的3’端,并且在转录时,被宿主细胞识别为向转录的mrna添加多聚腺苷酸残基的信号。在所选宿主细胞中起作用的任何多聚腺苷酸化序列均可用于本发明。丝状真菌宿主细胞的示例性多聚腺苷酸化序列可以来自米曲霉taka淀粉酶、黑曲霉葡糖淀粉酶、构巢曲霉邻氨基苯甲酸合酶、尖孢镰刀菌胰蛋白酶样蛋白酶和黑曲霉α-葡糖苷酶的基因。
[0060]
所述控制序列也可以是信号肽编码区,其编码与多肽的氨基端连接的氨基酸序列,并将编码的多肽导入细胞的分泌途径。所述核酸序列的编码序列的5’端可以固有地含有信号肽编码区,该编码区在翻译阅读框中与编码分泌多肽的编码区片段天然连接。或者,所述编码序列的5’端可以含有编码序列外源的信号肽编码区。在编码序列天然不包含信号肽编码区时,可能需要外源信号肽编码区。
[0061]
或者,所述外源信号肽编码区可以简单地取代天然信号肽编码区,以增强多肽的分泌。然而,可以使用将表达的多肽导入所选宿主细胞的分泌途径中的任何信号肽编码区。
[0062]
细菌宿主细胞的有效信号肽编码区是从芽孢杆菌ncib11837麦芽淀粉酶、嗜热脂肪芽孢杆菌α-淀粉酶、地衣芽孢杆菌枯草杆菌蛋白酶、地衣芽孢杆菌β-内酰胺酶、嗜热脂肪芽孢杆菌中性蛋白酶(nprt、nprs、nprm)和枯草芽孢杆菌prsa的基因获得的信号肽编码区。simonen和palva,1993,microbiolrev57:109-137进一步描述了信号肽。
[0063]
丝状真菌宿主细胞的有效信号肽编码区可以是从米曲霉taka淀粉酶、黑曲霉中性淀粉酶、黑曲霉葡糖淀粉酶、米黑根毛霉天冬氨酸蛋白酶、特异腐质霉纤维素酶和柔毛腐质霉脂肪酶基因中获得的信号肽编码区。
[0064]
用于酵母宿主细胞的有用信号肽可以来自酿酒酵母α因子和酿酒酵母转化酶的基因。其他宿主细胞系统的信号肽也是众所周知的。
[0065]
所述控制序列也可以是编码位于多肽氨基端的氨基酸序列的前肽编码区。所得的多肽被称为酶原或多肽原(或在某些情况下称为酶原(zymogen))。多肽原通常是无活性的,并且可以通过肽原从多肽原的催化或自催化裂解而转化为成熟的活性多肽。肽原编码区可从枯草芽孢杆菌碱性蛋白酶(apre)、枯草芽孢杆菌中性蛋白酶(nprt)、酿酒酵母α-因子、米黑根毛霉天冬氨酸蛋白酶和嗜热毁丝霉乳糖酶的基因获得(wo95/33836)。
[0066]
当信号肽和肽原区都存在于多肽的氨基端时,肽原区位于多肽氨基端的旁边,信号肽区位于肽原区氨基端的旁边。
[0067]
还可能需要添加调控序列,其允许相对于宿主细胞的生长调控taq dna聚合酶突变体的表达。调控系统的实例是那些响应化学或物理刺激(包括调控化合物的存在)导致基因表达开启或关闭的系统。在原核宿主细胞中,合适的调控序列包括lac、tac和trp操纵系统。在酵母宿主细胞中,合适的调控系统包括,例如,adh2系统或gal1系统。在丝状真菌中,合适的调控序列包括takaα-淀粉酶启动子、黑曲霉葡糖淀粉酶启动子和米曲霉葡糖淀粉酶启动子。其他宿主细胞的调控系统也是众所周知的。
[0068]
调控序列的其他实例是允许基因扩增的序列。在真核生物系统中,这些包括在甲氨蝶呤存在下扩增的二氢叶酸还原酶基因和用重金属扩增的金属硫蛋白基因。在这些情况下,编码本发明多肽的核酸序列将与调控序列有效连接。
[0069]
一个具体实施方案中包括重组表达载体,其包含编码工程改造的taq dna聚合酶突变体的多核苷酸,和一个或多个表达调节区,例如启动子和终止子,以及复制起点,这取决于它们将被导入的宿主的类型。上述各种核酸和控制序列可以连接在一起以产生重组表达载体,所述重组表达载体可以包括一个或多个方便的限制性位点,以允许在这些位点插入或取代编码taq dna聚合酶突变体的核酸序列。或者,taq dna聚合酶突变体的核酸序列可以通过将核酸序列或包含该序列的核酸构建体插入合适的表达载体中来表达。在构建表达载体时,编码序列位于载体中,使得编码序列与合适的控制序列有效连接以进行表达。
[0070]
所述重组表达载体可以是任何载体(例如质粒或病毒),其可以方便地进行重组dna程序,并且可以引起taq dna聚合酶突变体多核苷酸序列的表达。载体的选择通常取决于载体与导入载体的宿主细胞的相容性。所述载体可以是线性或闭合环状质粒。
[0071]
所述表达载体可以是自主复制载体,即作为染色体外实体存在的载体,其复制独立于染色体复制,例如质粒、染色体外元件、微型染色体或人工染色体。所述载体可以包含任何确保自我复制的手段。或者,所述载体可以是当导入宿主细胞时整合到基因组中并与其整合的染色体一起复制的载体。此外,可以使用单个载体或质粒,或两个或多个载体或质粒,它们一起包含要导入宿主细胞基因组的总dna,或转座子。
[0072]
本发明所述的表达载体优选包含一个或多个选择标记,其允许容易地选择转化的细胞。选择标记是其产物提供杀生物剂或病毒抗性、对重金属的抗性、对营养缺陷型的原养型等的基因。细菌选择标记的实例是来自枯草芽孢杆菌或地衣芽孢杆菌的dal基因,或赋予抗生素抗性例如氨苄青霉素、卡那霉素、氯霉素(实施例1)或四环素抗性的标记。酵母宿主细胞的合适标记是ade2、his3、leu2、lys2、met3、trp1和ura3。用于丝状真菌宿主细胞的选择标记包括但不限于amds(乙酰胺酶)、argb(鸟氨酸氨基甲酰基转移酶)、bar(膦丝菌素乙
酰转移酶)、hph(潮霉素磷酸转移酶)、niad(硝酸还原酶)、pyrg(乳清酸核苷-5'-磷酸脱羧酶)、sc(硫酸腺苷酸转移酶)和trpc(邻氨基苯甲酸合酶)及其等同物。用于曲霉细胞的实施方案包括构巢曲霉或米曲霉的amds和pyrg基因以及吸水链霉菌的bar基因。昆虫、植物和哺乳动物细胞的选择标记也是众所周知的。
[0073]
本发明所述的表达载体优选包含允许载体整合到宿主细胞基因组中或允许载体在细胞中独立于基因组自主复制的元件。为了整合到宿主细胞基因组中,所述载体可以依赖编码多肽的核酸序列或载体的任何其它元件,以通过同源或非同源重组将载体整合到基因组中。
[0074]
或者,所述表达载体可以包含用于指导通过同源重组整合到宿主细胞的基因组中的额外的核酸序列。所述额外的核酸序列使载体能够在染色体中的精确位置整合到宿主细胞基因组中。所述整合元件可以是与宿主细胞基因组中的靶序列同源的任何序列。此外,所述整合元件可以是非编码或编码核酸序列。另一方面,所述载体可以通过非同源重组整合到宿主细胞的基因组中。
[0075]
对于自主复制,所述载体可以进一步包含使载体能够在所讨论的宿主细胞中自主复制的复制起点。细菌复制起点的实例是p15a ori,或允许在大肠杆菌中复制的质粒pbr322、puc19、pacyc177(该质粒具有p15a ori)或pacyc184的复制起点,以及允许在芽孢杆菌中复制的pub110、pe194、pta1060或pam31的复制起点。酵母宿主细胞中使用的复制起点的实例是2微米复制起点ars1、ars4、ars1和cen3的组合,以及ars4和cen6的组合。所述复制起点可以是一个突变,使其在宿主细胞中对温度敏感(参见,例如,ehrlich,1978,proc natl acad sci.usa 75:1433)。
[0076]
所述taq dna聚合酶突变体的一个以上拷贝的核酸序列可以被插入宿主细胞以增加基因产物的产生。核酸序列拷贝数的增加可以通过将至少一个额外的序列拷贝整合到宿主细胞基因组中或通过在核酸序列中包含可扩增的选择标记基因来获得,其中可以通过在合适的选择试剂存在下培养细胞来选择含有可扩增的选择标记基因拷贝的细胞,从而选择核酸序列的额外拷贝。
[0077]
所述taq dna聚合酶突变体多核苷酸的表达载体是可商购的。合适的商业表达载体包括来自sigma-aldrich chemicals,st.louis mo.的p3xflagtm表达载体,其包括用于在哺乳动物宿主细胞中表达的cmv启动子和hgh多聚腺苷酸化位点,以及用于在大肠杆菌中扩增的pbr322复制起点和氨苄青霉素抗性标记。其他合适的表达载体是pbluescriptii sk(-)和pbk-cmv,它们可从stratagene,lajolla ca商购,以及来自pbr322(gibco brl)、puc(gibco brl)、prep4、pcep4(invitrogen)或ppoly(lathe et al.,1987,gene 57:193-201)的质粒。
[0078]
用于表达编码taq dna聚合酶突变体的多核苷酸的合适宿主细胞是本领域熟知的,包括但不限于细菌细胞,例如大肠杆菌、开菲尔乳杆菌、短乳杆菌、小乳杆菌、链霉菌和鼠伤寒沙门菌细胞;真菌细胞,例如酵母细胞(例如,酿酒酵母或毕赤酵母(atcc申请号201178));昆虫细胞,例如果蝇s2和甜菜夜蛾sf9细胞;动物细胞,例如cho、cos、bhk、293和bowes黑色素瘤细胞;和植物细胞。
[0079]
可通过本领域已知的各种方法将用于表达所述taq dna聚合酶突变体的多核苷酸导入细胞。技术包括电穿孔、生物弹道微粒轰击、脂质体介导的转染、氯化钙转染和原生质
体融合等。
[0080]
编码所述taq dna聚合酶突变体的多核苷酸可以根据已知的合成方法通过标准固相方法制备。在一些实施方案中,可单独合成多达约100个碱基的片段,然后连接(例如,通过酶促或化学诉讼方法,或聚合酶介导的方法)以形成任何所需的连续序列。例如,多核苷酸可以通过化学合成来制备,所述化学合成使用例如,由beaucage et al.,1981,tet lett 22:1859-69描述的经典亚磷酰胺方法,或由matthes et al.,1984,embo j.3:801-05描述的方法,例如,其通常在自动化合成方法中实践。根据亚磷酰胺方法,合成寡核苷酸,例如,在自动dna合成仪中,纯化、退火、连接和克隆到合适的载体中。此外,基本上任何核酸都可以从各种商业来源中获得,例如,midland certified reagent company,midland,tex.;great american gene company,ramona,calif.;expressgen inc.chicago,ill.;以及operon technologies inc.,alameda,calif.
[0081]
使用任何一种或多种众所周知的蛋白质纯化技术,包括溶菌酶处理、超声处理、过滤、盐析、超离心和色谱法,可以从细胞和/或培养基中回收宿主细胞中表达的经工程改造的taq dna聚合酶突变体。用于从细菌(例如大肠杆菌)中裂解和高效提取蛋白质的合适溶液,可从st.louismo的sigma-aldrich购得,商品名为cellyticb.tm.。
[0082]
分离所述taq dna聚合酶突变体的色谱技术包括反相色谱、高效液相色谱、离子交换色谱、凝胶电泳和亲和色谱等。纯化条件将部分取决于诸如净电荷、疏水性、亲水性、分子量、分子形状等因素,并且对本领域技术人员来说是显而易见的。
[0083]
在一些实施方案中,亲和技术可用于分离所述taq dna聚合酶突变体。对于亲和层析纯化,可以使用与taq dna聚合酶突变体特异性结合的任何抗体。为了产生抗体,可以通过注射化合物来免疫各种宿主动物,包括但不限于兔、小鼠、大鼠等。所述化合物可以通过侧链官能团或连接至侧链官能团的接头连接至合适的载体,例如牛血清白蛋白。根据宿主种类,可以使用各种佐剂来增加免疫反应,包括但不限于弗氏佐剂(完全和不完全)、矿物凝胶如氢氧化铝、表面活性物质如溶血卵磷脂、普朗尼克多元醇、聚阴离子、肽、油乳剂、匙孔血蓝蛋白、二硝基苯酚,以及潜在有用的人类佐剂如bcg(卡介苗)和细小棒杆菌。
[0084]
实施例1
[0085]
本实施例制备taq dna聚合酶突变体。
[0086]
与野生型taq dna聚合酶相比,taq dna聚合酶突变体表现出更高的逆转录酶活性,通过聚合酶链式反应进行工程改造、表征和筛选,通过琼脂糖凝胶电泳进行可视化,使用基于探针的实时荧光定量pcr(qpcr)进行初始筛选后,使用典型的逆转录循环方案检测指定的核糖核酸(rna)靶序列。
[0087]
通过常规反向pcr诱变seqnoid.1产生taq dna聚合酶突变体。对所有突变体进行测序验证,在大肠杆菌中表达并纯化,所有taq dna聚合酶突变体和野生型taq dna聚合酶(氨基酸序列为seq id no.1,核酸序列为seq id no.2)都添加了c端标签,以便于纯化。
[0088]
具有c端histag的taq dna聚合酶的dna序列(野生型)如seq id no.2所示。
[0089]
seq id no.2:
[0090]
atgcgcggtatgctgccgttatttgaaccgaaaggtcgtgtgctgctggttgatggtcatcacttagcatatcgtacctttcatgccctgaaaggcctgaccacctctcgcggcgaaccggttcaggcagtgtatggttttgccaaatcactgctgaaagcattaaaagaagatggcgatgcagtgattgttgtgtttgatgccaaagccccgagctttc
gtcatgaagcctatggcggctacaaagcaggtcgcgccccgaccccggaagattttccgcgtcagctggccttaattaaagaattagttgacttgctgggcttagcacgtctggaagttccgggctatgaagcagatgatgttttagcctcactggccaaaaaagccgaaaaagaaggctatgaagttcgcattctgaccgcagataaggatctgtatcagctgctgagcgatcgtattcatgtgttacatccggaaggctatctgattaccccggcatggttatgggaaaaatatggtttacgtccggatcagtgggcagattatcgtgcactgaccggtgacgaatcagataatctgccgggcgttaaaggtattggtgaaaaaaccgcccggaaattattagaagaatggggtagtctggaagcattactgaaaaatctggatcgcctgaaaccggcaattcgcgaaaaaattttagcccacatggatgacttaaaactgtcttgggatctggccaaagtgcgtaccgatctgccgttagaagttgattttgccaaacgtcgcgaaccggatcgtgaacgcctacgagcctttctggaacgcttagaatttggctcactgttacatgaatttggcttactggaatctccgaaagcattagaagaagccccgtggccgccgccggaaggcgcctttgtgggctttgtgctgagtaggaaagaaccgatgtgggcagacttgctggccctggccgcagcacgcggcggtcgcgttcatcgtgccccggaaccgtacaaagccctgcgtgacctgaaagaagcacgcggcttattagccaaagacctgagtgttctggcattaagggaaggcttaggcctgccgccgggcgatgatccgatgctgctggcctatctgcttgacccgagtaataccaccccggaaggcgttgcacgtcgctatggcggcgagtggaccgaagaagcaggcgaacgtgcagccctgtcagaacgtctgtttgccaatctgtggggtcgcttagaaggcgaagaacgcttactgtggttatatcgtgaagtggaacgtccgctgagcgcagtgctggcacacatggaagccaccggtgtgcgcttagatgttgcatatctgcgtgccctgtctctggaagttgcagaagaaattgcacgcttagaagccgaagtttttcgcttagcaggtcatccgtttaacttaaatagtcgcgatcagctggaaagggttctgtttgatgaattaggcctgccggcaattggcaagaccgaaaaaaccggtaaacgctctacctcagccgcagttctggaagccctgcgcgaagcccatccgattgttgaaaaaattttacagtatcgtgaactgaccaaactgaaatctacctatattgatccgttaccggatctaattcatccgcgtaccggtcgcttacatacccgttttaatcagaccgccaccgccaccggtcgcttatcaagtagcgatccgaacttgcagaatattccggtgcgtaccccgttaggtcagcgcattcgtcgtgcctttattgcagaagaaggttggttattagttgcattagattatagtcagattgaactgcgtgtgttagcccatctgagcggcgacgaaaatctgattcgtgtgtttcaggaaggtcgcgatattcataccgaaaccgcctcttggatgtttggtgttccgcgcgaagcagttgatccgttaatgcgccgtgcagccaaaaccattaattttggtgtgctgtatggtatgagcgcacatcgcctgtcacaggaactggcaattccgtatgaagaagcacaggcctttattgaacgctattttcagtcttttccgaaagttcgcgcatggattgaaaaaaccttagaagaaggtcgtcgtcgcggctatgtggaaaccctgtttggtcgtcgtcgctatgttccggatctggaagcgagagttaaatcagtgcgtgaagccgccgaacgcatggcctttaatatgccggttcagggaacggcagctgaccttatgaaactggcaatggttaaactgtttccgcgcctggaagaaatgggtgcacgaatgctgttacaggttcatgatgaattagttctggaagccccgaaagaacgcgccgaagcagttgcacgtctggccaaagaagtgatggaaggtgtgtatccgttagcagttccgttagaagtggaagtgggtattggtgaagattggctgagcgccaaagaaggttctggcagttcaggtcatcaccaccatcatcactaa。
[0091]
qpcr在以下条件下进行,其中靶基因是28s基因。
[0092]
正向引物:5
’‑
ccgctgcggtgagccttgaa-3’[0093]
反向引物:5
’‑
tctccgggatcggtcgcgtt-3’[0094]
靶基因:28s rna,源自总rna-人肿瘤细胞系:hela(biochain cat#r1255811-50)。
[0095]
每个10μl反应体系包含1.5μl 50ng/μl taq dna聚合酶,0.4μl 10μm正向引物,0.4μl 10μm反向引物,1μl 10ng/μl的目标rna,0.4μl 10mm等摩尔dntp,0.1μl 1m dtt和1μl 10
×
反应缓冲液(最终组成20mm三羟甲基氨基甲烷盐酸盐、80mm三羟甲基氨基甲烷醋酸盐、10mm硫酸铵、10mm氯化钾、2mm硫酸镁、3mm醋酸镁,0.1%曲拉通x-100,ph 8.8(25℃)),
用水补足至10μl。
[0096]
用于qpcr测定的热循环仪是bio-rad t100,反应程序如下:60℃孵育20分钟,95℃变性5分钟,然后进行35个循环(95℃变性10秒,60℃延伸30秒),然后在75℃孵育5分钟。向每个样品中加入3μl含有6
×
gelred核酸染料(biotium cat#41003)的6
×
终止染料。将每个10μl的样品装入2%琼脂糖凝胶中,并与野生型(wt)taq聚合酶和低分子量dna长度标志(new england biolabs,cat#n3233)进行比较。
[0097]
结果如图1-图5所示,与野生型taq聚合酶相比,以本发明各taq dna聚合酶突变体进行扩增的扩增产物中均有明显的目标产物条带,表明本发明taq dna聚合酶突变体均能以rna为底物高效转化cdna,并在标准反应条件下扩增该cdna,即同时具备高效逆转录酶活性和聚合酶活性。
[0098]
实施例2
[0099]
本实施例提供taq dna聚合酶突变体在实时荧光定量pcr(qpcr)中应用。
[0100]
本发明获得的taq dna聚合酶突变体可用于使用常规qpcr方案对样品中rna进行定量,用于rna检测,而无需在反应混合物中添加额外的逆转录酶。
[0101]
综上所述,本发明通过点诱变获得taq dna聚合酶突变体,与野生型taq dna聚合酶不同,具备高效、稳定的逆转录酶活性,能够以rna底物为高效转化cdna,并在标准反应条件下扩增该cdna,无需额外添加逆转录酶,能够显著提高通过实时荧光定量pcr检测目标核糖核酸(rna)的效率,同时还能够简化方案,便于方案优化。
[0102]
申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
