1.本发明属于医疗领域,具体涉及一种稳定的酯肽类药物水溶液,旨在解决酯肽类药物的稳定性问题,包括达托霉素。
背景技术:
2.脂肽(lipopeptide)代表一类强效抗感染药物,其对多重耐药菌表现出高效的抗菌作用以及抗真菌活性。现在市场上有可获得的各种各样的脂肽药物如达托霉素(daptomycin)、泰拉万星(telavancin)、卡泊芬净(caspofungin)、米卡芬净(micafungin)、阿尼芬净(anidulafungin),以对抗侵袭性的通常危及生命的感染。
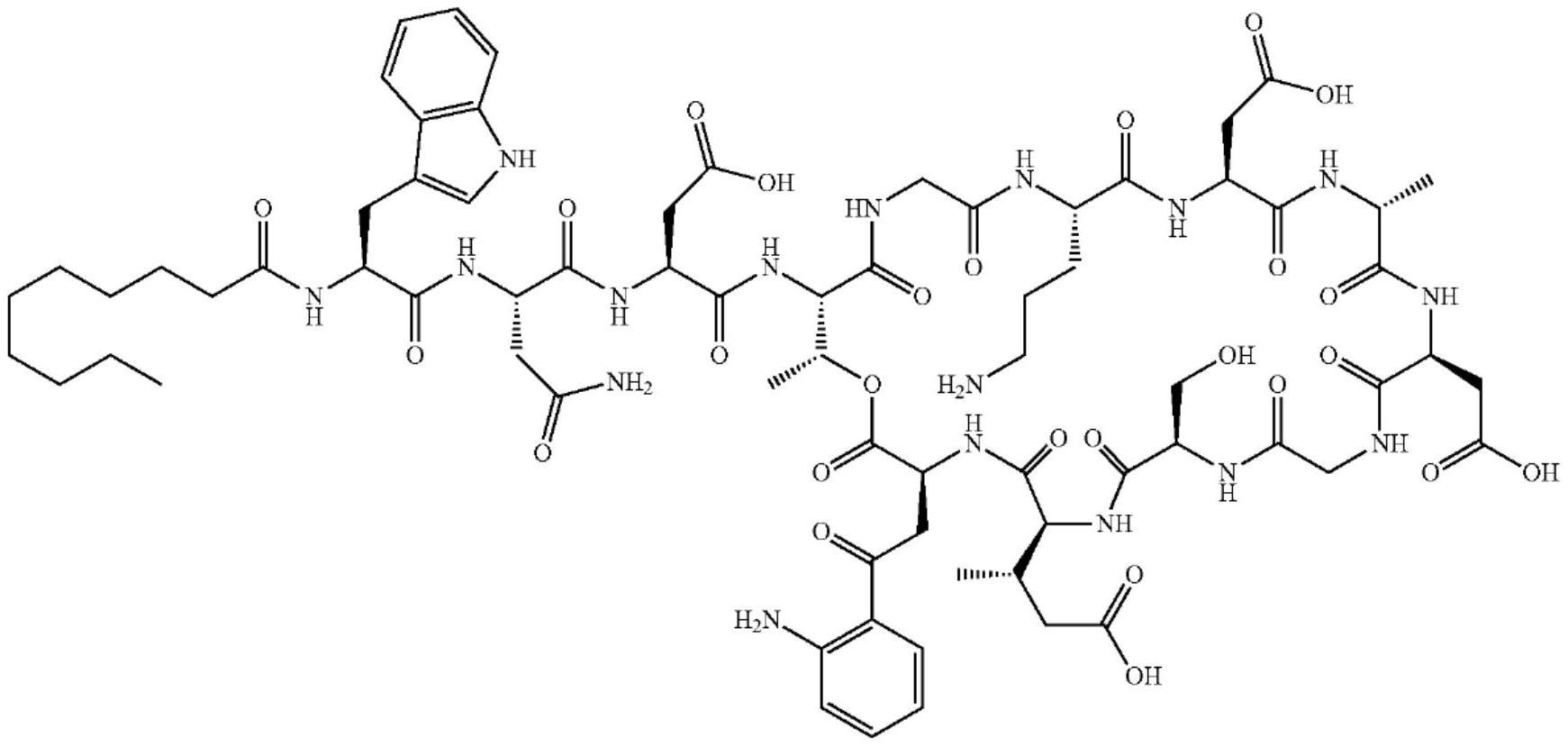
3.达托霉素(daptomycin)化学名为:n-decanoyl-l-tryptophyl-d-asparaginyl-l-aspartyl-l-threonylglycyl-l-ornithyl-l-aspartyl-d-alanyl-l-aspartylglycyl-d-seryl-threo-3-methyl-l-glutamyl-3-anthraniloyl-l-alanineε
1-lactone,分子式为:c
72h101n17o26
,分子量为:1620.67,结构式如下:
[0004][0005]
达托霉素(daptomycin,dap)为一种环酯肽类化合物。2003年,美国食品与药物管理局(fda)经过快速审理程序批准注射用达托霉素(商品名cubicin)用于治疗由一些革兰氏阳性敏感菌株引起的并发性皮肤及皮肤结构感染,如脓肿、手术切口感染和皮肤溃疡。达托霉素通过扰乱细胞膜对氨基酸的转运,从而阻碍细菌细胞壁肽聚糖的生物合成,改变细胞质膜的性质;另外,它还能通过破坏细菌的细胞膜,使其内容物外泄而达到杀菌的目的。因此细菌对达托霉素产生耐药性可能会比较困难。
[0006]
达托霉素对革兰氏阳性菌有强烈作用,用于治疗下列感染:
[0007]
1、复杂性皮肤及软组织感染(csssi):治疗由对本品敏感的金黄色葡萄球菌(包括甲氧西林耐药菌株)、化脓链球菌无乳链球菌、停乳链球菌似马亚种及粪肠球菌(仅用于万古霉素敏感的菌株)导致的复杂性肤及软组织感染。
[0008]
2、金黄色葡萄球菌(包括甲氧西林敏感和甲氧西林耐药)血流感染(菌血症),以及伴发的右侧感染性心内膜炎。
[0009]
根据现有文献,在溶液,尤其是在水性溶液中,达托霉素难以稳定,因为达托霉素易于水解降解,并且已知在微酸性溶液中通过asp-9残基上的天冬氨酰转肽作用而降解。因此达托霉素在国内外仅上市冻干粉针剂,静脉注射用。达托霉素冻干粉针在复溶时即会表现出快速降解,且达托霉素水溶液在短暂存储过程中也会出现降解,因此,达托霉素不适合在水溶液中长期储存。目前,以重构溶液的形式(即,含水状态的达托霉素)配制的市售的达托霉素在冷藏条件下的稳定性为5天,而在室温下最大稳定性为2天。达托霉素主要降解物是达托霉素的内脂水解物、达托霉素的β-异构体和脱水达托霉素,其结构式依次如下:
[0010]
[0011][0012]
例如kirsch披露了在纯化达托霉素过程中产生脱水达托霉素和达托霉素的β-异构体(pharmaceutical research,6:387-393,1989,kirsch)。kirsch描述了通过控制ph条件和温度条件而使脱水达托霉素和β-异构体的水平最小化的方法。然而,kirsch不能使达托霉素稳定且不能防止达托霉素向脱水达托霉素的转化及其随后向β-异构体的异构化。kirsch也不能防止达托霉素降解为与脱水达托霉素和β-异构体不相关的其它降解产物。美国专利us6696412披露了存在于发酵产物中的若干额外的杂质,其中达托霉素由所述发酵产物衍生得到,且该专利提供了产生增加的纯度的纯化达托霉素的方法。所述额外的杂质包括达托霉素的内酯水解产物。其公开了所述达托霉素纯化方法可包括形成达托霉素胶束、通过滤过除去低分子量污染物,然后将含有达托霉素的胶束滤液转化为非胶束状态,接着进行阴离子交换和反渗透渗滤以获得高纯度达托霉素,然后将其冻干,工艺复杂。
[0013]
wo2014041425公开了包含添加剂的冻干达托霉素制剂,所述辅料可以是抗氧化剂、有机酸或葡萄糖衍生物。wo2013103801公开了包含达托霉素和聚乙二醇的粉末制剂。wo20111063419公开了一种达托霉素冻干制剂,具有更短的复溶时间。虽然这些专利申请试图改善达托霉素的稳定性,但是均不可避免复溶步骤,以及错配的风险。
技术实现要素:
[0014]
为了解决现有技术中存在的问题,本发明采用如下技术方案:
[0015]
一种稳定的酯肽类药物水溶液,包括酯肽类药物、氨基酸衍生物。
[0016]
所述酯肽类药物选自达托霉素、泰拉万星(telavancin)、卡泊芬净(caspofungin)、米卡芬净(micafungin)、阿尼芬净(anidulafungin)等,优选为达托霉素。
[0017]
所述氨基酸衍生物含有游离巯基或n-乙酰-甘氨酸,n-乙酰-缬氨酸,n-乙酰-酪氨酸、n-乙酰-丙氨酸,n-乙酰-蛋氨酸,n-甲基-半胱氨酸中的一种。
[0018]
优选的,所述氨基酸衍生物具有如下式i结构:
[0019][0020]
其中r1选自氢,c
1-c3的烷基,卤素;r2和r3各自独立的选自cor4,氢,c
1-c6的烷基,且r2和r3中至少有一个为cor4,其中r4选自c
1-c6的烷基,芳基,烷芳基,所述芳基或烷芳基可用带有1-3个取代基团,所述取代基团选自卤素、硝基、烷酰基、c
1-c6的直链或支链烷基。
[0021]
示例性的,所述c
1-c3的烷基选自甲基,乙基,丙基,异丙基。
[0022]
示例性的,所述卤素选自cl,br,i。
[0023]
示例性的,所述c
1-c6的烷基选自甲基,乙基,丙基,异丙基,正丁基,异丁基,叔丁基,戊基,己基。所述芳基选自苯环、吡啶环、嘧啶环、吡嗪环、哒嗪环、呋喃环、噻吩环、吡唑环、咪唑环或三唑环。
[0024]
所述烷芳基具有通式(ch2)nar,其中n为1-5,优选为1-3,ar选自选自苯环、吡啶环、嘧啶环、吡嗪环、哒嗪环、呋喃环、噻吩环、吡唑环、咪唑环或三唑环。
[0025]
优选的,所述r1选自氢、甲基、乙基、氯。
[0026]
优选的,所述r4选自甲基,乙基,丙基。
[0027]
优选的,所述r2和r3其中有一个为氢。
[0028]
优选的,所述氨基酸衍生物具有如下结构:
[0029][0030]
其中r1、r2和r4的定义与前文相同。
[0031]
优选的,r1为氢、甲基、卤素;r2为氢、甲基;r4为甲基,乙基、丙基、苄基。
[0032]
优选的,所述氨基酸衍生物为n-乙酰-半胱氨酸。
[0033]
优选的,所述n-乙酰-半胱氨酸可以为d型或l型或dl的混合物。
[0034]
另一方面,本发明提供了一种稳定的酯肽类药物水溶液,包括酯肽类药物、氨基酸衍生物,所述酯肽类药物水溶液杂质增长率在0.01%w/w/天以内,优选的0.007%w/w/天以内。优选的,杂质增长率在0.005%w/w/天以内。
[0035]
在一个优选的技术方案中,加入n-乙酰半胱氨酸可以起到稳定达托霉素的作用,并能够有效降低或抑制达托霉素内脂水解物、达托霉素的β-异构体和脱水达托霉素的产生:
[0036]
[0037][0038]
在稳定性试验中,该达托霉素组合物展现优异的稳定性,示例性的,在2-8℃稳定至少12个月,至少18个月、至少24个月或至少32个月。
[0039]
优选的,所述肽酯类药物水溶液中肽酯类药物占比约0.1-50%w/w,优选的,肽酯类药物占比约0.1-30%w/w,更为优选的,肽酯类药物占比约0.1-20%w/w,最为优选的,所述肽酯类药物占比约0.5-10%w/w。
[0040]
优选的,所述氨基酸衍生物占比约0.01-50%w/w,优选的,所述氨基酸衍生物占比约0.01-10%w/w,更为优选的,所述氨基酸衍生物占比约0.01-5%w/w,更为优选的,所述氨基酸衍生物占比约0.01-2%w/w。
[0041]
其中“约”是指处于如本领域的普通技术人员所确定的特定值的可接受误差范围之内,所述特定值的部分取决于所述值是如何测量或测定的,即所述测量系统的限制。在特定测定、结果或实施方案的上下文中,除非实施例或说明书其它地方内另有明确说明,否则“约”意指在根据本领域惯例的一个标准偏差之内,或多至5%的范围。另外,本发明中数值为仪器测量值,存在一定程度的误差,一般而言,正负10%均属于合理误差范围内。当然需要考虑该数值所用之处的上下文,例如,各组分占比,该数值为测量后误差变化不超过正负10%,可以为正负9%、正负8%、正负7%、正负6%、正负5%、正负4%、正负3%、正负2%或正负1%,优选正负5%。
[0042]
优选的,所述肽酯类药物与氨基酸衍生物的摩尔用量比为1:(2-40);优选的,所述肽酯类药物与氨基酸衍生物的摩尔用量比为1:(10-30),更为优选的,所述肽酯类药物与氨基酸衍生物的摩尔用量比为1:(15-20);最优为优选的,所述肽酯类药物与氨基酸衍生物的摩尔用量比为1:20。
[0043]
进一步优选的,所述肽酯类药物水溶液包括多元醇。
[0044]
优选的,所述多元醇选自甘露醇,山梨醇,蔗糖,海藻糖。
[0045]
进一步优选的,所述酯肽类药物水溶液中包括有机溶剂。
[0046]
所述有机溶剂选自:二甲基乙酰胺,异丙醇,乙醇,苄醇,2-甲基-1-丙醇,叔丁醇,乙二醇,丙二醇,甘油,聚山梨醇酯,如聚山梨醇酯20,聚山梨醇酯40和聚山梨醇酯80,聚乙二醇(peg),如聚乙二醇200(peg 200),聚乙二醇300(peg 300),聚乙二醇400(peg400)和聚乙二醇600(peg 600)中的一种或一种以上的混合物。
[0047]
进一步,为了药用目的,本领域的技术人员可以在本发明的技术方案的基础上添加至少一种其他药用辅料,所述药用辅料例如可以为载体,抗氧化剂,表面活性剂,脂质,糖,有机酸,络合剂,防腐剂,稳定剂,增溶剂,表面活性剂,缓冲剂,稀释剂,粘合剂等。
[0048]
本发明的酯肽类药物水溶液,可以填装在玻璃小瓶、注射器、滴瓶、管、涂药器、单位分配器、输注袋、喷雾器、吸入装置或其它药物容器中。选择性的,所述药物组合物可以用诸如氮气的惰性气体进行填充保护。
[0049]
本发明的酯肽类药物水溶液,可以用于制备注射液、眼用制剂、耳用制剂、鼻腔制剂等剂型。
[0050]
本发明提供了一种酯肽类药物水溶液的制备方法,包括如下步骤:
[0051]
步骤a:于烧杯中称取处方量的氨基酸衍生物,加入处方量的水,搅拌使溶解,得到氨基酸衍生物溶液;
[0052]
步骤b:称取处方量的酯肽类药物,搅拌溶解于上述步骤a得到的氨基酸衍生物溶液;
[0053]
进一步的,所述制备方法包括加入其它药用辅料的步骤。
[0054]
本发明提供了应用所述酯肽类药物水溶液在用于制备治疗特别是由革兰氏阳性生物体引起的微生物感染的药物中的应用。
[0055]
最后,本发明在一个方面提供了应用所述酯肽类药物水溶液在用于制备治疗皮肤和软组织感染(cssti)、金黄色葡萄球菌血流感染(菌血症)的药物中的应用。
[0056]
同时需要注意,利用本发明提供的酯肽类药物水溶液的配方,在不加入水分的情况下,可以制备成固体制剂,如散剂、颗粒剂、片剂、胶囊剂,冻干粉等。
[0057]
本发明提供的肽酯类药物水溶液配方在8℃条件下,能够极大的降低杂质在水溶液中的增长速度。所得到的水溶液可以用于预防、治疗敏感菌株的感染,同时所述水溶液在2-8℃的稳定性至少在12个月以上。相比于冻干粉针剂,本发明提供的水溶液无需复溶步骤,可直接临床使用,减少了用药差错。
附图说明
[0058]
图1为处方7在40℃/24h的hplc谱图。
[0059]
图2为处方20在8℃/30天的hplc谱图。
[0060]
图3为处方21在8℃/60天的hplc谱图。
[0061]
图4为处方21在8℃/12月的hplc图谱。
具体实施方式
[0062]
为了更好地理解本发明的技术方案,下面结合具体的实施例对本发明的技术方案做进一步说明,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
[0063]
以下实施例hplc分析条件为:
[0064]
液相色谱仪waters uplc,色谱柱waters acquity uplc@beh shield rp18,流动相如下:
[0065]
无水硫酸钠溶液:称取无水硫酸钠3.46g,用1000ml纯化水溶解,磷酸调节ph至3.4。
[0066]
流动相a,无水硫酸钠溶液:乙腈=74:26比例混合;
[0067]
流动相b,无水硫酸钠溶液:乙腈=50:50比例混合;
[0068]
等度洗脱,流动相a:b=66:34。
[0069]
取待测样品,加10%乙腈稀释至1mg/ml,进样检测,柱温30℃,检测器uv,进样量2微升,检测波长223nm,流速0.2ml/min。
[0070]
实施例1:达托霉素和不同氨基酸的稳定性
[0071][0072]
制备步骤:
[0073]
1、于烧杯中称取处方量的氨基酸化合物,加入处方量的水,搅拌使溶解;
[0074]
2、称取处方量的达托霉素,搅拌溶解于上述步骤1得到的氨基酸化合物溶液;
[0075]
3、放置在40℃下,一定时间后取样检测有关物质,以峰面积归一化化计算杂质峰面积百分比,结果如下。
[0076]
总杂处方1处方2处方3处方4处方5处方6处方70天2.342.412.332.332.482.422.3124h7.487.7710.507.847.337.556.30增长量5.145.368.175.514.855.133.99
[0077]
以上结果可以看出,加入半胱氨酸可以稍微降低达托霉素在水溶液中的降解,减少总杂的增长,增加其稳定性,但是杂质增长率依然很高。
[0078]
处方7,40℃/24h hplc谱图见图1,其对应的数据如下:
[0079][0080][0081]
实施例2:达托霉素和不同有机溶剂处方的稳定性
[0082][0083]
制备步骤:
[0084]
1、于烧杯中称取处方量的有机溶剂,加入50ml的注射用水中,搅拌使溶解;
[0085]
2、称取处方量的达托霉素,搅拌溶解于上述步骤1得到的溶液中;
[0086]
3、放置在40℃下,一定时间后取样检测有关物质,以峰面积归一化化计算杂质峰面积百分比,结果如下。
[0087]
总杂处方8处方9处方10处方11处方120天2.652.783.152.802.8424h8.037.847.337.557.21增长量5.385.064.184.754.37
[0088]
以上结果可以看出,和达托霉素水溶液处方1相比,加入丙二醇、甘油,达托霉素的杂质增长稍微降低。
[0089]
实验例3:达托霉素和氨基酸衍生物的稳定性
[0090][0091]
制备步骤:
[0092]
1、于烧杯中称取处方量的氨基酸衍生物,加入50ml的注射用水中,搅拌使溶解;
[0093]
2、称取处方量的达托霉素,搅拌溶解于上述步骤1得到的溶液中;
[0094]
3、放置在8℃下,一定时间后取样检测有关物质,以峰面积归一化化计算杂质峰面积百分比,结果如下。
[0095][0096]
以上结果可以看出,和达托霉素水溶液处方1相比,处方14最稳定,降解速率最低。
[0097]
实验例4:达托霉素处方的稳定性
[0098][0099]
制备步骤:
[0100]
1、于烧杯中称取处方量的n-乙酰-l-半胱氨酸、甘露醇、甘油,加入50ml的注射用水中,搅拌使溶解;
[0101]
2、称取处方量的达托霉素,搅拌溶解于上述步骤1得到的溶液中;
[0102]
3、放置在8℃下,一定时间后取样检测有关物质,以峰面积归一化化计算杂质峰面积百分比,结果如下。
[0103]
总杂处方19处方20处方21处方220天2.332.142.252.1530天3.562.452.392.75增长量1.230.310.140.60速率/天0.040.010.0050.02
[0104]
以上结果可以看出,和达托霉素水溶液处方1相比,处方21最稳定,降解速率最低。处方20,8℃/30天的hplc谱图见图2,其对应的数据如下:
[0105]
peaknamerrt minarea%area1内脂水解物16.7000.04586522达托霉素22.53697.55188236183β异构体24.9560.0476334脱水达托霉素26.8731.20230937
[0106]
实施例5:不同酯肽类药物稳定性比较
[0107]
[0108]
制备步骤:
[0109]
1、于烧杯中称取处方量的n-乙酰-l-半胱氨酸、甘露醇、甘油,加入50ml的注射用水中,搅拌使溶解;
[0110]
2、称取处方量酯肽药物,搅拌溶解于上述步骤1得到的溶液中;
[0111]
3、放置在8℃下,一定时间后取样检测有关物质,以峰面积归一化化计算杂质峰面积百分比,结果如下。
[0112]
总杂处方23处方24处方25处方210天2.132.112.202.2560天2.462.462.562.55增长量0.330.350.360.31速率/天0.0050.0060.0060.005
[0113]
处方21,8℃/60天的hplc谱图见图3,其对应的数据如下:
[0114]
peaknamerrt minarea%area1内脂水解物12.7450.12186752达托霉素16.81797.45149576323β异构体18.6170.0350904脱水达托霉素19.8780.74113375
[0115]
实施例6:不同浓度达托霉素稳定性比较
[0116][0117]
制备步骤:
[0118]
1、于烧杯中称取处方量的n-乙酰-l-半胱氨酸、甘露醇、甘油,加入50ml的注射用水中,搅拌使溶解;
[0119]
2、称取处方量达托霉素,搅拌溶解于上述步骤1得到的溶液中;
[0120]
3、放置在8℃下,一定时间后取样检测有关物质,以峰面积归一化化计算杂质峰面积百分比,结果如下。
[0121]
总杂处方21处方26处方27处方280天2.252.312.122.2760天2.552.632.552.68增长量0.310.320.340.41速率/天0.0050.0050.0060.007
[0122]
从以上实验结果可以得出,当处方中达托霉素的量增加到30%w/w时,杂质的增长率依然能够控制在0.007范围以内。
[0123]
实施例7:不同时间达托霉素稳定性比较
[0124]
处方21达托霉素组合物放置在8℃下,在2个月、4个月、6个月、9个月、12个月稳定性考察,以峰面积归一化化计算杂质峰面积百分比,结果如下。
[0125]
总杂2个月4个月6个月9个月12个月0天2.252.252.252.252.25总增长量0.310.480.540.560.73速率/天0.0050.0040.0030.0020.002
[0126]
从以上实验结果可以得出,随着储存时间的延长,杂质增长率并没有随着储存的时间延长而延长,而是呈现下降的趋势,而总杂质增长率可以有效的控制在0.7%w/w范围内。处方21在8℃/12月hplc图谱见图4,其对应的数据如下:
[0127]
peaknamerrt minarea%area1内脂水解物12.7340.11190512达托霉素16.81597.02162853723β异构体18.5990.0350864脱水达托霉素19.8570.74124064
[0128]
实施例8:达托霉素组合物在不同氨基酸衍生物中稳定性比较
[0129]
所述氨基酸衍生物具有如下通式结构:
[0130][0131]
其中r1、r2和r3的定义与前文相同。
[0132][0133][0134]
制备步骤:
[0135]
1、于烧杯中称取处方量的氨基酸衍生物、甘露醇、甘油,加入50ml的注射用水中,搅拌使溶解;
[0136]
2、称取处方量达托霉素,搅拌溶解于上述步骤1得到的溶液中;
[0137]
3、放置在8℃下,一定时间后取样检测有关物质,以峰面积归一化化计算杂质峰面积百分比,结果如下。
[0138]
总杂处方21处方29处方30处方31处方320天2.252.052.182.312.1960天2.562.482.712.672.68增长量0.310.430.530.360.49速率/天0.0050.0070.0090.0060.008
[0139]
从以上实验结果可以得出,使用不同的带有游离巯基的氨基酸衍生物时,杂质的增长率依然能够控制在0.009%w/w/天范围以内。
[0140]
另外需要说明的是,在本发明的各实施例中各处方在0天时总杂含量不同是因为使用了不同的起始物料。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。