1.本发明涉及用于制备有机-无机复合水凝胶的组合物和包含该组合物的用于制备有机-无机复合水凝胶的试剂盒。
背景技术:
2.组织工程(tissue engineering)已被认为是一种再生或替代因疾病或事故而受损的人类生物组织或器官的方法。依照这种方法,通常可以使用病人自己的细胞和聚合物支架来制造人工组织和器官。
3.简而言之,在从病人身上收集一部分生物组织后,只分离和培养必要的细胞,以确保获得足够数量的细胞。这些细胞可以在具有三维结构的多孔聚合物支架中生长成生物组织,然后通过手术移植回病人体内。或者,细胞可以与如水凝胶等支持物混合,然后用注射器注射到活体中,以使生物组织再生。此时使用的聚合物支架发挥着生物组织细胞外基质(extracellular matrix,ecm)的各种作用。聚合物支架参与细胞的附着、增殖和分化,并控制待再生的生物组织的功能和结构。聚合物支架还调节水溶性因子、营养物和代谢物的扩散。特别是,聚合物支架和细胞之间的相互作用是组织工程中一个非常重要的因素。目前正在进行各种研究,包括生物相互作用、聚合物支架的物理特性以及控制可溶性因子从支架中的释放,以调节细胞和支架之间的相互作用。通过适当地调整这些因素来控制细胞的生长和分化,可以成功地使所期望的生物组织再生。
4.作为这样的聚合物支架,具有能够包含大量水的三维亲水聚合物网络结构的水凝胶因其具有高含水量和类似于细胞外基质(ecm)结构的结构特性而最近受到了最多的关注。然而,由于水凝胶的机械强度低,人们一直在研究如何改善其性能。
5.作为相关的现有技术,专利文献1提出了一种负载细胞的生物相容性聚合物-生物相容性天然材料混合支架的生产方法,包括以下步骤:(a)通过在板上并排分布两个或多个生物相容性聚合物支杆(strut),形成支杆层的步骤;(b)在分布的生物相容性聚合物支杆层上,以与分布的生物相容性聚合物支杆方向交叉的方向间隔并排分布生物相容性聚合物支杆的步骤;(c)在步骤(b)中分布的生物相容性聚合物支杆之间分布包含选自以下项中的至少一种天然生物相容性材料的支杆但不与生物相容性聚合物支杆接触的同时在分布的生物相容性天然材料中形成交联的步骤:负载细胞的明胶、岩藻多糖、胶原蛋白、海藻酸盐、壳聚糖和透明质酸;以及(d)通过依次重复上述步骤(b)和(c)形成混合结构的步骤。
6.此外,专利文献2提出了一种聚合物-陶瓷混合膜以及其制备方法,其中通过在特定范围内调整聚合物和陶瓷的混合比例来控制柔韧性和机械性能。
7.然而,专利文献1(韩国专利号:10-1360942)中提出的方法有一个缺点,即它需要一个热处理工艺,这使得它很难在室温下制造,并且不能制造成各种形状。专利文献2(韩国专利公布号:10-2019-0057268)提出的方法能够在一定程度上改善水凝胶的机械性能,但存在一个问题,即当使用更多的陶瓷来提高机械强度时,水凝胶难以形成。
8.为了解决上述问题,本发明人开发了一种用于制备有机-无机复合水凝胶的组合物以及含有该组合物和固化液的试剂盒从而完成了本发明,作为用于制备具有高的水含量并表现出非常优异的机械性能的有机-无机复合水凝胶的组合物,该组合物包含可光聚合的生物相容性聚合物和可在室温下通过水合反应固化的磷酸钙陶瓷粉末。
技术实现要素:
9.在一个方面,本发明的目的是提供一种用于形成组织再生支架的有机-无机复合水凝胶组合物和包含该组合物的试剂盒。
10.为了实现上述目的,在本发明的一个方面,本发明提供了一种用于制备有机-无机复合水凝胶的组合物,其包含具有可光交联的官能团的生物相容性聚合物和磷酸钙基陶瓷粉末。
11.生物相容性聚合物和磷酸钙基陶瓷粉末的重量比可以大于1:20且小于等于1:1,优选地大于1:20且小于等于1:2,更优选地1:15至1:5,并且最优选地1:12至1:7。
12.生物相容性聚合物可以是选自下列项中的至少一种:海藻酸盐、羟丙基甲基纤维素(hpmc)、羟乙基纤维素(hec)、甲基纤维素、羧甲基纤维素(cmc)、明胶、胶原蛋白、纤维蛋白原、壳聚糖、琼脂、基质胶(matrigel)、淀粉、果胶、聚乙烯醇、聚氨酯、聚(乙二醇)、聚(丙二醇)、透明质酸和聚(乙烯基吡咯烷酮)。
13.磷酸钙基陶瓷粉末可以是选自下列项中的至少一种:tcp(磷酸三钙)、羟基磷灰石、dcpd(二水磷酸二钙)、mcpm(一水磷酸一钙)、dcpa(无水磷酸二钙)和bcp(双相磷酸钙),并且优选地可以是α-tcp(α-磷酸三钙)。
14.用于制备有机-无机复合水凝胶的组合物还可以包含功能部件和细胞中的至少一种。
15.在本发明的另一个方面,本发明提供了一种用于制备有机-无机复合水凝胶的试剂盒,其包含用于制备有机-无机复合水凝胶的组合物以及固化液,所述组合物包含具有可光交联的官能团的生物相容性聚合物和磷酸钙基陶瓷粉末。
16.生物相容性聚合物和磷酸钙基陶瓷粉末的重量比可以为大于1:20且小于等于1:1,优选地大于1:20且小于等于1:2,更优选地1:15至1:5,并且最优选地1:12至1:7。
17.固化液可以是选自下列项中的至少一种:盐水、pbs(磷酸盐缓冲盐水)、mcpm(一水磷酸一钙)、dsp(脱水磷酸二钠)、msp(脱水磷酸一钠)、a-mem(最小必需培养基)和hbss(汉克斯平衡盐溶液(hank's balanced salt solution))。
18.固化液可以还包括钙离子(ca
2
)。
19.试剂盒还可以包括功能部件和细胞中的至少一种。
20.在本发明的另一个方面,本发明提供了一种有机-无机复合水凝胶,其包括具有可光交联的官能团的生物相容性聚合物和与生物相容性聚合物结合的磷酸钙基陶瓷。
21.磷酸钙基陶瓷是cdha(缺乏ca的羟基磷灰石(ca-deficient hydroxyapatite))。
22.在本发明的另一个方面,本发明提供了一种生物材料,其包括有机-无机复合水凝胶。
23.有益效果
24.根据一个方面,用于制备有机-无机复合水凝胶的组合物可用于在室温下生产具
有高水含量和优异机械性能的有机-无机复合水凝胶。
25.根据一个方面,用于制备有机-无机复合水凝胶的组合物可用于通过uv照射对生物相容性聚合物进行光交联和通过固化液将磷酸钙基陶瓷固化来生产具有非常优异的机械性能的有机-无机复合水凝胶。
26.根据另一个方面,用于制备有机-无机复合水凝胶的试剂盒是包含用于制备有机-无机复合水凝胶的组合物和固化液的试剂盒,该组合物具有高流动性,因此易于注入人体中,在室温下固化后具有优异的细胞粘附效果。因此,该试剂盒在注入人体后,通过使用uv照射和固化液进行固化,可以通过最小的手术干预将药物或细胞递送到人体内期望的位置,并且所制得的有机-无机复合水凝胶可以用作用于组织再生的支架。
27.本发明的效果并不局限于上述效果,应理解为包括从本发明的详细描述或从权利要求书中描述的本发明的配置中可以推断出的所有效果。
附图说明
28.图1至图5是示出在用固化液固化之前和之后测量根据实施例和比较例的水凝胶的尺寸的结果的图,这些水凝胶是通过改变生物相容性聚合物和磷酸钙陶瓷粉末的重量比而制得的。
29.图6至图11是比较根据实施例和比较例的每个水凝胶的抗压强度值的图,这些水凝胶是通过改变生物相容性聚合物和磷酸钙陶瓷粉末的重量比以及固化液的类型而制得的。
30.图12是示出在用固化液固化之前用x射线衍射(xrd)装置测量根据实施例和比较例的水凝胶的晶体结构的结果的图,这些水凝胶是通过改变生物相容性聚合物和磷酸钙陶瓷粉末的重量比而制得的。
31.图13是示出在用固化液固化之后用x射线衍射(xrd)装置测量根据实施例和比较例的水凝胶的晶体结构的结果的图,这些水凝胶是通过改变生物相容性聚合物和磷酸钙陶瓷粉末的重量比而制得的。
32.图14是示出在冻干之前测量的根据实施例和比较例的水凝胶的水含量的结果的图,这些水凝胶是通过改变生物相容性聚合物和磷酸钙陶瓷粉末的重量比而制得的。
33.图15是示出在冻干之后测量的根据实施例和比较例的水凝胶的水含量的结果的图,这些水凝胶是通过改变生物相容性聚合物和磷酸钙陶瓷粉末的重量比而制得的。
34.图16是示出在扫描电子显微镜(sem)下观察的根据实施例和比较例的水凝胶表面的照片,这些水凝胶是通过改变生物相容性聚合物和磷酸钙陶瓷粉末的重量比而制得的。
35.图17是示出在荧光显微镜下观察在根据实施例和比较例的水凝胶上培养十八烷基罗丹明b(octadecyl rhodamine b)染色细胞后的细胞粘附能力的结果的照片,这些水凝胶是通过改变生物相容性聚合物和磷酸钙陶瓷粉末的重量比而制得的。
36.图18是示出为确定是否形成水凝胶而观察的根据实施例和比较例的组合物的光交联和离子交联后的状态的照片。
37.图19是示出为确定是否形成水凝胶而观察的根据一个实施方案的其中生物相容性聚合物和磷酸钙陶瓷粉末以1:20的重量比混合的组合物的光交联后的状态的照片。
38.图20是示出根据实施例和比较例的通过改变生物相容性聚合物和磷酸钙陶瓷粉
末的重量比而制得的水凝胶的初始药物装载效率的图。
39.图21是示出根据实施例和比较例通过改变生物相容性聚合物和磷酸钙陶瓷粉末的重量比而制得的水凝胶在药物装载后一个月的释放行为的图。
40.图22是示出在水凝胶表面培养mg-63细胞2周后测量表面细胞dna含量的结果的图,目的是证实根据实施例和比较例的通过改变生物相容性聚合物和磷酸钙陶瓷粉末的重量比而制得的水凝胶诱导成骨分化的可能性。
41.图23是示出在水凝胶表面培养mg-63细胞2周后测量表面细胞的alp活性的结果的图,目的是证实根据实施例和比较例的通过改变生物相容性聚合物和磷酸钙陶瓷粉末的重量比而制得的水凝胶诱导成骨分化的可能性。
42.图24是示出将根据实施例和比较例的组合物注入活组织后确认通过uv进行的固化的实验过程的照片。
43.图25是示出图12的实验结果的照片。
44.图26是示出根据实施例和比较例的水凝胶在注入到活组织后通过uv固化的抗压强度值的图。
具体实施方式
45.下面,结合附图描述本发明的优选实施方案。然而,本发明的实施方案可以以各种方式进行修改和变更,本发明不限于以下说明。对本领域有一般了解的本领域技术人员都很清楚,给出本发明的实施方案是为了更准确地解释本发明。因此,为了说明清楚,附图中的要素的形状和大小可能被放大,附图中用相同标记表示的要素是相同的要素。在所有附图中,显示相似功能或活性的因素也由相同的标记表示。此外,在整个说明书中“包含”一个要素并不排除其他要素,而是可以包括其他要素,除非另有特别说明。
46.在本发明的一个方面,本发明提供了用于制备有机-无机复合水凝胶的组合物,其包含具有可光交联的官能团的生物相容性聚合物和磷酸钙基陶瓷粉末。
47.根据一个方面,用于制备有机-无机复合水凝胶的组合物可用于制备具有高水含量和优异机械性能的有机-无机复合水凝胶。
48.此外,根据一个方面,用于制备有机-无机复合水凝胶的组合物可用于制备具有优异细胞粘附能力的有机-无机复合水凝胶。
49.因此,根据一个方面,用于制备有机-无机复合水凝胶的组合物可以是用于制备用作生物材料如用于组织再生支架的水凝胶的组合物,但并不总是限于此。
50.下面,将详细描述根据一个方面的用于制备有机-无机复合水凝胶的组合物。
51.根据一个方面,用于制备有机-无机复合水凝胶的组合物包括具有可光交联的官能团的生物相容性聚合物。
52.生物相容性聚合物可以是选自下列项中的至少一种:海藻酸盐、羟丙基甲基纤维素(hpmc)、羟乙基纤维素(hec)、甲基纤维素、羧甲基纤维素(cmc)、明胶、胶原蛋白、纤维蛋白原、壳聚糖、琼脂、基质胶、淀粉、果胶、聚乙烯醇、聚氨酯、聚(乙二醇)、聚(丙二醇)、透明质酸和聚(乙烯基吡咯烷酮)。
53.生物相容性聚合物的分子量可以是5,000道尔顿至5,000,000道尔顿,更优选10,000道尔顿至1,000,000道尔顿。
54.生物相容性聚合物具有可光交联的官能团,通过该官能团可以被光交联。
55.此时,可光交联的官能团可以是选自下列项中的至少一种:甲基丙烯酸酯基、丙烯酸酯基、乙烯基、环氧基和酪氨酸基。
56.例如,生物相容性聚合物可以是具有甲基丙烯酸酯基的海藻酸盐。
57.如果生物相容性聚合物不包括可光交联的官能团,使用上述组合物制备有机-无机复合水凝胶可能会导致一些问题,例如由于交联不良而不能产生水凝胶或制备的水凝胶机械强度较低。
58.根据一个方面,用于制备有机-无机复合水凝胶的组合物包括磷酸钙基陶瓷粉末。
59.磷酸钙基陶瓷粉末可以是选自下列项中的至少一种:α-tcp(α-磷酸三钙)、β-tcp(β-磷酸三钙)、羟基磷灰石、dcpd(二水磷酸二钙)、mcpm(一水磷酸一钙)、dcpa(无水磷酸二钙)和bcp(双相磷酸钙)。然而,可能更优选的是,磷酸钙基陶瓷粉末是α-tcp,它可以在室温下通过水合反应固化。
60.具体来说,α-tcp可以在室温下通过与固化液如pbs的水合反应,在相变为具有优异的细胞粘附能力和机械强度的cdha(缺乏ca的羟基磷灰石)的同时被固化。
61.根据一个方面,用于制备有机-无机复合水凝胶的组合物可以在室温下通过光照射和浸入固化液中形成有机-无机复合水凝胶。形成的水凝胶可以具有非常优异的机械性能,因为它是通过水凝胶的光交联和陶瓷粉末的固化而结合的。
62.根据一个方面,用于制备有机-无机复合水凝胶的组合物包含的磷酸钙基陶瓷粉末的量等于或大于生物相容性聚合物的重量。
63.该组合物可以包括的生物相容性聚合物和磷酸钙基陶瓷粉末的重量比为大于1:20且小于等于1:1,优选地大于1:20且小于等于1:2,更优选地1:15至1:5,并且最优选地1:12至1:7。
64.如果磷酸钙基陶瓷粉末的重量小于生物相容性聚合物的重量,则所产生的有机-无机复合水凝胶的机械强度可能较低,使其难以用于需要较高机械强度的用途,并且由于其粘附能力低,也难以作为生物材料,如用于组织再生的支架。
65.此外,如果磷酸钙基陶瓷粉末的重量是生物相容性聚合物重量的20倍以上,则聚合物的光交联可能无法正常完成,因此可能无法形成有机-无机复合水凝胶。
66.根据一个方面,用于制备有机-无机复合水凝胶的组合物还可以包括功能部件和细胞中的至少一种。
67.功能部件可以包括药物、蛋白质例如生长因子等。
68.根据一个方面,用于制备有机-无机复合水凝胶的组合物还可以包括功能部件和细胞中的至少一种,以用于在体内递送细胞、生长因子、药物等的目的,也可以用作生物材料,例如在体内用于组织再生的支架。
69.在本发明的另一个方面,本发明提供了一种用于制备有机-无机复合水凝胶的试剂盒,所述试剂盒包括用于制备有机-无机复合水凝胶的组合物,该组合物包含具有可光交联的官能团的生物相容性聚合物和磷酸钙基陶瓷粉末;和固化液。
70.下面,将详细描述根据另一个方面的用于制备有机-无机复合水凝胶的试剂盒。
71.用于制备有机-无机复合水凝胶的试剂盒可以包括用于制备有机-无机复合水凝胶的组合物和用于在室温下固化组合物中包括的磷酸钙基陶瓷粉末的固化液。
72.用于制备有机-无机复合水凝胶的组合物可以包括上述用于制备有机-无机复合水凝胶的组合物的配置。
73.可以使用水溶液作为固化液,但是可以优选使用用于细胞培养的培养基,以增加待制备的有机-无机水凝胶的生物相容性。
74.固化液可以是选自下列项中的至少一种:盐水、pbs(磷酸盐缓冲盐水)、mcpm(一水磷酸一钙)、dsp(脱水磷酸二钠)、msp(脱水磷酸一钠)、a-mem(最小必需培养基)和hbss(汉克斯平衡盐溶液)。
75.用于制备有机-无机复合水凝胶的试剂盒是用于制备用作生物材料如组织再生用支架的水凝胶的试剂盒,并且还可包括功能部件和细胞中的至少一种。功能部件可包括药物、蛋白质如生长因子等。
76.有机-无机复合水凝胶可以通过以下方法使用用于制备有机-无机复合水凝胶的试剂盒来制备。
77.具体而言,该制备过程包括以下步骤:通过照射光对用于制备有机-无机复合水凝胶的包含具有可光交联的官能团的生物相容性聚合物和磷酸钙基陶瓷粉末的组合物进行光交联的步骤;以及将光交联的组合物浸入固化液中的步骤。
78.首先,通过照射光,例如uv,对用于制备有机-无机复合水凝胶的组合物进行光交联的步骤。
79.该步骤是对包含在组合物中的生物相容性聚合物进行光交联以形成水凝胶的步骤。
80.该组合物可通过光照射形成具有优异的机械强度的水凝胶。
81.例如,当用uv照射含有海藻酸盐和α-tcp的重量比为1:10的溶液时,海藻酸盐的交联可以很好地形成,而当通过在含有钙离子的溶液中浸泡来进行离子交联时,海藻酸盐的交联可能无法适当地形成。
82.由于用于制备有机-无机复合水凝胶的组合物具有流动性,所以它可以以创伤最小的方法很容易地递送到体内的目标位置。因此,可以在将组合物递送到身体的目标位置后,通过对组合物进行照射光(如uv)来进行光交联的步骤。
83.组合物可以包括的生物相容性聚合物和磷酸钙基陶瓷粉末的重量比为大于1:20且小于等于1:1,优选地大于1:20且小于等于1:2,更优选地1:15至1:5,并且最优选地1:12至1:7。
84.通过以上述重量比包括生物相容性聚合物和磷酸钙基陶瓷粉末,用于制备有机-无机复合水凝胶的组合物可用于制备具有高水含量和显著优异的机械强度的水凝胶。
85.接下来,进行将光交联的组合物浸入固化液中的步骤。
86.该步骤是固化通过光交联形成的水凝胶中包含的陶瓷粉末的步骤。
87.此时,可使用水溶液作为固化液,但优选可以使用用于细胞培养的培养基,以增加待制备的有机-无机水凝胶的生物相容性。
88.通过uv照射形成的含有陶瓷粉末的水凝胶在注入人体中后,可以通过注入培养基来固化,也可以通过体液来固化,而不需要注入单独的固化液。
89.固化液可以优选为pbs(磷酸盐缓冲盐水)以进一步提高待制备的有机-无机水凝胶的机械强度,并且更优选地为包含钙离子(ca
2
)的pbs(磷酸盐缓冲盐水)。
90.在本发明的另一个方面,本发明提供了一种有机-无机复合水凝胶,其包括具有可光交联的官能团的生物相容性聚合物,以及与生物相容性聚合物结合的磷酸钙基陶瓷。
91.有机-无机复合水凝胶包含具有可光交联的官能团的生物相容性聚合物和与生物相容性聚合物结合的磷酸钙基陶瓷,并且磷酸钙基陶瓷可以优选地为cdha(缺乏钙的羟基磷灰石)。
92.有机-无机复合水凝胶具有高水含量和优异的机械强度和细胞粘附能力,因此它可以用作生物材料,如用于组织再生的支架。
93.在本发明的另一个方面,本发明提供了一种包括有机-无机复合水凝胶的生物材料。
94.下面,将通过以下实施例和实验例来详细描述本发明。
95.然而,以下实施例和实验例仅用于说明本发明,并且本发明的内容不限于此。
96.《制备例1》
97.将3克海藻酸钠(分子量:200,000-300,000;fmc生物聚合物公司)溶解在300毫升0.1m 2-(n-吗啉基)乙磺酸(mes)缓冲液(0.3m nacl,ph=6.5)中,将1.628克n-羟基琥珀酰亚胺(sulfo-nhs)、2.875克二氯乙烷(edc)和1.234克n-(2-氨基乙基)甲基丙烯酰胺盐酸盐(aema)在其中混合,随后合成20小时。合成后,使用蒸馏水透析4天,用活性炭处理,通过0.22微米的过滤器过滤,并冻干,以制备具有甲基丙烯酸酯基的海藻酸盐。
98.《实施例1》用于制备有机-无机复合水凝胶的组合物
99.通过将0.087克在制备例1中制得的海藻酸盐溶解在蒸馏水中,制备海藻酸盐溶液。然后,向该溶液中加入0.0435克α-tcp(α-磷酸三钙),并使用三维超声波混合器进行分散,制备海藻酸盐和α-tcp的重量比为1:0.5的用于制备有机-无机复合水凝胶的组合物。
100.《实施例2》用于制备有机-无机复合水凝胶的组合物
101.按照与实施例1相同的方式制备海藻酸盐和α-tcp的重量比为1:1的用于制备有机-无机复合水凝胶的组合物,不同之处在于将实施例1中α-tcp的重量改为0.087g。
102.《实施例3》用于制备有机-无机复合水凝胶的组合物
103.按照与实施例1相同的方式制备海藻酸盐和α-tcp的重量比为1:2的用于制备有机-无机复合水凝胶的组合物,不同之处在于将实施例1中α-tcp的重量改为0.174g。
104.《实施例4》用于制备有机-无机复合水凝胶的组合物
105.按照与实施例1相同的方式制备海藻酸盐和α-tcp的重量比为1:5的用于制备有机-无机复合水凝胶的组合物,除了将实施例1中的α-tcp的重量改为0.435g。
106.《实施例5》用于制备有机-无机复合水凝胶的组合物
107.按照与实施例1相同的方式制备海藻酸盐和α-tcp的重量比为1:10的用于制备有机-无机复合水凝胶的组合物,除了将实施例1中α-tcp的重量改为0.87g。
108.《实施例6》用于制备有机-无机复合水凝胶的组合物
109.按照与实施例1相同的方式制备海藻酸盐和α-tcp的重量比为1:20的用于制备有机-无机复合水凝胶的组合物,除了将实施例1中α-tcp的重量改为1.74g。
110.《实施例7》有机-无机复合水凝胶
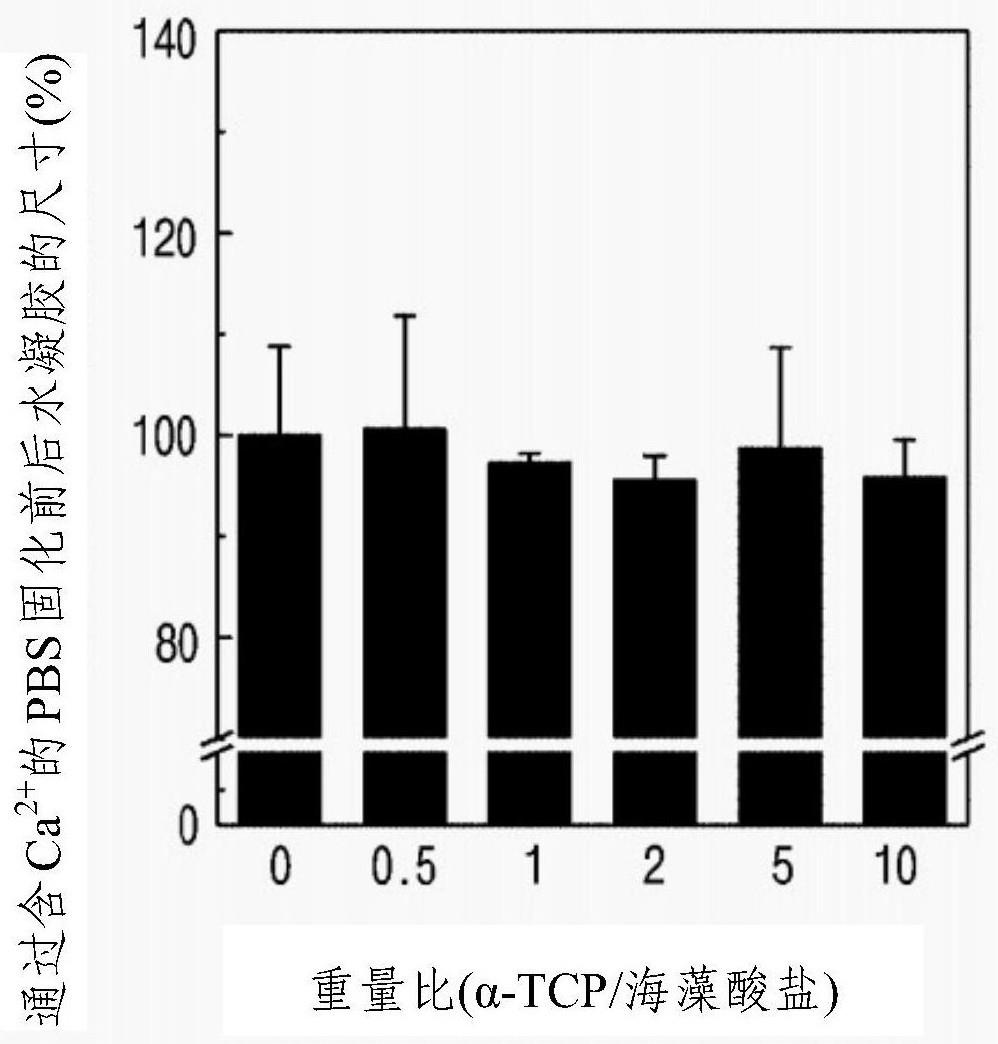
111.将实施例1至实施例6的溶液通过uv照射进行光交联,然后在37℃下将其浸入以下各固化液中约25小时,制备有机-无机复合水凝胶。
112.此时,使用α-mem(最小必需培养基)、pbs(磷酸盐缓冲盐水)、含有约0.1克/升氯化钙(cacl2)的pbs(磷酸盐缓冲盐水)、hbss(汉克斯平衡盐溶液)和盐水作为固化液。
113.《比较例1》
114.通过将0.087克在制备例1中制得的海藻酸盐溶解在5毫升蒸馏水中来制备海藻酸盐溶液。
115.《比较例2》
116.将比较例1的溶液通过uv照射进行光交联,然后在37℃下将其浸入以下各固化液中约25小时,制备水凝胶。
117.此时,使用α-mem(最小必需培养基)、pbs(磷酸盐缓冲盐水)、含有约0.1克/升氯化钙(cacl2)的pbs(磷酸盐缓冲盐水)、hbss(汉克斯平衡盐溶液)和盐水作为固化液。
118.《比较例3》
119.通过添加钙离子(ca
2
),将上述比较例1(α-tcp/海藻酸盐=0)、实施例2(α-tcp/海藻酸盐=1)、实施例5(α-tcp/海藻酸盐=10)和实施例6(α-tcp/海藻酸盐=20)的溶液进行离子交联,然后在37℃下将其浸入以下各pbs(磷酸盐缓冲盐水)固化液中约25小时,以制备有机-无机复合水凝胶。
120.《实验例1》尺寸变化分析
121.在根据一个方面制备有机-无机水凝胶的过程中,在实施例7和比较例2中,通过改变生物相容性聚合物和磷酸钙基陶瓷粉末的重量比以及固化液的类型,使用imagej程序测量水凝胶在被固化液固化之前和之后的尺寸。结果示出在图1至图5中。
122.图1至图5的横轴代表组合物中所包含的α-tcp与海藻酸盐的重量比。
123.如图1至图5所示,可以看出,与用uv照射光交联后和用固化液固化之前相比,用固化液固化后,水凝胶的尺寸有轻微下降的趋势,但没有显著的差异。因此,当根据一个方面的组合物被注入到体内作为组织替代材料和再生材料使用,然后在体内固化时,可以预期它将保持其初始体积,而不会因固化液而减少体积。
124.《实验例2》机械性能的评价
125.为了确认本发明的有机-无机水凝胶根据固化液的使用、生物相容性聚合物和磷酸钙基陶瓷粉末的重量比以及固化液的类型而产生的机械性能差异,用旋转流变仪(rotational rheometer)(ta仪器公司)通过轴向压缩模式(axial compression mode)的方法测量实施例7中制得的有机-无机复合水凝胶和比较例2中制得的水凝胶各自的抗压强度。比较了从上述测量得到的应力-应变曲线(stress-strain curve)的低模量值,并在图6至图11中示出。
126.结果,如图6至图11所示,当不使用固化液时(定型前(before setting)),即使增加α-tcp的含量,抗压强度也没有改善,而当使用固化液时,抗压强度随着α-tcp含量的增加而改善。
127.通过这一点,发现当有机-无机复合水凝胶中包含磷酸钙基陶瓷粉末时,水凝胶的机械性能优于不包含磷酸钙基陶瓷粉末时的机械性能。这可以归因于这样一个事实:当不包括α-tcp时,通过uv照射光交联的有机-无机复合水凝胶没有被固化液固化,而当包括α-tcp时,通过固化液进行了固化。
128.此外,无论固化液的类型如何,与不含α-tcp的比较例1的水凝胶(α-tcp/海藻酸盐
重量比值=0)相比,实施例1至实施例5的水凝胶(α-tcp/海藻酸盐重量比值=0.5~10)表现出更高的抗压强度。特别是,当海藻酸盐与α-tcp的重量比值为5~10时,抗压强度很高,并且当海藻酸盐与α-tcp的重量比值为10时显著的高。
129.通过这一点,发现当生物相容性聚合物和磷酸钙基陶瓷粉末的重量比值为5至10时,特别是当重量比值为10时,机械性能可以得到显著改善。
130.此外,在使用含有钙离子(ca
2
)的pbs(pbs w/ca)的情况下,与使用其他固化液的情况和使用不含钙离子的pbs(pbs w/o ca)的情况相比,当生物相容性聚合物和磷酸钙基陶瓷粉末的重量比值为5至10时,特别是当重量比值为10时,机械性能得到显著改善。
131.《实验例3》晶体结构变化的分析
132.为了确认根据一个方面制备有机-无机水凝胶的过程中由固化液固化之前和之后的晶体结构,在实施例7和比较例2中,使用x射线衍射法测量浸入固化液之前和之后的晶体结构。使用pbs作为固化液的结果示出在图12和图13中。
133.作为晶体结构分析的结果,组合物的主要成分海藻酸盐和α-tcp在浸入固化液之前存在,如图12所示,而浸入固化液之后,海藻酸盐和cdha存在,如图13所示。
134.这可以归因于固化液将组合物中含有的α-tcp相变为cdha。
135.通过机械性能评价和晶体结构分析结果发现,通过混合生物相容性聚合物和α-tcp,通过uv照射进行光交联,使用固化液将α-tcp相变为cdha进行固化,并在低温下进行固化,可以显著提高水凝胶的机械性能。
136.《实验例4》水含量的评价
137.为了评价根据一个方面的有机-无机水凝胶的水含量,对实施例7中制得的有机-无机复合水凝胶和比较例2中制得的水凝胶测量了冻干前(图14)和冻干后(图15)的水含量。使用pbs作为固化液的结果示出在图14和图15中。
138.如图14和图15所示,作为冻干前后的对比结果,随着所使用的α-tcp含量的增加,水含量略有下降,但即使α-tcp的含量是海藻酸盐重量的10倍时,水含量也高于80%。通过这一点,发现即使α-tcp的含量是海藻酸盐重量的10倍时,水凝胶也能保持优良的水含量。
139.此外,当α-tcp的含量是海藻酸盐重量的10倍时,发现在冻干前可以包含相对于冻干后约4.2倍以上的水。通过这一点,可以预计它表现出很高的细胞亲和力,对体内的营养物输送和气体供应是有利的。
140.《实验例5》表面分析
141.为了分析根据一个方面的有机-无机水凝胶的表面结构,用扫描电子显微镜(sem)观察实施例7中制得的有机-无机复合水凝胶和比较例2中制得的水凝胶的表面。使用pbs作为固化液的结果示出在图16中。
142.如图16所示,随着α-tcp含量的增加,α-tcp颗粒在表面的暴露增加,α-tcp颗粒相互聚集并连接,可以看出,通过连接,有机-无机复合水凝胶的机械性能得到改善。据此发现,在有机-无机复合水凝胶组合物中应包括一定比例的α-tcp,以实现通过陶瓷粉末改善机械性能的效果。
143.《实验例6》细胞粘附能力的评价
144.为了确认根据一个方面的有机-无机水凝胶的细胞粘附特性,将用十八烷基罗丹明b染色的细胞接种在实施例7中制得的有机-无机复合水凝胶和比较例2中制得的水凝胶
表面上,培养24小时后,通过在荧光显微镜下观察确定细胞粘附的程度。使用pbs作为固化液的结果示出在图17中。
145.如图17所示,在使用不含α-tcp的比较例1的组合物(α-tcp 0)制得的水凝胶上,细胞培养几乎无法进行,而在使用实施例2的组合物(α-tcp 1)(其中α-tcp与海藻酸盐的重量比为1)制得的有机-无机复合水凝胶上,细胞培养以最低程度进行。在使用含有更多α-tcp的组合物制得的有机-无机复合水凝胶上培养了大量的细胞,特别是在使用α-tcp的重量为海藻酸盐的5倍至10倍的组合物制得的有机-无机复合水凝胶上培养了相当多的数量的细胞。
146.这可归因于这样一个事实,即根据一个方面,由α-tcp结晶生成的chda暴露在有机-无机复合水凝胶的表面上,而细胞粘附能力因chda而显著改善。
147.《实验例7》光交联和离子交联之间的差异
148.为了证实光交联和离子交联在形成有机-无机水凝胶方面的差异,用实施例7的方法将实施例2、实施例5、实施例6和比较例1的组合物进行光交联以形成水凝胶,并比较和观察用比较例3的方法进行离子交联后的形状。结果示出在图18和图19中。
149.图18示出了通过实施例7的方法将实施例2和实施例5以及比较例1的组合物进行光交联,以及通过比较例3的方法进行离子交联而形成的水凝胶的形状的比较观察结果。如图18所示,不含α-tcp的比较例1的组合物通过光交联和离子交联形成水凝胶,而含有α-tcp的实施例2和实施例5的组合物通过光交联形成水凝胶,但由于钙离子的交联性差,没有通过离子交联形成水凝胶。这表明,光交联比离子交联使含有海藻酸盐和α-tcp的组合物更有效地形成水凝胶结构。
150.图19示出了通过实施例7的方法对实施例6的组合物进行光交联后观察其形状的结果。如图19所示,当海藻酸盐和α-tcp的重量比为1:20时,确认没有形成水凝胶,因为即使通过光交联方法也没有适当地进行交联。
151.从上述结果发现,当α-tcp/海藻酸盐的重量比值小于20时,含有海藻酸盐和α-tcp的组合物可以通过光交联形成水凝胶。
152.《实验例8》生长因子递送特性
153.为了证实递送生长因子(一种用于诱导组织分化的蛋白质形式)的可行性,将bsa加入到比较例1和实施例2至实施例5的溶液中,通过uv照射进行光交联,然后在37℃下浸入pbs(磷酸盐缓冲盐水)固化液中约24小时,以制备有机-无机复合水凝胶,并确认其初始药物装载效率和一个月的释放行为。结果示出在图20和图21中。
154.图20是示出初始药物装载效率的图,证实了初始固化24小时后剩余的蛋白质的量随着有机-无机复合水凝胶中陶瓷材料比例的增加而增加。
155.此外,图21是示出一个月的释放行为的图,证实了可以从有机-无机复合水凝胶中诱导蛋白质释放超过一个月的时间。
156.《实验例9》成骨分化诱导特性
157.为了证实诱导成骨分化作为功能性骨替代物的可能性,使用实施例2至实施例5的溶液在通过实施例7的方法制得的有机-无机复合水凝胶表面上培养mg-63细胞2周,并确认表面的细胞的dna和alp活性。结果示出在图22和图23中。
158.如图22和图23所示,证实了陶瓷比例越高,成骨分化因子alp的活性越高,特别是
当α-tcp相对于海藻酸盐的重量为5倍以上时,证实了成骨分化被非常迅速地诱导。
159.《实验例10》注入活组织后的固化特性评价
160.为了确认注入活组织中以后通过uv和固化液的固化特性,进行了以下实验。
161.图24是示出注入活组织中以后通过uv确认固化特性的实验过程的照片。
162.如图24所示,将实施例1至实施例5的用于制备有机-无机复合水凝胶的组合物和比较例1的组合物分别滴在玻璃基底上,放置实验大鼠的皮肤,使组合物置于大鼠的皮肤之下,用uv照射大鼠的皮肤,以确定uv是否通过大鼠的皮肤,使组合物产生水凝胶。
163.作为实验的结果,证实了uv穿过大鼠的皮肤,并由实施例1至实施例5的用于制备有机-无机复合水凝胶的组合物和比较例1的组合物形成了水凝胶。实施例5和比较例1的结果示出在图25中。
164.此外,在将由实施例1至实施例5的用于制备有机-无机复合水凝胶的组合物和比较例1的组合物形成的水凝胶在生理盐水中浸泡约24小时后,以与实验例2相同的方式进行抗压强度测量实验,并比较由此得到的应力-应变曲线的低模量值,结果示出在图26中。
165.如图26所示,作为抗压强度测试的结果,由实施例1至实施例5的组合物(α-tcp/海藻酸盐重量比值=0.5~10)形成的水凝胶比由不含α-tcp的比较例1的组合物(α-tcp/海藻酸盐重量比值=0)形成的水凝胶表现出更高的抗压强度。特别是,当α-tcp的重量相对于海藻酸盐的重量为5倍至10倍时,抗压强度更高,而当其为10倍时,抗压强度明显更高。
166.从上述结果证实,根据一个实施方案的用于制备有机-无机复合水凝胶的组合物可以注射到动物体内,然后通过uv照射固化成水凝胶,然后可以通过固化液如盐水来提高强度。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。