1.本发明属于有机合成领域,尤其涉及一种2-烷氧基吲哚化合物的制备方法。
背景技术:
2.2-烷氧基吲哚化合物广泛存在于各种具有重要生物活性分子骨架中,如选择性5-ht4受体拮抗剂gr-125487和sb-207266等(synth.commun.2016,46,1036-1043;bioorg.med.chem.2001,9,2119-2128;j.med.chem.1995,38,4760-4763;curr.med.chem.2010,17,334-362)。
[0003][0004]
尽管2-烷氧基吲哚化合物极为重要,然而传统方法合成该类化合物需要多步或贵金属。通过c-h活化烷氧基化反应直接合成2-烷氧基吲哚化合物的报道较少,目前该类反应并不广泛,具有较大的应用前景。
[0005]
基于此,我们发展了一种吲哚化合物为起始原料,过渡金属钴催化的c-h活化烷氧基化反应高效地合成2-烷氧基吲哚化合物的方法。
技术实现要素:
[0006]
本发明提供了一种2-烷氧基吲哚化合物的制备方法,该制备方法步骤简单,可以兼容多种官能团,反应适用性好,此方法还可以扩大至克级,为工业上大规模生产应用提供了可能。
[0007]
一种2-烷氧基吲哚化合物的制备方法,包括如下步骤:将钴催化剂、吲哚化合物以及氧化剂加入到有机溶剂中,于90~110℃进行反应16~24小时,反应完全后,后处理得到所述的2-烷氧基吲哚化合物;
[0008]
所述的吲哚化合物的结构如式(ii)所示:
[0009]
[0010]
所述的2-烷氧基吲哚化合物的结构如式(ⅰ)所示:
[0011][0012]
式(ⅰ)~(ii)中,r为c1~c4烷基、取代或者未取代的芳基、或者取代或者未取代的苄基;r’为c1~c5烷基或三氟乙醇基;
[0013]
所述芳基或者苄基上的取代基为c1~c4烷基或卤素。
[0014]
作为优选,所述的钴催化剂为乙酰丙酮钴。
[0015]
作为优选,所述的氧化剂为碳酸银。
[0016]
所述的吲哚化合物:钴催化剂:氧化剂=1:0.2:2;
[0017]
反应式如下:
[0018][0019]
反应可能的机理:首先,钴(ii)催化剂被碳酸银氧化且与吲哚化合物配位生成钴(iii)中间体。其次,钴(iii)中间体发生set作用形成自由基钴(ii)配合物。随后,自由基钴(ii)配合物被碳酸银氧化,同时吲哚2位c-h键活化形成钴(iii)配合物。最后,醇与钴(iii)中间体经历配位、迁移插入、还原消除等过程得到2-烷氧基吲哚化合物。
[0020]
本发明中,可选用的后处理过程包括:过滤,硅胶拌样,最后经过柱层析纯化得到相应的2-烷氧基吲哚化合物,采用柱层析纯化为本领域常用的技术手段。
[0021]
作为优选,r为c1~c4烷基、芳基、或者苄基;r’为c1~c4烷基,反应的产率较高。
[0022]
作为优选,所述的反应的时间为16~24小时,反应时间较短难以保证反应的完全。
[0023]
本发明中,作为优选,反应在所述的醇中进行,此时,各种原料都能以较高的转化率转化成产物。
[0024]
所述的醇的用量能将原料较好的溶解即可,0.2mmol的吲哚化合物使用的醇的量约为2.0ml。
[0025]
作为优选,所述的催化剂为乙酰丙酮钴,在众多钴催化剂中反应效率较高。
[0026]
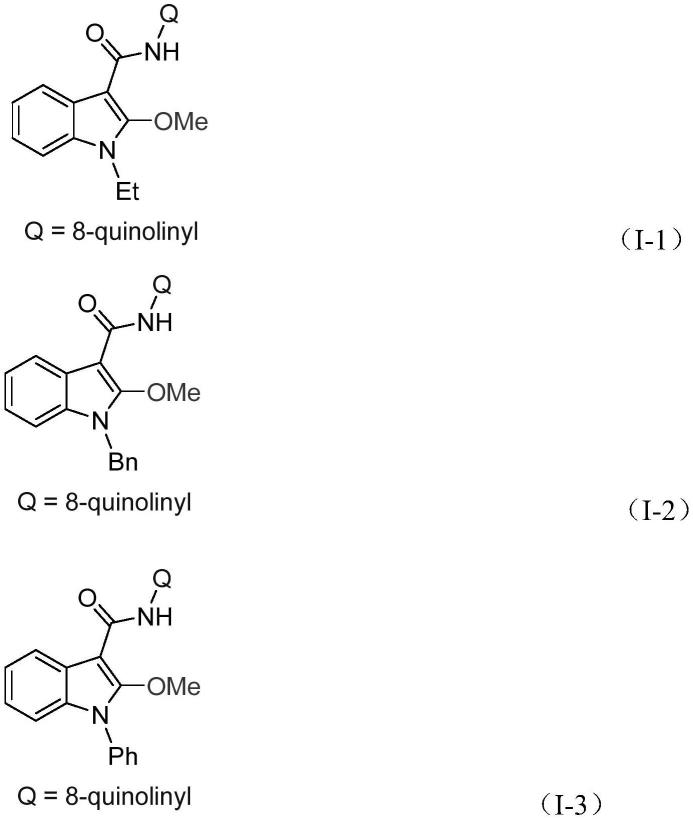
作为进一步的优选,所述的2-烷氧基吲哚化合物为式(i-1)-式(i-5)所示化合物中的一种:
[0027][0028]
[0029]
上述制备方法中,所述的乙酰丙酮钴、醇和碳酸银一般采用市售产品,都能从市场上方便地得到;所述的吲哚化合物可由8-氨基喹啉、吡啶甲酸和卤代物快速合成得到。
[0030]
同现有技术相比,本发明的有益效果体现在:该制备方法易于操作,后处理简便;反应起始原料及催化剂廉价易得,底物官能团容忍范围广,反应效率高,能够快速合成2-烷氧基吲哚化合物,实用性较强。
具体实施方式
[0031]
下面结合具体实施例对本发明做进一步的描述。
[0032]
按照表1的原料配比在35ml的schlenk管中加入乙酰丙酮钴、吲哚化合物(ii)、碳酸银和醇2.0ml,混合搅拌均匀,按照表2的反应条件反应t小时,过滤,硅胶拌样,经过柱层析纯化得到相应的2-烷氧基吲哚化合物(ⅰ),反应过程如下式所示:
[0033][0034]
表1实施例1~15的原料加入量
[0035][0036]
表2
[0037]
[0038][0039]
表1和表2中,t为反应温度,t为反应时间。
[0040]
实施例1~5制备得到化合物的结构确认数据:
[0041]
由实施例1制备得到的2-烷氧基吲哚化合物(i-1)的核磁共振(1h nmr、
13
c nmr)和高分辨(hrms)检测数据为:
[0042][0043]1h nmrr(400mhz,cdcl3)δ11.04(s,1h),9.05(d,j=7.7hz,1h),8.88(dd,j=4.1,1.5hz,1h),8.51
–
8.48(m,1h),8.17(dd,j=8.2,1.4hz,1h),7.59(t,j=8.0hz,1h),7.49
–
7.44(m,2h),7.31
–
7.28(m,3h),4.28(s,3h),4.20(q,j=7.2hz,2h),1.48(t,j=7.2hz,3h);
13
c nmr(100mhz,cdcl3)δ162.8,153.5,148.1,139.0,136.4,135.9,131.0,128.2,127.8,125.6,122.3,122.0,121.7,121.5,120.6,116.3,109.3,95.6,64.3,37.0,15.2;hrms(esi-tof)m/z:[m na]
calcd.for c
21h19
n3nao
2
:368.1369;found:368.1375.
[0044]
由实施例2制备得到的2-烷氧基吲哚化合物的核磁共振(1h nmr、
13
c nmr)和高分辨(hrms)检测数据为:
[0045][0046]1h nmr(400mhz,cdcl3)δ10.97(s,1h),8.97(d,j=7.6hz,1h),8.78(dd,j=4.1,1.3hz,1h),8.42(d,j=7.9hz,1h),8.09(dd,j=8.2,1.3hz,1h),7.51(t,j=8.0hz,1h),7.41(d,j=8.0hz,1h),7.37(dd,j=8.2,4.2hz,1h),7.26
–
7.22(m,2h),7.20
–
7.17(m,2h),7.16
–
7.09(m,4h),5.29(s,2h),4.07(s,3h);
13
c nmr(100mhz,cdcl3)δ162.8,153.9,148.2,139.0,136.6,136.4,135.9,131.8,129.1,128.3,127.9,127.8,126.5,125.5,122.7,122.3,121.7,121.6,120.7,116.5,109.9,96.1,64.5,45.5;hrms(esi-tof)m/z:[m na]
calcd.for c
26h21
n3nao
2
:430.1526;found:430.1529.
[0047]
由实施例3制备得到的2-烷氧基吲哚化合物的核磁共振(1h nmr、
13
c nmr)和高分辨(hrms)检测数据为:
[0048][0049]1h nmr(400mhz,cdcl3)δ11.33(s,1h),9.07(dd,j=7.7,0.8hz,1h),8.83(dd,j=4.2,1.6hz,1h),8.58(d,j=8.0hz,1h),8.16(dd,j=8.2,1.5hz,1h),7.63
–
7.57(m,5h),7.53(d,j=6.9hz,1h),7.49(dd,j=8.2,0.9hz,1h),7.44(dd,j=8.2,4.2hz,1h),7.33(ddd,j=8.1,6.3,1.9hz,1h),7.22(dt,j=8.0,3.9hz,2h),3.93(s,3h);
13
c nmr(100mhz,cdcl3)δ162.9,152.9,148.1,139.1,136.4,136.0,135.3,132.9,129.9,128.6,128.3,127.8,127.3,125.4,123.0,122.8,122.0,121.5,120.7,116.5,110.0,97.0,63.3;hrms(esi-tof)m/z:[m h]
calcd.for c
25h20
n3o
2
:394.1550;found:394.1557.
[0050]
由实施例4制备得到的2-烷氧基吲哚化合物的核磁共振(1h nmr、
13
c nmr)和高分辨(hrms)检测数据为:
[0051][0052]1h nmr(400mhz,cdcl3)δ10.98(s,1h),9.08(d,j=7.7hz,1h),8.88(d,j=4.0hz,1h),8.50(dd,j=5.7,2.4hz,1h),8.17(d,j=8.2hz,1h),7.59(t,j=7.9hz,1h),7.50
–
7.44(m,2h),7.29(d,j=1.8hz,3h),4.45(q,j=7.0hz,2h),4.19(q,j=7.2hz,2h),1.64(t,j=7.1hz,3h),1.48(t,j=7.2hz,3h);
13
c nmr(100mhz,cdcl3)δ163.1,152.3,148.0,139.0,136.4,136.0,131.2,128.3,127.8,125.8,122.3,122.0,121.8,121.5,120.6,116.5,109.3,96.3,73.6,37.0,15.6,15.1;hrms(esi-tof)m/z:[m na]
calcd.for c
22h21
n3o2na
:382.1526;found:382.1536.
[0053]
由实施例5制备得到的2-烷氧基吲哚化合物的核磁共振(1h nmr、
13
c nmr)和高分辨(hrms)检测数据为:
[0054][0055]1h nmr(400mhz,cdcl3)δ10.93(s,1h),9.08(d,j=7.7hz,1h),8.88(d,j=4.1hz,1h),8.49
–
8.47(m,1h),8.18(d,j=8.2hz,1h),7.59(t,j=8.0hz,1h),7.50
–
7.45(m,2h),7.32
–
7.27(m,3h),4.86
–
4.80(m,1h),4.19(q,j=7.2hz,2h),1.52(d,j=6.1hz,6h),1.49(t,j=7.2hz,3h);
13
c nmr(100mhz,cdcl3)δ163.4,150.9,147.9,138.9,136.4,136.0,131.5,128.3,127.9,126.0,122.1,121.9,121.6,121.5,120.6,116.5,109.3,97.5,80.9,37.3,22.2,14.8;hrms(esi-tof)m/z:[m h]
calcd.for c
23h24
n3o
2
:374.1863;found:374.1873。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。