一种具有ⅰ型气管发育不全表型的双侧肺脏缺失小鼠模型及其构建方法
技术领域
1.本发明属于医药领域,具体涉及一种具有ⅰ型气管发育不全表型的双侧肺脏缺失小鼠模型及其构建方法。
背景技术:
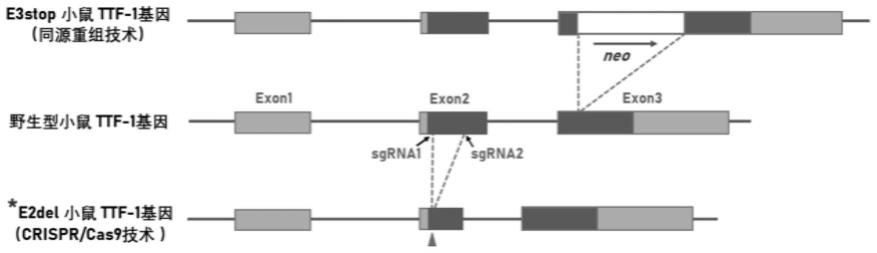
2.全世界范围都面临着临床供体器官短缺问题。通过干细胞囊胚互补在动物体内再生异种器官可能是潜在的解决途径。该方法通过敲除某一器官发育的主要基因构建该器官定向缺失的动物模型,然后以该动物模型的早期发育阶段的胚胎(囊胚)为宿主,通过向囊胚腔中注射干细胞以使外源注入的干细胞在宿主发育过程中优先形成缺失的器官。目前,用于囊胚互补研究的肺脏缺失模型主要是通过基因工程技术改造ttf-1(甲状腺转录因子-1)、fgf-10(成纤维细胞生长因子-10)、fgfr-2(成纤维细胞生长因子受体-2)或β-catenin(β-连环蛋白)基因实现的。其中,通过全身删除fgf10基因获得的小鼠模型表现为肺缺失,但也导致了其他大量组织器官的严重发育异常[1]。另外,全身删除fgf10基因或上皮特异性删除fgfr2或β-catenin基因的小鼠模型的肺脏内部组织并没有完全缺失,故而作为囊胚互补研究的宿主胚胎时,对供体干细胞参与胚胎发育产生较大影响[1,2]。1996年kimura等人通过传统同源重组方法获得一种肺脏缺失小鼠模型[3],该模型通过向胚胎干细胞的ttf-1基因第3外显子处插入含终止密码子的新霉素耐药基因(neo ),再经过种系嵌合和交配传代获得的ttf-1双等位基因敲除小鼠,以下简称为ttf1-e3stop小鼠(见图1)。ttf1-e3stop小鼠肺脏的形态呈半透明无定形的囊状,被认为是发育不全的支气管树上皮结构;而且多数ttf1-e3stop胎鼠的囊状肺脏仅存在于单侧胸腔内,这意味着以ttf1-e3stop小鼠为宿主胚胎的囊胚互补研究多数仅能获得单侧的由供体细胞衍生的肺脏。另外,所有的ttf1-e3stop小鼠均表现为胚胎期发育异常导致的气管和食管没有分离的气食管瘘畸形(tracheoesophageal fistula,tef);而以ttf1-e3stop作为宿主胚胎的囊胚互补研究已经证明,这种先天的气管和食管发育异常无法被小鼠胚胎干细胞救援,并最终导致获得的嵌合体子鼠由于仍然存在tef表型而在出生时全部死亡[4]。除上述发育异常外,ttf1-e3stop小鼠还存在甲状腺缺失和间脑畸形[3,5]。
技术实现要素:
[0003]
针对ttf1-e3stop小鼠模型存在的不足之处,我们利用高效新型基因编辑技术crispr/cas9,通过删除ttf-1基因的第二外显子序列,制备一种气管和食管完全分离的双侧肺脏缺失的小鼠模型,以下简称ttf1-e2del小鼠。
[0004]
本发明解决其技术问题采用的技术方案是:
[0005]
第一方面,本发明首先保护一种具有ⅰ型气管发育不全表型的双侧肺脏缺失小鼠模型的构建方法,包括如下具体步骤:
[0006]
(1)寻找小鼠ttf-1基因,确定第二外显子编码区作为目标区域;
[0007]
(2)体外转录获得sgrna和cas9 mrna,将其显微注射到小鼠的细胞受精卵内,培养24h后,通过胚胎移植,将存活的细胞移植到同期发情的cd1假孕母鼠的输卵管中,通过手术获得发育到期的子鼠;
[0008]
(3)pcr测序确认ttf-1第二外显子双等位基因敲除子鼠,小鼠模型构建成功。
[0009]
具体的,针对ttf-1基因的第二外显子区域设计crispr/cas9技术所需要的向导rna(sgrna),合成sgrna序列并克隆于sgrna表达载体;在体外分别转录sgrna和编码cas9的mrna,通过小鼠胚胎显微注射方法,向受精卵内注射两种rna分子;再通过胚胎移植技术向同期发情的假孕母鼠输卵管内移植注射后的小鼠胚胎;待母鼠怀孕并妊娠到期时,通过手术获得即将发育到期的子鼠;通过pcr和sanger测序鉴定子鼠的基因型,即ttf-1基因第二外显子的删除情况,确认哪些子鼠为ttf1-e2del。
[0010]
本发明继续通过解剖、固定与石蜡包埋切片、h&e染色、免疫荧光染色、免疫组织化学染色等方法鉴定ttf1-e2del子鼠的肺脏、气管-食管、甲状腺和间脑等组织器官的表型。
[0011]
作为本技术的优选技术方案,所述sgrna包括sgrna1、sgrna2,
[0012]
所述sgrna1的序列为:5'-tgacatcttgagtcccctgg-3',如seq id no:1所示;
[0013]
所述sgrna2的序列为:5'-cgcctaccacatgacggg-3',如seq id no:2所示。
[0014]
第二方面,本发明还保护前文所述构建方法构建得到的具有ⅰ型气管发育不全表型的双侧肺脏缺失小鼠模型。
[0015]
第三方面,本发明保护前文所述的具有ⅰ型气管发育不全表型的双侧肺脏缺失小鼠模型在囊胚干细胞互补研究中的应用。
[0016]
第四方面,本发明还保护前文所述的具有ⅰ型气管发育不全表型的双侧肺脏缺失小鼠模型在器官再生研究中的应用。
[0017]
第五方面,本发明还保护前文所述的具有ⅰ型气管发育不全表型的双侧肺脏缺失小鼠模型在小鼠ttf-1基因功能研究中的应用。
[0018]
第六方面,本发明保护前文所述构建方法在构建其他肺脏缺失动物模型(如大鼠、兔、猪、牛、羊等)以及在此基础上的、器官再生和基因功能研究中的应用。
[0019]
本发明构建的小鼠模型可应用于囊胚干细胞互补研究并实现器官再生,同时可检测干细胞的嵌合能力和向组织器官发育的分化潜能;为探索ttf-1基因在胚胎发育中的作用提供研究材料,为其他肺脏缺失动物模型的制备提供研究思路。
[0020]
有益效果
[0021]
本发明提供的一种具有ⅰ型气管发育不全表型的双侧肺脏缺失小鼠模型的构建方法,与现有技术相比,具有以下有益效果:本发明利用crispr/cas9技术,获得的32只子鼠。经基因型鉴定发现其中有27只子鼠的ttf1基因第二外显子序列发生双等位基因敲除(称为ttf1-e2del小鼠),双等位基因编辑效率达到84.38%;所有ttf1-e2del小鼠的表型为双侧囊状肺脏(缺少肺实质,没有肺泡ii型细胞和血管,含有基底细胞和发育不全的支气管树,见图2和图3)、甲状腺发育异常(见图4)以及间脑未见明显异常(见图5),更为重要的是57%的ttf1-e2del小鼠出现了类似于人类先天气管食管发育畸形(气管和食管成功分离的ⅰ型气管发育不全,见图6),即获得了气管-食管完全分离的双侧肺脏缺失的小鼠模型。
附图说明
[0022]
图1为ttf1-e2del小鼠模型的基因编辑模式图;
[0023]
图2为ttf1-e2del小鼠模型的囊状肺;
[0024]
图3为ttf1-e2del小鼠囊状肺脏内细胞组成;
[0025]
图4为ttf1-e2del小鼠的甲状腺发育异常;
[0026]
图5为ttf1-e2del小鼠的间脑未见明显异常;
[0027]
图6为ttf1-e2del小鼠的ⅰ型气管发育不全。
具体实施方式
[0028]
以下结合实施例对本发明做进一步详细说明。所用试剂或者仪器设备未注明生产厂商的,均视为可以通过市场购买的常规产品。
[0029]
实施例1:
[0030]
(1)设计并体外转录sgrna:以小鼠ttf-1基因(genbank,nc_000078.7)第二外显子编码区作为目标区域,使用在线crispr设计工具(http://crispr.mit.edu/)设计向导rna(sgrna),分别命名为ttf1-sgrna1和ttf1-sgrna2。其具体序列分别为:5'-tgacatcttgagtcccctgg-3'和5'-cgcctaccacatgacggg-3'。合成sgrna的dna寡核苷酸序列,将其退火处理并通过bsai限制内切酶酶切位点克隆至addgene公司的sgrna表达载体puc57kan-t7-grna(#115520),克隆成功的载体称为sgrna表达质粒(puc57kan-t7-ttf1-sgrna1和puc57kan-t7-ttf1-sgrna2)。利用限制性内切酶drai分别将上述sgrna表达质粒线性化,再使用invitrogen公司的mega shortscript
tm
t7转录试剂盒(am1354)体外转录线性化的sgrna表达质粒,再利用qiagen公司的mirneasy mini kit试剂盒获得纯化后的sgrna(ttf1-sgrna1和ttf1-sgrna2)。
[0031]
(2)体外转录cas9蛋白的mrna:利用限制性内切酶agei将addgene公司的cas9蛋白表达质粒pst1374-n-nls-flag-linker-cas9(#44758)线性化,再使用invitrogen公司的mmessage mmachine
tm
t7转录试剂盒(am1344)体外转录线性化的cas9蛋白表达质粒,再利用qiagen公司的mirneasy mini kit试剂盒获得纯化后的cas9蛋白的mrna(cas9-mrna)。
[0032]
(3)小鼠受精卵的显微注射:先后向c57bl/6j雌性小鼠注射5iu的孕马血清促性腺激素(pmsg)和5iu人绒毛膜促性腺激素(hcg),两者间隔48小时,完成超数排卵;超数排卵的雌鼠与雄鼠合笼。解剖经过合笼并已见栓的超数排卵雌鼠,由输卵管壶腹部收集受精卵,置于ksom培养液中。通过显微注射的方法,将混合好的5ng/μl ttf1-sgrna1、5ng/μl ttf1-sgrna2和10ng/μl cas9-mrna共同注射到1-细胞受精卵的原核内。将注射后的受精卵转移培养至ksom培养基中,在37℃、5% co2的培养箱中培养24h;通过胚胎移植,将存活的2-细胞期胚胎移植到同期发情的cd1假孕母鼠的输卵管中。观察母鼠妊娠情况,在妊娠期19天左右,通过手术获得即将发育到期的子鼠,进行以下基因型和表型鉴定。
[0033]
(4)鉴定子鼠基因型:剪取e19子鼠的尾巴,利用北京天根生物有限公司的基因组dna提取试剂盒提取子鼠的基因组dna。通过pcr反应扩增ttf-1基因的第二外显子区域,pcr引物为正向5
’‑
ggtgtttaccttgtcatcagcatgtaagctaattatctcgg-3’和反向5
’‑
tcacttactggcggggaagcgc-3’;pcr反应条件为94℃5min;94℃30s,65℃30s,72℃2min,35个循环;72℃7min,4℃∞。将纯化后的pcr产物克隆至takara公司的pmd18-t载体中,并转化至
dh5α大肠杆菌感受态细胞中;平板培养菌落后,随机挑取10个以上菌落进行sanger测序;将测序结果与野生型小鼠的ttf-1基因进行比较,从而确认e19子鼠的ttf-1基因敲除情况,将ttf-1第二外显子双等位基因敲除子鼠命名为ttf1-e2del小鼠。
[0034]
(5)解剖鉴定ttf1-e2del小鼠的肺部表型:随机拿取已获得的ttf1-e2del小鼠进行解剖,初步确认胸腔内的双侧透明囊状肺脏结构。
[0035]
(6)苏木精-伊红(h&e)染色鉴定肺部、食管-气管、甲状腺和间脑各部位的组织形态和细胞组成:使用10%福尔马林固定解剖后肺部组织或整体ttf1-e2del小鼠,经脱水处理和石蜡包埋后,将目标组织以4μm厚度切片;切片经二甲苯中脱蜡和再水化后,分别使用苏木精染细胞核和伊红染细胞质,并在复水和树脂封片后用尼康正置显微镜拍照记录。
[0036]
(7)免疫组织化学法分析各组织内蛋白的表达:将上述固定、石蜡包埋和切片的样本,经脱蜡和梯度水化后,用30%过氧化氢去除内源性过氧化氢酶,再用柠檬酸进行抗原修复,之后用1%牛血清白蛋白(bsa)将样本室温封闭1小时进行抗原阻断;完成抗原阻断的样本,按研究目标选择细胞特异性的一抗4℃过夜孵育样本,再使用相应的二抗在室温下孵育样本1-2小时;用含0.05% tween20的pbs(ph 7.4)缓冲液清洗完成抗体孵育的样本,再使用invitrogen公司的dab染色液进行染色,最后使用苏木精进行染色并封片。一抗ttf-1(sc53136)从santa cruz公司购买,稀释比例为1:300;一抗trp63(ab124762)从abcam公司购买,稀释比例为1:5000;二抗为山羊抗兔igg(abcam,ab6721,稀释比例1:10000)和山羊抗小鼠igg(keygene,kgaa37,稀释比例1:500)。
[0037]
(8)免疫荧光染色法分析各组织内蛋白的表达:将上述固定、石蜡包埋和切片的样本,经脱蜡和梯度水化后,用30%过氧化氢去除内源性过氧化氢酶,再用柠檬酸进行抗原修复后,用含0.2%triton x-100的pbs浸泡样本20min,再用10% bsa将样本室温封闭1小时进行抗原阻断;完成抗原阻断的样本,按研究目标选择细胞特异性的一抗4℃过夜孵育样本,再使用相应的二抗在室温下孵样本育1-2小时;拍照记录前滴加sigma公司的dapi染液(d9542)进行细胞核染色。一抗ttf-1(#12373)从cell signaling technology公司购买,稀释比例为1:250;一抗sp-c(sc518029)从santa cruz公司购买,稀释比例为1:2000;一抗α-tubulin(ab7291)从abcam公司购买,稀释比例为1:1000;荧光二抗为cy3山羊抗兔igg(abclone,as007,稀释比例1:5000)、山羊抗兔igg alexa fluor 488(invitrogen,a11034,稀释比例1:1000)、山羊抗小鼠igg alexa fluor 546(invitrogen,a11030,稀释比例1:500)和山羊抗小鼠igg alexa fluor 488(invitrogen,a32723,稀释比例1:1000)。
[0038]
结果如下:
[0039]
(1)图1为ttf1-e2del小鼠模型的基因编辑模式图,如图1所示,ttf1-e2del小鼠模型是利用crispr/cas9技术删除小鼠ttf-1基因第二外显子(exon2)序列获得的,而ttf1-e3stop小鼠模型是利用传统的同源重组技术在小鼠ttf-1基因第三外显子(exon3)处插入新霉素抗性基因(neo)获得的。
[0040]
(2)图2为ttf1-e2del小鼠模型的囊状肺,由胸腔解剖图和肺脏h&e染色图可知,与野生型小鼠相比,ttf1-e2del小鼠模型为双侧囊状肺脏,缺少肺实质,没有肺泡ii型细胞和血管。
[0041]
(3)图3为ttf1-e2del小鼠囊状肺脏内细胞组成;由肺脏内各类细胞特异性蛋白的免疫荧光染色和免疫组织化学染色图可知,与野生型小鼠相比,ttf1-e2del小鼠的肺脏已
完全不表达ttf-1蛋白(见图3a和3c);肺泡细胞特异性的表面活性蛋白sp-c不表达(见图3b);基底细胞特异性蛋白trp63仅表达于缺少肺实质的残留支气管树结构内(见图3c);肺脏内远端支气管区域不表达纤毛细胞特异性蛋白α-tubulin,而α-tubulin在近端支气管区域正常表达,表明肺脏区域内的支气管树发育不全(见图3d)。
[0042]
(4)图4为ttf1-e2del小鼠的甲状腺发育异常;由甲状腺区域h&e染色图可知,与野生型小鼠相比,ttf1-e2del(简称e2del)小鼠模型的甲状腺发育异常,表现为内部组织结构缺失,缺少甲状腺滤泡等,仅存外部轮廓;由免疫荧光染色图可知,ttf1-e2del小鼠异常的甲状腺包含的细胞均不表达ttf-1蛋白。
[0043]
(5)图5为ttf1-e2del小鼠的间脑未见明显异常;由间脑区域h&e染色图可知,与野生型小鼠相比,ttf1-e2del小鼠模型的间脑发育未见明显异常;由免疫组织化学染色图可知,ttf1-e2del小鼠的间脑区域的下丘脑包含的细胞均不表达ttf-1蛋白。
[0044]
(6)图6为ttf1-e2del小鼠的ⅰ型气管发育不全;从头部到颈部将小鼠气管和食管肺发育的区域水平划分为3个(水平位置1-3),其中水平位置2的横截面示意图用于明确地区分野生型、气食管瘘畸形和ⅰ型气管发育不全(见图6a)。由h&e染色图可知,与野生型小鼠相比,ttf1-e2del小鼠表现为ⅰ型气管发育不全(包括水平位置1中气管和食管完全分离,水平位置2中由气管发育不全导致的主气管分支位置上移,水平位置3中左右主气管之间相距位置较远),这有别于ttf1-e3stop小鼠的气食管瘘畸形(见图6b)。
[0045]
本发明的保护内容不局限于以上实施例。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求为保护范围。
[0046]
相关文献:
[0047]
[1]kitahara,a.;ran,q.;oda,k.;yasue,a.;abe,m.;ye,x.;sasaoka,t.;tsuchida,m.;sakimura,k.;ajioka,y.;et al.generation of lungs by blastocyst complementation in apneumic fgf10-deficient mice.cell rep.2020,31,107626.
[0048]
[2]mori,m.;furuhashi,k.;danielsson,j.a.;hirata,y.;kakiuchi,m.;lin,c.s.;ohta,m.;riccio,p.;takahashi,y.;xu,x.;et al.generation of functional lungs via conditional blastocyst complementation using pluripotent stem cells.nat.med.2019,25,1691-1698.
[0049]
[3]kimura,s.;hara,y.;pineau,t.;fernandez-salguero,p.;fox,c.h.;ward,j.m.;gonzalez,f.j.the t/ebp null mouse:thy-roid-specific enhancer-binding protein is essential for the organogenesis of the thyroid,lung,ventral forebrain,and pituitary.genes dev.1996,10,60-69.
[0050]
[4]wen,b.;li,e.;ustiyan,v.;wang,g.;guo,m.;na,c.l.;kalin,g.t.;galvan,v.;xu,y.;weaver,t.e.;et al.in vivo generation of lung and thyroid tissues from embryonic stem cells using blastocyst complementation.am.j.respir.crit.care.med.2020,203,471-483.
[0051]
[5]minoo,p.;su,g.;drum,h.;bringas,p.;kimura,s.defects in tracheoesophageal and lung morphogenesis in nkx2.1(-/-)mouse embryos.dev.biol.1999,209,60-71.
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。