1.本发明属于肺炎疫苗领域,涉及一种23价肺炎球菌多糖疫苗(包括1、2、3、4、5、6b、7f、8、9n、9v、10a、11a、12f、14、15b、17f、18c、19a、19f、20、22f、23f和33f等23种肺炎链球菌血清型)的生产工艺。
背景技术:
2.肺炎链球菌是一类革兰染色阳性致病菌,1881年被首次分离识别。肺炎球菌表面黏液层的化学成分为多糖的荚膜是主要的致病物质之一,具有抗原性,并因其结构相异将肺炎球菌划分为90多个血清型。肺炎链球菌荚膜多糖具有免疫原性,可以激发产生保护性抗体,4价、14价、23价肺炎多糖疫苗相继应运而生。其中,23价肺炎球菌多糖疫苗是现有的包含种类最多的一种肺炎多糖疫苗,是通过对23种不同血清型的肺炎球菌荚膜多糖抗原纯化后按配方混合而成,全球85~90%侵袭性肺炎球菌感染是由此23种血清型造成。
3.23价肺炎球菌荚膜多糖疫苗可对相应的肺炎链球菌产生抗体,为非t细胞依赖型抗原,可诱导机体产生igm,在接种后的第3周,抗体的产生达到高峰,且有效抗体水平至少可持续5年。各疫苗上市生产企业已然具备成熟的肺炎多糖疫苗制备工艺,但制备过程多以传统生产工艺进行多糖疫苗的制备,工艺过程中多以25%乙醇沉淀核酸、苯酚抽提法去除蛋白进行荚膜多糖精制,而且伴随大量乙醇进行分级沉淀多糖。工艺方法中引入的苯酚具高毒性,污染生产环境,且影响产品的安全性,大量有机乙醇的使用也增大了操作安全隐患。
4.为提高肺炎多糖的产率、疫苗的安全性及有效性,肺炎多糖生产工艺在不断进行技术创新提升。专利cn102257127a提出产生高分子量的分离的肺炎链球菌荚膜多糖溶液的改良方法,具体方法是向6a、6b、19和19f这类含有磷酸二酯键的肺炎链球菌血清型的培养基中提供co2、hco
3-或co
32-;专利cn103833865a则利用灭活后的培养液经离心、膜分离、分段醇沉、层析的方法提纯肺炎荚膜多糖,该发明在纯化工艺中避免了有机试剂及酶的使用,改进多糖生产纯化工艺;类似的,专利cn107936128a在肺炎多糖生产纯化工艺也提出改良方法,具体的以控制发酵液的细菌密度、裂解剂浓度、添加裂解剂后的裂解时间及控制ph,可直接经离心、超滤等步骤后用乙醇沉淀多糖,即为精制多糖,该方法取消微滤、层析等步骤,取消ctab、酶、苯酚等物料的使用,且收率高、操作简单等优点,然而工艺中以乙醇沉糖、以无水乙醇及丙酮洗糖,增加了工艺操作安全风险;专利cn105131139a则是引入核酸酶处理的方法纯化肺炎多糖,极大的缩短了工艺时间,然而核酸酶的使用却提高了生产成本;专利cn104781413a提出的另外培养可以利用培养产物(乳酸等)使ph降低至适合蛋白沉淀的范围,去除了ph调节剂酸化的蛋白沉淀过程,使多糖生产工艺简化;专利cn111893084a中提出向肺炎链球菌发酵体系中连续补料含有己醇胺的发酵培养基,可实现高密度发酵,并声明该方法可极大的提高多糖产量(产量提高3~6倍)。
5.肺炎荚膜多糖生产工艺的技术创新是为了更快速高效生产的更安全可靠的肺炎疫苗,本发明在肺炎球菌荚膜多糖生产工艺优化升级的基础上提出一种23价肺炎球菌多糖
疫苗的制备方法。具体的,肺炎链球菌菌种复苏、扩增后,进行发酵培养,于对数生长期后期或稳定期前期收获,在收获的培养液中加入脱氧胆酸钠溶液进行灭活,高速离心去除菌体,加入十六烷基三甲基溴化铵(ctab),收集沉淀或上清,收集的沉淀或上清液继续纯化,经过解离、沉淀、超滤、层析、冻干等工序,得到白色固体为肺炎球菌多糖,将各型别肺炎多糖按配方混合得到23价肺炎多糖疫苗。
6.特别的,本发明提出的23价肺炎球菌多糖疫苗生产工艺特别在肺炎多糖制备工艺进行了技术创新,提供了一种新的肺炎球菌多糖的制备方法。主要体现在:
7.(1)本发明提供了23个型别肺炎球菌多糖的新的制备方法,尤其是提供了8、10a、11a、12f、14、15b、17f、20、22f、23f和33f等型别的一种新的多糖制备工艺。
8.(2)本发明提供的肺炎球菌多糖生产工艺,通过调节葡萄糖补加速度,控制发酵过程葡萄糖浓度,进而控制发酵过程菌体浓度;通过控制添加裂解剂浓度、裂解时间及控制ph,保证菌体破碎及蛋白沉淀效果。
9.(3)本发明提供的肺炎球菌多糖生产工艺,控制料液缓冲溶液的离子强度及酸碱度,使酸性多糖(或酸性杂质)与ctab形成不溶性沉淀物,且在适宜离子强度的含氯离子溶液中多糖被重新解离出来。
10.(4)本发明提供的肺炎球菌多糖生产工艺,采用加入碘化钠溶液去除大部分引入的ctab。电离产生的i-会降低ctab的临界胶束浓度,使大部分ctab以胶束形式沉淀,离心分离,残留的ctab采用超滤技术去除。
11.(5)本发明提供的肺炎球菌多糖生产工艺,以羟基磷灰石为离子交换介质,用合适浓度的磷酸盐缓冲液平衡层析介质,多糖溶液上样至层析柱,蛋白及核酸杂质与介质结合,目标成分多糖则流穿,因此收集多糖洗脱峰,可去除大部分核酸与蛋白。
12.(6)本发明提供的肺炎球菌多糖生产工艺,将多糖溶液以冷冻干燥的方法获取固体肺炎多糖。用冷冻干燥能够较好保持被干燥物的形貌与性能的特点,替代了75~80%乙醇沉淀多糖、无水乙醇、无水丙酮干燥多糖的生产工艺。
13.(7)本发明提供的肺炎球菌多糖生产工艺,过程料液澄清过滤采用0.65um玻璃纤维材质滤芯或深层过滤器,可以解决因料液堵塞膜材问题。
14.(8)本发明提供的肺炎球菌多糖生产工艺,未采用传统25%乙醇沉淀杂质,75%乙醇沉淀多糖的步骤,避免了引入有机试剂乙醇、丙酮,生产安全及产品安全性均提高。
15.(9)本发明该提供的肺炎球菌多糖生产工艺,未采用传统的酚抽提去除蛋白的工艺,避免了引入高毒性苯酚,工艺过程有更高的安全性、稳定性和重现性,产品更安全。
技术实现要素:
16.本发明提供了23个型别肺炎球菌多糖的新的制备方法,尤其是提供了2、8、9n、10a、11a、12f、15b、17f、20、22f、33f等10个型别肺炎链球菌血清型多糖的制备方法。
17.本发明所述的23价肺炎球菌多糖的制备方法,包括如下步骤:
18.(1)肺炎球菌的培养及发酵;
19.(2)发酵收获液杀菌、沉淀及离心;
20.(3)发酵上清液ctab沉淀酸性多糖或杂质;
21.(4)解离、沉淀ctab;
22.(5)层析进一步去除核酸及蛋白;
23.(6)纯化后样品超滤、冻干制成肺炎球菌多糖;
24.其中,步骤(1)肺炎球菌的培养及发酵,方法为:
25.1、2、3、4、5、6b、7f、8、9n、9v、10a、11a、12f、14、15b、17f、18c、19a、19f、20、22f、23f和33f型肺炎球菌,来自中国食品药品检定研究院中国医学菌种保藏中心。
26.原始种子批视为0代,原始种子批传2代制备主代种子批,主代种子批传2代制备工作种子批,工作种子开启后至接种发酵罐培养传代次数为5代。
27.培养基以胰酪大豆液体培养基(tryptic soy broth,tsb)为基础,每升培养基含胰酪大豆液体培养基(固体粉末)基质30g,细菌的生长在mg
2
离子存在的情况更有益,因此,在培养基中添加40mg/l的mgso4。为防止发酵过程大量气泡产生而影响菌体生长,每kg培养基中加入消泡剂0.1~0.3ml。
28.用哥伦比亚血琼脂平板培养基开启工作菌种,置于37
±
1℃、10%co2以下条件下培养,24小时以内基本可形成菌苔。复苏后的菌种在液体培养基(约1l)中,37
±
1℃、4%~6%co2条件下扩增培养,12小时内逐渐形成浑浊的菌液。
29.将培养的菌液接种于9l培养基中,放大培养。在100l发酵罐(90l培养基)、1000l发酵罐(400l或900l培养基)逐级放大培养,至对数生长期后期或稳定期前期,加入脱氧胆酸钠裂解菌体。
30.发酵期间培养条件控制为:
31.温度35~38℃,ph值在6.6~7.5之间,搅拌转速40~100转/分钟,通气量0.1~0.4v/v/m(每l发酵液每分钟体积),发酵时间不超过10小时。20l、100l、1000l发酵罐培养,对数生长期后期或稳定期前期停止发酵。发酵过程中检测葡糖糖浓度及od值,调整葡萄糖补加速度,尽可能控制发酵液中葡萄糖浓度在5~25mmol/l,控制菌体浓度。
32.其中步骤(2)发酵收获液杀菌、沉淀及离心,方法为:
33.在收获的培养液中加入脱氧胆酸钠溶液杀菌,脱氧胆酸钠终浓度为0.06~0.24%,灭活4小时以上;用醋酸溶液调ph值至4.0~6.0,静置沉淀杂质4小时以上;离心,上清液调ph值至中性,用0.65um玻璃纤维滤芯澄清过滤后,用100kd膜包浓缩,用不少于5倍体积缓冲溶液进行超滤。
34.其中步骤(3)发酵上清液ctab沉淀酸性多糖或杂质,并解离,方法为:
35.用碳酸钠溶液调节料液ph值至7.2~7.6,加入十六烷基三甲基溴化铵(ctab)溶液,至ctab终浓度为1~3%,混合均匀后沉淀过夜,离心收集目标成分。
36.其中,1、2、3、4、5、6b、8、9n、9v、10a、11a、12f、15b、18c、19a、19f、20、22f和23f型离心后收集沉淀,7f、14、17f和33f型离心后收集上清液,此4个型别无需进行解离步骤。
37.其中步骤(4)解离、沉淀去除ctab,方法为:
38.沉淀物中加入0.2~0.5mol/l的氯化钠溶液,使多糖与ctab解离12小时以上,离心收集上清液。步骤3)或步骤4)收集的上清液加入碘化钠至终浓度为0.2~1.5%,混合均匀,静置沉淀1小时以上,离心,上清液经0.65um玻璃纤维材质滤芯澄清过滤后,用100kd膜包浓缩,用不少于5倍体积的缓冲溶液进行超滤。
39.其中步骤(5)层析进一步去除核酸及蛋白,方法为:
40.层析介质为ii型羟基磷灰石(cht ii),0.002~0.01mol/l磷酸盐缓冲液作为平衡
液,纯化过程中,监测206nm吸收值,收集主流穿峰为多糖组分,层析柱使用0.5~1.0mol/l的磷酸缓冲生理盐水进行再生,0.3~0.5mol/l氢氧化钠溶液进行清洁。
41.其中步骤(6)纯化后样品超滤、冻干制成肺炎球菌多糖,方法为:
42.层析后样品用100kd膜包、冷却注射用水进行透析,透析体积应不低于浓缩料液5倍体积,并在线检测透过液电导应小于10μs/cm。多糖溶液澄清过滤后冻干,温度降至-40℃以下后保温,应不低于4h;产品完全冻结后在真空状态下进行水分升华,升华过程应不低于50h;待制品冰层完全消失后进入解析干燥阶段,保温过程应不低于4h。冻干全程产品温度应不高于30℃;冻干结束,应为白色疏松固体,即为纯化的肺炎球菌多糖。
43.最优选的,本发明的所述的23价肺炎球菌多糖的制备方法,包括如下步骤:
44.(1)肺炎球菌的培养及发酵:
45.以哥伦比亚血琼脂培养基开启工作菌种,培养条件为37
±
1℃、10%co2;复苏后于液体培养基中扩增培养,培养条件为37
±
1℃、4%~6%co2;转移至发酵罐以胰酪大豆液体培养基进行菌体发酵培养,培养温度36~38℃,ph值在6.8~7.2之间,搅拌转速40~100转/分钟,通气量0.1~0.4v/v/m(每l发酵液每分钟体积),发酵时间不超过10小时。20l、100l、1000l发酵罐培养,对数生长期后期或稳定期前期停止发酵。发酵过程中检测葡糖糖浓度及od值,20l发酵罐培养,菌液od
600
控制在0.5~1.5之间;100l发酵罐培养,菌液od
600
控制在0.5~1.5之间,调整葡萄糖补加速度,尽可能控制发酵液中葡萄糖浓度在10~25mmol/l,控制菌体浓度;
46.(2)发酵收获液杀菌、沉淀及离心:
47.在收获的培养液中加入脱氧胆酸钠溶液杀菌,脱氧胆酸钠终浓度为0.12%,灭活4小时以上;用醋酸溶液调ph值至4.5~5.0,静置沉淀杂质20小时以上;离心,上清液调ph值至6.9
±
0.2,用0.65um玻璃纤维滤芯澄清过滤后,用100kd膜包浓缩,用20倍体积的0.01mol/l缓冲溶液进行超滤。超滤用溶液为0.01mol/l磷酸缓冲溶液(17f为0.01mol/l磷酸缓冲生理盐水);
48.(3)发酵上清液ctab沉淀酸性多糖或杂质:
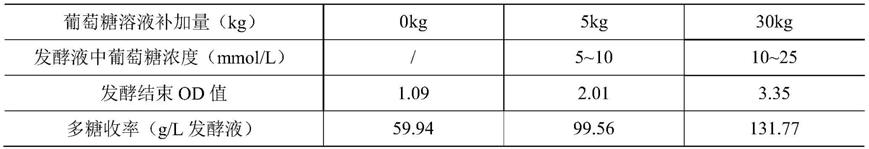
49.用碳酸钠溶液调节料液ph值至7.2~7.6,加入ctab溶液至终浓度为1%,特别的,23f型ctab终反应浓度为3%,混合均匀后沉淀过夜,离心收集目标成分;
50.其中,1、2、3、4、5、6b、8、9n、9v、10a、11a、12f、15b、18c、19a、19f、20、22f和23f型离心后收集沉淀,7f、14、17f和33f型离心后收集上清液,此4个型别无需进行解离步骤;
51.(4)解离、沉淀ctab:
52.沉淀物中加入0.25mol/l的氯化钠溶液(3型为0.35mol/l的氯化钠溶液),使多糖与ctab解离12小时以上,离心收集上清液。步骤3)或步骤4)收集的上清液加入碘化钠至终浓度为0.5%,混合均匀,静置沉淀1小时以上,离心,上清液经0.65um玻璃纤维材质滤芯澄清过滤后,用100kd膜包浓缩,用20倍体积的缓冲溶液进行超滤,超滤用溶液为0.005mol/l磷酸盐缓冲溶液;
53.(5)层析进一步去除核酸及蛋白:
54.层析介质为ii型羟基磷灰石(cht ii),0.005mol/l磷酸盐缓冲液作为平衡液,纯化过程中,监测206nm吸收值,收集多糖流穿峰峰值降至2/3高度前样品,层析柱使用0.5mol/l的磷酸缓冲生理盐水进行再生,0.5mol/l氢氧化钠溶液进行清洁;
55.(6)纯化后样品超滤、冻干制成肺炎球菌多糖:
56.层析后样品用100kd膜包、冷却注射用水进行透析,透析体积应不低于浓缩料液10倍体积,并在线检测透过液电导应小于10μs/cm。多糖溶液澄清过滤后冻干,温度降至-45℃保温6h;产品完全冻结后在真空状态下进行水分升华,升华温度为22℃,75h;待制品冰层完全消失后进入解析干燥阶段,保温30℃,5h;冻干全程产品温度应不高于30℃;冻干结束,应为白色疏松固体,即为纯化的肺炎球菌多糖。
57.本发明进一步包括,将上述纯化步骤所得的23个型别的肺炎球菌多糖作为疫苗制剂的活性成分,根据制剂学的要求制备成疫苗制剂。
58.本发明提出的23价肺炎球菌多糖疫苗,疫苗制剂为液体剂型。1个免疫剂量0.5ml含:
59.纯化肺炎球菌多糖(1、2、3、4、5、6b、7f、8、9n、9v、10a、11a、12f、14、15b、17f、18c、19a、19f、20、22f、23f和33f):23种血清型各25μg/剂;
60.稀释剂:0.01mol/l pbs溶液(ph 6.0~7.5),0.5ml/剂,含氯化钠、磷酸氢二钠、磷酸二氢钠和注射用水。
61.其制备方法包括如下步骤:
62.(1)取检定合格的23个型别的肺炎球菌多糖,加入0.01mol/l pbs溶液溶解。
63.(2)补加pbs溶液至配制量,使各单型多糖终浓度为50μg/ml,
64.(3)用0.22μm滤芯除菌过滤后分装,规格0.5ml/支。
65.本发明的优点在于,提供了23个型别肺炎球菌多糖的新的制备方法,尤其是提供了8、10a、11a、12f、14、15b、17f、20、22f、23f和33f等型别的一种新的多糖制备工艺。新工艺采用ctab沉淀-氯化钠解离-碘化钠沉淀ctab-超滤-羟基磷灰石层析-超滤-冻干进行多糖纯化,避免了乙醇、苯酚的使用。碘化钠电离产生的i-会降低ctab的临界胶束浓度,使大部分ctab以胶束形式沉淀;不再使用苯酚、乙醇,防止了苯酚对环境及人员的危害,防止了乙醇使用过程中的易燃易爆危险;切向流超滤膜包、羟基磷灰石的配合使用使蛋白、核酸含量更低,且适用于工业化生产;冻干工艺获得低含水量的多糖粉末,多糖稳定性好。本发明所得的23价肺炎球菌多糖疫苗安全性及免疫原性良好。
附图说明
66.图1、23个型别肺炎多糖核磁共振图谱(氢谱)
67.图2、23个型别肺炎多糖分子量大小检测图谱
具体实施方式
68.为了更好地理解本发明,通过以下实施例进一步说明本发明的有益效果,但不作为对于本发明的限制。
69.实施例1:不同葡萄糖补料量下发酵菌体浓度及多糖产量对比(以8型为例)
70.(1)用哥伦比亚血琼脂平板培养基开启8型工作菌种,置于37
±
1℃、10%co2以下条件下培养,24小时以内基本可形成菌苔。复苏后的菌种在液体培养基(约1l)中,37
±
1℃、4%~6%co2条件下扩增培养,12小时内逐渐形成浑浊的菌液。将培养的菌液接种于9l培养基中,放大培养。在100l发酵罐(90l培养基)、1000l发酵罐(400l培养基)逐级放大培养。发
酵期间培养条件控制为:温度36~38℃,ph值在6.8~7.2之间,搅拌转速40~100转/分钟,通气量0.1~0.4v/v/m,发酵时间不超过10小时。
71.(2)8型肺炎球菌最后一级发酵过程中,控制葡萄糖浓度及补加量,可以影响发酵结束菌体浓度,进而影响多糖产量。对比发酵过程不补加葡萄糖、补加少量葡萄糖、控制葡萄糖浓度在10~25mmol/l之间菌体浓度,发现控制发酵液中葡萄糖浓度在10~25mmol/l之间时菌体生长最好,多糖收率最高。结果见表1。
72.表1葡萄糖补加量对菌体生长、多糖收率的影响
[0073][0074]
实施例2:不同裂解剂浓度对杀菌效果及多糖抗原性影响(以3、7f、18c型为例)
[0075]
我们选择0.03%、0.06%、0.12%和0.24%的doc浓度,观察了不同浓度的doc经不同的反应时间对肺炎链球菌的杀灭情况,同时用相应抗血清制备的琼脂板进行单扩散实验,通过观察扩散环的直径,以判断多糖抗原性的变化,结果见下表。由表可知:当裂解剂浓度达到0.06%灭活3小时可以完全灭活细菌,且0.06%、0.12%和0.24%的doc浓度灭活后的菌液,其单扩散实验的扩散环直径相当,说明不同裂解剂浓度对多糖的抗原性并无显著影响。
[0076]
表2不同doc浓度对肺炎链球菌的杀灭效果以及多糖抗原性的影响
[0077][0078][0079]
实施例3:不同裂解ph值所得的肺炎多糖质量对比(以5型为例)
[0080]
在收获的5型肺炎球菌多糖培养液中加入脱氧胆酸钠溶液杀菌,脱氧胆酸钠终浓度为0.12%,灭活4小时以上。
[0081]
上述料液各取30l,分别用醋酸溶液调ph值至3.5、4.0、4.5、5.0、5.5,静置沉淀30分钟;离心收集上清液,调ph值至6.9
±
0.2,澄清过滤后用不少于20倍体积的0.001mol/l磷酸缓冲液超滤浓缩至800~1000ml左右,取样测定料液多糖含量、蛋白含量,结果见表3。随着裂解剂ph的降低,超滤浓缩后料液蛋白多糖比例有明显降低。但多糖在酸性环境下会降
解,ph越低,降解越严重,进而影响多糖分子相对分子量及功能团含量。
[0082]
表3裂解剂不同ph值沉淀蛋白效果对比
[0083][0084]
实施例4:不同ctab浓度对多糖产量及杂质含量的影响(以6b、7f、9v、14、18c为例)
[0085]
选择了6b、7f、9v、14、18c五个型别发酵上清超滤后料液,添加4%碳酸钠溶液,调节ph值至7.4
±
0.2。选取0.5%、1.0%和1.5%三个ctab浓度进行试验,对比最终收获多糖的单位产量、蛋白含量、核酸含量,结果如下表。由表可知,ctab浓度由0.5%增加至ctab浓度至1%,多糖产量提升,残余蛋白质、核酸含量也相对较低。ctab浓度增加至1.5%,部分型别蛋白含量增加。因此ctab浓度1.0%为最优条件。
[0086]
表4不同ctab浓度对多糖产量及杂质含量的影响
[0087][0088]
实施例5:氯化钠浓度不同对3型肺炎多糖解聚效果的影响
[0089]
对比了2种nacl浓度对肺炎3型多糖纯化的影响,发现0.25mol/lnacl浓度不能充分解离3型复合多糖,0.35mol/l的nacl解离浓度充分可以解离3型复合多糖。具体结果如下表:
[0090]
表5不同nacl解聚浓度对3型肺炎多糖纯化的影响
[0091][0092]
实施例6:nai浓度不同对ctab沉淀效果的影响(以3型为例)
[0093]
nai溶液电离产生的i-会降低ctab的临界胶束浓度,使大部分ctab以胶束形式沉淀。解聚离心后收集上清,加入5%碘化钠溶液,可使引入的ctab沉淀下来。选取0.2%、0.5%、1.0%、1.5%四个nai浓度,进行沉淀试验。对四个浓度放置1小时后的ctab沉淀进行离心收集、烘干、称重。对比沉淀重量如下表。由表可知,0.2%、0.5%、1.0%、1.5%四个nai浓度,收获的沉淀样品重量基本一致,均无明显变化趋势,证明nai浓度在0.2%~1.5%可确保充分沉淀ctab。
[0094]
表6不同nai浓度各离心杯中沉淀重量(g)
[0095][0096]
实施例7:酚抽提方法与层析纯化法所得多糖蛋白含量对比(以5型为例)
[0097]
取沉淀ctab后上清液20l,分成两份。
[0098]
层析纯化法:取10l上清液,用100kd膜包浓缩,不少于20倍体积的0.005mol/l磷酸盐缓冲溶液进行超滤。超滤后料液用ii型羟基磷灰石(cht ii),0.005mol/l磷酸盐缓冲液作为平衡液,进行纯化,监测206nm吸收值,多糖流穿峰收集位置为起峰至峰值降至2/3高度。层析后样品用100kd膜包、注射用水透析后,冻干得到多糖粉末。
[0099]
酚抽提法:取10l上清液,用100kd膜包浓缩,不少于20倍体积的10%饱和中性醋酸钠溶液进行超滤。超滤后料液用冷酚溶液进行抽提2次,每次加入冷酚溶液为料液体积的1~2倍。抽提后抽取上清液,用用100kd膜包、注射用水透析后,冻干得到多糖粉末。
[0100]
对比酚抽提方法与层析纯化法所得多糖蛋白含量,发现两种方法得到的多糖功能基团含量无明显差异,但层析纯化法去除蛋白、核酸的效果优于酚抽提法。
[0101]
表7酚抽提方法与层析纯化法所得多糖蛋白含量对比
[0102][0103]
实施例8:层析纯化后样品不同收集位置对多糖质量的影响(以9v、19f型为例)
[0104]
羟基磷灰石为混合型介质,有部分分子筛作用,将层析的收集位置提前,可以得到杂质蛋白含量更低,相对分子量更大(kd值更低)的多糖,且多糖的功能基团含量无明显变化。以9v、19f型多糖为例,结果如下表所示。
[0105]
表8层析收集位置不同多糖质量结果对比
[0106][0107]
实施例9:多糖纯化过程蛋白、核酸杂质去除能力(以2、4、14、23f型为例)
[0108]
ctab沉淀、解聚离心、nai沉淀等步骤可以去除料液中一半以上的杂质蛋白质和核酸。层析纯化步骤可以更大程度上去除料液中的杂质蛋白质和核酸。取2、4、14、23f型生产过程料液,检测多糖含量、核酸含量、蛋白含量,证明纯化工艺去除杂质蛋白及核酸能力。结
果见表10。
[0109]
表9本发明的多糖过程样品杂质蛋白、核酸的去除能力
[0110][0111]
实施例10:冻干对多糖抗原性影响
[0112]
多糖冻干前后样品,按5mg/ml稀释溶解,使用特异性抗血清进行多糖抗原性检测。各型肺炎球菌多糖冻干前后均能与对应肺炎球菌抗血清形成沉淀圈,且沉淀圈直径无明显差异,说明冻干对多糖抗原性无影响。
[0113]
选取3型多糖进行冻干前后kd值检测分析,结果显示冻干对多糖kd值无影响。
[0114]
表10本发明的多糖冻干前后抗原性比较
[0115][0116]
实施例11:肺炎球菌荚膜多糖的制备(血清型1、2、3、4、6b、8、10a、12f、15b、18c、19a、20、22f、23f)
[0117]
1)原始种子,来自中国食品药品检定研究院中国医学菌种保藏中心。原始种子批视为0代,原始种子批传2代制备主代种子批,主代种子批传2代制备工作种子批,工作种子开启后至接种发酵罐培养传代次数为5代。
[0118]
2)用哥伦比亚血琼脂平板培养基开启工作菌种,置于37
±
1℃、10%co2以下条件下培养,24小时以内基本可形成菌苔。复苏后的菌种在液体培养基(约1l)中,37
±
1℃、4%~6%co2条件下扩增培养,12小时内逐渐形成浑浊的菌液。将培养的菌液接种于9l培养基中,放大培养。在100l发酵罐(90l培养基)、1000l发酵罐(900l培养基,3型为400l培养基)逐级放大培养,至对数生长期后期或稳定期前期,加入脱氧胆酸钠裂解菌体。
[0119]
发酵期间培养条件控制为:
[0120]
温度36~38℃,ph值在6.8~7.2之间,搅拌转速40~100转/分钟,通气量0.1~0.4v/v/m,发酵时间不超过10小时。20l发酵罐培养,菌液od
600
控制在0.9~1.5之间;100l发酵罐培养,菌液od
600
控制在0.9~1.5之间;1000l发酵罐培养,对数生长期后期或稳定期前期停止发酵。发酵过程中检测葡糖糖浓度及od值,通过调整葡萄糖补加速度,尽可能控制发酵液中葡萄糖浓度在10~20mmol/l,控制菌体浓度。
[0121]
3)在收获的培养液中加入脱氧胆酸钠溶液杀菌,脱氧胆酸钠终浓度为0.12%,灭活4小时以上;用醋酸溶液调ph值至5.0,静置沉淀杂质4小时以上;离心,上清液调ph值至6.9
±
0.2,用0.65um玻璃纤维滤芯澄清过滤后,用100kd膜包浓缩,用不少于20倍体积生的0.01mol/l磷酸缓冲溶液(不含氯化钠)进行超滤。
[0122]
4)用碳酸钠溶液调节料液ph值至7.2~7.6,加入十六烷基三甲基溴化铵(ctab)溶液,至ctab终浓度为1%,混合均匀后沉淀过夜,离心收集沉淀。沉淀物中加入0.25~0.35mol/l的氯化钠溶液(或0.35),使多糖与ctab解离12小时以上,离心收集上清液。上清液加入碘化钠至终浓度为0.5%,混匀后静置沉淀1小时以上,离心,上清液经0.65um玻璃纤维材质滤芯澄清过滤后,用100kd膜包浓缩,用不少于20倍体积的0.005mol/l磷酸盐缓冲溶液进行超滤。
[0123]
5)层析介质为ii型羟基磷灰石(cht ii),0.005mol/l磷酸盐缓冲液作为平衡液,纯化过程中,监测206nm吸收值,多糖流穿峰收集位置为起峰至峰值降至2/3高度;每批次发酵样品分1~2次纯化(3型分4次纯化)。
[0124]
6)层析后样品用100kd膜包、冷却注射用水进行透析,透析体积应不低于浓缩料液5倍体积,并在线检测透过液电导率应小于10μs/cm。多糖冻干过程中温度降至-45℃,6h;升华过程22℃,75h;解析干燥阶段,保温30℃,5h。冻干结束,应为白色疏松固体,即为纯化的肺炎球菌多糖。
[0125]
实施例12:肺炎球菌荚膜多糖的制备(血清型5、9n、9v、11a、19f)
[0126]
1)原始种子,来自中国食品药品检定研究院中国医学菌种保藏中心。原始种子批视为0代,原始种子批传2代制备主代种子批,主代种子批传2代制备工作种子批,工作种子开启后至接种发酵罐培养传代次数为5代。
[0127]
2)用哥伦比亚血琼脂平板培养基开启工作菌种,置于37
±
1℃、10%co2以下条件下培养,24小时以内基本可形成菌苔。复苏后的菌种在液体培养基(约1l)中,37
±
1℃、4%~6%co2条件下扩增培养,12小时内逐渐形成浑浊的菌液。将培养的菌液接种于9l培养基中,放大培养。在100l发酵罐(90l培养基)、1000l发酵罐(900l培养基)逐级放大培养,至对数生长期后期或稳定期前期,加入脱氧胆酸钠裂解菌体。
[0128]
发酵期间培养条件控制为:
[0129]
温度36~38℃,ph值在6.8~7.2之间,搅拌转速40~100转/分钟,通气量0.1~0.4v/v/m,发酵时间不超过10小时。20l发酵罐培养,菌液od
600
控制在0.9~1.5之间;100l发酵罐培养,菌液od
600
控制在0.9~1.5之间;1000l发酵罐培养,对数生长期后期或稳定期前期停止发酵。发酵过程中检测葡糖糖浓度及od值,通过调整葡萄糖补加速度,尽可能控制发酵液中葡萄糖浓度在10~20μg/ml,控制菌体浓度。
[0130]
3)在收获的培养液中加入脱氧胆酸钠溶液杀菌,脱氧胆酸钠终浓度为0.12%,灭活4小时以上;用醋酸溶液调ph值至5.0,静置沉淀杂质4小时以上;离心,上清液调ph值至
6.9
±
0.2,用0.65um玻璃纤维滤芯澄清过滤后,用100kd膜包浓缩,用不少于20倍体积生的0.01mol/l磷酸缓冲溶液进行超滤。
[0131]
4)用碳酸钠溶液调节料液ph值至7.2~7.6,加入十六烷基三甲基溴化铵(ctab)溶液,至ctab终浓度为1%,混合均匀后沉淀过夜,离心收集沉淀。沉淀物中加入0.25mol/l的氯化钠溶液,使多糖与ctab解离12小时以上,离心收集上清液。上清液加入碘化钠至终浓度为0.5%,混匀后静置沉淀1小时以上,离心,上清液经0.65um玻璃纤维材质滤芯澄清过滤后,用100kd膜包浓缩,用不少于20倍体积的0.005mol/l磷酸盐缓冲溶液进行超滤。
[0132]
5)层析介质为ii型羟基磷灰石(cht ii),0.005mol/l磷酸盐缓冲液作为平衡液,纯化过程中,监测206nm吸收值,多糖流穿峰起始位置开始收集,至上峰值平稳后5l内停止收集。每批次发酵样品分2次纯化。
[0133]
6)层析后样品用100kd膜包、冷却注射用水进行透析,透析体积应不低于浓缩料液5倍体积,并在线检测透过液电导率应小于10μs/cm。多糖冻干过程中温度降至-45℃,6h;升华过程22℃,75h;解析干燥阶段,保温30℃,5h。冻干结束,应为白色疏松固体,即为纯化的肺炎球菌多糖。
[0134]
实施例13:肺炎球菌荚膜多糖的制备(血清型7f、14、17f、33f)
[0135]
1)原始种子,来自中国食品药品检定研究院中国医学菌种保藏中心。原始种子批视为0代,原始种子批传2代制备主代种子批,主代种子批传2代制备工作种子批,工作种子开启后至接种发酵罐培养传代次数为5代。
[0136]
2)用哥伦比亚血琼脂平板培养基开启工作菌种,置于37
±
1℃、10%co2以下条件下培养,24小时以内基本可形成菌苔。复苏后的菌种在液体培养基(约1l)中,37
±
1℃、4%~6%co2条件下扩增培养,12小时内逐渐形成浑浊的菌液。将培养的菌液接种于9l培养基中,放大培养。在100l发酵罐(90l培养基)、1000l发酵罐(900l培养)逐级放大培养,至对数生长期后期或稳定期前期,加入脱氧胆酸钠裂解菌体。
[0137]
发酵期间培养条件控制为:
[0138]
温度36~38℃,ph值在6.8~7.2之间,搅拌转速40~100转/分钟,通气量0.1~0.4v/v/m,发酵时间不超过10小时。20l发酵罐培养,菌液od
600
控制在0.9~1.5之间;100l发酵罐培养,菌液od
600
控制在0.9~1.5之间;1000l发酵罐培养,对数生长期后期或稳定期前期停止发酵。发酵过程中检测葡糖糖浓度及od值,通过调整葡萄糖补加速度,尽可能控制发酵液中葡萄糖浓度在10~20μg/ml,控制菌体浓度。
[0139]
3)在收获的培养液中加入脱氧胆酸钠溶液杀菌,脱氧胆酸钠终浓度为0.12%,灭活4小时以上;用醋酸溶液调ph值至5.0,静置沉淀杂质4小时以上;离心,上清液调ph值至6.9
±
0.2,用0.65um玻璃纤维滤芯澄清过滤后,用100kd膜包浓缩,用不少于20倍体积生的0.01mol/l磷酸(17f用0.01mol/l磷酸盐盐(含氯化钠))缓冲溶液进行超滤。
[0140]
4)用碳酸钠溶液调节料液ph值至7.2~7.6,加入十六烷基三甲基溴化铵(ctab)溶液,至ctab终浓度为1%,混合均匀后沉淀过夜,离心收集上清(7f、14、17f、33f为中性多糖,不与ctab沉淀,目标成分多糖在上清液内)。上清液加入碘化钠至终浓度为0.5%,混匀后静置沉淀1小时以上,离心,上清液经0.65um玻璃纤维材质滤芯澄清过滤后,用100kd膜包浓缩,用不少于20倍体积的0.005mol/l磷酸盐缓冲溶液进行超滤。
[0141]
5)层析介质为ii型羟基磷灰石(cht ii),0.005mol/l磷酸盐缓冲液作为平衡液,
纯化过程中,监测206nm吸收值,收集位置为起峰至峰值降至2/3高度前;每批次发酵样品分2次纯化。
[0142]
6)层析后样品用100kd膜包、冷却注射用水进行透析,透析体积应不低于浓缩料液5倍体积(33f型50倍体积),并在线检测透过液电导率应小于10μs/cm。多糖冻干过程中温度降至-45℃,6h;升华过程22℃,75h;解析干燥阶段,保温30℃,5h。冻干结束,应为白色疏松固体,即为纯化的肺炎球菌多糖。
[0143]
实施例14:23价肺炎球菌多糖疫苗的制备
[0144]
准确称取23种型别肺炎球菌多糖,并以适量0.01mol/l pbs溶液预溶解,搅拌使多糖充分溶解后补加pbs溶液,使各型多糖糖含量在50μg/ml。检测ph合格(合格标准:6.0~7.5)后以0.2μm孔径滤芯除菌过滤,过滤后分装于1ml预灌封注射器内,密封包装后即为23价肺炎多糖疫苗,所得疫苗规格0.5ml/支,各型别多糖含量均为25μg/剂。
[0145]
实施例15:多糖结构分析
[0146]
本发明所得的23个型别的肺炎球菌多糖核磁共振图谱(氢谱)与文献报道图谱一致,详见附图1。
[0147]
实施例16:多糖分子量
[0148]
本发明所得的23个型别的肺炎球菌多糖采用多角度激光散射-凝胶色谱联用仪(hpsec-malls)进行分子量检测,采用分子筛色谱柱,按分子大小进行分离,大分子先行分离出,通过激光光散射器与示差检测器连用检测。多角度激光散射图谱详见附图2,多糖重均分子量(mw)及多分散系数(mw/mn)详见下表。
[0149]
表11本发明所得的23个型别的肺炎球菌多糖重均分子量检测结果
[0150][0151][0152]
实施例17:23价肺炎多糖疫苗毒理学研究
[0153]
本发明所得的23价肺炎球菌多糖疫苗进行毒理学研究,开展单次给药毒性(急性毒性试验)、重复给药毒性、局部耐受性(局部刺激性试验)、抗原性(过敏试验)、免疫毒性五方面的研究,毒理学试验结果见下表。
[0154]
表12本发明所得的23价肺炎球菌多糖疫苗毒理学研究结果
[0155][0156]
实施例18:23价肺炎多糖疫苗免疫原性研究
[0157]
本发明所得的23价肺炎球菌多糖疫苗临床有效性试验受试对象为2岁及以上人群,分为2-6岁、7-17岁、18-50岁以及50岁及以上4个年龄组,选择美国默沙东公司生产的23价肺炎球菌多糖疫苗(纽莫法)做为阳性对照疫苗。
[0158]
给药途径及计量:接种23价肺炎球菌多糖疫苗,0.5ml/瓶,肌肉注射,接种1剂。
[0159]
接种疫苗后30天采血检测血清抗23种肺炎球菌多糖的特异性抗体阳转率和特异性抗体浓度(gmc)。23个型别肺炎球菌抗体阳转率,试验组非劣效于对照组;23个型别肺炎球菌免疫前后特异性抗体浓度(gmc)增长倍数,试验组非劣效于对照组,结果见下表。
[0160]
表13本发明所得的23价肺炎球菌多糖疫苗特异性抗体阳转率(%)
[0161][0162]
表14本发明所得的23价肺炎球菌多糖疫苗免疫前后特异性抗体浓度(gmc)增长倍数
[0163]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。