鉴定il-17途径的调节剂的方法
1.相关申请的交叉引用
2.本技术根据35u.s.c.
§
119(e)要求2020年4月30日提交的美国临时申请号63/017,960的优先权,其全部公开内容据此以引用方式并入本文。
技术领域
3.发明涉及用于鉴定调节il-17途径的药剂的方法、组合物和试剂盒。
背景技术:
4.白介素-17(il-17)是由活化的t辅助性17(th17)细胞、cd8 t细胞、γδt细胞、ilc3和nk细胞响应于细胞因子诸如il-23、il-1β和tgf-β而分泌的细胞因子。il-17调节介体的产生,该介体诸如来自多种细胞类型的抗微生物肽、促炎性细胞因子和趋化因子,该多种细胞类型包括参与炎症或宿主防御中的组织损伤的中性粒细胞和病理学的募集的成纤维细胞和滑膜细胞。il-17也与其他细胞因子(诸如tnf-α和il-iβ)协同作用,以增强促炎性环境。
5.由于其参与免疫调节功能,正在研究il-17的抑制剂作为自身免疫疾病诸如银屑病、银屑病性关节炎、强直性脊柱炎和多发性硬化症的可能治疗。银屑病是常见的慢性炎性皮肤病,其病因复杂,涉及遗传风险因素和环境触发因素。银屑病是由过度增生的角质细胞和浸润的活化免疫细胞之间的慢性相互作用引起的(harden j.等人,j autoimmun.2015;64:66-73)。il-17是银屑病中白介素-23(il-23)下游的促炎性细胞因子和主要介体。il-17直接作用于角质细胞以引起炎症反应,并且中和il-17或阻断其受体的抗体已成为银屑病患者的高效药物(ha h.-l.等人,proc.natl.acad.sci.u.s.a.2014;111(33):e3422-3431。虽然口服小分子il-17途径拮抗剂尚未进入后期临床试验,但它们仍然是有吸引力的发现领域,因为它们的开发可能会为许多无法获得生物制剂的患者拓宽治疗选择。因此,鉴定抑制il-17途径的小分子将为银屑病以及其他il-17驱动的自身免疫疾病提供治疗机会。
技术实现要素:
6.因此,需要开发鉴定il-17途径的抑制剂的方法。本发明通过提供用于鉴定调节il-17途径的药剂的组合物和方法来满足这种需要。
7.在一般方面,本文公开了鉴定调节il-17途径的药剂的方法。
8.在一些实施方案中,该方法包括:
9.a)使细胞与il-17,优选地il-17a,或t细胞条件培养基接触;
10.b)使细胞与药剂接触;
11.c)将细胞与il-17或t细胞条件培养基和药剂一起孵育;
12.d)在孵育步骤后收集细胞上清液;
13.e)检测细胞上清液中粒细胞集落刺激因子(g-csf)的水平;以及
14.f)将与药剂接触的细胞上清液中的g-csf水平与对照细胞上清液进行比较,其中
与对照细胞上清液相比,与药剂接触的细胞上清液中的g-csf水平的调节表明药剂能够调节il-17途径。
15.在某些实施方案中,在细胞与药剂接触后24小时收集细胞上清液。
16.在某些实施方案中,该方法还包括:
17.a)收集细胞;
18.b)在孵育步骤后,检测细胞中选自defb4a、s100a7a、saa2、ccl20、rnase7、saa4、il-23a、s100a12、defb103a、c15orf48、zc3h12a、saa1、sprr2b、prss22、cxcl1、il-36g、nfkbiz、il-8、plat、cxcl5、pdzk1ip1、rsad2、krt78、slc39a2、csf3、lcn2、sprr3、dhrs9、glul、rhcd、cxcl2、serpinb3和s100p的一个基因或一组基因的表达水平;
19.c)将与药剂接触的细胞的一个基因或一组基因的表达水平与对照细胞进行比较,其中与对照细胞相比,与药剂接触的细胞中一个或多个基因的表达水平的调节证实该药剂能够调节il-17途径。
20.在另一个实施方案中,该方法包括:
21.a)使细胞与il-17,优选地il-17a,或t细胞条件培养基接触;
22.b)使细胞与药剂接触;
23.c)将细胞与il-17或t细胞条件培养基和药剂一起孵育,优选地持续6至72小时;
24.d)在孵育步骤后收集细胞;
25.e)在孵育步骤后,检测细胞中选自defb4a、s100a7a、saa2、ccl20、rnase7、saa4、il-23a、s100a12、defb103a、c15orf48、zc3h12a、saa1、sprr2b、prss22、cxcl1、il-36g、nfkbiz、il-8、plat、cxcl5、pdzk1ip1、rsad2、krt78、slc39a2、csf3、lcn2、sprr3、dhrs9、glul、rhcd、cxcl2、serpinb3和s100p的一个基因或包含1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个或更多个基因的组的表达水平;以及
26.f)将与药剂接触的细胞的1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个或更多个基因的表达水平与对照细胞进行比较,其中与对照细胞相比,与药剂接触的细胞的一个或多个基因的表达水平的调节指示该药剂能够调节il-17途径。
27.在某些实施方案中,药剂选自小分子、多肽、抗体和多核苷酸。
28.在某些实施方案中,药剂具有1μm或更小的ic50。
29.在某些实施方案中,药剂是小分子调节剂,诸如il-17a抑制剂,优选地选自以下结构的il-17ai-1至6及其药学上可接受的盐:
30.[0031][0032]
在某些实施方案中,细胞是角质细胞或成纤维细胞,优选地人角质细胞。
[0033]
在另一个方面,本发明提供了用于鉴定il-17途径的调节剂的试剂盒,该试剂盒包括
[0034]
a)能够检测一组基因的一组探针,该组基因包含选自defb4a、s100a7a、saa2、ccl20、rnase7、saa4、il-23a、s100a12、defb103a、c15orf48、zc3h12a、saa1、sprr2b、prss22、cxcl1、il-36g、nfkbiz、il-8、plat、cxcl5、pdzk1ip1、rsad2、krt78、slc39a2、csf3、lcn2、sprr3、dhrs9、glul、rhcd、cxcl2、serpinb3和s100p的1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个或更多个基因;以及
[0035]
b)用于进行鉴定il-17途径调节剂的测定的说明书。
[0036]
在某些实施方案中,一组基因由defb4a、s100a7a、saa2、ccl20、rnase7、saa4、il-23a、s100a12、defb103a、c15orf48、zc3h12a、saa1、sprr2b、prss22、cxcl1、il-36g、nfkbiz、il-8、plat、cxcl5、pdzk1ip1、rsad2、krt78、slc39a2和csf3组成。
[0037]
在某些实施方案中,探针是寡核苷酸。
[0038]
根据以下公开内容,包括本发明的详细描述和其优选的实施方案以及所附权利要求书,本发明的其他方面、特征和优点将显而易见。
附图说明
[0039]
结合附图进行阅读时,能够更好地理解前述发明内容和以下对本专利申请的优选实施方案的详细说明。但是,应当理解,本专利申请不限于附图中示出的精确实施方案。
[0040]
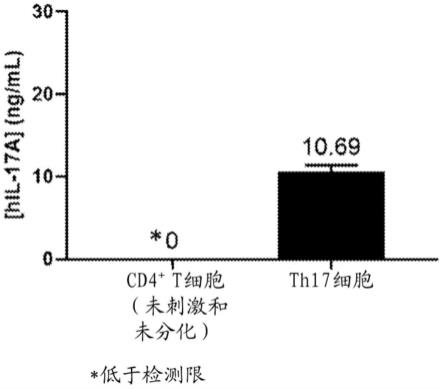
图1示出未刺激的和未分化的cd4 t细胞的培养基中以及来自th17细胞的条件培养基中的人il-17a的浓度。
[0041]
图2a-图2c示出在正常人角质细胞(nhk)中不存在和/或存在抑制剂化合物的情况
下重组人il-17(rhil-17a)刺激的结果。图2a和图2c示出nhk细胞的上清液中粒细胞集落刺激因子(g-csf)的水平(pg/ml)。图2b示出nhk细胞的活力百分比。
[0042]
图3a-图3p示出响应于rhil-17a刺激和各种剂量的抑制剂化合物的nhk细胞的g-csf水平和细胞活力。图3a-图3b:p38抑制剂(p38i),图3c-图3d:pak抑制剂,图3e-图3f:il-17a抑制剂1(il-17ai-1),图3g-图3h:il-17a抑制剂2(il-17ai-2),图3i-图3j:il-17a抑制剂3(il-17ai-3),图3k-图3l:il-17a抑制剂4(il-17ai-4),图3m-图3n:il-17a抑制剂5(il-17ai-5),以及图3o-图3p:il-17a抑制剂6(il-17ai-6)。
[0043]
图4a-图4b示出在正常人角质细胞(nhk)中不存在和/或存在抑制剂化合物的情况下th17细胞条件培养基刺激的结果。图4a示出上清液中的g-csf水平(pg/ml)。图4b示出抑制剂对th17刺激的g-csf从nhk产生的剂量依赖性抑制。
[0044]
图5a-图5b示出在不存在和/或存在抑制剂的情况下,在有或没有rhil-17刺激下,来自正常人角质细胞(nhk)的一组基因的基因表达。
[0045]
图6示出在不存在和/或存在抑制剂的情况下用标准组织培养基或th17细胞条件培养基治疗的来自正常人角质细胞(nhk)的一组基因的基因表达。
具体实施方式
[0046]
背景以及说明书全篇中引用或描述了各种出版物、文章和专利;这些参考文献中的每一者全文均以引用方式并入本文。本说明书中包括的对文件、行为、材料、装置、文章等的讨论旨在为本发明提供上下文。此类讨论并不是承认这些事项中的任一事项或全部事项均相对于所公开或受权利要求书保护的任何发明形成现有技术的一部分。
[0047]
除非另有定义,否则本文使用的所有技术和科学术语的含义与本发明所属领域的普通技术人员通常所理解的含义相同。否则,本文所用的某些术语具有本说明书中所述的含义。
[0048]
应该注意的是,除非上下文清楚地指明,否则如本文和所附权利要求中所用的单数形式
″
一个/一种
″
和
″
所述/该
″
包括复数引用物。
[0049]
除非另有说明,否则任何数值,例如本文所述的浓度或浓度范围,应理解为在所有情况下均由术语
″
约
″
修饰。因此,数值通常包括所述值的
±
10%。例如,1mg/ml的浓度包括0.9mg/ml至1.1mg/ml。同样,1%至10%(w/v)的浓度范围包括0.9%(w/v)至11%(w/v)。除非上下文另有明确指示,否则如本文所用,使用的数值范围明确地包括所有可能的子范围、该范围之内的所有单个数值,包括此类范围之内的整数和该范围之内的分数。
[0050]
除非另有说明,否则在一系列元素之前的术语
″
至少
″
应理解为指代系列中的每个元素。本领域的技术人员将会认识到、或仅使用常规实验就能够确定本文所述发明的具体实施方案的多种等同物。此类等同物旨在由本发明所涵盖。
[0051]
如本文所用,术语
″
包含
″
、
″
包括
″
、
″
具有
″
或
″
含有
″
或其任何其他变型应被理解为是指包括指定的整数或整数组,但不排除任何其他整数或整数组,并且是非排他性的或开放式的。例如,包含元素列表的组合物、混合物、过程、方法、制品或设备不一定仅限于那些元素,而是可以包括这些组合物、混合物、过程、方法、制品或设备未明确列出或固有的其他元素。此外,除非明确地指明相反,否则
″
或
″
是指包括性的
″
或
″
而不是排他性的
″
或
″
。例如,条件a或b由以下任一项满足:a为真(或存在)而b为假(或不存在),a为假(或不存在)而b为
真(或存在),以及a和b两者为真(或存在)。
[0052]
还应当理解,当提及优选发明的部件的尺寸或特性时,本文使用的
″
约
″
、
″
大约
″
、
″
大致
″
、
″
基本上
″
和类似的术语表示所描述的尺寸/特性不是严格的边界或参数,并且不排除在功能上相同或相似的微小变化,如本领域普通技术人员所理解的。至少,包括数值参数的这种参考将包括使用本领域已接受的数学和工业原理(例如,舍入、测量或其他系统误差、制造公差等)的变化,不会改变最低有效数字。
[0053]
如本文所用,同义地称为
″
核酸分子
″
、
″
核苷酸
″
或
″
核酸
″
的术语
″
多核苷酸
″
是指任何多核糖核苷酸或多脱氧核糖核苷酸,其可为未修饰的rna或dna或者修饰的rna或dna。
″
多核苷酸
″
包括但不限于单链和双链的dna、为单链区和双链区的混合物的dna、单链和双链的rna以及为单链区和双链区的混合物的rna、包含可为单链或更典型地为双链或者为单链区和双链区的混合物的dna和rna的杂合分子。此外,
″
多核苷酸
″
是指包含rna或dna或rna和dna两者的三链区。术语多核苷酸还包括含有一个或多个修饰的碱基的dna或rna,以及具有出于稳定性或其他原因而被修饰的主链的dna或rna。
″
修饰的
″
碱基包括例如三苯甲基化的碱基和稀有碱基诸如肌苷。可以对dna和rna进行多种修饰;因此,
″
多核苷酸
″
包括通常天然存在的多核苷酸的化学修饰、酶修饰或代谢修饰形式,以及病毒和细胞特有的dna和rna的化学形式。
″
多核苷酸
″
也包括相对短的核酸链,通常被称为寡核苷酸。
[0054]
如本文所用,术语
″
肽
″
、
″
多肽
″
或
″
蛋白质
″
可指由氨基酸组成的分子,并且可被本领域的技术人员识别为蛋白质。本文使用氨基酸残基的常规单字母或三字母代码。术语
″
肽
″
、
″
多肽
″
和
″
蛋白质
″
在本文中可互换使用,指任何长度的氨基酸的聚合物。该聚合物可为直链或支链的,其可包含经修饰的氨基酸,并且其可夹杂有非氨基酸。该术语还涵盖已被天然修饰或通过干预修饰的氨基酸聚合物;天然修饰或干预修饰为例如二硫键形成、糖基化、脂化、乙酰化、磷酸化或任何其他操作或修饰,诸如与标记组分缀合。该定义还包括例如含有一种或多种氨基酸类似物(包括例如非天然氨基酸等)以及本领域已知的其他修饰的多肽。
[0055]
如本文所用,术语
″
表达
″
是指基因产物的生物合成。该术语涵盖基因到rna的转录。该术语还涵盖rna到一个或多个多肽的翻译,并且还涵盖所有天然存在的转录后和翻译后修饰。表达的rna或多肽可处于细胞的细胞质内,处于胞外环境诸如细胞培养物的生长培养基中,或锚定至细胞膜。
[0056]
术语
″
基因表达水平
″
或
″
表达水平
″
是指样品或参考标准品中由给定基因编码的一种或多种产物(例如,rna、蛋白质)的水平(例如,量)。表达水平可为相对的或绝对的。
[0057]
如本文所用,术语
″
归一化(normalize或normalizing)
″
是指操纵离散表达水平数据的操纵,其中一个或多个测试基因的表达水平相对于一个或多个对照基因(诸如一个或多个管家基因)的表达水平或对照细胞中一个或多个相同基因的表达进行表述。例如,可从一个或多个测试基因的表达水平值中扣除一个或多个管家基因的表达水平值,从而允许多个样品之间的归一化标志物值或归一化标志物值与参考的比较。
[0058]
如本文所用,术语
″
管家基因
″
是指编码组成型表达并且是基本维持和必需细胞功能所需的转录物和/或蛋白质的基因。管家基因通常不以细胞或组织依赖性方式表达,最常由给定生物体中的所有细胞表达。管家蛋白质的一些示例包括b2m、tfrc、ywhaz、rplo、18s、gusb、ubc、tbp、gapdh、ppib、polr2a、actb、pgk1、hprt1、ipo8或hmbs等。
[0059]
为了帮助本技术的读者,已将说明书分成各个段落或章节,或者涉及本技术的各个实施方案。这些分割不应被认为是将段落或章节或实施方案的实质与另一段落或章节或实施方案的实质拆开。相反,本领域技术人员将理解,本说明书具有广泛的应用,并且涵盖可设想到的各个章节、段落和句子的所有组合。对任何实施方案的讨论仅意图是示例性的,并且不旨在表明本公开(包括权利要求书)的范围限于这些示例。
[0060]
如本文所用,
″
il-17
″
是指白介素17,包括所有家族成员il-17a、il-17b、il-17c、il-17d、il-17e和il-17f。il-17也被称为il17、ctla8或ctla-8。il-17是由一组被称为th17细胞的t辅助性细胞响应于用il-23刺激而产生的促炎性细胞因子。il-17家族的所有成员具有类似的蛋白质结构。il-17调节nf-κb和丝裂原活化蛋白激酶的活性。高水平的il-17与若干种慢性炎性疾病相关联,包括银屑病、银屑病性关节炎、强直性脊柱炎、类风湿性关节炎和多发性硬化症。
″
il-17
″
包括来自任何动物物种的il-17,以及il-17的重组产物。il-17可以是il-17的同源二聚体或il-17的异源二聚体。人il-17的示例性氨基酸序列在genbank登录号np_002181.1中表示,其可由核酸序列编码,诸如genbank登录号nm_002190.3中的核酸序列。
[0061]
如本文所用,
″
il-17途径
″
是指参与il-17信号传导和应答的任何组分,包括但不限于il-17、il-17受体和il-17诱导的基因和/或蛋白质。
[0062]
如本文所用,术语
″
调节剂
″
或
″
调节的药剂
″
是指可破坏、预防、抑制、中和、拮抗和/或干扰il-17、il-17受体或il-17途径的表达、活性和/或信号传导的任何药剂或分子。调节剂包括但不限于小分子、多肽、抗体和多核苷酸。调节剂的非限制性示例是抗il-17抗体苏金单抗(caligor coghlan,secaucus,nj)和抗il-17受体抗体柏达鲁单抗(caligor coghlan,secaucus,nj)。
[0063]
如本文所用,术语
″
小分子
″
或
″
sm
′′
是指分子量范围为约100g/mol至约1500g/mol的任何化合物。例如,小分子化合物可具有在400g/mol至约1050g/mol、或500g/mol至约1000g/mol、或约600g/mol至约900g/mol、或约300g/mol至约750g/mol、或约500g/mol至约800g/mol范围内的分子量。另选地,sm调节剂可具有在约100g/mol、或200g/mol、或约300g/mol、或约400g/mol、或约500g/mol、或约600g/mol的下限至约400g/mol、或约500g/mol、或约600g/mol、或约700g/mol、或约800g/mol、或约900g/mol、或约1000g/mol、或约1100g/mol、或约1200g/mol、或约1300g/mol、或约1400g/mol、或约1500g/mol的上限范围内的分子量。il-17的小分子调节剂的示例包括但不限于il-17a抑制剂(il-17ai),诸如本文所述的il-17ai-1至il-17ai-6,或其药学上可接受的盐。
[0064]
对于小分子,根据cahn-ingold-prelog r-s系统指定绝对立体化学。其中绝对构型是已知的手性中心通过使用标准顺序规则方法指定的前缀r和s描绘或标记,并且在必要时通过适当的位次优先(pure&appl.chem.45,1976,11-30)。某些示例含有被描绘或标记为(r*)或(s*)的化学结构。当(r*)或(s*)用于化合物的名称或化合物的化学表示中时,旨在表示该化合物是该立体中心处的纯单一异构体;然而,该立体中心的绝对构型尚未确定。因此,指定为(r*)的化合物是指在具有(r)或(s)的绝对构型的该立体中心处的纯单一异构体的化合物,并且指定为(s*)的化合物是指在具有(r)或(s)的绝对构型的该立体中心处的
纯单一异构体的化合物。例如,是指一种化合物,其是:
[0065][0066]
如本文所用,术语
″
抗体
″
广义地使用,并且包括免疫球蛋白或抗体分子,包括人抗体、人源化抗体、复合抗体和嵌合抗体以及单克隆或多克隆抗体片段。一般来讲,抗体是蛋白质或肽链,其对于特定抗原表现出结合特异性。抗体可来源于任何物种,并且例如可以是igm、igg(例如igg1、igg2、igg3或igg4)、igd、iga或ige。
[0067]
如本文所用,术语
″
抗原结合片段
″
是指抗体片段,诸如像,双抗体、fab、fab
′
、f(ab
′
)2、fv片段、二硫键稳定fv片段(dsfv)、(dsfv)2、双特异性dsfv(dsfv-dsfv
′
)、二硫键稳定双抗体(ds双抗体)、单链抗体分子(scfv)、单结构域抗体(sdab)、scfv二聚体(二价双抗体)、由包含一个或多个cdr的抗体的一部分形成的多特异性抗体、骆驼化单结构域抗体、纳米抗体、结构域抗体、二价结构域抗体或结合抗原但不包含完整抗体结构的任何其他抗体片段。
[0068]
如本文所用,
″
g-csf
″
或
″
gcsf
″
是指粒细胞集落刺激因子。它也被命名为csf3或c17orf33。粒细胞/巨噬细胞集落刺激因子是通过控制血液的2个相关白细胞群(粒细胞和单核细胞-巨噬细胞)的产生、分化和功能而在血细胞生成中起作用的细胞因子。il-17诱导基质细胞中g-csf的表达(fossiez等人,(1996)j exp med.183(6):2593-603)。
[0069]
本发明整体涉及鉴定调节il-17途径的药剂,并且提供可用于该目的的方法、组合物和试剂盒。
[0070]
方法
[0071]
根据一个特定方面,本文公开了鉴定调节白介素-17(il-17)途径的药剂的方法,该方法包括:
[0072]
a)使细胞与il-17,优选地il-17a,或t细胞条件培养基接触;
[0073]
b)使细胞与药剂接触;
[0074]
c)将细胞与il-17或t细胞条件培养基和药剂一起孵育;
[0075]
d)在孵育步骤后收集细胞上清液;
[0076]
e)检测细胞上清液中粒细胞集落刺激因子(g-csf)的水平;以及
[0077]
f)将与药剂接触的细胞上清液中的g-csf水平与对照细胞上清液进行比较,其中与对照细胞上清液相比,与药剂接触的细胞上清液中的g-csf水平的调节表明药剂能够调节il-17途径。
[0078]
在一个实施方案中,在细胞与药剂接触后6和72小时之间收集细胞上清液。优选地,在细胞与药剂接触后24小时收集细胞上清液。
[0079]
本文涵盖本领域可用的用于检测g-csf的水平的任何方法。例如,g-csf的水平可使用抗体来测量。抗体可以为标记的(例如,荧光标记的)或未标记的。另外,抗体可为游离于溶液中或固定的。
[0080]
在一个实施方案中,g-csf的水平使用均相时间分辨荧光测定(htrf)来测量。该技术将荧光共振能量转移技术(fret)与时间分辨测量(tr)相结合。例如,使用不同的特异性抗体以夹心测定形式检测g-csf,一种用eu
3 -穴状化合物(供体)标记,并且第二种用d2(受体)标记。当染料紧密接近时,用光源(激光或闪光灯)激发供体触发朝向受体的荧光共振能量转移(fret),该受体继而以特定波长发出荧光。两种缀合物与样品中存在的抗原结合,从而生成fret。信号强度与所形成的抗原-抗体复合物的数量成比例,并且因此与g-csf浓度成比例。
[0081]
在某些实施方案中,药剂降低细胞上清液中g-csf的水平。
[0082]
在一个实施方案中,该方法还包括a)收集细胞;b)在孵育步骤后,检测细胞中选自defb4a、s100a7a、saa2、ccl20、rnase7、saa4、il-23a、s100a12、defb103a、c15orf48、zc3h12a、saa1、sprr2b、prss22、cxcl1、il-36g、nfkbiz、il-8、plat、cxcl5、pdzk1ip1、rsad2、krt78、slc39a2、csf3、lcn2、sprr3、dhrs9、glul、rhcd、cxcl2、serpinb3和s100p的一个基因或一组基因的表达水平;c)将与药剂接触的细胞的一个基因或一组基因的表达水平与对照细胞进行比较,其中与对照细胞相比,与药剂接触的细胞中一个或多个基因的表达水平的调节证实该药剂能够调节il-17途径。
[0083]
本文涵盖本领域可用的用于检测基因或一组基因的表达的任何方法。在某些实施方案中,在核酸(例如,rna)水平上检测基因。例如,测量样品中存在的rna(例如,mrna)的量(例如,以确定表达的水平)。因此,
″
检测表达
″
涵盖其中基因被确定为不表达、不被可检测地表达、以低水平表达、以正常水平表达或过表达的情况。核酸(例如,rna、扩增cdna等)可以使用本领域普通技术人员已知的多种核酸技术进行检测/定量,包括但不限于核酸杂交和核酸扩增。样品中的mrna表达可使用northern印迹或原位杂交、rna酶保护测定、微阵列或基于pcr的方法(诸如逆转录聚合酶链式反应(rt-pcr),任选地随后是定量pcr(qpcr))来定量。rt-pcr步骤通常使用特异性引物、随机六聚体、或低聚-dt引物来引发,这取决于表达谱的环境和目标。
[0084]
也可使用微阵列或rna测序(rnaseq)来分析基因表达的水平,该微阵列或rna测序使用可商购获得的平台,诸如来自luminex、affymetrix、illumina和agilent的那些。例如,quantigene plex基因表达测定(thermofisher;waltham,ma)使用靶特异性探针组的杂交,并且然后使用具有标记探针的分支dna技术实现信号扩增。在最后步骤中,添加链霉亲和素藻红蛋白(sape)产生与样品中存在的靶rna的量成比例的信号。使用luminex仪器读取信号。
[0085]
如本文所用,
″
探针
″
是指能够选择性地结合预期靶生物分子的任何分子或试剂。靶分子可以是基因,例如,对应于基因的核苷酸转录物。根据本公开,探针可由本领域的技术人员合成,或来源于适当的生物制剂。探针可经过专门设计以进行标记。可用作探针的分子的示例包括但不限于核酸(诸如与基因或mrna杂交的寡核苷酸)、蛋白质、肽、抗体、适体、
亲和体和有机分子。
[0086]
在另一个方面,本文公开了鉴定调节白介素-17(il-17)途径的药剂的方法,该方法包括:
[0087]
a)使细胞与il-17或t细胞条件培养基接触;
[0088]
b)使细胞与药剂接触;
[0089]
c)将细胞与il-17或t细胞条件培养基和药剂一起孵育,优选地持续6至72小时;
[0090]
d)在孵育步骤后收集细胞;
[0091]
e)在孵育步骤后,测量细胞中选自defb4a、s100a7a、saa2、ccl20、rnase7、saa4、il-23a、s100a12、defb103a、c15orf48、zc3h12a、saa1、sprr2b、prss22、cxcl1、il-36g、nfkbiz、il-8、plat、cxcl5、pdzk1ip1、rsad2、krt78、slc39a2、csf3、lcn2、sprr3、dhrs9、glul、rhcd、cxcl2、serpinb3和s100p的一个基因或包含1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个或更多个基因的组的表达水平;以及
[0092]
f)将与药剂接触的细胞的1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个或更多个基因的表达水平与对照细胞进行比较,其中与对照细胞相比,与药剂接触的细胞的一个或多个基因的表达水平的调节指示该药剂能够调节il-17途径。
[0093]
在某些实施方案中,该方法包括使细胞与il-17和药剂顺序地接触。在其他实施方案中,该方法包括使细胞与il-17和药剂同时接触。例如,il-17和药剂可以在接触细胞之前组合并孵育。
[0094]
在某些实施方案中,il-17是重组il-17,优选地重组人il-17;更优选地重组人il-17a。在一个实施方案中,该方法包括使细胞与0.2ng/ml至200ng/ml il-17接触。优选地,该方法包括使细胞与5ng/ml il-17接触。
[0095]
在某些实施方案中,t细胞条件培养基是th17细胞条件培养基。在某些实施方案中,th17条件培养基包含il-17,优选地il-17a。
[0096]
在某些实施方案中,药剂选自小分子、多肽、抗体和多核苷酸。在该方法中可以使用维持细胞活力的任何浓度的药剂。可以使用本领域普通技术人员已知的多种技术(诸如本文所例示的那些技术)来测量待使用的药剂的浓度和细胞活力。
[0097]
本文使用的示例性il-17的小分子调节剂包括但不限于下表1中列出的il-17a抑制剂il-17ai-1至il-17ai-6及其药学上可接受的盐:
[0098]
表1.示例性il-17a的小分子调节剂
[0099][0100][0101]
以下化合物:
[0102]
公开于liu,s.等人,
″
binding site elucidation and structure guided design of macrocyclic il-17a antagonists
″
,scientific reports,6 30859,doi:10.1038/srep30859(2016)中。该化合物被制备为非对映异构体的混合物,通过超临界流体色谱(sfc)分离(色谱柱:daicel chiralpak ad(250mm*30mm,10um);流动相:[0.1%nh3h2o ipa];b%:40%-40%,5.3分钟;420分钟)。使用本文公开的方法来评估更有效的非对映异构体,本文指定为il-17ai-1:
[0103]
调节剂il-17ai-2和il-17ai-3公开于美国临时申请号63/017682中,该申请以引用方式并入本文。
[0104]
调节剂il-17ai-4和il-17ai-5公开于美国临时申请号63/017679中,该申请以引用方式并入本文。
[0105]
调节剂il-17ai-6公开于名称为
″
macrocyclic compounds for modulating il-17
″
的pct专利申请公布号wo 2013/116682中,该申请以引用方式并入本文(参见例如化合物479)。
[0106]
在某些实施方案中,药剂具有1μm或更小的ic50。半数最大抑制浓度(ic50)是物质抑制特定生物或生物化学功能的有效性的量度。这种定量测量指示需要多少特定物质来将给定的生物过程抑制一半,并且是本领域中常用的。鉴于本公开,可用本领域已知的方法测定ic50。它可以用功能测定或用竞争结合测定来确定。在某些实施方案中,ic50是在体外将il-17诱导的g-csf从细胞分泌抑制50%所需的药剂浓度。
[0107]
在某些实施方案中,药剂是小分子调节剂,该小分子调节剂选自具有以下结构的il-17ai-1至6及其药学上可接受的盐:
[0108]
[0109][0110]
在一个实施方案中,在孵育步骤中,将细胞与il-17和药剂一起孵育6至72小时。优选地,在孵育步骤中,将细胞与il-17和药剂一起孵育24小时。
[0111]
在某些实施方案中,细胞是人细胞。在一个实施方案中,细胞是成纤维细胞或角质细胞;优选地人角质细胞。在某些实施方案中,该方法还包括在使细胞与il-17接触之前使人角质细胞在角质细胞生长培养基中生长,直至达到约70%-90%汇合。
[0112]
在某些实施方案中,对照细胞是在不添加化合物的情况下与il-17接触的细胞。
[0113]
在某些实施方案中,一组基因包含细胞中选自defb4a、s100a7a、saa2、ccl20、rnase7、saa4、il-23a、s100a12、defb103a、c15orf48、zc3h12a、saa1、sprr2b、prss22、cxcl1、il-36g、nfkbiz、il-8、plat、cxcl5、pdzk1ip1、rsad2、krt78、slc39a2、csf3、lcn2、sprr3、dhrs9、glul、rhcd、cxcl2、serpinb3和s100p的1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个或更多个基因。在一个实施方案中,一组基因由defb4a、s100a7a、saa2、ccl20、rnase7、saa4、il-23a、s100a12、defb103a、c15orf48、zc3h12a、saa1、sprr2b、prss22、cxcl1、il-36g、nfkbiz、il-8、plat、cxcl5、pdzk1ip1、rsad2、krt78、slc39a2和csf3组成。
[0114]
试剂盒
[0115]
在另一个方面,本发明涉及用于鉴定il-17途径的调节剂的试剂盒。
[0116]
如本文所用,术语
″
试剂盒
″
是指试剂和其他材料的组合。预期试剂盒可包括试剂,诸如缓冲剂、蛋白质稳定试剂、信号产生系统(例如,荧光信号生成系统)、抗体、对照蛋白以及测试容器(例如,微量滴定板等)。术语
″
试剂盒
″
不旨在限于试剂和/或其它材料的特定组合。在一个实施方案中,该试剂盒包括使用说明书。测试试剂盒可以任何合适的方式包装,通常根据需要用单个容器或各种容器中的元件包装,以及用用于进行测试的说明书包装。在一些实施方案中,该试剂盒还优选地包括阳性对照样品。可以以本领域已知的多种方式生产试剂盒。
[0117]
在一个实施方案中,该试剂盒包括a)能够检测一组基因的一组探针,该组基因包含选自defb4a、s100a7a、saa2、ccl20、rnase7、saa4、il-23a、s100a12、defb103a、c15orf48、zc3h12a、saa1、sprr2b、prss22、cxcl1、il-36g、nfkbiz、il-8、plat、cxcl5、pdzk1ip1、rsad2、krt78、slc39a2、csf3、lcn2、sprr3、dhrs9、glul、rhcd、cxcl2、serpinb3和s100p的2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个或更多个基因;以及b)用于进行鉴定il-17途径调节剂的测定的说明书。在某些实施方案中,一组基因由defb4a、s100a7a、saa2、ccl20、rnase7、saa4、il-23a、s100a12、defb103a、c15orf48、zc3h12a、saa1、sprr2b、prss22、cxcl1、il-36g、nfkbiz、il-8、plat、cxcl5、pdzk1ip1、rsad2、krt78、slc39a2和csf3组成。
[0118]
任何组合物可以试剂盒或试剂混合物的形式提供。例如,标记探针可在用于检测一组基因的试剂盒中提供。在某些实施方案中,探针是寡核苷酸。试剂盒可包括测定所必需或足够的所有组分,其可包括但不限于检测试剂(例如,探针)、缓冲液、对照试剂(例如,阳性和阴性对照)、扩增试剂、固体载体、标签、说明书手册等。
[0119]
在另一个方面,本发明涉及本发明的试剂盒在如本文所述的本发明的任何方法中的用途。
[0120]
实施方案
[0121]
本发明还提供以下非限制性实施方案。
[0122]
实施方案1为一种鉴定调节白介素-17(il-17)途径的药剂的方法,该方法包括:
[0123]
a)使细胞与il-17或t细胞条件培养基,优选地il-17a接触;
[0124]
b)使细胞与药剂接触;
[0125]
c)将细胞与il-17或t细胞条件培养基和药剂一起孵育;
[0126]
d)在孵育步骤后收集细胞上清液;
[0127]
e)检测细胞上清液中粒细胞集落刺激因子(g-csf)的水平;以及
[0128]
f)将与药剂接触的细胞上清液中的g-csf水平与对照细胞上清液进行比较,其中与对照细胞上清液相比,与药剂接触的细胞上清液中的g-csf水平的调节表明药剂能够调节il-17途径。
[0129]
实施方案2为根据实施方案1所述的方法,其中在细胞与药剂接触后6和72小时之间收集细胞上清液;优选地,在接触细胞后24小时。
[0130]
实施方案3为根据实施方案1或2所述的方法,其中g-csf的水平使用抗体来测量。
[0131]
实施方案4为根据实施方案1至3中任一项所述的方法,其中g-csf的水平使用均相时间分辨荧光测定来测量。
[0132]
实施方案5为根据实施方案1至4中任一项所述的方法,其中药剂降低细胞上清液中g-csf的水平。
[0133]
实施方案6为根据实施方案1至5中任一项所述的方法,还包括
[0134]
a)收集细胞;
[0135]
b)在孵育步骤后,检测细胞中选自defb4a、s100a7a、saa2、ccl20、rnase7、saa4、il-23a、s100a12、defb103a、c15orf48、zc3h12a、saa1、sprr2b、prss22、cxcl1、il-36g、nfkbiz、il-8、plat、cxcl5、pdzk1ip1、rsad2、krt78、slc39a2、csf3、lcn2、sprr3、dhrs9、glul、rhcd、cxcl2、serpinb3和s100p的一个基因或一组基因的表达水平;
[0136]
c)将与药剂接触的细胞的一个基因或一组基因的表达水平与对照细胞进行比较,其中与对照细胞相比,与药剂接触的细胞中一个或多个基因的表达水平的调节证实该药剂能够调节il-17途径。
[0137]
实施方案7为一种鉴定调节白介素-17(il-17)途径的药剂的方法,该方法包括:
[0138]
a)使细胞与il-17或t细胞条件培养基接触;
[0139]
b)使细胞与药剂接触;
[0140]
c)将细胞与il-17或t细胞条件培养基和药剂一起孵育,优选地持续6至72小时;
[0141]
d)在孵育步骤后收集细胞;
[0142]
e)在孵育步骤后,检测细胞中选自defb4a、s100a7a、saa2、ccl20、rnase7、saa4、il-23a、s100a12、defb103a、c15orf48、zc3h12a、saa1、sprr2b、prss22、cxcl1、il-36g、nfkbiz、il-8、plat、cxcl5、pdzk1ip1、rsad2、krt78、slc39a2、csf3、lcn2、sprr3、dhrs9、glul、rhcd、cxcl2、serpinb3和s100p的一个基因或包含1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个或更多个基因的组的表达水平;以及
[0143]
f)将与药剂接触的细胞的1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个或更多个基因的表达水平与对照细胞进行比较,其中与对照细胞相比,与药剂接触的细胞的一个或多个基因的表达水平的调节指示该药剂能够调节il-17途径。
[0144]
实施方案8为根据实施方案1至7中任一项所述的方法,其中该方法包括使细胞与
il-17和药剂顺序地接触。
[0145]
实施方案9为根据实施方案1至7中任一项所述的方法,其中该方法包括使细胞与il-17和药剂同时接触。
[0146]
实施方案10为根据权利要求1至9中任一项所述的方法,其中il-17是重组il-17,优选地重组人il-17;更优选地重组人il-17a。
[0147]
实施方案11为根据实施方案1至9中一项所述的方法,其中t细胞条件培养基是t辅助性17(th17)细胞条件培养基。
[0148]
实施方案12为根据权利要求1至10中任一项所述的方法,其中该方法包括使细胞与0.2ng/ml至200ng/ml il-17接触;优选地,该方法包括使细胞与5ng/ml il-17接触。
[0149]
实施方案13为根据实施方案1至12中任一项所述的方法,其中药剂选自小分子、多肽、抗体和多核苷酸。
[0150]
实施方案13a为根据实施方案1至12中任一项所述的方法,其中药剂是小分子或抗体。
[0151]
实施方案13a为根据实施方案1至12中任一项所述的方法,其中药剂是小分子或抗体。
[0152]
实施方案13b为根据实施方案13a所述的方法,其中药剂是小分子。
[0153]
实施方案13c为根据实施方案13a所述的方法,其中药剂是抗体。
[0154]
实施方案14为根据实施方案13至13c中任一项所述的方法,其中药剂具有1μm或更小的ic50。
[0155]
实施方案15为根据实施方案所述13的方法,其中药剂是小分子调节剂,诸如il-17a抑制剂,优选地选自以下结构的il-17ai-1至6及其药学上可接受的盐:
[0156]
[0157]
[0158][0159]
实施方案16为根据实施方案1至15中任一项所述的方法,其中细胞在孵育步骤中与il-17或t细胞条件培养基和药剂一起孵育6至72小时。
[0160]
实施方案17为根据实施方案1至16中任一项所述的方法,其中细胞是人细胞。
[0161]
实施方案18为根据实施方案1至17中任一项所述的方法,其中细胞是角质细胞或成纤维细胞,优选地人角质细胞。
[0162]
实施方案19为根据实施方案18所述的方法,其中该方法还包括在使细胞与il-17或t细胞条件培养基接触之前使人角质细胞在角质细胞生长培养基中生长,直至达到约70%-90%汇合。
[0163]
实施方案20为根据实施方案6至19中任一项所述的方法,其中一组基因由defb4a、s100a7a、saa2、ccl20、rnase7、saa4、il-23a、s100a12、defb103a、c15orf48、zc3h12a、saa1、sprr2b、prss22、cxcl1、il-36g、nfkbiz、il-8、plat、cxcl5、pdzk1ip1、rsad2、krt78、slc39a2和csf3组成。
[0164]
实施方案21为一种用于鉴定il-17途径的调节剂的试剂盒,该试剂盒包括
[0165]
a)能够检测一组基因的一组探针,一组基因包含选自defb4a、s100a7a、saa2、ccl20、rnase7、saa4、il-23a、s100a12、defb103a、c15orf48、zc3h12a、saa1、sprr2b、prss22、cxcl1、il-36g、nfkbiz、il-8、plat、cxcl5、pdzk1ip1、rsad2、krt78、slc39a2、csf3、lcn2、
[0166]
sprr3、dhrs9、glul、rhcd、cxcl2、serpinb3和s100p的2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个或更多个基因;以及
[0167]
b)用于进行鉴定il-17途径调节剂的测定的说明书。
[0168]
实施方案22为根据实施方案21所述的试剂盒,其中一组基因由defb4a、s100a7a、saa2、ccl20、rnase7、saa4、il-23a、s100a12、defb103a、c15orf48、zc3h12a、saa1、sprr2b、prss22、cxcl1、il-36g、nfkbiz、il-8、plat、cxcl5、pdzk1ip1、rsad2、krt78、slc39a2和csf3组成。
[0169]
实施方案23为根据实施方案21或22所述的试剂盒,其中探针是寡核苷酸,诸如用检测剂标记的寡核苷酸。
[0170]
实施方案24为根据实施方案21至23中任一项所述的试剂盒在根据权利要求6至20中任一项所述的方法中的用途。
[0171]
实施例
[0172]
实施例1:用rhil-17a刺激或th17条件培养基刺激的nhk测定
[0173]
为了测试il-17途径的潜在调节剂,将正常人角质细胞(nhk)与重组il-17a或th17条件培养基和潜在抑制剂化合物一起孵育,然后如下详细所述测量细胞上清液中粒细胞集落刺激因子(g-csf)的水平。
[0174]
th17条件培养基制备
[0175]
使用sepmate管(stemcell technologies,85450),使用ficoll-paque密度梯度离心(ficoll-paque,ge,17-1440-03)从人全血中分离外周血单核细胞(pbmc)。然后按照供应商方案(miltenyi biotec,130-096-533),通过人工磁性标记和细胞分离(ls柱,miltenyi biotec,130-042-401)分离cd4 t细胞。在补充有10%fbs、青霉素-链霉素(sigma,p0781-100ml)、l-谷氨酰胺(sigma,g7513-100ml)和2-巯基乙醇(gibco,21985-023)的500μl的rpmi培养基(rpmi 1640,hyclone,sh30096.01)中,以2
×
106个细胞/ml将cd4 t细胞接种在24孔板上。在rpmi培养基中制备th17极化培养基,并且向每个孔中添加250μl,最终浓度为:使用t细胞活化/扩增试剂盒(miltenyi biotec,130-091-441)以每孔2x细胞数制备的抗cd3/抗cd28小珠,抗人白介素-4(il-4)[10ug/ml]、抗人干扰素γ(ifnγ)[10ug/ml]抗体(thermofisher,16-7048-85,16-7318-85)、人il-2[60u/ml](pepro tech,200-02)、人il-1β[10ng/ml]、人il-23[10ng/ml]、人il-6[50ng/ml]和人tgfβ[12ng/ml](r&d systems,201-lb-010、1290-il-010、206-il-010、240-b-010)。在37℃下用5%co2孵育四天后,收集并合并板中的细胞培养基,并且将其在nhk测定中用作th17条件培养基。按照供应商方案(r&d systems,dy317-05,dy5194-05,dy1335b-05)使用duoset elisa试剂盒测定th17条件培养基中的人il-17a的水平。在th17条件培养基中检测到人il-17a,而未刺激、未分化的cd4 t细胞在上清液中没有可检测水平的il-17a(图1)。
[0176]
nhk处理
[0177]
将正常人角质细胞(lonza,basel,switzerland)在烧瓶中在角质细胞生长培养基(kgm-gold bullet kit,lonza)中在37℃下用5%co2在潮湿气氛中培养。将细胞以14,000个细胞/孔接种于96孔板细胞培养板以用于转录组学分析,或以3个细胞/孔至4,000个细胞/孔接种于384孔板以用于ic50测定。在接种后,将板在37℃下用5%co2孵育24小时。
[0178]
在第2天,去除细胞板的每个孔中的培养基,并用补充有5%胎牛血清(fbs)的新鲜kgm培养基替换。接下来,工作浓度的重组人il-17a(gibco;gaithersburg,md)或含有il-17a的th17条件培养基在kgm中用5%fbs制备。将il-17a或th17条件培养基与滴定的化合物(在nhk g-csf测定中用于ic50测定的7种浓度,以及在表2中显示的quantigene的选定浓度)或dmso在室温下预孵育1小时,然后添加到细胞培养板中,每孔最终体积对于96孔板为200μl,并且对于384孔板为100μl。重组il-17a的最终浓度为5ng/ml,并且th17条件培养基中il-17a的最终浓度为3ng/ml-4ng/ml,并且培养物中dmso为0.2%。对于未刺激的对照物,用仅含0.2%dmso的培养基治疗细胞。
[0179]
表2
[0180]
[0181][0182]
1.liu s等人,binding site elucidation and structure guided design of macrocyclic il-17a antagonists.sci rep.2016年8月16日,6:30859。
[0183]
2.p38丝裂原活化蛋白激酶抑制剂,sigma aldrich,目录号:sml2212-5mg
[0184]
3.p21-活化激酶(pak)抑制剂,sigma aldrich,目录号:5006130001
[0185]
4.wadsworth sa、cavender de、beers sa、lalan p、schafer ph、malloy ea等人,rwj 67657,a potent,orally active inhibitor of p38 mitogen-activated protein kinase.pharmacol exp ther 1999,291:680-687。
[0186]
5.lps刺激的hpbmc对tnfa分泌的抑制
[0187]
6.lps刺激的hpbmc对il-1β分泌的抑制
[0188]
7.murray bw等人,small-molecule p21-activated kinase inhibitor pf-3758309is a potent inhibitor of oncogenic signaling and tumor growth.proc natl acad sci u s a.,2010年5月18日,107(20):9446-51
[0189]
8.来自使用肽底物的酶测定的pak1激酶结构域的ki
[0190]
9.来自使用肽底物的酶测定的pak2激酶结构域的ic50
[0191]
10.来自使用肽底物的酶测定的pak3激酶结构域的ic50
[0192]
11.由等温量热分析和表面等离子体共振确定pak4的kd
[0193]
12.来自使用肽底物的酶测定的pak5激酶结构域的ki
[0194]
13.来自使用肽底物的酶测定的pak5激酶结构域的ki
[0195]
14.来自rhil-17a刺激的nhk测定的数据
[0196]
15.来自th17条件培养基刺激nhk的数据
[0197]
在过夜培养后,小心收集细胞上清液以用于g-csf检测,并进一步分析细胞的活力或基因表达。
[0198]
检测g-csf
[0199]
使用人g-csf均相时间分辨荧光(htrf)测定试剂盒(cisbio,目录号63adk055pebl;codolet,france)根据制造商的方案测量g-csf水平。使用不同的特异性抗
体以夹心测定形式检测g-csf,一种用eu3 -穴状化合物(供体)标记,并且第二种用d2(受体)标记。当染料紧密接近时,用光源(激光或闪光灯)激发供体触发朝向受体的荧光共振能量转移(fret),该受体继而以特定波长(665nm)发出荧光。两种缀合物与样品中存在的抗原结合,从而生成fret。信号强度与所形成的抗原-抗体复合物的数量成比例,并且因此与g-csf浓度成比例。
[0200]
简言之,向低体积384孔htrf板的每个孔中添加16μl的标准品或样品(cisbio,目录号66pl384100)。然后添加4μl的含有抗g-csf-d2缀合物和抗gcsf-eu 穴状化合物缀合物的工作抗体溶液。将板在室温下孵育过夜。接下来,使用读板器在两个不同波长(665nm和620nm)下读取荧光发射。然后将每个孔的htrf比率计算为[(665nm处的信号/620nm处的信号)
×
10,000]。然后将δf%计算为[((标准品或样品比率-背景比率)/背景比率)
×
100]。为每个板生成标准曲线,并通过使用graphpad prism 7.0版软件利用四参数逻辑(4-pl)曲线拟合来分析数据。
[0201]
检测细胞活力
[0202]
为了测试用il-17或化合物治疗是否影响细胞活力,用celltiter-发光细胞活力测定(promega;madison,wi)根据制造商的方案测试细胞。
[0203]
在重构之前,在室温下平衡底物小瓶和缓冲溶液。通过向底物小瓶中添加适当体积的缓冲液来重构冻干的底物溶液。在短暂混合后,将等体积的重构试剂添加到含有细胞的板的每个孔中的培养基体积中。将板短暂振荡以混合并在室温下孵育10分钟,然后使用envision读板器读取发光信号。
[0204]
百分比细胞活力被计算为:
[0205]
%活力=((样品rlu/无刺激平均值,rlu)*100)。
[0206]
如图2a和图2c所示,与未刺激的细胞相比,il-17a刺激了nhk细胞中g-csf的产生。尽管p38抑制剂和pak抑制剂不抑制il-17刺激的g-csf产生,但il-17ai-1大环抑制剂、il-17受体单克隆抗体和il-17单克隆抗体在所有测试浓度下抑制g-csf产生(图2a)。此外,全部具有不同结构的小分子抑制剂il-17ai-2至il-17ai-6在所有测试浓度下都能够抑制g-csf产生(图2c)。用抗体同型对照物的治疗没有导致g-csf产生的抑制。如图2b所示,il-17a刺激不影响细胞活力。最高剂量的20μm pak抑制剂对细胞具有毒性,这也减少了g-csf产生,但其他测试浓度是良好耐受的,如图2b所示。其他化合物在测试浓度下不引起细胞毒性。这些结果证实,il-17抑制剂减少g-csf产生不是由细胞毒性引起的。
[0207]
图3a至图3f示出p38抑制剂(图3a至图3b)、pak抑制剂(图3c至图3d)、il-17ai-1(图3e至图3f)、il-17ai-2(图3g至图3h)、il-17ai-3(图3i至图3j)、il-17ai-4(图3k至图3l)、il-17ai-5(图3m至图3n)和il-17ai-6(图3o至图3p)的剂量依赖性g-csf水平和对应细胞活力。这些结果证明il-17a抑制剂以剂量依赖性方式减少g-csf产生,而p38抑制剂不抑制g-csf水平。pak抑制剂显示出对g-csf产生的一些剂量依赖性抑制,与il-17a抑制剂相比,其效力低得多。
[0208]
图4a示出th17条件培养基也刺激nhk细胞的培养基中的g-csf表达,而il-17受体单克隆抗体和il-17单克隆抗体抑制g-csf产生。图4b示出两种抗体对g-csf产生的抑制是剂量依赖性的。这些结果证明th17条件培养基刺激的g-csf产生也可用于测试il-17途径的调节剂。
[0209]
实施例2:il-17a基因组的转录组学分析
[0210]
鉴定了一组il-17a刺激的基因,最初通过微阵列实验,后来通过rt-pcr证实,以评估il-17途径的调节剂,如表2所示。在用人重组il-17a和如实施例1中描述的化合物治疗的人角质细胞中,使用plex基因表达测定测量组中基因的表达水平。为表2中所示的37个基因设计杂交探针。
[0211]
表2
[0212]
[0213][0214]
在有和没有化合物的情况下与il-17a孵育24小时后,将50μl裂解缓冲液(quantigene,thermofisher)添加到含有100μl细胞的每个孔中。将板覆盖并在设置为50℃-55℃,170rpm的vortemp中孵育30分钟以裂解细胞。然后将板在-80℃下保持冷冻。在quantigene实验的当天,制备样品和试剂并根据制造商的方案(quantigene,thermofisher)进行测定。在最后步骤中,在luminex仪器(luminex;austin,tx)上读取样品板的荧光强度信号。
[0215]
样品(s)中给定基因(g)的原始表达值被定量为对应探针的原始荧光强度的中值。每个样品s的归一化因子由四个管家基因actb、gapdh、hprt1和ppib的原始表达确定,作为样品s中四个管家基因的几何平均值(几何平均数)与所有样品中四个管家基因的几何平均数的比率。样品s中每个基因的归一化表达值进一步定量为原始表达值除以样品s中的归一化因子。
[0216]
将响应于il-17a刺激的角质细胞中基因g表达的变化计算为其在il-17a刺激的样品中的归一化表达值的几何平均数与未刺激的样品中的归一化表达值的几何平均数的比率。对于每个基因g,样品s中的相对表达值(rel_exp_s)通过其在样品s中的归一化表达(norm_exp_s)以及其在il-17a刺激的样品(gm_norm_exp_stim)和未刺激的样品(gm_norm_exp_unstim)中的归一化表达的几何平均数来进一步确定,使用如下公式:rel_exp_s=(norm_exp_s-gm_norm_exp_unstim)/(gm_norm_exp_stim-gm_norm_exp_unstim)。对于给定的化合物或抗体,在所有il-17a诱导的基因中(倍数变化>1.5),基因表达诱导的%抑制计算为(1-相对表达的平均值)
×
100。
[0217]
图5a和图5b示出用重组il-17a刺激的nhk中一组基因的基因表达水平的热图。小分子调节剂il-17ai-1至il-17ai-6、柏达鲁单抗和苏金单抗全部以剂量依赖性方式抑制基因组的表达,证明该基因组可用于鉴定il-17或il-17受体的调节剂。此外,柏达鲁单抗和苏金单抗的同种型对照物没有显示出对基因表达的抑制,证实了这些变化对柏达鲁单抗或苏
金单抗治疗是特异性的。p38和pak抑制剂的治疗没有导致基因组表达的总体减少,相反,它们显示了增强一些基因和抑制其他基因的混合效应,证明该il-17基因组可以将il-17活化的下游的靶标的抑制剂与上游的那些靶标的抑制剂如苏金单抗(抗il-17a)和柏达鲁单抗(抗il-17受体)区分开,并且可用于鉴定il-17途径特异性调节剂。
[0218]
图6示出用th17条件培养基刺激的nhk中一组基因的基因表达水平的热图。热图证明th17条件培养基刺激一组基因,并且柏达鲁单抗和苏金单抗以剂量依赖性方式抑制该组基因的表达。此外,柏达鲁单抗和苏金单抗的同种型对照物没有显示出对基因表达的抑制,证实了这些变化对柏达鲁单抗或苏金单抗治疗是特异性的。
[0219]
本领域的技术人员应当理解,在不脱离本发明的广义的发明构思的情况下,可对上述实施方案作出修改。因此,应当理解,本发明不局限于所公开的特定实施方案,但本发明旨在涵盖在本发明实质和范围内的修改,如本说明书所定义。
[0220]
本文引用的所有文献均以引用方式并入本文。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。