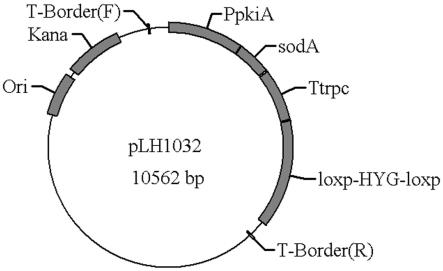
no.2;所述超氧化物歧化酶基因soda的基因序列为ncbi-locus_tag为ani_1_470064;如上所述的提高l-苹果酸生产水平和发酵强度的黑曲霉菌株的构建方法,步骤如下:(1)构建超氧化物歧化酶基因soda表达载体以提取的野生型黑曲霉cbs513.88的rna反转录得到的cdna为模板,通过pcr反应扩增超氧化物歧化酶基因soda,回收pcr产物获得目的片段;将基因soda片段克隆到载体plh509上,构建超氧化物歧化酶基因soda过表达载体plh1032;(2)黑曲霉超氧化物歧化酶基因soda过表达菌株的获得将载体plh1032化转至黑曲霉苹果酸高产菌株中,经转化子筛选获得黑曲霉超氧化物歧化酶基因soda过表达菌株。
8.进一步地,所述黑曲霉菌株的出发菌株为黑曲霉苹果酸高产菌株s575和/或黑曲霉苹果酸高产菌株s1662。
9.进一步地,所述黑曲霉苹果酸高产菌株s1662为l-苹果酸高产菌株s1149成功诱导抗性标记基因后获得的转化子;所述菌株s1149抗性标记诱导重组方法为:将菌株s1149的孢子均匀地涂布到含有30
ꢀµ
g/ml四环素的mm培养基上,28℃培养至长出单克隆,随机挑选多个单克隆转接到pda培养基上并于28℃培养24 h,随后将克隆一一对应地转接到含有潮霉素的pda培养基上并于28℃培养24 h,最后进行表型观察筛选抗性标记诱导重组的转化子,即在pda培养基上正常生长、在含有潮霉素的pda培养基上不能生长的为成功诱导重组的转化子。
10.利用如上所述的黑曲霉菌株发酵l-苹果酸的方法,步骤如下:将黑曲霉菌株接种在pda培养基上,于28℃培养5天,至产生分生孢子,收集孢子并将孢子悬液接种于发酵培养基中,孢子的添加终浓度为1
×
108孢子/50 ml,在28℃恒温200 rpm培养5天,即得l-苹果酸。
11.进一步地,所述发酵培养基的成分及配制方法为:蔗糖 0~100g/l,细菌蛋白胨 0~6 g/l,无水磷酸二氢钾 0~0.15 g/l,无水磷酸氢二钾 0~0.15 g/l,二水氯化钙 0~0.1 g/l,七水硫酸镁 0~0.1 g/l,氯化钠 0~0.005 g/l,七水硫酸亚铁 0~0.005 g/l,无水柠檬酸 0~0.001 g/l,溶剂为水,115℃高压灭菌20 min即得;其中,所有组分的取值均不为0;每1 l pda培养基的制备方法为:准确称取去皮马铃薯200 g,切成1 cm3的小块,加蒸馏水不间断搅拌煮沸30 min,用双层纱布过滤收集滤液,加入20 g葡萄糖搅拌至完全溶解,蒸馏水定容至1 l并分装于广口瓶中,121℃高压灭菌20 min;其中,固体培养基加入质量终浓度为1.5%的琼脂。
12.进一步地,所述方法得到的l-苹果酸生产水平和发酵强度与出发高产苹果酸菌株s575相比提高了4.7%-8.1%,与另外一株出发高产苹果酸菌株s1662相比提高了5.5%-9.7%。
13.如上所述的黑曲霉菌株在l-苹果酸生产方面中的应用。
14.本发明取得的有益效果是:1、本发明克服了现有技术中的不足,现有的利用黑曲霉发酵生产苹果酸的过程中因氧化还原反应而积累了一部分氧自由基,会对细胞本身造成一定的损害进而使得生产水
平和发酵强度发生退化,导致发酵工艺成本提高,本发明提供了一种soda基因过表达的黑曲霉菌株及增强了黑曲霉在发酵过程中抵抗氧自由基带来的损伤的方法。本发明显著地提高了黑曲霉发酵苹果酸的生产水平和发酵强度,减少了发酵生产苹果酸过程中的原材料及能源动力成本,为工业化发酵生产苹果酸提供了优良菌株。
15.2、本发明黑曲霉菌株能够应用在l-苹果酸生产方面中,该菌株于摇瓶条件下发酵5天,得到的l-苹果酸生产水平和发酵强度与出发菌株s575相比提高了4.67%-8.12%,与另外一株生产苹果酸菌株s1662相比提高了5.52%-9.68%。为微生物发酵法制备苹果酸提供了优良的菌株。
16.3、本发明所用的出发菌株是黑曲霉苹果酸高产菌株s575和s1662,所述黑曲霉菌株是分别在s575和s1662的基础上过表达超氧化物歧化酶基因soda的黑曲霉菌株,其中黑曲霉菌株s575及s1662均为高产l-苹果酸菌株。
附图说明
17.图1为本发明中构建的用于过表达超氧化物歧化酶基因soda的载体plh1032图谱;图2为本发明中对过表达载体plh1032的双酶切验证图;其中,m为dna marker,n为阴性对照,s为ecor i和xba i双酶切验证载体;图3为本发明中对载体plh1032中超氧化物歧化酶基因soda的测序对比结果;图4为本发明中soda基因在菌株s575中过表达的转化子基因组pcr验证图,其中,m为dna marker,n为阴性对照,p为阳性对照,1-4为成功过表达soda基因的黑曲霉转化子基因组;图5为本发明中s575及以s575为出发菌株成功构建的soda基因过表达工程菌株oes-1、oes-2、oes-3、oes-4于摇瓶发酵中第5天的l-苹果酸产量及生产效率图;图6为本发明中soda基因在菌株s1662中过表达的转化子基因组pcr验证图,其中,m为dna marker,n为阴性对照,p为阳性对照,5-8为成功过表达soda基因的黑曲霉转化子基因组;图7为本发明中s1662及以s1662为出发菌株成功构建的soda基因过表达工程菌株oes-5、oes-6、oes-7、oes-8于摇瓶发酵中第5天的l-苹果酸产量及生产效率图。
具体实施方式
18.为更好理解本发明,下面结合实施例对本发明做进一步地详细说明,但是本发明要求保护的范围并不局限于实施例所表示的范围。
19.本发明中所使用的的原料,如无特殊说明,均为常规市售产品,本发明中所使用的方法,如无特殊说明,均为本领域常规方法,本发明所使用的各物质质量均为常规使用质量。
20.一株提高l-苹果酸生产水平和发酵强度的黑曲霉(aspergillus niger)菌株,所述黑曲霉菌株为过表达超氧化物歧化酶soda的黑曲霉菌株;所述超氧化物歧化酶soda的基因序列为seq id no.1,其氨基酸序列为seq id no.2;所述超氧化物歧化酶基因soda的基因序列为ncbi-locus_tag为ani_1_470064;
如上所述的提高l-苹果酸生产水平和发酵强度的黑曲霉菌株的构建方法,步骤如下:(1)构建超氧化物歧化酶基因soda表达载体以提取的野生型黑曲霉cbs513.88的rna反转录得到的cdna为模板,通过pcr反应扩增超氧化物歧化酶基因soda,回收pcr产物获得目的片段;将基因soda片段克隆到载体plh509上,构建超氧化物歧化酶基因soda过表达载体plh1032;(2)黑曲霉超氧化物歧化酶基因soda过表达菌株的获得将载体plh1032化转至黑曲霉苹果酸高产菌株中,经转化子筛选获得黑曲霉超氧化物歧化酶基因soda过表达菌株。
21.进一步地,所述黑曲霉菌株的出发菌株为黑曲霉苹果酸高产菌株s575和/或黑曲霉苹果酸高产菌株s1662。
22.较优地,所述黑曲霉苹果酸高产菌株s1662为l-苹果酸高产菌株s1149成功诱导抗性标记基因后获得的转化子;所述菌株s1149抗性标记诱导重组方法为:将菌株s1149的孢子均匀地涂布到含有30
ꢀµ
g/ml四环素的mm培养基上,28℃培养至长出单克隆,随机挑选多个单克隆转接到pda培养基上并于28℃培养24 h,随后将克隆一一对应地转接到含有潮霉素的pda培养基上并于28℃培养24 h,最后进行表型观察筛选抗性标记诱导重组的转化子,即在pda培养基上正常生长、在含有潮霉素的pda培养基上不能生长的为成功诱导重组的转化子。
23.利用如上所述的黑曲霉菌株发酵l-苹果酸的方法,步骤如下:将黑曲霉菌株接种在pda培养基上,于28℃培养5天,至产生分生孢子,收集孢子并将孢子悬液接种于发酵培养基中,孢子的添加终浓度为1
×
108孢子/50 ml,在28℃恒温200 rpm培养5天,即得l-苹果酸。
24.较优地,所述发酵培养基的成分及配制方法为:蔗糖 0~100g/l,细菌蛋白胨 0~6 g/l,无水磷酸二氢钾 0~0.15 g/l,无水磷酸氢二钾 0~0.15 g/l,二水氯化钙 0~0.1 g/l,七水硫酸镁 0~0.1 g/l,氯化钠 0~0.005 g/l,七水硫酸亚铁 0~0.005 g/l,无水柠檬酸 0~0.001 g/l,溶剂为水,115℃高压灭菌20 min即得;其中,所有组分的取值均不为0;每1 l pda培养基的制备方法为:准确称取去皮马铃薯200 g,切成1 cm3的小块,加蒸馏水不间断搅拌煮沸30 min,用双层纱布过滤收集滤液,加入20 g葡萄糖搅拌至完全溶解,蒸馏水定容至1 l并分装于广口瓶中,121℃高压灭菌20 min;其中,固体培养基加入质量终浓度为1.5%的琼脂。
25.较优地,所述方法得到的l-苹果酸生产水平和发酵强度与出发高产苹果酸菌株s575相比提高了4.7%-8.1%,与另外一株出发高产苹果酸菌株s1662相比提高了5.5%-9.7%。
26.如上所述的黑曲霉菌株在l-苹果酸生产方面中的应用。
27.具体地,相关的制备及检测如下:实施例1:soda基因过表达载体的构建本实施例包括以下步骤:为扩增超氧化物歧化酶基因soda序列片段,以提取的野生型黑曲霉cbs513.88的rna反转录得到的cdna为模板设计扩增引物soda-f和soda-r,通过pcr扩增回收得到soda基
因序列片段,胶回收后与经ecor i和xba i双酶切处理得到的载体plh509借助one-step clone kit试剂盒进行连接,将连接产物化转至e. coli jm109感受态细胞中,均匀地涂布在含有100
ꢀµ
g/ml卡那霉素抗性的lb固体培养基中,37℃倒置过夜培养,挑取单克隆经菌落pcr验证和提质粒双酶切验证(图2),获得成功连接soda基因序列片段的载体plh1032,其图谱如图1所示。
28.通过扩增获得的载体plh1032中soda基因序列测序结果与已知soda基因序列对比结果如图3所示。
29.所述扩增引物序列见表1:表1引物序列表1中下划线序列表示酶切位点。
30.所述soda基因序列为seq id no.1,长度为465 bp;氨基酸序列为seq id no.2,氨基酸个数为155个。
31.所述含有卡那霉素抗性的lb固体培养基成分为:胰蛋白胨10 g/l、酵母浸出物5 g/l、氯化钠10 g/l、琼脂粉15 g/l。121℃灭菌20 min。灭菌冷却至50℃左右时添加卡那霉素至终浓度为100
ꢀµ
g/ml。
32.实施例2:l-苹果酸高产菌株s575过表达超氧化物歧化酶基因soda菌株的获得本实施例包括以下步骤:将载体plh1032电转至农杆菌,之后将含有相应载体的农杆菌与黑曲霉宿主菌株s575在im培养基上共培养进行农杆菌介导转化,培养2.5天后将培养产物均匀地涂布在cm培养基中进行培养直至长出转化子,对转化子进行筛选,转化子表型为潮霉素抗性不敏感,对此类转化子提基因组验证,设计验证引物(表1),扩增结果满足引物p1和引物p2扩增呈阳性(图4),此类转化子为成功过表达超氧化物歧化酶基因soda的菌株。
33.所述基因过表达的转化方法为农杆菌介导法。
34.所述农杆菌介导法的电转条件为:capacitance: 25 μf, voltage: 2.5 kv, resistance: 200 ω, pulse: 5 msec。
35.所述所用农杆菌菌株为agl-1菌株。
36.所述im培养基配制方法为:15 g琼脂加水定容至905.7 ml,121℃灭菌20 min,加入提前准备的无菌k buffer 0~0.8 ml、mn buffer 0~20 ml、1% cacl2·
2h2o 0~1 ml、0.01% feso
4 0~10 ml、im trace elements 0~5 ml、20% nh4no
3 0~2.5 ml、50%甘油 0~10 ml、1m mes 0~40 ml、20%葡萄糖 0~5 ml,待温度冷却至50℃左右时加入卡那霉素并使其终浓度为0~100
ꢀµ
g/ml、加入乙酰丁香酮并使其终浓度为0~200
ꢀµ
m。其中,所有组分的取值均不为0。
37.所述cm培养基配制方法为:20 g琼脂加水定容到897 ml,121℃灭菌20 min,加入提前准备的无菌asp n 0~20 ml、50%葡萄糖0~20 ml、1m mgso4 0~2 ml、cm trace elements 0~1 ml、10%酪蛋白水解物0~10 ml、10%酵母浸出物0~50 ml,待温度冷却至50℃左右时加入潮霉素并使其终浓度为250
ꢀµ
g/ml、加入链霉素并使其终浓度为100
ꢀµ
g/ml、加入头孢噻污纳并使其终浓度为100
ꢀµ
g/ml、加入氨苄青霉素并使其终浓度为100
ꢀµ
g/ml。其中,所有组分的取值均不为0。
38.所述验证引物序列见表1。
39.实施例3:摇瓶发酵提高l-苹果酸生产水平和发酵强度的方法本实施例具体详见表2:由表2所示,在培养基、培养条件和发酵时间完全相同的情况下,对照组s575生产l-苹果酸的产量为105.21 g/l,而在s575基础上过表达超氧化物歧化酶基因获得的转化子1-4的l-苹果酸产量分别为110.13 g/l、113.76 g/l、112.78 g/l和112.10 g/l,生产水平和发酵强度分别提高了4.7%、8.1%、7.2%和6.5%。
40.以上实施例结果表明,在l-苹果酸高产菌株s575上过表达超氧化物歧化酶基因可显著提高其l-苹果酸的生产水平和发酵强度。
41.实施例4:菌株s1662过表达超氧化物歧化酶基因soda菌株的获得本实施例包括以下步骤:将载体plh1032电转至农杆菌,之后将含有相应载体的农杆菌与黑曲霉宿主菌株s1662在im培养基上共培养进行农杆菌介导转化,培养2.5天后将培养产物均匀地涂布在cm培养基中进行培养直至长出转化子,对转化子进行筛选,转化子表型为潮霉素抗性不敏感,对此类转化子提基因组验证,设计验证引物(表1),扩增结果满足引物p1和引物p2扩增呈阳性(图6),此类转化子为成功过表达超氧化物歧化酶基因soda的菌株。
42.所述基因过表达的转化方法为农杆菌介导法。
43.所述农杆菌介导法的电转条件为:capacitance: 25 μf, voltage: 2.5 kv, resistance: 200 ω, pulse: 5 msec。
44.所述所用农杆菌菌株为agl-1菌株。
45.所述im培养基配制方法为:15 g琼脂加水定容至905.7 ml,121℃灭菌20 min,加入提前准备的无菌k buffer 0~0.8 ml、mn buffer 0~20 ml、1% cacl2·
2h2o 0~1 ml、0.01% feso
4 0~10 ml、im trace elements 0~5 ml、20% nh4no
3 0~2.5 ml、50%甘油 0~10 ml、1m mes 0~40 ml、20%葡萄糖 0~5 ml,待温度冷却至50℃左右时加入卡那霉素并使其终浓度为0~100
ꢀµ
g/ml、加入乙酰丁香酮并使其终浓度为0~200
ꢀµ
m。其中,所有组分的取值均不为0。
46.所述cm培养基配制方法为:20 g琼脂加水定容到897 ml,121℃灭菌20 min,加入提前准备的无菌asp n 0~20 ml、50%葡萄糖0~20 ml、1m mgso4 0~2 ml、cm trace elements 0~1 ml、10%酪蛋白水解物0~10 ml、10%酵母浸出物0~50 ml,待温度冷却至50℃左右时加入潮霉素并使其终浓度为250
ꢀµ
g/ml、加入链霉素并使其终浓度为100
ꢀµ
g/ml、加入头孢噻污纳并使其终浓度为100
ꢀµ
g/ml、加入氨苄青霉素并使其终浓度为100
ꢀµ
g/ml。其中,所有组分的取值均不为0。
47.所述验证引物序列见表1。
48.所述菌株s1662的来源为l-苹果酸高产菌株s1149成功诱导抗性标记基因后获得的转化子。
49.所述s1149抗性标记诱导重组方法为:将大约400个s1149菌株的孢子均匀地涂布到含有30
ꢀµ
g/ml四环素的mm培养基上,28℃培养至长出单克隆,随机挑选100个单克隆转接到pda培养基上28℃培养24 h,随后将克隆一一对应地转接到含有潮霉素的pda培养基上28℃培养24 h,最后进行表型观察筛选抗性标记诱导重组的转化子,即在pda培养基上正常生长在含有潮霉素的pda培养基上不能生长的为成功诱导重组的转化子。
50.实施例5:摇瓶发酵提高l-苹果酸生产水平和发酵强度的方法本实施例具体详见表3:
由表3所示,在培养基、培养条件和发酵时间完全相同的情况下,对照组s1662生产l-苹果酸的产量为126.76 g/l,而在s1662基础上过表达超氧化物歧化酶基因获得的转化子5-8的l-苹果酸产量分别为136.44 g/l、139.03 g/l、133.76 g/l和134.09 g/l,生产水平和发酵强度分别提高了7.6%、9.7%、5.5%和5.8%。
51.以上实施例结果表明,在l-苹果酸高产菌株s1662上过表达超氧化物歧化酶基因可显著提高其l-苹果酸的生产水平和发酵强度。
52.实施例6:菌株发酵生产l-苹果酸的检测利用本发明构建的黑曲霉soda基因过表达菌株于摇瓶中发酵生产苹果酸的方法,其具体步骤如下:首先,将获得的工程菌株接种在pda培养基上,并置于28℃培养箱中倒置培养5天至产生足够的分生孢子;所述pda培养基的制备方法:准确称取去皮马铃薯200 g,切成约1 cm3的小块,加蒸馏水不间断搅拌煮沸30 min,用双层纱布过滤收集滤液,加入20 g葡萄糖搅拌至完全溶
解,蒸馏水定容至1 l并分装于广口瓶中,121℃高压灭菌20 min。固体培养基加入1.5%琼脂。
53.然后,收集菌株的分生孢子并接种于苹果酸发酵培养基中,其中孢子的浓度为1
×
108个/50 ml,将摇瓶放置于28℃、200 rpm条件下培养5天。
54.所述苹果酸发酵培养基的组成为:蔗糖0~100 g/l,细菌蛋白胨 0~6 g/l,无水磷酸二氢钾 0~0.15 g/l,无水磷酸氢二钾 0~0.15 g/l,氯化钙二水 0~0.1 g/l,硫酸镁七水 0~0.1 g/l,氯化钠 0~0.005 g/l,硫酸亚铁七水 0~0.005 g/l,无水柠檬酸 0~0.001 g/l,溶剂为水。115℃高压灭菌20 min。其中,所有组分的取值均不为0。
55.最后,收集发酵产物,制备检测样品,样品经hplc测定其中l-苹果酸的含量。结果显示,得到的l-苹果酸生产水平和发酵强度与出发苹果酸高产菌株s575相比提高了4.7%-8.1%(图5),与出发苹果酸高产菌株s1662相比提高了5.5%-9.7%(图7)。
56.所述检测样品的制备方法为:吸取振荡均匀的发酵液2 ml,加入等体积的2 m hcl,充分反应,离心取上清液,稀释50倍,经0.22
ꢀµ
m滤膜过滤后存放于液相小瓶中待hplc分析。
57.所述hplc检测有机酸的方法为:安捷伦高效液相色谱仪uv检测器,aminexhpx-87h色谱柱(300 mm*7.8 mm),5 mm h2so4流动相,0.6 ml/min流速,65℃色谱柱温,210 nm检测波长,20
ꢀµ
l进样体积。
58.本发明的研究成果显著提高了黑曲霉发酵生产苹果酸的生产水平和发酵强度,减少了发酵生产苹果酸过程中成本,为工业化发酵生产苹果酸提供了优良菌株。
59.本发明中使用到的序列如下:seq id no.1:atggtcaaggctgtcgctgttatccgtggagactctaaggtctccggcactgtcactttcgagcaggccaacgagaacacccccaccaccatctcctggaacatcactggccacgacgccaacgctgagcgtggcttccacgtccaccagttcggtgacaacaccaacggctgcacctccgctggccctcacttcaaccccttcggcaagacccacggtgctcccgaggacgacgagcgtcacgtcggtgaccttggcaacttcaagaccgatgccgagggtaacgccgttggttccaagcaggacaagctggtgaagctcatcggtgctgagagcgtcctgggccggaccctggtcgtccacgctggtactgatgaccttggccgtggtggcaacgaggagtccaagaagaccggtaacgctggtcctcgtcccgcttgcggtgtcattggcattgctgcttaaseq id no.2:metvallysalavalalavalileargglyaspserlysvalserglythrvalthrphegluglnalaasngluasnthrprothrthrilesertrpasnilethrglyhisaspalaasnalagluargglyphehisvalhisglnpheglyaspasnthrasnglycysthrseralaglyprohispheasnpropheglylysthrhisglyalaprogluaspaspgluarghisvalglyaspleuglyasnphelysthraspalagluglyasnalavalglyserlysglnasplysleuvallysleuileglyalagluservalleuglyargthrleuvalvalhisalaglythraspaspleuglyargglyglyasnglugluserlyslysthrglyasnalaglyproargproalacysglyvalileglyilealaala*尽管为说明目的公开了本发明的实施例,但是本领域的技术人员可以理解:在不脱离本发明及所附权利要求的精神和范围内,各种替换、变化和修改都是可能的,因此,本发明的范围不局限于实施例所公开的内容。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。