rna纯化方法
发明领域
1.本发明总体上涉及rna纯化方法领域。具体地,本发明涉及将ssrna与dsrna分离的一种方法;以减少rna样品中的dsrna含量并且因此增加所述样品中的ssrna的浓度,反之亦然。所述方法基于对含有ssrna、dsrna和至少一种盐的rna样品进行的过滤步骤。
2.发明背景
3.体外转录产生的rna由两个不同的亚群组成:单链rna(ssrna)和双链rna(dsrna)。根据设想的应用,纯化这些亚群中的一个是有利的,例如对于rna干扰,dsrna是有利的;而对于治疗用途,ssrna可以是优选的,因为dsrna具有固有的免疫原性,因此体外转录的rna应在治疗用途前耗尽dsrna。
4.文献中先前描述过,单链rna(ssrna)和双链rna(dsrna)可以使用可变浓度的氯化锂选择性沉淀(voloudakis等,2015)。此外,已经描述过可以使用纤维素层析法分离ssrna和dsrna,其中dsrna与纤维素材料结合,并且允许ssrna流过(ep3445850a1,等,2019)。然而,这些技术很难扩大到工业批量规模。
5.然而,需要进一步的rna纯化方法,所述方法产生超纯rna级分,其中dsrna或备选的ssrna的剩余级分尽可能低,并且该方法可以扩大到工业批量规模。
6.作为这种新型纯化方法开发的一部分,开发了一种基于切向流过滤(tff)的方法,旨在对产物中间体进行浓缩和渗滤。尽管治疗上有用的mrna通常具有几百千道尔顿的摩尔质量,但令人惊讶地发现,当使用标称截止值低至30kd的过滤器时,会发生显著的产物损失。本发明人的进一步研究表明,这一观察是由于rna的二级结构大部分是线性的,从而解释了为什么高分子量分子能够迁移通过低分子量截止滤膜。基于这些观察结果,本发明人相应地开发了一种使用过滤步骤分离dsrna和ssrna的方法,所述方法包括dsrna和ssrna具有不同二级结构并因此在使用的过滤器方面表现不同的情况。
技术实现要素:
7.在第一方面,本发明涉及将ssrna与dsrna分离的方法;所述方法包含以下步骤:
8.a)提供包含至少一种盐、ssrna和dsrna的样品;
9.b)将步骤a)的所述样品应用于过滤器,从而将所述ssrna与所述dsrna分离。
10.在一个进一步的实施方案中,所述盐包含离子,所述离子选自包含单价阳离子、三价阳离子、单价阴离子、二价阴离子、三价阴离子或其组合的列表。
11.在另一个进一步的实施方案中,所述盐选自包含钠盐、钾盐、锂盐或铵盐的列表,特别是nacl、licl、nh4cl、kcl、na3po4或na2so4。
12.所述盐可以例如以大约5mm至2m的浓度存在;例如大约5mm至1m,大约5mm至500mm;或者大约15mm至2m;例如大约100mm至1m。
13.在本发明的另一特定实施方案中,所述样品可以进一步包含至少一种醇,所述醇可以例如选自包含乙醇、异丙醇、丙醇的列表。所述醇可以例如以大约10%-30%(v/v)的浓度存在。
14.在另一个具体的实施方案中,所述过滤器具有大约30kd至300kd的孔径。
15.在另一个进一步的实施方案中,所述样品进一步包含tris-hcl和/或edta。
16.在一个非常具体的实施方案中,所述样品包含大约10mm之间的edta,大约100mm之间的所述盐,并且具有约7.8的ph。
17.在本发明方法的另一个进一步的实施方案中,步骤b)可以使用选自切向流过滤、渗滤、死端过滤或其组合的方法来实施。
18.在一个进一步的实施方案中,所述方法不包括基于纤维素的层析步骤和/或基于纤维素的过滤器。
19.在一个进一步的方面,本发明还提供了过滤步骤在从样品中分离dsrna和ssrna中的用途。
20.在一个进一步的方面,本发明提供通过本文所定义的方法获得的ssrna或dsrna分子,以及其在人类医学和/或兽医学中的用途。
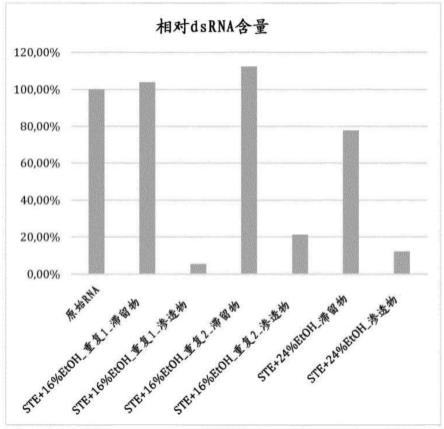
附图说明
21.现在具体参考附图,应强调,所示的细节仅作为示例,并且仅用于本发明不同实施方案的说明性讨论的目的。它们是为了提供被认为是本发明的原理和概念方面的最有用和最容易描述的内容而提出的。在这方面,不试图比基本理解本发明所必需的更详细地展示本发明的结构细节。结合附图进行的描述使本领域技术人员清楚本发明的几种形式如何在实践中体现。
22.图1:使用50kd过滤器在1m licl或ste 16%乙醇(v/v)中纯化的rna样品的相对dsrna含量。
23.图2:使用50kd过滤器在ste 16%乙醇(v/v)或ste 24%乙醇(v/v)中纯化的rna样品的相对dsrna含量。
24.图3:使用100kd过滤器进行死端过滤或使用100kd过滤器进行无渗滤的tff在ste 16%etoh中纯化的样品的相对dsrna含量。
25.图4:使用100kd过滤器进行tff在ste中纯化的样品的相对dsrna含量。
26.图5:显示了在适当的盐缓冲液中超滤和使用tff将缓冲液交换至wfi后rna的相对dsrna含量(5000ng/样品)的狭缝杂交。dsrna标准品:25ng/ml(a1,h6)、12.5ng/ml(b1,g6)、6.25ng/ml(c1,f6)、3.13ng/ml(d1,e6)、1.56ng/ml(e1,f6),0.78ng/ml(f1,c6)、0.39ng/ml(g1,b6)、wfi(h1,a6)。用盐缓冲液超滤(uf)接着进行tff后的rna样品:ste(a2,a4)、hold(b2,b4)、ate(c2,c4)、kte(e2,e4)、lte(f2,f4)、hold(g2,g4)、na3po4te(h2,h4)、na2so4(a5,a7)。
27.图6:纯化过程前后总rna的相对dsrna含量,所述纯化过程由使用不同盐缓冲液进行超滤然后将缓冲液交换至wfi组成。
28.图7:不同跨膜压力(tmp)条件下超滤后dsrna含量。
29.图8:在不同剪切速率条件下超滤后dsrna含量。
30.图9:使用不同浓度的盐超滤后dsrna含量。
31.图10:使用具有不同孔径的过滤器超滤后dsrna含量。
32.发明的具体实施方式
33.现在将进一步描述本发明。在以下段落中,更详细地定义了本发明的不同方面。除非明确表示相反,否则如此定义的每个方面可以与任何其他方面或多个方面相结合。特别地,说明为优选的或有利的任何特征可以与说明为优选的或有利的任何其他一个或多个特征组合。
34.当涉及例如参数、量、时距等可测量值时,本文中使用的术语“大约”或“大致”意味着包含指定值的 /-10%或更小、优选为 /-5%或更小、更优选为 /-1%或更小、以及更优选为 /-0.1%或更小的变化,只要这些变化适合在所公开的发明中应用。应当理解,修饰语“大约”或“大致”所指的值本身也被具体地、优选地公开。
35.如在说明书和所附权利要求中所使用的,单数形式“一个”、“一种”和“所述”包括复数指代,除非上下文明确另有规定。
36.如上文所述,本发明提供了一种分离ssrna和dsrna的方法,所述方法包括过滤步骤。据我们所知,ssrna和dsrna的分离尚未通过使用过滤器进行。相反,文献描述了单链rna(ssrna)和双链rna(dsrna)可以使用可变浓度的氯化锂选择性沉淀(voloudakis等,2015),或使用纤维素层析法分离,其中dsrna与纤维素材料结合,并且允许ssrna流过(ep3445850a1,等,2019)。本发明与这些公开内容的不同之处在于使用过滤器而不是基于纤维素的柱。具体而言,现有技术方法依赖于选择性结合剂的使用,例如dsrna所结合的纤维素材料。因此,通过从液体中分离选择性结合剂( dsrna),可以实现ssrna和dsrna之间的分离。与本发明技术的主要区别在于,本发明中的分离依赖于简单的过滤步骤,而不需要选择性结合剂,例如纤维素材料。这两种技术完全不同且不易互换。虽然过滤器已经用于rna生产,例如分离和/或纯化总rna的情形,但它们还没有用于特异性分离ssrna。
37.因此,本发明提供了一种将ssrna与dsrna分离的方法;所述方法包括以下步骤:
38.a)提供包含至少一种盐、ssrna和dsrna的样品;
39.b)通过过滤技术将所述ssrna与所述dsrna分离。
40.备选地,本发明提供了一种将ssrna与dsrna分离的方法;所述方法包括以下步骤:
41.a)提供包含至少一种盐、ssrna和dsrna的样品;
42.b)在不存在选择性结合剂例如纤维素的情况下,将步骤a)的所述样品应用于过滤器,从而将所述ssrna与所述dsrna分离。
43.特别地,本发明因此提供了一种将ssrna与dsrna分离的方法;所述方法包括以下步骤:
44.a)提供包含至少一种盐、ssrna和dsrna的样品;
45.b)将步骤a)的所述样品应用于过滤器,从而将所述ssrna与所述dsrna分离。
46.换言之,本发明还提供了一种纯化ssrna的方法;所述方法包括以下步骤:
47.a)提供待纯化的rna样品,其中所述样品包含或补充有至少一种盐;
48.b)将步骤a)的所述样品应用于过滤器,从而从任何dsrna污染中纯化所述ssrna样品。
49.此外,本发明提供了一种纯化dsrna的方法;所述方法包括以下步骤:
50.a)提供待纯化的rna样品,其中所述样品包含或补充有至少一种盐;
51.b)将步骤a)的所述样品应用于过滤器,从而从任何ssrna污染中纯化所述dsrna样
品。
52.又备选地,本发明提供了一种提供单链rna(ssrna)的方法,包括:
53.(i)提供包含dsrna和ssrna的rna制备物;
54.(ii)在选择性地允许单链rna(ssrna)流过过滤器进入渗透物并且允许dsrna保留在滞留物中的条件下,使rna制备物与所述过滤器接触;
55.(iii)获得含有所述ssrna的渗透物。
56.又备选地,本发明提供了一种提供双链rna(dsrna)的方法,包括:
57.(i)提供包含dsrna和ssrna的rna制备物;
58.(ii)在选择性地允许单链rna(ssrna)流过过滤器进入渗透物并且允许dsrna保留在滞留物中的条件下,使rna制备物与所述过滤器接触;
59.(iii)获得含有所述dsrna的滞留物。
60.本文所用的“选择性地允许ssrna流过所述过滤器
……
的条件”表述是指这样的条件:诱导ssrna和/或dsrna构象和/或结构变化(例如,增强),从而迫使两种类型的分子形成不同的形式,可以使用过滤器选择性地分离该不同形式。例如,可以选择这样的条件,使得dsrna被强制形成大体积的3d结构,而相同的条件可以允许ssrna保持线性。显然,当应用于过滤器时,大体积的3d结构与线性结构相比表现不同,因此可以有效地彼此分离。
61.在本发明的上下文中,术语“过滤器”是指在过滤步骤中使用的结构,过滤步骤是将两种或更多种组分彼此分离的物理、生物或化学操作。特别地,本发明的过滤器允许通过使用迫使两种物质形成不同三维构象的介质将dsrna和ssrna彼此分离。通过改变过滤器的孔径,可以在良好的分离和足够的产率之间找到平衡。在一个特定的实施方案中,所使用的过滤器具有30kd至300kd的标称截止值,例如50kd至100kd;备选地约30kd、约50kd、约70kd、约100kd;约150kd、约200kd、约250kd、约300kd或其间的任何值。
62.令人惊讶地发现,这些过滤器甚至在本发明的情形中都是合适的,因为标称截止值远低于所应用的ssrna和dsrna的分子量,因此预期使用这些过滤器不能获得这些分子之间的分离。然而,通过改变介质条件,特别是通过至少一种盐的存在,令人惊讶地获得了良好的分离。
63.在本发明的上下文中,术语“标称截止”或“分子量截止”是指90%的物质被过滤器保留的最低分子量。
64.本发明的方法可应用于包括过滤步骤的任何类型的纯化方法,例如但不限于切向流过滤、渗滤、死端过滤或其组合。
65.术语“切向流过滤”或“交叉流过滤”是一种过滤类型,其中进料通过过滤器或床,其中固体被截留在过滤器中,而滤液在另一端被释放。交叉流过滤说明大部分进料流切向穿过过滤器表面,而不是进入过滤器,例如在死端过滤中。交叉流过滤的优点在于,在过滤过程中,会堵塞过滤器的滤饼会被连续且基本上冲洗掉,从而增加了过滤部件可操作的时间长度。它也可以作为一个连续的过程来应用,而不是分批死端过滤。交叉流过滤的主要驱动力是跨膜压力,所述跨膜压力是过滤器两侧压力差的量度。进料在相对于渗透侧的正压力下切向通过过滤器。小于膜孔径的材料的一部分作为渗透物或滤液通过膜,其他所有物质作为滞留物保留在膜的进料侧。
66.术语“渗滤”是一种稀释过程,所述过程涉及使用微分子渗透过滤器基于组分的分
子大小去除或分离溶液中的组分(例如盐、小蛋白、溶剂等渗透分子),以获得纯化的溶液。渗滤也可以与切向流动过滤相结合,其中说明以与渗透物流速相同的速率向进料中加入新鲜溶剂以替换渗透物体积,从而使系统中的体积保持恒定,并有效地从浆料中去除渗透物组分。
67.死端过滤是一种物理、生物或化学操作,所述操作通过过滤介质将固体物质和流体从混合物中分离出来,所述过滤介质具有复杂的结构,只有特定尺寸的颗粒才能通过。不能通过过滤介质的固体颗粒被称为筛上颗粒,而通过的流体(含有小颗粒)被称为滤液。筛上颗粒可以在过滤器顶部形成滤饼,并且也可以堵塞过滤器格栅,阻止流体相穿过过滤器,这称为堵塞。
68.在一个具体的实施方案中,本发明的方法不包括基于纤维素的层析步骤和/或基于纤维素的过滤器。在基于纤维素的层析中,含有分子(例如rna)的样品可以使用这些纤维素柱纯化。这种类型的柱不利用经典的过滤原理,其中分子从膜的一侧穿过所述膜到达另一侧。
69.可通过包含所述dsrna和ssrna的介质的组合物(例如缓冲液的组合物)来控制迫使dsrna和ssrna形成不同3d构象从而允许它们分离的样品条件。在这方面,“组合物组成”是指介质中(例如缓冲液中)所含组分的类型和量。
70.因此,在一个实施方案中,所述条件可以通过包含水和一定浓度的盐的介质(例如缓冲液)实现,所述浓度的盐诱导所述dsrna和ssrna形成不同3d构象。因此,为了满足这些条件,所述rna制备物可以作为包含ssrna、dsrna和介质(例如缓冲液)的液体提供。
71.本发明人惊奇地发现,dsrna和ssrna可以在至少一种盐的存在下使用过滤器选择性地分离。在一个实施方案中,所述介质包含浓度为大约5mm至2m的盐;优选为大约5mm至1m;更优选为大约5mm至500mm;备选地,盐可以以大约15mm至2m,优选20mm至1m,例如50mm至1m或100mm至1m的浓度存在。
72.本发明中的盐可以特别包含选自包含单价阳离子、三价阳离子、单价阴离子、二价阴离子、三价阴离子或其组合的列表的离子。
73.在本发明的上下文中,术语“离子”是指具有净电荷的粒子、原子或分子。阳离子是带正电的离子,电子比质子少,而阴离子是带负电的,电子比质子多。离子价决定了正电荷或负电荷的数量。因此,一价阳离子是具有单个正电荷的离子,三价阳离子是具有三个正电荷的离子,一价阴离子是具有单个负电荷的离子,二价阴离子是具有两个负电荷的离子,三价阴离子是具有三个负电荷的离子。
74.介质中的盐优选地选自钠盐、钾盐、锂盐或铵盐,例如选自nacl、licl、nh4cl、kcl、na3po4或na2so4。使用氯化钠盐时,优选的浓度范围为10mm至500mm,更优选为50mm至250mm,最优选为100mm至200mm。使用氯化锂盐时,优选的浓度范围为100mm至2m,更优选为250mm至1m,最优选为500mm至1m。然而,基于本技术中提供的信息和数据,技术人员可以容易地确定适用于本发明方法中使用的介质的其他盐及其浓度。
75.除了上述盐之外,所述介质可以进一步含有或补充有至少一种醇,例如用于进一步提高方法的效率和/或产率。所述醇优选地以10%至30%(v/v)的浓度存在或补充到介质中。因此,在一个实施方案中,上述限定的条件可以通过含有至少一种如上所述的盐和浓度为10%至25%(v/v)、优选为14%至19%(v/v)、更优选为14%至18%(v/v)、例如14%至
17%(v/v)、14%至16%(v/v)、15%至19%(v/v)、15%至18%(v/v)、15%至17%(v/v)、16%至19%(v/v)或16至18%(v/v)的醇的介质来实现。在一个特定的实施方案中,所述介质优选地包含至少10%的醇浓度,例如至少11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%。
76.介质的其它任选组分可以包含缓冲物质(例如tris或hepes)和/或螯合剂(如edta或氮基三乙酸edta)。在一个实施方案中,介质中的缓冲物质的浓度为5至100mm,优选为10至100mm,例如10至50mm、8至20mm或10至15mm。在一个实施方案中,介质的ph为6.5至8.0,优选为6.7至7.8,例如6.8至7.2(例如,当tris是缓冲物质时)或7.3至7.7(例如,当hepes是缓冲物质时)。在一个实施方案中,螯合剂在介质中的浓度为0.5至50mm,优选为0.5至30mm,例如1至5mm。在一个实施方案中,介质包含水、盐(例如氯化钠)、醇(例如乙醇)、tris和edta,优选为上述浓度。然而,基于本技术中提供的信息和数据,技术人员可以容易地确定除tris之外的缓冲物质和/或除edta之外的螯合剂和/或除氯化钠之外的盐以及它们的浓度,所述缓冲物质和/或螯合剂和/或盐以及浓度适合于本发明方法中使用的介质。
77.在一个进一步的实施方案中,所述介质包含量为16%至24%的乙醇和量为50至150mm的氯化钠。在另一个实施方案中,所述介质进一步包含量为0.5至5mm的edta和/或量为5至20mm的tris。
78.例如,在一个实施方案中,所述介质包含10mm tris-hcl(ph=7.5)、100mm nacl、1mm edta和16%乙醇(v/v)。在另一个实施方案中,所述介质包含10mm tris-hcl(ph=7.8)、100mm盐和1mm edta。
79.在另一个实施方案中,所述介质包含10mm tris-hcl(ph=7.5)、100mm nacl、1mm edta和24%乙醇(v/v)。在又一个实施方案中,所述介质包含10mm tris-hcl(ph=7.5)、1m licl、1mm edta和16%乙醇(v/v)。
80.可以对通过本发明的任何方法获得的ssrna或dsrna进行进一步处理,例如沉淀和/或修饰。例如,通过本发明方法获得的ssrna或dsrna可以使用常规方法(例如,使用“乙酸钠/异丙醇”沉淀法或“licl”沉淀法)沉淀,产生干燥形式的ssrna或dsrna制备物。所述干燥的ssrna或dsrna可以储存(例如,在-70℃下)或可以溶解在适当的溶剂(例如,水或te缓冲液(10mm tris,1mm edta))中然后储存(例如在-70℃下)或进一步使用(例如,用于制备药物组合物)。备选地或另外地,所述ssrna或dsrna可以在储存(例如,在-70℃下)或使用(例如,用于制备药物组合物)之前进一步修饰,例如,通过去除无帽5'-三磷酸盐和/或添加帽结构。
81.如本技术的实施例所示,本发明的方法提供了几个优点,例如,与hplc方法相比,本发明的方法成本有效且简单(不需要复杂的设备),避免了有毒物质(例如乙腈),并以相对高的纯度和产率提供纯化的rna。此外,本发明的方法可以容易地扩大规模,并且比传统的hplc方法花费更少的时间。在这方面,注意到传统的hplc方法通常受到柱尺寸和使用大型柱所涉及的背压问题的限制。本发明的方法并非如此。
82.本文中使用的术语“盐”是指由酸和碱的中和反应产生的任何离子化合物。优选地,所述盐(i)不是缓冲物质,(ii)不是螯合剂,或(iii)既不是缓冲物质也不是螯合剂。示例性酸包括无机酸(例如盐酸、氢溴酸、氢碘酸、硫酸、硝酸、磷酸、硼酸和高氯酸)和有机酸(例如一元羧酸,优选为具有1至5个(例如1、2或3个)碳原子的那些一元羧酸,例如甲酸、乙
酸和丙酸),优选为无机酸。示例性碱包括无机碱(例如naoh、氢氧化铵(nh4oh)和金属的氧化物和氢氧化物,优选为碱金属、土金属和碱土金属的氧化物或氢氧化物(例如li、na、k、rb、be、mg、ca、sr、al和zn的氧化物和氢氧化物))和有机碱(例如胺,如单烷基胺、二烷基胺或三烷基胺),优选为无机碱,更优选为li、na、k、mg、ca、al和zn的氧化物和氢氧化物,更优选为li、na、k和zn的氧化物和氢氧化物,例如li、na和k的氧化物和氢氧化物。可用于当前方法的示例性盐包括licl、nacl、nh4cl、kcl、na3po4或na2so4;例如licl或nacl;优选为nacl。
83.本文中使用的术语“缓冲物质”和“缓冲剂”是指即使向溶液中加入强酸或强碱也能保持溶液ph值几乎恒定的化合物混合物。在一个实施方案中,所述缓冲物质或缓冲剂是弱酸与其共轭碱的混合物。在另一个实施方案中,所述缓冲物质或缓冲剂是弱碱与其共轭酸的混合物。优选地,所述缓冲物质不是螯合剂。适用于本发明情形的缓冲物质的实例包括三(羟甲基)氨基甲烷(tris)、4-(2-羟乙基)-1-哌嗪乙磺酸(hepes)、3-吗啉基-2-羟基丙磺酸(mopso)、3-(n-吗啉基)丙基磺酸(mops)、n,n-双(2-羟乙基)-2-氨基乙磺酸(bes)、2-[(2-羟基-1,1-双(羟甲基)乙基)氨基]乙磺酸(tes)、哌嗪-n,n
’‑
双(2-乙磺酸)(pipes)和3-(n,n-双[2-羟乙基]氨基)-2-羟基丙磺酸(dipso),优选为tris或hepes,更优选为tris。所需的ph值(例如ph 6.5至8.0,优选为ph 6.6至7.8,例如ph 6.8至7.6、ph 6.8至7.2、ph 6.9至7.5、ph 6.9至7.3、ph 7.0至7.7、ph 7.0到7.5、ph 7.0至7.3、ph 7.3至7.8、ph 7.3至7.7或ph 7.3至7.6)可以通过向相应的碱(例如tris)中加入足量的酸(例如无机酸,如盐酸)或通过向相应的酸中加入足量的碱(例如无机碱,如氢氧化钠)来实现。
[0084]
本文中使用的关于本发明的术语“螯合剂”是指一种化合物(优选为有机化合物),所述化合物为多齿配体并且能够与单个中心原子(优选为单个金属阳离子,例如ca或mg离子)形成两个或更多个(优选为三个或更多个,例如四个或更多个)配位键。在这方面,“多齿”是指在单个配体分子中具有多于一个(即,两个或更多个,优选为三个或更多个,例如四个或更多个)供体基团的配体,其中供体基团优选地包括具有自由电子对的原子。优选地,所述螯合剂不是缓冲物质。螯合剂的实例包括edta、氮基三乙酸、柠檬酸盐(例如柠檬酸钠)、1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(dota)、1,4,7-三氮杂环壬烷-1,4,7-三乙酸(nota)、3,6,9,15-四氮杂双环[9.3.1]十五碳-1(15),11,13-三烯-3,6,9-三乙酸(pcta)和1,4,7,10-四氮杂环十二烷-1,4,7-三乙酸(do3a),优选为edta或氮基三乙酸、更优选为edta。
[0085]
如本文结合ssrna或包含ssrna的rna制备物所使用的术语“基本上不含dsrna”,其中所述ssrna或包含ssrna的rna制备物已经经受了本发明的方法,所述术语是指与在所述ssrna或包含ssrna的rna制备物经受本发明的方法之前所述ssrna或包含ssrna的rna制备物中含有的dsrna量相比,在ssrna或包含ssrna的rna制备物中的dsrna的量减少了至少70%(优选为至少75%、至少80%、至少82%、至少84%、至少86%、至少88%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%)。
[0086]
如本文结合dsrna或包含dsrna的rna制备物所使用的术语“基本上不含ssrna”,其中所述dsrna或包含dsrna的rna制备物已经经受了本发明的方法,所述术语是指与在所述dsrna或包含dsrna的rna制备物经受本发明的方法之前所述dsrna或包含dsrna的rna制备物中含有的ssrna量相比,在dsrna或包含dsrna的rna制备物中的ssrna的量减少了至少
70%(优选为至少75%、至少80%、至少82%、至少84%、至少86%、至少88%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%)。
[0087]
优选地,经过本发明方法的所述ssrna或包含ssrna的rna制备物具有一定含量的dsrna,使得当向受试者施用所述ssrna或包含ssrna的rna制备物时,基本上不会在所述受试者中诱导不期望的反应(例如不期望的炎性细胞因子(例如ifn-a)的诱导和/或不期望的效应器酶的激活导致来自本发明ssrna的蛋白质合成的抑制)。
[0088]
例如,术语“基本上不含dsrna”和“基本上不会诱导不期望的反应”可以指当给受试者施用ssrna或包含ssrna的rna制备物时,其中所述ssrna或rna制备物已经经受了本发明的方法,诱导炎性细胞因子(特别是ifn-a)的量与对照ssrna(即,未经受本发明方法的ssrna或包含ssrna的rna制备物)相比减少了至少60%(例如,至少62%、至少64%、至少66%、至少68%、至少70%、至少72%、至少74%、至少76%、至少78%、至少80%)。优选地,术语“基本上不含dsrna”和“基本上不会诱导不期望的反应”是指当给受试者施用ssrna或包含ssrna的rna制备物时,其中所述ssrna或rna制备物已经经受了本发明的方法,且所述ssrna编码肽或蛋白质,导致ssrna在施用后至少10小时(例如,至少12小时、至少14小时、至少16小时、至少18小时、至少20小时、至少22小时或至少24小时)翻译为肽或蛋白质。例如ssrna或包含ssrna的rna制备物中dsrna的含量(其中所述ssrna或包含ssrna的rna制备物已经经受了本发明的方法)可以是基于所述ssrna或包含ssrna的rna制备物的总重量的至多5重量%(优选为至多4重量%、至多3重量%、至多2重量%、至多1重量%、至多0.5重量%、至多0.1重量%、至多0.05重量%、至多0.01重量%、至多0.005重量%、至多0.001重量%)。
[0089]
本发明上下文中的“核酸”是脱氧核糖核酸(dna)或优选为核糖核酸(rna),更优选为mrna。根据本发明,核酸包括基因组dna、cdna、mrna、重组产生的和化学合成的分子。根据本发明,核酸可以是单链或双链且线性或共价闭合以形成环的分子形式。核酸可用于引入细胞,即转染细胞,例如,以rna的形式,所述rna可以通过dna模板的体外转录制备。此外,所述rna可以在应用前通过稳定序列、加帽和/或聚腺苷酸化进行修饰。
[0090]
在本发明的上下文中,术语“rna”涉及包含核糖核苷酸残基的分子,并且优选地完全或基本上由核糖核苷酸残基组成。“核糖核苷酸”涉及在β-d-呋喃核糖基的2'位具有羟基的核苷酸。所述术语包括双链rna、单链rna、分离的rna如部分纯化的rna、基本上纯的rna、合成的rna、重组产生的rna,以及通过添加、缺失、取代和/或改变一个或多个核苷酸而与天然存在的rna不同的修饰的rna。这种改变可以包括添加非核苷酸材料,例如添加到rna的一个或两个末端或内部,例如在rna的一个或多个核苷酸处。rna分子中的核苷酸也可以包含非标准核苷酸,例如非天然存在的核苷酸或化学合成的核苷酸或脱氧核苷酸。这些改变的rna可以称为类似物。核酸可以包含在载体中。本文中使用的术语“载体”包括技术人员已知的任何载体,包括质粒载体、粘粒载体、噬菌体载体如λ噬菌体、病毒载体如腺病毒或杆状病毒载体、或人工染色体载体如细菌人工染色体(bac)、酵母人工或天然存在rna的类似物。
[0091]
根据本发明,术语“rna”包括并优选地指“mrna”,其意为“信使rna”,并涉及可以使用dna作为模板产生并编码肽或蛋白质的“转录物”。mrna通常包含5’非翻译区(5
’‑
utr)、蛋白质或肽编码区和3’非翻译区域(3
’‑
utr)。mrna在细胞中和体外具有有限的半衰期。优选
地,mrna通过使用dna模板的体外转录产生。在本发明的一个实施方案中,所述rna通过体外转录或化学合成获得。所述体外转录方法是技术人员已知的。例如,有多种商业上可获得的体外转录试剂盒。
[0092]
rna可以从细胞中分离,可以由dna模板制备,或者可以使用本领域已知的方法化学合成。在优选的实施方案中,rna是在体外由dna模板合成的。在一个特别优选的实施方案中,rna,特别是ssrna,例如mrna或抑制性ssrna(例如反义rna、sirna或mirna),在体外由dna模板转录产生。在一个特别优选的实施方案中,rna是体外转录的rna(ivt rna)。为了提供修饰的rna,可以在合成期间(优选为体外转录)引入相应的修饰的核苷酸,例如修饰的天然存在的核苷酸、非天然存在的核苷酸和/或修饰的非天然存在的核苷酸,或者可以在转录后在rna中进行修饰和/或添加修饰。
[0093]
根据本发明,“rna”包括mrna、trna、rrna、snrnas、ssrna、dsrnas和抑制性rna。根据本发明,“ssrna”包括mrna和抑制性ssrna(如反义ssrna、sirna或mirna)。“ssrna”表示单链rna,“dsrna”表示双链rna,并且是具有两条部分或完全互补链的rna。
[0094]
根据本发明,术语“mrna”是指“信使rna”,并涉及可以通过使用dna模板产生并可以编码肽或蛋白质的“转录物”。通常,mrna包含5'-utr、蛋白质编码区和3'-utr。在本发明的上下文中,mrna优选地通过dna模板的体外转录产生。如上所述,体外转录方法是技术人员已知的,并且各种体外转录试剂盒是商业上可获得的。mrna在细胞中和体外仅具有有限的半衰期。因此,根据本发明,rna的稳定性和翻译效率可以根据需要进行修饰。例如,通过一种或多种具有稳定作用和/或增加mrna翻译效率的修饰,可以稳定mrna并增加其翻译。根据本发明,为了增加mrna的表达,可以在编码区(即编码表达的肽或蛋白质的序列)内对其进行修饰,优选地不改变表达的肽或蛋白质的序列,从而增加gc含量以增加mrna的稳定性,并且进行密码子优化,并因此增强细胞中的翻译。
[0095]
在本发明的一个具体的实施方案中,所述mrna分子是编码免疫调节蛋白的mrna分子。
[0096]
在本发明的上下文中,术语“编码免疫调节蛋白的mrna分子”是指编码修饰抗原呈递细胞(更特别是树突状细胞)的功能的蛋白质的mrna分子。这些分子可以选自包含cd40l、cd70、catlr4、il-12p70、el选择素、ccr7和/或4-1bbl、icosl、ox40l、il-21的列表;更特别是cd40l、cd70和catlr4中的一种或多种。本发明方法中使用的免疫刺激因子的一个优选组合是cd40l和catlr4(即“dimix”)。在另一个优选的实施方案中,使用cd40l、cd70和catlr4免疫刺激分子的组合,所述组合在本文中也称为“trimix”。
[0097]
本文中使用或提及的mrna或dna可以是裸mrna或dna,或受保护的mrna或dna。dna或mrna的保护增加了其稳定性,但保留了将mrna或dna用于疫苗接种目的的能力。mrna和dna的保护的非限制性实例可以是:脂质体包封、鱼精蛋白保护、(阳离子)脂质脂复合物化(lipoplexation)、脂质、阳离子或聚阳离子组合物、甘露糖基化脂复合物化,泡沫脂质体化,聚乙烯亚胺(pei)保护、脂质体负载的微泡保护等。
[0098]
本说明书中使用的术语“靶向”不限于可以在本文中描述的具体实例。任何感染性病原体,如病毒、细菌或真菌都可以被靶向。此外,可以靶向任何肿瘤或癌细胞。
[0099]
在另一个具体的实施方案中,所述mrna分子是编码抗原特异性蛋白和/或疾病特异性蛋白的mrna分子。
[0100]
根据本发明,术语“抗原”包含任何分子,优选为肽或蛋白质,其包含至少一个将引发免疫应答和/或免疫应答所针对的表位。优选地,在本发明的上下文中,抗原是任选地在加工后诱导免疫应答的分子,所述免疫应答优选地对抗原或表达所述抗原的细胞特异。特别地,“抗原”涉及一种分子,所述分子在加工后任选地由mhc分子呈递,并与t淋巴细胞(t细胞)发生特异性反应。
[0101]
在一个具体的实施方案中,所述抗原是靶特异性抗原,其可以是肿瘤抗原或细菌、病毒或真菌抗原。所述靶特异性抗原可以衍生自以下任一种:从(一种或多种)靶细胞中分离的总mrna、一种或多种特异性靶mrna分子、(一种或多种)靶细胞的蛋白质裂解物、来自(一种或多种)靶细胞的特异性蛋白质或合成的靶特异性肽或蛋白质以及编码靶特异性抗原或其衍生肽的合成mrna或dna。
[0102]
本发明所述的ssrna(优选为mrna)可以具有修饰的核糖核苷酸,以增加其稳定性和/或减少细胞毒性。例如,在一个实施方案中,本发明所述的ssrna(优选为mrna)中,5-甲基胞苷部分或完全、优选地完全取代胞苷。备选地或另外地,在一个实施方案中,本发明所述的ssrna(优选为mrna)中,假尿苷或n(1)-甲基假尿苷部分或完全,优选地完全取代尿苷。被假尿苷修饰的rna(优选为ssrna,如mrna)(部分或完全,优选地完全取代尿苷)在本文中被称为“ψ-修饰”,而术语“n1ψ-修饰”意味着rna(优选为ssrna,如mrna)含有n(1)-甲基假尿苷(部分或完全,优选地完全取代尿苷)。
[0103]
在一个实施方案中,术语“修饰”涉及提供具有5'-帽或5'-帽类似物的rna(优选为ssrna,如mrna)。术语“5-帽”是指rna(优选为ssrna,如mrna)分子的5'-端上存在的帽结构,通常由鸟苷核苷酸组成,所述鸟苷核苷酸通过不寻常的5'至5'三磷酸连接与rna(优选为ssrna,如mrna)相连。在一个实施方案中,该鸟苷在7位甲基化。术语“普通5'-帽”是指天然存在的rna 5'-帽,优选地指7-甲基鸟苷帽(m7g)。在本发明的上下文中,术语“5'-帽”包括类似于rna帽结构的5'-帽类似物,并且被修饰为具有稳定rna(优选ssrna,如mrna)和/或增强rna(优选为ssrna,如mrna)翻译的能力,如果rna连接到其上,优选地在体内和/或细胞中。
[0104]
在本发明的上下文中,术语“转录”涉及一种过程,其中dna序列中的遗传密码被转录成rna。随后,所述rna可以被翻译成蛋白质。根据本发明,术语“转录”包含“体外转录”,其中术语“体外转录”涉及在无细胞系统中体外合成rna(特别是ssrna,如mrna)的过程。优选地,克隆载体用于产生转录物。这些克隆载体通常被称为转录载体,并且根据本发明被术语“载体”所包含。根据本发明,rna制备物包含通过体外转录、特别是合适的dna模板的体外转录产生的ssrna。用于控制转录的启动子可以是任何rna聚合酶的任何启动子。rna聚合酶的具体实例是t7、t3和sp6 rna聚合酶。优选地,所述体外转录由t7、t3或sp6启动子控制。用于体外转录的dna模板可以通过克隆核酸(特别是cdna)并将其引入用于体外转录的合适的载体而获得。所述cdna可以通过rna的逆转录获得。
[0105]
在另一方面,本发明还提供通过本文所定义的方法获得的ssrna分子,以及其在人类医学和/或兽医学中的用途,例如用于治疗癌症或传染病和/或用于疫苗接种目的。
实施例
[0106]
实施例1:使用过滤方法去除dsrna的概念证明
[0107]
所有实验均在repligen kr2i tff系统上进行。使用标称截止值为50kd的中空纤维过滤器(repligen,c04-e050-05-n)进行初始实验。
[0108]
制备了以下溶液:
[0109]-在1m licl中0.25mg/ml双沉淀的rna(rg-mrna_hucd40l_280219_lina)(10ml)
[0110]-在ste 16%etoh(10mm tris-hcl(ph=7.5),100mm nacl,16%乙醇(v/v))中0.25mg/ml双沉淀的rna(rg-mrna_hucd40l_280219_lina)(10ml)
[0111]
用0.5m naoh对tff系统进行消毒,并用100mm tris-hcl(ph=7.5)进行中和。使用辅助泵将溶液引入进料容器,并分别用1m licl或ste 16%etoh进行渗滤。渗滤长度设置为20个渗滤体积(200ml)。
[0112]
渗滤后,在标称截止值为30kd的amicon ultra-15离心过滤器(merck,ufc903096)上处理渗透物和滞留级分,用于浓缩并将缓冲液交换成水。
[0113]
缓冲液交换成水后回收的rna的量列于表1中。
[0114]
表1:使用50kd过滤器在1m licl或ste 16%etoh中渗滤后回收的rna
[0115][0116]
使用抗dsrna j2抗体(scicons)在狭缝杂交上分析样品的dsrna含量。
[0117]
如图1所示,rna在1m licl中的超滤导致渗透级分中dsrna含量与滞留级分相比显著降低。如表1所示,然而,该条件下的回收率很低。
[0118]
与滞留物相比,在ste 16%etoh纯化材料的渗透级分中也观察到明显减少,表明该方法允许以相对高的回收率从总rna混合物中去除dsrna。
[0119]
由于上述两种纯化ssrna的方法(通过添加licl或添加nacl和乙醇)都需要与标准rna沉淀(licl沉淀或nacl/etoh沉淀)中使用的那些条件非常相似的条件,因此假设这些条件可能以不同的方式作用于ssrna和dsrna,在一个亚群中引起沉淀或二级结构变化,而另一个亚群保持不受影响。由于一个亚群将是球状而非线性的,因此可以使用中间截止过滤膜分离两个亚群,该中间截止过滤膜允许线性但非球状rna通过。
[0120]
该假设最初在使用repligen中空纤维过滤器(mpes,40cm2,50kd截止值)的repligen kr2i tff系统上进行了测试。在ste 16%乙醇(0.25mg/ml rna,10mm tris-hcl ph=7.5,100mm nacl,1mm edta,16%乙醇(v/v))中制备rna溶液,并进行由20个渗滤体积(dv)组成的渗滤步骤。尽管在渗透级分(其迁移通过过滤器)中回收的rna相对较少,但与起始材料或渗透级分(未迁移通过过滤器)相比,所述级分含有明显减少的dsrna水平。
[0121]
在进一步的实验中,所述过滤器的标称截止值增加到100kd,以提高纯化过程的产率。使用这种调整后的方法,所述过程的产率提高到86%,而不会对获得的rna的纯化谱产生负面影响。
[0122]
实施例2:缓冲液组合物的优化
[0123]
为了提高dsrna清除率,用ste 24%etoh(10mm tris-hcl(ph=7.5),1mm edta,100mm nacl,24%乙醇(v/v))而不是ste 16%etoh重复实施例1中描述的实验。
[0124]
图2所示的数据表明,该方法在ste 16%etoh和ste 24%etoh中都能有效地从rna混合物中去除dsrna,两种条件之间没有明显差异。
[0125]
实施例3:不同孔径的评估
[0126]
根据先前的实验,确定当使用标称截止值为30kd的中空纤维过滤器(repligen,c04-e030-05-n)时,没有rna迁移到渗透物中,并且可以使用标称截止值为50kd的中空纤维过滤器分离ssrna和dsrna。进一步测试了所述技术是否可以使用标称截止值为70kd(repligen,c04-e070-05-n)和100kd(replingen,c04-e100-05-n)的过滤器来应用。
[0127]
制备以下溶液:在ste 16%乙醇中的0.15mg/ml rna(rg-mrna_hucd40l_280219_lina)(10ml)。所述tff系统用0.5m naoh消毒,并用100mm tris-hcl(ph=7.5)中和。
[0128]
用ste 16%etoh对溶液进行渗滤。渗滤长度设为20dv(200ml)。渗滤后,测定渗透物和滞留物级分的总rna含量(见表2)。
[0129]
表2:使用70kd或100kd过滤器在ste 16%etoh中渗滤后回收的rna
[0130][0131]
从表1和表2中呈现的数据可以清楚地看出,增加中空纤维过滤器的孔径会导致渗透物的回收率增加。虽然从70至100kd截止值的回收率并未导致回收率的进一步增加,但这确实导致了处理时间的显著减少。
[0132]
实施例4:死端过滤
[0133]
由于渗滤大大增加了该过程的缓冲液消耗并增加了处理时间,因此研究了该过程是否需要该步骤才能有效。在第一个实验中,在离心过滤器上切向流过滤被替换为死端过滤。
[0134]
制备以下溶液:在ste 16%乙醇中的0.1mg/ml rna(rg-mrna_hucd40l_280219_lina)(10ml)。将该溶液加载到截止值为100kd的amicon ultra-15离心过滤装置(merck,ufc910096)上,并以4000g离心10分钟。然后,用15ml ste 16%etoh洗涤过滤器两次。将渗透物收集在单独的管中。剩余在过滤器上的级分用h2o洗涤两次,并再次收集渗透物。
[0135]
将ste 16%和h2o级分加载到截止值为30kd的amicon ultra-15离心过滤装置(merck,ufc903096)上,并以4000g离心10分钟。继续该过程,直到整个体积通过过滤器。然后用15ml h2o洗涤过滤器5次。这些过滤的渗透物被丢弃。
[0136]
洗涤后,将滞留物转移到微量离心管中(eppendorf tube),并用200μl h2o洗涤过滤器。测定回收溶液的体积和浓度。
[0137]
从表3中可以明显表示,在ste 16%etoh中进行死端过滤后,只能回收非常有限量的ssrna。由于使用切向流过滤应用类似设置时未遇到此问题,因此材料与滤膜的粘附可能
是一个问题。
[0138]
表3:在100kd过滤器上进行死端过滤后回收的rna
[0139]
条件回收的rna(μg)回收率(%)rg-mrna_hucd40l_280219_lina_ste 16%1.860.186%rg-mrna_hucd40l_280219_lina_h2o859.3285.932%
[0140]
在第二个实验中,使用repligen kr2i tff系统,但没有对样品进行渗滤。相反,所述样品在中空纤维上循环,直到进料容器变空。
[0141]
表4:使用100kd过滤器进行无渗滤的切向流过滤后回收的rna
[0142][0143]
如表4所示,渗滤不是必需的,且当使用标准切向流过滤过滤rna时,可以回收大部分起始材料。
[0144]
再次使用dsrna狭缝杂交分析回收级分的dsrna含量(见图3)。
[0145]
尽管当应用死端过滤时回收的rna量很低(如表3所示),但图3中所示的数据表明,这仍然导致样品中存在的dsrna的量显著减少。当在没有渗滤步骤的情况下应用tff时,渗透物测试中存在的rna与原始材料相比,dsrna的存在显著降低。虽然产率与应用渗滤时相当,但dsrna的清除似乎更低。
[0146]
实施例5:
[0147]
为了验证是否需要乙醇来有效去除dsrna,进行了进一步的实验。
[0148]
制备以下溶液:在无乙醇添加的ste中的0.15mg/ml rna(rg-mrna_hucd40l_280219_lina)(10ml)。所述tff系统用0.5m naoh消毒,并用100mm tris-hcl(ph=7.5)中和。
[0149]
用ste对所述溶液进行渗滤。渗滤长度设为20dv(200ml)。渗滤后,使用抗dsrna j2抗体在狭缝杂交上分析原始材料和渗透级分的dsrna含量(scicons;图4)。
[0150]
如图4所示,进行ssrna纯化不需要乙醇的存在。
[0151]
实施例6:不同条件的测试
[0152]
在该实验中,测试了使用不同盐缓冲液的rna样品的超滤。因此,我们比较了所用盐条件下的产率和dsrna含量,并将纯化的材料与使用ste缓冲液的标准方法纯化的材料进行了比较:
[0153]
测试的盐缓冲液:
[0154]
·
ate:10mm tris-hcl,1mm edta,100mm nh4cl(ph 7.8)
[0155]
·
kte:10mm tris-hcl,1mm edta,100mm kcl(ph 7.8)
[0156]
·
lte:10mm tris-hcl,1mm edta,100mm licl(ph 7.8)
[0157]
·
mte:10mm tris-hcl,1mm edta,100mm mgcl2(ph 7.8)
[0158]
·
na3po4te:10mm tris-hcl,1mm edta,100mm na3po4(ph 7.8)
[0159]
·
na2so4te:10mm tris-hcl,1mm edta,100mm na2so4(ph 7.8)
[0160]
·
mgso4te:10mm tris-hcl,1mm edta,100mm mgso4(ph 7.8)
[0161]
·
ste-比较实施例-10mm tris-hcl,1mm edta,100mm naoh-ph 7.8
from in vitro-transcribed mrna(2019)。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。