1.本发明涉及免疫学、细胞生物学和再生医学交叉技术领域,具体而言,涉及修复型巨噬细胞、培养液及其应用。
背景技术:
2.糖尿病最为普遍和严重的并发症之一是俗称“糖尿病足”的慢性皮肤创伤,其多发于下肢,形成溃疡,难愈合甚至不愈合,已成为下肢截肢的首要原因,严重影响全球人类健康。然而,目前对于糖尿病创伤,无针对性治疗策略或药物,以常规护理和清创为主,治疗效果不佳,复发率高。
3.近年来对于糖尿病创伤的病理学研究不断深入,揭示其不同于普通皮肤创伤的生物学机制。普通皮肤创伤愈合可大致分为凝血、炎症、增殖和重塑四个阶段。其中,作为固有免疫系统核心成员的巨噬细胞(及其前体-单核细胞)发挥着关键作用。例如,在修复早期,单核细胞表达炎性因子并分化为炎性巨噬细胞,发挥吞噬病原体、招募细胞、促进血管新生等作用;而在修复后期,这类单核细胞转而表达抑炎性和促进再生的细胞因子,促进成纤维细胞增殖、血管成熟、基质重塑等,以高度动态和协同的方式完成创面愈合和组织修复。然而,糖尿病创面难以愈合的一个关键因素,即是在糖尿病病理情况下,创面局部的单核细胞或巨噬细胞从促炎性朝抑炎性的表型转变受阻,不仅无法发挥其在修复后期应该发挥的生理功能,而且还释放信号招募更多的炎性单核细胞进入创面,放大这一病理效应,造成局部持续炎症、并破坏创面的血管网络,阻碍修复。正因为这一复杂和综合的病理因素,单一靶点(如仅仅抑炎或促进细胞生长)的药物或治疗手段,即使在普通创伤愈合中有一定的作用,也难以有效促进糖尿病创伤愈合。因此,亟需提供一种新的巨噬细胞,具备很好的促进创伤愈合的功能。
4.鉴于此,特提出本发明。
技术实现要素:
5.本发明的目的在于提供修复型巨噬细胞、培养液及其应用。本发明实施例提供一种新的修复型巨噬细胞,该修复型巨噬细胞具备很好的促进创伤愈合的功能。
6.本发明是这样实现的:
7.第一方面,本发明提供一种修复型巨噬细胞,其利用tams的培养液或肿瘤提取液培养单核细胞或巨噬细胞得到。
8.在可选的实施方式中,所述tams的培养液是将tams在完全培养基内培养15-20天后得到的培养液;
9.优选地,所述完全培养基包括1640完全培养基。
10.在可选的实施方式中,所述tams是从肿瘤中分离得到的细胞。在可选的实施方式中,形成tams的步骤包括:将剪碎的肿瘤与胶原蛋白水解酶、核酸内切酶混合进行消化,而后过滤得到单细胞悬液,接着,利用红细胞裂解液去除红细胞,将所述单细胞悬液与白细胞
共同抗原磁珠进行孵育,而后分选白细胞共同抗原阳性细胞,接着,将白细胞共同抗原阳性细胞与cd45,cd11b,ly6g,,ly6c,mhc ii和siglecf抗体进行孵育,而后分选tams;
11.优选地,形成tams的步骤包括:将剪碎的肿瘤转入含有胶原酶型ⅳ和dnaseⅰ的裂解缓冲液中进行消化,形成单细胞和未消化的肿瘤组织块的混合物,而后将所述混合物进行过滤去除未消化的肿瘤组织块,得到总单细胞悬液,接着,利用红细胞裂解液对过滤后的总单细胞悬液进行处理,去除红细胞,再用磷酸缓冲液进行重悬形成单细胞悬液,将所述单细胞悬液与cd45磁珠孵育,而后分选cd45阳性的细胞,随后,cd45阳性细胞与cd45,cd11b,ly6g,,ly6c,mhc ii和siglecf抗体在冰上避光孵育,通过流式分选技术将tams分选出来。
12.在可选的实施方式中,形成所述肿瘤提取液的步骤包括:将剪碎的肿瘤与缓冲液混合进行匀浆,而后离心得到上清液;
13.优选地,形成所述肿瘤提取液的步骤包括:将剪碎的肿瘤与磷酸缓冲液按照0.2~0.5g肿瘤/1毫升的比例混合,而后进行多次匀浆,再离心,收集上清液。
14.在可选的实施方式中,所述肿瘤包括骨肉瘤、黑色素瘤、小鼠结肠腺癌和小鼠乳腺癌中的任意一种。
15.在可选的实施方式中,所述单核细胞和所述巨噬细胞均为从正常组织得到的细胞;
16.优选地,所述单核细胞和所述巨噬细胞均来源哺乳动物,
17.优选地,所述单核细胞来源于骨髓单核细胞或外周血单核细胞;
18.所述巨噬细胞来源于骨髓巨噬细胞或腹腔巨噬细胞。
19.在可选的实施方式中,每毫升tams的培养液对应添加0.25
×
107~1
×
107个单核细胞或0.25
×
107~1
×
107个巨噬细胞;每毫升肿瘤提取液对应添加0.25
×
107~1
×
107个单核细胞或0.25
×
107~1
×
107个巨噬细胞;
20.优选地,培养所述单核细胞或所述巨噬细胞的步骤包括:将所述单核细胞或所述巨噬细胞接种至含有tams的培养液的第一接种培养基或含有肿瘤提取液的第二接种培养基中,在37~38℃的条件下培养36-50小时;
21.优选地,tams的培养液在所述第一接种培养基中的体积浓度为15-25%;
22.优选地,所述肿瘤提取液在所述第二接种培养基中的浓度为20-40μg/ml。
23.第二方面,本发明提供一种培养液,其通过培养前述实施方式任一项所述的修复型巨噬细胞得到。
24.第三方面,本发明提供一种前述实施方式所述的修复型巨噬细胞或前述实施方式所述的培养液在制备以下任意一种制剂中的应用;
25.(1)诱导未极化的巨噬细胞向抑炎表型转变的诱导制剂;
26.(2)促进血管新生的修复剂;
27.(3)诱导成纤维细胞活化的活化剂;
28.(4)促进胶原沉积的制剂。
29.第四方面,本发明提供一种前述实施方式所述的修复型巨噬细胞在制备促进皮肤创面愈合的药物中的应用;
30.优选地,所述药物为促进糖尿病创面愈合的药物。
31.本发明具有以下有益效果:本发明实施例通过利用tams的培养液或肿瘤提取液培
养单核细胞或巨噬细胞,继而诱导单核细胞或巨噬细胞转化为修复型巨噬细胞,该修复型巨噬细胞经诱导后高表达cd80,cd163,cd206等表面生物标志物,高分泌il-4,il-16等促进免疫抑制的细胞因子,继而可以有效抑制炎症。同时,其还高分泌amphiregulin,igfbp-3,pentraxin3等促进血管新生的细胞因子,高分泌pdgf-b,afgf等促进细胞增殖和基质分泌的细胞因子,继而促进血管新生。同时,其还可促进成纤维活化和成纤维胶原沉积,进一步促进受损血管修复。通过上述作用继而最终实现皮肤创面的修复愈合。
附图说明
32.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
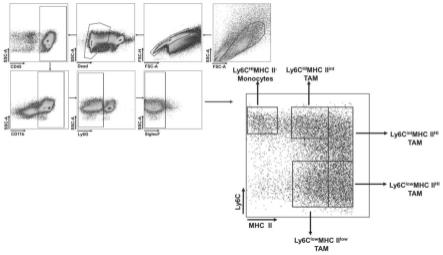
33.图1为本发明实施例1提供的tams的流式分选策略图;
34.图2为本发明实施例2提供的bmdms诱导分化的策略图;
35.图3为本发明实验例1提供的不同巨噬细胞的吉姆萨染色图;
36.图4为本发明实验例1提供的不同巨噬细胞的ki67免疫荧光染色图;
37.图5为本发明实验例1提供的不同巨噬细胞表面标志物表达情况图;
38.图6为本发明实验例1提供的tamems高表达促血管新生及基质细胞增殖的基因结果图;
39.图7为本发明实验例1提供的tamems独特的基因表达谱图;
40.图8为本发明实验例3提供的蛋白阵列检测结果;
41.图9为本发明实验例4提供的tamems诱导未极化(m0)巨噬细胞向免疫抑制表型转变的检测结果;
42.图10为本发明实验例5提供的tamems促进人血管内皮细胞成管实验的检测结果;
43.图11为本发明实验例6提供的tamems促进成纤维细胞活化的检测结果;
44.图12为本发明实验例7提供的不同巨噬细胞对正常老鼠创面的创口愈合结果图;
45.图13为本发明实验例8提供的不同巨噬细胞对糖尿病老鼠创面的创口愈合结果图;
46.图14为本发明实验例8提供的不同巨噬细胞对伤口处成纤维细胞的胶原分泌的影响结果图;
47.图15为本发明实验例8提供的不同巨噬细胞对伤口处血管新生及成熟的影响结果图;
48.图16为本发明实验例9提供的不同巨噬细胞促血管新生及基质细胞增殖的基因结果图;
49.图17为本发明实验例10提供的不同巨噬细胞促血管新生及基质细胞增殖的基因结果图。
具体实施方式
50.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中
的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
51.本发明实施例提供一种修复型巨噬细胞,其制备方法具体如下:
52.s1、制备单核细胞或者巨噬细胞;
53.该单核细胞或者巨噬细胞的来源从种属上判定,可以是小鼠、人、或其他哺乳动物来源;该单核细胞或者巨噬细胞的来源从细胞种类上判定,可以是骨髓来源单核细胞,骨髓来源巨噬细胞,腹腔来源巨噬细胞和外周血单核细胞等。
54.而制备该单核细胞或者巨噬细胞的方法或者步骤为常规的方法或步骤,此处不再进行赘述。
55.s2、tams的培养液的制备:
56.s2.1、制备tams;
[0057]“肿瘤相关巨噬细胞”(tumor-associated macrophages,tams)在肿瘤发展过程中发挥着重要的作用。这类细胞通过分泌丰富多样的细胞因子,抑制组织局部的免疫响应、诱导血管新生和成熟、促进细胞增殖迁移。发明人付出创造性劳动研究后发现,尽管肿瘤生长和创伤愈合是不同的生物学事件,但是肿瘤发展过程中tams的独特的生物学活性,恰好是糖尿病慢性难愈合创伤愈合亟需、而传统药物或治疗手段无法提供的。因此,利用tams对非肿瘤来源的单核/巨噬细胞进行培养诱导,从而获得与tams生物学性质相似的“修复型”巨噬细胞,将这些修复型巨噬细胞递送至糖尿病皮肤损伤部位,促进创面愈合与组织修复再生。
[0058]
首先,从肿瘤中分离得到的tams细胞,具体地,将剪碎的肿瘤与胶原蛋白水解酶、核酸内切酶混合进行消化,而后过滤得到单细胞悬液,接着,利用红细胞裂解液去除红细胞,将所述单细胞悬液与白细胞共同抗原磁珠进行孵育,而后分选白细胞共同抗原阳性细胞,接着,将白细胞共同抗原阳性细胞与cd45,cd11b,ly6g,,ly6c,mhc ii和siglecf抗体进行孵育,而后分选tams。
[0059]
更具体地,形成tams的步骤包括:将剪碎的肿瘤转入含有胶原酶型ⅳ和dnaseⅰ的裂解缓冲液中进行消化,形成单细胞和未消化的肿瘤组织块的混合物,而后将所述混合物进行过滤去除未消化的肿瘤组织块,得到总单细胞悬液,接着,利用红细胞裂解液对过滤后的总单细胞悬液进行处理,去除红细胞,再用磷酸缓冲液进行重悬形成单细胞悬液,将所述单细胞悬液与cd45磁珠孵育,而后分选cd45阳性的细胞,随后,cd45阳性细胞与cd45,cd11b,ly6g,,ly6c,mhc ii和siglecf抗体在冰上避光孵育,通过流式分选技术将tams分选出来。
[0060]
其中,肿瘤包括骨肉瘤、黑色素瘤、小鼠结肠腺癌和小鼠乳腺癌中的任意一种。肿瘤也可以选择其他能够分选出tams的肿瘤。且制备tams的方法也可以采用现有技术中的其他方法。
[0061]
s2.2、制备tams的培养液;
[0062]
将上述tams接种至完全培养基内培养,继而得到tams的培养液,其中,完全培养基包括1640完全培养基,培养时间为15-20天,培养温度为37~38℃,酸碱度为7.2~7.4,二氧化碳为5%。
[0063]
完全培养基除了采用上述1640完全培养基,现有技术中其他完全培养基或者能够培养tams的培养基也在本发明实施例的范围内。
[0064]
采用上述培养基和培养条件更有利于tams的培养,继而保证得到的tams的培养液的性能,有利于其对正常的单核细胞或者巨噬细胞的诱导或转换。
[0065]
s3、肿瘤提取液的制备;
[0066]
将剪碎的肿瘤与缓冲液混合进行匀浆,而后离心得到上清液;具体地,在剪碎的肿瘤中加入钢化匀浆珠,加入适量磷酸缓冲液(记为:pbs),其中,添加量为:0.2~0.5g肿瘤/1毫升pbs,pbs的ph为7.4,浓度为0.01m,而后用匀浆机匀浆,条件是:3~4次,每次1~2分钟,30~50赫兹。得到的匀浆液经离心机离心:10000-12000转,5-15分钟,0-4℃。取出上清液,即得到肿瘤提取液。得到的肿瘤提取液的浓度为20~50mg/ml。
[0067]
可以采用上述匀浆和离心条件,也可以采用其他匀浆或离心条件,只要能够得到肿瘤提取液即可。
[0068]
s4、诱导形成修复型巨噬细胞;
[0069]
将单核细胞或者巨噬细胞接种至含有tams的培养液的第一接种培养基或含有肿瘤提取液的第二接种培养基中进行培养,其中,培养时间为36-50小时,培养温度为37~38℃,tams的培养液在所述第一接种培养基中的体积浓度为15-25%(v:v),肿瘤提取液在所述第二接种培养基中的浓度为20-40μg/ml。每毫升tams的培养液对应添加0.25
×
107~1
×
107个单核细胞或0.25
×
107~1
×
107个巨噬细胞;每毫升肿瘤提取液对应添加0.25
×
107~1
×
107个单核细胞或0.25
×
107~1
×
107个巨噬细胞。采用上述培养条件更有利于tams对单核细胞或者巨噬细胞的诱导,有利于保证修复型巨噬细胞的形成。
[0070]
第二方面,本发明实施例提供一种培养液,其通过培养上述修复型巨噬细胞得到。
[0071]
第三发面,本发明实施例提供一种上述修复型巨噬细胞和培养液在制备以下任意一种制剂中的应用;
[0072]
(1)诱导未极化的巨噬细胞向抑炎表型转变的诱导制剂;
[0073]
(2)促进血管新生的修复剂;
[0074]
(3)诱导成纤维细胞活化的活化剂;
[0075]
(4)促进胶原沉积的制剂。
[0076]
第四方面,本发明实施例还提供一种上述修复型巨噬细胞在制备促进皮肤创面愈合的药物中的应用;
[0077]
优选地,所述药物为促进糖尿病创面愈合的药物。
[0078]
以下结合实施例对本发明的特征和性能作进一步的详细描述。
[0079]
实施例1
[0080]
本发明实施例提供一种修复型巨噬细胞,其制备方法如下:
[0081]
s1、小鼠骨髓单核细胞或巨噬细胞的提取分离与培养
[0082]
取小鼠股骨骨髓,用pbs冲洗出细胞,用70μm的细胞滤网过滤后,使用红血细胞裂解液去除红细胞。得到的细胞为小鼠骨髓单核细胞。所得单核细胞在含有20ng/ml m-csf的1640培液中分化7天,得到小鼠骨髓巨噬细胞(bmdms),即未极化的巨噬细胞(m0)。
[0083]
s2、肿瘤相关巨噬细胞(tams)的分选与培养
[0084]
将小鼠肉瘤细胞系s180细胞(1
×
106)注入动物左腋下皮下建立异位肿瘤模型。当
肿瘤大小达到1cm左右时,处死植入肿瘤的小鼠。取出肿瘤剪碎,转入含有0.2%胶原酶型ⅳ和0.1%dnaseⅰ的1
×
hbss裂解缓冲液中。以90转/分的速度在37度的摇床上消化45分钟形成单细胞和未消化的肿瘤组织块混合物,而后将所述混合物经70μm的细胞滤网过滤去除未消化的肿瘤组织块,得到总单细胞悬液,接着,利用红细胞裂解液对过滤后的总单细胞悬液进行处理,去除红细胞,再用磷酸缓冲液(pbs)进行重悬形成单细胞悬液,将所述单细胞悬液与cd45磁珠孵育。将获得的单细胞悬液与cd45磁珠孵育(107/10μl),然后根据磁珠分选的说明书,将cd45阳性的细胞分选出来。随后,cd45阳性细胞与cd45,cd11b,ly6g,,ly6c,mhc ii和siglecf抗体在冰上避光孵育30分钟,通过流式分选技术将tams分选出来,分选策略见图1。
[0085]
将得到的tams在1640完全培养基、温度为37~38℃、酸碱度为7.2~7.4、二氧化碳为5%的培养环境下培养15-20天,得到tams的培养液,该培养液用于下一步修复型巨噬细胞的诱导。
[0086]
s3、诱导形成修复型巨噬细胞;
[0087]
将107个小鼠骨髓巨噬细胞(bmdms)重新铺在10mm培养皿中,加入8毫升1640完全培养基和2毫升tams的培养液,在温度为37~38℃、酸碱度为7.2~7.4、二氧化碳为5%的培养环境下培养50小时,得到修复型巨噬细胞(记为tamems)。
[0088]
实施例2
[0089]
本实施例提供一种修复型巨噬细胞,其通过肿瘤提取液制备得到,具体制备方法如下:
[0090]
s1、同实施例1的s1方法一样分离与培养小鼠骨髓巨噬细胞(bmdms)。
[0091]
s2、肿瘤提取液的制备;
[0092]
将小鼠肉瘤细胞系s180细胞(1
×
106)注入动物左腋下皮下建立异位肿瘤模型。当肿瘤大小达到1cm左右时,处死植入肿瘤的小鼠。取出0.25g肿瘤剪碎,加入钢化匀浆珠,加入1毫升ph为7.4的磷酸缓冲液(pbs),而后用匀浆机匀浆,条件是:3次,每次2分钟,30赫兹。得到的匀浆液经离心机离心:12000转,10分钟,4℃。取出上清液,得到肿瘤提取液。
[0093]
s3、诱导形成修复型巨噬细胞
[0094]
将107个小鼠骨髓巨噬细胞(bmdms)重新铺在10mm培养皿中,加入10毫升含有肿瘤提取液(30μg/ml)的1640完全培养基,在温度为37~38℃、酸碱度为7.2~7.4、二氧化碳为5%的培养环境下培养36小时,得到肿瘤提取液诱导的修复型巨噬细胞(tems)。
[0095]
实施例3
[0096]
本实施例提供一种修复型巨噬细胞,其通过tams培养上清诱导单核细胞制备得到,具体制备方法如下:
[0097]
参照实施例1中的s1,在得到小鼠骨髓单核细胞之后,不再继续用m-csf诱导成巨噬细胞,而是直接用于后续实验。参照实施例1中的s2,制备tams的培养液。而后将107个小鼠骨髓单核细胞重新铺在10mm培养皿中,加入8毫升1640完全培养基和2毫升tams的培养液,在温度为37~38℃、酸碱度为7.2~7.4、二氧化碳为5%的培养环境下培养36-50小时,得到修复型巨噬细胞(记为tamemos)。
[0098]
对照组0:参照实施例1的制备方法诱导bmdms分化。诱导出了bmdms即为未极化的巨噬细胞(记为m0)。
[0099]
对照组1:参照实施例1的制备方法诱导bmdms分化,区别在于s3不同,s1和s2相同,具体地:用100ng/ml lps和40ng/ml ifn-γ刺激bmdms 48h,得到m1巨噬细胞(记为m1)。
[0100]
对照组2:参照实施例1的制备方法诱导bmdms分化,区别在于s3不同,s1和s2相同,具体地:用40ng/ml il-4和20ng/ml il-13刺激bmdms 48h得到m2巨噬细胞(记为m2)。
[0101]
整体bmdms诱导分化的策略见图2。
[0102]
实验例1
[0103]
对实施例1制备得到的修复型巨噬细胞(即tamems)、对照组0-2的m0巨噬细胞、m1巨噬细胞和m2巨噬细胞分别进行检测,参见图3-图7。图3为不同巨噬细胞的吉姆萨染色结果图,图4为不同巨噬细胞的ki67(细胞增殖指标)免疫荧光染色结果图,图5为不同巨噬细胞表面标志物表达情况,图6为tamems高表达促血管新生及基质细胞增殖的基因图,图7为单细胞rna测序展示了tamems独特的基因表达谱。
[0104]
根据图3可知,诱导出的tamems具有纤维状的形态,较对照组0-2的巨噬细胞有更长的细胞直径,且形态保持的时间更长。根据图4可知,与其他三种巨噬细胞相比,tamems具有一定的增殖能力。根据图5可知,tamems同时表达m1和m2的表面标志物,如cd80、cd206、cd163。根据图6可知,tamems高表达促血管新生和促基质细胞增殖的相关基因,如pdgf-b、ang。根据图7可知,tamems拥有与传统意义上m1和m2独特的基因表型。以上说明通过使用tams培养液可以在体外诱导出区别于m1和m2,且有促进组织修复潜力的修复型巨噬细胞。
[0105]
实验例2
[0106]
分别将实施例1制备得到的tamems、对照组0-2的m0巨噬细胞-m2巨噬细胞在相同条件下进行体外培养,而后分别收集培养上清液,其中,培养tamems得到的上清液,即为tamem-cm,对照组0-2的巨噬细胞的培养上清液分别依次记为m0-cm、m1-cm和m2-cm。具体地,107个上述得到的四种细胞铺在10cm培养皿中,加入10毫升1640完全培养基在细胞培养箱中培养36-50小时,培养条件包括:温度为37~38℃、酸碱度为7.2~7.4、二氧化碳为5%。而后分别收集培养上清液。
[0107]
实验例3
[0108]
分别分析实验例2制备得到的tamem-cm、m0-cm、m1-cm和m2-cm的可溶性细胞因子和血管生成因子的分泌情况。使用r&d systems公司的蛋白质组分析小鼠细胞因子阵列试剂盒(proteome profiler mouse cytokine array kit,panel a)和蛋白质组分析小鼠血管生成阵列试剂盒(proteome profiler mouse angiogenesis array kit),具体的操作参照官方说明书。结果见图8,根据图8可知,tamems的培养上清(即tamem-cm)包含较多的il-4,il-16等促进免疫抑制的细胞因子,还有更多的amphiregulin,igfbp-3,pentraxin 3等促进血管新生的细胞因子,和pdgf-b,afgf等促进细胞增殖和基质分泌的细胞因子。
[0109]
实验例4
[0110]
分别利用实验例2中的上清液培养小鼠骨髓巨噬细胞,具体地,将107个小鼠骨髓巨噬细胞铺入10cm培养皿,而后添加5毫升1640完全培养基和5毫升上述上清液,实验对照组只加入10毫升1640完全培养基(记为normal medium)。而后在温度为37~38℃、酸碱度为7.2~7.4、二氧化碳为5%的条件下培养时间36-50小时。并考察小鼠骨髓巨噬细胞的表型变化。
[0111]
结果参见图9,根据图9可知,tamems的培养上清(即tamem-cm)可以诱导m0巨噬细
胞向抑炎表型转变,说明该修复性巨噬细胞可以用于制备诱导m0巨噬细胞向抑炎表型转变的诱导制剂。
[0112]
实验例5
[0113]
将10μl基质胶matrigel铺在μ-slide板上。之后将104个人血管内皮细胞(huvecs)种在基质胶上,分别加入50μl实验例2制备得到的m0-cm、m1-cm、m2-cm和tamem-cm,1640完全培养基(记为normal medium)作为阴性对照,含vegf(40-80ng/ml)的1640完全培养基为阳性对照。而后在温度为37~38℃、酸碱度为7.2~7.4、二氧化碳为5%的条件下培养时间4-8小时。随后进行calcein am(钙黄绿素am)染色,显微镜观察,拍照结果参见图10,根据图10可知,相对于其他细胞,tamems有很强的促血管新生的能力。
[0114]
实验例6
[0115]
分别利用上述m0-cm、m1-cm、m2-cm和tamem-cm去培养小鼠成纤维细胞(l929),1640完全培养基(记为normal medium)作为阴性对照。通过免疫荧光观察其平滑肌动蛋白(α-sma)和胶原的表达情况。其中,每2
×
105~3
×
105个细胞对应0.5毫升上清液加0.5毫升1640完全培养基,温度为37~38℃、酸碱度为7.2~7.4、二氧化碳为5%的条件下培养时间24小时。
[0116]
检测结果参见图11,根据图11可知,与其他巨噬细胞相比,tamems更好的活化成纤维细胞。
[0117]
实验例7
[0118]
腹腔注射戊巴比妥钠(50mg/kg)麻醉正常(健康)小鼠,在其背部造出一个直径为6mm大小的全层切除伤口。将3
×
105个tamems种植在明胶纺织的静电纺丝上,之后移植在伤口处,用同样的方法移植对照组0-2的巨噬细胞即同样的方法移植m0-m2。不进行任何细胞移植的实验组为阴性对照组(记为blank control)。分别在0,3,6,9,12,15天观察其伤口大小,结果参见图12,根据图12可知,相较于其他巨噬细胞,在促伤口愈合方面,tamems展现出更强的能力。
[0119]
实验例8
[0120]
连续5天向小鼠腹腔内注射链脲霉素stz(50mg/kg)建立小鼠糖尿病模型。随后对这些老鼠进行连续14天的血糖观测,血糖持续高于14mmol/l的小鼠被用于建立伤口模型。与上述实验例5的方法一致,麻醉老鼠后,在其背部制造出直径为6mm的全层切除伤口,随后将种植在静电纺丝上的tamems和对照组0-2的m0-m2巨噬细胞移植到伤口处,不进行任何细胞移植的老鼠作为阴性对照组(记为blank control),正常老鼠(非糖尿病老鼠)同样的方法建立伤口模型作为阳性对照组(记为normal mice)。血管评估实验中,以未受伤的皮肤血管作为阳性对照(记为unwound)。随后分别在0,3,7,11,15,21天观察并记录伤口愈合的情况。
[0121]
结果参见图13,根据图13可知,tamems同样可以很好的促进糖尿病伤口的愈合,加快伤口的再上皮化而且有较多的皮肤附属器官的再生。
[0122]
同时,对小鼠伤口处成纤维细胞的胶原分泌进行检测,检测结果参见图14,根据图14可知,tamems可以促进伤口处成纤维细胞的胶原的沉积。
[0123]
同时,对小鼠伤口处血管新生及成熟进行检测,检测结果参见图15,根据图15可知,tamems促进伤口处血管的新生以及成熟。
[0124]
综上可以看出,本发明实施例提供的修复型巨噬细胞即tamems可以用于制备促进皮肤创面愈合的药物,特别是促进糖尿病创面愈合的药物。
[0125]
实验例9
[0126]
对实施例2制备得到的修复型巨噬细胞(即tems)、对照组0-2的m0巨噬细胞、m1巨噬细胞和m2巨噬细胞分别进行检测,参见图16。图16为tems及其他对照巨噬细胞促炎因子、抑炎因子及常见生长因子基因表达情况。根据图16可知,诱导出来的tems高表达抑炎型巨噬细胞的表型,且高表达生长因子,如vegf和pdgf。
[0127]
实验例10
[0128]
对实施例3制备得到的修复型巨噬细胞(即tamemos)、对照组0-2的m0巨噬细胞、m1巨噬细胞和m2巨噬细胞分别进行检测,参见图17。图17为tamemos及其他对照巨噬细胞促炎因子、抑炎因子及常见生长因子基因表达情况。根据图17可知,诱导出来的tamemo表型偏抑炎表型,但是生长因子表达不高。
[0129]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。