1.与鲁索替尼(ruxo1itinib)的口服液体配制品或剂型相关的组合物和技术。
背景技术:
2.鲁索替尼((r)-3-(4-(7h-吡咯并[2,3-d]嘧啶-4-基)-1h-吡唑-1-基)-3-环戊基丙烷腈)是经配制为口服速释片剂的市售产品,其以5-mg、10-mg、15-mg、20-mg和25-mg剂量强度每天两次(bid)施用,用于治疗jak激酶(janus kinase,jak)相关疾病,如成人患者的骨髓纤维化(mf)、真性红细胞增多症(pv)和移植物抗宿主病(gvhd)。本文提出的鲁索替尼的配制品通过提供呈液体形式的剂型来补充现有产品。
[0003]
gvhd在儿童患者(28天至18岁)中普遍存在,因此需要与年龄相适宜的剂型。除了儿童群体外,对于成人患者来说,也存在鲁索替尼固体剂型难以吞咽的问题。因此,需要多种剂量的鲁索替尼的经改进的新配制品,以提高安全性并增加患者依从性。
技术实现要素:
[0004]
本发明的一方面提供了口服液体配制品,其包含具有式i的鲁索替尼(也称为(r)-3-(4-(7h-吡咯并[2,3-d]嘧啶-4-基)-1h-吡唑-1-基)-3-环戊基丙烷腈):
[0005][0006]
或药学上可接受的盐。
[0007]
在一个实施例中,本发明涉及口服配制品,其包含:
[0008]
(a)鲁索替尼或其药学上可接受的盐,
[0009]
(b)溶剂,
[0010]
(c)防腐剂。
[0011]
在一个实施例中,口服配制品中的溶剂是水。
[0012]
在一个实施例中,口服配制品中的防腐剂是对羟基苯甲酸甲酯和对羟基苯甲酸丙酯的混合物。
[0013]
在一个实施例中,口服配制品进一步包含共溶剂。
[0014]
在一个实施例中,口服配制品进一步包含甜味剂。
[0015]
在一个实施例中,口服配制品进一步包含调味剂。
[0016]
在一个实施例中,口服配制品进一步包含ph调节剂。
[0017]
在一个实施例中,共溶剂是丙二醇。
[0018]
在一个实施例中,甜味剂是三氯蔗糖。
[0019]
在一个实施例中,调味剂是草莓调味剂。
[0020]
在一个实施例中,ph调节剂是柠檬酸。
[0021]
在一个实施例中,鲁索替尼(基于游离碱)浓度为约1mg/ml至5mg/ml。
[0022]
本发明的其他方面提供了治疗jak激酶(jak)相关疾病的方法,该方法包括施用本披露的口服配制品的步骤,该口服配制品包含约1mg至约65mg的鲁索替尼(基于游离碱)或其药学上可接受的盐。
附图说明
[0023]
图1概述了儿童急性gvhd试验的研究设计。
[0024]
图2概述了儿童慢性gvhd试验的研究设计。
具体实施方式
[0025]
目前jakafi/jakavi
tm
(鲁索替尼)的商业配制品是口服片剂,按每天两次(bid)施用。
[0026]
磷酸鲁索替尼在生物药剂学分类系统(bcs)中被指定为1类化合物。磷酸鲁索替尼是具有ph依赖性溶解度的水溶性药物,在较低ph下表现出溶解度增加。液体中的原料药主要由于氧化而降解。温度和氧气引起氧化降解的增加。对于口服溶液配制品,需要用酸化剂(如柠檬酸)将ph维持在2.4至4.0之间,以将药物保持在溶液中。在制造过程中,在药物分散步骤中进行氮气吹扫以提供具有最少氧气的惰性环境。发现将溶液的ph维持在2.4-4.0,并且使用正确的防腐剂系统(如对羟基苯甲酸甲酯加对羟基苯甲酸丙酯)、掩味剂(如三氯蔗糖)、调味剂(如草莓调味剂),以及简单的混合方法可有效得到稳定适口的口服溶液配制品。
[0027]
基于化学/物理稳定性(目前在室温下的保质期为12个月(随着额外稳定性数据的获得,保质期预计会延长))和微生物稳定性(具有最佳防腐剂水平和赋形剂安全水平),该配制品是稳定的。
[0028]
与大多数液体剂型在低温下储存不同,该配制品可在室温下储存。这是种无糖、多用途的配制品,可以给儿童患者长时间使用,而不用太担心龋齿。它也可用于难以吞咽固体剂型的成人患者。
[0029]
向患者施用的鲁索替尼的剂量取决于许多因素,如患者的体重、患者的体表面积、症状的严重程度以及正在施用的任何其他药物的性质。因此,相应地调整治疗剂量,以实现相当的药代动力学特征和相似的治疗效果。
[0030]
该配制品是速释配制品。其通常每天两次(bid)施用。
[0031]
如本文所用,术语“药物组合物”意指含有要施用于哺乳动物(例如人)以预防、治疗或控制影响该哺乳动物的特定疾病或病症的治疗化合物的混合物(例如固体分散体)和/或溶液(例如液体溶液)。例如,如本文所用,术语“药物组合物”还涵盖在高温和高压下形成的紧密的物理混合物。
[0032]
如本文所用,术语“药学上可接受的”是指在合理医学判断范围内,适合用于与哺
乳动物(尤其是人)的组织接触而不产生过度毒性、刺激、过敏反应、和与合理受益/风险比相称的其他问题并发症的那些化合物、材料、组合物和/或剂型。
[0033]
如本文所用,术语“治疗化合物”意指具有治疗或药理学作用,并且适合以特别适合用于口服施用的组合物向哺乳动物(例如人)施用的任何化合物、物质、药物、药剂或活性成分。在本发明中作为治疗化合物特别有用的是鲁索替尼及其药学上可接受的盐。
[0034]
如本文所用,术语“鲁索替尼”是指鲁索替尼的游离碱或其药学上可接受的盐(例如,磷酸鲁索替尼)。
[0035]
在示例性实施例中,口服配制品含有鲁索替尼磷酸盐。
[0036]
在另一个实施例中,口服配制品包含一种或多种防腐剂。防腐剂可以是单独或组合的抗微生物防腐剂。一种或多种防腐剂可选自由以下组成的组:山梨酸钾、苯甲酸钠、对羟基苯甲酸甲酯和对羟基苯甲酸丙酯。
[0037]
在一个特定实施例中,防腐剂是对羟基苯甲酸甲酯和对羟基苯甲酸丙酯的混合物。
[0038]
在防腐剂混合物中,对羟基苯甲酸甲酯与对羟基苯甲酸丙酯的比率可以从3∶1至1∶9(重量比)变化。
[0039]
配制品中防腐剂的浓度范围为约0.1mg/ml至5mg/ml。作为实例,防腐剂对羟基苯甲酸甲酯的浓度约为1.2-1.3mg/ml,并且对羟基苯甲酸丙酯的浓度为0.3-0.5mg/ml。
[0040]
在另一个实施例中,口服配制品包含一种或多种共溶剂。一种或多种共溶剂可选自由以下组成的组:乙醇、甘油、丙二醇和聚乙二醇。
[0041]
在一个特定实施例中,共溶剂是丙二醇。
[0042]
配制品中一种或多种共溶剂的浓度范围为约50mg/ml至300mg/ml。作为实例,共溶剂的浓度为约100-200mg/ml,更特定地,150mg/ml。
[0043]
在另一个实施例中,口服配制品包含一种或多种甜味剂以掩盖药物或赋形剂令人不快的感官特性。一种或多种甜味剂可选自由以下组成的组:蔗糖、三氯蔗糖、阿斯巴甜、乙酰磺胺酸钾和糖精钠。
[0044]
在一个特定实施例中,甜味剂是三氯蔗糖。
[0045]
配制品中甜味剂的浓度范围为约0.5mg/ml至6mg/ml。作为实例,甜味剂的浓度为约1-3mg/ml,更特定地,2mg/ml。
[0046]
在另一个实施例中,口服配制品包含一种或多种调味剂以掩盖药物或赋形剂令人不快的感官特性。调味剂可选自由以下组成的组:香蕉、巧克力、橙子、樱桃、草莓、蓝莓、什锦水果(tutti fruity)等的调味剂。
[0047]
在一个特定实施例中,调味剂是草莓调味剂。
[0048]
配制品中调味剂的浓度范围为约0.5mg/ml至5mg/ml。作为实例,草莓调味剂的浓度为约1-4mg/ml,更特定地,2.5mg/ml。
[0049]
在另一个实施例中,口服配制品包含一种或多种ph调节剂。一种或多种ph调节剂可选自由以下组成的组:柠檬酸、富马酸、乳酸、磷酸、酒石酸和琥珀酸。
[0050]
在一个特定实施例中,ph调节剂是柠檬酸。
[0051]
配制品中ph调节剂的浓度范围为约2mg/ml至8mg/ml。作为实例,ph调节剂的范围为约4-5mg/ml,特定地约4.27mg/ml。
[0052]
在另一个实施例中,口服配制品的ph水平在约2至4的范围内,特别地约2.7
±
0.5。
[0053]
在另一个实施例中,口服配制品中鲁索替尼(基于游离碱)的浓度为约o.1mg/ml至约10mg/ml,优选地约1mg/ml至6mg/ml,最优选地约1mg/ml至5mg/ml。
[0054]
方法
[0055]
本发明的另一方面涉及通过向需要这种治疗的个体施用本发明的口服液体配制品来治疗个体(例如,患者)的jak相关疾病或障碍的方法。jak相关疾病可包括与jak的表达或活性(包括过表达和/或异常活性水平)直接或间接相关的任何疾病、障碍或病症。jak相关疾病还可以包括可以通过调节jak活性来预防、改善或治愈的任何疾病、障碍或病症。
[0056]
在另外的实施例中,jak相关疾病是癌症,该癌症包括通过以下表征的那些:实体瘤(例如,前列腺癌、肾癌、肝癌、胰腺癌、胃癌、乳腺癌、肺癌、头颈癌、甲状腺癌、胶质母细胞瘤、卡波西肉瘤、卡斯尔曼病、子宫平滑肌肉瘤、黑色素瘤等)、血液学癌症(例如,淋巴瘤、白血病,如急性淋巴细胞白血病(all)、急性髓细胞性白血病(aml)或多发性骨髓瘤)和皮肤癌,如皮肤t细胞淋巴瘤(ctcl)和皮肤b细胞淋巴瘤。示例性ctcl包括塞扎里综合征和蕈样肉芽肿病。
[0057]
jak相关疾病可进一步包括骨髓增生性障碍(mpd),如真性红细胞增多症(pv)、原发性血小板增多症(et)、原发性骨髓纤维化(pmf)、慢性髓细胞性白血病(cml)、慢性粒-单核细胞白血病(cmml)、高嗜酸性粒细胞增多综合征(hes)、系统性肥大细胞病(smcd)等。在一些实施例中,该骨髓增生性障碍是骨髓纤维化(例如,原发性骨髓纤维化(pmf)或真性红细胞增多症/原发性血小板增多症后骨髓纤维化(post-pv/et mf))。在一些实施例中,该骨髓增生性障碍是原发性血小板增多症后骨髓纤维化(post-et mf)。在一些实施例中,该骨髓增生性障碍是真性红细胞增多症后骨髓纤维化(post-pv mf)。
[0058]
jak相关疾病可进一步包括移植物抗宿主病(gvhd),如急性移植物抗宿主病(agvhd)和慢性移植物抗宿主病(cgvhd)。
[0059]
实例
[0060]
以下实例说明了本发明的方面而不限制本发明。如下列出了用于制备口服溶液的配方。
[0061]
实例1:浓度为5mg/ml的稳定的儿童口服溶液配制品
[0062]
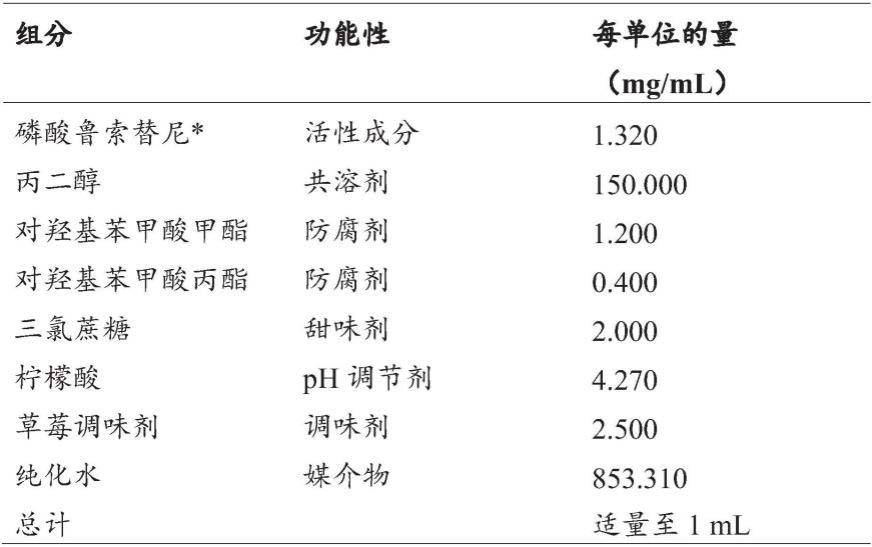
表1.配制品的组合物
[0063][0064]
*盐分因素:1.320
[0065]
这种稳定的儿童口服溶液(表1)已经开发出来,目前在室温下的保质期为12个月,并且随着额外稳定性数据的获得,保质期有可能延长。磷酸鲁索替尼倾向于与防腐剂苯甲酸钠形成共晶。已经发现,在目前的口服溶液配制品中,作为防腐剂系统的对羟基苯甲酸甲酯与对羟基苯甲酸丙酯的组合是可接受的。制造过程是具有几个混合子步骤的简单的混合过程,以在混合在一起之前溶解组分,不需要任何特殊的工艺或技术。使用三氯蔗糖、甜味剂和调味剂(像草莓调味剂)掩盖大部分的原料药的味道。从安全角度来看,配制品中的赋形剂及其水平对于年龄》1个月至18岁的儿童是可接受的。
[0066]
实例2:显示技术优势和/或意想不到的效果的关键表征数据
[0067]
由于主要具有氧化降解产物的原料药在较高温度/水分含量和/或氧气存在下的ph依赖性溶解度(见表2),开发稳定且适口的鲁索替尼口服溶液配制品具有挑战性。如下表2所示,磷酸鲁索替尼在水性介质中显示出ph依赖性溶解度。
[0068]
表1磷酸鲁索替尼的溶解度特征
[0069]
[0070]
为了使药物保持在溶液(1和5mg/ml)中,选择了适口的ph调节剂柠檬酸。选择0.43%的柠檬酸作为ph调节剂,以使溶液中的药物维持在ph 2.7
±
0.3。
[0071]
对初始配制品进行强制降解,以检查溶液的降解特征。以酸(0.1nhcl)、碱(0.1n naoh)、高温(如60℃)和氧化(3%h2o2)为主要参数进行强制降解。两种主要降解物521-11和536-11的水平增加(表3)。
[0072]
521-11的结构是
[0073]
536-11的结构是
[0074]
表0磷酸鲁索替尼的强制降解研究
[0075][0076]
已经生成了两种填充体积(125ml瓶中填充60ml,300ml瓶中填充140ml)的5mg/ml
口服溶液配制品的稳定性数据,并且发现这些数据是可接受的(表4)。
[0077]
表2配制品的稳定性数据
[0078][0079][0080]
*该杂质已被确认为4-羟基苯甲酸(对羟基苯甲酸酯的氧化产物)。
[0081]
**该杂质已被确认为536-11(磷酸鲁索替尼的氧化降解产物)
[0082]
发现口服溶液(5mg/ml)在室温下稳定,赋形剂的味道安全水平可接受,并且制造过程简单。
[0083]
实例3:在异基因造血干细胞移植后患有ii-iv级急性移植物抗宿主病的儿童患者中,添加至皮质类固醇的鲁索替尼的i/ii期开放标签、单组、多中心研究
[0084]
目的:
[0085]
急性移植物抗宿主病(agvhd)病理生理学始于宿主apc的激活,该宿主apc反过来将宿主抗原呈递给供体免疫细胞,导致供体t细胞增殖和炎性细胞因子产生。然后,这些炎性细胞因子募集并诱导额外的免疫效应细胞的增殖,从而使同种异体反应性组织损伤和炎症的不良循环永久化(paczesny等人2010)。鲁索替尼已被证明可降低mf患者的促炎性细胞因子。此外,临床前数据支持鲁索替尼在gvhd中的作用机制:i.)损害apc功能,ii.)抑制供体t细胞增殖,iii.)抑制不良的细胞因子产生,以及iv.)改善gvhd小鼠模型的存活率和疾病临床表现(parampalli yajnanarayana等人2015,heine等人2013,spoerl等人2014)。此外,最近发表的数据显示了在sr-agvhd患者的免疫抑制疗法中加入鲁索替尼治疗的临床疗
效的证据(zeiser等人2015;spoerl等人2014)。目前在成人患者和部分≥12岁的青少年的sr-agvhd环境中,正在进行单独使用鲁索替尼或与最佳可用疗法进行比较的临床研究。
[0086]
虽然儿童患agvhd的风险比成人低,但这种风险仍然很高,尤其是在使用替代供体来源时(jacobsohn和vogelsang 2007)。与成人相似,儿童患者的ii-iv级agvhd的治疗选择有限,包括全身皮质类固醇作为初始护理标准。由于只有30%-50%的儿童对皮质类固醇有应答,因此儿童群体对最佳初始和二线疗法的高医疗需求尚未得到满足。与单独使用皮质类固醇 /-cni相比,最近在sr-agvhd儿童患者中使用鲁索替尼的数据显示出令人鼓舞的总体应答率。鉴于这些数据(如上提到的),在目前缺乏有效的儿童agvhd一线或二线治疗的情况下,本研究旨在评估鲁索替尼治疗与皮质类固醇一起在年龄≥28天至<18岁的未接受治疗和sr-agvhd患者中的安全性、活性和药代动力学。与单独使用类固醇 /-cni作为ii-iv级agvhd的前期治疗相比,预期鲁索替尼将提供更高的疾病应答率。进一步预期,这种应答在类固醇剂量逐渐减少(taper)期间将是持久的,这对患者来说是有意义的临床益处。
[0087]
此外,由于在儿童中观察到的与长期暴露和类固醇的毒性作用相关的风险,未接受治疗的患者可能受益于类固醇减量(sparing)效应。鲁索替尼在未接受治疗和sr-agvhd两者中的预期作用机制和安全性特征相似,因为与成人相比,未接受治疗的患者没有经受广泛的潜在疾病的预治疗。
[0088]
在用鲁索替尼治疗的患者中,预期有意义的临床益处包括其类固醇减量效应、降低类固醇剂量逐渐减少期间经历突然加剧的患者比例、降低感染患者比例和感染严重程度、减少住院持续时间和再住院的需要、维持移植物抗恶性肿瘤效应、以及可能降低发展cgvhd的患者的比例。
[0089]
目标和终点
[0090]
表5目标和相关终点
[0091]
[0092]
[0093][0094]
研究设计
[0095]
这项开放标签、单组、i/ii期多中心研究将调查添加至年龄≥28天至<18岁的患有ii-iv级agvhd或ii-iv级sr-agvhd的婴儿、儿童和青少年的患者的免疫抑制方案的鲁索替尼的pk、活性和安全性。该试验将利用以下年龄组:第1组包括≥12岁至<18岁的患者,第2组包括≥6岁至<12岁的患者,第3组包括≥2岁至<6岁的患者,并且第4组包括≥28天至<2岁的患者。在整个研究过程中,患者将根据治疗开始的年龄保持在该年龄组中。最小年龄组(第4组(i/ii期))的招募开始将经受与数据监查委员会(dmc)、儿童委员会(pdco)协商的可用pk、安全性和活性数据的审查,并由申办方做出最终决定。
[0096]
将招募所有患者并进行24周(大约6个月)的治疗,或直至早期停药。还将对所有患者进行额外18个月的随访(总持续时间=自招募起2年)。如果发生agvhd突然加剧需要重新开始治疗,或者如果由于延长的剂量逐渐减少而在24周结束时没有停用鲁索替尼,患者可以在24周之后继续逐渐减少鲁索替尼剂量,最多48周。由于≥12岁至<18岁的患者(第1组)已经被纳入试验[cruxolitinibc2301],并用10mg bid治疗,该剂量为推荐的ii期剂量(rp2d),将用于治疗该年龄组的所有患者。对于ii期,所有其他年龄组将用i期期间确定的rp2d进行治疗。因此,所有≥12至<18岁的患者将自动纳入ii期。计划在第1组中接受治疗的前5名患者将经受广泛的pk采样,以告知i期中较小年龄组的rp2d测定。如果前5名患者中的一名或多名不可评估,其他患者可能会经受广泛的采样。
[0097]
i期
[0098]
患者将根据年龄分为4组,以便根据表2的可用数据进行适当的给药。
[0099]
·
i期(图1):将在28天内收集第2、3和4组的完整鲁索替尼浓度-时间过程、安全性和活性数据。最初将招募第2组和第3组,并且将产生自所有患者(包括第1组)的pk数据用于告知第4组的起始剂量。因此,只有在为第2组定义了rp2d并且为第3组定义了rp2d之后,第4组才会开放。
[0100]
·
pk和安全性数据将用于评估初步起始剂量的适当性,如果需要,可以对该初步起始剂量进行调整(即考虑预期与观察到的鲁索替尼暴露之间的任何潜在差异)。
[0101]
·
如果在5名可评估患者的pk采样后未确认第2、3或4组中的暴露,将在该特定年龄组中再招募5名患者,直到剂量/暴露得到确认(即根据dmc的暴露和安全性审查为这些年龄选择rp2d)。
[0102]
表6 i期:年龄组和给药原理
[0103][0104]
纳入标准
[0105]
符合纳入这项研究的受试者必须满足以下所有标准:
[0106]
1.在签署知情同意书时年龄≥28天且<18岁的男性或女性患者。
[0107]
2.使用骨髓、外周血干细胞或脐带血从任何供体来源(匹配的不相关的供体、同胞、单倍体相同的供体)进行allosct(异基因造血干细胞移植)的患者。清髓性或低强度条件处理(conditioning)的接受者符合条件。
[0108]
3.在研究治疗开始前48小时内临床确诊为ii-iv级agvhd的患者。
[0109]
患者可能患有
[0110]
根据harris等人2016年的未接受治疗的ii-iv级agvhd。
[0111]
或
[0112]
根据制度准则的类固醇难治性ii-iv级agvhd,并且患者目前正在接受全身皮质类固醇治疗。
[0113]
4.明显的骨髓植入,嗜中性粒细胞绝对计数(anc)》1000/μl,血小板计数》20,000/μl。(允许使用生长因子补充剂和输血支持。)
[0114]
5.能够吞咽研究药(study medication)。
[0115]
6.在筛选时,即在未接受治疗的agvhd或类固醇难治性agvhd诊断时,患者、父母或监护人的书面研究知情同意书和/或允许书。
[0116]
排除标准
[0117]
符合任何以下标准的受试者不具有纳入此研究的资格。
[0118]
1.已接受以下针对agvhd的全身疗法:
[0119]
a.除了先前在急性gvhd发作后,最多72h的甲基泼尼松龙或等效物的全身皮质类固醇疗法外,未接受治疗的agvhd患者先前接受过任何agvhd的全身治疗。允许患者先前接受gvhd预防,这不算作全身治疗(只要预防是在agvhd的诊断之前开始的);
[0120]
或
[0121]
b.sr-agvhd患者除接受皮质类固醇治疗外,还接受过两次或更多次针对agvhd的全身治疗。
[0122]
2.临床表现类似于具有急性和慢性gvhd特征的初发慢性gvhd或gvhd重叠综合征(如jagasia等人2015定义)。
[0123]
3.在过去6个月内,先前的allosct失败。
[0124]
4.存在需要治疗的临床活动性不受控制的感染,该感染包括严重细菌、真菌、病毒或寄生虫感染。如果已经开始适当的疗法,并且在筛选时没有出现进展的体征,则认为感染受到控制。感染进展定义为可归因于败血症的血流动力学不稳定性、新症状、恶化的身体体征或可归因于感染的放射学发现。无其他体征或症状的持续发热不视为进展性感染。
[0125]
5.根据治疗医师的评估,存在不受控制的乙型肝炎病毒(hbv)或丙型肝炎病毒(hcv)的证据。
[0126]
6.临床活动性结核病的证据(根据当地实践进行临床诊断;由于无反应性,因不能提供信息,所以不需要皮肤试验)。
[0127]
7.已知的人类免疫缺陷病毒感染(hiv)。
[0128]
8.存在复发的原发性恶性肿瘤,或在进行allosct后已接受复发治疗的患者,或由于治疗前产生的恶性肿瘤复发而需要戒断免疫抑制的患者。
[0129]
9.施用非计划性dli用于恶性肿瘤重现的先发治疗后发生的急性gvhd。注意:作为移植程序的一部分而不是为了治疗恶性肿瘤复发而接受计划性dli的患者符合条件。
[0130]
10.严重的呼吸系统疾病,包括接受机械通气的患者或通过室内空气脉搏血氧饱和度测定静息o2饱和度<90%的患者。
[0131]
11.存在严重受损的肾功能(在研究治疗开始前72小时内确认),其定义为:
[0132]
·
肾小球滤过率(gfr)<30ml/min/1.73m2,使用通过更新的床边施瓦兹方程(bedside schwartz equation)或科克罗夫特高尔特方程计算的估计的肌酐清除率
[0133]
或
[0134]
·
肾透析需求
[0135]
12.临床上显著或不受控制的心脏病,包括以下任何一种:
[0136]
·
自研究治疗施用的第1天起6个月内的急性心肌梗死
[0137]
·
不受控制的高血压
[0138]
·
纽约心脏协会iii类或iv类充血性心力衰竭
[0139]
·
自筛起最近6个月内的不稳定性心绞痛
[0140]
·
临床上显著的(症状性)心律失常(例如,持续性室性心动过速、和临床上显著的第二度或第三度av阻断而没有起搏器、需要血管加压剂或肌力支持的循环衰竭、或需要疗法的心律失常)。
[0141]
13.淤胆型障碍,或未解决的肝窦阻塞综合征/静脉闭塞性病(定义为不归因于agvhd和持续的器官功能障碍的持续性胆红素异常)。
[0142]
14.在导致allosct的潜在诊断之前,有骨障碍(如成骨不全、佝偻病、肾性骨营养不良、骨髓炎、骨质减少、纤维性发育不良、骨软化症等)史。
[0143]
15.导致allosct的潜在诊断前有内分泌或肾脏相关生长迟缓史。
[0144]
16.筛选后7天内,以剂量》1mg/kg/天的甲基泼尼松龙(或剂量为1.25mg/kg/天的等效药物泼尼松)对除agvhd以外的适应症进行的任何皮质类固醇疗法。允许在条件反射或细胞输注期间施用常规皮质类固醇。
[0145]
17.目前使用干扰凝血或血小板功能的药(包括但不限于阿司匹林和相关药物、肝素、和华法林(以最小化出血风险))的疗法。注意:如果以亚治疗剂量使用肝素或低分子量肝素(lmwh),例如预防肝窦阻塞综合征/静脉闭塞性病,则允许使用。
[0146]
18.进行性多灶性白质脑病(pml)史。
[0147]
19.在开始当前allosct条件处理后,接受针对任何适应症的jak抑制剂疗法的患者。
[0148]
20.在治疗开始前30天内或研究产品的5个半衰期内进行研究治疗,以时间较长者为准。
[0149]
21.经研究人员判断,会干扰全面参与研究(包括研究治疗的施用和参加必要的研究就诊)的任何情况;对患者造成重大风险的任何情况;或干扰研究数据的解释的任何情况。
[0150]
22.已知对全身免疫抑制疗法或鲁索替尼(或其赋形剂中的任一种)过敏、超敏或不耐受。
[0151]
23.怀孕或哺乳的女性患者。
[0152]
24.不同意禁欲,或者如果性活跃,不同意使用避孕措施的具有生育潜力(例如,行经)的女性患者。
[0153]
研究治疗
[0154]
所有患者的研究治疗将以5mg片剂或口服儿童配制品(以液体形式服用)的形式施用,每天两次。
[0155]
·
未接受治疗的agvhd:除鲁索替尼外,治疗必须包括以标准剂量调整至治疗谷水平的基泼尼松龙(或等效药物泼尼松) /-环孢霉素或他克莫司
[0156]
·
sr-agvhd:除鲁索替尼外,允许同时使用以标准剂量调整至治疗谷水平的皮质类固醇 /-环孢霉素或他克莫司。
[0157]
除研究治疗外,患者可以接受标准的allosct支持护理,该支持护理包括抗感染药和输血支持。根据机构指南,允许继续使用全身皮质类固醇、cni(环孢霉素或他克莫司)和局部皮质类固醇疗法。只有在诊断出agvhd之前,用于预防agvhd的其他全身药才可以在第1天后继续使用。对于sr-agvhd患者,在治疗开始之前,需要停止除皮质类固醇 /-cni以外的用于agvhd的其他全身治疗。
[0158]
表7剂量和治疗时间表
[0159]
[0160][0161]
研究者将指导患者根据方案接受研究治疗。
[0162]
在研究期间规定和分配给患者的所有剂量和所有剂量改变都必须记录在剂量施用记录病例报告表(crf)上。
[0163]
鲁索替尼将根据年龄组以指定的起始剂量每天两次口服施用,以5-mg片剂或等效剂量的口服儿童配制品给药。鲁索替尼(片剂或口服儿童配制品)应间隔大约12小时(早晚)服用,不考虑食物。鲁索替尼将由医院人员在住院环境中施用,或由患者在门诊环境中自行施用。
[0164]
应指导患者在计划的给药前血液收集日不要在家接受研究治疗。在这些就诊中,将在给药前血液收集后施用给药。
[0165]
即使患者在治疗期间进入下一个后续年龄组,根据年龄在第1天分配的起始剂量也可能不会增加。
[0166]
实例4:在异基因干细胞移植后患有中度和重度慢性移植物抗宿主病的儿童受试者中,添加至皮质类固醇的鲁索替尼的ii期开放标签、单组、多中心研究
[0167]
目的:
[0168]
慢性移植物抗宿主病(cgvhd))病理生理学始于由受损组织和/或病原体表达的宿主抗原呈递细胞(apc)的激活(dhir等人2014)。然后激活的宿主apc将宿主抗原呈递给供体免疫细胞,导致供体t细胞增殖和炎性细胞因子产生。然后,这些炎性细胞因子募集并诱导额外的免疫效应细胞的增殖,从而使同种异体反应性组织损伤和炎症的不良循环永久化(paczesny等人2010)。预计在小鼠模型和患有cgvhd的成人受试者中确定的cgvhd中的这种信号传导级联,在<12岁的儿童受试者中与在≥12岁的受试者中相同。鲁索替尼已被证明可降低mf患者的促炎性细胞因子。此外,临床前数据支持鲁索替尼在gvhd中的作用机制:i.)损害apc功能,ii.)抑制供体t细胞增殖,iii.)抑制不良的细胞因子产生,以及iv.)改善gvhd小鼠模型的存活率和疾病临床表现(parampalli yajnanarayana等人2015)、(heine等人2013)、(spoerl等人2014)。发表的数据显示了在患有sr-cgvhd的受试者的免疫抑制疗法中加入鲁索替尼治疗的临床疗效的证据(zeiser等人2015)、(spoerl等人2017)。
[0169]
目前在成人受试者和≥12岁的青少年的sr-cgvhd环境中,正在进行单独使用鲁索
替尼或与最佳可用疗法进行比较的临床研究。尽管儿童发展cgvhd的风险低于成人(baird等人2010),但儿童群体中cgvhd的发生率很高,并且最近随着外周血干细胞和不相关的供体的广泛使用而增加(zecca等人2002)。儿童中度至重度cgvhd的治疗变化很大,主要是根据成人的经验推断出来的。虽然没有证据证明“标准疗法”,但皮质类固醇和钙调磷酸酶抑制剂(cni)通常被用作一线疗法。
[0170]
与成人相似,儿童患者的中度至重度cgvhd的治疗选择有限,包括全身皮质类固醇作为初始护理标准。由于只有30%至50%的儿童对皮质类固醇的使用有应答,因此儿童群体对最佳初始和二线疗法的高医疗需求尚未得到满足(wolff等人2011)。此外,对初始免疫抑制治疗(最有可能是皮质类固醇)有应答的儿童需要长期免疫抑制治疗,因此对整体健康和生活质量产生使人衰弱的持续和不可逆的影响(fraser等人,2006年)。
[0171]
鉴于现有数据(如上提到的),在目前缺乏有效的儿童cgvhd一线或二线治疗的情况下,本研究旨在评估鲁索替尼治疗在患有未接受治疗的cgvhd或sr-cgvhd的儿童受试者(年龄≥28天至<18岁)中的药代动力学、安全性和活性。与单独使用类固醇 /-钙调磷酸酶抑制剂(cni)作为中度至重度cgvhd的前期治疗相比,预期鲁索替尼将提供更高的疾病应答率。进一步预期,这种应答在类固醇剂量逐渐减少期间将是持久的,这对儿童受试者来说是有意义的临床益处。在用鲁索替尼治疗的患者中,预期有意义的临床益处包括其类固醇减量效应、降低类固醇剂量逐渐减少期间经历突然加剧的儿童受试者比例、降低感染受试者比例和感染严重程度、减少住院持续时间和再住院的需要、以及维持移植物抗恶性肿瘤效应。
[0172]
目标和终点
[0173]
表8目标和相关终点
[0174]
[0175]
[0176][0177]
研究设计
[0178]
这项开放标签、单组、ii期多中心研究将调查添加至年龄≥28天至<18岁的患有中度至重度未接受治疗的cgvhd或sr-cgvhd的婴儿、儿童和青少年的受试者的免疫抑制方案的鲁索替尼的活性、药代动力学和安全性。该研究将招募大约42名受试者。受试者将根据年龄分组如下:第1组包括≥12岁至《18岁的受试者,第2组包括≥6岁至<12岁的受试者,第3组包括≥2岁至<6岁的受试者,并且第4组包括≥28天至<2岁的受试者。在整个研究过程中,受试者将根据治疗开始的年龄保持在该年龄组中。最小年龄组(第4组)的招募开始将取决于实例3研究中该年龄组数据的可用性,以及经受与数据监测委员会(dmc)协商的由当前研究中第1组至第3组生成的可用pk、安全性和活动数据的审查,并由主办方做出最终决定。第1、2和3组的初步分析需要每组至少5名可评估受试者。第4组不需要最低数量的可评估受试者。
[0179]
在从第28天到第1天的筛选期后,符合条件的受试者将在周期1第1天开始研究治疗(鲁索替尼),并将接受最长3年(39个周期/156周)的治疗或直至早期停药。对于因任何原因在39个周期之前停用鲁索替尼的受试者,将每6个月随访一次,直到达到从第一剂鲁索替尼起3年后。在当地法律法规允许的情况下,所有在治疗3年后继续接受鲁索替尼治疗益处的受试者将有可能在研究之外从其他来源继续接鲁索替尼治疗。
[0180]
鲁索替尼剂量基于该剂量在类固醇难治性移植物抗宿主病(sr-gvhd)受试者中产生的初步疗效和安全性数据(zeiser等人2015),并基于iii期试验cruxolitinibc2301和cruxolitinibd2301产生的pk/安全性数据。由于≥12岁至<18岁的受试已经在接受cruxolitinibd2301中的10mg bid治疗,该剂量为推荐的ii期剂量(rp2d),将用于治疗该年龄组的所有受试者。
[0181]
在实例3的儿童agvhd研究中招募的儿童受试者将提供pk数据,该数据将用于确认上述剂量的适当性,因此,一旦在适当的年龄组中确认了剂量,则<12岁的患者将仅被登记在当前研究的第2至第4组中。如果在实例3的儿童agvhd研究中确认了不同的剂量,则需要在当前研究中相应地调整剂量。参加成人agvhd研究和cgvhd研究的受试者也可以提供pk数据,该数据将用作确认该剂量适当性的附加信息。
[0182]
该试验的研究设计如图2所示。
[0183]
纳入标准
[0184]
符合纳入这项研究的受试者必须满足以下所有标准:
[0185]
1.在签署知情同意书时年龄≥28天且<18岁的男性或女性受试者。
[0186]
2.使用骨髓、外周血干细胞或脐带血从任何供体来源(匹配的不相关的供体、同胞、单倍体相同的供体)进行成功的allosct的受试者。清髓性或低强度条件处理
(conditioning)的接受者符合条件。
[0187]
3.根据nih 2014共识标准,在周期1第1天之前诊断为中度至重度cgvhd的受试者。必须排除支持cgvhd诊断的临床症状的其他可能诊断(例如感染、药物副作用、恶性肿瘤)。受试者必须是:
[0188]
·
除了先前在慢性gvhd发作后,最多72h的甲基泼尼松龙或等效物的全身皮质类固醇疗法外,未接受治疗的cgvhd受试者先前接受过针对cgvhd的任何全身治疗。允许受试者先前接受过cgvhd预防的全身治疗(只要预防是在cgvhd的诊断之前开始的)。
[0189]
或
[0190]
·
根据制度准则,类固醇难治性中度至重度cgvhd,并且在周期1第1天之前,仍在接受全身皮质类固醇治疗cgvhd,持续时间为<18个月。如果皮质类固醇因应答而中断,则<18个月的持续时间适用于皮质类固醇使用的最后一段时间。
[0191]
4.能够吞咽研究药。
[0192]
5.受试者和/或父母/法定监护人的书面研究知情同意书(以及适当时的允许书)
[0193]
排除标准
[0194]
符合任何以下标准的受试者不具有纳入此研究的资格。
[0195]
1.不允许患有先前接受过用jak1-或jak2-或jak1/2-抑制剂的cgvhd治疗的sr-cgvhd受试者,除非受试者达到完全或部分应答,并且在周期1第1天之前已停止治疗先前的jak抑制剂至少4周,或长达先前jak抑制剂半衰期的5倍,以较长者为准。
[0196]
2.在周期1第1天开始鲁索替尼前3周内,开始全身钙调磷酸酶抑制剂(cni;环孢霉素或他克莫司)的受试者。注意:当自开始鲁索替尼后》3周开始使用时,允许全身cni。
[0197]
3.在过去6个月内,先前的allosct失败;存在复发的原发性恶性肿瘤,或在进行allosct后已接受复发治疗的患者,或由于治疗前产生的恶性肿瘤复发而需要戒断免疫抑制的受试者。
[0198]
4.严重的呼吸系统疾病,包括接受机械通气的患者或通过室内空气脉搏血氧饱和度测定静息氧气饱和度<90%的受试者。
[0199]
5.胃肠(gi)功能受损(与gvhd无关)或可能显著改变口服鲁索替尼的吸收的gi疾病(gvhd无关)(例如,溃疡性疾病、不受控的恶心、呕吐、腹泻、吸收不良综合征或小肠切除术)。
[0200]
6.淤胆型障碍,或未解决的肝窦阻塞综合征/静脉闭塞性病(定义为不归因于cgvhd和持续的器官功能障碍的持续性胆红素异常)。
[0201]
7.存在需要治疗的临床活动性不受控制的感染,该感染包括严重细菌、真菌、病毒或寄生虫感染。如果已经开始适当的疗法,并且在筛选时没有出现进展的体征,则认为感染受到控制。感染进展定义为可归因于败血症的血流动力学不稳定性、新症状、恶化的身体体征或可归因于感染的放射学发现。无其他体征或症状的持续发热不视为进展性感染。
[0202]
8.已知的人类免疫缺陷病毒(hiv)感染。
[0203]
9.根据研究者或代表的评估,存在不受控制的乙型肝炎病毒(hbv)或丙型肝炎病毒(hcv)的证据。
[0204]
10.施用非计划性淋巴细胞输注(dli)用于恶性肿瘤重现的先发治疗后发生的cgvhd。作为移植程序的一部分而不是为了治疗恶性肿瘤复发而接受计划性dli的受试者符
合条件。
[0205]
11.经研究人员判断,会干扰全面参与研究(包括研究药物的施用和参加必要的研究就诊)的任何情况;对受试者造成重大风险的任何情况;或干扰研究数据的解释的任何情况。
[0206]
12.已知对研究药、赋形剂或类似化合物中的任一种过敏、超敏或不耐受。
[0207]
13.在导致allosct的潜在诊断之前,有骨障碍(如成骨不全、佝偻病、肾性骨营养不良、骨髓炎、骨质减少、纤维性发育不良、骨软化症等)史。
[0208]
14.导致allosct的潜在诊断前有内分泌或肾脏相关生长迟缓史。
[0209]
15.怀孕或哺乳的女性青少年受试者。
[0210]
16.不同意禁欲,或者如果性活跃,不同意使用高效避孕措施的具有生育潜力(例如,行经)的女性受试者。
[0211]
17.临床活动性结核病的证据(根据当地实践进行临床诊断)
[0212]
18.筛选就诊后7天内,以剂量>1mg/kg/天的甲基泼尼松龙(或剂量为1.25mg/kg/天的等效药物泼尼松)对除cgvhd以外的适应症进行的任何皮质类固醇疗法。
[0213]
19.目前使用干扰凝血或血小板功能的药(包括但不限于阿司匹林和相关药物、肝素、和华法林(以最小化出血风险)的疗法。注意:如果以亚治疗剂量使用肝素或低分子量肝素(lmwh),例如预防肝窦阻塞综合征/静脉闭塞性病,则允许使用。
[0214]
20.受试者正在接受每日剂量高于200mg的氟康唑治疗。
[0215]
21.受试者正在接受且不同意停止草药制剂/药。这些草药包括但不限于圣约翰草、卡瓦根、麻黄(ma huang)、银杏、脱氢表雄酮(dhea)、育亨宾、锯叶棕和人参。在第一剂研究治疗前至少7天,受试者必须停止使用草药。
[0216]
22.进行性多灶性白质脑病(pml)史。
[0217]
23.在治疗开始前30天内或研究产品的5个半衰期内进行研究治疗,以时间较长者为准。
[0218]
24.存在严重受损的肾功能(在鲁索替尼开始前72h内确认),其定义为:
[0219]
·
肾小球滤过率(gfr)<30ml/min/1.73m2,使用通过更新的床边施瓦兹方程或科克罗夫特高尔特方程计算的估计的肌酐清除率,
[0220]
或
[0221]
·
肾透析需求
[0222]
25.根据研究者判断的严重共病
[0223]
26.根据研究者的判断,预期寿命少于1个月。
[0224]
27.临床上显著或不受控制的心脏病,包括以下任何一种:
[0225]
·
自周期1鲁索替尼施用的第1天起6个月内的急性心肌梗死
[0226]
·
不受控制的高血压
[0227]
·
纽约心脏协会iii类或iv类充血性心力衰竭
[0228]
·
自筛起最近6个月内的不稳定性心绞痛
[0229]
·
临床上显著的(症状性)心律失常(例如,持续性室性心动过速、和临床上显著的第二度或第三度av阻断而没有起搏器、需要血管加压剂或肌力支持的循环衰竭、或需要疗法的心律失常)。
[0230]
治疗
[0231]
研究治疗包括:
[0232]
·
研究性治疗:
[0233]
·
是指鲁索替尼(研究性药物)
[0234]
·
其他研究治疗:
[0235]
·
是指同时使用皮质类固醇治疗未接受治疗的cgvhd或sr-cgvhd
[0236]
鲁索替尼将以5mg鲁索替尼片剂或鲁索替尼口服儿童配制品的形式每天两次施用。
[0237]
·
未接受治疗的cgvhd:除鲁索替尼外,治疗必须包括甲基泼尼松龙(或等效药物泼尼松)
[0238]
·
sr-cgvhd:除鲁索替尼外,允许同时使用皮质类固醇。
[0239]
除研究治疗外,受试者可以接受标准的allosct支持护理,该支持护理包括抗感染药和输血支持。
[0240]
在诊断出cgvhd之前,用于预防cgvhd的全身免疫抑制药可以在周期1第1天后继续使用。如果在鲁索替尼开始前至少3周,即在周期1第1天开始,则可在周期1第1天后继续全身cni。cni应以标准剂量使用,并调整至治疗谷水平。根据机构指南,允许继续使用针对cgvhd的局部皮质类固醇疗法。对于sr-cgvhd受试者,在鲁索替尼开始之前,需要停止除皮质类固醇 /-cni以外的用于cgvhd的其他全身治疗。
[0241]
表9剂量和治疗时间表
[0242]
[0243][0244]
*口服使用的片剂可按照药房手册中的说明粉碎(如果根据bsa的计算剂量不是5mg或10mg,则不允许粉碎)。在这种情况下,应施用口服儿童配制品。应根据药房手册中的说明分配口服儿童配制品。
[0245]
**根据药房手册中的说明,计算剂量可以四舍五入到最接近的可用体积
[0246]
研究者将指导受试者根据方案接受研究性治疗。
[0247]
在研究期间规定和分配给受试者的所有剂量和所有剂量改变都必须记录在剂量施用记录电子病例报告表(crf)上。
[0248]
鲁索替尼将根据年龄组以指定的剂量每天两次口服施用,以5mg片剂或等效剂量的口服儿童配制品给药。鲁索替尼(片剂或口服儿童配制品)应间隔大约12小时(早晚)服用,不考虑食物。鲁索替尼将由研究者或代表施用,或由受试者或父母/法定监护人在门诊环境中自行施用。
[0249]
应指导受试者在计划的pk和生物标志物样品给药前血液收集日不要在家接受研究治疗。在这些就诊中,将在给药前血液收集后施用给药。
[0250]
在受试者完成周期7第1天就诊评估之前,不得更改周期1第1天分配的鲁索替尼剂量(基于年龄),除非需要调整剂量以管理安全性事件。在周期7第1天后,研究者必须根据受试者的年龄和/或生长情况重新评估分配的鲁索替尼剂量。如果新计算剂量与之前计算剂量相比变化》10%,则应调整基于生长的给药。所有剂量变化必须记录在剂量施用记录电子病例报告表(ecrf)上。
[0251]
实例5:浓度为1mg/ml的稳定的儿童口服溶液配制品
[0252]
表10.配制品的组合物
[0253][0254]
*盐分因素1.320
[0255]
实例6:稳定性结果
[0256]
a.目标
[0257]
此实例含有以下的稳定性数据:
[0258]
鲁索替尼1mg/ml和5mg/ml溶液的技术批次变体001稳定性数据涵盖长达6个月的储存期,以及鲁索替尼5mg/ml的技术批次变体002稳定性数据(891147,891148)长达24个月。
[0259]
鲁索替尼5mg/ml溶液的临床批次变体002稳定性数据(891147)涵盖长达12个月的储存期数据,使用中研究42天和冻融研究涵盖长达28天。
[0260]
研究的技术批次列于表14,并且临床批次研究列于表28。鲁索替尼是bcs i类化合物。目前的溶液配制品是鲁索替尼水基溶液,含有普通防腐剂和调味剂,含/不含蔗糖。
[0261]
开发稳定性报告dsr2810(5.0)适用于鲁索替尼1mg/ml和5mg/ml溶液配制品技术批次和临床批次。
[0262]
表11.药物产品变体的说明
[0263]
[0264]
[0265][0266]
b.药物产品的规格
[0267]
当前的临床开发规格as2810中规定了分析规格。
[0268]
c.稳定性研究
[0269]
包装的说明
[0270]
表13.包装的说明
[0271]
[0272]
[0273]
[0274][0275]
表15.稳定性程序1mg/ml安慰剂溶液,t0100216,bo_125_amber_cr_closure
[0276]
[0277]1测试的拉伸点(pull point)以粗体显示。
[0278]
表16.稳定性程序5mg/ml安慰剂溶液,t011 0216,bo_125_amber_cr_closure
[0279][0280]1测试的拉伸点以粗体显示
[0281]
表17.稳定性程序1mg/ml溶液,t109 1215,bo_125_amber_cr_closure
[0282][0283]1测试的拉伸点以粗体显示
[0284]
表18.稳定性程序1mg/ml溶液,t111 1215,bo_125_amber_cr_closure
[0285][0286]1测试的拉伸点以粗体显示
[0287]
表19.稳定性程序5mg/ml溶液,t110 1215,bo_125_amber_cr_closure
[0288][0289]1测试的拉伸点以粗体显示
[0290]
表20.稳定性程序5mg/ml溶液,t112 1215,bo_125_amber_cr_closure
[0291][0292]1测试的拉伸点以粗体显示
[0293]
表21.稳定性程序1mg/ml溶液,t109 1215,bo_300br
[0294][0295]1测试的拉伸点以粗体显示
[0296]
表22.稳定性程序1mg/ml溶液,t111 1215,bo_300br
[0297][0298]1测试的拉伸点以粗体显示
[0299]
表23.稳定性程序5mg/ml溶液,t110 1215,bo_300br
[0300][0301]1测试的拉伸点以粗体显示
[0302]
表24.稳定性程序5mg/ml溶液,t112 1215,bo_300br
[0303][0304]1测试的拉伸点以粗体显示
[0305]
表25.稳定性程序5mg/ml溶液,h0004(60ml),bo_125_amber_cr_closure
[0306][0307]1测试的拉伸点以粗体显示。
[0308]
2 45天
[0309]
表26.稳定性程序5mg/ml溶液,h0004(140ml),bo_300_amber_cr_closure
[0310][0311]1测试的拉伸点以粗体显示。
[0312]
2 45天
[0313]
表27稳定性程序5mg/ml溶液,h0004(60ml),使用中研究bo_125_amber_cr_closure
[0314][0315]1测试的拉伸点以粗体显示。
[0316][0317]
表29.稳定性程序5mg/ml溶液,2034827(140ml),使用中研究bo_300_amber_cr_closure
[0318][0319]
表c0.稳定性程序5mg/ml溶液,2034827(140ml),冻融研究bo_300_amber_cr_closure
[0320][0321]
表31.稳定性程序5mg/ml溶液,2034827(140ml)_upright_bo_300_amber_cr_closure
[0322][0323]1测试的拉伸点以粗体显示。
[0324]
2 6周
[0325]
表c2.稳定性程序5mg/ml溶液,2034827(140ml)_inverted_bo_300_amber_cr_closure
[0326][0327]1测试的拉伸点以粗体显示。
[0328]
2 6周
[0329]
特殊测试
[0330]
冻融循环测试
[0331]
该测试使用一个包装在bo_300_amber_cr_closure容器中的临床批次(5mg/ml,批次:2034827)进行。将稳定性样品储存四个完整的冻融循环(-20℃/环境rh下放置6天,然后在25℃/60%rh下放置1天)。28天后采集样品并进行分析。5mg/ml(140ml)bo_300_amber_cr_closure容器的冻融循环测试结果被认为是最坏的情况(具有较大顶空),也适用于5mg/ml(60ml)bo_125_amber_cr_closure容器。
[0332]
使用中研究
[0333]
该测试用一个包装在bo_125_amber_cr_closure中的技术批次(5mg/ml,批次h0004),和一个包装在bo_300_amber_cr_closure容器中的临床批次(5mg/ml,批次2034827)进行。
[0334]
技术批次和临床批次均在25℃/60%rh下储存长达42天并进行分析。
[0335]
d.结果、讨论和解释
[0336]
技术批次
[0337]
在5摄氏度/环境rh下测试
[0338]
bo_125_amber_cr_closure和bo_300_amber_cr_closure(5mg/ml剂量)
[0339]
获得的以下技术批次号的所有结果:h0004(60ml)/(5mg/ml)bo_125_amber_cr_closure,以及h0004(140ml)/(5mg/ml)bo_300_amber_cr_closure,均符合规格。在5℃/环境rh下,配制品(5mg/ml)的鲁索替尼、对羟基苯甲酸甲酯和对羟基苯甲酸丙酯的ph值、对映异构体含量、降解产物和测定值没有显著的变化。
[0340]
所有测试的物理和化学性质(包括活性测定和防腐剂、降解产物、对映异构体、ph以及24个月内的外观)均没有显著的变化。
[0341]
25摄氏度/60%rh下的长期条件
[0342]
bo_125_amber_cr_closure和bo_300_amber_cr_closure(5mg/ml剂量)
[0343]
获得的以下技术批次号的所有结果:h0004(60ml)/(5mg/ml)bo_125_amber_cr_closure,以及h0004(140ml)/(5mg/ml)bo_300_amber_cr_closure,均符合规格。在25℃/60%rh的长期条件下,配制品(5mg/ml)的鲁索替尼、对羟基苯甲酸甲酯和对羟基苯甲酸丙酯的ph值、对映异构体含量、降解产物和测定值没有显著的变化。
[0344]
所有测试的物理和化学性质(包括活性测定和防腐剂、降解产物、对映异构体、ph以及24个月内的外观)均没有显著的变化。
[0345]
在40摄氏度/75%rh下测试
[0346]
bo_125_amber_cr_closure和bo_300_amber_cr_closure(5mg/ml剂量)
[0347]
获得的以下技术批次号的所有结果:h0004(60ml)/(5mg/ml)bo_125_amber_cr_closure,以及h0004(140ml)/(5mg/ml)bo_300_amber_cr_closure,在40℃/75%rh的加速条件,配制品(5mg/ml)的鲁索替尼、对羟基苯甲酸甲酯和对羟基苯甲酸丙酯的ph值、对映异构体含量和测定值没有显著的变化。
[0348]
对于批次h0004(60ml)和h0004(140ml)两者,在6个月的分析中观察到降解产物的oos结果。对于批次号:h0004(60ml)和h0004(140ml),分别观察到0.6%和0.7%水平下未知杂质rrt 0.33结果。在根本原因调查过程中,确定该未知杂质是与防腐剂相关的降解。更多详情,请参考aqwa#2184230。此外,对h0004(60ml)和h0004(140ml)两者进行6个月的分析,分别观察到0.4%水平的536-11降解产物。虽然这些没有超过当前规格中设定的早期阶段限制,但需要监控增长情况。
[0349]
所有其他结果(物理和化学)都保持在这些批次的规格限值范围内。
[0350]
使用中研究
[0351]
bo_125_amber_cr_closure(5mg/ml剂量)
[0352]
该测试使用一个包装在bo_125_amber_cr_closure容器的技术批次:h0004(60ml)
进行。将样品在25℃/60%rh下储存在开口瓶中长达42天,并进行分析。
[0353]
所有测试的物理和化学性质(包括活性测定和防腐剂、降解产物、对映异构体、ph以及42天的外观)均没有显著的变化。
[0354]
临床批次
[0355]
在5摄氏度/环境rh下测试
[0356]
bo_300_amber_cr_closure_upright_(5mg/ml剂量)
[0357]
获得的以下临床批次号的所有结果:2034827(140ml)/(5mg/ml)bo_300_amber_cr_closure_upright,这些结果均符合规格。在5℃/环境rh下,配制品(5mg/ml)的鲁索替尼、对羟基苯甲酸甲酯和对羟基苯甲酸丙酯的ph值、对映异构体含量、降解产物和测定值没有显著的变化。
[0358]
所有测试的物理和化学性质(包括活性测定和防腐剂、降解产物、对映异构体、ph以及12个月内的外观)均没有显著的变化。
[0359]
25摄氏度/60%rh下的长期条件
[0360]
bo_300_amber_cr_closure_upright(5mg/ml剂量)
[0361]
获得的以下临床批次号的所有结果:2034827(140ml)/(5mg/ml)bo_300_amber_cr_closure_upright,这些结果均符合规格。在25℃/60%rh下,配制品的鲁索替尼、对羟基苯甲酸甲酯和对羟基苯甲酸丙酯的ph值、对映异构体含量、降解产物和测定值没有显著的变化。
[0362]
所有测试的物理和化学性质(包括活性测定和防腐剂、降解产物、对映异构体、ph以及12个月内的外观)均没有显著的变化。
[0363]
在30摄氏度/75%rh下测试
[0364]
bo_300_amber_cr_closure_upright_(5mg/ml剂量)
[0365]
获得的以下临床批次号的所有结果:2034827(140ml)/(5mg/ml)bo_300_amber_cr_closure_upright,这些结果均符合规格。在30℃/75%rh下,配制品的鲁索替尼、对羟基苯甲酸甲酯和对羟基苯甲酸丙酯的ph值、对映异构体含量、降解产物和测定值没有显著的变化。
[0366]
所有测试的物理和化学性质(包括活性测定和防腐剂、降解产物、对映异构体、ph以及12个月内的外观)均没有显著的变化。
[0367]
在40摄氏度/75%rh下测试
[0368]
bo_300_amber_cr_closure_upright(5mg/ml剂量)
[0369]
获得的以下临床批次号的所有结果:2034827(140ml)/(5mg/ml)bo_300_amber_cr_closure_upright结果,在40℃/75%rh的加速条件,配制品(5mg/ml)的鲁索替尼、对羟基苯甲酸甲酯和对羟基苯甲酸丙酯的ph值、对映异构体含量和测定值没有显著的变化。
[0370]
在降解产物6个月分析中,观察到oos结果,观察到0.33min时,0.3%和0.7%水平未指明的杂质rrt的结果。在根本原因调查过程中,确定该未知杂质是与防腐剂相关的降解。更多详情,请参考aqwa#2338758。此外,在0.5%的水平上观察到536-11降解产物。
[0371]
所有其他结果(物理和化学)都保持在这些批次的规格限值范围内。
[0372]
在5摄氏度/环境rh下测试
[0373]
bo_300_amber_cr_closure_inverted_(5mg/ml剂量)
[0374]
获得的以下临床批次号的所有结果:2034827(140ml)/(5mg/ml)bo_300_amber_cr_closure_inverted,这些结果均符合规格。在5℃/环境rh下,配制品(5mg/ml)的鲁索替尼、对羟基苯甲酸甲酯和对羟基苯甲酸丙酯的ph值、对映异构体含量、降解产物和测定值没有显著的变化。
[0375]
所有测试的物理和化学性质(包括活性测定和防腐剂、降解产物、对映异构体、ph以及12个月内的外观)均没有显著的变化。
[0376]
25摄氏度/60%rh下的长期条件
[0377]
bo_300_amber_cr_closure_inverted(5mg/ml剂量)
[0378]
获得的以下临床批次号的所有结果:2034827(140ml)/(5mg/ml)bo_300_amber_cr_closure_inverted,这些结果均符合规格。在25℃/60%rh下,配制品的鲁索替尼、对羟基苯甲酸甲酯和对羟基苯甲酸丙酯的ph值、对映异构体含量、降解产物和测定值没有显著的变化。
[0379]
所有测试的物理和化学性质(包括活性测定和防腐剂、降解产物、对映异构体、ph以及12个月内的外观)均没有显著的变化。
[0380]
在30摄氏度/75%rh下测试
[0381]
bo_300_amber_cr_closure_inverted(5mg/ml剂量)
[0382]
获得的以下临床批次号的所有结果:2034827(140ml)/(5mg/ml)bo_300_amber_cr_closure_inverted,这些结果均符合规格。在30℃/75%rh下,配制品的鲁索替尼、对羟基苯甲酸甲酯和对羟基苯甲酸丙酯的ph值、对映异构体含量、降解产物和测定值没有显著的变化。
[0383]
所有测试的物理和化学性质(包括活性测定和防腐剂、降解产物、对映异构体、ph以及12个月内的外观)均没有显著的变化。
[0384]
在40摄氏度/75%rh下测试
[0385]
bo_300_amber_cr_closure_inverted(5mg/ml剂量)
[0386]
获得的以下临床批次号的所有结果:2034827(140ml)/(5mg/ml)bo_300_amber_cr_closure_inverted,这些结果均符合规格。在40℃/75%rh下,配制品的鲁索替尼、对羟基苯甲酸甲酯和对羟基苯甲酸丙酯的ph值、对映异构体含量和测定值没有显著的变化。
[0387]
对于降解产物3个月和6个月分析,分别观察到0.2%和0.5%水平的536-11结果。虽然这些没有超过当前规格中设定的早期阶段限制,但需要监控增长情况。
[0388]
所有其他结果(物理和化学)都保持在这些批次的规格限值范围内。
[0389]
在5摄氏度/环境rh下测试
[0390]
bo_125_amber_cr_closure(安慰剂,1mg/ml和5mg/ml剂量)
[0391]
在稳定性研究期间,仅测试了对羟基苯甲酸甲酯的测定和山梨酸钾的测定,并且没有测试安慰剂样品的所有其他物理和化学参数。
[0392]
当样品储存在5℃/环境rh下时,所有测试样品中对羟基苯甲酸甲酯和api的测定值没有显著的变化。5mg/ml糖配制品样品(t1121215)中山梨酸钾的测定值没有变化,5mg/ml非糖配制品样品(t1101215)中山梨酸钾的测定值从99.3%(时间为0天)略微下降至93.5%(6m),并且1mg/ml非糖配制品样品中山梨酸钾的测定值从94.8%(时间为0天)显著下降至83.3%(6个月)。在1mg/ml糖配制品样品(t1111215)中,山梨酸钾的测定值下降,不
是稳定性指标。然而,山梨酸钾的测定值显著下降。在6m时间点,1mg/ml无糖安慰剂中山梨酸钾含量变为25%,5mg/ml糖安慰剂中山梨酸钾含量变为48%。相比之下,糖配制品中山梨酸钾的下降速度慢于非糖配制品中山梨酸钾的下降。在1mg/ml无糖样品中,在1m时的0.1%水平观察到rrt为0.42、0.43和0.48的三种降解产物,但在稳定性时间点上,在0.1%处仅观察到rrt 0.42的峰值。在1个月时,在0.1%水平的1mg/ml配制品中观察到rrt 0.59处的降解峰,并在3个月时增加到0.2%水平。在5mg/ml的糖和非糖样品中,在超过0.1%水平时无降解峰。
[0393]
在长达6个月内,所有样品的外观和ph值都没有变化。
[0394]
所有结果(物理和化学)都保持在这些批次的规格限值范围内。
[0395]
bo_300br(1mg/ml和5mg/ml剂量)
[0396]
除了在6m时1mg/ml糖配制品的山梨酸钾的测定值,所有测试的物理和化学性质(包括活性测定和防腐剂、杂质分布、对映异构体、ph和外观)均没有显著。1mg/ml糖配制品中山梨酸钾的含量在3m时没有变化,但在6m时急剧下降至79.5%。在报告阈值(0.1%)以上没有观察到降解产物。
[0397]
所有结果(物理和化学)都保持在这些批次的规格限值范围内。
[0398]
加速测试(25摄氏度/60%rh)
[0399]
bo_125_amber_cr_closure(安慰剂,1mg/ml和5mg/ml剂量)
[0400]
对于安慰剂样品,在稳定性研究期间,仅测试了对羟基苯甲酸甲酯的测定和山梨酸钾的测定,并且没有测试所有其他物理和化学参数。
[0401]
鲁索替尼和对羟基苯甲酸甲酯的ph值、对映异构体含量和测定值没有观察到显著的变化。山梨酸钾在储存期间显著降低,尤其是在安慰剂中。在6m时间点,1mg/ml无糖安慰剂中山梨酸钾含量变为12%,5mg/ml糖安慰剂中山梨酸钾含量变为24%。山梨酸钾在所有样品批次中也下降,但没有在安慰剂中下降得快。山梨酸钾的测定规格“仅供参考”。
[0402]
仅在t1091215(1mg/ml无蔗糖配制品)3个月样品中观察到0.1%水平的rrt 0.43处的杂质。1个月后,在同一批次的样品中观察到rrt 0.48处的杂质,但在3个月和6个月的样品中没有观察到。在t1111215(1mg/ml蔗糖配制品)1个月样品而不是3个月样品中观察到0.2%水平的rrt 0.59处的杂质,而是在6个月样品中观察到0.3%水平的杂质。在两种5mg/ml配制品中均未观察到超过0.1%水平的降解产物。t10911215和t1111215的外观在长达3个月内保持透明无色,但在6个月内,透明度是透明的,并且颜色与批次号为t1091215的
‘
y5’(浅黄色)相匹配,并且透明度与乳白色标准iv(根据欧洲药典)相匹配,批次号t1111215的颜色保持无色。t110 1215(5mg/ml非蔗糖配制品)的颜色在3个月和6个月时与
‘
y4’(黄色)匹配,并且透明度保持清晰长达6个月。t1121215(5mg/ml蔗糖配制品)的颜色在3个月和6个月时与
‘
y5’(黄色)匹配,并且透明度保持清晰长达6个月。然而,在这些样品中没有检测到报告阈值(0.1%)以上的降解产物。
[0403]
所有结果(物理和化学)都保持在这些批次的规格限值范围内。
[0404]
bo_300br(1mg/ml和5mg/ml剂量)
[0405]
在bo_300br中得到的所有结果与在bo_125_amber_cr_closure中得到的结果非常相似或前者略好于后者。两种非糖配制品(1mg/ml和5mg/ml两者)的鲁索替尼和对羟基苯甲酸甲酯的ph值、对映异构体含量和测定值以及山梨酸钾的测定值均没有显著的变化。糖配
制品批次的山梨酸钾在储存期间显著降低。然而,山梨酸钾的测定规格“仅供参考”。
[0406]
t1091215、t1111215和t1101215的外观在长达3个月内保持无色,但在6个月时,批次号t1111215的颜色变化为
‘
y5’(浅黄色),并且所有三个批次的透明度在长达6个月内保持清晰。对于批次号t1121215,透明度在长达6个月内保持透明,但在1个月内颜色为无色,在3个月时颜色与
‘
y5’(浅黄色)匹配,在6个月时颜色与
‘
y4’(黄色)匹配。在rt(0.1%)以上没有观察到降解产物。所有结果均保持在规格界限内。
[0407]
在40摄氏度/75%rh下测试
[0408]
bo_125_amber_cr_closure(安慰剂,1mg/ml和5mg/ml剂量)
[0409]
对于安慰剂样品,在稳定性研究期间,仅测试了对羟基苯甲酸甲酯的测定和山梨酸钾的测定,并且没有测试所有其他物理和化学参数。除颜色变化和降解特征外,储存在40℃/75%rh下的样品的所有其他物理和化学测试结果与储存在25℃/60%rh下的样品非常相似。如所预期的,储存在40℃/75%rh下的样品中山梨酸钾的下降速度快于储存在25℃/60%rh下的样品。然而,山梨酸钾的测定规格“仅供参考”。
[0410]
储存在40℃/75%rh下的大多数样品的降解特征与储存在25℃/60%rh下的样品相同。唯一的区别是在t11012151个月的样品中检测到杂质536-11和537-11。t1101215和t1121215在1个月时颜色变成淡黄色。t1091215和t1111215在长达3个月内未观察到颜色变化,在6个月时观察到黄色变化。
[0411]
所有结果(物理和化学)都保持在这些批次的规格限值范围内。
[0412]
bo_300br(1mg/ml和5mg/ml剂量)
[0413]
除颜色变化外,储存在40℃/75%rh下的样品的所有其他物理和化学测试结果与储存在25℃/60%rh下的样品非常相似。t1111215在3个月和6个月时颜色变成淡黄色。所有结果均保持在规格界限内。
[0414]
临床批次
[0415]
使用中研究
[0416]
bo_300_amber_cr_closure(5mg/ml剂量)
[0417]
该测试使用一个包装在bo_300_amber_cr_closure容器的临床批次:2034827(140ml)进行。将样品在25℃/60%rh下储存在开口瓶中长达42天,并进行分析。
[0418]
所有测试的物理和化学性质(包括活性测定和防腐剂、降解产物、对映异构体、ph以及42天的外观)均没有显著的变化。
[0419]
冻融循环测试(20摄氏度/环境rh/25摄氏度/60%rh 28天)(5mg/ml剂量)
[0420]
bo_300_amber_cr_closure(5mg/ml剂量)
[0421]
该测试使用一个包装在bo_300_amber_cr_closure容器的临床批次:2034827(140ml)进行。样品在20℃/环境rh/25℃/60%rh下循环长达28天并进行分析。
[0422]
所有测试的物理和化学性质(包括活性测定和防腐剂、降解产物、对映异构体、ph以及28天的外观)均没有显著的变化。
[0423]
e.结论
[0424]
当分别包装在bo_125_amber_cr_closure和bo_300_amber_cr_closure中,并在25℃/60%rh的长期条件下储存长达24个月,在40℃/75%rh的加速条件下储存长达3个月,在5℃/rh下储存长达24个月时,技术批次h0004(60ml)和h0004(140ml)的鲁索替尼溶液配制
品(891147、891148)在5mg/ml下显示出总体良好的稳定性行为。在所有测试条件下,所有测试参数都保持在建议的规格范围内。
[0425]
在40℃/75%rh条件下,两个批次h0004(60ml)和h0004(140ml)6个月观察到降解产物的oos结果。在批次号h0004(60ml)和h0004(140ml)中分别观察到0.6%和0.7%水平下未知杂质rrt 0.33结果。在根本原因调查过程中,确定该未知杂质是与防腐剂相关的降解。更多详情,请参考aqwa#2184230。此外,在0.4%水平上观察到536-11降解产物,该降解产物需要进行监测。
[0426]
当包装在bo_300_amber_cr_closure_upright(定向)中,在25℃/60%rh的长期条件下储存长达12个月,在40℃/75%rh的加速条件下储存长达3个月,在30℃/75%rh下储存长达12个月,并且在5℃/rh下储存长达12个月时,5mg/ml的临床批次号2034827(140ml)5mg/ml的鲁索替尼溶液配制品(891147)显示出总体良好的稳定性行为。在所有测试条件下,所有测试参数都保持在建议的规格范围内。
[0427]
在40℃/75%rh条件下,批次2034827(140ml)_upright(定向)6个月观察到降解产物的oos结果。在批次号2034827(140ml)_upright中,观察到0.7%上的未知杂质rrt 0.33结果。在根本原因调查过程中,确定该未知杂质是与防腐剂相关的降解。更多详情,请参考aqwa#2338758。此外,在0.5%水平上观察到536-11降解产物,该降解产物需要进行监测。
[0428]
当包装在bo_300_amber_cr_closure_inverted中,在25℃/60%rh的长期条件下储存长达12个月,在30℃/75%rh下储存长达12个月,并且在5℃/rh下储存长达12个月时,5mg/ml的临床批次号2034827(140ml)_5mg/ml的鲁索替尼溶液配制品(891147)显示出总体良好的稳定性行为。在所有测试条件下,所有测试参数都保持在建议的规格范围内。
[0429]
在40℃/75%rh条件下,在3个月和6个月对批次2034827(140ml)_inverted进行分析,在0.2%和0.5%水平下分别观察到536-11降解产物的结果。虽然这些没有超过当前规格中设定的早期阶段限制,但需要监控增长情况。
[0430]
发现鲁索替尼溶液配制品(891147、891148)技术批次h0004(60ml)和临床批次2034827(140ml)长达42天的化学和物理稳定性,当分别储存在bo_125_amber_cr_closure和bo_300_amber_cr_closure容器中时,支持42天的使用期限。
[0431]
根据5mg/ml技术批次h0004(60ml)和h0004(140ml)变体002在24个月时25℃/60%rh下和3个月时40℃/75%rh下的可用稳定性数据,建议药品储存为
‘
储存温度请勿超过25℃’,建议保质期为
‘
24’个月。此外,临床批次2034827_upright(140ml)在12个月时25℃/60%rh下、在12个月时30℃/75%rh下和在3个月时40℃/75%rh下的稳定性数据,以及临床批次2034827inverted(140ml)在12个月时25℃/60%rh下、在12个月时30℃/75%rh下和在3个月时40℃/75%rh下的稳定性数据也支持“24”个月的建议保质期。根据3个月40℃/75%rh下的稳定性数据(变体002),指定运输类别为
‘
温度控制(tempcontrol)’。
[0432]
除山梨酸钾的外观和测定外,获得自技术批次(变体001)的所有其他化学和物理测试结果表明,当包装在bo_125_amber_cr_closure或bo_300br中时,鲁索替尼1mg/ml和5mg/ml溶液配制品在40℃/75%rh(加速条件)、25℃/60%rh(长期储存条件)和5℃/环境rh(冷藏条件)下储存长达6个月时是稳定的。在5℃/环境rh(冷藏条件)下,测试样品的外观在长达6个月的时间内没有变化。在25℃/60%rh度和40℃/75%rh下储存时观察到颜色变化。注意到,对于相同的配制品和样品剂量强度,用bo_300br包装的样品比用bo_125_amber_
cr_closure包装的样品具有更好的结果。糖配制品的颜色变化快于非糖配制品,并且5mg/ml剂量强度的颜色变化快于1mg/ml剂量强度。所有测试的物理和化学性质(包括对映体、活性成分测定、降解产物)都均保持在规格界限内长达6个月。
[0433]
表33.保质期、贮存条件、运输类别以及使用期限的合理性
[0434]
[0435]
[0436]
[0437]
[0438]
[0439]
[0440]
[0441]
[0442]
[0443]
[0444]
[0445]
[0446]
[0447]
[0448]
[0449]
[0450]
[0451]
[0452]
[0453]
[0454]
[0455]
[0456]
[0457]
[0458]
[0459]
[0460]
[0461]
[0462]
[0463]
[0464]
[0465]
[0466]
[0467]
[0468]
[0469]
[0470]
[0471]
[0472]
[0473]
[0474]
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。