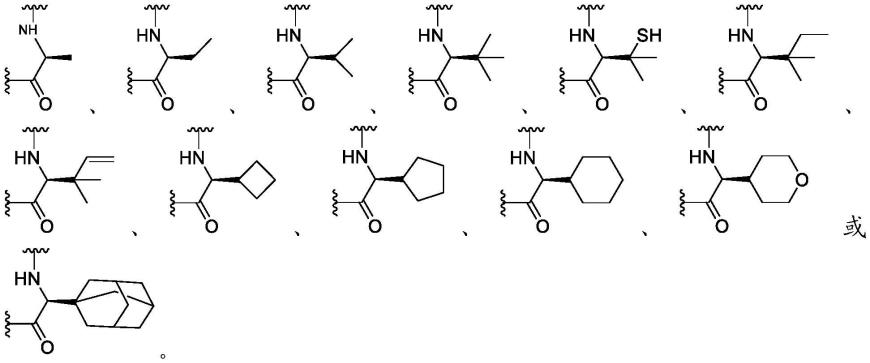
大环化合物及其使用方法
1.相关专利申请的交叉引用
2.本技术要求2020年6月23日提交的美国临时专利申请号63/043,071的权益和优先权,其全部内容据此以引用方式并入本文。
3.序列表
4.本技术含有序列表,所述序列表已经以ascii格式以电子方式提交并且以全文引用的方式并入本文中。所述ascii副本创建于2021年6月21日,命名为p35749-us_sl.txt,并且大小为57,535个字节。
背景技术:
5.细胞维持和正常功能需要细胞蛋白质的受控降解。例如,调节蛋白质的降解会触发细胞周期中的事件,例如dna复制,染色体分离等。因此,这种蛋白质降解会影响细胞的增殖、分化和死亡。
6.小分子抑制剂为针对细胞内蛋白质的主要靶向治疗药物。例如,最近的研究结果已经表明,溴结构域和额外末端结构域(bet)家族的含溴结构域蛋白(例如brd4)的小分子抑制可能在多种人类疾病(包括癌症、炎症、纤维化和病毒复制)中具有临床效用。参见例如,stratton ms、haldar sm和mckinsey ta.brd4 inhibition for the treatment of pathological organ fibrosis f1000research 2017,6:f1000 faculty rev:1015;prinjha等人,trends pharm.sci.,33(3):146-153(2012);和muller等人,expert rev.,13(29):1-20(2011年9月)。这是可能的,因为潜在机制在于转录调控中。因此,在整个家族中,溴结构域的选择性抑制创造了作为人类功能障碍的新型治疗剂的各种机会。
7.虽然蛋白质抑制剂可以阻断或减小细胞中的蛋白质活性,但小分子抑制剂具有局限性。首先,靶蛋白必须具有口袋或活性位点以结合小分子抑制剂,并且据估计,约75%的人类蛋白质组缺乏小分子可接近的口袋,因此使用该策略无成药性。其次,需要持续高的全身药物水平以维持对于疗效而言足够的细胞内浓度,这通常会导致脱靶效应和副作用。第三,小分子通常仅破坏多结构域蛋白质的一个结构域的活性。其他结构域的功能活性以及它们的与其他蛋白质的相互作用得到保留。例如,brd4为包含若干功能结构域的多结构域蛋白,该若干功能结构域包括两个关键的溴结构域。brd4抑制剂可能仅影响这些结构域的一个子集和随之而来的brd4活性,而brd4蛋白质水平的消耗预期会具有更深远的影响,这由brd4敲低研究所模拟。在癌细胞中,多结构域激酶的抑制可能会经由其他替代激酶来导致它们的下游信号传导级联反应的补偿性反馈激活。最后,许多癌症基因高度突变,从而导致蛋白质结构和表达水平的构象变化以及随之而来的耐药性。
8.细胞中的蛋白质降解不仅会减小活性,还会完全移除靶蛋白。因此,利用细胞的蛋白质降解途径可以提供用于减小蛋白质水平和蛋白质活性的手段。细胞的主要蛋白质降解途径中的一个途径已知为泛素-蛋白酶体系统。在该系统中,通过泛素化蛋白质来标记,蛋白质被蛋白酶体降解。蛋白质的泛素化是通过与靶蛋白结合并且将泛素分子添加至蛋白质的e3泛素连接酶完成的。e3泛素连接酶是包括e1和e2泛素连接酶的途径的一部分,这使e3
泛素连接酶可将泛素添加至蛋白质中。
9.为了在药理学上利用该降解途径,已经开发出异双功能小分子以通过化学降解诱导剂(cide)来诱导靶蛋白降解。cide利用细胞内泛素-蛋白酶体系统以选择性地降解靶蛋白。cide将e3泛素连接酶与待被靶向以进行降解的蛋白质结合在一起。为了促进由蛋白酶体来降解蛋白质,cide由与e3泛素连接酶结合的基团和与待被靶向以进行降解的蛋白质结合的基团组成。这些基团通常与接头连接。该分子构建体可以使e3泛素连接酶与蛋白质接近,从而使其泛素化并标记用于由蛋白酶体来降解蛋白质。
10.一种具有治疗潜力的e3连接酶是von hippel-lindau(vhl)肿瘤抑制剂,该抑制剂是e3连接酶复合物vcb的底物识别亚基,其也由延伸蛋白b和c,cul2和rbx1组成。vhl的主要内源性底物为低氧诱导因子1α(hif-1α),该诱导因子为转录因子,其可响应于低氧水平而上调基因,例如促血管生成生长因子vegf和红细胞诱导的细胞因子促红细胞生成素。虽然hif-1α组成性表达,但在常氧条件下,通过脯氨酰羟化酶结构域(phd)蛋白的羟基化作用以及随后的vhl介导的泛素化作用,其细胞内水平保持在非常低的水平。
11.尽管cide解决了在细胞内蛋白质的靶向疗法中与小分子抑制剂相关联的许多问题,但它们也带来了一系列新的挑战。例如,小分子cide的效力通常取决于靶蛋白、cide与泛素系统之间形成的三元复合物的稳定性。因此,高效cide设计的一个关键方面为靶蛋白与泛素系统之间的三元复合物的稳定化。典型的(线性)cide分子包含长的灵活的接头元件。这导致表现出多种构象的动态分子和高熵结合惩罚,因此并不非常适合两种蛋白质之间的三元结构的稳定化。
12.因此,需要治疗涉及疾病(诸如癌症、纤维化、免疫紊乱)中的不需要或有缺陷的蛋白质(例如溴结构域蛋白,如brd4)的疾病和病症,并且需要可以抑制或降解这些蛋白质的化合物。
技术实现要素:
13.本文提供了包含e3泛素连接酶结合基序(eulbm)和至少一个氨基酸的大环化合物,以及制备和使用此类大环eulbm的方法。本文还提供了包含由至少一个氨基酸连接的e3泛素连接酶结合基序(eulbm)和靶蛋白结合基序(tpbm)的大环异双功能化学降解诱导剂(cide),以及制备和使用此类大环异双功能cide的方法。
14.在一方面,本文提供了包含eulbm和至少一个氨基酸的大环化合物。在实施例中,eulbm和三个或更多个氨基酸形成环状多肽。在实施例中,eulbm为vhl结合基序。在实施例中,大环化合物进一步包含与所述大环化合物中的至少一个氨基酸缀合的tpbm。
15.在一方面,本文提供了具有下式的化合物:
[0016][0017]
其中x1、x2、l
1a
、l
1b
、l
1c
、l
2a
、l
2b
、l
2c
各自独立地为键或氨基酸。
[0018]
在另一方面,x1为eulbm,并且l
1a
、l
1b
、l
1c
、x2、l
2a
、l
2b
、l
2c
各自独立地为键或氨基酸。
[0019]
在又一方面,x1为eulbm,x2为tpbm,并且l
1a
、l
1b
、l
1c
、l
2a
、l
2b
、l
2c
各自独立地为键或氨基酸。
[0020]
在其他方面,x2为d-α氨基酸或d-δ氨基酸,l
2c
为d-α氨基酸或d-β氨基酸或键。l
2a
和l
2b
各自独立地为键或氨基酸。l
1a
、l
1b
和l
1c
各自独立地为键或氨基酸。
[0021]
在一方面,本文提供了一种环状vhl结合基序寡肽,其包含选自由以下项组成的组的序列:seq id no.1-68中。
[0022]
在一方面,本文提供了一种环状寡肽,该环状寡肽连接到eulbm(例如vhl结合基序)以形成大环eulbm,该环状寡肽包含选自由以下项组成的组的序列:seq id no.69-111中。
[0023]
在一方面,本文提供了一种药物组合物,其包含如本文所述的化合物或其药用盐,以及药用赋形剂(包括实施例)。
[0024]
在一方面,本文提供了一种治疗癌症的方法,该方法包括向有此需要的受试者施用治疗有效量的如本文所述的化合物或其药用盐。
[0025]
在一方面,本文提供了一种治疗纤维化病症(例如特发性肺纤维化(ipf))的方法,该方法包括向有此需要的受试者施用治疗有效量的如本文所述的化合物或其药用盐。
[0026]
在一方面,本文提供了可以并入cide中的大环eulbm。
具体实施方式
[0027]
i.定义
[0028]
本文中使用的缩写在化学和生物领域中具有其常规含义。根据化学领域已知的化学价的标准规则来构建本文所述的化学结构和式。
[0029]
当取代基基团由它们的常规化学式(从左到右书写)指定时,它们同样包含化学上相同的取代基(将由从右到左书写结构所产生),例如,-ch2o-等同于-och
2-。
[0030]
除非另有说明,否则术语“烷基”本身或作为另一取代基的一部分意指直链(即非支链)或支链碳链(或碳)或它们的组合,其可以为完全饱和的、单不饱和的或多不饱和的,并且可以包括单价、二价和多价基团。烷基可以包括指定数目的碳(例如,c
1-c
10
意指一个至十个碳)。烷基为未环化的链。饱和烃基基团的实例包括但不限于以下基团,诸如甲基、乙基、正丙基、异丙基、正丁基、叔丁基、异丁基、仲丁基、甲基,例如正戊基、正己基、正庚基、正辛基等的同系物和异构体。不饱和烷基基团是具有一个或多个双键或三键的烷基基团。不饱和烷基基团的实例包括但不限于乙烯基、2-丙烯基、巴豆基、2-异戊烯基、2-(丁二烯基)、2,4-戊二烯基、3-(1,4-戊二烯基)、乙炔基、1-丙炔基和3-丙炔基、3-丁炔基以及高级同系物和异构体。烷氧基为经由氧接头(—o—)连接到分子的其余部分的烷基。烷基部分可以为烯基部分。烷基部分可以为炔基部分。烷基部分可以为完全饱和的。烯基可以包含多于一个的双键和/或除了该一个或多个双键之外的一个或多个三键。炔基可以包含多于一个的三键和/或除了该一个或多个三键之外的一个或多个双键。
[0031]
除非另有说明,否则术语“亚烷基”本身或作为另一取代基的一部分意指衍生自烷基的二价基团,例如但不限于,-ch2ch2ch2ch
2-。通常,烷基(或亚烷基)基团将具有1个至24个碳原子,在本文中优选那些具有10个或更少的碳原子的基团。“低级烷基”或“低级亚烷
基”为短链烷基或亚烷基基团,其通常具有八个或更少的碳原子。除非另有说明,否则术语“亚烯基”本身或作为另一取代基的一部分意指衍生自烯烃的二价基团。
[0032]
除非另有说明,否则术语“杂烷基”本身或与另一术语组合意指包含至少一个碳原子和至少一个杂原子(例如o、n、p、si和s)的稳定的直链或支链或它们的组合,并且其中氮原子和硫原子可以任选地发生氧化,并且氮杂原子可以任选地发生季铵化。杂原子(例如o、n、s、si或p)可以位于杂烷基基团的任何内部位置,或位于烷基基团连接到分子的其余部分的位置。杂烷基为未环化的链。实例包括但不限于:-ch
2-ch
2-o-ch3、-ch
2-ch
2-nh-ch3、-ch
2-ch
2-n(ch3)-ch3、-ch
2-s-ch
2-ch3、-ch
2-s-ch2、-s(o)-ch3、-ch
2-ch
2-s(o)
2-ch3、-ch=ch-o-ch3、-si(ch3)3、-ch
2-ch=n-och3、-ch=ch-n(ch3)-ch3、-o-ch3、-o-ch
2-ch3和-cn。至多两个或三个杂原子可以为连续的,诸如例如-ch
2-nh-och3和-ch
2-o-si(ch3)3。杂烷基部分可以包含一个杂原子(例如,o、n、s、si或p)。杂烷基部分可以包含两个任选地不同的杂原子(例如,o、n、s、si或p)。杂烷基部分可以包含三个任选地不同的杂原子(例如,o、n、s、si或p)。杂烷基部分可以包含四个任选地不同的杂原子(例如,o、n、s、si或p)。杂烷基部分可以包含五个任选地不同的杂原子(例如,o、n、s、si或p)。杂烷基部分可以包含至多8个任选地不同的杂原子(例如,o、n、s、si或p)。除非另有说明,否则术语“杂烯基”本身或与另一术语组合意指包含至少一个双键的杂烷基。杂烯基可以任选地包含多于一个双键和/或除了该一个或多个双键之外的一个或多个三键。除非另有说明,否则术语“杂炔基”本身或与另一术语组合意指包含至少一个三键的杂烷基。杂炔基可以任选地包含多于一个的三键和/或除了该一个或多个三键之外的一个或多个双键。
[0033]
类似地,除非另有说明,否则术语“亚杂烷基”本身或作为另一取代基的一部分意指衍生自杂烷基的二价基团,例如但不限于-ch
2-ch
2-s-ch
2-ch
2-和-ch
2-s-ch
2-ch
2-nh-ch
2-。对于亚杂烷基基团,杂原子也可以占据一个或两个链末端(例如亚烷基氧基、亚烷基二氧基、亚烷基氨基、亚烷基二氨基等)。更进一步,对于亚烷基和亚杂烷基连接基团,连接基团的取向并不由连接基团的式的书写方向所暗示。例如,式-c(o)2r'-表示-c(o)2r'-和-r'c(o)
2-两者。如上所述,如本文所用的杂烷基基团包括通过杂原子来连接到分子的其余部分的那些基团,诸如-c(o)r'、-c(o)nr'、-nr'r”、-or'、-sr'和/或-so2r'。在叙述“杂烷基”之后接着叙述特定杂烷基基团(例如-nr'r”等)时,应当理解术语杂烷基和-nr'r”不是冗余的或互相排斥的。相反,叙述特定杂烷基基团以增加清晰度。因此,术语“杂烷基”在本文中不应解释为排除特定杂烷基基团,例如-nr'r”等。
[0034]
除非另有说明,否则术语“环烷基”和“杂环烷基”本身或与其他术语组合分别意指“烷基”和“杂烷基”的环状形式。环烷基和杂环烷基是非芳族基团。此外,对于杂环烷基,杂原子可以占据杂环连接到分子的其余部分的位置。环烷基的实例包括但不限于环丙基、环丁基、环戊基、环己基、1-环己烯基、3-环己烯基、环庚基等。杂环烷基的实例包括但不限于1-(1,2,5,6-四氢吡啶基)、1-哌啶基、2-哌啶基、3-哌啶基、4-吗啉基、3-吗啉基、四氢呋喃-2-基、四氢呋喃-3-基、四氢噻吩-2-基、四氢噻吩-3-基、1-哌嗪基、2-哌嗪基等。单独或作为另一取代基的一部分的“亚环烷基”和“亚杂环烷基”分别意指衍生自环烷基和杂环烷基的二价基团。
[0035]
在实施例中,术语“环烷基”意指单环、双环或多环环烷基环系。在实施例中,单环环系为含有3个至8个碳原子的环状烃基团,其中此类基团可以为饱和的或不饱和的,但不
是芳族的。在实施例中,环烷基基团为完全饱和的。单环环烷基的实例包括环丙基、环丁基、环戊基、环戊烯基、环己基、环己烯基、环庚基和环辛基。双环环烷基环系是桥接单环或稠合双环。在实施例中,桥接单环包含单环环烷基环,其中单环的两个不相邻碳原子通过介于一个与三个附加碳原子之间的亚烷基桥(即,形式为(ch2)w的桥连基团,其中w为1、2或3)来进行连接。双环环系的代表性实例包括但不限于双环[3.1.1]庚烷、双环[2.2.1]庚烷、双环[2.2.2]辛烷、双环[3.2.2]壬烷、双环[3.3.1]壬烷和双环[4.2.1]壬烷。在实施例中,稠合双环环烷基环系包含稠合至苯基、单环环烷基、单环环烯基、单环杂环基或单环杂芳基的单环环烷基环。在实施例中,桥接或稠合的双环环烷基通过单环环烷基环内包含的任何碳原子来连接到母体分子部分。在实施例中,环烷基基团任选地被独立地为氧代或硫杂(thia)的一个或两个基团取代。在实施例中,稠合双环环烷基为稠合至苯环、5元或6元单环环烷基、5元或6元单环环烯基、5元或6元单环杂环基或者5元或6元单环杂芳基的5元或6元单环环烷基环,其中稠合的双环环烷基任选地由独立地为氧代或硫杂的一个或两个基团来进行取代。在实施例中,多环环烷基环系为稠合至以下项的单环环烷基环(基环):(i)选自由以下项组成的组的一个环系:双环芳基、双环杂芳基、双环环烷基、双环环烯基和双环杂环基;或(ii)独立地选自由以下项组成的组的两个其他环系:苯基、双环芳基、单环或双环杂芳基、单环或双环环烷基、单环或双环环烯基和单环或双环杂环基。在实施例中,多环环烷基通过基环内包含的任何碳原子来连接到母体分子部分。在实施例中,多环环烷基环系为稠合至以下项的单环环烷基环(基环):(i)选自由以下项组成的组的一个环系:双环芳基、双环杂芳基、双环环烷基、双环环烯基和双环杂环基;或(ii)独立地选自由以下项组成的组的两个其他环系:苯基、单环杂芳基、单环环烷基、单环环烯基和单环杂环基。多环环烷基基团的实例包括但不限于十四氢菲基、全氢吩噻嗪-1-基和全氢吩噁嗪-1-基。
[0036]
在实施例中,环烷基为环烯基。术语“环烯基”根据其一般含义使用。在实施例中,环烯基为单环、双环或多环环烯基环系。在实施例中,单环环烯基环系为含有3个至8个碳原子的环状烃基团,其中此类基团为不饱和的(即,包含至少一个环状碳碳双键),但不是芳族的。单环环烯基环系的实例包括环戊烯基和环己烯基。在实施例中,双环环烯基环为桥接单环或稠合双环。在实施例中,桥接单环包含单环环烯基环,其中单环的两个不相邻碳原子通过介于一个与三个附加碳原子之间的亚烷基桥(即,形式为(ch2)w的桥连基团,其中w为1、2或3)来进行连接。双环环烯基的代表性实例包括但不限于降冰片烯基和双环[2.2.2]辛2烯基。在实施例中,稠合双环环烯基环系包含稠合至苯基、单环环烷基、单环环烯基、单环杂环基或单环杂芳基的单环环烯基环。在实施例中,桥接或稠合的双环环烯基通过单环环烯基环内包含的任何碳原子来连接到母体分子部分。在实施例中,环烯基基团任选地被独立地为氧代或硫杂的一个或两个基团取代。在实施例中,多环环烯基环包含稠合至以下项的单环环烯基环(基环):(i)选自由以下项组成的组的一个环系:双环芳基、双环杂芳基、双环环烷基、双环环烯基和双环杂环基;或(ii)独立地选自由以下项组成的组的两个环系:苯基、双环芳基、单环或双环杂芳基、单环或双环环烷基、单环或双环环烯基和单环或双环杂环基。在实施例中,多环环烯基通过基环内包含的任何碳原子来连接到母体分子部分。在实施例中,多环环烯基环包含稠合至以下项的单环环烯基环(基环):(i)选自由以下项组成的组的一个环系:双环芳基、双环杂芳基、双环环烷基、双环环烯基和双环杂环基;或(ii)独立地选自由以下项组成的组的两个环系:苯基、单环杂芳基、单环环烷基、单环环烯基和单环杂
环基。
[0037]
在实施例中,杂环烷基为杂环基。如本文所用,术语“杂环基”意指单环、双环或多环杂环。杂环基单环杂环为包含独立地选自由o、n和s组成的组的至少一个杂原子的3元、4元、5元、6元或7元环,其中环为饱和的或不饱和的,但不是芳族的。3元或4元环含有选自由o、n和s组成的组的1个杂原子。5元环可以含有零个或一个双键以及选自由o、n和s组成的组的一个、二个或三个杂原子。6元或7元环包含零个、一个或两个双键和选自由o、n和s组成的组的一个、两个或三个杂原子。
[0038]
杂环基单环杂环通过杂环基单环杂环内包含的任何碳原子或任何氮原子来连接到母体分子部分。杂环基单环杂环的代表性实例包括但不限于氮杂环丁烷基、氮杂环庚烷基、氮丙啶基、二氮杂环庚烷基、1,3-二噁烷基、1,3-二氧杂环戊烷基、1,3-二硫杂环戊烷基、1,3-二噻烷基、咪唑啉基、咪唑烷基、异噻唑啉基、异噻唑烷基、异噁唑啉基、异噁唑烷基、吗啉基、噁二唑啉基、噁二唑烷基、噁唑啉基、噁唑烷基、哌嗪基、哌啶基、吡喃基、吡唑啉基、吡唑烷基、吡咯啉基、吡咯烷基、四氢呋喃基、四氢噻吩基、噻二唑啉基、噻二唑烷基、噻唑啉基、噻唑烷基、硫代吗啉基、1,1-二氧代硫代吗啉基(硫代吗啉砜)、噻喃基和三噻烷基。
[0039]
杂环基双环杂环为稠合至苯基、单环环烷基、单环环烯基、单环杂环或单环杂芳基的单环杂环。杂环基双环杂环通过双环环系的单环杂环部分内包含的任何碳原子或任何氮原子来连接到母体分子部分。双环杂环基的代表性实例包括但不限于2,3-二氢苯并呋喃-2-基、2,3-二氢苯并呋喃-3-基、二氢吲哚-1-基、二氢吲哚-2-基、二氢吲哚-3-基、2,3-二氢苯并噻吩-2-基、十氢喹啉基、十氢异喹啉基、八氢-1h-吲哚基和八氢苯并呋喃基。双环杂环基基团的实例包括但不限于苯并二氮杂和三唑并二氮杂。
[0040]
苯并二氮杂的一个非限制性实例为:其中三唑并(triazolopine)可以为取代或未取代的。三唑并二氮杂的一个非限制性实例为:其中三唑并(triazolopine)可以为取代或未取代的。在实施例中,杂环基基团任选地被独立地为氧代或硫杂的一个或两个基团取代。在某些实施例中,双环杂环基为稠合至苯环、5元或6元单环环烷基、5元或6元单环环烯基、5元或6元单环杂环基或者5元或6元单环杂芳基的5元或6元单环杂环基环,其中双环杂环基任选地由独立地为氧代或硫杂的一个或两个基团来进行取代。
[0041]
多环杂环基环系为稠合至以下项的单环杂环基环(基环):(i)选自由以下项组成的组的一个环系:双环芳基、双环杂芳基、双环环烷基、双环环烯基和双环杂环基;或(ii)独立地选自由以下项组成的组的两个其他环系:苯基、双环芳基、单环或双环杂芳基、单环或双环环烷基、单环或双环环烯基和单环或双环杂环基。多环杂环基通过基环内包含的任何碳原子或氮原子来连接到母体分子部分。在实施例中,多环杂环基环系为稠合至以下项的
单环杂环基环(基环):(i)选自由以下项组成的组的一个环系:双环芳基、双环杂芳基、双环环烷基、双环环烯基和双环杂环基;或(ii)独立地选自由以下项组成的组的两个其他环系:苯基、单环杂芳基、单环环烷基、单环环烯基和单环杂环基。多环杂环基基团的实例包括但不限于噻吩并三唑并二氮杂和三唑并苯并二氮杂。
[0042]
噻吩并三唑并二氮杂的一个非限制性实例为:其中噻吩并三唑并二氮杂可以为取代或未取代的。
[0043]“苯并三唑并二氮杂”或“三唑并苯并二氮杂”的非限制性实例为:其中苯并三唑并二氮杂或三唑并苯并二氮杂可以为取代或未取代的。
[0044]
除非另有说明,否则术语“卤代”或“卤素”本身或作为另一取代基的一部分意指氟、氯、溴或碘原子。此外,术语例如“卤代烷基”意指包括单卤代烷基和多卤代烷基。例如,术语“卤代(c
1-c4)烷基”包括但不限于氟甲基、二氟甲基、三氟甲基、2,2,2-三氟乙基、4-氯丁基、3-溴丙基等。
[0045]
除非另有说明,否则术语“酰基”意指-c(o)r,其中r为取代或未取代的烷基、取代或未取代的环烷基、取代或未取代的杂烷基、取代或未取代的杂环烷基、取代或未取代的芳基或者取代或未取代的杂芳基。
[0046]
除非另有说明,术语“芳基”意指多不饱和的芳族烃取代基,其可以为单环或者稠合在一起(即稠环芳基)或共价连接的多环(优选地1个至3个环)。稠环芳基是指稠合在一起的多个环,其中稠环中的至少一个稠环为芳基环。术语“杂芳基”是指包含至少一个杂原子(诸如n、o或s)的芳基基团(或环),其中氮原子和硫原子任选地发生氧化,并且氮原子任选地发生季铵化。因此,术语“杂芳基”包括稠环杂芳基基团(即稠合在一起的多个环,其中稠环中的至少一个稠环为杂芳族环)。5,6-稠环亚杂芳基是指稠合在一起的两个环,其中一个环具有5元并且另一个环具有6元,并且其中至少一个环为杂芳基环。同样,6,6-稠环亚杂芳基是指稠合在一起的两个环,其中一个环具有6元并且另一个环具有6元,并且其中至少一个环为杂芳基环。并且6,5-稠环亚杂芳基是指稠合在一起的两个环,其中一个环具有6元并且另一个环具有5元,并且其中至少一个环为杂芳基环。杂芳基基团可以通过碳或杂原子来连接到分子的其余部分。芳基基团和杂芳基基团的非限制性实例包括苯基、萘基、吡咯基、吡唑基、哒嗪基、三嗪基、嘧啶基、咪唑基、吡嗪基、嘌呤基、噁唑基、异噁唑基、噻唑基、呋喃基、噻吩基、吡啶基、嘧啶基、苯并噻唑基、苯并噁唑基、苯并咪唑基、苯并呋喃、异苯并呋喃基、吲哚基、异吲哚基、苯并噻吩基、异喹啉基、喹喔啉基、喹啉基、1-萘基、2-萘基、4-联苯
基、1-吡咯基、2-吡咯基、3-吡咯基、3-吡唑基、2-咪唑基、4-咪唑基、吡嗪基、2-噁唑基、4-噁唑基、2-苯基-4-噁唑基、5-噁唑基、3-异噁唑基、4-异噁唑基、5-异噁唑基、2-噻唑基、4-噻唑基、5-噻唑基、2-呋喃基、3-呋喃基、2-噻吩基、3-噻吩基、2-吡啶基、3-吡啶基、4-吡啶基、2-嘧啶基、4-嘧啶基、5-苯并噻唑基、嘌呤基、2-苯并咪唑基、5-吲哚基、1-异喹啉基、5-异喹啉基、2-喹喔啉基、5-喹喔啉基、3-喹啉基和6-喹啉基。上述芳基和杂芳基环系中的每一者的取代基选自由下述可接受的取代基组成的组。单独或作为另一取代基的一部分的“亚芳基”和“亚杂芳基”分别意指衍生自芳基和杂芳基的二价基团。杂芳基基团取代基可以-o-键合至环杂原子氮。
[0047]
稠环杂环烷基-芳基为稠合至杂环烷基的芳基。稠环杂环烷基-杂芳基为稠合至杂环烷基的杂芳基。稠环杂环烷基-环烷基为稠合至环烷基的杂环烷基。稠环杂环烷基-杂环烷基为稠合至另一个杂环烷基的杂环烷基。稠环杂环烷基-芳基、稠环杂环烷基-杂芳基、稠环杂环烷基-环烷基或稠环杂环烷基-杂环烷基可以各自独立地未被取代或被本文所述的取代基中的一个或多个取代基取代。
[0048]
螺环为两个或更多个环,其中相邻的环通过单个原子来进行连接。螺环内的各个环可以为相同的或不同的。螺环中的各个环可以为取代或未取代的,并且可以具有与一组螺环内的其他各个环不同的取代基。当不是螺环的一部分时,螺环内各个环的可能的取代基为同一环的可能的取代基(例如环烷基环或杂环烷基环的取代基)。螺环可以为取代或未取代的环烷基、取代或未取代的亚环烷基、取代或未取代的杂环烷基或者取代或未取代的亚杂环烷基,并且螺环基团内的各个环可以为紧接先前的列表中的任一者,该环包括具有一种类型的所有环(例如所有环均为经取代的亚杂环烷基,其中每个环可以为相同的或不同的经取代的亚杂环烷基)。当提及螺环系时,杂环螺环意指螺环,其中至少一个环为杂环并且其中每个环均可以为不同环。当提及螺环系时,经取代的螺环意指至少一个环被取代并且每个取代基可以任选地为不同的。
[0049]
符号表示化学部分与分子或化学式的其余部分的连接点。同样,虚线键(
“‑‑‑‑”
)也表示化学部分与分子或化学式的其余部分的连接点,例如在下式中:其中连接到末端胺和末端羰基的虚线键表示化学部分与分子的其余部分的连接点。
[0050]
如本文所用,术语“氧代”意指双键键合至碳原子的氧。
[0051]
如本文所用,术语“烷基磺酰基”意指具有式-s(o2)-r'的部分,其中r'为如上文所定义的取代或未取代的烷基基团。r'可以具有指定数量的碳(例如,“c
1-c4烷基磺酰基”)。
[0052]
术语“烷基亚芳基”作为亚芳基部分共价键合至亚烷基部分(本文也称为亚烷基接头)。在实施例中,烷基亚芳基基团具有下式:
[0053][0054]
烷基亚芳基部分可以在亚烷基部分或亚芳基接头上(例如在碳2、3、4或6处)被以下项取代(例如,具有取代基基团):卤素、氧代、-n3、-cf3、-ccl3、-cbr3、-ci3、-cn、-cho、-oh、-nh2、-cooh、-conh2、-no2、-sh、-so2ch
3-so3h、、-oso3h、-so2nh2、-nhnh2、-onh2、-nhc(o)
nhnh2、取代或未取代的c
1-c5烷基或者取代或未取代的2元至5元杂烷基)。在实施例中,烷基亚芳基为未取代的。
[0055]
上述术语(例如,“烷基”、“杂烷基”、“环烷基”、“杂环烷基”、“芳基”和“杂芳基”)中的每一者均包括所示基团的取代和未取代形式。下面提供了每种类型的基团的优选取代基。
[0056]
烷基和杂烷基基团(包括那些通常称为亚烷基、烯基、亚杂烷基、杂烯基、炔基、环烷基、杂环烷基、环烯基和杂环烯基的基团)的取代基可以为选自但不限于以下基团的各种基团中的一者或多者:-or'、=o、=nr'、=n-or'、-nr'r”、-sr'、-卤素、-sir'r”r”'、-oc(o)r'、-c(o)r'、-co2r'、-conr'r”、-oc(o)nr'r”、-nr”c(o)r'、-nr'-c(o)nr”r”'、-nr”c(o)2r'、-nr-c(nr'r”r”')=nr
””
、-nr-c(nr'r”)=nr”'、-s(o)r'、-s(o)2r'、-s(o)2nr'r”、-nrso2r'、-nr'nr”r”'、-onr'r”、-nr'c(o)nr”nr”'r
””
、-cn、-no2、-nr'so2r”、-nr'c(o)r”、-nr'c(o)-or”、-nr'or”,其数量在零至(2m' 1)的范围内,其中m'为此类基团中的碳原子总数。r、r'、r”、r”'和r
””
各自优选独立地是指氢、取代或未取代的杂烷基、取代或未取代的环烷基、取代或未取代的杂环烷基、取代或未取代的芳基(例如,被1个至3个卤素取代的芳基)、取代或未取代的杂芳基、取代或未取代的烷基、烷氧基或硫代烷氧基基团或芳基烷基基团。例如,当本文所述的化合物包含多于一个的r基团时,r基团中的每个基团独立地选择为各个r'、r”、r”'和r
””
基团(当这些基团中的多于一个的基团存在时)。当r'和r”连接到相同的氮原子时,它们可以与氮原子结合以形成4元环、5元环、6元环或7元环。例如,-nr'r”包括但不限于1-吡咯烷基和4-吗啉基。根据有关取代基的上述讨论,本领域的技术人员将理解,术语“烷基”意指包括如下基团:该基团包括与除氢基团以外的基团结合的碳原子,诸如卤代烷基(例如,-cf3和-ch2cf3)和酰基(例如,-c(o)ch3、-c(o)cf3、-c(o)ch2och3等)。
[0057]
类似于针对烷基基团所述的取代基,芳基基团和杂芳基基团的取代基为变化的并且选自例如:-or'、-nr'r”、-sr'、-卤素、-sir'r”r”'、-oc(o)r'、-c(o)r'、-co2r'、-conr'r”、-oc(o)nr'r”、-nr”c(o)r'、-nr'-c(o)nr”r”'、-nr”c(o)2r'、-nr-c(nr'r”r”')=nr
””
、-nr-c(nr'r”)=nr”'、-s(o)r'、-s(o)2r'、-s(o)2nr'r”、-nrso2r'、-nr'nr”r”'、-onr'r”、-nr'c(o)nr”nr”'r
””
、-cn、-no2、-r'、-n3、-ch(ph)2、氟(c
1-c4)烷氧基和氟(c
1-c4)烷基、-nr'so2r”、-nr'c(o)r”、-nr'c(o)-or”、-nr'or”,其数量在零至芳族环系上的开放价总数的范围内;并且其中r'、r”、r”'和r
””
优选独立地选自氢、取代或未取代的烷基、取代或未取代的杂烷基、取代或未取代的环烷基、取代或未取代的杂环烷基、取代或未取代的芳基和取代或未取代的杂芳基。例如,当本文所述的化合物包含多于一个的r基团时,r基团中的每个基团独立地选择为各个r'、r”、r”'和r
””
基团(当这些基团中的多于一个的基团存在时)。
[0058]
环的取代基(例如环烷基、杂环烷基、芳基、杂芳基、亚环烷基、亚杂环烷基、亚芳基或亚杂芳基)可以描绘为环上的取代基而不是环的特定原子上的取代基(通常称为浮动取代基)。在此类情况下,取代基可以连接到环原子中的任何环原子(遵守化学价规则),并且在稠环或螺环的情况下,被描绘为与稠环或螺环的一个成员缔合的取代基(单环上的浮动取代基)可以为稠环或螺环中的任一者上的取代基(多环上的浮动取代基)。当取代基连接到环而不是特定的原子(浮动取代基),并且取代基的下标为大于一的整数时,多个取代基可以在相同的原子、相同的环,不同的原子,不同的稠环、不同的螺环上,并且每个取代基均可以任选地为不同的。当环与分子的其余部分的连接点不限于单个原子(浮动取代基)时,
连接点可以为环的任何原子,并且在稠环或螺环的情况下,可以为稠环或螺环中的任一者的任何原子,同时遵守化学价规则。在环、稠环或螺环包含一个或多个环杂原子,并且环、稠环或螺环示出为具有一个或多个浮动取代基(包括但不限于与分子的其余部分的连接点)的情况下,浮动取代基可以键合至杂原子。在环杂原子被示出为结合至具有浮动取代基的结构或式中的一个或多个氢(例如,具有与环原子的两个键和与氢的第三键的环氮)的情况下,当杂原子键合至浮动取代基时,取代基应理解为替代氢,同时遵守化学价规则。
[0059]
两个或更多个取代基可以任选地被接合以形成芳基基团、杂芳基基团、环烷基基团或杂环烷基基团。此类所谓的成环取代基通常但不一定被发现连接到环状基础结构。在一个实施例中,成环取代基连接到基础结构的相邻成员。例如,连接到环状基础结构的相邻成员的两个成环取代基创建稠环结构。在另一个实施例中,成环取代基连接到基础结构的单个成员。例如,连接到环状基础结构的单个成员的两个成环取代基创建螺环结构。在又一个实施例中,成环取代基连接到基础结构的非相邻成员。
[0060]
芳基或杂芳基环的相邻原子上的取代基中的两个取代基可以任选地形成式-t-c(o)-(crr')
q-u-的环,其中t和u独立地为-nr-、-o-、-crr'-或单键,并且q为0至3的整数。替代地,芳基或杂芳基环的相邻原子上的取代基中的两个取代基可以任选地被式-a-(ch2)
r-b-的取代基替代,其中a和b独立地为-crr'-、-o-、-nr-、-s-、-s(o)-、-s(o)
2-、-s(o)2nr'-或单键,并且r为1至4的整数。如此形成的新环的单键中的一个单键可以任选地被双键替代。替代地,芳基或杂芳基环的相邻原子上的取代基中的两个取代基可一任选地被式-(crr')
s-x'-(c”r”r”')
d-的取代基替代,其中s和d独立地为0至3的整数,并且x'为-o-、-nr'-、-s-、-s(o)-、-s(o)
2-或-s(o)2nr'-。取代基r、r'、r”和r”'优选独立地选自氢、取代或未取代的烷基、取代或未取代的杂烷基、取代或未取代的环烷基、取代或未取代的杂环烷基、取代或未取代的芳基以及取代的或未取代的杂芳基。
[0061]
如本文所用,术语“杂原子”或“环杂原子”意指包括氧(o)、氮(n)、硫(s)、磷(p)和硅(si)。
[0062]
如本文所用,“取代基基团”意指选自以下部分的基团:
[0063]
(a)氧代、卤素、-ccl3、-cbr3、-cf3、-ci3、-ch2cl、-ch2br、-ch2f、-ch2i、-chcl2、-chbr2、-chf2、-chi2、-cn、-oh、-nh2、-cooh、-conh2、-no2、-sh、-so3h、-so4h、-so2nh2、-nhnh2、-onh2、-nhc(o)nhnh2、-nhc(o)nh2、-nhso2h、-nhc(o)h、-nhc(o)oh、-nhoh、-occl3、-ocf3、-ocbr3、-oci3、-ochcl2、-ochbr2、-ochi2、-ochf2、-n3、未取代的烷基(例如,c
1-c8烷基、c
1-c6烷基或c
1-c4烷基)、未取代的杂烷基(例如,2元至8元杂烷基、2元至6元杂烷基或2元至4元杂烷基)、未取代的环烷基(例如,c
3-c8环烷基、c
3-c6环烷基或c
5-c6环烷基)、未取代的杂环烷基(例如,3元至8元杂环烷基、3元至6元杂环烷基或5元至6元杂环烷基)、未取代的芳基(例如,c
6-c
10
芳基、c
10
芳基,或苯基)或未取代的杂芳基(例如,5元至10元杂芳基、5元至9元杂芳基或5元至6元杂芳基),以及
[0064]
(b)被选自以下项至少一个取代基取代的烷基(例如,c
1-c8烷基、c
1-c6烷基或c
1-c4烷基)、杂烷基(例如,2元至8元杂烷基、2元至6元杂烷基或2元至4元杂烷基)、环烷基(例如,c
3-c8环烷基、c
3-c6环烷基或c
5-c6环烷基)、杂环烷基(例如,3元至8元杂环烷基、3元至6元杂环烷基或5元至6元杂环烷基)、芳基(例如,c
6-c
10
芳基、c
10
芳基,或苯基)、杂芳基(例如,5元至10元杂芳基、5元至9元杂芳基或5元至6元杂芳基):
[0065]
(i)氧代、卤素、-ccl3、-cbr3、-cf3、-ci3、-ch2cl、-ch2br、-ch2f、-ch2i、-chcl2、-chbr2、-chf2、-chi2、-cn、-oh、-nh2、-cooh、-conh2、-no2、-sh、-so3h、-so4h、-so2nh2、-nhnh2、-onh2、-nhc(o)nhnh2、-nhc(o)nh2、-nhso2h、-nhc(o)h、-nhc(o)oh、-nhoh、-occl3、-ocf3、-ocbr3、-oci3、-ochcl2、-ochbr2、-ochi2、-ochf2、-n3、-未取代的烷基(例如,c
1-c8烷基、c
1-c6烷基或c
1-c4烷基)、未取代的杂烷基(例如,2元至8元杂烷基、2元至6元杂烷基或2元至4元杂烷基)、未取代的环烷基(例如,c
3-c8环烷基、c
3-c6环烷基,或c
5-c6环烷基)、未取代的杂环烷基(例如,3元至8元杂环烷基、3元至6元杂环烷基或5元至6元杂环烷基)、未取代的芳基(例如,c
6-c
10
芳基、c
10
芳基,或苯基)或未取代的杂芳基(例如,5元至10元杂芳基、5元至9元杂芳基或5元至6元杂芳基),以及
[0066]
(ii)被选自以下项至少一个取代基取代的烷基(例如,c
1-c8烷基、c
1-c6烷基或c
1-c4烷基)、杂烷基(例如,2元至8元杂烷基、2元至6元杂烷基或2元至4元杂烷基)、环烷基(例如,c
3-c8环烷基、c
3-c6环烷基或c
5-c6环烷基)、杂环烷基(例如,3元至8元杂环烷基、3元至6元杂环烷基或5元至6元杂环烷基)、芳基(例如,c
6-c
10
芳基、c
10
芳基,或苯基)、杂芳基(例如,5元至10元杂芳基、5元至9元杂芳基或5元至6元杂芳基):
[0067]
(a)氧代、卤素、-ccl3、-cbr3、-cf3、-ci3、-ch2cl、-ch2br、-ch2f、-ch2i、-chcl2、-chbr2、-chf2、-chi2、-cn、-oh、-nh2、-cooh、-conh2、-no2、-sh、-so3h、-so4h、-so2nh2、-nhnh2、-onh2、-nhc(o)nhnh2、-nhc(o)nh2、-nhso2h、-nhc(o)h、-nhc(o)oh、-nhoh、-occl3、-ocf3、-ocbr3、-oci3、-ochcl2、-ochbr2、-ochi2、-ochf2、-n3、未取代的烷基(例如,c
1-c8烷基、c
1-c6烷基或c
1-c4烷基)、未取代的杂烷基(例如,2元至8元杂烷基、2元至6元杂烷基或2元至4元杂烷基)、未取代的环烷基(例如,c
3-c8环烷基、c
3-c6环烷基,或c
5-c6环烷基)、未取代的杂环烷基(例如,3元至8元杂环烷基、3元至6元杂环烷基或5元至6元杂环烷基)、未取代的芳基(例如,c
6-c
10
芳基、c
10
芳基,或苯基)或未取代的杂芳基(例如,5元至10元杂芳基、5元至9元杂芳基或5元至6元杂芳基),以及
[0068]
(b)被选自以下项至少一个取代基取代的烷基(例如,c
1-c8烷基、c
1-c6烷基或c
1-c4烷基)、杂烷基(例如,2元至8元杂烷基、2元至6元杂烷基或2元至4元杂烷基)、环烷基(例如,c
3-c8环烷基、c
3-c6环烷基或c
5-c6环烷基)、杂环烷基(例如,3元至8元杂环烷基、3元至6元杂环烷基或5元至6元杂环烷基)、芳基(例如,c
6-c
10
芳基、c
10
芳基,或苯基)、杂芳基(例如,5元至10元杂芳基、5元至9元杂芳基或5元至6元杂芳基):氧代、卤素、-ccl3、-cbr3、-cf3、-ci3、-ch2cl、-ch2br、-ch2f、-ch2i、-chcl2、-chbr2、-chf2、-chi2、-cn、-oh、-nh2、-cooh、-conh2、-no2、-sh、-so3h、-so4h、-so2nh2、-nhnh2、-onh2、-nhc(o)nhnh2、-nhc(o)nh2、-nhso2h、-nhc(o)h、-nhc(o)oh、-nhoh、-occl3、-ocf3、-ocbr3、-oci3、-ochcl2、-ochbr2、-ochi2、-ochf2、-n3、未取代的烷基(例如,c
1-c8烷基、c
1-c6烷基或c
1-c4烷基)、未取代的杂烷基(例如,2元至8元杂烷基、2元至6元杂烷基或2元至4元杂烷基)、未取代的环烷基(例如,c
3-c8环烷基、c
3-c6环烷基,或c
5-c6环烷基)、未取代的杂环烷基(例如,3元至8元杂环烷基、3元至6元杂环烷基或5元至6元杂环烷基)、未取代的芳基(例如,c
6-c
10
芳基、c
10
芳基,或苯基)或未取代的杂芳基(例如,5元至10元杂芳基、5元至9元杂芳基或5元至6元杂芳基)。
[0069]
如本文所用,“尺寸受限的取代基”或“尺寸受限的取代基基团”意指选自上文针对“取代基基团”所述的所有取代基的基团,其中每个取代或未取代的烷基为取代或未取代的c
1-c
20
烷基,每个取代或未取代的杂烷基为取代或未取代的2元至20元杂烷基,每个取代或
未取代的环烷基为取代或未取代的c
3-c8环烷基,每个取代或未取代的杂环烷基为取代或未取代的3元至8元杂环烷基,每个取代或未取代的芳基为取代或未取代的c
6-c
10
芳基,并且每个取代或未取代的杂芳基为取代或未取代的5元至10元杂芳基。
[0070]
如本文所用,“低级取代基”或“低级取代基基团”意指选自上文针对“取代基基团”所述的所有取代基的基团,其中每个取代或未取代的烷基为取代或未取代的c
1-c8烷基,每个取代或未取代的杂烷基为取代或未取代的2元至8元杂烷基,每个取代或未取代的环烷基为取代或未取代的c
3-c7环烷基,每个取代或未取代的杂环烷基为取代或未取代的3元至7元杂环烷基,每个取代或未取代的芳基为取代或未取代的苯基,并且每个取代或未取代的杂芳基为取代或未取代的5元至6元杂芳基。
[0071]
在一些实施例中,本文化合物中所述的每个经取代的基团被至少一个取代基基团取代。更具体地,在一些实施例中,本文化合物中所述的每个经取代的烷基、经取代的杂烷基、经取代的环烷基、经取代的杂环烷基、经取代的芳基、经取代的杂芳基、经取代的亚烷基、经取代的亚杂烷基、经取代的亚环烷基、经取代的亚杂环烷基、经取代的亚芳基和/或经取代的亚杂芳基被至少一个取代基基团取代。在其他实施例中,这些基团中的至少一个基团或所有基团被至少一个尺寸受限的取代基基团取代。在其他实施例中,这些基团中的至少一个基团或所有基团被至少一个低级取代基基团取代。
[0072]
在本文化合物的其他实施例中,每个取代或未取代的烷基可能为取代或未取代的c
1-c
20
烷基,每个取代或未取代的杂烷基为取代或未取代的2元至20元杂烷基,每个取代或未取代的环烷基为取代或未取代的c
3-c8环烷基,每个取代或未取代的杂环烷基为取代或未取代的3元至8元杂环烷基,每个取代或未取代的芳基为取代或未取代的c
6-c
10
芳基,和/或每个取代或未取代的杂芳基为取代或未取代的5元至10元杂芳基。在本文化合物的一些实施例中,每个取代或未取代的亚烷基为取代或未取代的c
1-c
20
亚烷基,每个取代或未取代的亚杂烷基为取代或未取代的2元至20元亚杂烷基,每个取代或未取代的亚环烷基为取代或未取代的c
3-c8亚环烷基,每个取代或未取代的亚杂环烷基为取代或未取代的3元至8元亚杂环烷基,每个取代或未取代的亚芳基为取代或未取代的c
6-c
10
亚芳基,和/或每个取代或未取代的亚杂芳基为取代或未取代的5元至10元亚杂芳基。
[0073]
在一些实施例中,每个取代或未取代的烷基为取代或未取代的c
1-c8烷基,每个取代或未取代的杂烷基为取代或未取代的2元至8元杂烷基,每个取代或未取代的环烷基为取代或未取代的c
3-c7环烷基,每个取代或未取代的杂环烷基为取代或未取代的3元至7元杂环烷基,每个取代或未取代的芳基为取代或未取代的c
6-c
10
芳基,和/或每个取代或未取代的杂芳基为取代或未取代的5元至9元杂芳基。在一些实施例中,每个取代或未取代的亚烷基为取代或未取代的c
1-c8亚烷基,每个取代或未取代的亚杂烷基为取代或未取代的2元至8元亚杂烷基,每个取代或未取代的亚环烷基为取代或未取代的c
3-c7亚环烷基,每个取代或未取代的亚杂环烷基为取代或未取代的3元至7元亚杂环烷基,每个取代或未取代的亚芳基为取代或未取代的c
6-c
10
亚芳基,和/或每个取代或未取代的亚杂芳基为取代或未取代的5元至9元亚杂芳基。在一些实施例中,化合物为以下“实例”章节、图或表中所示的化学物质。
[0074]
在实施例中,取代或未取代的部分(例如,取代或未取代的烷基、取代或未取代的杂烷基、取代或未取代的环烷基、取代或未取代的杂环烷基、取代或未取代的芳基、取代或未取代的杂芳基、取代或未取代的亚烷基、取代或未取代的亚杂烷基、取代或未取代的亚环
烷基、取代或未取代的亚杂环烷基、取代或未取代的亚芳基和/或取代或未取代的亚杂芳基)为未取代的(例如,分别为未取代的烷基、未取代的杂烷基、未取代的环烷基、未取代的杂环烷基、未取代的芳基、未取代的杂芳基、未取代的亚烷基、未取代的亚杂烷基、未取代的亚环烷基、未取代的亚杂环烷基、未取代的亚芳基和/或未取代的亚杂芳基)。在实施例中,取代或未取代的部分(例如,取代或未取代的烷基、取代或未取代的杂烷基、取代或未取代的环烷基、取代或未取代的杂环烷基、取代或未取代的芳基、取代或未取代的杂芳基、取代或未取代的亚烷基、取代或未取代的亚杂烷基、取代或未取代的亚环烷基、取代或未取代的亚杂环烷基、取代或未取代的亚芳基和/或取代或未取代的亚杂芳基)为经取代的(例如,分别为经取代的烷基、经取代的杂烷基、经取代的环烷基、经取代的杂环烷基、经取代的芳基、经取代的杂芳基、经取代的亚烷基、经取代的亚杂烷基、经取代的亚环烷基、经取代的亚杂环烷基、经取代的亚芳基和/或经取代的亚杂芳基)。
[0075]
在实施例中,经取代的部分(例如,经取代的烷基、经取代的杂烷基、经取代的环烷基、经取代的杂环烷基、经取代的芳基、经取代的杂芳基、经取代的亚烷基、经取代的亚杂烷基、经取代的亚环烷基、经取代的亚杂环烷基、经取代的亚芳基和/或经取代的亚杂芳基)被至少一个取代基基团取代,其中如果经取代的部分被多个取代基基团取代,则每个取代基基团均可以任选地为不同的。在实施例中,如果经取代的部分被多个取代基基团取代,则每个取代基基团为不同的。
[0076]
在实施例中,经取代的部分(例如,经取代的烷基、经取代的杂烷基、经取代的环烷基、经取代的杂环烷基、经取代的芳基、经取代的杂芳基、经取代的亚烷基、经取代的亚杂烷基、经取代的亚环烷基、经取代的亚杂环烷基、经取代的亚芳基和/或经取代的亚杂芳基)被至少一个尺寸受限的取代基基团取代,其中如果经取代的部分被多个尺寸受限的取代基基团取代,则每个尺寸受限的取代基基团均可以任选地为不同的。在实施例中,如果经取代的部分被多个尺寸受限的取代基基团取代,则每个尺寸受限的取代基基团为不同的。
[0077]
在实施例中,经取代的部分(例如,经取代的烷基、经取代的杂烷基、经取代的环烷基、经取代的杂环烷基、经取代的芳基、经取代的杂芳基、经取代的亚烷基、经取代的亚杂烷基、经取代的亚环烷基、经取代的亚杂环烷基、经取代的亚芳基和/或经取代的亚杂芳基)被至少一个低级取代基基团取代,其中如果经取代的部分被多个低级取代基基团取代,则每个低级取代基基团均可以任选地为不同的。在实施例中,如果经取代的部分被多个低级取代基基团取代,则每个低级取代基基团为不同的。
[0078]
在实施例中,经取代的部分(例如,经取代的烷基、经取代的杂烷基、经取代的环烷基、经取代的杂环烷基、经取代的芳基、经取代的杂芳基、经取代的亚烷基、经取代的亚杂烷基、经取代的亚环烷基、经取代的亚杂环烷基、经取代的亚芳基和/或经取代的亚杂芳基)被至少一个取代基基团、尺寸受限的取代基基团或低级取代基基团取代;其中如果经取代的部分被选自取代基基团、尺寸受限的取代基基团和低级取代基基团的多个基团取代;每个取代基基团、尺寸受限的取代基基团和/或低级取代基基团可以任选地为不同的。在实施例中,如果经取代的部分被选自取代基基团、尺寸受限的取代基基团和低级取代基基团的多个基团取代;则每个取代基基团、尺寸受限的取代基基团和/或低级取代基基团为不同的。
[0079]
本公开的某些化合物具有根据绝对立体化学可以被定义为(r)-或(s)-,或者对于氨基酸,被定义为(d)-或(l)-的不对称碳原子(光学中心或手性中心)或双键;对映异构体、
外消旋体、非对映异构体、互变异构体、几何异构体、立体异构形式,并且各个异构体被包含在本公开的范围内。本公开的化合物不包括本领域已知的太不稳定而无法合成和/或分离的那些化合物。本公开意在包括呈外消旋和光学纯形式的化合物。光学活性的(r)-和(s)-或者(d)-和(l)-异构体可以使用手性合成子或手性试剂制备,或使用常规技术解析。当本文所述的化合物含有烯键或其他几何不对称中心时,除非另有说明,否则旨在表示这些化合物同时包含e和z几何异构体两者。
[0080]
如本文所用,术语“异构体”是指具有相同数量和种类的原子并且因此具有相同分子量,但在原子的结构排列或构型方面不同的化合物。
[0081]
如本文所用,术语“互变异构体”是指两种或更多种结构异构体中的一种结构异构体,该结构异构体以平衡状态存在并且容易从一种异构体形式转化为另一种异构体形式。
[0082]
对于本领域技术人员显而易见的是,本公开的某些化合物可以呈互变异构形式存在,化合物的所有此类互变异构形式均在本公开的范围内。
[0083]
除非另有说明,否则本文描绘的结构还意在包括该结构的所有立体化学形式;即,每个不对称中心的r和s构型。因此,本公开的化合物的单一立体化学异构体以及对映异构体混合物和非对映异构体混合物均在本公开的范围内。
[0084]
除非另有说明,否则本文所描绘的结构还意在包括仅在一个或多个富含同位素的原子存在下不同的化合物。例如,除了由氘或氚来替代氢,或由富含
13
c或
14
c的碳来替代碳以外,具有本公开的结构的化合物均在本公开的范围内。
[0085]
本公开的化合物还可以在构成此类化合物的原子中的一个或多个原子处包含非天然比例的原子同位素。例如,化合物可以用放射性同位素来进行放射性标记,该放射性同位素为诸如例如氚(3h)、碘125(
125
i)或碳14(
14
c)。本公开的化合物的所有同位素变化,无论是否具有放射性,均被包含在本公开的范围内。
[0086]
应当注意,在整个申请中,替代方案以马库什基团书写,例如,包含多于一个可能的氨基酸的每个氨基酸位置。特别考虑到马库什基团的每个成员应当被分别考虑,从而包括另一个实施例,并且马库什基团不应被理解为单个单元。
[0087]
如本文所用,术语“生物缀合物反应性部分”和“生物缀合物反应性基团”是指由于生物缀合物反应性基团的原子或分子之间的缔合而能够形成生物缀合物(例如,共价接头或生物缀合物接头)的部分或基团。该缔合可以为直接的或间接的。例如,本文提供的第一生物缀合物反应性基团(例如,
–
nh2、-cooh、-n-羟基琥珀酰亚胺或-马来酰亚胺)与第二生物缀合物反应性基团(例如,巯基、含硫氨基酸、胺、包含胺侧链的氨基酸,或甲酸酯)之间的缀合可以为直接的,例如通过共价键或接头(例如,第二接头的第一接头);或间接的,例如通过非共价键(例如,静电相互作用(例如,离子键、氢键、卤键)、范德华相互作用(例如偶极-偶极、偶极-诱导偶极、伦敦色散)、环堆积(π效应)、疏水相互作用等)。在实施例中,在第一生物缀合物反应性基团与第二生物缀合物反应性基团之间形成的接头为共价接头。第一生物缀合物基团与第二生物缀合物之间的反应可以产生接头部分,该接头部分在本文中可以称为生物缀合物接头。在实施例中,生物缀合物接头包含肽部分。在实施例中,肽部分为拟肽部分。在实施例中,使用生物缀合物化学(即,两个生物缀合物反应性基团的缔合)来形成生物缀合物或生物缀合物接头,该生物缀合物化学包括但不限于亲核取代(例如,胺和醇与酰基卤、活性酯的反应)、亲电取代(例如,烯胺反应)和加成至碳-碳和碳-杂原子多重键
(例如,迈克尔反应、狄尔斯-阿尔德加成)。这些和其他有用的反应在例如以下文献中讨论:march,advanced organic chemistry,第3版,john wiley&sons,new york,1985;hermanson,bioconjugate techniques,academic press,san diego,1996;以及feeney等人,modification of proteins;advances in chemistry series,第198卷,american chemical society,washington,d.c.,1982。在实施例中,第一生物缀合物反应性基团(例如马来酰亚胺部分)共价连接至第二生物缀合物反应性基团(例如巯基)。在实施例中,第一生物缀合物反应性基团(例如卤代乙酰基部分)共价连接至第二生物缀合物反应性基团(例如巯基)。在实施例中,第一生物缀合物反应性基团(例如吡啶基部分)共价连接至第二生物缀合物反应性基团(例如巯基)。在实施例中,第一生物缀合物反应性基团(例如-n-羟基琥珀酰亚胺部分)共价连接至第二生物缀合物反应性基团(例如胺)。在实施例中,第一生物缀合物反应性基团(例如马来酰亚胺部分)共价连接至第二生物缀合物反应性基团(例如巯基)。在实施例中,第一生物缀合物反应性基团(例如-磺基-n-羟基琥珀酰亚胺部分)共价连接至第二生物缀合物反应性基团(例如胺)。
[0088]
用于本文生物缀合物化学的可用的生物缀合物反应性部分包括例如:
[0089]
(a)羧基基团或它们的各种衍生物,包括但不限于n-羟基琥珀酰亚胺酯、n-羟基苯并三唑酯、酸性卤化物、酰基咪唑、硫代酯、对硝基苯酯、烷基、烯基、炔基和芳族酯;
[0090]
(b)可以转化为酯、醚、醛等的羟基基团。
[0091]
(c)卤代烷基基团,其中卤化物随后可以被亲核基团(诸如例如胺、甲酸根阴离子、硫醇阴离子、负碳离子或醇盐离子)取代,从而导致新基团共价连接在卤素原子的位点处;
[0092]
(d)能够参与狄尔斯-阿尔德反应的亲二烯体基团,诸如例如马来酰亚胺基或马来酰亚胺基团;
[0093]
(e)醛基团或酮基团,其使得可能经由羰基衍生物(诸如例如亚胺、腙、缩氨基脲或肟)的形成或经由机制(诸如格氏加成或烷基锂加成)来实现随后的衍生化;
[0094]
(f)磺酰基卤化物基团,其用于随后与胺反应,例如以形成磺酰胺;
[0095]
(g)硫醇基团,其可以转化为二硫化物,与酰基卤反应,或键合至金属(例如金),或与马来酰亚胺反应;
[0096]
(h)胺基团或巯基基团(例如存在于半胱氨酸中),该胺基团或巯基基团可以例如被酰化、烷基化或氧化;
[0097]
(i)烯烃,其可以进行例如环加成、酰化、迈克尔加成等;
[0098]
(j)环氧化物,其可以与例如胺和羟基化合物反应;
[0099]
(k)亚磷酰胺和可用于核酸合成的其他标准官能团;
[0100]
(l)金属氧化硅键合;以及
[0101]
(m)金属键合至反应性磷基团(例如膦)以形成例如磷酸二酯键。
[0102]
(n)叠氮化物,其使用铜催化的环加成点击化学来偶联至炔烃。
[0103]
(o)生物素缀合物可以与亲和素或链霉亲和素反应以形成亲和素-生物素复合物或链霉亲和素-生物素复合物。
[0104]
生物缀合物反应性基团可以被选择为使得其不参与或干扰本文所述的缀合物的化学稳定性。替代性地,可通过存在的保护基团使其不参与交联反应来保护反应性官能团。在实施例中,生物缀合物包含衍生自不饱和键(例如马来酰亚胺)和巯基基团的反应的分子
实体。
[0105]“类似物(analog/analogue)”根据其在化学与生物学领域的一般含义使用,是指在结构上与另一种化合物(即所谓的“参比”化合物)相似但组成有所不同(例如,一个原子被不同元素的原子替代,或存在特定的官能团,或一种官能团被另一官能团替代,或与参比化合物的一个或多个手性中心的绝对立体化学结构不同)的化合物。因此,类似物是功能和外观与参比化合物相似或相当但结构或来源不同的化合物。
[0106]
如本文中使用的术语“一个(a)”或“一个(an)”意指“一个或多个”。此外,如本文所用,短语“被[n]取代”意指指定的基团可以被任何或所有指定的取代基中的一个或多个指定的取代基取代。例如,当基团(诸如烷基基团或杂芳基基团)“被未取代的c
1-c
20
烷基或未取代的2元至20元杂烷基取代”时,该基团可以包含一个或多个未取代的c
1-c
20
烷基,和/或一个或多个未取代的2元至20元杂烷基。
[0107]
此外,当一个部分被r取代基取代时,该基团可以被称为“经r取代的”。当一个部分经r取代时,该部分被至少一个r取代基取代并且每个r取代基任选地为不同的。当特定的r基团存在于化学属的描述(例如式(i))中时,可以使用罗马字母符号来区分该特定r基团的每次出现。例如,当存在多个r
13
取代基时,每个r
13
取代基均可以被区分为r
13a
、r
13b
、r
13c
、r
13d
等,其中r
13a
、r
13b
、r
13c
、r
13d
等中的每一者均在r
13
的定义的范围内进行定义并且任选地不同地进行定义。
[0108]
如本文所用,术语“约”意指包括指定值在内的值的范围,本领域普通技术人员将合理地考虑该值与指定值类似。在实施例中,约意指在标准偏差内(使用本领域通常可接受的测量值)。在实施例中,约意指延伸至指定值的 /-10%的范围。在实施例中,约包括指定值。
[0109]“可检测药剂”或“可检测部分”为可通过适当手段(诸如光谱手段、光化学手段、生化手段、免疫化学手段、化学手段、磁共振成像手段或其他物理手段)检测的组合物。例如,可用的可检测药剂包括
18
f、
32
p、
33
p、
45
ti、
47
sc、
52
fe、
59
fe、
62
cu、
64
cu、
67
cu、
67
ga、
68
ga、
77
as、
86
y、
90
y。
89
sr、
89
zr、
94
tc、
94
tc、
99m
tc、
99
mo、
105
pd、
105
rh、
111
ag、
111
in、
123
i、
124
i、
125
i、
131
i、
142
pr、
143
pr、
149
pm、
153
sm、
154-1581
gd、
161
tb、
166
dy、
166
ho、
169
er、
175
lu、
177
lu、
186
re、
188
re、
189
re、
194
ir、
198
au、
199
au、
211
at、
211
pb、
212
bi、
212
pb、
213
bi、
223
ra、
225
ac、cr、v、mn、fe、co、ni、cu、la、ce、pr、nd、pm、sm、eu、gd、tb、dy、ho、er、tm、yb、lu、
32
p、荧光团(例如荧光染料)、电子致密试剂、酶(例如,通常用于elisa测定)、生物素、地高辛、顺磁性分子、顺磁性纳米颗粒、超小超顺磁性氧化铁(“uspio”)纳米颗粒、uspio纳米颗粒聚集体、超顺磁性氧化铁(“spio”)纳米颗粒、spio纳米颗粒聚集体、单晶氧化铁纳米颗粒、单晶氧化铁、纳米颗粒造影剂,含有钆螯合物(“gd-螯合物”)分子的脂质体或其他递送载体、钆、放射性同位素、放射性核素(例如碳-11、氮-13、氧-15、氟-18,铷-82),氟脱氧葡萄糖(例如,经氟-18标记)、任何伽马射线发射放射性核素、正电子发射放射性核素、放射性标记葡萄糖、放射性标记水、放射性标记氨、生物胶体、微泡(例如包括微泡壳,其包含白蛋白、半乳糖、脂质和/或聚合物;微泡气芯,其包含空气、重气体、全氟化碳、氮气、八氟丙烷、全氟己烷(perflexane)脂质微球、全氟丙烷(perflutren)等)、碘化造影剂(例如,碘海醇、碘克沙醇、碘佛醇、碘帕醇、碘昔兰、碘普罗胺、泛影酸盐、甲基泛影酸盐、碘可酸盐)、硫酸钡、二氧化钍、金、金纳米颗粒、金纳米颗粒聚集体、荧光团、双光子荧光团,或者半抗原和蛋白质或其他可检测的实体,例如,可通过将放射性标记结合到
肽或与靶肽特异性反应的抗体中来进行检测。可检测部分为单价可检测药剂或能够与另一种组合物形成键的可检测药剂。
[0110]
可以用作根据本公开的实施例的显像剂和/或标记剂的放射性物质(例如,放射性同位素)包括但不限于
18
f、
32
p、
33
p、
45
ti、
47
sc、
52
fe、
59
fe、
62
cu、
64
cu、
67
cu、
67
ga、
68
ga、
77
as、
86
y、
90
y。
89
sr、
89
zr、
94
tc、
94
tc、
99m
tc、
99
mo、
105
pd、
105
rh、
111
ag、
111
in、
123
i、
124
i、
125
i、
131
i、
142
pr、
143
pr、
149
pm、
153
sm、
154-1581
gd、
161
tb、
166
dy、
166
ho、
169
er、
175
lu、
177
lu、
186
re、
188
re、
189
re、
194
ir、
198
au、
199
au、
211
at、
211
pb、
212
bi、
212
pb、
213
bi、
223
ra和
225
ac。可以用作根据本公开的实施例的附加显像剂的顺磁离子包括但不限于过渡金属和镧系金属(例如,原子序数为21至29、42、43、44或57至71的金属)的离子。这些金属包括cr、v、mn、fe、co、ni、cu、la、ce、pr、nd、pm、sm、eu、gd、tb、dy、ho、er、tm、yb和lu的离子。
[0111]
本公开的化合物的描述受到本领域技术人员已知的化学键合原理的限制。因此,当基团可以被多个取代基中的一个或多个取代基取代时,选择此类取代以便符合化学键合原理并且得到本身不稳定和/或本领域技术人员已知在环境条件(诸如水性、中性和若干已知的生理条件)下可能不稳定的化合物。例如,杂环烷基或杂芳基按照本领域技术人员已知的化学键合原理经由环杂原子来连接到分子的其余部分,从而避免本身不稳定的化合物。
[0112]
术语“离去基团”根据其在化学中的一般含义使用并且是指在化学反应(例如键形成、还原消除、缩合、交叉偶联反应)后与分子分离的部分(例如原子、官能团、分子),该化学反应涉及离去基团所连接到的原子或化学部分(在本文中也称为“离去基团反应性部分”)以及互补反应性部分(即,与离去基团反应性部分反应的化学部分),以在离去基团反应性部分的残余物与互补反应性部分之间形成新的键。因此,离去基团反应性部分和互补反应性部分形成互补反应性基团对。离去基团的非限制性实例包括氢、氢氧根、有机锡部分(例如有机锡杂烷基)、卤素(例如br)、全氟烷基磺酸根(例如三氟甲磺酸根)、甲苯磺酸根、甲磺酸根、水、醇、硝酸根、磷酸根、硫醚、胺、氨、氟化物、甲酸根、苯氧根、有机硼酸、硼酸酯和烷氧根。在实施例中,允许具有离去基团的两个分子接触,并且在反应和/或键形成(例如,偶姻缩合、羟醛缩合、claisen缩合、stille反应)后,离去基团与相应分子分离。在实施例中,离去基团为生物缀合物反应性部分。在实施例中,允许至少两个离去基团接触,使得离去基团足够接近以反应、相互作用或物理接触。在实施例中,离去基团被设计为促进反应。
[0113]
术语“保护基团”根据其在有机化学中的一般含义使用,并且是指与杂原子、杂环烷基或杂芳基共价结合以防止在移除保护基团之前,杂原子、杂环烷基或杂芳基在所执行的一个或多个化学反应期间发生反应的部分。通常,保护基团在多部分合成的一部分期间与杂原子(例如,o)结合,其中不希望杂原子与试剂反应(例如,化学还原)。保护后,可以移除保护基团(例如,通过调节ph)。在实施例中,保护基团为醇保护基团。醇保护基团的非限制性实例包括叔丁基、乙酰基、苯甲酰基、苄基、甲氧基甲基醚(mom)、四氢吡喃基(thp)和甲硅烷基醚(例如,三甲基甲硅烷基(tms))。在实施例中,保护基团为胺保护基团。胺保护基团的非限制性实例包括苄氧羰基(cbz)、叔丁氧羰基(boc)、9-芴基甲氧基羰基(fmoc)、烯丙基氧基羰基(alloc)、(4,4-二甲基-2,6-二氧代环己基亚基)乙基(dde)、1-(4,4-二甲基2,6-二氧代环己-1-基亚基)-3-甲基丁基(ivdde)、乙酰基、苯甲酰基、苄基、氨基甲酸酯、对甲氧基苄基醚(pmb)和对甲苯磺酰基(ts)。
[0114]
本领域普通技术人员将理解,当化合物或化合物属(例如,本文所述的属)的变量
(例如,部分或接头)由所有化合价均被填充的独立化合物的名称或式来描述时,变量的未填充的化合价将由使用该变量的上下文决定。例如,当如本文所述的化合物的变量通过单键连接(例如键合)至化合物的其余部分时,该变量被理解为表示单价形式(即,由于未填充的化合价而能够形成单键)的独立化合物(例如,如果在一个实施例中该变量被命名为“甲烷”,但已知该变量通过单键连接到化合物的其余部分,则本领域普通技术人员将理解该变量实际上为单价形式的甲烷,即甲基或
–
ch3)。同样,对于接头变量(例如,如本文所述的l1、l2或l3),本领域普通技术人员将理解该变量为二价形式的独立化合物(例如,如果在一个实施例中该变量被分配至“peg”或“聚乙二醇”,但该变量通过两个单独的键连接到化合物的其余部分,则本领域普通技术人员将理解该变量为二价的(即,能够通过两个未填充的化合价形成两个键)形式的peg而不是独立化合物peg)。
[0115]
术语“外源性”是指源自给定细胞或生物体外部的分子或物质(例如,化合物、核酸或蛋白质)。例如,本文所指代的“外源性启动子”为并非源自表达它的植物的启动子。相反,术语“内源性”或“内源性启动子”是指产自或源于给定细胞或生物体的分子或物质。
[0116]
术语“脂质部分”根据其在化学中的一般含义使用,并且是指通常以脂肪族烃链为特征的疏水性分子。在实施例中,脂质部分包括3个至100个碳的碳链。在实施例中,脂质部分包括5个至50个碳的碳链。在实施例中,脂质部分包括5个至25个碳的碳链。在实施例中,脂质部分包括8个至525个碳的碳链。脂质部分可以包括饱和或不饱和碳链,并且可以任选地被取代。在实施例中,脂质部分在末端处任选地被带电荷的部分取代。在实施例中,脂质部分为在末端处任选地被甲酸部分取代的烷基或杂烷基。
[0117]
带电荷的部分是指具有丰富的电子密度(即,阴电性)或电子密度不足(即,阳电性)的官能团。带电荷的部分的非限制性实例包括甲酸、醇、磷酸盐、醛和磺酰胺。在实施例中,带电荷的部分能够形成氢键。
[0118]
术语“偶联剂”根据其一般含义使用并且是指参与化学反应并导致共价键的形成(例如,介于生物缀合物反应性部分之间,介于生物缀合物反应性部分与偶联剂之间)的物质(例如,化合物或溶液)。在实施例中,试剂的含量在化学反应过程中被耗尽。这与溶剂形成对比,溶剂通常不会在化学反应过程中被耗尽。偶联剂的非限制性实例包括苯并三唑-1-基-氧基三吡咯烷基鏻六氟磷酸盐(pybop)、7-氮杂苯并三唑-1-基氧基)三吡咯烷基鏻六氟磷酸盐(pyaop)、6-氯-苯并三唑-1-基氧基-三-吡咯烷基鏻六氟磷酸盐(pyclock)、1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸盐(hatu)或2-(1h-苯并三唑-1-基)-1,1,3,3-四甲基脲六氟磷酸盐(hbtu)。
[0119]
术语“溶液”根据使用,并且是指其中次要成分(例如溶质或化合物)均匀分布在主要成分(例如溶剂)中的液体混合物。
[0120]
如本文所用,术语“有机溶剂”根据其在化学中的一般含义使用并且是指包括碳的溶剂。有机溶剂的非限制性实例包括乙酸、丙酮、乙腈、苯、1-丁醇、2-丁醇、2-丁酮、叔丁醇、四氯化碳、氯苯、氯仿、环己烷、1,2-二氯乙烷、二甘醇、二乙醚、二乙二醇二甲醚(二甘醇二甲醚)、1,2-二甲氧基乙烷(甘醇二甲醚,dme)、二甲基甲酰胺(dmf)、二甲基亚砜(dmso)、1,4-二噁烷、乙醇、乙酸乙酯、乙二醇、甘油、庚烷、六甲基磷酰胺(hmpa)、六甲基亚磷酰三胺(hmpt)、己烷、甲醇、甲基叔丁基醚(mtbe)、二氯甲烷、n-甲基-2-吡咯烷酮(nmp)、硝基甲烷、戊烷、石油醚(挥发油)、1-丙醇、2-丙醇、吡啶、四氢呋喃(thf)、甲苯、三乙胺、邻二甲苯、间
二甲苯或对二甲苯。在实施例中,有机溶剂为或包括氯仿、二氯甲烷、甲醇、乙醇、四氢呋喃或二噁烷。
[0121]
如本文所用,术语“盐”是指用于本发明的方法中的化合物的酸盐或碱盐。可接受的盐的说明性实例为无机酸(盐酸、氢溴酸、磷酸等)盐、有机酸(乙酸、丙酸、谷氨酸、柠檬酸等)盐、季铵(碘甲烷、碘乙烷等)盐。
[0122]
如本文所用的术语“结合”和“结合的”根据其一般含义使用并且是指原子或分子之间的缔合。该缔合可以为直接的或间接的。例如,结合的原子或分子可以为直接的,例如通过共价键或接头(例如,第一接头或第二接头);或间接的,例如通过非共价键(例如,静电相互作用(例如离子键、氢键、卤键)、范德华相互作用(例如偶极-偶极、偶极-诱导偶极、伦敦色散)、环堆积(π效应)、疏水相互作用等)。
[0123]
如本文所用,术语“能够结合”是指能够可测量地与靶标(例如,vhl连接酶、brd4蛋白)结合的部分(例如,如本文所述的化合物)。在实施例中,当一个部分能够结合靶标时,该部分能够以小于约20μm、10μm、5μm、1μm、500nm、250nm、100nm、75nm、50nm、25nm、15nm、10nm、5nm、1nm或约0.1nm的kd进行结合。
[0124]
如本文所用,当提及两个部分时,术语“缀合”意指两个部分进行键合,其中连接这两个部分的一个或多个键可以为共价的或非共价的。在实施例中,cide的靶蛋白结合基序和cide的e3泛素连接酶结合基序彼此共价键合(例如直接键合,或通过共价键合的中间体(例如环状肽)来进行键合)。在实施例中,这两个部分为非共价键合的(例如通过离子键、范德华键/相互作用、氢键、极性键或它们的组合或混合物),诸如cide的靶蛋白结合基序与其靶蛋白结合配偶体之间以及cide的e3泛素连接酶结合基序与其e3泛素连接酶结合配偶体之间的相互作用,以形成三元复合物。
[0125]
如本文所用,术语“非亲核碱”是指作为弱亲核试剂的任何空间位阻碱基。
[0126]
如本文所用,术语“亲核试剂”是指向亲电子试剂提供电子对以形成与反应相关的化学键的化学物质。所有具有自由电子对或至少一个π键的分子或离子均可以充当亲核试剂。
[0127]
如本文所用的术语“强酸”是指在水溶液中完全解离或电离的酸。常见强酸的实例包括盐酸(hcl)、硝酸(hno3)、硫酸(h2so4)、氢溴酸(hbr)、氢碘酸(hi)、高氯酸(hclo4)或氯酸(hclo3)。
[0128]
如本文所用,术语“碳阳离子稳定溶剂”是指能够与碳阳离子形成偶极-偶极相互作用,从而稳定碳阳离子的任何极性质子溶剂。
[0129]
术语“氨基酸”或“氨基酸残基”是指天然存在的氨基酸和合成的(非天然存在的)氨基酸,以及以类似于天然存在的氨基酸的方式起作用的氨基酸类似物和氨基酸模拟物。天然存在的氨基酸是由遗传密码编码的氨基酸,以及后来被修饰的氨基酸,例如羟脯氨酸、γ-羧基谷氨酸和o-磷酸丝氨酸。氨基酸类似物是指具有与天然存在的氨基酸相同的基本化学结构的化合物,即α碳、羧基基团、氨基基团和一个或两个r基团,例如高丝氨酸、正亮氨酸、甲硫氨酸亚砜、甲硫氨酸甲基锍和氨基异丁酸。此类类似物具有修饰的r基团(例如正亮氨酸)或修饰的肽骨架,但是保留了与天然存在的氨基酸相同的基本化学结构。氨基酸模拟物是指具有与氨基酸的一般化学结构不同的结构但以与天然存在的氨基酸相似的方式起作用的化合物。术语“非天然存在的氨基酸”和“非天然氨基酸”是指在自然界中未发现的氨
基酸类似物、合成氨基酸和氨基酸模拟物。在实施例中,氨基酸为d-氨基酸。在实施例中,氨基酸为l-氨基酸。在实施例中,氨基酸为天然氨基酸。在实施例中,氨基酸为天然α氨基酸(即具有一个或多个天然氨基酸侧链的α氨基酸)。在实施例中,氨基酸为非天然α氨基酸(即具有一个或多个非天然氨基酸侧链的α氨基酸)。在实施例中,氨基酸为天然β氨基酸(即具有一个或多个天然氨基酸侧链的β氨基酸)。在实施例中,氨基酸为非天然β氨基酸(即具有一个或多个非天然氨基酸侧链的β氨基酸)。在实施例中,氨基酸为天然γ氨基酸(即具有一个或多个天然氨基酸侧链的γ氨基酸)。在实施例中,氨基酸为非天然γ氨基酸(即具有一个或多个非天然氨基酸侧链的γ氨基酸)。在实施例中,氨基酸为天然δ氨基酸(即具有一个或多个天然氨基酸侧链的δ氨基酸)。在实施例中,氨基酸为非天然δ氨基酸(即具有一个或多个非天然氨基酸侧链的δ氨基酸)。
[0130]
在本文中,氨基酸可能由它们众所周知的三字母符号、由iupac-iub生化命名委员会推荐的单字母符号或如本公开另外定义来表示。
[0131]
术语“大环”或“大环化合物”在本文中用于指代在环中包含12个或更多个原子的分子,其中该环任选被取代。在实施例中,大环为环状肽。在实施例中,大环为在环中包含16个至30个原子的环状肽。在实施例中,大环为在环中包含16个至28个原子的环状肽。在实施例中,大环为在环中包含18个至24个原子的环状肽。在实施例中,大环在环中包含至少16个原子。在实施例中,大环在环中包含至少17个原子。在实施例中,大环在环中包含至少18个原子。在实施例中,大环在环中包含18个原子。在实施例中,大环在环中包含19个原子。在实施例中,大环在环中包含20个原子。在实施例中,大环为在环中包含21个原子的环状肽。在实施例中,大环为在环中包含22个原子的环状肽。在实施例中,大环为在环中包含23个原子的环状肽。在实施例中,大环在环中包含24个原子。
[0132]
如本文所用,“肽”是指至少两个氨基酸或氨基酸残基通过其n-末端和c-末端处的酰胺键而连接在一起的聚合物。肽可以与不包含氨基酸的部分缀合。在实施例中,肽包含一种或多种非天然氨基酸。在实施例中,肽内的非天然氨基酸为d-氨基酸。在实施例中,拟肽内的天然氨基酸为天然α氨基酸(即具有一个或多个天然氨基酸侧链的α氨基酸)。在实施例中,拟肽内的非天然氨基酸为非天然α氨基酸(即具有一个或多个非天然氨基酸侧链的α氨基酸)。在实施例中,拟肽内的氨基酸为天然β氨基酸(即具有一个或多个天然氨基酸侧链的β氨基酸)。在实施例中,拟肽内的氨基酸为非天然β氨基酸(即具有一个或多个非天然氨基酸侧链的β氨基酸)。在实施例中,拟肽内的氨基酸为天然γ氨基酸(即具有一个或多个天然氨基酸侧链的γ氨基酸)。在实施例中,拟肽内的氨基酸为非天然γ氨基酸(即具有一个或多个非天然氨基酸侧链的γ氨基酸)。在实施例中,拟肽内的非天然氨基酸为δ氨基酸(即具有一个或多个天然或非天然侧链的δ氨基酸)。在实施例中,拟肽内的非天然氨基酸为n-烷基化氨基酸,例如n-甲基化。在实施例中,拟肽内的非天然氨基酸为包含cα二取代的非天然氨基酸(即具有叔cα的氨基酸,例如氨基异丁酸)。在实施例中,两个氨基酸之间的肽键由杂芳基基团(诸如三唑、噻唑、噁唑、异噁唑、噁二唑)替代。在实施例中,键为拟肽键,其中两个氨基酸之间的肽键由硫代酰胺、磺酰胺、缩肽(酯键)、硫代缩肽(硫酯键)、硫醚、醚、烯烃或氟代烯烃替代。
[0133]
如本文所用,“肽部分”是指二价肽部分(即二价形式的肽)。在实施例中,肽部分形成如本文所述的大环的一部分。在实施例中,二价在二价肽的n-末端和c-末端处(即,肽部
luo,a patent review of brd4 inhibitors(2013-2019),expert opinion on therapeutic patents,30:1,57-81(2020)中找到,该文献以引用方式并入本文。
[0144]
如本文所用,“靶向部分”或“靶蛋白配体”是指能够与靶蛋白结合的靶蛋白结合基序内的单价化学部分。在实施例中,靶向部分为brd4靶向部分或brd4配体。
[0145]
术语“药用盐”意指包括用相对无毒的酸或碱制备的活性化合物的盐,这取决于在本文所述的化合物上发现的特定取代基。当本发明化合物含有相对酸性官能基时,可通过使此类化合物的中性形式与足量的所需碱(纯的或在合适惰性溶剂中)接触来获得碱加成盐。药用的碱加成盐的实例包括钠盐、钾盐、钙盐、铵盐、有机氨基盐或镁盐,或者类似的盐。当本发明化合物含有相对碱性官能基时,可通过使此类化合物的中性形式与足量的所需酸(纯的或在合适惰性溶剂中)接触来获得酸加成盐。药用的酸加成盐的实例包括衍生自无机酸(如盐酸、氢溴酸、硝酸、碳酸、一氢碳酸、磷酸、一氢磷酸、二氢磷酸、硫酸、一氢硫酸、氢碘酸或亚磷酸等)的那些加成盐,以及衍生自相对无毒的有机酸(如乙酸、丙酸、异丁酸、马来酸、丙二酸、苯甲酸、琥珀酸、辛二酸、富马酸、乳酸、扁桃酸、邻苯二甲酸、苯磺酸、对甲苯磺酸、柠檬酸、酒石酸、草酸、甲磺酸等)的盐。还包括氨基酸的盐,例如精氨酸盐等,以及有机酸的盐,如葡糖醛酸或半乳糖醛酸等(参见,例如,berge等人,“pharmaceutical salts”,journal of pharmaceutical science,1977,66,1-19)。本公开的某些特定化合物同时包含碱性和酸性官能团,这使得该化合物可以转化为碱或酸加成盐。
[0146]
因此,本公开的化合物可以作为盐存在,例如与药用酸的盐。本公开包括此类盐。此类盐的非限制性实例包括盐酸盐、氢溴酸盐、磷酸盐、硫酸盐、甲磺酸盐、硝酸盐、马来酸盐、乙酸盐、柠檬酸盐、富马酸盐、丙酸盐、酒石酸盐(例如,( )-酒石酸盐、(-)-酒石酸盐或它们的混合物(包括外消旋混合物))、琥珀酸盐、苯甲酸盐,和与氨基酸(例如谷氨酸)的盐。以及季铵盐(例如碘甲烷、碘乙烷等)。这些盐可以通过本领域技术人员已知的方法来进行制备。
[0147]
中性形式的化合物优选地通过使盐与碱或酸接触并以常规方式分离母体化合物来再生。母体形式的化合物可能在某些物理特性方面(例如在极性溶剂中的溶解度)不同于各种盐形式。
[0148]
除了盐形式之外,本公开还提供了呈前药形式的化合物。本文所述的化合物的前药是指在生理学条件下容易地经历化学变化以提供本公开的化合物的那些化合物。本文所述的化合物的前药可以在施用后体内转化。此外,前药可以通过化学或生物化学方法在离体环境中(诸如例如当与合适的酶或化学试剂接触时)转化为本公开的化合物。
[0149]
本公开的某些化合物可以非溶剂化物形式以及溶剂化物形式存在,包括水合形式。通常,溶剂化物形式等同于非溶剂化物形式,并且被本公开的范围所包括在内。本公开的某些化合物可以以多种结晶或无定形形式存在。通常,对于本公开考虑的用途而言,全部物理形式是等效的,并且旨在为本公开的范围所涵盖在内。
[0150]“药用赋形剂”和“药用载体”是指有助于向受试者施用活性剂和被受试者吸收并且可以包括在本公开的组合物中而不会对患者造成显著的不良毒理学影响的物质。药用赋形剂的非限制性实例包括水、nacl、生理盐水溶液、乳酸林格氏液、正常蔗糖、正常葡萄糖、结合剂、填充剂、崩解剂、润滑剂、包衣剂、甜味剂、调味剂、盐溶液(诸如林格氏溶液)、醇、油、明胶、碳水化合物诸如乳糖、直链淀粉或淀粉、脂肪酸酯、羟甲基纤维素、聚乙烯吡咯烷
和色素等。此类制备物可以灭菌并且如果需要,可以与助剂混合,诸如润滑剂、防腐剂、稳定剂、润湿剂、乳化剂、用于影响渗透压的盐、缓冲液、着色剂和/或芳香族物质等,这些物质不会与本公开的化合物发生有害反应。本领域技术人员将认识到其他药物赋形剂可用于本公开。
[0151]“抑制剂”是指当与对照相比时,诸如不存在该化合物或具有已知无活性的化合物,降低活性的化合物(例如本文所述的化合物)。
[0152]
如本文所定义,关于蛋白质-抑制剂相互作用的术语“抑制(inhibition/inhibit/inhibiting)”等意指相对于在不存在抑制剂的情况下的蛋白质的活性或功能,负面影响(例如降低)蛋白质的活性或功能。在实施例中,抑制意指相对于在不存在抑制剂的情况下的蛋白质的浓度或水平,负面影响(例如降低)蛋白质的浓度或水平。在实施例中,抑制是指疾病或疾病症状的减少。在实施例中,抑制是指特定蛋白质靶标的活性减小。因此,抑制至少部分地包括部分或完全阻断刺激,降低、防止或延缓激活,或者灭活、脱敏或下调信号转导或酶活性或蛋白质的量。在实施例中,抑制是指由直接相互作用(例如,抑制剂与靶蛋白结合)引起的靶蛋白的活性的减小。在实施例中,抑制是指由于间接相互作用(例如,抑制剂与激活靶蛋白的蛋白质结合,从而防止靶蛋白激活)而减小靶蛋白的活性。
[0153]
在本公开中,“包括”、“包含”、“含有”和“具有”等可以具有美国专利法中赋予它们的含义,并且可以意指“包括”、“包含”等。“基本由
……
组成”或“基本上由
……
组成”同样具有美国专利法中赋予的含义,并且该术语为开放式的,只要所列举的内容的基本或新颖特征不因超过所列举的内容的存在而改变,就允许存在比所列举的内容更多的内容,但排除现有技术实施例。
[0154]
如本文所用,术语“癌症”是指在哺乳动物(例如人类)中发现的所有类型的癌症、肿瘤或恶性肿瘤,包括白血病、淋巴瘤、癌和肉瘤。可以用本文提供的化合物或方法治疗的示例性癌症包括脑癌、神经胶质瘤、胶质母细胞瘤、成神经细胞瘤、前列腺癌、结肠直肠癌、胰腺癌、成神经管细胞瘤、黑色素瘤、宫颈癌、胃癌、卵巢癌、肺癌、头部癌症、霍奇金氏病和非霍奇金氏淋巴瘤。可以用本文提供的化合物或方法治疗的示例性癌症包括甲状腺癌、内分泌系统癌、脑癌、乳腺癌、宫颈癌、结肠癌、头颈癌、肝癌、肾癌、肺癌、卵巢癌、胰腺癌、直肠癌、胃癌和子宫癌。附加的实例包括甲状腺癌、胆管癌、胰腺癌、皮肤黑色素瘤、结肠腺癌、直肠腺癌、胃腺癌、食道癌、头颈部鳞状细胞癌、乳腺浸润性癌、肺腺癌、肺鳞状细胞癌、非小细胞肺癌、间皮瘤、多发性骨髓瘤、成神经细胞瘤、神经胶质瘤、多形性胶质母细胞瘤、卵巢癌、横纹肌肉瘤、原发性血小板增多症、原发性巨球蛋白血症、原发性脑肿瘤、恶性胰腺胰岛素瘤、恶性类癌、膀胱癌、癌前皮肤病变、睾丸癌、甲状腺癌、成神经细胞瘤、食管癌、泌尿生殖道癌、恶性高钙血症、子宫内膜癌、肾上腺皮质癌、内分泌或外分泌胰腺肿瘤、甲状腺髓样癌、甲状腺髓样癌症、黑色素瘤、结肠直肠癌、乳头状甲状腺癌、肝细胞癌或前列腺癌。
[0155]
术语“纤维化病症”或“纤维化”是指涉及器官或组织中的组织重塑(该组织重塑导致该器官或组织的正常功能的破坏)的任何病症。通常该病症是由于所导致的:响应于组织的炎症或损伤,正常的实质组织被纤维和/或结缔组织以及它们的成分替代。纤维化病症可以作为肺纤维化(诸如囊性纤维化、特发性肺纤维化)并且作为进行性大块纤维化、硬皮病/系统性硬化症以及辐射诱导的肺损伤而在肺中发生。纤维化病症也可以在肝脏中发生,诸如桥接纤维化和肝硬化。纤维化病症可以作为神经胶质疤进一步发生在大脑中,作为心肌
纤维化、间质纤维化和替代性纤维化发生在心脏中,作为动脉硬化发生在动脉中,作为动脉粥样硬化纤维化(athrofibrosis)和粘连性关节囊炎发生在关节中,作为克罗恩氏病发生在肠道中,作为杜普伊特伦氏挛缩发生在手和手指中,作为瘢痕疙瘩、肾源性系统纤维化和硬皮病/系统性硬化症发生在皮肤中,作为纵隔纤维化发生在纵隔中,作为腹膜后纤维化发生在腹膜后腔中,作为骨髓纤维化发生在骨髓中,作为佩罗尼氏病发生在阴茎中。
[0156]
术语“特发性肺纤维化”或“ipf”是指原因不明的慢性、进行性纤维化间质性肺炎,其局限于肺部并且与普通型间质性肺炎(uip)的放射学和/或组织病理学模式相关联。随着肺组织变为瘢痕性并且变厚,肺部更难将氧气转移至血流中。结果,大脑、心脏和其他器官得不到它们正常运作所需的氧气。ipf还可以以以下项为特征:正常肺、纤维化以及影响外周和胸膜下实质的间质性炎症的交替区域。纤维化的标志包括上皮下肌成纤维细胞/成纤维细胞灶以及胶原蛋白和细胞外基质沉积增加。该过量的疤痕组织会导致肺泡壁硬化和依从性降低,这会导致肺总量不可逆的损失和将氧气传输到毛细血管的能力下降。
[0157]
ipf与许多间质性肺病(ild)具有类似的特征,该特征中的许多特征会导致肺纤维化。存在超过200种称为ild的肺部相关疾病,其也称为弥漫性实质性肺疾病或dpld。因为这些疾病影响间质(肺泡周围的空间),所以ild被归类为一组。然而,ild也可能影响肺部的其他部分。
[0158]
存在被称为特发性间质性肺炎(iip)的ild的亚组,其中肺组织会发炎,并且也可能出现瘢痕。如本文所用,“肺炎”用于描述炎症而不是感染(例如细菌性肺炎)。iip可以被分类为多种病理学亚型。这些亚型包括普通型间质性肺炎(uip)、非特异性间质性肺炎(nsip)、脱屑性间质性肺炎(dip)、呼吸性细支气管炎间质性肺病(rb-ild)、急性间质性肺炎(aip)、隐源性机化性肺炎(cop)和淋巴细胞性间质性肺炎(lip)。ipf为iip的亚型,ipf中所示的病理学模式与uip基本相同。
[0159]
患有ipf的受试者在高分辨率计算机断层摄影(hrct)扫描中具有uip模式,其具有以下三个特征:(1)胸膜下、基底纤维化占优势;(2)网状异常;和(3)存在具有或不具有牵拉性支气管扩张症的蜂窝状结构。此外,ipf受试者不具有以下与uip模式不一致的特征中的任何特征:(i)上肺或中肺纤维化占优势;(ii)支气管血管周围纤维化占优势;(iii)广泛的磨玻璃影异常(广泛》网状异常);(iv)大量微结节(双侧,主要为上叶);(v)离散的囊肿(多个,双侧远离蜂窝区域);(vi)弥漫性马赛克征/空气滞留(双侧,在三叶或更多叶中);(vii)支气管肺段和/或肺叶中的实变。这些标准代表美国胸科学会(ats)、欧洲呼吸学会(ers)、日本呼吸学会(jrs)和拉丁美洲胸科学会(alat)的官方声明。(参见raghu g等人,am j respir crit care med.(2011)183:(6):788-824.)
[0160]
患有ipf的受试者在hrct扫描中也可以具有可能的uip模式,其具有uip的组织病理学确认。受试者具有存在于其hrct扫描中的以下两个特征:(1)胸膜下、基底纤维化占优势;和(2)网状异常。此外,不存在以下与uip模式不一致的功能:(i)上肺或中肺纤维化占优势;(ii)支气管血管周围纤维化占优势;(iii)广泛的磨玻璃影异常(广泛》网状异常);(iv)大量微结节(双侧,主要为上叶);(v)离散的囊肿(多个,双侧远离蜂窝区域);(vi)弥漫性马赛克征/空气滞留(双侧,在三叶或更多叶中);(vii)支气管肺段和/或肺叶中的实变。(参见raghu g等人,同上)。
[0161]
对于uip模式的组织病理学确认,满足以下四个标准:(i)明显纤维化/结构变形的
证据,
±
主要分布在胸膜下/间隔旁的蜂窝状结构;(2)存在由纤维化而导致的肺实质的片状受累;(3)存在成纤维细胞灶;以及(4)不存在表明替代性诊断的与uip诊断相反的特征,例如透明膜、机化性肺炎、肉芽肿、远离蜂窝状结构的明显的间质炎性细胞浸润、占优势的气道中心性变化等(参见raghu,同上)。
[0162]
术语“治疗(treating或treatment)”指成功治疗或改善受损伤、疾病、病理或病况的任何标记,包括任何客观或主观参数,诸如减轻;缓解;症状减少或使患者更易忍受损伤、病理或病况;减缓恶化或衰退的速度;降低恶化末期的衰弱程度;改善患者的身体或心理健康。症状的治疗或改善可基于客观或主观参数;包括体格检查、神经精神检查和/或精神病学评估的结果。术语“治疗”及其词形变化,可以包括预防损伤、病理、病况或疾病。在实施例中,治疗为预防。在实施例中,治疗不包括预防。
[0163]
如本文所用(以及如本领域所充分理解的)的“治疗(treating或treatment)”也广泛地包括在受试者的病况中获得有益或期望的结果(包括临床结果)的任何方法。有益或期望的临床结果可包括但不限于:减轻或改善一种或多种症状或病况,减轻疾病程度,稳定(即,不恶化)疾病状态,预防疾病的传播或蔓延,延缓或减慢疾病进展,改善或缓解疾病状态,减少疾病复发,以及缓解,包括部分的和完全的以及可检测的和不可检测的。换句话说,如本文所用的“治疗”包括对疾病的任何治愈、改善或预防。治疗可以预防疾病的发生;抑制疾病的蔓延;缓解疾病的症状,全部或部分消除疾病的根本原因,缩短疾病的持续时间,或实现这些目标的组合。
[0164]
本文所用的“治疗(treating/treatment)”包括预防性治疗。治疗方法包括向受试者施用治疗有效量的活性剂。施用步骤可以由单次施用组成,也可以包括一系列施用。治疗期的长度取决于多种因素,诸如病况的严重程度、患者的年龄、活性剂的浓度、用于治疗的组合物的活性、或它们的组合。还应当理解,用于治疗或预防的药物的有效剂量可以在特定治疗或预防方案的过程中增加或减少。剂量的变化可通过本领域已知的标准诊断测定得出并且变得明显。在一些情况下,可能需要长期施用。例如,将组合物以足以治疗患者的量和持续时间施用于受试者。在实施例中,治疗(treating/treatment)并非预防性治疗。
[0165]“患者”或“有此需要的受试者”是指患有或易于患有疾病或病症的活生物体,所述疾病或病症可通过施用如本文所提供的药物组合物来治疗。非限制性实例包括人类、其他哺乳动物、牛、大鼠、小鼠、犬、猴、山羊、绵羊、奶牛、鹿和其他非哺乳类动物。在一些实施例中,患者是人类。
[0166]“有效量”是足以使化合物达到相对于不存在化合物时的既定目的的量(例如,实现施用的效果,治疗疾病,降低酶活性,增加酶活性,减少信号传导途径,或减轻疾病或病症的一种或多种症状)。“有效量”的一个实例是足以有助于治疗、预防或减轻疾病的一种或多种症状的量,也可以称为“治疗有效量”。一种或多种症状的“减少”(以及该短语的语法等效形式)意指降低一种或多种症状的严重程度或频率或消除一种或多种症状。药物的“预防有效量”是当施用于受试者时将具有预期的预防效果的药物的量,例如,预防或延缓损伤、疾病、病理或病症的发生(或复发),或降低损伤、疾病、病理或病症或其症状发作(或复发)的可能性。单次施用后不一定能达到完全的预防效果,该效果可能只有在施用一系列剂量后才能达到。因此,预防有效的量可以一次或多次施用。如本文所用的“活性降低量”是指相对于不存在拮抗剂时降低酶活性所需的拮抗剂的量。如本文所用的“功能破坏量”是指相对于
不存在拮抗剂时破坏酶或蛋白质功能所需的拮抗剂的量。确切的量将取决于治疗的目的,并且可以由本领域技术人员使用已知技术来确定(参见,例如,lieberman,pharmaceutical dosage forms(vols.1-3,1992);lloyd,the art,science and technology of pharmaceutical compounding(1999);pickar,dosage calculations(1999);以及remington:the science and practice of pharmacy,第20版,2003,gennaro编撰,lippincott,williams&wilkins)。
[0167]
对于本文所述的任何化合物,治疗有效量可从细胞培养测定中初步确定。目标浓度将是那些能够实现本文所述的方法的活性化合物的浓度,如使用本文所述的方法或本领域已知的方法所测量的。
[0168]
如本领域所熟知的,用于人体的治疗有效量也可以从动物模型确定。例如,可将人用剂量配制为实现已发现对动物有效的浓度。人用剂量可通过监测化合物有效性和向上或向下调整剂量来调节,如上所述。根据上述方法和其他方法调整剂量以在人体内实现最大功效,完全在本领域普通技术人员的能力范围内。
[0169]
如本文所用的术语“治疗有效量”是指足以改善疾患的治疗剂的量,如上所述。例如,对于给定的参数,治疗有效量将表现出增加或减少至少5%、10%、15%、20%、25%、40%、50%、60%、75%、80%、90%或至少100%。疗效也可表示为增加或减少的“倍数”。例如,治疗有效量相比于对照可具有至少1.2倍、1.5倍、2倍、5倍或更多的效果。
[0170]
剂量可根据患者的需要和所用化合物而变化。在本公开的上下文中,向患者施用的剂量应足以随着时间的推移在患者体内实现有益的疗效。剂量的大小也将取决于任何不良副作用的存在、性质和程度。确定特定情况下的合适剂量在从业人员的技术范围内。通常,开始治疗时,剂量小于化合物的最佳剂量。此后,小幅增加剂量直到达到特定情况下的最佳效果。剂量和间隔可单独调整,以提供对正在治疗的特定临床适应症有效的所施用化合物的各种疗效水平。这将提供与个体疾病状态的严重程度相对应的治疗方案。
[0171]
如本文所用,术语“施用”意指口服施用;作为栓剂施用;局部接触;静脉内、肠胃外、腹膜内、肌内、病灶内、鞘内、鼻内或皮下施用;或向受试者植入缓释装置(例如,微型渗透泵)。通过任何途径来进行施用,包括肠胃外和经粘膜(例如,口腔、舌下、腭、牙龈、鼻、阴道、直肠或经皮)。胃肠外施用包括例如静脉内、肌内、小动脉内、皮内、皮下、腹膜内、心室内和颅内。其他递送模式包括但不限于脂质体制剂、静脉内输注、透皮贴剂等的使用。在实施例中,施用不包括施用除所述活性剂之外的任何活性剂。
[0172]
如本文所用,术语“三元复合物”是指通过三个不同部分之间的同时相互作用来形成的蛋白质复合物,该三个不同部分为:靶蛋白、cide和泛素系统成分,例如e3泛素连接酶。特别地,cide的靶蛋白结合基序与其靶蛋白结合配偶体之间以及cide的e3泛素连接酶结合基序与其e3泛素连接酶结合配偶体之间的相互作用或缔合,以形成蛋白质复合物。相互作用可以为非共价的。三元复合物的形成可以为静态的、瞬态的或间歇性的。
[0173]
如本文所用,术语“降解(degrade/degradation)”是指蛋白水解或蛋白质中的肽键中的一个或多个肽键的水解。蛋白质降解可以通过本领域已知的任何合适的方法来进行测量,该方法包括通过免疫荧光法、免疫印迹法、elisa、免疫组织化学法、质谱或放射性标记来监测靶蛋白水平。
[0174]
ii.化合物
[0175]
本公开涉及环状肽和包含由至少一个肽连接的e3泛素连接酶结合基序(eulbm)和靶蛋白结合基序(tpbm)的大环异双功能化学降解诱导剂(cide),以及制备和使用此类大环异双功能cide的方法。本文还提供了环状肽和大环eulbm。
[0176]
在一方面,本文提供了具有下式的化合物:
[0177][0178]
其中x1、x2、l
1a
、l
1b
、l
1c
、l
2a
、l
2b
、l
2c
各自独立地为键或氨基酸。
[0179]
在一方面,x1为eulbm。
[0180]
在另一方面,x1为vhl结合基序。
[0181]
在又一方面,x1为包含羟基脯氨酸的vhl结合基序。
[0182]
在又一方面,x2为d-α氨基酸或d-δ氨基酸。
[0183]
在又一方面,x2为包含d-α氨基酸或d-δ氨基酸的tpbm。
[0184]
在又一方面,x1为vhl结合基序,并且x2为包含d-α氨基酸或d-δ氨基酸的tpbm。
[0185]
在又一方面,x1为包含羟基脯氨酸的vhl结合基序,并且x2为包含d-α氨基酸或d-δ氨基酸的tpbm。
[0186]
在一方面,x1为eulbm,x2为tpbm,并且l
1a
、l
1b
、l
1c
、l
2a
、l
2b
、l
2c
各自独立地为键或氨基酸。
[0187]
在又一方面,x1为vhl结合基序,x2为tpbm,并且l
1a
、l
1b
、l
1c
、l
2a
、l
2b
、l
2c
各自独立地为键或氨基酸。
[0188]
在又一方面,x1为包含羟基脯氨酸的vhl结合基序,x2为tpbm,并且l
1a
、l
1b
、l
1c
、l
2a
、l
2b
、l
2c
各自独立地为键或氨基酸。
[0189]
在一方面,x1为eulbm,x2为包含d-α氨基酸或d-δ氨基酸的tpbm,并且l
1a
、l
1b
、l
1c
、l
2a
、l
2b
、l
2c
各自独立地为键或氨基酸。
[0190]
在又一方面,x1为vhl结合基序,x2为包含d-α氨基酸或d-δ氨基酸的tpbm,并且l
1a
、l
1b
、l
1c
、l
2a
、l
2b
、l
2c
各自独立地为键或氨基酸。
[0191]
在又一方面,x1为包含羟基脯氨酸的vhl结合基序,x2为包含d-α氨基酸或d-δ氨基酸的tpbm,并且l
1a
、l
1b
、l
1c
、l
2a
、l
2b
、l
2c
各自独立地为键或氨基酸。
[0192]
在另一方面,x1为eulbm,并且l
1a
、l
1b
、l
1c
、x2、l
2a
、l
2b
、l
2c
各自独立地为键或氨基酸。
[0193]
在另一方面,x1为vhl结合基序,并且l
1a
、l
1b
、l
1c
、x2、l
2a
、l
2b
、l
2c
各自独立地为键或氨基酸。
[0194]
在另一方面,x1为包含羟基脯氨酸的vhl结合基序,并且l
1a
、l
1b
、l
1c
、x2、l
2a
、l
2b
、l
2c
各自独立地为键或氨基酸。
[0195]
在另一方面,x1为eulbm,x2为d-α氨基酸或d-δ氨基酸,并且l
1a
、l
1b
、l
1c
、l
2a
、l
2b
、l
2c
各自独立地为键或氨基酸。
[0196]
在另一方面,x1为vhl结合基序,x2为d-α氨基酸或d-δ氨基酸,并且l
1a
、l
1b
、l
1c
、l
2a
、
l
2b
、l
2c
各自独立地为键或氨基酸。
[0197]
在另一方面,x1为包含羟基脯氨酸的vhl结合基序,x2为d-α氨基酸或d-δ氨基酸,并且l
1a
、l
1b
、l
1c
、l
2a
、l
2b
、l
2c
各自独立地为键或氨基酸。
[0198]
在其他方面,x2为d-α氨基酸或d-δ氨基酸,l
2c
为d-α氨基酸或d-β氨基酸或键。l
2a
和l
2b
各自独立地为键或氨基酸。l
1a
、l
1b
和l
1c
各自独立地为键或氨基酸。
[0199]
在一方面,x1为eulbm,x2为包含d-α氨基酸或d-δ氨基酸的tpbm,l
2c
为d-α氨基酸或d-β氨基酸或键。l
2a
和l
2b
各自独立地为键或氨基酸。l
1a
、l
1b
和l
1c
各自独立地为键或氨基酸。
[0200]
在又一方面,x1为vhl结合基序,x2为包含d-α氨基酸或d-δ氨基酸的tpbm,l
2c
为d-α氨基酸或d-β氨基酸或键。l
2a
和l
2b
各自独立地为键或氨基酸。l
1a
、l
1b
和l
1c
各自独立地为键或氨基酸。
[0201]
在又一方面,x1为包含羟基脯氨酸的vhl结合基序,x2为包含d-α氨基酸或d-δ氨基酸的tpbm,l
2c
为d-α氨基酸或d-β氨基酸或键。l
2a
和l
2b
各自独立地为键或氨基酸。l
1a
、l
1b
和l
1c
各自独立地为键或氨基酸。
[0202]
x1[0203]
x1为e3泛素连接酶结合基序(eulbm),例如vhl结合基序。在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为连接到l
1c
的l-α氨基酸,x
1b
为l-羟基脯氨酸或l-氟羟基脯氨酸,并且x
1c
为连接到l
2c
的d-α氨基酸或d-β氨基酸。
[0204]
x
1a
可以为键或氨基酸。在实施例中,x
1a
为l-α氨基酸或l-β氨基酸。在实施例中,x
1a
为l-tle、l-bme-ile、l-val、l-ala、l-abu、l-pen、l-cha、l-cpa、l-cba、l-bme2烯丙基gly、l-adagly、l-tle-tria、nme-l-tle-tria、l-tle-tria-cyp或l-thpgly。
[0205]
在实施例中,x
1a
为
–
nh-l
13a-l
13b-c(r
1a
)(r
1b
)-c(o)
–
或
[0206][0207]
其中x
1a
胺连接到l
1c
,并且x
1a
羰基连接到x
1b
。l
13a
为键、未取代的c
1-c8亚烷基或未取代的2元至8元亚杂烷基。l
13b
为键、取代或未取代的c
1-c8亚烷基、未取代的亚芳基或未取代的亚杂芳基。r
1a
和r
1b
各自独立地为氢、c
1-c6烷基、c
1-c6环烷基、三唑基或c
1-c6硫醇。
[0208]
在实施例中,经取代的l
13b
(例如,经取代的c
1-c8亚烷基)被至少一个取代基基团、尺寸受限的取代基基团或低级取代基基团取代;其中如果经取代的l
13b
被选自取代基基团、尺寸受限的取代基基团和低级取代基基团的多个基团取代;则每个取代基基团、尺寸受限的取代基基团和/或低级取代基基团可以任选地为不同的。在实施例中,当l
13b
被取代时,它被至少一个取代基基团取代。在实施例中,当l
13b
被取代时,它被至少一个尺寸受限的取代基基团取代。在实施例中,当l
13b
被取代时,它被至少一个低级取代基基团取代。
[0209]
在实施例中,x
1a
为
–
nh-c(r
1a
)(r
1b
)-c(o)
–
或
[0210][0211]
其中x
1a
胺连接到l
1c
,并且x
1a
羰基连接到x
1b
。r
1a
和r
1b
各自独立地为氢、c
1-c6烷基、c
2-c8烯基、c
1-c6环烷基、三唑基或c
1-c6硫醇。
[0212]
在实施例中,r
1b
为氢。
[0213]
在实施例中,x
1a
为
–
nh-ch(r
1a
)-c(o)
–
或
[0214][0215]
其中x
1a
胺连接到l
1c
,并且x
1a
羰基连接到x
1b
。r
1a
为氢、c
1-c6烷基、c
2-c8烯基、c
3-c6环烷基、三唑基或c
1-c6硫醇。
[0216]
在实施例中,r
1a
为未取代的c
1-c6烷基。在实施例中,r
1a
为未取代的c
1-c6硫醇。在实施例中,r
1a
为未取代的c
3-c6环烷基。在实施例中,r
1a
选自由以下项组成的组:甲基、乙基、异丙基、叔丁基、异丙基-硫醇、环丁基、环戊基、环己基、四氢吡喃基和金刚烷基。在实施例中,r
1a
为叔丁基。
[0217]
在实施例中,x
1a
为:
[0218][0219]
在实施例中,x
1a
为
–
nr
16-l
13a-l
13b-c(r
1a
)(r
1b
)-c(o)
–
或其中x
1a
胺连接到l
1c
,并且x
1a
羰基连接到x
1b
,并且其中l
13b
为任选地经取代的亚三唑基(triazolylene)或r
1a
为任选地经取代的三唑基。
[0220]
在实施例中,r
1a
为任选地经取代的三唑基,其中x
1a
具有下式:其中x
1a
胺连接到l
1c
,并且x
1a
羰基连接到x
1b
。
[0221]
在实施例中,x
1a
为三唑基取代的gly或α氨基酸。
[0222]
在实施例中,l
13b
为c
1-c6亚烷基、c
3-c6亚环烷基、c
1-c6亚杂烷基、c
3-c6亚杂环烷基或c
1-c6硫醇烯(thiolene)。例如,在实施例中,r
1a
为任选地经取代的三唑基并且l
13b
为c2硫醇烯,其中x
1a
具有下式:在实施例中,r
1a
为任选地经取代的三唑基并且l
13b
为c6亚杂环烷基,其中x
1a
具有下式:
[0223][0224]
在实施例中,l
13a
和l
13b
各自独立地选自键、
[0225]
在实施例中,l
13a
选自键、
[0226]
在实施例中,l
13b
为任选地经取代的亚三唑基,其中x
1a
具有下式:
[0227]
其中x
1a
胺连接到l
1c
,并且x
1a
羰基连接到x
1b
。
[0228]
在实施例中,r
15
选自氢、卤素、-cn、-c(o)nr
15ar15b
、取代或未取代的c
1-c6烷基、取代或未取代的2元至6元杂烷基、取代或未取代的c
3-c6环烷基、取代或未取代的苯基以及取代或未取代的5元至6元杂芳基,其中r
15a
和r
15b
独立地选自氢和取代或未取代的c
1-c6烷基。
[0229]
在实施例中,r
15
为氢。在实施例中,r
15
为卤素。在实施例中,r
15
为
–
cn。在实施例中,r
15
为-c(o)nr
15ar15b
。在实施例中,r
15
为取代或未取代的c
1-c6烷基。在实施例中,r
15
为取代或未取代的2元至6元杂烷基。在实施例中,r
15
为取代或未取代的c
3-c6环烷基。在实施例中,r
15
为取代或未取代的苯基。在实施例中,r
15
为取代或未取代的5元至6元杂芳基。在实施例中,r
15
为未取代的c
1-c6烷基。在实施例中,r
15
为未取代的2元至6元杂烷基。在实施例中,r
15
为未取代的c
3-c6环烷基。在实施例中,r
15
为未取代的苯基。在实施例中,r
15
为未取代的5元至6元杂芳基。
[0230]
在实施例中,经取代的r
15
(例如,经取代的烷基、经取代的杂烷基、经取代的环烷基、经取代的苯基和/或经取代的杂芳基)被至少一个取代基基团、尺寸受限的取代基基团
或低级取代基基团取代;其中如果经取代的r
15a
被选自取代基基团、尺寸受限的取代基基团和低级取代基基团的多个基团取代;则每个取代基基团、尺寸受限的取代基基团和/或低级取代基基团可以任选地为不同的。在实施例中,当r
15
被取代时,它被至少一个取代基基团取代。在实施例中,当r
15
被取代时,它被至少一个尺寸受限的取代基基团取代。在实施例中,当r
15
被取代时,它被至少一个低级取代基基团取代。
[0231]
在实施例中,经取代的r
15a
(例如,经取代的烷基)被至少一个取代基基团、尺寸受限的取代基基团或低级取代基基团取代;其中如果经取代的r
15a
被选自取代基基团、尺寸受限的取代基基团和低级取代基基团的多个基团取代;则每个取代基基团、尺寸受限的取代基基团和/或低级取代基基团可以任选地为不同的。在实施例中,当r
15a
被取代时,它被至少一个取代基基团取代。在实施例中,当r
15a
被取代时,它被至少一个尺寸受限的取代基基团取代。在实施例中,当r
15a
被取代时,它被至少一个低级取代基基团取代。
[0232]
在实施例中,经取代的r
15b
(例如,经取代的烷基)被至少一个取代基基团、尺寸受限的取代基基团或低级取代基基团取代;其中如果经取代的r
15b
被选自取代基基团、尺寸受限的取代基基团和低级取代基基团的多个基团取代;则每个取代基基团、尺寸受限的取代基基团和/或低级取代基基团可以任选地为不同的。在实施例中,当r
15b
被取代时,它被至少一个取代基基团取代。在实施例中,当r
15b
被取代时,它被至少一个尺寸受限的取代基基团取代。在实施例中,当r
15b
被取代时,它被至少一个低级取代基基团取代。
[0233]
在实施例中,l
13b
为任选地经取代的亚三唑基,l
13a
为键、取代或未取代的c
1-c8亚烷基、未取代的c
5-c6亚芳基或者取代或未取代的2元至8元亚杂烷基或它们的组合。在实施例中,l
13a
可以任选地被选自c
1-c6烷基、c
3-6
环烷基和-c(o)nr
13ar13b
的一个或多个取代基取代,其中r
13a
和r
13b
各自独立地选自氢和取代或未取代的c
1-c6烷基。
[0234]
在实施例中,经取代的r
13a
(例如,经取代的烷基)被至少一个取代基基团、尺寸受限的取代基基团或低级取代基基团取代;其中如果经取代的r
13a
被选自取代基基团、尺寸受限的取代基基团和低级取代基基团的多个基团取代;则每个取代基基团、尺寸受限的取代基基团和/或低级取代基基团可以任选地为不同的。在实施例中,当r
13a
被取代时,它被至少一个取代基基团取代。在实施例中,当r
13a
被取代时,它被至少一个尺寸受限的取代基基团取代。在实施例中,当r
13a
被取代时,它被至少一个低级取代基基团取代。
[0235]
在实施例中,经取代的r
13b
(例如,经取代的烷基)被至少一个取代基基团、尺寸受限的取代基基团或低级取代基基团取代;其中如果经取代的r
13b
被选自取代基基团、尺寸受限的取代基基团和低级取代基基团的多个基团取代;则每个取代基基团、尺寸受限的取代基基团和/或低级取代基基团可以任选地为不同的。在实施例中,当r
13b
被取代时,它被至少一个取代基基团取代。在实施例中,当r
13b
被取代时,它被至少一个尺寸受限的取代基基团取代。在实施例中,当r
13b
被取代时,它被至少一个低级取代基基团取代。
[0236]
在此类实施例中,l
13a
为l
13a1-l
13a2-l
13a3
,其中l
13a1
、l
13a2
和l
13a3
各自独立地选自键、-nh-、-s-、-o-、-c(o)-、-c(o)o-、-oc(o)-、-nhc(o)-、-c(o)nh-、-nhc(o)nh-、-nhc(nh)nh-、-c(s)-、取代或未取代的亚烷基(例如,c
1-c8、
1-c6、c
1-c4或c
1-c2)、取代或未取代的亚杂烷基(例如,2元至8元、2元至6元、4元至6元、2元至3元或4元至5元)、取代或未取代的亚环烷基(例如,c
3-c8、c
3-c6、c
4-c6或c
5-c6)、取代或未取代的亚杂环烷基(例如,3元至8元、3元至6元、4元至6元、4元至5元或5元至6元)、取代或未取代的亚芳基(例如,c
6-c
10
或亚苯基)或者
取代或未取代的亚杂芳基(例如,5元至10元、5元至9元或5元至6元)。
[0237]
在实施例中,l
13b
为任选地经取代的亚三唑基,并且l
13a
选自选自选自在实施例中,
–
nr
16-l
13a
–
具有结构
[0238]r16
可以为h、连接到l
13a
以形成5元或6元杂环的c
1-c6烷基或c
1-c6亚烷基。在实施例中,r
16
为连接回l
13a
以形成5元或6元杂环的亚烷基。在实施例中,
–
nr
16-l
13a
–
具有以下结构在实施例中,
–
nr
16-l
13a
–
具有结构
[0239]
在实施例中,-n-r
16-l
13a-选自由以下项组成的组:
[0240]
在实施例中,
–
nr
16-l
13a
–
具有结构
[0241]
在实施例中,x
1a
为为其中x
1a
胺连接到l
1c
,并且x
1a
羰基连接到x
1b
。
[0242]
l
13a
为l
13a1-l
13a2-l
13a3
。
[0243]
l
13b
为l
13b1-l
13b2-l
13b3
。
[0244]
l
13a1
、l
13a2
、l
13a3
、l
13b1
、l
13b2
、l
13b3
独立地选自由以下项组成的组:键、-nh-、-s-、-o-、-c(o)-、-c(o)o-、-oc(o)-、-nhc(o)-、-c(o)nh-、-nhc(o)nh-、-nhc(nh)nh-、-c(s)-、取代或未取代的亚烷基(例如,c
1-c8、c
1-c6、c
1-c4或c
1-c2)、取代或未取代的亚杂烷基(例如,2元至8元、2元至6元、4元至6元、2元至3元或4元至5元)、取代或未取代的亚环烷基(例如,c
3-c8、c
3-c6、c
4-c6或c
5-c6)、取代或未取代的亚杂环烷基(例如,3元至8元、3元至6元、4元至6元、4元至5元或5元至6元)、取代或未取代的亚芳基(例如,c
6-c
10
或亚苯基)以及取代或未取代的亚杂芳基(例如,5元至10元、5元至9元或5元至6元)。
[0245]r15
选自氢、卤素、-cn、-c(o)nr
15ar15b
、取代或未取代的烷基、取代或未取代的杂烷基、取代或未取代的环烷基、取代或未取代的芳基和取代或未取代的杂芳基,其中r
15a
和r
15b
独立地选自氢和取代或未取代的烷基。
[0246]r16
为h或连接到l
13a
以形成5元或6元环的烷基。
[0247]
在实施例中,经取代的l
13a1
(例如,经取代的亚烷基、经取代的亚杂烷基、经取代的亚杂环烷基和/或经取代的亚杂芳基)被至少一个取代基基团、尺寸受限的取代基基团或低级取代基基团取代;其中如果经取代的l
13a1
被选自取代基基团、尺寸受限的取代基基团和
低级取代基基团的多个基团取代;则每个取代基基团、尺寸受限的取代基基团和/或低级取代基基团可以任选地为不同的。在实施例中,当l
13a1
被取代时,它被至少一个取代基基团取代。在实施例中,当l
13a1
被取代时,它被至少一个尺寸受限的取代基基团取代。在实施例中,当l
13a1
被取代时,它被至少一个低级取代基基团取代。
[0248]
在实施例中,经取代的l
13a2
(例如,经取代的亚烷基、经取代的亚杂烷基、经取代的亚杂环烷基和/或经取代的亚杂芳基)被至少一个取代基基团、尺寸受限的取代基基团或低级取代基基团取代;其中如果经取代的l
13a2
被选自取代基基团、尺寸受限的取代基基团和低级取代基基团的多个基团取代;则每个取代基基团、尺寸受限的取代基基团和/或低级取代基基团可以任选地为不同的。在实施例中,当l
13a2
被取代时,它被至少一个取代基基团取代。在实施例中,当l
13a2
被取代时,它被至少一个尺寸受限的取代基基团取代。在实施例中,当l
13a2
被取代时,它被至少一个低级取代基基团取代。
[0249]
在实施例中,经取代的l
13a3
(例如,经取代的亚烷基、经取代的亚杂烷基、经取代的亚杂环烷基和/或经取代的亚杂芳基)被至少一个取代基基团、尺寸受限的取代基基团或低级取代基基团取代;其中如果经取代的l
13a3
被选自取代基基团、尺寸受限的取代基基团和低级取代基基团的多个基团取代;则每个取代基基团、尺寸受限的取代基基团和/或低级取代基基团可以任选地为不同的。在实施例中,当l
13a3
被取代时,它被至少一个取代基基团取代。在实施例中,当l
13a3
被取代时,它被至少一个尺寸受限的取代基基团取代。在实施例中,当l
13a3
被取代时,它被至少一个低级取代基基团取代。
[0250]
在实施例中,经取代的l
13b1
(例如,经取代的亚烷基、经取代的亚杂烷基、经取代的亚杂环烷基和/或经取代的亚杂芳基)被至少一个取代基基团、尺寸受限的取代基基团或低级取代基基团取代;其中如果经取代的l
13b1
被选自取代基基团、尺寸受限的取代基基团和低级取代基基团的多个基团取代;则每个取代基基团、尺寸受限的取代基基团和/或低级取代基基团可以任选地为不同的。在实施例中,当l
13b1
被取代时,它被至少一个取代基基团取代。在实施例中,当l
13b1
被取代时,它被至少一个尺寸受限的取代基基团取代。在实施例中,当l
13b1
被取代时,它被至少一个低级取代基基团取代。
[0251]
在实施例中,经取代的l
13b2
(例如,经取代的亚烷基、经取代的亚杂烷基、经取代的亚杂环烷基和/或经取代的亚杂芳基)被至少一个取代基基团、尺寸受限的取代基基团或低级取代基基团取代;其中如果经取代的l
13b2
被选自取代基基团、尺寸受限的取代基基团和低级取代基基团的多个基团取代;则每个取代基基团、尺寸受限的取代基基团和/或低级取代基基团可以任选地为不同的。在实施例中,当l
13b2
被取代时,它被至少一个取代基基团取代。在实施例中,当l
13b2
被取代时,它被至少一个尺寸受限的取代基基团取代。在实施例中,当l
13b2
被取代时,它被至少一个低级取代基基团取代。
[0252]
在实施例中,经取代的l
13b3
(例如,经取代的亚烷基、经取代的亚杂烷基、经取代的亚杂环烷基和/或经取代的亚杂芳基)被至少一个取代基基团、尺寸受限的取代基基团或低级取代基基团取代;其中如果经取代的l
13b3
被选自取代基基团、尺寸受限的取代基基团和低级取代基基团的多个基团取代;则每个取代基基团、尺寸受限的取代基基团和/或低级取代基基团可以任选地为不同的。在实施例中,当l
13b3
被取代时,它被至少一个取代基基团取代。在实施例中,当l
13b3
被取代时,它被至少一个尺寸受限的取代基基团取代。在实施例中,当l
13b3
被取代时,它被至少一个低级取代基基团取代。
[0253]
在实施例中,l
13a
为键、未取代的c
1-c8亚烷基、邻-双-乙基苯或未取代的2元至8元亚杂烷基;l
13b
为键、取代或未取代的c
1-c8亚烷基、未取代的亚芳基或未取代的亚杂芳基;并且r
1a
和r
1b
各自独立地为氢、c
1-c6烷基、c
1-c6环烷基或c
1-c6硫醇。
[0254]
在实施例中,l
13a
为键、未取代的c
1-c8亚烷基或未取代的2元至8元亚杂烷基。
[0255]
在实施例中,l
13b
为键、取代或未取代的c
1-c8亚烷基、未取代的亚芳基或未取代的亚杂芳基。
[0256]
在实施例中,r
1a
和r
1b
各自独立地为氢、c
1-c6烷基、c
1-c6环烷基、c
1-c6硫醇或三唑。
[0257]
在实施例中,x
1a
为在实施例中,x
1a
为在实施例中,x
1a
为在实施例中,x
1a
为在实施例中,在实施例中,x
1a
为在实施例中,x
1a
为在实施例中,x
1a
为在实施例中,x
1a
为在实施例中,x
1a
为在实施例中,x
1a
为在实施例中,x
1a
为
[0258]
在实施例中,x
1a
为其中r
1a
和r
1b
如本文所述(包括在
实施例中)。在实施例中,x
1a
为其中r
1a
和r
1b
如本文所述(包括在实施例中)。在实施例中,x
1a
为其中r
1a
和r
1b
如本文所述(包括在实施例中)。
[0259]
在实施例中,x
1a
为在实施例中,x
1a
为
[0260]
在实施例中,x
1a
为
[0261][0262]
x
1b
可以为具有式的经取代的脯氨酸,其中x
1b
氮连接到x
1a
羰基,并且x
1b
羰基连接到x
1c
的胺。r2和r
50
各自独立地为氢、羟基或卤素。
[0263]
在实施例中,r2为羟基,并且r
50
为氢。
[0264]
在实施例中,r2为羟基,并且r
50
为氟。
[0265]
在实施例中,x
1b
为l-羟基脯氨酸(l-hyp)或l-氟羟基脯氨酸(f-l-hyp)。
[0266]
在实施例中,x
1b
为
[0267]
x
1c
可以为键或氨基酸。在实施例中,x
1c
为α氨基酸或β氨基酸。在实施例中,x
1c
为d-α氨基酸或d-β氨基酸。
[0268]
在实施例中,x
1c
选自由以下项组成的组:d-mtpg、d-biphe、d-ala、aib、d-bta、l-bta、d-bmtpg、l-bmtpg、d-mtphe、l-biphe、l-tyr(o-me)、d-bbiphe和d-phe(4i)。
[0269]
在实施例中,x
1c
选自由以下项组成的组:d-mtpg、d-biphe、d-ala、aib、d-bta、d-mtphe和d-phe(4i)。
[0270]
在实施例中,x
1c
具有下式:其中胺连接到x
1b
,并且羰基连接到l
2c
。r
3a
和r
3b
各自独立地为氢、氧代、卤素、卤代烷基(诸如-ccl3、-cbr3、-cf3、-ci3、-ch2cl、-ch2br、-ch2f、-ch2i、-chcl2、-chbr2、-chf2和-chi2)、-o-卤代烷基(诸如-occl3、-ocbr3、-ocf3、-oci3、-och2cl、-och2br、-och2f、-och2i、-ochcl2、-ochbr2、-ochf2和-ochi2)、-cn、-oh、-nh2、-cooh、-conh2、-no2、-sh、-so3h、-so4h、-so2nh2、-nhnh2、-onh2、-nhc(o)nhnh2、-nhc(o)nh2、-nhso2h、-nhc(o)h、-nhc(o)oh、-nhoh、取代或未取代的烷基、取代或未取代的杂烷基、取代或未取代的环烷基、取代或未取代的杂环烷基、取代或未取代的芳基、取代或未取代的联芳基、取代的或未取代的杂芳基或者取代或未取代的二杂
芳基。变量n18为0或1。
[0271]
在实施例中,经取代的r
3a
(例如,经取代的烷基、经取代的杂烷基、经取代的环烷基、经取代的杂环烷基、经取代的芳基、经取代的联芳基、经取代的杂芳基和/或经取代的二杂芳基)被至少一个取代基基团、尺寸受限的取代基基团或低级取代基基团取代;其中如果经取代的r
3a
被选自取代基基团、尺寸受限的取代基基团和低级取代基基团的多个基团取代;则每个取代基基团、尺寸受限的取代基基团和/或低级取代基基团可以任选地为不同的。在实施例中,当r
3a
被取代时,它被至少一个取代基基团取代。在实施例中,当r
3a
被取代时,它被至少一个尺寸受限的取代基基团取代。在实施例中,当r
3a
被取代时,它被至少一个低级取代基基团取代。
[0272]
在实施例中,经取代的r
3b
(例如,经取代的烷基、经取代的杂烷基、经取代的环烷基、经取代的杂环烷基、经取代的芳基、经取代的联芳基、经取代的杂芳基和/或经取代的二杂芳基)被至少一个取代基基团、尺寸受限的取代基基团或低级取代基基团取代;其中如果经取代的r
3b
被选自取代基基团、尺寸受限的取代基基团和低级取代基基团的多个基团取代;则每个取代基基团、尺寸受限的取代基基团和/或低级取代基基团可以任选地为不同的。在实施例中,当r
3b
被取代时,它被至少一个取代基基团取代。在实施例中,当r
3b
被取代时,它被至少一个尺寸受限的取代基基团取代。在实施例中,当r
3b
被取代时,它被至少一个低级取代基基团取代。
[0273]
在实施例中,r
3b
为氢或c
1-c3烷基。
[0274]
在实施例中,r
3a
为氢、c
1-c4烷基或
[0275]
在实施例中,r
3a
为
[0276][0277]
l3为键、取代或未取代的亚烷基或者取代或未取代的亚杂烷基。在实施例中,l3为键或未取代的c
1-c2亚烷基。在实施例中,l3为键。在实施例中,l3为亚甲基。
[0278]
在实施例中,经取代的l3(例如,经取代的亚烷基和/或经取代的亚杂烷基)被至少一个取代基基团、尺寸受限的取代基基团或低级取代基基团取代;其中如果经取代的l3被选自取代基基团、尺寸受限的取代基基团和低级取代基基团的多个基团取代;则每个取代基基团、尺寸受限的取代基基团和/或低级取代基基团可以任选地为不同的。在实施例中,
当l3被取代时,它被至少一个取代基基团取代。在实施例中,当l3被取代时,它被至少一个尺寸受限的取代基基团取代。在实施例中,当l3被取代时,它被至少一个低级取代基基团取代。
[0279]
a1为c
5-c6芳基、5元至6元杂芳基或5元至6元杂环烷基a1为c
5-c6芳基、5元至6元杂芳基或5元至6元杂环烷基。在实施例中,a1为c
5-c6芳基、5元至6元杂芳基或5元至6元杂环烷基。在实施例中,a1为苯基。在实施例中,a1为噻吩基。
[0280]
在实施例中,r
3a
为
[0281]
r9为氢、经取代的c
1-c4烷基、卤素、-cn、-oh、-nh2、-cooh、-conh2、-no2、-sh、-so3h、-so4h、-so2nh2、-nhnh2、-onh2、-nhc(o)nhnh2、-nhc(o)nh2、-nhso2h、-nhc(o)h、-nhc(o)oh、-nhoh、-occl3、-ocf3、-ocbr3、-oci3、-ochcl2、-ochbr2、-ochi2、-ochf2、-n3、芳基、杂芳基、环烷基或杂环烷基,其中芳基、杂芳基和杂环烷基任选地被一个或多个取代基取代。
[0282]
在实施例中,经取代的r9(例如,经取代的芳基、经取代的杂芳基、经取代的环烷基和/或经取代的杂环烷基)被至少一个取代基基团、尺寸受限的取代基基团或低级取代基基团取代;其中如果经取代的r9被选自取代基基团、尺寸受限的取代基基团和低级取代基基团的多个基团取代;则每个取代基基团、尺寸受限的取代基基团和/或低级取代基基团可以任选地为不同的。在实施例中,当r9被取代时,它被至少一个取代基基团取代。在实施例中,当r9被取代时,它被至少一个尺寸受限的取代基基团取代。在实施例中,当r9被取代时,它被至少一个低级取代基基团取代。
[0283]
在实施例中,r9为选自由以下项组成的组的卤素取代的c
1-c4烷基:-ccl3、-cbr3、-cf3、-ci3、-ch2cl、-ch2br、-ch2f、-ch2i、-chcl2、-chbr2、-chf2和-chi2。
[0284]
在实施例中,r9为氢、未取代的c
1-c4烷基、卤素、c
5-c6芳基、5元至6元杂芳基或5元至6元杂环烷基,其中芳基、杂芳基和杂环烷基任选地被选自由c
1-c4烷基和卤素组成的组的一个或多个取代基取代。
[0285]
在实施例中,r9为氢。
[0286]
在实施例中,r9为取代或未取代的杂芳基。在实施例中,r9为未取代的杂芳基。在实施例中,r9为经取代的杂芳基。
[0287]
在实施例中,r9为取代或未取代的呋喃基、取代或未取代的吡咯基、取代或未取代的噻吩基、取代或未取代的咪唑基、取代或未取代的吡唑基、取代或未取代的噁唑基、取代或未取代的异噁唑基、取代或未取代的噻唑基、取代或未取代的异噻唑基或者取代或未取代的苯并噻唑基。
[0288]
在实施例中,r9为经取代的呋喃基、经取代的吡咯基、经取代的噻吩基、经取代的咪唑基、经取代的吡唑基、经取代的噁唑基、经取代的异噁唑基、经取代的噻唑基、经取代的异噻唑基或经取代的苯并噻唑基。
[0289]
在实施例中,r9为取代或未取代的噻唑基。在实施例中,噻唑基被至少一个未取代
的c
1-c6烷基取代。在实施例中,噻唑基被选自以下项的至少一个取代基取代:甲基、乙基、丙基、异丙基、丁基、异丁基和叔丁基。在实施例中,噻唑基被至少一个甲基取代。
[0290]
在实施例中,r9为未取代的芳基。在实施例中,r9为苯基。在实施例中,r9为卤素。在实施例中,r9为被甲基取代的噻唑基。
[0291]
在实施例中,a为苯基并且r9为苯基。在实施例中,a为苯基并且r9为未取代的苯基。在实施例中,a为苯基并且r9为被甲基取代的噻唑基。在实施例中,a为苯基并且r9为碘。在实施例中,a为噻吩基并且r9为溴。
[0292]
在实施例中,l3为亚甲基,a为苯基并且r9为被甲基取代的噻唑基。在实施例中,l3为亚甲基,a为苯基,r9为被甲基取代的噻唑基,并且n18为1。在实施例中,n18为0。
[0293]
在实施例中,r
3a
为
[0294]
在实施例中,r
3a
为
[0295]
在实施例中,r
3a
为
[0296]
在实施例中,r
3a
为
[0297]
在实施例中,r
3a
为
[0298]
在实施例中,x
1c
选自由以下项组成的组:
[0299][0300][0301]
在实施例中,x
1c
选自由以下项组成的组:
[0302][0303]
x1可能具有以下结构:
[0304]
其中x
1a
的胺连接到l
1c
,并且*表示与l
2c
的连接点。l
13a
为键、未取代的c
1-c8亚烷基、未取代的2元至8元亚杂烷基或未取代的3元至8元亚杂环烷基。l
13b
为键、取代或未取代的c
1-c8亚烷基、未取代的亚芳基或未取代的亚杂芳基。r
1a
和r
1b
各自独立地为氢、c
1-c6烷基、c
1-c6环烷基或c
1-c6硫醇。r2和r
50
各自独立地为氢、羟基或卤素。r
10
为氢或未取代的c
1-c3烷基。r
3b
为氢或c
1-c3烷基。变量n18为0或1。r
3a
选自由以下项组成的组:甲基、
[0305][0306]
在实施例中,x1具有以下结构:
[0307]
其中x
1a
的胺连接到l
1c
,并且*表示与l
2c
的连接点。l
13a
为键、未取代的c
1-c8亚烷基、未取代的2元至8元亚杂烷基或未取代的3元至8元亚杂环烷基。l
13b
为键、取代或未取代的c
1-c8亚烷基、未取代的亚芳基或未取代的亚杂芳基。r
1a
为c
1-c6烷基、c
1-c6环烷基或c
1-c6硫醇。r2为羟基,并且r
50
为氢、羟基或卤素。r
10
为氢或未取代的c
1-c3烷基。变量n18为0或1。r
3a
选自由以下项组成的组:甲基、
[0308][0309]
在实施例中,
–
x1–
或
–
x
1a-x
1b-x
1c
–
选自由以下项组成的组:
[0310]
在实施例中,l
13a
和l
13b
各自为键。
[0311]
在实施例中,r
1a
选自由以下项组成的组:甲基、乙基、异丙基、叔丁基、异丙基-硫醇、环丁基、环戊基、环己基、金刚烷基和四氢吡喃基。
[0312]
在实施例中,r
1b
为氢。
[0313]
在实施例中,r2为羟基,并且r
50
为氢。
[0314]
在实施例中,r
10
为氢。
[0315]
在实施例中,r
3a
为甲基,并且r
3b
为氢。
[0316]
在实施例中,r
3a
和r
3b
各自为甲基。
[0317]
在实施例中,x1选自由以下项组成的组:
[0318]
[0319]
[0320]
[0321]
[0322][0323]
在实施例中,x1为e3泛素连接酶结合基序(eulbm),例如vhl结合基序,其具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
选自l-tle、l-bme-ile、l-abu、l-val、l-ala、l-pen、l-cha、l-cpa、l-cba、l-bme2烯丙基gly、l-adagly、l-tle-tria、nme-l-tle-tria、l-tle-tria-cyp和l-thpgly;x
1b
为l-羟基脯氨酸或l-氟羟基脯氨酸;并且x
1c
选自d-mtpg、l-mtpg、d-biphe、d-ala、aib、d-bta、d-bmtpg、d-mtphe、d-phe和d-phe(4i)。
[0324]
l
2c
[0325]
在实施例中,l
2c
为键或者与x1和l
2b
形成肽键或拟肽键的天然或非天然氨基酸。当l
2c
为天然或非天然氨基酸时,l
2c
的氨基基团可以连接到x1,并且l
2c
的羰基可以连接到l
2b
。在实施例中,l
2c
为甘氨酸、d-α氨基酸或d-β氨基酸。
[0326]
在实施例中,l
2c
为甘氨酸。
[0327]
在实施例中,l
2c
为d-α氨基酸。
[0328]
在实施例中,l
2c
为d-β氨基酸。
[0329]
在实施例中,l
2c
选自由以下项组成的组:gly、d-ala、l-ala、bala、d-pyrala、d-phe、d-biphe、d-val、d-gln、d-lys和d-lys(n3)。
[0330]
在实施例中,l
2c
选自由以下项组成的组:gly、d-ala、bala、d-pyrala、d-phe、d-biphe、d-val、d-gln、d-lys和d-lys(n3)。
[0331]
在实施例中,l
2c
选自:选自:
[0332]
其中l
2c
羰基连接到l
2b
。
[0333]
在实施例中,l
2c
选自由以下项组成的组:
[0334][0335]
在实施例中,l
2c
为其中l
2c
羰基连接到l
2b
。在实施例中,l
2c
为其中l
2c
羰基连接到l
2b
。在实施例中,l
2c
为其中l
2c
羰基连接到l
2b
。在实施例中,l
2c
为其中l
2c
羰基连接到l
2b
。在实施例中,l
2c
为其中l
2c
羰基连接到l
2b
。在实施例中,l
2c
为其中l
2c
羰基连接到l
2b
。在实施例中,l
2c
为
其中l
2c
羰基连接到l
2b
。在实施例中,l
2c
为其中l
2c
羰基连接到l
2b
。在实施例中,l
2c
为其中l
2c
羰基连接到l
2b
。在实施例中,l
2c
为其中l
2c
羰基连接到l
2b
。在实施例中,l
2c
为其中l
2c
羰基连接到l
2b
。在实施例中,l
2c
为其中l
2c
羰基连接到l
2b
。在实施例中,l
2c
为其中l
2c
羰基连接到l
2b
。在实施例中,l
2c
为其中l
2c
羰基连接到l
2b
。
[0336]
在实施例中,l
2c
选自由以下项组成的组:选自由以下项组成的组:
[0337]
其中l
2c
羰基连接到x
2a
胺,并且l
2c
胺连接到x
1c
羰基。
[0338]
l
2b
[0339]
在实施例中,l
2b
为介于l
2c
与l
2a
之间的键或者与l
2c
和l
2a
形成肽键或拟肽键的天然或非天然氨基酸。当l
2b
为天然或非天然氨基酸时,l
2b
的氨基基团可以连接到l
2c
,并且l
2b
的羰基可以连接到l
2a
。
[0340]
在实施例中,l
2b
为介于l
2c
与l
2a
之间的键。
[0341]
l
2a
[0342]
在实施例中,l
2a
为介于l
2b
与x2之间的键或者与l
2b
和x2形成肽键或拟肽键的天然或非天然氨基酸。当l
2a
为天然或非天然氨基酸时,l
2a
的胺可以连接到l
2b
,并且l
2a
的羰基可以连接到x2。
[0343]
在实施例中,l
2a
为键。
[0344]
在实施例中,l
2a
为介于l
2b
与x2之间的键。
[0345]
在实施例中,l
2a
、l
2b
和l
2c
在x1与x2之间形成单键。
[0346]
在实施例中,l
2a
和l
2b
在l
2c
与x2之间形成单键。
[0347]
l
1a
[0348]
在实施例中,l
1a
为介于x2与l
1b
之间的键或者与x2和l
1b
形成肽键或拟肽键的天然或非天然氨基酸。当l
1a
为天然或非天然氨基酸时,l
1a
的胺可以连接到x2,并且l
1a
的羰基可以连接到l
1b
。
[0349]
在实施例中,l
1a
为键。
[0350]
在实施例中,l
1a
为介于x2与l
1b
之间的键。
[0351]
l
1b
[0352]
在实施例中,l
1b
为键或者与l
1a
和l
1c
形成肽键或拟肽键的天然或非天然氨基酸。当l
1b
为天然或非天然氨基酸时,l
1b
的胺可以连接到l
1a
,并且l
1b
的羰基可以连接到l
1c
。
[0353]
在实施例中,l
1b
为键。
[0354]
在实施例中,l
1b
为键或l-α氨基酸。
[0355]
在实施例中,l
1b
为介于l
1a
与l
1c
之间的键。
[0356]
在实施例中,l
1b
为l-α氨基酸。
[0357]
在实施例中,l
1b
为l-gln或l-ala。
[0358]
在实施例中,l
1b
为在实施例中,l
1b
羰基连接到l
1c
。
[0359]
l
1c
[0360]
在实施例中,l
1c
为键或者与l
1b
和x1形成肽键或拟肽键的天然或非天然氨基酸。当l
1b
为天然或非天然氨基酸时,l
1c
的胺可以连接到l
1b
,并且l
1c
的羰基可以连接到x1。
[0361]
在实施例中,l
1c
为d-α氨基酸、γ氨基酸、δ氨基酸或ε氨基酸。在实施例中,l
1c
为d-α氨基酸。在实施例中,l
1c
为γ氨基酸。在实施例中,l
1c
为δ氨基酸。在实施例中,l
1c
为ε氨基酸。
[0362]
在实施例中,l
1c
选自由以下项组成的组:d-cys(s-ac)、gly、d-hcys(s-ac)、nme-d-cys(s-ac)、o1pen、nme-o1pen、gaba、ava、aep、ahx、ahp、s1pen、d-cys(3gly,s-ac)、l-gln、
l-ala、nme-ava、2-氨基mepheac、nme-ahx、αme-ava、βme-ava、γme-ava、δme-ava和4pipac。在实施例中,l
1c
选自由以下项组成的组:d-cys(s-ac)、gly、d-hcys(s-ac)、nme-d-cys(s-ac)、o1pen、nme-o1pen、gaba、ava、aep、ahx、ahp、s1pen、nme-ava、2-氨基mepheac、nme-ahx、αme-ava、βme-ava、γme-ava和4pipac。在实施例中,l
1c
为d-cys(s-ac)。在实施例中,l
1c
为gly。在实施例中,l
1c
为d-hcys(s-ac)。在实施例中,l
1c
为nme-d-cys(s-ac)。在实施例中,l
1c
为o1pen。在实施例中,l
1c
为nme-o1pen。在实施例中,l
1c
为gaba。在实施例中,l
1c
为ava。在实施例中,l
1c
为aep。在实施例中,l
1c
为ahx。在实施例中,l
1c
为ahp。在实施例中,l
1c
为s1pen。在实施例中,l
1c
为nme-ava。在实施例中,l
1c
为2-氨基mepheac。在实施例中,l
1c
为nme-ahx。在实施例中,l
1c
为αme-ava。在实施例中,l
1c
为βme-ava。在实施例中,l
1c
为γme-ava。在实施例中,l
1c
为4pipac。
[0363]
在实施例中,l
1c
为取代或未取代的亚烷基接头,其包含键合至x2的氮原子。亚烷基接头的一个或多个碳原子可以被杂原子(诸如n、o或s)替代。取代或未取代的亚烷基接头l
1c
可以具有位于接头l
1c
的两端之间的中间亚芳基单元。亚芳基单元可以经由邻位、间位或对位排列来分离接头l
1c
的亚烷基部分。在实施例中,亚烷基可以被烷基、偕二烷基(gem-dialkyl)、螺环碳环或螺环杂环、氧代、烷氧基、硫代等取代。取代和杂原子替代可以结合以形成官能团,诸如酰胺和酯。在实施例中,亚烷基接头l
1c
可以包含5个至10个线性原子,或5个至8个线性原子。
[0364]
在实施例中,l
1c
为:
[0365][0366]
在实施例中,l
1c
为:
[0367][0368]
在实施例中,l
1c
为:
[0369][0370]
在实施例中,l
1c
为键、
[0371][0371]
其中l
1c
羰基连接到x1。
[0372]
在实施例中,l
1c
为:
[0373]
键、键、
其中l
1c
羰基连接到x1。
[0374]
在实施例中,l
1c
选自由以下项组成的组:选自由以下项组成的组:
[0375]
在实施例中,l
1c
为键。在实施例中,l
1c
为在实施例中,l
1c
为在实施例中,l
1c
为在实施例中,l
1c
为:在实施例中,l
1c
为:在实施例中,l
1c
为:
在实施例中,l
1c
为:在实施例中,l
1c
为:在实施例中,l
1c
为:在实施例中,l
1c
为:在实施例中,l
1c
为:在实施例中,l
1c
为:在实施例中,l
1c
为:在实施例中,l
1c
为:在实施例中,l
1c
为:在实施例中,l
1c
为:在实施例中,l
1c
为:在实施例中,l
1c
为:在实施例中,l
1c
为:在实施例中,l
1c
为:在实施例中,l
1c
为:在实施例中,l
1c
为:在实施例中,l
1c
为:
[0376]
在实施例中,l
1a
、l
1b
和l
1c
在x1与x2之间形成单键。
[0377]
在实施例中,l
1a
和l
1b
在l
1c
与x2之间形成单键。
[0378]
x2[0379]
在实施例中,x2为与l
1b
和x1形成肽键或拟肽键的天然或非天然氨基酸。l
1c
的胺可以连接到l
1b
,并且l
1c
的羰基可以连接到x1。
[0380]
在实施例中,x2为d-α氨基酸或d-δ氨基酸。
[0381]
在实施例中,x2为靶蛋白结合基序(tpbm)。x2包含靶向部分。靶向部分可以为单价形式的靶蛋白配体,其共价连接或缀合至与x2的另一部分形成键的大环,或者靶向部分可以为二价形式的靶蛋白配体,其整合到与l
1a
和l
2a
形成键的大环中。
[0382]
单价形式的靶蛋白配体可以以任何合适的方式连接或缀合至大环,该方式包括与x2的一部分形成肽、磺酰胺、酯、硫醚、醚或三唑键。在实施例中,x2的单价靶蛋白配体所连接或缀合至的部分为与l
1a
和l
2a
形成键的至少一个天然或非天然氨基酸。例如,该一个或多个氨基酸可以与l
1a
和l
2a
形成肽键或拟肽键。至少一个氨基酸可以包括d-α氨基酸或d-δ氨基酸。
[0383]
在实施例中,x2为包含d-α氨基酸或d-δ氨基酸的tpbm。
[0384]
在实施例中,x2包括d-α氨基酸。
[0385]
在实施例中,x2包括d-δ氨基酸。
[0386]
在实施例中,-x
2a
–
l
10-为d-dap、d-dap-nme、d-b2orn、d-dab、l-dap、d-pip、d-blys、d-dap(peg3)、(d/l)-二氨基乙酸、d-orn、l-orn、d-lys4ene或nme-d-dap。
[0387]
在实施例中,-x
2a
–
l
10-选自由以下项组成的组:d-dap、d-dap-nme、nme-d-dap、d-b2orn和d-pip。在实施例中,x2具有下式:
[0388][0389]
其中x
2a
为与l
1a
和l
2a
形成键的至少一个天然或非天然氨基酸。在式iia中,靶蛋白配体x3通过任何合适的接头l
10
来连接或缀合至x
2a
。在式iib中,伯胺或仲胺经由任何合适的接头l
11
来连接到x
2a
,并且r
11
为氢或未取代的c
1-5
烷基。
[0390]
在实施例中,x2具有下式:
[0391]
[0392]
其中x
2a
为与l
1a
和l
2a
形成键的至少一个天然或非天然氨基酸;l
10
为键、肽接头或非肽接头;并且x3为靶向部分。
[0393]
在实施例中,x2具有式其中x
2a
为与l
1a
和l
2a
形成键的至少一个天然或非天然氨基酸;l
11
为键或者取代或未取代的亚烷基;并且r
11
为氢或未取代的c
1-c5烷基。
[0394]
在实施例中,经取代的l
11
(例如,经取代的亚烷基)被至少一个取代基基团、尺寸受限的取代基基团或低级取代基基团取代;其中如果经取代的l
11
被选自取代基基团、尺寸受限的取代基基团和低级取代基基团的多个基团取代;则每个取代基基团、尺寸受限的取代基基团和/或低级取代基基团可以任选地为不同的。在实施例中,当l
11
被取代时,它被至少一个取代基基团取代。在实施例中,当l
11
被取代时,它被至少一个尺寸受限的取代基基团取代。在实施例中,当l
11
被取代时,它被至少一个低级取代基基团取代。
[0395]
在实施例中,式iia为
[0396][0397]
在实施例中,式iib为
[0398][0399]
在实施例中,x
2a
包含d-α氨基酸或d-δ氨基酸。
[0400]
在实施例中,x
2a
具有式其中x
2a
羰基连接到l
1a
,x
2a
胺连接到l
2a
,并且第三连接点分别连接到式iia和iib的l
10
或l
11
;l
12
和l
13
各自独立地为键,或者经取代或未取代的、饱和、不饱和或部分不饱和的c
1-c
10
烷基;并且r
12
为氢或未取代的c
1-c5烷基,或者r
12
任选地与l
10
或l
11
接合以形成未取代的杂环烷基。在实施例中,x
2a
具有式其中x
2a
羰基连接到l
1a
氨基,并且x
2a
胺连接到l
2a
羰基,并且第三连接点连接到l
10
;l
12
和l
13
各自独立地为键,或者经取代或未取代的、饱和、不饱和或部分不饱和的c
1-c
10
烷基;并且r
12
为氢或未取代的c
1-c5烷基。
[0401]
在实施例中,经取代的l
12
(例如,经取代的c
1-c
10
亚烷基)被至少一个取代基基团、
尺寸受限的取代基基团或低级取代基基团取代;其中如果经取代的l
12
被选自取代基基团、尺寸受限的取代基基团和低级取代基基团的多个基团取代;则每个取代基基团、尺寸受限的取代基基团和/或低级取代基基团可以任选地为不同的。在实施例中,当l
12
被取代时,它被至少一个取代基基团取代。在实施例中,当l
12
被取代时,它被至少一个尺寸受限的取代基基团取代。在实施例中,当l
12
被取代时,它被至少一个低级取代基基团取代。
[0402]
在实施例中,经取代的l
13
(例如,经取代的c
1-c
10
亚烷基)被至少一个取代基基团、尺寸受限的取代基基团或低级取代基基团取代;其中如果经取代的l
13
被选自取代基基团、尺寸受限的取代基基团和低级取代基基团的多个基团取代;则每个取代基基团、尺寸受限的取代基基团和/或低级取代基基团可以任选地为不同的。在实施例中,当l
13
被取代时,它被至少一个取代基基团取代。在实施例中,当l
13
被取代时,它被至少一个尺寸受限的取代基基团取代。在实施例中,当l
13
被取代时,它被至少一个低级取代基基团取代。
[0403]
在实施例中,r
12
为氢。
[0404]
在实施例中,r
12
为甲基。
[0405]
在实施例中,l
12
和l
13
各自为键。
[0406]
在实施例中,l
12
和l
13
各自独立地为未取代的饱和c
1-c
10
烷基。
[0407]
在实施例中,l
12
和l
13
各自独立地为未取代的未饱和c
1-c
10
烷基。
[0408]
在实施例中,l
12
和l
13
各自独立地为未取代的部分饱和c
1-c
10
烷基。
[0409]
在实施例中,l
12
为键,并且l
13
为未取代的饱和c
1-c
10
烷基。
[0410]
在实施例中,l
12
为键,并且l
13
为亚甲基。
[0411]
在实施例中,l
12
为未取代的饱和c
1-c
10
烷基,并且l
13
为键。
[0412]
在实施例中,l
12
为亚甲基,并且l
13
为键。
[0413]
在实施例中,l
12
为键,并且l
13
为未取代的不饱和c
1-c
10
烷基。
[0414]
在实施例中,l
12
为未取代的不饱和c
1-c
10
烷基,并且l
13
为键。
[0415]
在实施例中,l
12
为键,并且l
13
为未取代的部分饱和c
1-c
10
烷基。
[0416]
在实施例中,l
12
为未取代的部分饱和c
1-c
10
烷基,并且l
13
为键。
[0417]
在实施例中,l
12
为未取代的不饱和c
1-c
10
烷基,并且l
13
为未取代的饱和c
1-c
10
烷基。
[0418]
在实施例中,l
12
为未取代的饱和c
1-c
10
烷基,并且l
13
为未取代的不饱和c
1-c
10
烷基。
[0419]
在实施例中,l
12
为未取代的饱和c
1-c
10
烷基,并且l
13
为未取代的部分饱和c
1-c
10
烷基。
[0420]
在实施例中,l
12
为未取代的不饱和c
1-c
10
烷基,并且l
13
为未取代的部分饱和c
1-c
10
烷基。
[0421]
在实施例中,l
12
为未取代的部分饱和c
1-c
10
烷基,并且l
13
为未取代的饱和c
1-c
10
烷基。
[0422]
在实施例中,l
12
为未取代的部分饱和c
1-c
10
烷基,并且l
13
为未取代的不饱和c
1-c
10
烷基。
[0423]
x
2a
的实例如下:
[0424][0425]
其中x
2a
羰基连接到l
1a
氨基,x
2a
胺连接到l
2a
羰基,并且第三连接点连接到l
10
。
[0426]
l
10
可以为任何合适的接头,其包括键、肽接头或非肽接头。在实施例中,l
10
为肽接头,诸如
–
n(r
105
)c(o)或
–
(ch(r
112
))
n12
–
n(r
110
)
–
c(o)
–
(ch2)
n14
–
[o-ch
2-ch2]
n13-n(r
116
)
–
;或非肽接头,诸如
–
(ch(r
112
))
n12
–
n(r
110
)
–
、
–
(ch(r
112
))
n12
–
c(o)
––
s(o)2–
、
–
n(r
105
)
–
、
–o–
、
–s–
、
–
c(o)
–
、
–
c(o)o
–
、
–
oc(o)
–
、取代或未取代的亚烷基、取代或未取代的亚杂烷基、取代或未取代的亚杂环烷基,或者取代或未取代的亚杂芳基。
[0427]r105
、r
110
、r
112
和r
116
各自独立地为氢、c
1-c6烷基、卤素、-ccl3、-cbr3、-cf3、-ci3、-ch2cl、-ch2br、-ch2f、-ch2i、-chcl2、-chbr2、-chf2、-chi2、-cn、-oh、-nh2、-cooh、-conh2、-no2、-sh、-so3h、-so4h、-so2nh2、-nhnh2、-onh2、-nhc(o)nhnh2、-nhc(o)nh2、-nhso2h、-nhc(o)h、-nhc(o)oh、-nhoh、-occl3、-ocf3、-ocbr3、-oci3,-ochcl2、-ochbr2、-ochi2、-ochf2、-n3、未取代的烷基或未取代的杂烷基。
[0428]
在实施例中,r
105
、r
110
、r
112
和r
116
各自独立地为氢或未取代的c
1-c6烷基。
[0429]
在实施例中,r
105
、r
110
、r
112
和r
116
并且各自独立地为氢或未取代的甲基。
[0430]
在实施例中,r
105
为氢或未取代的c
1-c6烷基。
[0431]
在实施例中,r
105
为氢。
[0432]
变量n12、n13、n14和n18各自独立地为0至6的整数。
[0433]
在实施例中,经取代的l
10
(例如,经取代的亚烷基、经取代的亚杂烷基、经取代的亚杂环烷基和/或经取代的亚杂芳基)被至少一个取代基基团、尺寸受限的取代基基团或低级取代基基团取代;其中如果经取代的l
10
被选自取代基基团、尺寸受限的取代基基团和低级取代基基团的多个基团取代;则每个取代基基团、尺寸受限的取代基基团和/或低级取代基基团可以任选地为不同的。在实施例中,当l
10
被取代时,它被至少一个取代基基团取代。在实施例中,当l
10
被取代时,它被至少一个尺寸受限的取代基基团取代。在实施例中,当l
10
被取代时,它被至少一个低级取代基基团取代。
[0434]
在实施例中,l
10
为亚噁二唑基(oxadiazolylene)。在实施例中,l
10
为亚三唑基。在实施例中,l
10
为酯接头。
[0435]
在实施例中,l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
。
[0436]
在实施例中,r
110
为氢或未取代的c
1-c6烷基;
[0437]
在实施例中,r
110
为氢。
[0438]
在实施例中,r
112
为氢或未取代的c
1-c6烷基。
[0439]
在实施例中,r
112
为氢。
[0440]
在实施例中,r
110
为氢或未取代的甲基。
[0441]
在实施例中,n12为0、1、2、3或4。
[0442]
在实施例中,n12为1。
[0443]
在实施例中,n18为1。
[0444]
在实施例中,r
112
为氢,r
110
为氢或未取代的甲基,n12为1并且n18为1。
[0445]
在实施例中,l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
和r
112
各自独立地为氢或c
1-c6烷基,并且n12为0至6的整数。
[0446]
在实施例中,l
10
为
–
(ch2)
n5
–
n(r
105
)
–
,其中r
105
为氢或未取代的甲基并且n5为0、1、2、3或4。
[0447]
在实施例中,l
10
为
–
ch2–
nh
–
。
[0448]
在实施例中,-ch(r
112
)
n12-的碳连接到x2的α碳。在实施例中,如果l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,则r
110
任选地与r
12
形成未取代的杂环烷基。
[0449]
在实施例中,l
10
任选地与x
2a
的主链胺形成未取代的亚杂环烷基,例如
[0450][0451]
l
11
可以为任何合适的接头,其包括键或者取代或未取代的亚烷基。
[0452]
在实施例中,x2为选自以下项的tpbm:
[0453][0454][0454]
其中x2羰基连接到l
1a
,并且x3如本文所定义(包括它们的实施例)。
[0455]
在实施例中,x2选自由以下项组成的组:
[0456][0457]
其中x2羰基连接到l
1a
,并且x3如本文所定义(包括它们的实施例)。
[0458]
在实施例中,x2为在实施例中,x2为在实施例中,x2为在实施例中,x2为在实施例中,x2为在实施例中,x2为在实施例中,x2为
[0459]
x3[0460]
x3可以为靶向部分或配体,例如brd4靶向部分。
[0461]
在实施例中,x3为氮杂衍生物,诸如三唑并二氮杂或异噁唑氮杂。在实施例中,x3为噻吩并三唑并二氮杂。在实施例中,x3为苯并三唑并二氮杂。在实施例中,x3为噻吩并异噁唑并氮杂。在实施例中,x3为苯并异噁唑并氮杂。
[0462]
在实施例中,x3为取代(例如,被至少一个取代基基团、尺寸受限的取代基基团或低级取代基基团取代)或未取代的三唑并二氮杂。在实施例中,x3为取代(例如,被至少一
个取代基基团、尺寸受限的取代基基团或低级取代基基团取代)或未取代的噻吩并三唑并二氮杂。在实施例中,x3为取代(例如,被至少一个取代基基团、尺寸受限的取代基基团或低级取代基基团取代)或未取代的苯并三唑并二氮杂。在实施例中,x3为取代(例如,被至少一个取代基基团、尺寸受限的取代基基团或低级取代基基团取代)或未取代的异噁唑氮杂。在实施例中,x3为取代(例如,被至少一个取代基基团、尺寸受限的取代基基团或低级取代基基团取代)或未取代的噻吩并异噁唑并氮杂。在实施例中,x3为取代(例如,被至少一个取代基基团、尺寸受限的取代基基团或低级取代基基团取代)或未取代的苯并异噁唑并氮杂。每个取代基基团、尺寸受限的取代基基团或低级取代基基团任选地为不同的。
[0463]
靶向部分或配体x3可以为氮杂衍生物,例如具有下式的衍生物:
[0464]
其中
[0465]
环a和环b各自独立地为c
5-6
碳环、5元至6元杂环、c
5-6
芳基或5元至6元杂芳基。例如,环a和环b可以包括选自由以下项组成的组的环:三唑(triazo)环、异噁唑并环、噻吩并环、苯并环、呋喃基环、硒代苯基环和吡啶基环。在实施例中,环a为三唑,并且环b为噻吩并。在实施例中,环a为三唑,并且环b为苯并。在实施例中,环a为异噁唑并,并且环b为噻吩并。在实施例中,环a为异噁唑并,并且环b为噻吩并。
[0466]
每个r
113
独立地为氢、未取代的c
1-c4烷基、-o-r
113a
或
–
cf3,其中r
113a
为未取代的c
1-c4烷基。在实施例中,r
113
为未取代的甲基。变量n21为1、2或3。在实施例中,n21为1。
[0467]
每个r
107
独立地为氢、卤素或者任选地由卤素或羟基取代的c
1-c4烷基。变量n20为1、2或3。在实施例中,n20为1。
[0468]
每个r
108
独立地为卤素或任选地由卤素取代的苯基、未取代的c
1-c4烷基、未取代的c
1-c4烷氧基、氰基、—nr
109
—(ch2)
v5
—r
110
或—nr
109
—c(o)-(ch2)
v5
—r
110
。r
109
为氢或未取代的c
1-c4烷基。变量v5为0至4的整数。r
110
为任选地由卤素取代的苯基或任选地由卤素取代的吡啶基。变量n19为1或2。在实施例中,n19为1。
[0469]
l
15
为将靶向部分x3连接到l
10
的任何合适的接头。例如,l
15
可以为键、亚烷基、胺或羰基接头。羰基接头可以为亚烷基-羰基接头,并且胺接头可以为亚烷基-胺接头。在实施例中,l
15
为羰基接头,例如-(ch2)
n11
c(o)-。在实施例中,l
15
为胺接头,例如-(ch2)
n11
nh-。变量n11可以为0、1、2或3的整数。在实施例中,l
15
为-(ch2)
n11
c(o)-,其中n11为1。在实施例中,l
15
为-(ch2)
n11
nh-,其中n11为0。在实施例中,l
15
的羰基与l
10
的胺形成键。在实施例中,l
15
的胺
与l
10
的羰基形成键。在实施例中,l
15
与l
10
之间的键为肽键。
[0470]
在实施例中,l
15
为键、-(ch2)
n11
c(o)-、-(ch2)
n11
nh-,其中n11为0、1、2或3。
[0471]
靶向部分或配体可以为三唑并二氮杂衍生物,例如具有下式的衍生物:
[0472]
其中
[0473]
环a为c
5-6
碳环、5元至6元杂环、c
5-6
芳基或5元至6元杂芳基。环a可以包括选自由以下项组成的组的环:噻吩并环、苯并环、呋喃环、硒酚环和吡啶基环。
[0474]
每个r
107
独立地为氢、卤素或者任选地由卤素或羟基取代的c
1-c4烷基。变量n20为1、2或3。在实施例中,n20为1。
[0475]
每个r
108
独立地为卤素或任选地由卤素取代的苯基、未取代的c
1-c4烷基、未取代的c
1-c4烷氧基、氰基、—nr
109
—(ch2)
v5
—r
110
或—nr
109
—c(o)-(ch2)
v5
—r
110
。r
109
为氢或未取代的c
1-c4烷基。变量v5为0至4的整数。r
110
为任选地由卤素取代的苯基或任选地由卤素取代的吡啶基。变量n19为1或2。在实施例中,n19为1。
[0476]r113
为氢、未取代的c
1-c4烷基、-o-r
113a
或
–
cf3,其中r
113a
为未取代的c
1-c4烷基。在实施例中,r
113
为甲基。
[0477]
l
15
为羰基接头、-(ch2)
n11
c(o)-或-(ch2)
n11
nh-,其中n11为0、1、2或3。在实施例中,l
15
为-(ch2)
n11
c(o)-,其中n11为1。在实施例中,l
15
为-(ch2)
n11
nh-,其中n11为0。
[0478]
靶向部分或配体可以为三唑并二氮杂衍生物,例如具有下式的衍生物:
[0479][0480]
x4为s或
–
ch=ch-。在实施例中,x4为
–
ch=ch-。在实施例中,x4为s。
[0481]r106
为氢或未取代的c
1-c4烷基。在实施例中,r
106
为氢。在实施例中,r
106
为未取代的c
1-c4烷基。
[0482]r107
为氢、卤素或者任选地由卤素或羟基取代的c
1-c4烷基。
[0483]
每个r
108
独立地为卤素或任选地由卤素取代的苯基、未取代的c
1-c4烷基、未取代的c
1-c4烷氧基、氰基、—nr
109
—(ch2)
v5
—r
110
或—nr
109
—c(o)-(ch2)
v5
—r
110
。r
109
为氢或未取代的c
1-c4烷基。变量v5为0至4的整数。r
110
为任选地由卤素取代的苯基或任选地由卤素取代的吡啶基。变量n19为1或2。在实施例中,n19为1。
[0484]r113
为氢、未取代的c
1-c4烷基、-o-r
113a
或
–
cf3,其中r
113a
为未取代的c
1-c4烷基。在实施例中,r
113
为甲基。
[0485]
l
15
为羰基接头、-(ch2)
n11
c(o)-或-(ch2)
n11
nh-,其中n11为0、1、2或3。在实施例中,l
15
为-(ch2)
n11
c(o)-,其中n11为1。在实施例中,l
15
为-(ch2)
n11
nh-,其中n11为0。
[0486]
在实施例中,x3为噻吩并三唑并二氮杂衍生物,例如2-(4-(4-氯苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f][1,2,4]三唑并[4,3-a][1,4]二氮杂-6-基)乙酸(s)-叔丁酯(jq1)及其衍生物,诸如国际pct公开号wo2006129623、国际pct公开号wo2009084693和国际pct公开号wo2011143651中所公开的那些,其内容以引用方式并入本文。国际pct公开号wo2011143669中公开了其他噻吩并三唑并二氮杂衍生物,其内容以引用方式并入本文。
[0487]
在实施例中,x3具有下式:
[0488][0489]r106
为c
1-c4烷基。r
107
为氢、卤素或者任选地由卤素或羟基取代的c
1-c4烷基。r
108
为卤素或任选地由卤素取代的苯基、c
1-c4烷基、c
1-c4烷氧基或氰基、—nr
109
—(ch2)
v5
—r
110
或—nr
109
—c(o)-(ch2)
v5
—r
110
。r
109
为氢或c
1-c4烷基。变量v5为0至4的整数。r
110
为任选地由卤素取代的苯基或任选地由卤素取代的吡啶基。
[0490]
l
15
为羰基接头、-(ch2)
n11
c(o)-或-(ch2)
n11
nh-,其中n11为0、1、2或3。在实施例中,l
15
为-(ch2)
n11
c(o)-,其中n11为1。在实施例中,l
15
为-(ch2)
n11
nh-,其中n11为0。
[0491]
在实施例中,r
107
为c
1-c4烷基,并且r
108
为卤素。
[0492]
在实施例中,r
106
和r
107
各自为甲基。
[0493]
在实施例中,r
108
为氯。
[0494]
在实施例中,x3为
[0495][0496]
在实施例中,x3为
[0497][0498]
靶向部分或配体可以为三唑并二氮杂衍生物,例如具有下式的衍生物:
[0499][0500]
每个r
107
独立地为氢、卤素或者任选地由卤素或羟基取代的c
1-c4烷基。变量n20为1、2或3。在实施例中,n20为1。
[0501]
每个r
108
独立地为卤素或任选地由卤素取代的苯基、未取代的c
1-c4烷基、未取代的c1-c4烷氧基、氰基、—nr
109
—(ch2)
v5
—r
110
或—nr
109
—c(o)-(ch2)
v5
—r
110
。r
109
为氢或未取代的c
1-c4烷基。变量v5为0至4的整数。r
110
为任选地由卤素取代的苯基或任选地由卤素取代的吡啶基。变量n19为1或2。在实施例中,n19为1。
[0502]r113
为氢、未取代的c
1-c4烷基、-o-r
113a
或
–
cf3,其中r
113a
为未取代的c
1-c4烷基。在实施例中,r
113
为甲基。
[0503]
l
15
为羰基接头、-(ch2)
n11
c(o)-或-(ch2)
n11
nh-,其中n11为0、1、2或3。在实施例中,l
15
为-(ch2)
n11
c(o)-,其中n11为1。在实施例中,l
15
为-(ch2)
n11
nh-,其中n11为0。
[0504]
三唑并苯并二氮杂衍生物包括化合物(例如n-(1-甲基-6-苯基-4h-[1,2,4]三唑并[4,3-a][1,4]苯并二氮杂-4-基)氨基甲酸苄酯(gw841819x))以及us5185331中公开的其他化合物;2-[(4s)-6-(4-氯苯基)-8-甲氧基-1-甲基-4h-[1,2,4]三唑并[4,3-a][1,4]苯并二氮杂-4-基]-n-乙基乙酰胺(molibresib)以及国际pct公开号wo2011054553、wo2011054844和wo2011054845中公开的其他化合物,其内容以引用方式并入本文。其他三唑并苯并二氮杂可以包括8-氯-1,4-二甲基-6-苯基-4h-[1,2,4]三唑并[4,3-a][1,3,4]苯并三氮杂,诸如us4163104中公开的那些化合物以及在国际pct公开号wo2011161031中公开的那些化合物,其内容以引用方式并入本文。
[0505]
在实施例中,x3选自:
[0506][0507]
靶向部分或配体可以为异噁唑并氮杂衍生物,例如具有下式的衍生物:
[0508]
其中
[0509]
环a为c
5-6
碳环、5元至6元杂环、c
5-6
芳基或5元至6元杂芳基。环a可以包括选自由以下项组成的组的环:噻吩并环、苯并环、呋喃环、硒酚环和吡啶基环。
[0510]
每个r
107
独立地为氢、卤素或者任选地由卤素或羟基取代的c
1-c4烷基。变量n20为1、2或3。在实施例中,n20为1。
[0511]
每个r
108
独立地为卤素或任选地由卤素取代的苯基、未取代的c
1-c4烷基、未取代的c
1-c4烷氧基、氰基、—nr
109
—(ch2)
v5
—r
110
或—nr
109
—c(o)-(ch2)
v5
—r
110
。r
109
为氢或未取代的c
1-c4烷基。变量v5为0至4的整数。r
110
为任选地由卤素取代的苯基或任选地由卤素取代的吡啶基。变量n19为1或2。在实施例中,n19为1。
[0512]r113
为氢、未取代的c
1-c4烷基、-o-r
113a
或
–
cf3,其中r
113a
为未取代的c
1-c4烷基。在实施例中,r
113
为甲基。
[0513]
l
15
为羰基接头、-(ch2)
n11
c(o)-或-(ch2)
n11
nh-,其中n11为0、1、2或3。在实施例中,l
15
为-(ch2)
n11
c(o)-,其中n11为1。在实施例中,l
15
为-(ch2)
n11
nh-,其中n11为0。
[0514]
靶向部分或配体可以为异噁唑并氮杂衍生物,例如具有下式的衍生物:
[0515][0516]
x4为s或
–
ch=ch-。在实施例中,x4为
–
ch=ch-。在实施例中,x4为s。
[0517]r106
为氢或未取代的c
1-c4烷基。在实施例中,r
106
为氢。在实施例中,r
106
为未取代的c
1-c4烷基。
[0518]r107
为氢、卤素或者任选地由卤素或羟基取代的c
1-c4烷基。
[0519]
每个r
108
独立地为卤素或任选地由卤素取代的苯基、未取代的c
1-c4烷基、未取代的c
1-c4烷氧基、氰基、—nr
109
—(ch2)
v5
—r
110
或—nr
109
—c(o)-(ch2)
v5
—r
110
。r
109
为氢或未取代
的c
1-c4烷基。变量v5为0至4的整数。r
110
为任选地由卤素取代的苯基或任选地由卤素取代的吡啶基。变量n19为1或2。在实施例中,n19为1。
[0520]r113
为氢、未取代的c
1-c4烷基、-o-r
113a
或
–
cf3,其中r
113a
为未取代的c
1-c4烷基。在实施例中,r
113
为甲基。
[0521]
l
15
为羰基接头、-(ch2)
n11
c(o)-或-(ch2)
n11
nh-,其中n11为0、1、2或3。在实施例中,l
15
为-(ch2)
n11
c(o)-,其中n11为1。在实施例中,l
15
为-(ch2)
n11
nh-,其中n11为0。
[0522]
在实施例中,x3具有下式:
[0523][0524]r106
为c
1-c4烷基。r
107
为氢、卤素或者任选地由卤素或羟基取代的c
1-c4烷基。r
108
为卤素或任选地由卤素取代的苯基、c
1-c4烷基、c
1-c4烷氧基或氰基、—nr
109
—(ch2)
v5
—r
110
或—nr
109
—c(o)-(ch2)
v5
—r
110
。r
109
为氢或c
1-c4烷基。变量v5为0至4的整数。r
110
为任选地由卤素取代的苯基或任选地由卤素取代的吡啶基。l
15
为羰基接头、-(ch2)
n11
c(o)-或-(ch2)
n11
nh-,其中n11为0、1、2或3。在实施例中,l
15
为-(ch2)
n11
c(o)-,其中n11为1。在实施例中,l
15
为-(ch2)
n11
nh-,其中n11为0。
[0525]
在实施例中,r
107
为c
1-c4烷基,并且r
108
为卤素。
[0526]
在实施例中,r
106
和r
107
各自为甲基。
[0527]
在实施例中,r
108
为氯。
[0528]
在实施例中,x3为噻吩并异噁唑并氮杂衍生物,例如(s)-2-(4-(4-氯苯基)-2,3,9-三甲基-6h-异噁唑并[5,4-c]噻吩并[2,3-e]氮杂-6-基)乙酰胺(cpi-3)及其衍生物,诸如gehling等人,discovery,design,and optimization of isoxazole azepine bet inhibitors,acs med.chem.lett.2013,4,835-840和m.c.hewitt等人,development of methyl isoxazoloazepines as inhibitors of bet,bioorg.med.chem.lett.25(2015)1842
–
1848中所公开的那些,其内容以引用方式并入本文。
[0529]
在实施例中,x3为
[0530][0531]
靶向部分或配体可以为苯并异噁唑并氮杂衍生物,例如具有下式的衍生物:
[0532][0533]
每个r
107
独立地为氢、卤素或者任选地由卤素或羟基取代的c
1-c4烷基。变量n20为1、2或3。在实施例中,n20为1。
[0534]
每个r
108
独立地为卤素或任选地由卤素取代的苯基、未取代的c
1-c4烷基、未取代的c
1-c4烷氧基、氰基、—nr
109
—(ch2)
v5
—r
110
或—nr
109
—c(o)-(ch2)
v5
—r
110
。r
109
为氢或未取代的c
1-c4烷基。变量v5为0至4的整数。r
110
为任选地由卤素取代的苯基或任选地由卤素取代的吡啶基。变量n19为1或2。在实施例中,n19为1。
[0535]r113
为氢、未取代的c
1-c4烷基、-o-r
113a
或
–
cf3,其中r
113a
为未取代的c
1-c4烷基。在实施例中,r
113
为甲基。
[0536]
l
15
为羰基接头、-(ch2)
n11
c(o)-或-(ch2)
n11
nh-,其中n11为0、1、2或3。在实施例中,l
15
为-(ch2)
n11
c(o)-,其中n11为1。在实施例中,l
15
为-(ch2)
n11
nh-,其中n11为0。
[0537]
苯并异噁唑并氮杂衍生物包括化合物,例如2-[(4s)-6-(4-氯苯基)-1-甲基-4h-[1,2]噁唑并[5,4-d][2]苯并氮杂-4-基]乙酰胺(cpi-0610),如albrecht等人,identi fication of a benzoisoxazoloazepine inhibitor(cpi-0610)of the bromodomain and extra-terminal(bet)family as a candidate for human clinical trials,j.med.chem.2016,59,1330-1339和国际pct公开号wo2012075383所述,其内容以引用方式并入本文。
[0538]
在实施例中,x3为
[0539][0540]
在实施例中,x3为4-乙酰氨基-3-氟-n-((1r,4s)-4-羟基环己基)-5-((s)-1-苯基乙氧基)苯甲酰胺(gsk046),其公开于gilan等人,science 368,387
–
394(2020),具有结构
[0541][0542]
在实施例中,x3选自国际pct公开号wo2017/037116中公开的化合物,其内容以引用方式并入本文,诸如1-苄基-n5-环丙基-n3-甲基-2-氧代-1,2-二氢吡啶-3,5-二甲酰胺(gsk-620)和1-苄基-n3,n5-二甲基-2-氧代-1,2-二氢吡啶-3,5-二甲酰胺,其分别具有以下结构:
[0543][0544]
在实施例中,x3为
ava、βme-ava、γme-ava和4pipac;并且
[0558]
x2为靶蛋白结合基序,其具有下式:
[0559]
其中
[0560]
x
2a
–
l
10-选自由以下项组成的组:d-dap、d-dap-nme、nme-d-dap、d-b2orn和d-pip,并且
[0561]
x3选自由以下项组成的组:(s)-2-(4-(4-氯苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f][1,2,4]三唑并[4,3-a][1,4]二氮杂-6-基)乙酸叔丁酯、(s)-2-(2,3,9-三甲基-4-苯基-6h-噻吩并[3,2-f][1,2,4]三唑并[4,3-a][1,4]二氮杂-6-基)乙酸叔丁酯、n-(1-甲基-6-苯基-4h-[1,2,4]三唑并[4,3-a][1,4]苯并二氮杂-4-基)氨基甲酸苄酯、2-[(4s)-6-(4-氯苯基)-8-甲氧基-1-甲基-4h-[1,2,4]三唑并[4,3-a][1,4]苯并二氮杂-4-基]-n-乙基乙酰胺、8-氯-1,4-二甲基-6-苯基-4h-[1,2,4]三唑并[4,3-a][1,3,4]苯并三氮杂、(s)-2-(4-(4-氯苯基)-2,3,9-三甲基-6h-异噁唑并[5,4-c]噻吩并[2,3-e]氮杂-6-基)乙酰胺、2-[(4s)-6-(4-氯苯基)-1-甲基-4h-[1,2]噁唑并[5,4-d][2]苯并氮杂-4-基]乙酰胺、4-乙酰氨基-3-氟-n-((1r,4s)-4-羟基环己基)-5-((s)-1-苯基乙氧基)苯甲酰胺、1-苄基-n5-环丙基-n3-甲基-2-氧代-1,2-二氢吡啶-3,5-二甲酰胺和1-苄基-n3,n5-二甲基-2-氧代-1,2-二氢吡啶-3,5-二甲酰胺。
[0562]
在又一方面,本文提供了具有下式的化合物:
[0563][0564]
其中
[0565]
x1为e3泛素连接酶结合基序,例如vhl结合基序,其具有式
–
x
1a-x
1b-x
1c
–
,其中
[0566]
x
1a
为
–
nh-ch(r
1a
)-c(o)
–
或
[0567][0568]
其中x
1a
胺连接到l
1c
,并且x
1a
羰基连接到x
1b
,并且
[0569]r1a
为氢、c
1-c6烷基、c
2-c8烯基、c
1-c6环烷基或c
1-c6硫醇。
[0570]
x
1b
为其中x
1b
氮连接到x
1a
羰基,并且x
1b
羰基连接到x
1c
的胺,并且r2和r
50
各自独立地为氢、羟基或卤素;并且
[0571]
x
1c
为其中胺连接到x
1b
,并且羰基连接到l
2c
;r
3a
为氢、c
1-c4烷基或其中
[0572]
l3为键或亚甲基;a1为c
5-c6芳基、5元至6元杂芳基或5元至6元杂环烷基,
[0573]
a1为c
5-c6芳基、5元至6元杂芳基或5元至6元杂环烷基,
[0574]
r9为氢、未取代的c
1-c4烷基、卤素、c
5-c6芳基、5元至6元杂芳基或5元至6元杂环烷基,其中芳基、杂芳基和杂环烷基任选地被选自由c
1-c4烷基和卤素组成的组的一个或多个取代基取代
[0575]r3b
为氢或c
1-c3烷基;并且
[0576]
n18为0或1;
[0577]
l
2c
选自由以下项组成的组:
[0578][0579]
其中l
2c
羰基连接到l
2b
,并且l
2c
胺连接到x
1c
;
[0580]
l
2a
和l
2b
在l
2c
与x2之间形成单键;
[0581]
l
1a
和l
1b
在l
1c
与x2之间形成单键;
[0582]
l
1c
选自
[0583][0584]
[0585]
其中l
1c
胺连接到l
1b
,并且l
1c
羰基连接到x
1a
;并且
[0586]
x2为靶蛋白结合基序,其具有下式:
[0587][0588]
其中x
2a
具有式其中x
2a
羰基连接到l
1a
,x
2a
胺连接到l
2a
,并且第三连接点连接到l
10
;
[0589]
l
12
和l
13
各自独立地为键,或者经取代或未取代的、饱和、不饱和或部分不饱和的c
1-c
10
烷基;并且
[0590]r12
为氢或未取代的c
1-c5烷基,或者r
12
任选地与l
10
接合以形成未取代的杂环烷基;并且
[0591]
x3为
[0592]
其中
[0593]
环a和环b各自独立地选自由以下项组成的组:三唑环、异噁唑并环、噻吩并环、苯并环、呋喃基环、硒代苯基环和吡啶基环;
[0594]
每个r
113
独立地为氢、未取代的c
1-c4烷基、-o-r
113a
或
–
cf3,其中r
113a
为未取代的c
1-c4烷基;
[0595]
n21为1、2或3;
[0596]
每个r
107
独立地为氢、卤素或者任选地由卤素或羟基取代的c
1-c4烷基;
[0597]
n20为1、2或3;
[0598]
每个r
108
独立地为卤素或任选地由卤素取代的苯基、未取代的c
1-c4烷基、未取代的c1-c4烷氧基、氰基、—nr
109
—(ch2)
v5
—r
110
或—nr
109
—c(o)-(ch2)
v5
—r
110
;并且
[0599]
n19为1或2。
[0600]
环状寡肽eulbm
[0601]
在一方面,本文提供了环状寡肽和大环eulbm。在此类实施例中,x2包含d-α氨基酸或d-δ氨基酸。在实施例中,x2具有式iib的结构
[0602][0603]
其中x
2a
为与l
1a
和l
2a
形成键的至少一个天然或非天然氨基酸,并且伯胺或仲胺经由任何合适的接头l
11
来连接到x
2a
,并且r
11
为氢、未取代的c
1-5
烷基,或者r
11
任选与x
2a
接合以形成未取代的杂环烷基。
[0604]
在此类实施例中,x2选自
[0605][0606]
在实施例中,氨基酸序列-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-连接到eulbm(例如vhl结合基序)以形成大环eulbm。特别地,l
1c
的羰基基团和l
2c
的氨基基团可以连接到eulbm,以形成大环eulbm。在实施例中,环状寡肽l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为
[0607]
[0608]
[0609]
[0610]
[0611]
其中l
1c
的羰基基团和l
2c
的氨基基团连接到eulbm。r
52a
和r
52b
各自独立地为氢、c
1-c4烷基、ch
2-苯基、-ch
2-联苯基、-ch
2-吡啶基、-ch
2-ch
2-c(o)-nh2或-(ch2)
n15-r
111
。变量n15为1至4的整数。r
111
为-nh2、n3或-c(o)-nh2。r
53
为氢、
–
c(o)nh2、-[ch2]
n16-nh2–
或
–
[c(o)nh-ch2]
n17-c(o)nh2–
。变量n16和n17中的每一者均独立地为1至3的整数。r
54
为氢或未取代的c
1-c6烷基。l
11
为键或者取代或未取代的亚烷基。r
11
为氢、未取代的c
1-5
烷基或保护基团。在实施例中,l
2a
和l
2b
在l
2c
与x2之间形成键;并且l
1a
和l
1b
在x2与l
1c
之间形成键,或者l
1a
、l
1b
和l
1c
在x2与x
1a
之间形成键。
[0612]
在实施例中,-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-选自由以下项组成的组:
[0613]
[0614]
[0615]
[0616]
[0617]
[0618][0619]
其中l
1c
的羰基基团和l
2c
的氨基基团连接到eulbm,并且r
52a
、r
52b
、r
53
、r
54
、l
11
和r
11
如本文所定义(包括实施例)。在实施例中,l
2a
和l
2b
在l
2c
与x2之间形成键;并且l
1a
和l
1b
在x2与l
1c
之间形成键,或者l
1a
、l
1b
和l
1c
在x2与x
1a
之间形成键。
[0620]
在实施例中,化合物选自由以下项组成的组:
[0621]
[0622]
[0623]
[0624]
[0625]
[0626]
[0627]
[0628]
[0629]
[0630]
[0631]
[0632][0632]
或其药用盐。
[0633]
在实施例中,化合物选自由以下项组成的组:
[0634]
[0635]
[0636]
[0637]
[0638]
[0639]
[0640]
[0641]
[0642][0642]
或其药用盐。
[0643]
在实施例中,将环状寡肽eulbm并入环状寡肽cide中。在实施例中,环状肽eulbm为环状寡肽cide的合成中的中间体。
[0644]
环状寡肽cide
[0645]
在实施例中,包含x2作为tpbm的氨基酸序列-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-连接到
eulbm以形成环状寡肽大环异双功能cide。特别地,l
1c
的羰基基团和l
2c
的氨基基团可以连接到eulbm。在实施例中,氨基酸序列l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为
[0646]
[0647]
[0648]
[0649][0649]
其中l
1c
或x2的羰基基团和l
2c
的氨基基团连接到eulbm。r
52a
和r
52b
独立地为氢、c
1-c4烷基、ch
2-苯基、-ch
2-联苯基、-ch
2-吡啶基、-ch
2-ch
2-c(o)-nh2或-(ch2)
n15-r
111
。变量n15为1至4的整数。r
111
为-nh2、n3或-c(o)-nh2。r
53
为氢、
–
c(o)nh2、-[ch2]
n16-nh2–
或
–
[c(o)nh-ch2]
n17-c(o)nh2–
。变量n16和n17中的每一者均独立地为1至3的整数。r
54
为氢或未取代的c
1-c6烷基。在实施例中,l
2a
和l
2b
在l
2c
与x2之间形成键;并且l
1a
和l
1b
在x2与l
1c
之间形成键,或者l
1a
、l
1b
和l
1c
在x2与x
1a
之间形成键。
[0650]
在实施例中,-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为
[0651]
[0652]
[0653]
[0654][0654]
其中l
1c
的羰基基团和l
2c
的氨基基团连接到eulbm,并且r
52a
、l
10
、x3、r
52b
、r
53
和r
54
如本文所定义(包括实施例)。
[0655]
在实施例中,-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中l
1c
的羰基基团和l
2c
的氨基基
团连接到eulbm,并且r
52a
、l
10
、x3、r
53
和r
54
如本文所定义(包括实施例)。
[0656]
在实施例中,-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中l
1c
的羰基基团和l
2c
的氨基基团连接到eulbm,并且r
52a
、l
10
、x3、r
53
和r
54
如本文所定义(包括实施例)。
[0657]
在实施例中,-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中l
1c
的羰基基团和l
2c
的氨基基团连接到eulbm,并且r
52a
、l
10
、x3和r
54
如本文所定义(包括实施例)。
[0658]
在实施例中,-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中l
1c
的羰基基团和l
2c
的氨基基团连接到eulbm,并且r
52a
、l
10
、x3、r
53
和r
54
如本文所定义(包括实施例)。
[0659]
在实施例中,-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中l
1c
的羰基基团和l
2c
的氨基基团连接到eulbm,并且r
52a
、l
10
、x3和r
54
如本文所定义(包括实施例)。
[0660]
在实施例中,-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为
其中l
1c
的羰基基团和l
2c
的氨基基团连接到eulbm,并且r
52a
、l
10
、x3和r
54
如本文所定义(包括实施例)。
[0661]
在实施例中,-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中l
1c
的羰基基团和l
2c
的氨基基团连接到eulbm,并且r
52a
、l
10
、x3和r
54
如本文所定义(包括实施例)。
[0662]
在实施例中,-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中x2的羰基基团和l
2c
的氨基基团连接到eulbm,并且r
52a
、l
10
和x3如本文所定义(包括实施例)。
[0663]
在实施例中,-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中x2的羰基基团和l
2c
的氨基基团连接到eulbm,并且r
52a
、l
10
和x3如本文所定义(包括实施例)。
[0664]
在实施例中,-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中x2的羰基基团和l
2c
的氨基基团连接到eulbm,并且r
52a
、l
10
和x3如本文所定义(包括实施例)。
[0665]
在实施例中,-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为
其中l
1c
的羰基基团和l
2c
的氨基基团连接到eulbm,并且r
52a
、l
10
、x3和r
54
如本文所定义(包括实施例)。
[0666]
在实施例中,-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中l
1c
的羰基基团和l
2c
的氨基基团连接到eulbm,并且r
52a
、l
10
、x3和r
54
如本文所定义(包括实施例)。
[0667]
在实施例中,-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中l
1c
的羰基基团和l
2c
的氨基基团连接到eulbm,并且r
52a
、l
10
和x3如本文所定义(包括实施例)。
[0668]
在实施例中,-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中l
1c
的羰基基团和l
2c
的氨基基团连接到eulbm,并且r
52a
、l
10
、x3、r
52b
、r
53
和r
54
如本文所定义(包括实施例)。
[0669]
在实施例中,-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中l
1c
的羰基基团和l
2c
的氨基基团连接到eulbm,并且r
52a
、l
10
、x3、r
53
和r
54
如本文所定义(包括实施例)。
[0670]
在实施例中,-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中l
1c
的羰基基团和l
2c
的氨基基团连接到eulbm,并且r
52a
、l
10
和x3如本文所定义(包括实施例)。
[0671]
在实施例中,-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中l
1c
的羰基基团和l
2c
的氨基基团连接到eulbm,并且r
52a
、l
10
和x3如本文所定义(包括实施例)。
[0672]
在实施例中,-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中l
1c
的羰基基团和l
2c
的氨基基团连接到eulbm,并且r
52a
、l
10
和x3如本文所定义(包括实施例)。
[0673]
在实施例中,-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中l
1c
的羰基基团和l
2c
的氨基基团连接到eulbm,并且r
52a
、l
10
和x3如本文所定义(包括实施例)。
[0674]
在实施例中,-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中l
1c
的羰基基团和l
2c
的
氨基基团连接到eulbm,并且r
52a
、l
10
和x3如本文所定义(包括实施例)。
[0675]
在实施例中,-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中l
1c
的羰基基团和l
2c
的氨基基团连接到eulbm,并且r
52a
、l
10
和x3如本文所定义(包括实施例)。
[0676]
在实施例中,-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中l
1c
的羰基基团和l
2c
的氨基基团连接到eulbm,并且r
52a
、l
10
和x3如本文所定义(包括实施例)。
[0677]
在实施例中,r
52a
为氢、甲基、-ch
2-苯基、-ch
2-联苯基、-ch
2-吡啶基、异丙基、-ch
2-ch
2-c(o)-nh2、-(ch2)
4-n3或-(ch2)
4-nh2。在实施例中,r
52a
为氢。在实施例中,r
52a
为甲基。在实施例中,r
52a
为-ch
2-苯基。在实施例中,r
52a
为-ch
2-联苯基。在实施例中,r
52a
为-ch
2-吡啶基。在实施例中,r
52a
为异丙基。在实施例中,r
52a
为-ch
2-ch
2-c(o)nh2。在实施例中,r
52a
为-(ch2)
4-n3。在实施例中,r
52a
为-(ch2)
4-nh2。在实施例中,r
52a
和r
52b
各自为氢。在实施例中,r
52a
为甲基。在实施例中,r
52a
为-(ch2)
n15-r
111
。
[0678]
在实施例中,r
52b
为氢或c
1-c4烷基。
[0679]
在实施例中,r
53
为氢、
–
c(o)nh2、-ch
2-ch
2-nh2和
–
c(o)nh-ch
2-c(o)nh-ch
2-c(o)nh-ch
2-c(o)nh2。在实施例中,r
53
为氢。在实施例中,r
53
为
–
c(o)nh2、-ch
2-ch
2-nh2。在实施例中,r
53
为
–
c(o)nh-ch
2-c(o)nh-ch
2-c(o)nh-ch
2-c(o)nh2。
[0680]
在实施例中,r
54
为氢或甲基。在实施例中,r
54
为氢。在实施例中,r
54
为甲基。
[0681]
在实施例中,r
53
为
–
c(o)nh2。
[0682]
在实施例中,n16为2。
[0683]
在实施例中,n17为2。
[0684]
在实施例中,在实施例中,l
2a
和l
2b
在l
2c
与x2之间形成单键,并且l
1a
和l
1b
在l
1c
与x2之间形成单键,这意味着在l
1c
与x2之间存在直接键并且在l
2c
与x2之间存在直接键,即,l
1a
和l
1b
和l
2a
和l
2b
不存在。
[0685]
在实施例中,
[0686]-x
1a-x
1b-为
[0687]
x
1c
选自由以下项组成的组:
[0688][0689]
l
2c
选自由以下项组成的组:
[0690]
[0691][0692]
l
2a
和l
2b
在l
2c
与x2之间形成单键;
[0693]
x2选自由以下项组成的组:
[0694][0695]
其中
[0696]
x3为
[0697]
l
1a
和l
1b
在x2与l
1c
之间形成单键;并且
[0698]
l
1c
选自由以下项组成的组:
[0699][0700][0701]
在实施例中,-x
1a-x
1b-选自由以下项组成的组:
[0702]
x
1c
选自由以下项组成的组:
[0703][0704][0705]
l
2c
选自由以下项组成的组:
[0706][0707]
l
2a
和l
2b
在l
2c
与x2之间形成单键;
[0708]
x2选自由以下项组成的组:
[0709][0710]
其中
[0711]
x3为
[0712][0713]
l
1a
和l
1b
在x2与l
1c
之间形成单键,其中l
1c
为或
[0714]
l
1a
、l
1b
和l
1c
在x2与x1之间形成单键。
[0715]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其
中l
13a
和l
13b
形成单键,并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为羟基,并且r
50
为氢;x
1c
为其中r
3a
为r
3b
为氢,并且n18为0;-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中r
52a
和r
54
各自独立地为氢或c
1-c4烷基;r
53
为
–
c(o)nh2或-[ch2]
n16-c(o)nh2–
,其中n16为1至3的整数;l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
为氢或未取代的c
1-c6烷基,r
112
为氢,并且n12为1;并且x3为
[0716][0717]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其中l
13a
和l
13b
形成单键,并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为
羟基,并且r
50
为氢;x
1c
为其中r
3a
为r
3b
为氢,并且n18为0;-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中r
52a
和r
54
独立地为氢或c
1-c4烷基;r
53
为
–
c(o)nh2或-[ch2]
n16-c(o)nh2–
,其中n16为1至3的整数;l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
和r
112
独立地为氢,并且n12为1;并且x3为
[0718]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其中l
13a
和l
13b
形成单键,并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为羟基,并且r
50
为氢;x
1c
为其中r
3a
为r
3b
为氢,并且n18为0;-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为
其中r
52a
、r
52b
和r
54
独立地为氢或c
1-c4烷基;r
53
为
–
c(o)nh2或-[ch2]
n16-c(o)nh2–
,其中n16为1至3的整数;l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
和r
112
独立地为氢,并且n12为1;并且x3为
[0719]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其中l
13a
和l
13b
形成单键,并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为羟基,并且r
50
为氢;x
1c
为其中r
3a
为r
3b
为氢,并且n18为0;-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中r
52a
、r
52b
和r
54
独立地为氢或c
1-c4烷基;r
53
为
–
c(o)nh2或-[ch2]
n16-c(o)nh2–
,其中n16为1至3的整数;l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
和r
112
独立地为氢,并且n12为1;并且x3为
[0720][0721]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其中l
13a
和l
13b
形成单键,并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为羟基,并且r
50
为氢;x
1c
为其中r
3a
为c
1-c4烷基,r
3b
为氢,并且n18为0;-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中r
52a
和r
54
独立地为氢或c
1-c4烷基;r
53
为
–
c(o)nh2或-[ch2]
n16-c(o)nh2–
,其中n16为1至3的整数;l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
和r
112
独立地为氢,并且n12为1;并且x3为
[0722]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其中l
13a
和l
13b
形成单键,并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为羟基,并且r
50
为氢;x
1c
为其中r
3a
为r
3b
为氢,并且n18为0或1;l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中r
52a
和r
54
独立地为氢或c
1-c4烷基;l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
和r
112
独立地为氢,并且n12为1;并且x3为
[0723]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其中l
13a
和l
13b
形成单键,并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为羟基,并且r
50
为氢;x
1c
为其中r
3a
为r
3b
为氢,并且n18为0;-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中r
52a
、r
53
和r
54
独立地为氢或c
1-c4烷基;l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
和r
112
独立地为氢,并且n12为1;并且x3为
[0724]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其
中l
13a
和l
13b
形成单键,并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为羟基,并且r
50
为氢;x
1c
为其中r
3a
为r
3b
为氢,并且n18为0;-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中r
52a
、r
53
和r
54
独立地为氢或c
1-c4烷基;l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
和r
112
独立地为氢,并且n12为1;并且x3为
[0725]
在实施例中,x1为l
2c
为l
2b
为键;
l
2a
为键;x2为x
2a
为l
10
为(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
和r
112
独立地为氢,并且n12为1;x3为l
1a
为键;l
1b
为键;并且l
1c
为
[0726]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其中l
13a
和l
13b
形成单键,并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为羟基,并且r
50
为氢;x
1c
为其中r
3a
为r
3b
为氢,并且n18为0;-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中r
52a
、r
53
和r
54
独立地为氢或c
1-c4烷基;l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
和r
112
独立地
为氢,并且n12为1;并且x3为
[0727]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其中l
13a
和l
13b
形成单键,并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为羟基,并且r
50
为氢;x
1c
为其中r
3a
为r
3b
为氢,并且n18为0;l
2c
为l
2a
和l
2b
在l
2c
与x2之间形成单键;x2为l
1a
和l
1b
在l
1c
与x2之间形成单键;l
1c
为并且x3为
[0728]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其中l
13a
和l
13b
形成单键,并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为羟基,并且r
50
为氢;x
1c
为其中r
3a
为r
3b
为氢,并且n18为0;l
2c
为l
2a
和l
2b
在l
2c
与x2之间形成单键;x2为x
2a
为l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
和r
112
独立地为氢,并且n12为1;l
1a
为键;l
1b
为l
1c
为并且x3为
[0729]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其
中l
13a
和l
13b
形成单键,并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为羟基,并且r
50
为氢;x
1c
为其中r
3a
和r
3b
各自为甲基,并且n18为0;-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为
[0730]
其中r
52a
和r
54
独立地为氢或c
1-c4烷基;r
53
为
–
c(o)nh2或-[ch2]
n16-c(o)nh2–
,其中n16为1至3的整数;l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
为氢或未取代的c
1-c6烷基,r
112
为氢,并且n12为1;并且x3为
[0731]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其中l
13a
和l
13b
形成单键,并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为
羟基,并且r
50
为氢;x
1c
为其中r
3a
为r
3b
为氢,并且n18为0;-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中r
52a
和r
54
独立地为氢或c
1-c4烷基;l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
为氢或未取代的c
1-c6烷基,r
112
为氢,并且n12为1;并且x3为
[0732][0733]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其中l
13a
和l
13b
形成单键,并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为羟基,并且r
50
为氢;x
1c
为其中r
3a
为r
3b
为氢,并且n18为0;-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中r
52a
为-ch
2-苯基、-ch
2-联苯基、-ch
2-吡啶基或-(ch2)
n15-r
111
,其中r
111
为
–
nh2或
–
n3,并且
n15为1至4的整数;r
53
和r
54
独立为氢或c
1-c4烷基;l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
和r
112
独立地为氢,并且n12为1;并且x3为
[0734]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其中l
13a
和l
13b
形成单键,并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为羟基,并且r
50
为氢;x
1c
为其中r
3a
为r
3b
为氢,并且n18为0;-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中r
52a
、r
53
和r
54
独立地为氢或c
1-c4烷基;l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
为氢或未取代的c
1-c6烷基,r
112
为氢,并且n12为1;并且x3为
[0735][0736]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其中r
15
和r
16
为氢,l
13a
为并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为羟基,并且r
50
为氢;x
1c
为其中r
3a
为r
3b
为氢,并且n18为0;l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中r
52a
为氢或c
1-c4烷基;l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
和r
112
独立地为氢,并且n12为1;并且x3为
[0737]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其中l
13a
和l
13b
形成单键,并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为羟基,并且r
50
为氢;x
1c
为其中r
3a
为r
3b
为氢,并且n18为0;-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中r
52a
和r
54
独立地为氢或c
1-c4烷基;l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
为氢或未取代的c
1-c6烷基,r
112
为氢,并且n12为1;并且x3为
[0738][0739]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其中l
13a
和l
13b
形成单键,并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为羟基,并且r
50
为氢;x
1c
为其中r
3a
为r
3b
为氢,并且n18为0;-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中r
52a
和r
54
独立地为氢或c
1-c4烷基;l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
为氢或未取代的c
1-c6烷基,r
112
为氢,并且n12为1;并且x3为
[0740][0741]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其中l
13a
和l
13b
形成单键,并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为羟基,并且r
50
为氢;x
1c
为其中r
3a
为r
3b
为氢,并且n18为0;-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中r
52a
和r
54
独立地为氢或c
1-c4烷基;l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
为氢或未取代的c
1-c6烷基,r
112
为氢,并且n12为1;并且x3为
[0742][0743]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其中l
13a
和l
13b
形成单键,并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为羟基,并且r
50
为氢;x
1c
为其中r
3a
为r
3b
为氢,并且n18为0;-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中r
52a
和r
54
独立地为氢或c
1-c4烷基;l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
为氢或未取代的c
1-c6烷基,r
112
为氢,并且n12为1;并且x3为
[0744][0745]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其中l
13a
和l
13b
形成单键,并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为羟基,并且r
50
为氢;x
1c
为其中r
3a
为r
3b
为氢,并且n18为0;-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中r
52a
、r
52b
、r
53
和r
54
独立地为氢或c
1-c4烷基;l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
和r
112
独立地为氢,并且n12为1;并且x3为
[0746]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其中l
13a
和l
13b
形成单键,并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为羟基,并且r
50
为氢;x
1c
为其中r
3a
为r
3b
为氢,并且n18为0;-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中r
52a
为-ch
2-ch
2-c(o)-nh2,r
53
和r
54
独立地为氢或c
1-c4烷基;l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
和r
112
独立地为氢,并且n12为1;并且x3为
[0747][0748]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其
中l
13a
和l
13b
形成单键,并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为羟基,并且r
50
为氢;x
1c
为其中r
3a
为r
3b
为氢,并且n18为0;-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中r
52a
、r
52b
、r
53
和r
54
独立地为氢或c
1-c4烷基;l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
和r
112
独立地为氢,并且n12为1;并且x3为
[0749]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其中l
13a
和l
13b
形成单键,并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为羟基,并且r
50
为氢;x
1c
为其中r
3a
为r
3b
为
氢,并且n18为0;l
2a
、l
2b
和l
2c
各自为键;x2为x
2a
为l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
和r
112
独立地为氢,并且n12为1;l
1a
和l
1b
各自为键;l
1c
为并且x3为
[0750]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其中l
13a
和l
13b
形成单键,并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为羟基,并且r
50
为氢;x
1c
为其中r
3a
为r
3b
为氢,并且n18为0或1;l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中r
52a
和r
54
独立地为氢或c
1-c4烷基;l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
和r
112
独立地为
氢,并且n12为1;并且x3为
[0751]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其中r
15
为氢,r
16
为氢或未取代的甲基,l
13a
为并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为羟基,并且r
50
为氢;x
1c
为其中r
3a
为r
3b
为氢,并且n18为0;-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-为其中r
52a
为氢或c
1-c4烷基;l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
为氢或未取代的甲基,r
112
为氢,并且n12为1;并且
x3为
[0752]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其中r
15
为氢,r
16
为氢或未取代的甲基,l
13a
为并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为羟基,并且r
50
为氢;x
1c
为其中r
3a
为r
3b
为氢,并且n18为0;l
2a
、l
2b
和l
2c
各自为键;x2为x
2a
为l
10
为
–
(ch(r
112
))
n12
–
[0753]
n(r
110
)
–
,其中r
110
和r
112
独立地为氢,并且n12为1;l
1a
、l
1b
和l
1c
各自为键;并且x3为
[0754]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其中r
15
为氢,r
16
为氢或未取代的甲基,l
13a
为并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为羟基,并且r
50
为氢;x
1c
为其中r
3a
为r
3b
为氢,并且n18为0;l
2a
、l
2b
和l
2c
各自为键;x2为x
2a
为l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
和r
112
独立地为氢,并且n12为1;l
1a
、l
1b
和l
1c
各自为键;并且x3为
[0755]
在实施例中,x1具有式
–
x
1a-x
1b-x
1c
–
,其中x
1a
为其中r
15
为氢,r
16
为氢或未取代的甲基,l
13a
为并且r
1a
和r
1b
独立地为氢或c
1-c6烷基;x
1b
为其中r2为羟基,并且r
50
为氢;x
1c
为其中r
3a
为r
3b
为氢,并且n18为0;l
2a
、l
2b
和l
2c
各自为键;x2为x
2a
为l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
和r
112
独立地为氢,并且n12为1;l
1a
和l
1b
各自为键;l
1c
为并且x3为
nhc(nh)nh-、-c(s)-、经取代或未取代的亚烷基、经取代或未取代的亚杂烷基、经取代或未取代的亚环烷基、经取代或未取代的亚杂环烷基、经取代或未取代的亚芳基以及经取代或未取代的亚杂芳基;
[0767]r15
选自氢、卤素、-cn、-c(o)nr
15ar15b
、取代或未取代的烷基、取代或未取代的杂烷基、取代或未取代的环烷基、取代或未取代的芳基和取代或未取代的杂芳基,其中r
15a
和r
15b
独立地选自氢和取代或未取代的烷基;
[0768]r16
为h或连接到l
13a
以形成5元或6元环的烷基;
[0769]
x
1b
为其中x
1b
氮连接到x
1a
羰基,并且x
1b
羰基连接到
[0770]
x
1c
胺,并且r2和r
50
各自独立地为氢、羟基或卤素;并且x
1c
为其中x
1c
胺连接到x
1b
羰基,并且x
1c
羰基连
[0771]
接到l
2c
胺;
[0772]r3a
为氢、c
1-c4烷基或其中
[0773]
l3为键或亚甲基,
[0774]
a1为c
5-c6芳基、5元至6元杂芳基或5元至6元杂环烷基,
[0775]
r9为由以下项组成的组:氢、未取代的c
1-c4烷基、卤素、c
5-c6芳基、5元至6元杂芳基和5元至6元杂环烷基,其中所述芳基、杂芳基和杂环烷基任选地被选自未取代的c
1-c4烷基和卤素的一个或多个取代基取代;并且
[0776]
n18为0或1;
[0777]
l
2c
选自由以下项组成的组:
[0778][0779]
其中l
2c
羰基连接到x
2a
胺,并且l
2c
胺连接到x
1c
羰基;
[0780]
l
2a
和l
2b
在l
2c
与x2之间形成单键;
[0781]
l
1a
和l
1b
在l
1c
与x2之间形成单键;
[0782]
l
1c
为键或甘氨酸;
[0783]
x2为靶蛋白结合基序,其具有下式:
[0784]
其中
[0785]
x
2a
具有式其中x
2a
羰基连接到l
1c
胺,x
2a
胺连接到l
2c
羰基,并且第三连接点连接到l
10
,并且其中
[0786]
l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
和r
112
各自独立地为氢或c
1-c6烷基,并且n12为0至6的整数;
[0787]
l
12
和l
13
各自独立地为键,或者经取代或未取代的、饱和、不饱和或部分不饱和的c
1-c
10
烷基;并且
[0788]r12
为氢或未取代的c
1-c5烷基,或者r
12
任选地与l
10
接合以形成未取代的杂环烷基;
并且
[0789]
x3具有下式:
[0790]
其中
[0791]
l
15
为键、-(ch2)
n11
c(o)-、-(ch2)
n11
nh-,其中n11为0、1、2或3;
[0792]
环a和环b各自独立地选自由以下项组成的组:三唑环、异噁唑并环、噻吩并环、苯并环、呋喃基环、硒代苯基环和吡啶基环;
[0793]
每个r
113
独立地为氢、未取代的c
1-c4烷基、-o-r
113a
或
–
cf3,其中r
113a
为未取代的c
1-c4烷基;并且n21为1、2或3;
[0794]
每个r
107
独立地为氢、卤素或者任选地由卤素或羟基取代的c
1-c4烷基;并且n20为1、2或3;并且
[0795]
每个r
108
独立地为卤素或任选地由卤素取代的苯基、未取代的c
1-c4烷基、未取代的c
1-c4烷氧基、氰基、-nr
109-(ch2)
v5-r
110
或-nr
109-c(o)-(ch2)
v5-r
110
;并且n19为1或2。
[0796]
在实施例中,化合物选自由以下项组成的组:
[0797]
[0798][0799]
在一方面,提供了包含环状寡肽的化合物,其中环状寡肽包含选自由以下项组成的组的氨基酸序列:seq id no.1至seq id no.68和seq id no.112至seq id no.120,如表1中所列出,其中序列中的第一个氨基酸的氨基基团与序列中的最后一个氨基酸的羰基基团形成肽键以形成环状寡肽。
[0800]
表1.氨基酸序列的列表。
[0801]
[0802]
[0803][0804]
在实施例中,所公开的化合物包含环状寡肽,其中环状寡肽包含选自由以下项组成的组的氨基酸序列:seq id no.1、seq id no.3至seq id no.8、seq id no.15至seq id no.21、seq id no.23、seq id no.24、seq id no.27、seq id no.31、seq id no.32、seq id no.36至seq id no.44、seq id no.46、seq id no.49至seq id no.59、seq id no.62至seq id no.63、seq id no.66至seq id no.68以及seq id no.112至seq id no.120。
[0805]
在一方面,提供了一种包含环状寡肽的化合物,该环状寡肽具有整合到环状多肽中的eulbm(例如vhl结合基序),其中环状寡肽包含选自由以下项组成的组的氨基酸序列:seq id no.69至seq id no.111,如表2中所列出,其中第一个氨基酸连接到eulbm的第一连接点,并且最后一个氨基酸连接到eulbm的第二连接点。在实施例中,eulbm的第一连接点和第二连接点为相同的连接点。在实施例中,该化合物包含环状寡肽,该环状寡肽具有整合到环状多肽中的eulbm,其中环状寡肽包含选自由以下项组成的组的氨基酸序列:seq id no.69-111中。
[0806]
表2.序列表
no.73、seq id no.78至seq id no.82、seq id no.84、seq id no.86、seq id no.89至seq id no.96、seq id no.98至seq id no.107和seq id no.110至seq id no.111。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽具有整合到环状多肽中的eulbm,其中环状寡肽包含选自由以下项组成的组的二肽:gly、d-dap;l-ala、d-dap;d-ala、d-dap;d-val、d-dap;gly、d-dap-nme;d-b2orn、o1pen;d-b2orn、gly。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽具有整合到环状多肽中的eulbm,其中环状寡肽包含单肽,例如d-b2orn。
[0809]
在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:1的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:2的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:3的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:4的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:5的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:6的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:7的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:8的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:9的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:10的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:11的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:12的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:13的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:14的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:15的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:16的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:17的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:18的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:19的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:20的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:21的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:22的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:23的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:24的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:25的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:26的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:27的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:28的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:29的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:30的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:31的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:32的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:33的氨基
酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:34的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:35的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:36的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:37的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:38的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:39的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:40的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:41的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:42的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:43的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:44的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:45的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:46的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:47的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:48的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:49的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:50的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:51的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:52的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:53的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:54的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:55的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:56的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:57的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:58的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:59的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:60的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:61的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:62的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:63的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:64的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:65的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:66的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:67的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:68的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:69的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:70的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:71的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:72的氨基
no:111的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:112的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:113的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:114的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:115的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:116的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:117的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:118的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:119的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含seq id no:120的氨基酸序列。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含二肽gly、d-dap。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含二肽d-ala、d-dap。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含二肽d-val、d-dap。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含二肽gly、d-dap-nme。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含二肽d-b2orn、gly。在实施例中,所公开的化合物包含环状寡肽,该环状寡肽包含肽d-b2orn。
[0810]
在实施例中,x
1a
选自由以下项组成的组:l-tle、l-val、l-ala、l-abu、l-pen、l-cha、l-cpa、l-cba、l-bme2烯丙基gly、l-adagly、l-bme-ile和l-thpgly。
[0811]
在实施例中,x
1b
选自由l-hyp组成的组
[0812]
在实施例中,x
1c
选自由以下项组成的组:d-mtpg、l-mtpg、l-bmtpg、d-bmtpg、d-biphe、l-biphe、d-mttphe、aib、l-bta、d-bta和d-ala。
[0813]
在实施例中,l
1a
、l
1b
、l
2a
和l
2b
各自为键。
[0814]
在实施例中,x
1a
选自由以下项组成的组:l-tle、l-val、l-ala、l-abu、l-pen、l-cha、l-cpa、l-cba、l-bme2烯丙基gly、l-adagly、l-bme-ile和l-thpgly;x
1b
选自由l-hyp组成的组;并且x
1c
选自由以下项组成的组:d-mtpg、l-mtpg、l-bmtpg、d-bmtpg、d-biphe、l-biphe、d-mttphe、aib、l-bta、d-bta和d-ala。
[0815]
在实施例中,l
1c
选自由以下项组成的组:gly、ava、ahx、ahp、aep、gaba、l-cys、d-hcys、d-cys(s-ac)、d-hcys(s-ac)、d-cys(3gly s-ac)、nme-d-cys(s-ac)、o1pen、nme-o1pen、s1pen,
[0816]
在实施例中,l
2c
选自由以下项组成的组:gly、bala、l-ala、d-ala、d-pyrala、d-val、d-phe、d-biphe、d-gln、d-lys和d-lys(n3)。
[0817]
在实施例中,x2选自由以下项组成的组:d-dap、d-dap-nme、d-blys、d-dap(peg3)、d-b2orn、l-二氨基乙酸和d-二氨基乙酸。
[0818]
在实施例中,l
1a
、l
1b
、l
2a
和l
2b
各自为键;l
1c
选自由以下项组成的组:gly、ava、ahx、ahp、aep、gaba、l-cys、d-hcys、d-cys(s-ac)、d-hcys(s-ac)、d-cys(3gly s-ac)、nme-d-cys(s-ac)、o1pen、nme-o1pen、s1pen;l
2c
选自由以下项组成的组:gly、bala、l-ala、d-ala、d-pyrala、d-val、d-phe、d-biphe、d-gln、d-lys和d-lys(n3);并且x2选自由以下项组成的组:d-dap、d-dap-nme、d-blys、d-dap(peg3)、d-b2orn、l-二氨基乙酸和d-二氨基乙酸。
[0819]
在实施例中,x
1a
选自由以下项组成的组:l-tle、l-val、l-ala、l-abu、l-pen、l-cha、l-cpa、l-cba、l-bme2烯丙基gly、l-adagly、l-bme-ile和l-thpgly;x
1b
选自由l-hyp组
成的组;并且x
1c
选自由以下项组成的组:d-mtpg、l-mtpg、l-bmtpg、d-bmtpg、d-biphe、l-biphe、d-mttphe、aib、l-bta、d-bta和d-ala;l
1a
、l
1b
、l
2a
和l
2b
各自为键;l
1c
选自由以下项组成的组:gly、ava、ahx、ahp、aep、gaba、l-cys、d-hcys、d-cys(s-ac)、d-hcys(s-ac)、d-cys(3gly s-ac)、nme-d-cys(s-ac)、o1pen、nme-o1pen、s1pen;l
2c
选自由以下项组成的组:gly、bala、l-ala、d-ala、d-pyrala、d-val、d-phe、d-biphe、d-gln、d-lys和d-lys(n3);并且x2选自由以下项组成的组:d-dap、d-dap-nme、d-blys、d-dap(peg3)、d-b2orn、l-二氨基乙酸和d-二氨基乙酸。
[0820]
在实施例中,x
1a
选自由以下项组成的组:l-tle、l-tle-tria、nme-l-tle-tria和l-tle-tria-cyp。
[0821]
在实施例中,x
1b
选自由l-hyp组成的组
[0822]
在实施例中,x
1c
选自由以下项组成的组:d-mtpg、l-mtpg、l-bmtpg、d-bmtpg、d-biphe、l-biphe、d-mttphe、aib、l-bta、d-bta和d-ala。在实施例中,l
1a
、l
1b
、l
2a
和l
2b
各自为键。
[0823]
在实施例中,x
1a
选自由以下项组成的组:l-tle、l-tle-tria、nme-l-tle-tria和l-tle-tria-cyp;x
1b
选自由l-hyp组成的组;并且x
1c
选自由以下项组成的组:d-mtpg、l-mtpg、l-bmtpg、d-bmtpg、d-biphe、l-biphe、d-mttphe、aib、l-bta、d-bta和d-ala。
[0824]
在实施例中,l
1c
为键或gly。
[0825]
在实施例中,l
2c
选自由以下项组成的组:gly、bala、l-ala、d-ala、d-pyrala、d-val、d-phe、d-biphe、d-gln、d-lys和d-lys(n3)。
[0826]
在实施例中,x2选自由以下项组成的组:d-dap、d-dap-nme、d-blys、d-dap(peg3)、d-b2orn、l-二氨基乙酸和d-二氨基乙酸。
[0827]
在实施例中,l
1a
、l
1b
、l
2a
和l
2b
各自为键;l
1c
为键或gly;并且x2选自由以下项组成的组:d-dap、d-dap-nme、d-blys、d-dap(peg3)、d-b2orn、l-二氨基乙酸和d-二氨基乙酸。
[0828]
在实施例中,x
1a
选自由以下项组成的组:l-tle、l-tle-tria、nme-l-tle-tria和l-tle-tria-cyp;x
1b
选自由l-hyp组成的组;并且x
1c
选自由以下项组成的组:d-mtpg、l-mtpg、l-bmtpg、d-bmtpg、d-biphe、l-biphe、d-mttphe、aib、l-bta、d-bta和d-ala;l
1a
、l
1b
、l
2a
和l
2b
各自为键;l
1c
为键或gly、ava、ahx、ahp、aep、gaba、l-cys、d-hcys、d-cys(s-ac)、d-hcys(s-ac)、d-cys(3gly s-ac)、nme-d-cys(s-ac)、o1pen、nme-o1pen、s1pen;l
2c
选自由以下项组成的组:gly、bala、l-ala、d-ala、d-pyrala、d-val、d-phe、d-biphe、d-gln、d-lys和d-lys(n3);并且x2选自由以下项组成的组:d-dap、d-dap-nme、d-blys、d-dap(peg3)、d-b2orn、l-二氨基乙酸和d-二氨基乙酸。
[0829]
在一方面,提供了选自由以下项组成的组的化合物:
[0830]
[0831]
[0832]
[0833]
[0834]
[0835]
[0836]
[0837]
[0838]
[0839]
[0840]
[0841][0842]
或其药用盐。
[0843]
在实施例中,化合物选自由以下项组成的组:
[0844]
[0845]
[0846]
[0847]
[0848]
[0849]
[0850]
[0851][0852]
或其药用盐。
[0853]
在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或
其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用
盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为
或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供
的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本
文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施
例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本
文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药
用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用
盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药
用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中本文提供的化合物为或其
药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其
药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为
或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为
或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药
用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药
用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其
药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为
或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药
用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施
例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例
中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例
中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提
供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合
物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为
或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化
合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。在实施例中,本文提供的化合物为或其药用盐。
[0854]
蛋白质复合物
[0855]
在一方面,提供了一种复合物,其包含与如本文所述的化合物或其药用盐非共价结合的vhl蛋白和靶蛋白,其中vhl蛋白与vhl结合基序结合,并且靶蛋白与靶蛋白结合基序结合。
[0856]
在实施例中,靶蛋白为brd4蛋白,并且靶蛋白结合基序为brd4结合基序。
[0857]
在实施例中,vhl结合基序接触选自his 110、ser 111、tyr 112和his115的vhl蛋白的至少一个氨基酸残基。
[0858]
在实施例中,brd4结合基序接触选自leu 92、cys 136、asn 140和ile 146的brd4蛋白的至少一个氨基酸残基。
[0859]
在一方面,提供了如本文所述的化合物(包括实施例),其用于治疗癌症。
[0860]
在一方面,提供了如本文所述的化合物(包括实施例),其用于治疗纤维化病症。
[0861]
iii.药物组合物
[0862]
在一方面,本文提供了一种药物组合物,其包含如本文所述的化合物或其药用盐,以及药用赋形剂(包括实施例)。
[0863]
在实施例中,药物组合物用于治疗癌症。
[0864]
在实施例中,药物组合物用于治疗纤维化,例如特发性肺纤维化(ipf)。
[0865]
iv.使用方法
[0866]
在一方面,本文提供了一种治疗癌症的方法,该方法包括向有此需要的受试者施用治疗有效量的如本文所述的化合物或其药用盐。
[0867]
在一方面,本文提供了一种治疗纤维化病症的方法,该方法包括向有此需要的受试者施用治疗有效量的如本文所述的化合物或其药用盐。
[0868]
在一方面,本文提供了一种治疗纤维化(例如特发性肺纤维化(ipf))的方法,该方法包括向有此需要的受试者施用治疗有效量的如本文所述的化合物或其药用盐。
[0869]
v.实施例
[0870]
实施例p1.一种大环化合物,其包含e3泛素连接酶结合基序(eulbm)和至少一个氨基酸。
[0871]
实施例p2.根据实施例p1所述的大环化合物,其中eulbm和三个或更多个氨基酸形成环状多肽。
[0872]
实施例p3.根据实施例p1所述的大环化合物,其中eulbm为vhl结合基序。
[0873]
实施例p4.根据实施例p1所述的大环化合物,其进一步包含靶蛋白结合基序(tpbm),该靶蛋白结合基序与所述大环化合物中的至少一个氨基酸缀合。
[0874]
实施例p5.一种具有下式的化合物:
[0875][0876]
其中
[0877]
x1为eulbm;
[0878]
x2为d-α氨基酸或d-δ氨基酸;
[0879]
l
2c
为d-α氨基酸或d-β氨基酸或键;
[0880]
l
2b
为键或氨基酸;
[0881]
l
2a
为键或氨基酸;并且
[0882]
l
1a
、l
1b
和l
1c
各自独立地为键或氨基酸。
[0883]
实施例p6.根据实施例p5所述的化合物,其中l
2b
为键。
[0884]
实施例p7.根据实施例p5至p6中任一项所述的化合物,其中l
2a
为键。
[0885]
实施例p8.根据实施例p5至p7中任一项所述的化合物,其中l
1a
为键。
[0886]
实施例p9.根据实施例p5至p8中任一项所述的化合物,其中l
1b
为键或l-α氨基酸。
[0887]
实施例p10.根据实施例p5至p9中任一项所述的化合物,其中l
1b
为l-gln或l-ala。
[0888]
实施例p11.根据实施例p5至p10中任一项所述的化合物,其中l
1c
为d-α氨基酸。
[0889]
实施例p12.根据实施例p5至p11中任一项所述的化合物,其中l
1c
选自由以下项组成的组:d-cys(s-ac)、gly、d-hcys(s-ac)、nme-d-cys(s-ac)、o1pen、nme-o1pen、gaba、ava、aep、ahx、ahp、s1pen、nme-ava、2-氨基mepheac、nme-ahx、δme-ava、αme-ava、βme-ava和4pipac。
[0890]
实施例p13.根据实施例p5至p12中任一项所述的化合物,其中x1为包含羟基脯氨酸的vhl结合基序。
[0891]
实施例p14.根据实施例p5至p13中任一项所述的化合物,其中x1具有式
–
x
1a-x
1b-x
1c
–
,其中
[0892]
x
1a
为连接到l
1c
的l-α氨基酸或l-β氨基酸;
[0893]
x
1b
为l-羟基脯氨酸或l-氟羟基脯氨酸;并且
[0894]
x
1c
为连接到l
2c
的d-α氨基酸或d-β氨基酸。
[0895]
实施例p15.根据实施例p14所述的化合物,其中x
1a
选自由以下项组成的组:l-tle、l-bme-ile、l-tle-tria、l-val、l-ala、l-pen、l-cha、l-cpa、l-cba、l-bme2烯丙基gly、l-adagly和l-thpgly。
[0896]
实施例p16.根据实施例p14所述的化合物,其中x
1c
选自由以下项组成的组:d-mtpg、d-biphe、d-ala、aib、d-bta、l-bta、d-bmtpg、l-bmtpg、d-mtphe、l-biphe、l-tyr(o-me)、d-bbiphe和d-phe(4i)。
[0897]
实施例p17.根据实施例p5至p16中任一项所述的化合物,其中l
2c
选自由以下项组成的组:gly、d-ala、l-ala、bala、d-pyrala、d-phe、d-biphe、d-val、d-gln、d-lys和d-lys(n3)。
[0898]
实施例p18.根据实施例p5至p17中任一项所述的化合物,其中x2为包含d-α氨基酸或d-δ氨基酸的tpbm。
[0899]
实施例p19.根据实施例p18所述的化合物,其中x2具有下式:
[0900]
其中
[0901]
x
2a
为与l
1a
和l
2a
形成键的至少一个天然或非天然氨基酸;
[0902]
l
10
为键、肽接头或非肽接头;并且
[0903]
x3为靶向部分。
[0904]
实施例p20.根据实施例p19所述的化合物,其中x
2a
具有下式:
[0905]
其中
[0906]
x
2a
羰基连接到l
1a
氨基,并且x
2a
胺连接到l
2a
羰基,并且第三连接点连接到l
10
;
[0907]
l
12
和l
13
各自独立地为键,或者经取代或未取代的、饱和、不饱和或部分不饱和的c
1-c
10
烷基;并且
[0908]r12
为氢或未取代的c
1-c5烷基。
[0909]
实施例p21.根据实施例p19至p20中任一项所述的化合物,其中l
10
为
–
(ch(r
112
))
n12
–
n(r
110
)
–
,其中r
110
和r
112
各自独立地为氢或c
1-c6烷基,并且n12为0至6的整数。
[0910]
实施例p22.根据实施例p19至p20中任一项所述的化合物,其中-x
2a
–
l
10-选自由以下项组成的组:d-dap、d-dap-nme、d-b2orn、d-dab、l-dap、d-pip、d-blys、d-dap(peg3)、(d/l)-二氨基乙酸、d-orn、l-orn和nme-d-dap。
[0911]
实施例p23.根据实施例p19至p22中任一项所述的化合物,其中x3为三唑并二氮杂或异噁唑氮杂。
[0912]
实施例p24.根据实施例p19至p23中任一项所述的化合物,其中x3选自由以下项组成的组:噻吩并三唑并二氮杂、苯并三唑并二氮杂、噻吩并异噁唑并氮杂和苯并异噁唑并氮杂。
[0913]
实施例p25.根据实施例p19至p24中任一项所述的化合物,其中x3选自由以下项组成的组:
[0914]
[0915][0916]
实施例p26.根据实施例p19所述的化合物,其中-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-选自由以下项组成的组:
[0917]
[0918]
[0919]
[0920][0921]
其中
[0922]r52a
和r
52b
独立地选自由以下项组成的组:氢、c
1-c4烷基、-ch
2-苯基、-ch
2-联苯基、-ch
2-吡啶基、-ch
2-ch
2-c(o)-nh2和-(ch2)
n15-r
111
,其中n15为1至4的整数,并且r
111
选自由以下项组成的组:-nh2、n3和-c(o)-nh2;
[0923]r53
选自由以下项组成的组:氢、
–
c(o)nh2、-[ch2]
n16-nh2–
和
–
[c(o)nh-ch2]
n17-c(o)nh2–
,其中n16和n17中的每一者独立地为1至3的整数;
[0924]r54
为氢或未取代的c
1-c6烷基;
[0925]
l
10
为键、肽接头或非肽接头;并且
[0926]
x3为靶向部分。
[0927]
实施例p27.根据实施例p1至p26中任一项所述的化合物,其中所述化合物选自由以下项组成的组:
[0928]
[0929]
[0930]
[0931]
[0932]
[0933]
[0934]
[0935]
或其药用盐。
[0936]
实施例p28.根据实施例p5至p17中任一项所述的化合物,其中x2具有下式:
[0937]
其中
[0938]
x
2a
为与l
1a
和l
2a
形成键的至少一个天然或非天然氨基酸;
[0939]
l
11
为键或者经取代或未取代的亚烷基;并且
[0940]r11
为氢或未取代的c
1-5
烷基。
[0941]
实施例p29.根据实施例p28所述的化合物,其中-l
2c-l
2b-l
2a-x
2-l
1a-l
1b-l
1c-选自由以下项组成的组:
[0942]
[0943]
[0944]
[0945][0946]
其中
[0947]
l
1c
的羰基基团和l
2c
的氨基基团连接到x1;
[0948]r52a
和r
52b
各自独立地选自由以下项组成的组:氢、c
1-c4烷基、-ch
2-苯基、-ch
2-联苯基、-ch
2-吡啶基、-ch
2-ch
2-c(o)-nh2和-(ch2)
n15-r
111
,其中n15为1至4的整数,并且r
111
为-nh2、n3或-c(o)-nh2;
[0949]r53
为氢、
–
c(o)nh2、-[ch2]
n16-nh2–
或
–
[c(o)nh-ch2]
n17-c(o)nh2–
,其中n16和n17各自独立地为1至3的整数;
[0950]r54
为氢或未取代的c
1-c6烷基;
[0951]
l
11
为键或者经取代或未取代的亚烷基;并且
[0952]r11
为氢、未取代的c
1-5
烷基或保护基团。
[0953]
实施例p30.根据实施例p27至p29中任一项所述的化合物,其中所述化合物选自由以下项组成的组:
[0954]
[0955]
[0956]
[0957]
[0958]
[0959]
[0960][0961]
[0962]
或其药用盐。
[0963]
实施例p31.一种具有下式的化合物:
[0964][0965]
其中
[0966]
x1为vhl结合基序,其具有下式:
[0967]
–
x
1a-x
1b-x
1c
–
,其中
[0968]
x
1a
选自由以下项组成的组:l-tle、l-bme-ile、l-tle-tria、l-val、l-ala、l-pen、l-cha、l-cpa、l-cba、l-bme2烯丙基gly、l-adagly和l-thpgly;
[0969]
x
1b
为l-hyp或f-l-hyp;并且
[0970]
x
1c
选自由以下项组成的组:d-mtpg、d-biphe、d-ala、aib、d-bta、d-mtphe和d-phe(4i);
[0971]
l
2c
选自由以下项组成的组:gly、d-ala、bala、d-pyrala、d-phe、d-biphe、d-val、d-gln、d-lys和d-lys(n3);
[0972]
l
2a
和l
2b
在l
2c
与x2之间形成单键;
[0973]
l
1a
和l
1b
在l
1c
与x2之间形成单键;
[0974]
l
1c
选自由以下项组成的组:d-cys(s-ac)、gly、d-hcys(s-ac)、nme-d-cys(s-ac)、o1pen、nme-o1pen、gaba、ava、aep、ahx、ahp、s1pen、nme-ava、2-氨基mepheac、nme-ahx、αme-ava、βme-ava、γme-ava和4pipac;并且
[0975]
x2为靶蛋白结合基序,其具有下式:
[0976]
其中
[0977]
x
2a
–
l
10-选自由以下项组成的组:d-dap、d-dap-nme、nme-d-dap、d-b2orn和d-pip,并且
[0978]
x3选自由以下项组成的组:(s)-2-(4-(4-氯苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f][1,2,4]三唑并[4,3-a][1,4]二氮杂-6-基)乙酸叔丁酯、(s)-2-(2,3,9-三甲基-4-苯基-6h-噻吩并[3,2-f][1,2,4]三唑并[4,3-a][1,4]二氮杂-6-基)乙酸叔丁酯、n-(1-甲基-6-苯基-4h-[1,2,4]三唑并[4,3-a][1,4]苯并二氮杂-4-基)氨基甲酸苄酯、2-[(4s)-6-(4-氯苯基)-8-甲氧基-1-甲基-4h-[1,2,4]三唑并[4,3-a][1,4]苯并二氮杂-4-基]-n-乙基乙酰胺、8-氯-1,4-二甲基-6-苯基-4h-[1,2,4]三唑并[4,3-a][1,3,4]苯并三氮杂、(s)-2-(4-(4-氯苯基)-2,3,9-三甲基-6h-异噁唑并[5,4-c]噻吩并[2,3-e]氮杂-6-基)乙酰胺、2-[(4s)-6-(4-氯苯基)-1-甲基-4h-[1,2]噁唑并[5,4-d][2]苯并氮杂-4-基]乙酰胺、4-乙酰氨基-3-氟-n-((1r,4s)-4-羟基环己基)-5-((s)-1-苯基乙氧基)苯甲酰胺、1-苄基-n5-环丙基-n3-甲基-2-氧代-1,2-二氢吡啶-3,5-二甲酰胺和1-苄基-n3,n5-二甲基-2-氧代-1,2-二氢吡啶-3,5-二甲酰胺。
[0979]
实施例p32.一种具有下式的化合物:
[0980][0981]
其中
[0982]
x1为vhl结合基序,其具有式
–
x
1a-x
1b-x
1c
–
,其中
[0983]
x
1a
为
–
nh-ch(r
1a
)-c(o)
–
或
[0984][0985]
其中x
1a
胺连接到l
1c
,并且x
1a
羰基连接到x
1b
胺,并且
[0986]r1a
为氢、c
1-c6烷基、c
2-c8烯基、c
1-c6环烷基或c
1-c6硫醇。
[0987]
x
1b
为其中x
1b
氮连接到x
1a
羰基,并且x
1b
羰基连接到x
1c
胺,并且r2和r
50
各自独立地为氢、羟基或卤素;并且
[0988]
x
1c
为其中x
1c
胺连接到x
1b
羰基,并且x
1c
羰基连接到l
2c
胺;
[0989]r3a
为氢、c
1-c4烷基或其中
[0990]
l3为键或亚甲基,
[0991]
a1为c
5-c6芳基、5元至6元杂芳基或5元至6元杂环烷基,
[0992]
r9为由以下项组成的组:氢、未取代的c
1-c4烷基、卤素、c
5-c6芳基、5元至6元杂芳基和5元至6元杂环烷基,其中所述芳基、杂芳基和杂环烷基任选地被选自未取代的c
1-c4烷基和卤素的一个或多个取代基取代;并且n18为0或1;
[0993]
l
2c
选自由以下项组成的组:
[0994][0995]
其中l
2c
羰基连接到l
2b
胺,并且l
2c
胺连接到x
1c
羰基;
[0996]
l
2a
和l
2b
在l
2c
与x2之间形成单键;
[0997]
l
1a
和l
1b
在l
1c
与x2之间形成单键;
[0998]
l
1c
选自由以下项组成的组:键、选自由以下项组成的组:键、
[0999][0999]
其中l
1c
胺连接到l
1b
羰基,并且l
1c
羰基连接到x
1a
胺;并且
[1000]
x2为靶蛋白结合基序,其具有下式:
[1001]
其中
[1002]
x
2a
具有式其中x
2a
羰基连接到l
1a
胺,x
2a
胺连接到l
2a
羰基,并且第三连接点连接到l
10
,并且其中
[1003]
l
12
和l
13
各自独立地为键,或者经取代或未取代的、饱和、不饱和或部分不饱和的c
1-c
10
烷基;并且
[1004]r12
为氢或未取代的c
1-c5烷基,或者r
12
任选地与l
10
接合以形成未取代的杂环烷基;并且
[1005]
x3具有下式:
[1006]
其中
[1007]
环a和环b各自独立地选自由以下项组成的组:三唑环、异噁唑并环、噻吩并环、苯并环、呋喃基环、硒代苯基环和吡啶基环;
[1008]
每个r
113
独立地为氢、未取代的c
1-c4烷基、-o-r
113a
或
–
cf3,其中r
113a
为未取代的c
1-c4烷基;并且n21为1、2或3;
[1009]
每个r
107
独立地为氢、卤素或者任选地由卤素或羟基取代的c
1-c4烷基;并且n20为1、2或3;并且
[1010]
每个r
108
独立地为卤素或任选地由卤素取代的苯基、未取代的c
1-c4烷基、未取代的c
1-c4烷氧基、氰基、-nr
109-(ch2)
v5-r
110
或-nr
109-c(o)-(ch2)
v5-r
110
;并且n19为1或2。
[1011]
实施例p33.一种化合物,其包含环状肽,该环状肽包含选自由以下项组成的组的序列:seq id no.1至seq id no.68,其中所述序列中第一个氨基酸的胺端与所述序列中最后一个氨基酸的羧基端共价键合。
[1012]
实施例p34.一种化合物,其包含环状寡肽,该环状寡肽具有整合到环状多肽中的eulbm,其中该环状寡肽包含:氨基酸序列,该氨基酸序列选自由以下项组成的组:seq id no.69-111中。
[1013]
实施例p35.根据实施例p34所述的化合物,其中氨基酸序列的第一个氨基酸连接到eulbm的第一连接点,并且氨基酸序列的最后一个氨基酸连接到eulbm的第二连接点。
[1014]
实施例p36.根据实施例p35所述的化合物,其中eulbm的第一连接点和第二连接点为相同的连接点。
[1015]
实施例p37.一种复合物,其包含与根据实施例p4、p18至p27、p31和p32所述的化合物或其药用盐非共价结合的vhl蛋白和靶蛋白,其中vhl蛋白与eulbm结合,并且靶蛋白与靶蛋白结合基序结合。
[1016]
实施例p38.根据实施例p37所述的复合物,其中靶蛋白为brd4蛋白,并且靶蛋白结合基序为brd4结合基序。
[1017]
实施例p39.根据实施例p4、p18至p27、p31和p32所述的化合物,其用于治疗癌症。
[1018]
实施例p40.根据实施例p4、p18至p27、p31和p32所述的化合物,其用于治疗纤维化病症。
[1019]
实施例p41.根据实施例p4、p18至p27、p31和p32所述的化合物用于治疗癌症的用途。
[1020]
实施例p42.根据实施例p4、p18至p27、p31和p32所述的化合物用于治疗纤维化病症的用途。
[1021]
实施例p43.一种药物组合物,其包含根据实施例p4、p18至p27、p31和p32所述的化合物或其药用盐,以及药用赋形剂。
[1022]
实施例p44.根据实施例p41所述的药物组合物,其用于治疗癌症。
[1023]
实施例p45.根据实施例p41所述的药物组合物,其用于治疗纤维化病症。
[1024]
实施例p46.一种治疗癌症的方法,该方法包括向有此需要的受试者施用治疗有效量的根据实施例p4、p18至p27、p31和p32中任一项所述的化合物或其药用盐。
[1025]
实施例p47.一种治疗纤维化病症的方法,该方法包括向有此需要的受试者施用治疗有效量的根据实施例p4、p18至p27、p31和p32中任一项所述的化合物或其药用盐。
[1026]
实施例p48.如本文所述的本发明。
[1027]
应当理解,本文描述的实例和实施例仅用于说明目的,并且其各种修改或改变将被建议给本领域技术人员,并且将被包括在本技术的精神和界限内以及所附权利要求的范围内。本文引用的所有出版物、专利和专利申请出于所有目的通过引用整体并入本文。
[1028]
实例
[1029]
所使用的缩写的定义:boc,叔丁氧基羰基
[1030]
boc-d-b2orn(fmoc)-oh,boc-d-β2-高鸟氨酸-fmoc-n-ε
[1031]
dcm,二氯甲烷
[1032]
dic,n,n'-二异丙基碳二亚胺
[1033]
dipea,二异丙基乙胺
[1034]
dmf,二甲基甲酰胺
[1035]
dmso,二甲基亚砜
[1036]
dtt,1,4-二硫苏糖醇
[1037]
fmoc,芴基甲氧基羰基
[1038]
fmoc-aeeea-oh,fmoc-11-氨基-3,6,9-三氧杂十一酸
[1039]
fmoc-aep-oh,fmoc-6-氨基-4-氧杂己酸
[1040]
fmoc-ahp-oh,fmoc-7-氨基庚酸
[1041]
fmoc-ahx-oh,fmoc-6-氨基己酸
[1042]
fmoc-aib-oh,fmoc-2-氨基异丁酸
[1043]
fmoc-α-氨基-d-gly(boc)-oh,(r)-2-(fmoc-氨基)-2-(boc-氨基)-乙酸
[1044]
fmoc-α-氨基-l-gly(boc)-oh,(s)-2-(fmoc-氨基)-2-(boc-氨基)-乙酸
[1045]
fmoc-ava-oh,fmoc-5-氨基戊酸
[1046]
fmoc-d-bta-oh,fmoc-d-2-(5-溴噻吩基)丙氨酸
[1047]
fmoc-d-bip-oh,fmoc-d-丙氨酸(4,4'-联苯基)-oh
[1048]
fmoc-d-bbip-oh,fmoc-d-β-高丙氨酸(4,4'-联苯基)-oh
[1049]
fmoc-d-bmtpg-oh,fmoc-4-甲基噻唑-d-β-苯基甘氨酸-oh
[1050]
fmoc-l-bmtpg-oh,fmoc-4-甲基噻唑-l-β-苯基甘氨酸-oh
[1051]
fmoc-d-dab(boc)-oh,fmoc-n-γ-boc-d-2,4-二氨基丁酸
[1052]
fmoc-d-dap(boc)-oh,fmoc-n-β-boc-d-2,3-二氨基丙酸
[1053]
fmoc-d-dap(bnmeboc)-oh,fmoc-n-βme-boc-d-2,3-二氨基丙酸
[1054]
fmoc-d-homocys(trt)-oh,fmoc-d-高半胱氨酸(三苯甲基)-oh
[1055]
fmoc-d-lys(n3)-oh,n-α-fmoc-ε-叠氮基-d-赖氨酸
[1056]
fmoc-d-mtphe-oh,fmoc-4-甲基噻唑-d-苯丙氨酸-oh
[1057]
fmoc-d-pip(boc)-oh,(r)-1-(fmoc)-4-(boc)哌嗪-2-甲酸
[1058]
fmoc-d-pyr-oh,fmoc-l-ala(4'-吡啶基)-oh
[1059]
fmoc-gaba-oh,fmoc-γ-氨基丁酸
[1060]
fmoc-l-bme-ile-oh,fmoc-l-β-甲基异亮氨酸
[1061]
fmoc-l-blys(boc)-oh,fmoc-l-β-homolys(boc)-oh
[1062]
fmoc-l-bta-oh,fmoc-l-2-(5-溴噻吩基)丙氨酸
[1063]
fmoc-l-cis-hyp(tbu)-oh,fmoc-o-叔丁基-l-顺式-羟基脯氨酸
[1064]
fmoc-l-hyp(tbu)-oh,fmoc-o-叔丁基-l-反式-羟基脯氨酸
[1065]
fmoc-l-tyr(ome)-oh,fmoc-o-甲基-l-酪氨酸
[1066]
fmoc-l-tle-oh,fmoc-l-α-叔丁基-甘氨酸-oh
[1067]
fmoc-l-tle-tria-cyp-oh,fmoc-氨基甲基-环丙基-三唑-l-叔丁基-甘氨酸-oh
[1068]
fmoc-l-tle-tria-oh,fmoc-2-氨基乙氧基甲基-三唑-l-叔丁基-甘氨酸-oh
[1069]
fmoc-mtpg-oh,fmoc-4-甲基噻唑-苯基甘氨酸-oh
[1070]
fmoc-nme-l-tle-tria-oh,fmoc-2-甲基氨基乙氧基甲基-三唑-l-叔丁基-甘氨酸-oh
[1071]
fmoc-nme-o1pen-oh,fmoc-5-甲基氨基-3-氧杂戊酸
[1072]
fmoc-o1pen-oh,fmoc-5-氨基-3-氧杂戊酸
[1073]
fmoc-s1pen-oh,fmoc-5-氨基-3-硫代戊酸
[1074]
hatu,o-(7-氮杂苯并三唑-1-基)-n,n,n,n-四甲基脲六氟磷酸盐
[1075]
hfip,六氟异丙醇
[1076]
hoat,1-羟基-7-氮杂苯并三唑
[1077]
hplc,高压液相色谱
[1078]
i-bet726,4-[(2s,4r)-1-乙酰基-4-[(4-氯苯基)氨基]-1,2,3,4-四氢-2-甲基-6-喹啉基]-苯甲酸
[1079]
jq1,(s)-2-(4-(4-氯苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f][1,2,4]三唑并[4,3-a][1,4]二氮杂-6-基)乙酸
[1080]
(-)-jq1,(r)-2-(4-(4-氯苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f][1,2,4]三唑并[4,3-a][1,4]二氮杂-6-基)乙酸
[1081]
l-abu,l-氨基丁酸
[1082]
oxyma,氰基羟基亚氨基乙酸乙酯
[1083]
pyaop,(7-氮杂苯并三唑-1-基氧基)三吡咯烷基鏻六氟磷酸盐
[1084]
tbu,叔丁基
[1085]
tea,三乙胺
[1086]
tfa,三氟乙酸
[1087]
tis,三异丙基硅烷
[1088]
氨基酸结构:
[1089]
[1090]
[1091]
[1092]
[1093]
[1094]
[1095]
[1096]
[1097]
[1098][1099]
化学合成
[1100]
一般合成方案
[1101][1102]
实例1化合物1和化合物2的合成。
[1103][1104]
步骤1.自动固相肽合成。将rink-酰胺树脂(0.25mmol)添加至肽合成仪反应容器中。树脂在liberty blue自动微波辅助肽合成仪(cem公司)上用dmf溶胀(10分钟)。排出溶剂并且使用以下方法以偶联第一个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从rink-酰胺树脂中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-cys(trt)-oh(4.0当量)、oxyma(4.0当量)和
dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-dap(boc)-oh、fmoc-甘氨酸、fmoc-d-mtpg-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1105]
步骤2.安装cl-乙酰基基团。将10%氯乙酸酐与10当量tea在dcm中的溶液混合并且添加至树脂。将混合物温育30min,并用3x dcm、3x dmf和3x dcm充分洗涤。
[1106]
步骤3.线性肽的切割和整体脱保护。通过在tfa中混合3%tis、2%水来制备切割/脱保护溶液。将溶液添加至树脂,并且反应1小时。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空中从所收集的溶液中移除溶剂。用50ml冷二乙醚(-20℃)来对游离和脱保护的肽进行沉淀。通过离心来收集经沉淀的肽。
[1107]
步骤4.溶液中环化和肽纯化。将经沉淀的粗料重新悬浮在300ml 20%乙腈在水中的溶液中,并且通过添加10mm碳酸氢铵来升高ph,以诱导环化。将环化反应温育4小时。环化完成后,通过冻干来移除溶剂。将粗环化材料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用15%至50%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1108]
步骤5.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物并且分离两种立体异构体(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物1:室温1.3min,ms(esi )预期质量(m h)
:1142.35da,测得质量:1142.4da,化合物2:室温1.37min,ms(esi )预期质量(m h)
:1142.35da,测得质量:1142.4da。
[1109]
实例2化合物3的合成
[1110]
步骤1.自动固相肽合成。将rink-酰胺树脂(0.25mmol)添加至肽合成仪反应容器中。树脂在liberty blue自动微波辅助肽合成仪(cem公司)上用dmf溶胀(10分钟)。排出溶剂并且使用以下方法以偶联第一个氨基酸:
[1111]
通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从rink-酰胺树脂中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-homocys(trt)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-dap(boc)-oh、fmoc-甘氨酸、fmoc-mtpg-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1112]
步骤2.安装cl-乙酰基基团。将10%氯乙酸酐与10当量tea在dcm中的溶液混合并且添加至树脂。将混合物温育30min,并用3x dcm、3x dmf和3x dcm充分洗涤。
[1113]
步骤3.线性肽的切割和整体脱保护。通过在tfa中混合3%tis、2%水来制备切割/脱保护溶液。将溶液添加至树脂,并且反应1小时。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空中从所收集的溶液中移除溶剂。用50ml冷二乙醚(-20℃)来对游离和脱保护的肽进行沉淀。通过离心来收集经沉淀的肽。
[1114]
步骤4.溶液中环化和肽纯化。将经沉淀的粗料重新悬浮在300ml 20%乙腈在水中的溶液中,并且通过添加10mm碳酸氢铵来升高ph,以诱导环化。将环化反应温育4小时。环化完成后,通过冻干来移除溶剂。将粗环化材料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用15%至50%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1115]
步骤5.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物3:室温1.32min,ms(esi )预期质量(m h)
:1156.37da,测得质量:1156.4da。
[1116]
实例3化合物4的合成
[1117]
步骤1.自动固相肽合成。将rink-酰胺树脂(0.25mmol)添加至肽合成仪反应容器中。树脂在liberty blue自动微波辅助肽合成仪(cem公司)上用dmf溶胀(10分钟)。排出溶剂并且使用以下方法以偶联第一个氨基酸:
[1118]
通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从rink-酰胺树脂中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-cys(trt)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-dap(boc)-oh、fmoc-β-丙氨酸、fmoc-mtpg-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1119]
步骤2.安装cl-乙酰基基团。将10%氯乙酸酐与10当量tea在dcm中的溶液混合并且添加至树脂。将混合物温育30min,并用3x dcm、3x dmf和3x dcm充分洗涤。
[1120]
步骤3.线性肽的切割和整体脱保护。通过在tfa中混合3%tis、2%水来制备切割/脱保护溶液。将溶液添加至树脂,并且反应1小时。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空中从所收集的溶液中移除溶剂。用50ml冷二乙醚(-20℃)来对游离和脱保护的肽进行沉淀。通过离心来收集经沉淀的肽。
[1121]
步骤4.溶液中环化和肽纯化。将经沉淀的粗料重新悬浮在300ml 20%乙腈在水中的溶液中,并且通过添加10mm碳酸氢铵来升高ph,以诱导环化。将环化反应温育4小时。环化完成后,通过冻干来移除溶剂。将粗环化材料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用15%至50%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1122]
步骤5.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合
物,其为白色粉末,hplc纯度》95%。化合物4:室温1.34min,ms(esi )预期质量(m h)
:1156.37da,测得质量:1156.4da。
[1123]
实例4化合物5的合成
[1124]
步骤1.自动固相肽合成。将rink-酰胺树脂(0.25mmol)添加至肽合成仪反应容器中。树脂在liberty blue自动微波辅助肽合成仪(cem公司)上用dmf溶胀(10分钟)。排出溶剂并且使用以下方法以偶联第一个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从rink-酰胺树脂中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-homocys(trt)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-dap(boc)-oh、fmoc-β-丙氨酸、fmoc-mtpg-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1125]
步骤2.安装cl-乙酰基基团。将10%氯乙酸酐与10当量tea在dcm中的溶液混合并且添加至树脂。将混合物温育30min,并用3x dcm、3x dmf和3x dcm充分洗涤。
[1126]
步骤3.线性肽的切割和整体脱保护。通过在tfa中混合3%tis、2%水来制备切割/脱保护溶液。将溶液添加至树脂,并且反应1小时。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空中从所收集的溶液中移除溶剂。用50ml冷二乙醚(-20℃)来对游离和脱保护的肽进行沉淀。通过离心来收集经沉淀的肽。
[1127]
步骤4.溶液中环化和肽纯化。将经沉淀的粗料重新悬浮在300ml 20%乙腈在水中的溶液中,并且通过添加10mm碳酸氢铵来升高ph,以诱导环化。将环化反应温育4小时。环化完成后,通过冻干来移除溶剂。将粗环化材料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用15%至50%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1128]
步骤5.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化
最终产物并且分离主要立体异构体(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物5:室温1.35min,ms(esi )预期质量(m h)
:1170.39da,测得质量:1170.4da。
[1129]
实例5化合物8的合成
[1130]
步骤1.自动固相肽合成。
[1131]
将rink-酰胺树脂(0.25mmol)添加至肽合成仪反应容器中。树脂在liberty blue自动微波辅助肽合成仪(cem公司)上用dmf溶胀(10分钟)。排出溶剂并且使用以下方法以偶联第一个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从rink-酰胺树脂中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-cys(trt)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-dap(boc)-oh、fmoc-甘氨酸、fmoc-d-丙氨酸-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1132]
步骤2.安装cl-乙酰基基团。将10%氯乙酸酐与10当量tea在dcm中的溶液混合并且添加至树脂。将混合物温育30min,并用3x dcm、3xdmf和3x dcm充分洗涤。
[1133]
步骤3.线性肽的切割和整体脱保护。通过在tfa中混合3%tis、2%水来制备切割/脱保护溶液。将溶液添加至树脂,并且反应1小时。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空中从所收集的溶液中移除溶剂。用50ml冷二乙醚(-20℃)来对游离和脱保护的肽进行沉淀。通过离心来收集经沉淀的肽。
[1134]
步骤4.溶液中环化和肽纯化。将经沉淀的粗料重新悬浮在300ml 20%乙腈在水中的溶液中,并且通过添加10mm碳酸氢铵来升高ph,以诱导环化。将环化反应温育4小时。环化完成后,通过冻干来移除溶剂。将粗环化材料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用15%至50%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进
行冷冻干燥。
[1135]
步骤5.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物8:室温1.21min,ms(esi )预期质量(m h)
:983.34da,测得质量:983.3da,由晶体学确认的结构。
[1136]
实例6化合物9和化合物10的合成
[1137][1138]
步骤1.自动固相肽合成。将rink-酰胺树脂(0.25mmol)添加至肽合成仪反应容器中。树脂在liberty blue自动微波辅助肽合成仪(cem公司)上用dmf溶胀(10分钟)。排出溶剂并且使用以下方法以偶联第一个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从rink-酰胺树脂中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-cys(trt)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-dab(boc)-oh、fmoc-甘氨酸、fmoc-mtpg-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团
脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1139]
步骤2.安装cl-乙酰基基团。将10%氯乙酸酐与10当量tea在dcm中的溶液混合并且添加至树脂。将混合物温育30min,并用3x dcm、3x dmf和3x dcm充分洗涤。
[1140]
步骤3.线性肽的切割和整体脱保护。通过在tfa中混合3%tis、2%水来制备切割/脱保护溶液。将溶液添加至树脂,并且反应1小时。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空中从所收集的溶液中移除溶剂。用50ml冷二乙醚(-20℃)来对游离和脱保护的肽进行沉淀。通过离心来收集经沉淀的肽。
[1141]
步骤4.溶液中环化和肽纯化。将经沉淀的粗料重新悬浮在300ml 20%乙腈在水中的溶液中,并且通过添加10mm碳酸氢铵来升高ph,以诱导环化。将环化反应温育4小时。环化完成后,通过冻干来移除溶剂。将粗环化材料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用15%至50%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1142]
步骤5.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物并且分离两种立体异构体(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物9:室温1.34min,ms(esi )预期质量(m h)
:1156.37da,测得质量:1156.4da,化合物10:室温1.39min,ms(esi )预期质量(m h)
:1156.37da,测得质量:1156.4da。
[1143]
实例7化合物11的合成
[1144]
步骤1.自动固相肽合成。将rink-酰胺树脂(0.25mmol)添加至肽合成仪反应容器中。树脂在liberty blue自动微波辅助肽合成仪(cem公司)上用dmf溶胀(10分钟)。排出溶剂并且使用以下方法以偶联第一个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从rink-酰胺树脂中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-甘氨酸-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次
重复该脱保护、洗涤和偶联序列:fmoc-甘氨酸-oh、fmoc-甘氨酸-oh、fmoc-cys(trt)-oh、fmoc-d-dap(boc)-oh、fmoc-甘氨酸、fmoc-mtpg-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1145]
步骤2.安装cl-乙酰基基团。将10%氯乙酸酐与10当量tea在dcm中的溶液混合并且添加至树脂。将混合物温育30min,并用3x dcm、3x dmf和3x dcm充分洗涤。
[1146]
步骤3.线性肽的切割和整体脱保护。通过在tfa中混合3%tis、2%水来制备切割/脱保护溶液。将溶液添加至树脂,并且反应1小时。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空中从所收集的溶液中移除溶剂。用50ml冷二乙醚(-20℃)来对游离和脱保护的肽进行沉淀。通过离心来收集经沉淀的肽。
[1147]
步骤4.溶液中环化和肽纯化。将经沉淀的粗料重新悬浮在300ml 20%乙腈在水中的溶液中,并且通过添加10mm碳酸氢铵来升高ph,以诱导环化。将环化反应温育4小时。环化完成后,通过冻干来移除溶剂。将粗环化材料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用15%至50%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1148]
步骤5.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物11:室温1.19min,ms(esi )预期质量(m h)
:1313.42da,测得质量:1313.4da。
[1149]
实例8化合物12的合成
[1150]
步骤1.自动固相肽合成。将rink-酰胺树脂(0.25mmol)添加至肽合成仪反应容器中。树脂在liberty blue自动微波辅助肽合成仪(cem公司)上用dmf溶胀(10分钟)。排出溶剂并且使用以下方法以偶联第一个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从rink-酰胺树脂中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-cys(trt)-oh(4.0当量)、oxyma(4.0当量)和
dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-dap(boc)-oh、fmoc-l-丙氨酸、fmoc-mtpg-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1151]
步骤2.安装cl-乙酰基基团。将10%氯乙酸酐与10当量tea在dcm中的溶液混合并且添加至树脂。将混合物温育30min,并用3x dcm、3x dmf和3x dcm充分洗涤。
[1152]
步骤3.线性肽的切割和整体脱保护。通过在tfa中混合3%tis、2%水来制备切割/脱保护溶液。将溶液添加至树脂,并且反应1小时。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空中从所收集的溶液中移除溶剂。用50ml冷二乙醚(-20℃)来对游离和脱保护的肽进行沉淀。通过离心来收集经沉淀的肽。
[1153]
步骤4.溶液中环化和肽纯化。将经沉淀的粗料重新悬浮在300ml 20%乙腈在水中的溶液中,并且通过添加10mm碳酸氢铵来升高ph,以诱导环化。将环化反应温育4小时。环化完成后,通过冻干来移除溶剂。将粗环化材料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用15%至50%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1154]
步骤5.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物12:室温1.28分钟,ms(esi )预期质量(m h)
:1156.37da,测得质量:1156.4da。
[1155]
实例9化合物13和化合物14的合成
[1156][1157]
步骤1.自动固相肽合成。将rink-酰胺树脂(0.25mmol)添加至肽合成仪反应容器中。树脂在liberty blue自动微波辅助肽合成仪(cem公司)上用dmf溶胀(10分钟)。排出溶剂并且使用以下方法以偶联第一个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中
的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从rink-酰胺树脂中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-cys(trt)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-l-dap(boc)-oh、fmoc-甘氨酸、fmoc-mtpg-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1158]
步骤2.安装cl-乙酰基基团。将10%氯乙酸酐与10当量tea在dcm中的溶液混合并且添加至树脂。将混合物温育30min,并用3x dcm、3xdmf和3x dcm充分洗涤。
[1159]
步骤3.线性肽的切割和整体脱保护。通过在tfa中混合3%tis、2%水来制备切割/脱保护溶液。将溶液添加至树脂,并且反应1小时。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空中从所收集的溶液中移除溶剂。用50ml冷二乙醚(-20℃)来对游离和脱保护的肽进行沉淀。通过离心来收集经沉淀的肽。
[1160]
步骤4.溶液中环化和肽纯化。将经沉淀的粗料重新悬浮在300ml 20%乙腈在水中的溶液中,并且通过添加10mm碳酸氢铵来升高ph,以诱导环化。将环化反应温育4小时。环化完成后,通过冻干来移除溶剂将粗环化材料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用15%至50%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1161]
步骤5.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物并且分离两种立体异构体(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物13:室温1.31min,ms(esi )预期质量(m h)
:1142.36da,测得质量:1142.4da,化合物14:室温1.36min,ms(esi )预期质量(m h)
:1142.36da,测得质量:1142.4da。
[1162]
实例10化合物15的合成
[1163]
步骤1.自动固相肽合成。将rink-酰胺树脂(0.25mmol)添加至肽合成仪反应容器中。树脂在liberty blue自动微波辅助肽合成仪(cem公司)上用dmf溶胀(10分钟)。排出溶剂并且使用以下方法以偶联第一个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从rink-酰胺树脂中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-nmecys(trt)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-dap(boc)-oh、fmoc-甘氨酸、fmoc-mtpg-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1164]
步骤2.安装cl-乙酰基基团。将10%氯乙酸酐与10当量tea在dcm中的溶液混合并且添加至树脂。将混合物温育30min,并用3x dcm、3xdmf和3x dcm充分洗涤。
[1165]
步骤3.线性肽的切割和整体脱保护。通过在tfa中混合3%tis、2%水来制备切割/脱保护溶液。将溶液添加至树脂,并且反应1小时。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空中从所收集的溶液中移除溶剂。用50ml冷二乙醚(-20℃)来对游离和脱保护的肽进行沉淀。通过离心来收集经沉淀的肽。
[1166]
步骤4.溶液中环化和肽纯化。将经沉淀的粗料重新悬浮在300ml 20%乙腈在水中的溶液中,并且通过添加10mm碳酸氢铵来升高ph,以诱导环化。将环化反应温育4小时。环化完成后,通过冻干来移除溶剂将粗环化材料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用15%至50%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1167]
步骤5.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物15:室温1.32min,ms(esi )预期质量(m h)
:1156.37da,测得质量:1156.4da。
[1168]
实例11化合物18的合成
[1169]
步骤1.自动固相肽合成。将rink-酰胺树脂(0.25mmol)添加至肽合成仪反应容器中。树脂在liberty blue自动微波辅助肽合成仪(cem公司)上用dmf溶胀(10分钟)。排出溶剂并且使用以下方法以偶联第一个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从rink-酰胺树脂中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-cys(trt)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-dap(boc)-oh、fmoc-甘氨酸、fmoc-d-biphe-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1170]
步骤2.安装cl-乙酰基基团。将10%氯乙酸酐与10当量tea在dcm中的溶液混合并且添加至树脂。将混合物温育30min,并用3x dcm、3xdmf和3x dcm充分洗涤。
[1171]
步骤3.线性肽的切割和整体脱保护。通过在tfa中混合3%tis、2%水来制备切割/脱保护溶液。将溶液添加至树脂,并且反应1小时。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空中从所收集的溶液中移除溶剂。用50ml冷二乙醚(-20℃)来对游离和脱保护的肽进行沉淀。通过离心来收集经沉淀的肽。
[1172]
步骤4.溶液中环化和肽纯化。将经沉淀的粗料重新悬浮在300ml 20%乙腈在水中的溶液中,并且通过添加10mm碳酸氢铵来升高ph,以诱导环化。将环化反应温育4小时。环化完成后,通过冻干来移除溶剂。将粗环化材料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用15%至50%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1173]
步骤5.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合
物,其为白色粉末,hplc纯度》95%。化合物18:室温1.54min,ms(esi )预期质量(m h)
:1135.40da,测得质量:1135.4da。
[1174]
实例12化合物19的合成
[1175]
步骤1.自动固相肽合成。将rink-酰胺树脂(0.25mmol)添加至肽合成仪反应容器中。树脂在liberty blue自动微波辅助肽合成仪(cem公司)上用dmf溶胀(10分钟)。排出溶剂并且使用以下方法以偶联第一个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从rink-酰胺树脂中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-cys(trt)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-dap(boc)-oh、fmoc-甘氨酸、fmoc-l-biphe-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1176]
步骤2.安装cl-乙酰基基团。将10%氯乙酸酐与10当量tea在dcm中的溶液混合并且添加至树脂。将混合物温育30min,并用3x dcm、3xdmf和3x dcm充分洗涤。
[1177]
步骤3.线性肽的切割和整体脱保护。通过在tfa中混合3%tis、2%水来制备切割/脱保护溶液。将溶液添加至树脂,并且反应1小时。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空中从所收集的溶液中移除溶剂。用50ml冷二乙醚(-20℃)来对游离和脱保护的肽进行沉淀。通过离心来收集经沉淀的肽。
[1178]
步骤4.溶液中环化和肽纯化。将经沉淀的粗料重新悬浮在300ml 20%乙腈在水中的溶液中,并且通过添加10mm碳酸氢铵来升高ph,以诱导环化。将环化反应温育4小时。环化完成后,通过冻干来移除溶剂。将粗环化材料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用15%至50%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1179]
步骤5.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化
最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物19:室温1.56min,ms(esi )预期质量(m h)
:1135.40da,测得质量:1135.4da。
[1180]
实例13化合物20的合成
[1181]
步骤1.自动固相肽合成。将rink-酰胺树脂(0.25mmol)添加至肽合成仪反应容器中。树脂在liberty blue自动微波辅助肽合成仪(cem公司)上用dmf溶胀(10分钟)。排出溶剂并且使用以下方法以偶联第一个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从rink-酰胺树脂中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-cys(trt)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-dap(boc)-oh、fmoc-甘氨酸、fmoc-l-bta-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1182]
步骤2.安装cl-乙酰基基团。将10%氯乙酸酐与10当量tea在dcm中的溶液混合并且添加至树脂。将混合物温育30min,并用3x dcm、3x dmf和3x dcm充分洗涤。
[1183]
步骤3.线性肽的切割和整体脱保护。通过在tfa中混合3%tis、2%水来制备切割/脱保护溶液。将溶液添加至树脂,并且反应1小时。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空中从所收集的溶液中移除溶剂。用50ml冷二乙醚(-20℃)来对游离和脱保护的肽进行沉淀。通过离心来收集经沉淀的肽。
[1184]
步骤4.溶液中环化和肽纯化。将经沉淀的粗料重新悬浮在300ml 20%乙腈在水中的溶液中,并且通过添加10mm碳酸氢铵来升高ph,以诱导环化。将环化反应温育4小时。环化完成后,通过冻干来移除溶剂。将粗环化材料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用15%至50%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1185]
步骤5.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物20:室温1.58min,ms(esi )预期质量(m h)
:1143.24da,测得质量:1143.2da。
[1186]
实例14化合物21的合成
[1187]
步骤1.自动固相肽合成。将rink-酰胺树脂(0.25mmol)添加至肽合成仪反应容器中。树脂在liberty blue自动微波辅助肽合成仪(cem公司)上用dmf溶胀(10分钟)。排出溶剂并且使用以下方法以偶联第一个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从rink-酰胺树脂中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-cys(trt)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-dap(boc)-oh、fmoc-甘氨酸、fmoc-mtpg-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1188]
步骤2.安装cl-乙酰基基团。将10%氯乙酸酐与10当量tea在dcm中的溶液混合并且添加至树脂。将混合物温育30min,并用3x dcm、3x dmf和3x dcm充分洗涤。
[1189]
步骤3.线性肽的切割和整体脱保护。通过在tfa中混合3%tis、2%水来制备切割/脱保护溶液。将溶液添加至树脂,并且反应1小时。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空中从所收集的溶液中移除溶剂。用50ml冷二乙醚(-20℃)来对游离和脱保护的肽进行沉淀。通过离心来收集经沉淀的肽。
[1190]
步骤4.溶液中环化和肽纯化。将经沉淀的粗料重新悬浮在300ml 20%乙腈在水中的溶液中,并且通过添加10mm碳酸氢铵来升高ph,以诱导环化。将环化反应温育4小时。环化完成后,通过冻干来移除溶剂。将粗环化材料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用15%至50%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1191]
步骤5.i-bet726偶联。制备i-bet726甲酸(0.95当量,相对于环化肽)、hatu(2.0当
量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将i-bet726反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物21:室温1.16min,ms(esi )预期质量(m h)
:1176.42da,测得质量:1176.4da。
[1192]
实例15化合物22的合成
[1193]
步骤1.自动固相肽合成。将rink-酰胺树脂(0.25mmol)添加至肽合成仪反应容器中。树脂在liberty blue自动微波辅助肽合成仪(cem公司)上用dmf溶胀(10分钟)。排出溶剂并且使用以下方法以偶联第一个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从rink-酰胺树脂中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-cys(trt)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-dap(boc)-oh、fmoc-甘氨酸、fmoc-mtpg-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1194]
步骤2.安装cl-乙酰基基团。将10%氯乙酸酐与10当量tea在dcm中的溶液混合并且添加至树脂。将混合物温育30min,并用3x dcm、3x dmf和3x dcm充分洗涤。
[1195]
步骤3.线性肽的切割和整体脱保护。通过在tfa中混合3%tis、2%水来制备切割/脱保护溶液。将溶液添加至树脂,并且反应1小时。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空中从所收集的溶液中移除溶剂。用50ml冷二乙醚(-20℃)来对游离和脱保护的肽进行沉淀。通过离心来收集经沉淀的肽。
[1196]
步骤4.溶液中环化和肽纯化。将经沉淀的粗料重新悬浮在300ml 20%乙腈在水中的溶液中,并且通过添加10mm碳酸氢铵来升高ph,以诱导环化。将环化反应温育4小时。环化完成后,通过冻干来移除溶剂。将粗环化材料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用15%至50%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1197]
步骤5.bet砜偶联。制备bet砜甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、
hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将bet砜反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物22:室温1.19min,ms(esi )预期质量(m h)
:1242.38da,测得质量:1242.4da。
[1198]
实例16化合物23的合成
[1199]
步骤1.自动固相肽合成。将rink-酰胺树脂(0.25mmol)添加至肽合成仪反应容器中。树脂在liberty blue自动微波辅助肽合成仪(cem公司)上用dmf溶胀(10分钟)。排出溶剂并且使用以下方法以偶联第一个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从rink-酰胺树脂中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-cys(trt)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-dap(boc)-oh、fmoc-甘氨酸、fmoc-d-bta-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1200]
步骤2.安装cl-乙酰基基团。将10%氯乙酸酐与10当量tea在dcm中的溶液混合并且添加至树脂。将混合物温育30min,并用3x dcm、3x dmf和3x dcm充分洗涤。
[1201]
步骤3.线性肽的切割和整体脱保护。通过在tfa中混合3%tis、2%水来制备切割/脱保护溶液。将溶液添加至树脂,并且反应1小时。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空中从所收集的溶液中移除溶剂。用50ml冷二乙醚(-20℃)来对游离和脱保护的肽进行沉淀。通过离心来收集经沉淀的肽。
[1202]
步骤4.溶液中环化和肽纯化。将经沉淀的粗料重新悬浮在300ml 20%乙腈在水中的溶液中,并且通过添加10mm碳酸氢铵来升高ph,以诱导环化。将环化反应温育4小时。环化完成后,通过冻干来移除溶剂将粗环化材料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用15%至50%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进
行冷冻干燥。
[1203]
步骤5.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物23:室温1.59min,ms(esi )预期质量(m h)
:1143.24da,测得质量:1143.3da。
[1204]
实例17化合物24的合成
[1205]
步骤1.自动固相肽合成。将rink-酰胺树脂(0.25mmol)添加至肽合成仪反应容器中。树脂在liberty blue自动微波辅助肽合成仪(cem公司)上用dmf溶胀(10分钟)。排出溶剂并且使用以下方法以偶联第一个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从rink-酰胺树脂中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-cys(trt)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-dap(boc)-oh、fmoc-甘氨酸、fmoc-l-tyr(ome)-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1206]
步骤2.安装cl-乙酰基基团。将10%氯乙酸酐与10当量tea在dcm中的溶液混合并且添加至树脂。将混合物温育30min,并用3x dcm、3x dmf和3x dcm充分洗涤。
[1207]
步骤3.线性肽的切割和整体脱保护。通过在tfa中混合3%tis、2%水来制备切割/脱保护溶液。将溶液添加至树脂,并且反应1小时。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空中从所收集的溶液中移除溶剂。用50ml冷二乙醚(-20℃)来对游离和脱保护的肽进行沉淀。通过离心来收集经沉淀的肽。
[1208]
步骤4.溶液中环化和肽纯化。将经沉淀的粗料重新悬浮在300ml 20%乙腈在水中的溶液中,并且通过添加10mm碳酸氢铵来升高ph,以诱导环化。将环化反应温育4小时。环化
完成后,通过冻干来移除溶剂。将粗环化材料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用15%至50%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1209]
步骤5.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物24:室温1.53min,ms(esi )预期质量(m h)
:1089.38da,测得质量:1089.4da。
[1210]
实例18化合物25的合成
[1211]
步骤1.自动固相肽合成。将rink-酰胺树脂(0.25mmol)添加至肽合成仪反应容器中。树脂在liberty blue自动微波辅助肽合成仪(cem公司)上用dmf溶胀(10分钟)。排出溶剂并且使用以下方法以偶联第一个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从rink-酰胺树脂中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-cys(trt)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-pip(boc)-oh、fmoc-甘氨酸、fmoc-mtpg-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1212]
步骤2.安装cl-乙酰基基团。将10%氯乙酸酐与10当量tea在dcm中的溶液混合并且添加至树脂。将混合物温育30min,并用3x dcm、3x dmf和3x dcm充分洗涤。
[1213]
步骤3.线性肽的切割和整体脱保护。通过在tfa中混合3%tis、2%水来制备切割/脱保护溶液。将溶液添加至树脂,并且反应1小时。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空中从所收集的溶液中移除溶剂。用50ml冷二乙醚(-20℃)来对游离和脱保护的肽进行沉淀。通过离心来收集经沉淀的肽。
[1214]
步骤4.溶液中环化和肽纯化。将经沉淀的粗料重新悬浮在300ml 20%乙腈在水中
的溶液中,并且通过添加10mm碳酸氢铵来升高ph,以诱导环化。将环化反应温育4小时。环化完成后,通过冻干来移除溶剂。将粗环化材料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用15%至50%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1215]
步骤5.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物25:室温1.41min,ms(esi )预期质量(m h)
:1168.37da,测得质量:1168.4da。
[1216]
实例19化合物26和化合物31的合成
[1217][1218]
步骤1.自动固相肽合成。将rink-酰胺树脂(0.25mmol)添加至肽合成仪反应容器中。树脂在liberty blue自动微波辅助肽合成仪(cem公司)上用dmf溶胀(10分钟)。排出溶剂并且使用以下方法以偶联第一个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从rink-酰胺树脂中移除fmoc基
团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-cys(trt)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-dap(boc)-oh、fmoc-d-丙氨酸、fmoc-mtpg-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1219]
步骤2.安装cl-乙酰基基团。将10%氯乙酸酐与10当量tea在dcm中的溶液混合并且添加至树脂。将混合物温育30min,并用3x dcm、3xdmf和3x dcm充分洗涤。
[1220]
步骤3.线性肽的切割和整体脱保护。通过在tfa中混合3%tis、2%水来制备切割/脱保护溶液。将溶液添加至树脂,并且反应1小时。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空中从所收集的溶液中移除溶剂。用50ml冷二乙醚(-20℃)来对游离和脱保护的肽进行沉淀。通过离心来收集经沉淀的肽。
[1221]
步骤4.溶液中环化和肽纯化。将经沉淀的粗料重新悬浮在300ml 20%乙腈在水中的溶液中,并且通过添加10mm碳酸氢铵来升高ph,以诱导环化。将环化反应温育4小时。环化完成后,通过冻干来移除溶剂。将粗环化材料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用15%至50%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1222]
步骤5.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物并且分离两种立体异构体(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物26:室温1.35min,ms(esi )预期质量(m h)
:1156.37da,测得质量:1156.4da,化合物31:室温1.38min,ms(esi )预期质量(m h)
:1156.37da,测得质量:1156.4da。由以下项确认的立体化学
[1223]
实例20化合物27的合成
[1224]
步骤1.自动固相肽合成。将rink-酰胺树脂(0.25mmol)添加至肽合成仪反应容器中。树脂在liberty blue自动微波辅助肽合成仪(cem公司)上用dmf溶胀(10分钟)。排出溶
剂并且使用以下方法以偶联第一个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从rink-酰胺树脂中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-cys(trt)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-dap(boc)-oh、fmoc-甘氨酸、fmoc-mtpg-oh、fmoc-l-顺式-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1225]
步骤2.安装cl-乙酰基基团。将10%氯乙酸酐与10当量tea在dcm中的溶液混合并且添加至树脂。将混合物温育30min,并用3x dcm、3x dmf和3x dcm充分洗涤。
[1226]
步骤3.线性肽的切割和整体脱保护。通过在tfa中混合3%tis、2%水来制备切割/脱保护溶液。将溶液添加至树脂,并且反应1小时。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空中从所收集的溶液中移除溶剂。用50ml冷二乙醚(-20℃)来对游离和脱保护的肽进行沉淀。通过离心来收集经沉淀的肽。
[1227]
步骤4.溶液中环化和肽纯化。将经沉淀的粗料重新悬浮在300ml 20%乙腈在水中的溶液中,并且通过添加10mm碳酸氢铵来升高ph,以诱导环化。将环化反应温育4小时。环化完成后,通过冻干来移除溶剂。将粗环化材料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用15%至50%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1228]
步骤5.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物27:室温1.3min,ms(esi )预期质量(m h)
:1142.36da,测得质量:1142.4da。
[1229]
实例21化合物28的合成
[1230]
步骤1.自动固相肽合成。将rink-酰胺树脂(0.25mmol)添加至肽合成仪反应容器
中。树脂在liberty blue自动微波辅助肽合成仪(cem公司)上用dmf溶胀(10分钟)。排出溶剂并且使用以下方法以偶联第一个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从rink-酰胺树脂中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-l-cys(trt)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-dap(boc)-oh、fmoc-甘氨酸、fmoc-mtpg-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1231]
步骤2.安装cl-乙酰基基团。将10%氯乙酸酐与10当量tea在dcm中的溶液混合并且添加至树脂。将混合物温育30min,并用3x dcm、3xdmf和3x dcm充分洗涤。
[1232]
步骤3.线性肽的切割和整体脱保护。通过在tfa中混合3%tis、2%水来制备切割/脱保护溶液。将溶液添加至树脂,并且反应1小时。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空中从所收集的溶液中移除溶剂。用50ml冷二乙醚(-20℃)来对游离和脱保护的肽进行沉淀。通过离心来收集经沉淀的肽。
[1233]
步骤4.溶液中环化和肽纯化。将经沉淀的粗料重新悬浮在300ml 20%乙腈在水中的溶液中,并且通过添加10mm碳酸氢铵来升高ph,以诱导环化。将环化反应温育4小时。环化完成后,通过冻干来移除溶剂。将粗环化材料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用15%至50%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1234]
步骤5.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物28:室温1.31min,ms(esi )预期质量(m h)
:1142.36da,测得质量:1142.4da。
[1235]
实例22化合物29的合成
[1236]
步骤1.自动固相肽合成。将rink-酰胺树脂(0.25mmol)添加至肽合成仪反应容器中。树脂在liberty blue自动微波辅助肽合成仪(cem公司)上用dmf溶胀(10分钟)。排出溶剂并且使用以下方法以偶联第一个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从rink-酰胺树脂中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-cys(trt)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-dap(bnmeboc)-oh、fmoc-甘氨酸、fmoc-mtpg-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1237]
步骤2.安装cl-乙酰基基团。将10%氯乙酸酐与10当量tea在dcm中的溶液混合并且添加至树脂。将混合物温育30min,并用3x dcm、3x dmf和3x dcm充分洗涤。
[1238]
步骤3.线性肽的切割和整体脱保护。通过在tfa中混合3%tis、2%水来制备切割/脱保护溶液。将溶液添加至树脂,并且反应1小时。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空中从所收集的溶液中移除溶剂。用50ml冷二乙醚(-20℃)来对游离和脱保护的肽进行沉淀。通过离心来收集经沉淀的肽。
[1239]
步骤4.溶液中环化和肽纯化。将经沉淀的粗料重新悬浮在300ml 20%乙腈在水中的溶液中,并且通过添加10mm碳酸氢铵来升高ph,以诱导环化。将环化反应温育4小时。环化完成后,通过冻干来移除溶剂。将粗环化材料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用15%至50%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1240]
步骤5.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合
物,其为白色粉末,hplc纯度》95%。化合物29:室温1.36min,ms(esi )预期质量(m h)
:1156.37da,测得质量:1156.4da。
[1241]
实例23化合物34的合成
[1242]
步骤1.自动固相肽合成。将rink-酰胺树脂(0.25mmol)添加至肽合成仪反应容器中。树脂在liberty blue自动微波辅助肽合成仪(cem公司)上用dmf溶胀(10分钟)。排出溶剂并且使用以下方法以偶联第一个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从rink-酰胺树脂中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-cys(trt)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-dap(boc)-oh、fmoc-甘氨酸、fmoc-aib-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1243]
步骤2.安装cl-乙酰基基团。将10%氯乙酸酐与10当量tea在dcm中的溶液混合并且添加至树脂。将混合物温育30min,并用3x dcm、3x dmf和3x dcm充分洗涤。
[1244]
步骤3.线性肽的切割和整体脱保护。通过在tfa中混合3%tis、2%水来制备切割/脱保护溶液。将溶液添加至树脂,并且反应1小时。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空中从所收集的溶液中移除溶剂。用50ml冷二乙醚(-20℃)来对游离和脱保护的肽进行沉淀。通过离心来收集经沉淀的肽。
[1245]
步骤4.溶液中环化和肽纯化。将经沉淀的粗料重新悬浮在300ml 20%乙腈在水中的溶液中,并且通过添加10mm碳酸氢铵来升高ph,以诱导环化。将环化反应温育4小时。环化完成后,通过冻干来移除溶剂。将粗环化材料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用15%至50%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1246]
步骤5.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a
(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物34:室温1.25min,ms(esi )预期质量(m h)
:997.36da,测得质量:997.4da。
[1247]
实例24化合物49的合成
[1248]
步骤1.自动固相肽合成。将rink-酰胺树脂(0.25mmol)添加至肽合成仪反应容器中。树脂在liberty blue自动微波辅助肽合成仪(cem公司)上用dmf溶胀(10分钟)。排出溶剂并且使用以下方法以偶联第一个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从rink-酰胺树脂中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-cys(trt)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-dap(boc)-oh、fmoc-甘氨酸、fmoc-aib-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1249]
步骤2.安装cl-乙酰基基团。将10%氯乙酸酐与10当量tea在dcm中的溶液混合并且添加至树脂。将混合物温育30min,并用3x dcm、3x dmf和3x dcm充分洗涤。
[1250]
步骤3.线性肽的切割和整体脱保护。通过在tfa中混合3%tis、2%水来制备切割/脱保护溶液。将溶液添加至树脂,并且反应1小时。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空中从所收集的溶液中移除溶剂。用50ml冷二乙醚(-20℃)来对游离和脱保护的肽进行沉淀。通过离心来收集经沉淀的肽。
[1251]
步骤4.溶液中环化和肽纯化。将经沉淀的粗料重新悬浮在300ml 20%乙腈在水中的溶液中,并且通过添加10mm碳酸氢铵来升高ph,以诱导环化。将环化反应温育4小时。环化完成后,通过冻干来移除溶剂。将粗环化材料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用15%至50%乙腈梯度)来进行纯化;流动相a
(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1252]
步骤5.pe3和jq-1偶联。制备fmoc-aeeea-oh(1.1当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物,并且添加至干燥环化肽。将反应温育3小时,然后用20%4-甲基哌啶在0.5ml dmf中的溶液进行fmoc脱保护。通过二乙醚沉淀法来沉淀反应产物。通过制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物来安装jq1。将jq1反应混合物添加至peg修饰的肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物49:室温1.21分钟,ms(esi )预期质量(m h)
:1331.46da,测得质量:1331.5da。
[1253]
实例25化合物50和化合物51的合成
[1254][1255]
步骤1.自动固相肽合成。将rink-酰胺树脂(0.25mmol)添加至肽合成仪反应容器中。树脂在liberty blue自动微波辅助肽合成仪(cem公司)上用dmf溶胀(10分钟)。排出溶剂并且使用以下方法以偶联第一个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从rink-酰胺树脂中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-cys(trt)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-dap(boc)-oh、fmoc-甘氨酸-oh、fmoc-mtpg-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1256]
步骤2.安装cl-乙酰基基团。将10%氯乙酸酐与10当量tea在dcm中的溶液混合并且添加至树脂。将混合物温育30min,并用3x dcm、3x dmf和3x dcm充分洗涤。
[1257]
步骤3.线性肽的切割和整体脱保护。通过在tfa中混合3%tis、2%水来制备切割/脱保护溶液。将溶液添加至树脂,并且反应1小时。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空中从所收集的溶液中移除溶剂。用50ml冷二
乙醚(-20℃)来对游离和脱保护的肽进行沉淀。通过离心来收集经沉淀的肽。
[1258]
步骤4.溶液中环化和肽纯化。将经沉淀的粗料重新悬浮在300ml 20%乙腈在水中的溶液中,并且通过添加10mm碳酸氢铵来升高ph,以诱导环化。将环化反应温育4小时。环化完成后,通过冻干来移除溶剂。将粗环化材料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用15%至50%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1259]
步骤5.靶蛋白结合部分4偶联。制备靶蛋白结合部分4甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将靶蛋白结合部分4反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽靶蛋白结合部分4甲酸。通过反相hplc来纯化最终产物并且分离两种立体异构体(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物50:室温1.32分钟,ms(esi )预期质量(m h)
:1138.38da,测得质量:1138.4da,化合物51:室温1.34分钟,ms(esi )预期质量(m h)
:1138.38da,测得质量:1138.4da。
[1260]
实例26化合物53的合成
[1261]
步骤1.自动固相肽合成。将rink-酰胺树脂(0.25mmol)添加至肽合成仪反应容器中。树脂在liberty blue自动微波辅助肽合成仪(cem公司)上用dmf溶胀(10分钟)。排出溶剂并且使用以下方法以偶联第一个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从rink-酰胺树脂中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-cys(trt)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-dap(boc)-oh、fmoc-甘氨酸、fmoc-mtpg-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1262]
步骤2.安装cl-乙酰基基团。将10%氯乙酸酐与10当量tea在dcm中的溶液混合并且添加至树脂。将混合物温育30min,并用3x dcm、3x dmf和3x dcm充分洗涤。
[1263]
步骤3.线性肽的切割和整体脱保护。通过在tfa中混合3%tis、2%水来制备切割/脱保护溶液。将溶液添加至树脂,并且反应1小时。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空中从所收集的溶液中移除溶剂。用50ml冷二乙醚(-20℃)来对游离和脱保护的肽进行沉淀。通过离心来收集经沉淀的肽。
[1264]
步骤4.溶液中环化和肽纯化。将经沉淀的粗料重新悬浮在300ml 20%乙腈在水中的溶液中,并且通过添加10mm碳酸氢铵来升高ph,以诱导环化。将环化反应温育4小时。环化完成后,通过冻干来移除溶剂。将粗环化材料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用15%至50%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1265]
步骤5.(-)-jq1偶联。制备(-)-jq1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将(-)-jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽(-)-jq1甲酸。通过反相hplc来纯化最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物53:室温1.2分钟,ms(esi )预期质量(m h)
:1142.36da,测得质量:1142.4da。
[1266]
实例27化合物68的合成
[1267]
步骤1.自动固相肽合成。将rink-酰胺树脂(0.25mmol)添加至肽合成仪反应容器中。树脂在liberty blue自动微波辅助肽合成仪(cem公司)上用dmf溶胀(10分钟)。排出溶剂并且使用以下方法以偶联第一个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从rink-酰胺树脂中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-cys(trt)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-α-氨基-d-gly(boc)-oh、fmoc-甘氨酸、fmoc-mtpg-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
mtpg-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1274]
步骤2.安装cl-乙酰基基团。将10%氯乙酸酐与10当量tea在dcm中的溶液混合并且添加至树脂。将混合物温育30min,并用3x dcm、3xdmf和3x dcm充分洗涤。
[1275]
步骤3.线性肽的切割和整体脱保护。通过在tfa中混合3%tis、2%水来制备切割/脱保护溶液。将溶液添加至树脂,并且反应1小时。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空中从所收集的溶液中移除溶剂。用50ml冷二乙醚(-20℃)来对游离和脱保护的肽进行沉淀。通过离心来收集经沉淀的肽。
[1276]
步骤4.溶液中环化和肽纯化。将经沉淀的粗料重新悬浮在300ml 20%乙腈在水中的溶液中,并且通过添加10mm碳酸氢铵来升高ph,以诱导环化。将环化反应温育4小时。环化完成后,通过冻干来移除溶剂。将粗环化材料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用15%至50%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1277]
步骤5.jq1偶联。制备jq1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq1甲酸。通过反相hplc来纯化最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物69:室温1.27分钟,ms(esi )预期质量(m h)
:1128.34da,测得质量:1128.3da。
[1278]
内酰胺大环化合物的一般合成方案
[1279]
实例29化合物16和化合物17的合成
[1280][1281]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-o1pen-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1282]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-甘氨酸、fmoc-mtpg-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1283]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复
切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1284]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1285]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1286]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物并且分离两种立体异构体(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物16:室温1.34min,ms(esi )预期质量(m h)
:1083.37da,测得质量:1083.4da,化合物17:室温1.37min,ms(esi )预期质量(m h)
:1083.37da,测得质量:1083.4da。由晶体学确认的立体化学。
[1287]
实例30化合物32和化合物30的合成
[1288]
[1289]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-aep-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1290]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-甘氨酸、fmoc-mtpg-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1291]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1292]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1293]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1294]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物并且分离两种立体异构体(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物32:室温1.36分钟,ms(esi )预期质量(m h)
:1097.39da,测得质量:1097.4da,化合物30:室温1.39分钟,ms(esi )预期质量(m h)
:1097.39da,测得质量:1097.4da。
[1295]
实例31化合物33的合成
[1296]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-l-丙氨酸-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1297]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-甘氨酸、fmoc-mtpg-oh、fmoc-l-hyp(tbu)-oh、fmoc-l-tle-oh和fmoc-甘氨酸-oh。如上所述,将末端fmoc-甘氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1298]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1299]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1300]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%
tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1301]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物33:室温1.34分钟,ms(esi )预期质量(m h)
:1110.38da,测得质量:1110.4da。
[1302]
实例32化合物35的合成
[1303]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-o1pen-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1304]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-l-丙氨酸、fmoc-mtpg-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-tle上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1305]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所
收集的溶液中移除溶剂。
[1306]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1307]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1308]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物35:室温1.36min,ms(esi )预期质量(m h)
:1097.39da,测得质量:1097.9da。
[1309]
实例33化合物36和化合物37的合成
[1310][1311]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-甘氨酸-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1312]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树
脂用7ml dmf洗涤4次。通过将fmoc-l-blys(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-甘氨酸、fmoc-mtpg-oh、fmoc-l-hyp(tbu)-oh、fmoc-l-tle-oh。如上所述,将末端fmoc-tle上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1313]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1314]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1315]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1316]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物并且分离两种立体异构体(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物36:室温1.26min,ms(esi )预期质量(m h)
:1095.41da,测得质量:1095.4da,化合物37:室温1.29min,ms(esi )预期质量(m h)
:1095.41da,测得质量:1095.4da。
[1317]
实例34化合物38和化合物39的合成
[1318][1319]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-ahx-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1320]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-甘氨酸、fmoc-mtpg-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-tle上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1321]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1322]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1323]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1324]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物并且分离两种立体异构体(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物38:室温1.33min,ms(esi )预期质量(m h)
:1095.41da,测得质量:1095.4da,化合物39:室温1.36min,ms(esi )预期质量(m h)
:1095.41da,测得质量:1095.4da。由晶体学确认的立体化学。
[1325]
实例35化合物40的合成
[1326]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-o1pen-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1327]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树
脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-甘氨酸-oh、fmoc-d-bip-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1328]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1329]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1330]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1331]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至80%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物40:室温1.59min,ms(esi )预期质量(m h)
:1076.42da,测得质量:1076.4da。由晶体学确认的结构。
[1332]
实例36化合物41的合成
[1333]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料
合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-o1pen-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1334]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-丙氨酸-oh、fmoc-d-bip-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1335]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1336]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1337]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1338]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5μm c18(2)150x4.6,使用45%至85%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物41:室温1.63min,ms(esi )预期质量(m h)
:1090.44da,测得质量:1090.4da。
[1339]
实例37化合物42的合成
[1340]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-o1pen-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1341]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-缬氨酸-oh、fmoc-d-bip-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1342]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1343]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1344]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%
tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1345]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5μm c18(2)150x4.6,使用50%至90%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物42:室温1.7min,ms(esi )预期质量(m h)
:1118.46da,测得质量:1118.5da。由晶体学确认的结构。
[1346]
实例38化合物43的合成
[1347]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-o1pen-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1348]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-pyr-oh、fmoc-d-bip-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1349]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1350]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合
pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1351]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1352]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至85%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物43:室温1.65min,ms(esi )预期质量(m h)
:1167.46da,测得质量:1167.5da。
[1353]
实例39化合物44的合成
[1354]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-o1pen-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1355]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复
该脱保护、洗涤和偶联序列:fmoc-d-苯丙氨酸-oh、fmoc-d-bip-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1356]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1357]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1358]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1359]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5μm c18(2)150x4.6,使用50%至90%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物44:室温1.73min,ms(esi )预期质量(m h)
:1166.47da,测得质量:1166.5da。
[1360]
实例40化合物45的合成
[1361]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-o1pen-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然
后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1362]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-bip-oh、fmoc-d-bip-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1363]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1364]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1365]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1366]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5μm c18(2)150x4.6,使用65%至95%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物45:室温1.82min,ms(esi )预期质量(m h)
:1242.50da,测得质量:1242.5da。
[1367]
实例41化合物46和化合物47的合成
[1368][1369]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-s1pen-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1370]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-甘氨酸、fmoc-mtpg-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1371]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1372]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1373]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻
干燥。
[1374]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物并且分离两种立体异构体(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物46:室温1.38分钟,ms(esi )预期质量(m h)
:1099.35da,测得质量:1099.4da,化合物47:室温1.42分钟,ms(esi )预期质量(m h)
:1099.35da,测得质量:1099.4da。由晶体学确认的立体化学。
[1375]
实例42化合物48的合成
[1376]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-d-dap(boc)-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1377]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-甘氨酸-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-bip-oh和fmoc-l-hyp(tbu)-oh。如上所述,将末端残基上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1378]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1379]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1380]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1381]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至80%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物48:室温1.63min,ms(esi )预期质量(m h)
:1100.43da,测得质量:1100.4da。
[1382]
实例43化合物52的合成
[1383]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-o1pen-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1384]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0
当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-缬氨酸-oh、fmoc-d-bip-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1385]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1386]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1387]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1388]
步骤6.靶蛋白结合部分4偶联。制备靶蛋白结合部分4甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将靶蛋白结合部分4反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽靶蛋白结合部分4甲酸。通过反相hplc来纯化最终产物并且分离两种立体异构体(phenomenex luna 5μm c18(2)150x4.6,使用50%至90%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物52:室温1.68min,ms(esi )预期质量(m h)
:1114.49da,测得质量:1114.5da。由晶体学确认的结构。
[1389]
实例44化合物54的合成
[1390]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-o1pen-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1391]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-甘氨酸、fmoc-d-bmtpg-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1392]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1393]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1394]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1395]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物54:室温1.33分钟,ms(esi )预期质量(m h)
:1097.39da,测得质量:1097.4da。由晶体学确认的结构。
[1396]
实例45化合物55的合成
[1397]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-o1pen-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1398]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-甘氨酸、fmoc-l-bmtpg-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1399]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1400]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1401]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%
tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1402]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物55:室温1.35分钟,ms(esi )预期质量(m h)
:1097.39da,测得质量:1097.4da。由晶体学确认的结构。
[1403]
实例46化合物56的合成
[1404]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-d-dap(boc)-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1405]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-丙氨酸-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-bip-oh和fmoc-l-hyp(tbu)-oh。如上所述,将末端残基上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1406]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复
切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1407]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1408]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1409]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至80%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物56:室温1.64min,ms(esi )预期质量(m h)
:1114.45da,测得质量:1114.5da。
[1410]
实例47化合物57的合成
[1411]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-o1pen-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1412]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下
温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-丙氨酸-oh、fmoc-d-bip-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-bme-ile-oh。如上所述,将末端fmoc-l-bme-ile上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1413]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1414]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1415]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1416]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至90%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物57:室温1.69min,ms(esi )预期质量(m h)
:1104.45da,测得质量:1104.5da。
[1417]
实例48化合物58的合成
[1418]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-ava-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1419]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-丙氨酸-oh、fmoc-d-bip-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1420]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1421]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1422]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1423]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至90%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物58:室温1.66分钟,ms(esi )预期质量(m h)
:1088.46da,测得质量:1088.5da。
[1424]
实例49化合物59的合成
[1425]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-gaba-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1426]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-丙氨酸-oh、fmoc-d-bip-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1427]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1428]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1429]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%
tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1430]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至90%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物59:室温1.65分钟,ms(esi )预期质量(m h)
:1074.44da,测得质量:1074.4da。
[1431]
实例50化合物60的合成
[1432]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-ahx-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1433]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-丙氨酸-oh、fmoc-d-bip-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1434]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1435]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1436]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1437]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5μm c18(2)150x4.6,使用50%至90%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物60:室温1.68min,ms(esi )预期质量(m h)
:1102.47da,测得质量:1102.5da。
[1438]
实例51化合物61的合成
[1439]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-ahp-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1440]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0
当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-丙氨酸-oh、fmoc-d-bip-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1441]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1442]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1443]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1444]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5μm c18(2)150x4.6,使用50%至90%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物61:室温1.7分钟,ms(esi )预期质量(m h)
:1116.49da,测得质量:1116.5da。
[1445]
实例52化合物62的合成
[1446]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-o1pen-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反
应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1447]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-β-丙氨酸-oh、fmoc-d-bip-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1448]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1449]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1450]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1451]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至80%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物62:室温1.63min,ms(esi )预期质量(m h)
:1090.44da,测得质量:1090.4da。
[1452]
实例53化合物63的合成
[1453]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-nme-o1pen-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1454]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-丙氨酸-oh、fmoc-d-bip-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1455]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1456]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1457]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%
tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1458]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5μm c18(2)150x4.6,使用50%至90%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物63:室温1.67min,ms(esi )预期质量(m h)
:1104.45da,测得质量:1104.5da
[1459]
实例54化合物6和化合物7的合成
[1460][1461]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-l-谷氨酰胺(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1462]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-甘氨酸、fmoc-mtpg-oh、fmoc-l-hyp(tbu)-oh、fmoc-l-tle-oh和fmoc-甘氨酸。如上所述,将末端fmoc-甘氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1463]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所
收集的溶液中移除溶剂。
[1464]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1465]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1466]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤4后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来纯化最终产物并且分离两种立体异构体(phenomenex luna 5μm c18(2)150x4.6,使用40%至70%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物6:室温1.21min,ms(esi )预期质量(m h)
:1167.41da,测得质量:1167.4da,化合物7:室温1.24min,ms(esi )预期质量(m h)
:1167.41da,测得质量:1167.4da。由晶体学确认的立体化学。
[1467]
实例55化合物64的合成
[1468]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-o1pen-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1469]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树
脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-甘氨酸-oh、fmoc-d-bbip-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1470]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1471]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1472]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1473]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至80%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物64:室温1.68min,ms(esi )预期质量(m h)
:1090.44da,测得质量:1090.4da。
[1474]
实例56化合物65的合成
[1475]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加
fmoc-o1pen-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1476]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-丙氨酸-oh、fmoc-d-bbip-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1477]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1478]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1479]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1480]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至85%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物65:室温1.71min,ms(esi )预期质量(m h)
:1118.46da,测得质量:1118.4da。
[1481]
实例57化合物66的合成
[1482]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-o1pen-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1483]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-谷氨酰胺-oh、fmoc-d-bip-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1484]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1485]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1486]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%
tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1487]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至80%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物66:室温1.6分钟,ms(esi )预期质量(m h)
:1147.46da,测得质量:1147.5da。
[1488]
实例58化合物67的合成
[1489]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-o1pen-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1490]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将boc-d-b2orn(fmoc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-bip-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1491]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所
收集的溶液中移除溶剂。
[1492]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1493]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1494]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5μm c18(2)150x4.6,使用50%至90%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物67:室温1.64min,ms(esi )预期质量(m h)
:1061.45da,测得质量:1061.4da。
[1495]
实例59化合物70的合成
[1496]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-o1pen-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1497]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树
脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-丙氨酸-oh、fmoc-d-mtphe-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1498]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1499]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1500]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1501]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至80%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物70:室温1.49分钟,ms(esi )预期质量(m h)
:1111.40da,测得质量:1111.4da。
[1502]
实例60化合物71的合成
[1503]
步骤1.装载第一个氨基酸。将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料
合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-o1pen-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1504]
步骤2.自动固相肽合成。在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-dap(boc)-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-lys(n3)-oh、fmoc-d-bip-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-oh。如上所述,将末端fmoc-l-叔亮氨酸上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1505]
步骤3.从树脂上切割线性肽。通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1506]
步骤4.溶液中环化。用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1507]
步骤5.整体脱保护和肽纯化。在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1508]
步骤6.jq-1偶联。制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5μm c18(2)150x4.6,使用40%至80%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物71:室温1.53分钟,ms(esi )预期质量(m h)
:1173.49da,测得质量:1173.5da。
[1509]
实例61化合物72的合成
[1510]
化合物71与100mm dtt在室温下进行温育并且反应过夜,以将叠氮基基团还原为对应的胺。通过反相hplc来纯化所得化合物(phenomenex luna 5μm c18(2)150x4.6,使用40%至80%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物72:室温1.43min,ms(esi )预期质量(m h)
:1147.49da,测得质量:1147.5da。
[1511]
实例62化合物207的合成
[1512]
步骤1.装载第一个氨基酸。
[1513]
将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加boc-d-b2orn(fmoc)-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1514]
步骤2.自动固相肽合成。
[1515]
在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:
[1516]
通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤
4次。通过将fmoc-d-bip-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-l-hyp(tbu)-oh和fmoc-l-tle-tria-cyp-oh。如上所述,将末端残基上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1517]
步骤3.从树脂上切割线性肽。
[1518]
通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1519]
步骤4.溶液中环化。
[1520]
用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1521]
步骤5.整体脱保护和肽纯化。
[1522]
在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1523]
步骤6.jq-1偶联。
[1524]
制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5u c18(2)150x4.6,使用40%至80%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物207:室温1.69min,ms(esi )预期质量(m h)
:1081.46da,测得质量:1081.5da。
[1525]
实例63化合物208的合成
[1526]
步骤1.装载第一个氨基酸。
[1527]
将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加boc-d-b2orn(fmoc)-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1528]
步骤2.自动固相肽合成。
[1529]
在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:
[1530]
通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-bip-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-l-hyp(tbu)-oh、fmoc-l-tle-tria-cyp-oh和fmoc-甘氨酸-oh。如上所述,将末端残基上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1531]
步骤3.从树脂上切割线性肽。
[1532]
通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1533]
步骤4.溶液中环化。
[1534]
用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1535]
步骤5.整体脱保护和肽纯化。
[1536]
在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保
护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1537]
步骤6.jq-1偶联。
[1538]
制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5u c18(2)150x4.6,使用40%至80%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物208:室温1.67min,ms(esi )预期质量(m h)
:1138.48da,测得质量:1138.5da。
[1539]
实例64化合物206的合成
[1540]
步骤1.装载第一个氨基酸。
[1541]
将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加boc-d-b2orn(fmoc)-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1542]
步骤2.自动固相肽合成。
[1543]
在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:
[1544]
通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-bip-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-l-hyp(tbu)-oh和fmoc-l-tle-tria-oh。如上所述,将末端残基上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分
洗涤。
[1545]
步骤3.从树脂上切割线性肽。
[1546]
通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1547]
步骤4.溶液中环化。
[1548]
用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1549]
步骤5.整体脱保护和肽纯化。
[1550]
在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1551]
步骤6.jq-1偶联。
[1552]
制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5u c18(2)150x4.6,使用40%至80%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物206:室温1.58min,ms(esi )预期质量(m h)
:1085.45da,测得质量:1085.5da。
[1553]
实例64化合物202的合成
[1554]
步骤1.装载第一个氨基酸。
[1555]
将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-d-dap(boc)-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1556]
步骤2.自动固相肽合成。
[1557]
在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:
[1558]
通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-缬氨酸-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-bip-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-tria-oh。如上所述,将末端残基上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1559]
步骤3.从树脂上切割线性肽。
[1560]
通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1561]
步骤4.溶液中环化。
[1562]
用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1563]
步骤5.整体脱保护和肽纯化。
[1564]
在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1565]
步骤6.jq-1偶联。
[1566]
制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5u c18(2)150x4.6,使用40%至80%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物202:室温1.66min,ms(esi )预期质量(m h)
:1142.47da,测得质量:1142.5da。
30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1579]
步骤6.jq-1偶联。
[1580]
制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5u c18(2)150x4.6,使用40%至80%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物203:室温1.63min,ms(esi )预期质量(m h)
:1114.44da,测得质量:1114.5da。
[1581]
实例66化合物205的合成
[1582]
步骤1.装载第一个氨基酸。
[1583]
将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-d-dap(boc)-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1584]
步骤2.自动固相肽合成。
[1585]
在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:
[1586]
通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-甘氨酸-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-bip-oh、fmoc-l-hyp(tbu)-oh和fmoc-nme-l-tle-tria-oh。如上所述,将末端残基上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1587]
步骤3.从树脂上切割线性肽。
[1588]
通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离
肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1589]
步骤4.溶液中环化。
[1590]
用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1591]
步骤5.整体脱保护和肽纯化。
[1592]
在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1593]
步骤6.jq-1偶联。
[1594]
制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5u c18(2)150x4.6,使用40%至80%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物205:室温1.64min,ms(esi )预期质量(m h)
:1114.44da,测得质量:1114.5da。
[1595]
实例67化合物204的合成
[1596][1597]
步骤1.装载第一个氨基酸。
[1598]
将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-d-dap(bnmeboc)-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1599]
步骤2.自动固相肽合成。
[1600]
在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:
[1601]
通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-甘氨酸-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-bip-oh、fmoc-l-hyp(tbu)-oh和fmoc-nme-l-tle-tria-oh。如上所述,将末端残基上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1602]
步骤3.从树脂上切割线性肽。
[1603]
通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1604]
步骤4.溶液中环化。
[1605]
用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1606]
步骤5.整体脱保护和肽纯化。
[1607]
在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1608]
步骤6.jq-1偶联。
[1609]
制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5u c18(2)150x4.6,使用40%至80%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物204:室温1.67min,ms(esi )预期质量(m h)
:1128.46da,测得质量:1128.5da。
[1610]
实例68化合物201的合成
[1611][1612]
步骤1.装载第一个氨基酸。
[1613]
将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-d-dap(boc)-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1614]
步骤2.自动固相肽合成。
[1615]
在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:
[1616]
通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-d-丙氨酸-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联序列:fmoc-d-bip-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-tria-oh。如上所述,将末端残基上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1617]
步骤3.从树脂上切割线性肽。
[1618]
通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1619]
步骤4.溶液中环化。
[1620]
用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1621]
步骤5.整体脱保护和肽纯化。
[1622]
在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保
护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1623]
步骤6.jq-1偶联。
[1624]
制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5u c18(2)150x4.6,使用40%至80%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物201:室温1.64min,ms(esi )预期质量(m h)
:1114.45da,测得质量:1114.5da。
[1625]
实例69化合物200的合成
[1626][1627]
步骤1.装载第一个氨基酸。
[1628]
将2-氯三苯甲基氯(ctc)树脂(0.25mmol)添加至塑料合成容器。添加10ml dcm并且允许树脂在氮气下溶胀30min。在真空下排出树脂后,添加fmoc-d-dap(boc)-oh(2.0当量)和dipea(5.0当量)在dcm中的混合物。将树脂摇晃1h,并且过滤反应混合物。向树脂添加10%甲醇、10%dipea在dcm中的溶液,并且将混合物摇晃10分钟。然后在真空下排出溶剂并且将树脂用10ml dcm洗涤3次,然后用10ml dmf进行洗涤,并且在真空中干燥。
[1629]
步骤2.自动固相肽合成。
[1630]
在liberty blue自动微波辅助肽合成仪(cem公司)上,将来自步骤1的树脂用dmf溶胀(10分钟)并且在反应容器中进行混合。排出溶剂并且使用以下方法以偶联第二个氨基酸:
[1631]
通过将树脂与10ml的20%4-甲基哌啶在dmf中的溶液在75℃下温育15秒(两次),然后在90℃下温育50秒,从第一个氨基酸结构单元中移除fmoc基团。将树脂用7ml dmf洗涤4次。通过将fmoc-甘氨酸-oh(4.0当量)、oxyma(4.0当量)和dic(4.0当量)在5ml dmf中的溶液添加至反应容器来开始偶联。将反应混合物加热至75℃,持续15秒,然后在90℃下温育110秒并且通过鼓泡氮气来进行混合。对于以下结构单元,依次重复该脱保护、洗涤和偶联
序列:fmoc-d-bip-oh、fmoc-l-hyp(tbu)-oh和fmoc-l-tle-tria-oh。如上所述,将末端残基上的fmoc基团脱保护,并且使用dcm来将树脂转移至15ml聚丙烯烧结容器。然后用dcm(3x10ml)来进行充分洗涤。
[1632]
步骤3.从树脂上切割线性肽。
[1633]
通过在10ml dcm中混合20%hfip来制备裂解混合物。通过将裂解混合物添加至聚丙烯烧结容器并且温育30分钟,从树脂上切割线性肽。重复切割程序两次,并且将含有游离肽的经过滤的溶液收集至100ml圆底烧瓶中。在真空下从所收集的溶液中移除溶剂。
[1634]
步骤4.溶液中环化。
[1635]
用250ml dcm来重新悬浮干燥的裂解肽。通过在dcm中混合pyaop(2.0当量)、hoat(2.0当量)和dipea(4.0当量)来制备环化混合物。将环化混合物添加至上述线性肽在dcm中的溶液并且反应3小时。
[1636]
步骤5.整体脱保护和肽纯化。
[1637]
在真空中从环化肽溶液中移除溶剂。通过在tfa中混合3%tis、2%水来制备脱保护溶液。将溶液添加至半干燥的环化肽,并且反应1小时。在真空下移除tfa。将环化和脱保护的肽与50ml冷二乙醚(-20℃)混合以沉淀化合物。通过离心来收集经沉淀的肽。将经沉淀的粗料用dmso来进行重新悬浮并且通过反相制备型hplc(phenomenex c18 luna 30x250mm,使用30%至60%乙腈梯度)来进行纯化;流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。汇集所需的产物级分并且通过冻干来进行冷冻干燥。
[1638]
步骤6.jq-1偶联。
[1639]
制备jq-1甲酸(0.95当量,相对于环化肽)、hatu(2.0当量)、hoat(2.0当量)和dipea(2.0当量))在0.5ml dmf中的反应混合物。将jq1反应混合物添加至步骤5后所获得的干燥环化肽。通过lc-ms来监测反应,直至耗尽jq-1甲酸。通过反相hplc来分离最终产物(phenomenex luna 5u c18(2)150x4.6,使用40%至80%乙腈梯度);流动相a(0.1%tfa在水中的溶液),流动相b(100%乙腈)。将所需产物冷冻干燥,以得到最终化合物,其为白色粉末,hplc纯度》95%。化合物200:室温1.63min,ms(esi )预期质量(m h)
:1100.43da,测得质量:1100.4da。
[1640]
实例70:生物活性
[1641]
基于spr的三元复合物半衰期测量
[1642]
一系列s sa(链霉亲和素)芯片用于biacore t200或biacore 8k(ge health sciences)。运行缓冲液为50mm hepes ph 7.5、150mm nacl、0.2%(w/v)peg-3350、0.5mm tcep、0.001%tween 20和2%(v/v)dmso。brd4 bd1或brd4 bd2以大约500ru的水平固定在传感器芯片上,以便可以在同一测定中分析单独来自化合物的信号和三元复合物信号。流动通道1用作参考。通过注射100μg/ml胺-peg-生物素(thermo fisher)来阻断所有通道上的链霉亲和素。以3倍剂量应答注射100nm至11nm的化合物,并且以1μm的恒定浓度共注射vhl。用biacore s200评估软件中的定制模型来分析数据,全局拟合k
off
,同时允许k
on
和r
max
局部拟合,或在biacore8k上仅拟合解离。数据报告为半衰期(t
1/2
)=ln(2)/k
off
。
[1643]
eol1细胞中的brd4降解测定
[1644]
在第1天,将eol-1嗜酸性白血病细胞以每孔45,000个细胞的密度接种在corning purecoat amine微孔板(corning#354719)中的45μl/孔的测定培养基(rpmi,10%fbs,包含
l-谷氨酰胺)中。细胞附着到细胞板上后,将化合物在二甲基亚砜(dmso)中连续稀释1/3,以在384孔v型底部聚丙烯微量滴定板(greiner#781091)上产生20点稀释液。将2μl来自连续稀释液的每个样品转移至98μl测定培养基中作为中间稀释液。将每孔5μl的中间稀释液添加至45μl的细胞板。将第1、2、23和24列仅用0.2%最终浓度的dmso处理,以将数据归一化为“中性对照”。化合物处理后,将细胞板在37℃的温育箱中储存4小时。4小时后,通过将15μl的16%w/v多聚甲醛(electron microscopy sciences#15710-s)直接添加至细胞板中的50μl培养基和化合物中,将细胞固定在3.7%w/v最终浓度的多聚甲醛中。将细胞板在rt温育20分钟。将孔内容物抽吸出来,并用100μl/孔pbs洗涤3次。将包含0.5%w/v牛血清白蛋白,0.5%w/vtriton x-100(封闭/透化缓冲液)的50ul/孔的磷酸盐缓冲盐水(pbs)(ph 7.5)添加至每个孔。将样品温育20分钟。将孔内容物抽吸出来,并用100μl/孔的pbs洗涤3次。从孔中抽吸出pbs,并将每孔50μl的eol-1封闭缓冲液(包含10%正常山羊血清的pbs(abcam#ab7481))添加至每个孔。将试管在室温温育30分钟。从孔中倒出封闭缓冲液。通过将mab抗brd4[epr5150]抗体(abcam 128874)以1:500的比例稀释到抗体稀释缓冲液(pbs,2%正常山羊血清)中来进行brd4的免疫荧光染色。每孔添加25μl稀释于缓冲液中的brd4抗体,并且在4℃下温育过夜。
[1645]
在第2天,将样品用100μl/孔的pbs洗涤3次。将25μl/孔的第二抗体溶液(山羊抗兔igg,dylight 488缀合的高度交叉吸附的thermo fisher#35553)和以1μg/ml稀释于抗体稀释缓冲液中的hoechst 33342)分配至每个孔中。仅将hoechst 33342添加到底部3列以将数据归一化为“抑制剂对照”。将样品在室温温育2小时。将样品用100μl pbs洗涤3次。使用opera phenix高内涵筛选系统对brd4进行荧光定量成像。使用488nm和405nm通道捕获样品的荧光图像。hoechst通道用于识别核区域。在核区域中定量平均brd4强度为488。使用genedata screener进行数据分析,其中使用dmso和无一抗对照处理的样品以定义brd4中的0%和100%变化。剂量-应答对数(抑制剂)与应答的关系曲线,其用于定义曲线的拐点(dc
50
)和最大效应的平台。
[1646]
使用chemdraw v.15.1(perkinelmer)来计算单个拓扑极性表面积(tpsa)和clogp值。表3中提供了本文所述化合物的三元vhl/bd1和vhl/bd2复合物的半衰期、eol1细胞中brd4的dc
50
、分子的拓扑极性表面积(tpsa)和clogp(亲脂性)。
[1647]
表3
[1648]
细胞brd4降解的图例:-/ ,dc
50
》20μm; ,dc
50
《20μm; ,dc
50
《1μm; ,dc
50
《0.05μm
[1649]
[1650]
[1651]
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。