1.本发明涉及一种紫外光照强化携播性噬菌体控制高水力流态环境生物膜生长的方法,属于水与污水生物处理领域。
背景技术:
2.生物膜是附着在物质表面,被细胞外大分子聚合物包裹的有组织的微生物聚集体,为细胞生命活动提供了稳定的内环境,是微生物重要的生命形式。然而,生物膜可能导致病原体滋生、加速附着界面腐蚀等问题,在膜生物法处理污水和修复受污染水体的应用实践中,膜-水界面上生物膜的累积和粘附造成膜生物污染进而影响系统性能。
3.近年的研究证实,噬菌体作为细菌病毒可以通过流体裹挟与吸附、酶解大分子聚合物、侵染裂解细菌等多种方式进入生物膜内部,调节生物膜群落组装和功能。相较于传统的生物膜控制方法,应用噬菌体控制的方法避免了外源抗生素和抑菌剂的引入,作为一种原位生物膜控制策略具有良好应用前景。鉴于噬菌体在水与污水处理系统中的生态特性和潜力,优化可靠的噬菌体生物膜控制技术具有重要意义。
4.然而,噬菌体控制生物膜技术的实际应用场景中往往有着较为复杂的水力流态,一些场景中较高的水力流态会导致噬菌体在体系中的滞留时间大大减少,从而降低噬菌体的作用效率。例如,在水力停留时间低于1分钟的高水力流态环境下,体系投加噬菌体的控制效果显著下降。因此,如何在高水力流态环境下构建可靠的噬菌体生物膜控制技术,是目前亟待解决的技术问题。
技术实现要素:
5.本发明的目的是提供基于紫外光照强化的携播性噬菌体在高水力流态环境下的抑制生物膜生长的新方法,为污水生物处理系统生物膜相关的问题提供噬菌体控制手段。该方法主要包括以下步骤:(1)噬菌体前处理与浓缩;(2)噬菌体库构建与保存;(3)紫外光照诱发强化;(4)生物膜控制等步骤。该方法利用非宿主载体菌和噬菌体的携播作用使得在高水力流态环境中噬菌体得到了较好的运动能力和生物膜穿透性,并且通过紫外强化促进了噬菌体和宿主菌的共生关系,增强了噬菌体对生物膜生长的控制效果。
6.本发明具体的技术方案如下:
7.一种紫外强化携播性噬菌体控制高水力流态环境生物膜生长的方法,其包括以下步骤:
8.s1:将活性污泥在超声和搅拌处理下进行分散,再进行泥水分离后,取上清液过滤除菌并提取含噬菌体的滤液,滤液经过切向流系统进一步浓缩富集,得到噬菌体富集液;
9.s2:将能够吸附噬菌体的非宿主载体菌与所述噬菌体富集液混配并分散处理,待非宿主载体菌吸附噬菌体后,通过离心分离提取富集有携播性噬菌体和非宿主载体菌的沉淀部分,再对沉淀部分进行重悬后分散,再通过过滤去除非宿主载体菌,得到携播性噬菌体溶液;
10.s3:将所述携播性噬菌体溶液重新与所述非宿主载体菌混合后加入定殖有宿主菌生物膜的水环境体系中进行培养,维持体系中处于高水力流态环境,使携播性噬菌体随非宿主载体菌迁移并定殖到宿主菌生物膜上,直至生物膜生长到成熟阶段;其中在培养初期,需对体系施加紫外光照进而强化携播性噬菌体和宿主菌的感染和定殖,其余时间无需施加紫外光照避光培养。
11.作为优选,所述s1的具体做法如下:将活性污泥在冰浴下交替进行超声震荡处理和磁力搅拌使得污泥充分分散,再通过自然沉降实现泥水分离后收集上清液,不断重复多次充分去除污泥颗粒和团聚体,保留最后一次泥水分离得到的上清液;将收集得到的上清液依次经过0.45μm和0.22μm微孔滤膜过滤以去除污泥杂质和细菌,再用pbs溶液重悬后通过切向流浓缩系统进行浓缩,最后通过离心超滤进一步浓缩富集,得到噬菌体富集液。
12.作为优选,所述超声震荡处理和磁力搅拌交替进行至少三轮。
13.作为优选,所述s2的具体做法如下:将能够吸附噬菌体的非宿主载体菌培养至指数生长期,然后取菌液与所述噬菌体富集液混合后超声分散均匀,再置于冷藏环境中使非宿主载体菌吸附噬菌体,吸附后的混合液通过逐级离心实现固液分离,离心完毕后去除上清液,向固体沉淀中加入pbs溶液重悬,再通过超声分散使噬菌体分散在pbs溶液中,最后过0.22μm滤膜后得到具有携播性的载体菌-噬菌体混合液。
14.作为优选,所述非宿主载体菌为具有能够使噬菌体吸附于鞭毛上的鞭毛菌。
15.作为优选,所述非宿主载体菌通过将活性污泥用pbs溶液稀释后涂布在lb 琼脂平板培养基上过夜培养,然后选择平板上直径最大的若干菌落,在扫描电子显微镜下筛选能够吸附噬菌体的鞭毛细菌作为优势非宿主载体细菌。
16.作为优选,所述高水力流态环境为水力停留时间低于1分钟的水环境体系。
17.作为优选,所述培养初期为开始培养的前5~10分钟。
18.作为优选,所述紫外光照通过uv灯管的辐照来实现。
19.作为优选,所述紫外光照的最佳照射方式为:通过波长为313~365nm、功率为5~20w的uv灯管对宿主菌生物膜施加紫外光照射,照射距离为5~10cm,照射位置对应光照强度为2.0~5.0mw/cm2,照射时间为5~10分钟。
20.相对于现有技术而言,本发明的有益效果如下:
21.本方法从活性污泥中分离筛选出携播性噬菌体,通过紫外光照射促进了携播性噬菌体及其载体菌在宿主菌生物膜上的定殖,从而强化噬菌体在高水力流态环境中控制生物膜生长的效果。使用本方法后,生物膜体系中噬菌体的含量显著提升,在生物膜生长成熟过程中起到对宿主菌的抑制作用。紫外照射强化了这个作用,降低了宿主菌生物膜的生长速度,同时对生物膜表面的组成和结构产生影响。因此,本方法对于在高水力流态环境中控制生物膜生长具有重要意义,有助于在污水处理、管网等系统中缓解因生物膜引发的膜生物污垢、管网损耗和病原菌传播等问题。
附图说明
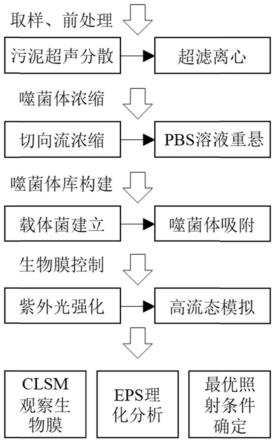
22.图1紫外强化携播性噬菌体控制高水力流态环境生物膜生长的流程图;
23.图2为实施例中最终构建的载体菌-携播噬菌体电镜图;
24.图3为实施例中有无紫外强化下携播性噬菌体对生物膜控制效果(clsm), (a)无
携播噬菌体组blank,(b)仅使用携播噬菌体组control group,(c)紫外强化携播噬菌体组experimental group控制生物膜的clsm拍照图;
25.图4为实施例中携播性噬菌体对成熟生物膜eps调控影响。
具体实施方式
26.下面结合附图和具体实施方式对本发明做进一步阐述和说明。本发明中各个实施方式的技术特征在没有相互冲突的前提下,均可进行相应组合。
27.本发明的发明构思是从活性污泥中筛选出具有携播性的噬菌体,可以通过被非宿主载体菌吸附来获得随载体菌进行定向迁移的能力,在高水力流态环境(如污水管网管道冲刷、膜生物反应器的清洗过程)中能够更精确地到达并定殖在目标菌生物膜,实现生物膜控制作用。另外,紫外光照能够以多种途径强化噬菌体控制生物膜生长的效果。在传统方法中,紫外光照通常作为成熟生物膜的控制手段,在物理层面破坏生物膜,往往需要持续的照射,消耗能量较大。而本发明中的紫外光照强化有别于传统方法,仅需要对初始的宿主细菌生物膜进行短时间照射,一方面通过破坏生物膜的表层结构,使载体菌和噬菌体更易于进入并获得更有利的生态位;另一方面,由于宿主菌与噬菌体的相互作用受到环境因素和非宿主生物的影响,在紫外光照的胁迫条件下,噬菌体与宿主之间的拮抗作用削弱,转而建立潜在的协同作用以对抗环境压力,从而提高生物膜中噬菌体浓度,从而有效控制环境宿主细菌生物膜生长。
28.本发明以强化携播性噬菌体在高水力流态环境中的生物膜控制作用为目标,从活性污泥中分离筛选出携播性噬菌体,通过非宿主载体菌的迁移作用定殖在生物膜上,使用紫外光照的手段强化了噬菌体的定殖率和对生物膜的控制效果。该方法主要包括以下步骤:(1)噬菌体前处理与浓缩;(2)噬菌体库构建与保存; (3)紫外光照诱发强化;(4)生物膜控制等步骤
29.如图1所示,该方法的具体实现方式如下:
30.s1:将活性污泥在超声和搅拌处理下进行分散,再进行泥水分离后,取上清液过滤除菌并提取含噬菌体的滤液,滤液经过切向流系统进一步浓缩富集,得到噬菌体富集液。
31.作为本发明实施例的一种优选方式,上述步骤s1的具体做法如下:将活性污泥在冰浴下交替进行超声震荡处理和磁力搅拌使得污泥充分分散,再通过自然沉降实现泥水分离后收集上清液,不断重复多次充分去除污泥颗粒和团聚体,保留最后一次泥水分离得到的上清液;将收集得到的上清液依次经过0.45μm和 0.22μm微孔滤膜过滤以去除污泥杂质和细菌,再用pbs溶液重悬后通过切向流浓缩系统进行浓缩,最后通过离心超滤进一步浓缩富集,得到噬菌体富集液。
32.作为本发明实施例的一种优选方式,上述超声震荡处理和磁力搅拌交替进行至少三轮。
33.s2:将能够吸附噬菌体的非宿主载体菌与所述噬菌体富集液混配并分散处理,待非宿主载体菌吸附噬菌体后,通过离心分离提取富集有携播性噬菌体和非宿主载体菌的沉淀部分,再对沉淀部分进行重悬后分散,再通过过滤去除非宿主载体菌,得到携播性噬菌体溶液。
34.作为本发明实施例的一种优选方式,上述s2的具体做法如下:将能够吸附噬菌体
的非宿主载体菌培养至指数生长期,然后取菌液与所述噬菌体富集液混合后超声分散均匀,再置于冷藏环境中使非宿主载体菌吸附噬菌体,吸附后的混合液通过逐级离心实现固液分离(该过程中没有吸附在载体菌上的噬菌体进入上清液,而吸附在载体菌上的噬菌体则进入沉淀中),离心完毕后去除上清液,向固体沉淀中加入pbs溶液重悬,再通过超声分散使噬菌体分散在pbs溶液中,最后过0.22μm滤膜后,非宿主载体菌被滤除,得到携播性噬菌体溶液。
35.需要说明的是,本发明中的非宿主载体菌并非指某种特定的菌种,其作用是作为增强噬菌体移动范围的载体细菌,因此只要能够使得噬菌体吸附在其表面进行移动即可。作为本发明实施例的一种优选方式,上述非宿主载体菌为具有能够使噬菌体吸附于鞭毛上的鞭毛菌,例如蜡样芽孢杆菌。当然,非宿主载体菌可以是单一的菌种,也可以是混合菌种,对此不做限制
36.作为本发明实施例的一种优选方式,上述非宿主载体菌可通过以下方式来制备:将活性污泥用pbs溶液稀释后涂布在lb琼脂平板培养基上过夜培养,然后选择平板上直径最大的若干菌落,在扫描电子显微镜下筛选能够吸附噬菌体的鞭毛细菌作为优势非宿主载体细菌。由于这种做法挑选的是平板上直径最大的若干菌落,因此表明这些菌落中的细菌具有运动性强、定殖效率高的特点,从中筛选出的鞭毛细菌即可用于吸附噬菌体。一般而言,可挑选平板上直径最大的3~5 个菌落,通过显微镜鉴定,将其中属于鞭毛细菌的菌落合并,作为非宿主载体细菌。
37.s3:将所述携播性噬菌体溶液重新与所述非宿主载体菌混合后加入定殖有宿主菌生物膜的水环境体系中进行培养,维持体系中处于高水力流态环境,使携播性噬菌体随非宿主载体菌迁移并定殖到宿主菌生物膜上,直至生物膜生长到成熟阶段;其中在培养初期,需对体系施加紫外光照进而强化携播性噬菌体和宿主菌的感染和定殖,其余时间无需施加紫外光照避光培养。
38.需要说明的是,本发明中的定殖有宿主菌生物膜的水环境体系具体形式不限,具体可根据实际的应用场景而定,如污水管网管道、膜生物反应器均可。在后续的实施例中,采用了一种模拟的水环境体系,宿主菌需要先定殖到特定的界面上,再模拟高水力流态环境下携播性噬菌体的迁移感染。
39.需要说明的是,本发明中的高水力流态环境以水力停留时间(hrt)为指标确定,即高水力流态环境为水力停留时间低于1分钟的水环境体系。对于一个流动室而言,可通过用蠕动泵泵入pbs缓冲液模拟高水力流态环境,通过改变恒定流速,在流动室内控制水力停留时间在1min以下。
40.需要说明的是,本发明中的培养初期为开始培养的前5~10分钟。
41.作为本发明实施例的一种优选方式,上述紫外光照通过uv灯管的辐照来实现。经过试验,确定的紫外光照的最佳照射方式为:通过波长为313~365nm、功率为5~20w的uv灯管对宿主菌生物膜施加紫外光照射,照射距离为5~10cm,照射位置对应光照强度为2.0~5.0mw/cm2,照射时间为5~10分钟。
42.在本发明的后续实施例中,培养使生物膜生长到成熟阶段后,可根据生物膜组成结构进行表征,评估噬菌体控制生物膜生长的效率。后续实施例中,使用 nikon a1-rsi clsm可视化生物膜结构;同时通过热提取法提取成熟的宿主菌生物膜的eps,以评估紫外照
射强化噬菌体控制宿主菌生物膜组成和结构的效果,确定最佳紫外光照强度和照射时间。
43.下面结合实验室条件下携播噬菌体筛选和紫外光照强化生物膜控制的具体实施例对本发明的实现过程和效果进行详细说明。
44.实施例
45.本实施例中,紫外强化携播性噬菌体控制高水力流态生物膜生长的方法具体包括以下步骤:
46.步骤1:污泥取样和上清液浓缩
47.取1l活性污泥在冰浴条件下进行预处理,交替进行超声处理和磁力搅拌充分分散(冰浴超声处理时间为5分钟,超声条件为30w,47khz,磁力搅拌转速条件为50rpm),分散完毕后自然沉降进行泥水分离并收集上清液;重复运行上述操作三次,以确保尽可能去除污泥颗粒和团聚体,保留最后一次泥水分离得到的上清液;将收集得到的上清液依次经过0.45μm和0.22μm微孔滤膜过滤,去除污泥杂质和细菌。之后,将过滤后的噬菌体溶液用pbs溶液补足至1l后通过切向流浓缩系统进一步浓缩至100ml,再经过离心超滤将噬菌体溶液浓缩至 25-30ml,得到噬菌体富集液。
48.步骤2:噬菌体库构建与保存
49.将污水处理系统中取得的活性污泥用pbs溶液稀释1000倍后,涂布在lb 琼脂培养基上,以过夜培养后平板上直径最大的3~5个大菌落作为运动性强、定殖效率高的待选菌落,并将各待选菌落在扫描电子显微镜下筛查选择鞭毛细菌菌落,将其中的鞭毛细菌菌落混合后作为优势非宿主载体细菌。
50.在lb琼脂培养基上筛选得到运动性强、定殖效率高的优势非宿主载体细菌后,将筛选得到的非宿主载体菌培养至指数生长期(od600为0.3~0.5),取2ml 菌液与污泥中浓缩得到的噬菌体富集液18ml混合超声分散均匀后置于4℃冰箱内8h,使非宿主载体菌吸附噬菌体。吸附后混合液于200
×
g、400
×
g、600
×
g、 800
×
g、1000
×
g逐级离心,离心时间分别为5min、5min、5min、5min、10min。离心完毕后,没有吸附在载体菌上的无携播能力噬菌体会处于上清液中,而吸附在载体菌上的噬菌体则处于离心沉淀中,此时用移液枪去除上清液,再加入pbs 溶液补足至10ml,轻轻振荡使沉淀重悬,超声分散使噬菌体从载体菌上脱离并分散在溶液中,过0.22μm滤膜后保存,滤除载体菌,得到携播性噬菌体溶液。
51.步骤3:紫外光照强化噬菌体定殖
52.将一张0.45μm的pvdf疏水滤膜放置在lb半琼脂培养基上作为生物膜生长的界面,滴加3ml宿主菌菌液在滤膜上,培养皿放置在20℃环境中培养一周使宿主菌生物膜在滤膜上生长。将滤膜放置在流动室(长
×
宽
×
高=2cm
×
2cm
×
3cm) 底部。将上述步骤2保存的携播性噬菌体溶液重新和培养至指数生长期的非宿主载体菌(od600为0.3~0.5)按1:1体积均匀混合形成载体菌-携播噬菌体,然后加入lb液体培养基使lb培养基浓度为0.1%,形成模拟用的混合液,再置于 4℃环境下吸附8h,通过蠕动泵向流动室内泵入上述混合液来模拟高水力流态环境下噬菌体携播与生物膜生长,蠕动泵恒定流速为20ml/min,对应的水力停留时间为0.6min,从而形成模拟所需的高水力流态。其中,在模拟运行开始的初期,需要通过波长为313nm、功率为5w的uv灯管对流动室施加紫外光照,照射距离为5cm,照射位置对应光照强度为2.0mw/cm2,照射时间为10min,照射10min 后即可停止紫外光照避光培养。
53.本实施例中最终构建的载体菌-携播噬菌体电镜图如图2所示。
54.另外,将以上实验记为实验组(experimental group)为了对比本发明的紫外光照和携播性噬菌体对于生物膜生长的影响,本实施例中设置了一个空白组 (blank)和一个对照组(control group)。其中空白组正常生长生物膜,不添加载体菌-噬菌体混合液,也不进行紫外光照射强化。对照组中,与上述实验组相比,区别在于不在模拟初期设置紫外光照射强化,全称采用避光培养。
55.步骤4:生物膜控制
56.对于上述三组实验,维持流动室内高水力流态环境使生物膜生长成熟。结束后,取出流动室的滤膜进行取样。通过激光共聚焦显微镜可视化生物膜结构,结果如图3所示。从图3中可发现,在紫外光照强化下,载体菌和携播性噬菌体在生物膜上的定殖率明显增加,生物膜的生长明显受到抑制,控制效果显著。通过热提取法提取成熟的宿主菌生物膜的eps,通过bca法定量分析蛋白含量,通过苯酚-硫酸法定量分析多糖含量,最终结果如图4所示,表明:对比未施加紫外光照强化的体系,紫外强化作用使成熟生物膜eps中蛋白含量显著下降,通过激光共聚焦显微镜拍照观察发现,在紫外光照强化作用下,成熟生物膜的形成厚度有明显减少。
57.以上所述的实施例只是本发明的一种较佳的方案,然其并非用以限制本发明。有关技术领域的普通技术人员,在不脱离本发明的精神和范围的情况下,还可以做出各种变化和变型。因此凡采取等同替换或等效变换的方式所获得的技术方案,均落在本发明的保护范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
