sars-cov-2抗体及其选择和使用方法
1.1.相关申请的交叉引用
2.本技术要求2020年5月17日提交的美国临时申请号63/026,121 的优先权,该申请的全部内容特此通过援引并入。
3.2.关于联邦资助的研究与开发的声明
4.本发明根据国防高级研究计划局(defense advanced researchprojects agency,darpa)授予的hr00 11-18-2-0001和国家过敏与 感染疾病研究所/国立卫生研究院(national institutes of allergy andinfection disease/national institutes of health)授予的hhs合同 75n93019c00074在政府支持下完成。政府享有本发明的某些权利。
5.3.联合研究协议各方的名称
6.出于35 u.s.c.103(c)(2)的目的,阿斯利康制药有限公司 (astrazeneca pharmaceuticals lp)与范德堡大学医学中心(vanderbiltuniversity medical center)之间就与抗covid抗体及其用途有关的发 明执行联合研究协议。
7.4.对以电子方式提交的序列表的引用
8.与本技术一起提交的ascii文本文件形式的以电子方式提交的 序列表(名称为2943-153pc01_sl_st25.txt;大小为40,379字节;且 创建日期为2021年5月11日)通过援引以其全文并入本文。
5.技术领域
9.本披露涉及与sars-cov-2的刺突蛋白特异性结合的抗体及其抗 原结合片段,以及制备、选择和使用这些抗体及其抗原结合片段的方
6.
背景技术:
10.已经出现了由严重急性呼吸道综合征冠状病毒2(sars-cov-2) 引起的冠状病毒2019(covid 19)大流行。sars-cov-2迅速在世 界范围内引起感染。该病毒的死亡率目前尚不确定,但全球病例数和 死亡数令人震惊:截至2020年5月,全球已确诊超过400万例且死 亡30万人。该病毒能够通过感染者咳嗽、打喷嚏或说话时从鼻子或 口腔排出的小飞沫在人与人之间传播。潜伏期(从暴露到症状发作的 时间)范围为0到24天,平均为3-5天,但是在恢复后的这段时间期 间可能具有传染性。大多数感染sars-cov-2的人在暴露11.5天内显 示出症状。症状包括发烧、咳嗽和呼吸困难。该病毒对患有2型糖尿 病、心脏病、慢性阻塞性肺病(copd)和/或肥胖症的高龄患者具有 更大的影响。大多数感染该病毒的患者具有轻度症状,但在一些患者 中,肺部感染很严重,导致严重的呼吸窘迫甚至死亡。
11.截至2020年5月,尚无获得批准的疫苗,也没有获得科学界和 医学界批准的具体治疗方法,但是正在研究几种疫苗和抗病毒方法。 例如,因为针对病毒表面刺突(s)糖蛋白的人单克隆抗体(mab) 介导对其他冠状病毒(包括sars-cov3-7和中东呼吸综合征68 (mers))的免疫,所以已经假设靶向sars-cov-2刺突蛋白的人 mab可能有望用于预防和治
疗sars-cov-2感染。基于该病毒如果传播到医疗保健系统较弱的国家可能产生的影响,世界卫生组织(who)已宣布该暴发为国际关注的突发公共卫生事件(pheic)。因此,迫切需要能够预防和治疗covid-19的药物。
7.
技术实现要素:
12.在本文提供的一些方面,与sars-cov-2的刺突蛋白(例如seqidno:63)特异性结合的抗体或其抗原结合片段与该刺突蛋白的包含氨基酸f486和/或n487(例如f486和n487)的表位结合。在一些方面,该抗体或其抗原结合片段竞争性抑制包含以下链的抗体与sars-cov-2的刺突蛋白的结合:(i)包含seqidno:39的氨基酸序列的可变重链(vh)和包含seqidno:40的氨基酸序列的可变轻链(vl);(ii)包含seqidno:31的氨基酸序列的可变重链(vh)和包含seqidno:32的氨基酸序列的可变轻链(vl);(iii)包含seqidno:47的氨基酸序列的可变重链(vh)和包含seqidno:48的氨基酸序列的可变轻链(vl);或(iv)包含seqidno:61的氨基酸序列的可变重链(vh)和包含seqidno:62的氨基酸序列的可变轻链(vl)。在一些方面,该抗体或其抗原结合片段和包含以下链的抗体与sars-cov-2的刺突蛋白的相同表位结合:(i)包含seqidno:39的氨基酸序列的可变重链(vh)和包含seqidno:40的氨基酸序列的可变轻链(vl);(ii)包含seqidno:31的氨基酸序列的可变重链(vh)和包含seqidno:32的氨基酸序列的可变轻链(vl);(iii)包含seqidno:47的氨基酸序列的可变重链(vh)和包含seqidno:48的氨基酸序列的可变轻链(vl);或(iv)包含seqidno:61的氨基酸序列的可变重链(vh)和包含seqidno:62的氨基酸序列的可变轻链(vl)。在一些方面,该抗体或其抗原结合片段含有(i)包含seqidno:39的氨基酸序列的可变重链(vh)和包含seqidno:40的氨基酸序列的可变轻链(vl);(ii)包含seqidno:31的氨基酸序列的可变重链(vh)和包含seqidno:32的氨基酸序列的可变轻链(vl);(iii)包含seqidno:47的氨基酸序列的可变重链(vh)和包含seqidno:48的氨基酸序列的可变轻链(vl);或(iv)包含seqidno:61的氨基酸序列的可变重链(vh)和包含seqidno:62的氨基酸序列的可变轻链(vl)。在一些方面,该抗体或其抗原结合片段包含分别具有seqidno:41-46或分别具有seqidno:55-60的vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3。在一些方面,该抗体或其抗原结合片段包含seqidno:47的vh和/或seqidno:48的vl,或包含seqidno:61的vh和/或seqidno:62的vl。在一些方面,该抗体或其抗原结合片段包含seqidno:61的vh和/或seqidno:62的vl。
13.在本文提供的一些方面,与sars-cov-2的刺突蛋白特异性结合的抗体或其抗原结合片段与该刺突蛋白的包含氨基酸g447和/或k444(例如g447和k444)的表位结合。在一些方面,该抗体或其抗原结合片段竞争性抑制包含以下链的抗体与sars-cov-2的刺突蛋白的结合:(i)包含seqidno:15的氨基酸序列的可变重链(vh)和包含seqidno:16的氨基酸序列的可变轻链(vl);或(ii)包含seqidno:23的氨基酸序列的可变重链(vh)和包含seqidno:24的氨基酸序列的可变轻链(vl)。在一些方面,该抗体或其抗原结合片段含有(i)包含seqidno:15的氨基酸序列的可变重链(vh)和包含seqidno:16的氨基酸序列的可变轻链(vl);或(ii)包含seqidno:23的氨基酸序列的可变重链(vh)和包含seqidno:24的氨基酸序列的可变轻链(vl)。在一些方面,该抗体或其抗原结合片段和包含以下链的抗体与sars-cov-2的刺突蛋白的相同表位结合:(i)包含seqidno:15的氨
基酸序列的可变重链(vh)和包含 seq id no:16的氨基酸序列的可变轻链(vl);或(ii)包含seq idno:23的氨基酸序列的可变重链(vh)和包含seq id no:24的氨基 酸序列的可变轻链(vl)。在一些方面,该抗体或其抗原结合片段含 有(i)包含seq id no:15的氨基酸序列的可变重链(vh)和包含 seq id no:16的氨基酸序列的可变轻链(vl);或(ii)包含seq idno:23的氨基酸序列的可变重链(vh)和包含seq id no:24的氨基 酸序列的可变轻链(vl)。
14.在一些方面,该抗体或其抗原结合片段与sars-cov交叉反应。 在一些方面,该抗体或其抗原结合片段不与sars-cov交叉反应。
15.在一些方面,该抗体或抗原结合片段抑制sars-cov-2与血管紧 张素转化酶2(ace2)的结合。
16.在一些方面,该抗体或抗原结合片段中和sars-cov-2。
17.在一些方面,该抗体或抗原结合片段是全人的。在一些方面,该 抗体或抗原结合片段是人源化的。
18.在一些方面,该抗体或抗原结合片段包含重链恒定区。在一些方 面,该重链恒定区选自由人免疫球蛋白igg1、igg2、igg3、igg4、iga1 和iga2重链恒定区组成的组,任选地其中该重链恒定区是人igg1。 在一些方面,该抗体或抗原结合片段包含轻链恒定区。在一些方面, 该轻链恒定区选自由人免疫球蛋白iggκ和iggλ轻链恒定区组成的 组,任选地其中该轻链恒定区是人iggκ轻链恒定区。在一些方面, 该抗体或抗原结合片段包含(i)人igg1重链恒定区和(ii)人iggκ轻 链恒定区。在一些方面,该抗体或抗原结合片段进一步包含:含有 yte突变的重链恒定区,任选地其中该人重链恒定区是人igg1重链 恒定区;和轻链恒定区,任选地其中该轻链恒定区是人iggκ轻链恒 定区。在一些方面,该抗体或抗原结合片段进一步包含:含有tm突 变的重链恒定区,任选地其中该重链恒定区是人igg1重链恒定区; 和轻链恒定区,任选地其中该轻链恒定区是人iggκ轻链恒定区。
19.在一些方面,该抗体或抗原结合片段是全长抗体。在一些方面, 该抗体或抗原结合片段是抗原结合片段。在一些方面,该抗原结合片 段包括fab、fab
′
、f(ab
′
)2、单链fv(scfv)、二硫键连接的fv、v-nar 结构域、ignar、iggδch2、微型抗体(minibody)、f(ab
′
)3、四链抗 体(tetrabody)、三链抗体(triabody)、双链抗体(diabody)、单结 构域抗体、(scfv)2或scfv-fc。
20.在一些方面,该抗体或抗原结合片段是分离的。在一些方面,该 抗体或抗原结合片段是单克隆的。在一些方面,该抗体或抗原结合片 段是重组的。
21.在一些方面,该抗体或其抗原结合片段进一步包含可检测标记。
22.在本文提供的一些方面,分离的多核苷酸包含编码本文提供的抗 体或其抗原结合片段的重链可变区的核酸分子和/或编码本文提供的 抗体或其抗原结合片段的轻链可变区的核酸分子。
23.在本文提供的一些方面,分离的载体包含本文提供的多核苷酸。
24.在本文提供的一些方面,宿主细胞包含本文提供的多核苷酸、本 文提供的载体或包含编码本文提供的抗体或其抗原结合片段的重链 可变区的核酸分子的第一载体和包含编码本文提供的抗体或其抗原 结合片段的轻链可变区的核酸分子的第二载体。
25.在本文提供的一些方面,产生与sars-cov-2的刺突蛋白结合的 抗体或其抗原结
合片段的方法包括培养本文提供的宿主细胞,使得该 核酸分子表达并且产生该抗体或其抗原结合片段。在一些方面,该方 法进一步包括分离该抗体或抗原结合片段。
26.在本文提供的一些方面,通过本文提供的方法产生抗体或其抗原 结合片段。
27.在本文提供的一些方面,选择抗体或其抗原结合片段的方法包括 确定该抗体或其抗原结合片段与sars-cov-2的刺突蛋白的包含氨基 酸f486和/或n487(例如f486和n487)的表位结合,以及选择该抗 体或其抗原结合片段。在一些方面,该确定包括测量该抗体或其抗原 结合片段与包含f486a和/或n487的sars-cov-2突变体刺突蛋白结 合的能力,并且如果该抗体或其抗原结合片段与该突变体蛋白结合, 则不选择该抗体或其抗原结合片段。在一些方面,该确定包括测量该 抗体或其抗原结合片段与包含f486a和/或n487a(例如f486a和 n487a)的sars-cov-2突变体刺突蛋白结合的能力,并且如果该抗 体或其抗原结合片段与该突变体蛋白结合,则不选择该抗体或其抗原 结合片段。如贯穿本披露所用,“选择抗体或其抗原结合片段的方法
”ꢀ
可用于选择用于在以下任一项中使用的抗体或其抗原结合片段:(i)抑 制sars-cov-2与ace2的结合;(ii)用于中和sars-cov-2的方法; (iii)治疗或预防sars-cov-2感染的方法;(iv)降低感染了 sars-cov-2的受试者中的病毒载量的方法;(v)用于检测样品中的sars-cov-2的方法。
28.在本文提供的一些方面,通过本文提供的方法选择抗体或其抗原 结合片段。
29.在本文提供的一些方面,选择抗体或其抗原结合片段的方法包括 确定该抗体或其抗原结合片段与sars-cov-2的刺突蛋白的包含氨基 酸g447和/或k444(例如g447和k444)的表位结合,以及选择该 抗体或其抗原结合片段。在一些方面,该确定包括测量该抗体或其抗 原结合片段与包含g447r和/或k444(例如g447r和k444)的 sars-cov-2突变体刺突蛋白结合的能力,并且如果该抗体或其抗原 结合片段与该突变体蛋白结合,则不选择该抗体或其抗原结合片段。 在一些方面,该确定包括测量该抗体或其抗原结合片段与包含g447r 和/或k444a(例如g447r和k444a)的sars-cov-2突变体刺突蛋 白结合的能力,并且如果该抗体或其抗原结合片段与该突变体蛋白结 合,则不选择该抗体或其抗原结合片段。
30.在本文提供的一些方面,通过本文提供的方法选择抗体或其抗原 结合片段。
31.在本文提供的一些方面,组合物包含本文提供的抗体或其抗原结 合片段。在一些方面,该组合物是进一步包含药学上可接受的赋形剂 的药物组合物。
32.在本文提供的一些方面,组合物包含(i)与sars-cov-2的刺突 蛋白特异性结合的第一抗体或其抗原结合片段,其中该第一抗体或其 抗原结合片段与sars-cov-2的刺突蛋白的受体结合结构域(rbd) 的ace2界面特异性结合,和(ii)与sars-cov-2的刺突蛋白特异性 结合的第二抗体或其抗原结合片段,其中该第二抗体或其抗原结合片 段与该刺突蛋白的rbd的顶端结构域特异性结合。
33.在本文提供的一些方面,组合物包含(i)与sars-cov-2的刺突 蛋白特异性结合的第一抗体或其抗原结合片段,其中该第一抗体或其 抗原结合片段与该刺突蛋白的包含f486和/或n487(例如f486和n487)的表位特异性结合,和(ii)与sars-cov-2的刺突蛋白特异 性结合的第二抗体或其抗原结合片段,其中该第二抗体或其抗原结合 片段与该刺突蛋白的包含g447和/或k444(例如g447和k444)的 表位特异性结合。
34.在一些方面,该第一抗体或其抗原结合片段和该第二抗体或其抗 原结合片段与非重叠表位结合和/或其中该第一抗体或其抗原结合片 段和该第二抗体或其抗原结合片
段可以同时与sars-cov-2刺突结构 域的三聚体结合。
35.在一些方面,第一抗体或其抗原结合片段是本文提供的抗体或其 抗原结合片段,和/或第二抗体或其抗原结合片段是本文提供的抗体或 其抗原结合片段。
36.在一些方面,该组合物是进一步包含药学上可接受的载剂的药物 组合物。
37.在本文提供的一些方面,选择用于在sars-cov-2感染的治疗或 预防中使用的抗体或其抗原结合片段的组合的方法包括确定第一抗 体或其抗原结合片段与sars-cov-2的刺突蛋白的包含氨基酸f486 和/或n487(例如f486和n487)的表位结合,确定第二抗体或其抗 原结合片段与sars-cov-2的刺突蛋白的包含氨基酸g447和/或k444 (例如g447和k444)的表位结合,以及选择这两种抗体或其抗原结 合片段。在一些方面,该确定包括测量该第一抗体或其抗原结合片段 与包含f486a和/或n487a的sars-cov-2突变体刺突蛋白结合的能 力和/或测量该第二抗体或其抗原结合片段与包含g447r和/或k444a 的sars-cov-2突变体刺突蛋白结合的能力,并且如果该抗体或其抗 原结合片段与该突变体蛋白结合,则不选择该抗体或其抗原结合片 段。
38.在本文提供的一些方面,组合物包含通过本文提供的方法选择的 抗体或其抗原结合片段的组合。
39.在本文提供的一些方面,抑制sars-cov-2与ace2结合的方法 包括使sars-cov-2与本文提供的抗体或抗原结合片段或组合物接 触。还提供了涉及本文提供的所述抗体或抗原结合片段或组合物的相 应方面,所述抗体或抗原结合片段或组合物用于在所述抑制 sars-cov-2与ace2结合的方法中使用。
40.在本文提供的一些方面,抑制sars-cov-2与ace2结合的方法 包括使该sars-cov-2与以下物质接触:(i)与sars-cov-2的刺突 蛋白特异性结合的第一抗体或其抗原结合片段,其中该第一抗体或其 抗原结合片段与sars-cov-2的刺突蛋白的受体结合结构域(rbd) 的ace2界面特异性结合,和(ii)与sars-cov-2的刺突蛋白特异性 结合的第二抗体或其抗原结合片段,其中该第二抗体或其抗原结合片 段与该刺突蛋白的rbd的顶端结构域特异性结合。还提供了涉及所 述第一和所述第二抗体或抗原结合片段的相应方面,所述第一和所述 第二抗体或抗原结合片段用于在所述抑制sars-cov-2与ace2结合 的方法中使用。
41.在本文提供的一些方面,抑制sars-cov-2与ace2结合的方法 包括使该sars-cov-2与以下物质接触:(i)与sars-cov-2的刺突 蛋白特异性结合的第一抗体或其抗原结合片段,其中该第一抗体或其 抗原结合片段与该刺突蛋白的包含f486和/或n487(例如f486和 n487)的表位特异性结合,和(ii)与sars-cov-2的刺突蛋白特异 性结合的第二抗体或其抗原结合片段,其中该第二抗体或其抗原结合 片段与该刺突蛋白的包含g447和/或k444(例如g447和k444)的 表位特异性结合。还提供了涉及所述第一和所述第二抗体或抗原结合 片段的相应方面,所述第一和所述第二抗体或抗原结合片段用于在所 述抑制sars-cov-2与ace2结合的方法中使用。
42.在本文提供的一些方面,中和sars-cov-2的方法包括使 sars-cov-2与本文提供的抗体或抗原结合片段或组合物接触。还提 供了涉及本文提供的所述抗体或抗原结合片段或组合物的相应方面, 所述抗体或抗原结合片段或组合物用于在所述中和sars-cov-2的方 法中使用。
43.在本文提供的一些方面,中和sars-cov-2的方法包括使该 sars-cov-2与以下物
质接触:(i)与sars-cov-2的刺突蛋白特异性 结合的第一抗体或其抗原结合片段,其中该第一抗体或其抗原结合片 段与sars-cov-2的刺突蛋白的受体结合结构域(rbd)的ace2界 面特异性结合,和(ii)与sars-cov-2的刺突蛋白特异性结合的第二 抗体或其抗原结合片段,其中该第二抗体或其抗原结合片段与该刺突 蛋白的rbd的顶端结构域特异性结合。还提供了涉及所述第一和所 述第二抗体或抗原结合片段的相应方面,所述第一和所述第二抗体或 抗原结合片段用于在所述中和sars-cov-2的方法中使用。
44.在本文提供的一些方面,中和sars-cov-2的方法包括使该 sars-cov-2与以下物质接触:(i)与sars-cov-2的刺突蛋白特异性 结合的第一抗体或其抗原结合片段,其中该第一抗体或其抗原结合片 段与该刺突蛋白的包含f486和/或n487(例如f486和n487)的表位 特异性结合,和(ii)与sars-cov-2的刺突蛋白特异性结合的第二抗 体或其抗原结合片段,其中该第二抗体或其抗原结合片段与该刺突蛋 白的包含g447和/或k444(例如g447和k444)的表位特异性结合。 还提供了涉及所述第一和所述第二抗体或抗原结合片段的相应方面, 所述第一和所述第二抗体或抗原结合片段用于在所述中和 sars-cov-2的方法中使用。
45.在一些方面,该接触是在体外的。在一些方面,该接触是在受试 者体内的。
46.在本文提供的一些方面,治疗或预防受试者中的sars-cov-2感 染的方法包括向受试者施用有效量的本文提供的抗体或抗原结合片 段或组合物。还提供了涉及本文提供的所述抗体或抗原结合片段或组 合物的相应方面,所述抗体或抗原结合片段或组合物用于在所述治疗 或预防sars-cov-2感染的方法中使用。
47.在本文提供的一些方面,治疗或预防受试者中的sars-cov-2感 染的方法包括向该受试者施用:(i)与sars-cov-2的刺突蛋白特异 性结合的第一抗体或其抗原结合片段,其中该第一抗体或其抗原结合 片段与sars-cov-2的刺突蛋白的受体结合结构域(rbd)的ace2 界面特异性结合,和(ii)与sars-cov-2的刺突蛋白特异性结合的第 二抗体或其抗原结合片段,其中该第二抗体或其抗原结合片段与该刺 突蛋白的rbd的顶端结构域特异性结合。还提供了涉及所述第一和 所述第二抗体或抗原结合片段的相应方面,所述第一和所述第二抗体 或抗原结合片段用于在所述治疗或预防sars-cov-2感染的方法中使 用。
48.在本文提供的一些方面,治疗或预防受试者中的sars-cov-2感 染的方法包括向该受试者施用:(i)与sars-cov-2的刺突蛋白特异 性结合的第一抗体或其抗原结合片段,其中该第一抗体或其抗原结合 片段与该刺突蛋白的包含f486和/或n487(例如f486和n487)的表 位特异性结合,和(ii)与sars-cov-2的刺突蛋白特异性结合的第二 抗体或其抗原结合片段,其中该第二抗体或其抗原结合片段与该刺突 蛋白的包含g447和/或k444(例如g447和k444)的表位特异性结 合。还提供了涉及所述第一和所述第二抗体或抗原结合片段的相应方 面,所述第一和所述第二抗体或抗原结合片段用于在所述治疗或预防 sars-cov-2感染的方法中使用。
49.在本文提供的一些方面,降低感染了sars-cov-2的受试者中的 病毒载量的方法包括向受试者施用有效量的本文提供的抗体或抗原 结合片段或组合物。还提供了涉及本文提供的所述抗体或抗原结合片 段或组合物的相应方面,所述抗体或抗原结合片段或组合物用于在所 述降低感染了sars-cov-2的受试者中的病毒载量的方法中使用。
50.在本文提供的一些方面,降低感染了sars-cov-2的受试者中的 病毒载量的方法
包括向该受试者施用:(i)与sars-cov-2的刺突蛋 白特异性结合的第一抗体或其抗原结合片段,其中该第一抗体或其抗 原结合片段与sars-cov-2的刺突蛋白的受体结合结构域(rbd)的ace2界面特异性结合,和(ii)与sars-cov-2的刺突蛋白特异性结 合的第二抗体或其抗原结合片段,其中该第二抗体或其抗原结合片段 与该刺突蛋白的rbd的顶端结构域特异性结合。还提供了涉及所述 第一和所述第二抗体或抗原结合片段的相应方面,所述第一和所述第 二抗体或抗原结合片段用于在所述降低感染了sars-cov-2的受试者 中的病毒载量的方法中使用。
51.在本文提供的一些方面,降低感染了sars-cov-2的受试者中的 病毒载量的方法包括向该受试者施用:(i)与sars-cov-2的刺突蛋 白特异性结合的第一抗体或其抗原结合片段,其中该第一抗体或其抗 原结合片段与该刺突蛋白的包含f486和/或n487(例如f486和n487) 的表位特异性结合,和(ii)与sars-cov-2的刺突蛋白特异性结合的 第二抗体或其抗原结合片段,其中该第二抗体或其抗原结合片段与该 刺突蛋白的包含g447和/或k444(例如g447和k444)的表位特异 性结合。还提供了涉及所述第一和所述第二抗体或抗原结合片段的相 应方面,所述第一和所述第二抗体或抗原结合片段用于在所述降低感 染了sars-cov-2的受试者中的病毒载量的方法中使用。
52.在一些方面,该第一抗体或其抗原结合片段和该第二抗体或其抗 原结合片段与非重叠表位结合和/或其中该第一抗体或其抗原结合片 段和该第二抗体或其抗原结合片段可以同时与sars-cov-2刺突结构 域的三聚体结合。在一些方面,第一抗体或其抗原结合片段和/或第二 抗体或其抗原结合片段是本文提供的抗体或其抗原结合片段。
53.在一些方面,该第一抗体或其抗原结合片段和该第二抗体或其抗 原结合片段同时施用。在一些方面,该第一抗体或其抗原结合片段和 该第二抗体或其抗原结合片段在分开的药物组合物中施用。在一些方 面,该第一抗体或其抗原结合片段和该第二抗体或其抗原结合片段依 序施用。
54.在一些方面,该受试者已暴露于sars-cov-2或处于暴露于 sars-cov-2的风险中。在一些方面,该受试者是人。
55.在一些方面,检测样品(例如,获得自受试者的分离样品)中的 sars-cov-2的方法(例如,体外方法)包括使该样品与本文提供的 抗体或其抗原结合片段或组合物接触。合适的样品的实例包括鼻咽样 品(例如,拭子样品)和唾液样品。样品可以是获得自受试者(例如, 人)的分离样品。
56.在一些方面,试剂盒包含本文提供的抗体或其抗原结合片段或组 合物,以及a)检测试剂,b)sars-cov-2刺突蛋白抗原,c)反映批 准使用或销售供人类施用的公告,或d)它们的组合。
8.附图说明
57.图1示出了各种抗体在中和野生型sars-cov-2(左)和假病毒 (右)方面的效力。
58.图2示出了假病毒与野生型sars-cov-2中和测定之间的相关 性。
59.图3示出了各种抗体与sars-cov-2的刺突蛋白的rbd(左) 和sars-cov-2的刺突蛋白的三聚体(右)结合的能力。
60.图4汇总了各种抗体组合中和假病毒的效力。
61.图5a和图5b示出了各种浓度的2196抗体和2130抗体的组合 (图5a)以及2196抗体和2096抗体的组合(图5b)的协同作用。 方框指示协同作用最大的区域。
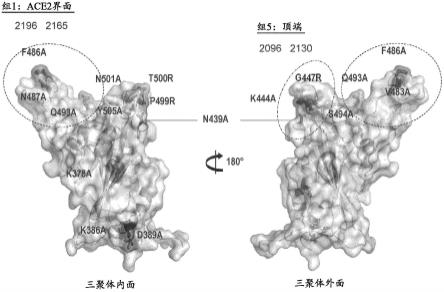
62.图6a-图6e示出了鉴定sars-cov-2刺突蛋白中2615(图6a)、 2130(图6b)、2094(图6c)、2196(图6d)和2096(图6e)抗 体的结合位点的突变扫描分析的结果。
63.图7示出了鉴定sars-cov-2刺突蛋白中ace2界面处的抗体结 合位点(组(bin)1抗体)的突变扫描分析的结果。
64.图8示出了鉴定sars-cov-2刺突蛋白中组4(2094)和组5(2096 和2130)抗体的结合位点的突变扫描分析的结果。
65.图9示出了sars-cov-2刺突蛋白的三聚体的三维结构并突出显 示了三聚体中与抗体接触的残基。
9.具体实施方式
66.本文提供了与sars-cov-2的刺突蛋白特异性结合的抗体(例如, 单克隆抗体)及其抗原结合片段,以及制备、选择和使用这些抗体及 其抗原结合片段的方法。sars-cov-2(例如,具有ncbi参考号: nc_045512的序列)也可称为“导致covid-19的冠状病毒株”,并 且可以与术语“2019新型冠状病毒”(2019-ncov)和“2019人类冠 状病毒”(hcov-19或hcov-19)互换使用。
67.9.1术语
68.术语“抗体”意指通过免疫球蛋白分子的可变区中的至少一个抗 原识别位点识别并特异性结合靶标(诸如蛋白质、多肽、肽、碳水化 合物、多核苷酸、脂质或前述的组合)的免疫球蛋白分子。如本文所 用,术语“抗体”涵盖完整多克隆抗体、完整单克隆抗体、嵌合抗体、 人源化抗体、人抗体、包含抗体的融合蛋白、以及任何其他修饰的免 疫球蛋白分子,只要这些抗体展现出所希望的生物活性即可。抗体可 以是以下五大类免疫球蛋白中的任一种:iga、igd、ige、igg和igm, 或其亚类(同种型)(例如igg1、igg2、igg3、igg4、iga1和iga2), 基于它们的重链恒定域的特性分别被称为α、δ、ε、γ和μ。不同类别 的免疫球蛋白具有不同的和熟知的亚基结构和三维构型。抗体可以是 裸的或缀合至其他分子如毒素、放射性同位素等等。
69.术语“抗体片段”是指完整抗体的一部分。“抗原结合片段”、
ꢀ“
抗原结合结构域”或“抗原结合区”是指与抗原结合的完整抗体的 一部分。抗原结合片段可以含有完整抗体的抗原决定区(例如,互补 决定区(cdr))。抗体的抗原结合片段的实例包括但不限于fab、 fab
′
、f(ab
′
)2和fv片段、线性抗体和单链抗体。抗体的抗原结合片段 可以源自任何动物物种,诸如啮齿动物(例如,小鼠、大鼠或仓鼠) 和人,或者可以人工产生。
70.术语“抗sar2-cov-2刺突蛋白抗体”、“sars-cov-2刺突蛋 白抗体”和“与sars-cov-2刺突蛋白结合的抗体”在本文中可以互 换用于指能够以足够的亲和力与sars-cov-2刺突蛋白结合的抗体, 使得该抗体可在靶向sars-cov-2中用作诊断剂和/或治疗剂。例如使 用fortebio或biacore所测量的,sars-cov-2刺突蛋白抗体与不相 关的非sars-cov-2刺突蛋白的结合程度可以小于该抗体与 sars-cov-2刺突蛋白的结合程度的约10%。在本文提供的一些方面, sars-cov-2刺突蛋白抗体也能够与sars-1的刺突蛋白结合。在本 文提供的一些方面,sars-cov-2刺突蛋白抗体不与sars-1的刺突 蛋白结合。
[0071]“单克隆”抗体或其抗原结合片段是指涉及单一抗原决定簇或表 位的高度特异性识别和结合的同源抗体或其抗原结合片段群。这与典 型地包括针对不同抗原决定簇的不同抗体的多克隆抗体相反。术语
ꢀ“
单克隆”抗体或其抗原结合片段涵盖完整和全长单克隆抗体以及抗 体片段(诸如fab、fab
′
、f(ab
′
)2、fv)、单链(scfv)突变体、包含 抗体部分的融合蛋白和包含抗原识别位点的任何其他修饰的免疫球 蛋白分子。此外,“单克隆”抗体或其抗原结合片段是指以任何数目 的方式(包括但不限于通过杂交瘤、噬菌体选择、重组表达和转基因 动物)制备的此类抗体及其抗原结合片段。
[0072]
如本文所用,术语“可变区”或“可变结构域”可互换使用并且 在本领域中是常见的。可变区通常是指抗体的一部分,通常是轻链或 重链的一部分,通常是成熟重链中氨基端约110至120个氨基酸或110 至125个氨基酸以及成熟轻链中约90至115个氨基酸,该部分在抗 体之间的序列广泛不同并且用于特定抗体对其特定抗原的结合和特 异性。序列的变异性集中在称为互补决定区(cdr)的那些区域中, 而可变结构域中保守性更高的区域称为框架区(fr)。不希望受任何 特定机制或理论的束缚,据信轻链和重链的cdr主要负责抗体与抗 原的相互作用和特异性。在一些方面,可变区是人可变区。在一些方 面,可变区包含啮齿动物或鼠类cdr和人框架区(fr)。在一些方 面,可变区是灵长类(例如,非人灵长类)可变区。在一些方面,可 变区包含啮齿动物或鼠类cdr和灵长类(例如,非人灵长类)框架 区(fr)。
[0073]
如本文所用,术语“互补决定区”或“cdr”是指抗体可变结构 域中在序列上是高变的和/或形成结构上限定的环(高变环)和/或含 有与抗原接触的残基的每个区域。抗体可包含六个cdr,例如vh中 的三个和vl中的三个。
[0074]
术语“vl”和“vl结构域”可互换用于指抗体的轻链可变区。
[0075]
术语“vh”和“vh结构域”可互换用于指抗体的重链可变区。
[0076]
术语“卡巴特(kabat)编号”和类似术语在本领域中是公认的 并且是指对抗体或其抗原结合片段的重链和轻链可变区中的氨基酸 残基进行编号的系统。在一些方面,可以根据卡巴特编号系统来确定 cdr(参见例如kabat ea和wu tt(1971)ann ny acad sci[纽约科 学院年鉴]190:382-391以及kabat ea等人,(1991)sequences ofproteins of immunological interest[免疫学相关蛋白序列],第五版,美 国卫生与公共服务部(u.s.department of health and human services), nih公开号91-3242)。使用卡巴特编号系统,抗体重链分子内的cdr 通常存在于氨基酸位置31至35(任选地可包括35位之后的一个或两 个附加氨基酸(在卡巴特编号方案中称为35a和35b))(cdr1)、 氨基酸位置50至65(cdr2)和氨基酸位置95至102(cdr3)。使 用卡巴特编号系统,抗体轻链分子内的cdr通常存在于氨基酸位置 24至34(cdr1)、氨基酸位置50至56(cdr2)和氨基酸位置89 至97(cdr3)。
[0077]
相反,乔西亚(chothia)是指结构环的位置(chothia和lesk,j. mol.biol.[分子生物学杂志]196:901-917(1987))。乔西亚cdr-h1 环的末端在利用卡巴特编号惯例编号时在h32与h34之间变化,这取 决于环的长度(这是因为卡巴特编号方案将插入放在h35a和h35b 处;如果35a和35b都不存在,那么环端点在32;如果只存在35a, 那么环端点在33;如果35a和35b都存在,那么环端点在34)。abm 高变区表示卡巴特cdr和乔西亚结构环之间的折衷,并且被牛津分 子(oxford molecular)abm抗体建模软件使用。
[0078][0079]
如本文所用,术语“恒定区”或“恒定结构域”是可互换的并且 具有其在本领域中常见的含义。恒定区是抗体的一部分,例如轻链和 /或重链的羧基端部分,该部分不直接涉及抗体与抗原的结合,但是可 以表现出各种效应子功能,诸如与fc受体的相互作用。相对于免疫 球蛋白可变结构域,免疫球蛋白分子的恒定区通常具有更保守的氨基 酸序列。在一些方面,抗体或抗原结合片段包含对于抗体依赖性细胞 介导的细胞毒性(adcc)而言足够的恒定区或其一部分。
[0080]
如本文所用,术语“重链”在用于指抗体时可以基于恒定结构域 的氨基酸序列指任何不同的类型,例如alpha(α)、delta(δ)、epsilon (ε)、gamma(γ)和mu(μ),分别产生iga、igd、ige、igg和 igm类抗体,包括igg亚类,例如igg1、igg2、igg3和igg4。重链 氨基酸序列是本领域熟知的。在一些方面,重链是人重链。
[0081]
如本文所用,术语“轻链”在用于指抗体时可以基于恒定结构域 的氨基酸序列指任何不同的类型,例如,kappa(κ)或lambda(λ)。 轻链氨基酸序列是本领域熟知的。在一些方面,轻链是人轻链。
[0082]
术语“嵌合”抗体或其抗原结合片段是指其中氨基酸序列源自两 个或更多个物种的抗体或其抗原结合片段。典型地,轻链和重链的可 变区对应于源自具有所需特异性、亲和力和能力的一个物种的哺乳动 物(例如小鼠、大鼠、兔等)的抗体或其抗原结合片段的可变区,而 恒定区同源于源自另一物种(通常为人)的抗体或其抗原结合片段中 的序列,以避免在该物种中引起免疫应答。
[0083]
术语“人源化”抗体或其抗原结合片段是指非人(例如鼠类)抗 体或其抗原结合片段的形式,这些形式是含有最少的非人(例如,鼠 类)序列的特异性免疫球蛋白链、嵌合免疫球蛋白或其片段。典型地, 人源化抗体或其抗原结合片段是人免疫球蛋白,其中来自互补决定区 (cdr)的残基被来自非人物种(例如,小鼠、大鼠、兔子或仓鼠) 的cdr的具有所希望特异性、亲和性和能力的残基替代(“cdr移 植”)(jones等人,nature[自然],321:522-525(1986);riechmann等 人,nature[自然]332:323-327(1988);verhoeyen等人,science[科学] 239:1534-1536(1988))。在一些情况下,人免疫球蛋白的fv框架区 (fr)残基被来自非人物种的具有所希望特异性、亲和性和能力的抗 体或片段中的相应残基置换。人源化抗体或其抗原结合片段可以通过 取代fv框架区中和/或置换的非人残基内另外的残基来进一步修饰, 以改进和优化抗体或其抗原结合片段特异性、亲和力和/或能力。通常, 人源
化抗体或其抗原结合片段将包含基本上所有至少一个(并且典型地两个或三个)可变结构域,该可变结构域包含对应于非人免疫球蛋白的所有或基本上所有cdr区,而所有或基本上所有fr区是人免疫球蛋白共有序列的那些。人源化抗体或其抗原结合片段还可以包含免疫球蛋白恒定区或结构域(fc),典型地是人免疫球蛋白的恒定区或结构域的至少一部分。用于产生人源化抗体的方法的实例描述于美国专利5,225,539;roguska等人,proc.natl.acad.sci.[美国国家科学院院刊]usa,91(3):969-973(1994);以及roguska等人,proteineng.[蛋白质工程]9(10):895-904(1996)。在一些方面,“人源化抗体”是表面重整抗体(resurfacedantibody)。
[0084]
术语“人”抗体或其抗原结合片段意指具有源自人免疫球蛋白基因座的氨基酸序列的抗体或其抗原结合片段,其中这种抗体或其抗原结合片段是使用本领域已知的任何技术制备的。人抗体或其抗原结合片段的这一定义包括完整抗体或全长抗体及其片段。
[0085]“结合亲和力”通常是指分子(例如抗体或其抗原结合片段)的单个结合位点与其结合配偶体(例如抗原)之间的非共价相互作用的总和的强度。除非另有说明,如本文所用,“结合亲和力”是指反映结合对的成员(例如抗体或其抗原结合片段和抗原)之间的1∶1相互作用的固有结合亲和力。分子x对其配偶体y的亲和力通常可以用解离常数(kd)表示。亲和力可以以本领域中已知的多种方式测量和/或表示,包括但不限于平衡解离常数(kd)和平衡缔合常数(ka)。kd是根据k
off
/k
on
的商计算的,而ka是根据k
on
/k
off
的商计算的。k
on
是指例如抗体或其抗原结合片段与抗原的缔合速率常数,而k
off
是指例如抗体或其抗原结合片段与抗原的解离。k
on
和k
off
可以通过本领域普通技术人员已知的技术来测定,诸如或kinexa。
[0086]
如本文所用,“表位”是本领域中的术语并且是指抗原中抗体或其抗原结合片段可以特异性结合的局部区域。表位可以是例如多肽的连续氨基酸(线性或连续表位),或者表位可以例如一起来自一个或多个多肽的两个或更多个非连续区域(构象性、非线性、不连续或非连续的表位)。在一些方面,抗体或其抗原结合片段结合的表位可以通过例如nmr光谱法、x射线衍射晶体学研究、elisa测定法、氢/氘交换联合质谱法(例如,液相色谱-电喷雾质谱法)、基于阵列的寡肽扫描测定法和/或诱变作图(例如,定点诱变作图)。对于x射线晶体学,可以使用本领域中任何已知的方法来完成结晶(例如,gieg
é
r等人,(1994)actacrystallogrdbiolcrystallogr[结晶学报,d辑:生物结晶学]50(pt4):339-350;mcphersona(1990)eurjbiochem[欧洲生物化学杂志]189:1-23;chayenne(1997)structure[结构]5:1269-1274;mcphersona(1976)jbiolchem[生物化学杂志]251:6300-6303)。抗体/其抗原结合片段:抗原晶体可以使用熟知的x射线衍射技术研究并且可以使用计算机软件进行改进,诸如x-plor(耶鲁大学(yaleuniversity),1992,由分子模拟公司(molecularsimulations,inc.)发行;参见例如methenzymol[酶学方法](1985)第114和115卷,wyckoffhw等人编辑;u.s.2004/0014194)和buster(bricogneg(1993)actacrystallogrdbiolcrystallogr[结晶学报,d辑:生物结晶学]49(pt1):37-60;bricogneg(1997)methenzymol[酶学方法]276a:361-423,编辑cartercw;roversip等人(2000)actacrystallogrdbiolcrystallogr[结晶学报,d辑:生物结晶学]56(pt10):1316-1323)。可以使用本领域技术人员已知的任何方法来完成诱变作图研究。对于诱变技术(包括丙氨酸扫描诱变技术)的描述,参见例如,champem等人,(1995)jbiol
chem[生物化学杂志]270: 1388-1394以及cunningham bc和wells ja(1989)science[科学]244: 1081-1085。
[0087]
与参考抗体“结合相同表位”的抗体是指与参考抗体结合相同氨 基酸残基的抗体。抗体与参考抗体结合相同表位的能力可以通过氢/ 氘交换测定法来确定(参见例如,coales等人rapid commun.massspectrom.[质谱学快报]2009;23:639-647)。
[0088]
如本文所用,术语“免疫特异性结合”、“免疫特异性识别”、
ꢀ“
特异性结合”和“特异性识别”在抗体或其抗原结合片段的上下文 中是类似术语。这些术语指示抗体或其抗原结合片段经由其抗原结合 结构域与表位结合并且指示结合需要抗原结合结构域与表位之间有 某种互补性。因此,在一些方面,与sars-cov-2的刺突蛋白“特异 性结合”的抗体也可以与一种或多种相关病毒(例如sars-1)的刺 突蛋白结合和/或也可以与sars-cov-2刺突蛋白的变体结合,但例如 使用fortebio或biacore测量的那样,与不相关的非sars-cov-2刺 突蛋白的结合程度小于抗体与sars-cov刺突蛋白结合的约10%。
[0089]
若抗体优先与该表位或重叠表位结合,其程度为在某种程度上阻 断参考抗体与表位的结合,则将该抗体称为“竞争性抑制”参考抗体 与给定表位的结合。竞争性抑制可以通过本领域已知的任何方法测 定,例如竞争性elisa测定法。可以说某抗体竞争性地将参考抗体与 给定表位的结合抑制至少90%、至少80%、至少70%、至少60%或至 少50%。
[0090]“分离的”多肽、抗体、多核苷酸、载体、细胞或组合物是呈自 然界中未发现形式的多肽、抗体、多核苷酸、载体、细胞或组合物。 分离的多肽、抗体、多核苷酸、载体、细胞或组合物包括已经被纯化 至它们不再呈自然界中发现形式的程度的那些。在一些方面,分离的 抗体、多核苷酸、载体、细胞或组合物是基本上纯的。如本文所用,
ꢀ“
基本上纯的”是指至少50%纯(即,不含污染物)、至少90%纯、 至少95%纯、至少98%纯或至少99%纯的材料。
[0091]
在文中可互换使用的术语“多肽”、“肽”和“蛋白质”是指具 有任何长度的氨基酸的聚合物。该聚合物可以是直链或支链的,它可 以包含修饰的氨基酸,并且它可以被非氨基酸中断。这些术语还涵盖 已经被天然修饰或通过干预修饰的氨基酸聚合物;例如,二硫键形成、 糖基化、脂化、乙酰化、磷酸化或任何其他操纵或修饰,诸如与标记 组分缀合。该定义还包括例如含有一种或多种氨基酸类似物(包括例 如,非天然氨基酸等)以及本领域已知的其他修饰的多肽。应当理解, 由于本发明的多肽是基于抗体的,因此在一些方面,这些多肽可以作 为单链或相关链出现。
[0092]“同一性百分比”是指两个序列(例如,氨基酸序列或核酸序列) 之间的同一性程度。可以通过比对两个序列,引入空位以最大化序列 之间的同一性来测定同一性百分比。可以使用本领域已知的程序来产 生比对。为了本文的目的,核苷酸序列的比对可以用设为默认参数的 blastn程序进行,而氨基酸序列的比对可以用设为默认参数的blastp 程序进行(参见万维网上的国家生物技术信息中心(ncbi), ncbi.nlm.nih.gov)。
[0093]
如本文所用,具有疏水性侧链的氨基酸包括丙氨酸(a)、异亮 氨酸(i)、亮氨酸(l)、蛋氨酸(m)、缬氨酸(v)、苯丙氨酸 (f)、色氨酸(w)和酪氨酸(y)。具有脂族疏水性侧链的氨基酸 包括丙氨酸(a)、异亮氨酸(i)、亮氨酸(l)、蛋氨酸(m)和 缬氨酸(v)。具有芳族疏水性侧链的氨基酸包括苯丙氨酸(f)、色 氨酸(w)和酪氨酸(y)。
[0094]
如本文所用,具有极性中性侧链的氨基酸包括天冬酰胺(n)、 半胱氨酸(c)、谷氨酰胺(q)、丝氨酸(s)和苏氨酸(t)。
等;“基本 上由......组成(consisting essentially of或consists essentially)”是开 放性的,允许超出所叙述的存在,只要所叙述的基本或新颖特征不被 超过叙述的存在改变,但是排除现有技术方面。
[0105]
除非明确声明或从上下文显而易见,如本文所用的,术语“或
”ꢀ
被理解为包括在内。如本文在短语诸如“a和/或b”中使用的术语“和 /或”旨在包括“a和b”、“a或b”、“a”和“b”。同样,如短 语诸如“a、b和/或c”中使用的术语“和/或”旨在涵盖以下每个方 面:a、b、和c;a、b或c;a或c;a或b;b或c;a和c;a 和b;b和c;a(单独);b(单独);和c(单独)。
[0106]
如本文所用,术语“约”和“大约”在用于修饰数值或数值范围 时,指示高于该数值或范围10%和低于该数值或范围10%的偏差仍在 所叙述的值或范围的预期含义内。应当理解,在本文中无论在何处用 语言“约”或“大约”数值或范围来描述各方面,也提供了指代特定 数值或范围(没有“约”)的类似方面。
[0107]
可以将本文提供的任何组合物或方法与本文提供的任何其他组 合物和方法中的一种或多种进行组合。
[0108]
9.2抗体及其抗原结合片段
[0109]
在特定方面,本文提供了与sars-cov-2的刺突蛋白结合的抗体 (例如,单克隆抗体,诸如人抗体)及其抗原结合片段。seq id no:63 中提供了sars-cov-2刺突蛋白的氨基酸序列:
[0110][0110][0110]
当本文所述的任一seq id no(特别 是seq id no:63)中指示了初始met氨基酸残基或相应的初始密码 子(例如
‘
起始’密码子)时,所
述残基/密码子是任选的。由于seqid no:63的位置1处存在蛋氨酸残基是任选的,因此技术人员在确 定氨基酸残基编号时将考虑蛋氨酸残基的存在/不存在。例如,当seqid no:63包括蛋氨酸时,位置编号将如上所定义(例如,f486将对 应于seq id no:63的f486;n487将对应于seq id no:63的n487; g447将对应于seq id no:63的g447;并且k444将对应于seq idno:63的k444)。替代性地,当seq id no:63中不存在蛋氨酸时, 氨基酸残基编号应修改为-1(例如,f486将对应于seq id no:63的 f485;n487将对应于seq id no:63的n486;g447将对应于seq idno:63的g446;并且k444将对应于seq id no:63的k443)。当 本文所述的其他多肽序列的位置1处的蛋氨酸存在/不存在时,类似的 考虑适用,并且技术人员将容易地使用本领域常规技术确定正确的氨 基酸残基编号。
[0111]
seq id no:63的氨基酸1-12是刺突蛋白的信号肽。因此, sars-cov-2的刺突蛋白的成熟形式含有seq id no:63的氨基酸 13-1273。seq id no:63的氨基酸13-1213对应于胞外结构域;氨基 酸1214-1234对应于跨膜结构域;并且氨基酸1235-1273对应于胞质 结构域。
[0112]
在一些方面,本文所述的抗体或其抗原结合片段与sars-cov-2 的刺突蛋白结合,并且与sars-cov-2的刺突蛋白的受体结合结构域(rbd)的ace2界面特异性结合。
[0113]
在一些方面,本文所述的抗体或其抗原结合片段与sars-cov-2 的刺突蛋白结合并且与该刺突蛋白的包含氨基酸f486的表位特异性 结合。在一些方面,本文所述的抗体或其抗原结合片段与sars-cov-2 的刺突蛋白结合并且与该刺突蛋白的包含氨基酸n487的表位特异性 结合。在一些方面,本文所述的抗体或其抗原结合片段与sars-cov-2 的刺突蛋白结合并且与该刺突蛋白的包含氨基酸f486或n487的表位 特异性结合。在一些方面,本文所述的抗体或其抗原结合片段与 sars-cov-2的刺突蛋白结合并且与该刺突蛋白的包含氨基酸f486 和n487(例如f486和n487)的表位特异性结合。
[0114]
在一些方面,本文所述的抗体或其抗原结合片段与sars-cov-2 的刺突蛋白结合并且与刺突蛋白的rbd的顶端结构域特异性结合。
[0115]
在一些方面,本文所述的抗体或其抗原结合片段与sars-cov-2 的刺突蛋白结合并且与该刺突蛋白的包含氨基酸g447的表位特异性 结合。在一些方面,本文所述的抗体或其抗原结合片段与sars-cov-2 的刺突蛋白结合并且与该刺突蛋白的包含氨基酸k444的表位特异性 结合。在一些方面,本文所述的抗体或其抗原结合片段与sars-cov-2 的刺突蛋白结合并且与该刺突蛋白的包含氨基酸g447或k444的表位 特异性结合。在一些方面,本文所述的抗体或其抗原结合片段与 sars-cov-2的刺突蛋白结合并且与该刺突蛋白的包含氨基酸g447 和k444的表位特异性结合。
[0116]
在一些方面,与sars-cov-2的刺突蛋白特异性结合的本文所述 的抗体或其抗原结合片段与sars-cov交叉反应。在一些方面,与 sars-cov-2的刺突蛋白特异性结合的本文所述的抗体或其抗原结合 片段不与sars-cov交叉反应。
[0117]
在一些方面,本文所述的抗体或其抗原结合片段与sars-cov-2 的刺突蛋白结合,并包含表1中列出的抗体的六个cdr(即,该抗体 的三个vh cdr和同一抗体的三个vl cdr)。
[0118]
表1.抗体序列
[0119]
[0120]
[0121][0122]
在一些方面,本文所述的抗体或其抗原结合片段与sars-cov-2 的刺突蛋白结合并包含表1中列出的抗体的vh。例如,本文所述的 抗体或其抗原结合片段可包含含有选自以下的序列的vh:seq id no: 7、seq id no:15、seq id no:23、seq id no:31、seq id no:
cdr3(其可以是与刺突蛋白的包含g447和/或k444(例如g447 和k444)的表位特异性结合的第二抗体或其抗原结合片段的实例)。 本文所述的抗体或其抗原结合片段可包含分别具有seq id no:17-22 的vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和 vl-cdr3(其可以是与刺突蛋白的包含g447和/或k444(例如g447 和k444)的表位特异性结合的第二抗体或其抗原结合片段的实例)。 本文所述的抗体或其抗原结合片段可包含分别具有seq id no:25-30 的vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和 vl-cdr3(其可以是与刺突蛋白的包含f486和/或n487(例如f486 和n487)的表位特异性结合的第一抗体或其抗原结合片段的实例)。 本文所述的抗体或其抗原结合片段可包含分别具有seq id no:33-38 的vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和 vl-cdr3(其可以是与刺突蛋白的包含f486和/或n487(例如f486 和n487)的表位特异性结合的第一抗体或其抗原结合片段的实例)。 本文所述的抗体或其抗原结合片段可包含分别具有seq id no:41-46 的vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和 vl-cdr3。本文所述的抗体或其抗原结合片段可包含分别具有seqid no:9-14的vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2 和vl-cdr3。本文所述的抗体或其抗原结合片段可包含分别具有seqid no:65、66、49、50、51和52的vh-cdr1、vh-cdr2、vh-cdr3、 vl-cdr1、vl-cdr2和vl-cdr3。本文所述的抗体或其抗原结合片 段可包含分别具有seq id no:55-60的vh-cdr1、vh-cdr2、 vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3。
[0125]
在一些方面,可以根据乔西亚编号方案确定抗体或其抗原结合片 段的cdr,乔西亚编号方案是指免疫球蛋白结构环的位置(参见例如 chothia c和lesk am,(1987),j mol biol[分子生物学杂志]196: 901-917;al-lazikani b等人,(1997)j mol biol[分子生物学杂志]273: 927-948;chothia c等人,(1992)j mol biol[分子生物学杂志]227: 799-817;tramontano a等人,(1990)j mol biol[分子生物学杂志] 215(1):175-82;以及美国专利号7,709,226)。典型地,当使用卡巴特 编号惯例时,乔西亚cdr-h1环存在于重链氨基酸26至32、33或34 处,乔西亚cdr-h2环存在于重链氨基酸52至56处,并且乔西亚 cdr-h3环存在于重链氨基酸95至102处,而乔西亚cdr-l1环存在 于轻链氨基酸24至34处,乔西亚cdr-l2环存在于轻链氨基酸50 至56处,并且乔西亚cdr-l3环存在于轻链氨基酸89至97处。乔 西亚cdr-h1环的末端在利用卡巴特编号惯例编号时在h32与h34 之间变化,这取决于环的长度(这是因为卡巴特编号方案将插入放在 h35a和h35b处;如果35a和35b都不存在,那么环端点在32;如 果只存在35a,那么环端点在33;如果35a和35b都存在,那么环 端点在34)。
[0126]
在一些方面,本文提供了与sars-cov-2的刺突蛋白特异性结合 并且包含表1中列出抗体的乔西亚vh和vl cdr的抗体及其抗原结 合片段。在一些方面,与sars-cov-2的刺突蛋白特异性结合的抗体 或其抗原结合片段包含一个或多个cdr,其中乔西亚和卡巴特cdr 具有相同的氨基酸序列。在一些方面,本文提供了与sars-cov-2的 刺突蛋白特异性结合并且包含卡巴特cdr和乔西亚cdr的组合的抗 体及其抗原结合片段。
[0127]
在一些方面,可以根据如lefranc m-p,(1999)the immunologist [免疫学家]7:132-136和lefranc m-p等人,(1999)nucleic acids res [核酸研究]27:209-212中所述的imgt编号系统来确定抗体或其抗原 结合片段的cdr。根据imgt编号方案,vh-cdr1处于位置26至 35,vh-cdr2处于位置51至57,vh-cdr3处于位置93至102, vl-cdr1处于位置27至32,
vl-cdr2处于位置50至52,并且vl-cdr3处于位置89至97。在一些方面,本文提供了与sars-cov-2的刺突蛋白特异性结合并且包含表1中列出抗体的imgtvh和vlcdr的抗体及其抗原结合片段,例如,如lefrancm-p(1999)同上和lefrancm-p等人,(1999)同上所述)。
[0128]
在一些方面,可以根据maccallumrm等人,(1996)jmolbiol[分子生物学杂志]262:732-745确定抗体或其抗原结合片段的cdr。另请参见例如martina.“proteinsequenceandstructureanalysisofantibodyvariabledomains[抗体可变结构域的蛋白质序列和结构分析],”在antibodyengineering[抗体工程]中,kontermann和d
ü
bel编辑,第31章,第422-439页,柏林斯普林格出版社(springer-verlag,berlin)(2001)。在一些方面,本文提供了与sars-cov-2的刺突蛋白特异性结合并且包含如通过maccallumrm等人的方法确定的表1中列出抗体的vh和vlcdr的抗体及其抗原结合片段。
[0129]
在一些方面,可以根据abm编号方案确定抗体或其抗原结合片段的cdr,abm编号方案是指代表卡巴特cdr和乔西亚结构环之间折衷的abm高变区,并且被牛津分子的abm抗体建模软件(牛津分子集团有限公司(oxfordmoleculargroup,inc.))使用。在一些方面,本文提供了与sars-cov-2的刺突蛋白特异性结合并且包含如通过abm编号方案确定的表1中列出抗体的vh和vlcdr的抗体及其抗原结合片段。
[0130]
在一些方面,本文提供了包含重链和/或轻链的抗体。人恒定区序列的非限制性实例已在本领域中描述,例如参见美国专利号5,693,780和kabatea等人,(1991)同上。
[0131]
关于重链,在一些方面,本文所述的抗体的重链可以是alpha(α)、delta(δ)、epsilon(ε)、gamma(γ)或mu(μ)重链。在一些方面,所述抗体的重链可包含人alpha(α)、delta(δ)、epsilon(ε)、gamma(γ)或mu(μ)重链。在一些方面,与sars-cov-2的刺突蛋白免疫特异性结合的本文所述的抗体包含重链,其中vh结构域的氨基酸序列包含表1中所列的氨基酸序列并且其中重链的恒定区包含人gamma(γ)重链恒定区(例如人igg1重链恒定区)的氨基酸序列。在一些方面,与sars-cov-2的刺突蛋白特异性结合的本文所述的抗体包含重链,其中vh结构域的氨基酸序列包含表1中所列的序列,并且其中重链的恒定区包含本文所述的或本领域已知的人重链的氨基酸。
[0132]
在一些方面,本文所述的抗体或其抗原结合片段的轻链是人κ轻链或人λ轻链。在一些方面,与sars-cov-2的刺突蛋白免疫特异性结合的本文所述的抗体包含轻链,其中vl结构域的氨基酸序列包含表1中所列的序列,并且其中轻链的恒定区包含人κ或λ轻链恒定区的氨基酸序列。
[0133]
在一些方面,与sars-cov-2的刺突蛋白免疫特异性结合的本文所述的抗体或其抗原结合片段包含轻链,其中vl结构域的氨基酸序列包含表1中所列的序列,并且其中轻链的恒定区包含人κ轻链恒定区的氨基酸序列。
[0134]
在一些方面,本文所述的抗体的轻链是λ轻链。在一些方面,与sars-cov-2的刺突蛋白免疫特异性结合的本文所述的抗体包含轻链,其中vl结构域的氨基酸序列包含表1中所列的序列,并且其中轻链的恒定区包含人λ轻链恒定区的氨基酸序列。
[0135]
在一些方面,与sars-cov-2的刺突蛋白免疫特异性结合的本文所述的抗体包含含有本文所述的任何氨基酸序列的vh结构域和vl结构域,并且其中恒定区包含igg、ige、igm、igd、iga或igy免疫球蛋白分子或人igg、ige、igm、igd、iga或igy免疫球蛋白分子的恒定区的氨基酸序列。在一些方面,与sars-cov-2的刺突蛋白免疫特异性结合的本文所述
的抗体包含含有本文所述的任何氨基酸序列 的vh结构域和vl结构域,并且其中恒定区包含igg、ige、igm、 igd、iga或igy免疫球蛋白分子、免疫球蛋白分子的任何类别(例如 igg1、igg2、igg3、igg4、iga1和iga2)或任何亚类(例如igg2a 和igg2b)的恒定区的氨基酸序列。在一些方面,恒定区包含人igg、 ige、igm、igd、iga或igy免疫球蛋白分子的任何类别(例如igg1、 igg2、igg3、igg4、iga1和iga2)或任何亚类(例如igg2a和igg2b) 的恒定区的氨基酸序列。
[0136]
fc区工程化在本领域中用于例如延长治疗性抗体及其抗原结合 片段的半衰期并避免体内降解。在一些方面,可以修饰igg抗体或抗 原结合片段的fc区,以便增加igg分子对新生儿fc受体(fcrn)的 亲和力,从而介导igg分解代谢并避免igg分子降解。合适的fc区 氨基酸取代或修饰是本领域已知的并且包括例如三元取代 m252y/s254t/t256e(称为“yte”)(参见例如,美国专利7,658,921; 美国专利申请公开2014/0302058;和yu等人,antimicrob.agentschemother.[抗微生物药剂与化学疗法],61(1):e01020-16(2017))。在 一些方面,与sars-cov-2的刺突蛋白结合的抗体或抗原结合片段(例 如,单克隆抗体或片段)包含含有yte突变的fc区。
[0137]
重链恒定区中的三元突变(tm)l234f/l235e/p331s(根据欧盟 编号惯例;sazinsky等人proc natl acad sci usa[美国国家科学院院 刊],105:20167-20172(2008))可以显著降低igg效应子功能。在一些 方面,包含三元突变的igg1序列包含seq id no:64的序列。
[0138][0139]
在一些方面,将一个、两个或更多个突变(例如,氨基酸取代) 引入本文所述的抗体或其抗原结合片段的fc区中(例如,引入ch2 结构域(人igg1的残基231-340)和/或ch3结构域(人igg1的残基 341-447)和/或铰链区中,根据卡巴特编号系统(卡巴特中的eu索引) 进行编号),以改变抗体或其抗原结合片段的一种或多种功能特性, 诸如血清半衰期、补体固定、fc受体结合和/或抗原依赖性细胞毒性。
[0140]
在一些方面,将一个、两个或更多个突变(例如,氨基酸取代) 引入fc区(ch1结构域)的铰链区,使得铰链区中半胱氨酸残基的 数目改变(例如增加或减少),如例如美国专利号5,677,425中所述。 可以改变ch1结构域的铰链区中半胱氨酸残基的数量,以例如促进轻 链和重链的组装,或改变(例如增加或减少)抗体或其抗原结合片段 的稳定性。
[0141]
在一些方面,将一个、两个或更多个突变(例如,氨基酸取代) 引入本文所述的抗体或其抗原结合片段的fc区(例如,ch2结构域 (人igg1的残基231-340)和/或ch3结构域(人igg1的残基341-447) 和/或铰链区,根据卡巴特编号系统(卡巴特中的eu索引)进行编号), 以增加或降低抗体或其抗原结合片段对效应细胞表面上的fc受体(例 如,活化fc受体)的亲和力。fc区中降低或增加对fc受体的亲和力 的突变以及将此类突变引入fc受体或其片段中的技术是本领域技术 人员已知的。在fc受体中可以产生以改变抗体或其抗原结合片段对 fc受体的亲和力的突变的实例描述于例如smith p等人,(2012)pnas [美国国家
科学院院刊]109:6181-6186,美国专利号6,737,056以及国 际公开号wo 02/060919、wo 98/23289和wo 97/34631,其通过援引 并入本文。
[0142]
在一些方面,将一个、两个或更多个氨基酸突变(即,取代、插 入或缺失)引入igg恒定结构域或其fcrn结合片段(优选fc或铰链
ꢀ‑
fc结构域片段)中以改变(例如,减少或增加)体内抗体或其抗原 结合片段的半衰期。参见例如国际公开号wo 02/060919、wo98/23289和wo 97/34631;以及美国专利号5,869,046、6,121,022、 6,277,375和6,165,745的突变实例,这些突变将改变(例如,减少或 增加)体内抗体或其抗原结合片段的半衰期。在一些方面,将一个、 两个或更多个氨基酸突变(即,取代、插入或缺失)引入igg恒定结 构域或其fcrn结合片段(优选fc或铰链-fc结构域片段)中以减少 体内抗体或其抗原结合片段的半衰期。在一些方面,将一个、两个或 更多个氨基酸突变(即,取代、插入或缺失)引入igg恒定结构域或 其fcrn结合片段(优选fc或铰链-fc结构域片段)中以增加体内抗 体或其抗原结合片段的半衰期。在一些方面,抗体或其抗原结合片段 可以在第二恒定(ch2)结构域(人igg1的残基231-340)和/或第三 恒定(ch3)结构域(人igg1的残基341-447)中具有一个或多个氨 基酸突变(例如,取代),根据卡巴特中的eu索引编号(kabat ea 等人,(1991)同上)。在一些方面,根据如同卡巴特中的eu索引编号, igg1的恒定区包含在位置252处的蛋氨酸(m)至酪氨酸(y)取代, 在位置254处的丝氨酸(s)至苏氨酸(t)取代,以及在位置256处 的苏氨酸(t)至谷氨酸(e)取代。参见美国专利号7,658,921,其 通过援引并入本文。已经证实这种类型的突变体igg(称为“yte突 变体”)与相同抗体的野生型形式相比会展示出增加四倍的半衰期(参 见dall’acqua wf等人,(2006)j biol chem[生物化学杂志]281: 23514-24)。在一些方面,抗体或其抗原结合片段包含的igg恒定结 构域包含在根据如同卡巴特中的eu索引进行编号的位置251-257、 285-290、308-314、385-389和428-436处的氨基酸残基的一个、两个、 三个或更多个氨基酸取代。
[0143]
在一些方面,将一个、两个或更多个氨基酸取代引入igg恒定结 构域fc区中,以改变抗体或其抗原结合片段的一个或多个效应子功 能。例如,选自根据如同卡巴特中的eu索引进行编号的氨基酸残基 234、235、236、237、297、318、320和322的一个或多个氨基酸可 以被不同的氨基酸残基置换,使得该抗体或其抗原结合片段对效应配 体的亲和力改变,但保留了亲本抗体的抗原结合能力。对其的亲和力 改变的效应配体可以是例如fc受体或补体的c1组分。这种方法在美 国专利号5,624,821和5,648,260中有更详细的描述。在一些方面,恒 定区结构域的缺失或失活(通过点突变或其他手段)可减少循环的抗 体或其抗原结合片段的fc受体结合,从而增加肿瘤定位。对于使恒 定结构域缺失或失活从而增加肿瘤定位的突变的描述,参见例如美国 专利号5,585,097和8,591,886。在一些方面,可以将一个或多个氨基 酸取代引入fc区以去除fc区上的潜在糖基化位点,从而可以减少fc 受体结合(参见例如shields rl等人,(2001)j biol chem[生物化学 杂志]276:6591-604)。
[0144]
在一些方面,选自根据如同卡巴特中的eu索引进行编号的恒定 区中的氨基酸残基322、329和331的一个或多个氨基酸可以被不同 的氨基酸残基置换,使得该抗体或其抗原结合片段具有改变的c1q结 合和/或改变或消除的补体依赖性细胞毒性(cdc)。这种方法在美国 专利号6,194,551(idusogie等人)中有更详细的描述。在一些方面, 改变ch2结构域的n端区域中的氨基酸位置231至238内的一个或 多个氨基酸残基,从而改变抗体固定补体的能力。这种方法在国际公 开号wo 94/29351中有进一步描述。在一些方面,通过在以下
位置使 一个或多个氨基酸突变(例如,引入氨基酸取代)来修饰fc区以增 加抗体或其抗原结合片段介导抗体依赖性细胞毒性(adcc)的能力 和/或增加抗体或其抗原结合片段对fcγ受体的亲和力:238、239、248、 249、252、254、255、256、258、265、267、268、269、270、272、 276、278、280、283、285、286、289、290、292、293、294、295、 296、298、301、303、305、307、309、312、315、320、322、324、 326、327、328、329、330、331、333、334、335、337、338、340、 360、373、376、378、382、388、389、398、414、416、419、430、 434、435、437、438或439,根据如同卡巴特中的eu索引进行编号。 这种方法在国际公开号wo 00/42072中有进一步描述。
[0145]
在一些方面,本文所述的抗体或其抗原结合片段包含在根据如同 卡巴特中的eu索引进行编号的位置267、328或其组合处具有突变(例 如,取代)的igg1的恒定结构域。在一些方面,本文所述的抗体或 其抗原结合片段包含具有选自由s267e、l328f及其组合组成的组的 突变(例如,取代)的igg1的恒定结构域。在一些方面,本文所述 的抗体或其抗原结合片段包含具有s267e/l328f突变(例如,取代) 的igg1的恒定结构域。在一些方面,包含具有s267e/l328f突变(例 如,取代)的igg1的恒定结构域的本文所述的抗体或其抗原结合片 段对fcγriia、fcγriib或fcγriia和fcγriib具有增加的结合亲和力。
[0146]
工程化的糖型可用于多种目的,包括但不限于增强或降低效应子 功能。在本文所述的抗体或其抗原结合片段中产生工程化糖型的方法 包括但不限于以下中披露的那些:例如p等人,(1999)natbiotechnol[自然
·
生物技术]17:176-180;davies j等人,(2001) biotechnol bioeng[生物技术与生物工程]74:288-294;shields rl等人, (2002)j biol chem[生物化学杂志]277:26733-26740;shinkawa t等 人,(2003)j biol chem[生物化学杂志]278:3466-3473;niwa r等人, (2004)clin cancer res[临床癌症研究]1:6248-6255;presta lg等人, (2002)biochem soc trans[生化学会会刊]30:487-490;kanda y等人, (2007)glycobiology[糖生物学]17:104-118;美国专利号6,602,684、 6,946,292和7,214,775;美国专利公开号us 2007/0248600、 2007/0178551、2008/0060092和2006/0253928;国际公开号wo00/61739、wo 01/292246、wo 02/311140和wo 02/30954;potillegent
tm
技术(新泽西州普林斯顿市宝万有限公司(biowa,inc.princeton, n.j.));以及糖基化工程技术(瑞士苏黎世格黎卡特生 物技术股份公司(glycart biotechnology ag,zurich,switzerland))。 另请参见例如ferrara c等人,(2006)biotechnol bioeng[生物技术与生 物工程]93:851-861;国际公开号wo 07/039818、wo 12/130831、 wo 99/054342、wo 03/011878和wo 04/065540。
[0147]
在一些方面,可以将本文所述的任何恒定区突变或修饰引入本文 所述的具有两个重链恒定区的抗体或其抗原结合片段的一个或两个 重链恒定区。
[0148]
在一些方面,与sars-cov-2的刺突蛋白特异性结合的本文所述 的抗体或其抗原结合片段抑制sars-cov-2与血管紧张素转化酶2 (ace2)的结合。
[0149]
在一些方面,与sars-cov-2的刺突蛋白特异性结合的本文所述 的抗体或其抗原结合片段中和sars-cov-2。在一些方面,与 sars-cov-2的刺突蛋白特异性结合的本文所述的抗体或其抗原结合 片段中和sars-cov-2加假病毒。
[0150]
竞争结合测定法可用于确定两种抗体是否与重叠表位结合。竞争 性结合可以在一种测定法中确定,在该测定法中,测试的免疫球蛋白 抑制参考抗体与常见抗原(诸如
sars-cov-2的刺突蛋白或sars-cov-2)的特异性结合。已知许多类型的竞争性结合测定法,例如:固相直接或间接放射免疫测定法(ria)、固相直接或间接酶免疫测定法(eia)、夹心竞争测定法(参见stahlic等人,(1983)methodsenzymol[酶学方法]9:242-253);固相直接生物素-亲和素eia(参见kirklandtn等人,(1986)jimmunol[免疫学杂志]137:3614-9);固相直接标记测定法、固相直接标记夹心测定法(参见harlowe和laned,(1988)antibodies:alaboratorymanual[抗体:实验室手册],冷泉港出版社(coldspringharborpress));使用i-125标记的固相直接标记ria(参见morelga等人,(1988)molimmunol[分子免疫学]25(1):7-15);固相直接生物素-亲和素eia(cheungrc等人,(1990)virology[病毒学]176:546-52);以及直接标记ria(moldenhauerg等人,(1990)scandjimmunol[斯堪的纳维亚免疫学杂志]32:77-82)。典型地,这种测定法涉及使用与载有以下任一个的固体表面或细胞结合的纯化抗原:未标记的测试免疫球蛋白以及标记的参考免疫球蛋白。竞争性抑制可以通过在测试免疫球蛋白的存在下测定与固体表面或细胞结合的标记的量来测量。通常测试免疫球蛋白过量存在。通常,当竞争性抗体过量存在时,它将以至少50-55%、55-60%、60-65%、65-70%、70-75%或更高抑制参考抗体与共同抗原的特异性结合。可以使用标记的抗原或标记的抗体以多种不同形式配置竞争结合测定法。在该测定法的常见形式中,将抗原固定在96孔板上。然后使用放射性标记或酶标记来测量未标记的抗体阻断标记的抗体与抗原结合的能力。更多详情,参见例如,wagenerc等人,(1983)jimmunol[免疫学杂志]130:2308-2315;wagenerc等人,(1984)jimmunolmethods[免疫学方法杂志]68:269-274;kurokim等人,(1990)cancerres[癌症研究]50:4872-4879;kurokim等人,(1992)immunolinvest[免疫学研究]21:523-538;kurokim等人,(1992)hybridoma[杂交瘤]11:391-407和antibodies:alaboratorymanual[抗体:实验室手册],编者edharlow和laned同上,第386-389页。
[0151]
在一些方面,使用表面等离振子共振例如通过“串联方法”,诸如abdicheyn等人,(2009)analyticalbiochem[分析生物化学]386:172-180描述的方法来进行竞争测定法,从而将抗原固定在芯片表面,例如cm5传感器芯片上,然后使抗体或抗原结合片段在芯片上运行。为了确定抗体或其抗原结合片段是否和与如本文所述的sars-cov-2的刺突蛋白结合的抗体竞争,首先使抗体或其抗原结合片段在芯片表面上运行以达到饱和,然后添加潜在的竞争性抗体。然后可以相对于非竞争性对照确定和定量竞争性抗体或其抗原结合片段的结合。
[0152]
在另一方面,本文提供了竞争性抑制(例如,以剂量依赖性方式)所述抗体或其抗原结合片段与sars-cov-2的刺突蛋白或与sars-cov-2的结合的抗体,如使用本领域技术人员已知的或本文所述的测定法(例如,elisa竞争性测定法或悬浮阵列或表面等离振子共振测定法)所确定的。
[0153]
在一些方面,与sars-cov-2的刺突蛋白特异性结合的如本文所述的抗原结合片段选自由fab、fab
′
、f(ab
′
)2和scfv组成的组,其中fab、fab
′
、f(ab
′
)2或scfv包含与sars-cov-2的刺突蛋白或与sars-cov-2特异性结合的本文所述的抗体或其抗原结合片段的重链可变区序列和轻链可变区序列。fab、fab
′
、f(ab
′
)2或scfv可以通过本领域技术人员已知的任何技术产生,包括但不限于下文第7.4节中讨论的那些技术。在一些方面,fab、fab
′
、f(ab
′
)2或scfv进一步包含延长体内抗体半衰期的部分。该部分也称为“半衰期延长
部分”。可以 使用本领域技术人员已知的用于延长体内fab、fab
′
、f(ab
′
)2或scfv 的半衰期的任何部分。例如,半衰期延长部分可包括fc区、聚合物、 白蛋白或白蛋白结合蛋白或化合物。聚合物可包括天然或合成的、任 选经取代的直链或支链的聚亚烷基、聚亚烯基、聚氧化烯、多糖、聚 乙二醇、聚丙二醇、聚乙烯醇、甲氧基聚乙二醇、乳糖、直链淀粉、 葡聚糖、糖原或其衍生物。取代基可包括一个或多个羟基、甲基或甲 氧基基团。在一些方面,可以通过添加一个或多个用于附接半衰期延 长部分的c端氨基酸来修饰fab、fab
′
、f(ab
′
)2或scfv。在一些方面, 半衰期延长部分是聚乙二醇或人血清白蛋白。在一些方面,fab、fab
′
、 f(ab
′
)2或scfv与fc区融合。
[0154]
可以将与sars-cov-2的刺突蛋白结合的抗体或其抗原结合片段 与可检测标记或物质融合或缀合(例如,共价或非共价连接)。可检 测标记或物质的实例包括酶标记物,诸如葡萄糖氧化酶;放射性同位 素,诸如碘(
125
i、
121
i)、碳(
14
c)、硫(
35
s)、氚(3h)、铟(
121
in) 和锝(
99
tc);发光标记,诸如鲁米诺;以及荧光标记,诸如荧光素 和若丹明,以及生物素。此类标记的抗体或其抗原结合片段可用于检 测sars-cov-2的刺突蛋白或sars-cov-2。参见例如下文第7.6.2 节。
[0155]
9.3抗体及其抗原结合片段的组合
[0156]
在一些方面,本文提供的组合物包含与sars-cov-2的刺突蛋白 结合的抗体及其抗原结合片段的组合,例如,与sars-cov-2的刺突 蛋白结合的第一抗体或其抗原结合片段和与sars-cov-2的刺突蛋白 结合的第二抗体或其抗原结合片段。在一些方面,本文提供的方法使 用与sars-cov-2的刺突蛋白结合的抗体及其抗原结合片段的组合, 例如,与sars-cov-2的刺突蛋白结合的第一抗体或其抗原结合片段 和与sars-cov-2的刺突蛋白结合的第二抗体或其抗原结合片段。
[0157]
在本文提供的组合物和方法的一些方面,第一抗体或其抗原结合 片段与sars-cov-2刺突蛋白的受体结合结构域(rbd)的ace2界 面结合。在本文提供的组合物和方法的一些方面,第二抗体或其抗原 结合片段与刺突蛋白的rbd的顶端结构域特异性地结合。在本文提 供的组合物和方法的一些方面,第一抗体或其抗原结合片段与sars-cov-2刺突蛋白的rbd的ace2界面结合并且第二抗体或其抗 原结合片段与刺突蛋白的rbd的顶端结构域特异性结合。
[0158]
在本文提供的组合物和方法的一些方面,第一抗体或其抗原结合 片段与该刺突蛋白的包含f486的表位特异性结合。在本文提供的组 合物和方法的一些方面,第二抗体或其抗原结合片段与该刺突蛋白的 包含g447的表位特异性结合。在本文提供的组合物和方法的一些方 面,第一抗体或其抗原结合片段与该刺突蛋白的包含f486的表位特 异性结合,并且第二抗体或其抗原结合片段与该刺突蛋白的包含g447 的表位特异性结合。
[0159]
在本文提供的组合物和方法的一些方面,第一抗体或其抗原结合 片段与刺突蛋白的包含f486和/或n487(例如f486和n487)的表位 特异性结合。在本文提供的组合物和方法的一些方面,第二抗体或其 抗原结合片段与刺突蛋白的包含g447和/或k444(例如g447和k444) 的表位特异性结合。在本文提供的组合物和方法的一些方面,第一抗 体或其抗原结合片段与刺突蛋白的包含f486和/或n487(例如f486 和n487)的表位特异性结合,并且第二抗体或其抗原结合片段与该 刺突蛋白的包含g447和/或k444(例如g447和k444)的表位特异 性结合。
[0160]
在本文提供的组合物和方法的一些方面,第一抗体或其抗原结合 片段与该刺突蛋白的包含f486的表位特异性结合,并且第二抗体或 其抗原结合片段与该刺突蛋白的rbd的顶端结构域特异性结合。在 本文提供的组合物和方法的一些方面,第一抗体或其抗原结合片段与 sars-cov-2刺突蛋白的rbd的ace2界面结合并且第二抗体或其抗 原结合片段与该刺突蛋白的包含g447的表位特异性结合。
[0161]
在本文提供的组合物和方法的一些方面,第一抗体或其抗原结合 片段与刺突蛋白的包含f486和/或n487(例如f486和n487)的表位 特异性结合,并且第二抗体或其抗原结合片段与该刺突蛋白的rbd 的顶端结构域特异性结合。在本文提供的组合物和方法的一些方面, 第一抗体或其抗原结合片段与sars-cov-2刺突蛋白的rbd的ace2 界面结合,并且第二抗体或其抗原结合片段与该刺突蛋白的包含g447 和/或k444(例如g447和k444)的表位特异性结合。
[0162]
在本文提供的组合物和方法的一些方面,第一抗体和第二抗体或 其抗原结合片段与sars-cov-2的刺突蛋白的非重叠表位结合。在本 文提供的组合物和方法的一些方面,第一抗体和第二抗体或其抗原结 合片段可以与sars-cov-2的刺突蛋白的rbd或同时与sars-cov-2 的刺突蛋白的三聚体结合。
[0163]
在本文提供的组合物和方法的一些方面,第一抗体和第二抗体或 其抗原结合片段以协同量存在或以协同量使用。在本文提供的组合物 和方法的一些方面,第二抗体或其抗原结合片段(例如,2130)以第 一抗体或其抗原结合片段(例如,2196)的量的约240倍的量存在或 使用。在本文提供的组合物和方法的一些方面,第二抗体或其抗原结 合片段(例如,2096)以第一抗体或其抗原结合片段(例如,2196) 的量的约5倍的量存在或使用。
[0164]
在本文提供的方法的一些方面,第一抗体和第二抗体或其抗原结 合片段处于相同的组合物中。在本文提供的方法的一些方面,第一抗 体和第二抗体或其抗原结合片段处于分开的组合物中。
[0165]
9.4抗体产生
[0166]
与sars-cov-2的刺突蛋白免疫特异性结合的抗体及其抗原结合 片段可以通过本领域已知的用于合成抗体及其抗原结合片段的任何 方法,例如通过化学合成或通过重组表达技术来产生。除非另有说明, 否则本文所述的方法采用分子生物学、微生物学、遗传分析、重组 dna、有机化学、生物化学、pcr、寡核苷酸合成和修饰、核酸杂交 以及本领域技术范围内相关领域的常规技术。这些技术例如在本文引 用的参考文献中有描述并且在文献中对其进行了充分解释。参见例如 sambrook j等人,(2001)molecular cloning:a laboratory manual[分子 克隆:实验室手册],cold spring harbor laboratory press[冷泉港实验室 出版社],纽约冷泉港(cold spring harbor,ny);ausubel fm等人, current protocols in molecular biology[分子生物学实验指南],约翰
·
威 利父子公司(john wiley&sons)(1987年和年度更新);currentprotocols in immunology[免疫学实验指南],约翰
·
威利父子公司(johnwiley&sons)(1987年和年度更新)gait(编辑)(1984)oligonucleotidesynthesis:a practical approach[寡核苷酸合成:实用方法],irl出版社 (irl press);eckstein(编辑)(1991)oligonucleotides and analogues:apractical approach[寡核苷酸和类似物:实用方法],irl出版社(irlpress);birren b等人,(编辑)(1999)genome analysis:a laboratorymanual[基因组分析:实验室手册],
cold spring harbor laboratorypress[冷泉港实验室出版社]。
[0167]
在一些方面,本文提供了制备与sars-cov-2的刺突蛋白免疫特 异性结合的抗体或抗原结合片段的方法,该方法包括培养本文所述的 细胞或宿主细胞。在一些方面,本文提供了制备与sars-cov-2的刺 突蛋白免疫特异性结合的抗体或其抗原结合片段的方法,该方法包括 使用本文所述的细胞或宿主细胞(例如,包含编码本文所述的抗体或 其抗原结合片段的多核苷酸的细胞或宿主细胞)表达(例如,重组表 达)该抗体或其抗原结合片段。在一些方面,该细胞是分离的细胞。 在一些方面,已将外源多核苷酸引入细胞中。在一些方面,该方法进 一步包括分离或纯化从细胞、宿主细胞或培养物中获得的抗体或抗原 结合片段的步骤。
[0168]
用于产生多克隆抗体的方法是本领域已知的(参见例如在:shortprotocols in molecular biology[精编分子生物学实验指南],(2002)第5 版中的第11章,ausubel fm等人编辑,约翰
·
威利父子公司(johnwiley and sons),纽约)。
[0169]
可以使用本领域已知的多种多样的技术来制备单克隆抗体或其 抗原结合片段,这些技术包括使用杂交瘤、重组以及噬菌体展示技术、 基于酵母的呈递技术或其组合。例如,可以使用杂交瘤技术产生单克 隆抗体或其抗原结合片段,这些杂交瘤技术包括本领域已知的并且例 如在以下文献中教导的那些技术:harlow e和lane d,antibodies:alaboratory manual[抗体:实验室手册],(cold spring harbor laboratorypress[冷泉港实验室出版社],1988年第2版);hammerling gj等人, 在:monoclonal antibodies and t-cell hybridomas[单克隆抗体和t细 胞杂交瘤]563681(纽约爱思唯尔出版社(elsevier,n.y.),1981), 或如kohler g和milstein c(1975)nature[自然]256:495中所述。可 用于选择和生成本文所述的抗体的基于酵母的呈递方法的实例包括 例如wo 2009/036379 a2、wo 2010/105256和wo 2012/009568中披 露的那些,将其各自通过援引以其全文并入本文。
[0170]
在一些方面,单克隆抗体或抗原结合片段是由克隆细胞(例如, 产生重组抗体或抗原结合片段的杂交瘤或宿主细胞)产生的抗体或抗 原结合片段,其中该抗体或抗原结合片段与sars-cov-2的刺突蛋白 免疫特异性结合,例如通过elisa或本领域或本文提供的实例中已知 的其他抗原结合测定法所确定的。在一些方面,单克隆抗体或其抗原 结合片段可以是人抗体或其抗原结合片段。在一些方面,单克隆抗体 或其抗原结合片段可以是fab片段或f(ab’)2片段。本文所述的单克隆 抗体或其抗原结合片段可以例如通过如kohler g和milstein c(1975) nature[自然]256:495中所述的杂交瘤方法制备,或者可以例如使用 如本文所述的技术从噬菌体文库中分离。制备克隆细胞系和由此表达 的单克隆抗体及其抗原结合片段的其他方法是本领域熟知的(参见例 如在:short protocols in molecular biology[精编分子生物学实验指南] (2002)第5版中第11章,ausubel fm等人,同上)。
[0171]
本文所述的抗体的抗原结合片段可以通过本领域技术人员已知 的任何技术生成。例如,本文所述的fab和f(ab’)2片段可以通过使用 酶诸如木瓜蛋白酶(用于产生fab片段)或胃蛋白酶(用于产生f(ab’)2片段)对免疫球蛋白分子进行蛋白水解裂解来产生。fab片段对应于 四聚抗体分子的两条相同臂之一,并且含有与重链的vh和ch1结构 域配对的完整轻链。f(ab’)2片段含有四聚抗体分子的两条抗原结合臂, 这两条抗原结合臂通过铰链区中的二硫键连接。
[0172]
此外,还可以使用本领域已知的各种噬菌体展示和/或基于酵母的 呈递方法来生成本文所述的抗体或其抗原结合片段。在噬菌体展示方 法中,将蛋白质展示在噬菌体颗粒的表面上,这些颗粒携带对其进行 编码的多核苷酸序列。具体地说,编码vh和vl结构域的dna序列 是从动物edna文库(例如,受感染组织的人或鼠类edna文库)来 扩增。通过pcr将编码这些vh和vl结构域的dna与sefv接头重 组在一起,并且克隆至噬粒载体中。将该载体以电穿孔转至大肠杆菌 中,并且用辅助噬菌体对该大肠杆菌进行感染。这些方法中所使用的 噬菌体典型地是包括fd和m13的丝状噬菌体,并且vh和vl结构 域通常重组融合至噬菌体基因iii或基因viii。表达与特定抗原结合 的抗体或其抗原结合片段的噬菌体可以用抗原来选择或鉴定,例如, 使用标记的抗原或结合或捕获于固体表面或珠粒上的抗原。可以用于 制备本文所述的抗体或片段的噬菌体展示方法的实例包括在以下文 献中披露的那些:brinkman u等人,(1995)j immunol methods[免疫 学方法杂志]182:41-50;ames rs等人,(1995)j immunol methods[免 疫学方法杂志]184:177-186;kettleborough ca等人,(1994)eur jimmunol[欧洲免疫学杂志]24:952-958;persic l等人,(1997)gene[基 因]187:9-18;burton dr和barbas cf(1994)advan immunol[高级免 疫学]57:191-280;pct申请号pct/gb91/001134;国际公开号wo90/02809、wo 91/10737、wo 92/01047、wo 92/18619、wo 93/1 1236、 wo 95/15982、wo 95/20401和wo 97/13844;以及美国专利号 5,698,426、5,223,409、5,403,484、5,580,717、5,427,908、5,750,753、 5,821,047、5,571,698、5,427,908、5,516,637、5,780,225、5,658,727、 5,733,743和5,969,108。
[0173]
9.4.1多核苷酸
[0174]
在一些方面,本文提供了包含编码与sars-cov-2的刺突蛋白免 疫特异性结合的本文所述的抗体或其抗原结合片段或其结构域(例 如,可变轻链区和/或可变重链区)的核苷酸序列的多核苷酸,和载体, 例如包含此类多核苷酸以在宿主细胞(例如,大肠杆菌(e.coli)和 哺乳动物细胞)中重组表达的载体。
[0175]
在一些方面,本文提供了多核苷酸,其包含编码与sars-cov-2 的刺突蛋白免疫特异性结合并且包含如本文所述的氨基酸序列的抗 体或其抗原结合片段,以及与此类抗体或抗原结合片段竞争结合 sars-cov-2(例如,以剂量依赖性方式)或与和此类抗体或抗原结 合片段相同的表位结合的抗体或抗原结合片段的核苷酸序列。
[0176]
本文还提供编码与sars-cov-2的刺突蛋白特异性结合的本文所 述的抗体或其抗原结合片段的多核苷酸,这些多核苷酸例如通过密码 子/rna优化、异源信号序列置换和消除mrna不稳定元件而得以优 化。通过引入密码子变化(例如,由于遗传密码的简并性而编码相同 氨基酸的密码子变化)和/或消除mrna中的抑制区来生成编码与 sars-cov-2的刺突蛋白特异性结合的抗体或其抗原结合片段或其结 构域(例如,重链、轻链、vh结构域或vl结构域)的优化核酸以 进行重组表达的方法可以通过相应地采用例如美国专利号5,965,726; 6,174,666、6,291,664、6,414,132和6,794,498中描述的优化方法来进 行。
[0177]
可以使用本领域熟知的方法(例如pcr和其他分子克隆方法) 从来自合适的来源(例如杂交瘤)的核酸生成编码本文所述的抗体或 其抗原结合片段或其结构域的多核苷酸。例如,使用可与已知序列的 3
′
和5
′
末端杂交的合成引物进行的pcr扩增可以使用从产生目标抗体 的杂交瘤细胞获得的基因组dna进行。此类pcr扩增方法可以用于 获得包含编码抗体或其抗原结合片段的轻链和/或重链的序列的核酸。 此类pcr扩增方法可以用于获
得包含编码抗体或其抗原结合片段的 可变轻链区和/或可变重链区的序列的核酸。可将扩增的核酸克隆到载 体中以在宿主细胞中表达并进一步克隆,例如以生成嵌合抗体和人源 化抗体或其抗原结合片段。
[0178]
本文提供的多核苷酸可以例如呈rna的形式或呈dna的形式。 dna包括cdna、基因组dna和合成dna,并且dna可以是双链 的或单链的。如果是单链的,则dna可以是编码链或非编码(反义) 链。在一些方面,多核苷酸是缺少一个或多个内源内含子的cdna或 dna。在一些方面,多核苷酸可以是非天然存在的多核苷酸。在一些 方面,多核苷酸是重组产生的。在一些方面,多核苷酸是分离的。在 一些方面,多核苷酸是基本上纯的。在一些方面,多核苷酸是从天然 组分中纯化的。
[0179]
9.4.2细胞和载体
[0180]
在一些方面,本文提供了包含多核苷酸的载体(例如,表达载体), 这些多核苷酸包含编码与sars-cov-2的刺突蛋白结合的抗体及其抗 原结合片段或其结构域的核苷酸序列,以在宿主细胞中,例如在哺乳 动物细胞中重组表达。本文还提供了细胞,例如宿主细胞,这些细胞 包含此类载体以重组表达与sars-cov-2的刺突蛋白结合的本文所述 的抗体或其抗原结合片段(例如,人抗体或其抗原结合片段)。在一 个特定的方面,本文提供了产生本文所述的抗体或其抗原结合片段的 方法,这些方法包括在宿主细胞中表达这种抗体或其抗原结合片段。
[0181]
在一些方面,与sars-cov-2的刺突蛋白特异性结合的本文所述 的抗体或其抗原结合片段或其结构域(例如,本文所述的重链或轻链) 的重组表达涉及含有编码该抗体或其抗原结合片段或其结构域的多 核苷酸的表达载体的构建。一旦获得了编码本文所述的抗体或其抗原 结合片段或其结构域(例如,重链或轻链可变结构域)的多核苷酸, 就可以通过重组dna技术,使用本领域熟知的技术来产生用于产生 该抗体或其抗原结合片段的载体。因此,本文描述了通过表达含有编 码抗体或其抗原结合片段或其结构域(例如,轻链或重链)的核苷酸 序列的多核苷酸来制备蛋白质的方法。可以使用本领域技术人员熟知 的方法来构建含有抗体或其抗原结合片段或其结构域(例如,轻链或 重链)的编码序列及适当的转录和翻译控制信号的表达载体。这些方 法包括例如体外重组dna技术、合成技术以及体内基因重组。还提 供了可复制的载体,这些载体包含可操作地连接至启动子的编码本文 所述的抗体或其抗原结合片段、重链或轻链、重链或轻链可变结构域 或重链或轻链cdr的核苷酸序列。此类载体可以例如包括编码抗体 或其抗原结合片段的恒定区的核苷酸序列(参见例如,国际公开号 wo 86/05807和wo 89/01036;以及美国专利号5,122,464),并且可 以将抗体或其抗原结合片段的可变结构域克隆到这种载体中用于表 达整个重链、整个轻链、或整个重链和轻链两者。
[0182]
可以通过常规技术将表达载体转移至细胞(例如,宿主细胞)中, 然后可以通过常规技术培养所得的细胞以产生本文所述的抗体或其 抗原结合片段(例如,包含表1中提供的抗体的六个cdr、vh、vl、 vh和vl、重链、轻链或重链和轻链的抗体或其抗原结合片段)或其 结构域(例如,表1中提供的抗体的vh、vl、vh和vl、重链或轻 链)。因此,本文提供了含有编码本文所述的抗体或其抗原结合片段 (例如,包含表1中提供的抗体的六个cdr、vh、vl、vh和vl、 重链、轻链或重链和轻链的抗体或其抗原结合片段)或其结构域(例 如,表1中提供的抗体的vh、vl、vh和vl、重链或轻链)的多核 苷酸的宿主细胞,该多核苷酸与启动子可
操作地连接以在宿主细胞中 表达此类序列。在用于表达双链抗体或其抗原结合片段的一些方面, 可以将单独编码重链与轻链两者的载体在宿主细胞中共表达,以用于 表达整个免疫球蛋白,如下所详述。在一些方面,宿主细胞含有载体, 该载体包含编码本文所述抗体的重链和轻链(例如,表1中提供的抗 体的重链和轻链)或其结构域(例如,表1中提供的抗体的vh和vl) 的多核苷酸。在一些方面,宿主细胞含有两种不同的载体,第一载体 包含编码本文所述的抗体或其抗原结合片段的重链或重链可变区的 多核苷酸,而第二载体包含编码本文所述的抗体(例如,包含表1中 提供的抗体的六个cdr的抗体)的轻链或轻链可变区或其结构域的 多核苷酸。在一些方面,第一宿主细胞包含第一载体,第一载体包含 编码本文所述的抗体或其抗原结合片段的重链或重链可变区的多核 苷酸,并且第二宿主细胞包含第二载体,第二载体包含编码本文所述 的抗体或其抗原结合片段(例如,包含表1中提供的抗体的六个cdr 的抗体或其抗原结合片段)的轻链或轻链可变区的多核苷酸。在一些 方面,由第一细胞表达的重链/重链可变区与第二细胞的轻链/轻链可 变区缔合以形成本文所述的抗体或其抗原结合片段(例如,包含表1 中提供的抗体的六个cdr的抗体或其抗原结合片段)。在一些方面, 本文提供了包含这种第一宿主细胞和这种第二宿主细胞的宿主细胞 群。
[0183]
在一些方面,本文提供了载体群,该载体群包含:第一载体,第 一载体包含编码本文所述的抗体或其抗原结合片段的轻链/轻链可变 区的多核苷酸,和第二载体,第二载体包含编码本文所述的抗体或其 抗原结合片段(例如,包含表1中提供的抗体的cdr的抗体或其抗 原结合片段)的重链/重链可变区的多核苷酸。替代性地,可以使用编 码并且能够表达重链多肽和轻链多肽两者的单个载体。
[0184]
可以利用多种宿主表达载体系统来表达本文所述的抗体及其抗 原结合片段(例如,包含表1中提供的抗体的cdr的抗体或其抗原 结合片段)(参见,例如美国专利号5,807,715)。此类宿主表达系统 代表着可以产生并随后纯化目标编码序列的媒介物,而且还代表当用 适当的核苷酸编码序列转化或转染时,原位表达本文所述的抗体或其 抗原结合片段的细胞。这些包括但不限于微生物,诸如用含有抗体编 码序列的重组噬菌体dna、质粒dna或粘粒dna表达载体转化的 细菌(例如大肠杆菌和枯草杆菌(b.subtilis));用含有抗体编码序 列的重组酵母表达载体转化的酵母(例如,酵母属(saccharomyces)、 毕赤酵母属(pichia));用含有抗体编码序列的重组病毒表达载体 (例如,杆状病毒)转化的昆虫细胞系统;用重组病毒表达载体(例 如,花椰菜花叶病毒camv;烟草花叶病毒tmv)感染的或用含有抗 体编码序列的重组质粒表达载体(例如,ti质粒)转化的植物细胞系 统(例如,绿藻类,如莱茵衣藻(chlamydomonas reinhardtii));或 带有含源自哺乳动物基因组的启动子(例如金属硫蛋白启动子)或源 自哺乳动物病毒的启动子(例如,腺病毒晚期启动子;牛痘病毒7.5k 启动子)的重组表达构建体的哺乳动物细胞系统(例如cos(例如 cos1或cos)、cho、bhk、mdck、hek 293、ns0、per.c6、 vero、crl7o3o、hss78bst、hela和nih 3t3、hek-293t、hepg2、 sp210、r1.1、b-w、l-m、bsc1、bsc40、yb/20和bmt10细胞)。 在一些方面,用于表达本文所述的抗体及其抗原结合片段(例如,包 含表1中提供的抗体的cdr的抗体或其抗原结合片段)的细胞是cho 细胞,例如来自于cho gs system
tm
(龙沙(lonza))的cho细胞。 在一些方面,用于表达本文所述的抗体的细胞是人细胞,例如人细胞 系。在一些方面,哺乳动物表达载体是poptivec
tm
或pcdna3.3。在 一些方面,尤其用于表达完整重组抗体分子的
细菌细胞(诸如大肠杆 菌)或真核细胞(例如,哺乳动物细胞)用于表达重组抗体分子。例 如,哺乳动物细胞诸如中国仓鼠卵巢(cho)细胞,与载体诸如来自 人巨细胞病毒的主要立即早期基因启动子元件相结合是抗体的有效 表达系统(foecking mk和hofstetter h(1986)gene[基因]45: 101-105;和cockett mi等人,(1990)biotechnology[生技术]8: 662-667)。在一些方面,本文所述的抗体或其抗原结合片段是由cho 细胞或ns0细胞产生的。
[0185]
另外,可选择调节所插入序列的表达、或以所希望的特定方式来 修饰并且加工基因产物的宿主细胞株。蛋白质产物的此类修饰(例如 糖基化)和加工(例如裂解)可有助于蛋白质的功能。为此,可以使 用具有用于初级转录物的正确加工、基因产物的糖基化和磷酸化的细 胞机器(cellular machinery)的真核宿主细胞。此类哺乳动物宿主细 胞包括但不限于cho、vero、bhk、hela、mdck、hek293、nih 3t3、w138、bt483、hs578t、htb2、bt2o和t47d、ns0(不内 源产生任何免疫球蛋白链的鼠类骨髓瘤细胞系)、crl7o3o、cos (例如,cos1或cos)、per.c6、vero、hss78bst、hek-293t、 hepg2、sp210、r1.1、b-w、l-m、bsc1、bsc40、yb/20、bmt10 和hss78bst细胞。在一些方面,在哺乳动物细胞诸如cho细胞中产 生与sars-cov-2的刺突蛋白特异性结合的本文所述的抗体或其抗原 结合片段。
[0186]
一旦本文所述的抗体或其抗原结合片段已经通过重组表达产生, 就可以通过本领域已知的用于免疫球蛋白分子的纯化的任何方法将 其纯化,例如,通过色谱法(例如,离子交换色谱法、亲和色谱法(特 别是通过对于蛋白质a纯化后的特异性抗原的亲和色谱法)以及尺寸 排阻色谱法)、离心、差别溶解度,或者通过用于蛋白质的纯化的任 何其他标准技术。此外,本文所述的抗体或其抗原结合片段可以融合 至本文所述的或者本领域中另外已知的异源多肽序列,以便促进纯 化。
[0187]
在一些方面,本文所述的抗体或其抗原结合片段是分离或纯化 的。通常,分离的抗体或其抗原结合片段是基本上不含具有与分离的 抗体或其抗原结合片段不同的抗原特异性的其他抗体或其抗原结合 片段的抗体或其抗原结合片段。例如,在一些方面,本文所述的抗体 或其抗原结合片段的制剂基本上不含细胞材料和/或化学前体。
[0188]
9.5药物组合物
[0189]
本文提供了组合物,这些组合物包含在生理上可接受的载剂、赋 形剂或稳定剂中的具有所希望的纯度的本文所述的抗体或其抗原结 合片段或本文所述的抗体或其抗原结合片段的组合(remington’spharmaceutical sciences[雷明顿药物科学](1990)宾夕法尼亚州伊斯顿 马克出版有限公司(mack publishing co.,easton,pa))。载剂、赋 形剂或稳定剂在所采用的剂量及浓度下对接受者无毒。
[0190]
在一些方面,以具有药学上可接受的载剂的配制品的形式提供包 含与sars-cov-2的刺突蛋白结合的至少一种抗体或其抗原结合片段 的组合物(参见例如gennaro,remington:the science and practice ofpharmacy with facts and comparisons:drugfacts plus[雷明顿:有事实 和比较的药学科学和实践:药品事实 ],第20版(2003);ansel等人, pharmaceutical dosage forms and drug delivery systems[药物剂型和 药物递送系统],第7版,lippencott williams和wilkins(2004);kibbe 等人,handbook of pharmaceutical excipients[药用辅料手册],第3版, 医药出版社(pharmaceutical press)(2000))。在一些方面,本文所述 的药物组合物包含与sars-cov-2的刺突蛋白结合
的两种抗体或抗原 结合片段,例如,与sars-cov-2的刺突蛋白的不同表位结合的两种 抗体或其抗原结合片段。在一些方面,本文所述的药物组合物包含与 sars-cov-2的刺突蛋白的受体结合结构域(rbd)的不同表位结合 的两种抗体或抗原结合片段。在一些方面,本文所述的药物组合物包 含与sars-cov-2的刺突蛋白的rbd的非重叠表位结合的两种抗体 或抗原结合片段。在一些方面,本文所述的药物组合物包含可以同时 与sars-cov-2结合的两种抗体或抗原结合片段。在一些方面,本文 所述的药物组合物包含与sars-cov-2刺突蛋白的rbd的不同表位 结合的两种抗体或抗原结合片段,其中第一抗体或其抗原结合片段与 sars-cov-2的刺突蛋白的包含f486和/或n487(例如f486和n487) 的表位结合,并且第二抗体或其抗原结合片段与sars-cov-2的刺突 蛋白的包含g447和/或k444(例如g447和k444)的表位结合。在 一些方面,该药物组合物包含协同量的第一抗体和第二抗体或其抗原 结合片段。在一些方面,该药物组合物包含的第二抗体或其抗原结合 片段(例如,2130)是第一抗体或其抗原结合片段(例如,2196)的 约240倍。在一些方面,该药物组合物包含的第二抗体或其抗原结合 片段(例如,2096)是第一抗体或其抗原结合片段(例如,2196)的 约5倍。
[0191]
本文所述的药物组合物可用于阻断sars-cov-2病毒刺突蛋白与 宿主细胞受体即血管紧张素转化酶2(ace2)的结合。
[0192]
本文所述的药物组合物可用于预防和/或治疗患者中的 sars-cov-2感染或与患者中的sars-cov-2感染有关的一种或多种 病状或并发症。在一些方面,患者可能已经暴露于sars-cov-2。可 以根据本文所述的方法预防和/或治疗的sars-cov-2感染或与 sars-cov-2感染有关的一种或多种病状或并发症的实例包括但不限 于发烧、咳嗽、疲劳、呼吸短促、呼吸困难、肌肉痛、发冷、肌肉痛、 发冷、咽喉痛、味觉或嗅觉丧失、头痛、胸痛、恶心、呕吐和腹泻。 可以根据本文所述的方法治疗的患者中与sars-cov-2感染有关的一 种或多种病状或并发症的其他实例包括但不限于心脏并发症、呼吸系 统并发症、糖尿病并发症、器官衰竭和血凝块。在一些方面,本文提 供的药物组合物可在具有sars-cov-2感染的一种或多种风险因素的 患者中用于治疗或预防sars-cov-2感染或与本文所述的 sars-cov-2感染有关的一种或多种病状或并发症。在一些方面,风 险因素包括但不限于:年满65岁或以上,免疫功能受损,患有慢性 肺部疾病、哮喘或糖尿病中的一种或多种。
[0193]
在一些方面,本文所述的药物组合物用作药物。在一些方面,本 文所述的药物组合物用作诊断剂,例如以检测从患者(例如,人类患 者)获得的样品(例如,分离样品)中sars-cov-2的存在。合适的 样品的实例包括鼻咽样品(例如,拭子样品)和唾液样品。
[0194]
本文提供的用于体内施用的组合物可以是无菌的。这容易通过例 如经无菌滤膜过滤而实现。
[0195]
在一些方面,提供了药物组合物,其中该药物组合物包含与 sars-cov-2的刺突蛋白结合的至少一种(例如,一种或两种)抗体 或其抗原结合片段(例如,两种抗体或其抗原结合片段,其中第一抗 体或其抗原结合片段与sars-co-v2的刺突蛋白的包含f486和/或 n487(例如f486和n487)的表位结合,并且第二抗体或其抗原结合 片段与sars-co-v2的刺突蛋白的包含g447和/或k444(例如g447 和k444)的表位结合)和药学上可接受的载剂。合适的抗体或其抗 原结合片段的实例如上所述。
[0196]
9.6用途和方法
[0197]
9.6.1治疗用途和方法
[0198]
在一些方面,本文提供了阻断受试者中sars-cov-2病毒刺突蛋 白与宿主细胞受体即血管紧张素转化酶2(ace2)的结合的方法,该 方法包括向有需要的受试者施用本文所述的与sars-cov-2的刺突蛋 白结合的抗体或其抗原结合片段,或如以上和本文所述的其药物组合 物。
[0199]
在一些方面,本文提供了预防和/或治疗患者中的sars-cov-2 感染或患者中的与sars-cov-2感染有关的一种或多种病状或并发症 的方法。治疗或预防sars-cov-2感染的方法可包括向有需要的患者 (例如,人类患者)施用与sars-cov-2的刺突蛋白结合的抗体或其 抗原结合片段。
[0200]
在一些方面,本文提供了降低处于获得sars-cov-2感染风险中 的受试者中的感染可能性的方法。降低处于获得sars-cov-2感染风 险中的受试者中的感染可能性的方法可以包括施用与sars-cov-2的 刺突蛋白结合的抗体或其抗原结合片段。
[0201]
在一些方面,本文提供了预防和/或治疗sars-cov-2感染或与 sars-cov-2感染有关的一种或多种病状或并发症的方法。与 sars-cov-2感染有关的病状或并发症包括但不限于发烧、咳嗽、疲 劳、呼吸短促、呼吸困难、肌肉痛、发冷、肌肉痛、发冷、咽喉痛、 味觉或嗅觉丧失、头痛、胸痛、恶心、呕吐和腹泻。在一些方面,本 文提供了预防和/或治疗具有sars-cov-2感染的一种或多种风险因 素的患者中的sars-cov-2感染的方法。在一些方面,风险因素包括 但不限于年满65岁或以上,免疫功能受损,患有慢性肺部疾病、哮 喘或糖尿病中的一种或多种,和/或免疫功能受损。在一些方面,此类 方法包括向有需要的患者(例如,人类患者)施用本文提供的与 sars-cov-2的刺突蛋白结合的抗体或其抗原结合片段,或本文中包 含与sars-cov-2的刺突蛋白结合的抗体或其抗原结合片段的药物组 合物。在一些方面,此类方法包括向有需要的患者(例如,人类患者) 施用本文提供的与sars-cov-2的刺突蛋白结合的两种抗体或其抗原 结合片段,或本文中包含与sars-cov-2的刺突蛋白结合的两种抗体 或其抗原结合片段的药物组合物。这两种抗体或其抗原结合片段可以 是与sars-co-v2的刺突蛋白的包含f486和/或n487(例如f486和 n487)的表位结合的第一抗体或其抗原结合片段和与sars-co-v2的 刺突蛋白的包含g447和/或k444(例如g447和k444)的表位结合 的第二抗体或其抗原结合片段。在一些方面,施用协同量的第一抗体 和第二抗体或其抗原结合片段。在一些方面,施用的第二抗体或其抗 原结合片段(例如,2130)是第一抗体或其抗原结合片段(例如,2196) 的约240倍。在一些方面,施用的第二抗体或其抗原结合片段(例如, 2096)是第一抗体或其抗原结合片段(例如,2196)的约5倍。
[0202]
在一些方面,此类方法包括向有需要的患者(例如,人类患者) 施用包含本文中包含与sars-cov-2的刺突蛋白结合的一种或多种抗 体或其抗原结合片段的组合物。在一些方面,患者存在包括但不限于 以下方面的风险因素:年满65岁或以上,免疫功能受损,患有慢性 肺部疾病、哮喘或糖尿病中的一种或多种。
[0203]
在一些方面,将与sars-cov-2的刺突蛋白结合的抗体或其抗原 结合片段、或药物组合物施用于诊断患有sars-cov-2感染的患者(例 如,人类患者),以阻断sars-cov-2病毒刺突蛋白与患者中的宿主 细胞受体即血管紧张素转化酶2(ace2)的结合。在一些方面,将与 sars-cov-2的刺突蛋白结合的抗体或其抗原结合片段、或药物组合 物施用于处于获得sars-cov-2的风险中的受试者(例如,人类受试 者)。
[0204]
通常,患者是人,但是也可以治疗非人哺乳动物,包括转基因哺 乳动物。
[0205]
在一些方面,本发明涉及本文提供的抗体或其抗原结合片段或药 物组合物,用作药物。在一些方面,本发明涉及本文提供的抗体或其 抗原结合片段或药物组合物,用于预防或治疗sars-cov-2感染的方 法中。在一些方面,本发明涉及本文提供的抗体或其抗原结合片段或 药物组合物,用于治疗受试者中的sars-cov-2感染的方法中,该方 法包括向受试者施用有效量的本文提供的抗体或其抗原结合片段或 药物组合物。
[0206]
在病状的治疗中将会有效的抗体或其抗原结合片段或组合物的 量将取决于疾病的性质。组合物中采用的精确剂量也将取决于施用途 径和疾病的严重性。
[0207]
9.6.2检测和诊断用途
[0208]
本文所述的与sars-cov-2的刺突蛋白结合的抗体或其抗原结合 片段(参见例如,第7.2节)可用于使用本领域技术人员已知的经典 方法测定生物样品(例如,鼻咽样品、唾液样品)中的sars-cov-2 蛋白水平或sars-cov-2水平,这些方法包括免疫测定法(如酶联免 疫吸附测定法(elisa))、免疫沉淀或蛋白质印迹法。合适的抗体 测定标记是本领域已知的,并且包括酶标记,诸如葡萄糖氧化酶;放 射性同位素,诸如碘(
125
i、
121
i)、碳(
14
c)、硫(
35
s)、氚(3h)、 铟(
121
in)和锝(
99
tc);发光标记,诸如鲁米诺;以及荧光标记, 诸如荧光素和若丹明,以及生物素。此类标记可用于标记本文所述的 抗体或其抗原结合片段。替代性地,可以标记识别本文所述的与 sars-cov-2的刺突蛋白结合的抗体或其抗原结合片段的第二抗体或 其抗原结合片段,并且和与sars-cov-2的刺突蛋白结合的抗体或其 抗原结合片段组合使用以检测sars-cov-2蛋白水平。
[0209]
测定sars-cov-2蛋白的表达水平旨在包括直接地(例如,通过 测定或估计绝对蛋白水平)或相对地(例如,通过与第二生物样品中 的疾病相关多肽水平比较)定性或定量测量或估计第一生物样品中的 sars-cov-2蛋白水平。可测量或估计第一生物样品中的sars-cov-2 蛋白表达水平,并与标准sars-cov-2蛋白水平比较,该标准取自从 没有该病症的个体获得的第二生物样品,或者通过求取来自没有该病 症的个体群体的水平的平均值而确定。
[0210]
如本文所用,术语“生物样品”是指从潜在地表达sars-cov-2 的受试者(例如,获得自受试者的分离样品)、细胞系、组织、或其 他细胞来源获得的任何生物样品。用于从动物(例如,人)获得组织 活检物和体液的方法是本领域熟知的。合适的样品的实例包括鼻咽样 品(例如,拭子样品)和唾液样品。
[0211]
本文所述的与sars-cov-2的刺突蛋白结合的抗体或其抗原结合 片段可以携带可检测的或功能性的标记。当使用荧光标记时,可以利 用当前可用的显微镜术和荧光激活细胞分选分析(facs)或本领域 已知的两种程序的组合来鉴定和定量特异性结合成员。本文所述的与 sars-cov-2的刺突蛋白结合的抗体或其抗原结合片段可以携带荧光 标记。示例性的荧光标记包括例如反应性探针和缀合探针,例如,氨 基香豆素(aminocoumarin)、荧光素和德克萨斯红(texas red)、 alexa fluor染料、cy染料和dylight染料。与sars-cov-2的刺突蛋 白特异性结合的抗体或其抗原结合片段可以携带放射性标记,诸如同 位素3h、
14
c、
32
p、
35
s、
36
cl、
51
cr、
57
co、
58
co、
59
fe、
67
cu、
90
y、 99
tc、
111
in、
117
lu、
121
i、
124
i、
125
i、
131
i、
198
au、
211
at、
213
bi、
225
ac和 186
re。当使用放射性标记时,可以利用本领域已知的当前可用的计数 程序来鉴定和定量与sars-cov-2的刺突蛋白结合的抗体或其抗原结 合片段的特异性结
合。在标记是酶的情况下,可以通过本领域已知的 目前利用的比色、分光光度、荧光分光光度、安培或气体定量技术中 的任何一种来完成检测。这可以通过在允许抗体或抗原结合物与 sars-cov-2的刺突蛋白之间形成复合物的条件下,使样品或对照样 品和与sars-cov-2刺突蛋白结合的抗体或其抗原结合片段接触来实 现。抗体或抗原结合片段与sars-cov-2的刺突蛋白之间形成的任何 复合物都在样品中被检测到并且进行比较(任选地和对照进行比较)。 鉴于本文所述的与sars-cov-2的刺突蛋白结合的抗体或其抗原结合 片段对sars-cov-2的特异性结合,可以使用这些抗体或其抗原结合 片段来特异性检测sars-cov-2(例如,在受试者中)。
[0212]
本文还包括一种测定系统,该测定系统可以以测试试剂盒的形式 制备,用于定量分析例如sars-cov-2刺突蛋白的存在程度。该系统 或测试试剂盒可以包含标记的组分,例如标记的抗体或抗原结合片 段,以及一种或多种其他免疫化学试剂。有关试剂盒的更多信息,参 见例如下文第7.7节。
[0213]
在一些方面,本文提供了体外检测样品中的sars-cov-2刺突蛋 白的方法,包括使样品与抗体或其抗原结合片段接触。在一些方面, 本文提供了本文提供的抗体或其抗原结合片段用于体外检测样品中 的sars-cov-2刺突蛋白的用途。一方面,本文提供了在检测受试者 或获自受试者的样品中的sars-cov-2刺突蛋白中使用的本文提供的 抗体或其抗原结合片段或药物组合物。一方面,本文提供了用作诊断 剂的本文提供的抗体或其抗原结合片段或药物组合物。在一些方面, 该抗体包含可检测标记。在一些方面,该受试者是人。
[0214]
9.7试剂盒
[0215]
本文提供了包含一种或多种本文所述的抗体或其抗原结合片段 或其缀合物的试剂盒。在一些方面,本文提供了一种药物包装或试剂 盒,该药物包装或试剂盒包括填充有本文所述的药物组合物的成分, 诸如本文提供的一种或多种抗体或其抗原结合片段的一个或多个容 器。任选地,与这样一个或多个容器相关联的可以是由管理药物或生 物制品的制造、使用或销售的政府机构规定的形式的公告,该公告反 映该机构针对人类施用,对制造、使用或销售的许可。
[0216]
本文还提供了可在诊断方法中使用的试剂盒。在一些方面,试剂 盒在一个或多个容器中包含本文所述的抗体或其抗原结合片段,优选 纯化的抗体或其抗原结合片段。在一些方面,本文所述的试剂盒含有 可以用作对照的基本上分离的sars-cov-2刺突蛋白抗原。在一些方 面,本文所述的试剂盒进一步包含不与sars-cov-2刺突蛋白抗原反 应的对照抗体或其抗原结合片段。在一些方面,本文所述的试剂盒含 有一种或多种用于检测抗体或其抗原结合片段与sars-cov-2刺突蛋 白抗原的结合的要素(例如,抗体或其抗原结合片段可以与可检测底 物(诸如荧光化合物、酶底物、放射性化合物或发光化合物)缀合或 识别第一抗体或其抗原结合片段的第二抗体或其抗原结合片段可与 可检测底物缀合)。在一些方面,本文提供的试剂盒可包括重组产生 的或化学合成的sars-cov-2刺突蛋白抗原。试剂盒中提供的 sars-cov-2刺突蛋白抗原还可附接到固体支撑体上。在一些方面, 以上所述试剂盒的检测装置包括sars-cov-2刺突蛋白抗原所附接到 其上的固体支撑体。这种试剂盒还可以包括未附接的报告因子标记的 抗人抗体或其抗原结合片段或抗小鼠/大鼠抗体或其抗原结合片段。在 这方面,可以通过报告因子标记的抗体或其抗原结合片段的结合来检 测与sars-cov-2的刺突蛋白结合的抗体或其抗原结合片段与 sars-cov-2刺突蛋白抗原的
结合。
[0217]
以说明的方式而不是以限制的方式提供以下实例。
[0218]
10.实例
[0219]
该实例章节(即,第10节)中的实例是以说明的方式而不是以 限制的方式提供的。
[0220]
10.1实例1:sars-cov-2的刺突蛋白的产生
[0221]
sars-cov-2刺突(s)蛋白是有3个受体结合结构域(rbd) 集中在刺突顶部的一种糖蛋白三聚体。s蛋白需要几个步骤来完成能 够结合ace2受体的活性构象。为了表达sars-cov-2刺突(s)蛋 白,克隆rbd(残基334-526)、rbd单突变变体和n端结构域(ntd) (残基16-305)(genbank:mn908947),其具有n端cd33前导 序列以及c端gssg接头、avitag、gssg接头和8xhis标签。在 freestyle 293细胞(赛默飞世尔(thermo fisher))中表达刺突蛋白, 并使用histrap柱(通用电气医疗集团(ge healthcare))通过亲和 色谱法分离,然后用superdex200柱(通用电气医疗集团)通过尺寸 排阻色谱法分离。通过sds-page分析纯化的蛋白质,以确保纯度和 适当的分子量。
[0222]
10.2实例2:与sars-cov-2的刺突蛋白结合的抗体的产生
[0223]
为了制备covid-19特异性中和抗体,按照rimms免疫接种方 案,用sars-cov-2刺突(s)蛋白的受体结合结构域(rbd)对人 源化小鼠进行免疫接种(kilpatrick ke等人,hybridoma[杂交瘤]1997 年8月;16(4):381-9)。从小鼠中分离出来自淋巴结和脾脏的b细胞, 并用于生成杂交瘤(如tkaczyk等人,clin vaccine immunol[临床疫苗 免疫学]2012年3月;19(3):377-85中所述)。在假病毒测定中筛选与 rbd的结合和活性后,使用体外转录和翻译从选定孔中分离v基因 并组合配对(如xiao等人,mabs[抗体]2016年7月;8(5):916-27中所 述)以确认正确的vh和vl对的结合。
[0224]
产生另外的抗体,如zost等人“rapid isolation and profiling of adiverse panel of human monoclonal antibodies targeting the sars-cov-2 spike protein[快速分离和分析靶向sars-cov-2刺突蛋白的多种人单 克隆抗体],”biorxiv(2020)(可在 https://doi.org/10.1101/2020.05.12.091462上获得)。
[0225]
表1中提供了示例性抗体的序列。
[0226]
10.3实例3:抗体效力
[0227]
抗体选择的关键标准是效力。因此,在中和测定法中测试了抗体 的效力。中和测定法使用野生型sars-cov-2和s蛋白假型慢病毒并 在下文描述。所要求保护的抗体表现出特别高的效力,表明抑制感染 的能力提高。
[0228]
s蛋白假型慢病毒的生成
[0229]
接种悬浮293细胞,并用表达荧光素酶的第三代基于hiv的慢病 毒载体连同编码以下蛋白的包装质粒转染:具有c端19个氨基酸缺 失、rev和gag-pol的sars2刺突蛋白。转染后16-20小时更换培养 基,并在24小时后收获病毒上清液。通过低速离心去除细胞碎片, 并使上清液通过0.45μm过滤装置。通过超速离心使假病毒沉淀,然 后将其重悬于pbs中成100倍浓缩原液。
[0230]
假病毒中和测定法
[0231]
在384孔微量滴定板中制备单克隆抗体的连续稀释液,并在37℃ 下与假病毒一起预孵育30分钟,并向其中添加稳定表达ace2的293 细胞。将板放回37℃培养箱中48小时,并
在envision 2105多模式 酶标仪(珀金埃尔默(perkin elmer))上,使用bright-glo
tm
荧光素 酶测定系统(普洛麦格(promega))根据制造商的建议测量荧光素 酶活性。相对于单独的假病毒对照计算抑制百分比。使用graphpadprism软件版本8.1.0通过非线性回归测定ic50值。从至少3个独立 实验中测定每种抗体的平均ic50值。
[0232]
抗体假病毒中和ic50(ng/ml)20827.820943.020963.3210354.621301.621651.221960.7cvh-67.6
[0233]
使用野生型sars-cov-2和假病毒的结果分别示于图1的左图和 右图中。图2中的数据显示,假病毒与野生型sars-cov-2之间的相 关性是一致的。
[0234]
10.4实例4:抗体分组(antibody binning)
[0235]
非竞争性抗体可以组合使用,以降低病毒抗性或逃逸的潜力。因 此,测试了抗体同时与rbd和刺突蛋白三聚体结合的能力。结果示 于图3中。
[0236]
10.5实例5:协同抗体对
[0237]
协同作用的抗体对可以增加效力。因此,检查了与sars-cov-2 的刺突蛋白的不同表位结合的抗体的组合协同作用的能力。如图4所 示的结果证明,未显示出同时结合的抗体(例如,2196 2096或2196 2130)可以具有高协同作用。使用上述假病毒测定法,在每种抗体 的不同浓度下,进一步研究2196 2130和2196 2096抗体组合的协 同活性。如图5a所示,当单个抗体分别显示14%和7%的中和作用, 但它们的组合中和42%的假病毒时,用0.1ng/ml的2196和2.4ng/ml 的2130观察到最大协同作用。在图5b中看到类似的趋势,其中当单 个抗体分别显示15%和23%的中和作用,但它们的组合中和56%的假 病毒时,用2.4ng/ml的2196和12ng/ml的2096观察到最大协同作 用。
[0238]
10.6实例6:丙氨酸扫描
[0239]
使用octet red96仪器(fortebio;颇尔生命科学公司(pall lifesciences))进行生物层光干涉法(bli)。首先通过将10μg/ml(约 200nm)的八组氨酸标记的rbd突变体捕获到五组氨酸生物传感器 上300秒来确认结合。然后将生物传感器浸没在结合缓冲液(pbs/0.2% 吐温20)中洗涤60秒,接着浸入含有150nm nab的溶液中180秒(缔 合),接着随后浸入结合缓冲液中180秒(解离)。将每种rbd突 变体的应答针对野生型rbd归一化。
[0240]
抗体2165、2130、2094、2196和2096的结果示于图6a-6e中。 图7中汇总了组1中示例性抗体的结果(参见图3)。该数据表明 sars-cov-2的刺突蛋白的f486和n487对于与组1抗体的相互作用 很重要。图8中汇总了组4(2094)/组5(2096和2130)中示例性抗 体的结果(参见图3)。该数据表明g447和k444对于与组5抗体的 相互作用很重要。图9示出了sars-cov-2刺突蛋白中对于与组1、 组4和组/5抗体的相互作用很重要的氨基酸的位置。鉴于组1和组5 中的抗体的组合具有高效力,这些数据证明,与sars-cov-2刺突蛋 白的f486和/或
n487和g447和/或k444结合的抗体的组合特别有效。
[0241]
***
[0242]
本发明的范围不受本文描述的方面的限制。实际上,除了本文描 述的那些之外,根据前面的描述和附图,本发明的各种修改对于本领 域技术人员将变得显而易见。此类修改旨在落入所附权利要求书的范 围内。
[0243]
本文引用的所有参考文献(例如,出版物或专利或专利申请)通 过援引以其全文并入本文并用于所有目的,其程度如同具体和单独指 示各个参考文献(例如,出版物或专利或专利申请)通过援引以其全 文并入以用于所有目的一样。
[0244]
一些方面在以下权利要求书的范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。