作为端粒病的治疗方法的用于化学抑制tgs1的药物组合物
技术领域
1.本发明涉及一种tgs1酶(三甲基鸟苷合酶1)的抑制剂,特别是西奈芬净(sinefungin),用于增加端粒酶rna(terc)的剂量并促进端粒长度增长。本发明进一步涉及一种药物组合物,包括这种抑制剂和一种或多种赋形剂。
2.这种抑制剂可用于治疗以端粒过度缩短为特征和/或由端粒过度缩短引起的病症(端粒病)。本发明进一步提供了一种体外方法,以增加terc的剂量并促进从受上述病症影响的病人身上获得的细胞和/或组织中的端粒长度增加。
背景技术:
3.端粒病包括各种由编码蛋白质的基因突变引起的遗传疾病,这些蛋白质调节端粒的稳定性和端粒酶的活性,端粒酶通过保护端粒免于细胞衰老和凋亡来保持端粒的长度不变(niewisch,m.r.&savage,s.a.expert rev hematol,2019)。端粒病,包括先天性角化不良(dc)、再生障碍性贫血、特发性肺纤维化、hoyeraal hreidarsson综合征,都是遗传性疾病,具有一个共同的主要缺陷:端粒过短和不同类型的干细胞的复制能力强烈下降(niewisch,m.r.&savage,s.a.expert rev hematol,2019)。造血系的干细胞尤其受到影响,随之造成贫血和免疫缺陷。治疗的主要希望之一是确定能够平衡端粒功能障碍的原因并促进患者细胞中端粒的延长的策略(boyraz,b.et al.j.clin invest 126,2016;fok,w.c.et al.blood 133,2019)。
4.端粒病的主要发病机制之一是低剂量的terc,即端粒酶的rna成分,其中涉及到其活性的降低,从而导致了端粒的逐渐变短。terc的缺失是由编码rna terc的基因的功能丧失和单倍体不足引起的,或者是由编码parn和dyskerin的基因的隐性突变引起的,这两种蛋白质对rna terc的成熟和稳定至关重要。这三个基因的突变在dc患者中发现的频率很高。对parn和dyskerin基因的突变和terc单倍体不足的特征分析表明,即使这种rna的剂量略有减少,也会产生非常严重的表型后果,并涉及端粒的急剧缩短(armanios,m.&blackburn,e.h.nat rev genet 13,2012)。
5.一个非常有前途的潜力体现在对增加terc剂量的机制的识别上,其目的是平衡患者细胞中端粒的逐渐缩短。因而对确定新的有效治疗方法的兴趣是巨大的。
6.目前可用于治疗端粒病的方法(例如,在骨髓功能不全的疾病如dc中,移植造血干细胞)并不直接作用于主要的致病因素,即短端粒。具体来说,还不存在具有公认效力的化合物,这些化合物可以用来刺激端粒的延长,以治疗端粒病患者,并旨在平衡由端粒酶的rna剂量减少所造成的缺陷。
7.在患者的细胞中再生端粒以增加其复制能力的可能性代表了很好的治疗机会。
8.西奈芬净(sinefungin)
9.西奈芬净是几种核酸特异性甲基转移酶的抑制剂,这些核酸使用腺苷甲硫氨酸(ado-met)作为甲基供体。其作用机制是与ado-met竞争,使其与酶上现有的甲基供体部位结合(schluckebier,g.et al.j mol biol 265,1997)。一些研究表明,西奈芬净具有抗菌
(yadav m.k.et al.biomed res int,2014)和抗病毒(zhao z.et al.bmc bioinformatics 17,2016;hercik k.et al.arch virol 162,2017)的特性,后者是由这种分子阻断甲基转移酶的活性决定的,这种转移酶将甲基添加到病毒rna末端5'处的帽子上(rna鸟嘌呤-n7甲基转移酶)(pugh c.s.et al.j.biol chem 253,1978;zheng s.et al.j biol chem 281,2006;li j.et al.j virol 81,2007)。该分子甚至显示出抗真菌效果,通过抑制mrna帽子的鸟嘌呤-n7甲基转移酶和ado-met合成酶来实现(zheng s.et al.nucleic acids res 35,2007)。参与5'帽修饰途径的酶在病毒、真菌和哺乳动物中是不同的,西奈芬净对真菌帽甲基转移酶的抑制效果是对人类同源物的十倍(chrebet g.l.et al.j biomol screen 10,2005)。西奈芬净对利什曼属原生动物(genus leishmania)(bhattacharya a.et al.mol cell biol 12,1992)、锥虫属(trypanosoma)(mcnally k.p.&agabian n.mol cell biol 12,1992)、疟原虫属(plasmodium)(trager w.et al.exp parasitol 50,1980)和痢疾阿米巴(entamoeba histolytica)(ferrante a.et al.trans r soc trop med hyg 78,1984)显示出抑制性活性。用西奈芬净治疗增加了感染弓形虫(ferrante a.et al.c r acad sci iii 306,1988)和各种绝缘的利什曼虫(avila j.l.am j trop med hyg 43,1990;paolantonacci p.et al.antimicrob agents chemother 28,1985)的小鼠的存活率,而没有显示出临床上可检测的毒性。然而,在山羊(zweygarth e.et al.trop med parasitol 37,1986)和狗(robert-gero m.et al.nato asi series book series(nssa,volume 171)leishmaniasis,1989)中进行的两项高剂量研究中发现了肾毒性效应。已经开发和测试了不同的西奈芬净的类似物(devkota k.et al.acs med chem lett 5,2014;zheng w.et al.j am chem soc 134,2012;liu q.et al.bioorg med chem 25,2017;niitsuma m.et al.j antibiot(tokyo)63,2010;tao z.et al.eur j med chem 157,2018)以优化其抗寄生虫的特性。其与s-腺苷甲硫氨酸的相似性,使西奈芬净作为胱硫醚β合成酶的动力学稳定剂成为了高胱氨酸尿症的潜在治疗佐剂(majtan t.et al.biochimie 126,2016)。此外,在小鼠肾纤维化模型中用西奈芬净治疗,通过其对set7/9赖氨酸甲基转移酶的抑制活性确定了病理学上的改善(sasaki k.et al.j am soc nephrol 27,2016)。
10.一项最终确定hiv病毒转录物帽甲基化特征的研究表明,西奈芬净在人体细胞中抑制rna超甲基化酶tgs1(yedavalli v.s.&jeang k.t.proc natl acad sci 107,2010)。tgs1三甲基化由聚合酶ii转录的各类rna的单甲基鸟苷帽,其中包括snrna、snorna、不同病毒rna和端粒酶rna。tgs1已被证明参与酿酒酵母和粟酒裂殖酵母中端粒酶的rna生物发生(franke j.et al.j cell sci 121,2008;tang w.et al.nature 484,2012)。yedavalli等人证明了用西奈芬净的治疗通过限制感染活性来抑制未剪接或部分剪接的hiv病毒转录物的核质转运(yedavalli v.s.&jeang k.t.proc natl acad sci 107,2010)。
技术实现要素:
11.在测试西奈芬净对terc或tgs1的其他靶rna的影响方面,西奈芬净作为tgs1抑制剂的作用没有被进一步探索,也从未在人体细胞中进行过检测。经过广泛的实验,发明人发现,对terc单甲基鸟苷帽进行三甲基化的rna超甲基化酶tgs1(三甲基鸟苷合酶1)是该rna剂量的负调节剂,并且tgs1中的突变诱导培养细胞中的端粒酶活性显着增加且延长培养细胞中的端粒。
12.本发明基于以下发现:通过抑制剂对培养的人体细胞中的tgs1酶进行化学抑制,通过防止rna terc降解和通过确定可用于掺入端粒酶的量的增加,以及随后的对端粒酶活性的刺激来稳定rna terc,从而导致端粒的净延长。
13.具体地,如先前的研究所示,发明人证明了s-腺苷甲硫氨酸的类似物西奈芬净是一种抑制tgs1甲基转移酶活性的药剂(yedavalli v.s.&jeang k.t.proc natl acad sci 107,2010)。
14.这些研究代表了调节端粒酶生物发生领域的绝对新颖性,并且通过检测作为由端粒酶活性降低和端粒过度缩短引起的病状的治疗靶点的tgs1,证明了通过遗传或化学途径,特别是通过西奈芬净抑制tgs1,使得terc的剂量增加。鉴于此类治疗的效果,这一发现在治疗领域具有巨大的应用潜力。
15.因此,本发明的第一方面是一种用于预防和/或治疗以端粒病为特征和/或由端粒病引起的病状的tgs1酶抑制剂,特别是西奈芬净。本发明的第二方面是一种包含tgs1酶抑制剂和一种或多种赋形剂的组合物。由于其活性成分,本发明涉及的组合物可以通过tgs1酶抑制剂的有效性改善与端粒病相关的和/或由端粒病引起的病状。
16.本发明的第三方面是一种增加人体细胞和/或组织中的端粒酶rna(terc)剂量和促进端粒长度增长的体外方法。所述方法包括对从受以端粒病为特征的和/或由端粒病引起的病状影响的患者获得的细胞和/或组织绝缘,然后用tgs1酶抑制剂或用包含所述tgs1酶抑制剂和一种或多种赋形剂的组合物处理所述细胞和/或组织。
17.本发明实施例的进一步应用和优点将通过以下详细描述显而易见。
附图说明
18.图1
19.图示西奈芬净对端粒酶作用的模型。tgs1负向调节端粒酶的rna成分即terc的丰度。西奈芬净通过抑制tgs1,决定了terc的剂量增加,致使活性端粒酶亚单位数量的增加以及随之发生的端粒的延长。
20.图2
21.西奈芬净与s-腺苷甲硫氨酸类似,抑制由tgs1催化的超甲基化反应。(a)在100μm存在或不存在的情况下,将1μg重组gst-tgs1或gst与50μm的[3h-ch3]adomet(sam),以及5mm的m7gtp(mmg)孵化,进行超甲基化体外试验;将反应混合物的等分试样放置在纤维素-聚乙烯亚胺上,用tlc法解析反应产物;通过液体闪烁计数的方式定量3h-ch3在mmg的甲基化衍生物(dmg或tmg)中的结合。(b)在没有蛋白质或gst的情况下进行对照反应。(c)显示了3h-甲基向二核苷酸帽转移的实体。
[0022]
图3
[0023]
西奈芬净决定了htr剂量的增加和端粒的延长。(a、e)对umuc3细胞(a)或hela parn ko细胞系(e)的rna上的htr水平进行qrt-pcr分析,无论是否使用50μm西奈芬净处理10天。条形表示经处理的细胞和未处理的细胞中htr水平的变化,通过三个平行测定得到。
[0024]
(b、d、f)通过端粒限制性片段分析法(trf,根据roake,c.m.et al.mol cell74,2019中所述的方法进行)在两种表现出短端粒特征的细胞类型中测定端粒长度:umuc3肿瘤细胞系和缺乏tgs1或去腺苷酶parn的hela细胞。
[0025]
(b、d)对从具备tgs1(umuc3亲代,tgs1 wt)或缺乏tgs1(tgs1 r1,tgs1r2)的umuc3细胞中提取的基因组dna进行trf分析,这些细胞在经过指定时间的培养过程中通过或不通过西尼芬净进行处理(所有细胞系在实验中都显示出翻倍时间的可比性)。在经处理的对照组细胞中发生端粒的延长(对比b和d中的第1和2泳道),但在经处理的突变克隆tgs1 r1和r2中没有发生(对比d中的第4和5泳道、第7和8泳道)。在未处理的亲代细胞中没有观察到端粒的延长(第9-10泳道)。
[0026]
(f)hela parn ko细胞在指定的培养时间内经过或不经过50μm的西奈芬净进行处理。由于端粒酶的rna成分降低,parn ko细胞(第13泳道)的平均端粒长度要比亲代hela细胞系的短。
[0027]
(4.5kb vs 7.5kb)用西奈芬净治疗46天后,注意到hela parn ko细胞中端粒的延长(第1和2泳道)。
具体实施方式
[0028]
术语表
[0029]
除非另有说明,本说明书中使用的术语为本领域技术人员理解的一般含义。
[0030]
在本说明书中的缩写tgs1指定为三甲基鸟苷合酶1蛋白,其特点是具有甲基转移酶活性,即从供体分子转移甲基到受体的能力。更具体地,tgs1与人类酶有关(见uniprot q96rs0(tgs1_human))。这种酶对鸟嘌呤(g)残基具有特异性,例如,它参与由聚合酶ii转录的各种类型的rna的单甲基鸟苷帽的三甲基化,其中包括snrna、snorna、不同的病毒rna和端粒酶的rna。
[0031]
本技术中的缩写terc,也被称为tr、htr或ter,表示端粒酶复合物的rna成分(端粒酶rna成分)。terc成分也被称为“模板区(mould region)”,因为它是在端粒酶(逆转录酶)作用下的端粒延长的模板。terc的核苷酸序列主要由胞嘧啶(c)和腺苷(a)的残基组成,与物种特定的端粒序列互补,因此通过引导端粒dna的正确合成,促进染色体的端粒末端和酶复合物的催化部位之间的配对。
[0032]
在本发明的一般术语“端粒病”下,指以端粒缩短为特征和/或由端粒缩短引起的所有病状和/或综合征。这些病状包括所有由直接参与端粒代谢的基因突变引起的疾病,称为“原发性端粒病”,那些具有类似症状但由控制dna修复的基因引起的疾病,称为“继发性端粒病”(opresko,p.l.&shay,j.w.ageing res rev 33,2017),甚至所有已证明短端粒代表易感因素的病症和/或疾病(armanios,m.mutat res 730,2012),例如,肺气肿(stanley,s.e.et al.j clin invest 125,2015)。
[0033]“平均端粒长度”(缩写为ltm),是指染色体末端区域的平均长度,由高度重复的dna组成。由于这种物理量涉及双链dna的序列,其一般是根据组成所述序列的碱基对数(缩写为pb,或bp或bps)来衡量的。通常这种序列的大小需要使用缩写“kbp”,等于一千对碱基。不同物种之间的平均端粒长度是不同的。在人类中,端粒在出生时的平均长度为12至15kb。端粒在儿童时期迅速缩短,之后在成人时期每年减少大约0-100bp,其速度根据细胞的类型、暴露于氧化环境或心理压力以及其他因素(包括直接参与端粒代谢的基因或控制dna修复的基因的突变)而不同。
[0034]
如上所述,本发明的一方面涉及一种用于预防和/或治疗以端粒病为特征和/或由
端粒病引起的病状的tgs1(三甲基鸟苷合酶1)酶抑制剂。tgs1酶三甲基化terc单甲基鸟苷的帽,是该rna剂量的负调节剂,因此抑制tgs1使得人细胞中端粒酶terc的rna成分的剂量增加,且决定了端粒的延长。
[0035]
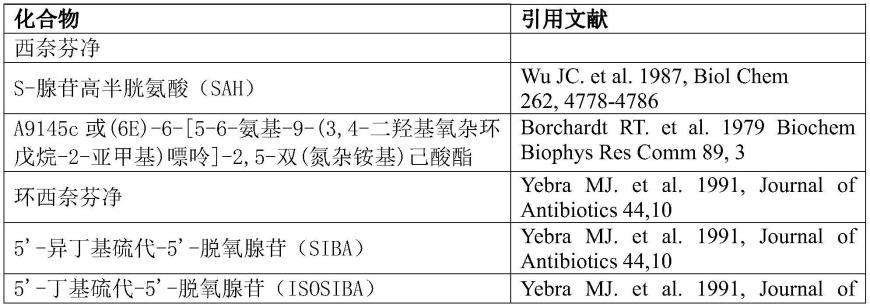
根据本发明的一方面,tgs1酶的抑制剂是s-腺苷甲硫氨酸的竞争性抑制剂。适用于本发明的抑制剂的非限制性示例可选自如表1所示的化合物。表1表1
[0036]
根据本发明,tgs1酶的抑制剂优选为甲基转移酶活性的抑制剂西奈芬净。西奈芬净是一种天然核苷,类似于s-腺苷甲硫氨酸,它具有以下结构:
[0037]
本发明进一步涉及一种组合物,包括根据本文所述实施例之一的所述tgs1酶的抑制剂和一种或多种赋形剂。
[0038]
根据本发明的组合物的一个非限制性的示例包括选自那些通常现有技术已知的赋形剂,如稀释剂(例如二盐基磷酸钙、乳糖、微晶纤维素和纤维素衍生物)、吸收剂、吸附剂、润滑剂、粘合剂、崩解剂、表面活性剂、抗氧化剂、防腐剂、乳化剂、湿润剂、螯合剂和它们的混合物。
[0039]
根据本发明的组合物可以进一步包括保护性化合物,在某些情况下,可以有利于抑制剂在相关细胞中的运输和/或特定释放。这种化合物可以包括本领域已知的任何药理学运输系统,例如生物相容性聚合物、微粒子系统、脂质体、纳米结构材料、光敏胶囊、纳米颗粒、阳离子脂质。
[0040]
本发明组合物的给药途径包括但不限于:口服途径、动脉内途径、鼻内途径、腹膜内途径、静脉内途径、肌内途径、皮下途径或经皮途径。
[0041]
根据本发明的一方面,通过根据本文所述的剂型的tgs1酶抑制剂或包含这种抑制剂的组合物决定的平均端粒长度的增加至少为0.5kb。
[0042]
本发明还涉及根据本文所述实施方案中任一项的tgs1酶抑制剂或包含所述抑制剂的组合物在预防和/或治疗以短端粒为特征的所有病状中的用途,如表2所示。
[0043]
在这些病状中,有一些是由直接参与端粒代谢的基因突变引起的疾病(原发性端粒病),或者有一些是那些具有类似症状但由控制dna修复的基因引起的疾病(继发性端粒病)(opresko,p.l.&shay,j.w.ageing res rev 33,2017)。这些类别包括但不限于:再生障碍性贫血、coats’plus综合征、先天性角化不良、hoyeraal hreidarsson综合征、急性白血病、特发性肺纤维化、revesz综合征、共济失调毛细血管扩张症、bloom综合征、werner综合征、recql4障碍、早衰症(hutchinson-gilford progeria)。
[0044]
其他以短端粒为特征的病状包括那些被证明短端粒作为其条件的一个易感因素(armanios,m.mutat res 730,2012)。这些包括特发性肺纤维化,非特异性肺炎,闭塞性支气管炎组织性肺炎,慢性超敏性肺炎,间质性纤维化,肺气肿、肺气肿合并肺纤维化、巨细胞症、细胞减少症、骨髓发育不良、骨髓发育不全、骨髓增生异常综合征、急性髓细胞白血病、转氨酶升高、萎缩、纤维化、隐性肝硬化。表2可从治疗中受益的以短端粒为特征的临床病症(修改自armanios,m.mutat res 730,2012;stanley,s.e.et al.j clin invest 125,2015)。
[0045]
本发明另一方面涉及在体外使用tgs1酶抑制剂来增加端粒酶rna(terc)剂量并促进人细胞和/或组织中的端粒长度增加。
[0046]
本发明另一方面涉及一种增加端粒酶rna(terc)剂量和促进人细胞和/或组织中端粒长度增加的体外方法。所述方法包括用tgs1酶抑制剂或用包含该抑制剂和一种或多种赋形剂的组合物处理培养细胞和/或组织,其中该细胞和/或组织从患有以端粒病为特征的和/或由端粒病引起的病状影响的患者获得。
[0047]
可以通过根据本发明的体外方法处理的细胞的非限制性示例包括:上皮细胞、内皮细胞、神经系统细胞、血细胞、免疫系统细胞、角质细胞、纤维母细胞或成肌细胞。通过本发明的体外方法处理的细胞可以包括肿瘤细胞和/或非肿瘤细胞。在本发明的一方面,处理的细胞优选为诱导多能干细胞和/或用于制造诱导多能干细胞的细胞,因为这些细胞能够分化不同的细胞系。
[0048]
本技术中描述的方法可用于体外处理多种应用中使用的细胞,其中包括自体或异源细胞治疗、组织工程、人造器官的生长、诱导多能干细胞的产生或细胞分化技术。
[0049]
诱导的来自患者的多能干细胞可以用tgs1抑制剂处理以获得端粒恢复到最佳长度的自体细胞来源,目的是提高移植成功率。这种方法可避免与同种异体干细胞移植中经常发现的供体相容性相关的问题。如果治疗显示在有机体水平上具有良好的耐受性,则可以构成移植的替代方案,这将允许改善移植不可行的患者的预后。
[0050]
抑制剂化合物的浓度将根据特定细胞类型在合适的毒理学试验中的反应来确定,旨在评估所检查化合物的最小剂量,在治疗1周后能够产生≥1.5倍的rna terc增加而不会引起增长率的变化。必须在处理一个月后评估相关端粒延长的测量,并且相对于未处理的对照细胞的长度增加≥0.5kb将被认为是显著的。
[0051]
对于体外治疗,化合物或组合物可以通过使用细胞生物学、细胞培养、组织培养等领域的现有技术中包含的任何技术来施用。根据期望的端粒延伸百分比,根据本发明的方
法的治疗可以进行一次或多次。在本发明的一个方面,细胞和/或组织的体外处理可以持续不超过96小时、不超过72小时、不超过48小时、不超过36小时、不超过24小时、不超过18小时、不超过12小时、不超过8小时,或甚至更少的时间。根据本发明的一个方面,这种体外使用方法甚至包括(a)从培养细胞中提取基因组dna和(b)分析平均端粒长度(ltm)。这种分析可以通过“端粒限制片段分析”(trf)进行。
[0052]
本文还描述了一种体内方法,包括根据所述实施例中任一项所述的体外方法的步骤和用于从患者获得细胞和/或组织的初步步骤和/或处理过的细胞再灌注治疗后的步骤。
[0053]
根据本发明的任一实施例的体外方法还可用于评估和选择tgs1酶的替代抑制剂化合物,可潜在用于预防和/或治疗以端粒病为特征和/或由端粒病引起的病症。因此,本发明还涉及用于鉴定用于预防和/或治疗以端粒病为特征和/或由端粒病引起的病症的候选化合物的体外筛选方法,包括以下步骤:
[0054]
(i)在所述候选化合物存在和不存在的情况下测定tgs1酶的甲基转移酶活性;
[0055]
(ii)用该候选化合物处理培养的细胞和/或组织,其中该细胞和/或组织以端粒病为特征;
[0056]
(iii)分析处理步骤(ii)之前和之后的平均端粒长度,其中该处理步骤之后平均端粒长度增长表明化合物适用于预防和/或治疗以端粒病为特征和/或由端粒病引起的病状。
[0057]
根据本发明的体外筛选方法的一个实施例,步骤(i)的tgs1酶甲基转移酶活性测定可以通过超甲基化测定进行。
[0058]
根据本发明的一个方面,超甲基化测定包括以下步骤:
[0059]
(a)在存在或不存在所述候选化合物的情况下,使tgs1酶与甲基供体化合物和底物接触;
[0060]
(b)分离和量化产生的该底物的甲基化衍生物。
[0061]
在根据本发明的体外筛选方法的一个优选实施方案中,所述使用的tgs1酶是与gst标签融合的重组tgs1酶,并且固定在固体支持物上,例如谷胱甘肽珠,所述甲基供体化合物为[3h-ch3]腺苷甲硫氨酸(ado-met),所述底物为m7gtp(mmg)。
[0062]
根据本发明的一个方面,在步骤(b)超甲基化测定中,底物产生的甲基化衍生物的分离可以通过薄层色谱(tlc)进行,而定量可以通过液体闪烁计数进行。
[0063]
在根据本发明的体外筛选方法的一个实施方案中,分析平均端粒长度的步骤(iii)可以在从培养的细胞中提取基因组dna后通过“端粒限制性片段分析”(trf)进行。
[0064]
根据本发明的一个方面,所述体外筛选方法可以进一步包括在处理步骤(iii)之后的确定端粒酶的rna剂量的附加步骤,例如通过qrt-pcr和northern印迹,其中端粒酶的rna剂量的增加表明该化合物适用于预防和/或治疗以端粒病为特征和/或由端粒病引起的病状。
[0065]
根据本文所述实施方案中任一项的体外筛选方法甚至可以包括在存在和不存在所述候选化合物的情况下确定端粒酶的催化活性的步骤,例如通过“端粒重复扩增方案”(trap),其中端粒酶催化活性的增加表明该化合物适用于预防和/或治疗以端粒病为特征和/或由端粒病引起的病状。
[0066]
实例
[0067]
体外研究
[0068]
图1的模型示出本发明涉及的已确定机制。在图3所示的实验中,证明了西奈芬净在诱导端粒延长方面极为有效。西奈芬净被施用于两种端粒非常短的细胞系,之前已经对其进行了表征:突变umuc3细胞和parn去腺苷酶(dc的致病因素之一)的hela细胞;在用西奈芬净处理的细胞中,注意到端粒显著延长。
[0069]
用重组gst-tgs1酶进行体外超甲基化测定
[0070]
采用与蛋白gst融合的重组tgs1酶,通过重组体外超甲基化试验评价西奈芬净抑制tgs1酶甲基转移酶活性的能力。从细菌细胞中纯化tgs1-gst(仍固定在谷胱甘肽珠上或单独的gst上)后,在存在或不存在西奈芬净的情况下进行测定,使用[3h-ch3]adomet作为甲基供体且m7gtp(mmg)作为底物。如图2a所示,在含有野生型(wt)酶的反应混合物中(gst-tgs1,蓝线),两个峰很可能对应于m7gtp底物上的甲基转移产物,该产物转化为m
2,7
gtp(dmg)和m
2,2,7
gtp(tmg)。在不含任何蛋白质的反应中,或在仅含有gst珠的反应中(图2b),仅显示一个峰,可能对应于[3h-ch3]adomet的色谱迁移率。当向反应混合物中加入100μm西奈芬净时,只显示了一个与[3h-ch3]adomet共迁移的峰(图2a,红线),以确认西奈芬净抑制tgs1甲基转移酶活性的能力(图2c)。
[0071]
用西奈芬净处理umuc3细胞
[0072]
测试了西奈芬净对特征为活性端粒酶的htr水平低和短端粒的umuc3膀胱肿瘤细胞系的作用(xu l.&blackburn e.h.mol cell 28,2007)。umuc3细胞用西奈芬净100μm处理10天,然后测定rna htr的水平。处理后的细胞显示htr的水平增长至处理过的突变细胞的1.5倍(图3a),表明对tgs1的化学抑制对htr剂量的影响与通过tgs1酶的突变诱导的剂量完全相当。特别地,当umuc3细胞在西奈芬净的存在下培养至超过15次群体倍增时,观察到端粒延长(图3b)。为了确认西奈芬净能够特异性地攻击tgs1酶,在特征为crispr诱导的tgs1突变的umuc3细胞的克隆上测试了使用西奈芬净进行处理(chen等人)(图3c),其中由于tgs1的缺乏,端粒随着时间的推移而延长(图3d)。在存在或不存在西奈芬净的情况下,将对照细胞和突变细胞培养46天。与对照细胞相反,在用西奈芬净处理的tgs1酶突变的umuc3细胞中观察到端粒的额外延长(图3d,对比泳道4和5、7和8)。这一观察结果表明西奈芬净对端粒长度的影响是tgs1失活的结果。
[0073]
用西奈芬净处理hela parn ko细胞
[0074]
测试了西奈芬净对parn去腺苷酶(parn ko)突变的hela细胞(先天性角化不良的致病因素之一)的影响(tummala et al.,2015)(roake c.m.et al.mol cell 74,2019)。从s.artandi(斯坦福大学)的实验室获得的parn ko细胞由于端粒酶的rna成分水平低而具有短端粒的特点。用西奈芬净治疗10天后,观察到parn ko细胞中htr水平显著增加(图3e)。此外,作为在以低htr水平为特征的细胞中用西奈芬净治疗的有效性的指示因素,在用西奈芬净处理46天后观察到parn ko细胞的端粒长度显著增加(图3f)。
[0075]
结论
[0076]
本发明基于以下发现:在tgs1酶的甲基转移酶活性中使用抑制剂特别是西奈芬净,决定了端粒酶的rna成分剂量的增加并促进了端粒的延长。西奈芬净已上市,但从未在人体细胞上以刺激端粒酶和诱导端粒延长为目的进行过测试。在本发明中,通过证明其在端粒延长中的有效性,表现了抑制tgs1对六种不同类型的具有肿瘤衍生的永生化细胞的作
用。
[0077]
鉴于这样的治疗效果,本发明提出了一种体外方法来增加端粒酶rna的剂量并促进人体细胞和/或组织中端粒长度的增加,这些细胞和/或组织来源于受以端粒病为特征和/或由端粒病引起的病状影响的患者。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。