用于整合原位空间测定的方法和组合物
1.相关申请的交叉引用
2.本技术要求2020年2月21日提交的名称为“methods for determining location of a biological analyte in a biological sample”的美国临时申请号62/980,078和2020年11月9日提交的名称为“methods and compositions for integrated in situ spatial assay”的美国临时申请号63/111,518的优先权权益,所述申请的内容出于所有目的以引用的方式整体并入本文。
技术领域
3.本公开在一些方面涉及用于样品中的生物靶标的整合原位空间测定的方法和组合物。
背景技术:
4.对样品中的生物靶标进行谱分析(profiling),如细胞的基因组学、转录组学或蛋白质组学谱分析,对于许多目的都是必不可少的,如了解细胞身份的分子基础和开发用于疾病的治疗。显微术成像(其可解析样品中的多种分析物)提供有价值的信息,如分析物丰度和原位分析物的空间信息。目前的基于原位杂交和测序的方法效率低,但这种组织内分析的潜在价值可能是巨大的。因此,需要新的和改进的原位分析方法。
技术实现要素:
5.在一些实施方案中,本文公开了一种用于分析生物样品中的靶核酸的方法,所述方法包括使生物样品(例如,组织样品,如组织切片)与一个或多个探针(例如,核酸探针)接触,所述一个或多个探针直接或间接地与所述生物样品中的第一靶核酸杂交。在一些实施方案中,生物样品被提供在第一基底上。生物样品可包括细胞,例如,从活检物或细胞培养物分离的细胞,所述细胞沉积在表面上。生物样品可例如在诸如聚合物基质或水凝胶的基质中任选地可逆交联。在一些实施方案中,生物样品是经加工的或清除的组织样品。在一些实施方案中,方法包括通过检测所述第一靶核酸和/或所述一个或多个探针或其产物来在原位例如在所述生物样品中的空间位置处分析所述第一靶核酸,而所述第一靶核酸和/或所述一种或多种探针或其产物不与直接或间接地固定在第二基底上的捕获剂结合。在一些实施方案中,第二基底是在其上提供所述生物样品的第一基底。在一些实施方案中,第二基底与所述第一基底分开,尽管基底的材料和/或其上的分子在所述第一基底与所述第二基底之间可相同或不同。
6.在一些实施方案中,第一基底和/或第二基底包含直接或间接地固定在其上的多种捕获剂(例如,捕获探针),并且多种捕获剂中的一者或多者(例如,一个或多个捕获探针,如每个捕获探针)包含(i)能够捕获核酸的捕获结构域和(ii)对应于所述捕获探针在所述基底上的位置的定位结构域(例如,包含核酸序列的空间条形码)。
7.在一些实施方案中,方法包括对一种或多种分析物和/或其产物的原位分析,和/
或对用于所述样品中的一种或多种分析物的一个或多个探针(和/或其产物)的原位分析。在一些实施方案中,方法包括在所述生物样品的空间位置处检测用于所述一种或多种分析物的一个或多个探针。在一些实施方案中,一个或多个探针中的至少一者包含指示所述第一靶核酸中的序列(或其互补序列)的条形码序列。在一些实施方案中,生物样品在所述基底上成像以例如通过原位分析如原位测序确定所述条形码序列的序列或其互补序列,所述互补序列可位于所述至少一个探针或其产物中。在任何前述实施方案中,在原位分析之前或期间,与所述分析物结合的分析物(和/或其产物)和/或探针(和/或其产物)不与固定在人工阵列(例如,包含含有空间条形码的核酸探针的阵列)上的捕获剂结合,尽管所述分析物和/或其产物和/或所述探针和/或其产物可例如通过核酸杂交或与所述生物样品中的其它组分或与诸如聚合物基质或水凝胶的基质的可逆或不可逆交联固定在所述生物样品中。
8.在一些实施方案中,方法还包括提供允许所述第一基底和/或所述第二基底上的捕获剂捕获第二靶核酸或其互补序列或其产物(例如,扩增产物)的条件。在一些实施方案中,方法包括使可逆交联的组织样品去交联,从而允许所述捕获剂捕获第二靶核酸或其互补序列或其产物(例如,扩增产物)。
9.在任何前述实施方案中,(分析物和/或用于所述分析物的探针)的所述产物可以是杂交产物、连接产物、延伸产物(例如,通过dna或rna聚合酶)、复制产物、转录/逆转录产物和/或扩增产物,如滚环扩增产物。
10.在一些实施方案中,第二靶核酸或其互补序列或其产物被固定在所述第二基底(例如,包含固定化核酸分子的人工阵列)上的位置处的捕获剂捕获,并且所述捕获剂的定位结构域(例如,空间条形码)对应于所述捕获探针在所述第二基底上的位置。在一些实施方案中,经捕获的分子的产物例如使用与所述经捕获的分子杂交的一个或多个探针在所述第二基底上的所述位置处产生。在一些实施方案中,经捕获的分子和/或其产物在它们存在于所述位置时不进行检测或分析;相反,将所述经捕获的分子和/或其产物从所述第二基底移除并随后例如通过对经移除分子库进行测序而进行检测或分析,所述经移除分子包括包含所述第二靶核酸序列或其互补序列的分子和所述定位结构域(例如,空间条形码)的序列那些。在一些实施方案中,经捕获的分子和/或其产物在它们保持在所述第二基底上的所述位置时不与可检测标记的探针(例如,荧光标记的探针)接触。在一些实施方案中,经捕获的分子的产物是引物延伸产物或逆转录产物。在一些实施方案中,经捕获的分子的产物不是滚环扩增产物。在一些实施方案中,经捕获的分子的产物是滚环扩增(rca)产物,但所述方法不包括在所述第二基底上的所述位置处检测所述rca产物。
11.在本文公开的任何实施方案中,第一靶核酸和第二靶核酸可相同或不同。在本文公开的任何实施方案中,第二靶核酸可包含所述第一靶核酸或其互补序列或其产物(例如,杂交产物、连接产物、延伸产物(例如,通过dna或rna聚合酶)、复制产物、转录/逆转录产物和/或扩增产物)中的一者或多者。在本文公开的任何实施方案中,第一靶核酸和第二靶核酸可包含重叠序列,或者可在序列上不重叠。
12.在一些实施方案中,方法还包括产生空间标记的多核苷酸,所述空间标记的多核苷酸包含(i)所述第二靶核酸的序列或其互补序列和(ii)所述定位结构域(例如,空间条形码)的序列或其互补序列。在一些实施方案中,空间标记的多核苷酸由经捕获的核酸产生,其中使所述多核苷酸的全部或部分从所述基底释放用于分析。在一些实施方案中,本文公
开的方法用于分析所述生物样品中所述第一靶核酸和第二靶核酸的存在/不存在、分布、位置、量、水平、表达或活性。
13.在任何前述实施方案中,捕获剂不需要被提供在所述生物样品所在的同一基底上。换言之,所述生物样品可位于第一基底上用于原位分析,并且已经完成所述原位分析的样品中的分子可与一个或多个第二基底接触。在多个第二基底的情况下,所述样品可顺序地与每个第二基底接触,或者如果两个或更多个第二基底仅覆盖所述样品的子区域,则可并行地接触。一个或多个所述第二基底可与一个或多个第三基底接触以制造所述第二基底的复制品。
14.在一些实施方案中,本文公开了一种用于分析生物样品中的靶核酸的方法,所述方法包括使基底上的生物样品(例如,组织样品,如组织切片)与一个或多个探针(例如,核酸探针)接触,所述一个或多个探针直接或间接地与所述生物样品中的第一靶核酸或其互补序列或扩增产物杂交。所述基底可包含直接或间接地固定在其上的多种捕获剂,其中所述多种捕获剂中的一种捕获剂包含(i)能够捕获核酸的捕获结构域和(ii)对应于所述捕获剂在所述基底上的位置的空间条形码。在一些实施方案中,方法还包括在所述生物样品的空间位置处检测所述一个或多个核酸探针,以及提供允许所述捕获剂直接或间接地捕获第二靶核酸或其互补序列或扩增产物的条件。在一些实施方案中,方法产生空间标记的多核苷酸,所述空间标记的多核苷酸包含所述第二靶核酸的序列或其互补序列和所述空间条形码的序列或其互补序列。在一些实施方案中,使所述生物样品与直接或间接地与所述生物样品中的第一靶核酸或其互补序列或扩增产物杂交的一个或多个探针(例如,核酸探针)接触,并且在允许所述捕获剂直接或间接地捕获第二靶核酸或其互补序列或扩增产物检测之前检测所述探针。
15.在另一个方面,本文公开了一种用于分析生物样品的方法,所述方法包括使第一基底上的生物样品与一个或多个核酸探针接触,所述一个或多个核酸探针直接或间接地与所述生物样品中的第一靶核酸或其互补序列或扩增产物杂交。在一些实施方案中,方法还包括在所述生物样品的空间位置处检测所述一个或多个核酸探针,以及提供允许多种捕获剂直接或间接地捕获第二靶核酸或其互补序列或其扩增产物的条件,其中所述多种捕获剂中的一种捕获剂包含能够捕获核酸的捕获结构域和空间条形码。在一些实施方案中,方法还包括产生空间标记的多核苷酸,所述空间标记的多核苷酸包含所述第二靶核酸的序列或其互补序列和所述空间条形码的序列或其互补序列。
16.在某些实施方案中,多种捕获剂直接或间接地连结至所述第一基底或第二基底。
17.在任一前述实施方案中,空间条形码对应于所述捕获剂在所述第一基底或第二基底上的位置。
18.在任一前述实施方案中,方法还包括在提供允许多种捕获剂直接或间接地捕获第二靶核酸或其互补序列或其扩增产物的条件之前,向所述生物样品提供包含所述多种捕获剂的第二基底。
19.在一些实施方案中,本文公开了一种分析生物样品的方法,所述方法包括使第一基底上的生物样品与一个或多个核酸探针接触,所述一个或多个核酸探针直接或间接地与所述生物样品中的第一靶核酸或其互补序列或扩增产物杂交。在一些实施方案中,方法还包括在所述生物样品的空间位置处检测所述一个或多个核酸探针,以及提供允许多种捕获
剂直接或间接地捕获第二靶核酸或其互补序列或其扩增产物的条件,其中所述多种捕获剂直接或间接地连结至所述第一基底或第二基底,并且其中所述多种捕获剂中的一种捕获剂包含能够捕获核酸的捕获结构域和对应于所述捕获剂在所述第一基底上或所述第二基底上的位置的空间条形码。在一些实施方案中,方法还包括产生空间标记的多核苷酸,所述空间标记的多核苷酸包含(i)所述第二靶核酸的序列或其互补序列和(ii)所述空间条形码的序列或其互补序列。
20.在任何前述实施方案中,第一靶核酸和所述第二靶核酸可包含相同的核酸序列。在任何前述实施方案中,第一靶核酸和所述第二靶核酸可包含不同的核酸序列。在任何前述实施方案中,第一靶核酸和所述第二靶核酸可以是相同的分子。在任何前述实施方案中,第一靶核酸和所述第二靶核酸可以是不同的分子。
21.在任何前述实施方案中,第二靶核酸可以是或包含所述第一靶核酸、其互补序列、其杂交产物、其连接产物、其延伸产物、其复制产物、其转录/逆转录产物和/或其扩增产物。
22.在任何前述实施方案中,第二靶核酸可以是或包含所述一个或多个核酸探针中的至少一个、所述核酸探针的互补序列、所述核酸探针的杂交产物、所述核酸探针的连接产物、所述核酸探针的延伸产物、所述核酸探针的复制产物、所述核酸探针的转录/逆转录产物和/或核酸探针的扩增产物。
23.在任何前述实施方案中,第一靶核酸和/或所述第二靶核酸还可包含rna序列。在任何前述实施方案中,第一靶核酸和/或所述第二靶核酸可以是mrna分子。
24.在任何前述实施方案中,生物样品可在使第一基底上的生物样品与一个或多个核酸探针接触之前或期间可逆地交联,所述一个或多个核酸探针直接或间接地与所述生物样品中的第一靶核酸或其互补序列或扩增产物杂交。
25.在任何前述实施方案中,方法可包括使所述可逆交联的生物样品去交联。
26.在任何前述实施方案中,方法可包括从所述生物样品中释放所述第二靶核酸或其互补序列或其扩增产物。
27.在任何前述实施方案中,方法可包括使所述生物样品中的第二靶核酸或其互补序列或其扩增产物与基底(或第一基底)或第二基底的捕获剂接触。在一些实施方案中,方法可包括将所述生物样品中的第二靶核酸或其互补序列或其扩增产物递送或驱动朝向所述基底(或所述第一基底)或朝向所述第二基底。
28.在任何前述实施方案中,方法可包括从所述基底(或所述第一基底)或从所述第二基底释放所述多种捕获剂,和/或将所述释放的多种捕获剂朝向生物样品递送或驱动和/或递送或驱动到所述生物样品之中或之上。
29.在任何前述实施方案中,多种捕获剂可包括可释放地偶联至分析物捕获剂的捕获剂。
30.在任何前述实施方案中,在空间位置检测所述一个或多个核酸探针是在经加工或清除的生物样品上进行。在任何前述实施方案中,生物样品可包括组织样品。在任何前述实施方案中,组织样品可以是厚度介于约1μm与约50μm之间的组织切片。在任何前述实施方案中,组织切片的厚度可介于约5μm与约35μm之间。在任何前述实施方案中,组织样品可被包埋在水凝胶中。
31.在任何前述实施方案中,第一靶核酸、其互补序列和/或其扩增产物可与基质例如
水凝胶可逆地交联。
32.在任何前述实施方案中,一个或多个核酸探针中的至少一个可包含指示所述第一靶核酸中的序列(或其互补序列)的条形码序列。
33.在任何前述实施方案中,检测所述一个或多个核酸探针可包括对所述生物样品成像。
34.在任何前述实施方案中,检测所述一个或多个核酸探针可确定所述条形码序列的序列或其互补序列或其经扩增序列。
35.在任何前述实施方案中,可在检测所述一个或多个核酸探针时进行原位测序。在任何前述实施方案中,检测所述一个或多个核酸探针可包括多个探针的原位测序和/或顺序杂交。
36.在任何前述实施方案中,一个或多个核酸探针可包括直接与所述第一靶核酸或其互补序列或扩增产物杂交的初级探针。
37.在任何前述实施方案中,第一靶核酸可以是mrna,所述互补序列可以是cdna,和/或所述扩增产物可以是滚环扩增(rca)产物。
38.在任一前述实施方案中,初级探针可包括挂锁探针、环状探针或环化探针。
39.在任何前述实施方案中,初级探针可包含一个或多个条形码序列,所述一个或多个条形码序列任选地对应于所述第一靶核酸的序列。
40.在任一前述实施方案中,检测步骤可包括使所述生物样品与能够直接或间接地与所述初级探针(或其互补序列或扩增产物)杂交的一个或多个可检测标记的探针接触,任选地其中所述一个或多个可检测标记的探针与所述初级探针(或其互补序列或扩增产物)的一个或多个条形码序列杂交。
41.在任一前述实施方案中,检测步骤可包括使所述生物样品与能够直接或间接地与所述初级探针(或其互补序列或扩增产物)杂交的一个或多个二级探针接触,任选地其中所述一个或多个二级探针与所述初级探针(或其互补序列或扩增产物)的一个或多个条形码序列杂交。
42.在任一前述实施方案中,检测步骤可包括使所述生物样品与能够直接或间接地与所述一个或多个二级探针(或其互补序列或扩增产物)杂交的一个或多个可检测标记的探针接触,任选地其中所述一个或多个可检测标记的探针与所述一个或多个二级探针(或其互补序列或扩增产物)的一个或多个条形码序列杂交。
43.在任一前述实施方案中,方法可包括对所述生物样品成像以对所述初级探针(或其互补序列或扩增产物)的一个或多个条形码序列和/或所述一个或多个二级探针(或其互补序列或扩增产物)的一个或多个条形码序列进行测序,任选地其中所述测序包括连接法测序或杂交测序。
44.在任何前述实施方案中,方法还包括产生包含所述条形码序列的序列或其互补序列的扩增产物。在任何前述实施方案中,扩增产物可通过滚环扩增产生。在任何前述实施方案中,扩增产物可包含一个或多个经修饰的核苷酸。
45.在任何前述实施方案中,原位测序可包括连接法测序。在任何前述实施方案中,原位测序可包括杂交测序。
46.在任何前述实施方案中,方法还包括在所述成像之后使所述基底上的生物样品透
化。
47.在任何前述实施方案中,第二靶核酸可以是mrna分子,并且所述捕获剂包含捕获探针。
48.在任何前述实施方案中,捕获探针可包含游离3'端,使得所述捕获探针使用所述第二靶核酸作为引物延伸的模板而用作逆转录酶(rt)引物。
49.在任何前述实施方案中,游离3'端可包含寡聚dt、随机序列或基因特异性序列。
50.在任何前述实施方案中,捕获探针还可包含位于所述空间条形码5'的通用结构域,其中所述通用结构域包含扩增结构域;和/或用于从所述基底的表面释放产生的空间标记的多核苷酸的裂解结构域。
51.在任何前述实施方案中,产生的空间标记的多核苷酸可以是cdna或其扩增产物。
52.在任何前述实施方案中,在提供允许多种捕获剂直接或间接地捕获第二靶核酸或其互补序列或其扩增产物的条件之前,所述捕获结构域可能不捕获所述第一靶核酸、其互补序列或其扩增产物。
53.在任何前述实施方案中,在使所述可逆交联的生物样品去交联之前,所述捕获结构域可能不捕获所述第一靶核酸、其互补序列或其扩增产物。
54.在任何前述实施方案中,捕获探针可通过杂交、通过连接或通过杂交、然后连接(例如通过夹板连接)捕获所述第二靶核酸或其互补序列或其扩增产物。
55.在任何前述实施方案中,捕获剂可捕获所述一个或多个核酸探针或其互补序列或其扩增产物。
56.在任何前述实施方案中,捕获剂可捕获与所述第一靶核酸杂交的一个或多个核酸探针。
57.在任何前述实施方案中,方法还包括在提供允许多种捕获剂直接或间接地捕获第二靶核酸或其互补序列或其扩增产物的条件之前,释放与所述第一靶核酸杂交的一个或多个核酸探针。
58.在任何前述实施方案中,空间标记的多核苷酸可包含所述一个或多个核酸探针的核酸探针的序列或其互补序列和所述空间条形码的序列或其互补序列。
59.在任何前述实施方案中,空间标记的多核苷酸或其一部分可释放(例如,从所述第一或第二基底)用于分析。
60.在任何前述实施方案中,方法可还包括确定所述空间标记的多核苷酸或其互补序列的至少一部分。
61.在任何前述实施方案中,确定可包括连接法测序、杂交测序、合成法测序和/或结合测序(sequencing by binding)。
62.在任何前述实施方案中,经释放的空间标记的多核苷酸可通过直接测序或间接测序进行分析,任选地在测序之前进行扩增。
63.在任何前述实施方案中,方法可还包括将所述空间标记的多核苷酸的空间条形码与所述一个或多个核酸探针的检测到的空间位置相关联。
64.在另一个方面,本文公开了一种分析生物样品的方法,所述方法包括使所述生物样品与第一核酸探针和第二核酸探针接触,其中所述第一核酸探针和第二核酸探针未固定在人工基底上。在一些实施方案中,方法还包括在所述生物样品中原位产生滚环扩增(rca)
产物,所述rca产物包含所述第一核酸探针的序列或其互补序列。在任何前述实施方案中,方法可还包括在第一基底上的生物样品的空间位置处检测与所述rca产物相关的信号(例如,荧光信号)。在任何前述实施方案中,方法可还包括提供允许多种捕获剂直接或间接地捕获所述第二核酸探针和/或其产物的条件,其中所述多种捕获剂直接或间接地连结至所述第一基底或第二基底,并且其中所述多种捕获剂中的一种捕获剂包含:(i)能够捕获核酸的捕获结构域,和(ii)对应于所述捕获剂在所述第一基底上或所述第二基底上的位置的空间条形码。在任何前述实施方案中,方法可还包括产生空间标记的多核苷酸,所述空间标记的多核苷酸包含(i)所述第二核酸探针的序列和/或其产物和(ii)所述空间条形码的序列或其互补序列。在一些实施方案中,方法不包括检测所述第一基底上或所述第二基底上的空间标记的多核苷酸。
65.在任何前述实施方案中,第一核酸探针和第二核酸探针可靶向相同或不同的分析物和/或结合至所述生物样品中的相同或不同的分子。在一些实施方案中,方法不包括产生包含所述第二核酸探针的序列或其互补序列的rca产物。在一些实施方案中,方法不包括在所述第一基底上或所述第二基底上的空间位置处检测与所述第二核酸探针或其产物相关的信号(例如,荧光信号)。
66.在任何前述实施方案中,方法可还包括从所述第一基底或所述第二基底除去所述空间标记的多核苷酸,其中在除去步骤之后确定所述空间标记的多核苷酸的序列。在任何前述实施方案中,方法可还包括使用连接法测序、杂交测序、合成法测序和/或结合测序来确定所述除去的空间标记的多核苷酸的序列或其互补序列。
67.在任何前述实施方案中,第一核酸探针可包含挂锁探针,所述挂锁探针任选地包含一个或多个条形码序列。在任何前述实施方案中,第二核酸探针可包含与所述生物样品中的rna或dna(例如,cdna)分子杂交的两个或更多个探针,其中所述两个或更多个探针任选地包含一个或多个条形码序列。在任何前述实施方案中,两个或更多个探针可与所述生物样品中的mrna分子杂交。在任何前述实施方案中,两个或更多个探针可与所述第一核酸探针(例如,挂锁探针)或其产物杂交。在任何前述实施方案中,方法可还包括连接与所述rna或dna分子杂交的两个或更多个探针以产生连接的第二核酸探针。在任何前述实施方案中,连接可以是rna模板化或dna模板化反应。在任何前述实施方案中,连接的第二核酸探针可被捕获剂捕获。
68.在另一个方面,本文公开了一种分析生物样品的方法,所述方法包括使第一基底上的生物样品与第一核酸探针和第二核酸探针接触,其中所述第一探针和第二核酸探针未固定在人工基底上。在一些实施方案中,方法还包括在所述生物样品中原位产生滚环扩增(rca)产物,所述rca产物包含所述第一核酸探针的序列或其互补序列。在任何前述实施方案中,方法可还包括提供允许多种捕获剂直接或间接地捕获所述第二核酸探针和/或其产物的条件,其中所述多种捕获剂直接或间接地连结至所述第一基底或第二基底,并且其中所述多种捕获剂中的一种捕获剂包含:(i)能够捕获核酸的捕获结构域,和(ii)对应于所述捕获剂在所述第一基底上或所述第二基底上的位置的空间条形码。在任何前述实施方案中,方法可还包括产生空间标记的多核苷酸,所述空间标记的多核苷酸包含(i)所述第二核酸探针的序列和/或其产物和(ii)所述空间条形码的序列或其互补序列。在任何前述实施方案中,可在所述第一基底上的生物样品的空间位置处检测与所述rca产物相关的信号(例
如,荧光信号)。在任何前述实施方案中,可从所述第一基底或所述第二基底除去空间标记的多核苷酸以确定所述空间标记的多核苷酸的序列。
69.在任何前述实施方案中,方法可还包括在所述第一基底上的生物样品的空间位置处检测与所述rca产物相关的信号(例如,荧光信号)。在任何前述实施方案中,方法可还包括从所述第一基底或所述第二基底除去所述空间标记的多核苷酸以确定所述空间标记的多核苷酸的序列。在任何前述实施方案中,方法可还包括使用连接法测序、杂交测序、合成法测序和/或结合测序来确定所述除去的空间标记的多核苷酸的序列或其互补序列。
附图说明
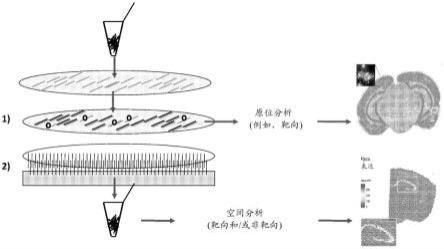
70.图1示出包括原位测定模块和空间测定模块的本文所述的整合原位空间测定的示例性工作流程。
71.图2a-2b示出本文公开的整合原位空间测定的示例性工作流程。
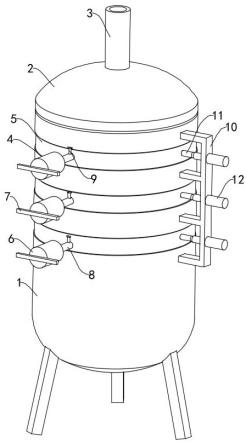
72.图3示出本文公开的整合原位空间测定的示例性工作流程。
73.图4a示出示例性原位测定工作流程,其中示例性初级探针组结合至rna靶标,并且示例性检测寡核苷酸与所述初级探针或其扩增产物(例如rca产物)的条形码序列杂交。在挂锁探针的情况下,挂锁可使用引物作为dna夹板连接。
74.图4b示出示例性原位测定工作流程,其中示例性初级探针组结合至rna靶标,示例性二级探针各自与所述初级探针或其扩增产物(例如rca产物)的条形码序列杂交,并且检测寡核苷酸与二级探针的条形码序列杂交。在挂锁探针的情况下,挂锁可使用引物作为dna夹板连接。
75.图4c示出示例性原位测定工作流程。使rna靶标逆转录以产生dna分子,并且示例性初级探针然后与所述dna分子杂交。在挂锁探针的情况下,挂锁可使用从所述rna产生的dna作为夹板连接。示例性桥接探针与所述初级探针或其扩增产物(例如rca产物)的条形码序列杂交,并且检测寡核苷酸与所述桥接探针杂交。
76.图5示出示例性原位测定工作流程。各种初级探针可与rna靶标杂交并使用rna为模板化连接和/或dna模板化连接来连接以形成包含一个或多个条形码序列的环化探针。二级探针或桥接探针可与所述环化探针或其扩增产物杂交(例如,如图4a-4c所示)。检测寡核苷酸可与所述环化探针或其扩增产物、二级探针或其扩增产物或桥接探针杂交(例如,如图4a-4c所示)。
77.图6a-6f示出使用本文公开的标记剂,例如用于非核酸分析物的示例性原位测定工作流程。
78.图7示出示例性空间测定工作流程。
79.图8示出示例性空间测定工作流程。
80.图9示出示例性空间测定工作流程。
81.图10示出示例性空间测定工作流程。
82.图11a-11b示出示例性空间测定工作流程。
83.图12是示出如本文所述的带条形码的捕获探针的实例的示意图。
84.图13a-13c示意性地说明分析靶核酸分子的方法。图13a示出靶核酸分子、第一探针和第二探针,并且图13b示出具有与其杂交的第一探针和第二探针的靶核酸分子。图13c
示出探针连接的核酸分子。
85.图14是示例性标记剂(例如,分析物捕获剂)的示意图。
86.图15是示例性标记剂(例如,分析物捕获剂)的示意图。
87.图16是描绘特征固定化捕获探针与标记剂(例如,分析物捕获剂)与相关的报告基因寡核苷酸之间的示例性相互作用的示意图。
88.图17是示出阵列内的带条形码特征的布置的示意图。
89.图18是说明防扩散介质例如盖的侧视图的示意图。
90.图19a-19b是示出被配置为将转录物分析物引导朝向带空间条形码的捕获探针阵列的电泳转移系统的展开图(图19a)和侧视图(图19b)的示意图。
91.图20是示出利用电泳转移系统的示例性工作流程的示意图。
具体实施方式
92.在一些方面,本文提供了使用显微术读出(例如,直接或间接地结合至靶分析物的探针的条形码序列的光学测序)和/或测序读出(例如,靶核酸序列本身和/或探针的条形码序列的ngs测序)的整合原位空间测定,例如用于分析完整组织中的细胞。在一些实施方案中,方法还包括对分析物如生物样品中的转录组或其子集进行空间谱分析。提供了用于这些原位空间测定(包括空间基因组学和转录组学测定)的方法、组合物、试剂盒、装置和系统。在一些实施方案中,所提供的方法是定量的并且保留组织样品内的空间信息,而无需物理地分离细胞或使用匀浆。本文还提供了用于检测和/或定量细胞、组织、器官或生物体中的核酸的组合物和方法。在一些实施方案中,本公开提供了用于对大量原位靶标,包括此类靶标的空间信息,例如组织样品中的rna转录物和/或dna基因座进行高通量谱分析的方法。
93.本技术中提及的所有出版物,包括专利文献、科学文章和数据库,出于所有目的以引用的方式整体并入,其并入程度如同每个单独的出版物均以引用的方式单独并入一样。如果本文中列出的定义与以引用的方式并入本文的专利、申请、公布的申请以及其它出版物中提出的定义相反或以其它方式不一致,则本文提出的定义优先于以引用的方式并入本文的定义。
94.本文所用的章节标题仅出于组构目的,并且不应被解释为限制所描述的主题。
95.i.综述
96.在一个方面,本文提供了一种方法,所述方法包括用于生物样品(例如组织样品)中的一种或多种目标靶分析物的原位测定模块。在一些实施方案中,测定包括原位分析组织样品中的分析物(例如,核酸分子)的存在/不存在、分布、位置、量、水平、表达或活性。靶分析物可包括核酸分子和非核酸分子,如蛋白质和肽。靶核酸分子可源自任何特定类型的细胞和/或特定亚细胞区域或在任何特定类型的细胞和/或特定亚细胞区域(例如来自细胞溶质、来自细胞核、来自线粒体、来自微粒体,并且更一般地来自任何其它区室、细胞器或细胞的部分)中进行分析。实例包括dna分析物,如基因组dna、甲基化dna、特定甲基化dna序列、片段化dna、线粒体dna和rna/dna杂合体。靶核酸分子的实例还包括rna分析物,如各种类型的编码和非编码rna。不同类型的rna分析物的实例包括信使rna(mrna)、核糖体rna(rrna)、转移rna(trna)、微小rna(mirna)、前体mrna和病毒rna。rna分析物可从细胞或细胞区室(例如,细胞核)获得或在细胞或细胞区室(例如,细胞核)中进行分析。
97.在一些实施方案中,方法包括分析组织样品的转录组或基因组,例如全转录组或基因组。在一些实施方案中,方法包括用于进行空间转录组学和/或空间基因组学的方法,所述方法能够同时分析组织样品中表达或存在的基因或基因组基因座的表达模式和/或位置/分布模式。
98.在一些实施方案中,原位测定是靶向测定,例如,分析直接或间接地结合至目标靶生物分析物(例如组织样品中的mrna分子)的预先设计的探针的测定。在一些实施方案中,原位测定包括提供与靶核酸(或其互补序列、扩增产物或衍生物)杂交的一个或多个核酸探针并在所述生物样品的空间位置处检测所述一个或多个核酸探针。在一些实施方案中,预先设计的探针包含一个或多个初级探针或探针组,例如,与靶分析物结合的探针;和/或一个或多个二级探针或探针组,例如与初级探针或其互补序列或其产物(例如,杂交产物、连接产物、延伸产物(例如,通过dna或rna聚合酶)、复制产物、转录/逆转录产物和/或扩增产物)结合的探针。在一些实施方案中,预先设计的探针包含一个或多个高阶探针或探针组,例如与第n阶探针或其互补序列或其产物(例如杂交产物、连接产物、延伸产物(例如,通过dna或rna聚合酶)、复制产物、转录/逆转录产物和/或扩增产物)结合的第(n 1)阶探针,其中n是2或更大的整数。在一些实施方案中,预先设计的探针是带条形码的探针。在一些实施方案中,第n阶探针包含条形码序列(第n阶条形码序列),并且第(n 1)阶探针结合至所述第n阶条形码序列且包含用于由另一个带条形码的探针或由可检测标记的探针(例如荧光标记的检测寡核苷酸)结合的第(n 1)阶条形码序列,其中n是1或更大的整数。在本文公开的任何实施方案中,探针与另一个探针或与靶分析物的结合可以是直接的(例如,通过核酸序列的直接杂交或抗原-抗体结合)或间接的(例如,通过一个或多个桥接寡核苷酸的间接杂交或结合相互作用)。可使用显微术,例如高分辨率光学显微术来分析结合相互作用,以提供靶分析物的存在/不存在、分布、位置、量、水平、表达或活性的读出。在一些实施方案中,原位测定包括原位测序和/或原位杂交,如探针的顺序杂交。在一些实施方案中,原位测定分析约20、约50、约100、约200、约500、约1,000、约2,000、约5,000或约10,000个基因,例如来自组织样品中的基因的mrna转录物。在一些实施方案中,来自组织样品中的约100与约1,000个之间基因的mrna转录物在原位进行分析。
99.在另一个方面,本文公开的方法还包括空间测定模块,例如,对组织样品中的分析物(例如,核酸分子)的存在/不存在、分布、位置、量、水平、表达或活性的定量和/或定性分析,其中保留是组织样品内的分析物的存在/不存在、分布、位置、量、水平、表达或活性的空间模式。在一些实施方案中,方法包括分析组织样品的转录组或基因组,例如全转录组或基因组。在一些实施方案中,方法包括用于进行空间转录组学和/或空间基因组学的方法,所述方法能够同时分析组织样品中表达或存在的基因或基因组基因座的表达模式和/或位置/分布模式。在一些实施方案中,方法将基于阵列的核酸分子捕获与高通量核酸测序技术相结合,这允许组织样品中的核酸分子(例如,rna或dna分子)被捕获并用定位标签(例如,空间条形码)进行标记。在一些实施方案中,方法还包括合成核酸分子,对所述核酸分子进行测序(例如使用核苷酸拆分),并且进行分析以确定哪些基因在组织样品的任何和所有部分中表达。在一些实施方案中,可同时获得组织样品中每个细胞的个别的、单独的和特异性的转录组,从而提供来自组织样品内的单独细胞的高度平行的综合转录组特征,而不会丢失所述研究的组织样品内的空间信息。
100.在一些实施方案中,本文公开的方法包括以任何合适的顺序依次进行一个或多个原位测定和一个或多个空间测定。第一分析物的原位分析可在空间测定中用捕获探针阵列分析第二靶分析物之前、同时或之后进行。在一些实施方案中,本文公开的方法包括提供双重读出,例如显微术读出和测序读出。在一些实施方案中,本文公开的方法包括分析用于原位测定的显微术读出和用于空间测定的测序读出。在一些实施方案中,本文公开的方法包括分析所述原位测定中的第一分析物和所述空间测定中的第二分析物。在一些实施方案中,第一分析物和第二分析物是相同的分子。在一些实施方案中,第一分析物和第二分析物是不同的分子。在一些实施方案中,第一分析物和第二分析物包含共同的核酸序列,或者一者包含核酸序列且另一者包含互补序列或其产物(例如,杂交产物、连接产物、延伸产物(例如,通过dna或rna聚合酶)、复制产物、转录/逆转录产物和/或扩增产物)中的一者或多者。在一些实例中,第二分析物可包含第一分析物的核酸序列或用于所述第一分析物的标记剂的核酸序列。在一些实例中,第二分析物可包含第一分析物的核酸序列的互补核酸序列或用于所述第一分析物的标记剂的核酸序列。在一些实例中,第二分析物可以是第一分析物或靶向所述第一分析物的探针(例如,用于原位测定中的探针)的产物(例如,杂交产物、连接产物、延伸产物(例如,通过dna或rna聚合酶)、复制产物、转录/逆转录产物和/或扩增产物,例如rca产物)。在一些实施方案中,第一分析物和第二分析物包含不同的核酸序列。
101.在一些实施方案中,本文公开的方法包括使基底(例如载玻片)上的生物样品与直接或间接地与所述生物样品中的第一靶核酸或其互补序列或产物(例如,杂交产物、连接产物、延伸产物(例如,通过dna或rna聚合酶)、复制产物、转录/逆转录产物和/或扩增产物)。在一些实施方案中,对基底上的生物样品进行原位分析,例如,样品中的第一靶核酸的原位测序。在一些实施方案中,生物样品是组织样品,如新鲜分离或保存的组织切片。在一些实施方案中,生物样品通过可逆交联固定。在一些实施方案中,加工所述生物样品,使得一个或多个分析物分子(例如,rna分子)被可逆地锁定在适当位置以保持所述组织样品中的分析物和/或相对于所述组织样品中的一种或多种其它分析物的存在/不存在、分布、位置、量、水平、表达或活性的空间模式。在一些实施方案中,生物样品被包埋在基质,如聚合物基质中。在一些实施方案中,生物样品是水凝胶包埋的。在一些实施方案中,一个或多个分析物分子(例如,rna分子)被探针靶向并使用原位成像进行分析,例如带条形码的探针的连接法测序、杂交测序、合成法测序、结合测序和/或顺序杂交,然后解码。在一些实施方案中,样品中多种分析物的分子以高度多路复用的方法进行原位分析。
102.在一些实施方案中,一旦记录了原位分析的图像,所述方法就还包括处理样品,使得所述样品中的第二靶核酸或其互补序列或产物(例如,杂交产物、连接产物、延伸产物、复制产物、转录/逆转录产物、衍生物和/或扩增产物)被释放。例如,方法可还包括使样品去交联,使得所述样品中的第二靶核酸或其互补序列或产物(例如,杂交产物、连接产物、延伸产物(例如,通过dna或rna聚合酶)、复制产物、转录/逆转录产物和/或扩增产物)未锁定在适当位置(例如锁定至水凝胶)。在一些实施方案中,允许第二靶核酸(例如,mrna)或其互补序列或其产物被多种捕获剂直接或间接地捕获。在一些实施方案中,在原位分析期间,多种捕获剂被提供在支撑样品的基底(例如,薄载玻片)上。在一些实施方案中,用于原位成像的基底是第一基底,并且多种捕获剂被提供在第二基底上,所述第二基底被提供给所述第一基底上的样品。在一些实施方案中,多种捕获剂中的一种捕获剂包含(i)能够捕获核酸的捕获
结构域和(ii)对应于所述捕获剂在所述第一基底和/或所述第二基底上的位置的空间条形码。
103.在一些实施方案中,第一靶核酸和第二靶核酸是相同的分子。在一些实施方案中,第一靶核酸和第二靶核酸是不同的分子。在一些实施方案中,第一分析物和第二分析物包含共同的核酸序列,或者一者包含核酸序列且另一者包含所述核酸序列的互补序列或其产物(例如,杂交产物、连接产物、延伸产物(例如,通过dna或rna聚合酶)、复制产物、转录/逆转录产物和/或扩增产物)序列。在一些实施方案中,第一靶核酸和第二靶核酸包含不同的核酸序列。在一些实施方案中,第二靶核酸包含在原位分析中使用的探针,所述探针可在原位分析之后从样品中释放。在一些实施方案中,第二靶核酸包含在原位分析期间产生的扩增产物,所述扩增产物可在原位分析之后从样品中释放。在一些实施方案中,第二靶核酸包含由一个或多个核酸探针靶向的核酸序列,所述核酸序列可在原位分析之后从样品中释放。在一些实施方案中,第二靶核酸包含在原位分析期间(例如,经由连接或延伸)产生的核酸,所述核酸可在原位分析之后从样品中释放。在一些实施方案中,第二靶核酸包含两种或更多种类型的分析物。第二靶核酸可在进行第一分析物的原位分析之前、同时或之后产生或加工。
104.在一些实施方案中,本文公开的方法包括例如通过裂解或透化去交联的组织样品对样品进行加工,以允许样品中的一个或多个分子被捕获剂直接或间接地捕获。在一些实施方案中,允许样品中的一个或多个分子迁移,例如迁移出样品的一个或多个细胞和/或迁移出样品。在一些实施方案中,允许第一靶核酸或其互补序列或产物(例如,杂交产物、连接产物、延伸产物(例如,通过dna或rna聚合酶)、复制产物、转录/逆转录产物和/或扩增产物)迁移出样品的细胞,以被基底上的捕获剂捕获。在一些实施方案中,允许第二靶核酸或其互补序列或产物(例如,杂交产物、连接产物、延伸产物(例如,通过dna或rna聚合酶)、复制产物、转录/逆转录产物和/或扩增产物)迁移出样品的细胞,以被基底上的捕获剂捕获。
105.在一些实施方案中,本文公开的方法包括产生空间标记的多核苷酸,所述空间标记的多核苷酸包含(i)第二靶核酸的序列或其互补序列和(ii)空间条形码的序列或其互补序列。在一些实施方案中,第二靶核酸与在原位成像期间分析的第一靶核酸相同。在一些实施方案中,第二靶核酸与在原位成像期间分析的第一靶核酸不同。在一些实施方案中,多种第二靶核酸在空间测定中进行分析。在一些实施方案中,多种第二靶核酸是转录组或其子集。
106.在一些实施方案中,第二靶核酸包含mrna序列,并且捕获剂包含捕获探针。在一些实施方案中,捕获探针包含游离3'端,使得所述捕获探针用作逆转录酶(rt)引物,使用第二靶核酸作为模板进行引物延伸。在一些实施方案中,第二靶核酸包含dna(例如,cdna)。在一些实施方案中,使用mrna模板(例如,逆转录)在原位测定之前或期间产生第二靶核酸。在一些实施方案中,使样品经受逆转录反应,其中在本文公开的原位测定模块之前或期间,使所述样品中的一种或多种rna分子逆转录以产生dna分子(例如,cdna)。所产生的dna分子可在本文公开的整合方法的原位测定模块中和/或空间测定模块中进行分析。在一些实施方案中,游离3'端包含寡聚dt、随机序列或基因特异性序列。在一些实施方案中,捕获探针还包含位于空间条形码5'的通用结构域,其中所述通用结构域包含(i)扩增结构域;和/或(ii)用于从基底的表面释放产生的空间标记的多核苷酸的裂解结构域。在一些实施方案中,所
产生的空间标记的多核苷酸是cdna或其扩增产物。
107.在一些实施方案中,本文公开的方法包括释放空间标记的多核苷酸或其部分或其互补序列或产物(例如,杂交产物、连接产物、延伸产物(例如,通过dna或rna聚合酶)、复制产物、转录/逆转录产物和/或扩增产物)用于分析。在一些实施方案中,使空间标记的多核苷酸或其部分、互补序列或产物从基底释放,例如从第一或第二基底释放。在一些实施方案中,方法包括确定空间标记的多核苷酸或其部分、互补序列或产物的至少一部分的序列的步骤。在一些实施方案中,确定步骤包括连接法测序、杂交测序、合成法测序和/或结合测序。在一些实施方案中,通过直接测序分析所释放的空间标记的多核苷酸或其部分、互补序列或产物。在一些实施方案中,通过间接测序分析所释放的空间标记的多核苷酸或其部分、互补序列或产物。在一些实施方案中,方法包括在释放步骤之前、期间或之后扩增空间标记的多核苷酸或其部分、互补序列或产物,例如扩增空间标记的多核苷酸或其部分、互补序列或产物。在一些实施方案中,确定步骤包括在测序之前扩增所释放的空间标记的多核苷酸或其部分、互补序列或产物。在一些实施方案中,方法包括将空间标记的多核苷酸的空间条形码与一个或多个核酸探针的检测到的空间位置相关联。
108.图1提供整合原位空间测定的示例性工作流程。原位测定通常采用靶向方法询问一组例如介于约100与约1,000个基因之间的靶分析物和来自其的mrna转录物,使用显微镜和光学信号分析来确定序列。在一些实施方案中,原位测定包括对直接或间接地结合分析物的探针的一个或多个条形码序列的原位测序。在一些实施方案中,原位测定包括检测指示一种或多种检测寡核苷酸与直接或间接地与分析物的核酸部分杂交的探针的一个或多个条形码序列的原位杂交的信号,并且来自顺序杂交的信号的空间和/或时间模式用于对分析物进行分析。在一些实施方案中,与对同一样品的原位测定相比,本文公开的整合原位空间测定从样品中获得分析物的更多空间信息。在一些实施方案中,原位探针(例如,挂锁探针)结合至样品中的靶分析物(例如,核酸分子)以用于原位分析。原位探针可包含两个或更多个探针,当结合至靶分子并连接两个或更多个探针(例如,通过诸如rna模板化连接的连接(例如,如图13a-13c所示)和/或dna模板化连接)时,所述两个或更多个探针组装形成以更大的探针。原位探针或其产物可例如使用滚环扩增进行扩增,以产生可原位测序的扩增产物,例如,如图1所示。在一些实施方案中,通过进行本文公开的整合原位空间测定,原位测定和检测可涉及检测靶分析物(例如,同时避免光学拥挤),所述原位空间测定补充有可捕获同一样品上的额外信息(例如,与靶分析物和/或其它目标分析物相关的信息)的空间测定。在一些实施方案中,在原位测定和检测中分析生物样品中的第一组靶分析物,而在空间测定中分析同一生物样品中的第二组靶分析物。
109.在一些实施方案中,除了原位探针之外,本文公开的一种或多种分析物标记和/或捕获探针也在原位测定之前和/或期间与样品接触。在一些实施方案中,使靶向一种或多种分析物的一组探针在原位测定之前和/或期间与样品接触,但不在原位分析中进行分析。相反,靶向一种或多种分析物的探针可在如本文所述的空间分析(如基于空间阵列的测定)中进行分析。在一些情况下,所述组探针用于捕获多种靶向分析物以在空间分析中进行分析。在一些实施方案中,使靶向一种或多种分析物(例如,蛋白质或细胞特征)的标记剂或结合剂在原位测定和/或空间测定之前或期间与样品接触。
110.图1-3提供整合原位空间测定的示例性工作流程。如图1所示,原位分析可以是非
靶向的(例如,如在fisseq中)并且优选地是靶向的,例如对于约100与约1,000个之间的基因和/或mrna转录物。可使同一样品经受空间分析,例如本文公开的基于空间阵列的分析,所述空间分析可以是靶向的和/或非靶向的。在一些方面,空间分析可提供靶向读出(例如,对于靶分析物的预定组)或非靶向读出(例如,对于样品的转录组谱分析)。在一些方面,空间分析使用用于一组预定mrna转录物或原位探针(用于靶向读出)的具有基因特异性捕获序列的捕获剂和用于非靶向转录组谱分析的具有poly-t序列的捕获剂。在一些实施方案中,分析物、原位探针和/或其产物和/或分析物捕获剂(例如,分析物捕获探针)迁移至包含含有捕获探针的特征的基底。
111.在图2a中,在201中,使样品与用于原位测定模块的探针(例如,挂锁探针)接触。用于原位测定模块和/或空间测定模块的其它剂,如探针、标记剂、分析物捕获剂和/或捕获剂可在样品与样品用于原位测定的探针接触之前、一起或之后与所述样品接触。任选地,分析物、探针和/或其它试剂(包括用于原位测定模块和/或空间测定模块的那些)可在202中以任何合适的顺序和组合延伸、连接、扩增、逆转录和/或以其它方式反应或加工。例如,样品中的rna分子可在原位检测之前逆转录成所产生的dna分子,例如在201和/或202中。原位测定模块的信号在203中进行检测并任选地进行分析。在任选的样品加工和/或透化之后,在204中使用捕获探针捕获在原位测定模块之后来自样品的分析物。用于空间测定模块的剂,如探针(例如,模板化连接探针)、标记剂、分析物捕获剂和/或捕获剂可在201、202、203和/或204之前、一起或之后与样品接触。在205中,例如通过分析捕获探针和/或所捕获的分析物来获得空间分辨的分析物信息。示例性工作流程的步骤可以任何合适的顺序进行。在一些实施方案中,步骤201、202和203中的任何一个或多个在步骤204和205之前进行。原位测定模块和/或空间测定模块中的分析物可包括一种或多种核酸分析物和/或一种或多种非核酸分析物,如蛋白质分析物。
112.在图2b中,使样品与206中用于空间测定模块的靶向分析物的探针(例如,模板化连接探针)和/或与用于原位测定模块207的探针(例如,挂锁探针)接触。用于原位测定模块和/或空间测定模块的其它剂,如探针、标记剂、分析物捕获剂和/或捕获剂可在步骤206和/或207之前、一起或之后与样品接触。任选地,分析物、探针和/或其它试剂(包括用于原位测定模块和/或空间测定模块的那些)可在208中以任何合适的顺序和组合延伸、连接、扩增、逆转录和/或以其它方式反应或加工。例如,样品中的rna分子可在原位检测之前逆转录成所产生的dna分子,例如在206、207和/或208期间或之前。在一些情况下,206可在步骤207之前、一起或之后进行。原位测定模块的信号在209中进行检测并任选地进行分析。在任选的样品加工和/或透化之后,在210中使用捕获探针捕获在原位测定模块之后来自样品的分析物。用于空间测定模块的剂,如探针(例如,模板化连接探针)、标记剂、分析物捕获剂和/或捕获剂可在207、208、209和/或210之前、一起或之后与样品接触。在211中,例如通过分析捕获探针和/或所捕获的分析物来获得空间分辨的分析物信息。示例性工作流程的步骤可以任何合适的顺序进行。在一些实施方案中,步骤206、207、208和209中的任何一个或多个在步骤210和211之前进行。原位测定模块和/或空间测定模块中的分析物可包括一种或多种核酸分析物和/或一种或多种非核酸分析物,如蛋白质分析物。
113.图3示出另一示例性工作流程。样品包含各种核酸分子或与各种核酸分子接触,所述各种核酸分子包括靶向核酸1的任选带条形码的探针;靶向核酸2的带条形码的可环化探
针(例如,挂锁探针)和靶向相同或不同核酸的用于连接的带条形码的探针(例如,rna模板化连接探针);靶向核酸3的带条形码的可环化探针(例如,挂锁探针)和使用可环化探针的序列(例如,可环化探针的条形码序列)作为连接模板的带条形码的探针;可为标记剂,如报告基因寡核苷酸的一部分(与识别样品中的分析物的抗体缀合的核酸4显示为实例)或样品中的内源分子,如经历逆转录以原位产生cdna的rna(例如,mrna分子)的核酸4。各种核酸分子可存在于样品中或以任何合适的组合且以任何合适的时间顺序与样品接触。包括各种探针的外源分子可同时与样品接触并在一锅结合/杂交反应中孵育。除非另有说明,否则各种核酸分子(包括核酸1-4和各种探针)中的任何一者或多者可以是dna或rna或其复合物、缀合物或杂合体,并且可以是样品内源性地或外源性地添加至样品中。核酸分子,包括用于原位测定模块和/或空间测定模块的那些可以任何合适的顺序和组合延伸、连接、扩增、逆转录和/或以其它方式反应或加工。可检测并任选地分析原位测定模块的信号。例如,可使用rca扩增靶向核酸2的带条形码的可环化探针(例如,挂锁探针),并且可使用检测探针(例如,包括可检测标记的探针和/或中间体探针)原位检测rca产物。用于连接的带条形码的探针被连接并且可保持与核酸2杂交,但在一些情况下,在原位测定模块中未检测到。在核酸3的实例中,用于连接的带条形码的探针与挂锁探针杂交,并使用条形码序列作为模板进行连接。然而,在环化挂锁探针的滚环扩增过程中,连接的探针可从环化挂锁探针移位。移位的连接探针可在核酸3的位置处可逆地交联(例如,与核酸3或rca产物或样品中的一种或多种其它分子或其中包埋样品的基质可逆地交联)。在任选的样品加工和/或透化之后,通过空间阵列上的捕获剂捕获在原位测定模块之后来自样品的分析物。在从空间阵列移除捕获的分子并收集所述捕获的分子和/或其产物以用于测序之后,例如,通过分析捕获探针和/或所捕获的分析物来获得空间分辨的分析物信息。
114.下文以举例的方式提供本公开的另外细节。
115.ii.分析物
116.本公开中描述的方法、组合物、设备和系统可用于检测和分析多种不同的分析物。在一些方面,本文公开的分析物可包括任何待分析的生物物质、结构、部分或组分。在一些方面,本文公开的靶标可类似地包括任何目标分析物。
117.分析物可来源于特定类型的细胞和/或特定亚细胞区域。例如,分析物可来源于细胞溶质、来自细胞核、来自线粒体、来自微粒体,并且更一般地,来自细胞的任何其它区室、细胞器或部分。特异性地靶向某些细胞区室和细胞器的透化剂可用于选择性地从细胞释放分析物以供分析,和/或允许一种或多种试剂(例如,用于原位分析的探针和/或用于空间分析的探针)接近细胞或细胞区室或细胞器中的分析物。
118.分析物可大致分类为两组中的一者:核酸分析物和非核酸分析物。本文公开的整合原位空间测定可用于以任何合适的组合分析核酸分析物和/或非核酸分析物。在一些方面,本文公开的方法的一个或多个原位测定模块可分析样品中的第一多种核酸分析物,并且所述方法的一个或多个空间测定模块可分析所述样品中的第二多种核酸分析物,其中所述第二多种任选地是比所述第一多种更大组的核酸分析物。在本文的任何实施方案中,本文公开的方法的一个或多个原位测定和/或空间测定模块可分析多种非核酸分析物,如蛋白质分析物。
119.非核酸分析物的实例包括但不限于脂质、碳水化合物、肽、蛋白质、糖蛋白(n-连接
或o-连接)、脂蛋白、磷蛋白、蛋白质的特定磷酸化或乙酰化变体、蛋白质的酰胺化变体、蛋白质的羟基化变体、蛋白质的甲基化变体、蛋白质的泛素化变体、蛋白质的硫酸化变体、病毒外壳蛋白、细胞外和细胞内蛋白质、抗体和抗原结合片段。在一些实施方案中,分析物在细胞内部或细胞表面上,如跨膜分析物或附着于细胞膜的分析物。在一些实施方案中,分析物可以是细胞器(例如,细胞核或线粒体)。在一些实施方案中,分析物是细胞外分析物,如分泌的分析物。
120.对应于分析物的细胞表面特征可包括但不限于受体、抗原、表面蛋白、跨膜蛋白、分化簇蛋白、蛋白质通道、蛋白质泵、载体蛋白、磷脂、糖蛋白、糖脂、细胞-细胞相互作用蛋白复合物、抗原呈递复合物、主要组织相容性复合物、工程化的t细胞受体、t细胞受体、b细胞受体、嵌合抗原受体、细胞外基质蛋白、细胞表面蛋白的翻译后修饰(例如磷酸化、糖基化、泛素化、亚硝基化、甲基化、乙酰化或脂化)状态、间隙连接和粘附连接。
121.核酸分析物的实例包括dna分析物,如基因组dna、甲基化dna、特定甲基化dna序列、片段化dna、线粒体dna、原位合成的pcr产物和rna/dna杂合体。
122.核酸分析物的实例还包括rna分析物,如各种类型的编码和非编码rna。不翻译成蛋白质的非编码rna(ncrna)的实例包括转移rna(trna)和核糖体rna(rrna),以及小非编码rna,如微小rna(mirna)、小干扰rna(sirna)、piwi相互作用rna(pirna)、小核仁rna(snorna)、小核rna(snrna)、细胞外rna(exrna)、小卡哈尔体特异性rna(scarna)和长ncrna,如xist和hotair。不同类型的rna分析物的实例包括信使rna(mrna),包括新生rna、前体mrna、初级转录物rna和加工的rna,如加帽mrna(例如,具有5'7-甲基鸟苷帽)、聚腺苷酸化mrna(3'端的poly-a尾)和已除去一个或多个内含子的剪接mrna。本文公开的分析物中还包括非加帽mrna、非聚腺苷酸化mrna和非剪接mrna。rna分析物的其它实例包括rrna、trna、mirna和病毒rna。rna可以是转录物(例如,存在于组织切片中)。rna可以是小的(例如,长度小于200个核酸碱基)或大的(例如,长度大于200个核酸碱基的rna)。小rna的实例包括5.8s核糖体rna(rrna)、5s rrna、trna、mirna、sirna、snorna、pirna、trna来源的小rna(tsrna)和rdna来源的小rna(srrna)。rna可以是双链rna或单链rna。rna可以是环状rna。rna可以是细菌rrna(例如,16s rrna或23srrna)。
123.在某些实施方案中,可从活细胞中提取分析物。可调整加工条件以确保生物样品在分析期间保持活性,并且从样品的活细胞中提取(或释放)分析物。活细胞来源的分析物只能从样品中获得一次,或者可每隔一段时间从继续保持存活状态的样品中获得。
124.一般而言,系统、设备、方法和组合物可用于分析任何数量的分析物。例如,所分析的分析物的数量可以是存在于样品的区域中或基底的单个特征内的至少约2、至少约3、至少约4、至少约5、至少约6、至少约7、至少约8、至少约9、至少约10、至少约11、至少约12、至少约13、至少约14、至少约15、至少约20、至少约25、至少约30、至少约40、至少约50、至少约100、至少约1,000、至少约10,000、至少约100,000种或更多种不同的分析物。
125.iii.样品和样品加工
126.a.生物样品
127.在一些实施方案中,本文公开了用于分析生物样品的方法和组合物,所述生物样品可获自受试者以用于使用包括但不限于活检、手术和激光捕获显微术(lcm)的多种技术中的任一种进行分析,并且通常包括来自受试者的细胞和/或其它生物材料。除了上述受试
者之外,生物样品也可获自原核生物,如细菌,例如大肠杆菌、葡萄球菌或肺炎支原体;古细菌;病毒,如丙型肝炎病毒或人类免疫缺陷病毒;或类病毒。生物样品可获自非哺乳动物生物体(例如,植物、昆虫、蜘蛛、线虫、真菌或两栖动物)。生物样品也可获自真核生物,如患者来源的类器官(pdo)或患者来源的异种移植物(pdx)。可从其获得生物样品的受试者可以是健康或无症状的个体、患有或疑似患有疾病的个体(例如,患有诸如癌症的疾病的患者)或易患疾病的个体和/或需要治疗或疑似需要治疗个体。
128.生物样品可包括任何数量的大分子,例如,细胞大分子和细胞器(例如,线粒体和细胞核)。生物样品可以是核酸样品和/或蛋白质样品。生物样品可以是碳水化合物样品或脂质样品。生物样品可作为组织样品获得,如组织切片、活组织检查、芯活组织检查、针抽吸物或细针抽吸物。样品可以是流体样品,如血液样品、尿液样品或唾液样品。样品可以是皮肤样品、结肠样品、面颊拭子、组织学样品、组织病理学样品、血浆或血清样品、肿瘤样品、活细胞、培养的细胞、临床样品例如全血或血液来源的产品、血细胞或培养的组织或细胞,包括细胞悬浮液。在一些实施方案中,生物样品可包括沉积在表面上的细胞。
129.无细胞生物样品可包括细胞外多核苷酸。细胞外多核苷酸可从身体样品分离,所述身体样品例如血液、血浆、血清、尿液、唾液、粘膜分泌物、痰液、粪便和泪液。
130.生物样品可来源于本文提及的受试者或生物体的同质培养物或群体,或者可替代地来自若干不同生物体的集合,例如,在群落或生态系统中。
131.生物样品可包括一种或多种患病细胞。患病细胞可具有改变的代谢性质、基因表达、蛋白质表达和/或形态特征。疾病的实例包括炎性病症、代谢病症、神经系统病症和癌症。癌细胞可源自实体瘤、血液恶性肿瘤、细胞系,或作为循环肿瘤细胞获得。
132.生物样品还可包括胎儿细胞。例如,可进行诸如羊膜穿刺术的程序以从母体循环中获得胎儿细胞样品。胎儿细胞的测序可用于鉴定许多遗传病症中的任一种,包括例如非整倍性如唐氏综合症、爱德华兹综合征和帕陶综合征(patau syndrome)。此外,胎儿细胞的细胞表面特征可用于鉴定许多病症或疾病中的任一种。
133.生物样品还可包括免疫细胞。对此类细胞的免疫组库,包括基因组、蛋白质组和细胞表面特征的序列分析可提供丰富的信息,以促进了解免疫系统的状态和功能。例如,在自体干细胞移植后确定多发性骨髓瘤(mm)患者中微小残留病(mrd)的状态(例如,阴性或阳性)被认为是mm患者中mrd的预测因子(参见,例如,美国专利申请公布号2018/0156784,其全部内容以引用的方式并入本文)。
134.生物样品中的免疫细胞的实例包括但不限于b细胞、t细胞(例如,细胞毒性t细胞、自然杀伤t细胞、调控性t细胞和t辅助细胞)、自然杀伤细胞、细胞因子诱导的杀伤(cik)细胞、骨髓细胞,如粒细胞(嗜碱性粒细胞、嗜酸性粒细胞、嗜中性粒细胞/多叶核嗜中性粒细胞)、单核细胞/巨噬细胞、肥大细胞、血小板/巨核细胞和树突细胞。
135.如上所论述,生物样品可包括单一目标分析物,或多于一种目标分析物。提供了用于进行多重测定以分析单个生物样品中的两种或更多种不同分析物的方法。
136.b.生物样品的加工
137.可进行多个步骤来制备或加工用于分析和/或在分析期间的生物样品。除非另有说明,否则下文所述的制备或加工步骤通常可以任何方式和以任何顺序组合,以适当地制备或加工特定样品用于和/或分析。
138.在一些实施方案中,可用一种或多种可用于原位测定和/或空间测定的试剂处理样品。在一些实施方案中,可用一种或多种酶处理样品。例如,可添加一种或多种核酸内切酶以使dna片段化、dna聚合酶和用于扩增核酸的dntp。也可添加到样品中的其它酶包括但不限于聚合酶、转座酶、连接酶以及dna酶和rna酶。在一些实施方案中,可将逆转录酶添加到样品中,包括具有末端转移酶活性的酶、引物和模板转换寡核苷酸。模板转换可用于增加cdna的长度,例如,通过将预定义的核酸序列附加到cdna上。在一些实施方案中,可在空间测定期间分析cdna。
139.i.组织切片
140.生物样品可从受试者收获(例如,通过手术活检、整个受试者切片)或在生长基底或培养皿上作为细胞群在体外生长,并作为组织切片(tissue slice)或组织切片(tissue section)制备以供分析。生长的样品可足够薄,无需进一步加工步骤即可进行分析。可替代地,可使用机械切割设备(如振动刀片切片机)将生长样品和通过活检或切片获得的样品制备为薄组织切片。作为另一替代方案,在一些实施方案中,可通过将生物样品的触摸印片(touch imprint)施加至合适的基底材料上来制备薄组织切片。
141.组织切片的厚度可以是细胞的最大横截面尺寸的一部分(例如,小于0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2或0.1)。然而,也可使用厚度大于最大横截面细胞尺寸的组织切片。例如,可使用低温恒温器切片,其可以是例如10-20微米厚。
142.更一般地,组织切片的厚度通常取决于用于制备切片的方法和组织的物理特性,并且因此可制备和使用具有多种不同厚度的切片。例如,组织切片的厚度可以是至少0.1、0.2、0.3、0.4、0.5、0.7、1.0、1.5、2、3、4、5、6、7、8、9、10、12、13、14、15、20、30、40或50微米。如果需要或方便,也可使用更厚的切片,例如至少70、80、90或100微米或更大。通常,组织切片的厚度介于1-100微米、1-50微米、1-30微米、1-25微米、1-20微米、1-15微米、1-10微米、2-8微米、3-7微米或4-6微米之间,但如上所述,也可分析厚度大于或小于这些范围的切片。
143.也可从单个生物样品获得多个切片。例如,通过使用切片刀片对活检样品进行连续切片,可从手术活检样品获得多个组织切片。可以这种方式保存连续切片之间的空间信息,并且可对切片进行连续分析以获得关于生物样品的三维信息。
144.ii.冷冻
145.在一些实施方案中,可通过在适合维持或保持组织结构的完整性(例如,物理特性)的温度下深度冷冻来制备生物样品(例如,如上所述的组织切片)。这样的温度可例如小于-20℃或小于-25℃、-30℃、-40℃、-50℃、-60℃、-70℃、-80℃、-90℃、-100℃、-110℃、-120℃、-130℃、-140℃、-150℃、-160℃、-170℃、-180℃、-190℃或-200℃。可使用许多合适的方法将冷冻的组织样品切片(例如切成薄片)到基底表面上。例如,可使用设定在适合维持组织样品的结构完整性和样品中核酸的化学性质的温度下的冷冻切片机(例如,低温恒温器)来制备组织样品。这样的温度可例如低于-15℃、低于-20℃或低于-25℃。
146.iii.福尔马林固定和石蜡包埋
147.在一些实施方案中,可使用福尔马林固定和石蜡包埋(ffpe)来制备生物样品,其是已建立的方法。在一些实施方案中,可使用福尔马林固定和石蜡包埋来制备细胞悬浮液和其它非组织样品。在固定样品并包埋在石蜡或树脂块中之后,可如上所述对样品进行切片。在分析之前,可通过将组织切片在适当的溶剂(例如二甲苯)中孵育、然后冲洗(例如,
99.5%乙醇2分钟,96%乙醇2分钟和70%乙醇2分钟)来从组织切片中除去石蜡包埋材料(例如,脱蜡)。
148.iv.固定
149.作为上述福尔马林固定的替代方案,可将生物样品固定在多种其它固定剂中的任一种中,以在分析之前保持样品的生物结构。例如,可通过浸入乙醇、甲醇、丙酮、多聚甲醛(pfa)-triton以及它们的组合中来固定样品。
150.在一些实施方案中,丙酮固定用于新鲜冷冻样品,所述新鲜冷冻样品可包括但不限于皮层组织、小鼠嗅球、人脑肿瘤、人死后脑和乳腺癌样品。当进行丙酮固定时,可不进行预透化步骤(如下所述)。可替代地,可结合透化步骤进行丙酮固定。
151.在一些实施方案中,本文提供的方法包括一个或多个后固定(post-fixing)(也称为后固定(postfixation))步骤。在一些实施方案中,在使样品与本文公开的多核苷酸(例如一个或多个探针,如环状或挂锁探针)接触后进行一个或多个后固定步骤。在一些实施方案中,在样品中形成包含探针和靶标的杂交复合物之后进行一个或多个后固定步骤。在一些实施方案中,在本文公开的连接反应(如用于使挂锁探针环化的连接)之前进行一个或多个后固定步骤。
152.在一些实施方案中,在使样品与用于非核酸分析物如蛋白质分析物的结合或标记剂(例如,抗体或其抗原结合片段)接触之后进行一个或多个后固定步骤。标记剂可包含核酸分子(例如,报告基因寡核苷酸),所述核酸分子包含对应于标记剂并因此对应于(例如,独特标识)分析物的序列。在一些实施方案中,标记剂可包含含有一个或多个条形码序列的报告基因寡核苷酸。在一些实施方案中,使样品在原位测定和/或空间测定期间与标记剂接触。
153.可使用本文公开的任何合适的固定试剂,例如depc-pbs中的3%(w/v)多聚甲醛进行后固定步骤。
154.v.包埋
155.作为上述石蜡包埋的替代方案,可将生物样品包埋在多种其它包埋材料中的任一种中,以在切片和其它处理步骤之前向样品提供结构基底。一般而言,在分析从样品中获得的组织切片之前除去包埋材料。合适的包埋材料包括但不限于蜡、树脂(例如甲基丙烯酸酯树脂)、环氧树脂和琼脂。
156.在一些实施方案中,生物样品可包埋在水凝胶基质中。以这种方式包埋样品通常涉及使生物样品与水凝胶接触,使得生物样品被水凝胶包围。例如,可通过使样品与合适的聚合物材料接触并激活聚合物材料以形成水凝胶来包埋样品。在一些实施方案中,形成水凝胶,使得水凝胶在生物样品中内化。
157.在一些实施方案中,经由形成水凝胶的聚合物材料的交联而使生物样品固定在水凝胶中。交联可化学地和/或光化学地进行,或者可替代地通过本领域已知的任何其它水凝胶形成方法进行。
158.水凝胶基质的组成和对生物样品的施加通常取决于生物样品的性质和制备(例如,切片、未切片、固定类型)。作为一个实例,在生物样品是组织切片的情况下,水凝胶基质可包括单体溶液和过硫酸铵(aps)引发剂/四甲基乙二胺(temed)促进剂溶液。作为另一个实例,在生物样品由细胞(例如,培养的细胞或从组织样品分离的细胞)组成的情况下,可将
细胞与单体溶液和aps/temed溶液一起孵育。对于细胞,水凝胶基质凝胶在隔室中形成,所述隔室包括但不限于用于培养、维持或运输细胞的装置。例如,水凝胶-基质可用添加到隔室至约0.1μm至约2mm深度的单体溶液加aps/temed形成。
159.生物样品的水凝胶包埋的另外方法和方面例如在chen等人,science 347(6221):543
–
548,2015中进行了描述,所述文献的全部内容以引用的方式并入本文。
160.vi.染色
161.为了便于可视化,可使用多种染色剂和染色技术对生物样品进行染色。在一些实施方案中,例如,可使用许多染色剂对样品进行染色,所述染色剂包括但不限于吖啶橙、俾斯麦棕、胭脂红、考马斯蓝、甲酚紫、dapi、伊红、溴化乙锭、酸性品红、苏木精、赫斯特染色剂、碘、甲基绿、亚甲基蓝、中性红、尼罗蓝、尼罗红、四氧化锇、碘化丙啶、罗丹明或番红。
162.可使用苏木精和伊红(h&e)染色技术、使用巴氏染色(papanicolaou staining)技术、马松三色(masson’s trichrome)染色技术、银染色技术、苏丹染色技术和/或使用高碘酸希夫(pas)染色技术对样品进行染色。pas染色通常在福尔马林或丙酮固定后进行。在一些实施方案中,可使用罗曼诺夫斯基氏染色剂(romanowsky stain),包括瑞氏染色剂(wright’s stain)、詹纳尔氏染色剂(jenner’s stain)、卡恩-格林华染色剂(can-grunwald stain)、利什曼染色剂(leishman stain)和吉姆萨染色剂(giemsa stain)对样品进行染色。
163.在一些实施方案中,可对生物样品进行脱色。使生物样品脱色或褪色的方法在本领域中是已知的,并且通常取决于施加到样品上的染色剂的性质。例如,在一些实施方案中,通过抗体偶联将一种或多种免疫荧光染色剂施加至样品。可使用诸如经由用还原剂处理和洗涤剂洗涤、离液盐处理、用抗原修复溶液处理和用酸性甘氨酸缓冲液处理来裂解二硫键联的技术除去此类染色剂。用于多重染色和脱色的方法例如在bolognesi等人,j.histochem.cytochem.2017;65(8):431-444;lin等人,nat commun.2015;6:8390;pirici等人,j.histochem.cytochem.2009;57:567
–
75以及glass等人,j.histochem.cytochem.2009;57:899
–
905中进行了描述,所述文献各自的全部内容以引用的方式并入本文。
164.vii.等距膨胀
165.在一些实施方案中,包埋在水凝胶中的生物样品可等距膨胀。可使用的等距膨胀方法包括水合作用,这是膨胀显微术中的制备步骤,如chen等人,science 347(6221):543
–
548,2015中所描述。
166.等距膨胀可通过将生物样品的一种或多种组分锚定至凝胶,然后形成凝胶、蛋白水解和溶胀来进行。生物样品的等距膨胀可在将生物样品固定在基底上之前发生,或者在将生物样品固定至基底之后发生。在一些实施方案中,等距膨胀的生物样品可在使基底与本文公开的捕获探针接触之前从所述基底除去。
167.一般而言,用于进行生物样品的等距膨胀的步骤可取决于样品的特性(例如,组织切片的厚度、固定、交联)和/或目标分析物(例如,将rna、dna和蛋白质锚定至凝胶的不同条件)。
168.在一些实施方案中,将生物样品中的蛋白质锚定至可溶胀凝胶,如聚电解质凝胶。抗体可在被锚定至可溶胀凝胶之前、之后或结合被引导至蛋白质。生物样品中的dna和/或
rna也可通过合适的接头锚定至可溶胀凝胶。此类接头的实例包括但不限于6-((丙烯酰基)氨基)己酸(丙烯酰基-x se)(可从thermofisher,waltham,ma获得)、标记-it胺(可从mirusbio,madison,wi获得)和标记x(例如在chen等人,nat.methods 13:679-684,2016中进行了描述,其全部内容以引用的方式并入本文)。
169.样品的等距膨胀可提高样品的后续分析的空间分辨率。可通过将等距膨胀的样品与尚未等距膨胀的样品进行比较来确定空间谱分析中增加的分辨率。
170.在一些实施方案中,使生物样品等距膨胀至其未膨胀尺寸的至少2倍、2.1倍、2.2倍、2.3倍、2.4倍、2.5倍、2.6倍、2.7倍、2.8倍、2.9倍、3倍、3.1倍、3.2倍、3.3倍、3.4倍、3.5倍、3.6倍、3.7倍、3.8倍、3.9倍、4倍、4.1倍、4.2倍、4.3倍、4.4倍、4.5倍、4.6倍、4.7倍、4.8倍或4.9倍的尺寸。在一些实施方案中,使样品等距膨胀至其未膨胀尺寸的至少2倍且小于20倍。
171.viii.交联
172.在一些实施方案中,使生物样品在原位测定模块之前或期间可逆地交联。在一些方面,分析物或与其结合的探针的多核苷酸和/或扩增产物(例如,扩增子)可锚定至聚合物基质。例如,聚合物基质可以是水凝胶。在一些实施方案中,多核苷酸探针和/或其扩增产物(例如,扩增子)中的一者或多者可进行修饰以含有可用作锚定位点以将所述多核苷酸探针和/或扩增产物附接至聚合物基质的官能团。在一些实施方案中,包含寡聚dt的经修饰探针可用于结合目标mrna分子,随后是所述mrna分子的可逆交联。
173.在一些实施方案中,随机靶向的带条形码的挂锁探针可用于结合目标核酸分子(例如,dna或rna,如mrna转录物),然后用经修饰的核苷酸进行扩增(例如,滚环扩增)以将扩增子锁定在适当位置。在一些方面,在扩增步骤期间,可将经修饰的核苷酸添加至反应以将所述经修饰的核苷酸并入扩增产物中。经修饰的核苷酸的实例包括胺修饰的核苷酸。在一些实施方案中,胺修饰的核苷酸包含丙烯酸n-羟基琥珀酰亚胺部分修饰。其它胺修饰的核苷酸的实例包括但不限于5-氨基烯丙基-dutp部分修饰、5-炔丙基氨基-dctp部分修饰、n6-6-氨基己基-datp部分修饰或7-脱氮-7-炔丙基氨基-datp部分修饰。
174.在一些实施方案中,经由形成水凝胶的聚合物材料的交联而使生物样品固定在水凝胶中。交联可化学地和/或光化学地进行,或者可替代地通过本领域已知的任何其它水凝胶形成方法进行。
175.当基底包含凝胶(例如,水凝胶或凝胶基质)时,凝胶内的寡核苷酸可附接至基底。术语“水凝胶”和“水凝胶基质”在本文中可互换使用以指代包括网络的大分子聚合物凝胶。在网络中,一些聚合物链可任选地交联,尽管交联并不总是发生。
176.在一些实施方案中,水凝胶可包括水凝胶亚基。“水凝胶亚基”是亲水性单体、分子前体或可聚合(例如,交联)以形成三维(3d)水凝胶网络的聚合物。水凝胶亚基可包括任何方便的水凝胶亚基,如但不限于丙烯酰胺、双丙烯酰胺、聚丙烯酰胺及其衍生物、聚(乙二醇)及其衍生物(例如peg-丙烯酸酯(peg-da)、peg-rgd)、明胶-甲基丙烯酰基(gelma)、甲基丙烯酸化透明质酸(meha)、聚脂肪族聚氨酯、聚醚聚氨酯、聚酯聚氨酯、聚乙烯共聚物、聚酰胺、聚乙烯醇、聚丙二醇、聚四亚甲基氧化物、聚乙烯吡咯烷酮、聚丙烯酰胺、聚(丙烯酸羟乙酯)和聚(甲基丙烯酸羟乙酯)、胶原蛋白、透明质酸、壳聚糖、葡聚糖、琼脂糖、明胶、藻酸盐、蛋白质聚合物、甲基纤维素等,以及它们的组合。
177.在一些实施方案中,水凝胶包括混杂材料,例如,水凝胶材料包括合成和天然聚合物的要素。合适的水凝胶的实例描述于例如美国专利号6,391,937、9,512,422和9,889,422以及美国专利申请公布号2017/0253918、2018/0052081和2010/0055733中,所述专利各自的全部内容以引用的方式并入本文。
178.在一些实施方案中,将交联剂和/或引发剂添加至水凝胶亚基中。交联剂的实例包括但不限于双丙烯酰胺和双吖丙啶。引发剂的实例包括但不限于偶氮二异丁腈(aibn)、核黄素和l-精氨酸。包含交联剂和/或引发剂可导致在稍后的聚合步骤中相互作用的生物大分子之间的共价键合增加。
179.在一些实施方案中,水凝胶可具有胶体结构,如琼脂糖,或聚合物网状结构,如明胶。
180.在一些实施方案中,一些水凝胶亚基共价聚合(例如,经历“形成”)或物理地交联,以形成水凝胶网络。例如,水凝胶亚基可通过任何方法聚合,所述方法包括但不限于热交联、化学交联、物理交联、离子交联、光交联、照射交联(例如,x射线、电子束)以及它们的组合。诸如光刻光聚合的技术也可用于形成水凝胶。
181.可选择水凝胶亚基的聚合方法以形成具有不同性质(例如,水凝胶的孔径、溶胀性质、生物降解性、传导性、透明度和/或渗透性)的水凝胶。例如,水凝胶可包括尺寸足以允许大分子(例如,核酸、蛋白质、染色质、代谢物、grna、抗体、碳水化合物、肽、代谢物和/或小分子)进入样品(例如,组织切片)中的孔。已知孔径通常随着水凝胶亚基浓度的增加而减小,并且通常随着水凝胶亚基与交联剂的比率增加而增加。因此,可制备固定剂/水凝胶组合物,所述组合物包含允许此类生物大分子通过的浓度的水凝胶亚基。
182.在一些实施方案中,水凝胶可形成基底。在一些实施方案中,基底包括水凝胶和一种或多种第二材料。在一些实施方案中,水凝胶被置于一种或多种第二材料的顶部。例如,水凝胶可预先形成,然后置于一种或多种第二材料的顶部、底部或与一种或多种第二材料呈任何其它构型。在一些实施方案中,水凝胶形成在基底形成期间接触一种或多种第二材料之后发生。水凝胶形成也可在位于基底上的结构(例如,孔、脊、突起和/或标记)内发生。
183.在一些实施方案中,基底上的水凝胶形成在特征附接至基底之前、同时或之后发生。例如,当捕获探针附接(例如,直接或间接地)至基底时,可在已经含有捕获探针的基底上进行水凝胶形成。
184.在一些实施方案中,水凝胶形成在生物样品内发生。在一些实施方案中,将生物样品(例如,组织切片)包埋在水凝胶中。在一些实施方案中,将水凝胶亚基输注至生物样品中,并且水凝胶的聚合由外部或内部刺激引发。
185.在其中在生物样品内形成水凝胶的实施方案中,可使用官能化化学。在一些实施方案中,官能化化学包括水凝胶-组织化学(htc)。适用于htc的任何水凝胶-组织主链(例如,合成的或天然的)都可用于锚定生物大分子和调节官能化。使用htc主链变体的方法的非限制性实例包括clarity、pact、exm、switch和epact。在一些实施方案中,生物样品内的水凝胶形成是永久性的。例如,生物大分子可永久粘附至水凝胶,从而允许进行多轮询问。在一些实施方案中,生物样品内的水凝胶形成是可逆的。
186.在一些实施方案中,在聚合之前、同时和/或之后将额外的试剂添加至水凝胶亚基。例如,另外的试剂可包括但不限于寡核苷酸(例如,捕获探针)、使dna片段化的核酸内切
酶、用于dna的片段化缓冲液、dna聚合酶、用于扩增核酸并将条形码附接至经扩增片段的dntp。可使用其它酶,包括但不限于rna聚合酶、转座酶、连接酶、蛋白酶k和dna酶。另外的试剂还可包括逆转录酶,包括具有末端转移酶活性的酶、引物和模板转换寡核苷酸。在一些实施方案中,在聚合之前、同时和/或之后将光学标记添加至水凝胶亚基。
187.在一些实施方案中,在聚合之前、同时和/或之后将htc试剂添加至水凝胶。在一些实施方案中,在聚合之前、同时和/或之后将细胞标记剂添加至水凝胶。在一些实施方案中,在聚合之前、同时和/或之后将细胞穿透剂添加至水凝胶。
188.可使用任何合适的方法清除包埋在生物样品中的水凝胶。例如,电泳组织清除方法可用于从水凝胶包埋的样品中除去生物大分子。在一些实施方案中,将水凝胶包埋的样品在水凝胶清除之前或之后储存在介质(例如,封固剂、甲基纤维素或其它半固体介质)中。
[0189]“条件性可除去涂层”是可在施加释放剂后从基底表面除去的涂层。在一些实施方案中,条件性可除去涂层包括如本文所述的水凝胶,例如,包含基于多肽的材料的水凝胶。以基于多肽的材料为特征的水凝胶的非限制性实例包括基于合成肽的材料,其特征在于蜘蛛丝和人肌肉l型钙通道(例如,)的跨膜区段的组合;含有重复精氨酸-丙氨酸-天冬氨酸-丙氨酸序列的两亲性16残基肽(radarada radarada)(例如);eak16(aeaeakakaeae akak);kld12(kldlkldlkldl)和pgmatrix
tm
。
[0190]
在一些实施方案中,条件性可除去涂层中的水凝胶是刺激响应性水凝胶。刺激响应性水凝胶可在施加一种或多种外部触发剂(例如,释放剂)时经历凝胶至溶液和/或凝胶至固体转变。参见例如,willner,acc.chem.res.50:657-658,2017,其以引用的方式整体并入本文。刺激响应性水凝胶的非限制性实例包括热响应性水凝胶、ph响应性水凝胶、光响应性水凝胶、氧化还原响应性水凝胶、分析物响应性水凝胶或它们的组合。在一些实施方案中,刺激响应性水凝胶可以是多刺激响应性水凝胶。
[0191]“释放剂”或“外部触发剂”是当释放剂被施加至条件性可除去涂层时允许从基底除去条件性可除去涂层的剂。外部触发剂或释放剂可包括物理触发剂,如热、磁、超声、电化学和/或光刺激;以及化学触发剂,如ph、氧化还原反应、超分子复合物和/或生物催化驱动反应。参见例如,echeverria等人,gels(2018),4,54;doi:10.3390/gels4020054,其以引用的方式整体并入本文。“释放剂”或“外部触发剂”的类型可取决于条件性可除去涂层的类型。例如,可在施加包括还原剂如二硫苏糖醇(dtt)的释放剂时除去特征在于氧化还原响应性水凝胶的条件性可除去涂层。作为另一个实例,可在施加改变ph的释放剂后除去ph响应性水凝胶。
[0192]
在一些实施方案中,本文公开的方法包括使可逆交联的生物样品去交联。在一些实施方案中,去交联在空间测定之前进行。去交联不需要是完全的。在一些实施方案中,可逆交联的生物样品中仅一部分交联分子被去交联并允许迁移。
[0193]
ix.细胞的解聚
[0194]
在一些实施方案中,生物样品对应于细胞(例如,源自细胞培养物、组织样品或沉积在表面上的细胞)。在具有多个细胞的细胞样品中,单个细胞可以是天然未聚集的。例如,细胞可源自细胞悬浮液和/或来自组织或组织切片的解离或解聚的细胞。
[0195]
可替代地,样品中的细胞可聚集,并且可使用例如酶促或机械技术解聚成单个细胞。用于酶解聚的酶的实例包括但不限于分散酶、胶原酶、胰蛋白酶以及它们的组合。可例
如使用组织匀浆器进行机械解聚。生物样品可包含沉积在表面上并经受本文公开的原位测定和空间测定的解聚细胞(例如,非粘附细胞或悬浮细胞)。
[0196]
x.组织透化和处理
[0197]
在一些实施方案中,生物样品可被透化以促进分析物转移出样品,和/或促进物质(如捕获探针)转移到样品中。如果样品未充分透化,则从样品中捕获的分析物的量可能太低而无法进行充分分析。相反,如果组织样品的渗透性太强,则组织样品内的分析物的相对空间关系可能丢失。因此,在使组织样品足够透化以获得良好信号强度同时仍保持样品中分析物分布的空间分辨率之间的平衡是令人希望的。
[0198]
通常,可通过使样品暴露于一种或多种透化剂来使生物样品透化。用于此目的的合适剂包括但不限于有机溶剂(例如,丙酮、乙醇和甲醇)、交联剂(例如,多聚甲醛)、洗涤剂(例如,皂苷、triton x-100
tm
或tween-20
tm
)和酶(例如,胰蛋白酶、蛋白酶)。在一些实施方案中,生物样品可与细胞透化剂一起孵育以促进样品的透化。用于样品透化的另外方法例如在jamur等人,method mol.biol.588:63-66,2010中进行了描述,所述文献的全部内容以引用的方式并入本文。用于样品透化的任何合适的方法通常可与本文所述的样品结合使用。
[0199]
在一些实施方案中,当在分析程序期间使用防扩散介质来限制分析物或其它物质的迁移时,所述防扩散介质可包括至少一种透化试剂。例如,防扩散介质可包括含有透化缓冲液或试剂的孔(例如,微孔、纳米孔或微微孔)。在一些实施方案中,当防扩散介质是水凝胶时,所述水凝胶可包括透化缓冲液。在一些实施方案中,在使水凝胶与样品接触之前,将水凝胶浸泡在透化缓冲液中。在一些实施方案中,水凝胶或其它防扩散介质可含有干燥试剂或单体,以在将防扩散介质施加至生物样品时递送透化试剂。在一些实施方案中,防扩散介质(即水凝胶)共价附接至固体基底(即丙烯酸化载玻片)。在一些实施方案中,水凝胶可进行修饰以含有捕获探针并递送透化试剂。例如,水凝胶膜可进行修饰以包括带空间条形码的捕获探针。然后将带空间条形码的水凝胶薄膜浸泡在透化缓冲液中,然后使所述带空间条形码的水凝胶薄膜与样品接触。因此,带空间条形码的水凝胶膜将透化试剂递送至与带空间条形码的水凝胶接触的样品表面,从而增强分析物迁移和捕获。在一些实施方案中,将带空间条形码的水凝胶施加至样品并置于透化本体溶液中。在一些实施方案中,浸泡在透化试剂中的水凝胶薄膜夹在样品与带空间条形码的阵列之间。在一些实施方案中,靶分析物能够扩散通过透化试剂浸泡的水凝胶并杂交或结合在水凝胶另一侧的捕获探针。在一些实施方案中,水凝胶的厚度与分辨率损失成比例。在一些实施方案中,孔(例如,微孔、纳米孔或微微孔)可含有带空间条形码的捕获探针和透化试剂和/或缓冲液。在一些实施方案中,带空间条形码的捕获探针和透化试剂固持在间隔物之间。在一些实施方案中,将样品冲孔、切割或转移到孔中,其中靶分析物扩散通过透化试剂/缓冲液并且扩散至带空间条形码的捕获探针。在一些实施方案中,分辨率损失可与间隙厚度(例如样品与捕获探针之间的透化缓冲液的量)成比例。在一些实施方案中,防扩散介质(例如水凝胶)的厚度介于大约50-500微米之间,包括500、450、400、350、300、250、200、150、100或50微米厚,或50与500微米以内的任何厚度。
[0200]
在一些实施方案中,可通过多孔膜将透化溶液递送至样品。在一些实施方案中,多孔膜用于限制扩散分析物损失,同时允许透化试剂到达样品。可控制膜化学性质和孔径,以
使分析物损失最小化。在一些实施方案中,多孔膜可由玻璃、硅、纸、水凝胶、聚合物整料或其它材料制成。在一些实施方案中,材料可以是天然多孔的。在一些实施方案中,材料可具有蚀刻到固体材料中的孔隙或孔。在一些实施方案中,透化试剂流动通过多孔膜上方的微流体室或通道。在一些实施方案中,流动控制样品对透化试剂的接近。在一些实施方案中,多孔膜夹在带空间条形码的阵列与样品之间,其中透化溶液施加在多孔膜上。透化试剂扩散通过膜的孔隙并且扩散到组织中。
[0201]
在一些实施方案中,可通过向样品添加一种或多种裂解试剂来使生物样品透化。合适的裂解剂的实例包括但不限于生物活性试剂,如用于裂解不同细胞类型(例如革兰氏阳性或阴性细菌、植物、酵母、哺乳动物)的裂解酶,如溶菌酶、无色肽酶、溶葡球菌酶、唇形酶(labiase)、立枯丝核菌裂解酶(kitalase)、溶细胞酶和多种其它市售裂解酶。
[0202]
其它裂解剂可额外地或替代地添加至生物样品以促进透化。例如,基于表面活性剂的裂解溶液可用于裂解样品细胞。裂解溶液可包括离子型表面活性剂,例如肌氨酰和十二烷基硫酸钠(sds)。更一般地,化学裂解剂可包括但不限于有机溶剂、螯合剂、洗涤剂、表面活性剂和离液剂。
[0203]
在一些实施方案中,生物样品可通过非化学透化方法透化。非化学透化方法是本领域已知的。例如,可使用的非化学透化方法包括但不限于物理裂解技术,如电穿孔、机械透化方法(例如,使用匀浆器和研磨球以机械方式破坏样品组织结构的珠磨(bead beating))、声学透化(例如,超声处理)和热裂解技术,如加热以诱导样品的热透化。
[0204]
在分析样品之前,可将额外的试剂添加至生物样品以进行各种功能。在一些实施方案中,可将dna酶和rna酶灭活剂或抑制剂如蛋白酶k和/或螯合剂如edta添加至样品中。例如,本文公开的方法可包括增加用于结合的核酸的可接近性的步骤,例如打开细胞中的dna以供探针杂交的变性步骤。例如,蛋白酶k处理可用于释放dna和与其结合的蛋白质。
[0205]
xi.rna种类的选择性富集
[0206]
在一些实施方案中,当rna是分析物时,可选择性地富集一种或多种目标rna分析物种类。例如,可通过向样品添加一种或多种寡核苷酸来选择一种或多种目标rna种类。在一些实施方案中,额外的寡核苷酸是用于通过酶(例如,聚合酶)引发反应的序列。例如,与一种或多种目标rna具有序列互补性的一个或多个引物序列可用于扩增一种或多种目标rna,从而选择性富集这些rna。
[0207]
在一些实施方案中,一个或多个核酸探针可用于与靶核酸(例如,cdna或rna分子,如mrna)杂交并在模板化连接反应(例如,rna模板化连接(rtl)或dna模板化连接(例如,在cdna上))中连接以产生用于分析的产物。在一些方面,当分析两种或更多种分析物时,使用对每种rna或cdna分析物具有特异性(例如,特异地杂交)的第一和第二探针。例如,在本文提供的方法的一些实施方案中,模板化连接用于检测生物样品中的基因表达。可靶向由标记剂或结合剂(例如,抗体或其表位结合片段)结合的目标分析物(如蛋白质)以供分析,其中所述结合剂与包含鉴定所述结合剂的报告基因序列的报告基因寡核苷酸缀合或以其它方式结合。探针可与报告基因寡核苷酸杂交并在模板化连接反应中连接以产生用于分析的产物。在一些实施方案中,探针寡核苷酸之间的间隙可首先在连接之前填充,例如使用mu聚合酶、dna聚合酶、rna聚合酶、逆转录酶、vent聚合酶、taq聚合酶和/或它们的任何组合、衍生物和变体(例如,工程化突变体)。在一些实施方案中,测定可还包括模板化连接产物的扩
增(例如,通过多重pcr)。
[0208]
在一些实施方案中,与捕获的rna(例如,cdna)的互补链具有序列互补性的寡核苷酸可结合至cdna。例如,具有与一种或多种目标cdna互补的序列的生物素化寡核苷酸结合至cdna,并且可使用本领域已知的多种方法中的任一种(例如,链霉亲和素珠),使用生物素化-链霉亲和素亲和性进行选择。
[0209]
可替代地,可使用多种方法中的任一种来缩小选择(例如,除去)一种或多种rna。例如,可将探针施用于选择性地与核糖体rna(rrna)杂交的样品,从而减少样品中rrna的库和浓度。由于样品中存在的非特异性rna的减少,将捕获探针随后施加至样品可导致其它类型的rna的捕获得到改善。另外地和可替代地,双链体特异性核酸酶(dsn)处理可除去rrna(参见例如,archer等人,selective and flexible depletion of problematic sequences from rna-seq libraries at the cdna stage,bmc genomics,15 401,(2014),所述文献的全部内容以引用的方式并入本文)。此外,羟基磷灰石色谱法可除去丰富的种类(例如,rrna)(参见例如,vandernoot,v.a.,cdna normalization by hydroxyapatite chromatography to enrich transcriptome diversity in rna-seq applications,biotechniques,53(6)373-80,(2012),所述文献的全部内容以引用的方式并入本文)。
[0210]
iv.原位测定模块
[0211]
在一些方面,本文提供了包括使用显微术作为读出的原位测定的方法,例如核酸测序、杂交或涉及光学读出的其它检测或确定方法。在一些方面,检测或确定靶核酸的一个、两个、三个、四个、五个或更多个核苷酸的序列在完整组织中的细胞中原位进行。在一些实施方案中,测定包括检测扩增产物(例如,rca产物)的存在或不存在。在一些实施方案中,本公开提供了用于大量靶标(如转录物和/或dna基因座)的原位高通量谱分析的方法,所述方法例如用于检测和/或定量细胞、组织、器官或生物体中的核酸和/或蛋白质。在一些实施方案中,探针与样品的杂交和/或原位测定期间的检测步骤在样品中未被捕获探针或捕获剂捕获的分析物上进行。
[0212]
a.原位分析
[0213]
在一些方面,本文提供了包括基于包含核酸序列的探针的原位杂交分析生物靶标的方法。在一些实施方案中,方法包括可检测标记的寡核苷酸与直接或间接地结合至样品中的生物靶标的带条形码的探针的顺序杂交。在一些实施方案中,可检测标记的寡核苷酸直接结合至一个或多个带条形码的探针。在一些实施方案中,可检测标记的寡核苷酸间接地结合至一个或多个带条形码的探针,例如,经由一种或多种桥接核酸分子。
[0214]
在一些方面,基于原位杂交的测定用于定位和分析天然生物样品(例如,组织或单个细胞的一部分或切片)内的核酸序列(例如,包含一个或多个特定目标序列的dna或rna分子)。在一些实施方案中,原位测定用于分析生物样品中mrna转录物(例如,转录组或其子集,或目标mrna分子)的存在、不存在、量或水平,同时保留空间背景。在一些实施方案中,本公开提供了用于原位杂交的组合物和方法,所述方法使用直接或间接标记的分子(例如,互补dna或rna或经修饰的核酸)作为与目标生物样品内的靶核酸结合或杂交的探针。
[0215]
在一些实例中,核酸探针可用放射性同位素、表位、半抗原、生物素或荧光团标记,以能够检测染色体上或组织中特定核酸序列的位置。在一些实施方案中,探针是基因座特
异性的(例如,基因特异性的)并且结合或偶联至染色体的特定区域。在替代实施方案中,探针是结合或偶联至每个染色体内的重复序列的类α或着丝粒重复探针。探针也可以是结合或偶联至沿着整个染色体的序列的全染色体探针(例如,多个较小探针)。
[0216]
在一些实施方案中,本文提供了一种包括dna原位杂交以测量和定位dna的方法。在一些实施方案中,本文提供了一种包括rna原位杂交以测量和定位生物样品(例如,固定的组织样品)内的rna(例如,mrna、lncrna和mirna)的方法。在一些实施方案中,rna原位杂交涉及单分子rna荧光原位杂交(fish)。在一些实施方案中,荧光标记的核酸探针与预定rna靶杂交,以可视化生物样品中的基因表达。在一些实施方案中,fish方法包括使用对每个靶标具有特异性的单个核酸探针,例如单分子fish(smfish)。smfish的使用可产生荧光信号,所述荧光信号允许对rna转录物的定量测量。在一些实施方案中,smfish包含一组长度为约50个碱基对的核酸探针,其中每个探针与一组荧光团偶联。例如,所述组核酸探针可包括五个探针,其中每个探针与五个荧光团偶联。在一些实施方案中,所述核酸探针各自与一个荧光团偶联。例如,smfish方案可使用一组约40个长度约20个碱基对的核酸探针,每个核酸探针与单个荧光团偶联。在一些实施方案中,核酸探针的长度变化,包括10至100个碱基对,如30至60个碱基对。可替代地,可使用靶向同一rna转录物的不同区域的多个核酸探针。本领域技术人员将理解,可改变核酸探针的类型、核酸探针的数量、与所述探针偶联的荧光团的数量以及所述探针的长度,以适合单个测定的规格。
[0217]
在其它实施方案中,smfish被应用于多路复用工作流程,其中使用连续/顺序杂交(例如,如在seqfish或seqfish 中)以在靶转录物上赋予时间条形码。连续几轮荧光原位杂交可伴随着成像和探针剥离,检测目标生物样品(例如,组织样品、单细胞或提取的rna)中的单独转录物(例如,rna转录物)。在一些实施方案中,每轮杂交包含靶向独特rna转录物的预定义探针组(例如,约10与约50个探针之间,如24至32个探针)。在一些实例中,预定义探针组是多色的。任选地,将多个核酸探针附接到样品上,其中每个探针包含用于扩增的起始序列,从而允许降低的自发荧光(例如,如在单分子杂交链反应(smhcr)中)。在一些实施方案中,本文所述的多路复用smfish方法可多路复用10至超过10,000个mrna,任选地伴随成像,以有效地且准确地分析整个转录组。原位杂交方法可还包括使用两个探针来结合靶转录物(例如,rna转录物),所述靶转录物用作扩增引物的结合靶标。在一些实施方案中,此过程导致信号扩增(例如,如在rnascope中)。在一些实施方案中,原位杂交方法可采用金属标签而不是荧光团(例如,成像质谱流式细胞术)。金属缀合的抗体可偶联至与生物样品上的转录物杂交的金属标签。在一些实施方案中,质谱流式细胞术可用于定量金属丰度,从而允许同时评估生物样品内的rna和蛋白质。
[0218]
在一些实施方案中,本文所述的方法包括误差稳健的多路复用fish方案(例如,merfish)。在一些实施方案中,所述方案包括非读出核酸探针(例如,初级探针),所述非读出核酸探针包含与一个或多个侧翼区偶联的结合区(例如,与诸如rna转录物的靶标结合的区域)。在一些实施方案中,每个非读出核酸探针与两个侧翼区偶联。非读出核酸探针可与生物样品(例如,组织样品或单个细胞)内的转录物(例如,rna转录物)杂交,使得荧光读出核酸探针可随后与非读出核酸探针的侧翼区连续杂交。在一些实施方案中,每轮杂交包括连续成像和探针剥离以淬灭来自前几轮的读出核酸探针的信号。rna可通过fish成像,并且检测和/或校正在多个成像轮次中累积的误差(例如,不完美杂交)。在一些实施方案中,采
用膨胀显微术来增加检测到的rna靶标的数量而无信号重叠。在类似的实施方案中,非读出核酸探针在成像之前与靶转录物交联。可通过本领域已知的任何方法进行交联。在优选的实施方案中,使用水凝胶组织包埋进行交联。在所述交联步骤之后,可进行条形编码,包括使用与预定颜色偶联的读出探针进行顺序杂交以产生独特条形码(例如,从连续杂交产生假色)。
[0219]
在一些实施方案中,探针的一个或多个条形码被可检测标记的检测寡核苷酸(如荧光标记的寡核苷酸)靶向。在一些实施方案中,一种或多种解码方案用于解码信号(如荧光)以用于序列确定。在本文的任何实施方案中,条形码(例如,初级和/或二级条形码序列)可使用任何合适的方法或技术进行分析,所述方法或技术包括本文所述的那些,如靶标的rna顺序探测(rna spot)、顺序荧光原位杂交(seqfish或seqfish )、单分子荧光原位杂交(smfish)或多重误差文件的荧光原位杂交(merfish)。在一些实施方案中,本文提供的方法包括通过顺序杂交和用多个标记的探针(例如,检测寡核苷酸)检测来分析条形码。示例性解码方案在eng等人,“transcriptome-scale super-resolved imaging in tissues by rna seqfish ,”nature 568(7751):235-239(2019);chen等人,“spatially resolved,highly multiplexed rna profiling in single cells,”science;348(6233):aaa6090(2015);us10,457,980b2;us 2016/0369329 a1;wo 2018/026873 a1;和us2017/0220733a1中进行了描述,所述文献全部以引用的方式整体并入。在一些实施方案中,这些测定能够同时实现信号扩增、组合解码和纠错方案。
[0220]
使用fish技术的变型的原位杂交的类似策略也可被本文所述的方法采用。在一些实施方案中,方法包括非条形编码多路复用fish方案(例如,衔尾蛇sm-fish(osmfish))。非条形编码方法可限于检测特定数量的靶标,由所进行的杂交轮次的数量限定。在一些实施方案中,在每个杂交轮次之后进行成像,其中在成像后剥离探针,从而允许后续杂交和成像轮次。
[0221]
本公开的另外实施方案可包括使用不依赖于从预定位置探针捕获转录物的原位杂交方案。在一些实施方案中,可使用生物样品中转录物的无光学空间制图(例如,化学编码的显微术系统)。在一些实施方案中,首先用独特的核苷酸标签(例如,独特分子标识符)原位标记转录物。此第一反应之后可以是第二原位扩增反应,由一组新的独特核苷酸标签(例如,独特事件标识符)标记。在一些实施方案中,rna或dna测序可用于鉴定每个分子链序列(例如,多联体)。在其它实施方案中,可使用算法来评估序列的接近性并与序列信息组合产生目标转录物的图像。
[0222]
在一些实施方案中,本文提供了一种方法,所述方法包括将内源环境内靶标的测序信息和空间信息联系起来。例如,核酸序列的分析可直接在目标完整生物样品内的dna或rna上进行,例如通过原位测序。在一些实施方案中,除了所述转录物的空间分辨率之外,本公开允许同时鉴定和定量多个靶标,如100、1000或更多个转录物(例如,mrna转录物)。在一些方面,转录物的空间分辨率可以是亚细胞的。任选地,可使用本文所述的信号扩增策略来增加空间分辨率。
[0223]
在一些实施方案中,荧光染料用于靶向核酸碱基,并且挂锁探针用于原位靶向靶rna。在一些实施方案中,将mrna逆转录成cdna,并且挂锁探针能够结合或偶联至cdna。在一些实施方案中,挂锁探针包含末端与靶序列(例如,靶cdna转录物)互补的寡核苷酸。在挂锁
探针与靶序列杂交后,酶可用于连接挂锁探针的末端,并催化环化dna的形成。
[0224]
在一些实施方案中,挂锁探针的末端在与靶rna或cdna杂交后紧密接近,以允许挂锁探针的连接和环化。挂锁探针可另外包含一个或多个条形码序列。在替代实施方案中,在与靶rna或cdna杂交后,在挂锁探针的末端之间可存在间隙,所述间隙在连接挂锁探针的末端和环化之前必须用核酸填充(例如,通过dna聚合)。在一些实施方案中,挂锁探针的末端之间的间隙具有可变长度,例如至多四个碱基对,并且可允许读出实际rna或cdna序列。在一些实施方案中,dna聚合酶具有链置换活性。在一些实施方案中,dna聚合酶可能不具有链置换活性,如在条形码原位靶测序(baristaseq)中使用的聚合酶,其使用间隙填充挂锁探针方法提供至多15个碱基的读取长度。参见例如,chen等人,nucleic acids res.2018,46,e22,其以引用的方式整体并入本文。
[0225]
本文所述的方法可包括在挂锁探针位置处的dna环化和扩增(例如滚环扩增)。在一些实施方案中,扩增导致挂锁探针序列的多个重复。扩增的挂锁探针的测序和/或解码可使用连接法测序进行。在替代方法中,使用杂交测序或合成法测序。在一些实施方案中,在测序过程中通过本文所述的交联来使扩增子稳定。在一些实施方案中,本公开中呈现的原位测序方法可在微流体平台上自动化。
[0226]
本领域技术人员将理解原位测序的另外方法。例如,在一些实施方案中,带条形码的挂锁探针可能不被逆转录。相反,第二引物直接结合(例如,连接)至与挂锁探针相邻的rna序列。在一些实施方案中,进行扩增(例如滚环扩增),其中扩增产物通过本领域已知的任何合适的方法(例如水凝胶-组织化学)包埋在水凝胶中,然后清除掉未结合的蛋白质和脂质.包埋的扩增产物可例如使用连接法测序方法的变型进行测序,以确定每个挂锁探针的条形码序列。在一些实施方案中,本文所述的化学和测序的组合可用于分析靶转录物在3d中的空间取向。
[0227]
在一些实施方案中,本公开中描述的原位测序方法可以是非靶向的。在一些实施方案中,非靶向原位测序可包括对目标生物样品内的基因表达的全基因组/转录组谱分析,例如,如在荧光原位rna测序(fisseq)中。在一些实施方案中,rna种类被捕获并转化为交联的cdna扩增子(例如,与样品的细胞蛋白基质交联的cdna)。在一些实施方案中,使用经修饰的胺碱基进行cdna合成以促进交联过程。交联的cdna扩增子的合成之后可以是如本文其它地方所述的扩增(例如滚环扩增)。在一些实施方案中,连接法测序可用于对扩增产物进行测序。在一些实施方案中,测序步骤包括分区测序以选择性地对扩增产物的亚群进行测序。在一些实施方案中,本文所述的策略允许串联检测rna、dna和/或蛋白质。在一些实施方案中,原位测序可与非原位测序组合,例如,如在原位转录组可接近性测序(insta-seq)中。
[0228]
在一些实施方案中,原位测序涉及以顺序的、模板依赖性的方式并入标记的核苷酸(例如,荧光标记的单核苷酸或二核苷酸)或标记的引物(例如,标记的随机六聚体)与核酸模板的杂交,使得可确定所并入的核苷酸或标记的引物延伸产物的身份(即核苷酸序列),并且由此确定相应模板核酸的核苷酸序列。原位测序的方面在例如mitra等人,(2003)anal.biochem.320,55-65和lee等人,(2014)science,343(6177),1360-1363中进行了描述。此外,用于进行原位测序的方法和系统的实例描述于wo2014/163886、wo2018/045181、wo2018/045186和us 10,138,509以及us.10,179,932中。用于原位测序的示例性技术包括但不限于starmap(例如描述于wang等人,(2018)science,361(6499)5691中)、merfish(例
如描述于moffitt,(2016)methods in enzymology,572,1-49中)和fisseq(例如描述于us 2019/0032121)中。
[0229]
i.探针和探针杂交
[0230]
在一些方面,本文公开的方法涉及使用与靶核酸(如rna分子)杂交的一个或多个探针或探针组。示例性探针或探针组可基于挂锁探针、间隙挂锁探针、snail(夹板核苷酸辅助分子内连接)探针组、playr(用于rna的邻位连接测定)探针组、plish(邻位连接原位杂交)探针组和rna模板化连接探针。特定探针或探针组设计可有所不同。在一些实施方案中,初级探针(例如,直接结合至rna靶标的dna探针)通过滚环扩增进行扩增,例如,使用来自挂锁连接的环状探针或环化探针作为模板。在一些实施方案中,初级探针,如挂锁探针或包含挂锁探针的探针组含有一个或多个条形码。在一些实施方案中,一个或多个条形码指示靶核酸中的序列,如目标单个核苷酸(例如,snp或点突变)、二核苷酸序列、长度约5个核苷酸的短序列或任何合适长度的序列。
[0231]
在一些实施方案中,本文提供了能够进行dna模板化连接的探针或探针组,如来自cdna分子。参见例如,美国专利8,551,710,其特此以引用的方式整体并入。在一些实施方案中,本文提供了能够进行rna模板化连接的探针或探针组参见例如,公布为wo2019068880的pct申请pct/ep2018/077161,其特此以引用的方式整体并入。在一些实施方案中,探针组是snail探针组。参见例如,美国专利公布20190055594,其特此以引用的方式整体并入。在一些实施方案中,本文提供了能够进行邻位连接的探针或探针组,例如用于rna(例如,playr)探针组的邻位连接测定。参见例如,美国专利公布20160108458,其特此以引用的方式整体并入。
[0232]
在一些实施方案中,环状探针可间接地与靶核酸杂交。在一些实施方案中,环状构建体由能够进行邻位连接的探针组,例如邻位连接原位杂交(plish)探针组形成。参见例如公布为wo2018175779的pct申请pct/us2018/023846,其特此以引用的方式整体并入。
[0233]
示例性探针组和杂交复合物示于图4a中,其中挂锁或环状探针直接地与rna转录物杂交。夹板引物可用于促进dna模板化挂锁连接。挂锁或环状探针可包含靶向(例如,靶标杂交)序列和一个或多个靶条形码区域,如图4a中所示的初级条形码序列bc1和bc2。在探针杂交和/或任何环化步骤以提供环状探针后,在一些实施方案中,环状探针例如在rca反应中进行扩增,以产生包含初级/靶条形码(例如,bc1)或其互补序列的经扩增分子。在一些实施方案中,在扩增后,所述方法还包括使用能够与一个或多个条形码序列(例如,bc1或bc2)或其互补序列杂交的可检测标记的寡核苷酸(如荧光标记的检测寡核苷酸)来检测扩增产物。
[0234]
另一个示例性探针组和杂交复合物示于图4b中,其中挂锁或环状探针直接地与rna转录物杂交。夹板引物可用于促进dna模板化挂锁连接。挂锁或环状探针可包含靶向(例如,靶标杂交)序列和一个或多个靶条形码区域,如图4b中所示的初级条形码序列bc1和bc2。在探针杂交和/或任何环化步骤以提供环状探针后,在一些实施方案中,环状探针例如在rca反应中进行扩增,以产生包含初级/靶条形码(例如,bc1)或其互补序列的经扩增分子。在一些实施方案中,在扩增后,所述方法还包括使用检测探针(例如,二级探针),所述检测探针包含(1)直接或间接地与靶向探针的初级/靶条形码区域杂交的条形码结合区域,和(2)各自与可检测标记的寡核苷酸杂交的两个或更多个检测条形码区域(例如,sbc11和
sbc12)。例如,图4b示出两个检测探针,二级探针1和二级探针2。二级探针1包含直接或间接地与靶向探针的bc1杂交的条形码结合区域,以及四个检测条形码区域,二级条形码(sbc)11、sbc12、sbc13和sbc14。sbc11、sbc12、sbc13和sbc14中的每一个都能够与可检测标记的寡核苷酸,如荧光标记的检测寡核苷酸杂交。同样,二级探针2包含直接或间接地与靶向探针的bc2杂交的条形码结合区域,以及四个检测条形码区域,二级条形码(sbc)21、sbc22、sbc23和sbc24,所述二级条形码中的每一个都能够与可检测标记的寡核苷酸,如荧光标记的检测寡核苷酸杂交。在一些实施方案中,两个或更多个二级条形码彼此不同。例如,与同一初级探针结合的二级探针的所有二级条形码可能不同,例如,每个二级条形码可特异性地与检测寡核苷酸杂交并由检测寡核苷酸序列独特标识。
[0235]
虽然为了便于说明,图4b示出与初级探针杂交的二级探针,但应当理解,在一些实施方案中,初级探针或包含初级探针的探针组首先与rna靶标杂交,然后扩增在靶标杂交(例如使用rca)后为环状或环化的初级探针。图4b示出初级探针的rca产物,其中初级条形码bc1和bc2序列或其互补序列被扩增。因此,rca产物能够与多个二级探针1以及多个二级探针2杂交。
[0236]
在本文公开的任何实施方案中,本文公开了多重测定,其中用多个初级探针(例如,挂锁初级探针)探测多种靶核酸(例如,基因或rna转录物),并且任选地与所述初级条形码(或其互补序列)杂交的多个二级探针全部立刻杂交,然后是顺序二级条形码检测和信号解码。
[0237]
图4c提供另一个示例性原位测定工作流程。使rna靶标逆转录以产生dna分子,并且初级探针然后与所述dna分子杂交。在挂锁探针的情况下,挂锁可使用从所述rna产生的dna作为夹板连接。代替使用图4b中的二级带条形码的探针,图4c示出能够与初级探针或其扩增产物(例如,rca产物)的条形码序列杂交的桥接探针。桥接探针可包含不与初级探针的条形码序列(或其互补序列)杂交、但能够与一种或多种可检测标记的检测寡核苷酸杂交的序列。通过杂交测序化学在条形编码系统中使用检测寡核苷酸用于rna转录物的空间检测的示例性方法可在gyllborg等人,“hybridization-based in situ sequencing(hybiss):spatial transcriptomic detection in human and mouse brain tissue,”biorxiv 2020.02.03.931618找到,所述文献以引用的方式整体并入本文。
[0238]
图5提供另一示例性原位测定工作流程。各种初级探针可与rna靶标杂交并使用rna为模板化连接和/或dna模板化连接来连接以形成包含一个或多个条形码序列的环化探针。二级探针或桥接探针可与所述环化探针或其扩增产物杂交(例如,如图4a-4c所示)。检测寡核苷酸可与所述环化探针或其扩增产物、二级探针或其扩增产物或桥接探针杂交(例如,如图4a-4c所示)。例如,挂锁探针可使用rna模板化连接进行环化,参见例如图5中的第一和第三挂锁探针。rna模板化连接酶可用于闭合线性dna探针的环以使挂锁环化,并且可通过将核糖核苷酸并入dna挂锁探针中来提高连接效率。参见例如,pct/ep2018/077161,其以引用的方式整体并入本文。在一些实施方案中,可通过使用dna夹板寡核苷酸来提高挂锁探针连接效率,如图5中的第二和第四挂锁探针中所示。在一些实施方案中,两个半部(例如,如在连接之前图5中的第四挂锁探针中所示)可充当彼此的dna夹板以用于连接。任何合适的rna模板化连接或dna模板化连接方法都可用于原位测定中并且涵盖于本公开中。
[0239]
图6a示出包含报告基因寡核苷酸的示例性结合剂或标记剂(例如,抗体或其抗原
结合片段)。在一些实施方案中,本文公开的方法包括将来自生物样品的一种或多种分析物转移至基底上的特征阵列,所述特征中的每一者与阵列上的独特空间位置相关。在一些实施方案中,标记剂可包含含有一个或多个条形码序列的报告基因寡核苷酸。因此,报告基因寡核苷酸可以是本文公开的核酸分析物,并且可使用本文公开的任何方法进行分析。例如,如图6a所示,可使用诸如挂锁探针的探针来分析报告基因寡核苷酸。在一些实例中,可使用原位杂交(例如,顺序杂交)和/或原位测序(例如,使用挂锁探针和连接的挂锁探针的滚环扩增)来分析特异性地识别蛋白质的标记剂的报告基因寡核苷酸。此外,标记剂和/或其互补序列和/或其产物(例如,杂交产物、连接产物、延伸产物(例如,通过dna或rna聚合酶)、复制产物、转录/逆转录产物和/或扩增产物)可被本文公开的捕获剂捕获并使用空间测定进行分析。
[0240]
在一些实施方案中,分析物(核酸分析物或非核酸分析物)可被一种或多种报告基因寡核苷酸(例如抗体)特异性地结合,所述报告基因寡核苷酸各自附接至报告基因寡核苷酸。在一些实施方案中,分析物(核酸分析物或非核酸分析物)可被两种标记剂(例如抗体)特异性地结合,所述标记剂各自附接至可参与连接、复制和序列解码反应的报告基因寡核苷酸(例如,dna),例如使用探针或探针组(例如,如图6b中所示的挂锁探针、如图6c中所示的snail探针组、如图6d中所示的环状探针或如图6e中所示的挂锁探针和连接子(connector))。在一些实施方案中,探针组可包含两种或更多种探针寡核苷酸,所述探针寡核苷酸各自包含彼此互补的区域。例如,邻位连接反应可包括附接至抗体对的报告基因寡核苷酸,如果抗体已经彼此接近,例如通过结合同一靶蛋白(复合物)则所述抗体可通过连接而连结,并且所形成的dna连接然后用于模板pcr扩增,如例如等人,methods.(2008),45(3):227-32中所描述,所述文献的全部内容以引用的方式并入本文。在一些实施方案中,邻位连接反应可包括附接至抗体的报告基因寡核苷酸,所述抗体各自结合至结合对或复合物的一个成员,例如用于分析结合对或复合物的成员之间的结合。对于使用邻近的寡核苷酸检测分析物,参见例如美国专利申请公布号2002/0051986,其全部内容以引用的方式并入本文。在一些实施方案中,邻近的两种分析物可被两种标记剂(例如抗体)特异性地结合,所述标记剂各自附接至报告基因寡核苷酸(例如dna),所述报告基因寡核苷酸当邻近时当结合至它们各自的靶标时可参与连接、复制和/或序列解码反应。
[0241]
在一些实施方案中,两种分析物(或分析物的两个区域)可被两种不同的标记剂(例如,抗体)特异性地结合,所述标记剂各自附接至报告基因寡核苷酸(例如,dna),如果两种标记剂足够接近以允许报告基因寡核苷酸通过连接而连结,则所述报告基因寡核苷酸可连接。在一些情况下,一旦发生连接,连接的产物(例如,连接的报告基因寡核苷酸)或其产物或衍生物就可被捕获剂捕获并进行分析。
[0242]
在一些实施方案中,两种分析物(或分析物的两个区域)可被两种标记剂(例如,抗体)特异性地结合,所述标记剂各自附接至报告基因寡核苷酸(例如,dna),并且将包含用于与两种报告基因寡核苷酸中的一者杂交的第一区域和用于与另一报告基因寡核苷酸杂交的第二区域的探针添加至样品。在一些实施方案中,探针是任选地包含可与标记剂相关的条形码的挂锁探针。在一些方面,可通过使用于连接的两个或更多个探针与探针的序列(例如挂锁探针)杂交来检测探针。在一些情况下,用于连接的两个或更多个探针中的一者使用挂锁探针作为模板进行连接,并且连接的产物可被捕获剂捕获并进行分析。在一些情况下,
可连接探针(例如,挂锁探针)并用于下游分析或检测。例如,连接的探针可用于rca,并且可使用任何合适的方法检测rca产物。在一些实施方案中,来自标记剂的信息可用于表征细胞(例如,通过用所述标记剂靶向细胞标志物和/或蛋白质)。在一些情况下,可将来自标记剂的信息与来自章节iv中提供的原位测定的信息相关联。
[0243]
在图6a、6b和6e中,一种或多种报告基因寡核苷酸(和任选地一种或多种其它核酸分子,如图6e中所示的连接子)有助于探针的连接。连接后,探针可形成环化探针。在一些实施方案中,可使用并连接一个或多个合适的探针,其中所述一个或多个探针包含与一种或多种报告基因寡核苷酸(或其部分)互补的序列。探针可包含一个或多个条形码序列。在一些实施方案中,一种或多种报告基因寡核苷酸可充当用于环化探针的滚环扩增(rca)的引物。在一些实施方案中,除一种或多种报告基因寡核苷酸以外的核酸用作用于环化探针的滚环扩增(rca)的引物。例如,能够在除与一种或多种报告基因寡核苷酸杂交的序列以外的序列处与环化探针杂交的核酸可用作rca的引物。在其它实施方案中,snail探针组(例如,如图6c所示)中的引物用作rca的引物。
[0244]
在图6f中,一种或多种分析物可被两种第一抗体特异性地结合,所述第一抗体各自进而被各自附接至报告基因寡核苷酸(例如,dna)的第二抗体识别。与报告基因寡核苷酸、探针和探针组、连接子和/或引物附接的第二抗体可包括图6a-6e中所示的那些中的任一者。每个核酸分子可帮助连接探针以形成环化探针。在一些情况下,探针可包含一个或多个条形码序列。此外,报告基因寡核苷酸可充当用于环化探针的滚环扩增的引物。核酸分子、环化探针和rca产物可使用本文公开的用于原位分析以及空间分析的任何合适的方法进行分析。
[0245]
在一些实施方案中,使直接或间接地靶向一种或多种分析物(例如,核酸、蛋白质或细胞特征)的一个或多个探针在原位测定模块之前或期间与样品接触。一个或多个探针可包括标记剂(例如,包含报告基因寡核苷酸的抗体)、挂锁探针或探针组、模板化连接探针、分析物捕获剂或它们的任何组合。在一些实施方案中,使直接或间接地靶向一种或多种分析物(例如,核酸、蛋白质或细胞特征)的一个或多个探针在原位测定模块之后但在空间测定模块之前或期间与样品接触,其中所述一个或多个探针可包括标记剂(例如,包含报告基因寡核苷酸的抗体)、模板化连接探针、分析物捕获剂、捕获探针或它们的任何组合。
[0246]
ii.连接
[0247]
在一些实施方案中,所提供的方法涉及连接一种或多种多核苷酸,所述一种或多种多核苷酸是包含用于原位分析的靶核酸的杂交复合物的一部分。在一些实施方案中,连接涉及化学连接。在一些实施方案中,连接涉及模板依赖性连接。在一些实施方案中,连接涉及模板非依赖性连接。在一些实施方案中,连接涉及酶促连接。
[0248]
在一些实施方案中,酶促连接涉及使用连接酶。在一些方面,本文使用的连接酶包含通常用于将多核苷酸连结在一起或连结单个多核苷酸的末端的酶。rna连接酶、dna连接酶或另一种类的连接酶可用于将两个核苷酸序列连接在一起。连接酶包括atp依赖性双链多核苷酸连接酶、nad-i依赖性双链dna或rna连接酶和单链多核苷酸连接酶,例如ec 6.5.1.1(atp依赖性连接酶)、ec 6.5.1.2(nad 依赖性连接酶)、ec 6.5.1.3(rna连接酶)中描述的任何连接酶。连接酶的具体实例包括细菌连接酶,如大肠杆菌dna连接酶、tth dna连接酶、热球菌属(菌株9
°
n)dna连接酶(9
°ntm
dna连接酶,new england biolabs)、taq dna连
接酶、ampligase
tm
(epicentre biotechnologies)以及噬菌体连接酶,如t3 dna连接酶、t4 dna连接酶和t7 dna连接酶及以及其突变体。在一些实施方案中,连接酶是t4 rna连接酶。在一些实施方案中,连接酶是splintr连接酶。在一些实施方案中,连接酶是单链dna连接酶。在一些实施方案中,连接酶是t4 dna连接酶。在一些实施方案中,连接酶是具有dna-夹板dna连接酶活性的连接酶。在一些实施方案中,连接酶是具有rna-夹板dna连接酶活性的连接酶。
[0249]
在一些实施方案中,本文的连接是直接连接。在一些实施方案中,本文的连接是间接连接。“直接连接”是指多核苷酸的末端彼此紧邻杂交以形成连接酶的底物,从而导致它们彼此连接(分子内连接)。可替代地,“间接”是指多核苷酸的末端彼此不相邻地杂交,即被一个或多个插入核苷酸或“间隙”隔开。在一些实施方案中,所述末端不直接彼此连接,而是通过一种或多种插入(所谓的“间隙”或“间隙填充”(寡)核苷酸)的中间性或通过探针的3'端延伸以“填充”对应于所述插入核苷酸的“间隙”发送(分子间连接)。在一些情况下,多核苷酸的杂交末端之间的一种或多种核苷酸的间隙可被与夹板、挂锁探针或靶核酸互补的一种或多种“间隙”(寡)核苷酸“填充”。所述间隙可以是1至60个核苷酸的间隙或1至40个核苷酸的间隙或3至40个核苷酸的间隙。在具体实施方案中,间隙可以是约1、2、3、4、5、6、7、8、9或10个或更多个核苷酸,或所指示值之间的任何整数(或整数范围)的核苷酸的间隙。在一些实施方案中,所述末端区域之间的间隙可由间隙寡核苷酸或通过延伸多核苷酸的3'端来填充。在一些情况下,连接包括将探针的末端连接到至少一个间隙(寡)核苷酸,使得间隙(寡)核苷酸并入所得多核苷酸中。在一些实施方案中,本文的连接之前是间隙填充。在其它实施方案中,本文的连接不需要间隙填充。
[0250]
在一些实施方案中,多核苷酸的连接产生解链温度高于未连接的多核苷酸的解链温度的多核苷酸。因此,在一些方面,在包括扩增和检测的后续步骤之前,连接使含有连接的多核苷酸的杂交复合物稳定。
[0251]
在一些方面,使用高保真连接酶,如热稳定的dna连接酶(例如,taq dna连接酶)。热稳定的dna连接酶在升高的温度下具有活性,从而允许通过在接近dna链的解链温度(tm)的温度下孵育连接来进一步区分。与退火的完全碱基配对的底物相比,这选择性地降低退火的错配底物的浓度(预期在错配周围具有略低的tm)。因此,可通过连接酶活性位点的内在选择性与平衡条件的组合来实现高保真连接,以减少退火的错配dsdna的发生率。
[0252]
iii.扩增
[0253]
在一些实施方案中,本发明的方法包括扩增一种或多种多核苷酸,例如挂锁探针或由挂锁探针形成的环状探针的步骤。在一些实施方案中,扩增是通过进行滚环扩增(rca)而实现。在其它实施方案中,添加与挂锁探针杂交的引物并照此用于扩增。
[0254]
在一些实施方案中,进行除去步骤以除去未与靶核酸和/或环状探针特异性地杂交的分子。在一些实施方案中,进行除去步骤以除去未连接的探针。在一些实施方案中,除去步骤在连接之后和扩增之前进行。
[0255]
在一些实施方案中,扩增在介于或介于约20℃与约60℃之间的温度下进行。在一些实施方案中,扩增在介于或介于约30℃与约40℃之间的温度下进行。在一些方面,扩增步骤,如滚环扩增(rca)在介于处于或约25℃与处于或约50℃之间,如处于或约25℃、27℃、29℃、31℃、33℃、35℃、37℃、39℃、41℃、43℃、45℃、47℃或49℃的温度下进行。
[0256]
在一些实施方案中,在存在适当的dntp前体和其它辅因子的情况下添加dna聚合酶后,使引物延伸以产生环状模板的多个拷贝。此扩增步骤可利用等温扩增或非等温扩增。在一些实施方案中,在杂交复合物形成和扩增探针缔合后,使杂交复合物滚环扩增以产生含有cdna的多个拷贝的cdna纳米球(即,扩增子)。用于滚环扩增(rca)的技术在本领域中是已知的,如线性rca、分支rca、树突状rca或它们的任何组合。(参见例如,baner等人,nucleic acids research,26:5073-5078,1998;lizardi等人,nature genetics 19:226,1998;mohsen等人,acc chem res.2016年11月15日;49(11):2540
–
2550;schweitzer等人proc.natl acad.sci.usa 97:101 13-1 19,2000;faruqi等人,bmc genomics 2:4,2000;nallur等人,nucl.acids res.29:el 18,2001;dean等人genome res.1 1:l095-1099,2001;schweitzer等人,nature biotech.20:359-365,2002;美国专利号6,054,274、6,291,187、6,323,009、6,344,329和6,368,801)。用于rca的示例性聚合酶包括dna聚合酶,如phi29聚合酶、klenow片段、嗜热脂肪芽孢杆菌dna聚合酶(bst)、t4 dna聚合酶、t7 dna聚合酶或dna聚合酶i。在一些方面,可采用已进行工程化或突变以具有所需特征的dna聚合酶。在一些实施方案中,聚合酶是phi29 dna聚合酶。
[0257]
在一些方面,在扩增步骤期间,可将经修饰的核苷酸添加至反应以将所述经修饰的核苷酸并入扩增产物(例如,纳米球)中。经修饰的核苷酸的实例包括胺修饰的核苷酸。在方法的一些方面,例如,用于将产生的扩增产物(例如,纳米球)锚定或交联至支架、细胞结构和/或其它扩增产物(例如,其它纳米球)。在一些方面,扩增产物包含经修饰的核苷酸,如胺修饰的核苷酸。在一些实施方案中,胺修饰的核苷酸包含丙烯酸n-羟基琥珀酰亚胺部分修饰。其它胺修饰的核苷酸的实例包括但不限于5-氨基烯丙基-dutp部分修饰、5-炔丙基氨基-dctp部分修饰、n6-6-氨基己基-datp部分修饰或7-脱氮-7-炔丙基氨基-datp部分修饰。
[0258]
在一些方面,多核苷酸和/或扩增产物(例如,扩增子)可锚定至聚合物基质。例如,聚合物基质可以是水凝胶。在一些实施方案中,一个或多个多核苷酸探针可进行修饰以含有可用作锚定位点以将所述多核苷酸探针和/或扩增产物附接至聚合物基质的官能团。
[0259]
可根据所提供的实施方案使用的示例性修饰和聚合物基质包括例如在wo 2014/163886、wo 2017/079406、us 2016/0024555、us 2018/0251833和wo2014/025392中描述的那些。在一些实例中,支架还含有可与探针组或扩增产物的修饰或官能团反应或并入探针组或扩增产物的修饰或官能团的修饰或官能团。在一些实例中,支架可包含寡核苷酸、聚合物或化学基团,以提供基质和/或支撑结构。
[0260]
扩增产物通常可固定在基质内被扩增的核酸的位置,从而产生扩增子的局部集落。扩增产物可通过空间因子固定在基质内。扩增产物也可通过共价或非共价键合而固定在基质中。以这种方式,可认为扩增产物附接至基质。通过固定至基质,如通过共价键合或交联,原始扩增子的大小和空间关系得以保持。通过固定至基质,如通过共价键合或交联,扩增产物在机械应力下抵抗运动或解开。
[0261]
在一些方面,扩增产物与周围基质共聚和/或共价附接,从而保留它们的空间关系和其固有的任何信息。例如,如果扩增产物是由包埋在基质中的细胞内的dna或rna产生的扩增产物,则所述扩增产物也可进行官能化以形成与基质的共价附接,从而保留它们在细胞内的空间信息,由此提供亚细胞定位分布模式。在一些实施方案中,所提供的方法包括在存在水凝胶亚基的情况下包埋一种或多种多核苷酸探针组和/或扩增产物以形成一种或多
种水凝胶包埋的扩增产物。在一些实施方案中,所描述的水凝胶-组织化学包括将核酸共价附接至原位合成的水凝胶以用于组织清除、酶扩散和多循环测序,而现有的水凝胶-组织化学方法则不能。在一些实施方案中,为了使扩增产物能够包埋在组织-水凝胶环境中,将胺修饰的核苷酸在扩增步骤(例如,rca)中包含,使用丙烯酸n-羟基琥珀酰亚胺酯用丙烯酰胺部分官能化,并与丙烯酰胺单体共聚形成水凝胶。
[0262]
iv.检测和分析
[0263]
在一些实施方案中,可通过合成法测序(sbs)进行测序。在一些实施方案中,测序引物与一个或多个条形码处或附近的序列互补。在此类实施方案中,合成法测序可包括逆转录和/或扩增以产生模板序列,引物序列可从所述模板序列结合。示例性sbs方法包括描述的那些,例如但不限于us 2007/0166705、us 2006/0188901、us 7,057,026、us 2006/0240439、us 2006/0281109、wo 05/065814、us 2005/0100900、wo 06/064199、wo07/010,251、us 2012/0270305、us 2013/0260372和us 2013/0079232。
[0264]
在一些实施方案中,可通过顺序荧光杂交(例如,杂交测序)进行测序。顺序荧光杂交可涉及包含寡核苷酸和可检测标记的检测探针的顺序杂交。
[0265]
在一些实施方案中,可使用单分子连接法测序来进行测序。此类技术利用dna连接酶来并入寡核苷酸并鉴定此类寡核苷酸的并入。寡核苷酸通常具有与寡核苷酸所杂交的序列中特定核苷酸的身份相关的不同标记。参与连接法测序的方面和特征例如在shendure等人science(2005),309:1728-1732以及us 5,599,675;us 5,750,341;us 6,969,488;us 6,172,218;和us 6,306,597中进行了描述。
[0266]
在一些实施方案中,检测探针的条形码被可检测标记的检测寡核苷酸(如荧光标记的寡核苷酸)靶向。在一些实施方案中,一种或多种解码方案用于解码信号(如荧光)以用于序列确定。在本文的任何实施方案中,条形码(例如,初级和/或二级条形码序列)可使用任何合适的方法或技术进行分析(例如,检测或测序),所述方法或技术包括本文所述的那些,如靶标的rna顺序探测(rna spot)、顺序荧光原位杂交(seqfish)、单分子荧光原位杂交(smfish)、多重误差稳健的荧光原位杂交(merfish)、基于杂交的原位测序(hybiss)、原位测序、靶向原位测序、荧光原位测序(fisseq)或空间分辨的转录物扩增子读出映射(starmap)。在一些实施方案中,本文提供的方法包括通过顺序杂交和用多个标记的探针(例如,检测寡核苷酸)检测来分析条形码。示例性解码方案在eng等人,“transcriptome-scale super-resolved imaging in tissues by rna seqfish ,”nature 568(7751):235-239(2019);chen等人,“spatially resolved,highly multiplexed rna profiling in single cells,”science;348(6233):aaa6090(2015);us 10,457,980b2;us 2016/0369329 a1;wo 2018/026873 a1;和us 2017/022073 3a1中进行了描述,所述文献全部以引用的方式整体并入。在一些实施方案中,这些测定能够同时实现信号扩增、组合解码和纠错方案。
[0267]
在一些实施方案中,核酸杂交可用于测序。这些方法利用与条形码序列的至少一部分互补的标记的核酸解码器探针。多重解码可使用具有可区分标记的许多不同探针的库来进行。核酸杂交测序的非限制性实例描述于例如us 8,460,865和gunderson等人,genome research 14:870-877(2004)中。
[0268]
在一些实施方案中,可在测序期间使用dna聚合酶活性的实时监测。例如,可通过
荧光共振能量转移(fret)检测核苷酸并入,如例如在levene等人,science(2003),299,682-686;lundquist等人,opt.lett.(2008),33,1026-1028和term"perfectly等人,proc.natl.acad.sci.usa(2008),105,1176-1181中所描述。
[0269]
在一些方面,可在室温下进行分析和/或序列确定,以在低背景噪声和误差减少的情况下最佳保留组织形态。在一些实施方案中,分析和/或序列确定包括在测序进行时消除误差累积。
[0270]
在一些实施方案中,分析和/或序列确定涉及洗涤以除去未结合的多核苷酸,然后展现荧光产物以用于成像。
[0271]
在一些方面,检测(包括成像)使用多种不同类型的显微术中的任一种进行,例如共聚焦显微术、双光子显微术、光场显微术、完整组织膨胀显微术和/或clarity
tm-优化的单层光显微术(colm)。
[0272]
在一些实施方案中,荧光显微术用于检测探针的检测和成像。在一些方面,荧光显微镜是代替或除反射和吸收之外使用荧光和磷光来研究有机或无机物质的性质的光学显微镜。在荧光显微术中,用激发样品中的荧光的波长的光照射样品。然后通过显微镜物镜对通常波长比照明更长的荧光光进行成像。在这种技术中可使用两个滤光片;照明(或激发)滤光片,其确保照明接近单色且处于正确波长;以及第二发射(或屏障)滤光片,其确保没有任何激发光源到达检测器。可替代地,这些功能均可通过单个双色向滤光片来完成。“荧光显微镜”包括任何使用荧光来生成图像的显微镜,无论是更简单的设置,如落射荧光显微镜;还是更复杂的设计,如共聚焦显微镜,其使用光学切片来获得荧光图像的更好分辨率。
[0273]
在一些实施方案中,共聚焦显微术用于检测探针的检测和成像。共聚焦显微镜在检测器前面的光学共轭平面中使用点照明和针孔来消除离焦信号。由于只能检测到由非常接近焦平面的荧光产生的光,因此图像的光学分辨率(特别是在样品深度方向上)比宽场显微镜要好得多。然而,由于来自样品荧光的大部分光在针孔处被阻挡,这种提高的分辨率是以降低的信号强度为代价——因此通常需要长时间曝光。由于一次仅照明样品中的一个点,因此2d或3d成像需要在试样中的规则光栅(即平行扫描线的矩形图案)上进行扫描。焦平面的可实现厚度主要由所用光的波长除以物镜的数值孔径限定,但也由试样的光学性质决定。薄光学切片可能使这些类型的显微镜特别擅长样品的3d成像和表面谱分析。clarity
tm
优化的单层光显微术(colm)提供了用于大型澄清样品的快速3d成像的替代显微术。colm询问大型免疫染色组织,允许提高采集速度并产生更高质量的生成数据。
[0274]
可采用的其它类型的显微术包括亮视野显微术、斜射照明显微术、暗视野显微术、相差显微术、差分干涉对比(dic)显微术、干涉反射显微术(也称为反射干涉对比,或ric)、单平面照明显微术(spim)、超分辨率显微术、激光显微术、电子显微术(em)、透射电子显微术(tem)、扫描电子显微术(sem)、反射电子显微术(rem)、扫描透射电子显微术(stem)和低-电压电子显微术(lvem)、扫描探针显微术(spm)、原子力显微术(atm)、弹道电子发射显微术(beem)、化学力显微术(cfm)、导电原子力显微术(c-afm)、电化学扫描隧道显微术(ecstm)、静电力显微术(efm)、流体力显微术(fluidfm)、力调制显微术(fmm)、面向特征的扫描探针显微术(fospm)、开尔文探针力显微术(kpfm)、磁力显微术(mfm)、磁共振力显微术(mrfm)、近场扫描光学显微术(nsom)(或snom,扫描近场光学显微术,snom)、压电响应力显微术(pfm)、pstm光子扫描隧道显微术(pstm)、ptms光热显微分光术/显微术(ptms)、scm扫描电
容显微术(scm)、secm扫描电化学显微术(secm)、sgm扫描门显微术(sgm)、shpm扫描霍尔探针显微术(shpm)、sicm扫描离子电导显微术(sicm)、spsm自旋极化扫描隧道显微术(spsm)、ssrm扫描扩散电阻显微术(ssrm)、sthm扫描热显微术(sthm)、stm扫描隧道显微术(stm)、stp扫描隧道电位测定法(stp)、svm扫描电压显微术(svm)和同步x射线扫描隧道显微术(sxstm)以及完整组织膨胀显微术(exm)。
[0275]
v.空间测定模块
[0276]
在一些方面,本文公开的整合原位空间测定包括一个或多个空间测定模块。在整合原位空间测定的一些实施方案中,在样品中进行一个或多个原位测定模块。例如,可仅对样品进行一个原位测定模块,如顺序荧光原位杂交测定或原位测序测定。在一些实施方案中,在使同一样品经受一个或多个空间测定模块之前,可使样品经受两个或更多个原位测定模块,如顺序荧光原位杂交测定,然后是原位测序测定。
[0277]
在一个方面,本文提供了用于生物样品的空间分析(例如基于空间阵列的分析)的方法、组合物、设备和系统。空间分析方法的非限制性方面在美国专利公布号10,308,982;美国专利公布号9,879,313;美国专利公布号9,868,979;liu等人,biorxiv 788992,2020;美国专利公布号10,774,372;美国专利公布号10,774,374;wo 2018/091676;美国专利公布号10,030,261;美国专利公布号9,593,365;美国专利号10,002,316;美国专利号9,727,810;美国专利公布号10,640,816;rodriques等人,science 363(6434):1463-1467,2019;wo 2018/045186;lee等人,nat.protoc.10(3):442-458,2015;美国专利公布号10,179,932;wo 2018/045181;美国专利公布号10,138,509;trejo等人,plos one 14(2):e0212031,2019;美国专利申请公布号2018/0245142;chen等人,science 348(6233):aaa6090,2015;gao等人,bmc biol.15:50,2017;wo 2017/144338;wo 2018/107054;wo 2017/222453;wo 2019/068880;wo 2011/094669;美国专利号7,709,198;美国专利号8,604,182;美国专利号8,951,726;美国专利号9,783,841;美国专利号10,041,949;wo 2016/057552;wo 2017/147483;美国专利公布号10,370,698;wo 2016/166128;美国专利公布号10,364,457;美国专利公布号10,317,321;wo 2018/136856;wo 2019/075091;美国专利号10,059,990;wo 2018/057999;wo 2015/161173;以及gupta等人,nature biotechnol.36:1197-1202,2018中进行了描述,并且可在本文中以任何组合使用。本文描述了空间分析方法的其它非限制性方面。
[0278]
在一些实施方案中,本文公开的方法包括将来自生物样品的一种或多种分析物转移至基底上的特征阵列,所述特征中的每一者与阵列上的独特空间位置相关。每个特征可包含能够捕获一个或多个核酸分子的多种捕获剂,并且同一特征的每种捕获剂可包含对应于所述特征在阵列上的独特空间位置的空间条形码。转移的分析物的后续分析包括确定分析物的身份和样品内每种分析物的空间位置。样品内每种分析物的空间位置是基于阵列中每种分析物所结合的特征以及所述特征在阵列内的相对空间位置来确定的。
[0279]
在一些实施方案中,进行空间测定以分析一种或多种分析物(例如,第二靶核酸)。在一些实施方案中,第二靶核酸是或包含第一靶核酸(例如,dna或rna)、其序列、其互补序列、其杂交产物、其连接产物、其延伸产物、其复制产物、其转录/逆转录产物和/或其扩增产物(例如,滚环扩增(rca)产物)。例如,在原位测定之前或期间使用第一靶核酸作为模板产生的逆转录产物(例如,在章节iv中所描述)可在空间测定中进行测定。在一些情况下,在原
位测定之前或期间产生的连接产物可在空间测定中进行测定。在一些实施方案中,第二靶核酸是或包含一个或多个核酸探针中的至少一个、所述核酸探针的互补序列、所述核酸探针的杂交产物、所述核酸探针的连接产物、所述核酸探针的延伸产物、所述核酸探针的复制产物、所述核酸探针的转录/逆转录产物和/或核酸探针的扩增产物。例如,在原位测定之前或期间提供的探针或其条形码(例如,在章节iv中所描述)可在空间测定中进行测定。
[0280]
在一些实施方案中,本文公开的方法包括将空间条形码与一种或多种分析物,例如一种或多种细胞(如相邻细胞)中的分子相关联,使得空间条形码将一种或多种分析物和/或一种或多种细胞的内容物鉴定为与特定空间位置相关联。
[0281]
在一些实施方案中,本文公开的方法包括将靶分析物驱动出细胞并朝向带空间条形码的阵列。图7描绘示例性实施方案,其中在步骤701中使填充有捕获探针(如本文进一步描述)的带空间条形码的阵列与样品接触,并且使样品透化,从而允许靶分析物远离样品并朝向样品迁移。在步骤702中,靶分析物与带空间条形码的阵列上的捕获探针相互作用。一旦靶分析物与捕获探针结合(例如,杂交),则任选地从阵列中除去样品并分析捕获探针以便在步骤703中获得空间分辨的分析物信息。
[0282]
在一些实施方案中,本文公开的方法包括将带空间条形码的核酸分子(例如,地址标签或捕获探针)朝向样品递送或驱动和/或递送或驱动到样品之中或之上。在一些实施方案中,本文公开的方法包括从阵列裂解带空间条形码的核酸分子(例如,地址标签或捕获探针)并将裂解的核酸分子朝向样品驱动和/或驱动到样品之中或之上。图8描绘示例性实施方案,其中填充有捕获探针(如本文进一步描述)的带空间条形码的阵列可在步骤801中与样品接触。在步骤802中,带空间条形码的捕获探针被裂解且然后与所提供的样品内的细胞相互作用。相互作用可以是共价或非共价相互作用,如细胞-表面相互作用。相互作用可以是由递送系统或细胞穿透肽促进的细胞内相互作用。可替代地,可使样品透化和固定/交联以限制一种或多种靶分析物的迁移,同时允许带空间条形码的捕获探针朝向样品迁移和/或迁移到样品之中或之上。一旦带空间条形码的捕获探针与特定分析物(例如,一个或多个细胞中的分析物)缔合,就可任选地除去样品用于分析。样品可在分析之前任选地解离。一旦标记的分析物或细胞与带空间条形码的捕获探针缔合,就可在步骤803分析捕获探针以获得关于标记的分析物或细胞的空间分辨信息。
[0283]
图9示出包括在步骤901中在带空间条形码的阵列上制备样品的示例性工作流程。样品制备可包括将样品置于载玻片上、加工样品(例如,固定和/或透化样品)和/或使样品与一种或多种试剂(例如,用于染色的一种或多种探针和/或抗体)接触以用于成像。然后在步骤902中使用明视野(以对样品苏木精和伊红染色成像)和荧光(以对特征成像)模式,任选地在阵列上对样品进行成像。在一些实施方案中,然后从样品中释放靶分析物,并且在步骤903中形成带空间条形码的阵列的捕获探针杂交或结合所释放的靶分析物。然后在步骤904中从阵列中除去样品,并且在步骤905中从阵列裂解捕获探针。然后在加工分析物(例如,通过逆转录以将rna分析物如mrna转录物转化为cdna)的同时在步骤905b中以两种模式对样品和阵列进行任选的第二次成像,并且扩增子文库在906中制备并在907中进行测序。在一些实施方案中,在908中使两组图像在空间上重叠,以便相关联空间上鉴定的样品信息。当样品和阵列未在905b中进行第二次成像时,可提供斑点坐标文件来代替第二成像步骤。在一些实施方案中,扩增子文库制备906可用pcr衔接子(例如,独特的pcr衔接子)进行
并在907中进行测序。
[0284]
图10示出利用基底上的空间标记阵列的另一个示例性工作流程,其中用空间条形码标记的捕获探针簇集在基底上的区域(例如,特征)处。空间标记的捕获探针可包括捕获结构域、空间条形码和任选的裂解结构域、一个或多个功能序列和/或独特分子标识符。空间标记的捕获探针还可包括5'端修饰以用于可逆地附接至基底。例如,在1001中使带空间条形码的阵列与样品接触,并且在1002中通过施加透化试剂使样品透化。在一些实施方案中,在原位测定模块之前或期间进行透化步骤,并且生物样品不需要为空间测定模块再次透化。可通过将阵列/样品组件置于本体溶液中来施用透化试剂。可替代地,可通过防扩散介质和/或诸如盖的物理屏障将透化试剂施用于样品,其中样品夹在防扩散介质和/或屏障与含阵列的基底之间。使用本文公开的多种技术使分析物迁移朝向带空间条形码的捕获阵列。例如,可使用防扩散介质盖和被动迁移发生分析物迁移。作为另一个实例,分析物迁移可以是主动迁移,例如使用电泳转移系统。一旦分析物与带空间条形码的捕获探针紧密接近,在1003中捕获探针就可杂交或以其它方式结合靶分析物。在1004中可任选地从阵列中除去样品。在1005中捕获探针可任选地地从阵列裂解,并且可通过进行逆转录酶第一链cdna反应对捕获的分析物进行空间标记。可任选地使用模板转换寡核苷酸进行第一链cdna反应。例如,模板转换寡核苷酸可与通过逆转录酶添加至cdna的3'端的poly(c)尾杂交。然后可使原始mrna模板和模板转换寡核苷酸从cdna变性,并且带条形码的捕获探针然后可与cdna杂交,并且可产生cdna的互补序列。然后可纯化并收集第一链cdna用于下游扩增步骤。在1006中可使用pcr扩增第一链cdna,其中正向和反向引物位于空间条形码的侧翼并靶向目标分析物区域,从而产生与特定空间条形码相关的文库。在一些实施方案中,cdna包含合成法测序(sbs)引物序列。对文库扩增子进行测序和分析,以在1007和1008中解码空间信息。
[0285]
图11a-11b描绘示例性工作流程,其中将样品从带空间条形码的阵列中除去并且将带空间条形码的捕获探针从阵列中除去以用于带条形码的分析物扩增和文库制备。在一些实施方案中,本文公开的方法包括在不裂解捕获探针的情况下在带空间条形码的阵列上进行第一链合成,例如使用模板转换寡核苷酸。
[0286]
在一些实施方案中,待在空间测定模块中分析的第二分析物包含rna,如mrna转录物。在一些实施方案中,本文公开的方法包括样品制备1101(例如,包括去交联步骤)和任选的样品透化1102,两者均可如本文别处所述进行,例如,结合原位测定模块和/或空间测定模块。如图11a所示,一旦捕获探针捕获rna靶标(例如,来自已在本文公开的原位测定模块中进行分析的样品的mrna转录物),就在1104中使在1103中通过模板转换和逆转录酶产生的第一链cdna变性且然后使第二链延伸。然后使第二链cdna从第一链cdna变性,中和,并在1105中转移至管中。可使用本文论述的标准技术进行cdna定量和扩增。然后可在1106中对cdna进行文库制备并在1107中进行索引,包括片段化、末端修复、a加尾和/或索引pcr步骤,然后在1108中进行任选的文库qc步骤。
[0287]
在一些实施方案中,待在空间测定模块中进行分析的第二分析物包含dna(如在原位测定模块中产生的mrna的cdna)、与原位测定模块中的mrna或cdna杂交的探针、原位测定模块中的探针的连接产物(例如,使用dna模板化连接或rna模板化连接,例如,如图13所示)和/或原位测定模块中的mrna、cdna或探针的扩增产物。在一些实施方案中,第二分析物(例
如,第二核酸分析物)包含来自连接在原位测定模块中使用的挂锁探针和/或所述探针的rca产物的环状探针或环化探针。在一些实施方案中,本文公开的方法包括样品制备1109(例如,包括去交联步骤以使来自原位测定模块的mrna、cdna、探针、连接产物和/或rca产物去交联)和任选的样品透化1110,两者均可如本文别处所述进行,例如,结合原位测定模块和/或空间测定模块。如图11b所示,一旦第二分析物接近带空间条形码的捕获探针,所述捕获探针就可杂交或以其它方式结合第二核酸分析物(例如,来自原位测定模块的cdna、探针、连接产物和/或rca产物)。可任选地从阵列中除去样品。在1111中可使用捕获的第二核酸分析物的序列作为模板通过聚合酶延伸捕获探针。在1112中可使由延伸的捕获探针和捕获的第二核酸分析物形成的双链体变性且然后使用与延伸的捕获探针杂交的第二链引物延伸第二链。在1113中然后使第二链从延伸的捕获探针变性、中和并转移至管中。可使用本文论述的标准技术进行第二链的dna定量和扩增。然后可在1114中对dna进行文库制备并在1115中进行索引,包括片段化、末端修复、a加尾和/或索引pcr步骤,然后在1116中进行任选的文库qc步骤。
[0288]
用于样品制备、透化、dna产生(例如,第一链cdna产生和第二链产生)、dna扩增(例如,cdna扩增)和质量控制以及空间基因表达文库构建的示例性步骤例如在wo 2020/047002、wo 2020/047004、wo 2020/047005、wo 2020/047007和wo 2020/047010中公开,其全部以引用的方式整体并入本文。
[0289]
a.靶向分析物
[0290]
在一些实施方案中,本文公开的空间测定包括捕获靶向分析物。在一些情况下,本文公开的空间测定包括使用原位分析来分析第一靶分析物和使用捕获探针阵列来分析第二靶分析物。第一分析物的原位分析可在用捕获探针阵列分析第二靶分析物之前、同时或之后进行。在一些实施方案中,在原位测定期间在探针与样品的杂交和检测步骤完成之后,通过捕获探针或捕获剂捕获分析物(或其衍生物)。在一些实施方案中,第二靶核酸被与第二靶核酸(例如,rna,如福尔马林固定的rna,或由rna分子产生的cdna分子)互补的一个或多个核酸探针靶向,其中所述一个或多个探针或由所述一个或多个探针产生的产物从样品中释放以与捕获探针阵列相互作用(例如,在原位分析之后)。例如,在本文提供的方法的一些实施方案中,模板化连接用于检测生物样品中的(例如,第二靶分析物的)基因表达。在一些方面,模板化连接的步骤包括探针对(例如,dna探针)与组织切片内的第二靶核酸分子(例如,rna,如福尔马林固定的rna,或由rna分子产生的cdna分子)的杂交。在一些实施方案中,相邻退火的探针对可原位连接。在一些实施方案中,样品可用一种或多种试剂(如rna酶h或蛋白酶k以从组织中释放rna模板化连接产物(例如,释放到溶液中))进行处理以用于下游分析(例如,杂交或以其它方式捕获到捕获探针阵列上)。在一些实施方案中,测定可还包括模板化连接产物的扩增(例如,通过多重pcr)。
[0291]
在一些方面,模板化连接(例如,dna或rna模板化连接)可包括dna连接酶。在一些方面,模板化连接(例如,rna模板化连接)可包括rna连接酶。在一些方面,模板化连接可包括t4 rna连接酶。在一些方面,模板化连接用于检测rna、确定rna序列同一性和/或表达监测和转录物分析。在一些方面,模板化连接允许核酸中的特定变化(例如,突变、添加、缺失或单核苷酸多态性(snp))的检测,特定核酸的检测或表达,或(例如,在相似细胞途径中或在特定病理学中表达的)一组特定核酸的检测或表达。在一些实施方案中,包括模板化连接
的方法用于例如通过基因分型、dna拷贝数或rna转录物的定量、样品内特定转录物的定位等分析核酸。在一些方面,本文提供的包括模板化连接的系统和方法鉴定单核苷酸多态性(snp)。在一些方面,此类系统和方法利用模板化连接来鉴定突变。在一些方面,此类系统和方法利用模板化连接来鉴定rna同种型或剪接变体。在一些方面,使用模板化连接(例如,rna模板化连接(rtl)或dna模板化连接(例如,在cdna上))分析两种或更多种rna分析物。
[0292]
在一些方面,当分析两种或更多种分析物时,使用对每种rna或cdna分析物具有特异性(例如,特异地杂交)的第一和第二探针。在一些情况下,使用模板化连接分析蛋白质分析物。例如,在一些实施方案中,使样品与对目标分析物(如蛋白质)具有特异性的结合剂(例如,抗体或其表位结合片段)接触,其中所述结合剂与包含鉴定所述结合剂的报告基因序列的报告基因寡核苷酸缀合或以其它方式缔合。探针然后可与报告基因寡核苷酸杂交并在模板化连接反应中连接以产生用于进一步分析的产物(例如,使用捕获探针阵列)。
[0293]
在一些实施方案中,一对探针被设计成与靶序列杂交,使得所述探针彼此相邻地杂交,以使得两个相邻探针的5'和3'端可连接。在一些实施方案中,可通过确定两个探针是否在连接酶存在下连接来确定生物样品中靶序列的存在或不存在。图13示意性地示出分析核酸分子(例如,cdna或rna,如mrna)的代表性方法。在图13中尽管示出具有3'poly-a尾的核酸分子,但应当理解可分析任何合适的核酸分子,并且连接可包括rna模板化连接(rtl)和/或dna模板化连接(例如,在cdna上)。图13a示出包含靶区域1302和1304的核酸分子1300。在一些情况下,靶区域1302和1304彼此相邻。探针1306包含探针序列1308、结合序列1310和反应性部分1312。探针1314包含探针序列1316、衔接子序列1348和反应性部分1318。探针1306的探针序列1308与靶区域1302互补。类似地,探针1314的探针序列1316与靶区域1304互补。图13b示出与靶区域1302杂交的探针1306的探针序列1308和与靶区域1304杂交的探针1314的探针序列1316。在一些情况下,探针1306的反应性部分1312和探针1314的反应性部分1318彼此相邻。图13c示出通过反应性部分1312和1318的反应产生的连接部分1320。在一些情况下,部分1312和1318化学地连接(例如,点击化学),并且在其它情况下,酶促连接(例如,连接酶,如splintr、kod连接酶或t4连接酶)。连接的探针1306和1314包含探针连接的核酸分子1330,其包含序列1310、1308、1316和1348。在一些情况下,探针连接的核酸分子(例如,1230)可包含捕获探针结合结构域,所述捕获探针结合结构域包含与捕获探针1202的捕获结构域1207互补的序列。在一些情况下,探针(例如,1306和或1314)可包含捕获探针结合结构域,所述捕获探针结合结构域包含与捕获探针中存在的特定捕获结构域(例如,捕获探针1202的1207)互补的序列。在一些实施方案中,本文的连接之前是间隙填充(例如,如果探针1306和探针1314彼此不相邻)。在一些情况下,靶区域1302和1304彼此不相邻并且可相隔1、2、3、4、5、6、7、8、9、10个或更多个核苷酸。
[0294]
在一些方面,三个或更多个探针用于本文提供的模板化连接方法中。在一些实施方案中,三个或更多个探针被设计成与靶序列杂交,使得所述三个或更多个探针彼此相邻地杂交,以使得相邻探针的5'和3'端可连接。在一些实施方案中,可通过确定三个或更多个探针是否在连接酶存在下连接来确定生物样品中靶序列的存在或不存在。
[0295]
在一些方面,探针是dna探针。在一些方面,使用一对dna探针。在一些实施方案中,探针是双链探针或部分双链探针。在一些情况下,探针是嵌合dna/rna探针。在一些方面,探针是核糖核苷酸修饰的dna探针。关于示例性探针和核糖核苷酸修饰的dna探针,参见例如,
zhang等人,chem commun 2013年11月4日;49(85):10013-5;美国专利号9,371,598;美国专利申请公布号2019/0367997和2018/0237864。
[0296]
在一些方面,rna模板花连接方法利用t4 rna连接酶2来有效地连结在固定rna靶序列上原位杂交的相邻嵌合rna-dna探针对。任选的后续处理(例如,用蛋白酶k或用rna酶h)释放模板化连接产物以用于下游分析(例如,捕获和在阵列结合的捕获探针上进行分析)。
[0297]
本文提供了包括第一探针寡核苷酸和第二探针寡核苷酸(例如,模板化连接,如rtl探针)的靶向核酸(例如,由其产生的rna或cdna分子)分析方法。第一和第二探针寡核苷酸各自包含与目标分析物的序列互补的序列。在一些实施方案中,第一和第二探针寡核苷酸结合至彼此相邻或在同一转录物上的互补序列。在一些实施方案中,第一探针寡核苷酸和第二探针寡核苷酸所结合的互补序列彼此相距1、2、3、4、5、6、7、8、9、10、约15、约20、约25、约30、约35、约40、约45、约50、约55、约60、约65、约70、约75、约80、约85、约90、约95、约100、约125、约150、约175、约200、约250、约300、约350、约400、约450、约500、约600、约700、约800、约900或约1000个核苷酸。探针寡核苷酸之间的间隙可首先在连接之前填充,例如使用mu聚合酶、dna聚合酶、rna聚合酶、逆转录酶、vent聚合酶、taq聚合酶和/或它们的任何组合、衍生物和变体(例如,工程化突变体)。在一些实施方案中,当第一和第二探针寡核苷酸彼此相隔一个或多个核苷酸时,核糖核苷酸连接在所述第一与第二探针寡核苷酸之间。在一些实施方案中,当第一和第二探针寡核苷酸彼此相隔一个或多个核苷酸时,脱氧核糖核苷酸连接在所述第一与第二探针寡核苷酸之间。关于示例性探针和连接介导的反应和分析,参见例如,美国专利申请公布号20200239874。
[0298]
在一些方面,本文公开了检测rna表达的方法,所述方法包括使第一探针、第二探针和连接酶(例如,t4 rna连接酶)接触。在一些实施方案中,第一探针和第二探针被设计成与靶序列杂交,使得第一探针的5'端和第二探针的3'端相邻并且可连接,其中第一探针的至少5'-末端核苷酸和第二探针的至少3'-末端核苷酸是脱氧核糖核苷酸(dna),并且其中靶序列是rna分子(如mrna分子)。在一些实施方案中,一个或多个探针可包含一种或多种核糖核苷酸。杂交后,如果靶样品中存在靶序列,则连接酶(例如,t4 rna连接酶)连接第一探针和第二探针,但如果靶样品中不存在靶序列,则不连接第一探针和第二探针。可通过使用例如本文别处描述的阵列结合的捕获剂分析连接的探针产物来确定生物样品中靶序列的存在或不存在和空间定位。可使用多种方法中的任一种来确定第一和第二探针是否在连接酶存在下连接,所述方法包括但不限于,对连接产物进行测序;使连接产物与检测探针杂交,所述检测探针仅在所述第一和第二探针在连接酶存在下连接时杂交;限制酶分析;和本领域已知的其它方法。
[0299]
在一些实施方案中,本文公开的第一和/或第二探针包含以下中的一者或多者:在3'端的一个或多个核糖核酸碱基(例如,在3'端的至少两个核糖核酸碱基);一个或多个功能序列;在5'端的磷酸化核苷酸;和/或捕获探针结合结构域。在一些实施方案中,功能序列是引物序列或引物结合序列。在一些实施方案中,功能序列包括可用于后续加工中的一个或多个功能序列。在一些情况下,捕获探针结合结构域是与捕获探针中存在的特定捕获结构域互补的序列。例如,如图13所示,结合序列1310可与图12中的捕获探针1202的捕获结构域1207互补。在一些实施方案中,捕获探针结合结构域包含poly(a)序列。在一些实施方案
中,捕获探针结合结构域包含聚尿苷序列、聚胸苷序列或两者。在一些实施方案中,捕获探针结合结构域包含随机序列(例如,随机六聚体或八聚体)。在一些实施方案中,捕获探针结合结构域与检测特定目标靶标的捕获探针中的捕获结构域互补。在一些实施方案中,提供了与捕获探针结合结构域相互作用的捕获探针结合结构域阻断部分。在一些实施方案中,捕获探针结合结构域阻断部分包含与捕获探针结合结构域互补或基本互补的序列。在一些实施方案中,捕获探针结合结构域阻断部分防止捕获探针结合结构域在存在时结合捕获探针。在一些实施方案中,在将捕获探针结合结构域(例如,存在于连接的探针中)与捕获探针结合之前除去捕获探针结合结构域阻断部分。在一些实施方案中,捕获探针结合结构域阻断部分包含聚尿苷序列、聚胸苷序列或两者。
[0300]
在一些实施方案中,第一探针寡核苷酸与分析物杂交。在一些实施方案中,第二探针寡核苷酸与分析物杂交。在一些实施方案中,第一探针寡核苷酸和第二探针寡核苷酸两者均与分析物杂交。杂交可在具有与探针寡核苷酸100%互补的序列的靶标处发生。在一些实施方案中,杂交可在具有与探针寡核苷酸至少(例如至少约)80%、至少(例如至少约)85%、至少(例如至少约)90%、至少(例如至少约)95%、至少(例如至少约)96%、至少(例如至少约)97%、至少(例如至少约)98%或至少(例如至少约)99%互补的序列的靶标处发生。在杂交后,在一些实施方案中,使第一探针寡核苷酸延伸。在杂交后,在一些实施方案中,使第二探针寡核苷酸延伸。
[0301]
在一些实施方案中,本文公开的方法包括在使第一和第二探针寡核苷酸杂交后的洗涤步骤。洗涤步骤除去任何未结合的寡核苷酸并且可使用本领域已知的任何技术进行。在一些实施方案中,预hyb缓冲液用于洗涤样品。在一些实施方案中,使用磷酸盐缓冲液。在一些实施方案中,进行多个洗涤步骤以除去未结合的寡核苷酸。
[0302]
在一些实施方案中,在探针寡核苷酸(例如,第一和第二探针寡核苷酸)与分析物杂交后,将探针寡核苷酸(例如,第一探针寡核苷酸和第二探针寡核苷酸)连接在一起,从而产生与分析物互补单个连接的探针。如本文所述,连接可以酶促或化学方式进行。
[0303]
在一些情况下,第一和第二探针寡核苷酸与分析物的第一和第二靶区域杂交,并且使探针寡核苷酸经受核酸反应以将它们连接在一起。例如,可使用连接酶(例如,t4 rna连接酶(rnl2)、splintr连接酶、单链dna连接酶或t4 dna连接酶)使探针经受酶促连接反应。关于使用连接原位杂交(lish)的分析,参见例如,credle等人,nucleic acids research,2017,第45卷,第14期e128;关于kod连接酶的描述,参见例如zhang l.等人;archaeal rna ligase from thermoccocus kodakarensis for template dependent ligation rna biol.2017;14(1):36
–
44。在酶促连接反应之后,第一和第二探针寡核苷酸可被认为连接。
[0304]
在一些实施方案中,探针寡核苷酸(例如,第一探针寡核苷酸和第二探针寡核苷酸)可各自包含反应性部分,使得在与靶标杂交并暴露于适当的连接条件后,所述探针寡核苷酸可彼此连接。在一些实施方案中,包含反应性部分的探针寡核苷酸化学地连接。例如,能够与核酸分子的第一靶区域杂交的探针寡核苷酸可包含第一反应性部分,并且能够与核酸分子的第二靶区域杂交的探针寡核苷酸可包含第二反应性部分。当第一和第二探针寡核苷酸与核酸分子的第一和第二靶区域杂交时,第一和第二反应性部分可彼此相邻。探针的反应性部分可选自由以下组成的非限制性组:叠氮化物、炔烃、硝酮(例如,1,3-硝酮)、应变
烯烃(例如,反式环烯烃,如环辛烯或氧杂降冰片二烯)、四嗪、四唑、碘化物、硫代酸酯(例如,硫代磷酸酯)、酸、胺和磷酸酯。例如,第一探针寡核苷酸的第一反应性部分可包含叠氮化物部分,并且第二探针寡核苷酸的第二反应性部分可包含炔烃部分。第一和第二反应性部分可反应形成连接部分。第一和第二反应性部分之间的反应可以是例如环加成反应,如应变促进的叠氮化物-炔烃环加成、铜催化的叠氮化物-炔烃环加成、应变促进的炔烃-硝酮环加成、狄尔斯-阿尔德(diels-alder)反应、[3 2]环加成、[4 2]环加成或[4 1]环加成;硫醇-烯反应;亲核取代反应;或另一种反应。在一些情况下,第一和第二反应性部分之间的反应可产生三唑部分或异噁唑啉部分。第一和第二反应性部分之间的反应可包括使反应性部分经受合适的条件,如合适的温度、ph或压力,并提供用于所述反应的一种或多种试剂或催化剂。例如,第一和第二反应性部分之间的反应可由铜催化剂、钌催化剂或诸如二氟辛炔、二苄基环辛炔或二芳基氮杂环辛酮的应变物质催化。与核酸分子的第一靶区域杂交的第一探针寡核苷酸的第一反应性部分和与核酸分子的第二靶区域杂交的第三探针寡核苷酸的第二反应性部分之间的反应可连接第一探针寡核苷酸和第二探针寡核苷酸以提供连接的探针。在连接后,第一和第二探针寡核苷酸可被认为连接。因此,第一和第二反应性部分的反应可包括化学连接反应,如铜催化的5'叠氮化物与3'炔烃“点击”化学反应以在两种探针寡核苷酸之间形成三唑键联。在其它非限制性实例中,碘化物部分可化学连接至硫代磷酸酯部分以形成硫代磷酸酯键,酸可连接至胺以形成酰胺键,和/或磷酸酯和胺可连接以形成氨基磷酸酯键。
[0305]
在一些实施方案中,使两个rtl探针(左手(lhs)和右手(rhs))与分析物(例如,靶mrna)接触并杂交。在使用连接酶(例如,rnl2)连接两个rtl探针后,可使用rna酶h酶促消化靶rna。在一些实施方案中,在章节iv中描述的原位测定之前或期间提供rtl探针。在一些实施方案中,可进行透化步骤,可释放rtl探针并将其捕获在空间阵列上。在一些方面,rtl探针的捕获序列与捕获探针杂交。杂交后,rtl探针在3'端延伸,从而产生rtl探针,所述探针也具有空间条形码序列。扩增和测序鉴定rtl探针序列及其位置(例如,使用空间条形码序列)。
[0306]
b.捕获剂(例如,捕获探针)
[0307]
本文的捕获探针或捕获剂可包含能够捕获(直接或间接地)和/或标记生物样品中的目标分析物(例如,第二靶核酸)的任何分子。在一些实施方案中,捕获探针是核酸或多肽。在一些实施方案中,捕获探针是缀合物(例如,寡核苷酸-抗体缀合物)。在一些实施方案中,捕获探针包含条形码(例如,空间条形码和/或独特分子标识符(umi))和捕获结构域。
[0308]
在一些实施方案中,生物样品中的分析物可在与捕获探针相互作用之前进行预加工。例如,在与捕获探针相互作用之前,由聚合酶(例如,dna聚合酶或逆转录酶)催化的聚合反应在生物样品中进行。在一些实施方案中,用于聚合反应的引物包含增强与捕获探针的杂交的官能团。捕获探针可包含适当的捕获结构域以捕获目标生物分析物(例如,poly(dt)序列以捕获poly(a)mrna)。
[0309]
在一些实施方案中,逆转录酶(rt)催化反应在一个或多个核酸探针与用于原位测定模块的生物样品中的第一核酸靶标杂交期间发生。在一些实施方案中,rt反应将生物样品中的一种或多种rna分析物转化为用于原位测定模块和/或空间测定模块的dna。在一些实施方案中,一个或多个核酸探针包括与另一种探针连接或与其自身连接的探针。例如,使
用rna模板化和/或dna模板化连接来连接挂锁探针。
[0310]
在一些实施方案中,逆转录酶(rt)催化的反应在核酸探针与另一探针或自身连接后发生,其中所述核酸探针与用于原位测定模块的生物样品中的第一核酸靶杂交。在一些实施方案中,rt反应将生物样品中的一种或多种rna分析物转化为用于原位测定模块和/或空间测定模块的dna。
[0311]
在一些实施方案中,对生物分析物进行预加工以通过下一代测序产生文库。例如,可通过添加修饰(例如,允许与捕获探针相互作用的序列的连接)来对分析物进行预加工。在一些实施方案中,使用片段化技术(例如,使用转座酶和/或片段化缓冲液)使分析物(例如,dna或rna)片段化。
[0312]
片段化之后可以是分析物的修饰。例如,修饰可以是通过连接允许与捕获探针杂交的衔接子序列添加。在目标分析物为rna的一些实施方案中,进行poly(a)加尾。向不含poly(a)尾的rna添加poly(a)尾可促进与捕获探针的杂交,所述捕获探针包含具有功能量的poly(dt)序列的捕获结构域。
[0313]
在一些实施方案中,在与捕获探针相互作用之前,在生物样品中进行由连接酶催化的连接反应。在一些实施方案中,连接可通过化学连接进行。在一些实施方案中,连接可使用如下文进一步描述的点击化学进行。在一些实施方案中,捕获结构域包含与rna分子具有互补性的dna序列,其中所述rna分子与第二dna序列具有互补性,并且其中rna-dna序列互补性用于将第二dna序列与捕获结构域中的dna序列连接。在这些实施方案中,rna分子的直接检测是可能的。
[0314]
在一些实施方案中,在与捕获探针相互作用之前,在生物样品中进行靶标特异性反应。靶标特异性反应的实例包括但不限于靶标特异性衔接子、探针和/或其它寡核苷酸的连接,使用对一种或多种分析物具有特异性的引物进行靶标特异性扩增,以及使用原位杂交、dna显微术进行靶标特异性检测,和/或抗体检测。在一些实施方案中,捕获探针包含靶向靶标特异性产物(例如,扩增或连接)的捕获结构域。
[0315]
图12是示出如本文所述的捕获探针的实例的示意图。如所示,捕获探针1202任选地通过裂解结构域1203(如二硫化物接头)偶联至特征1201。所述捕获探针可包含适用于后续加工的功能序列,如功能序列1204,其可包含测序仪特异性流动池附接序列,例如p5序列;以及功能序列1206,其可包含测序引物序列,例如r1引物结合位点。在一些实施方案中,序列1204包含p7序列,并且序列1206包含r2引物结合位点。空间条形码1205可包含在捕获探针中,以用于对靶分析物进行条形编码。通常可选择功能序列以与多种不同测序系统中的任一种及其要求相容。可使用合适的功能序列的此类测序系统和技术的实例包括(但不限于)roche 454测序、ion torrent proton或pgm测序、illumina x10测序、pacbio smrt测序、oxford nanopore测序和基于cmos基的探测器(互补金属氧化物半导体)的测序。此外,在一些实施方案中,可选择功能序列以与其它测序系统相容,包括非商业化测序系统,例如基于合成法测序、杂交测序、连接法测序和/或结合测序的系统。
[0316]
在一些实施方案中,空间条形码1205、功能序列1204(例如,流动池附接序列)和1206(例如,测序引物序列)对于附接至给定特征的所有探针可以是共同的。空间条形码还可包含捕获结构域1207以促进靶分析物的捕获。
[0317]
在一些实施方案中,捕获探针可包含一个或多个可裂解捕获探针,其中裂解的捕
获探针可进入非透化细胞中并结合至样品内的靶分析物。捕获探针可含有裂解结构域、细胞穿透肽、报告分子和二硫键(-s-s-)。在一些情况下,捕获探针还可包含空间条形码和捕获结构域。
[0318]
i.捕获结构域
[0319]
在一些实施方案中,每种捕获剂(例如,捕获探针)包含至少一个捕获结构域,所述捕获结构域可包含特异性地结合至所需分析物的寡核苷酸、多肽、小分子或它们的任何组合。在一些实施方案中,捕获结构域可用于捕获或检测所需的分析物,如核酸分子。
[0320]
在一些实施方案中,捕获结构域包含被配置成与一种或多种分析物,如一种或多种不同类型的核酸(例如,rna分子和dna分子)相互作用的功能性核酸序列。在一些实施方案中,功能性核酸序列可包括n-聚体序列(例如,随机n-聚体序列),所述n-聚体序列被配置为与多种核酸分子(包括rna和/或dna分子)相互作用。在一些实施方案中,功能性序列可包括poly(t)序列,所述poly(t)序列被配置为通过mrna转录物的poly(a)尾与信使rna(mrna)分子相互作用。在一些实施方案中,功能性核酸序列包含蛋白质(例如,转录因子、dna结合蛋白或rna结合蛋白)的结合靶标,其中目标分析物包含蛋白质。在一些实施方案中,诸如蛋白质分析物的非核酸分析物直接或间接地缀合至能够与捕获剂的捕获结构域相互作用的核酸分子。
[0321]
捕获探针可包含核糖核苷酸和/或脱氧核糖核苷酸以及能够参与沃森-克里克类型或类似碱基对相互作用的合成核苷酸残基。在一些实施方案中,捕获结构域能够引发逆转录反应以产生与捕获的rna分子互补的cdna。在一些实施方案中,捕获探针的捕获结构域能够引发dna延伸(聚合酶)反应以产生与捕获的dna分子互补的dna。在一些实施方案中,捕获结构域可模板化捕获的dna分子与直接或间接地固定在基底上的表面探针之间的连接反应。在一些实施方案中,捕获结构域可连接至捕获的dna分子的一条链。例如,splintr连接酶连同rna或dna序列(例如,简并rna)可用于将单链dna或rna连接至捕获结构域。在一些实施方案中,具有rna模板化连接酶活性的连接酶,例如splintr连接酶、t4 rna连接酶2或kod连接酶,可用于将单链dna或rna连接至捕获结构域。在一些实施方案中,捕获结构域包含夹板寡核苷酸。在一些实施方案中,捕获结构域捕获夹板寡核苷酸。
[0322]
在一些实施方案中,捕获结构域位于捕获探针的3'端并且包含可例如通过模板依赖性聚合而延伸的游离3'端,以形成如本文所述的延伸的捕获探针。在一些实施方案中,捕获结构域包含能够与存在于与阵列接触的组织样品的细胞中的核酸(例如rna或其它分析物)杂交的核苷酸序列。在一些实施方案中,可选择或设计捕获结构域以选择性地或特异性地结合至靶核酸。例如,可选择或设计捕获结构域以通过与mrna poly(a)尾杂交来捕获mrna。因此,在一些实施方案中,捕获结构域包含poly(t)dna寡核苷酸,即通过磷酸二酯键连接的一系列连续脱氧胸苷残基,其能够与mrna的poly(a)尾杂交。在一些实施方案中,捕获结构域可包含在功能上或结构上类似于poly(t)尾的核苷酸。例如,poly(u)寡核苷酸或包括脱氧胸苷类似物的寡核苷酸。在一些实施方案中,捕获结构域包含至少10、11、12、13、14、15、16、17、18、19或20个核苷酸。在一些实施方案中,捕获结构域包含至少25、30或35个核苷酸。
[0323]
在一些实施方案中,随机序列(例如随机六聚体或类似序列)可用于形成捕获结构域的全部或部分。例如,随机序列可与poly(t)(或poly(t)类似物)序列结合使用。因此,当
捕获结构域包含poly(t)(或“poly(t)样”)寡核苷酸时,它还可包含随机寡核苷酸序列(例如,“poly(t)-随机序列”探针)。例如,这可位于poly(t)序列的5'或3',例如在捕获结构域的3'端。poly(t)-随机序列探针可促进mrna poly(a)尾的捕获。在一些实施方案中,捕获结构域可以是完全随机的序列。在一些实施方案中,可使用简并捕获结构域。
[0324]
在一些实施方案中,两个或更多个捕获探针的库形成混合物,其中一个或多个捕获探针的捕获结构域包含poly(t)序列,并且一个或多个捕获探针的捕获结构域包含随机序列。在一些实施方案中,两个或更多个捕获探针的库形成混合物,其中一个或多个捕获探针的捕获结构域包含poly(t)样序列,并且一个或多个捕获探针的捕获结构域包含随机序列。在一些实施方案中,两个或更多个捕获探针的库形成混合物,其中一个或多个捕获探针的捕获结构域包含poly(t)-随机序列,并且一个或多个捕获探针的捕获结构域包含随机序列。在一些实施方案中,可将具有简并捕获结构域的探针添加至本文列出的任何前述组合中。在一些实施方案中,具有简并捕获结构域的探针可取代本文所述的每一对中的探针之一。
[0325]
捕获结构域可基于其被设计为捕获的特定基因序列或特定基序序列或共同/保守序列(即,序列特异性捕获结构域)。因此,在一些实施方案中,捕获结构域能够选择性地结合至所需的核酸亚型或亚群,例如特定类型的rna,如mrna、rrna、trna、srp rna、tmrna、snrna、snorna、smy rna、scarna、grna、rna酶p、rna酶mrp、terc、sl rna、arna、顺式-nat、crrna、lncrna、mirna、pirna、sirna、shrna、tasirna、rasirna、7sk、erna、ncrna或其它类型的rna。在一个非限制性实例中,捕获结构域能够选择性地结合至所需的核糖核酸亚群,例如微生物组rna,如16srrna。
[0326]
在一些实施方案中,捕获结构域包含“锚”或“锚定序列”,其是被设计用于确保捕获结构域与预期生物分析物杂交的核苷酸序列。在一些实施方案中,锚定序列包括核苷酸序列,包括1-聚体、2-聚体、3-聚体或更长的序列。在一些实施方案中,短序列是随机的。例如,包含poly(t)序列的捕获结构域可被设计用于捕获mrna。在此类实施方案中,锚定序列可包括有助于确保poly(t)捕获结构域与mrna杂交的随机3-聚体(例如,ggg)。在一些实施方案中,锚定序列可以是vn、n或nn。可替代地,可使用特定核苷酸序列来设计序列。在一些实施方案中,锚定序列位于捕获结构域的3'端。在一些实施方案中,锚定序列位于捕获结构域的5'端。
[0327]
在一些实施方案中,捕获探针的捕获结构域在使生物样品与阵列接触之前被封闭,并且当生物样品中的核酸在其被捕获在阵列上之前进行修饰时使用封闭探针。在一些实施方案中,封闭探针用于封闭或修饰捕获结构域的游离3'端。在一些实施方案中,封闭探针可与捕获探针杂交以掩蔽捕获结构域的游离3'端,例如发夹探针或部分双链探针。在一些实施方案中,捕获结构域的游离3'端可通过化学修饰进行封闭,例如添加叠氮甲基作为化学可逆加帽部分,使得捕获探针不包含游离3'端。在使生物样品与阵列接触之前封闭或修饰捕获探针,特别是在捕获结构域的游离3'端,防止对捕获探针的修饰,例如,防止将poly(a)尾添加至捕获探针的游离3'端。
[0328]
3'修饰的非限制性实例包括双脱氧c-3'(3'-ddc)、3'反向dt、3'c3间隔区、3'氨基和3'磷酸化。在一些实施方案中,生物样品中的核酸可进行修饰,使得它可被捕获结构域捕获。例如,可将衔接子序列(包含能够与捕获探针的捕获结构域结合的结合结构域)添加至
核酸,例如片段化基因组dna的末端。在一些实施方案中,这通过衔接子序列的连接或核酸的延伸来实现。在一些实施方案中,使用酶在核酸序列的末端并入额外的核苷酸,例如poly(a)尾。在一些实施方案中,捕获探针可进行可逆地掩蔽或修饰,使得捕获探针的捕获结构域不包含游离3'端。在一些实施方案中,3'端被除去、修饰或使其不可接近,使得捕获结构域对用于修饰生物样品的核酸的过程(例如连接或延伸)不敏感。
[0329]
在一些实施方案中,对捕获探针的捕获结构域进行修饰以允许除去在生物样品的核酸分子的修饰期间发生的对捕获探针的任何修饰。在一些实施方案中,捕获探针可包含捕获结构域下游(即捕获结构域的3')的额外序列,即阻断结构域。
[0330]
在一些实施方案中,捕获探针的捕获结构域可以是非核酸结构域。不完全基于核酸的合适捕获结构域的实例包括但不限于模拟本文所述的任何捕获结构域的功能的蛋白质、肽、适体、抗原、抗体和分子类似物。
[0331]
ii.裂解结构域
[0332]
每个捕获探针可任选地包含至少一个裂解结构域。裂解结构域代表用于将探针可逆地附接至阵列特征的探针的部分,如下文将进一步描述的。此外,捕获探针的一个或多个区段或区域可任选地通过裂解结构域的裂解而从阵列特征释放。作为实例,空间条形码和/或通用分子标识符(umi)可通过裂解结构域的裂解而释放。
[0333]
在一些实施方案中,将捕获探针连接至特征的裂解结构域是二硫键。可添加还原剂以使二硫键断裂,从而导致捕获探针从特征释放。作为另一个实例,加热也可导致裂解结构域的降解和附接的捕获探针从阵列特征的释放。在一些实施方案中,激光辐射用于加热和降解特定位置的捕获探针的裂解结构域。在一些实施方案中,裂解结构域是光敏化学键(即,当暴露于光如紫外光时解离的化学键)。
[0334]
裂解结构域的其它实例包括不稳定的化学键,如但不限于酯键联(例如,可用酸、碱或羟胺裂解)、邻位二醇键联(例如,可经由高碘酸钠裂解)、狄尔斯-阿尔德(diels-alder)键联(例如,可经由热裂解)、砜键联(例如,可经由碱裂解)、甲硅烷基醚键联(例如,可经由酸裂解)、糖苷键联(例如,可经由淀粉酶裂解)、肽键联(例如,可经由蛋白酶裂解)或磷酸二酯键联(例如,可经由核酸酶(例如,dna酶)裂解)。
[0335]
在一些实施方案中,裂解结构域包含由能够裂解核酸分子,例如能够破坏两个或更多个核苷酸之间的磷酸二酯键联的一种或多种酶识别的序列。键可通过其它核酸分子靶向酶,如限制酶(例如,限制性核酸内切酶)裂解。例如,裂解结构域可包含限制性核酸内切酶(限制酶)识别序列。限制酶在称为限制性位点的特定识别核苷酸序列处切割双链或单链dna。在一些实施方案中,稀有切割限制酶,即具有长识别位点(长度至少8个碱基对)的酶用于降低在捕获探针中的其它地方裂解的可能性。
[0336]
在一些实施方案中,裂解结构域包含poly(u)序列,其可被尿嘧啶dna糖基化酶(udg)和dna糖基化酶-裂解酶核酸内切酶viii的混合物(商业上称为user
tm
酶)裂解。可释放的捕获探针一旦释放就可用于反应。因此,例如,可激活捕获探针可通过从特征释放捕获探针来激活。
[0337]
在捕获探针例如通过表面探针间接地附接至基底的一些实施方案中,裂解结构域包含一个或多个错配核苷酸,使得表面探针和捕获探针的互补部分不是100%互补(例如,错配碱基对的数量可以是一个、两个或三个碱基对)。这种错配例如通过muty和t7核酸内切
酶i识别,这导致核酸分子在错配位置处裂解。
[0338]
在捕获探针例如通过表面探针间接地附接至特征的一些实施方案中,裂解结构域包含切口酶识别位点或序列。切口酶是仅裂解dna双链体的单链的核酸内切酶。因此,裂解结构域可包含靠近表面探针的5'端(和/或捕获探针的5'端)的切口酶识别位点,使得表面探针或捕获探针的裂解使所述表面探针与捕获探针之间的双链体不稳定,从而从特征释放捕获探针。
[0339]
在捕获探针直接附接至特征的一些实施方案中,也可使用切口酶。例如,可使基底与杂交至捕获探针的裂解结构域的核酸分子接触以提供或重构切口酶识别位点,例如裂解辅助探针。因此,与切口酶接触将导致裂解结构域的裂解,从而从特征释放捕获探针。此类裂解辅助探针也可用于提供或重构用于其它裂解酶,例如限制酶的裂解识别位点。
[0340]
一些切口酶通过结合至并识别特定核苷酸识别序列而仅在dna分子上的特定位点引入单链切口。已经发现了许多天然存在的切口酶,目前已经确定了其中至少四者的序列识别性质。切口酶在美国专利号6,867,028中进行了描述,所述专利以引用的方式整体并入本文。一般而言,任何合适的切口酶可用于结合至裂解结构域的互补切口酶识别位点。使用后,切口酶可从测定中除去或在释放捕获探针后失活,以防止捕获探针的不希望的裂解。
[0341]
不完全基于核酸的合适捕获结构域的实例包括但不限于模拟本文所述的任何捕获结构域的功能的蛋白质、肽、适体、抗原、抗体和分子类似物。
[0342]
在一些实施方案中,捕获探针不存在裂解结构域。具有缺少裂解结构域的附接捕获探针的底物的实例例如在macosko et al.,(2015)cell 161,1202
–
1214中进行了描述,所述文献的全部内容以引用的方式并入本文。
[0343]
在一些实施方案中,对应于裂解结构域的捕获探针的区域可用于一些其它功能。例如,可包含用于核酸延伸或扩增的额外区域,裂解结构域将通常位于所述额外区域中。在此类实施方案中,区域可补充功能结构域或甚至作为额外功能结构域存在。在一些实施方案中,存在裂解结构域,但其使用是任选的。
[0344]
iii.功能结构域
[0345]
每个捕获探针可任选地包含至少一个功能结构域。每个功能结构域通常包含用于整个分析程序中的下游分析步骤的功能性核苷酸序列。
[0346]
在一些情况下,核酸分子可包含一个或多个功能序列。例如,功能序列可包含用于附接至测序流动池的序列,例如用于测序的p5序列。在一些情况下,核酸分子或其衍生物(例如,从核酸分子产生的寡核苷酸或多核苷酸)可包含另一个功能序列,例如,用于附接至测序流动池以进行illumina测序的p7序列。在一些情况下,功能序列可包含一个条形码序列或多个条形码序列。在一些情况下,功能序列可包含独特分子标识符(umi)。在一些情况下,功能序列可包含引物序列(例如,用于illumina测序的r1引物序列、用于illumina测序的r2引物序列等)。在一些情况下,功能序列可包含部分序列,如部分条形码序列、部分锚定序列、部分测序引物序列(例如,部分r1序列、部分r2序列等)、被配置为附接至测序仪的流动池的部分序列(例如,部分p5序列、部分p7序列等),或本文别处描述的任何其它类型序列的部分序列。例如,部分序列可含有全序列的连续或连续部分或区段,但不是全部。在一些情况下,下游程序可使部分序列或其衍生物延伸,以实现部分序列或其衍生物的全序列。此类捕获探针及其用途的实例在美国专利公布号2014/0378345和2015/0376609
中进行了描述,所述专利各自的全部内容以引用的方式并入本文。可选择功能结构域以与各种不同的测序系统,例如454测序、ion torrent proton或pgm、illumina x10等,或来自illumina、bgi、qiagen、thermo-fisher、pacbio和roche的其它平台及其要求相容。
[0347]
iv.空间条形码
[0348]
如上所论述,捕获探针可包含一个或多个空间条形码(例如,两个或更多个、三个或更多个、四个或更多个、五个或更多个)空间条形码。“空间条形码”是充当传达或能够传达空间信息的标签或标识符的连续核酸区段或两个或更多个非连续核酸区段。在一些实施方案中,捕获探针包含具有空间方面的空间条形码,其中所述条形码与阵列内的特定位置或基底上的特定位置相关联。示例性空间条形码在美国专利号10,030,261中进行了描述,所述专利以引用的方式并入本文。
[0349]
空间条形码可以是分析物的一部分,或独立于分析物(即,捕获探针的一部分)。空间条形码可以是附接至分析物(例如,核酸分子)的标签或除分析物的内源性特征(例如,分析物或末端序列的大小)以外的标签的组合。空间条形码可以是独特的。在空间条形码是独特的一些实施方案中,空间条形码用作与一个特定捕获探针相关联的空间条形码和独特分子标识符(umi)两者。
[0350]
空间条形码可具有多种不同的格式。例如,空间条形码可包括:多核苷酸空间条形码;随机核酸和/或氨基酸序列;和合成核酸和/或氨基酸序列。在一些实施方案中,空间条形码以可逆或不可逆的方式附接至分析物。在一些实施方案中,在样品的测序之前、期间和/或之后,将空间条形码添加至例如dna或rna样品的片段。在一些实施方案中,空间条形码允许鉴定和/或定量单独测序读数。在一些实施方案中,空间条形码用作荧光条形码,荧光标记的寡核苷酸探针与所述空间条形码杂交。
[0351]
在一些实施方案中,空间条形码是基本上不与生物样品中的分析物核酸分子杂交的核酸序列。在一些实施方案中,空间条形码与生物样品中的核酸分子的实质部分(例如,80%或更多)中的核酸序列具有小于80%序列同一性(例如,小于70%、60%、50%或小于40%序列同一性)。
[0352]
空间条形码序列可在捕获探针的序列内包含约6至约20个或更多个核苷酸。在一些实施方案中,空间条形码序列的长度可以是约6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个核苷酸或更长。在一些实施方案中,空间条形码序列的长度可以是至少约6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个核苷酸或更长。在一些实施方案中,空间条形码序列的长度是至多约6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个核苷酸或更短。
[0353]
这些核苷酸可以是完全连续的,即在相邻核苷酸的单段中,或者它们可分成两个或更多个被1个或多个核苷酸分开的单独子序列。在一些情况下,分开的空间条形码子序列的长度可以是约4至约16个核苷酸。在一些实施方案中,空间条形码子序列可以是约4、5、6、7、8、9、10、11、12、13、14、15、16个核苷酸或更长。在一些实施方案中,空间条形码子序列可以是至少约4、5、6、7、8、9、10、11、12、13、14、15、16个核苷酸或更长。在一些实施方案中,空间条形码子序列可以是至多约4、5、6、7、8、9、10、11、12、13、14、15、16个核苷酸或更短。
[0354]
对于附接至共同阵列特征的多个捕获探针,所述多个捕获探针中的一个或多个空间条形码序列可包括对于偶联至所述特征的所有捕获探针都相同的序列,和/或在偶联至所述特征的所有捕获探针之间不同的序列。在一些实施方案中,附接至共同阵列特征的多
个捕获探针可具有相同空间条形码,但具有不同的捕获结构域,所述捕获结构域被设计为将特征的空间条形码与多于一种靶分析物相关联。例如,特征可与两种、三种、四种、五种、六种、七种、八种、九种、十种或更多种不同类型的带空间条形码的捕获探针偶联,每种类型的带空间条形码的捕获探针都具有空间条形码。在一些方面,捕获-探针带条形码构建体可被定制用于分析与核酸相关并且能够与这种构建体结合的任何给定分析物。在一些实施方案中,分析物是能够与本文公开的带空间条形码的捕获探针结合的核酸分析物。在一些实施方案中,分析物是共价或非共价连接至能够与本文公开的带空间条形码的捕获探针结合的核酸的非核酸分析物(例如,蛋白质分析物)。例如,本文公开的方法可包括同时分析多种分析物,包括但不限于:dna、rna(例如,mrna和/或非编码rna)、细胞表面或细胞内蛋白质和代谢物、条形码标记剂或它们的任何组合。
[0355]
附接至单个阵列特征的捕获探针可包含相同(或共同)的空间条形码序列、不同的空间条形码序列或两者的组合。附接至特征的捕获探针可包含多组捕获探针。给定组的捕获探针可包含相同的空间条形码序列。相同的空间条形码序列可不同于另一组的捕获探针的空间条形码序列。
[0356]
多个捕获探针可包含与空间阵列上的特定位置相关联的空间条形码序列(例如,核酸条形码序列)。例如,第一多个捕获探针可基于第一区域内的捕获探针共有的空间条形码序列而与第一区域相关联,并且第二多个捕获探针可基于第二区域内的捕获探针共有的空间条形码序列而与第二区域相关联。第二区域可以或可以不与第一区域相关联。额外的多个捕获探针可与其它区域内的捕获探针共有的空间条形码序列相关联。在一些实施方案中,空间条形码序列在多个捕获探针分子中可以是相同的。
[0357]
在一些实施方案中,多个不同的空间条形码并入单个阵列捕获探针中。例如,一组混合但已知的空间条形码序列可通过提供位置身份的重复或独立确认来向给定斑点或位置提供空间条形码的更强寻址或归属。在一些实施方案中,多个空间条形码代表特定阵列点位置的增加特异性。
[0358]
v.独特分子标识符
[0359]
捕获探针可包含一个或多个(例如,两个或更多个、三个或更多个、四个或更多个、五个或更多个)独特分子标识符(umi)。独特分子标识符是用作特定分析物或结合特定分析物(例如,通过捕获结构域)的捕获探针的标记或标识符的连续核酸区段或两个或更多个非连续核酸区段。
[0360]
umi可以是独特的。umi可包含一个或多个特异性多核苷酸序列、一个或多个随机核酸和/或氨基酸序列和/或一个或多个合成核酸和/或氨基酸序列。
[0361]
在一些实施方案中,umi是基本上不与生物样品中的分析物核酸分子杂交的核酸序列。在一些实施方案中,umi与生物样品中的核酸分子的实质部分(例如,80%或更多)中的核酸序列具有小于80%序列同一性(例如,小于70%、60%、50%或小于40%序列同一性)。
[0362]
umi可在捕获探针的序列内包含约6至约20个或更多个核苷酸。在一些实施方案中,umi序列的长度可以是约6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个核苷酸或更长。在一些实施方案中,umi序列的长度可以是至少约约6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个核苷酸或更长。在一些实施方案中,umi序列的长度是至多约6、7、8、9、10、
11、12、13、14、15、16、17、18、19、20个核苷酸或更短。
[0363]
这些核苷酸可以是完全连续的,即在相邻核苷酸的单段中,或者它们可分成两个或更多个被1个或多个核苷酸分开的单独子序列。在一些情况下,umi子序列的长度可以是约4至约16个核苷酸。在一些实施方案中,umi子序列可以是约4、5、6、7、8、9、10、11、12、13、14、15、16个核苷酸或更长。在一些实施方案中,umi子序列可以是至少约4、5、6、7、8、9、10、11、12、13、14、15、16个核苷酸或更长。在一些实施方案中,umi子序列可以是至多约4、5、6、7、8、9、10、11、12、13、14、15、16个核苷酸或更短。
[0364]
在一些实施方案中,umi以可逆或不可逆的方式附接至分析物。在一些实施方案中,在分析物的测序之前、期间和/或之后,将umi添加至例如dna或rna样品的片段。在一些实施方案中,umi允许鉴定和/或定量单独测序读数。在一些实施方案中,umi用作荧光条形码,荧光标记的寡核苷酸探针与所述umi杂交。
[0365]
vi.捕获探针的其它方面
[0366]
对于附接至阵列特征的捕获探针,单个阵列特征可包括一个或多个捕获探针。在一些实施方案中,单个阵列特征包括数百或数千个捕获探针。在一些实施方案中,捕获探针与特定单个特征相关联,其中单个特征含有捕获探针,所述捕获探针包含对阵列上的限定区域或位置而言独特的空间条形码。
[0367]
在一些实施方案中,特定特征可含有捕获探针,所述捕获探针多于一个空间条形码(例如,特定特征处的一个捕获探针可包含与同一特定特征处的另一个捕获探针中包含的空间条形码不同的空间条形码,同时两个捕获探针均包含第二共同空间条形码),其中每个空间条形码对应于阵列上的特定限定区域或位置。例如,与阵列上的一个特定特征相关联的多个空间条形码序列可通过提供位置的重复或独立确认来向给定位置提供更强寻址或归属。在一些实施方案中,多个空间条形码代表特定阵列点位置的增加特异性。在非限制性实例中,特定阵列点可用两个不同的空间条形码编码,其中每个空间条形码标识阵列内的特定限定区域,并且具有两个空间条形码的阵列点标识其中两个限定区域重叠的子区域,例如,如维恩图的重叠部分。
[0368]
在另一个非限制性实例中,特定阵列点可用三个不同的空间条形码编码,其中第一空间条形码标识阵列内的第一区域,第二空间条形码标识第二区域,其中第二区域是完全在所述第一区域内的子区域,并且第三空间条形码标识第三区域,其中所述第三区域是完全在所述第一和第二子区域内的子区域。
[0369]
在一些实施方案中,附接至阵列特征的捕获探针从阵列特征释放以用于测序。可替代地,在一些实施方案中,捕获探针保持附接至阵列特征,并且在保持附接至阵列特征的同时对探针进行测序。捕获探针的测序的其它方面在本公开的后续章节中描述。
[0370]
在一些实施方案中,阵列特征可包括附接至所述特征的不同类型的捕获探针。例如,阵列特征可包括具有被设计为与一种类型的分析物结合的捕获结构域的第一类型的捕获探针,以及具有被设计为与第二类型的分析物结合的捕获结构域的第二类型的捕获探针。一般而言,阵列特征可包括附接至单个阵列特征的一种或多种(例如,两种或更多种、三种或更多种、四种或更多种、五种或更多种、六种或更多种、八种或更多种、十种或更多种、12种或更多种、15种或更多种、20种或更多种、30种或更多种、50种或更多种)不同类型的捕获探针。
[0371]
在一些实施方案中,捕获探针是核酸。在一些实施方案中,捕获探针通过其5'端附接至阵列特征。在一些实施方案中,捕获探针从5'至3'端包含:一个或多个条形码(例如,空间条形码和/或umi)和一个或多个捕获结构域。在一些实施方案中,捕获探针从5'至3'端包含:一个条形码(例如,空间条形码或umi)和一个捕获结构域。在一些实施方案中,捕获探针从5'至3'端包含:可裂解结构域、功能结构域、一个或多个条形码(例如,空间条形码和/或umi)和捕获结构域。在一些实施方案中,捕获探针从5'至3'端包含:可裂解结构域、功能结构域、一个或多个条形码(例如,空间条形码和/或umi)、第二功能结构域和捕获结构域。在一些实施方案中,捕获探针从5'至3'端包含:可裂解结构域、功能结构域、空间条形码、umi和捕获结构域。在一些实施方案中,捕获探针不包含空间条形码。在一些实施方案中,捕获探针不包含umi。在一些实施方案中,捕获探针包含用于起始测序反应的序列。
[0372]
在一些实施方案中,捕获探针通过其3'端固定在特征上。在一些情况下,捕获探针包含:衔接子序列-条形码(例如,空间条形码)-任选的独特分子标识符(umi)序列-捕获结构域。在一些实施方案中,捕获探针从3'至5'端包含:一个或多个条形码(例如,空间条形码和/或umi)和一个或多个捕获结构域。在一些实施方案中,捕获探针从3'至5'端包含:一个条形码(例如,空间条形码或umi)和一个捕获结构域。在一些实施方案中,捕获探针从3'至5'端包含:可裂解结构域、功能结构域、一个或多个条形码(例如,空间条形码和/或umi)和捕获结构域。在一些实施方案中,捕获探针从3'至5'端包含:可裂解结构域、功能结构域、空间条形码、umi和捕获结构域。
[0373]
在一些实施方案中,捕获探针包含原位合成的寡核苷酸。在一些实施方案中,原位合成的寡核苷酸包含一个或多个恒定序列,其中一者或多者充当引发序列(例如,用于扩增靶核酸的引物)。在一些实施方案中,恒定序列是可裂解序列。在一些实施方案中,原位合成的寡核苷酸包含条形码序列,例如可变条形码序列。在一些实施方案中,原位合成的寡核苷酸附接至阵列的特征。
[0374]
在一些实施方案中,捕获探针是两个或更多个寡核苷酸序列,例如连接在一起的两个或更多个寡核苷酸序列的产物。在一些实施方案中,寡核苷酸序列中的一者是原位合成的寡核苷酸。
[0375]
在一些实施方案中,捕获探针包含夹板寡核苷酸。可使用夹板寡核苷酸和本领域已知的或本文描述的任何种类的连接酶(例如,splintr连接酶)将两个或更多个寡核苷酸连接在一起。
[0376]
在一些实施方案中,寡核苷酸中的一者包含:恒定序列(例如,与夹板寡核苷酸的一部分互补的序列)、简并序列和捕获结构域(例如,如本文所述)。在一些实施方案中,通过使酶在寡核苷酸序列的末端添加多核苷酸来产生捕获探针。捕获探针可包含简并序列,所述简并序列可充当独特分子标识符。
[0377]
捕获探针可包含简并序列,所述简并序列是其中核苷酸序列的一些位置含有许多可能的碱基的序列。简并序列可以是包含约或至少5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45或50个核苷酸的简并核苷酸序列。在一些实施方案中,核苷酸序列在核苷酸序列内含有1、2、3、4、5、6、7、8、9、0、10、15、20、25个或更多个简并位置。在一些实施方案中,简并序列用作umi。
[0378]
在一些实施方案中,捕获探针包含限制性核酸内切酶识别序列或可通过特定酶活
性裂解的核苷酸序列。例如,尿嘧啶序列可通过特定酶活性裂解。作为另一个实例,其它经修饰的碱基(例如,通过甲基化修饰的)可被特定核酸内切酶识别并裂解。可使捕获探针经受酶促裂解,所述酶促裂解除去封闭结构域和在修饰过程中添加至捕获探针的3'端的任何额外核苷酸。封闭结构域的除去展示和/或恢复捕获探针的捕获结构域的游离3'端。在一些实施方案中,可除去额外的核苷酸以展示和/或恢复捕获探针的捕获结构域的3'端。
[0379]
在一些实施方案中,封闭结构域可在其合成时或在其合成之后并入捕获探针中。捕获结构域的末端核苷酸是可逆终止子核苷酸(例如,3'-o-封闭的可逆终止子和3'-未封闭的可逆终止子),并且可在探针合成期间或之后包含在捕获探针中。
[0380]
vii.延伸的捕获探针
[0381]“延伸的捕获探针”是具有扩大的核酸序列的捕获探针。例如,在捕获探针包含核酸的情况下,“延伸的3'端”指示向捕获探针的最3'核苷酸添加另外的核苷酸以延伸捕获探针的长度,例如,通过用于延伸核酸分子的标准聚合反应,包括由聚合酶(例如,dna聚合酶或逆转录酶)催化的模板化聚合。
[0382]
在一些实施方案中,延伸捕获探针包括从捕获的(杂交的)rna产生cdna。此过程涉及杂交的核酸的互补链的合成,例如基于捕获的rna模板(与捕获探针的捕获结构域杂交的rna)产生cdna。因此,在延伸捕获探针(例如cdna产生)的初始步骤中,捕获的(杂交的)核酸(例如rna)充当延伸(例如逆转录)步骤的模板。
[0383]
在一些实施方案中,使用逆转录延伸捕获探针。例如,逆转录包括使用逆转录酶从rna,例如(信使rna)合成cdna(互补或拷贝dna)。在一些实施方案中,当组织仍在适当位置时进行逆转录,从而产生分析物文库,其中所述分析物文库包括来自相邻捕获探针的空间条形码。在一些实施方案中,使用一种或多种dna聚合酶延伸捕获探针。
[0384]
在一些实施方案中,捕获探针的捕获结构域包含用于产生与捕获探针杂交的核酸的互补链的引物,例如用于dna聚合酶和/或逆转录的引物。通过延伸反应产生的核酸(例如,dna和/或cdna)分子并入捕获探针的序列。捕获探针的延伸,例如dna聚合酶和/或逆转录反应可使用多种合适的酶和方案进行。
[0385]
在一些实施方案中,产生全长dna(例如cdna)分子。在一些实施方案中,“全长”dna分子是指整个捕获的核酸分子。然而,如果核酸(例如rna)在组织样品中部分降解,则捕获的核酸分子的长度将与组织样品中的初始rna不同。在一些实施方案中,对延伸的探针(例如第一链cdna分子)的3'端进行修饰。例如,可将接头或衔接子连接至延伸的探针的3'端。这可使用单链连接酶,如t4 rna连接酶或circligase
tm
(可从epicentre biotechnologies,madison,wi获得)来实现。在一些实施方案中,模板转换寡核苷酸用于延伸cdna以产生全长cdna(或尽可能接近全长cdna)。在一些实施方案中,第二链合成辅助探针(能够与延伸的捕获探针的3'端杂交的部分双链dna分子)可使用双链连接酶,如t4 dna连接酶连接至延伸的探针(例如第一链cdna)分子的3'端。适用于连接步骤的其它酶是本领域已知的,并且包括例如tth dna连接酶、taq dna连接酶、热球菌属(菌株9
°
n)dna连接酶(9
°ntm dna连接酶,new england biolabs)、ampligase
tm
(可从epicentre biotechnologies,madison,wi获得)和splintr(可从new england biolabs,ipswich,ma获得)。在一些实施方案中,多核苷酸尾(例如poly(a)尾)并入延伸的探针分子的3'端。在一些实施方案中,使用末端转移酶活性酶并入多核苷酸尾。
[0386]
在一些实施方案中,在扩增和/或分析,例如序列分析之前,处理双链延伸的捕获探针以除去任何未延伸的捕获探针。这可通过多种方法来实现,例如使用酶,来如核酸外切酶或纯化柱降解未延伸的探针。
[0387]
在一些实施方案中,扩增延伸的捕获探针以产生足以用于例如通过dna测序进行分析的量。在一些实施方案中,延伸的捕获探针(例如,dna和/或cdna分子)的第一链充当扩增反应(例如,聚合酶链反应)的模板。
[0388]
在一些实施方案中,扩增反应使用包含亲和基团的引物将亲和基团并入延伸的捕获探针(例如,rna-cdna杂合体)上。在一些实施方案中,引物包含亲和基团,并且延伸的捕获探针包含亲和基团。亲和基团可对应于先前描述的任何亲和基团。
[0389]
在一些实施方案中,包含亲和基团的延伸的捕获探针可偶联至对亲和基团具有特异性的阵列特征。在一些实施方案中,基底可包括抗体或抗体片段。在一些实施方案中,阵列特征包含抗生物素蛋白或链霉抗生物素蛋白,并且亲和基团包含生物素。在一些实施方案中,阵列特征包含麦芽糖,并且亲和基团包含麦芽糖结合蛋白。在一些实施方案中,阵列特征包含麦芽糖结合蛋白,并且亲和基团包含麦芽糖。在一些实施方案中,扩增延伸的捕获探针可起到从阵列特征释放延伸的探针的作用,只要延伸的探针的拷贝不附接至所述阵列特征。
[0390]
在一些实施方案中,延伸的捕获探针或其互补序列或扩增子从阵列特征释放。从阵列特征释放延伸的捕获探针或其互补序列或扩增子的步骤可以多种方式实现。在一些实施方案中,延伸的捕获探针或其互补序列通过核酸裂解和/或通过变性(例如通过加热使双链分子变性)而从特征释放。
[0391]
vi.标记剂
[0392]
在一些实施方案中,本文提供了用于使用分析物捕获剂对生物分析物(例如,rna、dna和细胞表面或细胞内蛋白质和/或代谢物)进行空间谱分析的方法、组合物、装置和试剂盒。在一些实施方案中,分析物捕获剂(有时也称为“标记剂”)可包括与分析物(例如,样品中的分析物)和捕获剂(例如附接至基底的捕获探针)相互作用以鉴定分析物的剂。在一些实施方案中,可在本文提供的原位测定和/或空间测定之前、期间或之后使样品与一种或多种标记剂接触。在一些实施方案中,方法包括在使样品与一种或多种标记剂接触之后的一个或多个后固定(post-fixing)(也称为后固定(post-fixation))步骤。在一些实施方案中,分析物捕获剂包含分析物结合部分和捕获剂条形码结构域。
[0393]
在本文所述的方法和系统中,能够与一种或多种特征结合或以其它方式偶联的一种或多种标记剂可用于表征分析物、细胞和/或细胞特征。在一些情况下,细胞特征包括细胞表面特征。分析物可包括但不限于蛋白质、受体、抗原、表面蛋白、跨膜蛋白、分化簇蛋白、蛋白质通道、蛋白质泵、载体蛋白、磷脂、糖蛋白、糖脂、细胞-细胞相互作用蛋白复合物、抗原呈递复合物、主要组织相容性复合物、工程化的t细胞受体、t细胞受体、b细胞受体、嵌合抗原受体、间隙连接、粘附连接或它们的任何组合。在一些情况下,细胞特征可包括细胞内分析物,如蛋白质、蛋白质修饰(例如,磷酸化状态或其它翻译后修饰)、核蛋白、核膜蛋白或它们的任何组合。
[0394]
标记剂可包括但不限于蛋白质、肽、抗体(或其表位结合片段)、亲脂性部分(如胆固醇)、细胞表面受体结合分子、受体配体、小分子、双特异性抗体、双特异性t细胞衔接器、t
细胞受体衔接器、b细胞受体衔接器、前抗体(pro-body)、适体、单域抗体、affimer、darpin和蛋白质支架或它们的任何组合。标记剂可包括(例如附接至)报告基因寡核苷酸,所述报告基因寡核苷酸指示结合基团所结合的细胞表面特征。例如,报告基因寡核苷酸可包含允许鉴定标记剂的条形码序列。例如,对一种类型的细胞特征(例如,第一细胞表面特征)具有特异性的标记剂可具有与其偶联的第一报告基因寡核苷酸,而对不同细胞特征(例如,第二细胞表面特征)具有特异性的标记剂可具有与其偶联的不同报告基因寡核苷酸。对于示例性标记剂、报告基因寡核苷酸和使用方法的描述,参见例如美国专利号10,550,429;美国专利公布20190177800;和美国专利公布20190367969,所述专利各自以引用的方式整体并入本文。
[0395]
在其它情况下,例如为了促进样品多路复用,对特定细胞特征具有特异性的标记剂可具有与第一报告基因寡核苷酸偶联的第一多个标记剂(例如,抗体或亲脂性部分)和与第二报告基因寡核苷酸偶联的第二多个标记剂。
[0396]
在一些方面,这些报告基因寡核苷酸可包含核酸条形码序列,所述核酸条形码序列允许鉴定报告基因寡核苷酸所偶联至的标记剂。选择寡核苷酸作为报告基因可提供以下优点:能够在序列方面产生显著多样性,同时还容易地可附接至大多数生物分子,例如抗体等,以及容易地例如使用测序或阵列技术检测。
[0397]
报告基因寡核苷酸与标记剂的附接(偶联)可通过多种直接或间接、共价或非共价缔合或附接中的任一种来实现。例如,可使用化学缀合技术(例如,可从innova biosciences获得的抗体标记试剂盒)以及其它非共价附接机制,例如,使用生物素化抗体和寡核苷酸(或与寡核苷酸偶联的包含一个或多个生物素化接头的珠粒)与抗生物素蛋白或链霉抗生物素蛋白接头将寡核苷酸共价附接至标记剂(如蛋白质,例如抗体或抗体片段)的一部分。可获得抗体和寡核苷酸生物素化技术。参见例如,fang等人,“fluoride-cleavable biotinylation phosphoramidite for 5
′‑
end-labelling and affinity purification of synthetic oligonucleotides,”nucleic acids res.2003年1月15日;31(2):708-715,所述文献出于所有目的以引用的方式完全并入本文。同样,已经开发出并且容易获得蛋白质和肽生物素化技术。参见例如,美国专利号6,265,552,所述专利出于所有目的以引用的方式完全并入本文。此外,点击反应化学如甲基四嗪-peg5-nhs酯反应、tco-peg4-nhs酯反应等可用于将报告基因寡核苷酸偶联至标记剂。可商购的试剂盒(如来自thunderlink和abcam的试剂盒)以及本领域常用的技术可用于在适当情况下将报告基因寡核苷酸偶联至标记剂。在另一个实例中,标记剂间接地(例如,通过杂交)偶联至包含鉴定标记剂的条形码序列的报告基因寡核苷酸。例如,标记剂可直接偶联(例如,共价结合)至杂交寡核苷酸,所述杂交寡核苷酸包含与报告基因寡核苷酸的序列杂交的序列。杂交寡核苷酸与报告基因寡核苷酸的杂交使标记剂与报告基因寡核苷酸偶联。在一些实施方案中,如在施加刺激后,报告基因寡核苷酸可从标记剂释放。例如,如本文其它地方针对从支撑物释放分子总体描述的,报告基因寡核苷酸可通过不稳定键(例如,化学不稳定的、光不稳定的、热不稳定的等)附接至标记剂。在一些情况下,本文所述的报告基因寡核苷酸可包含可用于后续加工中的一个或多个功能序列,如衔接子序列、独特分子标识符(umi)序列、测序仪特异性流动池附接序列(如p5、p7或部分p5或p7序列)、引物或引物结合序列、测序引物或引物结合序列(如r1、r2或部分r1或r2序列)。
[0398]
在一些情况下,标记剂可包含报告基因寡核苷酸和标记。标记可以是荧光团、放射性同位素、能够进行比色反应的分子、磁性粒子或能够检测的任何其它合适的分子或化合物。标记可直接或间接地缀合至标记剂(或报告基因寡核苷酸)(例如,标记可与可结合至标记剂或报告基因寡核苷酸的分子缀合)。在一些情况下,标记缀合至与报告基因寡核苷酸的序列互补(例如杂交)的第一寡核苷酸。
[0399]
图14是包含分析物结合部分1404和报告基因1408的示例性标记剂(例如,分析物捕获剂)1402的示意图。标记剂1402通过分析物结合部分1404能够结合至分析物1406。标记剂(例如,分析物捕获剂)也能够与带空间条形码的捕获探针相互作用。分析物结合部分可以高亲和力和/或高特异性结合至分析物1406。报告基因1408可包含核酸(例如,报告基因寡核苷酸),所述核酸可以与捕获剂(例如,捕获探针)的捕获结构域的至少一部分或全部杂交。分析物结合部分1404可包含多肽和/或适体(例如,结合至特定靶分析物的寡核苷酸或肽分子)。分析物结合部分1404可包含抗体或抗体片段(例如,抗原结合片段)。
[0400]
图15是包含分析物结合部分1504和报告基因寡核苷酸1508的另一种示例性标记剂(例如,分析物捕获剂)1502的示意图。分析物结合部分1504可包含特异性地结合至分析物1506的抗体或其抗原结合片段。可捕获分析物的标记剂(例如,分析物捕获剂)也能够与带空间条形码的捕获探针相互作用。例如,报告基因寡核苷酸1508可包含一个或多个条形码结构域1510和能够与捕获探针的捕获结构域结合的序列1512。报告基因寡核苷酸1508可任选地包含一个或多个功能序列。
[0401]
图16是描绘特征固定化捕获探针1624与标记剂(例如,分析物捕获剂)1626之间的示例性相互作用的示意图。特征固定化捕获探针1624可附接至特征1602(任选地通过可裂解的接头1604)并且包含空间条形码1608以及一个或多个功能序列1606和1610,如本文别处所描述。捕获探针还可包含捕获结构域1612,所述捕获结构域能够结合至标记剂(例如,分析物捕获剂)1626。标记剂(例如,分析物捕获剂)1626可包含一个或多个功能序列1618、一个或多个捕获剂条形码结构域1616以及能够结合至捕获探针1624的捕获结构域1612的分析物捕获序列1614。标记剂(例如,分析物捕获剂)还可包含接头1620,所述接头允许剂条形码结构域1616与分析物结合部分1622偶联。特征固定化捕获探针1624和标记剂(例如,分析物捕获剂)1626一起形成捕获剂,所述捕获剂包含可释放地偶联至捕获探针的标记剂(例如,分析物捕获剂)。在一些实例中,图14中的报告基因1408和/或图15中的报告基因寡核苷酸包含分析物捕获序列1614、一个或多个捕获剂条形码结构域1616和一个或多个功能序列1618。
[0402]
在一些实施方案中,分析物结合部分可包含能够结合至分析物(例如,生物分析物,例如,大分子成分)的任何分子或部分。在本文所述的任何空间谱分析方法的一些实施方案中,分析物捕获剂的与生物分析物结合的分析物结合部分可包括但不限于抗体或其表位结合片段、细胞表面受体结合分子、受体配体、小分子、双特异性抗体、双特异性t细胞衔接器、t细胞受体衔接器、b细胞受体衔接器、前抗体、适体、单域抗体、affimer、darpin以及蛋白支架或它们的任何组合。分析物结合部分可以高亲和力和/或高特异性结合至大分子成分(例如,分析物)。分析物结合部分可包含核苷酸序列(例如,寡核苷酸),所述核苷酸序列可对应于分析物结合部分的至少一部分或全部。分析物结合部分可包含多肽和/或适体(例如,结合至特定靶分子,例如分析物的多肽和/或适体)。分析物结合部分可包含结合至
特定分析物(例如,多肽)的抗体或抗体片段。
[0403]
在一些实施方案中,分析物捕获剂能够结合至细胞内存在的分析物。在一些实施方案中,分析物捕获剂能够结合至细胞表面分析物,所述细胞表面分析物可包括但不限于受体、抗原、表面蛋白、跨膜蛋白、分化簇蛋白、蛋白质通道、蛋白质泵、载体蛋白、磷脂、糖蛋白、糖脂、细胞-细胞相互作用蛋白复合物、抗原呈递复合物、主要组织相容性复合物、工程化的t细胞受体、t细胞受体、b细胞受体、嵌合抗原受体、细胞外基质蛋白、细胞表面蛋白的翻译后修饰(例如磷酸化、糖基化、泛素化、亚硝基化、甲基化、乙酰化或脂化)状态、间隙连接和粘附连接。在一些实施方案中,分析物捕获剂能够结合至翻译后修饰的细胞表面分析物。在此类实施方案中,分析物捕获剂可基于给定翻译后修饰状态(例如磷酸化、糖基化、泛素化、亚硝基化、甲基化、乙酰化或脂化)对细胞表面分析物具有特异性,使得细胞表面分析物谱可包括一种或多种分析物的翻译后修饰信息。
[0404]
在一些实施方案中,分析物捕获剂包含与分析物结合部分缀合或以其它方式附接的捕获剂条形码结构域。在一些实施方案中,捕获剂条形码结构域与分析物结合部分共价连接。在一些实施方案中,捕获剂条形码结构域是核酸序列。在一些实施方案中,捕获剂条形码结构域包含分析物结合部分条形码和分析物捕获序列。
[0405]
如本文所用,术语“分析物结合部分条形码”是指与分析物结合部分相关或以其它方式鉴定分析物结合部分的条形码。在一些实施方案中,通过鉴定其相关的分析物结合部分条形码来鉴定分析物结合部分,也可鉴定分析物结合部分所结合的分析物。分析物结合部分条形码可以是给定长度的核酸序列和/或与分析物结合部分相关的序列。分析物结合部分条形码通常可包括本文所述的条形码的多个方面中的任一个。例如,对一种类型的分析物具有特异性的分析物捕获剂可具有与其偶联的第一捕获剂条形码结构域(例如,其包含第一分析物结合部分条形码),而对不同分析物具有特异性的分析物捕获剂可具有与其偶联的不同捕获剂条形码结构域(例如,其包含第二条形码分析物结合部分条形码)。在一些方面,这样的捕获剂条形码结构域可包含分析物结合部分条形码,所述分析物结合部分条形码允许鉴定捕获剂条形码结构域所偶联至的分析物结合部分。捕获剂条形码结构域的选择可允许序列方面的显著多样性,同时还容易地可附接至大多数分析物结合部分(例如,抗体)以及容易地检测(例如,使用测序或阵列技术)。在一些实施方案中,分析物捕获剂可包含分析物结合部分,捕获剂条形码结构域附接至所述分析物结合部分。例如,分析物捕获剂可包含第一分析物结合部分(例如,与分析物结合的抗体,例如第一细胞表面特征),所述第一分析物结合部分具有与其相关的捕获剂条形码结构域,所述捕获剂条形码结构域包含第一分析物结合部分条形码。
[0406]
在一些实施方案中,分析物捕获剂的捕获剂条形码结构域包含分析物捕获序列。如本文所用,术语“分析物捕获序列”是指被配置为与捕获探针的捕获结构域杂交、结合、偶联或以其它方式相互作用的区域或部分。在一些实施方案中,分析物捕获序列包含与捕获探针的捕获结构域互补或基本互补的核酸序列,使得分析物捕获序列与捕获探针的捕获结构域杂交。在一些实施方案中,分析物捕获序列包含与包含poly(t)核酸序列的捕获结构域杂交的poly(a)核酸序列。在一些实施方案中,分析物捕获序列包含与包含poly(a)核酸序列的捕获结构域杂交的poly(t)核酸序列。在一些实施方案中,分析物捕获序列包含与捕获结构域杂交的非同聚核酸序列,所述捕获结构域包含与分析物捕获区域的非同聚核酸序列
互补(或基本上互补)的非同聚核酸序列。
[0407]
在本文所述的采用分析物捕获剂的任何空间分析方法的一些实施方案中,捕获剂条形码结构域可直接偶联至分析物结合部分,或者它们可附接至珠粒、分子晶格(例如线性、球状、交联的)或其它聚合物或与分析物结合部分附接或以其它方式缔合的其它框架,其允许将多个捕获剂条形码结构域附接至单个分析物结合部分。捕获剂条形码结构域与分析物结合部分的附接(偶联)可通过多种直接或间接、共价或非共价缔合或附接中的任一种来实现。例如,在捕获剂条形码结构域与包含抗体或抗原结合片段的分析物结合部分偶联的情况下,此类捕获剂条形码结构域可使用化学方法缀合技术(例如,可从innova biosciences获得的抗体标记试剂盒)共价附接至抗体或抗原结合片段的一部分。在一些实施方案中,捕获剂条形码结构域可使用非共价附接机制(例如,使用与寡核苷酸偶联的包含一个或多个生物素化接头的生物素化抗体和寡核苷酸或珠粒与抗生物素蛋白或链霉抗生物素蛋白接头)偶联至抗体或抗原结合片段。可使用抗体和寡核苷酸生物素化技术,并且例如在fang等人,nucleic acids res.(2003),31(2):708-715中进行了描述,所述文献的全部内容以引用的方式并入本文。同样,蛋白质和肽生物素化技术已开发并且可使用,并且例如在美国专利号6,265,552中进行了描述,所述专利的全部内容以引用的方式并入本文。此外,点击反应化学如甲基四嗪-peg5-nhs酯反应、tco-peg
4-nhs酯反应等可用于将捕获剂条形码结构域偶联至分析物结合部分。分析物结合部分上的反应性部分还可包括用于靶向醛的胺、用于靶向马来酰亚胺(例如,游离硫醇)的胺、用于靶向点击化学化合物(例如,炔烃)的叠氮化物、用于靶向链霉抗生物素蛋白的生物素、用于靶向edc的磷酸酯,其进而靶向活性酯(例如,nh2)。分析物结合部分上的反应性部分可以是与分析物结合部分上的反应性部分结合的化学化合物或基团。将分析物结合部分与捕获剂条形码结构域缀合的示例性策略包括使用商业试剂盒(例如,solulink、thunder link)、轻度还原铰链区和马来酰亚胺标记的缀合、标记的酰胺的染色促进的点击化学反应(例如,不含铜)以及糖链的高碘酸盐氧化和胺缀合的缀合。在分析物结合部分是抗体的情况下,可在缀合寡核苷酸之前或同时对抗体进行修饰。例如,可用β-1,4-半乳糖基转移酶的底物允许突变体、galt(y289l)和带有叠氮化物的尿苷二磷酸-n-乙酰半乳糖胺类似物尿苷二磷酸-galnaz对抗体进行糖基化。经修饰的抗体可与具有二苯并环辛炔-peg4-nhs基团的寡核苷酸缀合。在一些实施方案中,可避免某些步骤(例如,cooh激活(例如,edc)和同双功能交联剂)以防止分析物结合部分与它们自身缀合。在本文所述的任何空间谱分析方法的一些实施方案中,分析物捕获剂(例如,与寡核苷酸偶联的分析物结合部分)可例如通过转染(例如,使用转染胺、阳离子聚合物、磷酸钙或电穿孔)、通过转导(例如,使用噬菌体或重组病毒载体)、通过机械递送(例如,磁珠)、通过脂质(例如,1,2-二油酰基-sn-甘油基-3-磷酸胆碱(dopc))或通过转运蛋白递送至细胞中。可使用外泌体将分析物捕获剂递送至细胞中。例如,可产生释放包含分析物捕获剂的外泌体的第一细胞。分析物捕获剂可附接至外泌体膜上。分析物捕获剂可包含在外泌体的细胞溶质内。可收获所释放的外泌体并将其提供给第二细胞,从而将分析物捕获剂递送至第二细胞中。分析物捕获剂可在递送至细胞中之前、期间或之后从外泌体膜释放。在一些实施方案中,使细胞透化以允许分析物捕获剂与细胞内细胞成分(如但不限于细胞内蛋白、代谢物和核膜蛋白)偶联。在细胞内递送之后,分析物捕获剂可用于分析如本文所述的细胞内成分。
[0408]
在本文所述的任何空间谱分析方法的一些实施方案中,与分析物捕获剂偶联的捕获剂条形码结构域可包含使其不能被聚合酶延伸的修饰。在一些实施方案中,当结合至样品中的捕获探针的捕获结构域或核酸用于引物延伸反应时,捕获剂条形码结构域可充当模板,而不是引物。当捕获剂条形码结构域还包含条形码(例如,分析物结合部分条形码)时,这样的设计可通过增加捕获剂条形码结构域与未条形编码的样品核酸之间的亲和力来增加分子条形编码的效率,并消除衔接子伪影的潜在形成。在一些实施方案中,捕获剂条形码结构域可包含随机n-聚体序列,所述序列用使其不能被聚合酶延伸的修饰加帽。在一些情况下,可设计随机n-聚体序列的组成以最大化与游离未条形编码的ssdna分子的结合效率。所述设计可包括具有较高gc含量的随机序列组成、在特定位置具有固定g或c的部分随机序列、鸟苷的使用、锁核酸的使用或它们的任何组合。
[0409]
用于通过聚合酶阻断引物延伸的修饰可以是不同长度的碳间隔基团或双脱氧核苷酸。在一些实施方案中,修饰可以是具有脱嘌呤或脱嘧啶结构的无碱基位点、碱基类似物或磷酸主链的类似物,如通过酰胺键连接的n-(2-氨基乙基)-甘氨酸的主链、四氢呋喃或1’,2
’‑
双脱氧核糖。修饰还可以是尿嘧啶碱基、2'ome修饰的rna、c3-18间隔区(例如,具有3-18个连续碳原子的结构,如c3间隔区)、乙二醇多聚体间隔区(例如,间隔区18(六乙二醇间隔区)、生物素、二脱氧核苷酸三磷酸、乙二醇、胺或磷酸酯。
[0410]
在本文所述的任何空间谱分析方法的一些实施方案中,与分析物结合部分偶联的捕获剂条形码结构域包含可裂解结构域。例如,在分析物捕获剂结合至分析物(例如,细胞表面分析物)后,可裂解并收集捕获剂条形码结构域,以用于根据如本文所述的方法进行下游分析。在一些实施方案中,捕获剂条形码结构域的可裂解结构域包含允许物质从珠粒释放的u-切除元件。在一些实施方案,u切除元件可包含含有至少一个尿嘧啶的单链dna(ssdna)序列。所述物质可经由ssdna序列附接至珠粒。所述物质可通过尿嘧啶-dna糖基化酶(例如,以除去尿嘧啶)和核酸内切酶(例如,以诱导ssdna断裂)的组合释放。如果核酸内切酶从裂解产生5'磷酸基团,则可在下游加工中包括额外的酶处理以消除磷酸基团,例如,在连接额外的测序柄元件之前,例如,illumina完整p5序列、部分p5序列、完整r1序列和/或部分r1序列。
[0411]
在一些实施方案中,分析物捕获剂的分析物结合部分包含一种或多种抗体或其抗原结合片段。包含分析物结合部分的抗体或抗原结合片段可特异性结合至靶分析物。在一些实施方案中,分析物是蛋白质(例如,生物样品(例如,细胞)表面上的蛋白质或细胞内蛋白质)。在一些实施方案中,包含多个分析物结合部分的多种分析物捕获剂结合存在于生物样品中的多种分析物。在一些实施方案中,多种分析物包括单一种类的分析物(例如,单一种类的多肽)。在多种分析物包括单一种类的分析物的一些实施方案中,多种分析物捕获剂的分析物结合部分是相同的。在多种分析物包括单一种类的分析物的一些实施方案中,多种分析物捕获剂的分析物结合部分是不同的(例如,多种分析物捕获剂的成员可具有两种或更多种种类的分析物结合部分,其中两种或更多种种类的分析物结合部分中的每一者结合单一种类的分析物,例如在不同的结合位点)。在一些实施方案中,多种分析物包括多种不同种类的分析物(例如,多种不同种类的多肽)。
[0412]
在一些实施方案中,来自生物样品的多种不同种类的分析物(例如,多肽)可随后与生物样品的一种或多种物理性质相关。例如,多种不同种类的分析物可与生物样品中分
析物的位置相关。这种信息(例如,当分析物结合部分识别多肽时的蛋白质组信息)可与其它空间信息(例如,来自生物样品的遗传信息,如dna序列信息、转录组信息(即,转录物序列)或两者)结合使用。例如,细胞的细胞表面蛋白可与细胞的一种或多种物理性质(例如,细胞的形状、大小、活性或类型)相关。可通过对细胞成像来表征一种或多种物理性质。细胞可被分析物捕获剂结合,所述分析物捕获剂包含与细胞表面蛋白结合的分析物结合部分和鉴定所述分析物结合部分的分析物结合部分条形码,并且可对细胞进行空间分析(例如,本文描述的各种空间分析方法中的任一种)。例如,与细胞表面蛋白结合的分析物捕获剂可与捕获探针(例如,阵列上的捕获探针)结合,所述捕获探针包含与分析物捕获剂的捕获剂条形码结构域上存在的分析物捕获序列相互作用的捕获结构域。捕获剂条形码结构域的全部或部分(包括分析物结合部分条形码)可使用捕获结构域的3'端作为引发位点用聚合酶复制,从而产生包含捕获探针的全部或部分(包括捕获探针上存在的空间条形码)和分析物结合部分条形码的拷贝的延伸的捕获探针。在一些实施方案中,可使具有延伸的捕获探针的空间阵列与样品接触,其中与空间阵列相关的分析物捕获剂捕获靶分析物。然后可将含有延伸的捕获探针的分析物捕获剂从空间阵列的捕获探针变性,所述延伸的捕获探针包含捕获探针的空间条形码和分析物结合部分条形码。这允许重复使用空间阵列。可将样品解离成非聚集细胞(例如单细胞)并通过本文所述的单细胞/液滴方法进行分析。可对延伸的捕获探针进行测序以获得核酸序列,其中捕获探针的空间条形码与分析物捕获剂的分析物结合部分条形码相关。延伸的捕获探针的核酸序列因此可与分析物(例如,细胞表面蛋白)相关,且进而与细胞的一种或多种物理性质(例如,形状或细胞类型)相关。在一些实施方案中,延伸的捕获探针的核酸序列可与附近细胞的细胞内分析物相关,其中使用本文所述的任何细胞透化或分析物迁移技术释放细胞内分析物。
[0413]
在本文所述的任何空间谱分析方法的一些实施方案中,从分析物捕获剂释放的捕获剂条形码结构域然后可进行序列分析以鉴定哪些分析物捕获剂与分析物结合。基于与空间阵列上的特征(例如,特定位置的特征)相关的捕获剂条形码结构域和分析物结合部分条形码序列的存在,可产生生物样品的分析物谱。可将单独细胞或细胞群体的谱与来自其它细胞(例如“正常”细胞)的谱进行比较,以鉴定分析物的变化,其可提供诊断相关的信息。在一些实施方案中,这些谱可用于诊断以细胞表面受体的变化为特征的多种病症,如癌症和其它病症。
[0414]
vii.基底和阵列
[0415]
在一些实施方案中,本文的基底(例如,本文的第一基底和/或第二基底)可以是不溶于水性液体并且允许支撑物上的生物样品、分析物、特征和/或试剂(例如,探针,如捕获探针)的定位的任何支撑物。在一些实施方案中,生物样品可附接至基底。取决于样品的性质和分析方法中的后续步骤,生物样品的附接可以是不可逆的或可逆的。在某些实施方案中,可通过将合适的聚合物涂层施加至基底并使样品与聚合物涂层接触而使样品可逆地附接至基底。然后可例如使用至少部分地溶解聚合物涂层的有机溶剂而使样品与基底脱离。水凝胶是适用于此目的的聚合物的实例。
[0416]
在一些实施方案中,基底可用一种或多种物质涂覆或官能化以促进样品与基底的附接。可用于涂覆或官能化基底的合适物质包括但不限于凝集素、聚赖氨酸、抗体和多糖。
[0417]
通常,基底用作将捕获探针直接或间接附接至阵列特征的支撑物。此外,在一些实
施方案中,基底(例如,相同基底或不同基底)可用于为生物样品,特别是例如薄组织切片提供支撑。因此,“基底”是不溶于水性液体并且允许基底上的生物样品、分析物、特征和/或捕获探针的定位的支撑物。
[0418]
多种不同的基底可用于上述目的。通常,基底可以是任何合适的支持材料。示例性基底包括但不限于玻璃、改性和/或官能化玻璃、水凝胶、薄膜、膜、塑料(包括例如,丙烯酸树脂、聚苯乙烯、苯乙烯和其它材料的共聚物、聚丙烯、聚乙烯、聚丁烯、聚氨酯、teflon
tm
、环状烯烃、聚酰亚胺等)、尼龙、陶瓷、树脂、zeonor、二氧化硅或基于二氧化硅的材料(包括硅和改性硅)、碳、金属、无机玻璃、光纤束和聚合物,如聚苯乙烯、环状烯烃共聚物(coc)、环状烯烃聚合物(cop)、聚丙烯、聚乙烯和聚碳酸酯。
[0419]
基底也可对应于流动池。流动池可由任何前述材料形成,并且可包括允许试剂、溶剂、特征和分子通过所述池的通道。
[0420]
在上文论述的基底材料的实例中,聚苯乙烯是适合结合带负电荷的大分子的疏水性材料,因为它通常含有较少亲水性基团。对于固定在载玻片上的核酸,通过增加玻璃表面的疏水性,可增加核酸固定。这种增强可允许形成相对更致密的堆积形成(例如,提供改进的特异性和分辨率)。
[0421]
在一些实施方案中,基底涂覆有表面处理,如聚(l)-赖氨酸。另外地或可替代地,可通过硅烷化(例如用环氧-硅烷、氨基-硅烷)和/或通过用聚丙烯酰胺处理来处理基底。
[0422]
基底通常可具有任何合适的形式或格式。例如,基底可以是平坦的、弯曲的,例如朝向发生生物样品(例如组织样品)与基底之间的相互作用的区域凸形或凹形弯曲。在一些实施方案中,基底是平面的,例如平面、芯片或载玻片。基底可在基底内含有一个或多个图案化表面(例如,通道、孔、突出部、脊、凹部等)。
[0423]
基底可具有任何所需的形状。例如,基底通常可以是薄的、平坦的形状(例如,正方形或矩形)。在一些实施方案中,基底结构具有圆角(例如,为了提高安全性或稳健性)。在一些实施方案中,基底结构具有一个或多个截止角(例如,用于与滑动夹或十字工作台一起使用)。在一些实施方案中,当基底结构为平坦时,基底结构可以是具有平坦表面的任何适当类型的支撑物(例如,芯片或载玻片如显微镜载玻片)。
[0424]
基底可任选地包括各种结构,如但不限于突出部、脊和通道。基底可被微图案化以限制径向扩散(例如,以防止空间条形码的重叠)。可对用此类结构修饰的基底进行修饰,以允许单独位点处的分析物、特征或探针的关联。例如,用各种结构修饰基底的位点可与其它位点邻接或不邻接。
[0425]
在一些实施方案中,可修饰基底的表面,使得形成可仅具有或容纳单个特征的离散位点。在一些实施方案中,可修饰基底的表面,使得特征粘附至随机位点。
[0426]
在一些实施方案中,使用诸如(但不限于)压印技术、微蚀刻技术和模制技术的技术来修饰基底的表面以含有一个或多个孔。在基底包括一个或多个孔的一些实施方案中,基底可以是凹载玻片或凹穴玻片。例如,孔可由基底表面上的一个或多个浅凹陷形成。在基底包括一个或多个孔的一些实施方案中,孔可通过将盒(例如,含有一个或多个室的盒)附接至基底结构的表面来形成。
[0427]
在一些实施方案中,基底的结构(例如,孔)可各自带有不同的捕获探针。可根据结构在基底表面之中或之上的位置来鉴定附接至每个结构的不同捕获探针。示例性基底包括
其中分离结构位于基底上的阵列,包括例如具有容纳特征的孔的那些。
[0428]
在一些实施方案中,基底包括在基底表面上的一个或多个标记,例如以提供用于将空间信息与目标分析物的表征相关联的指导。例如,可用网格线标记基底(例如,以允许容易地估计在放大率下观察到的物体的大小和/或提供用于计数物体的参考区域)。在一些实施方案中,基准标记物可包括在基底上。可使用包括但不限于印刷、喷砂和沉积在表面上的技术来制作此类标记。
[0429]
在修饰基底以含有一种或多种结构(包括但不限于孔、突出部、脊或标记)的一些实施方案中,所述结构可包括物理改变的位点。例如,用各种结构修饰的基底可包括物理性质,包括但不限于物理构型、磁力或压缩力、化学官能化位点、化学改变位点和/或静电改变位点。
[0430]
在修饰基底以含有各种结构(包括但不限于孔、突出部、脊或标记)的一些实施方案中,所述结构以图案形式应用。可替代地,所述结构可以是随机分布的。
[0431]
在一些实施方案中,处理基底以最小化或减少特征内或特征之间的非特异性分析物杂交。例如,处理可包括用对非特异性杂交产生物理屏障的水凝胶、薄膜和/或膜涂覆基底。可使用任何合适的水凝胶。例如,可使用根据美国专利号6,391,937、9,512,422和9,889,422以及美国专利申请公布号u.s.2017/0253918和u.s.2018/0052081中所述的方法制备的水凝胶基质。前述文献中的每一个的全部内容以引用的方式并入本文。
[0432]
处理可包括添加反应性或能够被激活的官能团,使得其在接受刺激后变为反应性(例如,光反应性)。处理可包括用具有一种或多种物理性质(例如,机械、电、磁和/或热)的聚合物处理,所述物理性质使非特异性结合最小化(例如,在某些位置激活基底以允许在那些位置进行分析物杂交)。
[0433]
基底(例如,阵列上的特征)可包括数十至数十万或数百万个单独寡核苷酸分子(例如,至少约10,000、50,000、100,000、500,000、1,000,000、10,000,000、100,000,000、1,000,000,000或10,000,000,000个寡核苷酸分子)。
[0434]
在一些实施方案中,基底的表面涂覆有细胞允许涂层以允许活细胞粘附。“细胞允许涂层”是允许或帮助细胞在基底上维持细胞活力(例如,保持存活)的涂层。例如,细胞允许涂层可增强细胞附着、细胞生长和/或细胞分化,例如,细胞允许涂层可为活细胞提供营养物。细胞允许涂层可包括生物材料和/或合成材料。细胞允许涂层的非限制性实例包括以一种或多种细胞外基质(ecm)成分(例如,蛋白聚糖和纤维蛋白,如胶原蛋白、弹性蛋白、纤连蛋白和层粘连蛋白)、聚赖氨酸、聚(l)-鸟氨酸和/或生物相容性硅酮(例如,)为特征的涂层。例如,包含一种或多种细胞外基质组分的细胞允许涂层可包含i型胶原蛋白、ii型胶原蛋白、iv型胶原蛋白、弹性蛋白、纤连蛋白、层粘连蛋白和/或玻连蛋白。在一些实施方案中,细胞允许涂层包含从engelbreth-holm-swarm(ehs)小鼠肉瘤提取的溶解的基底膜制剂(例如,)。在一些实施方案中,细胞允许涂层包含胶原蛋白。细胞允许涂层可用于在带空间条形码的阵列上培养贴壁细胞,或在与带空间条形码的阵列接触时保持组织样品或切片的细胞活力。
[0435]
a.用于原位测定模块的基底
[0436]
在一些实施方案中,生物样品提供在用于本文公开的整合测定的一个或多个原位测定模块的第一基底上。在一些实施方案中,使第一基底上的生物样品与用于一个或多个
原位测定模块的一个或多个核酸探针接触。一个或多个核酸探针可直接或间接地与生物样品中的第一靶核酸或其互补序列或扩增产物杂交。在一些实施方案中,第一基底包含固定在其上的多种捕获剂,并且所述捕获剂能够直接或间接地捕获第二靶核酸或其互补序列或其扩增产物。
[0437]
多种不同的基底可用于原位测定模块,只要基底与样品和样品加工、原位试剂和反应以及原位信号检测(例如,光学成像,如荧光显微术)相容。基底可以是任何合适的支撑材料并且通常是透明的。例如,可使用诸如盖玻片的载玻片。第一基底可包括但不限于玻璃、改性和/或官能化玻璃、水凝胶、薄膜、膜、塑料、尼龙、陶瓷、树脂、zeonor、二氧化硅或基于二氧化硅的材料(包括硅和改性硅)、碳、金属、无机玻璃、光纤束和聚合物,如聚苯乙烯、环状烯烃共聚物(coc)、环状烯烃聚合物(cop)、聚丙烯、聚乙烯和聚碳酸酯。第一基底也可对应于流动池。
[0438]
在一些实施方案中,第一基底的厚度介于约0.01mm与约5mm之间,例如,介于约0.05mm与约3mm之间、介于约0.1mm与约2.5mm之间、介于约0.2mm与约2mm之间、介于约0.5mm与约1.5mm之间,或约1mm。在一些实施方案中,第一基底的厚度是或是约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9或2.0mm,或介于前述值中的任一者之间的厚度。
[0439]
b.用于空间测定模块的基底
[0440]
在一些实施方案中,第一基底和第二基底是相同的。在一些实施方案中,同一基底可用于本文公开的一个或多个原位测定模块以及一个或多个空间测定模块。例如,生物样品在原位测定模块之前附着至基底,并在原位成像和空间分析期间保持附着至同一基底,包括例如通过由同一基底提供的捕获剂捕获分析物。在一些实施方案中,同一基底包含固定在其上的多种捕获剂。在一些实施方案中,多种捕获剂在原位测定和空间测定期间保持固定在基底上,并且生物样品中的分子被释放、递送和/或驱动朝向基底以供捕获剂捕获所述分子。在一些实施方案中,多种捕获剂在原位测定期间保持固定在基底上,但被释放、递送和/或驱动朝向生物样品和/或其中和/或其上的分子以用于空间测定。
[0441]
在一些实施方案中,第一基底和第二基底是不同的。在一些实施方案中,第一基底和第二基底是分开的基底。例如,附着有用于原位测定的样品的第一基底可不包含固定在第一基底上的多种捕获剂。相反,捕获剂提供在一个或多个第二基底上,所述一个或多个第二基底在原位测定模块期间或之后提供给生物样品。例如,第一基底、生物样品和第二基底可形成夹层以促进样品和基底之间的分子相互作用和/或材料转移。在一些实施方案中,多种捕获剂在空间测定期间保持固定在第二基底上,并且生物样品中的分子被释放、递送和/或驱动朝向第二基底以供捕获剂捕获所述分子。在一些实施方案中,多种捕获剂从第二基底释放。在一些实施方案中,来自第二基底的多种捕获剂被递送和/或驱动朝向生物样品和/或其中和/或其上的分子。
[0442]
在一些实施方案中,在样品在第一基底上原位成像之后,将包含多种捕获剂的第二基底提供给样品。多种捕获剂可从第二基底释放并被递送和/或驱动朝向第一基底上的生物样品和/或其中和/或其上的分子,并且分子相互作用(例如,分析物捕获)和空间测定模块的后续步骤(例如,捕获的mrna分子的逆转录)在第一基底上进行。
[0443]
在其它实施方案中,在原位测定模块之后,使生物样品接近用于空间测定模块的
第二基底。在一些实施方案中,第一基底不从生物样品移除,并且由样品和基底形成的夹层用于空间测定模块中。在其它实施方案中,可除去第一基底。在一些实施方案中,在第一基底上的原位测定模块之后,将生物样品转移到第二基底上,所述第二基底包含能够捕获样品中或样品上的分析物的多种捕获剂,以便对捕获的分析物进行空间条形编码。可使用装置来促进样品在基底之间的转移,例如,从普通显微镜载玻片至包含固定在其上的多种捕获剂(例如,捕获探针的覆层)的基底。
[0444]
在任何前述实施方案中,捕获剂不需要被提供在所述生物样品所在的同一基底上。换言之,生物样品可位于第一基底上用于原位分析,并且已经完成所述原位分析的样品中的分子可与一个或多个第二基底接触和/或转移至一个或多个第二基底上。在多个第二基底的情况下,所述样品可顺序地与每个第二基底接触,或者如果两个或更多个第二基底仅覆盖所述样品的子区域,则可并行地接触。一个或多个所述第二基底可与一个或多个第三基底接触以制造所述第二基底的复制品。
[0445]
多种不同的基底可用于空间测定模块,只要基底与样品和样品加工、空间测定试剂和反应以及用于空间读出的测序文库的制备相容。基底可以是任何合适的支撑材料。用于空间测定模块的基底可以但不需要是透明的,如果它不也用于原位测定模块的话。例如,可使用诸如盖玻片的载玻片。用于空间测定模块的基底(例如,第一基底或第二基底)可包括但不限于玻璃、改性和/或官能化玻璃、水凝胶、薄膜、膜、塑料、尼龙、陶瓷、树脂、zeonor、二氧化硅或基于二氧化硅的材料(包括硅和改性硅)、碳、金属、无机玻璃、光纤束和聚合物,如聚苯乙烯、环状烯烃共聚物(coc)、环状烯烃聚合物(cop)、聚丙烯、聚乙烯和聚碳酸酯。用于空间测定模块的基底(例如,第一或第二基底)也可对应于流动池。
[0446]
在一些实施方案中,用于空间测定模块的基底(例如,第一或第二基底)的厚度介于约0.01mm与约5mm之间,例如,介于约0.05mm与约3mm之间、介于约0.1mm与约2.5mm之间、介于约0.2mm与约2mm之间、介于约0.5mm与约1.5mm之间,或约1mm。在一些实施方案中,用于空间测定模块的基底的厚度是或是约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9或2.0mm,或介于前述值中的任一者之间的厚度。
[0447]
在本文描述的许多方法中,特征(如下文进一步描述)共同定位在基底上。“阵列”是不规则或形成规则图案的多个特征的特定排列。阵列中的单独特征基于它们的相对空间位置而彼此不同。一般而言,阵列中的多个特征中的至少两个包括不同的捕获探针(例如,本文所述的捕获探针的任何实例)。
[0448]
阵列可用于同时测量大量分析物。在一些实施方案中,至少部分地使用寡核苷酸来产生阵列。例如,单一种类的寡核苷酸(例如,捕获探针)的一个或多个拷贝可对应于或直接或间接地附接至阵列中的给定特征。在一些实施方案中,阵列中的给定特征包括两种或更多种种类的寡核苷酸(例如,捕获探针)。在一些实施方案中,直接或间接地附接至阵列上的给定特征的两种或更多种种类的寡核苷酸(例如,捕获探针)包括共同的(例如,相同的)空间条形码。
[0449]“特征”是充当样品分析中使用的各种分子实体的支撑物或储库的实体。特征的实例包括但不限于珠粒、任何二维或三维几何形状的点(例如,喷墨点、掩蔽点、网格上的正方形)、孔和水凝胶垫。在一些实施方案中,特征直接或间接地附接或固定至基底。在一些实施方案中,特征不直接或间接地附接或固定至基底,而是例如设置在封闭或部分封闭的三维
空间(例如,孔或凹部)内。
[0450]
除了上述那些之外,可使用多种其它特征来形成本文所述的阵列。例如,在一些实施方案中,由喷射印刷、丝网印刷或静电沉积在基底上的聚合物和/或生物聚合物形成的特征可用于形成阵列。生物聚合物的喷射印刷例如在pct专利申请公布号wo 2014/085725中进行了描述。聚合物的喷射印刷例如在de gans等人,adv mater.16(3):203-213(2004)中进行了描述。用于聚合物和生物聚合物的静电沉积的方法例如在hoyer等人,anal.chem.68(21):3840-3844(1996)中进行了描述。前述参考文献中的每一个的全部内容以引用的方式并入本文。
[0451]
作为另一个实例,在一些实施方案中,特征由金属微米或纳米粒子形成。用于沉积此类粒子以形成阵列的合适方法例如在lee等人,beilstein j.nanotechnol.8:1049-1055(2017)中进行了描述,所述文献的全部内容以引用的方式并入本文。
[0452]
作为另一实例,在一些实施方案中,特征由组装在基底上的磁性粒子形成。用于组装阵列的此类粒子和方法的实例在ye等人,scientific reports 6:23145(2016)中进行了描述,所述文献的全部内容以引用的方式并入本文。
[0453]
作为另一个实例,在一些实施方案中,特征对应于其中一个或多个光学标记已被并入和/或已通过诸如永久光漂白的工艺改变的基底区域。以这种方式实现特征的合适基底包括例如多种聚合物。用于形成此类特征的方法例如在moshrefzadeh等人,appl.phys.lett.62:16(1993)中进行了描述,所述文献的全部内容以引用的方式并入本文。
[0454]
作为又一个实例,在一些实施方案中,特征可对应于组装(例如,通过自组装)以形成阵列的胶体颗粒。合适的胶体颗粒例如在sharma,resonance 23(3):263-275(2018)中进行了描述,所述文献的全部内容以引用的方式并入本文。
[0455]
作为另一实例,在一些实施方案中,可通过单体溶液在基底上的点阵列光聚合来形成特征。特别地,双光子和三光子聚合可用于制造尺寸相对较小(例如,亚微米)的特征。用于以这种方式在基底上制备特征的合适方法例如在nguyen等人,materials today 20(6):314-322(2017)中进行了描述,所述文献的全部内容以引用的方式并入本文。
[0456]
在一些实施方案中,特征直接或间接地附接或固定至液体可渗透的基底。在一些实施方案中,特征直接或间接地附接或固定至生物相容的基底。在一些实施方案中,特征直接或间接地附接或固定至为水凝胶的基底。
[0457]
图17描绘阵列内的带条形码特征的示例性布置。从左到右,图17示出(l)包括六个带空间条形码的阵列的载玻片;(c)六个带空间条形码的阵列之一的放大示意图,其示出与生物样品相关的带条形码特征网格;和(r)阵列的一个截面的放大示意图,其示出阵列内多个特征的特定标识(标记为id578、id579、id560等)。
[0458]
在一些实施方案中,可在珠粒阵列的珠粒上形成特征。如本文所用,术语“珠粒阵列”是指包括多个珠粒作为阵列中的特征的阵列。在一些实施方案中,珠粒附接至基底。例如,珠粒可任选地附接至诸如显微镜载玻片的基底并且靠近生物样品(例如,包括细胞的组织切片)。珠粒也可悬浮在溶液中并沉积在表面(例如,膜、组织切片或基底(例如,显微镜载玻片))上。基底之上或之内的珠粒阵列的实例包括位于孔中的珠粒,如beadchip阵列(可从llumina inc.,san diego,ca获得)、来自454lifesciences(roche,basel,switzerland的
子公司)的测序平台中使用的阵列以及来自ion torrent(life technologies,carlsbad,ca的子公司)的测序平台中使用的阵列。珠粒阵列的实例描述于例如美国专利号6,266,459;6,355,431;6,770,441;6,859,570;6,210,891;6,258,568;和6,274,320;美国专利申请公布号2009/0026082;2009/0127589;2010/0137143;和2010/0282617;以及pct专利申请公布号wo 00/063437和wo 2016/162309中,所述专利各自的全部内容以引用的方式并入本文。
[0459]“柔性阵列”包括附接至或包埋于置于生物样品上的柔性基底(例如膜或胶带)中的多个带空间条形码特征。在一些实施方案中,柔性阵列包括包埋在水凝胶基质中的多个带空间条形码特征。为了形成这样的阵列,将微阵列的特征复制到水凝胶中,并通过除去水来减小水凝胶的尺寸。这些步骤可进行多次。例如,在一些实施方案中,用于制备高密度带空间条形码的阵列的方法可包括将多个特征从微阵列复制到第一水凝胶中,其中使所述第一水凝胶与所述微阵列接触;通过除去水来减小包括所复制特征的第一水凝胶的尺寸,从而形成包括所述复制特征的第一收缩水凝胶;将所述第一收缩水凝胶中的特征复制到第二水凝胶中,其中使所述第二水凝胶与所述第一水凝胶接触;通过除去水来减小包括所复制特征的第二水凝胶的尺寸,从而形成包括所复制特征的第二收缩水凝胶,从而产生高密度带空间条形码的阵列。结果是包含带空间条形码特征的高密度柔性阵列。
[0460]
在一些实施方案中,可将带空间条形码的珠粒负载到基底(例如,水凝胶)上以产生高密度自组装珠粒阵列。
[0461]
柔性阵列可预先平衡,与功能浓度的反应缓冲液和酶组合(例如,逆转录混合物)。在一些实施方案中,柔性珠粒阵列可储存延长的时间段(例如,数天)或冷冻直到准备好使用。在一些实施方案中,生物样品(例如,组织切片)的透化可通过在与柔性阵列接触之前添加酶/洗涤剂来进行。柔性阵列可直接置于样品上,或放置成与生物样品间接接触(例如,在生物样品与柔性珠粒阵列之间具有插入层或物质)。在一些实施方案中,一旦将柔性阵列施加至样品,就可在固体微球或第一尺寸的环形珠粒和第二尺寸的环形珠粒上进行分析物的逆转录和靶向捕获。
[0462]“微毛细管阵列”是通过微毛细管分配的一系列阵列特征。“微毛细管通道”是由微毛细管创建的单独分区。例如,微毛细管通道可与其它微毛细管通道流体隔离,使得阵列中一个微毛细管通道中的流体或其它内容物与阵列中相邻微毛细管通道中的流体或其它内容物分离。微毛细管的密度和顺序可以是离散位点的任何合适的密度或顺序。
[0463]
在一些实施方案中,对微毛细管阵列进行处理以产生有助于负载的条件。一个实例是使用电晕棒(bd-20ac,electro technic products)来产生亲水性表面。在一些实施方案中,将特征(例如,附接有捕获探针的珠粒)负载到微毛细管阵列上,使得所述特征在阵列内的确切位置是已知的。例如,可将含有空间条形码的捕获探针放置到微毛细管通道中,使得所述空间条形码能够实现带条形码的核酸分子的条形码序列所来源的位置的鉴定。
[0464]
在一些实施方案中,当使用随机分布来分布特征时,可进行经验测试以产生有助于每个微毛细管单个特征的负载/分布条件。在一些实施方案中,可能希望实现仅促进每个微毛细管通道单个特征(例如,珠粒)的分布条件。在一些实施方案中,可能希望通过使特征流动通过微毛细管通道来实现促进每个微毛细管通道多于一个特征(例如,珠粒)的分布条件。
[0465]
在一些实施方案中,阵列中的一些或所有特征包括捕获探针。在一些实施方案中,阵列可包括直接或间接地附接至基底的捕获探针。
[0466]
捕获探针包括可特异性地结合(例如,杂交)至样品内的靶分析物(例如,mrna、dna或蛋白质)的捕获结构域(例如,核苷酸序列)。在一些实施方案中,捕获探针与靶标的结合(例如,杂交)可通过检测视觉信号,例如已并入靶标中的荧光团、重金属(例如,银离子)或化学发光标记来进行检测和定量。在一些实施方案中,视觉信号的强度与生物样品中每种分析物的相对丰度相关。由于阵列可含有数千个或数百万个(或更多个)捕获探针,因此具有捕获探针的特征阵列可并行询问许多分析物。
[0467]
在一些实施方案中,基底包括被设计为捕获来自一种或多种生物体的分析物的一个或多个捕获探针。在一个非限制性实例中,基底可含有被设计用于捕获来自一种生物体(例如,人)的mrna的一个或多个捕获探针和被设计用于捕获来自第二生物体(例如,细菌)的dna的一个或多个捕获探针。
[0468]
可使用多种技术将捕获探针附接至基底或特征。在一些实施方案中,捕获探针直接附接至固定在阵列上的特征。在一些实施方案中,捕获探针通过化学固定被固定至基底。例如,化学固定可在基底上的官能团和与捕获探针上的相应功能元件之间发生。捕获探针中的示例性相应功能元件可以是捕获探针的固有化学基团,例如羟基,或者可将功能元件引入到捕获探针上。基底上的官能团的实例是胺基团。在一些实施方案中,待固定的捕获探针包括官能胺基团或经化学修饰以包含官能胺基团。用于这种化学修饰的手段和方法在本领域中是众所周知的。
[0469]
在一些实施方案中,捕获探针是核酸。在一些实施方案中,捕获探针通过其5'端固定在特征或基底上。在一些实施方案中,捕获探针通过其5'端固定在特征或基底上并且从5'至3'端包含:一个或多个条形码(例如,空间条形码和/或umi)和一个或多个捕获结构域。在一些实施方案中,捕获探针通过其5'端固定在特征上并且从5'至3'端包含:一个条形码(例如,空间条形码或umi)和一个捕获结构域。在一些实施方案中,捕获探针通过其5'端固定在特征或基底上并且从5'至3'端包含:可裂解结构域、功能结构域、一个或多个条形码(例如,空间条形码和/或umi)和捕获结构域。
[0470]
在一些实施方案中,捕获探针通过其5'端固定在特征或基底上并且从5'至3'端包含:可裂解结构域、功能结构域、一个或多个条形码(例如,空间条形码和/或umi)、第二功能结构域和捕获结构域。在一些实施方案中,捕获探针通过其5'端固定在特征或基底上并且从5'至3'端包含:可裂解结构域、功能结构域、空间条形码、umi和捕获结构域。在一些实施方案中,捕获探针通过其5'端固定在特征或基底上并且不包含空间条形码。在一些实施方案中,捕获探针通过其5'端固定在特征或基底上并且不包含umi。在一些实施方案中,捕获探针包含用于起始测序反应的序列。
[0471]
在一些实施方案中,捕获探针通过其3'端固定在特征或基底上。在一些实施方案中,捕获探针通过其3'端固定在特征或基底上并且从3'至5'端包含:一个或多个条形码(例如,空间条形码和/或umi)和一个或多个捕获结构域。在一些实施方案中,捕获探针通过其3'端固定在特征或基底上并且从3'至5'端包含:一个条形码(例如,空间条形码或umi)和一个捕获结构域。在一些实施方案中,捕获探针通过其3'端固定在特征或基底上并且从3'至5'端包含:可裂解结构域、功能结构域、一个或多个条形码(例如,空间条形码和/或umi)和
捕获结构域。在一些实施方案中,捕获探针通过其3'端固定在特征或基底上并且从3'至5'端包含:可裂解结构域、功能结构域、空间条形码、umi和捕获结构域。
[0472]
待固定的捕获探针内官能团的定位可用于控制和塑造捕获探针的结合行为和/或取向,例如官能团可置于捕获探针的5'或3'端或捕获探针的序列内。在一些实施方案中,捕获探针可还包括基底(例如,附接至捕获探针的支撑物、附接质特征的支撑物或附接至基底的支撑物)。用于待固定的捕获探针的典型基底包括能够与此类捕获探针结合,例如与胺官能化的核酸结合的部分。此类基底的实例是羧基、醛或环氧支撑物。
[0473]
在一些实施方案中,可将捕获探针固定在其上的基底可例如通过激活基底上可用的官能团而化学激活。术语“激活的基底”涉及其中相互作用或反应性化学官能团通过化学修饰程序建立或启用的材料。例如,可在使用前激活包括羧基的基底。此外,某些基底含有可与捕获探针中已经存在的特定部分反应的官能团。
[0474]
在一些实施方案中,使用共价键联将捕获探针直接偶联至底物。在一些实施方案中,通过使捕获探针的“第一”核苷酸与基底分离的接头(即化学接头)将捕获探针间接偶联至基底。在一些实施方案中,捕获探针不直接结合至阵列,而是间接地相互作用,例如通过结合至自身直接或间接地结合至阵列的分子。在一些实施方案中,捕获探针间接地附接至基底(例如,通过包含聚合物的溶液)。
[0475]
在捕获探针例如通过与能够结合捕获探针的表面探针杂交而间接地固定在阵列的特征上的一些实施方案中,所述捕获探针可还包含能够与表面探针的5'端杂交的上游序列(与组织样品的核酸,例如rna杂交的序列的5')。单独地,捕获探针的捕获结构域可被视为捕获结构域寡核苷酸,在捕获探针间接地固定在阵列上的实施方案中,所述捕获结构域寡核苷酸可用于捕获探针的合成。
[0476]
在一些实施方案中,基底由惰性材料或基质(例如,载玻片)组成,所述惰性材料或基质已通过例如用包含能够固定捕获探针的反应性基团的材料处理而被官能化。参见例如,wo 2017/019456,其全部内容以引用的方式并入本文。非限制性实例包括负载在惰性基底上的聚丙烯酰胺水凝胶(例如,载玻片;参见wo 2005/065814和美国专利申请号2008/0280773,其全部内容以引用的方式并入本文)。
[0477]
在一些实施方案中,使用共价方法将官能化生物分子(例如,捕获探针)固定在官能化基底上。用于共价附接的方法包括,例如,胺和激活的羧酸酯(例如,n-羟基琥珀酰亚胺酯)的缩合;在还原性胺化条件下胺和醛的缩合;和环加成反应,如狄尔斯-阿尔德[4 2]反应、1,3-偶极环加成反应和[2 2]环加成反应。用于共价附接的方法还包括例如,点击化学反应,包括[3 2]环加成反应(例如,胡伊斯根(huisgen)1,3-偶极环加成反应和铜(i)催化的叠氮化物-炔烃环加成(cuaac));硫醇-烯反应;狄尔斯-阿尔德反应和反电子需求狄尔斯-阿尔德反应;异腈和四嗪的[4 1]环加成;以及小碳环的亲核开环(例如,用氨基寡核苷酸打开环氧化物)。用于共价附接的方法还包括,例如,马来酰亚胺和硫醇;和对硝基苯酯官能化的寡核苷酸和聚赖氨酸官能化的底物。用于共价附接的方法还包括,例如,二硫化物反应;自由基反应(参见例如,美国专利号5,919,626,其全部内容以引用的方式并入本文);和酰肼官能化基底(例如,其中酰肼官能团直接或间接地附接至基底)和醛官能化寡核苷酸(参见例如,yershov等人(1996)proc.natl.acad.sci.usa 93,4913
–
4918,其全部内容以引用的方式并入本文)。
[0478]
在一些实施方案中,使用光化学共价方法将官能化生物分子(例如,捕获探针)固定在官能化基底上。用于光化学共价附接的方法包括,例如,蒽醌缀合的寡核苷酸的固定(参见例如,koch等人(2000)bioconjugate chem.11,474-483,其全部内容以引用的方式并入本文)。
[0479]
在一些实施方案中,使用非共价方法将官能化生物分子(例如,捕获探针)固定在官能化基底上。用于非共价附接的方法包括,例如,生物素官能化的寡核苷酸和链霉抗生物素蛋白处理的基底(参见例如,等人(1993)analytical biochemistry 209,278
–
283和gilles等人(1999)nature biotechnology 17,365
–
370,其全部内容以引用的方式并入本文)。
[0480]
在一些实施方案中,寡核苷酸(例如,捕获探针)可根据以下中阐述的方法附接至基底或特征:美国专利号6,737,236、7,259,258、7,375,234、7,427,678、5,610,287、5,807,522、5,837,860和5,472,881;美国专利申请公布号2008/0280773和2011/0059865;shalon等人(1996)genome research,639
–
645;rogers等人(1999)analytical biochemistry 266,23
–
30;stimpson等人(1995)proc.natl.acad.sci.usa 92,6379
–
6383;beattie等人(1995)clin.chem.45,700
–
706;lamture等人(1994)nucleic acids research 22,2121
–
2125;beier等人(1999)nucleic acids research 27,1970
–
1977;joos等人(1997)analytical biochemistry 247,96
–
101;nikiforov等人(1995)analytical biochemistry 227,201
–
209;timofeev等人(1996)nucleic acids research 24,3142
–
3148;chrisey等人(1996)nucleic acids research 24,3031
–
3039;guo等人(1994)nucleic acids research 22,5456
–
5465;running和urdea(1990)biotechniques 8,276
–
279;fahy等人(1993)nucleic acids research 21,1819
–
1826;zhang等人(1991)19,3929
–
3933;以及rogers等人(1997)gene therapy 4,1387
–
1392。前述文献中的每一个的全部内容以引用的方式并入本文。
[0481]
可通过各种方法制备阵列。在一些实施方案中,通过在阵列上合成(例如,原位合成)寡核苷酸或通过喷射印刷或光刻来制备阵列。例如,高密度dna寡核苷酸的光引导合成可通过光刻或固相dna合成来实现。为了实施光刻合成,可将用光化学保护基团修饰的合成接头附接至基底,并且可使用光刻掩模(施加至基板的特定区域)和光来修饰光化学保护基团,从而产生具有局部光脱保护的阵列。许多这些方法在本领域中是已知的,并且例如在miller等人,“basic concepts of microarrays and potential applications in clinical microbiology.”clinical microbiology reviews 22.4(2009):611-633;us201314111482a;us9593365b2;us2019203275;和wo2018091676中进行了描述,所述文献以引用的方式整体并入本文。
[0482]
在一些实施方案中,将阵列用寡核苷酸“点样”或“印刷”,然后将这些寡核苷酸(例如,捕获探针)附接至基底。寡核苷酸可通过非接触或接触印刷施加。非接触式打印机可使用与计算机打印机相同的方法(例如,气泡喷射或喷墨)以将探针溶液的小液滴排出到基底上。专门的喷墨样打印机可将纳升至皮升体积的寡核苷酸溶液液滴(而不是墨水)排出到基底上。在接触印刷中,每个打印针直接将寡核苷酸溶液施加至表面上的特定位置。可通过dna的磷酸主链的负电荷与基底表面的正电荷涂层的静电相互作用或通过dna中的胸苷碱基与经处理的基底表面上的胺基团之间的uv交联共价键来将寡核苷酸附接至基底表面。在
一些实施方案中,基底是载玻片。在一些实施方案中,寡核苷酸(例如,捕获探针)通过与化学基质(例如环氧-硅烷、氨基-硅烷、赖氨酸、聚丙烯酰胺等)的共价键附接至基底。
[0483]
阵列也可通过原位合成来制备。在一些实施方案中,可使用光刻法制备这些阵列。所述方法通常依赖于基底上的uv掩蔽和光引导组合化学合成来直接在阵列表面上选择性地合成探针,每个点一次一个核苷酸,同时用于多个点。在一些实施方案中,基底含有在游离端上具有可通过光除去的保护基团的共价接头分子。uv光被引导通过光刻掩模,以用羟基脱保护和激活选定位点,所述羟基起始与附接至激活位点的引入受保护核苷酸的偶联。掩模以可选择暴露位点的方式设计,并且因此指定阵列上可附接每个核苷酸的坐标。可重复所述过程,施加新的掩模,激活不同的位点组并偶联不同的碱基,从而允许在每个位点构建任意寡核苷酸。此过程可用于合成成千上万的不同寡核苷酸。在一些实施方案中,可使用无掩模阵列合成器技术。它使用可编程微镜阵列来创建数字掩模,以反射所需的uv光图案,以使特征脱保护。
[0484]
在一些实施方案中,喷墨点样工艺也可用于原位寡核苷酸合成。不同的核苷酸前体加催化剂可印刷在基底上,然后与偶联和脱保护步骤组合。这种方法依赖于在重复轮次的逐碱基印刷中在阵列表面上印刷皮升体积的核苷酸,从而延长阵列上寡核苷酸探针的长度。
[0485]
也可通过电场的主动杂交来制备阵列,以控制核酸转运。当将正电流施加至阵列上的一个或多个测试位点时,可将带负电荷的核酸转运至特定位点或特征。阵列的表面可含有结合分子(例如链霉抗生物素蛋白),一旦电子寻址的生物素化探针到达它们的靶向位置,所述结合分子就允许形成键(例如,链霉抗生物素蛋白-生物素键)。然后从有源特征中除去正电流,并且可通过靶向施加正电流来激活新的测试位点。重复所述过程,直到阵列上的所有位点都被覆盖。
[0486]
用于空间分析的阵列可通过如本文所述的各种方法生成。在一些实施方案中,阵列具有多个包含空间条形码的捕获探针。可确定这些空间条形码及其与阵列上的位置的关系。在一些情况下,此类信息容易获得,因为寡核苷酸以预定模式在阵列上点样、印刷或合成。在一些情况下,可通过本文所述的方法,例如通过原位测序、通过与空间条形码相关的各种标记等使空间条形码解码。在一些实施方案中,可使用阵列作为模板来生成子阵列。因此,空间条形码可转移至具有已知模式的子阵列。
[0487]
在一些实施方案中,可通过连接多个寡核苷酸而生成包含带条形码的探针的阵列。在一些情况下,多个寡核苷酸含有条形码的一部分,并且在连接多个寡核苷酸时生成完整条形码。例如,可将含有条形码的第一部分的第一寡核苷酸附接至基底(例如,使用本文所述的将寡核苷酸附接至基底的任何方法),并且然后可将含有所述条形码的第二部分的第二寡核苷酸连接到第一寡核苷酸上以生成完整条形码。条形码的第一、第二和任何额外部分的不同组合可用于增加条形码的多样性。在第二寡核苷酸在连接之前也附接至基底的情况下,第一和/或第二寡核苷酸可通过含有裂解位点的表面接头附接至基底。连接后,连接的寡核苷酸通过在裂解位点处裂解而线性化。
[0488]
为了增加条形码的多样性,可将包含两个或更多个不同条形码序列的多个第二寡核苷酸连接至包含相同条形码序列的多个第一寡核苷酸上,从而生成两个或更多个不同种类的条形码。为了实现选择性连接,附接至含有条形码的第一部分的基底的第一寡核苷酸
最初可用保护基团(例如,光可裂解保护基团)保护,并且可在第一和第二寡核苷酸之间的连接之前除去所述保护基团。在阵列上的条形码探针通过连接两个或多个寡核苷酸产生的情况下,寡核苷酸的浓度梯度可施加至基底,使得寡核苷酸的不同组合根据其在基底上的位置并入带条形码的探针中。
[0489]
阵列上的带条形码的探针也可通过将单个核苷酸添加值阵列上的现有寡核苷酸来产生,例如使用以模板非依赖性方式起作用的聚合酶。可将单个核苷酸以浓度梯度添加至现有寡核苷酸,从而取决于探针在阵列上的位置而产生具有不同长度的探针。
[0490]
还可通过修饰现有阵列,例如通过修饰附接至阵列的寡核苷酸来制备阵列。例如,可在包含寡核苷酸的阵列上产生探针,所述寡核苷酸在3'端附接至阵列并且具有游离5'端。寡核苷酸可以是原位合成的寡核苷酸,并且可包含条形码。寡核苷酸的长度可小于50个核苷酸(nt)(例如,小于45、40、35、30、25、20、15或10nt)。为了使用这些寡核苷酸产生探针,与寡核苷酸的一部分互补的引物(例如,寡核苷酸所共有的恒定序列)可用于与寡核苷酸杂交并延伸(使用寡核苷酸作为模板)以形成双链体并产生3'突出端。因此,3'突出端允许将额外的核苷酸或寡核苷酸添加到双链体上。可通过例如将一个或多个寡核苷酸添加至3'突出端的末端(例如,通过夹板寡核苷酸介导的连接)来产生捕获探针,其中添加的寡核苷酸可包含捕获结构域的序列或序列的一部分。
[0491]
在现有阵列上的寡核苷酸包含可与夹板寡核苷酸杂交的识别序列的情况下,也可通过经由夹板寡核苷酸将额外的寡核苷酸直接连接至现有寡核苷酸上来产生探针。识别序列可在现有阵列上寡核苷酸的游离5'端或游离3'端。可用于本公开的方法的识别序列可不含限制酶识别位点或二级结构(例如,发夹),并且可包含高含量的鸟嘌呤和胞嘧啶核苷酸,并且因此具有高稳定性。
[0492]
可通过以规则图案或不规则排列将珠粒(例如,带条形码的珠粒)附接至基底来产生珠粒阵列。可通过例如选择性地激活基底上的区域以允许珠粒的附接而将珠粒附接至基底上的选择性区域。激活基底上的选择性区域可包括激活施加在基底上的涂层(例如,光可裂解涂层)或聚合物。珠粒可反复地附接,例如,珠粒的子集可一次附接,并且可重复相同过程来附接剩余的珠粒。可替代地,珠粒可在一个步骤中全部附接至基底。
[0493]
可通过首先在基底上制备多个带条形码的探针、将多个珠粒沉积在基底上并使用基底上的探针作为模板产生附接至珠粒的探针来产生带条形码的珠粒或包含多个带条形码的探针的珠粒。
[0494]
大规模商业制造方法允许将数百万个寡核苷酸连接至阵列。可商购的阵列包括来自roche nimblegen,inc.,(wisconsin)和affymetrix(thermofisher scientific)的阵列。
[0495]
在一些实施方案中,可根据wo 2012/140224、wo 2014/060483、wo 2016/162309、wo 2017/019456、wo 2018/091676和wo 2012/140224以及美国专利申请号2018/0245142中所述的方法制备阵列。前述文献的全部内容以引用的方式并入本文。
[0496]
c.捕获用于空间分析的分析物
[0497]
在本章节中,描述了用于捕获分析物的方法和系统的一般方面。单独的方法步骤和系统特征可组合存在于许多不同的实施方案中;本文所述的具体组合不以任何方式限制步骤和特征的其它组合。
[0498]
一般而言,当使生物样品与例如包含捕获探针或剂的基底(例如,具有包埋、点样、印刷在基底上的捕获探针的基底或具有包含捕获探针的特征(例如,珠粒、孔)的基底)接触时,可捕获分析物。
[0499]
如本文所用,使生物样品与包含特征的基底“接触(contact)”、“接触(contacted)”和/或“接触(contacting)”可指任何接触(例如,直接或间接),使得捕获探针可与来自生物样品的分析物相互作用(例如,捕获)。例如,基底可在没有直接物理接触的情况下靠近或邻近生物样品,但能够捕获来自所述生物样品的分析物。在一些实施方案中,使生物样品与基底直接物理接触。在一些方面,使分析物释放并且与捕获剂接近或接触。在一些实施方案中,使生物样品与基底间接物理接触。例如,液体层可位于生物样品与基底之间。在一些实施方案中,分析物扩散通过液体层。在一些实施方案中,捕获探针扩散通过液体层。在一些实施方案中,试剂可通过生物样品与基底之间的液体层递送。在一些实施方案中,间接物理接触可以是在生物样品与包括具有捕获探针的特征的第一基底之间存在第二基底(例如,水凝胶、薄膜、多孔膜)。在一些实施方案中,试剂可通过第二基底递送至生物样品。
[0500]
i.防扩散介质/盖
[0501]
为了通过促进分析物朝向空间标记的捕获探针扩散来提高效率,可使用防扩散介质。通常,生物分析物的分子扩散在所有方向上发生,包括朝向捕获探针(即朝向带空间条形码的阵列)和远离捕获探针(即进入本体溶液中)。增加朝向带空间条形码的阵列的扩散可减少分析物扩散远离带空间条形码的阵列,并提高捕获探针的捕获效率。
[0502]
在一些实施方案中,将生物样品置于带空间条形码基底的顶部,并且将防扩散介质置于生物样品的顶部。例如,可将防扩散介质置于已经放置成与生物样品接触的阵列上。在一些实施方案中,防扩散介质和空间标记阵列是同一部件。例如,防扩散介质可在防扩散介质(例如,盖玻片、载玻片、水凝胶或膜)之内或之上含有空间标记的捕获探针。在一些实施方案中,将样品置于基底上,并且将防扩散介质置于生物样品的顶部。此外,可将带空间条形码的捕获探针阵列紧密靠近地放置在防扩散介质上方。例如,可将防扩散介质夹在空间标记的阵列与基底上的样品之间。在一些实施方案中,将防扩散介质布置或点样到样品上。在其它实施方案中,将防扩散介质放置成与样品紧密靠近。
[0503]
通常,防扩散介质可以是已知限制生物分析物的扩散性的任何材料。例如,防扩散介质可以是实心盖(例如,盖玻片或载玻片)。在一些实施方案中,防扩散介质可由玻璃、硅、纸、水凝胶聚合物整料或其它材料制成。在一些实施方案中,玻璃面可以是丙烯酸化载玻片。在一些实施方案中,防扩散介质是多孔膜。在一些实施方案中,材料可以是天然多孔的。在一些实施方案中,材料可具有蚀刻到固体材料中的孔隙或孔。在一些实施方案中,可操纵孔径以使靶分析物的损失最小化。在一些实施方案中,可操纵膜化学以使靶分析物的损失最小化。在一些实施方案中,防扩散介质(即水凝胶)共价附接至基底(即载玻片)。在一些实施方案中,防扩散介质可以是已知限制poly(a)转录物的扩散性的任何材料。在一些实施方案中,防扩散介质可以是已知限制蛋白质的扩散性的任何材料。在一些实施方案中,防扩散介质可以是已知限制大分子成分的扩散性的任何材料。
[0504]
在一些实施方案中,防扩散介质包括一种或多种防扩散介质。例如,一种或多种防扩散介质可在使介质与生物样品接触之前以多种方式组合,包括但不限于涂覆、分层或点
样。作为另一个实例,可将水凝胶放置到生物样品上,然后将盖(例如,载玻片)放置在水凝胶的顶部。
[0505]
在一些实施方案中,施加力(例如,流体动力压力、超声振动、溶质对比、微波辐射、血管循环或其它电、机械、磁、离心和/或热力)以控制扩散并增强分析物捕获。在一些实施方案中,一种或多种力和一种或多种防扩散介质用于控制扩散并增强捕获。例如,离心力和载玻片可同时使用。可使用力和防扩散介质的多种组合中的任一种来控制或减轻扩散并增强分析物捕获。
[0506]
在一些实施方案中,将防扩散介质连同带空间条形码的阵列和样品一起浸没在本体溶液中。在一些实施方案中,本体溶液包含透化试剂。在一些实施方案中,防扩散介质包含至少一种透化试剂。在一些实施方案中,在使防扩散介质与样品接触之前,将防扩散介质(即水凝胶)浸泡在透化试剂中。在一些实施方案中,防扩散介质可包括含有透化缓冲液或试剂的孔(例如,微孔、纳米孔或微微孔)。在一些实施方案中,防扩散介质可包含透化试剂。在一些实施方案中,防扩散介质可含有干燥试剂或单体,以在将防扩散介质施加至生物样品时递送透化试剂。在一些实施方案中,在将组件浸没在本体溶液中之前,将防扩散介质添加至带空间条形码的阵列和样品组件中。在一些实施方案中,在样品已经暴露于透化试剂之后,将防扩散介质添加至带空间条形码的阵列和样品组件中。在一些实施方案中,使透化试剂流动通过防扩散介质上方的微流体室或通道。在一些实施方案中,流动控制样品对透化试剂的接近。在一些实施方案中,靶分析物从样品中扩散出来并朝向本体溶液扩散,并且包埋在包埋空间标记的捕获探针的防扩散介质中。在一些实施方案中,游离溶液夹在生物样品与防扩散介质之间。
[0507]
图18是防扩散介质的示例性使用的图示。可使防扩散介质1802与样品1803接触。在图18中,载玻片1804填充有带空间条形码的捕获探针1806,并且使样品1803、1805与阵列1804、1806接触。可将防扩散介质1802施加至样品1803,其中样品1803夹在防扩散介质1802与捕获探针涂覆的载玻片1804之间。当将透化溶液1801施加至样品时,使用防扩散介质/盖1802通过减少分析物向外扩散到介质中来引导分析物1805向捕获探针1806迁移。可替代地,盖可含有透化试剂。
[0508]
ii.用于捕获的条件
[0509]
基底上(或基底上的特征上)的捕获探针通过在别处描述的捕获结构域与释放的分析物相互作用,以捕获分析物。在一些实施方案中,进行某些步骤以增强阵列的捕获探针对分析物的转移或捕获。此类修改的实例包括但不限于调整用于使基底与生物样品接触的条件(例如,时间、温度、取向、ph水平、生物样品的预处理等),使用力来运输分析物(例如,电泳、离心、机械等),进行扩增反应以增加生物分析物的量(例如,pcr扩增、原位扩增、克隆扩增),和/或使用标记的探针用于检测扩增子和条形码。
[0510]
在一些实施方案中,通过用透化试剂处理生物样品来促进对分析物的捕获。如果生物样品未充分透化,则捕获在基底上的分析物的量可能太低而不能进行充分分析。相反,如果生物样品的渗透性太强,则分析物可能远离其在生物样品中的来源扩散,使得生物样品内分析物的相对空间关系丧失。因此,在使生物样品足够透化以获得良好信号强度同时仍保持生物样品中分析物分布的空间分辨率之间的平衡是所需的。制备生物样品以促进的方法在本领域中是已知的并且可根据生物样品和生物样品的制备方式(例如,新鲜冷冻、
ffpe等)进行修改。
[0511]
iii.被动捕获方法
[0512]
在一些实施方案中,分析物可从样品迁移至基底。用于促进迁移的方法可以是被动的(例如,扩散)和/或主动的(例如,核酸的电泳迁移)。被动迁移的非限制性实例可包括由脱水物体再水化产生的简单扩散和渗透压。
[0513]
通过扩散被动迁移使用浓度梯度。扩散是不受束缚的物体朝向平衡的移动。因此,当存在高物体浓度的区域和低物体浓度的区域时,物体(捕获探针、分析物等)移动至浓度较低的区域。在一些实施方案中,不受束缚的分析物沿浓度梯度向下移动。
[0514]
在一些实施方案中,可将不同的试剂添加至生物样品,使得生物样品再水合,同时提高分析物的捕获。在一些实施方案中,可用透化试剂使生物样品再水合。在一些实施方案中,可用染色溶液(例如苏木精和伊红染色剂)使生物样品再水合。
[0515]
iv.主动捕获方法
[0516]
在本文所述的任何方法的一些实例中,可使细胞或生物样品中的分析物转运(例如,被动地或主动地)至捕获探针(例如,固定至固体表面的捕获探针)。
[0517]
例如,可使用电场(例如,使用电泳)、压力梯度、流体流动、化学浓度梯度、温度梯度和/或磁场使细胞或生物样品中的分析物转运至捕获探针(例如,固定化捕获探针)。例如,可通过例如凝胶(例如,水凝胶基质)、流体或透化细胞使分析物转运至捕获探针(例如,固定化捕获探针)。
[0518]
在一些实例中,可将电泳场施加至分析物以促进分析物朝向捕获探针迁移。在一些实施方案中,样品接触基底和固定在基底(例如,载玻片、盖玻片或珠粒)上的捕获探针,并且施加电流以促进带电分析物朝向固定在基底上的捕获探针的定向迁移。电泳组件可用于施加电流,其中使细胞或生物样品与阴极和捕获探针(例如,固定在基底上的捕获探针)接触,并且其中使捕获探针(例如,固定在基底上的捕获探针)与细胞或生物样品和阳极接触。
[0519]
分析物的电泳转移可在保持样品中分析物的相对空间排列的同时进行。因此,由捕获探针(例如,固定在基底上的捕获探针)捕获的分析物保留细胞或生物样品的空间信息。向分析物施加电泳场还可导致温度升高(例如,热量)。在一些实施方案中,升高的温度(例如,热量)可促进分析物朝向捕获探针迁移。
[0520]
在一些实例中,空间可寻址微电极阵列用于通过捕获探针对至少一种目标带电分析物进行空间受限的捕获。微电极阵列可被配置为包括高密度的离散位点,所述位点具有用于施加电场以促进目标带电分析物的迁移的小面积。例如,可使用空间可寻址微电极阵列在目标区域上进行电泳捕获。
[0521]
微电极阵列上的高密度离散位点可用于小型装置。表面可包括任何合适密度的离散位点(例如,适合于在给定量的时间内加工导电基底上的样品的密度)。在一个实施方案中,表面具有大于或等于约500个位点/1mm2的离散位点密度。在一些实施方案中,表面具有约100、约200、约300、约400、约500、约600、约700、约800、约900、约1,000、约2,000、约3,000、约4,000、约5,000、约6,000、约7,000、约8,000、约9,000、约10,000、约20,000、约40,000、约60,000、约80,000、约100,000或约500,000个位点/1mm2的离散位点密度。在一些实施方案中,表面具有至少约200、至少约300、至少约400、至少约500、至少约600、至少约700、
至少约800、至少约900、至少约1,000、至少约2,000、至少约3,000、至少约4,000、至少约5,000、至少约6,000、至少约7,000、至少约8,000、至少约9,000、至少约10,000、至少约20,000、至少约40,000、至少约60,000、至少约80,000、至少约100,000或至少约500,000个位点/1mm2的离散位点密度。
[0522]
示出被配置为将转录物分析物引导朝向带空间条形码的捕获探针阵列的电泳转移系统的示意图在图19a和图19b中示出。在电泳系统的这种示例性配置中,样品1902夹在阴极1901与带空间条形码的捕获探针阵列1904、1905之间,并且带空间条形码的捕获探针阵列1904、1905夹在样品1902与阳极1903之间,使得样品1902、1906与带空间条形码的捕获探针1907接触。当向电泳转移系统施加电场时,带负电荷的mrna分析物1906将被拉向带正电荷的阳极1903并进入含有带空间条形码的捕获探针1907的带空间条形码的阵列1904、1905中。带空间条形码的捕获探针1907然后与mrna靶分析物1906相互作用/杂交/固定所述靶分析物,从而使分析物捕获更有效。电泳系统设置可取决于靶分析物而改变。例如,蛋白质可以是阳性、阴性、中性或极性的,这取决于蛋白质以及其它因素(例如等电点、溶解度等)。熟练的从业人员具有布置电泳转移系统以促进特定靶分析物的捕获的知识和经验。
[0523]
图20是示出利用电泳转移系统的示例性工作流程方案的说明。在实例中,图a描绘与样品接触的柔性带空间条形码特征阵列。样品可以是柔性阵列,其中阵列被固定在水凝胶、膜或其它柔性基底上。图b描绘阵列与样品的接触以及阵列-样品组件的成像。样品/阵列组件的图像可用于验证样品放置、选择目标区域或如本文所述对阵列上的样品进行成像的任何其它原因。图c描绘使用电泳转移系统施加电场以帮助有效捕获靶分析物。在此,带负电荷的mrna靶分析物朝向带正电荷的阳极迁移。图d描绘逆转录试剂的施加和捕获的靶分析物的第一链cdna合成。图e描绘用于文库构建(图f)和下一代测序(图g)的阵列移除和制备。
[0524]
d.目标区域
[0525]
生物样品可具有显示可能表明疾病的存在或疾病表型的发展的形态特征的区域。例如,肿瘤活检样品内特定位点的形态学特征可指示受试者中癌症的侵袭性、治疗抗性、转移潜力、迁移、分期、诊断和/或预后。肿瘤活检样品中特定位点的形态学特征的变化通常与特定位点内细胞中的分析物的水平或表达的变化相关,其进而可用于提供有关受试者中癌症的侵袭性、治疗抗性、转移潜力、迁移、分期、诊断和/或预后的信息。选择用于特定分析的生物样品内的区或区域(例如,生物样品中具有目标形态特征的区域)通常被描述为“目标区域”。可在本文所述的原位测定和/或空间测定之前、同时和/或之后鉴定、检测、观察、分析目标区域。在一些情况下,可进行行一个或多个显微术步骤以在本文所述的原位测定和/或空间测定之前、期间和/或之后对生物样品进行可视化或成像。例如,任何合适的成像如明场和/或荧光成像可用于使染色或未染色的生物样品(例如苏木精、伊红、dapi等)可视化。
[0526]
生物样品中的目标区域可用于分析生物样品内的特定目标区域,并且由此将实验和数据收集集中至生物样品的特定区域(而不是整个生物样品)。这导致生物样品的分析的时间效率提高。
[0527]
可使用多种不同的技术鉴定生物样品中的目标区域,所述技术例如膨胀显微术、明场显微术、暗场显微术、相差显微术、电子显微术、荧光显微术、反射显微术、干涉显微术、
共聚焦显微术和视觉鉴定(例如,通过眼睛)以及它们的组合。例如,可进行生物样品的染色和成像以鉴定目标区域。在一些实例中,目标区域可对应于细胞结构的特定结构。在一些实施方案中,可在可视化之前对生物样品进行染色以提供生物样品的不同区域之间的对比。可根据生物样品的类型和待染色的细胞区域来选择染色的类型。在一些实施方案中,可使用多于一种染色剂来可视化生物样品的不同方面,例如样品的不同区域、特定细胞结构(例如,细胞器)或不同细胞类型。在其它实施方案中,可在不染色生物样品的情况下对生物样品进行可视化或成像。
[0528]
在一些实施方案中,可使用一个或多个基准标记物(即,在所产生的图像中出现的放置在成像系统的视野中的物体)来进行成像。基准标记物通常用作参考点或测量标尺。基准标记物可包括但不限于可检测标记,如荧光、放射性、化学发光和比色标记。使用基准标记物来稳定和定向生物样品例如在carter等人,applied optics 46:421-427,2007)进行了中描述,所述文献的全部内容以引用的方式并入本文。在一些实施方案中,基准标记物可以是物理粒子(例如,纳米粒子、微球、纳米球、珠粒或本文所述或本领域已知的任何其它示例性物理粒子)。
[0529]
在一些实施方案中,基准标记物可存在于基底上以提供生物样品的定向。在一些实施方案中,微球可与基底偶联以有助于生物样品的定向。在一些实施方案中,与基底偶联的微球可产生光学信号(例如,荧光)。在另一个实例中,微球可以特定图案或设计(例如,六边形设计)附接至阵列的一部分(例如,角落),以有助于生物样品在基底上的特征阵列上的定向。在一些实施方案中,量子点可偶联至基底以有助于生物样品的定向。在一些实例中,与基底偶联的量子点可产生光学信号。
[0530]
在一些实施方案中,基准标记物可以是固定化分子,可检测信号分子可与所述固定的分子相互作用以产生信号。例如,标记物核酸可连接或偶联至当经受特定波长(或波长范围)的光时能够发荧光的化学部分。这种标记物核酸分子可在对组织样品染色以使组织切片可视化或成像之前、同时或之后与阵列接触。尽管不是必需的,但是使用可使用用于检测标记的cdna的相同条件(例如,成像条件)来检测的标记物可能是有利的。
[0531]
在一些实施方案中,包括基准标记物以有助于组织样品或其图像相对于基底上的固定化捕获探针的定向。可使用任何数量的用于标记阵列的方法,使得仅在对组织切片进行成像时才可检测到标记物。例如,分子(例如产生信号的荧光分子)可直接或间接地固定在基底的表面上。可以图案(例如,边缘、一个或多个行、一条或多条线等)在基底上提供标记物。
[0532]
在一些实施方案中,基准标记物可随机放置在视野中。例如,可将含有荧光团的寡核苷酸在基底上的随机位置处随机印刷、压印、合成或附接至基底(例如载玻片)。可使组织切片与基底接触,使得含有荧光团的寡核苷酸接触或接近来自组织切片的细胞或细胞的组分(例如,mrna或dna分子)。可获得基底和组织切片的图像,并且可确定荧光团在组织切片图像内的位置(例如,通过查看覆盖有荧光团检测的组织切片的光学图像)。在一些实施方案中,基准标记物可精确地放置在视场中(例如,在基底上的已知位置处)。在这种情况下,基准标记物可在基底上压印、附接或合成并与生物样品接触。通常,拍摄样品和基准标记物的图像,并且可通过查看图像来确认基准标记物在基底上的位置。
[0533]
在一些实施方案中,基准标记物可以是附接至基底的固定化分子(例如,物理粒
子)。例如,基准标记物可以是纳米粒子,例如纳米棒、纳米线、纳米立方体、纳米锥体或球形纳米粒子。在一些实例中,纳米粒子可由重金属(例如,金)制成。在一些实施方案中,纳米粒子可由金刚石制成。在一些实施方案中,基准标记物可以是肉眼可见的。示例性基准标记物及其用途(例如,用于空间分析)例如在wo 2020/047002、wo 2020/047004、wo 2020/047005、wo 2020/047007、wo 2020/047010和wo2020/123320中公开,其全部以引用的方式整体并入本文。
[0534]
在一些实施方案中,原位测定模块可提供用于本文公开的整合方法的空间测定模块的一种或多种基准标记物,例如,如章节viii中所述。在一些实施方案中,在原位分析中提供探针靶向的第一分析物可提供用于随后空间测定模块中的一种或多种分析物的分子基准标记物。例如,第一核酸、互补序列、与原位测定模块中的第一核酸直接或间接杂交的探针、所述探针的连接产物和/或所述探针的扩增产物(例如,rca产物)可首先在原位测定模块中进行分析,然后捕获在基底上进行空间分析。捕获的分子与原位信号相关,并且可充当空间参考,以提供有关待在空间测定模块中进行分析、但尚未通过一个或多个探针靶向和/或在原位测定模块中进行分析的一种或多种其它分析物(例如,核酸分子)的信息。
[0535]
在一些实施方案中,在使生物样品与空间阵列接触之前对生物样品进行染色和成像以选择用于空间分析的样品。在一些实施方案中,染色包括施加如上所述的基准标记物,包括荧光、放射性、化学发光或比色可检测标记物。在一些实施方案中,生物样品的染色和成像允许用户鉴定用户所希望评估的特定样品(或目标区域)。
[0536]
在一些实施方案中,处理基底以最小化或减少特征内或特征之间的非特异性分析物杂交。例如,处理可包括用对非特异性杂交产生物理屏障的水凝胶、薄膜和/或膜涂覆基底。可使用任何合适的水凝胶。例如,可使用根据美国专利号6,391,937、9,512,422和9,889,422以及美国专利申请公布号u.s.2017/0253918和u.s.2018/0052081中所述的方法制备的水凝胶基质。前述文献中的每一个的全部内容以引用的方式并入本文。
[0537]
处理可包括添加反应性或能够被激活的官能团,使得其在接受刺激后变为反应性(例如,光反应性)。处理可包括用具有一种或多种物理性质(例如,机械、电、磁和/或热)的聚合物处理,所述物理性质使非特异性结合最小化(例如,在某些位置激活基底以允许在那些位置进行分析物杂交)。
[0538]
在一些实例中,阵列(例如,本文所述的任何示例性阵列)可仅与生物样品(例如,细胞、特征或目标区域)的一部分接触。在一些实例中,生物样品仅与阵列(例如,本文所述的任何示例性阵列)的一部分接触。在一些实施方案中,可使阵列的一部分去激活,以使其不与生物样品中的分析物相互作用(例如,阵列中捕获探针的光学去激活、化学去激活、热去激活或封闭(例如,使用封闭探针))。在一些实例中,可从生物样品中除去目标区域,然后可使目标区域与阵列(例如,本文所述的任何阵列)接触。可使用显微外科手术、激光捕获显微切割、分块、切片机、切丁、胰蛋白酶消化、标记和/或荧光辅助细胞分选来从生物样品中除去目标区域。在一些实施方案中,目标区域的分析物或其衍生物(例如,与分析物相关的带条形码分子)可从样品中除去并进行分析。
[0539]
viii.标记的和/或捕获的分析物的分析
[0540]
在来自样品的分析物已经与捕获探针、分析物捕获剂或其它带条形码的寡核苷酸序列杂交或以其它方式缔合后,根据上文结合一般基于空间细胞的分析方法描述的任何方
法,通过测序对由杂交/缔合产生的带条形码的构建体进行分析以鉴定分析物。
[0541]
在样品通过与同细胞表面杂交、结合或缔合或引入细胞中的捕获探针或分析物捕获剂杂交而直接进行空间条形编码的一些实施方案中,如上所述,可对完整样品进行测序。
[0542]
多种不同的测序方法可用于分析带条形码的分析物构建体。一般而言,所测序的多核苷酸可以是例如核酸分子,如脱氧核糖核酸(dna)或核糖核酸(rna),包括其变体或衍生物(例如,单链dna或dna/rna杂合体,以及具有核苷酸类似物的核酸分子)。
[0543]
多核苷酸的测序可通过各种商业系统进行。更一般地,可使用核酸扩增、聚合酶链反应(pcr)(例如,数字pcr和微滴数字pcr(ddpcr)、定量pcr、实时pcr、多重pcr、基于pcr的单重法、乳液pcr)和/或等温扩增进行测序。
[0544]
用于对遗传物质进行测序的方法的其它实例包括但不限于dna杂交方法(例如,dna印迹)、限制酶消化方法、桑格测序方法、下一代测序方法(例如,单分子实时测序、纳米孔测序和聚合酶克隆测序(polony sequencing))、连接方法和微阵列方法。可使用的测序方法的另外实例包括靶向测序、单分子实时测序、外显子测序、基于电子显微术的测序、panel测序、晶体管介导的测序、直接测序、随机鸟枪法测序、桑格双脱氧终止测序、全基因组测序、杂交测序、焦磷酸测序、毛细管电泳、凝胶电泳、双重测序、循环测序、单碱基延伸测序、固相测序、高通量测序、大规模平行签名测序、低变性温度共扩增-pcr(cold-pcr)、通过可逆染料终止子测序、双末端测序、近期测序、核酸外切酶测序、连接法测序、短读长测序、单分子测序、合成法测序、实时测序、反向终止子测序、纳米孔测序、454测序、solexa基因组分析仪测序、solid
tm
测序、ms-pet测序以及它们的任何组合。
[0545]
核酸分子(包括带条形码的核酸分子或其衍生物)的序列分析可以是直接的或间接的。因此,序列分析底物(其可被视为经受序列分析步骤或过程的分子)可直接是带条形码的核酸分子,或者它可以是源自其的分子(例如,其互补序列)。因此,例如,在测序反应的序列分析步骤中,测序模板可以是带条形码的核酸分子,或者它可以是源自其的分子。例如,第一和/或第二链dna分子可直接进行序列分析(例如测序),即可直接参与序列分析反应或过程(例如测序反应或测序过程,或者是已进行测序或以其它方式鉴定的分子)。可替代地,带条形码的核酸分子可在序列分析(例如测序或通过另一种技术鉴定)之前进行第二链合成或扩增的步骤。序列分析底物(例如,模板)因此可以是扩增子或带条形码的核酸分子的第二链。
[0546]
在一些实施方案中,可对双链分子的两条链进行序列分析(例如,测序)。在一些实施方案中,可对单链分子(例如带条形码的核酸分子)进行分析(例如测序)。为了进行单分子测序,可在3'端对核酸链进行修饰。
[0547]
如上所述,大规模平行测序技术可用于对核酸进行测序。在一个实施方案中,大规模平行测序技术可基于可逆染料终止子。作为一个实例,首先将dna分子附接至例如玻璃或硅基底上的引物,并且扩增,使得形成局部克隆集落(桥式扩增)。添加了四种类型的ddntp,并且未并入的核苷酸被洗掉。与焦磷酸测序不同,由于封闭基团(例如,ddntp的糖部分上存在的3'封闭基团),dna一次仅延伸一个核苷酸。检测器获取荧光标记核苷酸的图像,然后将染料与末端3'封闭基团一起从dna中化学除去,作为后续循环的前体。可重复此过程,直到获得所需的序列数据。
[0548]
作为另一个实例,大规模平行焦磷酸测序技术还可用于对核酸进行测序。在焦磷
酸测序中,使核酸在油溶液中的水滴内扩增(乳液pcr),其中每个微滴含有附接至然后形成克隆集落的单一引物包被的珠粒的单个核酸模板。测序系统含有许多皮升体积的孔,每个孔含有单个珠粒和测序酶。焦磷酸测序使用荧光素酶来产生光以检测添加至新生核酸中的单独核苷酸,并且组合数据用于生成序列读数。
[0549]
作为焦磷酸测序的另一种示例性应用,可通过经由atp硫酸化酶立即转化为腺苷三磷酸(atp)来检测所释放的ppi,并且所产生的atp的水平可通过荧光素酶产生的光子来检测,如ronaghi等人,anal.biochem.242(1),84-9(1996);ronaghi,genome res.11(1),3-11(2001);ronaghi等人science 281(5375),363(1998);和美国专利号6,210,891、6,258,568和6,274,320中所描述,所述文献各自的全部内容以引用的方式并入本文。
[0550]
在一些实施方案中,通过检测在dna聚合期间释放的氢离子来进行测序。含有待测序的模板dna链的微孔可充满单一类型的核苷酸。如果引入的核苷酸与前导模板核苷酸互补,则将其并入生长互补链中。这导致释放氢离子,所述氢离子触发超灵敏离子传感器,这表明已经发生了反应。如果模板序列中存在均聚物重复,则将在单个循环中并入多个核苷酸。这导致相应数量的释放的氢离子和比例更高的电子信号。
[0551]
在捕获探针不包空间条形码的一些实施方案中,可在捕获探针捕获来自生物样品的分析物之后和分析物的分析之前添加空间条形码。当捕获分析物后添加空间条形码时,可在扩增分析物后添加条形码。在一些实施方案中,在分析物中核酸(例如,dna或rna)序列扩增后添加空间条形码,并且分析物可包括样品中的内源性核酸(例如,dna或rna)分子(例如,在原位测定模块之前存在于样品中的dna或rna分子)、在原位测定模块期间添加至样品的dna或rna分子(例如,直接或间接地杂交/结合至分析物的探针或标记剂)、在原位测定模块中产生的dna或rna分子(例如,逆转录产物、聚合酶延伸产物、连接产物如模板化连接产物和/或扩增产物如rca产物品)。在一些实施方案中,在rna的逆转录和cdna的聚合酶扩增之后添加空间条形码)。在一些实施方案中,分析物分析使用一种或多种捕获的分析物的直接测序,如样品中的内源性核酸(例如,dna或rna)分子(例如,在原位测定模块之前存在于样品中的dna或rna分子)、在原位测定模块期间添加至样品的dna或rna分子(例如,直接或间接地杂交/结合至分析物的探针或标记剂)、在原位测定模块中产生的dna或rna分子(例如,逆转录产物、聚合酶延伸产物、连接产物如模板化连接产物和/或扩增产物如rca产物品)的直接测序。在一些实施方案中,在捕获的rna的逆转录之后进行直接测序。在一些实施方案中,在捕获的rna的逆转录的扩增之后进行直接测序。
[0552]
在一些实施方案中,通过合成法测序(sbs)进行一种或多种捕获的分析物的直接测序。在一些实施方案中,测序引物与捕获探针的一个或多个结构域(例如,功能结构域)中的序列互补。在此类实施方案中,合成法测序可包括逆转录和/或扩增以产生模板序列(例如,功能结构域),引物序列可从所述模板序列结合。
[0553]
sbs可涉及将适当的引物(有时称为测序引物)与待测序的核酸模板杂交,延伸引物,并检测用于使引物延伸的核苷酸。优选地,用于使引物延伸的核酸在另一核苷酸被添加至生长核酸链之前检测,从而允许逐碱基原位核酸测序。通过在引物延伸反应中包括一个或多个标记的核苷酸来促进并入核苷酸的检测。为了允许适当的测序引物与待测序的核酸模板杂交,核酸模板通常应呈单链形式。如果构成核酸点的核酸模板以双链形式存在,则可使用本领域众所周知的方法,例如通过变性、裂解等,对这些进行加工以提供单链核酸模
板。与核酸模板杂交并用于引物延伸的测序引物优选地是短寡核苷酸,例如长度为15至25个核苷酸。测序引物可以溶液或以固定化形式提供。一旦通过使核酸模板和测序引物经受适当的条件而已使测序引物与待测序的核酸模板退火,就进行引物延伸,例如使用核酸聚合酶和核苷酸供应,其中的至少一些以标记的形式提供,并且如果提供了合适的核苷酸,则适用于引物延伸的条件。
[0554]
优选地,在每个引物延伸步骤之后,包括洗涤步骤以除去可能干扰后续步骤的未并入的核苷酸。一旦进行了引物延伸步骤,就监测核酸集落以确定标记的核苷酸是否已并入延伸的引物中。然后可重复引物延伸步骤以确定并入延伸的引物中的下一个和后续核苷酸。如果所确定的序列是未知的,则施加至给定集落的核苷酸通常以选定顺序施加,然后在整个分析过程中重复,例如datp、dttp、dctp、dgtp。
[0555]
描述了可使用的sbs技术,例如但不限于美国专利申请公布号2007/0166705、美国专利申请公布号2006/0188901、美国专利7,057,026、美国专利申请公布号2006/0240439、美国专利申请公布号2006/0281109、pct专利申请公布号wo 05/065814、美国专利申请公布号2005/0100900、pct专利申请公布号wo 06/064199、pct专利申请公布号wo07/010,251、美国专利申请公布号2012/0270305、美国专利申请公布号2013/0260372和美国专利申请公布号2013/0079232中的那些,所述文献各自的全部内容以引用的方式并入本文。
[0556]
在一些实施方案中,通过顺序荧光杂交(例如,杂交测序)进行捕获的rna的直接测序。在一些实施方案中,rna与捕获探针杂交的杂交反应在原位进行。在一些实施方案中,捕获的rna在与测序探针杂交之前不进行扩增。在一些实施方案中,rna在与测序探针杂交之前进行扩增(例如,逆转录成cdna和扩增cdna)。在一些实施方案中,使用单分子杂交链式反应进行扩增。在一些实施方案中,使用滚环扩增进行扩增。
[0557]
顺序荧光杂交可涉及包含简并引物序列和可检测标记的探针的顺序杂交。简并引物序列是能够与任何核酸片段杂交的短寡核苷酸序列,而与所述核酸片段的序列无关。例如,这种方法可包括以下步骤:(a)提供包含四个探针的混合物,所述探针各自在5'-末端包含a、c、g或t,还包含长度为5至11个核苷酸的简并核苷酸序列,并且还包含功能结构域(例如,荧光分子),所述功能结构域对于在5'-末端具有a、c、g或t的探针是不同的;(b)将步骤(a)的探针与靶多核苷酸序列相关联,其序列需求将通过此方法确定;(c)测量四个功能结构域的活性并记录活性的相对空间位置;(d)从靶多核苷酸序列中除去来自步骤(a)-(b)的试剂;并且重复步骤(a)-(d)持续n个循环,直到确定每个珠粒的空间结构域的核苷酸序列,修改为步骤(a)中使用的寡核苷酸与靶多核苷酸序列的部分互补,并且位置1至n位于序列部分的两侧。因为条形码序列不同,所以在一些实施方案中,这些额外的侧翼序列是简并序列。来自阵列上每个点的循环1至n的荧光信号可用于确定靶多核苷酸序列的序列。
[0558]
在一些实施方案中,使用顺序荧光杂交对捕获的rna的直接测序在体外进行。在一些实施方案中,捕获的rna在与测序探针杂交之前进行扩增(例如,逆转录成cdna和扩增cdna)。在一些实施方案中,将含有捕获的rna的捕获探针暴露于靶向rna的编码区的测序探针。在一些实施方案中,使一个或多个测序探针靶向每个编码区。在一些实施方案中,测序探针被设计成与测序试剂(例如,染料标记的读出寡核苷酸)杂交。测序探针然后可与测序试剂杂交。在一些实施方案中,对来自测序反应的输出进行成像。在一些实施方案中,特定cdna序列从测序反应的图像中分辨。在一些实施方案中,捕获的rna的逆转录在与测序探针
杂交之前进行。在一些实施方案中,测序探针被设计成靶向rna的编码区的互补序列(例如,靶向cdna)。
[0559]
在一些实施方案中,使用基于纳米孔的方法对捕获的rna进行直接测序。在一些实施方案中,使用纳米孔直接rna测序进行直接测序,其中捕获的rna易位通过纳米孔。可记录纳米孔电流并将其转换为碱基序列。在一些实施方案中,捕获的rna在纳米孔测序期间保持附接至基底。在一些实施方案中,捕获的rna在纳米孔测序之前从基底释放。在目标分析物为蛋白质的一些实施方案中,可使用基于纳米孔的方法进行蛋白质的直接测序。可使用的基于纳米孔的测序方法的实例在deamer等人,trends biotechnol.18,14 7-151(2000);deamer等人,acc.chem.res.35:817-825(2002);li等人,nat.mater.2:611-615(2003);soni等人,clin.chem.53,1996-2001(2007);healy等人,nanomed.2,459-481(2007);cockroft等人,j.am.chem.soc.130,818-820(2008);以及美国专利7,001,792中进行了描述。前述参考文献中的每一个的全部内容以引用的方式并入本文。
[0560]
在一些实施方案中,使用单分子连接法测序进行捕获的rna的直接测序。此类技术利用dna连接酶来并入寡核苷酸并鉴定此类寡核苷酸的并入。寡核苷酸通常具有与寡核苷酸所杂交的序列中特定核苷酸的身份相关的不同标记。连接法测序中涉及的方面和特征在例如shendure等人science(2005),309:1728-1732和美国专利号5,599,675;5,750,341;6,969,488;6,172,218;和6,306,597中进行了描述,所述参考文献各自的全部内容以引用的方式并入本文。
[0561]
在一些实施方案中,核酸杂交可用于测序。这些方法利用与条形码序列的至少一部分互补的标记的核酸解码器探针。多重解码可使用具有可区分标记的许多不同探针的库来进行。核酸杂交测序的非限制性实例在例如美国专利号8,460,865和gunderson等人,genome research 14:870-877(2004)中进行了描述,所述参考文献各自的全部内容以引用的方式并入本文。
[0562]
在一些实施方案中,商业高通量数字测序技术可用于分析条形码序列,其中制备dna模板用于测序不是一次一个,而是在批量过程中,并且其中优选并行读出许多序列,或者可替代地使用本身可并行化的超高通量串行过程。此类技术的实例包括测序(例如,基于流动池的测序技术)、使用经修饰核苷酸的合成法测序(如由illumina,inc.,san diego,ca以truseq
tm
和hiseq
tm
技术商业化)、helicos biosciences corporation,cambridge,ma的heliscope
tm
和pacific biosciences of california,inc.,menlo park,ca)的pacbio rs、通过离子检测技术测序(ion torrent,inc.,south san francisco,ca)和dna纳米球的测序(complete genomics,inc.,mountain view,ca)。
[0563]
在一些实施方案中,检测在将核苷酸并入延伸产物时释放的质子可用于本文所述的方法中。例如,美国专利申请公布号2009/0026082、2009/0127589、2010/0137143和2010/0282617中描述的测序方法和系统可用于对条形码进行直接测序。
[0564]
在一些实施方案中,可在测序期间使用dna聚合酶活性的实时监测。例如,可通过荧光共振能量转移(fret)检测核苷酸并入,如例如在levene等人,science(2003),299,682-686;lundquist等人,opt.lett.(2008),33,1026-1028和korlach等人,proc.natl.acad.sci.usa(2008),105,1176-1181中所描述。前述参考文献中的每一个的全部内容以引用的方式并入本文。
[0565]
在一些实施方案中,本文所述的方法可用于评估随时间推移细胞或生物样品中的分析物水平和/或表达(例如,在用剂处理之前或之后或不同分化阶段)。在一些实例中,本文所述的方法可对在不同时间点(例如,在用剂处理之前或之后、不同分化阶段、不同疾病进展阶段、不同受试者年龄,或在对剂发展耐药性之前或之后)从受试者获得的多个相似的生物样品或细胞进行。
[0566]
在一些实施方案中,查找表(lut)可用于将特征的一种性质与另一中性质相关联。这些性质包括例如位置、条形码(例如,核酸条形码分子)、空间条形码、光学标签、分子标签和其它性质。
[0567]
在一些实施方案中,查找表可将多个核酸条形码分子与特征相关联。在一些实施方案中,特征的光学标记可允许将所述特征与生物粒子(例如,细胞或细胞核)相关联。特征与生物粒子的关联可进一步允许将生物粒子的核酸分子的核酸序列与生物粒子的一种或多种物理性质(例如,细胞的类型或细胞的位置)相关联。例如,基于条形码与光学标记之间的关系,光学标记可用于确定特征的位置,从而将特征的位置与特征的条形码序列相关联。后续分析(例如,测序)可将条形码序列与来自样品的分析物相关联。因此,基于位置与条形码序列之间的关系,可确定生物分析物的位置(例如,在特定类型的细胞中,在生物样品的特定位置的细胞中)。
[0568]
在一些实施方案中,特征可具有附接至其的多个核酸条形码分子。多个核酸条形码分子可包含条形码序列。附接至给定特征的多个核酸分子可具有相同的条形码序列或两个或更多个不同的条形码序列。不同的条形码序列可用于提供改进的空间定位精度。
[0569]
如上所述,可进一步加工从样品获得的分析物,如rna、dna、肽、脂质和蛋白质。特别地,来自样品的单独细胞的内容物可提供有独特空间条形码序列,使得在对分析物进行表征时,可将分析物归结为源自同一细胞。更一般地,空间条形码可用于将分析物归属于样品中的相应空间位置。例如,多个空间条形码的分层空间定位可用于鉴定和表征样品的特定空间区域上的分析物。在一些实施方案中,空间区域对应于先前鉴定的特定目标空间区域,例如先前鉴定的细胞结构的特定结构。在一些实施方案中,空间区域对应于肉眼不能看到的小结构或细胞群。在一些实施方案中,独特分子标识符可用于在单个细胞水平上鉴定和表征分析物。
[0570]
分析物可包括核酸分子,所述核酸分子可用核酸条形码分子的条形码序列进行条形编码。在一些实施方案中,可对带条形码的分析物进行测序以获得核酸序列。在一些实施方案中,核酸序列可包括与样品相关的遗传信息。核酸序列可包括条形码序列或其互补序列。可使用lut将核酸序列的条形码序列或其互补序列与分析物的性质(例如颜色和/或强度)电子关联,以鉴定阵列中的相关特征。
[0571]
在一些实施方案中,生物样品中存在的一种或多种分析物的二维或三维空间谱分析可使用邻位捕获反应进行,所述反应是检测在空间上彼此接近和/或彼此相互作用的两种分析物的反应。例如,邻位捕获反应可用于检测空间上彼此接近的dna序列,例如,dna序列可在同一染色体内,但相隔约700bp或更小。作为另一个实例,邻位捕获反应可用于检测蛋白质缔合,例如,两种彼此相互作用的蛋白质。可原位进行邻位捕获反应以检测在空间上彼此靠近和/或在细胞内彼此相互作用的两种分析物。邻位捕获反应的非限制性实例包括dna纳米显微技术(nanoscopy)、dna显微术和染色体构象捕获方法。染色体构象捕获(3c)和
衍生实验程序可用于估计不同基因组元件之间的空间接近性。染色质捕获方法的非限制性实例包括染色体构象捕获(3-c)、构象芯片上捕获(4-c)、5-c、chia-pet、hi-c、靶向染色质捕获(t2c)。此类方法的实例在miele等人,methods mol biol.(2009),464;simonis等人,nat.genet.(2006),38(11):1348-54、raab等人,embo.j.(2012),31(2):330
–
350和eagen等人,trends biochem.sci.(2018)43(6):469-478中进行了描述,所述文献各自的全部内容以引用的方式并入本文。
[0572]
在一些实施方案中,邻位捕获反应包括邻位连接。在一些实施方案中,邻位连接可包括使用具有可参与连接、复制和序列解码反应的附接dna链的抗体。例如,邻位连接反应可包括连接至抗体对的寡核苷酸,如果抗体已经与每个寡核苷酸接近,例如通过结合同一靶蛋白(复合物)则所述抗体可通过连接而连结,并且所形成的dna连接然后用于模板pcr扩增,如例如等人,methods.(2008),45(3):227-32中所描述,所述文献的全部内容以引用的方式并入本文。在一些实施方案中,邻位连接可包括染色体构象捕获方法。
[0573]
在一些实施方案中,邻位捕获反应对彼此约400nm距离(例如,约300nm、约200nm、约150nm、约100nm、约50nm、约25nm、约10nm或约5nm)内的分析物进行。通常,邻位捕获反应可以是可逆的或不可逆的。
[0574]
在一些实施方案中,本文公开的方法包括将原位测定的结果与空间测定的结果相相关、比较和/或整合。在一些实施方案中,本文公开的方法包括将来自原位测定的第一分析物(例如,第一核酸或蛋白质分析物)的存在/不存在、分布、位置、量、水平、表达或活性与来自空间测定的第二分析物(例如,第二核酸或蛋白质分析物)的存在/不存在、分布、位置、量、水平、表达或活性相关联、比较和/或整合。
[0575]
在一些实施方案中,本文公开了一种分析生物样品的方法,所述方法包括使第一基底上的生物样品与一个或多个探针接触,所述一个或多个探针包含直接或间接地与所述生物样品中的第一靶标(其为核酸)(或其互补序列或扩增产物)杂交的核酸分子。第一靶标可以是rna分子。在一些实施方案中,方法还包括在所述生物样品的空间位置处检测所述一个或多个核酸探针,以及提供允许多种捕获剂捕获第二靶标(其可以是蛋白质靶标)的条件。在一些实施方案中,蛋白质靶标被包含对应于结合剂和/或蛋白质靶标的核酸标记的结合剂结合,并且捕获剂可捕获核酸标记,从而捕获蛋白质靶标。可在空间测定中分析捕获的核酸标记(对应于结合剂和/或蛋白质靶标)或其互补序列或其扩增产物。例如,多种捕获剂可直接或间接地连结至第一基底或第二基底,并且多种捕获剂中的一种捕获剂包含能够捕获核酸(例如,核酸标记)的捕获结构域,和对应于捕获剂在第一基底或第二基底上的位置的空间条形码。在一些实施方案中,方法还包括产生空间标记的多核苷酸,所述空间标记的多核苷酸包含(i)核酸标记(对应于结合剂和/或蛋白质靶标)的序列或其互补序列和(ii)空间条形码的序列或其互补序列。在本文的任何实施方案中,可在检测样品的空间位置处的一个或多个探针之前、期间或之后使生物样品与用于蛋白质分析物的结合剂接触。在本文的任何实施方案中,可在针对为核酸的第一靶标对样品进行原位测序模块之前、期间或之后使生物样品与用于蛋白质分析物的结合剂接触。在一些实施方案中,蛋白质分析物或其亚基或多肽序列可由核酸分析物的序列编码。
[0576]
在一些实施方案中,本文公开了一种分析生物样品的方法,所述方法包括使第一基底上的生物样品与一个或多个探针接触,所述探针包含直接或间接地与结合剂的核酸标
记物(或其互补序列或扩增产物)杂交的核酸分子,所述结合剂结合第一靶标,所述第一靶标是生物样品中的非核酸靶标。第一靶标可以是蛋白质。核酸标记可对应于结合剂和/或蛋白质靶标。在一些实施方案中,方法还包括在所述生物样品的空间位置处检测所述一个或多个核酸探针,以及提供允许多种捕获剂捕获第二靶标(其为核酸靶标如mrna)的条件。可在空间测定中分析捕获的核酸靶标或其互补序列或其扩增产物。例如,多种捕获剂可直接或间接地连结至第一基底或第二基底,并且多种捕获剂中的一种捕获剂包含能够捕获核酸(例如,核酸靶标如mrna)的捕获结构域,和对应于捕获剂在第一基底或第二基底上的位置的空间条形码。在一些实施方案中,方法还包括产生空间标记的多核苷酸,所述空间标记的多核苷酸包含(i)核酸靶标如mrna的序列或其互补序列和(ii)空间条形码的序列或其互补序列。在本文的任何实施方案中,蛋白质分析物或其亚基或多肽序列可由核酸分析物的序列编码。
[0577]
在一些实施方案中,本文公开的方法在原位将来自样品中的第一多种分析物的完整组织特征与能够进行同一样品中的第二多种分析物的全转录组、核苷酸分辨率(例如,全rna序列)分析的测定步骤整合。在一些实施方案中,第一和第二多种分析物包含目标核酸序列。在一些实施方案中,第一和第二多种分析物是mrna转录物。在一些实施方案中,第一多种分析物是第二多种分析物的子集,例如,第一多种是用于靶向分析的一组mrna转录物,并且第二多种是用于非靶向分析的全转录组或其子集。在一些实施方案中,第一多种分析物包含蛋白质分析物,并且第二多种分析物包含对应于至少一些蛋白质分析物的核酸分子(例如,mrna转录物)。
[0578]
在一些实施方案中,本文公开的方法包括对空间完整组织环境中的第一多种分析物的原位分析和第二多种分析物的空间分析,其中所述空间分析可以是对所述原位分析的确认或补充。在一些实施方案中,原位分析包括生物样品,例如从生物体分离的组织切片或基底上的组织培养物的2d分析。在一些实施方案中,原位分析包括生物样品,例如从生物体分离的组织切片或呈3d形式的组织培养物如类器官培养物的3d分析。
[0579]
在一些实施方案中,本文公开的方法包括对第一多种核酸或蛋白质分析物的原位分析,例如用于通过使用核酸或蛋白质分析物作为生物标志物进行组织样品中的细胞表型;以及对第二多种核酸分析物的空间分析,例如用于以发现模式对许多其它核酸分子(例如,mrna)进行更深入测序,例如以鉴定与一种或多种特定细胞表型相关的核酸分子。
[0580]
在一些实施方案中,本文公开的方法包括使用来自样品的原位分析的结果来验证来自同一样品的空间测定的结果。例如,多种核酸或蛋白质分析物的原位测序结果可用于验证对应于原位分析的蛋白质分析物的相同或相关核酸分析物或核酸分子(来自空间基因组学分析的dna序列或来自空间转录组学分析的rna转录物序列)。在另一个实例中,多种核酸分析物的空间分析结果可用于例如通过关于组织中的组织形态学和/或其它分子提供核酸分析物的组织形态学和/或空间关系的信息验证相同或相关核酸分析物的原位分析。
[0581]
在一些实施方案中,本文公开的方法包括样品中的一种或多种蛋白质分析物的原位分析和同一样品中的一种或多种核酸分析物(例如mrna)的空间分析。在一些实施方案中,原位分析包括使样品与一个或多个探针接触,其中探针包含结合蛋白质分析物或其一部分(例如表位)的分析物结合部分(例如抗体)和对应于所述分析物结合部分和/或所述蛋白质分析物或其部分的核酸条形码序列。在一些实施方案中,原位分析还包括例如通过光
学成像对一个或多个探针进行分析。例如,一个或多个探针可以是包含一个或多个核酸条形码序列的带条形码的探针,其可直接或间接地被可检测标记的检测探针结合。可分析可检测信号或一系列信号,如包括空间模式和/或时间模式的荧光,以揭示样品中的一种或多种蛋白质分析物的存在/不存在、分布、位置、量、水平、表达或活性。在一些实施方案中,一种或多种蛋白质分析物在组织样品中原位进行分析(例如,通过成像),而无需迁移出组织样品的细胞。在一些实施方案中,一种或多种蛋白质分析物在组织样品中原位进行分析(例如,通过成像),而无需迁移出组织样品,例如迁移到基底上。在一些实施方案中,探针包含分析物结合部分(例如抗体),并且核酸条形码序列在原位分析期间不被裂解。例如,对于原位分析,核酸条形码序列不从与蛋白质分析物结合的探针的分析物结合部分(例如抗体)释放或被基底上的捕获剂捕获;然而,在原位分析之后,核酸条形码序列可与从样品释放的其它核酸分子(例如,mrna转录物)一起被释放并被用于空间分析的捕获剂捕获。
[0582]
在一些实施方案中,本文公开的方法包括样品中的一种或多种非聚腺苷酸化分析物(例如,非聚腺苷酸化mrna转录物)的原位分析,以及同一样品中的一种或多种聚腺苷酸化分析物(例如,具有poly-a尾的mrna转录物)的空间分析。
[0583]
在一些实施方案中,本文公开的方法包括组织样品的第一区域的原位分析和同一组织样品中的第二区域的空间分析。在一些实施方案中,第一和第二区域不重叠。在一些实施方案中,第一和第二区域重叠。所述区域可相同,或者一个区域可完全位于另一个区域内。在一个实例中,例如使用超分辨率显微镜将样品中的细胞的一部分针对第一多种分析物(例如,一组目标mrna转录物)进行原文分析,并且使包含细胞的区域(例如,1cm
×
1cm组织切片)针对第二多种分析物(例如用于非靶向转录组分析的所有mrna转录物)进行本文公开的空间测定。
[0584]
在一些实施方案中,本文公开的方法包括使用多个探针对第一多种分析物(例如,目标核酸分析物)的原位分析。多个探针可包括初级探针、二级探针和/或甚至更高阶探针,其中任何一者或多者可包含核酸条形码序列。探针与分析物或另一探针的结合可以是直接的(例如,直接杂交)或间接的(例如,通过夹板或桥接探针)。在一些实施方案中,本文公开的方法包括使用一个或多个探针对核酸分析物(例如,dna或mrna)的原位分析,所述一个或多个探针直接或间接地结合至所述核酸分析物或其互补序列或产物(例如,杂交产物、连接产物、延伸产物(例如,通过dna或rna聚合酶)、复制产物、转录/逆转录产物和/或扩增产物)。在一些实施方案中,方法还包括本文公开的空间分析,其中提供允许捕获剂直接或间接地不仅捕获核酸分析物(例如,dna或mrna)、而且捕获一个或多个探针中的至少一个的条件。在一些实施方案中,方法还包括产生第一空间标记的多核苷酸,所述第一空间标记的多核苷酸包含(i)核酸分析物的序列或其互补序列和(ii)本文公开的捕获剂的空间条形码的序列或其互补序列,其中所述空间条形码对应于捕获剂在基底(例如,本文公开的第一基底或第二基底)上的位置。在一些实施方案中,方法还包括产生第二空间标记的多核苷酸,所述第二空间标记的多核苷酸包含(i)一个或多个探针中的一个的序列或其互补序列和(ii)本文公开的捕获剂的空间条形码的序列或其互补序列。在一些实施方案中,方法包括分析第一空间标记的多核苷酸(用于分析核酸分析物)和第二空间标记的多核苷酸(用于分析直接或间接地结合核酸分析物的探针),并且一者的分析可用于验证或补充另一个。
[0585]
在一些实施方案中,方法包括将核酸分析物(例如,dna或mrna)和一个或多个探针
中的至少一个捕获在基底上相同位置处的不同捕获剂分子上。在一些实施方案中,方法包括将核酸分析物(例如,dna或mrna)和一个或多个探针中的至少一个捕获具有相同空间条形码序列的不同捕获剂分子上。在一些实施方案中,方法包括将核酸分析物(例如,dna或mrna)和一个或多个探针中的至少一个捕获在同一捕获剂上。在一些实施方案中,方法包括产生空间标记的多核苷酸,所述空间标记的多核苷酸包含(i)核酸分析物的序列或其互补序列,(ii)一个或多个探针中的至少一个的序列或其互补序列和(iii)本文公开的捕获剂的空间条形码的序列或其互补序列。
[0586]
在一些实施方案中,捕获在基底上的探针可充当空间参考以提供关于在原位分析中未被一个或多个探针靶向的一种或多种其它分析物(例如,内源性核酸分子)的信息。
[0587]
在一些实施方案中,原位测定模块用作空间测定模块的基准标记物。例如,包含靶向1号基因的第一分析物mrna1的探针p1的探针组可用于原位分析脑组织切片。已知mrna1在脑中表达,并且在原位成像期间在组织样品中的位置x检测到这种转录物。探针p1和包含1号基因的mrna1的转录物被基底上的捕获剂捕获,通过空间条形码(包括对应于位置x的空间条形码)标记,并进行测序。来自位置x的测序读数不仅包括包含对应于p1的序列的那些和包含对应于mrna1的序列的那些(作为原位读出的验证),而且包括包含对应于mrna2的序列的测序读数。mrna2可以是不同于1号基因的2号基因的转录物,或者是来自1号基因的mrna1的变体(例如,剪接变体)。mrna2可以或可以不被原位探针组中的探针(例如,探针p1)靶向。不管怎样,包含对应于mrna2的序列和对应于位置x的空间条形码或其互补序列的测序读数表明mrna2在位置x也存在和/或表达,尽管mrna2不由原位分析中的探针代表。在此实例中,在基底上捕获的探针(例如p1)充当基底上的位置(例如位置x)处的空间参考,并且对包含对应于所述位置的空间条形码的序列或其互补序列的空间标记的多核苷酸的分析可提供关于未被原位分析中的探针代表或靶向的分析物(例如mrna2)的存在/不存在、分布、位置、量、水平、表达或活性的信息。
[0588]
ix.组合物和试剂盒
[0589]
本文还提供试剂盒,所述试剂盒例如包括本文公开的一种或多种多核苷酸以及用于进行本文提供的方法的试剂,例如包括如本文所述的杂交、连接、扩增、检测、测序、阵列制备、分析物捕获和/或样品制备的一个或多个步骤所需的试剂。在一些实施方案中,试剂盒包括一个或多个基底(例如,第一基底和/或第二基底)。在一些实例中,基底可包括直接或间接地固定在其上的多种捕获剂(例如,捕获探针)。在一些实施方案中,试剂盒还包括靶核酸。在一些实施方案中,任何或所有多核苷酸都是dna分子。在一些实施方案中,靶核酸是信使rna分子。
[0590]
试剂盒的各种组分可存在于单独容器或某些相容组分可预组合于单一容器中。在一些实施方案中,试剂盒还含有用于使用所述试剂盒的组分来实施所提供的方法的说明书。
[0591]
在一些实施方案中,试剂盒可含有进行所提供方法的一个或多个步骤所需的试剂和/或消耗品。在一些实施方案中,试剂盒含有用于固定、包埋和/或透化生物样品的试剂。在一些实施方案中,试剂盒含有试剂,如用于连接和/或扩增的酶和缓冲液,如连接酶和/或聚合酶。在一些方面,试剂盒还可包括本文所述的任何试剂,例如洗涤缓冲液和连接缓冲液。在一些实施方案中,试剂盒含有用于检测和/或测序的试剂,如条形码检测探针或可检
测标记。在一些实施方案中,试剂盒任选地含有其它组分,例如核酸引物、酶和试剂、缓冲液、核苷酸、经修饰的核苷酸、用于另外测定的试剂。
[0592]
x.术语
[0593]
在整个本公开中使用特定术语来解释所描述的设备、系统、方法和组合物的各个方面。
[0594]
已描述本发明的一些说明性实施方案,应为本领域技术人员显而易知的是前述事项仅是说明性而非限制性的,已仅通过举例方式加以呈现。众多修改和其它说明性实施方案在本领域普通技术人员的能力范围内,并且预期属于本发明的范围。具体来说,尽管本文呈现的许多实例涉及方法动作或系统要素的特定组合,但应了解那些动作和那些要素可以其它方式组合以达成相同目标。
[0595]
除非上下文另外清楚地指示,否则如本文所用,单数形式“一个/种(a/an)”和“所述”包括复数个指示物。例如,“一个/种(a/an)”表示“至少一个/种”或“一个或多个(一种或多种)”。
[0596]
如本文所用的术语“约”是指本技术领域的技术人员容易知道的相应值的通常误差范围。本文中对“约”某一个值或参数的提及包括(以及描述)针对所述值或参数本身的实施方案。
[0597]
贯穿本公开内容,所要求保护的主题的各个方面以范围形式呈现。应该理解的是,范围形式的描述仅仅是为了方便以及简洁,不应该被理解为对要求保护的主题范围的不灵活的限制。因此,范围的描述应当被认为是具有确切披露的所有可能的子范围以及该范围内的单独数值。例如,在提供数值范围的情况下,应当理解,在该范围的上限和下限之间的每个中间值以及在该规定范围内的任何其它规定值或中间值都涵盖在要求保护的主题内。这些较小范围的上下限可独立地包含于较小范围中,并且也涵盖于所要求保护的主题中,受所述范围内任何具体排除的限值的约束。在指定范围包括界限中的一个或两个的情况下,排除那些包括的界限中的一个或两个的范围也包含在本发明内。无论范围的宽度如何,这都适用。
[0598]
在权利要求中使用顺序术语,如“第一”、“第二”、“第三”等来修饰权利要求要素本身并不意味一个权利要求要素超过另一个的任何优先、居先或次序或进行方法的动作所依的时序,而是仅用作区分具有某一名称的一个权利要求要素与(如果不使用顺序术语,那么将)具有相同名称的另一要素以区分所述权利要求要素的标记。类似地,使用a)、b)等或i)、ii)等本身并不意味权利要求书中的步骤的任何优先、居先或次序。类似地,在说明书中使用这些术语本身并不意味任何需要的优先、居先或次序。
[0599]
(i)条形码
[0600]“条形码”是传达或能够传达信息(例如,关于样品、珠粒和/或捕获探针中的分析物的信息)的标签或标识符。条形码可以是分析物的一部分,与分析物无关。条形码可附接至分析物。特定条形码相对于其它条形码可以是独特的。
[0601]
条形码可具有多种不同的格式。例如,条形码可包括:多核苷酸条形码;随机核酸和/或氨基酸序列;和合成的核酸和/或氨基酸序列。条形码可以可逆或不可逆的方式附接至分析物或附接至另一个部分或结构。在样品的测序之前或期间,可将条形码添加至例如脱氧核糖核酸(dna)或核糖核酸(rna)样品的片段。条形码可允许鉴定和/或定量单独测序
读数(例如,条形码可以是或可包括独特分子标识符或“umi”)。
[0602]
条形码可例如以单细胞分辨率空间分辨生物样品中存在的分子组分(例如,条形码可以是或可包括“空间条形码”)。在一些实施方案中,条形码包括umi和空间条形码两者。在一些实施方案中,条形码包括一起用作单一条形码的两个或更多个子条形码。例如,多核苷酸条形码可包括由一个或多个非条形码序列隔开的两个或更多个多核苷酸序列(例如,子条形码)。
[0603]
(ii)核酸和核苷酸
[0604]
术语“核酸”和“核苷酸”旨在与它们在本领域中的使用一致并且包括天然存在的物种或其功能类似物。核酸的特别有用的功能类似物能够以序列特异性方式与核酸杂交(例如,能够与两种核酸杂交,使得可在两种杂交的核酸之间发生连接)或能够用作用作特定核苷酸序列的复制的模板。天然存在的核酸通常具有含磷酸二酯键的主链。类似结构可具有替代主链键联,包括本领域已知的那些中的任一种。天然存在的核酸通常具有脱氧核糖(例如,在脱氧核糖核酸(dna)中发现)或核糖(例如在核糖核酸(rna)中发现)。
[0605]
核酸可含有具有本领域中已知的这些糖部分的多种类似物中的任一种的核苷酸。核酸可包含天然或非天然核苷酸。在这点上,天然脱氧核糖核酸可具有选自由以下组成的组的一个或多个碱基:腺嘌呤(a)、胸腺嘧啶(t)、胞嘧啶(c)或鸟嘌呤(g),并且核糖核酸可具有选自由以下组成的组的一个或多个碱基:尿嘧啶(u)、腺嘌呤(a)、胞嘧啶(c)或鸟嘌呤(g)。可包含在核酸或核苷酸中的有用的非天然碱基是本领域已知的。
[0606]
(iii)探针和靶标
[0607]“探针”或“靶标”在用于提及核酸或核酸序列时,旨在作为方法或组合物上下文中核酸或序列的语义标识符,并且不限制超出明确指示的核酸或序列的结构或功能。
[0608]
(iv)寡核苷酸和多核苷酸
[0609]
术语“寡核苷酸”和“多核苷酸”可互换使用来指长度为约2至约500个核苷酸的单链核苷酸多聚体。寡核苷酸可以是合成的、酶促制备的(例如,通过聚合)或使用“分裂库”方法。寡核苷酸可包含核糖核苷酸单体(即,可以是寡核糖核苷酸)和/或脱氧核糖核苷酸单体(即,寡脱氧核糖核苷酸)。在一些实例中,寡核苷酸可在寡核苷酸中包含脱氧核糖核苷酸单体和核糖核苷酸单体的组合(例如,脱氧核糖核苷酸单体和核糖核苷酸单体的随机或有序组合)。例如,寡核苷酸的长度可以是4至10、10至20、21至30、31至40、41至50、51至60、61至70、71至80、80至100、100至150、150至200、200至250、250至300、300至350、350至400或400-500个核苷酸。寡核苷酸可包含附接(例如,共价或非共价)至多聚体结构的一个或多个功能部分。例如,寡核苷酸可包含一种或多种可检测标记(例如,放射性同位素或荧光团)。
[0610]
(v)受试者
[0611]“受试者”是动物,如哺乳动物(例如,人或非人猿),或禽类(例如,鸟),或其它生物体,如植物。受试者的实例包括但不限于哺乳动物,如啮齿动物、小鼠、大鼠、兔、豚鼠、有蹄类动物、马、绵羊、猪、山羊、牛、猫、狗、灵长类动物(即人或非人灵长类动物);植物,如拟南芥、玉米、高粱、燕麦、小麦、大米、油菜或大豆;藻类,如莱茵衣藻;线虫,如秀丽隐杆线虫;昆虫,如黑腹果蝇、蚊、果蝇或蜜蜂;蛛形纲动物,如蜘蛛;鱼,如斑马鱼;爬行动物;两栖动物,如蛙或非洲爪蟾;盘基网柄菌;真菌,如卡氏肺孢子虫、红鳍东方鲀、酵母、酿酒酵母或粟酒裂殖酵母;或恶性疟原虫。
[0612]
(vi)夹板寡核苷酸
[0613]“夹板寡核苷酸”是当与其它多核苷酸杂交时充当“夹板”以使多核苷酸彼此相邻定位、使得它们可连接在一起的寡核苷酸。在一些实施方案中,夹板寡核苷酸是dna或rna。夹板寡核苷酸可包含与来自两个或更多个不同寡核苷酸的核苷酸序列部分互补的核苷酸序列。在一些实施方案中,夹板寡核苷酸有助于连接“供体”寡核苷酸和“受体”寡核苷酸。一般而言,rna连接酶、dna连接酶或另一其它种类的连接酶用于将两个核苷酸序列连接在一起。
[0614]
在一些实施方案中,夹板寡核苷酸的长度介于10与50个寡核苷酸之间,例如,介于10与45间、10与40、10与35、10与30、10与25或10与20个寡核苷酸之间。在一些实施方案中,夹板寡核苷酸的长度介于15与50、15与45、15与40、15与35、15与30、15与30或15与25个寡核苷酸之间。
[0615]
(vii)衔接子(adaptor)、衔接子(adapter)和标签
[0616]“衔接子(adaptor)”、“衔接子(adapter)”和“标签”是在本公开中可互换使用的术语,并且是指可使用许多不同技术中的任一种,包括(但不限于)连接、杂交和标签化偶联至多核苷酸序列(在称为“标记”的过程中)。衔接子也可以是添加功能的核酸序列,例如,间隔区序列、引物序列/位点、条形码序列、独特分子标识符序列。
[0617]
(viii)杂交(hybridizing)、杂交(hybridize)、退火(annealing)和退火(anneal)
[0618]
术语“杂交(hybridizing)”、“杂交(hybridize)”、“退火(annealing)”和“退火(anneal)”在本公开中可互换使用,并且是指两个不同分子内基本上互补或互补的核酸序列的配对。配对可通过其中核酸序列与基本上或完全互补的序列通过碱基配对连结以形成杂交复合物的任何过程来实现。出于杂交的目的,如果两个核酸序列的至少60%(例如,至少70%、至少80%或至少90%)的单独碱基彼此互补,则两个核酸序列是“基本上互补的”。
[0619]
(ix)引物
[0620]“引物”是具有3'端的单链核酸序列,其可用作核酸延伸反应中的核酸聚合酶的底物。rna引物由rna核苷酸形成且用于rna合成,而dna引物由dna核苷酸形成且用于dna合成。引物还可包括rna核苷酸和dna核苷酸(例如,以随机或设计的模式)。引物还可包括本文所述的可具有额外功能的其它天然或合成核苷酸。在一些实例中,dna引物可用于引发rna合成,反之亦然(例如,rna引物可用于引发dna合成)。引物的长度可不同。例如,引物可以是约6个碱基至约120个碱基。例如,引物可包括至多约25个碱基。在一些情况下,引物可指引物结合序列。
[0621]
(x)引物延伸
[0622]“引物延伸”是指其中两个核酸序列(例如,来自两个不同捕获探针中的每一个的恒定区)通过它们各自的末端互补核酸序列(即,例如,3'末端)的重叠而变得连接(例如,杂交)。这种连接之后可以是一个或两个末端的核酸延伸(例如,酶促延伸),使用另一个核酸序列作为延伸的模板。酶促延伸可通过酶进行,所述酶包括但不限于聚合酶和/或逆转录酶。
[0623]
(xi)邻位连接
[0624]“邻位连接”是通过酶促手段(例如,连接酶)连接彼此接近的两个(或更多个)核酸序列的方法。在一些实施方案中,邻位连接可包括“间隙填充”步骤,所述步骤涉及基于模板
核酸分子的核酸序列通过聚合酶并入一种或多种核酸,从而跨越两个目标核酸分子之间的距离(参见例如美国专利号7,264,929,其全部内容以引用的方式并入本文)。
[0625]
多种不同的方法可用于邻位连接核酸分子,包括(但不限于)“粘性末端”和“平末端”连接。此外,单链连接可用于对单链核酸分子进行邻位连接。粘性末端邻位连接涉及在连接事件本身之前,在两个待连接的核酸分子之间的互补单链序列的杂交。平末端邻位连接通常不包括来自每个核酸分子的互补区域的杂交,因为两个核酸分子在连接位点均缺乏单链突出端。
[0626]
(xii)核酸延伸
[0627]“核酸延伸”通常涉及以模板依赖性方式将一种或多种核酸(例如a、g、c、t、u、核苷酸类似物或其衍生物)并入分子(如但不限于核酸序列)中,使得通过酶(如聚合酶或逆转录酶)并入连续核酸,从而产生新合成的核酸分子。例如,与互补核酸序列杂交的引物可用于通过使用互补核酸序列作为核酸合成的模板来合成新的核酸分子。类似地,与poly(dt)序列(例如,捕获结构域)杂交的mrna转录物的3'聚腺苷酸化尾可用作相应cdna分子的单链合成的模板。
[0628]
(xiii)pcr扩增
[0629]“pcr扩增”是指使用聚合酶链反应(pcr)来产生遗传物质的拷贝,包括dna和rna序列。用于实施pcr的合适试剂和条件描述于例如美国专利4,683,202、4,683,195、4,800,159、4,965,188和5,512,462中,所述专利各自的全部内容以引用的方式并入本文。在典型pcr扩增中,反应混合物包含待扩增的遗传物质、酶、用于引物延伸反应的一种或多种引物以及用于反应的试剂。寡核苷酸引物的长度足以在退火条件下提供与互补遗传物质的杂交。引物的长度通常取决于扩增结构域的长度,但通常将是至少4个碱基、至少5个碱基、至少6个碱基、至少8个碱基、至少9个碱基、至少10个碱基对(bp)、至少11bp、至少12bp、至少13bp、至少14bp、至少15bp、至少16bp、至少17bp、至少18bp、至少19bp、至少20bp、至少25bp、至少30bp、至少35bp,并且可长达40bp或更长,其中引物的长度通常将在18至50bp的范围内。遗传物质可与单个引物或一组两个引物(正向引物和反向引物)接触,这取决于是需要遗传物质的引物延伸、线性还是指数扩增。
[0630]
在一些实施方案中,pcr扩增过程使用dna聚合酶。dna聚合酶活性可由一种或多种不同的dna聚合酶提供。在某些实施方案中,dna聚合酶来自细菌,例如,dna聚合酶是细菌dna聚合酶。例如,dna聚合酶可来自埃希氏菌属、芽孢杆菌属、嗜热菌属或热球菌属的细菌。
[0631]
可使用的dna聚合酶的合适实例包括但不限于:大肠杆菌dna聚合酶i、bsu dna聚合酶、bst dna聚合酶、taq dna聚合酶、vent
tm
dna聚合酶、deepvent
tm
dna聚合酶、taq dna聚合酶、热启动taq dna聚合酶、crimsontaq dna聚合酶、crimson taq dna聚合酶、dna聚合酶、dna聚合酶、hemodna聚合酶、dna聚合酶、dna聚合酶、高保真dna聚合酶、铂pfx dna聚合酶、accuprime pfx dna聚合酶、phi29 dna聚合酶、klenow片段、pwo dna聚合酶、pfu dna聚合酶、t4 dna聚合酶和t7 dna聚合酶。
[0632]
术语“dna聚合酶”不仅包括天然存在的酶,而且包括其所有经修饰的衍生物,还包
括天然存在的dna聚合酶的衍生物。例如,在一些实施方案中,dna聚合酶可能已经进行修饰以除去5'-3'核酸外切酶活性。可使用的dna聚合酶的序列修饰衍生物或突变体包括但不限于保留野生型序列的至少一些功能(例如dna聚合酶)活性的突变体。在不同反应条件(例如温度、模板浓度、引物浓度等)下,突变可影响酶的活性谱,例如增强或降低聚合速率。突变或序列修饰也可影响酶的核酸外切酶活性和/或热稳定性。
[0633]
在一些实施方案中,pcr扩增可包括反应,如但不限于链置换扩增反应、滚环扩增反应、连接酶链反应、转录介导的扩增反应、等温扩增反应和/或环介导的扩增反应。
[0634]
在一些实施方案中,pcr扩增使用与靶dna片段的3'标签互补的单一引物。在一些实施方案中,pcr扩增使用第一和第二引物,其中第一引物的至少3'端部分与靶核酸片段的3'标签的至少一部分互补,并且其中第二引物的至少3'端部分表现出靶核酸片段的5'标签的至少一部分的序列。在一些实施方案中,第一引物的5'端部分与靶核酸片段的3'标签不互补,并且第二引物的5'端部分未表现出靶核酸片段的5'标签的至少一部分的序列。在一些实施方案中,第一引物包括第一通用序列和/或第二引物包括第二通用序列。
[0635]
在一些实施方案中(例如,当pcr扩增使捕获的dna扩增时),可使用dna连接酶将pcr扩增产物连接至另外的序列。dna连接酶活性可由一种或多种不同的dna连接酶提供。在一些实施方案中,dna连接酶来自细菌,例如,dna连接酶是细菌dna连接酶。在一些实施方案中,dna连接酶来自病毒(例如,噬菌体)。例如,dna连接酶可以是t4 dna连接酶。适用于连接步骤的其它酶包括但不限于tth dna连接酶、taq dna连接酶、热球菌属(菌株9on)dna连接酶(9ontm dna连接酶,可从new england biolabs,ipswich,ma获得)和ampligase
tm
(可从epicentre biotechnologies,madison,wi获得)。也可使用衍生物,例如序列修饰的衍生物,和/或其突变体。
[0636]
在一些实施方案中,通过逆转录聚合酶链反应(rt-pcr)扩增遗传物质。所需的逆转录酶活性可由一种或多种不同的逆转录酶提供,所述逆转录酶的合适实例包括但不限于:m-mlv、mulv、amv、hiv、arrayscript
tm
、multiscribe
tm
、thermoscript
tm
和i、ii、iii和iv酶。“逆转录酶”不仅包括天然存在的酶,而且包括其所有此类经修饰的衍生物,还包括天然存在的逆转录酶的衍生物。
[0637]
此外,可使用m-mlv、mulv、amv和hiv逆转录酶的序列修饰衍生物或突变体进行逆转录,包括保留野生型序列的至少一些功能(例如逆转录酶)活性的突变体。逆转录酶可作为组合物的一部分提供,所述组合物包含其它组分,例如增强或改善逆转录酶活性的稳定化组分,如rna酶抑制剂;dna依赖性dna合成的抑制剂,例如放线菌素d。逆转录酶的许多序列修饰衍生物或突变体(例如m-mlv)以及包含未修饰的和修饰的酶的组合物是可商购的,例如arrayscript
tm
、multiscribe
tm
、thermoscript
tm
和i、ii、iii以及iv酶。
[0638]
某些逆转录酶(例如禽成髓细胞瘤病毒(amv)逆转录酶和莫洛尼鼠白血病病毒(m-mulv,mmlv)逆转录酶)可使用rna(cdna合成)和单链dna(ssdna)两者作为模板合成互补dna链。因此,在一些实施方案中,逆转录反应可使用能够使用rna和ssdna两者作为延伸反应的模板的酶(逆转录酶),例如amv或mmlv逆转录酶。
[0639]
在一些实施方案中,rna和/或dna的定量使用本领域众所周知的技术通过实时pcr(也称为定量pcr或qpcr)进行,所述技术如但不限于“taqman
tm”或或在毛细管
上(“capillaries”)进行。在一些实施方案中,遗传物质的定量通过光学吸光度和实时pcr确定。在一些实施方案中,遗传物质的定量通过数字pcr确定。在一些实施方案中,可将所分析的基因与对应于表达(mrna)和数量(dna)的参考核酸提取物(dna和rna)进行比较,以便比较靶核酸的表达水平。
[0640]
(xiv)抗体
[0641]“抗体”是识别并结合至互补靶抗原的多肽分子。抗体通常具有类似于y形的分子结构形状。天然存在的抗体(称为免疫球蛋白)属于免疫球蛋白类别igg、igm、iga、igd和ige中的一者。抗体也可合成生产。例如,作为单克隆抗体的重组抗体可使用合成基因通过从源细胞中回收抗体基因、扩增到适当的载体中并将所述载体引入宿主以使宿主表达所述重组抗体来合成。一般而言,可使用合适的寡核苷酸引物和/或杂交探针从任何种类的产生抗体的动物克隆重组抗体。重组技术可用于产生抗体和抗体片段,包括非内源性种类。
[0642]
合成抗体可来源于非免疫球蛋白来源。例如,可从核酸(例如适体)和其中插入高变环以形成抗原结合位点的非免疫球蛋白蛋白质支架(如肽适体)产生抗体。基于核酸或肽结构的合成抗体可比免疫球蛋白来源的抗体更小,从而导致更大的组织渗透。
[0643]
抗体还可包括affimer蛋白,所述蛋白是通常具有约12-14kda的分子量的亲和试剂。affimer蛋白通常以高亲和力和特异性结合至靶标(例如,靶蛋白)。此类靶标的实例包括但不限于泛素链、免疫球蛋白和c反应蛋白。在一些实施方案中,affimer蛋白源自半胱氨酸蛋白酶抑制剂,并且包含肽环和提供结合位点的可变n-末端序列。
[0644]
抗体还可指“表位结合片段”或“抗体片段”,如本文所用,其通常是指能够与完整抗体结合相同表位的完整抗体的一部分,尽管不一定达到相同的程度。尽管多种类型的表位结合片段是可能的,但表位结合片段通常包含(例如,通过二硫键)保持在一起的至少一对重链和轻链可变区(分别vh和vl)以保留抗原结合位点,并且不包含fc区的全部或一部分。抗体的表位结合片段可通过任何合适的技术(例如,重组dna技术或完整抗体的酶或化学裂解)从给定抗体获得,并且通常可以筛选完整抗体相同的方式筛选特异性。在一些实施方案中,表位结合片段包含f(ab’)2片段、fab'片段、fab片段、fd片段或fv片段。在一些实施方案中,术语“抗体”包括抗体来源的多肽,如单链可变片段(scfv)、双抗体或其它多聚体scfv、重链抗体、单结构域抗体或包含抗体的足够部分(例如,一个或多个互补决定区(cdr))的其它多肽以赋予多肽特异性抗原结合能力。
[0645]
(xv)亲和基团
[0646]“亲和基团”是对与另一特异性或特定分子或部分缔合或结合具有高亲和力或偏好的分子或分子部分。与另一特异性或特定分子或部分的缔合或结合可通过非共价相互作用,如氢键合、离子力和范德华相互作用进行。亲和基团可以是例如生物素,其对与蛋白质抗生物素蛋白或链霉抗生物素蛋白缔合或结合具有高亲和力或偏好。例如,亲和基团也可指对生物素具有亲和力的抗生物素蛋白或链霉抗生物素蛋白。亲和基团和与其结合或缔合的特异性或特定分子或部分的其它实例包括但不限于抗体或抗体片段和它们各自的抗原,如地高辛和抗地高辛抗体、凝集素和碳水化合物(例如,糖、单糖、二糖或多糖),以及受体和受体配体。
[0647]
任何一对亲和基团及与其结合或缔合的特异性或特定分子或部分可具有相反的作用,例如,使得在第一分子与第二分子之间,在第一种情况下,第一分子被表征为第二分
子的亲和基团,并且在第二种情况下,第二分子被表征为第一分子的亲和基团。
[0648]
(xvi)标记、可检测标记和光学标记
[0649]
术语“可检测标记”、“光学标记”和“标记”在本文中可互换使用来指与待检测的分子缔合(例如,缀合)的直接或间接可检测部分,例如用于原位测定的探针、捕获探针或分析物。可检测标记本身可直接检测(例如,放射性同位素标记或荧光标记),或者在酶标记的情况下可间接检测,例如通过催化底物化合物或组合物的化学改变,所述底物化合物或组合可直接检测。可检测标记可适用于小规模检测和/或适合于高通量筛选。因此,合适的可检测标记包括但不限于放射性同位素、荧光团、化学发光化合物、生物发光化合物和染料。
[0650]
可检测标记可定性地检测(例如,光学或光谱),或者它可被定量。定性检测通常包括确认可检测标记的存在或存在的检测方法,而可定量检测通常包括具有可定量(例如,数字可报告)值如强度、持续时间、极化和/或其它性质的检测方法。在一些实施方案中,可检测标记与特征或与特征相关的捕获探针结合。例如,可检测标记的特征可包括附接至珠粒的荧光、比色或化学发光标记(参见例如,rajeswari等人,j.microbiol methods 139:22-28,2017和forcucci等人,j.biomed opt.10:105010,2015,所述文献各自的全部内容以引用的方式并入本文)。
[0651]
在一些实施方案中,可将多个可检测标记附接至待检测的特征、捕获探针或组合物。例如,可检测标记可在核酸聚合或扩增过程中并入(例如,标记的核苷酸,如-dctp)。可使用任何合适的可检测标记。在一些实施方案中,可检测标记是荧光团。例如,荧光团可来自包括以下的基团:7-aad(7-氨基放线菌素d)、吖啶橙( dna)、吖啶橙( rna)、alexa350、alexa430、alex a488、alexa532、alexa546、alexa546、alexa555、alexa568、alexa594、alexa633、alexa647、alexa660、alexa680、alexa680、alexa700、alexa750、别藻蓝蛋白(apc)、amca/amc a-x、7-氨基放线菌素d(7-aad)、7-氨基-4-甲基香豆素、6-氨基喹啉、苯胺蓝、ans、apc-cy7、atto-tag
tm
cbqca、atto-tag
tm
fq、金胺o-feulgen、bcecf(高ph)、bfp(蓝色荧光蛋白)、bfp/gfp fret、bobo
tm-1/bo-pro
tm-1、bobo
tm-3/bo-pr o
tm-3、fl、
t
mr、tr-x、x、530/550、558/568、564/570、581/591、630/650-x、650-665-x、btc、钙黄绿素、钙黄绿素蓝、calcium crimson
tm
、calcium green-1
tm
、cal cium orange
tm
、白、5-羧基荧光素(5-fam)、5-羧基萘并荧光素、6-羧基罗丹明6g、5-羧基四甲基罗丹明(5-tamra)、羧基-x-罗丹明(5-rox)、cascadecascade yellow
tm
、ccf2(gen eblazer
tm
)、cfp(青色荧光蛋白)、cfp/yfp fret、色霉素a3、cl-nerf(低ph)、cpm、6-cr 6g、ctc甲臜、6g、ctc甲臜、细胞色素(pe-cy5)、丹磺酰胺、丹磺酰尸胺、丹磺酰氯、dapi、dapoxyl、dcfh、dhr、dia(4-di-16-asp)、did(dilc18(5))、dids、dil(dilc18(3))、dio(dioc18(3))、dir(dilc18(7))、di-4 anepps、di-8 anepps、dm-nerf(4.5-6.5ph)、dsred(红色荧光蛋白)、ebfp、ecfp、egfp、-97醇、伊红、赤藓红、溴化乙锭、乙锭同二
聚体-1(ethd-1)、氯化铕(iii)、5-fam(5-羧基荧光素)、快蓝、荧光素-dt亚磷酰胺、fitc、fluo-3、fluo-4、fluoro-gold
tm
(高ph)、fluoro-gold
tm
(低ph)、fluoro-jade、1-43、fura-2(高钙)、fura-2/bcecf、fura red
tm
(高钙)、fura red
tm
/fluo-3、geneblazer
tm
(ccf2)、gfp红移(rsgfp)、gfp野生型、gfp/bfp fret、gfp/dsred fret、赫斯特33342和33258、7-羟基-4-甲基香豆素(ph 9)、1,5iaedans、indo-1(高钙)、indo-1(低钙)、吲哚二碳菁、吲哚三碳菁、jc-1、6-joe、jojo
tm-1/jo-pro
tm-1、lds 751( dna)、lds 751( rna)、lolo
tm-1/lo-pro
tm-1、荧光黄、lysosensor
tm
蓝(ph 5)、lysosensor
tm
绿(ph 5)、lysosensor
tm
黄/蓝(ph 4.2)、4.2)、绿、红、黄、mag-fura-2、mag-indo-1、magnesium green
tm
、marina4-甲基伞形酮、光神霉素、绿、橙、红、nbd(胺)、尼罗红、oregon488、oregon500、oregon514、太平洋蓝、pbf1、pe(r-藻红蛋白)、pe-cy5、pe-cy7、pe-德克萨斯红、percp(多甲藻素叶绿素蛋白)、percp-cy5.5(trured)、pharred(apc-cy7)、c-藻蓝蛋白、r-藻蓝蛋白、r-藻红蛋白(pe)、pi(碘化丙啶)、pkh26、pkh67、popo
tm-1/po-pro
tm-1、popo
tm-3/po-pro
tm-3、碘化丙啶(pi)、pympo、芘、派洛宁y、quantam红(pe-cy5)、喹吖因氮芥、r670(pe-cy5)、红613(pe-德克萨斯红)、红色荧光蛋白(dsred)、试卤灵、rh 414、rhod-2、罗丹明b、rhodamine green
tm
、rhodamine red
tm
、罗丹明鬼笔环肽、罗丹明110、罗丹明123、5-rox(羧基-x-罗丹明)、s65a、s65c、s65l、s65t、sbfi、sits、(高ph)、(高ph)、(低ph)、sodium green
tm
、、#1、#2、#2、11、13、17、45、45、蓝、绿、橙、5-tamra(5-羧基四甲基罗丹明)、四甲基罗丹明(tritc)、texas/texastexastexas(nhs酯)、硫杂二碳花菁、噻唑橙、二碳花菁、噻唑橙、三色(pe-cy5)、tritc(四甲基罗丹明)、trured(percp-cy5.5)、ww 781、x-罗丹明(xritc)、y66f、y66h、y66w、yfp(黄色荧光蛋白)、罗丹明(xritc)、y66f、y66h、y66w、yfp(黄色荧光蛋白)、6-fam(荧光素)、6-fam(nhs酯)、6-fam(叠氮化物)、hex、tamra(nhs酯)、雅吉玛黄、max、tet、tex615、atto 488、atto 532、atto 550、atto 565、atto rho101、atto 590、atto 633、atto 647n、tye 563、tye 665、tye 705、5’700、5’800、5
’’
800cw(nhs酯)、wellred d4染料、wellred d3染料、well red d2染料、640(nhs酯)和dy 750(nhs酯)。
[0652]
如上所述,在一些实施方案中,可检测标记是或包括发光或化学发光部分。常见的发光/化学发光部分包括但不限于过氧化物酶,如辣根过氧化物酶(hrp)、大豆过氧化物酶(sp)、碱性磷酸酶和荧光素酶。给定适当的底物(例如,氧化试剂加化学发光化合物),这些蛋白质部分可催化化学发光反应。已知许多化合物家族在各种条件下提供化学发光。化学发光化合物家族的非限制性实例包括2,3-二氢-l,4-酞嗪二酮鲁米诺、5-氨基-6,7,8-三甲
氧基-和二甲氨基[ca]苯并类似物。这些化合物可在碱性过氧化氢或次氯酸钙和碱存在下发光。化学发光化合物家族的其它实例包括例如2,4,5-三苯基咪唑、对二甲氨基和-甲氧基取代基、草酸盐如草酰活性酯、对硝基苯基、n-烷基吖啶酯、荧光素、亮光素(lucigenin)或吖啶鎓酯。在一些实施方案中,可检测标记是或包括基于金属或基于质量的标记。例如,小簇金属离子、金属或半导体可充当质量代码。在一些实例中,金属可选自元素周期表的第3-15族,例如y、la、ag、au、pt、ni、pd、rh、ir、co、cu、bi或它们的组合。
[0653]
(xvii)模板转换寡核苷酸
[0654]“模板转换寡核苷酸”是在逆转录期间与通过逆转录酶(例如,具有末端转移酶活性的酶)添加的非模板核苷酸杂交的寡核苷酸。在一些实施方案中,模板转换寡核苷酸与通过逆转录酶添加的未模板化poly(c)核苷酸杂交。在一些实施方案中,模板转换寡核苷酸将共同的5'序列添加至用于cdna扩增的全长cdna。
[0655]
在一些实施方案中,模板转换寡核苷酸将共同序列添加到被逆转录的rna的5'端。例如,模板转换寡核苷酸可与添加到cdna分子末端上的未模板化poly(c)核苷酸杂交,并为逆转录酶提供模板以继续复制至模板转换寡核苷酸的5'端,从而产生准备用于进一步扩增的全长cdna。在一些实施方案中,一旦产生了全长cdna分子,模板转换寡核苷酸就可充当cdna扩增反应中的引物。
[0656]
在一些实施方案中,在逆转录或其它基于末端转移酶的反应之前、同时或之后添加模板转换寡核苷酸。在一些实施方案中,模板转换寡核苷酸包含于捕获探针中。在某些实施方案中,使用模板转换寡核苷酸的样品分析方法可涉及从组织样品的分析物产生核酸产物,然后用模板转换寡核苷酸进一步加工所述核酸产物。
[0657]
模板转换寡核苷酸可包含杂交区和模板区。杂交区可包含能够与靶标杂交的任何序列。在一些实施方案中,杂交区可例如包含一系列g碱基以补充cdna分子3'端的突出c碱基。系列g碱基可包含1个g碱基、2个g碱基、3个g碱基、4个g碱基、5个g碱基或多于5个g碱基。模板序列可包含待并入cdna中的任何序列。在其它实施方案中,杂交区可包含除至少一个g碱基之外的至少一个碱基。在其它实施方案中,杂交可包含不是g碱基的碱基。在一些实施方案中,模板区包含至少1个(例如,至少2、3、4、5个或更多个)标签序列和/或功能序列。在一些实施方案中,模板区和杂交区通过间隔区分开。
[0658]
在一些实施方案中,模板区包含条形码序列。条形码序列可充当空间条形码和/或充当独特分子标识符。模板转换寡核苷酸可包括脱氧核糖核酸;核糖核酸;经修饰的核酸,包括2-氨基嘌呤、2,6-二氨基嘌呤(2-氨基-da)、反向dt、5-甲基dc、2'-脱氧肌苷、super t(5-羟基丁炔基-2'-脱氧尿苷)、super g(8-氮杂-7-脱氮杂鸟苷)、锁核酸(lna)、解锁核酸(una,例如una-a、una-u、una-c、una-g)、iso-dg、iso-dc、2'氟碱基(例如,氟c、氟u、氟a和氟g)或前述的任何组合。
[0659]
在一些实施方案中,模板转换寡核苷酸的长度可以是至少约1、2、10、20、50、75、100、150、200或250个核苷酸或更长。在一些实施方案中,模板转换寡核苷酸的长度可以是至多约2、10、20、50、100、150、200或250个核苷酸或更长。
[0660]
实施例
[0661]
包括下列实施例仅出于说明性目的,并且不旨在限制本公开的范围。
[0662]
实施例1:使用用于原位测序的snail探针、然后基于空间阵列的分析分析样品。
[0663]
此实施例说明通过使用原位测序(例如,使用荧光显微术作为读出)生成靶核酸分子的序列和空间信息、然后进行同一样品的基于空间阵列的分析(例如,使用阵列上捕获的分子的ngs测序)(图1)来分析生物样品的方法。
[0664]
将生物样品(例如,组织样品)放置在薄阵列载玻片,如具有足够强度的盖玻片上。可使用本领域已知的各种技术固定组织。例如,可使用多聚甲醛(pfa,聚合甲醛)和可逆交联剂固定组织。在一些情况下,可通过将样品包埋在水凝胶中并使核酸分子与水凝胶交联来将样品中的核酸分子(例如,rna)锁定在适当位置。组织样品可首先用胃蛋白酶和hcl透化,然后固定。可在透化步骤和/或用可逆交联剂处理之前和/或之后固定组织。
[0665]
在组织固定后,通过探针靶向mrna并在典型高度多重原位成像方法,例如探针杂交、连接、滚环扩增、然后连接法测序或杂交测序之后在原位进行分析,具有显微术读出。例如,可将原位初级探针(例如snail探针)、热稳定逆转录酶(rt)(例如,在40℃或更高的杂交温度下工作良好的任何rt酶)、dntp、模板转换寡核苷酸和其它组分与合适的缓冲液一起添加到组织中。因此,在此实施例中,cdna是在示例性工作流程早期的逆转录过程中产生的(例如,原位探针杂交过程中的rt)。
[0666]
在一些情况下,可添加去交联催化剂以将mrna捕获到载玻片上,或者如果使用可逆交联剂则可恢复交联。rt过程产生稳定的cdna,所述cdna在原位方案的其余部分中保留下来。snail探针的3'oh可用于滚环扩增(rca),但不可用于rt(例如,因为引物的3'端与挂锁杂交,而不与rna靶标杂交),因此来自未连接的挂锁探针的rna的不需要的rt不会发生。
[0667]
在一些情况下,可使用pfa或其它交联剂进行后固定步骤。为了在原位方案过程中保留内源性转录组,可使用各种抑制剂,包括核糖核酸酶(rna酶)抑制剂和随机引物,以保护dna-rna杂合体中rna免受rna酶a和/或rna酶h降解。
[0668]
一旦原位方案完成,就任选地用蛋白酶k(prok)渗透组织和/或可任选地进行去交联步骤,使得诸如mrna、cdna、探针、连接产物和/或扩增产物的分子不再锁定在适当位置(例如,水凝胶)。在一些情况下,探针(例如,snail探针)迁移到包含带空间条形码的捕获探针的阵列上。在一些情况下,snail探针组的挂锁探针包含可被阵列载玻片捕获的序列。裂解组织并将转录组(例如,所产生的cdna)捕获到阵列载玻片上。然后进行文库制备和测序。
[0669]
在一些情况下,为了直接分析mrna,可使用各种方法将mrna锁定在阵列载玻片上的适当位置。例如,可进行mrna的经修饰的探针(例如寡聚(dt)探针)捕捞((例如,寡聚-dt fish),然后交联,并使用随机靶向的带条形码的挂锁探针,从而允许rca具有经修饰的核苷酸,以将扩增子锁定在适当位置。在这种方法中,可原位分析数百个rna,而剩余的rna通过捕获在空间阵列上和测序进行分析。
[0670]
实施例2:使用用于原位测序的挂锁探针和桥接探针、然后基于空间阵列的分析来分析样品。
[0671]
此实施例说明分析样品中的靶核酸、产生空间和测序信息的替代方法(图1)。
[0672]
将生物样品(例如,组织样品)固定在载玻片上并任选地如实施例1中所述透化。在组织固定后,通过包含挂锁探针的原位初级探针靶向mrna,每个挂锁探针包含锚定序列和条形码序列,例如,如gyllborg等人,“hybridization-based in situ sequencing(hybiss):spatial transcriptomic detection in human and mouse brain tissue,”biorxiv 2020.02.03.931618中所描述。使初级探针(挂锁探针)与组织样品杂交,并且将未
结合的探针从样品中洗掉。挂锁探针与对应于目标基因的rna杂交,并使用rna模板化连接进行连接,使得挂锁探针的3'oh不再可用于rt。在示例性工作流程中,在挂锁探针连接之后进行rt。
[0673]
然后在rca反应中通过dna聚合酶扩增闭合环。rt过程产生稳定的cdna,所述稳定的cdna在原位方案的其余部分中保留下来。
[0674]
在一些情况下,可使用pfa或其它交联剂进行后固定步骤。为了在原位方案过程中保留内源性转录组,可使用各种抑制剂,包括核糖核酸酶(rna酶)抑制剂和随机引物,以保护dna-rna杂合体中rna免受rna酶a和/或rna酶h降解。
[0675]
一旦原位方案完成,就任选地用蛋白酶k(prok)渗透组织和/或可任选地进行去交联步骤,使得诸如mrna、cdna、探针、连接产物和/或扩增产物的分子不再锁定在适当位置(例如,水凝胶)。在一些情况下,探针迁移到包含带空间条形码的捕获探针的阵列上。在一些情况下,挂锁探针包含可被阵列捕获的序列。裂解组织并将转录组(例如,所产生的cdna)捕获到阵列载玻片上。然后进行文库制备和转录组的测序。这种方法可捕获具有核苷酸分辨率的阵列上的完整转录,同时进行全面测序读出。
[0676]
本发明在范围上不意图限制于具体公开的实施方案,例如提供这些实施方案来说明本发明的各个方面。根据本文的描述和教导,对所述组合物和方法的各种修改将变得显而易见。此类变化可在不脱离本公开的真实范围和精神的情况下实施并且意图落入本公开的范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。