t细胞细胞毒性的调节和相关治疗
发明领域
1.本发明涉及用于调节(包括增强)t细胞细胞毒性的产品和方法。具体而言,公开了增强的t细胞细胞毒性以用于治疗增殖性病症,例如癌症。
背景技术:
2.肿瘤新生抗原是t细胞介导的癌细胞识别的关键底物(schumacher,t.n.&schreiber,r.d.,science 2015)。新生抗原特异性t细胞对免疫检查点阻断(immune checkpoint-blockade,icb)有响应,并且已在患有非小细胞肺癌(nsclc)和其他癌症类型的患者的血液和肿瘤中检测出(rizvi,n.a.et al.,science 2015;mcgranahan,n.et al.,science 2016;gros,a.et al.,nat.med.,2016)。虽然肿瘤突变负担(tumour mutational burden,tmb)预测对检查点阻断的响应(rizvi,n.a.et al.,science 2015;van allen,e.m.et al.,science 2015;snyder,a.et al.,n.engl.j.med.2014),但临床上明显的肿瘤通常在没有治疗的情况下进展,这表明抗肿瘤t细胞应答的功能受损(thommen,d.s.&schumacher;t.n.,cancer cell 2018;reading,j.l.et al.,immunol.rev.2018)。
3.t细胞活化由抗原特性决定,抗原特性包括丰度、理化特性、mhc亲和力和自相似性(zinkernagel,r.m.et al.,immunol.rev.1997;rolland,m.et al.,plos one 2007;neefjes,j.&ovaa,h.,nature chemical biology 2013)。在急性感染和疫苗接种中,最佳t细胞刺激导致从祖细胞(例如初始、中枢记忆)分化为效应物和效应物记忆表型,同时获得不同的效应物功能(zhu,j.,yamane,h.&paul,w.e.,annu.rev.immunol.2010;kaech,s.m.&wherry,e.j.,immunity 2007)。然而,癌症和慢性感染中持续的高抗原负荷驱使t细胞分化为功能障碍状态,由持续的t细胞受体(t cell receptor,tcr)刺激介导,该刺激诱导转录因子(包括tox),其促进基因表达、表观遗传的和代谢的变化,逐渐限制t细胞效应物功能(wherry,e.j.&kurachi,m.rev.immunol.,2015;philip,m.&schietinger,a.curr.opin.immunol.2019;kallies,a.,zehn,d.&utzschneider,d.t.nat.rev.immunol.2019)。
4.抗原暴露对肿瘤浸润cd4和cd8子集的相对平衡和功能特征的作用尚不清楚,并且可能与识别限制抗肿瘤t细胞功能的关键可靶向途径有关。
5.guo et al.,nature medicine 24,978-985(2018)描述了基于组合的单一细胞表达和t细胞抗原受体的谱系追踪分析,揭示了肿瘤浸润淋巴细胞的多个亚群。这些包括经历耗竭的肿瘤浸润cd8
t细胞,以及表现出耗竭前状态的细胞。鉴定了在每个不同亚群中特异性表达的列表,包括耗竭的肿瘤cd8
t细胞(90个基因)。
6.对增强免疫介导的癌症治疗的治疗剂和方法的需求仍未得到满足。本发明解决了这些和其他需要,并提供了如本文所述的相关优点。
技术实现要素:
7.广义地说,本发明涉及调节t细胞功能障碍以增强t细胞的细胞毒性,并从而增强
抗癌治疗。具体而言,本公开内容涉及使用药理学药剂来增强针对肿瘤的免疫应答,以及使用经改造t细胞(包括嵌合抗原受体t细胞(car-t)、经改造以表达转基因t细胞受体的t细胞和新生抗原反应性t细胞(nar-t)),它们在治疗肿瘤时表现出增强的细胞毒性活性。如本文中详细公开的,本发明人已经鉴定了由来自具有高肿瘤突变负担的肿瘤的肿瘤浸润淋巴细胞群中扩增的功能障碍t细胞(称为新生抗原相关功能障碍t细胞,即neo-dys)表达的关键基因。他们还发现,这些基因是控制对功能障碍t细胞中抗肿瘤t细胞功能的限制的关键因素,并且靶向这些基因增强了新生抗原负荷高的癌症中的肿瘤免疫应答。特别是,靶向这些基因可能在可能表现出一些免疫逃逸的肿瘤,例如对免疫治疗有抗性或可能对免疫治疗有抗性的肿瘤的情况下特别有用。本发明人还通过实验验证了这些靶基因的子集,表明了所有鉴定的靶基因的可能效果。
8.因此,在本发明的第一个方面中,提供了用于治疗增殖性病症的方法中的经改造t细胞,其具有经调节的选自以下的一种或更多种基因的表达:stom、furin、sit1、cd7、samsn1、sirpg、cd82、fcrl3、il1rap、axl、e2f1、c5orf30、cldnd1、cotl1、dusp4、epha1、fabp5、gfi1、itm2a、park7、pecam1、phlda1、rab27a、rbpj、rgs1、rgs2、rnaseh2a、suv39h1和tnip3。在一些实施方案中,经改造t细胞具有降低的选自以下的一种或更多种基因的表达:sit1、samsn1、sirpg、cd7、fcrl3、il1rap、furin、stom、axl、e2f1、c5orf30、cldnd1、cotl1、dusp4、epha1、fabp5、gfi1、itm2a、park7、pecam1、phlda1、rab27a、rbpj、rgs1、rgs2、rnaseh2a、suv39h1、cd82和tnip3,和/或者提高的选自以下的一种或更多种基因的表达或活性:sit1、samsn1、sirpg、cd7、fcrl3、il1rap、furin、stom、axl、e2f1、c5orf30、cldnd1、cotl1、dusp4、epha1、fabp5、gfi1、itm2a、park7、pecam1、phlda1、rab27a、rbpj、rgs1、rgs2、rnaseh2a、suv39h1、cd82和tnip3。优选地,经改造t细胞具有降低的选自以下的一种或更多种基因的表达:sit1、samsn1、sirpg、cd7、cd82、fcrl3、il1rap、furin、stom、axl、e2f1、c5orf30、cldnd1、cotl1、dusp4、epha1、fabp5、gfi1、itm2a、park7、pecam1、phlda1、rab27a、rbpj、rgs1、rgs2、rnaseh2a、suv39h1、和tnip3,和/或者提高的cd7和/或sirpg的表达或者提高的cd7和/或sirpg的活性。在一些这样的实施方案中,一种或更多种基因选自axl、cd7、e2f1、fcrl3、furin、il1rap、pecam1、samsn1、sirpg、sit1、suv39h1、tnip3、和stom。在本公开内容的上下文中,基因的经调节表达包括转录水平和蛋白质产物水平下的调节。
9.在一些实施方案中,一种或更多种基因选自stom、furin、sit1、cd7、samsn1、sirpg、cd82、fcrl3、il1rap、axl、e2f1。这些基因中的每一个的调节已被实验地表明对t细胞活化有影响。特别地,一种或更多种基因可以有利地选自选自stom、furin、sit1和cd7的一种或更多种基因。在一些实施方案中,一种或更多种基因选自sit1、samsn1、sirpg、cd7、cd82、fcrl3、il1rap、furin、stom、axl、和e2f1。在一些实施方案中,一种或更多种基因选自stom、furin、sit1、sirpg、il1rap和cd7。特别地,一种或更多种基因可以有利地选自sit1、sirpg和il1rap。优选地,一种或更多种基因包括sit1。
10.在一些实施方案中,一种或更多种基因选自sit1、cd7、stom、furin、il1rap、sirpg、axl、e2f1a、cd82、samsn1、和fcrl3。对cd8 t细胞中所有这些基因的调节已被实验地表明对t细胞活化有影响。在一些这样的实施方案中,经改造t细胞是cd8
t细胞。优选地,一种或更多种基因选自sit1、cd7、stom、furin、il1rap和sirpg。在一些实施方案中,一种或更多种基因选自cd7、cd82、cotl1、dusp4、fabp5、itm2a、park7、phlda1、rab27a、rbpj、rgs1、
rgs2、samsn1、sit1、sirpg和tnip3。在一些这样的实施方案中,经改造t细胞是cd8
t细胞。在一些实施方案中,一种或更多种基因选自cd7、cd82、samsn1、sirpg和sit1。特别地,一种或更多种基因优选地包括sit1和/或sirpg。优选地,一种或更多种基因包括sit1。
11.在一些实施方案中,一种或更多种基因选自epha1、fcrl3、pecam1、stom、axl、furin、和il1rap。在一些实施方案中,一种或更多种基因选自epha1、fcrl3、pecam1、stom、axl、furin、il1rap、e2f1、c5orf30、cldnd1、gfi1、rnaseh2a、sirpg和suv39h1。在一些实施方案中,一种或更多种基因选自epha1、fcrl3、pecam1、stom、axl、furin、il1rap、e2f1、c5orf30、cldnd1、gfi1、rnaseh2a、和suv39h1。在一些这样的实施方案中,经改造t细胞是cd4
t细胞,例如效应cd4
t细胞。在一些实施方案中,一种或更多种基因选自sit1、cd7、stom、furin、il1rap、sirpg、axl、e2f1a、cd82、samsn1、和fcrl3。对cd4 t细胞中所有这些基因的调节已被实验地表明对t细胞活化有影响。优选地,一种或更多种基因选自axl、furin、il1rap、stom、fcrl3、sirpg和e2f1。在一些实施方案中,一种或更多种基因选自axl、furin、il1rap、stom、fcrl3、和e2f1。特别地,一种或更多种基因优选地包括il1rap和/或sirpg。
12.在一些实施方案中,t细胞包含嵌合抗原受体t细胞(car-t)、经改造t细胞受体(tcr)t细胞、来源于pbmc的经改造t细胞、或新生抗原反应性t细胞(nar-t)。优选地,t细胞包含新生抗原反应性t细胞(nar-t)。在一些实施方案中,t细胞被改造以表达转基因t细胞受体(tcr),例如癌症特异性tcr(例如ny eso-1)。在一些实施方案中,t细胞是如stadtmauer et al.(science 28feb 2020:vol.367,issue 6481,eaba7365)所述的经改造细胞,或如stadtmauer et al.中所述获得的细胞。在一些实施方案中,t细胞被改造以敲除编码内源性t细胞受体的一种或更多种基因(例如,编码内源性t细胞受体链tcrα(trac)和tcrβ(trbc)的基因)或下调其的表达。在一些实施方案中,经改造t细胞是tcr转导的t细胞。在一些实施方案中,一种或更多种基因包含sit1并且经改造t细胞包含来源于pbmc的经改造t细胞。经改造t细胞可以是car-t细胞或tcr转导的t细胞。
13.在一些实施方案中,经改造t细胞已被改造以过表达cd7和/或sirpg。在一些这样的实施方案中,经改造t细胞是经改造以过表达cd7的肿瘤浸润淋巴细胞,或者其中经改造t细胞不是肿瘤浸润淋巴细胞并且经改造t细胞已被改造以过表达sirpg。在一些实施方案中,经改造t细胞已被改造以具有降低的cd7和/或sirpg的表达。在一些这样的实施方案中,经改造t细胞是经改造以具有降低的sirpg的表达的肿瘤浸润淋巴细胞,或者其中经改造t细胞不是肿瘤浸润淋巴细胞并且经改造t细胞已被改造以具有降低的cd7的表达。在一些实施方案中,t细胞对于所述对象是自体的。
14.在本公开内容的任何方面的一些实施方案中,增殖性病症包括实体瘤。特别地,实体瘤可以是癌性肿瘤,包括原发性肿瘤或转移的继发性肿瘤。在本公开内容的任何方面的一些实施方案中,增殖性病症包括预计具有高新生抗原负荷的肿瘤。在一些实施方案中,如果肿瘤具有高肿瘤突变负担,则预测该肿瘤具有高新生抗原负荷。如果肿瘤具有每兆碱基至少1个体细胞突变、每兆碱基至少5个体细胞突变、或每兆碱基至少体细胞突变,则可以认为该肿瘤具有高肿瘤突变负担。如果肿瘤属于具有高体细胞突变患病率(prevalence)的癌症类型(例如,每兆碱基的体细胞突变的中值至少为1、至少为5或至少为10的肿瘤类型),则预测该肿瘤具有高新生抗原负荷。例如,肿瘤可以是黑素瘤或鳞状肺癌。alexandrov et al.(nature volume 500,pages 415
–
421(2013))中已经量化了多种癌症类型的体细胞突
变患病率。在本公开内容任何方面的一些实施方案中,增殖性病症选自黑素瘤、肺鳞状细胞癌、肺腺癌、膀胱癌、小细胞肺癌、食管癌、结直肠癌、宫颈癌、头颈癌、胃癌、子宫内膜癌和肝癌。
15.在本公开内容的任何方面的一些实施方案中,增殖性病症包括预计已经发生免疫逃逸或处于发生免疫逃逸的风险中的肿瘤。根据本公开内容,预计已经发生免疫逃逸或处于发生免疫逃逸的风险中的肿瘤是已经获得或预测可能获得免疫治疗的抗性的肿瘤或者显示出对免疫治疗的抗性的肿瘤。这些可包括:(i)已经经历免疫治疗且对所述免疫治疗未能响应或不再响应于所述免疫治疗的患者中的肿瘤,(ii)预计不太可能响应于免疫治疗的患者中的肿瘤,其中所述患者可未经历过(免疫治疗)治疗,(iii)被确定不具有t细胞浸润或具有低t细胞浸润的肿瘤,和(iv)在肿瘤浸润t细胞群中具有高比例的功能障碍t细胞的肿瘤。在一些实施方案中,如果选自sit1、samsn1、sirpg、cd7、fcrl3、il1rap、furin、stom、axl、e2f1、c5orf30、cldnd1、cotl1、dusp4、epha1、fabp5、gfi1、itm2a、park7、pecam1、phlda1、rab27a、rbpj、rgs1、rgs2、rnaseh2a、suv39h1、和tnip3的一种或更多种标志物的表达高于相应的对照值,和/或cd82的表达低于对照值,则可认为肿瘤在肿瘤浸润t细胞群中具有高比例的功能障碍t细胞,其中对照值可以对应于对照t细胞群中一种或更多种标志物的相应表达。在一些实施方案中,如果选自sit1、samsn1、sirpg、cd7、cd82、fcrl3、il1rap、furin、stom、axl、e2f1、c5orf30、cldnd1、cotl1、dusp4、epha1、fabp5、gfi1、itm2a、park7、pecam1、phlda1、rab27a、rbpj、rgs1、rgs2、rnaseh2a、suv39h1、和tnip3的一种或更多种标志物的表达高于或低于相应的对照值,则可认为肿瘤在肿瘤浸润t细胞群中具有高比例的功能障碍t细胞,其中对照值可以对应于对照t细胞群中一种或更多种标志物的相应表达。对照t细胞群可以是对照肿瘤浸润t细胞群。对照t细胞群可以是不显示功能障碍表型的t细胞群。功能障碍t细胞表型可以是t细胞耗竭表型或终末分化表型。对照t细胞群可以是具有低pd1表达、低gzmb表达和/或低eomes表达的t细胞群。对照值可以对应于能够控制肿瘤增殖的对照t细胞群中的一种或更多种标志物的相应表达。对照值可以对应于在刺激之后表达ifnγ的对照t细胞群中一种或更多种标志物的相应表达。
16.在任何方面的一些实施方案中,实体瘤包括癌。在一些实施方案中,癌选自非小细胞肺癌(non-small cell lung cancer,nsclc)或肾细胞癌(renal cell carcinoma,rcc)。优选地,癌是非小细胞肺癌(nsclc)。在一些实施方案中,实体瘤包括黑素瘤。在任何方面的一些实施方案中,增殖性病症选自肺腺癌、肾透明细胞癌、胰腺腺癌、肾乳头状癌、肝细胞癌、肾上腺皮质癌和间皮瘤。
17.在任何方面的一些实施方案中,降低的表达是通过一种或更多种基因的敲低(下调)或敲除来实现的。在一些实施方案中,敲除或下调是通过使用用于过表达的rna构建体或短发夹rna(shrna)、小干扰rna(sirna)、微rna(mirna)的转录激活因子样效应物核酸酶(talen)瞬时下调、crispr/cas9介导的基因编辑来改造的。特别考虑了对所选基因和/或其调节元件(例如启动子)的编辑。
18.在一些实施方案中,将经改造t细胞用于这样的治疗方法,所述治疗方法还包括同时、顺序或分开施用免疫检查点抑制剂治疗。在一些情况下,免疫检查点抑制剂治疗可包括ctla-4阻断、pd-1抑制、pd-l1抑制、lag-3(淋巴细胞激活3;基因id:3902)抑制、tim-3(t细胞免疫球蛋白和黏蛋白结构域3;基因id:84868)抑制、tigit(具有ig和itim结构域的t细胞
免疫受体;基因id:201633)抑制和/或btla(b和t淋巴细胞相关;基因id:151888)抑制。特别地,免疫检查点抑制剂可以包含:伊匹单抗(ipilimumab)、曲美木单抗(tremelimumab)、纳武单抗(nivolumab)、派姆单抗(pembrolizumab)、阿特珠单抗(atezolizumab)、阿维单抗(avelumab)或度伐单抗(durvalumab)。
19.在第二方面中,本发明提供了在哺乳动物对象中治疗增殖性病症的方法,其包括向有此需要的对象施用治疗有效量的经改造t细胞,其中t细胞已被改造以具有经调节的选自以下的一种或更多种基因的表达:stom、furin、sit1、cd7、samsn1、sirpg、cd82、fcrl3、il1rap、axl、e2f1、c5orf30、cldnd1、cotl1、dusp4、epha1、fabp5、gfi1、itm2a、park7、pecam1、phlda1、rab27a、rbpj、rgs1、rgs2、rnaseh2a、suv39h1和tnip3。在一些实施方案中,经改造t细胞具有降低的选自以下的一种或更多种基因的表达:sit1、samsn1、sirpg、cd7、cd82、fcrl3、il1rap、furin、stom、axl、e2f1、c5orf30、cldnd1、cotl1、dusp4、epha1、fabp5、gfi1、itm2a、park7、pecam1、phlda1、rab27a、rbpj、rgs1、rgs2、rnaseh2a、suv39h1、和tnip3,和/或者提高的cd7和/或sirpg的表达或者提高的cd7和/或sirpg的活性。在一些实施方案中,经改造t细胞已被改造以具有降低的选自以下的一种或更多种基因的表达:sit1、samsn1、sirpg、cd7、fcrl3、il1rap、furin、stom、axl、e2f1、c5orf30、cldnd1、cotl1、dusp4、epha1、fabp5、gfi1、il1rap、itm2a、park7、pecam1、phlda1、rab27a、rbpj、rgs1、rgs2、rnaseh2a、suv39h1、和tnip3,和/或者以具有提高的cd82的表达或提高的cd82的活性。
20.优选地,一种或更多种基因选自stom、furin、sit1、cd7、samsn1、sirpg、cd82、fcrl3、il1rap、axl、e2f1。在一些实施方案中,一种或更多种基因选自stom、furin、sit1和cd7。在一些实施方案中,一种或更多种基因选自stom、furin、sit1、cd7、il1rap和sirpg。在一些实施方案中,一种或更多种基因选自sit1、samsn1、sirpg、cd7、cd82、fcrl3、il1rap、furin、stom、axl、和e2f1。特别地,一种或更多种基因可以有利地选自sit1、sirpg和il1rap。优选地,一种或更多种基因包括sit1。
21.在一些实施方案中,一种或更多种基因选自sit1、cd7、stom、furin、il1rap、sirpg、axl、e2f1a、cd82、samsn1、和fcrl3。在一些这样的实施方案中,经改造t细胞是cd8
t细胞。在一些这样的实施方案中,一种或更多种基因选自sit1、cd7、stom、furin、il1rap和sirpg。在一些实施方案中,一种或更多种基因选自cd7、cd82、cotl1、dusp4、fabp5、itm2a、park7、phlda1、rab27a、rbpj、rgs1、rgs2、samsn1、sit1、sirpg和tnip3。在一些这样的实施方案中,经改造t细胞是cd8
t细胞。优选地,一种或更多种基因选自cd7、cd82、samsn1、sirpg和sit1。特别地,一种或更多种基因优选地包括sit1和/或sirpg。优选地,一种或更多种基因包括sit1。
22.在一些实施方案中,一种或更多种基因选自epha1、fcrl3、pecam1、stom、axl、furin、ll1rap、e2f1、c5orf30、cldnd1、gfi1、rnaseh2a、sirpg和suv39h1。在一些这样的实施方案中,经改造t细胞是cd4
t细胞,例如效应cd4
t细胞。在一些实施方案中,经改造t细胞是cd4
t细胞并且一种或更多种基因选自sit1、cd7、stom、furin、il1rap、sirpg、axl、e2f1a、cd82、samsn1、和fcrl3。在一些实施方案中,一种或更多种基因选自epha1、fcrl3、pecam1、stom、axl、furin和il1rap。优选地,一种或更多种基因选自axl、furin、il1rap、stom、fcrl3、sirpg和e2f1。特别地,一种或更多种基因优选地包括sirpg和/或il1rap。
23.在一些实施方案中,t细胞包含来源于pbmc的经改造t细胞、嵌合抗原受体t细胞(car-t)、经改造t细胞受体(tcr)t细胞或新生抗原反应性t细胞(nar-t)。优选地,t细胞包含新生抗原反应性t细胞(nar-t)。在一些实施方案中,t细胞经改造以表达转基因t细胞受体(tcr),例如癌症特异性tcr(例如ny eso-1)。在一些实施方案中,一种或更多种基因包含sit1并且经改造t细胞包含来源于pbmc的经改造t细胞。在一些实施方案中,经改造t细胞已被改造以过表达cd7和/或sirpg。在一些这样的实施方案中,经改造t细胞是被改造以过表达cd7的肿瘤浸润淋巴细胞,或者其中经改造t细胞不是肿瘤浸润淋巴细胞,并且经改造t细胞已被改造以过表达sirpg。在一些实施方案中,经改造t细胞已被改造以具有降低的cd7和/或sirpg的表达。在一些这样的实施方案中,经改造t细胞是经改造以具有降低的sirpg的表达的肿瘤浸润淋巴细胞,或者其中经改造t细胞不是肿瘤浸润淋巴细胞并且经改造t细胞已被改造以具有降低的cd7表达。在一些实施方案中,t细胞对于所述对象是自体的。在自体t细胞治疗中,从对象中取出的t细胞通常是离体经改造的,例如以将t细胞靶向肿瘤上表达的抗原(例如以插入编码嵌合抗原受体的基因)。有利地,根据本发明,t细胞可以在该离体阶段期间或作为该离体阶段的一部分进行另外的改造,以在随后将t细胞返回对象之前下调一种或更多种选定基因的表达。
24.在一些实施方案中,t细胞被改造以在施用于对象之前敲除一种或更多种选定基因或下调一种或更多种选定基因的表达。例如,t细胞可以被改造以敲除编码内源性t细胞受体的一种或更多种基因(例如,编码内源性t细胞受体链tcrα(trac)和tcrβ(trbc)的基因)或下调其的表达。在一些实施方案中,敲除或下调是通过使用用于过表达的rna构建体或短发夹rna(shrna)、小干扰rna(sirna)、微rna(mirna)的转录激活因子样效应物核酸酶(talen)瞬时下调、crispr/cas9介导的基因编辑来改造的。
25.在一些实施方案中,方法还包括向对象同时、顺序或分开施用免疫检查点抑制剂治疗。这样的组合治疗可产生抗肿瘤作用的协同增强。特别地,免疫检查点抑制剂治疗可包括ctla-4阻断、pd-1抑制、lag-3(淋巴细胞激活3;基因id:3902)抑制、tim-3(t细胞免疫球蛋白和黏蛋白结构域3;基因id:84868)抑制、tigit(具有ig和itim结构域的t细胞免疫受体;基因id:201633)抑制、btla(b和t淋巴细胞相关;基因id:151888)抑制和/或pd-l1抑制。例如,免疫检查点抑制剂可以选自:伊匹单抗、曲美木单抗、纳武单抗、派姆单抗、阿特珠单抗、阿维单抗或度伐单抗。
26.在一些实施方案中,方法还包括同时、顺序或分开施用根据第三方面的活性调节剂。
27.在第三方面中,本发明提供了由选自以下的基因编码的一种或更多种蛋白质的活性调节剂:stom、furin、sit1、cd7、samsn1、sirpg、cd82、fcrl3、il1rap、axl、e2f1、c5orf30、cldnd1、cotl1、dusp4、epha1、fabp5、gfi1、itm2a、park7、pecam1、phlda1、rab27a、rbpj、rgs1、rgs2、rnaseh2a、suv39h1和tnip3,所述活性调节剂用于增强患有增殖性病症的对象中的免疫治疗的方法中。优选地,活性调节剂是抑制剂并且一种或更多种基因选自:stom、furin、cd7、sit1、il1rap、samsn1、sirpg、cd82、fcrl3、e2f1、和axl。在一些实施方案中,活性调节剂是抑制剂并且一种或更多种基因选自:sit1、samsn1、sirpg、cd7、cd82、fcrl3、il1rap、furin、stom、e2f1、c5orf30、cldnd1、cotl1、dusp4、epha1、fabp5、gfi1、itm2a、park7、pecam1、phlda1、rab27a、rbpj、rgs1、rgs2、rnaseh2a、suv39h1、和tnip3。在一些实施
方案中,活性调节剂是cd82的激活剂。在一些实施方案中,活性调节剂是cd7和/或sirpg的激活剂。特别地,活性调节剂是抑制剂并且一种或更多种基因选自:sit1、sirpg和il1rap。优选地,一种或更多种基因包括sit1。活性调节剂可以是抑制剂,例如小分子抑制剂或阻断抗体。活性调节剂可以是激活剂,例如激动剂(例如激动剂抗体或配体)。
28.在一些实施方案中,活性调节剂是axl、cldnd1、e2f1、fabp5、furin、il1rap、samsn1、suv39h1或tnip3的小分子抑制剂。优选地,活性调节剂是axl、cldnd1、e2f1、furin、il1rap、samsn1、suv39h1或tnip3的小分子抑制剂。axl的可用小分子抑制剂包括bgb324(bemcentinib)和tp-093(dubermatinib)。e2f1的可用小分子抑制剂包括hlm006474(calbiochem,cas 353519-63-8)。fabp5的可用小分子抑制剂包括棕榈酸(pubchem substance id 24898107)。
29.在一些实施方案中,活性调节剂是(多)肽,例如结合并抑制axl、cd7、fcrl3、epha1、il1rap、itm2a、park7、pecam1、tnip3或sirpg的抗体或其片段。优选地,活性调节剂是结合并抑制axl、cd7、fcrl3、或sirpg的抗体或其片段。结合axl的抗体包括yw327.6s2(creative)、af154(r&d)和h#11b7-t11(creative)。结合cd7的抗体包括v55p2f2*b12(vertebrates antibodies limited)、rtf2(creative)和cht2(creative)。结合epha1的抗体包括2g7(creative)。结合fabp5的抗体包括hpa051895和sab1401130结合il1rap的抗体包括jg38-07(creative)。结合itm2a的抗体包括cbacn-303(creative)。结合park7的抗体包括cbl625(creative)。结合pecam1的抗体包括2h8(thermo fisher)、hrc72h88e3(creative)等。结合sirpg的抗体包括3h7(creative)和ox-119(absolute antibody)。tnip3阻断肽(nbp1-77365pep)可从novus获得。
30.在一些实施方案中,免疫治疗包括免疫检查点抑制、抗肿瘤疫苗或自体t细胞治疗。在一些实施方案中,免疫治疗包括施用根据第一或第二方面的经改造t细胞。在一些实施方案中,向对象施用的抑制剂/激活剂的量或剂量足以增强对象中cd4
t细胞和/或cd8
t细胞的细胞毒性活性。
31.在第四方面中,本发明提供了由选自以下的基因编码的一种或更多种蛋白质的活性调节剂:sit1、samsn1、sirpg、cd7、cd82、fcrl3、il1rap、furin、stom、axl、e2f1、c5orf30、cldnd1、cotl1、dusp4、epha1、fabp5、gfi1、itm2a、park7、pecam1、phlda1、rab27a、rbpj、rgs1、rgs2、rnaseh2a、suv39h1、和tnip3,所述活性调节剂用于增强患有增殖性病症的对象的免疫应答的方法中。活性调节剂可以是激活剂或抑制剂。在一些实施方案中,活性调节剂是抑制剂,优选地是由选自以下的基因编码的一种或更多种蛋白质的抑制剂:stom、furin、cd7、sit1、il1rap、samsn1、sirpg、cd7、cd82、fcrl3、il1rap、furin、stom、e2f1、和axl。在一些实施方案中,活性调节剂是激活剂,优选地是由选自cd7和sirpg的基因编码的一种或更多种蛋白质的激活剂。在一些实施方案中,活性调节剂是抑制剂并且一种或更多种基因选自:sit1、samsn1、sirpg、cd7、cd82、fcrl3、il1rap、furin、stom、e2f1、c5orf30、cldnd1、cotl1、dusp4、epha1、fabp5、gfi1、il1rap、itm2a、park7、pecam1、phlda1、rab27a、rbpj、
rgs1、rgs2、rnaseh2a、suv39h1、和tnip3。在一些实施方案中,活性调节剂是cd82的激活剂。在一些实施方案中,活性调节剂是sit1、sirpg或il1rap的抑制剂。在一些具体实施方案中,活性调节剂是cd82的抑制剂。
32.在一些实施方案中,活性调节剂是axl、cldnd1、e2f1、furin、il1rap、samsn1、suv39h1或tnip3的小分子抑制剂。在一些具体实施方案中,活性调节剂是cldnd1、e2f1、furin、il1rap、samsn1、suv39h1或tnip3的小分子抑制剂。在一些具体实施方案中,活性调节剂是il1rap的小分子抑制剂。在一些实施方案中,活性调节剂是结合并抑制axl、cd7、fcrl3、或sirpg的抗体或其片段。在一些具体实施方案中,活性调节剂是结合并抑制cd7、fcrl3或sirpg的抗体或其片段。在一些具体实施方案中,活性调节剂是结合并抑制sirpg的抗体或其片段。
33.在一些实施方案中,方法还包括施用免疫治疗。在一些这样的实施方案中,免疫治疗包括免疫检查点抑制、抗肿瘤疫苗或自体t细胞治疗。在一些实施方案中,免疫治疗包括使用根据第一或第二方面的经改造t细胞的t细胞治疗。在一些实施方案中,向对象施用的抑制剂/激活剂的量或剂量足以增强对象中cd4
t细胞和/或cd8
t细胞的细胞毒性活性。
34.在第五方面中,本发明提供了治疗哺乳动物对象中的增殖性病症的方法,其包括向对象施用治疗有效量的由选自以下的基因编码的一种或更多种蛋白质的活性调节剂:stom、furin、cd7、sit1、il1rap、samsn1、sirpg、cd82、fcrl3、axl、e2f1、c5orf30、cldnd1、cotl1、dusp4、epha1、fabp5、gfi1、il1rap、itm2a、park7、pecam1、phlda1、rab27a、rbpj、rgs1、rgs2、rnaseh2a、suv39h1、和tnip3,其中活性调节剂增强对象中一种或更多种t细胞的细胞毒性活性,并从而治疗增殖性病症。
35.活性调节剂可以是激活剂或抑制剂。在一些实施方案中,活性调节剂是抑制剂,优选地是由选自以下的基因编码的一种或更多种蛋白质的抑制剂:stom、furin、cd7、sit1、il1rap、samsn1、sirpg、cd7、cd82、fcrl3、il1rap、furin、stom、e2f1、和axl。在一些实施方案中,活性调节剂是激活剂,优选地是由选自cd7和sirpg的基因编码的一种或更多种蛋白质的激活剂。在一些实施方案中,活性调节剂是抑制剂并且一种或更多种基因选自:sit1、samsn1、sirpg、cd7、cd82、fcrl3、il1rap、furin、stom、e2f1、c5orf30、cldnd1、cotl1、dusp4、epha1、fabp5、gfi1、il1rap、itm2a、park7、pecam1、phlda1、rab27a、rbpj、rgs1、rgs2、rnaseh2a、suv39h1、和tnip3。在一些实施方案中,活性调节剂是cd82的激活剂。在一些实施方案中,活性调节剂是sit1、sirpg或il1rap的抑制剂。在一些具体实施方案中,活性调节剂是sit1的抑制剂。
36.在一些实施方案中,治疗方法还包括施用根据第一或第二方面的经改造t细胞。
37.在第六方面中,本发明提供了在哺乳动物对象中治疗增殖性病症的方法,其包括施用治疗有效量的根据第一或第二方面的经改造t细胞。在一些实施方案中,治疗方法还包括施用根据第三方面的活性调节剂。
38.根据第七方面,本发明提供了用于产生经改造t细胞的方法,其包括对t细胞进行遗传改造以增强选自以下的一种或更多种基因的表达和/或者敲除选自以下的一种或更多种基因或者下调选自以下的一种或更多种基因的表达:sit1、samsn1、sirpg、cd7、fcrl3、il1rap、furin、stom、axl、e2f1、c5orf30、cldnd1、cotl1、dusp4、epha1、fabp5、gfi1、itm2a、park7、pecam1、phlda1、rab27a、rbpj、rgs1、rgs2、rnaseh2a、suv39h1、cd82和tnip3。在一些
实施方案中,方法包括对t细胞进行遗传改造以敲除选自以下的一种或更多种基因或者下调选自以下的一种或更多种基因的表达:sit1、samsn1、fcrl3、il1rap、furin、stom、axl、e2f1、c5orf30、cldnd1、cotl1、dusp4、epha1、fabp5、gfi1、itm2a、park7、pecam1、phlda1、rab27a、rbpj、rgs1、rgs2、rnaseh2a、suv39h1、cd82和tnip3。在一些实施方案中,方法包括对t细胞进行遗传改造以增强选自cd7和sirpg的一种或更多种基因的表达。
39.在一些实施方案中,方法还包括在适合扩增的条件下培养t细胞以提供扩增的细胞群。在一些实施方案中,方法在体外进行。在一些实施方案中,对t细胞进行遗传改造是通过以下来进行的:使用用于过表达的rna构建体或短发夹rna(shrna)、小干扰rna(sirna)、微rna(mirna)的转录激活因子样效应物核酸酶(talen)瞬时下调、crispr/cas9介导的基因编辑,或者通过将核酸或载体引入细胞中。
40.在一些实施方案中,方法包括对t细胞进行遗传改造以增强cd82的表达和/或者敲除选自以下的一种或更多种基因或者下调选自以下的一种或更多种基因的表达:sit1、samsn1、sirpg、cd7、fcrl3、il1rap、furin、stom、axl、e2f1、c5orf30、cldnd1、cotl1、dusp4、epha1、fabp5、gfi1、itm2a、park7、pecam1、phlda1、rab27a、rbpj、rgs1、rgs2、rnaseh2a、suv39h1、和tnip3。在一些这样的实施方案中,一种或更多种基因选自axl、cd7、e2f1、fcrl3、furin、il1rap、pecam1、samsn1、sirpg、sit1、suv39h1、tnip3、和stom。在一些实施方案中,方法包括对t细胞进行遗传改造以增强cd7和/或sirpg的表达,和/或者敲除选自以下的一种或更多种基因或者下调选自以下的一种或更多种基因的表达:stom、furin、sit1、cd7、samsn1、sirpg、cd82、fcrl3、il1rap、axl、e2f1。在一些实施方案中,方法包括对t细胞进行遗传改造以增强cd82的表达和/或者敲除选自以下的一种或更多种基因或者下调选自以下的一种或更多种基因的表达:sit1、samsn1、sirpg、cd7、fcrl3、il1rap、furin、stom、axl、和e2f1。特别地,一种或更多种基因可以有利地选自sit1、sirpg和il1rap。优选地,一种或更多种基因包括sit1。
41.在一些实施方案中,方法包括对t细胞进行遗传改造以增强cd82的表达和/或者敲除选自以下的一种或更多种基因或者下调选自以下的一种或更多种基因的表达:cd7、cotl1、dusp4、fabp5、itm2a、park7、phlda1、rab27a、rbpj、rgs1、rgs2、samsn1、sit1、sirpg和tnip3。在一些这样的实施方案中,经改造t细胞是cd8
t细胞。优选地,方法包括对t细胞进行遗传改造以增强cd82的表达和/或者敲除选自以下的一种或更多种基因或者下调选自以下的一种或更多种基因的表达:cd7、samsn1、sirpg和sit1。特别地,一种或更多种基因优选地包括sit1和/或sirpg。优选地,一种或更多种基因包括sit1。
42.在一些实施方案中,方法包括对t细胞进行遗传改造以敲除选自以下的一种或更多种基因或者下调选自以下的一种或更多种基因的表达:epha1、fcrl3、pecam1、stom、axl、furin、和il1rap。在一些实施方案中,方法包括对t细胞进行遗传改造以敲除选自以下的一种或更多种基因或者下调选自以下的一种或更多种基因的表达:stom、furin、sit1、samsn1、cd82、fcrl3、il1rap、axl、e2f1。在一些实施方案中,一种或更多种基因选自:epha1、fcrl3、pecam1、stom、axl、furin、il1rap、e2f1、c5orf30、cldnd1、gfi1、rnaseh2a、sirpg和suv39h1。在一些实施方案中,一种或更多种基因选自:epha1、fcrl3、pecam1、stom、axl、furin、il1rap、e2f1、c5orf30、cldnd1、gfi1、rnaseh2a、和suv39h1。在一些这样的实施方案中,经改造t细胞是cd4
t细胞,例如效应cd4
t细胞。优选地,一种或更多种基因选自
100流式组群患者的人口统计详细信息。
47.图2
–
通过流式细胞术表征nsclc肿瘤内cd4 t细胞分化情况(a至i)对来自tracerx 100组群中14名患者的44个肿瘤区域的肿瘤浸润淋巴细胞(til)进行19标志物的流式细胞术。组合区域数据的无监督聚类确定了20个cd4亚群,这些亚群基于标志物表达和统一流形逼近与投影(uniform manifold approximation and projection,umap)降维空间中的共定位来手动分组为9个元集群。研究了与tmb的相关性。(a)热图代表由从所有样品中获得的流式细胞术数据的无监督聚类鉴定的所有20个集群的最小-最大级别(scaled)标志物表达。单独细胞中的数字代表集群中每种标志物的中值表达水平。左侧的条形示出每个集群内的事件数量。根据集群的表型特征和umap降维图中的共定位,将集群组合成元集群。(b)cd4分化情况的umap降维。来自(a)的元集群的位置已编号。(c)在无监督聚类的1000次迭代中的集群稳定性。细胞的集群身份(identity)是针对一次代表性迭代确定的(标签位于热图的右侧)。对于每种细胞,表示了在1000次迭代中在每个集群(标签在图下方)中被鉴定的概率。(d)肿瘤与ntl组织之间所有20个集群的差异丰度。显示了fdr调整的
–
log
10
p值和log2倍数变化值。(e)cd4群丰度与肿瘤基因组特征之间的关系。反映所测试的关系的方向和大小的p值和回归斜率(β系数)来自混合效应回归模型。(f)用于限定示例性样品的早期、tdys和tdt群的设门策略。(g)对于具有不同cd4染色的样品,显示了每个子集在所有手动设门(manually gated)中的cd4
细胞百分比。(h)早期、tdys和tdt子集丰度高vs.低的患者的无病存活(disease free survival,dfs)概率(根据中值分类)。示出了每个时间点的有风险的患者数量、对数秩p值和风险比(95%的置信区间)。(i)cd4子集丰度与阶段的关系。示出了混合效应回归模型p值(ns=不显著)。
48.图3-cd4分化偏斜(skewing)的出现与肿瘤突变负担相关。(a)来自肿瘤内cd4 t细胞的高维流式细胞术数据的迭代聚类,用于鉴定随tmb变化的群。(b)热图示出发现丰度随tmb稳定变化的群。集群丰度与tmb之间的相关性示出在右侧(皮尔逊r值)。(c)肿瘤vs.ntl组织中的差异集群丰度。示出了错误发现率调整的p值和log2倍数变化值。点的大小反映了集群的丰度。(d)评价的所有肿瘤区域中早期、tdys和tdt集群的分布。区域tmb显示在图上方。(e)在从前100名tracerx患者得到独立组群中的,早期的丧失和具有tmb的功能障碍子集的丰度增加。示出了发现组群1、验证组群2(左列和中列)和组合分析(右列)中手动设门群(以所有cd4细胞的百分比表示)的独立分析。每个点代表一个肿瘤区域,皮尔逊p值和r值与针对组织学和肿瘤多区域性校正的p值(pc)(来自混合效应回归模型)一起示出。(f)umap对cd4分化情况的降维。示出了不同tmb水平的cd4分化情况以及pd1和eomes荧光强度的分布。
49.图4-早期、tdys和tdt子集的表征。(a)手动设门早期、tdys和tdt子集的pd1 vs.cd57表达谱。(b)验证组群2中手动设门子集的标志物谱。山脊图(ridge plot)示出了有助于双轴图的独立样品的标志物分布。(c)根据(a)中表示的阈值,对关键标志物呈阳性的细胞百分比。示出了wilcoxon秩和检验p值(*p《0.05,**p《0.001,***p《0.0001,ns=不显著)。
50.图5-早期、tdys和tdt子集的单一细胞转录组学特征揭示了不同的调节机制。(a)早期、tdys和tdt子集是基于流式细胞术鉴定的特征通过应用于单一细胞rnaseq数据的双轴设门策略鉴定的。示出了tdys和tdt细胞的设门方案(cd3e
cd3g
cd4
cd8-细胞被预设门
(pregate),参见图s3a)。表达值表示为经归一化的log
10
转换的每百万读取计数(log
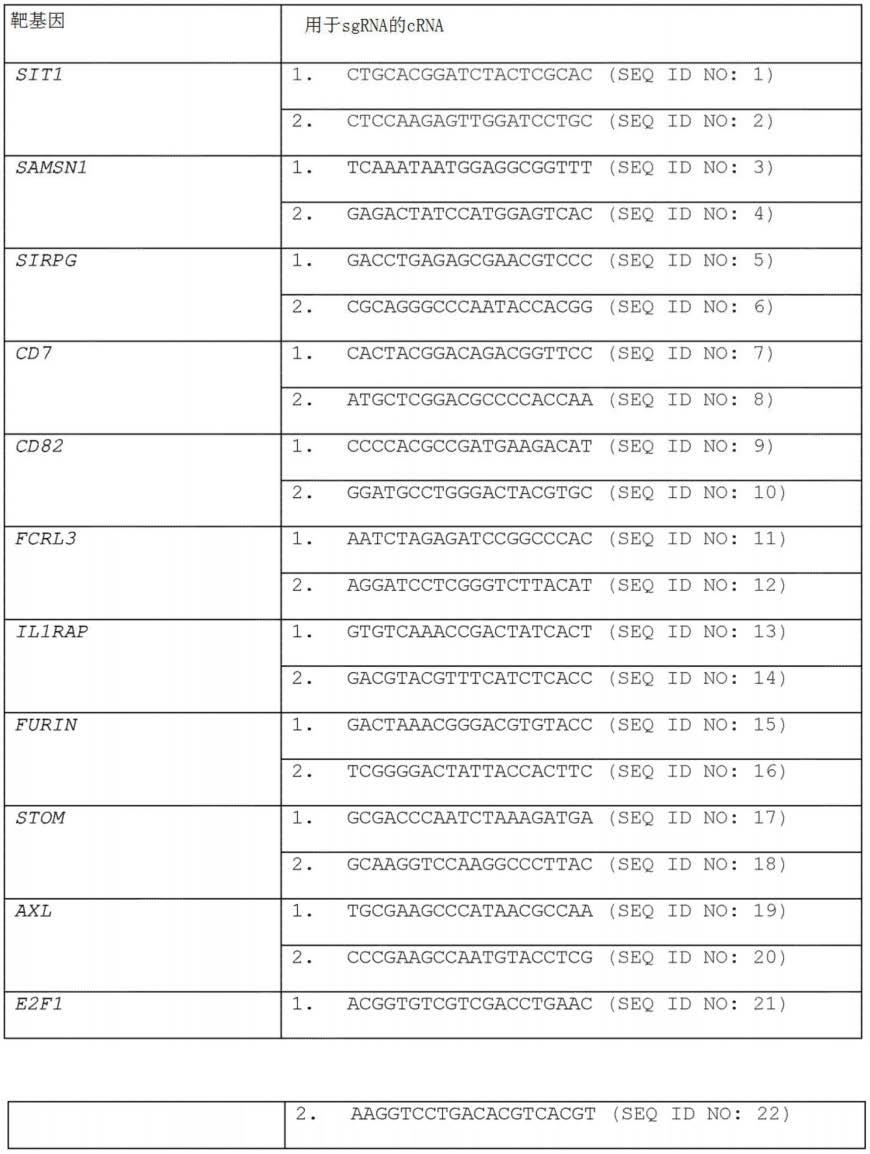
10
cpm)。(b)tdys和tdt随早期丰度的变化(占所有cd4
细胞的百分比)。示出了皮尔逊p值和r值。(c)使用设门策略中未使用但其预期表达(log
10
cpm)根据流式细胞术数据分析而已知的标志物确认子集身份。每个点代表一种单独的cd4 t细胞,并且示出了wilcoxon秩和检验p值(*p《0.05,**p《0.001,***p《0.0001,ns=不显著)。(d)示出了参与关键t细胞调节途径的基因的差异表达的热图。示出的所有基因在早期vs.tdys或早期vs.tdt之间的差异表达均》2倍,其中fdr调整的p《0.01。表达以z评分缩放的log
10 cpm值表示。(e,f)tdys和tdt vs.早期的差异表达的基因中cd4功能障碍特征的富集。(g)使用charoentong et al.2017的模块,在tdys和tdt vs.早期中富集的t辅助子集特征的gsea。示出了归一化富集评分(normalised enrichment score,nes)和fdr调整的p值。
51.图6
–
早期、tdys和tdt子集的单一细胞转录组学的表征(a)通过单一t细胞rna表达鉴定cd4早期子集的全设门策略。(b)早期、tdys和tdt子集之间典型th1、th2和tfh基因的差异表达。示出了wilcoxon秩和检验p值(*p《0.05,**p《0.001,***p《0.0001,ns=不显著)。
52.图7-早期、tdys和tdt子集的单一细胞转录组学的表征在早期、tdys和tdt群中,在单一t细胞rna表达水平上独有表达的表面蛋白编码基因(a)以及转录因子编码基因(b)。每种基因在一个子集vs.其子集中具有》4倍的差异表达,fdr调整的p《0.01。编码黏附分子和趋化因子受体(c)和含有itim的蛋白质(d)的差异表达基因;示出的所有基因在早期vs.tdys或早期vs.tdt之间的差异表达均》2倍,调整的p《0.01。(e)用于确认早期vs.tdys/tdt细胞的t中枢记忆样转录状态的gsea。示出了经归一化的富集评分(nes)和fdr调整的p值。
53.图8-cd4
ds
的经验证的基因特征预测了肺癌存活。(a)基因特征验证概述。使用具有高维流式细胞术和rnaseq二者的区域,在流式细胞术数据中鉴定了早期、tdys和tdt子集,并在rnaseq数据中测量了表达特征,以鉴定预测独立cd4子集的丰度的基因特征。(b)选定的cd4基因特征与早期、tdys和tdt子集的丰度之间的相关性。示出了皮尔逊相关r和fdr调整的-log
10 p值。进一步评价了显著相关的特征与tdys(中图)和tdt子集(右图)的关系。(c)xcell th2特征(xcell分化偏斜;xds)与tracerx rnaseq和tcga nsclc组群中的tmb相关。xds特征值是z评分缩放的,tmb值经过log
10
转换。示出了来自考虑肿瘤多区域性和组织学的混合效应回归模型的tracerx组群的经校正p值(pc)。示出了tcga分析的皮尔逊相关r值和p值。(d)kaplan-meier图表示具有高vs.低xds的患者的tracerx rnaseq组群中的无病存活(dfs)和tcga nsclc组群中的总存活(overall survival,os),根据上四分位数进行分类。示出了对数秩p值、风险比和95%置信区间。(e)tracerx中的dfs与作为连续变量的xds之间的关系的多变量cox回归分析。(f)kaplan-meier图表示具有高vs.低xds的从癌症基因组图谱(tcga)可公开获得的六个组群中的无病存活(dfs),根据上四分位数分类。示出了对数秩p值。(g)tcga组群中的dfs与作为连续变量的xds之间的关系的多变量cox回归分析,针对突变负担、阶段和t细胞浸润进行了校正。
54.图9-经验证的cd4
ds
基因特征预测了肺癌存活。(a)三个组群中患者阶段与xds特征之间的相关性。p值来自考虑组织学和多区域性的混合效应模型。(b)tracerx rnaseq组群中的多变量cox回归,针对克隆突变负担进行了校正。(c)tcga luad和lusc中的多变量cox回归分析,其示出了xds富集与存活之间的关系。
55.图10-基因特征、cd4子集丰度、tmb和dfs之间的相关性(a)tracerx rnaseq组群中分化偏斜的基因特征与cd4子集丰度之间的相关性。基因特征值已经进行z评分缩放。xue tcf7/lef1特征在具有tcf7和lef1双敲除的小鼠t细胞中富集。xds.核心特征是通过在原始xds特征中保留由tcf7/lef1敲除细胞上调的基因而获得的。xds.其他特征由剩余的xds基因组成。zheng cd4耗竭特征与通过流式细胞术测量的cd4
ds
不相关,并被选为阴性对照。皮尔逊p值和r值示出在图上。(b)与tmb的特征关系。(c)示出了多变量cox回归模型中与dfs的特征关系(包括t细胞浸润、组织学、阶段和tmb作为协变量(每个特征在单独的模型中进行评价))的森林图。
56.图11-cd4分化偏斜与treg丰度相关。(a)手动设门foxp3
treg丰度与组合tracerx流式细胞术组群中的tmb:早期丰度比率呈正相关。ith(肿瘤内基因组异质性)定义为[克隆/总突变负担]。绘制了皮尔逊r和fdr调整的-log
10 p值。(b)根据中值将区域分为高tmb vs.低tmb。在每组中,将区域根据三分位数进一步分为高、中和低cd4早期丰度(左侧图)。六个限定组中的每一个中的treg分布示出在右侧图中(示出了anova p值)。(c)先前发表的treg富集转录特征与通过流式细胞术测量的treg丰度之间的相关性,针对tracerx区域,其具有配对细胞术,以及rnaseq数据。(d)tracerx rnaseq中treg和cd4分化特征之间的关系,以及(e)tcga luad组群。示出了皮尔逊r值和p值以及针对样品多区域性校正的混合效应模型p值(pc)。(f)与tcga luad中的treg浸润呈正相关的趋化因子编码基因。在tracerx rnaseq组群中同样相关的基因被标为黑色,其他被标为灰色。(g)通过scrnaseq数据集中的早期、tdys、tdt和treg子集的编码与(f)中趋化因子相对应的趋化因子受体的基因的log
10 cpm表达。特征富集值经z评分缩放。(h)tmb、cd4 t细胞分化情况变化和患者结局之间关系的拟议模型。tmb产生增强肿瘤抗原性的抗原,促进了在充满祖细胞样cd4 t细胞的肿瘤的背景下的有效免疫。抗原持续性导致cd4分化偏斜。独立于tmb,treg也促进了cd4分化偏斜。tmb的竞争性免疫促进和妥协作用之间的平衡可有助于确定患者结局。
[0057]
图12-cd4分化偏斜与treg丰度相关。(a)tracerx流式细胞术组群中cd57 、cd57-和总treg丰度(占所有cd4细胞的百分比)与tmb之间的关系。(b至d)tracerx腺癌(b)、鳞状细胞癌(c)和tcga lusc(d)中treg转录特征与xds之间的关系。示出了皮尔逊p值和r值,以及来自在适当的情况下考虑了样品多区域性的混合效应回归模型的经校正p值(pc)。
[0058]
图13-实施例2的研究中使用的tracerx.100样品的患者人口统计和总结。a.consort图。b.患者组群的临床特征和组学分析(omics analysis)。c.根据组织学亚型和组织进行流式细胞术样品总结。luad:肺腺癌,lusc:肺鳞状细胞癌。
[0059]
图14-新生抗原负担限定了luad中的cd8 t细胞子集情况。a.上侧图:luad til内每个flowsom集群中cd8 t细胞的频率。集群由数字限定,彩色标题表示t细胞子集分类。下侧图:每个集群的经归一化标志物表达的热图。x轴表示集群描述。b.在luad病例中的每个cd8 t细胞集群的频率vs推定的新生抗原负荷的斯皮尔曼等级相关系数,实心圆圈和箭头表示显著相关性。c.luad til中新生抗原负荷vs集群频率的相关性图。d至f.luad肿瘤中cd8 t细胞的统一流形逼近与投影显示出标志物的相对表达(d),根据亲代子集染色的所有cd8 t细胞集群(e)或与新生抗原负荷相关的集群(f)。g.显示所示的集群(上)或手动设门cd8 t细胞子集(下)vs luad中新生抗原负荷的比率的相关性图。肿瘤区域(左)或患者(右)。所有图中的数据来自16名患者的n=32个肿瘤区域。b、c、g中的r和padj来自由bh校正
的2尾斯皮尔曼等级相关系数,fdr 0.05。luad:肺腺癌,lusc:肺鳞状细胞癌,temra:重新表达cd45ra的终末分化效应记忆细胞,tde:终末分化效应细胞,tcm:中枢记忆样细胞,trm:组织驻留记忆细胞,tdys:具有功能障碍表型的t细胞,cl:集群。
[0060]
图15
–
tracerx nsclc样品中cd8 t细胞的无监督流式细胞术分析。a.用于导出活cd8 t细胞进行聚类的设门树。直方图示出来自串联正常组织和til的cd8 t细胞中的pd-1表达。b.luad til中cd8 t细胞的原始flowsom聚类热图和树枝形结构关系图(dendogram)c.来自50次聚类迭代的luad和lusc正常组织和til中cd8 t细胞的串联flowsom热图。d.pd-1
hi trm子集中指示集群的左侧直方图和右侧流式细胞术图。e.luad til中每个集群中按丰度降序排列的cd8 t细胞的频率。f.根据luad和lusc样品的组织类型,每个集群中cd8 t细胞的频率。g.来自所示患者(cruk00xx)的luad肿瘤区域(表示为r1至r6)的til样品的图例中所示的每个子集或集群中cd8 t细胞的频率。肿瘤区域luad n=34(17名患者),lusc n=39(18名患者),ntl luad=10,lusc=12。til:肿瘤样品,ntl:非肿瘤肺。luad:肺腺癌,lusc:肺鳞状细胞癌。temra:重新表达cd45ra的终末分化效应记忆细胞,tde:终末分化效应细胞,tcm:中枢记忆样细胞,trm:组织驻留记忆细胞,trm-dys:具有功能障碍表型的组织驻留记忆细胞,cl:集群。*padj《0.05(通过bh校正调整的双向anova)。
[0061]
图16
–
通过流式细胞术鉴定的nsclc中的cd8 t细胞子集。cd8 t细胞集群通过迭代无监督聚类进行鉴定,并根据flowsom树枝形结构关系图上的超集群形成、降维空间中的定位和功能的手动注释分类为所示的子集。有关参考,参见“实施例2-结果”。pd-1
hi trm子集中的集群在最后3行中被细分。temra:重新表达cd45ra的终末分化效应记忆细胞,tde:终末分化效应细胞,tcm:中枢记忆样细胞,trm:组织驻留记忆细胞,trm-dys:具有功能障碍表型的组织驻留记忆细胞,cl:集群,icb:免疫检查点阻断,ln:淋巴结。
[0062]
图17
–
tracerx中配对正交数据的流式细胞术分析的集成。a.使用流式细胞术数据进行免疫组学相关分析的样品分析流程示意图。b.流式细胞术组群中的肿瘤区域的组学数据可用性vs样品id(患者:区域),根据组织学区分。path.til=浸润的病理学til估计值。c.研究中具有可用流式细胞术数据的样品中预测的新生抗原数量。d.示出了tmb和新生抗原负荷之间的相关性,样品来自流式细胞术分析中使用的n=32tluad til样品。luad:肺腺癌,lusc:肺鳞状细胞癌。
[0063]
图18
–
luad和lusc肿瘤中cd8 t细胞的无监督和手动设门流式细胞术分析。a.luad肿瘤中cd8 t细胞的统一流形逼近与投影,示出了所示标志物的相对表达和b.根据亲代子集着色的独立集群。c.用于确认flowsom集群的手动设门策略。d.比较了luad til中通过聚类和手动设门鉴定的cd8 t细胞的频率的相关矩阵,热反映了斯皮尔曼等级相关系数。e.tdys:trm比率与x轴上表示的突变或新生抗原的数目之间的斯皮尔曼相关性热图。f.luad til中指示的cd8 t细胞集群频率与高亲和力克隆新生抗原负荷的相关性。g.luad和lusc肿瘤中cd8 t细胞集群的频率。h.lusc til中指示的cd8 t细胞集群频率与新生抗原负荷的相关性。a至d、g中的数据来自n=33个肿瘤区域(17名患者),e至f n=32xy对(16名患者)。g至h中的lusc样品来自来自18名患者的n=36(g)或n=32xy对(h)。*padj《0.05 2尾斯皮尔曼秩检验(d,e,f,h)或双向anova(g)。《50nm=预测的neo亲和力阈值,tmb=肿瘤突变负担,mb=突变负担,non-neo=预测的非新生抗原编码突变。neo=新生抗原。
[0064]
图19-与新生抗原负荷相关的cd8 t细胞表现出功能障碍的表型标志和分子标志。
a.示出的标志物的荧光强度是在与新生抗原负荷相关的cd8 t细胞集群上测量的。b.tdys上指示的标志物的相对mfi vs trm集群2、3和5上的平均表达以有利于tdys的log2倍数变化表示。c.指示标志物的几何mfi与tdys设门luad cd8 t细胞中新生抗原负荷的相关性。d.为rnaseq分析分离的cd8 t细胞子集的分选逻辑,其示出了代表性患者。e.示出了来自tracerx中n=3名nsclc患者(cruk0024、cruk0069、cruk0017)的t细胞子集的rnaseq数据的差异基因表达分析的火山图,y轴代表多重比较调整的p值(fdr 0.05下的bh)。f.使用来自nsclc和黑素瘤cd8 t细胞子集的基因集的rnaseq数据的gsea。g.用于分析rnaseq数据的9个基因集中的4个的gsea富集图。padj=fdr 0.05下的bh校正的p值。
[0065]
图20
–
与新生抗原负担相关的cd8 t细胞群的扩展分析。a.指定集群中标志物的mfi,示出了来自16名luad患者的33个肿瘤区域的数据。对于trm集群,绘制了cl.2、3、5的平均值。b.在来自luad til的n=32xy对中,总cd8 t细胞上指示的标志物的mfi vs新生抗原负荷的相关性。c.低和高新生抗原负荷luad til区域中hla-dr表达的直方图(中值分割)。d.示出e的分析方法的示意图。e.示出每个标志物的斯皮尔曼等级相关值与x轴上指示的集群中的新生抗原负荷的相关矩阵。*padj《0.05。
[0066]
图21-与新生抗原负担相关的cd8 t细胞表现出肿瘤特异性功能障碍重编程和克隆型扩增。a.16名luad患者的n=33个肿瘤区域的非设门或cd45ra-cd57-pd-1
hi cd8 t细胞中tdys(cl.1)的频率,配对t检验。b.手动设门的cd45ra-cd57-pd-1
hi cd8 t细胞vs新生抗原负荷的相关性图,来自16名luad患者的n=32xy对肿瘤区域。c.从tracerx中n=3名nsclc患者(cruk0024、cruk0069、cruk0017)的til或匹配的正常组织中分选出来的pd-1
hi
cd57-ccr7-cd45ra-cd8 t细胞(tdys)或所有其他cd8 t细胞(非tdys)的rnaseq数据中差异表达基因的热图。d.使用来自鼠tcr转基因新生抗原诱导的肿瘤特异性t细胞功能障碍模型(schietinger et al immunity 2016)的基因集如上所述分选的til的gsea。e.来自cruk0024、cruk0069、cruk0017的肿瘤切除的tcrseq文库中的扩增的(1000个中》2个)t细胞受体序列的数量,所述tcrseq文库在分选的t细胞子集的rnaseq数据中匹配。黑色代表来自tcrseq中存在的rnaseq的扩增tcr序列。f.在每个分选的子集中鉴定的扩增tcr中的重叠或排他性。*padj《0.05,**padj《0.01。
[0067]
图22
–
从nsclc患者中分离的新表位特异性cd8 t细胞表现出功能障碍的表型。a.对在tracerx研究的试点病例中通过mhc多聚体分析检查的新表位反应性的描述。b.相对于来自l011、l012、l021的ntl、til和n=3新表位反应性(neo-ag til)中匹配的pbmc的pd-1mfi,误差棒代表sem。c.在患者l011中指示的群中所指示的标志物的表达。d.图例中指示的群的facs图和spice共表达谱由饼弧上示出的标志物表达限定。*padj《0.05,**padj《0.01。
[0068]
图23-新表位特异性cd8 t细胞表达功能障碍的基因程序,这些程序与多个组群中的突变负担相关。a.三个nsclc病例的离体til中的四种新表位反应性的mhc-多聚体鉴定,以及多聚体阳性或阴性til和匹配的ntl和pbmc上相关的pd-1表达。b.来自患者l011的多聚体阳性(n=33)和阴性(n=22)cd8 til的scrnaseq数据的分选策略和火山图。c.用于分析scrnaseq数据的9个基因集中的4个的gsea富集图。d.使用来自nsclc和黑素瘤cd8 t细胞子集的基因集的scrnaseq数据的gsea。e.示出了从来自小鼠和黑素瘤患者(melan.sv40 cd8 tdys)的新表位特异性cd8 t细胞和分选的tdys细胞(neo cd8 t dys)肿瘤特异性功能障碍
cd8 t细胞或nsclc的初始cd8 t细胞(初始cd8 t)发展的新生抗原负荷vs基因特征的经z转换的rnaseq评分的相关性图。来自tx.100luad(上排,来自35名患者的n=68个肿瘤区域)或tcgaluad(n=110)的数据。来自斯皮尔曼等级相关系数的相关性图中的r值和padj。e中的误差带代表95%的置信区间。*padj《0.05,**padj《0.01。
[0069]
图24
–
新生抗原相关功能障碍cd8 t细胞基因评分的产生、验证和应用。a.来自cl.1富集的集群rnaseq(trm-dys)和来自l011的新生抗原特异性cd8 t细胞(neo.cd8)neo.cd8 scrnaseq分析的gsea前沿基因vs来自guo et al在nsclc中的“tex”标志物基因(参阅正文以供参考)。红色突出了在每个数据集或两者(被用作neo.dys评分)中富集的基因。集群频率vs rnaseq评分的b.示意图和c.相关矩阵,用于使用利用流式细胞术的配对的luad病例验证基因特征。d.举例说明了rnaseq评分与wes数据整合的示意图和e.具有rnaseq数据的tx.100样品清单,示出了luad和lusc患者的可用组学数据。f.rnaseq评分分析中使用的luad病例的肿瘤区域中的病理学til估计值由样品集的中值新生抗原负荷分割。数据示出了12名患者的24个肿瘤区域(c)和35名患者的74个区域(f)。f中的误差棒代表sem。*padj《0.05,2尾斯皮尔曼检验。
[0070][0071]
图25
–
新生抗原负荷和mhc途径中断共同定义了cd8 t细胞功能障碍。a.来自具有可用的wes加rnaseq或流数据的tx.100中luad病例的抗原加工和呈递中的突变以及肿瘤区域中的hlaloh。b.在有或没有抗原呈递缺陷的证据的情况下,luad肿瘤区域中tdys细胞的频率(n=32个区域)。c.来自luad肿瘤区域的rnaseq数据,其示出了按新生抗原负荷(根据中值)和抗原呈递中断分类的组中的neo.tdys z-评分值。d.显示出在没有(左)或有(右)抗原呈递缺陷证据的情况下的luad肿瘤区域中新生抗原负荷vs neo.tdys rnaseq评分的相关性图。在c至d中,n=74个肿瘤区域。*padj《0.05。**padj《0.01。分析通过anova(b至c)或2尾斯皮尔曼秩检验(d)进行。通过r到z fisher变换计算的r的差异。
[0072]
图26-luad中cd8 t细胞子集与新生抗原定向免疫逃逸的关联。a.在有或没有抗原呈递缺陷的肿瘤中cd8 t细胞flowsom集群的频率。来自16名luad患者的n=32个肿瘤区域。b.在根据新生抗原负荷低或高区域(由中值限定)分组的抗原呈递缺陷分类肿瘤区域中的tdys cl.1cd8 t细胞的频率。c至d.根据c.分组或d.相关性分析vs luad肿瘤区域中的新生抗原负荷通过流式细胞术分析的有或没有抗原呈递缺陷的肿瘤区域中的tdys:trm比率。e.具有rnaseq数据的新生抗原高肿瘤区域中的新生抗原负荷,根据抗原呈递缺陷组进行区分。f至g.来自luad肿瘤区域的rnaseq数据,其示出了按新生抗原负荷(根据中值)和抗原呈递缺陷分类的组中的melan.sv40 tdys z评分值。f.显示出在没有(左)或有(右)免疫逃逸证据的luad肿瘤区域中的新生抗原负荷vs melan.sv40tdys rnaseq评分的相关性图。g.组分析。在d至e中,n=74个肿瘤区域。h.未经治疗的luad中的cd8 t细胞分化模型。*padj《0.05。**padj《0.01。通过anova或2尾斯皮尔曼秩检验进行分析。
[0073]
图27
–
对来自tracerx的肺癌患者的样品中的靶标的验证。(a至i)通过流式细胞术分析从iv期非小细胞肺癌中获得的肿瘤浸润淋巴细胞((a)中的sirpg、(d)中的sit1和(g)中的fcrl3的数据)。在不同子集的t细胞:非αβt细胞(群1)、pd1-tim3-cd8 t细胞(非肿瘤反应性的,群2)、pd1 tim3-cd8 t细胞(肿瘤反应性的,非耗竭的,群3)、pd1 tim3 cd8 t细胞(耗竭的cd8 t细胞,群4)和pd1 tim3 cd39 41bb cd8 t细胞(新生抗原反应性cd8 t细胞,
群5)上分析靶标表达。在两个不同的患者中分析每个靶标的表达,并绘制其平均荧光强度图((b)中的sirpg、(e)中的sit1和(h)中的fcrl3的数据)并显示在每个细胞子集的直方图中((c)中的sirpg、(f)中的sit1和(i)中的fcrl3的数据)。
[0074]
图28-sit1敲除t细胞显示出在体外再刺激之后ifnγ的产生增加。(a至c)将人外周血单个核细胞用αcd3和αcd28抗体刺激三天。在第三天,将细胞用cas9蛋白和靶向sit1的crrna进行电穿孔。将细胞用低剂量的白介素(interleuquin)2保持培养10天。在第10天,将细胞用cell trace violet染色,并用含有αcd3和αcd28的低剂量dynabead再刺激4天。在第14天,将细胞与布雷菲德菌素a(brefeldin a)一起培养4小时以积累细胞因子。将细胞染色用于流式细胞术并在facs symphony中获得细胞。(a)培养14天之后总cd3
t细胞上sit1表达的流式细胞术分析。(b)使cell trace violet(ctv)褪色(dilute)的ifnγ
cd4和cd8细胞的流式细胞术分析,将未经刺激的细胞用作对照。(c)ifnγ
t细胞的量化,对照非编辑相对于sit-1敲除。(d)所用方案的示意图。
[0075]
图29-选定的提出靶标的基因敲除。将人外周血单个核细胞用αcd3和αcd28抗体刺激三天。在第三天,将细胞用cas9蛋白和靶向每个所示靶基因(sirpg、sit1、il1rap)的crrna进行电穿孔。该图示出了在左上角图中鉴定的t细胞群(cd8和cd4 t细胞)中,fmo(荧光减一)对照(每个图中的顶部曲线)、未编辑的对照(每个图中的中间曲线)和已编辑的细胞(每个图中的底部曲线)中的每个靶基因的信号(事件数),以及在相应曲线旁边以百分比表示的阳性细胞的相关频率。
[0076]
图30.sit1敲除肿瘤浸润t细胞获得增强的增殖能力。将从nsclc患者获得的肿瘤浸润淋巴细胞ko并使用快速扩增方案(rapid expansion protocol,rep)扩增21天。在第21天,将细胞用ctv染色并用低剂量的αcd3/cd28珠再刺激。在四天之后,使用流式细胞术测量ctv稀释度。
[0077]
图31.与人t细胞共培养的表达okt3的肿瘤细胞。(a)pbmc来源的细胞:使用每个基因2种不同的crrna(命名为aa、ab、ac或ad)敲除人pbmc,然后进行cas9:crrna复合物的电穿孔。在4天之后,将经编辑的pbmc与表达抗cd3的肺肿瘤细胞(h228-oxt3)共培养。在24和72小时之后使用高维流式细胞术测量读出。(b)til:使用每个基因2种不同的crrna(命名为aa、ab、ac或ad)敲除nsclc til,然后进行cas9:crrna复合物的电穿孔。在4天之后,将经编辑的til与表达抗cd3的肺肿瘤细胞(h228-oxt3)共培养。在24和72小时后使用高维流式细胞术测量读出。
[0078]
图32.限定cd8 t细胞和cd4 t细胞中pd1 群的设门策略。这些图说明了用于限定cd4(b)和cd8(a)t细胞的pd1-、pd-1
高
和pd-1
总
(pd-1
int
pd-1
高
)群的设门策略。使用了四种不同的条件:未经刺激(左上)、用包被有抗cd3和抗cd28抗体的dynabead刺激(右上)、与肺癌细胞共培养(左下)以及与经修饰以表达抗cd3的肺癌细胞共培养(右下)。这些图示出了经修饰细胞示例样品(单一furin ko扩增的til样品)的结果。
[0079]
图33.与人pbmc来源的t细胞共培养的表达okt3的肿瘤细胞。这些图示出了图31a中描述的实验方案的结果。(a)体外刺激对照,cd8 t细胞,其在刺激72小时之后呈pd1 lamp-和pd1 lamp1 阳性。(b)体外刺激对照,cd4 t细胞,其在刺激72小时之后呈pd1 lamp1-和pd1 lamp1 阳性。(c)共培养的cd8 t细胞,其在刺激72小时之后呈pd1 lamp-和pd1 lamp1 阳性。(d)共培养的cd4 t细胞,其在刺激72小时之后呈pd1 lamp1-和pd1 lamp1
阳性。(e)共培养的cd4 t细胞,其在刺激72小时之后呈pd1 tim3 阳性。(f)共培养的cd8 t细胞,其在刺激72小时之后呈pd1 tim3 阳性。(a,b)未经刺激=未经刺激的t细胞;dynabead=用acd3/adc28覆盖的珠进行体外刺激;pma/离子霉素=用pma和离子霉素进行体外刺激。(c,d)ctrl=未经修饰的肿瘤细胞(x轴);acd3=经修饰以表达抗cd3的肿瘤细胞;1acd3 1:10=经修饰以表达抗cd3的肿瘤细胞与未修饰的肿瘤细胞的1:10混合物;ctrl=无规crrna(e,f)h228=未经修饰的肿瘤细胞,h228-okt3=经修饰以表达抗cd3的肿瘤细胞;1/10h2228-okt3=经修饰以表达抗cd3的肿瘤细胞与未经修饰肿瘤细胞的1:10混合物;ctrl=无规crrna。
[0080]
图34.h2228-okt3与nsclc til的共培养鉴定了pd1信号传导的调节物。nsclc til的敲除、与经修饰以表达抗cd3的肺癌细胞的共培养以及读出如关于图31b所解释的那样进行。该图示出的读出是cd4 t细胞群(a,b)和cd8 t细胞群(c,d)中pd-1
总
细胞(a,c)pd-1
高
细胞(b,d)的百分比。每种情况都是两次重复的结果,并示出平均值(主条)和平均值周围的标准偏差(细条)。对照是cd4 t和cd8 t细胞,其来自未经修饰的nsclc til(与经修饰以表达抗cd3的肺癌细胞共培养)。
[0081]
图35.与h2228-okt3肿瘤细胞共培养72小时之后,cd4和cd8 nsclc til furin ab ko的功能性和t细胞分化的变化。如关于图31b所述进行nsclc til的敲除、共培养和读出。这些图比较了未经编辑的cd4 til和furin ko cd4 til(a)、未经编辑的cd8 til和furin ko cd8 til(b)之间的功能性和t细胞分化的代表性标志物的阳性群的频率,由流式细胞术量化。每种情况都是两次技术重复的结果,并显示平均值和平均值附近的标准偏差。
[0082]
图36.与h2228-okt3肿瘤细胞共培养72小时之后,cd4和cd8 nsclc til axl ko的功能性和t细胞分化的变化。如关于图31b所述进行nsclc til的敲除、共培养和读出。a.未经编辑的cd4 til和axl ko cd4 til之间的功能性和t细胞分化的代表性标志物的阳性群的频率,通过流式细胞术量化。b.未经编辑的cd8 til和axl ko cd8 til之间的功能性和t细胞分化的代表性标志物的阳性群的频率,通过流式细胞术量化。对于每种情况,显示了两次重复的值,以及这些重复的平均值和平均值周围的标准偏差。
[0083]
图37.与h2228-okt3肿瘤细胞共培养72小时之后,cd4和cd8 nsclc til il1rap ko的功能性和t细胞分化的变化。如关于图31b所述进行nsclc til的敲除、共培养和读出。a.未经编辑的cd4 til和il1rap ko cd4 til之间的功能性和t细胞分化的代表性标志物的阳性群的频率,通过流式细胞术量化。b.未经编辑的cd8 til和il1rap ko cd8 til之间的功能性和t细胞分化的代表性标志物的阳性群的频率,通过流式细胞术量化。每种情况都是两次重复的结果,并显示平均值和平均值附近的标准偏差。
[0084]
图38.与h2228-okt3肿瘤细胞共培养72小时之后,cd4和cd8 nsclc til stom ko的功能性和t细胞分化的变化。如关于图31b所述进行nsclc til的敲除、共培养和读出。a.未经编辑的cd4 til和stom ko cd4 til之间的功能性和t细胞分化的代表性标志物的阳性群的频率,通过流式细胞术量化。b.未经编辑的cd8 til和stom ko cd8 til之间的功能性和t细胞分化的代表性标志物的阳性群的频率,通过流式细胞术量化。每种情况都是两次重复的结果,并显示平均值和平均值附近的标准偏差。
[0085]
图39.与h2228-okt3肿瘤细胞共培养72小时之后,cd4和cd8 nsclc til e2f1ako的功能性和t细胞分化的变化。如关于图31b所述进行nsclc til的敲除、共培养和读出。a.
未经编辑的cd4 til和e2f1a ko cd4 til之间的功能性和t细胞分化的代表性标志物的阳性群的频率,通过流式细胞术量化。b.未经编辑的cd8 til和e2f1a ko cd8 til之间的功能性和t细胞分化的代表性标志物的阳性群的频率,通过流式细胞术量化。每种情况都是两次重复的结果,并显示平均值和平均值附近的标准偏差。
[0086]
图40.与h2228-okt3肿瘤细胞共培养72小时之后,cd4和cd8 nsclc til samsn1 ko的功能性和t细胞分化的变化。如关于图31b所述进行nsclc til的敲除、共培养和读出。a.未经编辑的cd4 til和samsn1 ko cd4 til之间的功能性和t细胞分化的代表性标志物的阳性群的频率,通过流式细胞术量化。b.未经编辑的cd8 til和samsn1 ko cd8 til之间的功能性和t细胞分化的代表性标志物的阳性群的频率,通过流式细胞术量化。每种情况都是两次重复的结果,并显示平均值和平均值附近的标准偏差。
[0087]
图41.与h2228-okt3肿瘤细胞共培养72小时之后,cd4和cd8 nsclc til sirpg ko的功能性和t细胞分化的变化。如关于图31b所述进行nsclc til的敲除、共培养和读出。a.未经编辑的cd4 til和sirpg ko cd4 til之间的功能性和t细胞分化的代表性标志物的阳性群的频率,通过流式细胞术量化。b.未经编辑的cd8 til和sirpg ko cd8til之间的功能性和t细胞分化的代表性标志物的阳性群的频率,通过流式细胞术量化。每种情况都是两次重复的结果,并显示平均值和平均值附近的标准偏差。
[0088]
图42.与h2228-okt3肿瘤细胞共培养72小时之后,cd4和cd8 nsclc til cd7 ko的功能性和t细胞分化的变化。如关于图31b所述进行nsclc til的敲除、共培养和读出。a.未经编辑的cd4 til和cd7ko cd4 til之间的功能性和t细胞分化的代表性标志物的阳性群的频率,通过流式细胞术量化。b.未经编辑的cd8 til和cd7 ko cd8 til之间的功能性和t细胞分化的代表性标志物的阳性群的频率,通过流式细胞术量化。每种情况都是两次重复的结果,并显示平均值和平均值附近的标准偏差。
[0089]
图43.与h2228-okt3肿瘤细胞共培养72小时之后,cd4和cd8 nsclc til cd82 ko的功能性和t细胞分化的变化。如关于图31b所述进行nsclc til的敲除、共培养和读出。a.未经编辑的cd4 til和cd82ko cd4 til之间的功能性和t细胞分化的代表性标志物的阳性群的频率,通过流式细胞术量化。b.未经编辑的cd8 til和cd82 ko cd8 til之间的功能性和t细胞分化的代表性标志物的阳性群的频率,通过流式细胞术量化。每种情况都是两次重复的结果,并显示平均值和平均值附近的标准偏差。
[0090]
图44.与h2228-okt3肿瘤细胞共培养72小时之后,cd4和cd8 nsclc til fcrl3 ko的功能性和t细胞分化的变化。如关于图31b所述进行nsclc til的敲除、共培养和读出。a.未经编辑的cd4 til和fcrl3 ko cd4 til之间的功能性和t细胞分化的代表性标志物的阳性群的频率,通过流式细胞术量化。b.未经编辑的cd8 til和fcrl3 ko cd8 til之间的功能性和t细胞分化的代表性标志物的阳性群的频率,通过流式细胞术量化。每种情况都是两次重复的结果,并显示平均值和平均值附近的标准偏差。
[0091]
表1-用使用的crispr rna序列进行的crispr-cas9敲除所靶向的基因列表。
具体实施方式
[0092]
在描述本发明时,将采用以下术语,并且其旨在如以下所指示进行定义。
[0093]
在前述说明书中、或在所附权利要求中、或在附图中公开的以其特定的形式或者
在用于进行所公开的功能的方式或者用于获得所公开的结果的方法或工艺方面表示的特征可以适当地分别或以这样的特征的任何组合用于以其多种形式实现本发明。
[0094]
虽然已经结合上述示例性实施方案描述了本发明,但是当给出本公开内容时,许多等同的修改和变化对于本领域技术人员将是明显的。因此,以上阐述的本发明的示例性实施方案被认为是举例说明性的而不是限制性的。在不脱离本发明的精神和范围的情况下,可对所描述的实施方案进行多种改变。
[0095]
为了避免任何疑问,出于改善读者的理解的目的提供了本文中提供的任何理论说明。本发明人不希望受到任何这些理论说明的束缚。
[0096]
本文使用的任何章节标题仅用于组织目的,并且不应被解释为限制所描述的主题。
[0097]
在整个说明书(包括所附的权利要求书)中,除非上下文另有要求,否则词语“包含”和“包括”以及变化形式将被理解为暗示包含所指出的整体或步骤或者整体或步骤的组,但是不排除任何其他整体或步骤或者整体或步骤的组。
[0098]
必须注意的是,除非上下文另外明确指出,否则说明书和所附权利要求书中使用的没有数量词修饰的名词表示一个/种或更多个/种。范围可在本文中表示为从“约”一个特定值和/或至“约”另一特定值。当表达这样的范围时,另一个实施方案包括从一个特定值和/或至另一特定值。类似地,当通过使用在前的“约”将值表示为近似值时,将理解的是,特定值形成另一个实施方案。与数值相关的术语“约”是任选地,并且意指例如 /-10%。
[0099]
axl:本文中使用的“axl”是指由基因axl编码的酪氨酸蛋白激酶受体ufo蛋白。人axl蛋白的uniprot登录号是p30530。人bcl6的氨基酸序列以uniprot p30530-1显示,日期为2018年3月28日-v4(通过引用整体并入本文)。人axl基因的geneid是558。
[0100]
axl抑制剂:本文中使用的“axl抑制剂”是指抑制axl作为受体酪氨酸激酶的功能的化合物或药剂(包括干扰axl基因表达的药剂,例如rnai)。在一些实施方案中,axl抑制剂可以是小分子或肽。在一些实施方案中,axl抑制剂可以是小分子抑制剂bgb324(bemcentinib)或tp-093(dubermatinib)。在另一个实施方案中,axl抑制剂可以是抗体yw327.6s2(creative)、af154(r&d )或h#11b7-t11(creative)、或其衍生物。
[0101]
sit-1:“sit-1”(信号传导阈值调节跨膜衔接蛋白1,在本文中也称为“sit1”)由基因sit1编码。人sit-1的uniprot登录号是q9y3p8。人sit-1的氨基酸序列以q9y3p8-1显示,日期为1999年11月1日-v1(通过引用整体并入本文)。人sit-1基因的geneid是27240。
[0102]
samsn1:“samsn1”(含有sam结构域的蛋白质samsn-1)由基因samsn1编码。人samsn1的uniprot登录号是q9nsi8。人samsn1的氨基酸序列以q9nsi8-1显示,日期为2000年10月1日-v1(通过引用整体并入本文)。人samsn1基因的geneid是64092。
[0103]
sirpg:“sirpg”(信号调节蛋白γ)由sirpg基因编码。人sirpg的uniprot登录号是q9p1w8。人sirpg的氨基酸序列以q9p1w8-1显示,日期为2007年1月23日-v3(通过引用整体并入本文)。人sirpg基因的geneid是55423。
[0104]
cd7:“cd7”(t细胞抗原cd7)由基因cd7编码。人cd7的uniprot登录号是p09564。人cd7的氨基酸序列以p09564-1显示,日期为1989年7月1日-v1(通过引用将其整体并入本文)。人cd7基因的geneid是924。
[0105]
cd82:“cd82”(cd82抗原)由基因cd82编码。人cd82的uniprot登录号是p27701。人cd82的氨基酸序列以p27701-1显示,日期为1992年8月1日-v1(通过引用将其整体并入本文)。人cd82基因的geneid为3732。之前提出了cd82活性和免疫功能之间的关联(参见例如shibagaki et al.,eur j immunol.1999dec;29(12):4081-91和eur j immunol.1998apr;28(4):1125-33;lebel-binay s et al.,j immunol.1995jul1;155(1):101-10;laguadriere-gesbert et al.,eur j immunol.1998dec;28(12):4332-4344)。然而,本发明人首次证明cd82在功能障碍的t细胞中异常表达,并且增强cd82活性(通过蛋白质的表达或活化)可用于治疗增殖性病症。
[0106]
fcrl3:“fcrl3”(fc受体样蛋白3)由基因fcrl3编码。人fcrl3的uniprot登录号是q96p31。人fcrl3的氨基酸序列以q96p31-1显示,日期为2001年12月1日-v1(通过引用将其整体并入本文)。人fcrl3基因的geneid是115352。
[0107]
il1rap:“il1rap”(白介素-1受体辅助蛋白)由基因il1rap编码。人il1rap的uniprot登录号是q9nph3。人il1rap的氨基酸序列以q9nph3-1显示,日期为2003年8月22日-v2(通过引用将其整体并入本文)。人il1rap基因的geneid是3556。
[0108]
弗林蛋白酶:“弗林蛋白酶”由基因furin编码。人弗林蛋白酶的uniprot登录号是p09958。人弗林蛋白酶的氨基酸序列以p09958-1显示,日期为1990年4月1日-v2(通过引用将其整体并入本文)。人furin基因的geneid是5045。
[0109]
stom:“stom”(红细胞带7完整膜蛋白)由基因stom编码。人stom的uniprot登录号是p27105。人stom的氨基酸序列以p27105-1显示,日期为2007年1月23日-v3(通过引用将其整体并入本文)。人stom基因的geneid是2040。
[0110]
e2f1:“e2f1”(转录因子e2f1)由基因e2f1编码。e2f1a是指e2f1的e2f1a转录物。因此,本文对“e2f1a”的任何提及应解释为指代e2f1,并且对“e2f1”的任何提及应解释为包含e2f1a。人e2f1的uniprot登录号是q01094。人e2f1的氨基酸序列以q01094-1显示,日期为1993年7月1日-v1(通过引用将其整体并入本文)。人e2f1基因的geneid是1869。
[0111]
c5orf30:“c5orf30”(unc119结合蛋白c5orf30)由基因c5orf30编码。人c5orf30的uniprot登录号是q96gv9。人crorf30的氨基酸序列以q96gv9-1显示,日期为2001年12月1日-v1(通过引用将其整体并入本文)。人c5orf30基因的geneid是90355。
[0112]
cldn1:“cldn1”(密封蛋白-1)由基因cldn1编码。人cldn1的uniprot登录号是o95832。人cldn1的氨基酸序列以o95832-1显示,日期为1999年5月1日-v1(通过引用将其整体并入本文)。人cldn1基因的geneid是9076。
[0113]
cotl1:“cotl1”(毛状样蛋白)由基因xx编码。人cotl1的uniprot登录号是q14019。人cotl1的氨基酸序列以q14019-1显示,日期为2007年1月23日-v3(通过引用将其整体并入本文)。人cotl1基因的geneid是23406。
[0114]
dusp4:“dusp4”(双特异性蛋白磷酸酶4)由基因dusp4编码。人dusp4的uniprot登录号是q13115。人dusp4的氨基酸序列以q13115-1显示,日期为1996年11月1日-v1(通过引用将其整体并入本文)。人dusp4基因的geneid是1846。
[0115]
epha1:“epha1”(肝配蛋白a型受体1)由基因epha1编码。人epha1的uniprot登录号是p21709。人epha1的氨基酸序列以p21709-1显示,日期为2011年1月11日-v4(通过引用将其整体并入本文)。人epha1基因的geneid是2041。
[0116]
fabp5:“fabp5”(脂肪酸结合蛋白5)由基因fabp5编码。人fabp5的uniprot登录号是q01469。人fabp5的氨基酸序列以q01469-1显示,日期为2007年1月23日-v3(通过引用将其整体并入本文)。人fabp5基因的geneid是2171。
[0117]
gfi1:“gfi1”(锌指蛋白gfi-1)由基因gfi1编码。人gfi1的uniprot登录号是q99684。人gfi1的氨基酸序列以q99684-1显示,日期为2003年8月15日-v2(通过引用将其整体并入本文)。人gfi1基因的geneid为2672。
[0118]
itm2a:“itm2a”(完整膜蛋白2a)由基因itm2a编码。人itm2a的uniprot登录号是o43736。人itm2a的氨基酸序列以o43736-1显示,日期为1999年7月15日-v2(通过引用将其整体并入本文)。人itm2a基因的geneid是9452。
[0119]
park7:“park7”(蛋白质/核酸去糖化酶dj-1)由基因park7编码。人park7的uniprot登录号是q99497。人park7的氨基酸序列以q99497-1显示,日期为2004年7月5日-v2(通过引用将其整体并入本文)。人park7基因的geneid是11315。
[0120]
pecam1:“pecam1”(血小板内皮细胞黏附分子)由基因pecam1编码。人pecam1的uniprot登录号是p16284。人pecam1的氨基酸序列以p16284-1显示,日期为2018年3月28日-v2(通过引用将其整体并入本文)。人pecam1基因的geneid为5175。
[0121]
phlda1:“phlda1”(普列克底物蛋白同源物样结构域家族a成员1)由基因phlda1编码。人phlda1的uniprot登录号是q8wv24。人phlda1的氨基酸序列以q8wv24-1显示,日期为2009年5月5日-v4(通过引用将其整体并入本文)。人phlda1基因的geneid是22822。
[0122]
rab27a:“rab27a”(ras相关蛋白rab-27a)由基因rab27a编码。人rab27a的uniprot登录号是p51159。人rab27a的氨基酸序列以p51159-1显示,日期为2006年10月17日-v3(通过引用将其整体并入本文)。人rab27a基因的geneid是5873。
[0123]
rbpj:“rbpj”(无毛的重组结合蛋白抑制剂,也称为cbf-1、jκ-重组信号结合蛋白、rbp-j、rbp-jk和肾癌抗原ny-ren-30)由基因rbpj编码。人rbpj的uniprot登录号是q06330,并且uniprot标识符是suh_human。人rbpj的氨基酸序列以q06330-1显示,日期为2011年6月28日-v3(通过引用将其整体并入本文)。人rbpj基因的geneid是3516。
[0124]
rgs1:“rgs1”(g蛋白信号传导调节物1)由基因rgs1编码。人rgs1的uniprot登录号是q08116。人rgs1的氨基酸序列以q08116-1显示,日期为2009年3月24日-v3(通过引用将其整体并入本文)。人rgs1基因的geneid是5996。
[0125]
rgs2:“rgs2”(g蛋白信号传导调节物2)由基因rgs2编码。人rgs2的uniprot登录号是p41220。人rgs2的氨基酸序列以p41220-1显示,日期为1995年2月1日-v1(通过引用将其整体并入本文)。人rgs2基因的geneid是5997。
[0126]
rnaseh2a:“rnaseh2a”(核糖核酸酶h2亚基a)由基因rnaseh2a编码。人rnaseh2a的uniprot登录号是o75792。人rnaseh2a的氨基酸序列以o75792-1显示,日期为2002年5月15日-v2(通过引用将其整体并入本文)。人rnaseh2a基因的geneid是10535。
[0127]
suv39h1:“suv39h1”(组蛋白-赖氨酸n-甲基转移酶suv39h1)由基因suv39h1编码。人suv39h1的uniprot登录号是o43463。人suv39h1的氨基酸序列以o43463-1显示,日期为1998年6月1日-v1(通过引用将其整体并入本文)。人suv39h1基因的geneid是6839。
[0128]
tnip3:“tnip3”(tnfaip3相互作用蛋白3)由基因tnip3编码。人tnip3的uniprot登录号是q96kp6。人tnip3的氨基酸序列以q96kp6-1显示,日期为2009年11月24日-v2(通过引
用将其整体并入本文)。人tnip3基因的geneid是79931。
[0129]
嵌合抗原受体
[0130]
嵌合抗原受体(chimeric antigen receptor,car)是提供抗原结合和t细胞活化功能二者的重组受体分子。例如,在dotti et al.,immunol rev(2014)257(1)中回顾了car结构和改造,该文献通过引用整体并入于此。
[0131]
car包含与跨膜结构域连接的抗原结合结构域以及信号传导结构域。任选的铰链结构域可以提供抗原结合结构域与跨膜结构域之间的分隔,并且可以充当柔性接头。
[0132]
car的抗原结合结构域可以基于抗体的抗原结合区,所述抗体对car所靶向的抗原具有特异性。例如,car的抗原结合结构域可以包含与靶蛋白特异性结合的抗体的互补决定区(complementarity-determining region,cdr)的氨基酸序列。car的抗原结合结构域可以包含与靶蛋白特异性结合的抗体的轻链和重链可变区氨基酸序列或由其组成。抗原结合结构域可以作为包含抗体的轻链和重链可变区氨基酸序列的序列的单链可变片段(scfv)提供。car的抗原结合结构域可以基于其他蛋白质:蛋白质相互作用(例如配体:受体结合)来靶向抗原;例如,已经使用基于il-13的抗原结合结构域开发了靶向il-13rα2的car(参见例如kahlon etal.2004cancer res 64(24):9160-9166)。
[0133]
跨膜结构域位于car的抗原结合结构域与信号传导结构域之间。跨膜结构域提供用于将car锚定到表达car的细胞的细胞膜上,其中抗原结合结构域位于胞外空间,而信号传导结构域位于细胞内部。car的跨膜结构域可以来源于cd3-ζ、cd4、cd8或cd28的跨膜区序列。
[0134]
信号传导结构域允许活化t细胞。car信号传导结构域可包含cd3-ζ胞内结构域的氨基酸序列,其为表达car的t细胞的磷酸化和活化提供了免疫受体酪氨酸激活模体(immunoreceptor tyrosine-based activation motif,itam)。包含其他含itam的蛋白质序列的信号传导结构域也已用于car,例如包含fcγri的含itam区域的结构域(haynes et al.,2001j immunol 166(1):182-187)。包含来源于cd3-ζ胞内结构域的信号传导结构域的car通常被称为第一代car。
[0135]
car的信号传导结构域还可以包含来源于共刺激分子的信号传导结构域的共刺激序列,以促进与靶蛋白结合之后表达car的t细胞的活化。合适的共刺激分子包括cd28、ox40、4-1bb、icos和cd27。具有包含另外共刺激序列的信号传导结构域的car通常被称为第二代car。
[0136]
在一些情况下,car被改造以提供不同胞内信号传导途径的共刺激。例如,与cd28共刺激相关的信号传导优先激活磷脂酰肌醇3-激酶(p13k)途径,而4-1bb介导的信号传导是通过tnf受体相关因子(traf)衔接蛋白。因此,car的信号传导结构域有时包含来源于超过一种共刺激分子的信号传导结构域的共刺激序列。包含具有多个共刺激序列的信号传导结构域的car通常被称为第三代car。
[0137]
任选的铰链区可以提供抗原结合结构域与跨膜结构域之间的分隔,并且可以充当柔性接头。铰链区可以是允许结合部分以不同方向定向的柔性结构域。铰链区可以来源于免疫球蛋白的igg1或ch2ch3区域。
[0138]
新生抗原反应性t细胞(nar-t)
[0139]
新生抗原是新形成的抗原,其以前没有呈递给免疫系统。新生抗原是肿瘤特异性
的,它是癌细胞内突变的结果,并因此不被健康(即非肿瘤)细胞表达。
[0140]
与野生型健康细胞表达的非突变蛋白质相比,新生抗原可由改变癌细胞所表达的蛋白质的任何非沉默突变引起。例如,突变蛋白质可以是易位或融合。
[0141]“突变”是指与来自同一个体的健康细胞相比,肿瘤细胞中核苷酸序列(例如dna或rna)的差异。核苷酸序列的差异可导致来自同一个体的健康细胞不表达的蛋白质的表达。例如,突变可以是单核苷酸变体(single nucleotide variant,snv)、多核苷酸变体、缺失突变、插入突变、易位、错义突变、或剪接位点突变,其导致氨基酸序列变化(编码突变)。
[0142]
人白细胞抗原(human leukocyte antigen,hla)系统是编码人中的主要组织相容性复合物(major histocompatibility complex,mhc)蛋白的基因复合物。可以加工新生抗原以产生不同的肽,当在mhc分子的环境中呈递时,这些肽可以被t细胞识别。这样呈递的新生抗原可代表对象中治疗或预防癌症的治疗性或预防性干预的靶标。
[0143]
干预可以包括主动免疫治疗方法,例如向对象施用包含新生抗原的免疫原性组合物或疫苗。或者,可以采用被动免疫治疗方法,例如过继性t细胞转移或b细胞转移,其中识别新生抗原的t和/或b细胞从肿瘤或其他身体组织(包括但不限于淋巴结、血液或腹水)分离,离体或体外扩增并重新施用于对象。
[0144]
t细胞可以在已知为t细胞提供促有丝分裂刺激的条件下通过离体培养进行扩增。例如,t细胞可以与细胞因子(例如il-2)或促有丝分裂抗体(例如抗cd3和/或cd28)一起培养。t细胞可以与可能已被辐照的抗原呈递细胞(antigen-presenting cell,apc)共培养。apc可以是树突状细胞或b细胞。树突状细胞可能已经用含有已鉴定新生抗原的肽作为单一刺激剂或作为刺激新生抗原肽的合并物进行脉冲。t细胞的扩增可以使用本领域已知的方法进行,包括例如使用提供另外共刺激信号的人工抗原呈递细胞(artificial antigen presenting cell,aapc)以及呈递适当肽的自体pbmc。自体pbmc可以用含有新生抗原的肽作为单一刺激剂,或者作为刺激新生抗原的合并物进行脉冲。
[0145]
经改造t细胞
[0146]
本发明提供了经改造t细胞,其中选自以下的基因的表达或者由这些基因编码的蛋白质的表达或活性已被调节以增强细胞毒性活性:sit1、samsn1、sirpg、cd7、cd82、fcrl3、il1rap、furin、stom、axl、e2f1、c5orf30、cldnd1、cotl1、dusp4、epha1、fabp5、gfi1、itm2a、park7、pecam1、phlda1、rab27a、rbpj、rgs1、rgs2、rnaseh2a、suv39h1、和tnip3。事实上,发现上述基因与肿瘤浸润t细胞中的功能障碍表型相关。特别地,在这些功能障碍的群中观察到sit1、samsn1、sirpg、cd7、fcrl3、il1rap、furin、stom、axl、e2f1、c5orf30、cldnd1、cotl1、dusp4、epha1、fabp5、gfi1、itm2a、park7、pecam1、phlda1、rab27a、rbpj、rgs1、rgs2、rnaseh2a、suv39h1、和tnip3的表达上调,以及cd82的下调。
[0147]
细胞可以是真核细胞,例如哺乳动物细胞。哺乳动物可以是人或非人哺乳动物(例如兔、豚鼠、大鼠、小鼠或其他啮齿动物(包括啮齿目中的任何动物)、猫、狗、猪、绵羊、山羊、牛(包括奶牛(cow)),例如奶牛(dairy cow),或牛目(order bos)中的任何动物)、马(包括马科(order equidae)中的任何动物)、驴和非人灵长类)。
[0148]
在一些实施方案中,细胞可以来自人对象或可以已经从人对象获得。
[0149]
细胞可以是cd4
t细胞或cd8
t细胞。在一些实施方案中,细胞是靶蛋白反应性car-t细胞。在本文的实施方案中,“靶蛋白反应性”car-t细胞是这样的细胞,其响应于car的抗
原结合结构域所具有特异性(例如在细胞表面表达)的靶蛋白而表现出t细胞的某些功能特性。在一些实施方案中,特性是与效应t细胞(例如细胞毒性t细胞)相关的功能特性。
[0150]
在一些实施方案中,经改造t细胞可以表现出一种或更多种以下特性:对包含或表达靶蛋白的细胞的细胞毒性;增殖、ifnγ表达提高、cd107a表达提高、il-2表达提高、tnfα表达提高、穿孔素表达提高、颗粒酶b表达提高、颗粒溶素表达提高、和/或fas配体(fasl)表达提高(响应于靶蛋白或者包含或表达靶蛋白的细胞)。
[0151]
在一些实施方案中,经改造t细胞表达经改造t细胞受体。例如,经改造t细胞可以表达癌症特异性t细胞受体,例如ny-eso-1t细胞受体。在一些实施方案中,经改造t细胞不表达内源性t细胞受体。在一些实施方案中,经改造t细胞不表达免疫检查点分子程序性细胞死亡蛋白1(pd-1)。在一些实施方案中,经改造t细胞已被改造以移除内源性t细胞受体和/或免疫检查点分子程序性细胞死亡蛋白1(pd-1)。在一些实施方案中,经改造t细胞是如stadtmauer et al.(science 28feb 2020:vol.367,issue 6481,eaba7365)中所述的细胞,或如stadtmauer et al.所述获得的细胞。
[0152]
基因表达可以通过本领域技术人员已知的多种方法测量,例如通过基于报道分子的方法,或通过定量实时pcr(qrt-pcr)来测量mrna水平。类似地,蛋白质表达可以通过本领域公知的多种方法来测量,例如通过基于抗体的方法,例如通过western印迹、免疫组织化学、免疫细胞化学、流式细胞术、elisa、elispot或基于报道分子的方法。
[0153]
本发明还提供了用于产生根据本发明的经改造t细胞的方法,其包括对t细胞进行遗传改造(例如,使用用于过表达的rna构建体或短发夹rna(shrna)、小干扰rna(sirna)、微rna(mirna)的转录激活因子样效应物核酸酶(talen)瞬时下调、crispr/cas9介导的基因编辑,或者通过将核酸或载体引入细胞中)来增强cd82的表达和/或者敲除选自以下的一种或更多种基因或者下调选自以下的一种或更多种基因的表达:sit1、samsn1、sirpg、cd7、fcrl3、il1rap、furin、stom、axl、e2f1、c5orf30、cldnd1、cotl1、dusp4、epha1、fabp5、gfi1、itm2a、park7、pecam1、phlda1、rab27a、rbpj、rgs1、rgs2、rnaseh2a、suv39h1、和tnip3。在一些实施方案中,方法另外地包括在适合扩增的条件下培养t细胞以提供扩增的细胞群。在一些实施方案中,方法在体外进行。
[0154]
在一些实施方案中,经改造t细胞还包含特异性识别在肿瘤上或附近(例如肿瘤基质)表达的抗原的引入的t细胞受体(例如嵌合抗原受体)。本发明还提供了将编码t细胞受体的分离的核酸或载体引入经改造t细胞中的方法。在一些实施方案中,分离的核酸或载体包含在病毒载体中,或者所述载体是病毒载体。在一些实施方案中,方法包括通过电穿孔引入根据本发明的核酸或载体。
[0155]
组合物
[0156]
本发明还提供了包含根据本发明的细胞的组合物。
[0157]
根据本发明的经改造t细胞可以被配制成用于临床使用的药物组合物,并且可以包含可药用载体、稀释剂、赋形剂或辅料。
[0158]
根据本发明,还提供了用于产生药学上有用的组合物的方法,这样的产生方法可以包括选自以下的一个或更多个步骤:分离如本文所述的经改造t细胞;和/或将本文所述的经改造t细胞与可药用载体、辅料、赋形剂或稀释剂混合。
[0159]
car、核酸、细胞和组合物的用途和使用方法
[0160]
根据本发明的经改造t细胞和药物组合物可用于治疗性和预防性方法。
[0161]
本发明还提供了根据本发明的经改造t细胞或药物组合物在制备用于治疗或预防疾病或病症的药物中的用途。
[0162]
本发明还提供了治疗或预防疾病或病症的方法,其包括向对象施用治疗有效量或预防有效量的根据本发明的经改造t细胞或药物组合物。
[0163]
施用
[0164]
根据本发明的激活剂/抑制剂或经改造t细胞或组合物的施用优选以“治疗有效”或“预防有效”的量,这足以显示出对对象的益处。实际施用的量和施用的速度和时间过程,将取决于疾病或病症的性质和严重程度。治疗处方(例如剂量决定等)是全科医生和其他医生的责任,并且通常会考虑待治疗的疾病/病症、个体对象的病症、递送部位、施用方法和从业者已知的其他因素。上述技术和方案的实例可见于remington’s pharmaceutical sciences,20th edition,2000,pub.lippincott,williams&wilkins中。
[0165]
根据本发明的一些方面的激活剂/抑制剂和经改造t细胞、组合物和其他治疗剂、药物和药物组合物可以被配制用于通过多种途径施用,包括但不限于肠胃外、静脉内、动脉内、肌内、皮下、皮内、瘤内和经口。car、核酸、载体、细胞、组合物和其他治疗剂和治疗剂可以被配制为流体或固体形式。流体制剂可以被配制用于通过注射到人体或动物体的选定区域或通过输注到血液中来施用。施用可以通过注射或输注到血液中,例如静脉内或动脉内施用。
[0166]
施用可以单独或者与其他治疗同时或顺序地组合,这取决于待治疗的病症。
[0167]
在一些实施方案中,使用本发明的激活剂/抑制剂或经改造t细胞或组合物的治疗可以伴随其他治疗性或预防性干预,例如化学治疗、免疫治疗、放射治疗、手术、疫苗接种和/或激素治疗。
[0168]
同时施用是指将激活剂/抑制剂、经改造t细胞或组合物和治疗剂一起施用(例如作为含有这两种药剂的药物组合物(组合制剂)),或一者紧接着另一者并且任选地通过相同的施用途径,例如施用至同一动脉、静脉或其他血管。顺序施用是指施用一种治疗剂,然后在给定时间间隔之后分开施用另外的药剂。不要求两种药剂通过相同的途径施用,虽然在一些实施方案中是这种情况。时间间隔可以是任何时间间隔。
[0169]
化学治疗和放射治疗分别指用药物或用电离辐射(例如使用x射线或γ射线的放射治疗)治疗癌症。
[0170]
药物可以是化学实体或生物剂,化学实体例如小分子药物、抗生素、dna嵌入剂、蛋白质抑制剂(例如激酶抑制剂);生物剂例如抗体、抗体片段、核酸或肽适配体、核酸(例如dna、rna)、肽、多肽或蛋白质。药物可以被配制成药物组合物或药物。制剂可以包含一种或更多种药物(例如一种或更多种活性剂)以及一种或更多种可药用稀释剂、赋形剂或载体。
[0171]
治疗可涉及施用超过一种药物。药物可以单独施用,或与其他治疗组合同时或顺序地施用,这取决于待治疗的病症。例如,化学治疗可以是涉及施用两种药物的共同治疗,其中一种或更多种可旨在治疗癌症。化学治疗可以通过一种或更多种施用途径施用,例如肠胃外、静脉内注射、经口、皮下、皮内或瘤内。
[0172]
可以根据治疗方案施用化学治疗。治疗方案可以是化学治疗施用的预定时间表、计划、方案或时间表,其可以由医师或医疗人员准备并且可以被定制以适合需要治疗的患
者。治疗方案可以指示以下一项或更多项:向患者施用的化学治疗类型;每种药物或辐射的剂量;施用之间的时间间隔;每次治疗的长度;任何治疗休息期(treatment holiday)的数量和性质(如果有的话)等。对于共同治疗,可以提供单一的治疗方案,该方案指示每种药物的施用方式。
[0173]
化学治疗药物和生物制剂可以选自:烷化剂,例如顺铂、卡铂、氮芥、环磷酰胺、苯丁酸氮芥、异环磷酰胺;嘌呤或嘧啶抗代谢物,例如硫唑嘌呤或巯基嘌呤;生物碱和萜类化合物,例如长春花生物碱(例如长春新碱、长春碱、长春瑞滨、长春地辛)、鬼臼毒素、依托泊苷、替尼泊苷、紫杉烷(例如紫杉醇(taxoltm)、多西紫杉醇);拓扑异构酶抑制剂,例如i型拓扑异构酶抑制剂喜树碱伊立替康(camptothecins irinotecan)和拓扑替康(topotecan),或ii型拓扑异构酶抑制剂安吖啶、依托泊苷、磷酸依托泊苷、替尼泊苷;抗肿瘤抗生素(例如蒽环类抗生素),例如放线菌素d、多柔比星(doxorubicin)(adriamycintm)、表柔比星(epirubicin)、博来霉素(bleomycin)、雷帕霉素(rapamycin);基于抗体的药剂,例如抗pd-1抗体、抗pd-l1抗体、抗tim-3抗体、抗ctla-4、抗4-1bb、抗gitr、抗cd27、抗blta、抗ox43、抗vegf、抗tnfα、抗il-2、抗gpiib/iiia、抗cd-52、抗cd20、抗rsv、抗her2/neu(erbb2)、抗tnf受体、抗egfr抗体,单克隆抗体或抗体片段,实例包括:西妥昔单抗(cetuximab)、帕尼单抗(panitumumab)、英夫利昔单抗(infliximab)、巴利昔单抗(basiliximab)、贝伐单抗(bevacizumab)阿昔单抗(abciximab)、达利珠单抗(daclizumab)、吉妥珠单抗(gemtuzumab)、阿仑单抗(alemtuzumab)、利妥昔单抗(rituximab)帕利珠单抗(palivizumab)、曲妥珠单抗(trastuzumab)、依那西普(etanercept)、阿达木单抗(adalimumab)、尼妥珠单抗(nimotuzumab);egfr抑制剂例如埃罗替尼(erlotinib)、西妥昔单抗和吉非替尼(gefitinib);抗血管生成剂,例如贝伐单抗癌症疫苗,例如sipuleucel-t
[0174]
其他化学治疗药物可以选自:13-顺式-视黄酸、2-氯脱氧腺苷、5-阿扎胞苷5-氟尿嘧啶、6-巯基嘌呤、6-硫鸟嘌呤、abraxane、放线菌素-d阿地白介素、阿仑单抗(alemtuzumab)、alimta、阿利维a酸(alitretinoin)、all-全反维甲酸、α干扰素、六甲蜜胺、甲氨蝶呤、氨磷汀、氨鲁米特(aminoglutethimide)、阿那格雷(anagrelide)、阿那曲唑(anastrozole)、阿拉伯糖胞嘧啶、(anastrozole)、阿拉伯糖胞嘧啶、三氧化二砷、天冬酰胺酶、atra阿扎胞苷、bcg、bcnu、苯达莫司汀(bendamustine)、贝伐单抗、贝沙罗汀(bexarotene)、比卡鲁胺(bicalutamide)、bicnu、博来霉素、硼替佐米(bortezomib)、白消安(busulfan)、甲酰四氢叶酸钙、喜树碱-11、卡培他滨(capecitabine)、carac
tm
、卡铂(carboplatin)、卡莫司汀(carmustine)、cc-5013、cci-779、ccnu、cddp、ceenu、西妥昔单抗、苯丁酸氮芥(chlorambucil)、顺铂、嗜橙菌因子、克拉
屈滨(cladribine)、可的松(cortisone)、cpt-11、环磷酰胺、阿糖胞苷dacogen、放线菌素d、达依泊汀α(darbepoetin alfa)、达沙替尼(dasatinib)、柔红霉素、道诺霉素(daunorubicin)、盐酸道诺霉素(daunorubicin hydrochloride)、道诺霉素脂质体(daunorubicin liposomal)、decadron、地西他滨(decitabine)、denileukin、diftitox、depocyt
tm
、地塞米松(dexamethasone)、醋酸地塞米松(dexamethasone acetate)、磷酸钠地塞米松(dexamethasone sodium phosphate)、dexasone、右雷佐生(dexrazoxane)、dhad、dic、diodex、多西他赛(docetaxel)、多柔比星(doxorubicin)、多柔比星脂质体(doxorubicin liposomal)、droxia
tm
、dtic、eligard
tm
、ellence
tm
、eloxatin
tm
、表阿霉素(epirubicin)、阿法依泊汀(epoetin alfa)、erbitux、埃罗替尼(erlotinib)、欧文菌l-天冬酰胺酶(erwinia l-asparaginase)、雌莫司汀(estramustine)、ethyol依托泊苷(etoposide)、磷酸依托泊苷(etoposide phosphate)、依维莫司(everolimus)、依西美坦(exemestane)、非格司亭(filgrastim)、氟尿苷(floxuridine)、氟达拉滨(fludarabine)、氟尿嘧啶(fluorouracil)、氟羟甲睾酮(fluoxymesterone)、氟他米特(flutamide)、亚叶酸(folinic acid)、氟维司群(fulvestrant)、吉非替尼(gefitinib)、吉西他滨(gemcitabine)、吉妥珠单抗(gemtuzumab ozogamicin)、gleevec
tm
、wafer、戈舍瑞林(goserelin)、粒细胞-集落刺激因子、粒细胞巨噬细胞集落刺激因子、hexadrol、六甲蜜胺、hmm、hydrocort氢化可的松(hydrocortisone)、氢化可的松磷酸钠(hydrocortisone sodium phosphate)、氢化可的松琥珀酸钠(hydrocortisone sodium succinate)、氢可通磷酸盐(hydrocortone phosphate)、羟基脲(hydroxyurea)、替伊莫单抗(ibritumomab)、替伊莫单抗(ibritumomab tiuxetan)、伊达比星(idarubicin)、ifn-α、异环磷酰胺(ifosfamide)、il-11、il-2、甲磺酸伊马替尼(imatinib mesylate)、咪唑甲酰胺(imidazole carboxamide)、干扰素α、干扰素α-2b(peg缀合物)、白介素-2、白介素-11、(干扰素α-2b)、伊立替康(irinotecan)、异维甲酸(isotretinoin)、伊沙匹隆(ixabepilone)、ixempra
tm
、门冬酰胺酶(kidrolase)、拉帕替尼(lapatinib)、l-天冬酰胺酶、lcr、来那度胺(lenalidomide)、来曲唑(letrozole)、甲酰四氢叶酸(leucovorin)、瘤可宁(leukeran)、leukine
tm
、亮丙瑞林(leuprolide)、长春新碱(leurocristine)、leustatin
tm
、脂质体ara-c、liquid洛莫司汀(lomustine)、l-pam、l-sarcolysin、lupronmaxidex、氮芥(mechlorethamine)、盐酸氮芥(mechlorethamine hydrochloride)、甲地孕酮(megestrol)、乙酸
甲地孕酮(megestrol acetate)、美法仑(melphalan)、巯基嘌呤(mercaptopurine)、美司钠(mesna)、mesnex
tm
、甲氨蝶呤(methotrexate)、甲氨蝶呤钠盐(methotrexate sodium)、甲泼尼龙(methylprednisolone)、丝裂霉素、丝裂霉素-c、米托蒽醌(mitoxantrone)、mtc、mtx、氮芥(mustine)、mylocel
tm
、奈拉滨(nelarabine)、neulasta
tm
、、尼鲁米特(nilutamide)、氮芥(nitrogen mustard)、奥曲肽(octreotide)、乙酸奥曲肽(octreotide acetate)、onxal
tm
、oprevelkin、奥沙利铂(oxaliplatin)、紫杉醇(paclitaxel)、蛋白结合型紫杉醇、帕米膦酸钠(pamidronate)、帕尼单抗(panitumumab)、peg干扰素、培门冬酶(pegaspargase)、培非格司亭(pegfilgrastim)、peg-intron
tm
、peg-l-天冬酰胺酶、pemetrexed、喷司他丁(pentostatin)、苯丙氨酸氮芥(phenylalanine mustard)、泼尼松龙(prednisolone)、泼尼松(prednisone)、甲基苄肼(procarbazine)、甲基苄肼(procarbazine)、prolifeprospan 20与carmustine implant雷洛昔芬(raloxifene)、利妥昔单抗(rituximab)、(干扰素α-2a)、柔红霉素盐酸盐(rubidomycin hydrochloride)、sandostatin沙格司亭(sargramostim)、索拉非尼(sorafenib)、sprycel
tm
、sti-571、链脲菌素(streptozocin)、su11248、舒尼替尼(sunitinib)、他莫昔芬(tamoxifen)、他莫昔芬(tamoxifen)、替莫唑胺(temozolomide)、替西罗莫司(temsirolimus)、替尼泊甙(teniposide)、tespa、沙利度胺(thalidomide)、硫鸟嘌呤(thioguanine)、thioguanine硫代磷酰胺(thiophosphoamide)、噻替派(thiotepa)、噻替派(thiotepa)、拓扑替康(topotecan)、托瑞米芬(toremifene)、托西莫单抗(tositumomab)、曲妥珠单抗(trastuzumab)、维a酸(tretinoin)、trexall
tm
、tspa、vcr、vectibix
tm
、viadur
tm
、长春碱(vinblastine)、硫酸长春碱(vinblastine sulfate)、vincasar长春新碱(vincristine)、长春瑞滨(vinorelbine)、酒石酸长春瑞滨(vinorelbine tartrate)、vlb、vm-26、伏立诺他(vorinostat)、vp-16、16、zevalin
tm
、
唑来膦酸(zoledronic acid)、伏立诺他(zolinza)、
[0175]
癌症
[0176]
在一些实施方案中,根据本发明待治疗或预防的疾病或病症是癌症。
[0177]
癌症可以是任何不期望的细胞增殖(或本身表现为不期望的细胞增殖的任何疾病)、赘生物或肿瘤,或者不期望的细胞增殖、赘生物或肿瘤的提高的风险或者对于不期望的细胞增殖、赘生物或肿瘤的倾向。癌症可以是良性的或恶性的,并且可以是原发性的或继发性的(转移性的)。赘生物或肿瘤可以是细胞的任何异常生长或增殖并且可以位于任何组织中。组织的实例包括肾上腺、肾上腺髓质、肛门、阑尾、膀胱、血液、骨骼、骨髓、肠、脑、乳房、盲肠、中枢神经系统(包括或不包括脑)、小脑、宫颈、结肠、十二指肠、子宫内膜、上皮细胞(例如肾上皮细胞)、眼、生殖细胞、胆囊、食管、神经胶质细胞、头颈部、心脏、回肠、空肠、肾、泪腺、喉、肝、肺、淋巴、淋巴结、淋巴母细胞、上颌、纵隔、肠系膜、子宫肌层、口、鼻咽、网膜、口腔、卵巢、胰腺、腮腺、周围神经系统、腹膜、胸膜、前列腺、唾液腺、乙状结肠、皮肤、小肠、软组织、脾、胃、睾丸、胸腺、甲状腺、舌、扁桃体、气管、子宫、阴户、白细胞。
[0178]
不希望受理论束缚,认为免疫功能障碍可导致任何类型癌症的进展,因为大多数癌症存在于宿主免疫系统的背景下。事实上,大多数癌症至少最初被免疫系统识别和攻击,并最终能够通过肿瘤介导的免疫抑制和肿瘤逃避机制而进展。待治疗的癌症的实例可以选自膀胱癌、胃癌、食管癌、乳腺癌、结直肠癌、宫颈癌、卵巢癌、子宫内膜癌、肾癌(肾细胞)、肺癌(小细胞的、非小细胞的和间皮瘤)、脑癌(神经胶质瘤、星形细胞瘤、胶质母细胞瘤)、黑素瘤、淋巴瘤、小肠癌(十二指肠和空肠的)、白血病、胰腺癌、肝胆肿瘤、生殖细胞癌、前列腺癌、头颈癌、甲状腺癌和肉瘤。特别地,本发明人发现本发明可至少在治疗肺腺癌、肾透明细胞癌、胰腺癌、肾乳头状癌、肝细胞癌、肾上腺皮质癌和间皮瘤的背景下是有益的。本发明可在治疗被认为具有免疫原性的癌症方面特别有用。这些包括例如黑素瘤、肺鳞状细胞癌、肺腺癌、膀胱癌、小细胞肺癌、食管癌、结直肠癌、宫颈癌、头颈癌、胃癌、子宫内膜癌和肝癌。事实上,所有这些类型的癌症已被证明具有高体细胞突变率(例如,alexandrov et al.中的每兆碱基超过5个体细胞突变)。
[0179]
此外,本发明可特别可用于治疗具有高新生抗原负荷的癌症的情况下。如果癌症具有高肿瘤突变负担,则可以预测其具有高新生抗原负荷,这可以通过测量一个或多个样品的体细胞突变患病率(每兆碱基肿瘤基因组的体细胞突变数)来测量。alexandrov et al.中已经量化了多种癌症类型的体细胞突变患病率(nature volume 500,pages 415
–
421(2013))。具有高肿瘤突变负担的癌症类型可包括每兆碱基体细胞突变中值为至少1、至少5或至少10的癌症类型。例如、黑素瘤和鳞状肺癌通常被认为具有高突变负担。
[0180]
本发明可特别可用于治疗已经获得或预计可获得对免疫治疗的抗性或者显示出对免疫治疗的抗性的肿瘤。特别地,本发明可以有利地用于治疗患有增殖性病症(例如癌症或肿瘤)的患者:(i)所述患者已经经历免疫治疗且对所述免疫治疗未能响应或不再响应于所述免疫治疗,(ii)所述患者预计不太可能响应于免疫治疗,其中所述患者可未经历过(免疫治疗)治疗,(iii)其中所述患者的肿瘤不具有t细胞浸润或具有低t细胞浸润,和(iv)其中所述患者的肿瘤在肿瘤浸润t细胞群中具有高比例的功能障碍t细胞。在一些实施方案中,如果选自sit1、samsn1、sirpg、cd7、fcrl3、il1rap、furin、stom、axl、e2f1、c5orf30、
cldnd1、cotl1、dusp4、epha1、fabp5、gfi1、itm2a、park7、pecam1、phlda1、rab27a、rbpj、rgs1、rgs2、rnaseh2a、suv39h1、和tnip3中的一种或更多种标志物的表达高于相应的对照值,和/或者cd82的表达低于对照值,则可认为肿瘤在肿瘤浸润t细胞群中具有高比例的功能障碍t细胞,其中对照值可以对应于对照肿瘤浸润t细胞群中一种或更多种标志物的相应表达。对照肿瘤浸润t细胞群可以是早期分化的t细胞群。因此,根据本公开内容的治疗方法可以包括确定患者是否可能对免疫治疗有响应、患者的肿瘤是否不具有t细胞浸润或具有低t细胞浸润、和/或患者的肿瘤在肿瘤浸润t细胞群中是否具有高比例的功能障碍t细胞。
[0181]
待治疗的肿瘤可以是神经或非神经系统肿瘤。神经系统肿瘤可起源于中枢或周围神经系统,例如:胶质瘤、髓母细胞瘤、脑膜瘤、神经纤维瘤、室管膜瘤、神经鞘瘤、神经纤维肉瘤、星形细胞瘤和少突胶质细胞瘤。非神经系统癌症/肿瘤可起源于任何其他非神经组织,实例包括黑素瘤、间皮瘤、淋巴瘤、骨髓瘤、白血病、非霍奇金淋巴瘤(non-hodgkin’s lymphoma,nhl)、霍奇金淋巴瘤(hodgkin’s lymphoma)、慢性髓细胞性白血病(chronic myelogenous leukemia,cml)、急性髓系白血病(acute myeloid leukemia,aml)、骨髓增生异常综合征(mds)、皮肤t细胞淋巴瘤(cutaneous t-cell lymphoma,ctcl)、慢性淋巴细胞白血病(chronic lymphocytic leukemia,cll)、肝癌、表皮样癌、前列腺癌、乳腺癌、肺癌(例如小细胞)、结肠癌、卵巢癌、胰腺癌、胸腺癌、nsclc、血液癌和肉瘤。
[0182]
t细胞功能障碍和慢性肿瘤抗原刺激
[0183]
在一些实施方案中,根据本发明待治疗或预防的疾病或病症是具有高肿瘤突变负担(tmb)的癌症。
[0184]
肿瘤新生抗原是t细胞介导的癌细胞识别的关键底物。虽然tmb预测对免疫检查点阻断(icb)的响应(van allen,e.m.et al.,2015;rizvi et al.,2015;snyder et al.,2014;goodman et al,2017),但临床上明显的肿瘤通常在没有治疗的情况下进展并最终获得对治疗的抗性,这表明抗肿瘤t细胞响应的功能受损。在急性感染和疫苗接种中,最佳t细胞刺激导致从祖细胞分化为效应和效应记忆表型。然而,癌症和慢性感染中持续的高抗原负荷驱使t细胞分化为功能障碍状态。在这些环境中描述了两种广泛的功能障碍模式。首先,耗竭的特征在于共抑制和共刺激受体的高表达、细胞因子产生和复制能力受损(crawford,a.et al.,2014)。其次,终末分化的特征在于衰老的特征,包括端粒缩短、对凋亡的敏感性提高,以及包括cd57、klrg1和t-box转录因子脱中胚蛋白(eomes)在内的标志物的表达(fletcher,j.m.et al.,2005;palmer,b.e et al.,2005;patil,v.s.et al.,2018;di mitri d et al.,2007)。
[0185]
在具有高突变负担的肿瘤中,大多数cd8 t细胞表现出功能障碍的表型。然而,癌症中cd8 t细胞分化的基因组决定因素仍然不明确。此外,慢性肿瘤抗原刺激是否会损害人癌症中的cd4t细胞响应以前是未知的。本发明人已经发现,nsclc中的突变负担与肿瘤内cd4 t细胞分化偏斜(早期分化的cd4 t细胞群的丰度下降以及功能障碍的和终末分化的cd4 t细胞群的丰度增加)相关,已经在早期分化、功能障碍和终末分化的cd4 t细胞群中鉴定了不同的调节机制,并鉴定了作为存活之预测的cd4 t细胞分化偏斜的特征。由此,鉴定出与功能障碍cd4 t细胞相关的基因,对其的调节被证明增强对癌症新生抗原的免疫应答。类似地,在cd8区室中,本发明人发现tmb与组织驻留的cd8 t细胞群向功能障碍表型的偏斜显著相关。进一步表明,未经处理的新生抗原反应性cd8 t细胞具有功能障碍的表型标志和
分子标志,并且t细胞功能障碍的特征与独立nsclc组群中的tmb相关。由此,鉴定了与功能障碍的cd8 t细胞相关的基因,对其的调节被证明增强对癌症新生抗原的免疫应答。
[0186]
过继转移
[0187]
在本发明的一些实施方案中,治疗或预防方法可以包括过继转移免疫细胞,特别是t细胞。过继性t细胞转移通常是指从对象获得t细胞的过程,通常通过抽取血液样品(t细胞分离自该血液样品)。然后通常以某种方式处理或改变t细胞,任选地扩增t细胞,并随后将其施用于同一对象或不同对象。治疗通常旨在向对象提供具有某些所期望特征的t细胞群,或增加该对象中具有这样的特征的t细胞的频率。car-t细胞的过继转移在例如kalos and june 2013,immunity 39(1):49-60中进行了描述,其通过引用整体并入本文。
[0188]
在本发明中,过继转移是带有以下目的而进行的:在对象中引入靶蛋白反应性t细胞或提高靶蛋白反应性t细胞的频率(特别是靶蛋白反应性cd8
t细胞)。
[0189]
在一些实施方案中,从中分离出t细胞的对象是施用了经修饰t细胞的对象(即,过继转移是自体t细胞的)。在一些实施方案中,从其中分离出t细胞的对象是与施用经修饰t细胞的对象不同的对象(即,过继转移是同种异体t细胞的)。
[0190]
根据本发明进行修饰的至少一种t细胞可以根据技术人员公知的方法进行修饰。修饰可以包含核酸转移以用于永久或瞬时表达转移的核酸。
[0191]
在一些实施方案中,方法可以包括以下步骤中的一个或更多个:从对象采集血液样品;从血液样品中分离和/或扩增至少一种t细胞;在体外或离体细胞培养中培养至少一种t细胞;改造至少一种t细胞以提高cd82的表达和/或者敲除选自以下的一种或更多种基因或者下调选自以下的一种或更多种基因的表达:sit1、samsn1、sirpg、cd7、fcrl3、il1rap、furin、stom、axl、e2f1、c5orf30、cldnd1、cotl1、dusp4、epha1、fabp5、gfi1、itm2a、park7、pecam1、phlda1、rab27a、rbpj、rgs1、rgs2、rnaseh2a、suv39h1、和tnip3;任选地插入经修饰t细胞受体或car,或核酸,或编码经修饰t细胞受体或car的载体;扩增至少一种经改造t细胞,收集至少一种经改造t细胞;将经改造t细胞与辅料、稀释剂或载体混合;将经改造t细胞施用于对象。
[0192]
在根据本发明的一些实施方案中,对象优选地是人对象。在一些实施方案中,待根据本文本发明的治疗或预防方法治疗的对象是患有以靶蛋白的表达或上调表达为特征的疾病或病症或者处于发生这样的疾病或病症的风险中的对象。在一些实施方案中,待治疗的对象是患有这样的癌症或处于发生这样的癌症的风险中的对象,所述癌症例如表达靶蛋白的癌症,或其中靶蛋白的表达上调的癌症。
[0193]
在一些实施方案中,方法另外包括用于治疗或预防疾病或病症的治疗性或预防性干预,例如化学治疗、免疫治疗、放射治疗、手术、疫苗接种和/或激素治疗。在一些实施方案中,方法另外包括治疗性或预防性干预,其用于治疗或预防癌症。
[0194]
t细胞治疗
[0195]
t细胞治疗可包括过继性t细胞治疗、肿瘤浸润淋巴细胞(til)免疫治疗、自体细胞治疗、经改造自体细胞治疗(eact)和同种异体t细胞移植。
[0196]
免疫治疗的t细胞可以来自本领域已知的任何来源。例如,可以在体外从造血干细胞群中分化出t细胞,或者可以从对象获得t细胞。t细胞可以从例如外周血单个核细胞、骨髓、淋巴结组织、脐带血、胸腺组织、来自感染部位的组织、腹水、胸腔积液、脾组织和肿瘤中
获得。另外,t细胞可以来源于本领域可用的一种或更多种t细胞系。t细胞也可以使用本领域技术人员已知的任何数量的技术(例如ficoll
tm
分离和/或单采(apheresis))从收集自对象的单位血液中获得。us2013/0287748中公开了分离t细胞用于t细胞治疗的另外方法,其通过引用整体并入本文。
[0197]
术语“经改造自体细胞治疗”,可缩写为“eact
tm”,也称为过继细胞转移,是收集患者自身t细胞并随后对其进行遗传改造以识别和靶向在一种或更多种特定肿瘤细胞或恶性病的细胞表面上表达的一种或更多种抗原的过程。可以改造t细胞以表达例如嵌合抗原受体(car)或t细胞受体(tcr)。car阳性( )t细胞经改造以表达对特定肿瘤抗原具有特异性的胞外单链可变片段(scfv),所述特定肿瘤抗原与包含共刺激结构域和活化结构域的胞内信号传导部分相连。共刺激结构域可以来源于例如cd28,并且活化结构域可以来源于例如cd3-ζ(图1)。在某些实施方案中,car被设计为具有两个、三个、四个或更多个共刺激结构域。car scfv可被设计为靶向例如cd19,它是由b细胞谱系中的细胞表达的跨膜蛋白,所述b细胞谱系中的细胞包括所有正常b细胞和b细胞恶性病,包括但不限于nhl、cll和非t细胞all。示例性car t细胞治疗和构建体在us2013/0287748、us2014/0227237、us2014/0099309和us2014/0050708中进行了描述,并且这些参考通过引用整体并入。
[0198]
根据本发明进行改造的t细胞可以在其使用之前的任何阶段进行改造,特别是进行改造以过表达和/或敲除选自以下的一种或更多种基因或者降低选自以下的一种或更多种基因的表达可以在t细胞扩增的步骤之前或之后进行:sit1、samsn1、sirpg、cd7、fcrl3、il1rap、furin、stom、axl、e2f1、c5orf30、cldnd1、cotl1、dusp4、epha1、fabp5、gfi1、itm2a、park7、pecam1、phlda1、rab27a、rbpj、rgs1、rgs2、rnaseh2a、suv39h1、cd82、和tnip3。
[0199]
对象
[0200]
根据本发明待治疗的对象可以是任何动物或人。对象优选是哺乳动物,更优选是人。对象可以是非人哺乳动物,但更优选是人。对象可以是雄性或雌性。对象可以是患者。对象可以已被诊断为患有需要治疗的疾病或病症、可以被怀疑患有这样的疾病或病症、或可处于发生这样的疾病或病症的风险中。
[0201]
以下内容以实施例的方式呈现并且不应被解释为对权利要求书的范围的限制。
[0202]
实施例
[0203]
实施例1-突变负担与肺癌中肿瘤内cd4 t细胞失调的区室范围特征相关
[0204]
材料和方法
[0205]
患者和样品:本研究中的所有患者均来自英国多中心肺tracerx研究招募的前100名患者,如前所述(https://clinicaltrials.gov/ct2/show/nct01888601,独立研究伦理委员会批准参考13/lo/1546)。在所有参与者的书面同意下进行样品收集和数据分析。基于全外显子组测序和足够量的单细胞消化材料的可用性选择用于流式细胞术的样品。所有肿瘤样品均通过h&e载片的独立病理学审查进行了验证。
[0206]
流式细胞术:将新鲜肿瘤和ntl手术切除样本用释放酶tl(sigma)和dna酶i(roche)在rpmi-1640(sigma)中切成1mm的块,然后使用gentlemacs解离器(miltenyi biotec)在37℃下机械解离1小时。通过使混悬液轻轻地通过含有5ml完全rpmi-1640(含有2% fbs和2mm edta的pbs)的70μm细胞过滤器获得单细胞,并通过密度梯度离心(750g 10分钟)在ficoll paque plus(ge healthcare)上分离淋巴细胞。将界面(interface)用完全
rpmi-1640洗涤两次,在含有10% dmso(sigma)的90% fbs中重悬,并在染色之前冷冻保存。
[0207]
对于染色,将细胞解冻并在facs缓冲液(5% fbs)中洗涤。对于组群1,将细胞用针对表面标志物的以下抗体进行表面染色:cd45r0buv395(uclh1)、cd8 buv496(rpa-t8)、cd45ra buv563(hi100)、cd4 buv661(sk3)、cd28 buv737(28.2)、cd3 buv805(sk7)、pd1bv421(eh12.1)、cd57 bv605(nk-1)、41bb bv650(4b4-1)、cd27 bv786(l128)、tim3 bb515(7d3)、cd25 apc-r700(2a3),均来自bd;和来自biolegend的icos pe-cy7(c398.4a),然后使用foxp3转录因子染色缓冲液组(thermo)进行固定和透化,并使用来自bd的foxp3 af647(259d/c7)、tbet pe(4b10)、gzmb pe-cf594(gb11)和ki67 bv480(b56)和来自thermo的eomes percp-e710(wd1928)进行胞内染色。对于组群2,将细胞用针对表面标志物的以下抗体进行染色:cd8 buv496(rpa-t8)、cd45ra buv563(hi100)、hla-dr buv661(g46-6)、fas buv737(dx2)、cd3 buv805(sk7)、pd1 bv421(eh12.1)、cd57 bv605(nk-1)、cd127 bb515(hil-7r-m21)、cd28 apc-r700(28.2),均来自bd;和来自biolegend的cd4生物素(okt4)、cd27 bv510(o323)、ccr7 bv650(g043h7)、cd103 bv711(ber-act8)、icos bv786(c398.4a)、ctla4 pe-cy7(l3d10)。链霉亲和素buv395购自bd。胞内染色使用来自thermo的针对eomes的抗体percp-e710(wd1928)和foxp3 pe(pch101)、来自biolegend的ctla4 pe-cy7(l3d10)和nkg2d af647(1d11)以及来自bd的gzmb pe-cf594(gb11)进行。在这两个组群中,使用ebioscience fixable viability dye efluor 780(thermo)排除非活细胞。在bd symphony流式细胞仪上采集数据,并在flowjo v10(treestar)中针对大小、单峰、活力和cd3 cd8-t细胞对细胞进行设门以供进一步分析。
[0208]
cd4 t细胞鉴定:释放酶处理先前已被描述为切割cd4抗原,导致对该标志物37的变量检测(variable detection)。因此,设门cd3 cd8-以确保完全捕获t辅助群。确认了早期、tdys和tdt群的cd4状态,其使用具有明确cd4 群的区域从cd3 cd8-细胞中设门(n=20/61在两个组群中)。对这三个子集中cd4 细胞百分比的评价揭示超过85%的cd4表达(早期、tdys和tdt子集的平均cd4 分别为86.8%、95.2%和85.7%;图2g)。
[0209]
测序:多区域全外显子组测序、突变调用和克隆性估计如先前描述进行(jamal-hanjani,m.et al.,2017)。简而言之,将来自肿瘤和匹配种系样品的原始配对末端全外显子组测序读数与hg19基因组组装进行比对。考虑到变异等位基因频率、拷贝数和肿瘤纯度,鉴定非同义突变并将其分类为克隆或亚克隆(使用pyclone的经修饰版本(roth,a.et al.,2014)进行)。通过比较种系和肿瘤dna来鉴定来自每个肿瘤区域的同义和非同义突变。将rna使用allprep试剂盒(qiagen)的改良版本来提取,并在制备rna完整性评分》=5(通过tapestation(agilent technologies)测量)的样品的文库之前使核糖体耗竭。第二链cdna合成并入了dutp。对cdna进行末端修复、a加尾和衔接子连接。在扩增之前,使样品经历尿苷消化。制备好的文库在配对末端测序之前经过大小选择、多路复用和质量控制。进行了75bp配对末端测序,每个样品平均5000万的读数。fastq数据经过质量控制,并使用star与hg19基因组比对(dobin,a.et al.,2013)。转录量化使用带有默认参数的rsem进行(li,b.&dewey,c.n.,2011)。
[0210]
til评价:til估计是根据国际免疫肿瘤学生物标志物工作组(international immuno-oncology biomarker working group)指南(hendry,s.et al.,2017)进行的,该指
南已被证明在经过培训的病理学家中是可重现的(denkert,c.et al.,2016)。使用区域水平的h&e载片,确定基质面积与肿瘤面积的相对比例,并通过考虑单个核炎性细胞占据的基质面积除以总基质面积来报道基质区室的til百分比。在私人内部一致性测试中,证明了高再现性。国际免疫肿瘤学生物标志物工作组开发了免费提供的培训工具来培训病理学家对h&e载片进行最佳til评估(www.tilsincancer.org)。
[0211]
tcga数据:泛癌tcga数据从gdc网站(https://gdc.cancer.gov/about-data/publications/panimmune)(thorsson,v.et al.,2018)下载。这包括上四分位数归一化的基因转录计数估计、临床和突变负担数据。临床数据按先前公开的方式(liu et al.,2018)使用。为了测试tcga肺癌组群中xds特征与tmb之间的关系,使用mc3项目(ellrott et al.,2018)产生的数据计算非同义突变负担作为绝对计数,以与tracerx数据进行比较。对于存活和线性回归分析,使用了每mb的z评分缩放的非沉默突变,并发现其给出了与根据mc3项目数据估计的突变负担非常相似的结果。
[0212]
统计分析:所有计算均在r统计编程环境3.4.3版中进行。在探索性分析中,个别区域被视为独立的数据点。根据皮尔逊法进行相关性分析,并利用双尾wilcoxon秩和检验评价两个样品是否来源于同一个群。另外进行了假设检验,其使用混合效应线性回归模型来解释由于肿瘤多区域性和组织学影响(分别导致患者内和组内相似性)导致的数据内依赖性。混合效应建模是使用nlme包实现的。在适当的情况下,通过benjamini-hochberg法调整p值,以控制多重测试背景下的类型1错误率。使用存活包中实施的cox回归模型进行存活分析。使用survminer包产生kaplan-meier图和对数秩p值。
[0213]
流式细胞术数据的无监督分析
[0214]
聚类:使用从nowicka et al.修改的流水线对具有超过1000个活cd3
cd8-事件的所有样品进行聚类。使用flowcore包的estimatelogicle函数读取fcs文件并应用逻辑转换(hahne et al.,2009)。在聚类分析之前基于背景之上的低表达和基于pca的非冗余评分的计算(如先前定义的(nowicka et al.,2017;levine et al.,2015))将对细胞间表型方差贡献低的标志物移除,导致排除标志物tim3、ki67和41bb。数据被聚类到flowsom包(van gassen et al,2015)中实现的7
×
7节点方形自组织映射(self-organising map,som),然后使用consensusclusterplus包(wilkerson&hayes 2010)对节点进行分层共识聚类,如前所述。基于对共识矩阵和追踪图的检查,将数据过聚类到20个群中。为了理解集群关系,应用umap算法(becht,e.et al.,2018)对所有事件进行降维,因为与t-sne相比,它更好地保留了输入空间拓扑特性。umap是使用uwot包进行的,并且基于umap共定位和标志物表达将类似的集群手动分组到元集群中。
[0215]
差异丰度分析:为了确定解释样品的多区域性和配对的肿瘤与ntl组织之间集群的差异丰度,使用edger包(robinson et al.,2010)应用负二项式广义线性模型,如最近描述用于细胞术数据的(lun et al,2017)。
[0216]
使用tmb发现丰度存在差异的群:由于初始节点权重在som训练之前随机初始化,因此该过程中存在固有的随机性。为了解决这个问题,使用随机种子迭代聚类过程
×
1000,并在每次递归时进行皮尔逊相关性分析,以测试每个flowsom集群的丰度与样品tmb之间的关系。每次迭代时都保留benjamini-hochberg错误发现率(false discovery rate,fdr)《0.1的正相关和负相关集群。将在多次迭代中发现的类似集群根据它们的umap接近度和标
志物谱手动组合,以鉴定随tmb稳定变化的群。丰度最高的群(由在1000次迭代中被观察到超过200次的独立集群构成;n=9)被保留用于进一步分析。为了评价聚类稳定性,首先在代表性聚类迭代中标记每种细胞的群身份(population identity)。然后,对于每种细胞,通过将其在给定群中的鉴定频率除以1000次迭代中九个群的总鉴定频率来计算在上述九个群的每个中被鉴定的概率,以生成图s2c热图。
[0217]
肿瘤克隆多样性:肿瘤克隆多样性是通过计算每个区域的香农熵(基于每种克隆的数量和患病率)来估计的,使用熵包来实现。由单个亚克隆构成的区域被赋值为0。
[0218]
单细胞rna测序分析
[0219]
数据处理和插补:guo et al.的研究的计数和元数据从基因表达综合网站下载(登录号gse99254)。将计数》0的基因的文库大小或数量比所有细胞的中值低三个中值绝对偏差(median absolute deviation,mad)的细胞排除在外,将平均计数《1或在少于10种细胞中表达的基因也排除在外。将scimpute包用于鉴定和进行丢失表达值的插补(imputation)(li et al,2018)。
[0220]
设门:流式细胞术和scrnaseq两者均提供在单一细胞水平上表达的独立标志物的连续测量。对于具有匹配的细胞计数和scrnaseq数据的样品,已经报道了在群鉴定方面良好的技术间一致性,这支持了对scrnaseq数据进行类似流式细胞术的设门方法(oetjen et al,2018)。将每百万计数(count per million,cpm)表达数据通过m值的截尾均值(tmm)程序进行归一化以解释组合性(compositionality),然后进行log
10
转换以在双轴图上对群进行手动设门。
[0221]
差异基因表达分析:使用最近被描述为单细胞rna-seq数据中差异表达分析的顶级方法的edger edgerqlfdetrate程序
87
鉴定了三个子集之间差异表达的基因。以患者为辅助因素进行分析。对在超过25%的细胞中具有》1cpm的基因进行了差异分析。在soneson et al.研究中,这种方法导致i型错误控制率略高于p=0.05的规定水平(soneson et al,2018)。为了对此进行严格控制,如果由edger鉴定为在组间差异表达(倍数变化》2和fdr《0.05)的基因另外地使用wilcoxon秩和检验鉴定为在子集之间差异表达(p《0.05),则保留它们用于进一步分析。热图是使用log
10 cpm表达值用complexheatmap包(gu et al,2016)产生的。
[0222]
gsea:将fgea包(sergushichev,2016)用于具有10000个排列的预排序gsea
90
。将基因根据其在组间的log2倍数变化(logfc)使用edger::glmfit进行排序,其中prior.count=5。gsea是使用先前在慢性病毒感染(crawford et al.,2014)、狼疮肾炎(tilstra et al,2018)和自身免疫性结肠炎(shin et al.,2018)的小鼠研究中描述的cd4功能障碍特征进行的。通过选择每项研究中差异表达前100名的基因来构建这些特征。使用ensembl和ncbi homologene数据库鉴定了人直系同源物。为了确认早期子集中t细胞祖细胞样特征的富集,对来自msigdb(subramanian et al.,2005)的c7基因集进行了gsea,过滤以仅包括效应t中枢记忆特征(n=18)以及代表图s4e中排名前四的途径,来自以下出版物:gse11057(abbas et al,2009)、gse26928(chevalier et al,2011)、gse3982(jeffrey et al,2006)。
[0223]
集群rna测序数据分析
[0224]
cd4子集基因特征:基因特征富集使用上四分位数归一化的tcga和tracerx rna测
序rsem计数数据进行评价。测试了效应cd4子集t细胞基因特征与流式细胞术数据的相关性。对于具有匹配rna测序和病理学家评价的til的患者(n=56名患者,144个区域),发现danaher t细胞转录特征与til密度密切相关,并因此使用它来估计til密度(danaher et al.,2017)。对于每个特征,将组成基因的表达进行log
10
转换、z评分缩放,并将每个样品的平均值用于表示富集。排除了非蛋白质编码基因和那些在tcga和tracerx数据中均未体现的基因。对于treg特征,通过扣除每个区域的相应danaher t细胞特征值来校正til浸润的富集值。
[0225]
tcga xcell特征按照之前计算的那样(aranet al.,2017)使用。对于tracerx rnaseq数据,使用已发布的包(https://github.com/dviraran/xcell)产生xcell特征值,并在所有可进行rna测序的样品中缩放z评分。
[0226]
tcf7/lef1特征:xing et al.之前公开了关于小鼠tcf7/lef1敲除vs.野生型cd8胸腺细胞所差异表达的基因的rna测序数据(xing et al,2016)。在敲除细胞中上调的基因表征了晚期分化的t细胞,而下调的基因表征了祖细胞样t细胞。我们选择了141个上调基因和68个下调基因(倍数变化》4)以分别产生晚期分化和干性基因集。由于cd4
ds
涉及早期分化细胞的丧失和晚期分化子集的增加,因此cd4
ds
的特征被定义为干性减去晚期分化基因集的值。
[0227]
实施例1.1-突变负担与肿瘤内cd4 t细胞分化偏斜相关
[0228]
用19标志物流式细胞术在来自tracerx 100组群中14名患者的44个肿瘤区域的肿瘤浸润淋巴细胞(til)上对nsclc肿瘤内cd4 t细胞分化情况进行了表征(图1a)。选择样品以获得足够的单细胞消化材料和配对外显子组测序(n=37个区域)。对于12名患者,可获得匹配的非肿瘤肺(non-tumour lung,ntl)区域。
[0229]
由于先前报道的酶促肿瘤解离之后的cd4染色减弱(ahmadzadeh etal.,2019),因此对cd3 cd8-细胞进行了分析,以确保完全捕获t辅助细胞(图2f;参见验证方法的细节)。组合区域数据的无监督聚类鉴定了20个cd4子群(参见方法),将这些子群基于标志物表达和统一流形逼近与投影(umap,becht et al.,2018)降维空间的共定位手动分组为九个元集群(图2a、b)。这些群包括具有低活化标志物表达的抗原经历子集(cd45r0 cd28 pd1-icos低cd57-)和具有中等icos表达的类似群(cd45r0 cd28 pd1-icosintcd57-),分别标记为早期分化(早期)和早期过渡。将具有高共抑制和共刺激受体表达的群(cd45r0 pd1 icos高cd57-)标记为t功能障碍(tdys)(day et al.,2006;crawford et al.,2014)。4个群具有cd4终末分化特征,包括eomes和cd57表达:1.具有高pd1和中等icos表达的活化群使人联想到tdys,称为tdys/末端效应物(tdt;cd45r0 pd1 icosinteomes cd57 );2.具有低pd1和icos表达的非活化子集(cd45r0 pd1-icos低eomes cd57 )称为终末分化静息(terminally differentiated resting);3.重新表达cd45ra的t效应记忆细胞(temra)和4.cd45r0/cd45ra中等群,称为中等temra。虽然tdt细胞表达共刺激受体cd27和cd28(其通常与早期分化相关)(mahnke et al.,2013),但它们的表达也可以标记t细胞活化(warrington et al.,2003;salazar-fontana et al,2001)。还鉴定了可通过cd57表达区分的两个foxp3 cd25 t调节(treg)群。
[0230]
使用具有配对流式细胞术和外显子组测序数据的样品确定了丰度随外显子的、非同义的肿瘤突变负担(tmb)变化的cd4子集(n=14名患者;37个区域;图1a)。为了解释群鉴
定的随机性,将无监督聚类重复1000次。在每次迭代中,评价了集群丰度与tmb之间的关系以鉴定在丰度上始终随突变负担变化的群(图3a)。这种方法鉴定了八个效应物子集,包括随tmb丰度而下降的两个早期分化群,而两个tdys和两个tdt群随tmb丰度而提高(图3b,d)。中等temra和静息td(resting td)群还与tmb相关,但它们的静止表达谱和在ntl中与在肿瘤区域中相比更大的丰度表明抗肿瘤参与的可能性降低,并且将它们排除在进一步的分析之外(图3c,2d)。
[0231]
为了确认无监督分析的结果,用与以前相同的标准选择了tracerx患者的验证组群(n=15名患者,24个区域),用于具有重叠标志物组的til流式细胞术。对目的子集进行手动设门以进行进一步分析。在两个组群中,手动设门的早期丰度与tmb呈负相关,而与tdys和tdt丰度呈正相关(图3e)。在组合分析中,这些发现仍然很重要,而与肿瘤组织学类型和多区域性无关。使用术语cd4分化偏斜(cd4
ds
)来描述早期丰度下降和功能障碍的子集增加的这种模式。
[0232]
考虑了突变克隆性的作用,并发现非同义克隆突变而非亚克隆突变的负担与cd4
ds
相关(图2e)。通过香农指数测量的肿瘤克隆多样性和插入缺失突变负担均与cd4
ds
不相关。
[0233]
在慢性病毒感染中,早期分化的丧失(okoye et al.,2007)和功能障碍的cd4子集的增加与免疫受损相关(day et al.,2006;kaufmann et al.,2007)。在组合组群中,低早期和高频率的tdt细胞(根据中值分组)与更差的无病存活(dfs)相关,表明cd4
ds
可标志着抗肿瘤免疫受损(图2h)。cd4
ds
与肿瘤阶段之间没有关系(图2i)。
[0234]
cd4子集身份在验证组群中得到确认。手动设门群的pd1与cd57谱如图2a所示。ccr7表达证实了早期群t中枢记忆(tcm)富集,而tdys和tdt主要是cd45r0 ccr7-效应记忆细胞(图4b,c)。与功能障碍一致,tdys高表达icos和共抑制受体ctla4,而tdt具有高eomes和低il-7受体(cd127)表达(patil et al.,2018)。tdt具有最高的cd103 组织驻留记忆(tissue resident memory,trm)细胞频率。tdys和tdt二者都高度表达晚期分化标志物cd95(fas)(mahnke et al.,2013)。
[0235]
实施例1.2
–
早期、tdys和tdt子集的单细胞转录特征揭示了不同的发育和调节程序
[0236]
使用最近报道的nsclc til单细胞rna测序(scrnaseq)数据集(guo et al.,2018)对这些群的转录特征进行了表征。
[0237]
根据流式细胞术分析,通过手动设门策略鉴定了子集(图5a和6a)。在来自14名患者的2469种cd4 t细胞中,鉴定了175种早期(foxp3-cd28 ccr7 pdcd1-klrg1-icos低)、272种tdys(foxp3-cd28 pdcd1 klrg1-icos高)和143种tdt(foxp3-cd28 pdcd1 klrg1 )细胞。产生cd57抗原的b3gat1的丢失率(dropout rate)很高(80.3%的cd4 细胞)。由于klrg1和cd57在终末分化的t细胞上高度共表达(di mitri et al.,2011),因此使用前者来鉴定tdt细胞。
[0238]
scrnaseq与流式细胞术鉴定的群之间的一致性通过评价由流式细胞术表征且不用于scrnaseq设门的基因(ctla4、eomes、fas和il7r;图5c)的表达来证实。与它们的细胞术谱一致,scrnaseq tdys和tdt群分别具有高ctla4和eomes表达,并且与早期相比具有提高的fas。早期群身份通过编码cd127的il7r的高表达证实。
[0239]
tracerx流式细胞术测量的早期和tdys/tdt群的丰度呈负相关。scrnaseq确定的
群之间的类似关系提供了该组群中cd4
ds
的证据(图5b)。
[0240]
为了进一步表征scrnaseq群,在感染(crawford et al.,2014)和自身免疫(shin et al,2018,tilstra et al.,2018)的背景下用祖细胞样cd4 t细胞和功能障碍cd4 t细胞分化的特征进行了基因集富集分析(gene set enrichment analysis,gsea)。早期细胞显著上调了tcm特征基因(图7e),而tdys和tdt子集具有与持续抗原暴露有关的cd4功能障碍的转录谱(图5e,f)。
[0241]
差异基因表达分析揭示了scrnaseq鉴定的子集之间的显著转录差异(图5d,7a至d)。为了探索tdys和tdt组织积累的潜在调节物,分析了编码黏附分子和趋化因子受体的基因。在与组织驻留有关的基因中,两个子集都表达cxcr3,参与自身免疫中的cd4组织监测(nankin et al.,2002),而tdt细胞特异性表达鉴定上皮cd8 trm细胞的itga1(cheuk et al.,2017)(图5d、7c)。
[0242]
效应基因分析揭示了cd40lg的早期和tdys细胞表达二者,表明抗原参与和辅助功能(quezada et al.,2004)。tdt细胞表达作为cd8细胞毒性之特征的基因,包括那些编码穿孔素、颗粒酶分子和fas配体的基因,如前所述用于cd4终末分化的(hirschhorn-cymerman et al.,2012)。
[0243]
由于效应基因表达表明tdys和tdt子集可保留可在治疗上增强的功能潜力,因此探索了它们的共刺激和共抑制受体编码基因的表达,并发现不一致的表达模式表明它们受到可操作免疫治疗靶标的差异调节(图5d)。虽然编码gitr和ox40表达的基因的表达在tdys细胞中最高,但tdt细胞优先表达cd27,与流式细胞术数据一致(图3b),除了tnfrsf14(编码lightr)之外。tdys子集表达高水平的多个共抑制受体编码基因,而tdt细胞则通过lag3表达来区分。
[0244]
发现了特征性转录因子表达谱,包括维持t细胞干性的tcf7/lef1的早期表达(gattinoni et al.,2009),以及包括irf850和nrf151的负调节物的特异性tdys表达。tdys和tdt二者均表达功能障碍相关基因tox52(图5d、7b)。
[0245]
如图7d所示,还发现与早期群相比,tdys和tdt群差异表达编码itim(免疫受体酪氨酸抑制模体(immuno-receptor tyrosine-based inhibition motif))结构域蛋白的多个基因。这些是潜在的抑制分子,其可以代表治疗的新候选物。事实上,在具有itim的抑制性受体与其配体相互作用之后,它们的itim基序被src激酶家族的酶磷酸化。这使它们能够募集磷酸酶,例如shp1和shp2,其使得t细胞受体复合物去磷酸化,从而降低t细胞活化。因此,靶向这些在tdys和tdt群中显示异常活跃的分子可导致这些群中的t细胞活化增强,这是由于t细胞受体复合物缺乏去磷酸化,这转而应改善抗肿瘤免疫应答。其中的一个子集(特别是:epha1、fcrl3、pecam1、axl、furin、il1rap、stom、sirpg)特别有前景,并且其中一些(fcrl3、axl、furin、il1rap、stom、sirpg)被选中进行验证。il1rap和sirpg的验证数据显示在实施例3中。
[0246]
cd4 t细胞可以发展出特定谱系定型的特征,其由标志物表达和功能属性表征。使用先前公开的特征(charoentong et al.,2017)和关键谱系特异性基因的表达谱分析(图6b)在通过gsea的scrnaseq鉴定的子集中探索了这一点。与早期相比,tdys和tdt群二者均上调了与th2和t滤泡辅助(t follicular helper,tfh)分化相关的基因(图5g)。虽然tdys细胞具有相似的th1和th2富集,但tdt具有非显著的th1富集和活化的cd8特征,与细胞毒性
相关效应基因的表达保持一致。最后,在早期群中发现了th17特征基因的富集。这些结果表明子集中cd4功能的差异和异质获得,如先前在小鼠慢性lcmv25中的功能障碍的cd4细胞中观察到的。
[0247]
实施例1.3
–
肿瘤内cd4
ds
的转录特征预测了独立组群中的存活
[0248]
接下来,用配对流式细胞术和rna测序验证了tracerx样品中cd4
ds
的基因特征(n=20名患者,43个区域)。首先,在多重测试校正之后,鉴定了cd4分化的特征,并发现6/25与细胞术测量的早期丰度显著负相关(图8a,8b左图)。其中三个是th2特征,反映了tdys和tdt群的scrnaseq谱(图5g)。
[0249]
其次,测试了这六个特征是否如预期的与tdys和tdt丰度正相关。xcell th253和bindea th254特征与两个子集相关(图8b右图),并且继续分析xcell特征(以下称为xcell cd4分化偏斜;xds)。
[0250]
最后,用配对rna和外显子组测序确认了与tracerx样品中tmb相关的xds特征(n=64名患者,161个区域),以及确认了独立的nsclc tcga组群(图8c;肺腺癌[luad],n=507;肺鳞状细胞癌[lusc],n=479)。因此,xds特征预测通过流式细胞术测量的早期丰度的丧失和tdys和tdt群的丰度增加,并与tmb相关,因此可作为cd4
ds
的转录指标。
[0251]
cd4
ds
预测了tracerx流式细胞术组群中的存活(图2h),并且测试了xds特征是否在较大的tracerx rnaseq和tcga nsclc组群中表现相似。在单变量分析中,具有高(高于上四分位数)xds富集的tracerx患者的结局较差(p=0.039,风险比[hr]2.29)。这种关系在tcga luad(p《0.001,hr 1.79)中得到证实,但在tcga lusc组群中没有得到证实。作为多变量分析中针对阶段(图9a)、组织学亚型、til浸润和突变负担调整的连续变量,xds特征仍然是tracerx(在图8e中针对tmb进行调整,p=0.003,hr 2.11;在图s5b中针对克隆突变负担进行调整,p=0.007,hr 1.99)和tcga luad(图s5c,p=0.001,hr 1.27)中的存活的负预测因子。
[0252]
还在泛癌分析中测试了xds特征是否与其他tcga组群的结局相关(先前描述的23个组群中的n=5290名患者,以具有足够的存活分析数据(miller et al.,2019))。除了luad,还发现了六种肿瘤类型(肾透明细胞癌、胰腺腺癌、肾乳头状癌、肝细胞癌、肾上腺皮质癌和间皮瘤),其中xds特征与作为考虑til浸润和tmb的多变量分析中的连续变量的总存活呈负相关(图8f至g)。在其他23个测试组群的任何一个中,xds与更好的结局无关。因此,xds特征可以作为cd4
ds
的转录指标,并且本文鉴定的与cd4功能障碍相关的基因可代表至少对于luad、肾透明细胞癌、胰腺腺癌、肾乳头状癌、肝细胞癌、肾上腺皮质癌和间皮瘤是有前景的治疗靶标。
[0253]
鉴定了与这些组群中的xds特征相关的另外的基因集,并且根据目前对其功能的了解,其可能与效应物功能的丧失相关(数据未显示)。这些基因的表达与t细胞功能障碍特征的强相关性表明它们可能在功能障碍的群中失调,并且发明人假设其中一些可具有功能,使得“校正”这种失调可增强t细胞活性。其中,鉴定了代表有前景的治疗靶标的t细胞功能的潜在负调节物(特别是:e2f1、c5orf30、cldnd1、gfi1、rnaseh2a、和suv39h1),并选择其中之一(e2f1)进行验证。
[0254]
实施例1.4
–
tcf7/lef1丢失的转录特征预测了cd4
ds
[0255]
虽然三个th2基因特征与tdys和tdt丰度相关,但这些群不由scrnaseq数据集中的
th2基因表达表征(图6b),表明特征可以反映非th2特异性分化特征。使用的th2特征是从通过体外il4暴露(一种治疗,已知其会抑制维持转录因子tcf7和lef155的干性的表达)分化的t细胞产生的。因此,xds特征可通过反映t细胞成熟的转录程序与cd4
ds
相关。为了测试这一点,使用rnaseq从缺乏这些基因的小鼠t细胞中产生了tcf7/lef1缺陷的特征(xing et al.,2016)。在tracerx组群中,该特征与cd4
ds
、突变负担和存活高度相关(图10a、b和c),这支持了突变负担可加速肿瘤内cd4丧失祖细胞样潜能并对存活产生负面影响的假设。
[0256]
发现xds特征包含tcf7/lef1敲除之后上调的5/22基因(cep55、rrm2、nphp4、mad2l1、nup37)。将特征减少到仅这些基因保留了与cd4
ds
的相关性,而它们的去除完全消除了预测能力(图10)。这些结果表明,xds特征捕获了随cd4ds发生的干性丧失和t细胞成熟的特征,因为它包括了由tcf7/lef1缺失上调的基因。
[0257]
实施例1.5
–
调节性t细胞丰度与cd4
ds
相关
[0258]
虽然tmb与cd4
ds
相关,后者与较差的结局独立相关,但对tracerx患者的多变量分析表明,突变负担本身预测良好的存活(图8e)。这表明tmb以外的因素导致cd4
ds
的差异,具有一致的高或低的早期丰度和tmb的区域说明了这一点。因此,寻找形成tmb-cd4
ds
关系的其他因素,并发现总treg丰度与tmb和早期丰度之间的比率相关,而其他参数(年龄、吸烟和肿瘤突变克隆分布)则无关(图11a)。
[0259]
由于tmb和cd57
treg丰度在组群1的无监督分析中呈正相关(图3a),因此treg丰度与tmb:早期比率之间的关系可反映treg与tmb之间的相关性。然而,在组合流式细胞术组群中,手动设门总treg、cd57
treg和cd57-treg均未与tmb显著相关(图12a),表明treg丰度与tmb无关。
[0260]
接下来,测试了treg和早期子集丰度是否与tmb独立相关。根据中值将tracerx流式细胞术区域分为高tmb vs.低tmb,并在每个类别中根据三分位数将区域进一步分为高、中和低早期丰度组,从而产生六个亚类(图11b)。发现在tmb高组和低组二者中treg与早期丰度之间存在显著的负相关,这表明treg浸润可导致早期丰度降低,而与突变负担无关。
[0261]
为了评价tracerx rnaseq和nsclc tcga组群中的这种关系,首先以treg特征为基准,并发现了magnuson et al.特征在配对rnaseq数据情况下在tracerx样品中测试的那些中与细胞术测量的treg丰度最相关(图11c)。与流式细胞术数据一致,cd4
ds
和treg特征在tracerx rnaseq样品中呈正相关,但这在针对组织学和肿瘤多区域性校正的混合效应模型中没有达到显著性(图11d)。在tcga组群中,cd4
ds
和treg特征在luad患者(图11e)中显著相关,但在lusc患者中不相关(图12d)。因此,分别分析了tracerx腺癌和鳞状细胞癌患者,并发现cd4
ds
与treg特征之间的显著关系限于前者组织学组,这与tcga的分析一致(图12b,c)。
[0262]
最后,寻求转录差异来解释treg丰度的变化,这是通过进行线性回归以测试tcga luad中独立基因的表达与treg特征富集之间的关系来实现的。推断treg丰度可能与tme趋化因子表达相关,关注了趋化因子编码基因,并发现了与treg丰度正相关的11个候选物。其中,ccl1、ccl22、ccl11、ccl13、ccl26和ccl7也与tracerx rnaseq组群中预测的treg丰度呈正相关(图11g)。这些趋化因子被五个趋化因子受体编码基因(ccr1、ccr2、ccr3、ccr4和ccr8)识别,其中ccr1、ccr3、ccr4和ccr8在scrnaseq数据集中手动鉴定的foxp3
treg上高度表达。这些结果表明趋化因子受体表达可有助于nsclc肿瘤内treg丰度。
[0263]
实施例1-讨论
[0264]
在该实施例中,组合了高维流式细胞术、基因组的、集群和单细胞转录数据来表征nsclc肿瘤内cd4 t细胞区室。提供了与tmb和treg浸润相关的全局cd4失调的证据,表明该过程可能是新生抗原驱动的并且对微环境因素敏感。
[0265]
作为结局的负预测因子,cd4
ds
可指示由于cd4祖细胞的丧失和/或功能障碍的子集的增加而导致的cd4 t细胞抗肿瘤效力受损。祖细胞丧失可对肿瘤内cd4 t细胞衰竭至关重要。已知这些细胞维持抗病毒(okoye et al.,2007;wu et al.,2016)和自身免疫应答(paroni et al.,2017;orban et al.,2014;shi et al.,2018),存在新的证据,其表明cd8祖细胞在抗肿瘤控制和对检查点免疫治疗的响应中的重要性。对scrnaseq数据的分析揭示了维持t细胞干性的转录因子编码基因tcf7和lef1的早期子集表达,并且这些基因缺陷的转录特征与cd4
ds
和较差的存活相关(图10),进一步支持了早期分化的cd4丧失为抗肿瘤免疫失败的关键特征。早期子集丰度的下降可由活化诱导的耗竭导致。另外,由于tdys和tdt群在蛋白质水平(cd103;图4b)和转录水平(图5d)下差异表达趋化因子受体和黏附分子,因此它们在空间受限的tme中的积累的倾向可能会以优先在淋巴器官之间循环的ccr7
早期分化细胞为代价。
[0266]
虽然cd4 tdys和tdt子集具有功能受损的表型特征和转录特征,但它们可保留抗肿瘤潜力。两个子集都表达cd4效应基因ifng,而tdys群还表达cd4辅助功能的关键调节物cd40lg。另外,效应基因的cd8样转录谱的tdt表达暗示了细胞毒性能力。功能潜力的这些指标与显示出功能障碍的肿瘤内cd8 t细胞保持增殖能力的最近研究(simoni et al.,2018)一致。然而,功能障碍的cd4 t细胞与进展中的肿瘤共存并且它们的丰度与患者结局负相关的观察结果表明整体受损状态。这些发现一起支持这样的假说,即长期刺激的t细胞功能被调低,可能是为了阻止脱靶组织自身免疫,但并未完全消除。
[0267]
最近的研究表明,突变负担与癌症结局呈正相关,特别是在经历免疫治疗的患者中。相反,研究表明了伴随持续抗原暴露发生的分化偏斜和t细胞功能障碍。在tracerx组群中发现,tmb与结局呈正相关,而cd4
ds
与结局呈负相关,这支持了取决于抗原相遇的背景,突变可对免疫功能产生相反影响的观点(图8e)。如果突变产生用于早期分化的t细胞的识别和控制的抗原靶标,则tmb可发生相反的作用,所述早期分化的t细胞由于慢性靶标暴露而被驱动到功能障碍状态,或者随着后来分化的细胞积累而被剥夺tme内的生态位(图11h)。独立于tmb,treg丰度与cd4
ds
的测量相关,表明它们的存在可改变抗原驱动的cd4失调的程度。通过诱导衰老和共抑制受体表达,treg促进初始和效应cd4功能障碍(liu et al,2018;sawant et al.,2019)可能是这种关系的基础。由于tmb最强烈地预测经免疫治疗治疗的患者的存活,因此检查点抑制也可改变抗原驱动的t细胞抗肿瘤效力vs.慢性暴露引起的cd4
ds
之间的平衡。
[0268]
cd4
ds
与克隆突变而非亚克隆突变之间的关系表明抗原丰度的重要性(图2e)。由于大多数nsclc不表达cd4识别所需的mhc ii(he et al.,2017),因此携带ii类的抗原呈递细胞可能是cd4抗肿瘤免疫应答的关键调节物。与亚克隆突变相比,克隆突变可通过产生高于免疫激活最低阈值的新生抗原水平来优先驱动cd4
ds
(zingernagel eta l.,1997)。然而,组群中亚克隆突变的低范围可限制对与cd4
ds
关系的准确评价,并因此需要进一步的工作来探索这一点。
[0269]
研究建议了多种潜在的治疗靶标和合理免疫治疗选择的指南。单细胞rnaseq分析
揭示了tdys和tdt子集的共刺激和共抑制受体情况的不同和以前未描述的特征,并且鉴定了可操作的子集特异性(例如tdys上的gitr、icos和ox40、tdt上的cd27和lightr)和共享靶标(例如tigit和tim3)。其中,如上所述,一些基因被选为特别有前景的可操作靶标(epha1、fcrl3、pecam1、stom、axl、furin、ll1rap、e2f1、c5orf30、cldnd1、gfi1、rnaseh2a、sirpg和suv39h1),以及选择这些的子集用于实验验证(axl、furin、il1rap、stom、fcrl3、sirpg和e2f1)。il1rap和sirpg的数据显示在实施例3中。
[0270]
总之,在肿瘤内cd4分化情况中显示出与tmb和treg丰度相关发生的深刻变化,这让人想起在持续抗原暴露期间小鼠和人外周t细胞区室的改变。cd4
ds
预测多个组群中更糟糕的结局,并结合来自单细胞和集群rna测序的数据揭示了对该过程的生物学见解,具有潜在的治疗价值。
[0271]
实施例2-与新生抗原相关的cd8 t细胞功能障碍与非小细胞肺癌中的肿瘤免疫逃逸结合
[0272]
材料和方法
[0273]
患者和样品:如实施例1中所述,除了另外还包括来自tracerx肺试验研究(uclhrtb 10/h1306/42)的样品(以lo前缀指定)。
[0274]
用于免疫测定的淋巴细胞分离:在rpmi-1640(sigma,目录号r0883-500ml)中收集和运输组织样品。通过使用释放酶tl(roche,目录号05401127001)和dna酶i(roche,目录号11284932001)进行酶消化,随后使用miltenyi gentlemacs octodissociator进行细胞解聚,来产生单细胞悬液。将淋巴细胞通过在ficoll paque plus(ge healthcare,目录号17-1440-03)上梯度离心从单细胞悬液中分离,冷冻保存在含有10%dmso(sigma,目录号d2650-100ml)的胎牛血清(gibco,目录号10270-106)中并储存在液氮中。将血液样品收集在bd vacutainer edta血液收集管(bd目录号367525)中,然后通过梯度离心在ficoll paque(ge healthcare,目录号17-1440-03)上分离pbmc,并储存在液氮中。
[0275]
流式细胞术:将fc受体用人fc受体结合抑制剂(thermo,目录号572 14-9161-73)封闭随后进行染色。将非活细胞使用ebioscience fixable viability dye efluor 780(thermo,目录号65-0865-14)染色。将细胞在bd brilliant染色缓冲液(bd目录号563794)中染色,使用的以下单克隆抗体为:针对人cd45ro的buv395缀合抗体(克隆uclh1;bd目录号576 564291);针对人cd8的buv496缀合抗体(克隆rpa-t8;bd目录号564804);针对人cd45ra的buv563缀合抗体(克隆hi 100;bd目录号565702);针对人cd4的buv661缀合抗体(克隆sk3;bd目录号566003);针对人cd28的buv737缀合抗体(克隆28.2;bd目录号564438);针对人cd3的buv805缀合抗体(克隆sk7;bd目录号565511);针对人pd-1的bv421缀合抗体(克隆eh12;bd目录号562516);针对人cd57的bv605缀合抗体(克隆nk-1;bd目录号563896);针对人cd69的bv711缀合抗体(克隆fn50;bd目录号563836);针对人cd27的bv786缀合抗体(克隆l128;bd目录号563327)、针对人cd5的bv480缀合抗体(克隆ucht2;bd目录号566122);针对人cd38的bv650缀合抗体(克隆hit2;bd目录号740574);针对人cd103的bb515缀合抗体(克隆ber-act8;bd目录号564578);针对人cxcr6的percp-cy5.5缀合抗体(克隆k041e5;biolegend目录号356010);针对人ccr5的pe缀合抗体(克隆2d7/ccr5;bd目录号555993);针对人4-1bb的pe/dazzle 594缀合抗体(克隆4b4-1;biolegend目录号309826);针对人fas的pe-cy7缀合抗体(克隆dx2;biolegend目录号305622);针对人cd101的apc缀合抗体(克隆
bb27;biolegend目录号331010)和针对人hla-dr的apc-r700缀合抗体(克隆g46-6;bd目录号565127)。在bd symphony流式细胞仪上采集数据并在flowjo v10.5.3(treestar)中进行分析。如图15a所示,针对尺寸、单594细胞、活细胞、cd3 cd8 t细胞对细胞进行设门。
[0276]
无监督流式细胞术分析:使用定制流水线“cytofpipe”处理原始fcs文件,该流水线基于cytofkit(chen et al.,2016)、scaffold(spitzer et al.,2015)和citrus(bruggner et al.,2014)r包开发以用于流式细胞术和质谱细胞术数据的自动分析。具体来说,使用来自cytofkit的autolgcl转换来转换标志物表达值,并随后从每个文件中随机抽取固定数量的2000个细胞而不进行替换,并合并进行分析。无监督分析使用flowsom(van gassen et al.,2015)如在流水线中实施的那样进行。聚类基于表现出细胞间表型变异的标志物的表达:cd38、cd45ro、cd69、cxcr6、fas、pd1、cd103、hla-dr、cd27、cd57、cd45ra、cd5、cd28和cd101(不包括产生低信号的4-1bb和ccr5)。flowsom是在ntl和til样品上使用由先前的phenograph(weber et al.,2016)分析告知的k=15预定义数量的集群进行的。flowsom聚类在递归中使用不同的随机种子重复50次,以确保子集的稳定性。过滤集群以去除平均频率《1%的集群和仅存在于稀有样品中的集群(《10%样品运行)。将每个集群的中值强度值用于产生热图。使用所有通道的n
×
n系列双轴图检查每个集群。由于细胞间差异低,因此ccr5被排除在下游分析之外。将子集基于热图树枝形结构关系图上的超集群分组、关键标志物的常见表达谱、降维空间中群的拓扑结构和文献中的手动注释来分配。将与研究相关的集群和子集(与突变情况的显著相关性)使用手动设门策略验证。将umap(becht et al.,2019)降维用于可视化细胞群,因为它在集群相似性的拓扑保存方面具有优势,并且相对于替代降维技术(becht et al.,2019)改进了数据连续性。将umap使用flowsom集群或子集的过度绘图(over-plotting)或者相对标志物表达进行投影,并用于推断子集和集群间关系,如正文中所详细说明的。
[0277]
多区域全外显子组测序:如前所述(jamal-hanjani et al,2017)进行多区域肿瘤样本和来源于全血的匹配种系样品的全外显子组测序(whole exome sequencing,wes)。通过比较种系和肿瘤dna来鉴定来自每个肿瘤区域的同义和非同义突变。
[0278]
克隆突变和亚克隆突变调用:每个非同义突变的克隆性使用修改版本的pyclone(roth et al.,2014;mcgranahan et al.,2016)考虑基因拷贝数、肿瘤纯度和变异等位基因频率(variant allele frequency,vaf)来确定。将测序数据以登录号egas00001002247保存在欧洲基因组表型组档案(european genome-phenome archive)中。简而言之,对于每种突变,计算两个值,obsccf和phyloccf。obsccf对应于每种突变的观察到的癌细胞分数(cancer cell fraction,ccf)。相反,phyloccf对应于突变的系统发育ccf。为了阐明这两个值之间的差异,考虑肿瘤内每种癌细胞中存在的突变。一个肿瘤区域中的亚克隆拷贝数事件可导致癌细胞子集中这种突变的丢失。虽然该突变的obsccf因此低于1,但从系统发育的角度来看,该突变可被视为“克隆的”,因为它发生在肿瘤系统发育树的主干上,并且照此,phyloccf可为1。为了计算每种突变的obsccf,整合了局部拷贝数(从ascat获得)、肿瘤纯度(也从ascat获得)和变异等位基因频率。简而言之,对于给定的突变,首先计算观察到的突变拷贝数n
mut
,其使用以下公式描述携带给定突变的肿瘤细胞的分数乘以该基因座的染色体拷贝数:
[0279]nmut
=vaf
1p
[pcn
t
cnn(1-p)]
[0280]
其中vaf对应于突变碱基处的变异等位基因频率,以及p、cn
t
、cnn分别是肿瘤纯度、肿瘤基因座特异性拷贝数和正常基因座特异性拷贝数(假设常染色体的cnn为2)。然后,使用vaf并使用最大似然法将突变分配给可能的局部拷贝数状态之一来计算预期的突变拷贝数n
chr
。在这种情况下,仅考虑整数拷贝数。然后使用pyclone dirichlet过程聚类(roth et al.,2014)对所有突变进行聚类。对于每种突变,使用观察到的变体计数并设置参考计数,以使vaf等于聚类前(pre-clustering)ccf的一半。鉴于拷贝数和纯度已经校正,将主要等位基因拷贝数设置为2,并将次要等位基因拷贝数设置为0,以及将纯度设置为0.5;允许进行聚类以简单地对克隆突变和亚克隆突变进行分组(基于其聚类前ccf估计值)。以10,000次迭代和1000次老化以及默认参数运行pyclone,但将
‑‑
var prior设置为“bb”以及-ref prior设置为“normal
”’
。为了确定每种突变的phyloccf,实施了与上述类似的程序,除了针对亚克隆拷贝数事件校正突变。具体来说,如果观察到的变异等位基因频率与预期的显著不同(p<0.01,使用r中的prop.test)(考虑到克隆突变),则确定亚克隆拷贝数事件是否会导致观察到的和预期的vaf之间不显著(p>0.01)的差异。然后通过将n
mut
除以n
chr
来计算每种突变的聚类前ccf。使用来自ascat输出的原始值估计亚克隆拷贝数事件。最后,为了确保得失位的潜在不可靠vaf不会导致单独的突变集群,将每个估计的得失位ccf乘以区域特异性校正因子。假设所有区域中存在的大多数遍在突变都是克隆的,通过将遍在突变的中位突变ccf除以遍在得失位的中位得失位ccf来计算区域特异性校正因子。
[0281]
新生抗原结合物:确定了可能由样品中存在的已鉴定的非沉默突变产生的新的9至11聚体肽。使用netmhcpan-2.8和netmhc-4.0计算与患者的每个hla等位基因结合的所有肽的经预测的ic50结合亲和力和排序百分比评分,其代表与一组400,000个随机天然肽相比的预测亲和力的排序。预测的结合物被认为是通过两种工具中的任一种得到的预测的结合亲和力《500nm或排序百分比评分<2%的那些肽。强预测结合物是预测的结合亲和力《50nm或排序百分比评分《0.5%的那些肽。
[0282]
流式细胞术数据的相关分析:将在上述50次flowsom迭代中的第一次中鉴定的k=15cd8 t细胞集群用作初始研究的代表性集群。过滤集群以去除平均频率《1%(集群10)和存在于《10%样品中的聚类(聚类6,仅在cruk009:r1中检测到)。剩余13个集群的频率最初在配对wes数据的背景下通过2尾斯皮尔曼等级vs i)总新生抗原和ii)《50nm亲和力(“强”)的克隆新生抗原的数量的相关性基于先前在nsclc中鉴定的反应性(mcgranahan et al.,2016)进行分析。使用fdr 0.05下的原始benjamini-hochberg(bh)fdr程序将p值针对多次调整进行校正以控制i型错误,校正两组分析的p值。基于表型的相似性、通过umap在降维空间中的聚类以及它们与新生抗原负荷的共享负相关,将与新生抗原负荷(cl.2,3,5)共享负相关的trm集群组合用于下游分析。将tdys:trm比率用作确认与另外的基因组特征的关系的单一度量,所述另外的基因组特征包括总新生抗原、tmb、克隆突变或亚克隆突变、克隆新生抗原或亚克隆新生抗原、预计不会产生新生抗原的突变(非结合物)和“强”的总新生抗原或克隆新生抗原(对同源hla的亲和力《50nm)。当手动设门群确认无监督分析时,以及当使用独立肿瘤区域作为离散数据点的初始观察结果使用每位患者的多区域样品的平均值重新分析时,tdys:trm比率仍然与新生抗原负荷显著相关(图14e)。
[0283]
新生抗原反应性t细胞的多聚体分析:新生抗原特异性cd8 t细胞使用从对同源hla的预测的亲和力《500nm的患者特异性新生抗原产生的候选物突变体肽的高通量mhc多
聚体筛选(hadrup et al.,2009)进行鉴定,如前所述((mcgranahan et al.,2016)。合成了288和354个候选物突变体肽(预测的hla结合亲和力《500nm,包括来自同一错义突变的多个潜在肽变异),并分别用于筛选扩增的l011和l012 til。在患者l011中,发现til识别hla-b*3501限制的、mtfr2d326y来源的突变序列fafqeydsf(seq id no:23)(netmhc结合评分:22),但不识别野生型序列fafqeddsf(seq id no:24)(netmhc结合评分:10)。没有发现针对重叠肽afqeydsfek(seq id no:25)和kfafqeydsf(seq id no:26)的响应。在患者l012中,发现til识别hla-a*1101限制的、chtf18l769v来源的突变序列llldivapk(seq id no:27)(netmhc结合评分:37)但不识别野生型序列:llldilapk(seq id no:28)(netmhc结合评分:41)。没有发现针对重叠肽cllldivapk(seq id no:29)和ivapklrpv(seq id no:30)的响应。最后,在患者l012中,发现til识别hla-b*0702限制的、myadmr30w来源的突变序列spmivgspw(seq id no:31)(netmhc结合评分:15)以及野生型序列spmivgspr(netmhc结合评分:1329)。没有发现针对重叠肽spmivgspwa(seq id no:32)、spmivgspwal(seq id no:33)、spwaltqplgl(seq id no:34)和spwaltqpl(seq id no:35)的响应。患者l021为72岁男性吸烟者(50包年(pack year)),患有iiia期lusc(分化差,右上叶,51mm,淋巴结2/6肺门),如图13b所示。对于患者l021,从预测的克隆新生抗原库中筛选出235种肽。同时,评估了对hla匹配病毒肽的til响应。发现til识别hla-a*3002限制的、znf704 l301f来源的突变序列yfvhtday(seq id no:36)(netmhc结合评分:61)以及野生型序列ylvhtdhay(seq id no:37)(netmhc结合评分:27)。未检测到对重叠肽tlyfvhtdh(seq id no:38)、tlyfvhtdhay(seq id no:39)、lyfvhtdhay(seq id no:40)和apttlyfvh(seq id no:41)的响应。将新生抗原特异性cd8 t细胞用与链霉亲和素pe(biolegend,目录号405203)、apc(biolegend,目录号405207)bv650(biolegend,目录号405231)或pe-cy-7(biolegend,目录号405206)缀合的肽-mhc多聚体追踪并以活的单cd8 细胞中的双(lo11,lo21)或单(lo12)阳性细胞设门。l011和l012中新生抗原特异性cd8 t细胞的表型表征如前所述22进行。另外,将l021和l011中til、pbmc和ntl中新生抗原的mhc多聚体用以下染色:在流式细胞术neo板1的情况下:与bv711缀合的抗cd3(biolegend,目录号344838,克隆sk7);与bv785缀合的抗cd4(biolegend目录号344642,克隆sk3);与bv510缀合的抗cd8(biolegend,目录号301048,克隆rpa-t8);与pe/cy7缀合的抗cd45ra(biolegend,目录号304126,克隆hi100);与bv605缀合的抗ccr7(biolegend目录号353224,克隆g043h7);与bv650缀合的抗pd-1(biolegend,目录号329950,克隆eh12.2h7);在mhc-多聚体-pe、mhc-多聚体-apc或流式细胞术neo板2的情况下:与fitc缀合的抗ccr7(biolegend,目录号353216,克隆g043h7);抗cxcr6 percp/cy-5.5(biolegend,目录号356010克隆k041e5);与bv510缀合的抗cd8(biolegend,目录号301048,克隆rpa-t8);与bv605缀合的抗pd-1(biolegend,目录号329924克隆eh12.2h7);与bv650缀合的抗cd4(biolegend,目录号300536克隆rpa-t4);与bv711缀合的抗cd45ra(biolegend,目录号304138克隆hi100);与bv785缀合的抗cd69(biolegend,目录号310932,克隆fn50);与pe-dazzle-cf594缀合的抗4-1bb(biolegend,目录号309826,克隆4b4-1);与pe-cy7缀合的抗icos(biolegend,目录号313520,克隆c398.4a);与buv395缀合763的抗cd3(bd,目录号564001,克隆sk7);与alexa-fluor700缀合的抗cd28(biolegend,目录号302920,克隆cd28.2)。
[0284]
新生抗原反应性t细胞(neo.cd8)的单细胞rna测序:之前已经鉴定了在来源于患
者l01122的nsclc肿瘤区域中靶向克隆新生抗原(来自突变mtfr2基因)的cd8 新生抗原反应性t细胞(nart)。使用上述neo.板1和来自同一患者的新鲜解冻的冷冻保存til小瓶,基于双荧光多聚体标记重复了新生抗原反应性t细胞的染色。将来自nsclc样本的多聚体阳性和阴性单cd8 t细胞直接分选到c1集成流体回路(integrated fluidic circuit,ifc;fluidigm)中。按照制造商的说明进行细胞裂解、逆转录和cdna扩增。简而言之,将1000个单个、多聚体阳性或阴性cd8 t细胞直接流分选到直径为10μm至17μm的c1集成流体回路(ifc;fluidigm)中。在分选之前,细胞入口孔预装有3.5μl pbs 0.5% bsa。测量分选之后的总孔体积并用pbs 0.5% bsa将其调至5ul。添加1μl c1细胞混悬试剂(cell suspension reagent)(fluidigm)并通过移液混合最终溶液。将每个c1 ifc捕获位点在evos fl自动成像系统(thermo fisher scientific)下在明场中仔细检查,以检查空孔和细胞双联体(cell doublet)。还获得了所有捕获位点的自动扫描以供参考。在c1单细胞auto prep ifc上按照制造商的说明进行细胞裂解、逆转录和cdna扩增。将smarter v4 ultra low rna试剂盒(takara clontech)用于从单细胞合成cdna。将cdna用qubit dsdna hs(molecular probes)进行量化,并在agilent bioanalyser高灵敏度dna芯片上进行检查。根据用于mrna测序方案的fluidigm单细胞cdna文库,使用nextera xt dna样品制备试剂盒(illumina)构建illumina ngs文库。测序使用150bp配对末端试剂盒在illuminar nextseq 500上进行。使用fastqc评估所有测序数据以检测测序失败,并使用trimgalore过滤或修剪较低质量(lower quality)的读数。将包含低测序覆盖率或高重复率的异常样品丢弃。使用rnaseq数据的分析是在r统计计算框架3.5版中使用来自bioconductor 3.7版的包进行的。将单细胞rnaseq样品使用star算法映射到grch38参考人基因组,如包括在ensembl 84版中,并使用rsem算法估计转录物和基因丰度。在量化之后,使用scater包设置过滤阈值,基于使用加标(spike in)和线粒体基因过滤掉质量差的细胞,按基因总数过滤和按测序读数总数过滤。将剩余细胞在使用scran包估计的大小因子进行归一化之后使用。下游分析使用log2转换的归一化计数数据。所有计数数据、元数据和中间结果都保存在summarisedexperiment/singlecellexperiment r对象中。数据使用用于异常检测的edger bioconductor包和差异基因表达分析来处理。将差异表达的基因基于它们的蛋白质编码状态评估。对于所有差异基因表达比较,使用pheatmap包(kolde,r.,2012,版本rhaa4dhf)产生具有最高差异表达基因的信息热图。使用了在m3drop包中实现的单细胞无监督聚类,并产生了针对每个集群的显著的标志物基因用于下游分析。
[0285]
大量细胞制剂的rna测序和分析:将bd facsaria ii流式细胞仪用于从nsclc样品中分选cd8 肿瘤浸润淋巴细胞。将1000至50,000个cd8 til分选为正文中描述的两个群,患者体内组织中每个群的细胞数最大差异为1.5倍。将细胞直接分选到800μl trizol试剂(invitrogen)中,并在干冰中快速冷冻(在-80℃下长期储存)。提取时,将样品在室温下解冻,并且各自添加160μl氯仿。在离心步骤之后,将rna从水相中分离,并通过添加等体积的补充有20μg线性聚丙烯酰胺的异丙醇进行沉淀。将样品在80%乙醇中洗涤两次(第一次在4℃下洗涤过夜,第二次在室温下洗涤5分钟)。将rna沉淀重悬于3至15μl的经焦碳酸二乙酯处理的水(depc)中。然后将rna通过在agilent bionalyser rna 6,000pico芯片上上样0.5至1μl进行量化。在可能的情况下,使用smarterv3试剂盒(takara clontech)将来自所有样品的等量总rna(100pg)用于第一链合成,然后进行15至18个扩增循环(按照制造商的说
明)。将cdna在agencourt ampurexp磁珠上纯化,用新鲜的80%乙醇洗涤两次并在17μl洗脱缓冲液中洗脱。将1μl cdna用qubit dsdna hs(molecular probes)进行量化,并在agilent bioanalyser高灵敏度dna芯片上进行检查。从150pg输入cdna使用illumina nextera xt文库制备试剂盒产生测序文库。采用了1:4小型化版本的方案(参见“fluidigm single-cell cdna libraries for mrna sequencing”,pn_100-7168_l1)。标记时间为5分钟,837,然后使用illumina xt 24或96索引引物试剂盒进行12个扩增循环。然后将文库合并(每个样品1μl至2μl,取决于样品总数)并用等体积(1:1)的agencourt ampurexp磁珠进行纯化。最终洗脱在66至144μl重悬缓冲液中(取决于合并(pooled)样品的总数)。将文库在agilent bioanalyser高灵敏度dna芯片(大小范围150至2000bp)上检查,并通过qubit dsdna hs(molecular probes)进行量化。将文库在illuminar nextseq 500上使用150bp配对末端试剂盒按照制造商的说明进行测序。使用r中的tximport v1.9.8包输入60675个基因的原始计数。删除所有样品中平均计数《15的基因,留下14648个基因。然后将剩余基因的原始计数(作为tximport对象)转换为deseq2 v1.21.10对象用于归一化,并将betaprior设置为false。然后对负二项式分布的归一化计数进行差异表达分析,其中fdr设置为5%)。在差异表达之后,将log(基数2)倍数变化(log2fc)通过deseq2的lfcshrink函数缩小。对于下游分析,负二项分布归一化计数通过r中的deseq2的rlog函数转换为规则对数(rlog)计数,其中盲设置为false。通过绘制离差的最大似然估计(与最终离差估计重叠)与归一化计数的平均值来检查归一化计数的离差分布。通过boxplot函数通过箱须图另外检查了rlog计数在样品中的分布。使用rlog计数的主组分分析是使用stats基础包的prcomp函数进行的,随后产生双图以比较特征向量,即主组分(principal component,pc),1到3。通过在benjamini-hochberg q≤0.05和绝对log2fc≥1下的来自每个差异表达分析的基因中过滤进行监督聚类。这些统计学上显著差异表达基因的规则对数计数被转换为z尺度,并随后使用complexheatmap包的heatmap函数通过1减去皮尔逊相关距离和ward链接进行聚类。将每个样品的z评分的小提琴图添加至热图底部,以显示这些统计学上显著差异表达基因的分布。在热图顶部添加了指示不同样品组的颜色条。使用预选的k值围绕中心点(pam)聚类进行分区以鉴定基因集群,然后使用基因到集群的分配将热图和基因树枝形结构关系图拆分为单独的实体。
[0286]
从集群rnaseq中检索tcr:tcr是根据以下详述(参见下文的“tcr测序”)的最近公开的方案(oakes et al.,2017)进行的肿瘤区域rna的tcrseq鉴定的。使用r中的定制脚本,针对在tcrseq中鉴定的特定tcr的存在,从分选的cd8 til群中挖掘rna。简而言之,将从肿瘤区域中丰度最高的前100个tcr中的每一个的cdr3区域中选择的20碱基对序列与集群rnaseq转录物比对。将精确匹配的数量与使用相同长度的恒定(α或β)区域序列获得的匹配数量进行比较。通常,可以使用这种方法鉴定每rnaseq文库(100万至1000万个读数)中的数百个tcr恒定区。
[0287]
来自肿瘤组织的多区域rna测序:对来自tracerx 100组群中的每个肿瘤样本的全rna(核糖体耗竭的)进行配对末端rna测序。读数长度为75个碱基对,平均为5000万读数(每个末端2500万)。rnaseq数据的深入分析从tracerx 100组群中获得。rna测序数据将在公开之后存放在欧洲基因组表型档案中。
[0288]
拷贝数:通过首先将肿瘤分为免疫分类来鉴定拷贝数新生抗原耗竭。所有非同义
突变都被注释为是否在亚克隆拷贝数丢失的区域中。然后进行富集测试以确定与未被预测作为新生抗原的非同义突变相比,作为新生抗原的非同义突变是否更可能位于亚克隆拷贝数丢失的区域中。
[0289]
使用hla loh鉴定肿瘤区域:使用lohhla法鉴定具有hla loh事件的肿瘤区域,所述方法描述于(mcgranahan,2017)。
[0290]
免疫逃避改变:抗原呈递途径基因是从arrieta et al(2018)汇编的,并影响hla增强体、肽产生、分子伴侣或mhc复合体本身。它们包括以下基因的破坏性事件(相对于倍性(ploidy)定义的拷贝数丢失或非同义突变(jamal-hanjani et al,2017)):irf1、psme1、psme2、psme3、erap1、erap2、hspa、hspc、tap1、tap2、tapbp、calr、cnx、pdia3、b2m。
[0291]
基因特征:基因特征富集使用上四分位数归一化的tcga和tracerx rna测序计数数据评价,通过期望最大化(rsem)估计。tcga rna测序数据(thorsson et al,2018)从gdc网站(https://gdc.cancer.gov/about-data/publications/panimmune)下载。对于neotdys评分(根据图24a进行整理)或melan.sv40.tdys基因特征(从schietinger et al 2016检索,特别是从该公开的图s4c中检索)log
10
1转换的、z评分标准化的和平均值(每个样品的)用来表示富集。排除了非蛋白质编码基因和在tcga和tracerx数据二者中均未表示的那些基因。使用的所有其他基因特征都是使用这种方法产生的。选择tcga-luad组群选择以包括之前的研究中限定的具有新生抗原负荷的样品(van allen et al,2015)。
[0292]
tcr测序:tcrα和β测序是利用从nsclc肿瘤样品和非肿瘤肺组织或冷冻保存的pbmc样品中提取的全rna,使用定量实验和计算tcr测序流水线进行的(oakes et al.,2017)。该方案的重要特征是并入与每个cdna tcr分子连接的独特的分子标识符(unique molecular identifier,umi),其能够校正pcr和测序错误。用于tcr鉴定、误差校正和cdr3提取的工具套件可在https://github.com/innate2adaptive/decombinator免费获得。在公开之后,原始dna fastq文件和经处理的tcr序列将分别可在ncbi short read archive和github上获得。α和β转录物的数量高度相关。始终检测到比α链更多的β链,这很可能是由于βtcr转录物的数量更多。为了验证测序效率,将α和βtcr转录物的数量与所研究肿瘤区域的匹配的集群rna测序数据相关联,通过cdr3γ、δ和ε链的表达或通过t细胞基因特征的rnaseq表达来量化t细胞浸润。注意到,平均而言,每个独特的tcr:umi组合在原始未校正数据中出现超过10次,因此这些单例不太可能是由测序错误引起的。
[0293]
基因集富集分析(gsea):使用作为度量评分的倍数变化的正负号(sign)乘以从上述差异基因表达分析中获得的p值的倒数产生来自tdys富集的(集群rnaseq)和neo.cd8(scrnaseq)数据集的基因排序列表。然后使用gsea v3.0的preranked模块来测试先前公开的基因排序列表中cd8 t细胞基因集的富集。cd8 t细胞基因集来源于最近的出版物:guo et al(
‘
tdys nsclc’=90基因t细胞耗竭特征,
‘
pre-tdys nsclc’=gzmk过渡,
‘
naive nsclc'=lef1,'teff nsclc'=cx3cr1,
‘
tcm nsclc’=cd28,
‘
trm-nsclc’=znf683),thommen et al(
‘
pd1hi tdys nsclc’=合并的c1、c3、c5、c7,
‘
pd1lo int nsclc’=合并的c2、c4、c6、c8),li et al(
‘
melanoma tdys’=功能障碍的cd8 t细胞基因特征),如最初所述(subramanian et al,2005;houstis et al.,2003)。使用自定义r脚本创建点图以可视化gsea结果。鉴定了在每个tdys富集的集群rnaseq和neo.cd8 scrnaseq数据集(共识前沿基因)中对nsclc tdys基因集的富集信号贡献最大的基因,产生了被称为neo.dys核心的35
个基因的列表。
[0294]
病理学til估计:til估计是根据国际免疫肿瘤学生物标志物工作组指南进行的,这些指南已被证明在经培训的病理学家中是可再现的(hendry et al.,2017)。使用区域水平的h&e载片,确定基质与肿瘤面积的相对比例,并通过考虑单个核炎性细胞占据的基质面积除以总基质面积来报道基质区室的til百分比。在个人内部一致性测试中,证明了高再现性。国际免疫肿瘤学生物标志物工作组开发了免费提供的培训工具,用于培训病理学家对h&e载片进行最佳til评估(www.tilsincancer.org)。
[0295]
统计分析:使用prism版本8.0.0或r v 3.5.3根据图例中所示的统计测试分析数据,并注明包。
[0296]
实施例2—结果
[0297]
为了以单细胞分辨率剖析nsclc中的cd8 t细胞区室,开发了定制的高参数流式细胞术板,包括可用于限定以下的标志物:谱系(cd3、cd8)、抗原结合(4-1bb、hla-dr、cd38)、功能障碍(pd-1、cd101、fas)(thommen&schumacher,2018;philip et al.,2017;schietinger&greenberg,2014)、组织驻留(cd69、cd103、cxcr6)(hombrink et al.,2016;mackay et al.,2013)和早期(cd28、cd27、cd5)或终末(cd45ra、cd57)分化(appay et al.,2008)(方法)。流式细胞术在来自肺tracerx(通过治疗(rx)追踪非小细胞肺癌演变)研究的前100组群(jamal-hanjani et al.,2017)的患有早期、未治疗nsclc的37名患者的110份手术切除样本中进行(图13a至b)。样品包括来自腺癌(luad)、鳞状细胞癌(lusc)和其他组织学亚型(其他,图13c)的肿瘤区域(每位患者1至6个)和匹配的非肿瘤肺(n=25)。
[0298]
为了表征nsclc中cd8 t细胞子集的多样性,使用flowsom(van gassen et al.,2015)对来自所有肿瘤区域和非肿瘤肺的样品中的cd8 t细胞进行了无监督分析。flowsom分析产生了15个集群(cl)(图14a、图15a至b),这些集群基于树枝形结构关系图上的集群分组、降维空间中的拓扑学和随后的手动注释被分类为五个cd8 t细胞子集(图14a、图15a至b)。cd8 t细胞子集包括三个充分描述的cd103-(迁移)群,包括重新表达cd45ra的终末分化效应记忆细胞(terma;cd45ra
cd103-;cl.8,11)、终末分化效应细胞(tde;cd45ra-cd103-cd57
hla-dr
;cl.13,14,15)和中枢记忆样细胞(tcm;cd45ra-cd103-cd57-cd28
hi
cd5
hi
;cl.9)。在cd103
合并物(特征为稳定存在于非淋巴组织中的非循环的组织驻留群(mueller&mackay,2016))中,鉴定了代表经典组织驻留记忆细胞的两个子集(trm;cd45ra-cd103
cd69
pd-1
lo-int
cd27
lo
fas
lo-int
;cl.2,3,4,5)和包含具有t细胞功能障碍特征的异质群的pd-1
hi trm细胞(6)(pd-1
hi-trm;cd45ra-cd103
pd-1
hi
cd27
hi
fas
hi
;cl.1,7,12;图14a、图15b)。两个集群由于丰度(cl.10;《1%样品间平均频率)或分布(cl.6;仅存在于cruk009:r1中)而被排除在外。为了解释集群产生中的随机性,在聚类分析中使用flowsom的多次迭代观察到五个主要cd8 t细胞子集中的每一个(图15c)。
[0299]
在每个子集中,根据活化、迁移或成熟状态进一步细化集群身份(图14a下部注释)。其中由于在nsclc中功能障碍的cd8 t细胞上表达的cd38和cxcr6水平较低,因此pd-1
hi-trm子集cl.7被标记为功能障碍前(pre-tdys)(thommen et al.,2018;sguo et al.,2018)。cl.12没有抑制性分子cd10119,但表达终末分化标志物cd57('终末分化功能障碍;tdt),并且cl.1表达cxcr6并共同表达高水平的cd38和cd101,其与实体瘤中缺乏效应物功能相关(philip et al.,2017)(功能障碍“tdys”),图15d、图16。tdys(cl.1)是nsclc肿瘤中
丰度最高的群(luad 36.2% /-std.dev 18.1,lusc 35.9% /-15.6;padj《5.0
×
10-4
vs.所有其他集群),但这与tde cl.13相比不显著(padj=4.0
×
10-1
),图15e。值得注意的是,相对于正常组织,tdys(cl.1)和tdt(cl.12)在肿瘤中均富集(cl.1:luad,padj《1.0
×
10-5
,lusc padj《1.0x10-5
,cl.12:luad padj=4.1
×
10-2
,lusc padj=4.9
×
10-2
;图15f),但它们的频率在til样品中变化很大(例如,luad til中tdys cl.1的范围为5.6%至61.8%;图15f至g)。这些数据表明,相对于邻近的肺组织,nsclc肿瘤含有具有功能障碍表型的cd8 t细胞,其丰度在肿瘤区域和患者之间有所不同。
[0300]
为了确定肿瘤内cd8 t细胞分化的程度是否与肿瘤新生抗原负担有关,检查了预测的新生抗原负荷(来源于wes,参见方法)与每个肿瘤区域中所有cd8 t细胞集群的丰度之间的相关性(图17a至d)。在luad中,tcm样细胞(2尾斯皮尔曼等级相关系数r=-0.36,padj=4.0
×
10-2
)和trm集群cl.2(r=-0.36padj=2.7
×
10-2
)cl.3(r=-0.62,padj=8
×
10-4
)和cl.5(r=-0.58,padj=1.9
×
10-3
)与新生抗原负担呈负相关。相比之下,tdys细胞(cl.1,在pd-1
hi-trm子集中)的丰度与新生抗原负荷呈正相关(r=0.36,padj=4.0
×
10-2
,图14b至c)。使用统一流形逼近与投影算法(umap)(becht et al.,2019)在降维空间中可视化流式细胞术数据,显示出cd103-(temra,tcm,tde)和cd103
子集(含有trm和pd-1
hi-trm的tdys细胞)之间的明显的分隔。umap中tdys(与新生抗原负荷呈正相关)和trm集群2、3、5(与新生抗原负荷呈负相关)之间的密切关系与这些子集之间记录的tcr重叠(guo et al.,2018)一致,共同支持了新生抗原诱导的trm到tdys分化的概念。tcm样细胞(也与新生抗原负荷负相关)位于单独的cd103-分支内(图14d至e,图18a至b)。
[0301]
鉴于nsclc中cd103
cd8 t细胞的肿瘤反应性(ganesan et al.,2017),接下来关注组织驻留合并物中的反相关tdys和trm子集。为了捕捉tdys和trm细胞之间的肿瘤内平衡,将它们的相对丰度表示为与新生抗原负荷呈正相关的比率(tdys:trm)(无论是在量化flowsom集群(r=0.62,padj=8
×
10-4
)的情况下还是在通过手动设门鉴定群的情况下)(图14g,设门策略参见图18c至d)。无论每个肿瘤区域是否被独立治疗或是否使用给定患者的多区域样品的平均值,都观察到这种相关性(图14g)。
[0302]
接下来应用tdys:trm比率来测试与突变负荷的替代基因组量度的关联。正如预期的那样,tdys:trm比率与tmb显著相关(图18e)。令人感兴趣的是,观察到预测的高亲和力(同源hla《50nm)vs非结合性新生抗原(r=0.7.54vs 0.146)和先前显示在nsclc中引发反应性的克隆新生抗原(mcgranahan et al.,2016)vs亚克隆(r=0.65vs 0.44)的相关性更强的趋势(图18e至f),然而,这些比较需要在更大的组群中进行验证。尽管lusc肿瘤具有相似的cd8 t细胞子集组成(图18g),但lusc肿瘤并未显示出集群频率与新生抗原负荷之间的显著关联(图18h),这可能与较高的tmb(图17c)或与吸烟史相关的微环境差异有关(jamal-hanjani et al.,2017)。该数据支持了luad中cd8
cd103
组织驻留群的肿瘤新生抗原驱动的分化的模型,其中tdys群以非功能障碍的trm细胞为代价而积累,这与cd103
合并物中的肿瘤反应性一致(ganesan et al.,2017;djeinidi et al.,2015),并特别是在pd-1
高
(thommen et al.,2018)组织驻留cd8 t细胞中。
[0303]
为了更深入地了解tmb的变化可如何影响cd8 t细胞情况,探索了cd8 tdys细胞相对于其他cd8 t细胞子集的表型和分子谱。与trm(随着新生抗原负荷而降低的cl2、3、5)相比,tdys显示出抗原刺激提高(以高hla-dr、cd38、pd-1和cd27水平为标志)、对凋亡的敏感
性增强(fas)、效应物成熟降低(cd57)和抑制性受体表达提高(cd101)(philip et al.,2017)的证据(图14a、图19至b、图20a)。此外,在pd-1
hi trm子集(cl 7、12、1)中,tdys群(cl1)显示出与肺中t细胞应答(cxcr6)(lee et al.,2010)、内在抑制(cd101)、持续tcr连接(cd38)和缺乏终末分化(cd57-)相关的标志物的独特组合。因此,与其他组织驻留群相比,新生抗原相关的tdys细胞表现出明显的慢性刺激特征(参见图14a和图15c)。
[0304]
随后检查了独立标志物的表达是否随新生抗原负荷而变化。在总cd8 t细胞区室中,与肺中的tcr结合(pd1、hla-dr、41bb)和抗原特异性响应(cxcr6)(lee et al.,2010)相关的分子表达水平与新生抗原负荷相关,这与目前在该领域中的假设(即tmb与肿瘤内t细胞活化有关)一致(图20b至c)。接下来对所有cd8 t细胞集群重复该分析。tdys细胞的变化反映了总cd8 t细胞区室的变化(图19c),而在trm(例如cl.2)和pd-1
hi trm(cl.7、12)集群中观察到类似的非显著趋势(图20d至e)。这些数据进一步支持了trm合并物在高tmb肿瘤中被活化的假设,并表明cd8 tdys细胞对新生抗原剂量有特异性响应。
[0305]
基于使用高表达标志物来富集tdys(图19d,图21a)的设门策略(cd45ra-cd57-pd-1
hi
),对从tracerx中的3名患者分选的nsclc cd8 til进行rnaseq分析,并产生了与新生抗原负荷相关的群(图21b)。相对于cd8 t细胞区室的其余部分,tdys富集的cd8 t细胞表现出与细胞毒性相关的基因(fgfbp2、gzmk、klrg1、klrf1)、干细胞潜力(stem potential)相关的基因(tcf7)和淋巴细胞运输/淋巴结归巢相关的基因(itga5、sipr1、ccr7、sell;图19e,图21c)水平显著降低。相反,参与组织驻留的基因((编码cd103的itgae)、参与共抑制的基因(ctla4)和参与效应物功能转录调节的基因(batf)被上调(图19e),并且与正常肺组织相比,在til中的表达更高(图21c)。另外数个功能障碍的基因共享这种表达模式,但在调整以用于多重测试之后不显著(例如pdcd1、编码cd39的entpd1、cxcr6、cd27、icos、编码tim-3的havcr2、编码gitr的tnfrsf18、layn)。这些数据支持积累有新生抗原负荷的t细胞群表现出功能障碍的分子状态。
[0306]
为了正式测试这一点,使用来自黑素瘤(rizvi et al.,2016)和nsclc(guo et al.,2018;thommen et al.,2018)样品的肿瘤浸润淋巴细胞的限定的cd8 t细胞子集的基因集进行gsea。组群中分选的cd45ra-cd57-pd-1
hi cd8 t细胞强富集来自黑素瘤(归一化富集评分,nes 2.25,paadj《1.0
×
10-5
)和nsclc(nes 3.015至3.3318,padj《1.0
×
10-5
)的功能障碍cd8 t细胞特征,而剩余部分的cd8 t细胞富集了与流式细胞术所鉴定的非tdys子集的多样性一致的效应物、中枢记忆和过渡/功能障碍前特征(图19f至g)。值得注意的是,当使用来自从小鼠肿瘤模型中纯化的tcr转基因、新生抗原特异性cd8 t细胞的基因集进行类似分析(schietinger et al.,2016)时,观察到在功能障碍的早期、可逆阶段(第8至12天)而非晚期(d34)、不可逆的固定状态诱导的基因显著富集(图21d)。这符合正在持续的活化,而不是人tdys细胞的终末功能障碍。
[0307]
来自分选的tdys富集的cd8 t细胞的rnaseq的tcr被映射到匹配患者的定量、多区域tcrseq文库(oakes et al.,2017)。tcr的分析显示出提高的tdys富集细胞相对于非tdys的克隆扩增以及这些群之间共享的克隆型(图21e至f),表明tdys细胞经历抗原驱动的扩增以及从非tdys子集中的祖细胞群分化。这一发现与癌症小鼠模型中描述的cd8 t细胞子集的进行性分化(philip et al.,2017;schietinger et al.,2016;miller et al,2019;boldajipour et al.,2016)、潜在的tcm或trm细胞的祖细胞作用、以及在基于scrnaseq的
伪颞叶模型中记录的trm细胞向功能障碍命运的预测轨迹(guo et al.,2018)一致。总的来说,这些数据支持这样的模型,所述模型中肿瘤新生抗原活化肿瘤内cd8 t细胞,但也可能驱动分化为功能障碍的表型和分子状态。
[0308]
为了验证对新生抗原具有特异性的cd8 t细胞中出现的t细胞功能障碍,接下来分析了来自三名未经历过治疗的nsclc患者的离体、未经处理的til中对四种肿瘤新表位具有反应性的t细胞。将从头(de novo)或先前(mcgranahan et al.,2016)鉴定的对新表位具有特异性的mhc多聚体(图22a)用于染色til以进行流式细胞术分析。mhc-多聚体阳性cd8 t细胞(neo.cd8)表达的pd-1水平显著高于匹配的pbmc(18.31 /-9.59倍,padj=6.5
×
10-3
)、ntl(8.89 /-3.41倍,padj=6.5
×
10-3
)和多聚体阴性cd8 til(3.23 /-0.52倍,padj=1.6
×
10-2
)的pd-1水平(图23a,图22b)。cd8 t细胞上的pd-1水平超过自体pbmc的pd-1水平最近被证明与nsclc中缺乏tnfa和ifng的产生一致(thommen et al.,2018)。在测量表征nsclc中功能障碍的cd8 t细胞的其他标志物(icos、lag-3和ki67)时,neo.cd8也出现了类似的结果(图22c)(guo et al.,2018;thommen et al.,2018)。
[0309]
另外,对具有可用材料的两名患者的til进行了分化标志物染色,表明neo.cd8缺乏ccr7和cd45ra的表达,并且显示出cd57的低表达(图22d),这与组群中tdys细胞的表型一致。来自患者l011的离体til的neo.cd8(和匹配的多聚体阴性cd8 til)的scrnaseq揭示了在neo.cd8中显著上调的864个基因和在多聚体阴性细胞中更高的1441个基因(图23b)。在多聚体阴性cd8 til中优先表达的基因包括编码杀伤样受体亚家族成员(klrg1、klrc1、klrd1、klrf1)、杀伤细胞免疫球蛋白样受体(kir2dl1、kir3dl1、kir3dl2、kir3dx1)和其他细胞毒性相关蛋白(gnly、fgfbp2)、参与增强t细胞活化的分子(例如lyn)和协调t细胞再循环的受体(s1pr1、s1pr2、s1pr5、cxc3r1)的那些,图23b。
[0310]
这些数据与tdys的集群rnaseq和流式细胞术分析一致,共同支持了新生抗原反应性t细胞缺乏效应物、中枢记忆或细胞毒性t细胞的分子特征。neo.cd8中上调的基因包括参与myd88信号传导的基因(irf5、traf6)和参与i型ifn响应的基因(mx2、oas3),其有助于病毒感染中的t细胞耗竭(wilson et al.,2013)。另外,il27ra在neo.cd8中表达,这与对il-27介导的t细胞功能障碍的易感性提高一致(chihara et al.,2018)。此外,neo.cd8表达了数种转录因子,包括那些在慢性感染期间调节记忆细胞持久性的转录因子(runx2)(olesin et al.,2018),抑制il-2产生的转录因子(ikzf3)quintana et al.,2012)和区分在体内对抗pd-1保持敏感性的长期刺激记忆cd8 t细胞子集的转录因子(bcl-6)(im et al.,2016)。另外,neo.cd8表达与以下有关的基因:细胞周期(例如cdk4、cks1b)、mhcii复合物的组分(hla-doa、hla-dqb1、hla-dmb、hla-dqb2)和活化标志物(cd38、fas、icos),其指示正在进行的tcr信号传导和增殖,与实体瘤中neo.cd8、tdys和功能障碍的cd8 t细胞的表型一致(li et al.,2019;thommen et al.,2018)。nsclc中cd8 t细胞产生的功能障碍相关细胞因子(il-10)和趋化因子(cxcl13)(thommen et al.,2018)以及维持体内功能障碍的cd8 t细胞的稳态细胞因子的受体(boldajipour et al.,2016)(il-15ra)和鉴定nsclc中trm细胞的基因(pfkfb3、znf683)(guo et al.,2018)同样相对于多聚体阴性细胞而优先在neo.cd8细胞中表达。编码其他免疫共受体和抑制分子的数个基因与neo.cd8相关,但在调整以用于多重测试之后不显著(tnfrsf18、cd27、havcr2、entpd1),图23b。这些数据表明,neo.cd8表达组织驻留相关基因、结合抗原并进行增殖,但被t细胞外在和内在调节的多种途径抑制和/
或对所述途径敏感。据此,gsea显示neo.cd8强富集来自nsclc(guo et al.,2018;thommen et al.,2018)和黑素瘤4组群的cd8 t细胞的trm和功能障碍基因集(图23c至d)。这些数据证实新生抗原特异性cd8 t细胞表达组织驻留和功能障碍的特征。
[0311]
随后测试了来自集群(图19e至f)和scrnaseq(图23b至d)分析的gsea的通常富集的功能障碍基因是否可以作为新生抗原相关cd8 t细胞功能障碍的基因特征(以下简称neo.tdys评分;图24a中所示的基因特征产生方法-简而言之:如果基因(i)位于cl.1富集的集群rnaseq(trm-dys)的gsea前沿,(ii)在来自l011 scrnaseq分析的新生抗原特异性cd8 t细胞中,和(iii)在nsclc中来自guo et al.的“tdys”标志物基因列表中,则选择基因以形成特征的一部分。在neo.tdys特征中的基因中,一些基于它们在功能障碍的cd8 t细胞中的表达水平被选为特别有前景的可操作靶标(cd7、cd82、cotl1、dusp4、fabp5、itm2a、park7、phlda1、rab27a、rbpj、rgs1、rgs2、samsn1、sit1、sirpg和tnip3),并选择其中的子集进行实验验证(cd7、cd82、samsn1、sirpg和sit1)。sirpg和sit1的数据显示在实施例3中。
[0312]
与此同时,评价了第二个不相关的特征,该特征来源于晚期人肿瘤的mart1/melana特异性cd8 t细胞和schietinger et al(2016)开发的鼠早期功能障碍新生抗原特异性cd8 t细胞(以下称为melan.sv40tdys)。neo.tdys和melan.sv40tdys评分使用来自tracerx的rnaseq样品以及配对流式细胞术数据进行验证,这证实二者都可以用作tdys细胞频率和tdys:trm比率的代表(图24b至c)。随后检查了来自tracerx 100luad组群(上述特征验证中使用的区域被排除)和tcga-luad的rnaseq数据集中的功能障碍基因评分水平。neo.tdys和melan.sv40.tdys评分(不是对照初始cd8 t细胞基因评分(guo et al.,2018))与来自tracerx 100的luad病例(来自35名患者的n=68个区域;neo.tdys r=0.25,padj=2.7
×
10-2
,melan.sv40.tdys r=0.31,padj=1.3
×
10-2
)和luad tcga(n=110名具有可用新生抗原计数的患者,neo.tdys r=0.2,padj=1.7
×
10-2
,melan.sv40.tdys r=0.46,padj《1.0
×
1-5
)中的新生抗原负荷显著相关,图23e。病理学估计的til浸润与新生抗原负荷无关,表明这些结果没有被浸润的过度影响所混淆(图24f)。总之,这些数据表明新生抗原特异性t细胞功能障碍的分子特征与独立tracerx和tcga组群中的突变负担有关,这表明新表位可用性可以是特定luad肿瘤中cd8 t细胞功能障碍的辅因子。
[0313]
肿瘤免疫逃逸机制在nsclc中普遍存在,并表现在活跃的t细胞监视的区域,这表明肿瘤基因组演变对免疫选择压力的响应(34至36)。因此,检查了cd8 t细胞情况在有免疫逃逸证据的区域是否存在差异。将tx.100组群中的hla loh和抗原呈递缺陷如前所述表征(rosenthal et al.,2019;mcgranahan et al.,2017)(方法)。独立luad肿瘤区域被分类为具有缺陷型抗原呈递证据的区域(hlaa、b、c中的loh,或irf1、psme1、psme2、psme3、erap1、erap2、calr、pdia3、b2m中的任何非同义突变或有害拷贝数事件,如最近在arrieta et al.,2018中所回顾的那样)或不具有缺陷型抗原呈递证据的区域(没有hlaloh或突变/拷贝数抗原呈递机制),图25a。在所有flowsom cd8 t细胞集群中,只有tdys在以抗原呈递缺陷为特征的肿瘤中提高(图25b,图26a)。这在新生抗原高区域中是一致的(根据受试样品的中值限定,图26b),并通过提高的tdys:trm比率来反映(图26c)。另外,tdys:trm比率与具有免疫逃逸的肿瘤区域中的新生抗原负荷相关,但与没有免疫逃逸的肿瘤区域中的新生抗原负荷无关(图26d)。
[0314]
为了验证这些数据,在tx.100luad rnaseq组群中使用了neo.tdys评分。与流式细
胞术数据一致,发现neo.tdys评分在表现出免疫逃逸的肿瘤中提高(图25c)。这种提高仅在具有高新生抗原负荷和存在免疫逃逸机制二者的区域中观察到(图25c),并且不是由于具有或不具有免疫逃逸的高突变负担肿瘤之间的新生抗原负荷差异引起的(图26e)。最后,验证了新生抗原负担和neo.tdys评分之间的相关性仅在具有免疫逃逸证据的肿瘤区域中观察到(图25d)。使用sv40.tdys基因评分看到了类似的结局(图26f至g)。这些数据表明,新生抗原驱动的cd8 t细胞功能障碍优先发生在免疫选择压力高的区域。
[0315]
目前免疫肿瘤学领域的假设是,tmb对应于肿瘤特异性t细胞应答的广度和幅度,在检查点抑制期间增强了更有利的临床结局。然而,虽然肿瘤演变与t细胞监测之间的关系变得越来越明显(marty et al.,2017;luksza et al.,2017;havel et al.,2019),但肿瘤内cd8 t细胞活化和功能障碍的基因组决定因素尚未得到系统研究。本发明的工作支持了tmb与肿瘤免疫原性成正比,这通过与总cd8 t细胞上的hla-dr、cd38、4-1bb的相关性来反映。另外,本发明的数据与新生抗原指导的cd8 t细胞分化过程一致,导致以tcm和trm子集为代价的tdys的扩增。
[0316]
最关键的是,结果表明,tmb和cd8 t细胞情况之间的关系取决于演变背景。总的来说,这些数据支持这样的模型:通过该模型,肿瘤反应性t细胞引发初始细胞毒性响应,但受到慢性新生抗原刺激,导致t细胞功能障碍、次优肿瘤消除和随之而来的免疫逃逸演变(图26i)。相比之下,缺乏抗原呈递缺陷并表现出低t细胞功能障碍的高tmb肿瘤可代表响应的早期阶段和/或有利于新生抗原监测的微环境(图26i)。这一概念与具有高tmb和低免疫逃避能力(rosenthal et al.,2019)或低tdys:trm比率(guo et al.,2018)的nsclc患者的改善结局一致。值得注意的是,tdys可继续在mhc i途径失调的区域引起慢性刺激,这是由于在tracerx100组群中未检测到抗原呈递途径基因15的双等位基因丢失或hla的纯合缺失(mcgranahan et al.,2017)。总的来说,数据表明未经治疗的nsclc中的trm合并物受到动态新生抗原刺激,其进展为t细胞功能障碍,同时伴随免疫逃逸的演变。
[0317]
实施例3
–
与癌症中的t细胞功能障碍相关的可操作靶标的验证
[0318]
材料和方法
[0319]
流式细胞术。对于肿瘤样品,在染色之前15分钟将fc受体用人fc受体结合抑制剂(目录号14-9161-73,invitrogen)阻断。将非活细胞使用ebioscience fixable viability dye efluor 780(thermo,目录号65-0865-14)染色。将细胞用pbs洗涤并用流式细胞术单克隆抗体的混合物孵育(按照20分钟进行)。为了检测胞内表位,将细胞使用ebioscience foxp3/转录因子染色缓冲液套组(ebioscience,目录:00-5523-00)按照制造商方案固定和透化。将细胞重悬于pbs中并使用bd facsymphony机器获取。流式细胞术抗体购自biolegend、bd和thermofisher scientific(ebioscience):ki67(目录号564071bd biosciences,克隆:b56)、cd8(目录号564804bd biosciences,克隆:rpa-t8)、cd45ra(目录号565702bd biosciences,克隆:hi100)、cd38(目录号565069bd biosciences,克隆:hit2)、cd39(目录号564726bd biosciences,克隆:tu66)、cd3(目录号565511bd biosciences,克隆:sk7)、pd1(目录号562516bd biosciences,克隆:eh12.1)、sirpγ(目录号747683bd biosciences,克隆:ox-119)、ccr7(目录号353224biolegend,克隆g043h7)、cd25(目录号302634 biolegend,克隆:bc96)、tim3(目录号565566bd biosciences,克隆:7d3)、cd4(目录号317442biolegend,克隆:okt4)、cd28(目录号11-0289-42ebiosicence,克
隆:cd28.2)、lag3(目录号369312biolegend,克隆:11c3c65)、tcf1(目录号655208bd biosciences,克隆:7f11a10)、41bb(目录号309826biolegend,克隆:4b4-1)、fcrl3(目录号374409 biolegend,克隆:h5/fcrl3)、sit1(目录号367804biolegend,克隆:sit-01)、gzmb(目录号367804biolegend,克隆:qa16a02)。在bd symphony流式细胞仪上获取数据并在flowjo v10.5.3(treestar)中进行分析。
[0320]
来自tracerx的肺癌患者样品中的靶标验证。组织样品在rpmi-1640(目录号r0883-500ml,sigma)中收集和运输。通过使用释放酶tl(目录号05401127001,roche)和dna酶i(目录号11284932001,roche)进行酶消化,随后使用miltenyi gentlemacs octodissociator进行细胞解聚,来产生单细胞悬液。将淋巴细胞通过在ficoll paque plus(目录号17-1440-03,ge healthcare)上梯度离心从单细胞悬液中分离,冷冻保存在含有10% dmso(目录号d2650-100ml,sigma)的胎牛血清(目录号10270-106,gibco)中,并储存在液氮中。将从iv期肺癌患者获得的肿瘤浸润淋巴细胞如前所述使用针对每一个提出的靶标的单克隆抗体进行染色。在不同的cd4和cd8 t细胞群中评估了提出靶标的表达。功能障碍的肿瘤反应性cd4和cd8 t细胞通过pd1、tim3(功能障碍)和cd39和41bb(新生抗原反应性)的表达进行鉴定。将不同标志物的表达用于限定耗竭和未耗竭的t细胞群,期望在从非新生抗原反应性到耗竭的肿瘤反应性群的每个群上发现所提出的靶标的提高的表达。
[0321]
使用crispr/cas9技术对人pbmc来源的t细胞进行基因编辑。将冷冻的外周血单个核细胞解冻并在含有2ml生长培养基(rpmi 1640(目录号51536c,sigma-aldrich)的12孔板(目录号353043,falcon)中孵育过夜,所述生长培养基补充有5ml青霉素-链霉素(目录号p4333,sigma-aldrich)和50ml人血清(10%终浓度)(目录:g7513-100 ml,sigma-aldrich)(补充有50iu/ml的il2(proleukin,novartis))。第二天,将细胞转移到包被10μg/ml αcd3抗体(目录号be0001-2,bioxcell,克隆:okt3)的12孔板中,并在含有100iu/ml il2和10μg/ml αcd28抗体(目录号be0248,bioxcell,克隆:9.3)的2ml生长培养基中培养72小时。通过在0.6ml管中混合alt-r tracrrna(目录号1072534idt)和alt-r crrna 200μm(定制,idt)并在95℃下孵育5分钟制备sgrna。将sgrna与无核酸酶duplex缓冲液(目录号11050112,idt)混合,并随后与cas9蛋白(目录号1081059idt)混合,以形成核糖核蛋白复合物。将细胞用核糖核蛋白复合物(用于4d-nucleofector x kit small(v4xp-3032lonza)按照制造商的方案进行电穿孔,并在含有100iu/ml的生长培养基上放置三天。最后,将细胞染色用于流式细胞术,以及通过量化相对于cd4或cd8 t细胞数的对靶标呈阳性的细胞数来测量靶基因的敲除。使用的crna的序列如表1所示。
[0322]
表1.crispr/cas9敲除的靶标列表和用于每个靶标的crna序列。
[0323][0324]
使用低剂量的αcd3和αcd28在体外重新活化基因编辑的t细胞。在基因编辑之后,将1
×
106个人t细胞在含有50ui/mlil2(proleukin,novartis)的生长培养基中在96孔板(目录号163320,thermo scientific)中保存10天。通过移除100μl旧培养基并添加100μl新鲜培养基每两三天(two-three day)更换一次培养基。在第10天,计数1
×
106个细胞,将细胞用cell trace violet(目录号34557,thermofisher scientific)染色,并使用1/800稀释的αcd3/αcd28 dynabead(目录号32-14000,gibco)重新活化四天。第4天,将细胞用1μl/ml的golgiplug(目录号555029,bd biosciences)孵育,并随后染色用于流式细胞术。流式细胞术染色使用bd cytofix/cytoperm试剂盒(目录号554714bd biosciences)按照制造商
方案进行。使用的抗体如下:cd8(目录号564804bd biosciences,克隆:rpa-t8)、cd3(目录号565511bd biosciences,克隆:sk7)、cd4(目录号563877bd biosciences,克隆sk3)、tnfα(目录号17-7349082invitrogen,mab11)、ifnγ(目录号12-7319-42,克隆4s.b3)、il2(目录号17-7029-82ebioscience,克隆:mq1-17h2)。
[0325]
ny-eso-1转导t细胞的产生。将ny-eso-1t细胞受体使用e2a自切割肽克隆到与rqr8基因融合的逆转录病毒载体中。使用hek 393t细胞产生病毒,并将上清液用于转导t细胞。将外周血单个核细胞使用板结合的αcd3(目录号be0001-2,bioxcell,克隆:okt3)和αcd28(目录号be0248,bioxcell,克隆:9.3)活化三天。第三天,将细胞用含有病毒颗粒的上清液孵育,并再培养3至4天。然后将转导的细胞使用miltenyi cd34 分离试剂盒(目录号130-046-702)纯化并在il2上培养以使其扩增。这种方法先前在stadtmauer et al.(2020)中公开。产生的t细胞表达识别已知抗原的t细胞受体,该抗原由可获得的肿瘤细胞系表达。因此,该方法能够将t细胞重新定向到癌症特异性抗原,以测试靶向特定基因对癌症中t细胞功能的影响。
[0326]
抑制剂的体外评价。可以将cd4和cd8 t细胞在体外用低剂量的板结合的抗cd3抗体刺激,并在存在或不存在提高浓度的每种抑制剂的情况下通过高维流式细胞术评价增殖、活化表型以及颗粒酶随时间的上调。可以用分别从脾和外周血中分离的小鼠和人t细胞一式三份地进行实验。
[0327]
抑制剂的体内评价。可以将小鼠在胁腹和皮内用mca205肉瘤进行攻击,因为它们的肿瘤免疫微环境在sq实验室中得到了很好的表征。在肿瘤植入之后6、9和10天,可以将小鼠用以下处理:载剂、每种抑制剂、和抗ctla4,其作为cd4 til对颗粒酶b的上调的阳性对照。在肿瘤攻击之后十五天处死小鼠,并收获淋巴结和肿瘤用于细胞毒性活性的获得和免疫细胞分化的高维分析。实验可以一式三份地进行,其中每组n=5只小鼠。
[0328]
与基因编辑的pbmc来源的人t细胞共培养的表达okt3的肿瘤细胞。图31a举例说明了用于这些测定的方案。使用了以下对照条件:(i)未经刺激的细胞:在没有刺激的情况下保存在培养基中的t细胞(阴性对照);(ii)与不表达抗cd3的肿瘤细胞(ctrl)共培养的细胞((h2228),阴性对照);(iii)在体外刺激4小时之后活化t细胞并促进细胞因子产生的pma/离子霉素孵育(阳性对照);(iv)包被有抗cd3/cd28抗体的dynabead(阳性对照)。将来源于用无规非靶向crrna电穿孔的pbmc的t细胞用作ko作用的对照(ctrl)。只有sit1、sirpg和cd7用该测定进行了测试。
[0329]
nsclc til上的小型阵列crispr筛选。用于这些测定的方案如图31b所示。使用每个基因2种不同的crrna(命名为aa、ab、ac或ad)敲除nsclc til,然后进行cas9:crrna复合物的电穿孔(参见下文基因编辑的详细方案)。将单指导rna称为crrna和tracrrna的双联体(crrna:tracrrna)。在4天之后,将编辑的til与表达抗cd3的肺肿瘤细胞共培养(参见下文共培养的详细方案)。使用高维流式细胞术在24小时之后测量第一读出(读出1,pd1和lamp1的上调)。使用高维流式细胞术在72小时之后测量第二读出(读出2,细胞因子产生)。参见以下流式细胞术的详细方案。每种情况都是两次重复的结果。在每个cd4 和cd8 t细胞群中测量以下标志:pd-1-细胞比例、pd-1
高
细胞比例、pd-1
总
细胞比例(pd-1
高
细胞 pd-1
int
细胞)、tim3 细胞比例、lag3 细胞比例、lamp1 细胞比例、ifng 细胞比例、il-2细胞比例、gzmb 细胞比例。pd1和tim3是t细胞活化的负调节物。在nsclc肿瘤中,pd-1
高
cd8til表现出功能障碍
状态,并且它们的存在与t细胞多克隆刺激之后对pd-1阻断的响应受阻有关。thommen,daniela s et al,nat.med.2018。预计,由于pd-1是两个t细胞区室中的活化标志物,因此pd-1
高
cd4 til也会像cd8 til中一样显示功能障碍状态。lamp1是脱颗粒的标志物,脱颗粒是数个免疫细胞使用其以从分泌囊泡中释放细胞毒性分子(例如穿孔素和颗粒酶,通过细胞毒性t细胞)的过程。使用了以下对照条件:(i)未经刺激的细胞:在没有刺激的情况下保存在培养基中的t细胞(阴性对照);(ii)与不表达抗cd3的肿瘤细胞(ctrl)共培养的细胞((h2228),阴性对照);(iii)在体外刺激4小时之后活化t细胞并促进细胞因子产生的pma/离子霉素孵育(阳性对照);(iv)包被有抗cd3/cd28抗体的dynabead(阳性对照)。将用无规非靶向crrna电穿孔的t细胞用作ko作用的对照(ctrl)。
[0330]
用于限定cd4和cd8 t细胞中不同pd1群的设门策略如图32所示。图32a示出了cd8 t细胞的示例性ko(furin)的结果。该图示出,在未经刺激和h2228条件下(阴性对照),pd1
总
群较低(分别为4.14%和3.49%)。相比之下,在阳性对照条件(acd3/acd28珠)和使用表达acd3的肿瘤细胞(h228-okt3)的测试条件下,pd1
总
群较高(分别为35.6%和22.5%),表明如所预期的,样品中的t cd8 t细胞的成功活化。图32b示出了cd4 t细胞的类似结果,其中未经刺激条件与7.59% pd1
总
细胞相关,h2228阴性对照条件与7.62% pd1
总
细胞相关,acd3/acd28条件与71.4% pd1
总
细胞相关,并且h2228-oxt3条件与53.4% pd1
总
细胞相关。因此,图32上的数据证实了所使用的方法和所应用的设门策略二者都适用于检测pd-1信号传导的激活,其指示了t细胞活化。
[0331]
流式细胞术(实施例3.5至3.7):将细胞用pbs洗涤并用流式细胞术单克隆表面抗体的混合物在4℃下避光孵育(按照20分钟进行)。将非活细胞使用ebioscience fixable viability dye efluor 780(thermo,目录号65-0865-14)染色。为了检测胞内表位,将细胞使用固定/透化溶液试剂盒(目录号555028,bd biosciences)按照制造商方案进行固定和透化。在转录因子染色的情况下,按照制造商方案使用ebioscience foxp3/转录因子染色缓冲液套组(ebioscience,目录:00-5523-00)。一旦染色,将细胞重悬于pbs中并使用bd facs symphony机器获取。流式细胞术抗体购自biolegend、bd和thermo fisher scientific(ebioscience):ki67(目录号564071bd biosciences,克隆:b56)、cd69(目录号564364bd biosciences,克隆:fn50)、cd8(目录号564804bd biosciences,克隆:rpa-t8)、cd45ra(目录号565702bd biosciences,克隆:hi100)、cd38(目录号565069bd biosciences,克隆:hit2)、cd39(目录号564726bd biosciences,克隆:tu66)、sirpγ(目录号747683bd biosciences,克隆:ox-119)、cd3(目录号565511bd biosciences,克隆:sk7)、ki-67(目录号350505biolegend,克隆:ki-67)、cd25(目录号356119biolegend,克隆:m-a251)、ccr7(目录号353224biolegend,clone g043h7)、il-2(目录号564166,bd biosciences,克隆:mq1-17h12)、lamp-1(目录号328640biolegend,克隆:h4a3)、cd4(目录号317442biolegend,克隆:okt4)、cd4(目录号563877bd biosciences,克隆:sk3)、tim3(目录号565566bd biosciences,克隆:7d3)、gmcsf(目录号502312,biolegend,克隆:bvd2-21c11)、lag3(目录号61-2239-42,ebioscience,克隆:3ds223h)、pd-1(目录号329618,biolegend,克隆:eh12.2h7)、cd28(目录号11-0289-42ebiosicence,克隆:cd28.2)、lag3(目录号369312biolegend,克隆:11c3c65)、tcf1(目录号655208bd biosciences,克隆:7f11a10)、41bb(目录号309826biolegend,克隆:4b4-1)、fcrl3(目录号374409biolegend,
克隆:h5/fcrl3)、弗林蛋白酶(目录号ic1503r-100ug,r&d systems-biotechne)、sit1(目录号367804biolegend,克隆:sit-01)、gzmb(目录号367804biolegend,克隆:qa16a02)、tnfα(目录号17-7349082invitrogen,mab11)、ifnγ(目录号12-7319-42,clone 4s.b3)、il2(目录号17-7029-82ebioscience,克隆:mq1-17h2)。在bd symphony流式细胞仪上获取数据并在flowjo v10.5.3(treestar)中进行分析。
[0332]
来自肺癌患者的样品中的靶标验证。在rpmi-1640(目录号r0883-500ml,sigma)中收集和运输组织样品。通过使用释放酶tl(目录号05401127001,roche)和dna酶i(目录号11284932001,roche)进行酶消化,随后使用miltenyi gentlemacs octodissociator进行细胞解聚,来产生单细胞悬液。将淋巴细胞通过在ficoll paque plus(目录号17-1440-03,ge healthcare)上梯度离心从单细胞悬液中分离出,冷冻保存在含有10% dmso(目录号d2650-100ml,sigma)的胎牛血清(目录号10270-106,gibco)中,并储存在液氮中。将从iv期肺癌患者获得的肿瘤浸润淋巴细胞如前所述使用针对每一个提出的靶标的单克隆抗体进行染色。在不同的cd4和cd8 t细胞群中评估了提出靶标的表达。通过ki67、cd25、cd69、pd-1、tim3和其他t细胞分化标志物的表达来确定细胞的活化和增殖模式。它们的功能由lamp-1、gm-csf、gzmb和细胞因子ifnγ和il-2的表达决定。
[0333]
快速扩增方案。通过dudley et al.20031.所建立的饲养细胞存在的情况下,使用okt3刺激和高剂量的白介素2(il-2)扩增肿瘤浸润淋巴细胞(til)以达到大量细胞。为了制备饲养细胞,使用ficoll-paque plus(目录号17-1440-03,ge healthcare)通过梯度离心从健康供体的血液中分离外周血单个核细胞。将通过不同供体获得的pbmc合并在一起,并用50gy辐照。将经辐照的储液重悬于含10%二甲基亚砜(dmso)的胎牛血清中,并在-80℃冰箱中冷冻保存。将1
×
106til和经辐照的饲养细胞解冻,以1:200的比率混合并重悬于175cm2组织培养瓶(目录号83.3912.002,starstedt)中,所述组织培养瓶包含:30ng/ml okt3抗体(目录号be0001-2,bioxcell)、和75ml无血清aim-v培养基(目录号12055091,gibco)、75ml完全生长培养基(rpmi 1640(目录号51536c,sigma-aldrich)(其补充有5ml青霉素-链霉素(目录号p4333,sigma-aldrich)和50ml人血清(10%终浓度)(目录号g7513-100 ml,sigma-aldrich))。将烧瓶在37℃下在5% co2中直立孵育。第二天,将6000iu/ml的il-2(proleukin,novartis)添加至培养物。从第5天起,通过移除120ml培养基并用1:1gm/aim-v的新鲜混合物和6000iu/mlil-2替代它更换培养基。每两天测定一次细胞浓度,并根据需要将培养物分开以将细胞密度维持在大约1
×
106/ml。
[0334]
使用crispr/cas9技术对人t细胞进行基因编辑。将冷冻的外周血单个核细胞(pbmc)解冻并在含有2ml生长培养基(rpmi 1640(目录号51536c,sigma-aldrich)的12孔板(目录号353043,falcon)中孵育过夜,所述生长培养基补充有5ml青霉素-链霉素(目录号p4333,sigma-aldrich)和50ml人血清(10%终浓度)(目录:g7513-100 ml,sigma-aldrich)(补充有50iu/ml的il2(proleukin,novartis))。第二天,将细胞转移到包被有10μg/ml αcd3抗体(cat no.be0001-2,bioxcell,克隆:okt3)的12孔板中,并在含有100iu/ml il2和10μg/ml αcd28抗体(目录号be0248,bioxcell,克隆:9.3)的2ml生长培养基中培养72小时。在肿瘤浸润淋巴细胞(til)的情况下,在rep的第10天,取出细胞悬浮液的等分样品并保存在冰上。对于pbmc和til二者,sgrna是通过在0.6ml管中混合alt-r tracrrna 200μm(目录号1072534idt)和alt-r crrna 200μm(定制,idt)制备的,并在95℃下孵育5分钟。将sgrna
trace violet染色,并用含有αcd3和αcd28的低剂量dynabead再刺激4天。在第14天,将细胞用布雷非菌素a孵育4小时以积累细胞因子。将细胞染色用于流式细胞术并在facs symphony中获得。图28a示出了培养14天之后sit1敲除在总cd3
t细胞上的表达。图28b示出了使cell trace violet(ctv)褪色的ifnγ
cd4和cd8细胞,将未经刺激的细胞用作对照。图29c示出了对照未编辑的相对于sit-1敲除的ifnγ
t细胞的定量。ifnγ的产生是普遍接受的t细胞细胞毒性读出,并表明它们具有杀伤肿瘤细胞的能力(参见kaplan et al.,1998;gao et al.,2016;zaretsky et al.,2016)。图28的数据显示,在体外再刺激之后,与对照相比,降低t细胞中sit1的表达提高了它们的细胞毒性。这表明t细胞中sit1表达的下调使这样的t细胞能够更好地杀伤癌细胞和/或者限制或减少肿瘤生长(在患有增殖性病症的对象中)。
[0342]
实施例3.4-在用cd3/cd28珠再刺激之后sit1 ko nsclc til获得更高的增殖能力。将从nsclc患者获得的肿瘤浸润淋巴细胞ko并使用快速扩增方案(rep)扩增21天。在第21天,将细胞用ctv染色并用低剂量的αcd3/cd28珠再刺激。在四天之后,使用流式细胞术测量ctv稀释度。图30上的结果显示sit1敲除肿瘤浸润t细胞获得了增强的增殖能力。这表明sit调节在增强免疫应答方面的潜在作用,因为更大量的til(即更高的til增殖能力)应该与更强的潜在应答相关。
[0343]
实施例3.5-h2228-okt3与pbmc来源的基因编辑的人t细胞的共培养鉴定了t细胞活化的调节剂。如图31a所示,将人pbmc通过敲除目的靶标(特别是cd7、sirpg和sit1)进行修饰,然后与表达抗cd3的肿瘤细胞(100%的细胞,标记为“αcd3”或“h228-oxt3”,或10%的细胞,标记为“αcd31:10”或“1/10h228-oxt3”)或不表达抗cd3的相同肿瘤细胞(标记为“ctrl”或“h2228”)共培养。与使用全部表达抗cd3的肿瘤细胞群相比,使用10%的表达抗cd3的肿瘤细胞被认为代表了更具有生理性的条件。在共培养72小时之后测量以下的cd4和cd8细胞的比例:pd1 lamp1-、pd1 lamp1 和pd1 tim3 。将细胞同样在阴性对照条件(未经刺激)和两种阳性对照条件(用抗cd3抗cd28包被的dynabead刺激,和用pma和离子霉素刺激,其刺激细胞因子产生但预计不会上调pd1或lamp1)下培养。在每种条件下,使用对照细胞群,其中细胞用对照非靶向crrna进行电穿孔。
[0344]
这些结果显示在图33中,其中图33a和b示出了对照条件(抗cd3、抗cd28)的结果,并且图33c至f示出了与肿瘤细胞一起孵育的细胞的结果。图33a示出当用抗cd3/抗cd28包被的珠刺激时,cd7和sirpg ko对pd1 lamp1 cd8细胞有影响。特别是,与对照crrna相比,cd7ko与pd1 lamp cd8 t细胞的增加相关。与无规crrna相比,sirpgko与pd1 lamp cd8细胞的减少相关。图33b示出了cd4细胞中的类似图片。图33c示出了,当cd7被敲除时,表达αcd3的肿瘤细胞与pbmc的共培养导致cd8 t细胞上的pd1和lamp1二者的上调。图33c还示出了至少在αcd3条件下,sirpgko对pd1 lamp1 cd8 t细胞有影响。图33d示出了,当cd7被敲除时,表达αcd3的肿瘤细胞与pbmc的共培养导致cd4 t细胞上的pd1和lamp1二者的上调。图33d也示出了sirpg ko对pd1 lamp1 cd4细胞也有影响。图33e示出了,当cd7被敲除时,表达αcd3的肿瘤细胞与pbmc的共培养导致cd4 t细胞上pd1和tim3的上调。图33f示出了在cd8 t细胞中存在类似的图像。
[0345]
因此,该数据表明,在与表达抗cd3的肿瘤细胞共培养之后,cd7敲除导致pbmc中细胞因子产生增加和pd1、tim3上调。pd1和tim3是t细胞活化的负调节物,当t细胞被活化时上
调,以避免因凋亡而引起的死亡(活化诱导的细胞死亡)。这表明cd7也可充当活化中断物(activation break),当cd7缺失时,t细胞需要压制(press)它们的替代中断物(pd1和tim3)以避免由于过度活化而进入凋亡。因此,该数据表明cd7的调节,特别是负调节,可能会增强治疗情况下的免疫应答。数据还表明,sirpg可在t细胞共刺激中发挥作用,因为当该基因被敲除时,t细胞显示活化程度较低。因此,测定表明sirpg的激活/上调可以是用于增强免疫应答的有前景的治疗策略。在该测定中,未观察到对sit1的影响。然而,如实施例3.3和3.4中所解释的,在其他测定中观察到影响。此处使用的测定与实施例3.3和3.4中使用的测定在多个方面有所不同。特别地,本测定使用具有在肿瘤细胞上表达的抗cd3的单一刺激,肿瘤细胞是可产生多种其他信号的复杂系统。相比之下,实施例3.3和3.4中使用的测定使用了借助于珠上的抗cd3和抗cd28的双重刺激,这复制了在t细胞受体-mhc-肽相互作用时发生的信号(以cd3信号传导为结尾)和涉及cd28信号传导的共刺激二者,但由于珠本身是惰性的,因此不提供另外的信号。因此,显示在本系统中,肿瘤细胞本身可产生抑制t细胞活化的另外的信号,例如pd-l1信号传导,从而掩盖了sit1 ko的影响。此外,此处的dynabead对照也不能直接与示例3.3中的刺激相比较。实际上,此处的细胞静置时间(4天)比实施例3.3中的测定的(10天)更短,并且珠的浓度更高。
[0346]
实施例3.6-h2228-okt3与nsclc til共培养的鉴定了pd1信号传导的调节物。通过敲除目的靶标来修饰人nsclc til,然后将经修饰的til与表达抗cd3的肺肿瘤细胞共培养。使用流式细胞术在共培养72小时之后测量pd1 细胞的比例。其结果如图34所示。pd1 细胞的总量在cd4(图34a)或cd8 t细胞(图34c)中没有显示出重大差异。pd-1
高
群显示出cd4细胞的至少furin、stom、il1rap、axl、cd82和e2f1a的提高(图34b)。pd-1
高
群显示出cd8 t细胞的至少furin、il1rap和stom的提高(图34d)。因此,数据表明在til中敲除的所有这些基因之后,活化水平更高。因此,该数据表明这些基因的调节,特别是负调节,可增强治疗情况下的免疫应答。
[0347]
请注意,当仅说明单一构建体(如cd7、il1rap和sit1的情况)时,这是因为所述构建体在功能上得到了验证。在所有其他情况下,使用了两种构建体,因为这些构建体仅在计算机上进行了验证。因此,在该测定中缺乏影响(无论是在一种或两种构建体中)可能只是反映了该构建体的敲除性能不佳。此外,注意到这些测定未显示与cd7敲除相关的影响,而在实施例3.5中在pbmc来源的细胞中观察到影响。pbmc细胞和til是可受到不同的调节的不同的细胞群(scott et al.,2019;brummelman et al.,2019)。特别地,til是分化/耗竭的细胞。因此,数据表明,相比在其他细胞中的cd7调节(例如在经改造t细胞例如cart和tcr转导的t细胞的情况下(参见例如d’angelo et al.,2018)),或不仅仅依赖于til的任何调节(例如如通过使用小/大分子抑制剂),在til中的cd7调节可能是不太有前景的策略。换言之,仅仅因为基因调节不能活化作为耗竭细胞的til,并不意味着它不能活化尚未达到这种状态的细胞。然而,在til环境中具有明显效果的策略可在任何情况(不限于til)中都有用。这是因为即使是其他类型的细胞,一开始可能没有分化/耗竭,也会变得耗竭。因此,在til中有效的基因调节可最终阻止所有类型的过继性t细胞治疗的终末分化或耗竭。
[0348]
实施例3.7
–
与h2228-okt3肿瘤细胞共培养72小时之后,t细胞分化和cd4和cd8 nsclc til ko功能的变化。通过敲除目的靶标来修饰人nsclc til,然后将经修饰的til与表达抗cd3的肺肿瘤细胞共培养。在共培养72小时之后,使用流式细胞术测量了一系列t细
胞分化和功能性的标志物。特别地,pd1、tim3和lag3是t细胞活化之后上调的抑制性受体。随着t细胞被活化,它们上调这些分子以避免活化诱导的细胞死亡(activation induced cell death,aicd)。因此,如果这些基因在靶标被ko之后更高地表达,这表明靶标与t细胞活化有关。lamp1是脱颗粒标志物。它的上调表明t细胞产生和释放细胞因子。ifng是t细胞用来杀伤肿瘤细胞的效应细胞因子。il-2是t细胞在活化之后产生的细胞因子。il-2促进t细胞生长和存活。图35至44示出了基因furin(图35)、axl(图36)、il1rap(图37)、stom(图38)、e2f1a(图39)、samsn1(图40)、sirpg(图41)、cd7(图42)、cd82(图43)和fcrl3(图44)的该结果。对于每种条件,数据显示某种标志物呈阳性的细胞百分比(标记为“亲本的频率”)。还测量了平均荧光强度(mean fluorescence intensity,mfi)(数据未显示)。亲本的频率被认为是该测定中最可靠的量度。mfi是间接的表达量度,并被认为受机器行为的影响,因此它可能不太可靠。
[0349]
请注意,sit1的数据(未显示)与实施例3.5中的数据一致。在存在对肿瘤细胞的抗cd3刺激的情况下,在til上没有观察到ko的影响,这与在实施例3.3.和3.4中导致来源于pbmc的sitko中的活化提高的珠上的组合抗cd3抗cd28共刺激相反。因此,数据证实了sit1的调节,特别是负调节,可能增强不直接依赖于til的治疗情况下的免疫应答,例如在依赖于使用pbmc的tcr t细胞治疗或cart细胞治疗的情况下。
[0350]
图35a示出了当til与h2228-okt3表达细胞共培养时,nsclc til上furin的丧失增加了pd1 、lag3 、lamp1 、ifng 和il-2 cd4 t细胞群。在ko cd8 t细胞群上观察到类似的趋势(参见图35b)。该表型表明t细胞活化水平较高,表明在nsclc til的情况下furin在cd4和cd8 t细胞二者活化中发挥作用。因此,该数据表明furin的调节,特别是负调节,可能增强治疗情况下的免疫应答。
[0351]
图36a示出了当til与h2228-okt3表达细胞共培养时,nsclc til上axl的丧失增加了pd1 、lag3 、lamp1 、ifng 和il-2 cd4 t细胞群。这种表型表明t细胞的活化水平较高,这表明axl在nsclc til的情况下在cd4 t细胞活化中发挥作用。虽然观察到lag3、lamp1和il-2的变化,但cd8区室中axl的丧失并未导致测量参数的相同变化(图36b)。因此,该数据表明axl的调节,特别是至少在cd4 t细胞中的负调节,可能增强治疗情况下的免疫应答。
[0352]
图37a示出了当til与h2228-okt3表达细胞共培养时,nsclc til上il1rap的丧失增加了pd1 、lag3 、lamp1 、ifng 和il-2 cd4 t细胞群。在ko cd8 t细胞群中观察到类似的趋势(图37b)。这种表型表明t细胞的活化水平较高,这表明在nsclc til的情况下il1rap在cd4和cd8 t细胞二者的活化中具有重要作用。因此,该数据表明axl的调节,特别是负调节,可能增强治疗情况下的免疫应答。
[0353]
图38a示出了当til与h2228-okt3表达细胞共培养时,nsclc til上stomatin的丧失增加了pd1 、lag3 、lamp1 、ifng 和il-2 cd4 t细胞群。这种表型表明t细胞活化水平较高,这表明在nsclc cd4 til的情况下stomatin在t细胞活化中发挥作用。cd8区室中stomatin的丧失并没有导致如此清晰的图像,主要是由于数据中的噪声,虽然可存在pd1、lag3、lamp1和可能的ifng的增加(图38b)。因此,该数据表明stomatin的调节,特别是至少在cd4 t细胞中的负调节,可能增强治疗情况下的免疫应答。
[0354]
图39a示出了当til与h2228-okt3表达细胞共培养时,nsclc til上e2f1a的丧失增加了pd1 、lag3 、lamp1 、ifng 和il-2 cd4 t细胞群。该表型表明t细胞活化水平较高,这
表明在nsclc til的情况下e2f1a在cd4 t细胞活化中具有重要作用。与对照ko cd8 nsclc til相比,cd8区室中e2f1a的丧失不会以相同程度改变在该测定中测量的t细胞活化标志物(图39b)。然而,tim3、lamp1和il-2的增加显示也发生在cd8区室中。因此,该数据表明e2f1a的调节,特别是至少在cd4 t细胞中的负调节,可能增强治疗情况下的免疫应答。
[0355]
图40a示出了当til与h2228-okt3表达细胞共培养时,nsclc til上samsn1的丧失增加了pd1 、lag3 、lamp1 和il-2 cd4 t细胞群。这种表型表明t细胞的活化水平较高,这表明在nsclc til的情况下samsn1在cd4 t细胞活化中具有重要作用。与对照ko cd8 nsclc til相比,cd8区室中samsn1的丧失不会以相同程度改变在该测定中测量的t细胞活化标志物(图40b)。然而,lag3和il-2的增加显示也发生在cd8区室中。因此,该数据表明samsn1的调节,特别是至少在cd4 t细胞中的负调节,可能增强治疗情况下的免疫应答。
[0356]
图41a示出了当til与h2228-okt3表达细胞共培养时,nsclc til上sirpg的丧失增加了pd1 、tim3、lag3 、lamp1 和il-2 cd4 t细胞群。这种表型表明t细胞的活化水平较高,这表明在nsclc til的情况下sirpg在cd4 t细胞活化中具有重要作用。与对照ko cd8nsclc til相比,cd8区室中sirpg的丧失不会以相同程度改变在该测定中测量的t细胞活化标志物(图41b)。然而,lag3和il-2的增加显示也出现在cd8 t细胞区室中。因此,该数据表明sirpg的调节,特别是至少在cd4 t细胞中的负调节,可能增强til治疗情况下的免疫应答。注意到实施例3.5中的数据表明pbmc来源的细胞中cd4和cd8 t细胞的pd1 lamp1 群减少。这可表明该基因在til和pbmc来源的细胞中的作用不同。存在不同的sirpg同种型,已显示其在不同t细胞子集之中的表达不同(li,zhang&ren,2020)。因此,在pbmc上表达的同种型可与在til上表达的同种型不同,这可导致不同的功能,这解释了sirpgko在该数据中的作用与实施例3.5中的作用差异。因此,虽然所有可用数据都表明sirpg的调节可能增强治疗情况下的免疫应答,但数据表明负调节可以特别在til的情况下有效,而在其他情况下正调节可以是有效的。
[0357]
图42a示出了当til与h2228-okt3表达细胞共培养时,nsclc til上cd7的丧失减少了pd1 、lag3 、lamp1 、ifng 和il-2 cd4 t细胞群。这种表型表明t细胞的活化水平较低,这表明在nsclc til的情况下cd7在cd4 t细胞活化中具有重要作用。在cd8 t细胞中观察到类似的趋势(图42b)。因此,该数据表明cd7的调节,特别是正调节,可能增强til治疗情况下的免疫应答。注意到实施例3.5中的数据表明pbmc来源的细胞中cd4和cd8 t细胞的pd1 lamp1 群增加。这可表明该基因在til和pbmc来源的细胞中的作用不同。因此,虽然所有可用数据都表明cd7的调节可能增强治疗情况下的免疫应答,但数据表明正调节在til的情况下可特别有效,而在其他情况下负调节可以是有效的。这与lee et al.(1998)的发现一致,即敲除cd7的3月龄小鼠具有更高数量的发育中的t细胞(胸腺细胞),表明在增殖或t细胞活化中的作用。
[0358]
图43a示出了当til与h2228-okt3表达细胞共培养时,nsclc til上cd82的丧失增加了pd1 、lag3 、lamp1 、ifng 和il-2 cd4 t细胞群。这种表型表明t细胞的活化水平较高,这表明在nsclc til的情况下cd82在cd4 t细胞活化中具有重要作用。与对照ko cd8 nsclc til相比,cd8区室中cd82的丧失不会以相同程度改变在该测定中测量的t细胞活化标志物(图43b)。然而,lamp1和il-2的增加显示也发生在cd8区室中。因此,该数据表明cd82的调节,特别是至少在cd4 t细胞中的负调节,可能增强治疗情况下的免疫应答。
[0359]
图44a示出了当til与h2228-okt3表达细胞共培养时,nsclc til上fcrl3的丧失增加了pd1 、lag3 、lamp1 、和il-2 cd4 t细胞群。这种表型表明t细胞的活化水平较高,这表明在nsclc til的情况下cd82在cd4 t细胞活化中具有重要作用。与对照ko cd8 nsclc til相比,cd8 t细胞中cd82的丧失不会以相同程度改变在该测定中测量的t细胞活化标志物(图44b)。然而,lag3和il-2的增加显示也发生在cd8 t细胞中。因此,该数据表明fcrl3的调节,特别是至少在cd4 t细胞中的负调节,可能增强治疗情况下的免疫应答。
[0360]
实施例3—结论。该实施例中的数据表明,在鉴定的一组靶标(sit1、samsn1、sirpg、cd7、cd82、fcrl3、il1rap、furin、stom、axl、e2f1、c5orf30、cldnd1、cotl1、dusp4、epha1、fabp5、gfi1、itm2a、park7、pecam1、phlda1、rab27a、rbpj、rgs1、rgs2、rnaseh2a、suv39h1、和tnip3)中所有测试的靶标(sit1、cd7、sirpg、furin、stom、il1rap、axl、cd82、e2f1a、samsn1和fcrl3)均显示出参与t细胞活化的一些证据。换言之,每一个测试的经鉴定的靶标都被验证为潜在的调节靶标以增强治疗情况下的免疫应答。因此,数据表明,所有已鉴定的靶标(包括已验证的靶标和由于时间限制尚未验证的靶标)可能是用于调节以增强治疗情况下的免疫应答的可用靶标。
[0361]
特别地,实施例3.3中的数据表明pbmc来源的t细胞中sit1的负调节导致在体外用acd3/acd28刺激之后ifng产生的增加。实施例3.4中的数据表明,til中sit1的负调节导致在用抗cd3/抗cd28再刺激之后增殖能力提高。实施例3.5和3.7中的数据表明,在肿瘤癌细胞系的情况下,在仅cd3刺激(除了cd3刺激还提供了特征在于在抑制t细胞功能的其他蛋白质中pdl1的表达的抑制性微环境)之后,pbmc和til中sit1的负调节可能不会导致增加的t细胞活化。该数据表明sit1的调节(特别是负调节)可能增强治疗情况下(至少在这样的抑制性微环境不存在或可以减轻的情况下)的免疫应答。例如,sit1的负调节可能增强治疗情况下的免疫应答,其不直接依赖于til,例如在依赖pbmc(例如tcr转导的t细胞,参见例如d’angelo et al.,2018)使用的tcr t细胞治疗或cart细胞治疗的背景下。
[0362]
实施例3.5中的数据表明,pbmc中cd7的负调节导致t细胞活化增加。实施例3.7中的数据表明til中cd7的负调节导致t细胞活化降低。因此,该数据表明,cd7的调节可能增强治疗情况下的免疫应答,特别是当使用负调节时(除了在可能优选正调节的til的情况下)。可以通过细胞改造或通过用激动剂刺激来获得正调节。
[0363]
实施例3.6和3.7中的数据表明,til中stom、furin和il1rap的负调节导致cd4和cd8 t细胞二者中的t细胞活化增加。该数据表明,stom、furin和il1rap的调节(特别是负调节)可能增强治疗情况下的免疫应答。实施例3.6和3.7中的数据表明,til中axl、e2f1a、cd82、samsn1、和fcrl3的负调节导致至少在cd4 t细胞中t细胞活化增加和可能的在cd8 t细胞中的t细胞活化增加。
[0364]
实施例3.5中的数据表明pbmc中sirpg的负调节导致cd4和cd8t细胞二者中的t细胞活化降低。实施例3.7中的数据表明,til中sirpg的负调节导致至少cd4 t细胞中t细胞活化增加以及可能的在cd8 t细胞中的t细胞活化增加。因此,该数据表明sirpg的调节可能增强治疗情况下的免疫应答,特别是当使用正调节时(除了在可能优选负调节的til的情况下)。可以通过细胞改造或通过用激动剂刺激来获得正调节。
[0365]
本文所述的任何靶基因的正调节都可以通过修饰靶细胞以提高靶标的表达(例如,使用经改造免疫细胞)来实现。替代地或除此之外,本文所述的任何靶基因的正调节都
可以使用激动剂抗体来实现。激动剂抗体已被证明有望用于癌症免疫治疗(参见例如sakellariou-thompson et al.,2017)。替代地或除此之外,本文所述的以及作为受体的任何靶基因的正调节都可以使用受体的激动剂来实现。例如,已显示sirpβ2在t细胞和活化的nk细胞上表达,并且其结合抗原呈递细胞上的cd47,导致t细胞增殖增强(piccio et al,2005)。因此,例如,sirpg的激动剂可以类似地用于正调节sirpg,从而增强免疫应答。
[0366]
本文所述的任何靶基因的负调节都可以通过修饰靶细胞以降低靶标的表达(例如敲低或敲除靶标)(例如使用经改造免疫细胞)来实现。替代地或除此之外,本文所述的任何靶基因的负调节都可以使用阻断抗体或小分子抑制剂来实现。例如,用小分子抑制剂抑制激酶(例如axl)已被证明是可能的。此外,抑制其他激酶(例如p38和map激酶)已被证明促进了t细胞免疫的提高(ebert et al.,2016;gurusamy et al.,2020)。
[0367]-ooo-[0368]
本文中引用的所有参考文献整体地并且出于全部目的通过引用并入本文,其程度就如同每个单独的出版物、专利或专利申请被具体地和单独地指示为整体通过引用并入。
[0369]
本文中描述的具体实施方案是作为示例而非限制提供的。本文中包括的任何小标题仅是为了方便起见,而不应被解释为以任何方式限制本公开内容。
[0370]
参考文献
[0371]
thommen,d.s.&schumacher,t.n.t cell dysfunction in cancer.cancer cell 33,547-562(2018).
[0372]
borst,j.,ahrends,t.,babala,n.,melief,c.j.m.&kastenm
ü
ller,w.cd4 t cell help in cancer immunology and immunotherapy.nat.rev.immunol.18,635-647(2018).
[0373]
schietinger,a.,philip,m.,liu,r.b.,schreiber,k.&schreiber,h.bystander killing of cancer requires the cooperation of cd4( )and cd8( )t cells during the effector phase.j.exp.med.207,2469-77(2010).
[0374]
philip,m.et al.chromatin states define tumour-specific t cell dysfunction and reprogramming.nature 545,452-456(2017).
[0375]
schietinger,a.&greenberg,p.d.tolerance and exhaustion:defining mechanisms of t cell dysfunction.trendsimmunol.35,51-60(2014).
[0376]
hombrink,p.et al.programs for the persistence,vigilance and control of human cd8 lung-resident memory t cells.nat.immunol.(2016).doi:10.1038/ni.3589
[0377]
mackay,l.k.et al.the developmental pathway for cdl03 cd8 tissue-resident memory t cells of skin.nat.immunol.14,1294-1301(2013).
[0378]
appay,v.,van lier,r.a.w.,sallusto,f.&roederer,m.phenotype and function of human t lymphocyte subsets:consensus and issues.cytometrypart a(2008).doi:10.1002/cyto.a.20643
[0379]
hock,h.,dorsch,m.,diamantstein,t.&blankenstein,t.interleukin 7induces cd4 t cell-dependent tumour rej ection.j.exp.med.174,1291-8(1991).
[0380]
linnemann,c.et al.high-throughput epitope discovery reveals freguent recognition of neo-antigens by cd4 t cells in human melanoma.nat.med.21,81-5
(2015).
[0381]
sahin,u.et al.personalized rna mutanome vaccines mobilize poly-specific therapeutic immunity against cancer.nature 547,222-226(2017).
[0382]
tran,e.et al.cancerimmunotherapy based on mutation-specific cd4 t cells in a patient with epithelial cancer.science(80-.).9,641-645(2014).
[0383]
zinkernagel,r.m.et al.antigen localisation regulates immune responses in a dose-and time-dependent fashion:ageographical view of immune reactivity.immunol.rev.156,199-209(1997).
[0384]
neefjes,j.&ovaa,h.a peptide
′
s perspective on antigenpresentation to the immune system.nat.chem.biol.9,769-775(2013).
[0385]
zhu,j.,yamane,h.&paul,w.e.differentiation of effector cd4 t cell populations.annu.rev.immunol.28,445-489(2010).
[0386]
van allen,e.m.et al.genomic correlates of response to ctla-4 blockade in metastatic melanoma.science(80-.).350,207-211(2015).
[0387]
rizvi,n.a.et al.mutational landscape determines sensitivity to pd-1blockade in non-small cell lung cancer.science(80-.).348,124-8(2015).
[0388]
van,a.et al.genetic basis for clinical response to ctla-4 blockade in melanoma.n.engl.j.med.371,2189-2199(2014).
[0389]
goodman,a.m.et al.tumour mutational burden as an independent predictor of response to immunotherapy in diverse cancers.mol.cancer ther.16,2598-2608(2017).
[0390]
mcgranahan,n.et al.clonal neoantigens elicit t cell immunoreactivity and sensitivity to immune checkpoint blockade.science(80-.).351,1463-1469(2016).
[0391]
ganesan,a.p.et al.tissue-resident memory features are linked to the magnitude of cytotoxic t cell responses in human lung cancer.nat.immunol.(2017).
[0392]
rosenthal,r.et al.neoantigen-directed immune escape in lung cancer evolution.nature 567,479-485(2019).
[0393]
ciurea,a.,hunziker,l.,klenerman,p.,hengartner,h.&zinkernagel,r.m.impairment of cd4( )t cell responses during chronic virus infection prevents neutralizing antibody responses against virus escape mutants.j.exp.med.193,297-305(2001).
[0394]
harari,a.,petitpierre,s.,vallelian,f.&pantaleo,g.skewed representation of functionally distinct populations of virus-specific cd4 t cells in hiv-1-infected subjects with progressive disease:changes after antiretroviral therapy.blood 103,966-972(2004).
[0395]
day,c.l.et al.pd-1expression on hiv-specific t cells is associated with t-cell exhaustion and disease progression.nature 443,350-4(2006).
[0396]
kaufmann,d.e.et al.upregulation of ctla-4by hiv-specific cd4 t cells correlates with disease progression and defines a reversible immune dysfunction.nat.immunol.8,1246-1254(2007).
[0397]
frenz,t.et al.cd4 t cells in patients with chronic inflammatory rheumatic disorders show distinct levels of exhaustion.j.allergy clin.immunol.138,586-589.e10(2016).
[0398]
han,s.,asoyan,a.,rabenstein,h.,nakano,n.&obst,r.role of antigen persistence and dose for cd4 t-cell exhaustion and recovery.proc.natl.acad.sci.107,20453-20458(2010).
[0399]
jelley-gibbs,d.m.et al.repeated stimulation of cd4 effector t cells can limit their protective function.j.exp.med.201,1101-12(2005).
[0400]
palmer,b.e.,boritz,e.&wilson,c.c.effects of sustained hiv-1 plasma viremia on hiv-1gag-specific cd4 t cell maturation and function.j.immunol.172,3337-47(2004).
[0401]
crawford,a.et al.molecular and transcriptional basis of cd4 tcell dysfunction during chronic infection.immunity 40,289-302(2014).
[0402]
fletcher,j.m.et al.cytomegalovirus-specific cd4 t cells in healthy carriers are continuously driven to replicative exhaustion.j.immunol.175,8218-25(2005).
[0403]
palmer,b.e.,blyveis,n.,fontenot,a.p.&wilson,c.c.functional and phenotypic characterization of cd57 cd4 t cells and their association with hiv-1-induced t cell dysfunction.j.immunol.175,8415-23(2005).
[0404]
patil,v.s.et al.precursors of human cd4 cytotoxic t lymphocytes identified by single-cell transcriptome analysis.sci.immunol.3,eaan8664(2018).
[0405]
di mitri,d.et al.reversible senescence in human cd4 cd45ra cd27-memory t cells.j.immunol.187,2093-100(2011).
[0406]
okoye,a.et al.progressive cd4 central-memory t cell decline results in cd4 effector-memory insufficiency and overt disease in chronic siv infection.j.exp.med.204,2171-2185(2007).
[0407]
wu,t.et al.the tcf1-bcl6 axis counteracts type i interferon to repress exhaustion and maintain t cell stemness.sci.immmunol.1,(2016).
[0408]
paroni,m.et al.recognition of viral and self-antigens by th1 and th1/th17 central memory cells in patients with multiple sclerosis reveals distinct roles in immune surveillance and relapses.j.allergy clin.immmunol.140,797-808(2017).
[0409]
orban,t.et al.reduction in cd4 central memory t-cell subset in costimulation modulator abatacept-treated patients with recent-onset type 1diabetes is associated with slower c-peptide decline.diabetes 63,3449-57
drive high-quality survival outcome analytics.cell 173,400-416.e11(2018).
[0459]
ellrott,k.et al.scalable open science approach for mutation calling of tumour exomes using multiple genomic pipelines.cell syst.6,271-281.e7(2018).
[0460]
nowicka,m.et al.cytof workflow:differential discovery in high-throughput high-dimensional cytometry datasets.fl000research 6,748(2017).
[0461]
hahne,f.et a1.flowcore:a bioconductor package for high throughput flow cytometry.bmc bioinformatics 10,106(2009).
[0462]
levine,j.h.et al.data-driven phenotypic dissection of aml reveals progenitor-like cells that correlate with prognosis.cell 162,184-97(2015).
[0463]
van gassen,s.et al.flowsom:using self-organizing maps for visualization and interpretation of cytometry data.cytom.part a 87,636-645(2015).
[0464]
wilkerson,m.d.&hayes,d.n.consensusclusterplus:a class discovery tool with confidence assessments and item tracking.bioinformatics 26,1572-1573(2010).
[0465]
robinson,m.d.,mccarthy,d.j.&smyth,g.k.edger:a bioconductor package for differential expression analysis of digital gene expression data.bioinformatics 26,139-140(201 0).
[0466]
lun,a.t.l.,richard,a.c.&marioni,j.c.testing for differential abundance in mass cytometry data.nat.methods 14,707-709(2017).
[0467]
li,w.v.&li,j.j.an accurate and robust imputation method scimpute for single-cell rna-seq data.nat.commun.9,997(2018).
[0468]
oetjen,k.a.et al.human bone marrow assessment by single-cell rna sequencing,mass cytometry,and flow cytometry.jci insight 3,(2018).
[0469]
soneson,c.&robinson,m.d.bias,robustness and scalability in single-cell differential expression analysis.nat.methods 15,255-261(2018).
[0470]
gu,z.,eils,r.&schlesner,m.complex heatmaps reveal patterns and correlations in multidimensional genomic data.bioinformatics 32,2847-2849(2016).
[0471]
sergushichev,a.a.an algorithm for fast preranked gene set enrichment analysis usingcumulative statistic calculation.biorxiv 060012(2016).doi:10.1101/060012
[0472]
subramanian,a.et al.gene set enrichment analysis:a knowledge-based approach for interpreting genome-wide expression profiles.proc.natl.acad.sci.u.s.a.102,15545-50(2005).
[0473]
godec,j.et al.compendium of immune signatures identifiesconserved and species-specific biology in response to inflammation.immunity 44,194-206(2016).
9.doi:10.1016/j.cell.2016.08.069.epub 2016 sep 22.
[0503]
kaplan dh,shankaran v,dighe as,stockert e,aguet m,old lj,schreiber rd.demonstration of an interferon gamma-dependent tumor surveillance system in imrnunocompetent mice.proc natl acad sci u s a.1998jun 23;95(13):7556-61.
[0504]
balkhi my,wittmann g,xiong f,junghans rp.yy1 upregulates checkpoint receptors and downregulates type i cytokines in exhausted,chronically stimulated human t cells.iscience.2018;2:105-122.doi:10.1016/j.isci.2018.03.009
[0505]
david m.lee,herman f.staats,john s.sundy,dhavalkumar d.pate1,gregory d.sempowski,richard m.scearce,dawn m.jones,barton f.haynes.immunologic characterization of cd7-deficient mice.the journal of工mmunology june 15,1998,160(12)5749-5756.
[0506]
sakellariou-thompson d,forget ma,creasy c,bernard v,zhao l,kim yu,hurd mw,uraoka n,parra er,kang y,bristow ca,rodriguez-canales j,fleming jb,varadhachary g,javle m,overman mj,alvarez ha,heffernan tp,zhang j,hwu p,maitra a,haymaker c,bernatchez c.4-1bb agonist focuses cd8 tumor-infiltrating t-cell growth into a distinct repertoire capable of tumor recognition in pancreatic cancer.clin cancer res.2017dec 1;23(23):7263-7275.doi:10.1158/1078-0432.ccr-17-0831.
[0507]
scott,a.c.,d
ü
ndar,f.,zumbo,p.et al.tox is a critical regulator of tumour-specific t cell differentiation.nature 571,270-274(2019).
[0508]
jolanda brummelman,emilia m.c.mazza,giorgia alvisi,federico s.colombo,andrea grilli,joanna mikulak,domenico mavilio,marco alloisio,francesco ferrari,egesta lopci,pierluigi novellis,giulia veronesi,enrico lugli;high-dimensional single cell analysis identifies stem-like cytotoxic cd8
t cells infiltrating human tumors.j exp med 1october 2018;215(10):2520-2535.doi:https://doi.org/10.1084/jem.20180684
[0509]d′
angelo sp,melchiori l,merchant ms,bernstein d,glod j,kaplan r,grupp s,tap wd,chagin k,binder gk,basu s,lowther de,wang r,bath n,tipping a,betts g,ramachandrani,navenot jm,zhang h,wells dk,van winkle e,kari g,trivedi t,holdich t,pandite l,amado r,mackall cl.antitumor activity associated with prolonged persistence of adoptively transferred ny-eso-1
c259
t cells in synovial sarcoma.cancer discov.2018 aug;8(8):944-957.
[0510]
jiesheng li,zemin zhang,xianwen ren.landscape of transcript isoforms in single t cells infiltrating in non-small cell lun g cancer.journal of genetics and genomics.volume 47,issue 7,20july 2020,pages 373-388.
[0511]
dudley,m.e.,wunderlich,j.r.,shelton,t.e.,even,j.,&rosenberg,s.a.(2o03).generation of tumor-infiltrating lymphocyte cultures for use in adoptive transfer therapy for melanoma patients.journal of immunotherapy
(hagerstown,md.:1 997),26(4),332-342.
[0512]
peter j.r.ebert,jeanne cheung,yagai yang,erin mcnamara,rebecca hong,marina mos kalenko,stephen e.gould,heather maecker,bryan a.irving,jeong m.kim,marcia belvin,ira mellman,map kinaseinhibition promotes t cell and anti-tumor activity in combination with pd-l1 checkpoint blockade,irmmunity,volume 44,issue 3,2016,pages 609-621.
[0513]
devikala gurusamy,amanda n.henning,tori n.yamamoto,zhiya yu,nikolaos zacharakis,sri krishna,rigel j.kishton,suman k.vodnala,arash eidizadeh,li jia,christine m.kariya,mary a.black,robert eil,douglas c.palmer,jenny h.pan,madhusudhanan sukumar,shashank j.patel,nicholas p.restifo,multi-phenotype crispr-cas9 screen identifies p38 kinase as a target for adoptive immunotherapies,cancer cell,volume 37,issue 6,2020,pages 818-833.e9
[0514]
piccio l,vermi w,boles ks,fuchs a,strader ca,facchetti f,cella m,colonna m.adhesion of human t cells to antigen-presenting cells through sirpbeta2-cd47 interaction costimulates t-cell proliferation.blood.2005mar 15;105(6):2421-7.
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。