ezh2抑制剂用于治疗癌症的用途
1.相关申请
2.本技术要求于2020年5月28日提交的美国临时申请no.63/031,401的优先权和权益,其内容全文以引用方式并入本文。
背景技术:
3.在特定癌症和环境中,瘤内b细胞和基质b细胞参与抗肿瘤反应的抑制,这可对疾病和治疗结果产生负面影响。在另一些癌症和环境中,瘤内b细胞和基质b细胞显示有助于促进抗肿瘤反应。因此,本领域对减少瘤内b细胞和基质b细胞以治疗其中这些b细胞抑制抗肿瘤反应的癌症的抗癌治疗存在着尚未满足的需求。
技术实现要素:
4.本公开提供了一种治疗受试者中的癌症的方法,该方法包括向受试者给药至少一种治疗有效量的zeste同源物增强子(ezh2)的抑制剂,其中所述癌症以至少一种包含瘤内b细胞和/或基质b细胞的肿瘤为特征。
5.在一些实施方案中,癌症选自间皮瘤、前列腺癌、雄激素抗性前列腺癌、软组织肉瘤、上皮样肉瘤、上皮细胞癌、结肠直肠癌、肝细胞癌、乳腺癌、导管原位癌、非小细胞肺癌、皮肤黑素瘤、卵巢癌、腺样囊性肉瘤(acc)、结肠腺癌(coad)、肾透明细胞癌(kirc)、肾乳头状细胞癌(kirp)、低级别胶质瘤(lgg)、葡萄膜黑素瘤(uvm)、肾嫌色细胞癌(kich)和胰腺癌(paad)。
6.本公开提供了一种在受试者中减少至少一种肿瘤中的b细胞的数目和/或密度的方法,该方法包括向受试者给药至少一种治疗有效量的ezh2抑制剂。在一些实施方案中,b细胞包含瘤内b细胞。在一些实施方案中,b细胞包含基质b细胞。
7.在前述方法的一些实施方案中,与给药至少一种治疗有效量的ezh2抑制剂之前相比,至少一种肿瘤中的b细胞的数目和/或密度减少了至少约10%、或至少约25%、或至少约50%、或至少约75%、或至少约99%。
8.本公开提供了一种鉴定用ezh2抑制剂进行治疗的患有癌症的受试者的方法,该方法包括:a)确定来自受试者的肿瘤样本是否含有瘤内b细胞和/或基质b细胞;以及b)当肿瘤样本含有瘤内b细胞和/或基质b细胞时,鉴定出用ezh2抑制剂进行治疗的受试者。
9.本公开提供了一种治疗患有癌症的受试者的方法,该方法包括:a)确定来自受试者的肿瘤样本是否含有瘤内b细胞和/或基质b细胞;以及b)当肿瘤样本含有瘤内b细胞和/或基质b细胞时,向受试者给药至少一种治疗有效量的ezh2抑制剂。
10.本公开提供了一种鉴定用ezh2抑制剂进行治疗的患有癌症的受试者的方法,该方法包括:a)确定来自受试者的肿瘤样本中的瘤内b细胞和/或基质b细胞的水平;b)将步骤(a)中所确定的瘤内b细胞和/或基质b细胞的水平与预定截断水平进行比较;以及c)当步骤(a)中所确定的瘤内b细胞和/或基质b细胞的水平大于预定截断水平时,鉴定出用ezh2抑制剂进行治疗的受试者。
11.本公开提供了一种治疗患有癌症的受试者的方法,该方法包括:a)确定来自受试者的肿瘤样本中的瘤内b细胞和/或基质b细胞的水平;b)将步骤(a)中所确定的瘤内b细胞和/或基质b细胞的水平与预定截断水平进行比较;以及c)当步骤(a)中所确定的瘤内b细胞和/或基质b细胞的水平大于预定截断水平时,向受试者给药至少一种治疗有效量的ezh2抑制剂。
12.本公开提供了一种确定患有癌症的受试者对至少一种疗法的反应的方法,其中至少一种疗法包括给药ezh2抑制剂,该方法包括:a)确定在第一时间点从受试者收集的肿瘤样本中的瘤内b细胞和/或基质b细胞的第一水平,其中第一时间点在给药至少一种疗法之前;b)确定在第二时间点从受试者收集的肿瘤样本中的瘤内b细胞和/或基质b细胞的第二水平,其中第二时间点在给药至少一种疗法之后;c)将瘤内b细胞和/或基质b细胞的第二水平与瘤内b细胞和/或基质b细胞的第一水平进行比较;以及d)当瘤内b细胞和/或基质b细胞的第二水平低于瘤内b细胞和/或基质b细胞的第一水平时,确定受试者对至少一种疗法有反应。
13.本公开提供了一种确定患有癌症的受试者对至少一种疗法的反应的方法,其中至少一种疗法包括给药ezh2抑制剂,该方法包括:a)确定在第一时间点从受试者收集的肿瘤样本中的瘤内b细胞和/或基质b细胞的第一水平,其中第一时间点在给药至少一种疗法之前;b)确定在第二时间点从受试者收集的肿瘤样本中的瘤内b细胞和/或基质b细胞的第二水平,其中第二时间点在给药至少一种疗法之后;c)将瘤内b细胞和/或基质b细胞的第二水平与瘤内b细胞和/或基质b细胞的第一水平进行比较;以及d)当瘤内b细胞和/或基质b细胞的第二水平为瘤内b细胞和/或基质b细胞的第一水平的不超过75%时,确定受试者对至少一种疗法有反应。
14.在前述方法的一些实施方案中,步骤(d)包括当瘤内b细胞和/或基质b细胞的第二水平为瘤内b细胞和/或基质b细胞的第一水平的不超过50%、或不超过25%、或不超过10%时,确定受试者对至少一种疗法有反应。
15.本公开提供了一种治疗受试者中的癌症的方法,该方法包括:a)确定在第一时间点从受试者收集的肿瘤样本中的瘤内b细胞和/或基质b细胞的第一水平,其中第一时间点在给药至少一种治疗有效量的ezh2抑制剂之前;b)确定在第二时间点从受试者收集的肿瘤样本中的瘤内b细胞和/或基质b细胞的第二水平,其中第二时间点在给药至少一种治疗有效量的ezh2抑制剂之后;c)将瘤内b细胞和/或基质b细胞的第二水平与瘤内b细胞的第一水平进行比较;以及d)当瘤内b细胞和/或基质b细胞的第二水平低于瘤内b细胞的第一水平时,向受试者给药至少一种额外的治疗有效量的ezh2抑制剂,或者当瘤内b细胞和/或基质b细胞的第二表达水平大于或等于瘤内b细胞和/或基质b细胞的第一水平时,向受试者给药至少一种替代疗法。
16.本公开提供了一种治疗受试者中的癌症的方法,该方法包括:a)确定在第一时间点从受试者收集的肿瘤样本中的瘤内b细胞和/或基质b细胞的第一水平,其中第一时间点在给药至少一种治疗有效量的ezh2抑制剂之前;b)确定在第二时间点从受试者收集的肿瘤样本中的瘤内b细胞和/或基质b细胞的第二水平,其中第二时间点在给药至少一种治疗有效量的ezh2抑制剂之后;c)将瘤内b细胞和/或基质b细胞的第二水平与瘤内b细胞的第一水平进行比较;以及d)当瘤内b细胞和/或基质b细胞的第二水平为瘤内b细胞和/或基质b细胞
的第一水平的不超过75%时,向受试者给药至少一种额外的治疗有效量的ezh2抑制剂,或者当瘤内b细胞和/或基质b细胞的第二表达水平为瘤内b细胞和/或基质b细胞的第一水平的大于75%时,向受试者给药至少一种替代疗法。
17.在前述方法的一些实施方案中,步骤(d)包括当瘤内b细胞和/或基质b细胞的第二水平为瘤内b细胞和/或基质b细胞的第一水平的不超过50%、或不超过25%、或不超过10%时,向受试者给药至少一种额外的治疗有效量的ezh2抑制剂,或者当瘤内b细胞和/或基质b细胞的第二表达水平为瘤内b细胞和/或基质b细胞的第一水平的大于50%、或大于25%、或大于10%时,向受试者给药至少一种替代疗法。
18.在前述方法的一些实施方案中,ezh2抑制剂是
19.(他泽司他)、或其药学上可接受的盐。
20.在前述方法的一些实施方案中,瘤内b细胞和/或基质b细胞的水平是固定体积的肿瘤样本内的瘤内b细胞和/或基质b细胞的数目。
21.在前述方法的一些实施方案中,瘤内b细胞和/或基质b细胞的水平是肿瘤样本内的瘤内b细胞和/或基质b细胞的密度。
22.在前述方法的一些实施方案中,确定肿瘤样本中的瘤内b细胞和/或基质b细胞的水平包括对肿瘤样本执行免疫荧光分析。在前述方法的一些实施方案中,免疫荧光分析包括用特异性结合至少一种b细胞特异性细胞标记的荧光标记抗体对样本进行染色。
23.在前述方法的一些实施方案中,细胞标记选自:iga、ige、igd、igm、igg、cd1、cd1c、cd1d、cd5、cd10、cd19、cd20、cd21、cd22、cd23、cd24、cd25、cd27、cd30、cd38、cd40、cd72、cd78、cd79、cd80、cd93、cd95、cd138、cd148、cd319、il-6、pdl-2、cxcr3、cxcr4、cxcr5、cxcr6、notch2、tlr4、il-10、hla-dr、taci、pax5、fcrl3、b7-1、b7-2、ebf-1、e2a、oct2、pax5、obf1、spi-b、bcma、blimp1、irf4、xbp1和tgfβ。在一些实施方案中,细胞标记是cd20。在一些实施方案中,细胞标记是cd19。
24.在前述方法的一些实施方案中,确定瘤内b细胞的水平包括去至少一种b细胞特异性基因的表达水平。
25.在前述方法的一些实施方案中,确定瘤内b细胞的水平包括确定多种b细胞特异性基因的表达水平。
26.在前述方法的一些实施方案中,肿瘤是癌性肿瘤。在前述方法的一些实施方案中,癌症是间皮瘤。在一些实施方案中,间皮瘤是复发性/难治性(r/r)间皮瘤。在一些实施方案中,间皮瘤是上皮样的、双相性的、或肉瘤样的。在一些实施方案中,间皮瘤是上皮样的。在前述方法的一些实施方案中,癌症是上皮样肉瘤。
27.以上方面中的任一者可与任何其它方面组合。
28.除非另有定义,否则本文使用的所有技术术语和科学术语都具有与本公开所属领域的普通技术人员通常理解的相同的含义。在说明书中,单数形式也包括复数形式,除非上下文另有明确规定;作为实例,术语“一个”、“一种”和“该”应理解为单数或复数,并且术语“或”应理解为包括性的。以举例的方式,“一个要素”意指一个或多个要素。贯穿本说明书,词语“包含(comprising)”、或变型形式如“包含(comprises)”或“包含(comprising)”将理解为暗示包括所陈述的要素、整数或步骤,或要素、整数或步骤的组,但不排除任何其它要素、整数或步骤,或要素、整数或步骤的组。“约”可以理解为在所陈述值的10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.1%、0.05%、或0.01%之内。除非从上下文中另外清楚看出,本文所提供的所有数值均用术语“约”修饰。除非上下文中具体叙述或显而易见,否则如本文所用,术语“或”应理解为包括性的且涵盖“或”以及“和”两者。
29.虽然与本文所述的那些类似或等同的方法和材料均可用于本公开的实践或测试,下文描述了合适的方法和材料。本文所提及的所有出版物、专利申请、专利和其它参考文献均全文以引用方式并入。本文引用的参考文献不被承认为所要求保护的发明的现有技术。如发生矛盾,以本说明书及其所包括的定义为准。此外,材料、方法和实例仅是示例性的,而非旨在进行限制。根据以下具体实施方式和权利要求书,本公开的其它特征和优点将显而易见。
附图说明
30.当结合附图考虑时,通过以下具体实施方式将更清楚地理解以上和其它特征。
31.图1是显示在本公开的实施例1中所述的2期研究中治疗的间皮瘤患者中给药他泽司他之前和之后的瘤内b细胞水平的图表。
32.图2是显示在本公开的实施例1中所述的2期研究中治疗的间皮瘤患者中给药他泽司他之前和之后的基质b细胞水平的图表。
33.图3是显示在acc、coad、kirc、uvm或kirp肿瘤中表现出低b细胞基因标签或高b细胞基因标签的癌症患者中的累积生存率的一系列曲线图。使用timer 2.0应用程序执行分析,并从癌症基因组图谱(tcga)中检索分析的数据集。
34.图4是显示在acc、kich、kirp、lgg、meso或paad肿瘤中表现出低b基因细胞标签或高b细胞基因标签的癌症患者中的累积生存率的一系列曲线图。使用timer应用软件执行分析,并从tcga中检索分析的数据集。
35.图5是显示在uvm肿瘤中表现出低b细胞基因标签或高b细胞基因标签的癌症患者中的累积生存率的曲线图。使用timer应用软件执行分析,并从tcga中检索分析的数据集。
36.图6显示在从本公开的实施例1中所述的2期研究中治疗的间皮瘤患者收集的他泽司他给药之前和之后的样本中,六种不同的b细胞基因标签(b细胞记忆_xcell、b细胞_mcpcounter、b细胞初始_cibersort、b细胞_quantiseq、b细胞初始_cibersort-abs和b细胞_xcell)的相对表达水平。
37.图7a和图7b显示在从本公开的实施例3中所述的2期研究中治疗的上皮样肉瘤患者收集的他泽司他给药之前和之后样本中,15种不同的b细胞基因标签(b细胞记忆_cibersort、b细胞_cibersort-abs、b细胞记忆_xcell、b细胞初始_cibersort、b细胞初始_
cibersort-abs、b细胞初始_xcell、b细胞浆_cibersort、b细胞浆_cibersort-abs、b细胞浆_xcell、b细胞_epic、b细胞_mcpcounter和b细胞_quantiseq(图7a);和b细胞_timer、b细胞_xcell,以及类别转换记忆b细胞_xcell(图7b))和一种巨噬细胞基因标签(巨噬细胞_epic(图7b))的平均相对表达水平。
38.图8显示在本公开的实施例3中所述的2期研究中治疗的上皮样肉瘤患者中,他泽司他给药之前和之后所有患者样本中cd19和cd20的平均相对表达水平。
具体实施方式
39.本公开提供了用于在受试者中治疗以至少一种包含瘤内b细胞和/或基质b细胞的肿瘤为特征的癌症的方法,该方法包括向受试者给药ezh2抑制剂。本公开还提供了鉴定用ezh2抑制剂进行治疗的患有癌症的受试者的方法,该方法包括确定来自受试者的肿瘤样本中的瘤内b细胞和/或基质b细胞的水平。本公开还提供了确定受试者对至少一种疗法的反应的方法,其中该疗法包括给药ezh2抑制剂,该方法包括将在第一时间点从受试者收集的肿瘤样本中的瘤内b细胞和/或基质b细胞的水平与在第二时间点从受试者收集的肿瘤样本中的瘤内b细胞和/或基质b细胞的水平进行比较。本公开还提供了一种在受试者减少肿瘤中的瘤内b细胞和/或基质b细胞的数目和/或密度的方法,该方法包括向受试者给药ezh2抑制剂。在一些方面,ezh2抑制剂是他泽司他或其药学上可接受的盐。
40.在一些方面,本公开提供了一种治疗受试者中的癌症的方法,该方法包括向受试者给药至少一种治疗有效量的zeste同源物增强子(ezh2)的抑制剂,其中癌症以至少一种包含瘤内b细胞的肿瘤为特征。
41.在一些方面,本公开提供了一种治疗受试者中的癌症的方法,该方法包括向受试者给药至少一种治疗有效量的zeste同源物增强子(ezh2)的抑制剂,其中癌症以至少一种包含基质b细胞的肿瘤为特征。
42.在一些方面,本公开提供了一种治疗受试者中的癌症的方法,该方法包括向受试者给药至少一种治疗有效量的zeste同源物增强子(ezh2)的抑制剂,其中癌症以至少一种包含瘤内b细胞和基质b细胞的肿瘤为特征。
43.在前述方法的一些实施方案中,以至少一种包含瘤内b细胞的肿瘤为特征的癌症、或以至少一种包含基质b细胞的肿瘤为特征的癌症、或以至少一种包含瘤内b细胞和基质b细胞的肿瘤为特征的癌症可包括但不限于间皮瘤、前列腺癌、雄激素抗性前列腺癌、软组织肉瘤、上皮样肉瘤、上皮细胞癌、结肠直肠癌、肝细胞癌、乳腺癌、导管原位癌、非小细胞肺癌、皮肤黑素瘤、卵巢癌、腺样囊性肉瘤(acc)、结肠腺癌(coad)、肾透明细胞癌(kirc)、肾乳头状细胞癌(kirp)、低级别胶质瘤(lgg)、葡萄膜黑素瘤(uvm)、肾嫌色细胞癌(kich)和胰腺癌(paad)。在一些方面,癌症是间皮瘤。在一些实施方案中,间皮瘤是复发性/难治性(r/r)间皮瘤。在一些实施方案中,间皮瘤是上皮样间皮瘤。在一些实施方案中,间皮瘤是双相性间皮瘤。在一些实施方案中,间皮瘤是肉瘤样间皮瘤。在一些方面,癌症是上皮样肉瘤。
44.在一些方面,本公开提供了一种在受试者中减少至少一种肿瘤中的b细胞的数目和/或密度的方法,该方法包括向受试者给药至少一种治疗有效量的ezh2抑制剂。在前述方法的一些实施方案中,与给药至少一种治疗有效量的ezh2抑制剂之前相比,至少一种肿瘤中的b细胞的数目和/或密度可减少至少约10%、或至少约15%、或至少约20%、或至少约
25%、或至少约30%、或至少约35%、或至少约40%、或至少约45%、或至少约50%、或至少约55%、或至少约60%、或至少约65%、或至少约70%、或至少约75%、或至少约80%、或至少约85%、或至少约90%、或至少约95%、或至少约99%。
45.在一些方面,本公开提供了一种在受试者中减少至少一种肿瘤中的瘤内b细胞的数目和/或密度的方法,该方法包括向受试者给药至少一种治疗有效量的ezh2抑制剂。在前述方法的一些实施方案中,与给药至少一种治疗有效量的ezh2抑制剂之前相比,至少一种肿瘤中的瘤内b细胞的数目和/或密度可减少至少约10%、或至少约15%、或至少约20%、或至少约25%、或至少约30%、或至少约35%、或至少约40%、或至少约45%、或至少约50%、或至少约55%、或至少约60%、或至少约65%、或至少约70%、或至少约75%、或至少约80%、或至少约85%、或至少约90%、或至少约95%、或至少约99%。
46.在一些方面,本公开提供了一种在受试者中减少至少一种肿瘤中的基质b细胞的数目和/或密度的方法,该方法包括向受试者给药至少一种治疗有效量的ezh2抑制剂。在前述方法的一些实施方案中,与给药至少一种治疗有效量的ezh2抑制剂之前相比,至少一种肿瘤中的基质b细胞的数目和/或密度可减少至少约10%、或至少约15%、或至少约20%、或至少约25%、或至少约30%、或至少约35%、或至少约40%、或至少约45%、或至少约50%、或至少约55%、或至少约60%、或至少约65%、或至少约70%、或至少约75%、或至少约80%、或至少约85%、或至少约90%、或至少约95%、或至少约99%。
47.在一些方面,本公开提供了一种鉴定用ezh2抑制剂进行治疗的患有癌症的受试者的方法,该方法包括:a)确定来自受试者的肿瘤样本是否含有瘤内b细胞;以及b)当肿瘤样本含有瘤内b细胞时,鉴定出用ezh2抑制剂进行治疗的受试者。
48.在一些方面,本公开提供了一种鉴定用ezh2抑制剂进行治疗的患有癌症的受试者的方法,该方法包括:a)确定来自受试者的肿瘤样本是否含有基质b细胞;以及b)当肿瘤样本含有基质b细胞时,鉴定出用ezh2抑制剂进行治疗的受试者。
49.在一些方面,本公开提供了一种鉴定用ezh2抑制剂进行治疗的患有癌症的受试者的方法,该方法包括:a)确定来自受试者的肿瘤样本是否含有瘤内b细胞和基质b细胞;以及b)当肿瘤样本含有瘤内b细胞和基质b细胞时,鉴定出用ezh2抑制剂进行治疗的受试者。
50.在一些方面,本公开提供了一种治疗患有癌症的受试者的方法,该方法包括a)确定来自受试者的肿瘤样本是否含有瘤内b细胞;以及b)当肿瘤样本含有瘤内b细胞时,向受试者给药至少一种治疗有效量的ezh2抑制剂。
51.在一些方面,本公开提供了一种治疗患有癌症的受试者的方法,该方法包括:a)确定来自受试者的肿瘤样本是否含有基质b细胞;以及b)当肿瘤样本含有基质b细胞时,向受试者给药至少一种治疗有效量的ezh2抑制剂。
52.在一些方面,本公开提供了一种治疗患有癌症的受试者的方法,该方法包括:a)确定来自受试者的肿瘤样本是否含有瘤内b细胞和基质b细胞;以及b)当肿瘤样本含有瘤内b细胞和基质b细胞时,向受试者给药至少一种治疗有效量的ezh2抑制剂。
53.在一些方面,本公开提供了一种鉴定用ezh2抑制剂进行治疗的患有癌症的受试者的方法,该方法包括:a)确定来自受试者的肿瘤样本中的瘤内b细胞的水平;b)将步骤(a)中所确定的瘤内b细胞的水平与预定截断水平进行比较;以及c)当步骤(a)中所确定的瘤内b细胞的水平大于预定截断水平时,鉴定出用ezh2抑制剂进行治疗的受试者。
54.在一些方面,本公开提供了一种鉴定用ezh2抑制剂进行治疗的患有癌症的受试者的方法,该方法包括:a)确定来自受试者的肿瘤样本中的基质b细胞的水平;b)将步骤(a)中所确定的基质b细胞的水平与预定截断水平进行比较;以及c)当步骤(a)中所确定的基质b细胞的水平大于预定截断水平时,鉴定出用ezh2抑制剂进行治疗的受试者。
55.在一些方面,本公开提供了一种鉴定用ezh2抑制剂进行治疗的患有癌症的受试者的方法,该方法包括:a)确定来自受试者的肿瘤样本中的瘤内b细胞和基质b细胞的水平;b)将步骤(a)中所确定的瘤内b细胞和基质b细胞的水平与预定截断水平进行比较;以及c)当步骤(a)中所确定的瘤内b细胞和基质b细胞的水平大于预定截断水平时,鉴定出用ezh2抑制剂进行治疗的受试者。
56.在一些方面,本公开提供了一种治疗患有癌症的受试者的方法,该方法包括a)确定来自受试者的肿瘤样本中的瘤内b细胞的水平;b)将步骤(a)中所确定的瘤内b细胞的水平与预定截断水平进行比较;以及c)当步骤(a)中所确定的瘤内b细胞的水平大于预定截断水平时,向受试者给药至少一种治疗有效量的ezh2抑制剂。
57.在一些方面,本公开提供了一种治疗患有癌症的受试者的方法,该方法包括:a)确定来自受试者的肿瘤样本中的基质b细胞的水平;b)将步骤(a)中所确定的基质b细胞的水平与预定截断水平进行比较;以及c)当步骤(a)中所确定的基质b细胞的水平大于预定截断水平时,向受试者给药至少一种治疗有效量的ezh2抑制剂。
58.在一些方面,本公开提供了一种治疗患有癌症的受试者的方法,该方法包括:a)确定来自受试者的肿瘤样本中的瘤内b细胞和基质b细胞的水平;b)将步骤(a)中所确定的瘤内b细胞和基质b细胞的水平与预定截断水平进行比较;以及c)当步骤(a)中所确定的瘤内b细胞和基质b细胞的水平大于预定截断水平时,向受试者给药至少一种治疗有效量的ezh2抑制剂。
59.在一些方面,预定截断值可以是对照肿瘤样本中的瘤内b细胞和/或基质b细胞的水平。在一些方面,预定截断值可以是多个对照肿瘤样本中的瘤内b细胞和/或基质b细胞的平均(平均值)水平。在一些方面,对照肿瘤样本可以是从先前鉴定为对包括给药ezh2抑制剂的疗法有反应的受试者收集的肿瘤样本。在一些方面,对照肿瘤样本可以是从已被诊断患有以至少一种包含瘤内b细胞和/或基质b细胞的肿瘤为特征的癌症的受试者收集的肿瘤样本。
60.在一些方面,本公开提供了一种确定患有癌症的受试者对至少一种疗法的反应的方法,其中至少一种疗法包括给药ezh2抑制剂,该方法包括:a)确定在第一时间点从受试者收集的肿瘤样本中的瘤内b细胞的第一水平;b)确定在第二时间点从受试者收集的肿瘤样本中的瘤内b细胞的第二水平;c)将瘤内b细胞的第二水平与瘤内b细胞的第一水平进行比较;以及d)当瘤内b细胞的第二水平低于瘤内b细胞的第一水平时,确定受试者对至少一种疗法有反应。
61.在一些方面,本公开提供了一种确定患有癌症的受试者对至少一种疗法的反应的方法,其中至少一种疗法包括给药ezh2抑制剂,该方法包括:a)确定在第一时间点从受试者收集的肿瘤样本中的基质b细胞的第一水平;b)确定在第二时间点从受试者收集的肿瘤样本中的基质b细胞的第二水平;c)将基质b细胞的第二水平与基质b细胞的第一水平进行比较;以及d)当基质b细胞的第二水平低于基质b细胞的第一水平时,确定受试者对至少一种
疗法有反应。
62.在一些方面,本公开提供了一种确定患有癌症的受试者对至少一种疗法的反应的方法,其中至少一种疗法包括给药ezh2抑制剂,该方法包括:a)确定在第一时间点从受试者收集的肿瘤样本中的瘤内b细胞和基质b细胞的第一水平;b)确定在第二时间点从受试者收集的肿瘤样本中的瘤内b细胞和基质b细胞的第二水平;c)将瘤内b细胞和基质b细胞的第二水平与瘤内b细胞和基质b细胞的第一水平进行比较;以及d)当瘤内b细胞和基质b细胞的第二水平低于瘤内b细胞和基质b细胞的第一水平时,确定受试者对至少一种疗法有反应。
63.在一些方面,本公开提供了一种确定患有癌症的受试者对至少一种疗法的反应的方法,其中至少一种疗法包括给药ezh2抑制剂,该方法包括:a)确定在第一时间点从受试者收集的肿瘤样本中的瘤内b细胞的第一水平;b)确定在第二时间点从受试者收集的肿瘤样本中的瘤内b细胞的第二水平;c)将瘤内b细胞的第二水平与瘤内b细胞的第一水平进行比较;以及d)当瘤内b细胞的第二水平为瘤内b细胞的第一水平的不超过90%、或不超过85%、或不超过80%、或不超过75%、或不超过70%、或不超过65%、或不超过60%、或不超过55%、或不超过50%、或不超过45%、或不超过40%、或不超过35%、或不超过30%、或不超过25%、或不超过20%、或不超过15%、或不超过10%、或不超过5%时,确定受试者对至少一种疗法有反应。
64.在一些方面,本公开提供了一种确定患有癌症的受试者对至少一种疗法的反应的方法,其中至少一种疗法包括给药ezh2抑制剂,该方法包括:a)确定在第一时间点从受试者收集的肿瘤样本中的基质b细胞的第一水平;b)确定在第二时间点从受试者收集的肿瘤样本中的基质b细胞的第二水平;c)将基质b细胞的第二水平与基质b细胞的第一水平进行比较;以及d)当基质b细胞的第二水平为基质b细胞的第一水平的不超过90%、或不超过85%、或不超过80%、或不超过75%、或不超过70%、或不超过65%、或不超过60%、或不超过55%、或不超过50%、或不超过45%、或不超过40%、或不超过35%、或不超过30%、或不超过25%、或不超过20%、或不超过15%、或不超过10%、或不超过5%时,确定受试者对至少一种疗法有反应。
65.在一些方面,本公开提供了一种确定患有癌症的受试者对至少一种疗法的反应的方法,其中至少一种疗法包括给药ezh2抑制剂,该方法包括:a)确定在第一时间点从受试者收集的肿瘤样本中的瘤内b细胞和基质b细胞的第一水平;b)确定在第二时间点从受试者收集的肿瘤样本中的瘤内b细胞和基质b细胞的第二水平;c)将瘤内b细胞和基质b细胞的第二水平与瘤内b细胞和基质b细胞的第一水平进行比较;以及d)当瘤内b细胞和基质b细胞的第二水平为瘤内b细胞和基质b细胞的第一水平的不超过90%、或不超过85%、或不超过80%、或不超过75%、或不超过70%、或不超过65%、或不超过60%、或不超过55%、或不超过50%、或不超过45%、或不超过40%、或不超过35%、或不超过30%、或不超过25%、或不超过20%、或不超过15%、或不超过10%、或不超过5%时,确定受试者对至少一种疗法有反应。
66.在本公开的方法的一些实施方案中,第一时间点在给药至少一种疗法之前。在本公开的方法的一些实施方案中,第一时间点在给药至少一种疗法之前,其中至少一种疗法包括给药ezh2抑制剂。
67.在本公开的方法的一些实施方案中,第二时间点在给药至少一种疗法之后。在本
公开的方法的一些实施方案中,第二时间点在给药至少一种疗法之后,其中至少一种疗法包括给药ezh2抑制剂。
68.在一些方面,本公开提供了一种治疗受试者中的癌症的方法,该方法包括:a)确定在第一时间点从受试者收集的肿瘤样本中的瘤内b细胞的第一水平,其中第一时间点在给药至少一种治疗有效量的ezh2抑制剂之前;b)确定在第二时间点从受试者收集的肿瘤样本中的瘤内b细胞的第二水平,其中第二时间点在给药至少一种治疗有效量的ezh2抑制剂之后;c)将瘤内b细胞的第二水平与瘤内b细胞的第一水平进行比较;以及d)当瘤内b细胞的第二水平低于瘤内b细胞的第一水平时,向受试者给药至少一种额外的治疗有效量的ezh2抑制剂,或者当瘤内b细胞的第二表达水平大于或等于瘤内b细胞的第一水平时,向受试者给药至少一种替代疗法。
69.在一些方面,本公开提供了一种治疗受试者中的癌症的方法,该方法包括:a)确定在第一时间点从受试者收集的肿瘤样本中的基质b细胞的第一水平,其中第一时间点在给药至少一种治疗有效量的ezh2抑制剂之前;b)确定在第二时间点从受试者收集的肿瘤样本中的基质b细胞的第二水平,其中第二时间点在给药至少一种治疗有效量的ezh2抑制剂之后;c)将基质b细胞的第二水平与基质b细胞的第一水平进行比较;以及d)当基质b细胞的第二水平低于基质b细胞的第一水平时,向受试者给药至少一种额外的治疗有效量的ezh2抑制剂,或者当基质b细胞的第二表达水平大于或等于基质b细胞的第一水平时,向受试者给药至少一种替代疗法。
70.在一些方面,本公开提供了一种治疗受试者中的癌症的方法,该方法包括:a)确定在第一时间点从受试者收集的肿瘤样本中的瘤内b细胞和基质b细胞的第一水平,其中第一时间点在给药至少一种治疗有效量的ezh2抑制剂之前;b)确定在第二时间点从受试者收集的肿瘤样本中的瘤内b细胞和基质b细胞的第二水平,其中第二时间点在给药至少一种治疗有效量的ezh2抑制剂之后;c)将瘤内b细胞和基质b细胞的第二水平与瘤内b细胞和基质b细胞的第一水平进行比较;以及d)当瘤内b细胞和基质b细胞的第二水平低于瘤内b细胞和基质b细胞的第一水平时,向受试者给药至少一种额外的治疗有效量的ezh2抑制剂,或者当瘤内b细胞和基质b细胞的第二表达水平大于或等于瘤内b细胞和基质b细胞的第一水平时,向受试者给药至少一种替代疗法。
71.在一些方面,本公开提供了一种治疗受试者中的癌症的方法,该方法包括:a)确定在第一时间点从受试者收集的肿瘤样本中的瘤内b细胞的第一水平,其中第一时间点在给药至少一种治疗有效量的ezh2抑制剂之前;b)确定在第二时间点从受试者收集的肿瘤样本中的瘤内b细胞的第二水平,其中第二时间点在给药至少一种治疗有效量的ezh2抑制剂之后;c)将瘤内b细胞的第二水平与瘤内b细胞的第一水平进行比较;以及d)当瘤内b细胞的第二水平为瘤内b细胞的第一水平的不超过90%、或不超过85%、或不超过80%、或不超过75%、或不超过70%、或不超过65%、或不超过60%、或不超过55%、或不超过50%、或不超过45%、或不超过40%、或不超过35%、或不超过30%、或不超过25%、或不超过20%、或不超过15%、或不超过10%、或不超过5%时,向受试者给药至少一种额外的治疗有效量的ezh2抑制剂,或者当瘤内b细胞的第二表达水平为瘤内b细胞的第一水平的大于90%、或大于85%、或大于80%、或大于75%、或大于70%、或大于65%、或大于60%、或大于55%、或大于50%、或大于45%、或大于40%、或大于35%、或大于30%、或大于25%、或大于20%、或大
于15%、或大于10%、或大于5%时,向受试者给药至少一种替代疗法。
72.在一些方面,本公开提供了一种治疗受试者中的癌症的方法,该方法包括:a)确定在第一时间点从受试者收集的肿瘤样本中的基质b细胞的第一水平,其中第一时间点在给药至少一种治疗有效量的ezh2抑制剂之前;b)确定在第二时间点从受试者收集的肿瘤样本中的基质b细胞的第二水平,其中第二时间点在给药至少一种治疗有效量的ezh2抑制剂之后;c)将基质b细胞的第二水平与基质b细胞的第一水平进行比较;以及d)当基质b细胞的第二水平为基质b细胞的第一水平的不超过90%、或不超过85%、或不超过80%、或不超过75%、或不超过70%、或不超过65%、或不超过60%、或不超过55%、或不超过50%、或不超过45%、或不超过40%、或不超过35%、或不超过30%、或不超过25%、或不超过20%、或不超过15%、或不超过10%、或不超过5%时,向受试者给药至少一种额外的治疗有效量的ezh2抑制剂,或者当基质b细胞的第二表达水平为基质b细胞的第一水平的大于90%、或大于85%、或大于80%、或大于75%、或大于70%、或大于65%、或大于60%、或大于55%、或大于50%、或大于45%、或大于40%、或大于35%、或大于30%、或大于25%、或大于20%、或大于15%、或大于10%、或大于5%时,向受试者给药至少一种替代疗法。
73.在一些方面,本公开提供了一种治疗受试者中的癌症的方法,该方法包括:a)确定在第一时间点从受试者收集的肿瘤样本中的瘤内b细胞或基质b细胞的第一水平,其中第一时间点在给药至少一种治疗有效量的ezh2抑制剂之前;b)确定在第二时间点从受试者收集的肿瘤样本中的瘤内b细胞或基质b细胞的第二水平,其中第二时间点在给药至少一种治疗有效量的ezh2抑制剂之后;c)将瘤内b细胞或基质b细胞的第二水平与瘤内b细胞或基质b细胞的第一水平进行比较;以及d)当瘤内b细胞或基质b细胞的第二水平为瘤内b细胞或基质b细胞的第一水平的不超过90%、或不超过85%、或不超过80%、或不超过75%、或不超过70%、或不超过65%、或不超过60%、或不超过55%、或不超过50%、或不超过45%、或不超过40%、或不超过35%、或不超过30%、或不超过25%、或不超过20%、或不超过15%、或不超过10%、或不超过5%时,向受试者给药至少一种额外的治疗有效量的ezh2抑制剂,或者当瘤内b细胞或基质b细胞的第二表达水平为瘤内b细胞或基质b细胞的第一水平的大于90%、或大于85%、或大于80%、或大于75%、或大于70%、或大于65%、或大于60%、或大于55%、或大于50%、或大于45%、或大于40%、或大于35%、或大于30%、或大于25%、或大于20%、或大于15%、或大于10%、或大于5%时,向受试者给药至少一种替代疗法。
74.在本公开的方法的一些实施方案中,替代疗法可以包括不包括给药ezh-2抑制剂的疗法。替代疗法可以包括但不限于放射疗法、手术、化学疗法、免疫疗法、激素疗法、冷冻消融、射频消融、靶向药物疗法或它们的任何组合。
75.在本公开的方法的一些实施方案中,瘤内b细胞和/或基质b细胞的水平可为固定体积的肿瘤样本内的瘤内b细胞和/或基质b细胞的数目。
76.在本公开的方法的一些实施方案中,瘤内b细胞和/或基质b细胞的水平可为肿瘤样本内的瘤内b细胞和/或基质b细胞的平均密度。
77.本领域的普通技术人员将知晓用于测定肿瘤样本中的瘤内b细胞和/或基质b细胞的水平的方法,包括但不限于肿瘤样本的免疫荧光分析以及测定至少一种b细胞特异性基因的表达水平。
78.在本公开的方法的一些实施方案中,确定肿瘤样本中的瘤内b细胞和/或基质b细
胞的水平可包括对肿瘤样本执行免疫荧光分析。在一些实施方案中,免疫荧光分析包括用b细胞特异性荧光标记对样本进行染色,然后检测荧光标记以确定样本中b细胞的数目和/或密度。
79.在一些实施方案中,免疫荧光分析可为免疫组织化学。免疫组织化学分析可以使用本领域已知的标准技术执行。如技术人员所理解,免疫组织化学分析可包括用特异性结合至少一种b细胞特异性细胞标记的至少一种荧光标记抗体对样本进行染色。在一些方面,然后可以使用本领域已知的标准方法(包括但不限于显微镜)来检测这些荧光标记的抗体,以确定样本中b细胞的数目和/或密度。
80.在一些实施方案中,免疫荧光分析可为荧光流式细胞术。可以使用本领域已知的标准技术执行荧光流式细胞术。如技术人员所理解,荧光流式细胞术可包括分离肿瘤样本,用特异性结合至少一种b细胞特异性细胞标记的至少一种荧光标记抗体对分离的样本进行染色,并执行荧光流式细胞术,以基于多少细胞被荧光标记抗体染色来计数样本中的b细胞数目。
81.在本公开的方法的一些实施方案中,确定肿瘤样本中的瘤内b细胞和/或基质b细胞的水平可以包括确定至少一种b细胞特异性基因的表达水平。在本公开的方法的一些实施方案中,确定肿瘤样本中的瘤内b细胞和/或基质b细胞的水平可以包括确定多种b细胞特异性基因的表达水平。
82.在本公开的方法的一些实施方案中,确定肿瘤样本中的瘤内b细胞和/或基质b细胞的水平可以包括pcrp、靶向测序、高通量测序、新一代测序、rna印迹、逆转录pcr(rt-pcr)、实时pcr(qpcr)、定量pcr、qrt-pcr、流式细胞术、质谱、微阵列分析、微滴式数字pcr、蛋白质印迹或它们的任何组合。
83.b细胞
84.b细胞(也称为b淋巴细胞)是淋巴细胞亚型中的一种类型白细胞。作为适应性免疫系统的组分,b细胞分泌免疫球蛋白。b细胞还呈递抗原并分泌细胞因子。b细胞在其细胞膜上表达b细胞受体(bcr)。bcr允许b细胞结合特异性抗原,从而允许b细胞引发抗体反应。
85.b细胞的亚型包括但不限于浆母细胞、浆细胞、淋巴浆细胞样细胞、记忆b细胞、b-2细胞、滤泡性(fo)b细胞、边缘区(mz)b细胞、b-1细胞和调节性b(breg)细胞。
86.b细胞特异性标记可以包括但不限于iga、ige、igd、igm、igg、cd1、cd1c、cd1d、cd5、cd10、cd19、cd20、cd21、cd22、cd23、cd24、cd25、cd27、cd30、cd38、cd40、cd72、cd78、cd79、cd80、cd93、cd95、cd138、cd148、cd319、il-6、pdl-2、cxcr3、cxcr4、cxcr5、cxcr6、notch2、tlr4、il-10、hla-dr、taci、pax5、fcrl3、b7-1、b7-2、ebf-1、e2a、oct2、pax5、obf1、spi-b、bcma、blimp1、irf4、xbp1和tgfβ或本领域已知的任何其它标记。本领域技术人员将理解,不同类型的b细胞表现出不同的标记,并且标记的不同组合可用于鉴定特定类型的b细胞。
87.在一些方面,瘤内b细胞可具有cd20 cd27-pd-l1 cd19 cd5 cd43 (breg细胞)、igm igd-cd27 (记忆b细胞)、cd19 cd80 cd86 cd44 cd69 pd-l1 (活化b细胞)、cd20-cd24-cd27
hi cd38
hi
(浆细胞)表型或本领域已知的任何其它表型。技术人员可以使用表型内的任何单个标记作为瘤内b细胞的标记。
88.不受理论的束缚,在肿瘤的情形下,b细胞已显示抑制抗肿瘤反应(例如,参见yuen等人,trends cancer,2016,2(12),第747-757页)。b细胞可以产生淋巴毒素,这种淋巴毒素
诱导血管生成,从而促进肿瘤生长。此外,肿瘤衍生的胞外囊泡可以活化b细胞,从而使得它们产生抗体,这种抗体能够与特异性抗原结合并形成循环免疫复合物。这些循环免疫复合物可继而活化骨髓细胞上的fcγ受体,诱导它们变成髓源性抑制细胞。这些髓源性抑制细胞可以通过抑制抗肿瘤cd4 和cd8 t细胞反应来促进肿瘤生长。另外,breg细胞也可分泌免疫调节细胞因子(包括tgfβ),诱导cd4 t细胞变成foxp3 cd4 t调节性(treg)细胞。breg细胞也可分泌il-10。il-10可抑制cd4 th1细胞、自然杀伤(nk)细胞和cd8 细胞毒性t细胞。
89.不受理论的束缚,在肿瘤的情形下,b细胞也显示积极地介导抗肿瘤反应。b细胞可以产生淋巴毒素。淋巴毒素可促进三级淋巴器官的形成,其与疾病结果和患者生存率呈正相关。此外,浆细胞产生的抗体可以促使抗肿瘤反应。例如,抗肿瘤抗体可以促进抗体和补体介导的肿瘤细胞杀伤,可以促进巨噬细胞的fc介导的吞噬作用,并且可以促进自然杀伤细胞的抗体依赖性细胞介导的细胞毒性(adcc)。另外,b细胞产生的抗体所包被的肿瘤细胞可以被树突细胞摄取和加工,树突细胞继而将肿瘤抗原呈递给cd4 t细胞并将抗原交叉呈递给cd8 t细胞。如果所呈递的肿瘤抗原含有mhc-i表位,则抗肿瘤cd8 t细胞可被活化并被运送到肿瘤部位,在该处它们将进行攻击并杀伤肿瘤细胞。最后,b细胞也可摄取和加工肿瘤抗原,从而允许b细胞将这些抗原呈递给cd4 t细胞。
90.ezh2抑制剂
91.本领域的普通技术人员将知晓可与本文所述的方法结合使用的合适的ezh2抑制剂。
92.在本公开的方法的一些实施方案中,ezh2抑制剂可包括式ig的化合物:
93.或其药学上可接受的盐或酯,
94.其中
95.r2、r4和r
12
各自独立地为c
1-6
烷基;
96.r6为c
6-c
10
芳基或5或6元杂芳基,它们各自任选地被一个或多个
–q2-t2取代,其中q2为键或任选地被卤素、氰基、羟基或c
1-c6烷氧基取代的c
1-c3烷基连接基,并且t2为h、卤素、氰基、-ora、-nrarb、-(nrarbrc)
a–
、-c(o)ra、-c(o)ora、-c(o)nrarb、-nrbc(o)ra、-nrbc(o)ora、-s(o)2ra、-s(o)2nrarb、或r
s2
,其中ra、rb和rc各自独立地为h或r
s3
,a
–
为药学上可接受的阴离子,r
s2
和r
s3
各自独立地为c
1-c6烷基、c
3-c8环烷基、c
6-c
10
芳基、4至12元杂环烷基、或5或6元杂芳基,或者ra和rb与它们所连接的n原子一起形成具有0或1个额外杂原子的4至12元杂
环烷基环,并且r
s2
、r
s3
、以及ra和rb所形成的4至12元杂环烷基环任选地被一个或多个
–q3-t3取代,其中q3为键或各自任选地被卤素、氰基、羟基或c
1-c6烷氧基取代的c
1-c3烷基连接基,并且t3选自卤素、氰基、c
1-c6烷基、c
3-c8环烷基、c
6-c
10
芳基、4至12元杂环烷基、5或6元杂芳基、ord、coord、-s(o)2rd、-nrdre和-c(o)nrdre,rd和re各自独立地为h或c
1-c6烷基,或者
–q3-t3为氧代基;或者任何两个相邻的-q
2-t2与它们所连接的原子一起形成5或6元环,该5或6元环任选地含有1-4个选自n、o和s的杂原子且任选地被一个或多个选自卤素、羟基、cooh、c(o)o-c
1-c6烷基、氰基、c
1-c6烷氧基、氨基、单-c
1-c6烷基氨基、二-c
1-c6烷基氨基、c
3-c8环烷基、c
6-c
10
芳基、4至12元杂环烷基以及5或6元杂芳基的取代基取代;
97.r7为-q
4-t4,其中q4为键、c
1-c4烷基连接基、或c
2-c4烯基连接基,每个连接基任选地被卤素、氰基、羟基或c
1-c6烷氧基取代,并且t4为h、卤素、氰基、nrfrg、-orf、-c(o)rf、-c(o)orf、-c(o)nrfrg、-c(o)nrforg、-nrfc(o)rg、-s(o)2rf、或r
s4
,其中rf和rg各自独立地为h或r
s5
,r
s4
和r
s5
各自独立地为c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、c
3-c8环烷基、c
6-c
10
芳基、4至12元杂环烷基、或5或6元杂芳基,并且r
s4
和r
s5
各自任选地被一个或多个-q
5-t5取代,其中q5为键、c(o)、c(o)nrk、nrkc(o)、s(o)2、或c
1-c3烷基连接基,rk为h或c
1-c6烷基,并且t5为h、卤素、c
1-c6烷基、羟基、氰基、c
1-c6烷氧基、氨基、单-c
1-c6烷基氨基、二-c
1-c6烷基氨基、c
3-c8环烷基、c
6-c
10
芳基、4至12元杂环烷基、5或6元杂芳基、或s(o)
qrq
,其中q为0、1、或2并且rq为c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、c
3-c8环烷基、c
6-c
10
芳基、4至12元杂环烷基、或5或6元杂芳基,并且t5任选地被一个或多个选自卤素、c
1-c6烷基、羟基、氰基、c
1-c6烷氧基、氨基、单-c
1-c6烷基氨基、二-c
1-c6烷基氨基、c
3-c8环烷基、c
6-c
10
芳基、4至12元杂环烷基以及5或6元杂芳基的取代基取代,除了当t5为h、卤素、羟基、或氰基时;或者
–q5-t5为氧代基;并且
98.r8为h、卤素、羟基、cooh、氰基、r
s6
、or
s6
、或coor
s6
,其中r
s6
为c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、c
3-c8环烷基、4至12元杂环烷基、氨基、单-c
1-c6烷基氨基、或二-c
1-c6烷基氨基,并且r
s6
任选地被一个或多个选自卤素、羟基、cooh、c(o)o-c
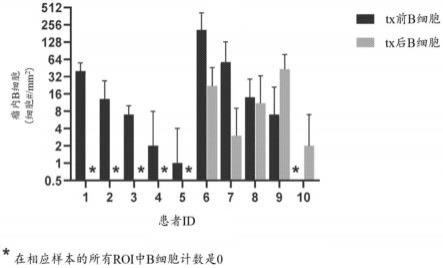
1-c6烷基、氰基、c
1-c6烷氧基、氨基、单-c
1-c6烷基氨基和二-c
1-c6烷基氨基的取代基取代;或者r7和r8与它们所连接的n原子一起形成具有0至2个额外杂原子的4至11元杂环烷基环,并且r7和r8所形成的4至11元杂环烷基环任选地被一个或多个-q
6-t6取代,其中q6为键、c(o)、c(o)nrm、nrmc(o)、s(o)2、或c
1-c3烷基连接基,rm为h或c
1-c6烷基,并且t6为h、卤素、c
1-c6烷基、羟基、氰基、c
1-c6烷氧基、氨基、单-c
1-c6烷基氨基、二-c
1-c6烷基氨基、c
3-c8环烷基、c
6-c
10
芳基、4至12元杂环烷基、5或6元杂芳基、或s(o)
prp
,其中p为0、1、或2,并且r
p
为c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、c
3-c8环烷基、c
6-c
10
芳基、4至12元杂环烷基、或5或6元杂芳基,并且t6任选地被一个或多个选自卤素、c
1-c6烷基、羟基、氰基、c
1-c6烷氧基、氨基、单-c
1-c6烷基氨基、二-c
1-c6烷基氨基、c
3-c8环烷基、c
6-c
10
芳基、4至12元杂环烷基以及5或6元杂芳基的取代基取代,除了当t6为h、卤素、羟基、或氰基时;或者-q
6-t6为氧代基。
99.在本公开的方法的一些实施方案中,ezh2抑制剂可包括他泽司他(epz-6438):
[0100][0101]
或其药学上可接受的盐。在一些实施方案中,药学上可接受的盐是他泽司他的氢溴酸盐。在一些实施方案中,药学上可接受的盐是他泽司他的单氢溴酸盐。在一些实施方案中,他泽司他在吗啉代取代基的氮处被质子化,提供具有以下结构的他泽司他的单氢溴酸盐:
[0102][0103]
他泽司他还描述于美国专利no.8,410,088、8,765,732和9,090,562中(它们的内容各自全文以引用方式并入本文)。
[0104]
在本公开的方法的一些实施方案中,ezh2抑制剂可为本领域已知和理解的任何ezh2抑制剂。在一些实施方案中,ezh2抑制剂可为us专利no.8,536,179中所述的ezh2抑制剂(描述gsk-126以及其他化合物并且对应于wo 2011/140324),它们的全部内容各自以引用方式并入本文。
[0105]
在一些实施方案中,ezh2抑制剂可为us专利no.8,598,167(对应于wo2012/118812)、us专利no.9,376,422(对应于wo2012/142513)、pct申请公开no.wo2014/062732、us专利申请公开no.2015-0344427(对应于wo2014/100646)、us专利no.9,701,666(对应于wo2014/100665)或us专利no.10,092,572(对应于wo2014/062733)中所述的任何ezh2抑制剂,它们的全部内容各自以引用方式并入本文。
[0106]
在本文所提供的策略、治疗模式、方法、组合以及组合物的一些实施方案中,ezh2抑制剂是pct/us2014/015706(公开为wo 2014/124418)、pct/us2013/025639(公开为wo 2013/120104)和us 14/839,273(公开为us 2015/0368229)中所述的ezh2抑制剂,它们的全
部内容各自以引用方式并入本文。
[0107]
在一些方面,ezh2抑制剂是化合物本身,即游离碱或“裸”分子。在一些方面,ezh2抑制剂是其盐,例如药学上可接受的盐,例如,裸分子的单hcl、二hcl或三hcl盐、单hbr或三hbr盐。基于本公开和本领域的知识,本文所提供的化合物的药学上可接受的盐对于本领域的技术人员将是显而易见的。本公开在这方面不受限制。
[0108]
在一些方面,ezh2抑制剂抑制h3-k27me2向h3-k27me3转化。在一些实施方案中,该抑制剂据说抑制h3-k27的三甲基化。由于h3-k27me1向h3-k27me2的转化先于h3-k27me2向h3-k27me3的转化,h3-k27me1向h3-k27me2转化的抑制剂自然也抑制h3-k27me2向h3-k27me3的转化,即,其抑制h3-k27的三甲基化。还可以抑制h3-k27me2向h3-k27me3的转化,而不抑制h3-k27me1向h3-k27me2的转化。这种类型的抑制还将导致抑制h3-k27的三甲基化,尽管不抑制h3-k27的二甲基化。
[0109]
在一些方面,ezh2抑制剂抑制h3-k27me1向h3-k27me2的转化和h3-k27me2向h3-k27me3的转化。这种抑制剂可以直接单独地抑制h3-k27me1向h3-k27me2的转化。或者,这种抑制剂可以直接抑制h3-k27me1向h3-k27me2的转化和h3-k27me2向h3-k27me3的转化两者。
[0110]
在一些方面,ezh2抑制剂抑制组蛋白甲基转移酶活性。组蛋白甲基转移酶活性的抑制可以使用任何合适的方法进行检测。例如,抑制可以根据组蛋白甲基转移酶活性率或作为组蛋白甲基转移酶活性的产物进行测量。
[0111]
抑制是与合适的对照相比可测量的抑制。在一些实施方案中,抑制是与合适的对照相比至少10%抑制。即,酶活性率或采用抑制剂的产物的量小于或等于不采用抑制剂得到的相应比率或量的90%。在各种其它实施方案中,抑制是与合适的对照相比至少20、25、30、40、50、60、70、75、80、90、或95%抑制。在一些实施方案中,抑制是与合适的对照相比至少99%抑制。即,酶活性率或采用抑制剂的产物的量小于或等于不采用抑制剂得到的相应比率或量的1%。
[0112]
在本公开的方法的一些方面中,ezh2抑制剂可以作为药物组合物的一部分给药,该药物组合物包含至少一种ezh2抑制剂与至少一种药学上可接受的赋形剂或载体的组合。
[0113]“药物组合物”是呈适于向受试者给药的形式的含有ezh2抑制剂的制剂。在一些实施方案中,药物组合物为散装或单位剂型。单位剂型是多种形式中的任一种,包括例如胶囊剂、iv袋、片剂、气雾剂吸入器上的单个泵或小瓶。组合物的单位剂量中的活性成分(例如,所公开的化合物或其盐、水合物、溶剂化物或异构体的制剂)的量是有效量,并且根据所涉及的具体治疗而变化。本领域的技术人员将理解,有时需要取决于患者的年龄和病症对剂量作出常规变化。剂量还将取决于给药途径。设想了多种途径,包括口服、肺部、直肠、肠胃外、经皮、皮下、静脉内、肌内、腹膜内、吸入、含服、舌下、胸膜内、鞘内、鼻内等。用于局部或经皮给药本公开的化合物的剂型包括散剂、喷剂、软膏剂、糊剂、霜剂、洗剂、凝胶剂、溶液剂、贴剂和吸入剂。在一些实施方案中,活性化合物在无菌条件下与药学上可接受的载体和所需要的任何防腐剂、缓冲剂或抛射剂进行混合。
[0114]
如本文所用,短语“药学上可接受的”是指在合理的医学判断范围内适用于与人类和动物的组织接触而无过度毒性、刺激、过敏反应、或其它问题或并发症,与合理的效/险比相称的那些化合物、阴离子、阳离子、材料、组合物、载体和/或剂型。
[0115]“药学上可接受的赋形剂”意指可用于制备药物组合物的赋形剂,其通常是安全
的、无毒的并且既不是生物学上也不是其他方面不期望的,并且包括对于兽医用途以及人类药物用途可接受的赋形剂。如本说明书和权利要求书中所用,“药学上可接受的赋形剂”包括一种以及多于一种这样的赋形剂两者。
[0116]
药物组合物可被配制为与其预期的给药途径相容。给药途径的实例包括肠胃外,例如静脉内、皮内、皮下、口服(例如吸入)、经皮(局部)和经粘膜给药。用于肠胃外、皮内、或皮下施用的溶液剂或混悬剂可以包括以下组分:无菌稀释剂如注射用水、盐水溶液、固定油、聚乙二醇、甘油、丙二醇或其它合成溶剂;抗菌剂,如苄醇或对羟基苯甲酸甲酯;抗氧化剂,如抗坏血酸或亚硫酸氢钠;螯合剂,如乙二胺四乙酸;缓冲剂如乙酸盐、柠檬酸盐或磷酸盐以及用于调节张性的试剂如氯化钠或右旋糖。ph可以用酸或碱(如盐酸或氢氧化钠)进行调节。肠胃外制剂可以封装在由玻璃或塑料制成的安瓿、一次性注射器或多剂量小瓶中。
[0117]
在一些方面,ezh2抑制剂能够以目前用于化疗治疗的许多公知方法给药于受试者。例如,为了治疗癌症,可以将化合物直接注射到肿瘤中,注射到血流或体腔中,或者口服或者用贴剂通过皮肤施用。所选择的剂量应当足以构成有效治疗,但不会高到引起不可接受的副作用。病症(例如,癌症、癌前等)的状态以及患者的健康状态应当优选地在治疗期间和治疗后的合理时间段内密切监测。
[0118]
如本文所用,术语“治疗有效量”是指治疗、改善、或预防所鉴定的疾病或病症,或者表现出可检测的治疗或抑制效应的药剂的量。该效应可以通过本领域已知的任何测定方法进行检测。受试者的精确有效量将取决于受试者的体重、体型和健康状态;病症的性质和程度;以及选择用于给药的治疗剂或治疗剂组合。针对给定情况的治疗有效量可以通过临床医师的技能和判断范围内的常规实验进行确定。在一些方面,待治疗的疾病或病症是癌症。在其它方面,待治疗的疾病或病症是细胞增殖性障碍。
[0119]
在其中ezh2抑制剂是他泽司他的本公开的方法的一些方面,可将他泽司他口服给药于受试者。在一些方面,可以将他泽司他每天口服给药于受试者两次。在一些方面,他泽司他的治疗有效量可为约800mg,每天给药两次。
[0120]
对于任何化合物,治疗有效量可初始在例如肿瘤细胞的细胞培养测定中或在动物模型(通常为大鼠、小鼠、兔、狗、或猪)中估计。动物模型也可用于确定适当的浓度范围和给药途径。这样的信息然后可用于确定在人体内给药的有用剂量和途径。治疗/预防功效和毒性例如ed
50
(50%群体中治疗有效的剂量)和ld
50
(50%群体致死的剂量)可以通过标准药学程序在细胞培养物或实验动物中进行测定。毒性与治疗效应之间的剂量比是治疗指数,并且它可表示为比率ld
50
/ed
50
。表现出较大治疗指数的药物组合物是优选的。剂量可以在该范围内变化,这取决于所采用的剂型、患者的敏感性和给药途径。
[0121]
剂量和给药被调整成提供足够水平的一种或多种活性剂或者维持期望的效应。可纳入考虑的因素包括疾病状态的严重程度、受试者的一般健康状态、受试者的年龄、体重和性别、饮食、给药时间和频率、药物组合、反应敏感性和对疗法的耐受性/反应。长效药物组合物可以每3至4天、每周、或每两周一次给药,这取决于特定制剂的半衰期和清除率。
[0122]
如本文所用,“药学上可接受的盐”是指本公开的化合物的衍生物,其中通过制备其酸或碱盐对母体化合物改性。药学上可接受的盐的实例包括但不限于碱性残基(如胺)的矿物或有机酸盐、酸性残基(如羧酸)的碱性盐或有机盐等。药学上可接受的盐包括例如由无毒的无机或有机酸形成的母体化合物的常规无毒盐或季铵盐。例如,这样的常规无毒盐
包括但不限于从选自以下的无机和有机酸衍生的那些:2-乙酰氧基苯甲酸、2-羟基乙烷磺酸、乙酸、抗坏血酸、苯磺酸、苯甲酸、碳酸氢式酸(bicarbonic)、碳酸、柠檬酸、乙二胺四乙酸、乙烷二磺酸、1,2-乙烷磺酸、富马酸、葡萄庚酸、葡萄糖酸、谷氨酸、乙醇酸、乙二醇氨苯胂酸、己基间苯二酚酸(hexylresorcinic)、海巴酸(hydrabamic)、氢溴酸、盐酸、氢碘酸、羟基马来酸、羟基萘甲酸、羟乙磺酸、乳酸、乳糖酸、月桂基磺酸、马来酸、苹果酸、扁桃酸、甲烷磺酸、萘磺酸(napsylic)、硝酸、草酸、扑酸、泛酸、苯乙酸、磷酸、聚半乳糖醛酸、丙酸、水杨酸、硬脂酸、次乙酸(subacetic)、琥珀酸、对氨基磺酸、磺胺酸、硫酸、单宁酸、酒石酸、甲苯磺酸,以及常见的氨基酸,例如甘氨酸、丙氨酸、苯丙氨酸、精氨酸等。
[0123]
药学上可接受的盐的其它实例包括己酸、环戊烷丙酸、丙酮酸、丙二酸、3-(4-羟基苯甲酰基)苯甲酸、肉桂酸、4-氯苯磺酸、2-萘磺酸、4-甲苯磺酸、樟脑磺酸、4-甲基二环-[2.2.2]-辛-2-烯-1-甲酸、3-苯基丙酸、三甲基乙酸、叔丁基乙酸、粘康酸等。本公开还涵盖了当母体化合物中存在的酸性质子被金属离子例如碱金属离子、碱土金属离子、或铝离子替代;或者与有机碱如乙醇胺、二乙醇胺、三乙醇胺、氨丁三醇、n-甲基葡糖胺等配位时形成的盐。
[0124]
应当理解,所有提及的药学上可接受的盐包括相同盐的溶剂加成形式(溶剂化物)。
[0125]
在一些方面,ezh2抑制剂或其药学上可接受的盐或溶剂化物可以口服、经鼻、经皮、肺部、吸入、含服、舌下、腹膜内、皮下、肌内、静脉内、直肠、胸膜内、鞘内和肠胃外给药。在一些实施方案中,化合物口服给药。本领域的技术人员将认识到某些给药途径的优点。
[0126]
在本公开的方法的一些方面,受试者患有癌症。“受试者”包括哺乳动物。哺乳动物可为例如任何哺乳动物,例如人、灵长类、鸟、小鼠、大鼠、家禽、狗、猫、牛、马、山羊、骆驼、绵羊或猪。在一些实施方案中,哺乳动物是人类。
[0127]
在本公开的方法的一些实施方案中,癌症可为间皮瘤、前列腺癌、雄激素抗性前列腺癌、软组织肉瘤、上皮样肉瘤、上皮细胞癌、结肠直肠癌、肝细胞癌、乳腺癌、导管原位癌、非小细胞肺癌、皮肤黑素瘤、卵巢癌、腺样囊性肉瘤(acc)、结肠腺癌(coad)、肾透明细胞癌(kirc)、肾乳头状细胞癌(kirp)、低级别胶质瘤(lgg)、葡萄膜黑素瘤(uvm)、肾嫌色细胞癌(kich)和胰腺癌(paad)。在一些方面,癌症可为间皮瘤。在一些实施方案中,间皮瘤可为复发性/难治性(r/r)间皮瘤。在一些实施方案中,间皮瘤可为上皮样间皮瘤。在一些实施方案中,间皮瘤可为双相性间皮瘤。在一些实施方案中,间皮瘤可为肉瘤样间皮瘤。
[0128]
在一些方面,受试者可患有复发性/难治性或抗性癌症。“复发性/难治性或抗性癌症”意指对治疗无反应的癌症。癌症可在治疗开始时有抗性,或者其可在治疗期间变得有抗性。在一些实施方案中,对其有需要的受试者在最近的疗法缓解后癌症复发。在一些实施方案中,对其有需要的受试者接受了所有已知有效的癌症治疗疗法并且均无效。在一些实施方案中,对其有需要的受试者接受了至少一种既往疗法。在某些实施方案中,既往疗法是单一疗法。在某些实施方案中,既往疗法是组合疗法。
[0129]
在一些方面,对其有需要的受试者可能由于先前疗法而患有继发性癌症。“继发性癌症”意指由于先前致癌疗法(如化学疗法)而产生或引起的癌症。
[0130]
在一些方面,受试者还可表现出对ezh2组蛋白甲基转移酶抑制剂或任何其它治疗剂的抗性。
[0131]
如本文所用,术语“反应性”可与术语“反应的”、“敏感的”和“敏感性”互换,并且其意指当给药组合物或疗法时,受试者显示治疗反应,例如,受试者的肿瘤细胞或肿瘤组织经历细胞凋亡和/或坏死,并且/或者展示减少的生长、分裂、或增殖。该术语还意指当给药组合物或疗法时,受试者将会或者具有相对于大范围群体更高的显示治疗反应的可能性,例如,受试者的肿瘤细胞或肿瘤组织经历凋亡和/或坏死,并且/或者展示减少的生长、分裂、或增殖。
[0132]
在一些方面,“样本”可为源于受试者的任何生物样本,并且包括但不限于细胞、组织样本、体液(包括但不限于粘液、血液、血浆、血清、尿液、唾液和精液)、肿瘤细胞和肿瘤组织。在一些实施方案中,样本选自骨髓、外周血细胞、血液、血浆和血清。样本可由接受治疗或测试的受试者提供。或者,样本可由医师根据本领域的常规实践获得。
[0133]
如本文所用,“正常细胞”是不能被分类为“细胞增殖性障碍”的一部分的细胞。正常细胞缺乏不受调节或异常的生长、或这两者,这些可导致不希望的病症或疾病的发展。在一些实施方案中,正常细胞具有正常功能的细胞周期检查点控制机制。
[0134]
如本文所用,“接触细胞”是指其中化合物或其它物质组合物与细胞直接接触,或者接近到足以在细胞中诱导期望的生物效应的状况。
[0135]
如本文所用,“治疗(treating)”或“治疗(treat)”描述了出于对抗疾病、病症、或障碍的目的而对患者进行管理和护理,并且包括根据本公开的方法给药疗法,以缓解疾病、病症或障碍的症状或并发症,或者消除疾病、病症或障碍。
[0136]
本公开的方法还可用于预防疾病、病症或障碍。如本文所用,“预防(preventing)”或“预防(prevent)”描述了减少或消除疾病、病症或障碍的症状或并发症的发作。
[0137]
如本文所用,术语“缓解”意在描述障碍的体征或症状的严重程度降低的过程。重要地,体征或症状可缓解而无需消除。在一些实施方案中,药物组合物的给药导致体征或症状的消除,然而,不需要消除。预期有效剂量会降低体征或症状的严重程度。例如,如果癌症的严重程度在多个位置中的至少一者内降低,则可在多个位置中发生的障碍(如癌症)的体征或症状得到缓解。
[0138]“癌细胞”或“癌性细胞”是表现为细胞增殖性障碍(即癌症)的细胞。任何可再现的测量手段均可用于鉴定癌细胞或癌前细胞。癌细胞或癌前细胞可通过组织样本(例如活检样本)的组织学分型或分级进行鉴定。癌细胞或癌前细胞可通过使用适当的分子标记进行鉴定。
[0139]
治疗癌症可导致肿瘤尺寸减小。肿瘤尺寸减小也可称为“肿瘤消退”。在一些实施方案中,在治疗后,肿瘤尺寸相对于其治疗前尺寸减小5%或更多;在一些实施方案中,肿瘤尺寸减小10%或更多;减小20%或更多;减小30%或更多;减小40%或更多;减小50%或更多;或减小75%或更多。肿瘤的尺寸可以通过任何可再现的测量手段进行测量。肿瘤的尺寸可测量为肿瘤的直径。
[0140]
治疗癌症可导致肿瘤体积减小。在一些实施方案中,在治疗后,肿瘤体积相对于其治疗前尺寸减小5%或更多;在一些实施方案中,肿瘤体积减小10%或更多;减小20%或更多;减小30%或更多;减小40%或更多;甚至减小50%或更多;并且最优选地,减小大于75%或更多。肿瘤体积可通过任何可再现的测量手段进行测量。
[0141]
治疗癌症导致肿瘤数目减少。在一些实施方案中,在治疗后,肿瘤数目相对于治疗
前数目减少5%或更多;在一些实施方案中,肿瘤数目减少10%或更多;减少20%或更多;减少30%或更多;减少40%或更多;甚至减少50%或更多;并且最优选地,减少大于75%。肿瘤数目可通过任何可再现的测量手段进行测量。肿瘤的数目可以通过计数肉眼可见的肿瘤或者在指定的放大倍数下进行测量。在一些实施方案中,指定放大倍数是2x、3x、4x、5x、10x、或50x。
[0142]
治疗癌症可导致远离原发性肿瘤部位的其它组织或器官中的转移病灶的数目减少。在一些实施方案中,在治疗后,转移病灶的数目相对于治疗前数目减少5%或更多;在一些实施方案中,转移病灶的数目减少10%或更多;减少20%或更多;减少30%或更多;减少40%或更多;减少50%或更多;并且最优选地,减少大于75%。转移病灶的数目可通过任何可再现的测量手段进行测量。转移病灶的数目可以通过计数肉眼可见的转移病灶或者在指定的放大倍数下进行测量。在一些实施方案中,指定放大倍数是2x、3x、4x、5x、10x、或50x。
[0143]
与仅接受载体的群体相比,治疗癌症可导致受治疗受试者群体的平均生存时间增加。在一些实施方案中,平均生存时间增加超过30天;超过60天;超过90天;并且最优选地超过120天。群体的平均生存时间的增加可以通过任何可再现的手段进行测量。群体的平均生存时间的增加可以例如通过计算群体在开始用活性化合物治疗后的平均生存时间长度进行测量。群体的平均生存时间的增加还可以例如通过计算群体在用活性化合物完成第一轮治疗后的平均生存时间长度进行测量。
[0144]
与未治疗的受试者群体相比,治疗癌症可导致受治疗受试者群体的平均生存时间增加。在一些实施方案中,平均生存时间增加超过30天;超过60天;超过90天;并且最优选地超过120天。群体的平均生存时间的增加可以通过任何可再现的手段进行测量。群体的平均生存时间的增加可以例如通过计算群体在开始用活性化合物治疗后的平均生存时间长度进行测量。群体的平均生存时间的增加还可以例如通过计算群体在用活性化合物完成第一轮治疗后的平均生存时间长度进行测量。
[0145]
与接受不是本公开的化合物、或其药学上可接受的盐、溶剂化物、类似物或衍生物的药物的单一疗法的群体相比,治疗癌症可导致受治疗受试者群体的平均生存时间增加。在一些实施方案中,平均生存时间增加超过30天;超过60天;超过90天;并且最优选地超过120天。群体的平均生存时间的增加可以通过任何可再现的手段进行测量。群体的平均生存时间的增加可以例如通过计算群体在开始用活性化合物治疗后的平均生存时间长度进行测量。群体的平均生存时间的增加还可以例如通过计算群体在用活性化合物完成第一轮治疗后的平均生存时间长度进行测量。
[0146]
与仅接受载体的群体相比,治疗癌症可导致受治疗受试者群体的死亡率降低。与未治疗的群体相比,治疗癌症可导致受治疗受试者群体的死亡率降低。与接受不是本公开的化合物、或其药学上可接受的盐、溶剂化物、类似物或衍生物的药物的单一疗法的群体相比,治疗癌症可导致受治疗受试者群体的死亡率降低。在一些实施方案中,死亡率降低超过2%;超过5%;超过10%;并且最优选地超过25%。受治疗的受试者群体的死亡率的降低可以通过任何可再现的手段进行测量。群体死亡率的降低可以例如通过计算群体在开始用活性化合物治疗后每单位时间的疾病相关死亡的平均数目进行测量。群体死亡率的降低还可以例如通过计算群体在用活性化合物完成第一轮治疗后每单位时间的疾病相关死亡的平均数目进行测量。
[0147]
治疗癌症可导致肿瘤生长速率降低。在一些实施方案中,在治疗后,肿瘤生长速率相对于治疗前的数值降低至少5%;在一些实施方案中,肿瘤生长速率降低至少10%;降低至少20%;降低至少30%;降低至少40%;降低至少50%;降低至少50%;并且最优选地降低至少75%。肿瘤生长速率可通过任何可再现的测量手段进行测量。肿瘤生长速率可以根据每单位时间肿瘤直径的变化进行测量。
[0148]
治疗癌症可导致肿瘤再生长的减少。在一些实施方案中,在治疗后,肿瘤再生长小于5%;在一些实施方案中,肿瘤再生长小于10%;小于20%;小于30%;小于40%;小于50%;小于50%;并且最优选地小于75%。肿瘤再生长可通过任何可再现的测量手段进行测量。例如,肿瘤再生长通过测量先前肿瘤治疗后的收缩之后肿瘤直径的增加进行测量。肿瘤再生长的减少通过在治疗停止后肿瘤不能再出现来指示。
[0149]
治疗或预防细胞增殖性障碍可导致细胞增殖速率降低。在一些实施方案中,在治疗后,细胞增殖速率降低至少5%;至少10%;至少20%;至少30%;至少40%;至少50%;甚至至少50%;并且最优选地至少75%。细胞增殖速率可通过任何可再现的测量手段进行测量。细胞增殖速率例如通过测量每单位时间组织样本中分裂细胞的数目进行测量。
[0150]
治疗或预防细胞增殖性障碍可导致增殖细胞的比例降低。在一些实施方案中,在治疗后,增殖细胞的比例降低至少5%;至少10%;至少20%;至少30%;至少40%;至少50%;至少50%;并且最优选地至少75%。增殖细胞的比例可通过任何可再现的测量手段进行测量。在一些实施方案中,增殖细胞的比例例如通过相对于未分裂细胞的数目来定量组织样本中分裂细胞的数目进行测量。
[0151]
增殖细胞的比例可等同于有丝分裂指数。
[0152]
治疗或预防细胞增殖性障碍可导致细胞增殖区域或区的尺寸减小。在一些实施方案中,在治疗后,细胞增殖的区域或区的尺寸相对于其治疗前的尺寸减小至少5%;减小至少10%;减小至少20%;减小至少30%;减小至少40%;减小至少50%;减小至少50%;并且最优选地减小至少75%。细胞增殖的区域或区的尺寸可通过任何可再现的测量手段进行测量。细胞增殖区域或区的尺寸可测量为细胞增殖区域或区的直径或宽度。
[0153]
治疗或预防细胞增殖性障碍可导致增殖细胞(例如恶性细胞)的生存或活力降低。在一些实施方案中,在治疗后,增殖细胞的生存或活力相对于治疗前的生存率或活力降低至少5%;降低至少10%;降低至少20%;降低至少30%;降低至少40%;降低至少50%;降低至少50%;和降低至少75%、降低至少80%、降低至少90%、降低至少95%、降低至少99%。增殖细胞的生存率或活力可通过任何可再现的测量手段进行测量。本文描述了用于测量细胞活力、生存和增殖率的一些示例性的合适测定,并且基于本公开和本领域的知识,额外合适的测定对于技术人员将是显而易见的。在一些示例性实施方案中,增殖细胞的生存率例如通过相对于细胞的初始数目来定量特定治疗时间后剩余细胞的数目进行测量。在一些实施方案中,细胞活力例如在体外细胞活力测定中进行测量。
[0154]
治疗或预防细胞增殖性障碍可导致具有异常外观或形态的细胞的数目或比例减少。在一些实施方案中,在治疗后,具有异常形态的细胞的数目相对于其治疗前的大小减少至少5%;减少至少10%;减少至少20%;减少至少30%;减少至少40%;减少至少50%;减少至少50%;并且最优选地减少至少75%。异常细胞外观或形态可通过任何可再现的测量手段进行测量。异常细胞形态可通过显微术进行测量,例如使用倒置组织培养显微镜。异常细
胞形态可表现为核多型性的形式。
[0155]
示例性实施方案
[0156]
实施方案1.一种治疗受试者中的癌症的方法,其包括向所述受试者给药至少一种治疗有效量的zeste同源物增强子(ezh2)的抑制剂,其中所述癌症以至少一种包含瘤内b细胞和/或基质b细胞的肿瘤为特征。
[0157]
实施方案2.根据实施方案1所述的方法,其中所述癌症选自间皮瘤、前列腺癌、雄激素抗性前列腺癌、软组织肉瘤、上皮样肉瘤、上皮细胞癌、结肠直肠癌、肝细胞癌、乳腺癌、导管原位癌、非小细胞肺癌、皮肤黑素瘤、卵巢癌、腺样囊性肉瘤(acc)、结肠腺癌(coad)、肾透明细胞癌(kirc)、肾乳头状细胞癌(kirp)、低级别胶质瘤(lgg)、葡萄膜黑素瘤(uvm)、肾嫌色细胞癌(kich)和胰腺癌(paad)。
[0158]
实施方案3.一种在受试者中减少至少一种肿瘤中的b细胞的数目和/或密度的方法,所述方法包括向所述受试者给药至少一种治疗有效量的ezh2抑制剂。
[0159]
实施方案4.根据实施方案3所述的方法,其中所述b细胞包含瘤内b细胞。
[0160]
实施方案5.根据实施方案3或实施方案4所述的方法,其中所述b细胞包含基质b细胞。
[0161]
实施方案6.根据实施方案3-5中任一项所述的方法,其中与给药所述至少一种治疗有效量的ezh2抑制剂之前相比,所述至少一种肿瘤中的b细胞的数目和/或密度减少至少约10%、或至少约25%、或至少约50%、或至少约75%、或至少约99%。
[0162]
实施方案7.一种鉴定用ezh2抑制剂进行治疗的患有癌症的受试者的方法,所述方法包括:
[0163]
a)确定来自所述受试者的肿瘤样本是否含有瘤内b细胞和/或基质b细胞;以及
[0164]
b)当所述肿瘤样本含有瘤内b细胞和/或基质b细胞时,鉴定出用ezh2抑制剂进行治疗的受试者。
[0165]
实施方案8.一种治疗患有癌症的受试者的方法,所述方法包括:
[0166]
a)确定来自所述受试者的肿瘤样本是否含有瘤内b细胞和/或基质b细胞;以及
[0167]
b)当所述肿瘤样本含有瘤内b细胞和/或基质b细胞时,向所述受试者给药至少一种治疗有效量的ezh2抑制剂。
[0168]
实施方案9.一种鉴定用ezh2抑制剂进行治疗的患有癌症的受试者的方法,所述方法包括:
[0169]
a)确定来自所述受试者的肿瘤样本中的瘤内b细胞和/或基质b细胞的水平;
[0170]
b)将步骤(a)中所确定的瘤内b细胞和/或基质b细胞的水平与预定截断水平进行比较;以及
[0171]
c)当步骤(a)中确定的瘤内b细胞和/或基质b细胞的所述水平大于所述预定截断水平时,鉴定出用ezh2抑制剂进行治疗的受试者。
[0172]
实施方案10.一种治疗患有癌症的受试者的方法,所述方法包括:
[0173]
a)确定来自所述受试者的肿瘤样本中的瘤内b细胞和/或基质b细胞的水平;
[0174]
b)将步骤(a)中所确定的瘤内b细胞和/或基质b细胞的水平与预定截断水平进行比较;以及
[0175]
c)当步骤(a)中确定的瘤内b细胞和/或基质b细胞的所述水平大于所述预定截断
水平时,向所述受试者给药至少一种治疗有效量的ezh2抑制剂。
[0176]
实施方案11.一种确定患有癌症的受试者对至少一种疗法的反应的方法,
[0177]
其中所述至少一种疗法包括给药ezh2抑制剂,所述方法包括:
[0178]
a)确定在第一时间点从所述受试者收集的肿瘤样本中的瘤内b细胞和/或基质b细胞的第一水平,其中所述第一时间点在给药所述至少一种疗法之前;
[0179]
b)确定在第二时间点从所述受试者收集的肿瘤样本中的瘤内b细胞和/或基质b细胞的第二水平,其中所述第二时间点在给药所述至少一种疗法之后;
[0180]
c)将瘤内b细胞和/或基质b细胞的所述第二水平与瘤内b细胞和/或基质b细胞的所述第一水平进行比较;以及
[0181]
d)当瘤内b细胞和/或基质b细胞的所述第二水平低于瘤内b细胞和/或基质b细胞的所述第一水平时,确定所述受试者对所述至少一种疗法有反应。
[0182]
实施方案12.一种确定患有癌症的受试者对至少一种疗法的反应的方法,其中所述至少一种疗法包括给药ezh2抑制剂,所述方法包括:
[0183]
a)确定在第一时间点从所述受试者收集的肿瘤样本中的瘤内b细胞和/或基质b细胞的第一水平,其中所述第一时间点在给药所述至少一种疗法之前;
[0184]
b)确定在第二时间点从所述受试者收集的肿瘤样本中的瘤内b细胞和/或基质b细胞的第二水平,其中所述第二时间点在给药所述至少一种疗法之后;
[0185]
c)将瘤内b细胞和/或基质b细胞的所述第二水平与瘤内b细胞和/或基质b细胞的所述第一水平进行比较;以及
[0186]
d)当瘤内b细胞和/或基质b细胞的所述第二水平为瘤内b细胞和/或基质b细胞的所述第一水平的不超过75%时,确定所述受试者对所述至少一种疗法有反应。
[0187]
实施方案13.根据实施方案12所述的方法,其中步骤(d)包括当瘤内b细胞和/或基质b细胞的所述第二水平为瘤内b细胞和/或基质b细胞的所述第一水平的不超过50%、或不超过25%、或不超过10%时,确定所述受试者对所述至少一种疗法有反应。
[0188]
实施方案14.一种治疗受试者中的癌症的方法,所述方法包括:
[0189]
a)确定在第一时间点从所述受试者收集的肿瘤样本中的瘤内b细胞和/或基质b细胞的第一水平,
[0190]
其中所述第一时间点在给药至少一种治疗有效量的ezh2抑制剂之前;
[0191]
b)确定在第二时间点从所述受试者收集的肿瘤样本中的瘤内b细胞和/或基质b细胞的第二水平,
[0192]
其中所述第二时间点在给药至少一种治疗有效量的ezh2抑制剂之后;
[0193]
c)将瘤内b细胞和/或基质b细胞的所述第二水平与瘤内b细胞的所述第一水平进行比较;以及
[0194]
d)当瘤内b细胞和/或基质b细胞的所述第二水平低于瘤内b细胞的所述第一水平时,向所述受试者给药至少一种额外的治疗有效量的ezh2抑制剂,或者
[0195]
当瘤内b细胞和/或基质b细胞的第二表达水平大于或等于瘤内b细胞和/或基质b细胞的第一水平时,向所述受试者给药至少一种替代疗法。
[0196]
实施方案15.一种治疗受试者中的癌症的方法,所述方法包括:
[0197]
a)确定在第一时间点从所述受试者收集的肿瘤样本中的瘤内b细胞和/或基质b细
胞的第一水平,
[0198]
其中所述第一时间点在给药至少一种治疗有效量的ezh2抑制剂之前;
[0199]
b)确定在第二时间点从所述受试者收集的肿瘤样本中的瘤内b细胞和/或基质b细胞的第二水平,
[0200]
其中所述第二时间点在给药至少一种治疗有效量的ezh2抑制剂之后;
[0201]
c)将瘤内b细胞和/或基质b细胞的所述第二水平与瘤内b细胞的所述第一水平进行比较;以及
[0202]
d)当瘤内b细胞和/或基质b细胞的所述第二水平为瘤内b细胞和/或基质b细胞的所述第一水平的不超过75%时,向所述受试者给药至少一种额外的治疗有效量的ezh2抑制剂,或者
[0203]
当瘤内b细胞和/或基质b细胞的所述第二表达水平为瘤内b细胞和/或基质b细胞的所述第一水平的大于75%时,向所述受试者给药至少一种替代疗法。
[0204]
实施方案16.根据实施方案15所述的方法,其中步骤(d)包括当瘤内b细胞和/或基质b细胞的所述第二水平为瘤内b细胞和/或基质b细胞的所述第一水平的不超过50%、或不超过25%、或不超过10%时,向所述受试者给药至少一种额外的治疗有效量的ezh2抑制剂,或者当瘤内b细胞和/或基质b细胞的所述第二表达水平为瘤内b细胞和/或基质b细胞的所述第一水平的大于50%、或大于25%、或大于10%时,向所述受试者给药至少一种替代疗法。
[0205]
实施方案17.根据前述实施方案中任一项所述的方法,其中所述ezh2抑制剂是
[0206][0207]
或其药学上可接受的盐。
[0208]
实施方案18.根据前述实施方案中任一项所述的方法,其中瘤内b细胞和/或基质b细胞的所述水平是固定体积的所述肿瘤样本内的瘤内b细胞和/或基质b细胞的数目。
[0209]
实施方案19.根据前述实施方案中任一项所述的方法,其中瘤内b细胞和/或基质b细胞的所述水平是所述肿瘤样本内的瘤内b细胞和/或基质b细胞的密度。
[0210]
实施方案20.根据前述实施方案中任一项所述的方法,其中确定肿瘤样本中的瘤内b细胞和/或基质b细胞的水平包括对所述肿瘤样本执行免疫荧光分析。
[0211]
实施方案21.根据实施方案20所述的方法,其中所述免疫荧光分析包括用特异性结合至少一种b细胞特异性细胞标记的荧光标记抗体对所述样本进行染色。
[0212]
实施方案22.根据实施方案21所述的方法,其中所述细胞标记选自:iga、ige、igd、igm、igg、cd1、cd1c、cd1d、cd5、cd10、cd19、cd20、cd21、cd22、cd23、cd24、cd25、cd27、cd30、cd38、cd40、cd72、cd78、cd79、cd80、cd93、cd95、cd138、cd148、cd319、il-6、pdl-2、cxcr3、cxcr4、cxcr5、cxcr6、notch2、tlr4、il-10、hla-dr、taci、pax5、fcrl3、b7-1、b7-2、ebf-1、e2a、oct2、pax5、obf1、spi-b、bcma、blimp1、irf4、xbp1和tgfβ。
[0213]
实施方案23.根据实施方案22所述的方法,其中所述细胞标记是cd20。
[0214]
实施方案24.根据前述实施方案中任一项所述的方法,其中确定瘤内b细胞的水平包括确定至少一种b细胞特异性基因的表达水平。
[0215]
实施方案25.根据前述实施方案中任一项所述的方法,其中确定瘤内b细胞的水平包括确定多种b细胞特异性基因的表达水平。
[0216]
实施方案26.根据前述实施方案中任一项所述的方法,其中所述肿瘤是癌性肿瘤。
[0217]
实施方案27.根据前述实施方案中任一项所述的方法,其中所述癌症是间皮瘤。
[0218]
实施方案28.根据实施方案27所述的方法,其中所述间皮瘤是复发性/难治性(r/r)间皮瘤。
[0219]
实施方案29.根据实施方案27或实施方案28所述的方法,其中所述间皮瘤是上皮样的、双相性的、或肉瘤样的。
[0220]
实施方案30.根据实施方案29所述的方法,其中所述间皮瘤是上皮样的。
[0221]
实施例
[0222]
实施例1——他泽司他给药减少患者中的瘤内b细胞和基质b细胞
[0223]
以下非限制性实施例展示了向患有癌症的受试者给药ezh2抑制剂导致瘤内b细胞和基质b细胞的数目和密度减少。
[0224]
在本实施例中,受试者入组2期、多中心、开放标签、2部分、单臂、2阶段研究,以评估在患有复发性或难治性恶性间皮瘤的成年受试者中每天两次连续口服给予800mg他泽司他的pk、安全性和功效。受试者继续接受研究治疗,直至疾病进展、发展出不可接受的毒性、撤回同意书、或终止研究。在研究时约每6周执行临床反应评估。受试者在疾病进展、发展出不可接受的毒性、撤回同意书、或终止研究时停止研究治疗。
[0225]
对于筛选时的给予前肿瘤取样以及第一或第二肿瘤评估(周期3或5)之时或之后的给予后肿瘤取样是根据当地临床地点程序通过收集肿瘤组织活检样本进行的,并且处理组织块用于福尔马林固定和石蜡包埋(ffpe)。这些ffpe样本储存于环境温度。治疗前和治疗后样本对可从12名受试者获得。对于9例病例(18个组织样本)获得ffpe组织块,且从3名受试者获得切片。
[0226]
如下执行肿瘤组织的制备:对于两例患者病例,从相同的块中连续切割下如由受过训练的病理学家确定的含有代表性肿瘤细胞的4-5微米厚的肿瘤组织切片。将切片固定于superfrost plus载玻片(fisherbrand
tm
)上并风干过夜。在可能的情况下,将来自同一患者病例的治疗前和治疗后切片固定于同一载玻片上,以减少试剂使用并减小治疗前和治疗后样本之间的多重连续抗体染色的技术可变性。10对活体组织切片的治疗前和治疗后样本通过了qc评价,并将这些样本进行多重免疫荧光(if)染色。
[0227]
执行一组cy3和cy5标记的抗体对的if染色。
[0228]
最初进行自体荧光移除过程。随后,进行8轮抗体染色,在后续的每轮抗体染色之
前发生经由碱性氧化的荧光染料失活。表1显示出依次施用和成像的抗体对。
[0229]
表1.抗体对
[0230][0231]
同样数目的所关注区域(roi)被选择用于每个样本的光谱分析,并且样本集合中的数目的范围为5-39。每个样本中有极少roi未通过qc,通常每个样本不超过1-2个。成功地成像和分析的所得roi数目的范围为4-39。总体而言,355个roi中有340个通过了qc评估(95.8%)。
[0232]
基于瘤内和基质区室中用抗cd20染色的各个细胞的数目确定b细胞含量,并且基于mm2计算b细胞密度。使用panck和ema染色产生的瘤内/基质掩模,这允许从基质信号中分离出瘤内信号。对于每个治疗前和治疗后活检样本,计算通过qc的每个roi的b细胞密度平均值。
[0233]
图1和表2显示,给药他泽司他导致8/10患者中的瘤内b细胞减少。
[0234]
表2.他泽司他给药前和给药后的瘤内b细胞水平
[0235][0236]
图2和表3显示,给药他泽司他导致9/10患者中的基质b细胞减少。
[0237]
表3.他泽司他给药前和给药后的基质b细胞水平
[0238]
[0239][0240]
值得注意的是,对于瘤内和基质区室,b细胞的数目和密度在5个病例中降低至零,表明他泽司他治疗对b细胞浸润的效应。事实上,瘤内b细胞密度平均减少77%(这因一个样本而有偏差,其中b细胞含量增加》500%),并且基质b细胞减少90%。然而,瘤内和基质区域中b细胞密度的中值减少分别为100%和99%。
[0241]
还使用rna-seq来分析他泽司他前和他泽司他后样本,以确定瘤内b细胞和基质b细胞的减少是否可以在遗传上观察到。如图6中所显示,六种不同的b细胞基因标签(b细胞记忆_xcell、b细胞_mcpcounter、b细胞初始_cibersort、b细胞_quantiseq、b细胞初始_cibersort-abs和b细胞_xcell)显示在给药他泽司他后相对表达水平降低,表明肿瘤相关b细胞的数目减少。此外,还分析了巨噬细胞基因标签(巨噬细胞_epic),并且显示在给药他泽司他之前和之后的样本之间没有变化。不受理论的束缚,这表明b细胞标签的减少可归因于他泽司他给药所致的肿瘤相关b细胞的特异性衰竭,而非来自肿瘤的免疫相关细胞的一般性衰竭。
[0242]
总之,这些结果表明,向患有癌症(包括间皮瘤)的受试者给药ezh2抑制剂导致受试者中瘤内b细胞和基质b细胞的水平降低。不受理论的束缚,这种降低可用于追踪受试者对ezh2抑制剂治疗的反应,以及鉴定出可特定受益于ezh2抑制剂治疗的受试者。
[0243]
实施例2——表达分析揭示在一些癌症中高b细胞标签与较差患者预后相关
[0244]
以下是非限制性实施例,其证明一些癌症中的高b细胞标签与较差的患者预后相关。timer 2.0和timer应用程序(参见li等人,cancer research,2017,77(21):e108-e110;li等人,genome biology,2016,17(1):174)用于分析来自癌症基因组图谱(cancer genome atlas)的数据,以检查一些癌症中的b细胞标签与患者预后之间的联系。图3显示timer 2.0分析的结果。如图3中所显示,在患有腺样囊性肉瘤(acc)、结肠腺癌(coad)、肾透明细胞癌(kirc)、肾乳头状细胞癌(kirp)和葡萄膜黑素瘤(uvm)的患者中,高b细胞标签与较差的预后相关。图4和5显示timer 1.0分析的结果,其揭示在患有acc(腺样囊性肉瘤)、kich(肾嫌色细胞癌)、kirp(肾乳头状细胞癌)、lgg(低级别胶质瘤)、meso(间皮瘤)、paad(胰腺癌)和uvm(葡萄膜黑素瘤)的患者中,高b细胞标签与较差的预后相关。
[0245]
这些结果表明,一些癌症类型中的临床结果与肿瘤相关b细胞呈负相关,并因此可以受益于减少肿瘤相关b细胞数目的疗法(如给药ezh2抑制剂)。
[0246]
实施例3——表达分析揭示给药他泽司他减少患有上皮样肉瘤的患者中的瘤内b细胞
[0247]
以下非限制性实施例证明向患有癌症的受试者给药ezh2抑制剂导致瘤内b细胞和基质b细胞的数目和密度减少。
[0248]
在本实施例中,受试者入组2期、多中心、开放标签、单臂、2阶段研究,以评估在患有ini1阴性肿瘤或复发性/难治性滑膜肉瘤的成年受试者中连续口服给予他泽司他800mg每天两次,以及1600mg每天一次的安全性、耐受性和功效。本研究的患者组还包括患有上皮样肉瘤的患者。受试者继续接受研究治疗,直至疾病进展、发展出不可接受的毒性、撤回同意书、或终止研究。在研究时约每8周执行临床反应评估。受试者在疾病进展、发展出不可接受的毒性、撤回同意书、或终止研究时停止研究治疗。
[0249]
对于筛选时的给予前肿瘤取样以及第一或第二肿瘤评估(周期3或5)之时或之后的给予后肿瘤取样是根据当地临床地点程序通过收集患有上皮样肉瘤的患者的肿瘤组织活检样本进行的,并且处理组织块用于福尔马林固定和石蜡包埋(ffpe)。这些ffpe样本储存于环境温度。治疗前和治疗后样本对可从22名受试者获得。
[0250]
使用批量rna测序来分析他泽司他前和他泽司他后样本,以确定特异性基因表达变化以及肿瘤浸润性b细胞标签。分析了几种不同的b细胞标签和一种巨噬细胞标签,包括b细胞记忆_cibersort、b细胞记忆_cibersort-abs、b细胞记忆_xcell、b细胞初始_cibersort、b细胞初始_cibersort-abs、b细胞初始_xcell、b细胞浆_cibersort、b细胞浆cibersort-abs、b细胞浆_xcell、b细胞_epic、b细胞_mcpcounter、b细胞_quantiseq、b细胞_timer、b细胞_xcell、类别转换的记忆b细胞_xcell和巨噬细胞_epic。如图7a和图7b中所显示,这些b细胞标签中有几种显示出在给药他泽司他后相对表达水平降低,表明肿瘤相关b细胞的数目减少。最后,还在他泽司他给药之前和之后的样本中分析了两种b细胞特异性标记基因cd19和cd20。该分析的结果显示于图8中。如图8中所显示,在他泽司他治疗后,cd19和cd20的水平也是降低的水平,表明表达这些标记的b细胞的数目减少。
[0251]
总之,这些结果表明,向患有癌症(包括上皮样肉瘤)的受试者给药ezh2抑制剂导致受试者中瘤内b细胞和基质b细胞的水平降低。不受理论的束缚,这种降低可用于追踪受试者对ezh2抑制剂治疗的反应,以及鉴定出可特定受益于ezh2抑制剂治疗的受试者。
[0252]
等同物
[0253]
前面的具体实施方式仅仅是出于举例说明的目的而呈现,且不旨在将本公开限制于所公开的精确形式。在以上所附具体实施方式中阐述了本公开的一个或多个实施方案的细节。尽管与本文所述的那些类似或等同的任何方法和材料均可用于本公开的实践或测试,现在描述优选的方法和材料。根据具体实施方式以及权利要求书,本公开的其它特征、目的和优点将是显而易见的。在本说明书和所附权利要求书中,单数形式包括复数指代,除非上下文另有明确规定。除非另有定义,否则本文使用的所有技术术语和科学术语都具有与本公开所属领域的普通技术人员通常理解的相同的含义。本说明书中引用的所有专利和出版物以引用方式并入。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。