靶向hsp70的单克隆抗体及其治疗用途
1.相关申请的交叉引用
2.本技术要求2020年3月27日提交的美国临时申请号63/001,011的优先权,通过引用将该申请的全部内容纳入本文。
3.对序列表的引用
4.本技术包含序列表,其以ascii格式通过efs-web提交并通过引用全部内容纳入本文。该ascii副本创建于2021年3月25日,命名为utfcp1469wo_st25.txt,大小为220千字节。
背景技术:
1.技术领域
5.本发明总体涉及医学、免疫学和癌症生物学领域。更具体地说,它涉及靶向hsp70的抗体及其使用方法。
6.2.相关领域的描述
7.据信,针对癌细胞的免疫反应的发展取决于一系列增强事件,这些事件被称为癌症免疫周期(chen&mellman,2013),它始于癌细胞死亡期间癌细胞抗原的释放。树突细胞(dc)被认为是该反应的关键早期组分,因为它们能够捕获并加工肿瘤抗原,然后通过组织相容性复合物(mhc)i类和ii类分子将这些肿瘤抗原递呈给t细胞,从而引发和活化效应cd4 和cd8 t细胞反应。dc的关键作用部分由肿瘤抑制dc活性的多种机制证明,包括缺氧、腺苷、乳酸、低ph以及白细胞介素(il)-10和pd-l1的表达等(veglia&gabrilovich,2017)。
8.一般来说,热休克蛋白(hsp)特别是hsp70被认为在这一过程中起着关键作用,因为它们能够连接先天免疫应答和适应性免疫应答(shevtsov&multhoff,2016)。例如,胞外hsp70结合并伴随肿瘤抗原,然后通过结合不同的细胞表面受体(包括cd91、氧化低密度脂蛋白受体1(olr1)和内皮细胞表达的清道夫受体(srec)-1等)靶向抗原呈递细胞(包括dc)(mcnulty等人,2013),从而将结合的抗原递送至dc进行加工。此外,肿瘤细胞分泌的胞外hsp70诱导巨噬细胞产生炎性细胞因子,如白细胞介素(il)-6和肿瘤坏死因子(tnf)-α(vega等人,2008),从而分别实现交叉呈递和t细胞活化。因此,hsp70被认为是癌症治疗的一个有吸引力的靶点,因为它作为一种细胞保护、抗凋亡因子在细胞内发挥着至关重要的作用,可以在面临各种胁迫源(包括辐射和多种化疗)时促进癌细胞存活(boudesco等人,2018)。此外,hsp70还被认为是癌症治疗的一个有吸引力的靶点,因为它不仅能够通过dc刺激免疫反应,还可能通过巨噬细胞、nk细胞和t细胞刺激免疫反应(shvetsov&multhoff,2016;zininga等人,2018)。
9.增强hsp70-肿瘤抗原复合物dc摄取的方法有望增强抗肿瘤免疫和打破耐受。已经开发了几种直接靶向胞内hsp70或一些其共同伴侣的药理学抑制剂(boudesco等人,2018),其可能作为辐射或化疗的敏化剂。此外,尽管膜结合的hsp70通常在正常细胞中不存在或仅在低水平被发现,但它通常在肿瘤细胞表面表现出增强的表达,并且在一些恶性肿瘤中与更具侵袭性的表型和较差的预后相关(boudesco等人,2018;chatterjee&burns,2017)。此
外,已发现hsp70-/-肿瘤的免疫原性较低,侵袭性更强(dodd等人,2015)。这导致了多种方法的开发和测试,包括基于铁磁和金纳米粒子的疗法、疫苗策略(shvetsov&multhoff,2016),以及单克隆抗体,如cmhsp70.1(stangl等人,2011),它们依赖于hsp70细胞表面表达的活性。
10.近年来,免疫检查点抑制剂(ici),包括针对细胞毒性t淋巴细胞相关蛋白4(ctla-4)和程序性细胞死亡1(pd-1)及其配体pd-l1的单克隆抗体,通过其在甚至晚期恶性肿瘤中诱导持久缓解的能力,已经彻底改变了免疫治疗。通常,人们认为对ici有反应的肿瘤往往具有更高的免疫细胞浸润和/或干扰素基因特征,或更高的肿瘤突变负荷(tmb),有时被称为“热”肿瘤(maleki vareki,2018)。相比之下,具有低免疫细胞浸润或低tmb的所谓“冷”肿瘤往往对ici没有反应,包括胰腺癌和前列腺癌(maleki vareki,2018)。尽管在治疗各种恶性肿瘤方面取得了进展,但仍需要将冷肿瘤转化为免疫原性更强的肿瘤的新方法,这可能为治疗这些肿瘤提供替代方法。
技术实现要素:
11.本发明部分基于抗-hsp70单克隆抗体或抗体片段的发现。在某些情况下,抗hsp70单克隆抗体或抗体片段可(例如)将与肿瘤衍生抗原相关的胞外或可溶性hsp70靶向免疫细胞(例如,树突细胞),从而治疗癌症和/或增强癌症治疗(例如,癌症免疫治疗)的功效。
12.在一个实施方式中,单克隆抗体或抗体片段是本文所述的77a抗体。例如在一个方面,所述抗体或抗体片段包括重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;以及轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列。
13.在一些方面,所述抗体或抗体片段包含与seq id no:7具有至少70%、75%、80%、85%或90%相同性的重链可变序列和与seq id no:8具有至少70%、75%、80%、85%或90%相同性的轻链可变序列。在一些方面,所述抗体或抗体片段包含与seq id no:7具有至少91%、92%、93%、94%、95%、96%、97%、98%、或99%相同性的重链可变序列和与seq id no:8具有至少91%、92%、93%、94%、95%、96%、97%、98%、或99%相同性的轻链可变序列。在一些方面,所述抗体或抗体片段包含具有seq id no:7序列的重链可变序列和具有seq id no:8序列的轻链可变序列。
14.在一些方面,所述抗体或抗体片段由与seq id no:9具有至少70%、75%、80%、85%或90%相同性的重链可变序列和与seq id no:10具有至少70%、75%、80%、85%或90%相同性的轻链可变序列编码。在一些方面,所述抗体或抗体片段由与seq id no:9具有至少91%、92%、93%、94%、95%、96%、97%、98%、或99%相同性的重链可变序列和与seq id no:10具有至少91%、92%、93%、94%、95%、96%、97%、98%、或99%相同性的轻链可变序列编码。在一些方面,所述抗体或抗体片段由seq id no:9的重链可变序列和seq id no:10的轻链可变序列编码。
15.在另一方面,提供77a抗体的人源化变体。例如,在一些方面,单克隆抗体或抗体片段包含具有以下序列的重链可变序列:
16.x1x2qlx3x4sgx5x6x7x8kpgx9sx
10
x
11
x
12
sckx
13
sgytftnygmnwvrqapgx
14
glx
15
wx
16
gwint
ytgeptyaddfkgrx
17
tx
18
x
19
x
20
dx
21
sx
22
x
23
tx
24
yx
25
x
26
x
27
x
28
x
29
lx
30
x
31
x
32
dtavyfcarydhamdywgqgtx
33
vtvss(seq id no:18),
17.其中x1是q或e,x2是i或v,x3是v或q,x4是q或e,x5是a,p,或g,x6是e或g,x7是v或l,x8是v或k,x9是a,e,g,或s,x
10
是v或l,x
11
是k或r,x
12
是v,l,或i,x
13
是a或t,x
14
是k或q,x
15
是e或k,x
16
是m或v,x
17
是f或v,x
18
是f,m,或i,x
19
是t或s,x
20
是t,r,或a,x
21
是t,d,或e,x
22
是t,a,或k,x
23
是s或n,x
24
是l或a,x
25
是m或l,x
26
是e或q,x
27
是l或m,x
28
是r,s,t,或n,x
29
是s或g,x
30
是r,k,或m,x
31
是s或t,x
32
是d或e,和x
33
是l,s,或t;
18.和/或轻链可变区,其具有序列:
19.x1x2x3x4tqspx5slx6x7sx8gx9rx
10
tix
11
ckssqsllnsgtrknylawyqqkx
12
gx
13
x
14
px
15
lliywtstresgvpx
16
rfsgsgsgtdftltix
17
x
18
lqx
19
edvax
20
yyckqsytlytfgx
21
gtkx
22
eik(seq id no:26),
20.其中x1是e或d,x2是i或v,x3是v或q,x4是l或m,x5是d或s,x6是a或s,x7是v或a,x8是l或v,x9是e或d,x
10
是a或v,x
11
是n或t,x
12
是a或p,x
13
是q或k,x
14
是s,v,或p,x
15
是k或r,x
16
是d或s,x
17
是s,d,或n,x
18
是s或t,x
19
是a或p,x
20
是v或t,x
21
是q或g,和x
22
是l或v。
21.在某些方面,所述抗体或抗体片段包含具有选自seq id no:12-16的序列的重链可变序列,或与seq id no:12-19中任一具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有选自seq id no:19-23的序列的轻链可变序列,或与seq id no:19-23中任一具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链序列。
22.此外,还提供了77a抗体的优化的人源化变体。例如,在一些方面,单克隆抗体或抗体片段包含重链可变区(vh),所述重链可变区域包含gyx1ftx2yg(seq id no:214)的vhcdr1氨基酸序列,其中x1是t、s或i且x2为n或k,intytgex1(seq id no:215)的vhcdr2氨基酸序列,其中x1是p、s、t或a,和x1rydhx2mdy(seq id no:216)的vhcdr3氨基酸序列,其中x1是a、t、v或g且x2是a、r、f、t、p、v、s、d、n、h、l、y或g;和/或轻链可变区(vl),其包含qslx1nsgtrkny(seq id no:212)的vlcdr1氨基酸序列,其中x1为l、f或v,seq id no:5的vlcdr2氨基酸序列,以及kqsyx1lyt(seq id no:213)的vlcdr3氨基酸序列,其中x1是t、n或s。在一些方面,单克隆抗体或抗体片段包含选自seq id no:1和164-166的vhcdr1氨基酸序列、选自seq id no:2和167-169的vhcdr2氨基酸序列以及选自seq id no:3和170-185的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含选自seq id no:4和159-161的vlcdr1氨基酸序列、seq id no:5的vlcdr2氨基酸序列和选自seq id no:6、162和163的vlcdr3氨基酸序列。
23.在一些方面,单克隆抗体或抗体片段包含具有以下序列的重链可变序列:
24.qix1lvqsgx2evkkpgasvkvsckasgyx3ftx4ygmnwvrqapgqglewmgwintytgex5x6yx7ddfkgrftfttdtstx8tx9ymx
10
x
11
rslrsddtavyfcx
12
rydhx
13
mdywgqgx
14
lvtvss(seq id no:104),
25.其中x1是q或h,x2是a,d,t,v,s,或p,x3是t,s,或i,x4是n或k,x5是p,s,t,或a,x6是t,r,k,或i,x7是a,t,v,s,或g,x8是s,r,或t,x9是a,v,或g,x
10
是e或d,x
11
是l或v,x
12
是a,t,v,或g,x
13
是a,r,f,t,p,v,s,d,n,h,l,y,或g,和x
14
是t或s;
26.和/或轻链可变序列,其具有序列:
27.eivltqspdslx1vslgeratix2ckssqslx3nsgtrknylx4wyqx5kx6gqspx7lx8iywtstresg
vpdrfsx9sgsgtdftlx
10
idx
11
lqx
12
edvax
13
yyckqsyx
14
lytfgggtkveik(seq id no:158),
28.其中x1是a,t,或s,x2是n或k,x3是l,f,或v,x4是a,s,或t,x5是q或k,x6是a,p,或s,x7是k或n,x8是l,v,或i,x9是g或a,x
10
是t或s,x
11
是s或r,x
12
是a或t,x
13
是v,i,或l,和x
14
是t,n,或s。
29.在一些方面,所述抗体或抗体片段包含具有选自seq id no:17和26-103的序列的重链可变序列,或与seq id no:17和26-103中任一具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有选自seq id no:24和105-107的序列的轻链可变序列,或与seq id no:24和105-107中任一具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列。
30.在一些方面,抗体结合或能够结合hsp70。在一些方面,抗体以小于约10、9、8、7、6、5、4、3、2、1、0.9、0.85、0.8、0.75、0.7、0.6或0.5nm的kd与人hsp70结合,如通过octet生物层干涉(bli)分析确定。
31.本文还提供了单克隆抗体或抗体片段,其竞争结合与根据本实施方式中任一所述的单克隆抗体和抗体片段相同的表位。例如,本发明包括与本文定义的77a抗体竞争结合hsp70的抗hsp70抗体。通过使用本领域已知的常规方法,可以确定抗体是否与77a抗体结合相同的表位,或是否与77a抗体竞争结合。例如,为了确定测试抗体是否与77a抗体结合相同的表位,允许77a抗体在饱和条件下与hsp70蛋白或肽结合。接下来,评估测试抗体结合hsp70蛋白或肽的能力。如果测试抗体在77a抗体饱和结合后能够结合hsp70蛋白或肽,则可以得出结论,测试抗体与77a抗体结合的表位不同。另一方面,如果在与77a抗体饱和结合后,测试抗体不能与hsp70蛋白或肽结合,则测试抗体可能与77a抗体结合相同的表位。
32.在一个实施方式中,本文提供的是单克隆抗体或抗体片段,其结合或能够结合由本实施方式中任一抗体或抗体片段识别的hsp70上的表位。
33.在一个实施方式中,本文提供的是单克隆抗体或抗体片段,其中所述单克隆抗体或者抗体片段结合由对应于seq id no:11的k573-q601的肽定义的hsp70表位。在某些方面,当与hsp70结合时,单克隆抗体或抗体片段与以下残基中的一个或两个结合:seq id no:11的h594、k595和q601。在一些方面,当与hsp70结合时,单克隆抗体或抗体片段与以下残基中的全部结合:seq id no:11的h594、k595和q601。在一些方面,当与hsp70结合时,单克隆抗体或抗体片段与以下残基中的至少一个结合:seq id no:11的k573、e576、w580、r596和e598。在一些方面,当与hsp70结合时,所述单克隆抗体或抗体片段还与以下残基中的至少两个、三个、四个或五个结合:seq id no:11的k573、e576、w580、r596和e598。在一些方面,当与hsp70结合时,单克隆抗体或抗体片段与以下残基中的全部结合:seq id no:11的k573、e576、w580、h594、r596、e598和q601。
34.在一些方面,本文提供了单克隆抗体或抗体片段,其中当与hsp70结合时,所述单克隆抗体或抗体片段增强免疫效应细胞对肿瘤衍生的adp-hsp70肽抗原复合物的摄取。
35.在本发明任一实施方式的一些方面中,抗体结合或能够结合hsp70。在本发明任一实施方式的一些方面中,抗体结合或能够结合adp结合形式的hsp70。在本发明任一实施方式的一些方面中,抗体结合或能够结合肽结合形式的hsp70。在本发明任一实施方式的一些方面中,抗体结合或能够结合adp结合形式和肽结合的hsp70。在本发明任一实施方式的一些方面,抗体以或能够以小于约10、9、8、7、6、5、4、3、2、1、0.9、0.85、0.8、0.75、0.7、0.6或
0.5nm的kd与人hsp70结合,如通过octet生物层干涉(bli)分析确定。在本发明任一实施方式的一些方面中,抗体不诱导抗体依赖性细胞毒性。在本发明任一实施方式的一些方面中,抗体不诱导补体依赖性细胞毒性。在本发明任一实施方式的某些方面,抗体增强免疫效应细胞(例如,单核细胞/巨噬细胞和树突细胞)对hsp70的摄取。在一些方面,摄取由人fcγr2a和/或人fcγr2b介导。
36.在本方面任一实施方式的一些方面,抗体片段是单价scfv(单链片段可变)抗体、二价scfv、fab片段、f(ab')2片段、f(ab')3片段、fv片段或单链抗体。在本发明任一实施方式的一些方面中,所述抗体为嵌合抗体、双特异性抗体或bite。在本发明任一实施方式的一些方面中,抗体是igg抗体或重组igg或抗体片段。
37.在本发明任一实施方式的一些方面中,抗体偶联或融合至成像剂或细胞毒性剂。在本发明任一实施方式的一些方面中,抗体经标记。在一些方面,标记是荧光标记、酶标记或放射性标记。
38.在一些方面,抗体或抗体片段是igg抗体或抗体片段。在一些方面,所述抗体或抗体片段为igg1、igg2、igg3或igg4抗体或抗体片段,例如所述的抗体或抗体片段包含seq id no:217-221中的任一种。
39.在一个实施方式中,本文提供了编码任何本实施方式的抗体的抗体重链和/或轻链可变区的分离的核酸。在一些方面,所述分离的核酸包含与seq id no:9和/或10至少85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的核苷酸序列。
40.在一个实施方式中,本文提供了包含本实施方式中任一的核酸的表达载体。
41.在一个实施方式中,本文提供了杂交瘤或经工程化改造的细胞,其包含编码本文实施方式中任一所述的抗体或抗体片段的核酸。
42.在一个实施方式中,本文提供了包含本实施方式中任一的核酸的杂交瘤或工程化改造的细胞。
43.在一个实施方式中,本文提供了制备本发明任一实施方式的单克隆抗体或抗体片段的方法,所述方法包括在允许抗体表达的条件下培养本发明任一实施方式的杂交瘤或工程化改造的细胞,并任选地从培养物中分离抗体。
44.在一个实施方式中,本文提供了包含一种或多种本发明任一实施方式的抗体或抗体片段的药物制剂。
45.在一个实施方式中,本文提供了治疗患有癌症的患者的方法,所述方法包括向患者给予有效量的本发明任一实施方式的抗体或抗体片段。在一些方面,这些方法增强了抗原递呈细胞对hsp70的摄取。在一些方面,抗原递呈细胞对hsp70的摄取由人fcγr2a和/或人fcγr2b介导。
46.在一些方面,方法进一步定义为增强细胞毒性t细胞介导的抗肿瘤免疫的方法。在一些方面,这些方法被进一步定义为提高免疫治疗敏感性的方法。在一些方面,方法进一步定义为增强免疫效应细胞对肿瘤衍生adp-hsp70肽抗原复合物摄取的方法。在一些方面,方法进一步定义为增强树突细胞的抗原呈递的方法。在一些方面,方法进一步定义为增强cd4 和cd8 t细胞对肿瘤抗原反应的方法。
47.在一些方面,癌症是免疫学上的冷癌症,例如胰腺癌或前列腺癌。
48.在一些方面,该方法还包括给予至少第二抗癌疗法,例如化疗、免疫疗法、放疗、基因疗法、外科手术、激素疗法、抗血管生成疗法或细胞因子疗法。
49.在一个实施方式中,提供了嵌合抗原受体(car)蛋白,其包含结合人hsp70的抗原结合结构域。
50.在一些方面,抗原结合结构域包含选自seq id no:1和164-166的vhcdr1氨基酸序列、选自seq id no:2和167-169的vhcdr2氨基酸序列以及选自seq id no:3和170-185的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含选自seq id no:4和159-161的vlcdr1氨基酸序列、seq id no:5的vlcdr2氨基酸序列和选自seq id no:6、162和163的vlcdr3氨基酸序列。在一些方面,抗原结合结构域包括重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;以及轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列。在一些方面中,car蛋白能结合hsp70。
51.在一些方面,抗原结合结构域包含具有选自seq id no:7,12-17和26-103的序列的重链可变序列,或与seq id no:7,12-17和26-103中任一具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有选自seq id no:8,19-24和105-107的序列的轻链可变序列,或与seq id no:8,19-24和105-107中任一具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列。
52.在一些方面,抗原结合结构域包含与seq id no:7具有至少70%、75%、80%、85%或90%相同性的重链可变序列和与seq id no:8具有至少至少70%、75%、80%、85%或90%相同性的轻链可变序列。在一些方面,所述抗原结合结构域包含与seq id no:7具有至少91%、92%、93%、94%、95%、96%、97%、98%或99%相同性的重链可变序列和与seq id no:8具有至少91%、92%,93%、94%、95%、96%、97%、98%或99%相同性的轻链可变序列。在一些方面,抗原结合结构域包含具有seq id no:7序列的重链可变序列和具有seq id no:8序列的轻链可变序列。
53.在一些方面,抗原结合结构域由与seq id no:9具有至少70%、75%、80%、85%或90%相同性的重链可变序列和与seq id no:10具有至少70%、75%、80%、85%或90%相同性的轻链可变序列编码。在一些方面,所述抗原结合结构域由与seq id no:9具有至少91%、92%、93%、94%、95%、96%、97%、98%或99%相同性的重链可变序列和与seq id no:10具有至少91%、92%,93%、94%、95%、96%、97%、98%或99%相同性的轻链可变序列编码。在一些方面,抗原结合结构域由seq id no:9的重链可变序列和seq id no:10的轻链可变序列编码。
54.在一些方面,抗原结合结构域是人源化抗原结合结构域。在一些方面,car蛋白进一步包括铰链结构域、跨膜结构域和细胞内信号转导结构域。铰链结构域可以是cd8a铰链结构域或igg4铰链结构域。跨膜结构域可以是cd8a跨膜结构或cd28跨膜结构域。胞内信号转导结构域可以包括cd3z胞内信号转导结构域。
55.在一个实施方式中,本文提供了编码本发明任一实施方式的car蛋白的核酸分子。在一些方面,编码car蛋白的序列与表达控制序列可操作连接。在一些方面,核酸分子进一步定义为表达载体。
56.在一个实施方式中,本文提供了包含编码嵌合抗原受体(car)蛋白的核酸分子的
工程化改造细胞,所述嵌合抗原受体蛋白包含结合或能够结合人hsp70的抗原结合结构域。在一些方面,所述核酸分子编码本发明任一实施方式的car蛋白。
57.在一些方面中,细胞是t细胞或nk细胞。在一些方面,核酸被整合到细胞的基因组中。在一些方面中,细胞是人细胞。
58.在一个实施方式中,本文提供药物组合物,其在药学上可接受的运载体中包含本发明任一实施方式的细胞群体。
59.在一个实施方式中,本文提供了治疗有需要的人患者的癌症的方法,包括向患者给予抗肿瘤有效量的细胞治疗,所述细胞治疗包括根据本发明任一实施方式的一种或多种细胞。在一些方面中,细胞是同种异体细胞或自体细胞。在一些方面,细胞是与患者匹配的hla。在一些方面,癌症是胰腺癌或前列腺癌。
60.在一些方面,该方法还包括给予至少第二抗癌疗法,例如化疗、免疫疗法、放疗、基因疗法、外科手术、激素疗法、抗血管生成疗法或细胞因子疗法。
61.在一个实施方式中,本文提供了检测体外样品中hsp70的方法,所述方法包括使体外样品与本发明任一实施方式的抗体或抗体片段接触,并检测抗体或抗体片段与样品的结合。在一些方面中,检测是通过流式细胞术、质谱、蛋白质印迹、免疫组织化学、elisa或ria进行的。
62.在一个实施方式中,本文提供了本发明任一实施方式的抗体分子、药物组合物、细胞或药物组合物,用于治疗对象中的癌症。
63.在一个实施方式中,本文提供了本发明任一实施方式的抗体分子、药物组合物、细胞或药物组合物的用途,用于制备治疗对象中的癌症的药物。
64.如本文所用,就特定组分而言,术语“基本上不含”在本文中用于表示该特定组分未被有意配制入组合物和/或仅作为污染物存在或以痕量存在。因此,由组合物的任何意外污染导致的特定组分的总量低于0.5%、0.1%或0.05%,优选低于0.01%。最优选的是使用标准分析方法无法检测到指定成分的量的组合物。
65.如本说明书中所用,“一”或“一个/种”可指一个/种或多个/种。如本文权利要求中所用,当与词语“包括/包含”结合使用时,词语“一”或“一个/种”可指一个或多于一个。
66.在权利要求中使用的术语“或”表示“和/或”,除非特别指出仅指替代方式,或替代方式互相排除,但公开内容支持仅指替代方式和“和/或”的定义。如本文所用,“另一”可指至少第二个/种或更多个/种。
67.在本技术全文中,术语“约”用于表示数值包括装置、用于确定该数值的方法、研究对象之间差异的固有误差变化,或在规定数值10%范围内的值。
68.通过以下详细说明,本发明的其他目的、特征和优点将显而易见。然而,应当理解,在指示本发明的优选实施方式的同时,详细描述和具体实施例仅是示例说明,因为本发明的精神和范围内的各种改变和修改对于本领域技术人员而言将由该详细描述变得显而易见。
69.附图简述
70.以下所述附图属于本说明书的一部分,包括于此用以进一步说明本文某些方面的内容。以下一幅或多幅附图与具体实施方式的详细描述有助于更好地理解本发明。
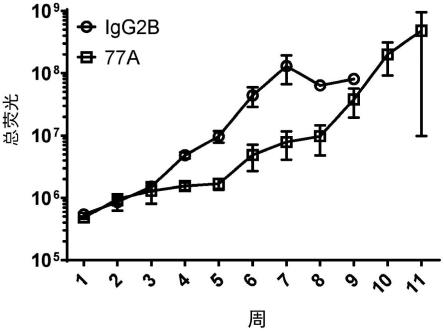
71.图1.注射mopc315.bm-luc细胞的balb/c小鼠在第1至第3周内每周两次接受200μg
注射所示hsp70 mab(方形)或其igg2b同种型对照(圆形)。使用全动物体内成像监测疾病负荷,并通过血清轻链水平确认。
72.图2a-c:octet分析研究77a对鼠hsp70(上图)、大肠杆菌中生产的人hsp70(中图)和sf9昆虫细胞中生产的人hsp70(下图)的亲和力(a)。77a显示与adp-hsp70复合物的优先结合(b)。当存在adp和肽底物(nrl)时,与hsp70-gfp的77a结合显示出最大的亲和力(c)。在(c)中的每组列中,列从左到右表示缓冲液、atp、adp、atp nrl和adp nrl。
73.图3a-f.全长(fl)hsp70在hsp70 ko 293t细胞中表达为n端gfp融合蛋白(a),以及所示长度的缺失突变体逐渐去除更多的c端氨基酸。用77a对细胞提取物进行ip后,用抗gfp抗体(b)通过蛋白质印迹(wb)检测蛋白质。然后产生较小的缺失以进行更精细的映射(c),并从细胞裂解物(cl)或培养基上清液(cm)中进行所指示的ip。用α-轻链(lc)抗体确认负荷。在代表蛋白质(d)相关区域的hsp70分子模型上标出了77a的推定结合域。使用丙氨酸扫描分析确定了构成77a表位的确切氨基酸,结果如(e)所示,显示一级和二级关键位点的带状图如(f)所示。
74.图4a-b:将luc标记的mm1.s人骨髓瘤细胞注射到裸鼠体内,并在第2周至第5周每周用igg2b同种型对照mab或77a以指定剂量进行两次治疗。第5周(a)显示了全动物实时成像数据,背侧(上图)和腹侧(下图)视图显示了igg2b治疗小鼠中的显著肿瘤生长,但77a治疗的小鼠中没有,尤其是在较高剂量水平下。然后在nsg小鼠中进行相同的实验,通过成像(b)和针对人轻链的elisa测量肿瘤生长。
75.图5.如图所示,在igg2b或77a存在下,将未成熟鼠dc2.4细胞与载剂(左两幅)或6x his标记的hsp70(右两幅)在37℃下孵育6小时。然后用对照igg(左图)或α-6x-his标签mab(右三图)对它们进行染色,并通过流式细胞仪测定hsp70的摄取。hsp70的显著摄取仅在77a的存在下可见(最右边的图)。
76.图6.在同种型对照mab或77a mab存在下,暴露于sf9衍生的6x-his标记的人hsp70的dc2.4细胞用与alexa fluor 594偶联的小麦胚芽凝集素(wga)染色以染色细胞膜,alexa fluor 488标记的α-6x-his标签mab染色以检测hsp70,或用4
′
,6-联脒-2-苯基吲哚(dapi)染色核,并且获得了独立以及合并的图像。代表性视野以200倍放大显示。
77.图7.暴露于hsp70和金标记的77a的dc的电子显微照片。放大倍数为100,000x。
78.图8a-c。用pbs或从a-375黑色素瘤细胞纯化的5μg adp-hsp70与10μg igg2b或77a的组合处理小鼠dc2.4细胞48小时,a-375黑色素瘤细胞是hsp70的良好来源,因为它们表达高水平的该蛋白。收获rna并将cdna与文中描述的qpcr阵列杂交。对于igg2b和pbs(a;上图)以及77a和pbs(a;下图)之间的比较,显示活化或抑制大于等于2倍的基因。数据来自3个生物学重复。然后进行ingenuity通路分析(b),以确定可能受这些变化影响的生物过程。然后使用biorad bio-plex
tm
pro小鼠细胞因子阵列分析成熟dc释放的细胞因子。柱状图(c)显示了hsp70和77a暴露细胞与hsp70及igg2b暴露细胞相比诱导的显著变化。在(c)中的每组柱中,左侧柱代表igg对照,右侧柱代表hsp70刺激。
79.图9a-g。将7500luc-4t1细胞注射到balb/c小鼠的第四右乳腺中。12天后,当所有小鼠都有可触及且可测量的肿瘤时,每周静脉注射200μg igg2b(实心方块)或77a(空心方块)两次,持续3周。使用卡尺和全动物成像测量原发(a)肿瘤体积,而成像用于评估肺转移(b)。在第32天收集外周血,并评估cd4 和cd8 t细胞(c),以及双重cd11c /mhc ii 类细胞
以及总mhc ii 类细胞(d)。77a诱导人原代cd4 和cd8 t细胞的hsp70摄取(e)。77a刺激mhc非依赖性细胞溶解性cd4-t细胞活性(f)。77a对裸鼠中a375黑色素瘤模型的活性(g)。
80.图10.在核苷酸结合域(nbd)中与atp结合的hsp70(以蓝色表示)具有开放构型以允许与底物结合域(sbd)相互作用。底物肽与sbd的相互作用,与j-蛋白和核苷酸交换因子(nef)协同,刺激hsp70 atp酶活性,导致盖子(lid)关闭,从而稳定hsp70与底物的相互作用。改编自(craig&marszalek,2017)。右图还显示了hsp70模型上77a结合的大致位置。
81.图11a-c。在adp-琼脂糖柱上纯化表达hsp70-gfp的10ml 4t1细胞沉淀的匀浆,以分离adp-hsp70-肽复合物,并在第-24天将10μg腹膜内注射到balb/c小鼠中,在第-10天皮下增强注射。然后如图9a-d所示在第0天用表达hsp70-gfp的4t1-luc细胞注射这些细胞。通过全动物成像监测肿瘤生长(a)。在第37天,当动物被安乐死时,分离脾细胞并在当天通过facs分析,或在表达hsp70-gfp的辐照4t1细胞存在下静置培养7天,然后通过facs进行分析。比较了脾脏分离(第0天)和培养7天后(左图)的cd4 (b)和cd8 (c)t细胞含量。还通过将指示的细胞级分暴露于活的野生型4t1细胞或表达hsp70-gfp的4t1细胞,然后进行活力研究来测试细胞毒性t细胞活性(右图)。
82.图12a-b。如上所述,在暴露于4t1细胞或表达hsp70-gfp的4t1细胞后,对从鼠脾脏分离的cd4 (a)和cd8 (b)t细胞进行细胞因子释放测定。ifnγ分泌显示在每个上图中,而il-2分泌显示在下图中。
83.图13.77a通过fcγr2a和fcγr2b诱导hsp70摄取。顶行表示表达人fcγr2a的hsp70敲除hek 293t细胞。底行表示表达所示人类fcγ受体的hsp70敲除的hek 293t细胞。
84.图14a-b。突出显示了鼠和人hsp70在77a的推定结合位点处的序列(a)。氨基酸差异被框出,而潜在的磷酸化位点用红色表示,泛素化位点用绿色表示。人hsp70中的三个模拟鼠形式的氨基酸突变降低了77a识别人hsp70的能力(b)。
85.图15a-b。77a的肿瘤靶点。在原位注射4t1细胞的balb/c小鼠(a)和基于ct26的免疫活性结肠癌模型(b)中评估igg2b或77a的pld。
86.图16.在表位分箱实验中测试抗体77a与所示抗体结合hsp70蛋白的竞争。图16中的数字反映了可能的竞争性抗体存在下的最大结合百分比。
87.图17.通过生物层干涉法(bli)测量的与adp-hsp70(顶部)和atp-hsp70(底部)结合的抗体77a。
88.图18.通过elisa测定抗体77a与adp-hsp70和atp-hsp70的结合,其中1号和2号分别代表阴性对照,其中不存在一抗或二抗。
89.图19.用所示抗体治疗携带ct-26肿瘤的小鼠后的肿瘤体积。方框中的天数(14、17、21)表示小鼠接受治疗的天数。*通过dunnett多重比较t检验确定,相对于同种型对照(igg2b)p=0.0023。
90.图20a-b。人源化变体hvh-1至hvh-5(图20a)和hvl-1至hvl-5(图20b)的序列比对。
91.图21.通过总mfi(左)和%gfp阳性细胞(右)测量,表达指示的人fcγ受体的细胞与hsp70gfp、gfp纳米体alexa-488和指示抗体孵育后的hsp70摄取。253-77a=77a;hc1 lc1=h77a-1;hc2 lc1=h77a-6;hc3 lc1=h77a-11。
92.图22.通过总mfi(左)和%gfp阳性细胞(右)测量,表达指示的人fcγ受体的细胞与hsp70gfp、gfp纳米体alexa-488和指示的igg2抗体孵育后的hsp70摄取。253-77a=77a;
hc1 lc1=h77a-1;hc2 lc1=h77a-6;hc3 lc1=h77a-11。
93.图23.通过总mfi(左)和%gfp阳性细胞(右)测量,表达指示的小鼠fcγ受体的细胞与hsp70gfp、gfp纳米体alexa-488和指示抗体孵育后的hsp70摄取。253-77a=77a;hc1 lc1=h77a-1;hc2 lc1=h77a-6;hc3 lc1=h77a-11。
94.图24.通过总mfi(左)和%gfp阳性细胞(右)测量,表达指示的小鼠fcγ受体的细胞与hsp70gfp、gfp纳米体alexa-488和指示igg2抗体孵育后的hsp70摄取。253-77a=77a;hc1 lc1=h77a-1;hc2 lc1=h77a-6;hc3 lc1=h77a-11。
95.图25.通过总mfi(左)和%gfp阳性细胞(右)测量,dc细胞与hsp70gfp、gfp纳米体alexa-488和指示抗体孵育后的hsp70摄取。显示了针对hsp70gfp门控的总细胞的结果。253-77a=77a;hc1 lc1=h77a-1;hc2 lc1=h77a-6;hc3lc1=h77a-11。
96.图26.通过%gfp阳性细胞(左)和mfi(右)测量,dc细胞与hsp70gfp、gfp纳米体alexa-488和指示抗体孵育后的hsp70摄取。显示了浆细胞样dc、cd303 ve、cd1c-ve细胞的结果。253-77a=77a;hc1 lc1=h77a-1;hc2lc1=h77a-6;hc3 lc1=h77a-11。
97.图27.通过%gfp阳性细胞(左)和mfi(右)测量,dc细胞与hsp70gfp、gfp纳米体alexa-488和指示抗体孵育后的hsp70摄取。显示了1型dc、cd141 ve、cd1c-ve细胞的结果。253-77a=77a;hc1 lc1=h77a-1;hc2 lc1=h77a-6;hc3lc1=h77a-11。
98.图28.通过%gfp阳性细胞(左)和mfi(右)测量,dc细胞与hsp70gfp、gfp纳米体alexa-488和指示抗体孵育后的hsp70摄取。显示了2型dc、cd1c ve、cd303-ve细胞的结果。253-77a=77a;hc1 lc1=h77a-1;hc2 lc1=h77a-6;hc3 lc1=h77a-11。
99.图29a-j.人源化变体hvh-1.1至hvh-1.78(图29a-f)和hvl-1.1至hvl-1.53(图29g-j)的序列比对。
具体实施方式
100.本发明部分基于抗hsp抗体或其片段的开发,其可用于治疗某些适应症,例如癌症。在某些情况下,抗hsp70单克隆抗体或抗体片段可(例如)将与肿瘤衍生抗原相关的胞外或可溶性hsp70靶向免疫细胞(例如,树突细胞),从而治疗癌症和/或增强癌症治疗(例如,癌症免疫治疗)的功效。
101.本文提供的数据显示,抗hsp70 mab(称作克隆77a)显示出独立于表面hsp70表达的活性,并将胞外hsp70与肿瘤衍生抗原靶向dc。该抗体可用于更好地理解hsp70在免疫中的作用,也可作为增强癌症免疫治疗效果的治疗手段。特别是,克隆77a是一种高亲和力的hsp70单克隆抗体,在免疫活性和裸鼠的血液恶性肿瘤和实体瘤模型中显示出抗肿瘤的效果,但在携带自发蛋白激酶、dna活化的催化亚基(prkdcscid)突变的免疫缺陷小鼠(也称为scid小鼠)中则没有。在体外试验中,该抗体增强dc对hsp70的细胞内摄取,导致与dc成熟相关的基因上调。当对原位移植的4t1细胞(一种对ici无反应的小鼠三阴性乳腺癌免疫冷模型)进行测试时,77a降低了原发性肿瘤的生长并抑制了肺和肝转移的发展。77a与聚乙二醇化脂质体阿霉素(pld)(一种引起免疫原性细胞死亡(icd)并增强hsp70-肿瘤肽复合物释放的药物)组合,治愈了4t1模型和结直肠癌模型中的一些小鼠。最后,当将从4t1细胞纯化的adp-hsp70复合物与77a一起作为疫苗时,与mab同种型对照相比,随后用4t1活细胞攻击后的肿瘤生长受到抑制,并且增强了4t1特异性细胞溶解性cd4 和cd8 t细胞活性的丰度。因
此,使用克隆77amab增强免疫细胞对hsp70的摄取可单独增强抗肿瘤免疫,也可在许多合理设计的联合方案中增强抗肿瘤免疫。
102.i.定义
103.本文所用“核酸”、“核酸序列”、“寡核苷酸”、“多核苷酸”或其他语法等同形式表示共价接合在一起的至少两个核苷酸,其为脱氧核糖核苷酸或核糖核苷酸,或其类似物。多核苷酸是任何长度的聚合物,包括,例如,20、50、100、200、300、500、1000、2000、3000、5000、7000、10000等。本文所述的多核苷酸通常包含磷酸二酯键,但在某些情况下,包括可能具有至少一个不同键的核酸类似物,例如磷酰胺,硫代磷酸、二硫代磷酸或o-甲基磷酰亚胺键,以及肽核酸骨架和键。可以制备天然多核苷酸和类似物的混合物;或者,可以制备不同的多核苷酸类似物的混合物,以及天然产生的多核苷酸和类似物的混合物。以下是多核苷酸的非限制性例子:基因或基因片段、外显子、内含子、信使rna(mrna)、转移rna、核糖体rna、核酶、cdna、crna、重组多核苷酸、支链多核苷酸、质粒、载体、任意序列的分离dna、任意序列的分离rna、核酸探针和引物。多核苷酸可包括修饰的核苷酸,如甲基化的核苷酸和核苷酸类似物。如果存在,对核苷酸结构的修饰可在聚合物的组装之前或之后赋予。核苷酸序列可间插有非核苷酸组分。多核苷酸聚合后可被进一步修饰,如通过与标记性组分偶联。该术语也包括双链和单链分子。除非另有说明或要求,术语多核苷酸包括双链形式和已知或预测构成双链形式的两种互补单链形式中的每一种。多核苷酸由4种核苷酸碱基的特定序列组成:腺嘌呤(a)、胞嘧啶(c)、鸟嘌呤(g)、胸腺嘧啶(t),并且当多核苷酸是rna时,尿嘧啶(u)替代胸腺嘧啶(t)。因此,术语“多核苷酸序列”是多核苷酸分子的字母表示。除非另有说明,否则具体多核苷酸序列还隐含地包括其保守修饰的变体(例如,简并密码子取代)和互补序列以及明确指出的序列。具体而言,可通过产生一个或多个选定(或所有)密码子的第三个位置被混合碱基和/或脱氧肌苷残基取代的序列来获得简并密码子取代。
104.术语“多肽”、“肽”和“蛋白质”在本文中指氨基酸残基的聚合物。这些术语也适用于其中一个或多个氨基酸残基是相应天然产生氨基酸的人造化学模拟物的氨基酸聚合物,以及天然产生的氨基酸聚合物、包含修饰残基的那些和非天然产生的氨基酸聚合物。在本情况中,术语“多肽”包含抗体或其片段。
105.如本文所使用的在重组核酸技术、微生物学、免疫学、抗体工程学以及分子和细胞生物学领域中使用的其他术语将被适用领域的普通技术人员普遍理解。
106.ii.抗体和抗体修饰
107.本文提供具有来自表1、6、9和10所示重链和轻链的克隆配对cdr的单克隆抗体。可使用本文所述方法制备此类抗体。
108.本发明的单克隆抗体具有几种应用,包括生产诊断试剂盒,用于检测hsp70,以及用于治疗与hsp70水平升高相关的疾病。在这些情况下,可以将此类抗体与诊断或治疗剂连接,在竞争性分析中将它们用作捕获剂或竞争剂,或单独使用它们而不附连额外的试剂。抗体可以发生突变或修饰,如下所述。制备和表征抗体的方法在本领域中是众所周知的(例如,参见《抗体:实验室手册》(antibodies:a laboratory manual),冷泉港实验室,1988年;美国专利第4,196,265号)。
[0109]“抗体”是能够通过免疫球蛋白分子可变区内的至少一个抗原识别位点来特异性结合诸如碳水化合物、多核苷酸、脂类、多肽等靶标的免疫球蛋白分子。如本文所用,该术语
不仅包括完整的多克隆或单克隆抗体,而且还包括其片段(例如fab,fab',f(ab')2,fv,fd,fd’,单链抗体(scfv),双抗体,线性抗体),其突变体,自然产生的变体,包含具有所需特异性的抗原识别位点的抗体部分的融合蛋白,人源化抗体,嵌合抗体,以及包含所需特异性的抗原识别位点的免疫球蛋白分子的任何其他修饰构型。
[0110]“分离的抗体”是从其自然环境的成分中分离和/或回收的抗体。其自然环境的污染成分是会干扰抗体的诊断或治疗用途的材料,可包括酶、激素和其他蛋白质或非蛋白质溶质。在具体情况下,将抗体纯化至:(1)通过lowry方法确定为抗体大于95重量%,特别是大于99重量%,或者(2)通过sds-page在还原或非还原条件下使用考马斯蓝或银染色确定至均质性。分离的抗体包括重组细胞内的原位抗体,因为抗体的天然环境的至少一种组分将不会存在。然而,分离的抗体通常经过至少一个纯化步骤来制备。
[0111]
基本的四链抗体单元是由两条相同的轻(l)链和两条相同的重(h)链组成的异四聚体糖蛋白。本文使用的术语“重链”是指通过其氨基末端区域与免疫球蛋白轻链结合的较大免疫球蛋白亚单位。重链包括可变区(vh)和恒定区(ch)。恒定区还包括ch1、铰链、ch2和ch3结构域。在ige、igm和igy的情况下,重链包含ch4结构域但不具有铰链结构域。本领域技术人员将理解,重链被分类为伽马、缪、阿尔法、德尔塔或艾普希龙(γ、μ、α、δ、ε),其中还有一些亚类(例如γ1-γ4、α1-α2)。该链的特性决定抗体“类别”分别为igg、igm、iga、igd或ige。免疫球蛋白亚类(同种型)例如igg1、igg2、igg3、igg4、iga1等已被充分表征,且已知提供功能性特化。
[0112]
本文使用的术语“轻链”是指与重链的氨基末端区域相联合的较小免疫球蛋白亚单位。与重链一样,轻链包括可变区(vl)和恒定区(cl)。轻链根据其恒定结构域(cl)的氨基酸序列分类为kappa或lambda(κ,λ)。一对轻链可以与各种重链中的任何一对结合形成免疫球蛋白分子。轻链的含义中还包括具有与κ恒定区(c-κ)连接的λ可变区(v-λ)的轻链或具有与λ恒定区(c-λ)连接的κ可变区(v-κ)的轻链。
[0113]
例如,igm抗体由5个基本异四聚体单元以及称为j链的额外多肽组成,从而包含10个抗原结合位点,而分泌型iga抗体则可聚合形成多价组装体,其中包含2-5个基本4链单元与j链。在igg的情况下,4链单元通常约为150,000道尔顿。每条l链通过共价二硫键与h链相连,而两条h链根据h链的同种型通过一个或多个二硫键彼此相连。各h链和l链也具有规则间隔的链内二硫桥。各h链具有n末端的可变结构域(vh),其后为各自为α和γ链的三个恒定结构域(ch),和μ和同种型的四个ch结构域。每条l链在n端具有可变结构域(vl),在其另一端具有恒定结构域(cl)。vl与vh对齐,cl与重链的第一恒定结构域(ch1)对齐。某些特定氨基酸残基被认为会形成轻链可变结构域与重链可变区之间的界面。vh和vl配对共同形成一个抗原结合位点。关于不同类别抗体的结构和特性,可见例如《基础与临床免疫学》(basic and clinical immunology),第8版,daniel p.stites,abba i.terr和tristram g.parslow等(合编),appleton&lange,康涅狄格诺沃克,1994年,第71页和第6章。
[0114]
抗体的“可变区”指单独或组合的抗体轻链可变区或抗体重链可变区。术语“可变”指可变区的某些区段在序列上在抗体间广泛变化的事实。轻(vl)链和重(vk)链部分的可变区介导抗原结合并确定特定抗体对其特定抗原的特异性。然而,可变性并不是均匀分布在整个可变区。相反,可变区由称之为框架区(fr)的较少可变的延伸组成,这些延伸被称之为互补决定区(cdr)或超变区的极致可变的较短区域分隔。天然重链和轻链的可变区各包含
四个fr,主要采用β-折叠构型,通过三个cdr相连(形成环连接),并在某些情况下形成β-折叠结构的一部分。cdr补充抗原的形状并决定抗体对抗原的亲和力和特异性。vl和vh中有六个cdr。各链中的cdr被fr聚集在一起,紧密相邻,与另一条链的cdr一起形成抗体的抗原结合位点(参见例如,kabat等,《免疫学感兴趣蛋白质序列》(sequences of proteins of immunological interest,美国国立卫生研究院公共卫生局,马里兰州贝塞斯达(1991))。
[0115]
本文使用的术语“高变区”是指负责抗原结合的抗体的氨基酸残基。高变区通常包括来自“互补性决定区”或“cdr”的氨基酸残基(例如,根据kabat编号系统进行编号时,vl中大致约残基24-34(l1)、50-56(l2)和89-97(l3)以及vh中大致约31-35(h1)、50-65(h2)和95-102(h3);kabat等人,《免疫学感兴趣蛋白质序列》,第五版,公共卫生服务,马里兰州贝塞斯达国立卫生研究院(1991年));和/或“高变环”中的那些残基(例如,当按照chothia编号系统进行编号时,vl中的残基24-34(l1)、50-56(l2)和89-97(l3)以及vh中的残基26-32(h1)、52-56(h2)和95-101(h3);chothia和lesk,j.mol.biol.196:901-917(1987));和/或来自“高变环”/cdr的残基(例如,残基27-38(l1)、56-65(l2)和105-120(l3))根据imgt编号系统进行编号时,vl中的27-38(h1)、56-65(h2)和vh中的105-120(h3);lefranc,m.p.等人nucl.acids res.27:209-212(1999),ruiz,m.等人nucl.acids res.28:219-221(2000))。可选地,抗体在以下一个或多个点具有对称插入:根据aho编号时,vl中的28、36(l1)、63、74-75(l2)和123(l3),以及vh中的28、36(h1)、63、74-75(h2)和123(h3);honneger,a.和plunkthun,a.j.mol.biol.309:657-670(2001))。如本文所使用的,cdr可指由这些列举方法任一或方法的组合或由其它期望的方法定义的cdr。此外,还可以使用高度保守的核心、边界和超变区的新定义。
[0116]
抗体的“恒定区”指单独或组合的抗体轻链的恒定区或抗体重链的恒定区。轻链(cl)和重链(ch1、ch2或ch3,或在igm和ige的情况下为ch4)的恒定区域赋予重要的生物学特性,例如分泌、经胎盘的移动性、fc受体结合、补体结合等。按照习惯,恒定区结构域的编号随着远离抗原结合位点或抗体的n末端而增加。恒定区并不直接使抗体与抗原的结合,但是展现出各种效应物功能,诸如使抗体参与抗体依赖性细胞毒性(adcc)、抗体依赖性细胞吞噬(adcp)、抗体依赖性中性粒细胞吞噬(adnp)和抗体依赖性补体沉积(adcd)。
[0117]
抗体可以是抗体片段。“抗体片段”仅包含完整抗体的一部分,通常包括完整抗体的抗原结合位点,因此保留结合抗原的能力。本定义包含的抗体片段的实例包括:(i)具有vl、cl、vh和ch1结构域的fab片段;(ii)fab'片段,其是在ch1结构域的c端具有一个或多个半胱氨酸残基的fab片段;(iii)具有vh和ch1结构域的fd片段;(iv)具有vh和ch1结构域以及ch1结构域c端的一个或多个半胱氨酸残基的fd'片段;(v)具有单抗体的vl和vh结构域的fv片段;(vi)由vh结构域组成的dab片段;(vii)分离的cdr区;(viii)f(ab')2片段,一种二价片段,包括通过铰链区的二硫桥连接的两个fab'片段;(ix)单链抗体分子(例如单链fv;scfv);(x)具有两个抗原结合位点的“双抗体”(diabodies),其包括连接到同一多肽链中的轻链可变结构域(vl)的重链可变结构域(vh);(xi)“线性抗体”,包括一对串联fd区段(vh-ch1-vh-ch1),其与互补轻链多肽一起形成一对抗原结合区。
[0118]
抗体可以是嵌合抗体。“嵌合抗体”指如下抗体,其中重链和轻链各自的氨基酸序列的一部分与源自特定物种或属于特定类别的抗体中的相应序列同源,而链的剩余区段与其他物种或类别的相应序列同源。例如,嵌合抗体可以是包含来自移植到异源非人类、人类
或人源化序列(例如,框架和/或恒定结构域序列)的非人类供体的抗原结合序列的抗体。典型地,在这些嵌合抗体中,轻链和重链的可变区模仿源自一种哺乳动物的抗体可变区,而恒定部分与源自另一种哺乳动物的抗体中的序列同源。例如,已开发出用人类来源的类似结构域替换单克隆抗体的轻链和重链恒定结构域且保留外源抗体的可变区域完好无损的方法。或者,在转基因人类免疫球蛋白基因的小鼠中产生“全人类”单克隆抗体。还开发了通过重组构建同时具有啮齿动物(例如,小鼠)和人类氨基酸序列的抗体可变结构域将单克隆抗体的可变结构域转化为更多人类形式的方法。在“人源化”单克隆抗体中,只有高变cdr源自小鼠单克隆抗体,而框架和恒定区源自人类氨基酸序列(参见美国专利号5,091,513和6,881,557,通过引用纳入本文)。据认为,将啮齿动物特有的抗体中的氨基酸序列替换为人类抗体相应位置的氨基酸序列将降低治疗使用期间出现不良免疫反应的可能性。杂交瘤或产生抗体的其他细胞也可能会发生基因突变或其他变化,这可能会或可能不会改变杂交瘤产生的抗体的结合特异性。
[0119]
a.单克隆抗体
[0120]
本文所用术语“单克隆抗体”指获自基本均一抗体群体的抗体,即除了存在少数可能天然发生的突变外,群体包含的单独抗体均是相同的。单克隆抗体具有针对单个抗原性位点的高度特异性。此外,与包含针对不同决定簇(表位)的不同抗体的多克隆抗体制备物相比,每一单克隆抗体针对抗原上单个决定簇。除了它们的特异性外,单克隆抗体的优势在于它们可以在不受其他抗体污染的情况下合成。修饰语“单克隆”不应解释为需要通过任何特定方法生产抗体。例如,本公开中有用的单克隆抗体可通过kohler等人首先描述的杂交瘤方法制备,nature,256:495(1975),或可使用细菌、真核动物或植物细胞中的重组dna方法制备(参见,例如,美国专利第4,816,567号)对抗原特异性b细胞进行单细胞分选后,产生对感染或免疫反应的抗原特异性浆母细胞,或在批量分选的抗原特异性集合中从单个细胞捕获连接的重链和轻链。也可通过例如clackson等,nature352:624-628(1991)和marks等,j.mol.biol.222:581-597(1991)所述的技术从噬菌体抗体文库中分离单克隆抗体。
[0121]
用于产生各种类型的单克隆抗体(包括人源化、嵌合和完全人化)的方法在本领域中是众所周知的且高度可预测的。例如,以下美国专利和专利申请提供了实施此类方法的说明:美国专利申请号2004/0126828和2002/0172677;以及美国专利号3,817,837;3,850,752;3,939,350;3,996,345;4,196,265;4,275,149;4,277,437;4,366,241;4,469,797;4,472,509;4,606,855;4,703,003;4,742,159;4,767,720;4,816,567;4,867,973;4,938,948;4,946,778;5,021,236;5,164,296;5,196,066;5,223,409;5,403,484;5,420,253;5,565,332;5,571,698;5,627,052;5,656,434;5,770,376;5,789,208;5,821,337;5,844,091;5,858,657;5,861,155;5,871,907;5,969,108;6,054,297;6,165,464;6,365,157;6,406,867;6,709,659;6,709,873;6,753,407;6,814,965;6,849,259;6,861,572;6,875,434;和6,891,024,均通过引用纳入本文。
[0122]
b.单链抗体
[0123]
单链可变片段(scfv)是免疫球蛋白重链和轻链可变区通过短接头肽连接的融合蛋白。这种嵌合分子保留了原始免疫球蛋白的特异性,尽管去除了恒定区并引入了接头肽。这种修饰通常使特异性保持不变。scfv可以直接从来源于杂交瘤或b细胞的亚克隆重链和轻链产生。单链可变片段缺少在完整抗体分子中发现的恒定fc区,因此,缺少用于纯化抗体
的共有结合位点(例如蛋白a/g)。这些片段通常可以使用蛋白l纯化/固定,因为蛋白l与κ轻链的可变区相互作用。
[0124]
柔性接头通常由有利于螺旋和旋转的氨基酸残基组成,如丙氨酸、丝氨酸和甘氨酸。然而,其他残基也可以发挥作用。例如,接头可以在vh c末端后两个残基处具有脯氨酸残基,在其他位置具有丰富的精氨酸和脯氨酸。
[0125]
还可以通过使用非肽接头或化学单元连接受体轻链和重链来产生单链抗体。通常,轻链和重链将在不同的细胞中产生、纯化,然后以适当的方式连接在一起(即,重链的n末端通过适当的化学桥连到轻链的c末端)。
[0126]
交联试剂用于形成连接两种不同分子官能团的分子桥,例如,稳定剂和凝聚剂。然而,可设想能够产生相同类似物的二聚体或多聚体或由不同类似物构成的异聚体复合物。为了以分步方式连接两种不同的化合物,可以使用杂双官能交联剂来消除不必要的同聚物形成。
[0127]
示例性的杂双官能交联剂包含两个反应性基团:一个与伯胺基团(例如n-羟基琥珀酰亚胺)反应,另一个与硫醇基团(如吡啶二硫化物、马来酰亚胺、卤素等)反应。通过伯胺反应基团,交联剂可以与一种蛋白质(例如,所选抗体或片段)的赖氨酸残基反应,并且通过巯基反应性基团,已经与第一种蛋白质结合的交联剂与另一种蛋白质的半胱氨酸残基(游离巯基)反应(例如,选择剂)。
[0128]
优选使用在血液中具有合理稳定性的交联剂。已知许多类型的含二硫键的接头,它们可以成功地用于偶联靶向和治疗/预防剂。具有空间阻碍的二硫键的接头可以证明在体内提供更大的稳定性,防止靶向肽在到达作用位点之前释放。因此,这些接头是一组连接剂。
[0129]
例如,smpt是一种双官能交联剂,含有一个被相邻苯环和甲基“空间阻碍”的二硫键。据信,二硫键的空间位阻起到保护键不受组织和血液中可能存在的硫醇化阴离子(如谷胱甘肽)攻击的作用,从而有助于在将附着的试剂递送至靶位点之前防止偶联物解偶联。与许多其他已知的交联试剂一样,smpt交联试剂具有交联官能团的能力,例如半胱氨酸的sh或伯胺(例如赖氨酸的ε氨基)。另一种可能类型的交联剂包括含有可裂解二硫键的杂双官能光反应性苯叠氮化物,如磺基琥珀酰亚胺基-2-对叠氮水杨酰胺基)乙基-1,3
’‑
二硫代丙酸盐。n-羟基琥珀酰亚胺基与伯氨基反应,苯叠氮化物(在光解时)无选择性地与任何氨基酸残基反应。
[0130]
除了受阻交联剂之外,还可以根据本发明使用非受阻接头。其他有用的交联剂,不被认为含有或产生受保护的二硫化物,包括sata、spdp和2-亚氨基噻吩。这种交联剂的使用在本领域是众所周知的。还可使用柔性接头。
[0131]
美国专利4680338描述了可用于生产配体与含胺聚合物和/或蛋白质的偶联物的双官能接头,特别是用于与螯合剂、药物、酶、可检测标记等形成抗体偶联物。美国专利5,141,648和5,563,250公开了含有在各种温和条件下可裂解的不稳定键的可裂解偶联物。这种接头特别有用,因为感兴趣的试剂可以直接结合到接头上,裂解导致活性试剂的释放。具体用途包括将游离氨基或游离巯基添加到蛋白质,如抗体或药物中。
[0132]
美国专利5,856,456提供了用于连接多肽组分以制备融合蛋白(例如单链抗体)的肽接头。接头的长度最多约50个氨基酸,含有至少一次带电氨基酸(优选精氨酸或赖氨酸),
随后是脯氨酸,并且其特征在于更大的稳定性和减少的聚集。美国专利5,880,270公开了在多种免疫诊断和分离技术中有用的含氨氧基的接头。
[0133]
c.双特异性和多特异性抗体
[0134]
抗体可以是双特异性或多特异性的。“双特异性抗体”是对至少两种不同表位具有结合特异性的抗体。示例性双特异性抗体可结合单个抗原的两个不同表位。其他此类抗体可将第一抗原结合位点与第二抗原的结合位点结合。或者,抗原特异性臂可与和白细胞上的触发分子结合的臂结合,例如t细胞受体分子(例如cd3),或igg的fc受体(fcγr),例如fcγri(cd64)、fcγrii(cd32)和fcγriii(cd16),以便将细胞防御机制集中并定位于感染细胞。双特异性抗体也可用于将细胞毒性剂定位于感染细胞。这些抗体具有一个抗原结合臂和一个结合细胞毒性剂的臂(例如,皂素、抗干扰素-α、长春花生物碱、蓖麻毒素a链、甲氨蝶呤或放射性同位素半抗原)。双特异性抗体可以制备成全长抗体或抗体片段(例如f(ab’)2双特异性抗体)。taki等人(2015)描述了一种双特异性抗-hsp70/抗-cd3抗体。
[0135]
制备双特异性抗体的方法是本领域已知的。全长双特异性抗体的传统生产基于两个免疫球蛋白重链-轻链对的共表达,其中两条链具有不同的特异性。由于免疫球蛋白重链和轻链的随机分拣,这些杂交瘤(四倍体)产生十种不同抗体分子的潜在混合物,其中只有一种具有正确的双特异性结构。通常通过亲和层析步骤纯化正确的分子是相当麻烦的,并且产物产率低。
[0136]
根据不同的方法,将具有所需结合特异性的抗体可变区(抗体-抗原结合位点)融合到免疫球蛋白恒定结构域序列。优选地,融合是用ig重链恒定结构域,其包含铰链、ch2和ch3区域的至少一部分。优选具有包含轻链键合所需位点的第一重链恒定区(ch1),其存在于至少一个融合物中。将编码免疫球蛋白重链融合物和(如需要)免疫球蛋白轻链的dna插入单独的表达载体中,并共同转染到合适的宿主细胞中。当在构建中使用的三条多肽链的不相等比率提供所需双特异性抗体的最佳产率时,这提供了调节三条多肽片段的相互比例的更大灵活性。然而,当以相等比率表达至少两条多肽链导致高产率或当比率对所需链组合的产率没有显著影响时,可以将两条或全部三条多肽链的编码序列插入单个表达载体中。
[0137]
双特异性抗体可以由在一条臂中具有第一结合特异性的杂交免疫球蛋白重链和在另一条臂的杂交免疫蛋白重链-轻链对(提供第二结合特异性)构成。这种不对称结构有助于从不需要的免疫球蛋白链组合中分离所需的双特异性化合物,因为只有一半双特异性分子中免疫球蛋白轻链的存在提供了一种简便的分离方法。这种方法在wo 94/04690中公开。关于产生双特异性抗体的进一步细节,参见例如suresh等人,methods in enzymology,121:210(1986)。
[0138]
根据美国专利5,731,168中描述的另一种方法,一对抗体分子之间的界面可经工程改造,以最大化从重组细胞培养中回收的异二聚体的百分数。优选的界面包括ch3结构域的至少一部分。在该方法中,来自第一抗体分子界面的一个或多个小氨基酸侧链被较大侧链(例如,酪氨酸或色氨酸)取代。通过用较小的氨基酸侧链(如丙氨酸或苏氨酸)替换较大的氨基酸侧链,在第二抗体分子的界面上形成与大侧链大小相同或相似的补偿“空腔”。这提供了一种机制,用于提高异二聚体相对于其他不需要的终产物如同二聚体的产率。
[0139]
双特异性抗体包括交联或“异偶联”的抗体。例如,异偶联物中的一种抗体可以与
亲和素耦合,另一种可以与生物素耦合。例如,有人提出这种抗体将免疫系统细胞靶向不想要的细胞(美国专利号4,676,980)。可以使用任何方便的交联方法制备异偶联抗体。合适的交联剂在本领域是众所周知的,并在美国专利4,676,980,以及许多交联技术中公开。
[0140]
文献中还描述了从抗体片段产生双特异性抗体的技术。例如,双特异性抗体可以使用化学连接制备。brennan等人,science,229:81(1985)描述了一种方法,其中完整抗体被蛋白酶解切割以生成f(ab’)2片段。这些片段在二硫醇络合剂亚砷酸钠存在下被还原,以稳定邻位二硫醇并防止分子间二硫化物的形成。然后将产生的fab’片段转化为硫代硝基苯甲酸酯(tnb)衍生物。然后通过用巯基乙胺还原将一种fab
’‑
tnb衍生物再转化为fab
’‑
硫醇,并与等摩尔量的另一种fab'-tnb衍生物混合以形成双特异性抗体。所产生的双特异性抗体可用作选择性固定酶的试剂。
[0141]
现有的技术有助于从大肠杆菌中直接回收fab'-sh片段,这些片段可以化学耦合形成双特异性抗体。shalaby等人,j.exp.med.,175:217-225(1992)描述了人源化双特异性抗体f(ab’)2分子的产生。每个fab’片段分别从大肠杆菌中分泌,并在体外进行定向化学耦合以形成双特异性抗体。由此形成的双特异性抗体能够与过表达erbb2受体的细胞和正常人t细胞结合,并触发人细胞毒性淋巴细胞对人乳腺肿瘤靶标的溶解活性。
[0142]
还描述了直接从重组细胞培养物中制备和分离双特异性抗体片段的各种技术(merchant等人,nat.biotechnol.16,677-681(1998))。例如,已经使用亮氨酸拉链产生了双特异性抗体(kostelny等人,j.immunol.,148(5):1547-1553,1992)。fos和jun蛋白的亮氨酸拉链肽通过基因融合与两种不同抗体的fab’部分连接。抗体同二聚体在铰链区被还原以形成单体,然后被再次氧化以形成抗体异二聚体。该方法也可用于生产抗体同二聚体。hollinger等人,proc.natl.acad.sci.usa,90:6444-6448(1993)描述的“双抗体(diabody)”提供了制备双特异性抗体片段的替代机制。这些片段包括一个vh,该vh通过一个接头连接到一个vl上,该接头太短而不能在同一链上的两个结构域之间配对。因此,一个片段的vh和vl结构域被迫与另一片段的互补vl和vh结构域配对,从而形成两个抗原结合位点。还报道了通过使用单链fv(sfv)二聚体制备双特异性抗体片段的另一种策略。见gruber等人,j.immunol.,152:5368(1994)。
[0143]
双特异性或多特异性抗体可以形成dock-and-lock
tm
(dnl
tm
)复合物(参见美国专利号7,521,056;7,527,787;7,534,866;7,550,143和7,666,400)。通常,该技术利用了camp依赖性蛋白激酶(pka)的调节(r)亚基的二聚化和对接结构域(ddd)序列与衍生自多种akap蛋白中任一种的锚定结构域(ad)序列之间发生的特异性高亲和力结合相互作用(baillie等人,febs letter.2005;579:3264;wong和scott,nat.rev.mol.cell biol.2004;5:959)。ddd和ad肽可以连接到任何蛋白质、肽或其他分子。由于ddd序列自发二聚并结合到ad序列,该技术允许在任何可能连接到ddd或ad序列的选定分子之间形成复合物。
[0144]
预期具有两个以上价态的抗体。例如,可以制备三特异性抗体(tutt等人,j.immunol.147:60,1991;xu等人,science,358(6359):85-90,2017)。抗体还可涉及允许受体二聚化或多聚化的序列或部分。这些序列包括源自iga的序列,其允许与j链结合形成多聚体。另一个多聚结构域是gal4二聚结构域。
[0145]
多价抗体可以比二价抗体更快地被表达与抗体结合的抗原的细胞内化(和/或代谢)。本发明的抗体可为具有三个或更多抗原结合位点的多价抗体(例如,四价抗体),其可
通过重组表达编码抗体多肽链的核酸而容易产生。多价抗体可以包括二聚结构域和三个或更多个抗原结合位点。优选的二聚结构域包括或由fc区或铰链区组成。在这种情况下,抗体将包含fc区以及fc区氨基末端的三个或更多个抗原结合位点。多价抗体可包含或由三至约八个(例如四个)抗原结合位点组成。多价抗体包含至少一条多肽链(优选两条多肽),其中所述多肽链包含两个或更多个可变区。例如,多肽链可以包含vd1-(x1).sub.n-vd2-(x2)n-fc,,其中vd1是第一可变区,vd2是第二可变区,fc是fc区的一条多肽链,x1和x2代表氨基酸或多肽,且n为0或1。例如,多肽链可以包含:vh-ch1-柔性接头-vh-ch1-fc区链;或vh-ch1-vh-ch1-fc区链。本文的多价抗体可进一步包含至少两种(优选四种)轻链可变区多肽。本文的多价抗体可以例如包括约2至约8个轻链可变区多肽。本文考虑的轻链可变区多肽包括轻链可变区,并且任选地还包括cl结构域。
[0146]
电荷修饰在多特异性抗体的情况下特别有用,其中fab分子中的氨基酸取代导致轻链与非匹配重链错配(bence-jones型副产物),这可能发生在基于fab的双/多特异性抗原结合分子的生产中,在其结合臂中的一个(或多个,在分子包含两个以上抗原结合fab分子的情况下)具有vh/vl交换(另见pct公开号wo2015/150447,特别是其中的实施例,通过引用全文并入本文)。
[0147]
d.bites
[0148]
双特异性t细胞衔接子是一种人工双特异性单克隆抗体,可引导宿主的免疫系统,更具体地说是t细胞的细胞毒性活性,以靶向患病细胞。bites是由不同抗体的两个单链可变片段(scfv)或来自四个不同基因的氨基酸序列组成的融合蛋白,位于约55千道尔顿的一条肽链上。其中一个scfv通过cd3受体与t细胞结合,另一个通过特定分子与感染细胞结合。
[0149]
与其他双特异性抗体一样,与普通单克隆抗体不同,bite在t细胞和靶细胞之间形成连接。这导致t细胞通过产生穿孔素和颗粒酶等蛋白质对靶细胞产生细胞毒性活性,而不依赖于mhc i或共刺激分子的存在。这些蛋白质进入靶细胞并引发凋亡。这种行为模拟了t细胞攻击感染细胞期间观察到的生理过程。
[0150]
e.抗体偶联物
[0151]
本发明的抗体可与至少一种物质连接以形成抗体偶联物。偶联物可以是例如与另一蛋白质、碳水化合物、脂类或混合部分的分子偶联的抗体。此类抗体偶联物包括但不限于包括将抗体连接到一种或多种聚合物的修饰。例如,抗体可连接到一个或多个水溶性聚合物。与水溶性聚合物的连接降低了抗体在水环境(例如生理环境)中沉淀的可能性。本领域技术人员可基于如下考虑因素选择合适的水溶性聚合物,包括但不限于聚合物/抗体偶联物是否将用于患者治疗,以及如果是,抗体的药理学特征(例如,半衰期、剂量、活性、抗原性和/或其他因素)。
[0152]
为了提高抗体分子作为诊断或治疗剂的功效,通常连接或共价结合或复合至少一种所需的分子或部分。这种分子或部分可以是但不限于至少一种效应分子或报告分子。效应分子包括具有所需活性的分子,例如细胞毒性活性。已结合于抗体的效应分子的非限制性实例包括毒素、抗肿瘤剂、治疗酶、放射性核素、抗病毒剂、螯合剂、细胞因子、生长因子和寡核苷酸或多核苷酸。相反,报告分子被定义为可使用测定法检测的任何部分。与抗体偶联的报告分子的非限制性实例包括酶、放射性标记物、半抗原、荧光标记物、磷光分子、化学发
光分子、发色团、光亲和分子、有色颗粒或配体、酶(例如,催化比色或荧光反应)、底物、固相基质,例如生物素。抗体可包含一种、两种或更多种这些标记物。
[0153]
抗体偶联物可用于向靶细胞递送细胞毒性剂。该类型的细胞毒性剂可改善抗体介导的细胞毒性,并包括诸如直接或间接刺激细胞死亡的细胞因子、放射性同位素、化疗药物(包括前药)、细菌毒素(例如,假单胞菌外毒素、白喉毒素等)、植物毒素(例如,蓖麻毒素、胶凝蛋白等)、化学偶联物(例如,美登木素毒素、奥瑞他汀、α-鹅膏蕈碱、蒽环类、卡雷霉素(calechaemicin)等)、放射性偶联物、酶偶联物(例如,rna酶偶联物、颗粒酶抗体导向的酶/前药疗法)等部分。
[0154]
抗体偶联物也可用作诊断试剂。抗体诊断通常分为两类,一类用于体外诊断,如各种免疫测定,另一类用于体内诊断方案,通常称为“抗体定向成像”本领域已知许多合适的成像剂,以及将其附着到抗体的方法(例如,参见美国专利5,021,236,4,938,948和4,472,509)。使用的成像部分可以是顺磁性离子、放射性同位素、荧光色素、nmr可检测物质和x射线成像剂。
[0155]
考虑用作偶联物的顺磁性离子是铬(iii)、锰(ii)、铁(iii)、铁(ii)、钴(ii)、镍(ii)、铜(ii)、钕(iii)、钐(iii)、镱(iii)、钆(iii)、钒(ii)、铽(iii)、镝(iii)、钬(iii)和/或铒(iii),其中钆是特别优选的。在其他情况如x射线成像时有用的离子,包括但不限于镧(iii)、金(iii),铅(ii)和铋(iii)。
[0156]
预期用于偶联的放射性同位素包括:锶
211
、
14
碳、
51
铬、
36
氯、
57
钴、
58
钴、铜
67
、
152
eu、镓
67
、3氢、碘
123
、碘
125
、碘
131
、铟
111
、
59
铁、
32
磷、铼
186
、铼
188
、
75
硒、
35
硫、锝
99m
和/或钇
90
。通常优选
125
i。锝
99m
和/或铟
111
也通常是优选的,因为它们的能量低并且适合于远距离检测。本公开的放射性标记的单克隆抗体可根据本领域公知的方法制备。例如,单克隆抗体可以通过与碘化钠和/或碘化钾以及化学氧化剂如次氯酸钠或酶氧化剂如乳过氧化物酶接触而碘化。根据本发明的单克隆抗体可以通过配体交换过程用锝
99m
标记,例如通过用亚锡溶液还原高锝酸盐,将还原的锝螯合到sephadex柱上并将抗体加到柱上。或者,可以使用直接标记技术,例如通过温育高锝酸盐、还原剂如sncl2、缓冲溶液如邻苯二甲酸钠钾溶液和抗体。通常用于将作为金属离子存在的放射性同位素与抗体结合的中间官能团是二亚乙基三胺五乙酸(dtpa)或乙二胺四乙酸(edta)。
[0157]
考虑用于偶联的荧光标记物包括alexa 350、alexa 430、amca、bodipy630/650、bodipy 650/665、bodip-fl、boidpy-r6g、bodipay-tmr、bodi-py-trx、级联蓝、cy3、cy5,6-fam、异硫氰酸荧光素、hex、6-joe、俄勒冈绿488、俄勒冈绿500、俄勒冈绿514、太平洋蓝、reg、罗丹明绿、罗丹明红、肾造影剂(renographin)、rox、tamra、tet、四甲基罗丹明和/或德克萨斯红。
[0158]
本公开中预期的其他类型的抗体是主要用于体外的那些,其中抗体与第二结合配体和/或酶(酶标签)连接,该酶在与显色底物接触时将产生有色产物。合适酶的例子包括脲酶、碱性磷酸酶、(辣根)过氧化氢酶或葡萄糖氧化酶。优选二级结合配体是生物素和亲和素以及链霉亲和素化合物。
[0159]
本领域已知几种将抗体附着或偶联到其偶联部分的方法。一些附着方法涉及使用金属螯合复合物,使用例如附着到抗体的有机螯合剂,例如二亚乙基三胺五乙酸酐(dtpa);亚乙基三胺四乙酸;n-氯对甲苯磺酰胺;和/或四氯-3α-6α-二苯甘脲-3(美国专利4,472,
509和4,938,948)。单克隆抗体也可以在耦合剂如戊二醛或高碘酸盐的存在下与酶反应。在这些耦合剂存在下或通过与异硫氰酸盐反应制备与荧光素标记物的偶联物。在美国专利4,938,948中,使用单克隆抗体实现乳腺肿瘤的成像,且可检测的成像部分使用诸如对羟基苯并咪酸甲酯或n-琥珀酰亚胺基-3-(4-羟基苯基)丙酸盐等接头结合到抗体。
[0160]
另一种已知的分子与抗体的位点特异性结合的方法包括抗体与基于半抗原的亲和标记物的反应。基本上,基于半抗原的亲和标记物与抗原结合位点中的氨基酸反应,从而破坏该位点并阻断特异性抗原反应。然而,这可能不是有利的,因为这会导致抗体偶联物失去抗原结合。
[0161]
含有叠氮基的分子也可用于通过低强度紫外光产生的反应性氮烯中间体与蛋白质形成共价键。特别是,嘌呤核苷酸的2-和8-叠氮基类似物已被用作定点光探针,以鉴定粗细胞提取物中的核苷酸结合蛋白。2-和8-叠氮核苷酸也已用于纯化蛋白的核苷酸结合域作图,并可用作抗体结合剂。
[0162]
还考虑了使用不改变抗体结合位点的反应条件,通过在免疫球蛋白的fc区选择性地引入巯基来衍生免疫球蛋白。本发明公开了根据该方法制备的抗体偶联物,以显示改进的寿命、特异性和灵敏度(美国专利5,196,066,通过引用并入本文)。文献中还公开了效应分子或报告分子的位点特异性附着,其中报告分子或效应分子与fc区的碳水化合物残基偶联。据报道,这种方法可产生诊断和治疗前景良好的抗体,目前正在临床评估中。
[0163]
f.抗体-药物偶联物
[0164]
抗体药物偶联物(adc)是一类新型高效生物制药药物,设计用于治疗疾病患者的靶向治疗。adc是由抗体(完整mab或抗体片段,如scfv)构成的复合分子,通过具有不稳定键的稳定化学接头与生物活性细胞毒性/抗病毒有效载荷或药物连接。抗体药物偶联物是生物偶联物和免疫偶联物的实例。
[0165]
通过将单克隆抗体的独特靶向能力与细胞毒性药物的抗癌能力相结合,抗体-药物偶联物可以灵敏区分健康组织和患病组织。这意味着,与传统的系统性方法相反,抗体药物偶联物靶向并攻击患病细胞,从而使健康细胞受到的影响较小。
[0166]
在基于adc的抗肿瘤疗法的开发中,将抗癌药物(例如,细胞的毒素或细胞毒素)与特异性靶向特定细胞标志物(例如,理想情况下仅在患病细胞中或其上发现的蛋白质)的抗体偶联。抗体在体内追踪这些蛋白质,并将它们附着在患病细胞的表面。抗体与靶蛋白(抗原)之间的生化反应在靶细胞中触发信号,然后靶细胞将抗体与细胞毒素一起吸收或内化。adc内化后,细胞毒性药物释放并杀死细胞或损害细胞复制。由于这种靶向性,理想情况下,该药物具有较低的副作用,并提供比其他药物更宽的治疗窗口。
[0167]
抗体和细胞毒性剂之间的稳定连接是adc的关键方面。接头基于化学基序,包括二硫化物、腙或肽(可裂解)或硫醚(不可裂解),并控制细胞毒性剂向靶细胞的分布和递送。在临床前和临床试验中,已证明可裂解和不可裂解类型的接头是安全的。本妥昔单抗维多汀包括一种酶敏感的可裂解接头,可将强效且剧毒的抗微管剂单甲基澳瑞他汀e或mmae(一种合成抗肿瘤剂)递送至人特异性cd30-阳性恶性细胞。由于mmae的高毒性,它通过阻断微管蛋白的聚合来抑制细胞分裂,因此不能用作单剂化疗药。然而,与抗-cd30单克隆抗体(cac10,肿瘤坏死因子或tnf受体的细胞膜蛋白)连接的mmae组合在细胞外液中被证明是稳定的,可被组织蛋白酶裂解,并可安全治疗。曲妥珠单抗美坦是另一种经批准的adc,是微管
形成抑制剂美登木素(dm-1,一种美登素的衍生物)和抗体曲妥珠单抗(/genentech/roche)的组合,通过稳定的、不可裂解的接头连接。
[0168]
更好、更稳定的接头的出现改变了化学键的功能。接头的类型,可裂解或不可裂解,赋予细胞毒性(如抗癌)药物特定的特性。例如,不可裂解的接头将药物保持在细胞内。结果,整个抗体、接头和细胞毒性试剂进入靶细胞,在靶细胞中抗体被降解至氨基酸水平。由此产生的复合物——氨基酸、接头和细胞毒性试剂——现在成为活性药物。相反,可裂解接头由宿主细胞中的酶催化,从而释放细胞毒性试剂。
[0169]
另一种类型的可裂解接头在细胞毒性药物和裂解位点之间添加了额外的分子。这种接头技术使研究人员能够创造出更具灵活性的adc,而无需担心切割动力学的变化。研究人员还在开发一种基于埃德曼降解的肽切割新方法。adc发展的未来方向还包括开发位点特异性偶联物(tdc),以进一步提高稳定性和治疗指数,以及α-发射免疫偶联物和抗体偶联纳米颗粒。
[0170]
g.内抗体
[0171]
在一个特定的实施方式中,抗体是适合在细胞内作用的重组抗体——这种抗体被称为“内抗体”。这些抗体可能通过多种机制干扰靶功能,例如通过改变细胞内蛋白质运输、干扰酶功能以及阻断蛋白质-蛋白质或蛋白质-dna相互作用。在许多方面,它们的结构模仿或平行于上文讨论的单链和单域抗体的结构。事实上,单转录物/单链是一个重要的特征,它允许在靶细胞中进行细胞内表达,也使蛋白质跨细胞膜转运更为可行。然而,需要额外特征。内抗体可能需要的另一个特征是细胞内靶向信号。已经设计出可将内抗体(或其他蛋白质)靶向亚细胞区域(如细胞质、细胞核、线粒体和er)的载体,并已上市(invitrogen corp.)。
[0172]
影响内抗体治疗实施的两个主要问题是递送,包括细胞/组织靶向和稳定性。关于递送,已经采用了多种方法,例如组织定向递送、使用细胞类型特异性启动子、基于病毒的递送、利用细胞通透性/膜易位肽以及利用外泌体递送。一种递送方式包括使用基于脂质的纳米颗粒或外泌体,如美国专利申请公开号2018/0177727中所述,其通过引用整体并入本文。关于稳定性,该方法通常是通过蛮力筛选,包括涉及噬菌体展示的方法,可能包括序列成熟或共有序列的开发,或更直接的修饰,如插入稳定化序列(例如,fc区、伴侣蛋白序列、亮氨酸拉链)和二硫化物置换/修饰。
[0173]
h.抗体的产生和纯化
[0174]
产生单克隆抗体的方法通常按照与制备多克隆抗体相同的路线开始。这两种方法的第一步都是对适当的宿主进行免疫。如本领域所知,用于免疫的特定组合物的免疫原性可能不同。因此,通常有必要增强宿主免疫系统,这可以通过将肽或多肽免疫原连接到运载体来实现。示例性和优选的运载体为钥孔戚血蓝蛋白(klh)和牛血清白蛋白(bsa)。其他白蛋白,例如卵清蛋白、小鼠血清白蛋白或兔血清白蛋白也可用作运载体。用于将多肽偶联到运载体蛋白的方法在本领域中是众所周知的,包括戊二醛、间-马来酰亚胺基-n-羟基丁二酰亚胺酯、碳二亚胺和双偶氮联苯胺。在本领域中还众所周知特定免疫原组合物的免疫原性可通过使用免疫反应的非特异性刺激物(称为佐剂)来增强。动物情况中的示例性和优选佐剂包括完全弗氏佐剂(含有杀死的结核分枝杆菌的免疫反应的非特异性刺激物),不完全弗氏佐剂和氢氧化铝佐剂,在人类情况中包括明矾(alum)、cpg、mfp59和免疫刺激分子的组
合(“佐剂系统”,如as01或as03)。接种以诱导抗原特异性b细胞的其他实验形式也是可能的,包括纳米颗粒疫苗,或以dna或rna基因在生理递送系统(如脂质纳米颗粒或金基因枪珠上)中递送,和用针、基因枪或经皮电穿孔装置递送的基因编码的抗原。抗原基因也可由复制感受态或缺陷型病毒载体编码来携带,如腺病毒、腺相关病毒、痘病毒、疱疹病毒或α病毒复制子,或者病毒样颗粒。
[0175]
产生产抗体细胞和骨髓瘤细胞杂交体的方法通常包括以2:1的比例将体细胞与骨髓瘤细胞混合,尽管在存在促进细胞膜融合的一种或多种试剂(化学或电)的情况下,比例可能从约20:1到约1:1不等。在某些情况下,用eb病毒(ebv)转化人类b细胞作为初始步骤,可增加b细胞的大小,增强与相对较大的骨髓瘤细胞的融合。在转化培养基中使用cpg和chk2抑制剂药物可提高ebv的转化效率。或者,人类b细胞可以通过与表达cd40配体(cd154)的转染细胞系在含有额外可溶性因子(如il-21和人类b细胞激活因子(baff,tnf超家族ii型成员))的培养基中共培养来激活。使用仙台病毒或聚乙二醇(peg)的融合方法也是已知的。使用电诱导融合方法也是合适的。融合程序通常以低频率(约为1
×
10-6
至1
×
10-8
)产生可存活的杂交体,但通过优化程序可以实现接近1/200的融合效率。然而,相对较低的融合效率并不构成问题,因为通过在选择性培养基中培养,可存活的融合杂交体与亲代未融合(infused)细胞(尤其是通常会无限分裂的未融合骨髓瘤细胞)区分开。选择性培养基通常是含有阻断组织培养基中核苷酸从头合成的试剂的培养基。示例性和优选试剂为氨基喋呤、氨甲喋呤和重氮丝氨酸。氨基喋呤、氨甲喋呤阻断嘌呤和嘧啶的从头合成,而重氮丝氨酸仅阻断嘌呤的合成。当使用氨基喋呤或氨甲喋呤时,培养基补充次黄嘌呤和胸苷作为核苷酸来源(hat培养基)。如果使用重氮丝氨酸,则培养基中补充次黄嘌呤。如果b细胞来源是ebv转化的人类b细胞系,则添加乌本苷(ouabain)以消除未与骨髓瘤融合的ebv转化系。
[0176]
优选的选择培养基是hat或含乌本苷的hat。只有能够运行核苷酸挽救途径的细胞才能在hat培养基中存活。骨髓瘤细胞缺乏挽救途径的关键酶,如次黄嘌呤磷酸核糖转移酶(hprt),由此无法存活。b细胞可以通过这一途径运作,但它们在培养物中的寿命有限,通常在两周内死亡。因此,唯一能在选择性培养基中存活的细胞是由骨髓瘤和b细胞形成的杂交细胞。当用于融合的b细胞来源为ebv转化的b细胞系时,如本文所述,乌本苷也可用于杂交体的药物选择,因为ebv转化的b细胞易受药物杀伤,而所用的骨髓瘤伴侣被选择为乌本苷耐受。
[0177]
培养提供杂交瘤群体,从中选择特定的杂交瘤。通常,杂交瘤的选择是通过在微量滴定板中进行单克隆稀释来培养细胞,然后测试单个克隆上清液(大约两到三周后)的所需反应性来进行的。该分析应灵敏、简单和快速,例如放射免疫分析、酶免疫分析、细胞毒性分析、斑块分析、斑点免疫结合分析等。然后将所选杂交瘤连续稀释或通过流式细胞术分选进行单细胞分选,并克隆到单个抗体产生细胞系中,然后这些克隆可以无限繁殖以提供单抗。细胞系可通过两种基本方式用于单抗的生产。可将杂交瘤样品注射到动物(如小鼠)体内(通常注入腹腔)。任选地,在注射之前,用烃,特别是油诸如姥鲛烷(pristane)对动物进行致敏。当以这种方式使用人类杂交瘤时,最好注射免疫功能低下的小鼠,如scid小鼠,以防止肿瘤排斥反应。经注射的动物产生肿瘤,分泌融合细胞杂交体产生的特异性单克隆抗体。然后,可提取动物的体液,如血清或腹水,以提供高浓度的单抗。单个细胞系也可以在体外培养,其中单克隆抗体自然分泌到培养基中,从中可以很容易地获得高浓度的单克隆抗体。
或者,人杂交瘤细胞系可用于在体外产生细胞上清液中的免疫球蛋白。该细胞系可适于在无血清培养基中生长,以优化回收高纯度人类单克隆免疫球蛋白的能力。
[0178]
可以培养杂交瘤,然后裂解细胞,提取总rna。随机六聚体可与rt生成rna的cdna拷贝,然后使用多重的pcr引物混合物进行pcr,以扩增所有人类可变基因序列。可将pcr产物克隆到pgem-t easy载体中,然后通过自动dna测序采用标准载体引物进行测序。可使用从杂交瘤上清液收集的抗体进行结合和中和测定,并使用蛋白g柱通过fplc纯化。
[0179]
通过将克隆载体中的重链和轻链fv dna亚克隆到igg质粒载体中,并转染到293(例如,freestyle)细胞或cho细胞中,可产生重组全长igg抗体,可从293或cho细胞上清液中收集和纯化抗体。其他合适的宿主细胞系统包括细菌,如大肠杆菌、昆虫细胞(s2、sf9、sf29、high five)、植物细胞(如烟草,含或不含人样聚糖工程化改造)、藻类,或在各种非人类转基因环境中,如小鼠、大鼠、山羊或牛。
[0180]
出于后续抗体纯化和宿主免疫的目的,还考虑了编码抗体的核酸的表达。抗体编码序列可以是rna,如天然rna或修饰rna。经修饰rna包括赋予mrna提高的稳定性和降低的免疫原性的某些化学修饰,从而促进治疗重要蛋白质的表达。例如,n1-甲基-假尿苷(n1mψ)在翻译能力方面优于其他几种核苷修饰及其组合。除了关闭免疫/eif2α磷酸化依赖性翻译抑制外,掺入的n1mψ核苷酸通过增加mr上的核糖体暂停和密度显著改变翻译过程的动力学。通过相同mrna上的核糖体循环或从头核糖体招募,经修饰mrna的核糖体负载量增加,使其更易于启动。此类修饰可用于增强rna接种后的体内抗体表达。无论是天然的还是经修饰的rna,都可作为裸rna递送或在递送载体(如脂质纳米颗粒)中递送。
[0181]
或者,编码抗体的dna可用于相同目的。dna包含在表达盒中,该表达盒包含在为其设计的宿主细胞中激活的启动子。该表达盒有利地包含在可复制载体中,例如传统质粒或微载体。载体包括病毒载体,如痘病毒、腺病毒、疱疹病毒、腺相关病毒和慢病毒。还涵盖了编码抗体基因的复制子,如基于vee病毒或辛德毕斯病毒的α病毒复制子。可通过肌肉内、皮下或皮内途径通过针头递送此类载体,或者在需要体内表达时通过经皮电穿孔递送。
[0182]
或者,分子克隆方法可用于产生单克隆抗体。用感兴趣抗原标记的单一b细胞可以使用顺磁珠选择或流式细胞仪分选进行物理分选,然后从单一细胞中分离rna,并通过rt-pcr扩增抗体基因。或者,可将抗原特异性批量分选细胞群分离成微囊泡,并使用重链和轻链扩增子的物理连接或囊泡重链和轻链基因的公共条形码从单一细胞中回收匹配的重链和轻链可变基因。也可以通过使用带有rt-pcr引物和用于标记转录物的条形码(每个细胞一个条形码)的细胞穿透型纳米颗粒来处理细胞,从抗原特异性b细胞群中获得形成单一细胞的匹配重链和轻链基因。抗体可变基因也可通过杂交瘤系的rna提取和通过rt-pcr获得的抗体基因分离并克隆到免疫球蛋白表达载体中。或者,从分离自细胞系的rna制备组合免疫球蛋白噬菌粒文库,并通过使用病毒抗原淘选表达适当抗体的噬菌粒。与传统杂交瘤技术相比,这种方法的优势在于一轮中可产生和筛选约104倍之多的抗体,且h和l链组合产生新的特异性,这进一步增加了找到合适抗体的机会。
[0183]
教导本公开中有用抗体的生产的其他美国专利(各自通过引用纳入本文)包括美国专利5,565,332,其描述了使用组合方法生产嵌合抗体;美国专利4,816,567,其描述了重组免疫球蛋白制剂;以及美国专利4,867,973,其描述了抗体-治疗剂偶联物。
[0184]
如果需要,可以使用过滤、离心和各种色谱法(如fplc或亲和色谱法)纯化通过任
何方法产生的单克隆抗体。本公开的单克隆抗体片段可通过包括用酶(例如胃蛋白酶或木瓜蛋白酶)消化和/或通过化学还原切割二硫键的方法从纯化的单克隆抗体获得。或者,可以使用自动肽合成仪合成本公开所涵盖的单克隆抗体片段。
[0185]
可以纯化本文所述的抗体。如本文所使用的术语“纯化的”意指能与其他组分分离的组合物,其中蛋白质相对于其天然可获得状态被纯化到任何程度。因此,纯化的蛋白质也指不受其天然存在环境影响的蛋白质。在使用术语“基本纯化的”的情况下,该名称将指其中蛋白质或肽构成组合物主要成分的组合物,例如构成组合物中约50%、约60%、约70%、约80%、约90%、约95%或更多的蛋白质。
[0186]
蛋白质纯化技术是本领域普通技术人员所熟知的。这些技术在某种程度上涉及将细胞环境粗分为多肽和非多肽组分。将多肽与其他蛋白质分离后,可使用色谱和电泳技术进一步纯化所需多肽,以实现部分或完全纯化(或纯化至同质)。特别适合于制备纯肽的分析方法有离子交换色谱法、排斥色谱法;聚丙烯酰胺凝胶电泳;等电聚焦。蛋白质纯化的其他方法包括,用硫酸铵、聚乙二醇、抗体等沉淀,或通过热变性,然后离心;凝胶过滤、反相、羟基磷灰石和亲和层析;以及这些技术和其他技术的组合。
[0187]
在纯化本公开的抗体时,可能需要在原核或真核表达系统中表达多肽,并使用变性条件提取蛋白质。可使用亲和柱从其他细胞组分纯化多肽,亲和柱结合多肽的标记部分。如本领域中一般所知,相信进行各种纯化步骤的顺序可以改变,或者某些步骤可以省略,并且仍然产生用于制备基本上纯化的蛋白质或肽的合适方法。
[0188]
通常,利用结合抗体fc部分的试剂(即蛋白a)分级完整抗体。或者,抗原可用于同时纯化和选择合适的抗体。此类方法通常利用结合到支持物(例如柱、过滤器或珠)的选择剂。抗体与支持物结合,去除污染物(例如,冲洗掉),并通过施加条件(盐、热等)释放抗体。
[0189]
结合本公开的启示,本领域技术人员将知道用于量化蛋白质或肽的纯化程度的各种方法。例如,这些包括测定活性级分的比活性,或通过sds/page分析评估级分内多肽的数量。评估级分纯度的另一种方法是计算级分的比活性,将其与初始提取物的比活性进行比较,从而计算纯度。当然,用于表示活性量的实际单位将取决于在纯化后选择的特定分析技术,以及表达的蛋白质或肽是否表现出可检测的活性。
[0190]
已知在不同的sds/page条件下,多肽的迁移可能会发生变化,有时会显著变化。因此,应了解,在不同电泳条件下,纯化或部分纯化表达产物的表观分子量可能不同。
[0191]
i.抗体的修饰
[0192]
抗体序列可能因多种原因而被修饰,例如表达改善、交叉反应性提高或脱靶结合减少。可通过本领域技术人员已知的任何技术制备修饰抗体,包括通过标准分子生物学方法表达的技术,或多肽的化学合成。
[0193]
例如,人们可能希望进行修饰,例如在抗体分子中引入保守变化。在进行此类改变时,可以考虑氨基酸的亲水性指数。亲水性氨基酸指数在赋予蛋白质交互生物功能方面的重要性在本领域中被普遍理解(kyte和doolittle,1982)。据认为,氨基酸的相对亲水性有助于形成所得蛋白质的二级结构,而二级结构又限定了该蛋白质与其他分子的相互作用,例如与酶、底物、受体、dna、抗体、抗原等。
[0194]
类似氨基酸的取代可以基于亲水性有效地进行。美国专利4,554,101(通过引用纳入本文)中陈述了由其相邻氨基酸的亲水性控制的蛋白质最大局部平均亲水性与该蛋白质
的生物活性相关。如美国专利4,554,101中详细说明,氨基酸残基的亲水性值如下:碱性氨基酸:精氨酸( 3.0)、赖氨酸( 3.0)和组氨酸(-0.5);酸性氨基酸:天冬氨酸( 3.0
±
1)、谷氨酸( 3.0
±
1)、天冬酰胺( 0.2)和谷氨酰胺( 0.2);亲水性非离子氨基酸:丝氨酸( 0.3)、天冬酰胺( 0.2)、谷氨酰胺( 0.2)和苏氨酸(-0.4),含硫氨基酸:半胱氨酸(-1.0)和甲硫氨酸(-1.3);疏水性非芳香族氨基酸:缬氨酸(-1.5)、亮氨酸(-1.8)、异亮氨酸(-1.8)、脯氨酸(-0.5
±
1)、丙氨酸(-0.5)和甘氨酸(0);疏水性芳香族氨基酸:色氨酸(-3.4)、苯丙氨酸(-2.5)和酪氨酸(-2.3)。
[0195]
一种氨基酸可被具有类似亲水性的另一种氨基酸取代,并产生生物或免疫修饰的蛋白质。在这种变化中,亲水性值在
±
2范围内的氨基酸的取代是优选的,那些在
±
1范围内的氨基酸的取代是特别优选的,那些在
±
0.5范围内的氨基酸的取代是更为优选的。
[0196]
氨基酸取代通常基于氨基酸侧链取代基的相对相似性,例如,其疏水性、亲水性、电荷、大小等。考虑到各种前述特征的示例性取代为本领域技术人员所熟知的,且包括:精氨酸和赖氨酸;谷氨酸和天冬氨酸;丝氨酸和苏氨酸;谷氨酰胺和天冬酰胺;以及缬氨酸、亮氨酸和异亮氨酸。
[0197]
本发明还涵盖了同型修饰。通过将fc区域修饰为不同的同种型,可以实现不同的功能。例如,改变为igg1可以增加抗体依赖性细胞毒性,改变为a类可以改善组织分布,改变为m类可以改善价性。
[0198]
可以设计具有改变的效应物功能的抗体fc区域,例如,通过修改c1q结合和/或fcγr结合,从而改变cdc活性和/或adcc活性。“效应物功能”负责激活或减少生物活性(例如,在对象中)效应物功能的示例包括但不限于:c1q结合;补体依赖性细胞毒性(cdc);fc受体结合;抗体依赖性细胞介导的细胞毒性(adcc);吞噬作用;细胞表面受体(例如,b细胞受体;bcr)等。此类效应物功能可要求fc区与结合结构域(例如,抗体可变结构域)结合,并可使用各种分析(例如,fc结合分析、adcc分析、cdc分析等)进行评估。
[0199]
例如,可以生成具有改善的c1q结合和改善的fcγriii结合(例如,同时具有改善的adcc活性和改善的cdc活性)的抗体的变体fc区。或者,如果希望降低或消除效应物功能,则可改造变体fc区使其具有降低的cdc活性和/或降低的adcc活性。在其他实施方式中,可仅提高这些活性中的一种,并且可选地,还可减少其他活性(例如,生成一个fc区变体,其adcc活性改善,但cdc活性降低,反之亦然)。
[0200]
一种分离的单克隆抗体或其抗原结合片段可含有基本上同质的聚糖,不含唾液酸、半乳糖或岩藻糖上述基本上同质的聚糖可共价连接到重链恒定区。
[0201]
单克隆抗体可能具有新的fc糖基化模式。fc区的糖基化通常为n-连接或o-连接。n-连接指糖部分附着在天冬酰胺残基的侧链上。o-连接糖基化指n-乙酰半乳糖胺、半乳糖或木糖中的一种附接于羟基氨基酸上,最常见的是丝氨酸或苏氨酸,虽然也可以使用5-羟脯氨酸或5-羟赖氨酸。酶促连接糖部分与天冬酰胺侧链肽序列的识别序列是天冬酰胺-x-丝氨酸和天冬酰胺-x-苏氨酸,其中x为脯氨酸以外的任意氨基酸。因此,多肽中这两种肽序列中任一的存在产生了潜在的糖基化位点。
[0202]
例如,可以通过使多肽中存在的一个或多个糖基化位点缺失和/或添加该多肽中不存在的一个或多个糖基化位点来改变糖基化模式。通过改变氨基酸序列,使其包含一个或多个上述三肽序列(用于n-连接糖基化位点),可以方便地实现将糖基化位点添加到抗体
的fc区。示例性糖基化变体具有重链残基asn 297的氨基酸取代。也可通过将一个或多个丝氨酸或苏氨酸残基添加到原始多肽序列(用于o-连接糖基化位点)或用丝氨酸或苏氨酸残基取代来进行改变。此外,asn 297变为ala可去除其中一个糖基化位点。
[0203]
分离的单克隆抗体或其抗原结合片段可以表示为gngn或g1/g2糖型的基本上同质的组合物存在,与没有基本上同质的gngn糖型且具有包含g0、g1f、g2f、gnf、gngnf或gngnfx的糖型的相同抗体相比,对fcγri和fcγriii的结合亲和力增强。fc糖基化在治疗性单克隆抗体的抗病毒和抗癌性质中起着重要作用。消除核心岩藻糖显著提高了自然杀伤(nk)细胞介导的单克隆抗体的adcc活性,但似乎对多形核细胞(pmn)的adcc活性有相反的作用。
[0204]
分离的单克隆抗体或其抗原结合片段可在表达β(1,4)-n-乙酰氨基葡萄糖转移酶iii(gnt iii)的细胞中表达,从而由gnt iii将glcnac加到抗体。这种方式产生抗体的方法见wo/9954342和wo/03011878。采用基因编辑技术,如成簇规律间隔短回文重复(crispr),可改变细胞系以增强或减少或消除某些翻译后修饰(如糖基化)。例如,可用crispr技术消除用于表达单克隆抗体的293或cho细胞中编码糖基化酶的基因。
[0205]
可以对从人类b细胞获得的抗体可变基因序列进行工程化改造,以增强其可制造性和安全性。通过搜索与如下所包含位点相关的序列基序,可以识别潜在的蛋白质序列不利因素(liabilities):
[0206]
1)不成对的cys残基,
[0207]
2)n-连接糖基化,
[0208]
3)asn脱酰胺化,
[0209]
4)asp异构化,
[0210]
5)sye截短化,
[0211]
6)met氧化,
[0212]
7)trp氧化,
[0213]
8)n-端谷氨酸,
[0214]
9)整合素结合性,
[0215]
10)cd11c/cd18结合性,或
[0216]
11)片段化。
[0217]
可通过改变包含编码抗体的cdna的合成基因来消除这些基序。
[0218]
可工程改造抗体以增强可溶性。例如,一些亲水性残基(如天冬氨酸、谷氨酸和丝氨酸)比其他亲水性残基(如天冬酰胺、谷氨酰胺、苏氨酸、赖氨酸和精氨酸)对蛋白质溶解度的贡献明显更大。
[0219]
已对来自献血者的人类b细胞进行了大规模的b细胞库深度测序。关于人类抗体库重要部分的序列信息有助于对健康人常见的抗体序列特征进行统计评估。通过了解人类重组抗体可变基因参考数据库中的抗体序列特征,可以估计抗体序列的“人类相似性”(hl)的位置特异性程度。hl已被证明有助于开发临床使用的抗体,如治疗性抗体或作为疫苗的抗体。目的是增加抗体的人类相似性,以减少潜在的不良反应和抗抗体免疫反应,这些反应将导致抗体药物的疗效显著降低或可能导致严重的健康影响。我们可以评估三名健康献血者总共约4亿个序列的组合抗体库的抗体特征,并创建聚焦于抗体高变区的新“相对人类相似性”(rhl)评分。rhl评分可以实现轻松区分人类序列(阳性评分)和非人类序列(阴性评分)。
抗体可以被工程化改造以消除人类库中不常见的残基。
[0220]
减少或消除抗体和抗体片段的抗原性的方法是本领域已知的。当将抗体给予人时,抗体最好是“人源化”的,以减少或消除人中的抗原性。优选地,每个人源化抗体对抗原具有与其衍生的非人源化小鼠抗体相同或基本相同的亲和力。
[0221]
在一种人源化方法中,创造了嵌合蛋白,其中小鼠免疫球蛋白恒定区被人免疫球蛋白恒定区取代。参见,例如,morrison等人,1984,proc.nat.acad.sci.81:6851-6855,neuberger等人,1984,nature 312:604-608;美国专利号6,893,625(robinson);5,500,362(罗宾逊);和4,816,567(cabilly)。
[0222]
在一种称为cdr移植的方法中,轻链和重链可变区的cdr被移植到另一物种的框架中。例如,鼠cdr可以移植到人fr中。在一些实施方式中,抗体的轻链可变区和重链可变区的cdr被移植到人fr或共有人fr中。为了产生共有人fr,将来自几个人重链或轻链氨基酸序列的fr进行比对以鉴定共有的氨基酸序列。cdr移植在美国专利号7,022,500(queen);6,982,321(winter);6,180,370(queen);6,054,297(carter);5,693,762(queen);5,859,205(adair);5,693,761(queen);5,565,332(hoogenboom);5,585,089(queen);5,530,101(queen);jones等人(1986)nature 321:522-525;riechmann等人(1988)nature 332:323-327;verhoeyen等人(1988)science 239:1534-1536;和winter(1998)febs lett 430:92-94中描述。
[0223]
在一种叫做“超人源化
tm”的方法中,人cdr序列选自人种系基因,基于人cdr与要人源化的小鼠抗体cdr的结构相似性。参见例如美国专利号6,881,557(foote);和tan等人,2002,j.immunol.169:1119-1125。
[0224]
其他降低免疫原性的方法包括“重塑”、“超嵌合”和“镶面(veneering)/表面重塑”。见例如vaswami等人,1998,annals of allergy,asthma,&immunol.81:105;roguska等人,1996,prot.engineer 9:895-904;and u.s.patent no.6,072,035(hardman)。在镶面/表面重塑方法中,鼠抗体中的表面可接触氨基酸残基被更常见于人抗体相同位置的氨基酸残基取代。例如,美国专利号5,639,641(pedersen)中描述了这种抗体的表面重塑。
[0225]
另一种将小鼠抗体转化为适合人类医疗用途的形式的方法称为activmab
tm
技术(vaccinex,inc.,rochester,ny),该技术涉及一种基于痘苗病毒的载体,用于在哺乳动物细胞中表达抗体。可以产生高水平的igg重链和轻链组合多样性。参见例如,美国专利号6,706,477(zauderer);6,800,442(zauderer);和6,872,518(zauderer)。将小鼠抗体转化为适合人类使用的形式的另一种方法是由kalobios pharmaceuticals,inc.(加利福尼亚州帕洛阿尔托)进行商业实践的技术。这项技术涉及使用专有的人类“受体”文库来产生用于抗体选择的“表位聚焦”文库。另一种将小鼠抗体修饰成适合人类医疗用途的形式的方法是人类工程(human engineering)
tm
,该技术由xoma(us)llc商业实践。见例如国际(pct)出版号wo 93/11794和美国专利号5,766,886(studnicka);5,770,196(studnicka);5,821,123(studnicka);和5,869,619(studnicka)。
[0226]
任何合适的方法,包括上述方法中的任何一种,都可以用于降低或消除抗体的人免疫原性。
[0227]
j.抗体表征
[0228]
根据本公开的抗体首先可通过其结合特异性来定义。本领域技术人员通过采用他
们熟知的技术评估给定抗体的结合特异性/亲和力,可以确定此类抗体是否属于本公开权利要求书的范围。例如,给定抗体结合的表位可由位于抗原分子内的3个或更多个(例如,3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个)氨基酸的单个连续序列组成(例如,结构域中的线性表位)。或者,表位可由位于抗原分子内的多个非连续氨基酸(或氨基酸序列)组成(例如,构象表位)。
[0229]
可用本领域普通技术人员已知的各种技术来确定抗体是否与多肽或蛋白质内的“一个或多个氨基酸相互作用”。示例性技术包括例如常规的交叉阻断实验,例如在《抗体》(antibodies),harlow和lane(冷泉港出版社,冷泉港,纽约)中描述的那些。可在各种结合分析中测定交叉阻断,如elisa、生物层干涉测量或表面等离子体共振。其他方法包括丙氨酸扫描突变分析,肽印迹分析(reineke(2004)methods mol.biol.248:443-63),肽裂解分析,使用单粒子重建的高分辨率电子显微镜技术,cryoem,或断层扫描,晶体学研究和nmr分析。另外,可以采用诸如表位切除,表位提取和抗原化学修饰的方法(tomer(2000)prot.sci.9:487-496)。可以用于鉴定抗体相互作用的多肽内氨基酸的另一种方法是通过质谱检测氢/氘交换。一般而言,氢/氘交换方法涉及氘标记目标蛋白质,然后将抗体与氘标记的蛋白质结合。接下来,蛋白质/抗体复合物被转移到水中,被抗体复合物保护的氨基酸内的可交换质子比不属于界面的氨基酸内的可交换质子以较慢的速率经历由氘到氢的反向交换。结果,形成蛋白质/抗体界面一部分的氨基酸可能保留氘,因此与未包含在界面中的氨基酸相比,其质量相对较高。抗体解离后,对目标蛋白进行蛋白酶切割和质谱分析,从而揭示与抗体相互作用的特定氨基酸相对应的氘标记残基。见例如ehring(1999)analytical biochemistry267:252-259;engen和smith(2001)anal.chem.73:256a-265a。
[0230]
术语“表位”是指抗原上b细胞和/或t细胞应答的部位。b细胞表位既可以由连续氨基酸形成,也可以由蛋白质三级折叠并列的非连续氨基酸形成。由连续氨基酸形成的表位通常在暴露于变性溶剂时保留,而由三级折叠形成的表位通常在用变性溶剂处理时丢失。表位通常包含呈现独特空间构象的至少3个、更通常至少5个或约8-10个氨基酸。
[0231]
修饰辅助概况分析(map),也称为基于抗原结构的抗体概况分析(asap),是一种根据每种抗体与化学或酶修饰抗原表面的结合图谱的相似性将针对同一抗原的大量单克隆抗体分类的方法(参见us 2004/0101920,通过引用整体纳入本文)。每一类别可反映一个独特的表位,该表位与另一类别所代表的表位明显不同或部分重叠。该技术允许快速筛选遗传学上相同的抗体,以便将特征描述集中在遗传学上不同的抗体上。当用于杂交瘤筛选时,map可能有助于鉴定产生具有所需特性的单克隆抗体的罕见杂交瘤克隆。map可用于将本公开的抗体分类为结合不同表位的抗体组。
[0232]
本公开包括可结合相同表位或相同表位一部分的抗体。通过使用本领域已知的常规方法,可以容易地确定抗体是否与参照抗体结合相同的表位或竞争与之结合。例如,为了确定测试抗体是否与参照抗体结合到同一表位,允许参照抗体在饱和条件下结合到靶分子。接下来,评估测试抗体结合目标分子的能力。如果测试抗体在参照抗体饱和结合目标分子后能够结合目标分子,则可以得出测试抗体与参照抗体结合不同表位的结论。另一方面,如果在与参照抗体饱和结合目标分子后,测试抗体不能与目标分子结合,则测试抗体可能与参照抗体结合相同的表位。
[0233]
为了确定抗体是否与例如77a抗体竞争结合,上述结合方法在两个方向上进行:在
package)中的gap、bestfit、blast、fasta和tfasta,575science dr.威斯康星州麦迪逊),或通过观察。
[0239]
适合测定序列相同性百分数和序列相似性百分数的算法示例是blast和blast 2.0算法,分别描述于altschul等(1977)nucl.acids res.25:3389-3402和altschul等(1990)j.mol.biol.215:403-410。blast和blast 2.0可与例如本文所述的参数一起使用,以确定本公开所述多核苷酸和多肽的序列相同性百分比。进行blast分析的软件可从国家生物技术信息中心(national center for biotechnology information)公开获得。抗体序列的重排性质和每个基因的可变长度要求对单个抗体序列进行多轮blast搜索。此外,手动组装不同的基因很困难且容易出错。序列分析工具igblast(万维网,ncbi.nlm.nih.gov/igblast/)识别与生殖系v、d和j基因的匹配、重排连接处的详细信息、ig v结构域框架区和互补性决定区的描述。igblast可以分析核苷酸或蛋白质序列,可以批量处理序列,并允许同时搜索种系基因数据库和其他序列数据库以最大限度地减少丢失可能最匹配的种系v基因的机会。
[0240]
一些方法中,“序列相同性百分比”通过两条最优排比的序列在至少20个位置的比较窗口中进行比较来确定,其中,就两序列的最优排比而言,多核苷酸或多肽序列在比较窗口中的部分相比参照序列(不含添加或缺失)可包含20%或更少(通常5%至15%或10%至12%)的添加或缺失(空位)。该百分比可如下计算:测定两种序列中出现相同核酸碱基或氨基酸残基的位置数产生匹配位置数,将该匹配位置数除以参照序列中位置的总数(即窗口大小),将所得结果乘以100产生序列相同性百分比。
[0241]
定义抗体的另一种方法是作为任何本文提供抗体及其抗原结合片段的“衍生物”。衍生抗体或抗体片段可使用本领域技术人员已知的技术通过化学修饰进行修饰,包括但不限于衣霉素的代谢合成、特定化学切割、乙酰化、调配等。在一个实施方式中,抗体衍生物将具有与亲本抗体类似或相同的功能。在另一个实施方式中,抗体衍生物将表现出相对于亲本抗体改变的活性。例如,衍生抗体(或其片段)可以比亲本抗体更紧密地结合到其表位或更耐蛋白水解。
[0242]
术语“衍生物”是指免疫特异性结合于抗原但包含相对于“亲本”(或野生型)分子包含一个、两个、三个、四个、五个或更多个氨基酸取代、添加、缺失或修饰的抗体或其抗原结合片段。此类氨基酸取代或添加可引入天然存在(即dna编码的)或非天然存在的氨基酸残基。术语“衍生物”包括例如具有改变的ch1、铰链、ch2、ch3或ch4区的变体,从而形成例如具有表现出增强或受损效应物或结合特性的变体fc区的抗体等。术语“衍生物”还包括非氨基酸修饰,例如,氨基酸可被糖基化(例如,甘露糖、2-n-乙酰葡萄糖胺、半乳糖、岩藻糖、葡萄糖、唾液酸、5-n-乙酰神经氨酸、5-糖神经氨酸(5-glycolneuraminic acid)等的含量改变)、乙酰化、聚乙二醇化、磷酸化、酰胺化,通过已知的保护/阻断基团、蛋白水解裂解、连接到细胞配体或其他蛋白质等衍生化。在一些实施方式中,改变的碳水化合物修饰调节了以下一种或多种:抗体的增溶、促进亚细胞运输和抗体的分泌,促进抗体组装、构象完整性和抗体介导的效应物功能。在特定实施方式中,相对于缺乏碳水化合物修饰的抗体,经改变的碳水化合物修饰增强抗体介导的效应物功能。导致抗体介导的效应功能改变的碳水化合物修饰在本领域中是公知的。
[0243]
人们可以确定抗体的生物物理性质。可以利用平均表观解链温度,利用高温使抗
体去折叠来确定相对稳定性。差示扫描量热法(dsc)测定分子的热容cp(每度加热所需的热量),作为温度的函数。可以使用dsc研究抗体的热稳定性。mab的dsc数据特别令人关注,因为它有时会解析mab结构内单个结构域的展开,在热谱图中产生多达三个峰(来自fab、ch2和ch3结构域的去折叠)。通常,fab结构域的去折叠产生最强的峰。dsc图谱和fc部分的相对稳定性显示了人igg1、igg2、igg3和igg4亚类的特征性差异(garber和demarest,biochem.biophys.res.common.355751-7572007)。还可以使用圆二色谱法(cd)使用cd光谱仪测定平均表观解链温度。以0.5nm的增量,在200至260nm范围内测定抗体的远紫外cd光谱。最终光谱可确定为20次累积的平均值。残基椭圆度值可在减去背景后计算。可检测抗体(0.1mg/ml)在235nm,25-95℃和1℃/分钟的加热速率下的热去折叠。可使用动态光散射(dls)评估聚集倾向。dls用于表征包括蛋白质的各种颗粒的大小。如果系统的尺寸不分散,则可以确定颗粒的平均有效直径。该测量取决于颗粒核心的大小、表面结构的大小和颗粒浓度。由于dls本质上测定了由粒子引起的散射光强度的波动,可以确定粒子的扩散系数。商用dla仪器中的dls软件显示不同直径的粒子群。使用dls可以方便地进行稳定性研究。样品的dls测定了通过确定颗粒的流体动力学半径是否增加来显示颗粒是否随时间聚集或随温度变化聚集。如果颗粒聚集在一起,则可以看到半径更大的颗粒群。通过原位控制温度,可以分析随温度变化的稳定性。毛细管电泳(ce)技术包括确定抗体稳定性特征的经验证的方法。可以使用ice方法来解决由于脱酰胺化、c-末端赖氨酸、唾液酸化、氧化、糖基化和任何其他可导致蛋白质pi变化。可通过毛细管柱(cief)中的高通量、游离溶液等电聚焦(ief)使用简单的蛋白质maurice仪器来评估每种所表达的抗体蛋白。全柱紫外吸收检测可每30秒进行一次,以实时监测等电点(pi)处的分子聚焦情况。该方法将传统凝胶ief的高分辨率与基于柱的分离中的定量和自动化优势相结合,同时消除了对转移步骤的需要。该技术可对所表达抗体的特性、纯度和异质性进行可重复的定量分析。结果鉴定了抗体上的电荷异质性和分子大小,具有吸光度和天然荧光检测模式,检测灵敏度降至0.7μg/ml。
[0244]
可以确定抗体序列的固有溶解度分数。固有溶解度分数可使用camsol intrinsic计算(sormanni等人,j mol biol 427478-4902015)。每个抗体片段(如单链抗体)hcdr3中残基95-102(kabat编号)的氨基酸序列可通过在线程序进行评估,以计算溶解度分数。还可以使用实验室技术测定溶解度。存在各种技术,包括向溶液中添加冻干蛋白质,直到溶液饱和并达到溶解度极限,或在具有适当分子量截止值的微浓缩器中通过超滤浓缩。最直接的方法是诱导无定形沉淀,该方法使用涉及使用硫酸铵沉淀蛋白质的方法来测定蛋白质溶解度(trevino等,j mol biol,366:449-460,2007)。硫酸铵沉淀提供了关于相对溶解度值的快速准确的信息。硫酸铵沉淀产生具有明确水相和固相的沉淀溶液,需要相对少量的蛋白质。利用硫酸铵诱导无定形沉淀进行的溶解度测量也可以在不同ph值下轻松完成。蛋白质的溶解度高度依赖于ph,ph被认为是影响溶解度的最重要的外部因素。
[0245]
一般认为,在个体发生过程中,应通过负选择消除自身反应性克隆;然而,很明显,许多具有自身反应特性的人类天然抗体存在于成人成熟库中,并且自身反应性可能增强许多抗病原体抗体的抗病毒功能。已经注意到,在早期b细胞发育期间,抗体中的hcdr3环通常富含正电荷,并表现出自身反应模式(wardemann等人,science 301,1374-1377,2003)。通过在显微镜下(使用贴壁的hela或hep-2上皮细胞)和流式细胞计数细胞表面染色(使用悬浮的jurkat t细胞和293s人类胚胎肾细胞)评估与人类来源细胞的结合水平,可以测试给
定抗体的自身反应性。自身反应性也可以通过评估组织阵列中与组织的结合来测量。
[0246]
k.具体实施方式
[0247]
在一个实施方式,本发明提供了单克隆抗体或抗体片段包含重链可变区(vh),所述重链可变区域包含gyx1ftx2yg(seq id no:214)的vhcdr1氨基酸序列,其中x1是t、s或i且x2为n或k,intytgex1(seq id no:215)的vhcdr2氨基酸序列,其中x1是p、s、t或a,和x1rydhx2mdy(seq id no:216)的vhcdr3氨基酸序列,其中x1是a、t、v或g且x2是a、r、f、t、p、v、s、d、n、h、l、y或g;和/或轻链可变区(vl),其包含qslx1nsgtrkny(seq id no:212)的vlcdr1氨基酸序列,其中x1为l、f或v,seq id no:5的vlcdr2氨基酸序列,以及kqsyx1lyt(seq id no:213)的vlcdr3氨基酸序列,其中x1是t、n或s。
[0248]
在一个实施方式中,本发明提供了单克隆抗体或抗体片段,其中抗体或抗体片段包含选自seq id no:1和164-166的vhcdr1氨基酸序列、选自seq id no:2和167-169的vhcdr2氨基酸序列以及选自seq id no:3和170-185的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含选自seq id no:4和159-161的vlcdr1氨基酸序列、seq id no:5的vlcdr2氨基酸序列和选自seq id no:6、162和163的vlcdr3氨基酸序列。
[0249]
在一个实施方式中,本文提供的是单克隆抗体或抗体片段,其中所述抗体或抗体片段包含:
[0250]
(i)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0251]
(ii)重链可变区(vh),其包含seq id no:164的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0252]
(iii)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:170的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0253]
(iv)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:162的vlcdr3氨基酸序列;
[0254]
(v)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:171的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0255]
(vi)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:172的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的
vlcdr3氨基酸序列;
[0256]
(vii)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:159的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0257]
(viii)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:173的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0258]
(ix)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:174的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0259]
(x)重链可变区(vh),其包含seq id no:164的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:175的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0260]
(xi)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:163的vlcdr3氨基酸序列;
[0261]
(xii)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:176的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0262]
(xiii)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:171的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:159的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0263]
(xiv)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:177的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0264]
(xv)重链可变区(vh),其包含seq id no:164的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:178的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0265]
(xvi)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:179的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含
seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0266]
(xvii)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:179的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:159的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0267]
(xviii)重链可变区(vh),其包含seq id no:164的vhcdr1氨基酸序列、seq id no:167的vhcdr2氨基酸序列和seq id no:174的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0268]
(xix)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:180的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0269]
(xx)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:181的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:162的vlcdr3氨基酸序列;
[0270]
(xxi)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:182的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0271]
(xxii)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:183的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0272]
(xxiii)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:181的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0273]
(xxiv)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:168的vhcdr2氨基酸序列和seq id no:184的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0274]
(xxv)重链可变区(vh),其包含seq id no:165的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:185的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0275]
(xxvi)重链可变区(vh),其包含seq id no:166的vhcdr1氨基酸序列、seq id no:
2的vhcdr2氨基酸序列和seq id no:170的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0276]
(xvii)重链可变区(vh),其包含seq id no:164的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:170的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0277]
(xxviii)重链可变区(vh),其包含seq id no:165的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0278]
(xxix)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:169的vhcdr2氨基酸序列和seq id no:174的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:160的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0279]
(xxx)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:184的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0280]
(xxxi)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:175的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0281]
(xxxii)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:167的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0282]
(xxxiii)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:169的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0283]
(xxxiv)重链可变区(vh),其包含seq id no:166的vhcdr1氨基酸序列、seq id no:167的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0284]
(xxxv)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:168的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0285]
(xxxvi)重链可变区(vh),其包含seq id no:166的vhcdr1氨基酸序列、seq id no:168的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0286]
(xxxvii)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:161的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0287]
(xxxviii)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:168的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:161的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0288]
(xxxix)重链可变区(vh),其包含seq id no:166的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:184的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0289]
(xl)重链可变区(vh),其包含seq id no:1的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:178的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:163的vlcdr3氨基酸序列;
[0290]
(xli)重链可变区(vh),其包含seq id no:164的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:170的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:162的vlcdr3氨基酸序列;
[0291]
(xlii)重链可变区(vh),其包含seq id no:166的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:183的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:161的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0292]
(xliii)重链可变区(vh),其包含seq id no:165的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:183的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;6;
[0293]
(xliv)重链可变区(vh),其包含seq id no:166的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:183的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:4的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0294]
(xlv)重链可变区(vh),其包含seq id no:165的vhcdr1氨基酸序列、seq id no:2的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:161的vlcdrl氨基酸序列、seq id no:5的vlcdr2氨基酸序列和seq id no:162
no:6的vlcdr3氨基酸序列;
[0305]
(viii)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:196的vhcdr2氨基酸序列和seq id no:172的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0306]
(ix)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:196的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:187的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0307]
(x)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:196的vhcdr2氨基酸序列和seq id no:173的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0308]
(xi)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:199的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0309]
(xii)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:196的vhcdr2氨基酸序列和seq id no:174的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0310]
(xiii)重链可变区(vh),其包含seq id no:192的vhcdr1氨基酸序列、seq id no:196的vhcdr2氨基酸序列和seq id no:175的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0311]
(xiv)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:200的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0312]
(xv)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:201的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0313]
(xvi)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:201的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:187的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0314]
(xvii)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:196的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包
no:196的vhcdr2氨基酸序列和seq id no:180的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0325]
(xxviii)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:201的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:162的vlcdr3氨基酸序列;
[0326]
(xxix)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:196的vhcdr2氨基酸序列和seq id no:181的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:162的vlcdr3氨基酸序列;
[0327]
(xxx)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:196的vhcdr2氨基酸序列和seq id no:182的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0328]
(xxxi)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:196的vhcdr2氨基酸序列和seq id no:183的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0329]
(xxxii)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:196的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:163的vlcdr3氨基酸序列;
[0330]
(xxxiii)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:196的vhcdr2氨基酸序列和seq id no:181的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0331]
(xxxiv)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:203的vhcdr2氨基酸序列和seq id no:184的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0332]
(xxxv)重链可变区(vh),其包含seq id no:194的vhcdr1氨基酸序列、seq id no:196的vhcdr2氨基酸序列和seq id no:185的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:189的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0333]
(xxxvi)重链可变区(vh),其包含seq id no:195的vhcdr1氨基酸序列、seq id no:197的vhcdr2氨基酸序列和seq id no:170的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0334]
(xxxvii)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:204的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0335]
(xxxviii)重链可变区(vh),其包含seq id no:192的vhcdr1氨基酸序列、seq id no:205的vhcdr2氨基酸序列和seq id no:170的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0336]
(xxxix)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:206的vhcdr2氨基酸序列和seq id no:171的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0337]
(xl)重链可变区(vh),其包含seq id no:194的vhcdr1氨基酸序列、seq id no:196的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0338]
(xli)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:207的vhcdr2氨基酸序列和seq id no:174的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:190的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0339]
(xlii)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:196的vhcdr2氨基酸序列和seq id no:184的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0340]
(xliii)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:206的vhcdr2氨基酸序列和seq id no:184的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0341]
(xliv)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:196的vhcdr2氨基酸序列和seq id no:175的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0342]
(xlv)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:196的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:189的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0343]
(xlvi)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:202的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:
6的vlcdr3氨基酸序列;
[0344]
(xlvii)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:207的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0345]
(xlviii)重链可变区(vh),其包含seq id no:195的vhcdr1氨基酸序列、seq id no:202的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0346]
(xlix)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:208的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0347]
(l)重链可变区(vh),其包含seq id no:195的vhcdr1氨基酸序列、seq id no:209的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0348]
(li)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:209的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:187的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0349]
(lii)重链可变区(vh),其包含seq id no:195的vhcdr1氨基酸序列、seq id no:206的vhcdr2氨基酸序列和seq id no:184的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0350]
(liii)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:210的vhcdr2氨基酸序列和seq id no:178的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:163的vlcdr3氨基酸序列;
[0351]
(liv)重链可变区(vh),其包含seq id no:192的vhcdr1氨基酸序列、seq id no:197的vhcdr2氨基酸序列和seq id no:170的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:162的vlcdr3氨基酸序列;
[0352]
(lv)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:210的vhcdr2氨基酸序列和seq id no:174的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:188的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0353]
(lvi)重链可变区(vh),其包含seq id no:195的vhcdr1氨基酸序列、seq id no:196的vhcdr2氨基酸序列和seq id no:183的vhcdr3氨基酸序列;和/或轻链可变区(vl),其
包含seq id no:187的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0354]
(lvii)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:209的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0355]
(lviii)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:196的vhcdr2氨基酸序列和seq id no:184的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:188的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0356]
(lix)重链可变区(vh),其包含seq id no:194的vhcdr1氨基酸序列、seq id no:196的vhcdr2氨基酸序列和seq id no:183的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0357]
(lx)重链可变区(vh),其包含seq id no:195的vhcdr1氨基酸序列、seq id no:196的vhcdr2氨基酸序列和seq id no:183的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:188的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0358]
(lxi)重链可变区(vh),其包含seq id no:192的vhcdr1氨基酸序列、seq id no:211的vhcdr2氨基酸序列和seq id no:170的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0359]
(lxii)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:210的vhcdr2氨基酸序列和seq id no:172的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:189的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0360]
(lxiii)重链可变区(vh),其包含seq id no:195的vhcdr1氨基酸序列、seq id no:196的vhcdr2氨基酸序列和seq id no:183的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:187的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0361]
(lxiv)重链可变区(vh),其包含seq id no:194的vhcdr1氨基酸序列、seq id no:206的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:187的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:162的vlcdr3氨基酸序列;
[0362]
(lxv)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:208的vhcdr2氨基酸序列和seq id no:183的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;
[0363]
(lxvi)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:
199的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:187的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列;或
[0364]
(lxvii)重链可变区(vh),其包含seq id no:193的vhcdr1氨基酸序列、seq id no:199的vhcdr2氨基酸序列和seq id no:184的vhcdr3氨基酸序列;和/或轻链可变区(vl),其包含seq id no:186的vlcdrl氨基酸序列、seq id no:191的vlcdr2氨基酸序列和seq id no:6的vlcdr3氨基酸序列。
[0365]
在一些方面,抗体或抗体片段包含具有以下序列的重链可变序列:
[0366]
x1x2qlx3x4sgx5x6x7x8kpgx9sx
10
x
11
x
12
sckx
13
sgytftnygmnwvrqapgx
14
glx
15
wx
16
gwintytgeptyaddfkgrx
17
tx
18
x
19
x
20
dx
21
sx
22
x
23
tx
24
yx
25
x
26
x
27
x
28
x
29
lx
30
x
31
x
32
dtavyfcarydhamdywgqgtx
33
vtvss(seq id no:18),
[0367]
其中x1是q或e,x2是i或v,x3是v或q,x4是q或e,x5是a,p,或g,x6是e或g,x7是v或l,x8是v或k,x9是a,e,g,或s,x
10
是v或l,x
11
是k或r,x
12
是v,l,或i,x
13
是a或t,x
14
是k或q,x
15
是e或k,x
16
是m或v,x
17
是f或v,x
18
是f,m,或i,x
19
是t或s,x
20
是t,r,或a,x
21
是t,d,或e,x
22
是t,a,或k,x
23
是s或n,x
24
是l或a,x
25
是m或l,x
26
是e或q,x
27
是l或m,x
28
是r,s,t,或n,x
29
是s或g,x
30
是r,k,或m,x
31
是s或t,x
32
是d或e,和x
33
是l,s,或t;
[0368]
和/或轻链可变序列,其具有序列:
[0369]
x1x2x3x4tqspx5slx6x7sx8gx9rx
10
tix
11
ckssqsllnsgtrknylawyqqkx
12
gx
13
x
14
px
15
lliywtstresgvpx
16
rfsgsgsgtdftltix
17
x
18
lqx
19
edvax
20
yyckqsytlytfgx
21
gtkx
22
eik(seq id no:26),其中
[0370]
x1是e或d,x2是i或v,x3是v或q,x4是l或m,x5是d或s,x6是a或s,x7是v或a,x8是l或v,x9是e或d,x
10
是a或v,x
11
是n或t,x
12
是a或p,x
13
是q或k,x
14
是s,v,或p,x
15
是k或r,x
16
是d或s,x
17
是s,d,或n,x
18
是s或t,x
19
是a或p,x
20
是v或t,x
21
是q或g,和x
22
是l或v。
[0371]
在一些方面,所述抗体或抗体片段包含具有以下序列的重链可变序列:
[0372]
qix1lvqsgx2evkkpgasvkvsckasgyx3ftx4ygmnwvrqapgqglewmgwintytgex5x6yx7ddfkgrftfttdtstx8tx9ymx
10
x
11
rslrsddtavyfcx
12
rydhx
13
mdywgqgx
14
lvtvss
[0373]
(seq id no:104),其中x1是q或h,x2是a,d,t,v,s,或p,x3是t,s,或i,x4是n或k,x5是p,s,t,或a,x6是t,r,k,或i,x7是a,t,v,s,或g,x8是s,r,或t,x9是a,v,或g,x
10
是e或d,x
11
是l或v,x
12
是a,t,v,或g,x
13
是a,r,f,t,p,v,s,d,n,h,l,y,或g,和x
14
是t或s;
[0374]
和/或轻链可变序列,其具有序列:
[0375]
eivltqspdslx1vslgeratix2ckssqslx3nsgtrknylx4wyqx5kx6gqspx7lx8iywtstresgvpdrfsx9sgsgtdftlx
10
idx
11
lqx
12
edvax
13
yyckqsyx
14
lytfgggtkveik
[0376]
(seq id no:158),其中x1是a,t,或s,x2是n或k,x3是l,f,或v,x4是a,s,或t,x5是q或k,x6是a,p,或s,x7是k或n,x8是l,v,或i,x9是g或a,x
10
是t或s,x
11
是s或r,x
12
是a或t,x
13
是v,i,或l,和x
14
是t,n,或s。
[0377]
在一些方面,所述抗体或抗体片段包含具有选自seq id no:7、12-17、26-103和225-229的序列的重链可变序列,或与seq id no:7、12-17、26-103和225-229中任一具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有选自seq id no:8、19-24、105-157和230-234的序列的轻链可变序列,或与seq id no:8、19-24、
105-157和230-234中任一具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列。
[0378]
在一些方面,所述抗体或抗体片段包括:
[0379]
(i)具有seq id no:7序列的重链可变序列,或与seq id no:7具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:8序列的轻链可变序列,或与seq id no:8具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0380]
(ii)具有seq id no:12序列的重链可变序列,或与seq id no:12具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:19序列的轻链可变序列,或与seq id no:19具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0381]
(iii)具有seq id no:12序列的重链可变序列,或与seq id no:12具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:20序列的轻链可变序列,或与seq id no:20具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0382]
(iv)具有seq id no:12序列的重链可变序列,或与seq id no:12具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:21序列的轻链可变序列,或与seq id no:21具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0383]
(v)具有seq id no:12序列的重链可变序列,或与seq id no:12具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:22序列的轻链可变序列,或与seq id no:22具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0384]
(vi)具有seq id no:12序列的重链可变序列,或与seq id no:12具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:23序列的轻链可变序列,或与seq id no:23具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0385]
(vii)具有seq id no:12序列的重链可变序列,或与seq id no:12具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:24序列的轻链可变序列,或与seq id no:24具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0386]
(viii)具有seq id no:13序列的重链可变序列,或与seq id no:13具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:19序列的轻链可变序列,或与seq id no:19具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0387]
(ix)具有seq id no:13序列的重链可变序列,或与seq id no:13具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:20序列的轻链可变序列,或与seq id no:20具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0388]
(x)具有seq id no:13序列的重链可变序列,或与seq id no:13具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:21序列的轻链可变序列,或与seq id no:21具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0389]
(xi)具有seq id no:13序列的重链可变序列,或与seq id no:13具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:22序列的轻链可变序列,或与seq id no:22具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0390]
(xii)具有seq id no:13序列的重链可变序列,或与seq id no:13具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:23序列的轻链可变序列,或与seq id no:23具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0391]
(xiii)具有seq id no:13序列的重链可变序列,或与seq id no:13具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:24序列的轻链可变序列,或与seq id no:24具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0392]
(xiv)具有seq id no:14序列的重链可变序列,或与seq id no:14具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:19序列的轻链可变序列,或与seq id no:19具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0393]
(xv)具有seq id no:14序列的重链可变序列,或与seq id no:14具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:20序列的轻链可变序列,或与seq id no:20具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0394]
(xvi)具有seq id no:14序列的重链可变序列,或与seq id no:14具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:21序列的轻链可变序列,或与seq id no:21具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0395]
(xvii)具有seq id no:14序列的重链可变序列,或与seq id no:14具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:22序列的轻链可变序列,或与seq id no:22具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0396]
(xviii)具有seq id no:14序列的重链可变序列,或与seq id no:14具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:23序列的轻链可变序列,或与seq id no:23具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0397]
(xix)具有seq id no:14序列的重链可变序列,或与seq id no:14具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:24序列的轻链可变序列,或与seq id no:24具有至少70%、80%、90%、95%、96%、97%、98%
no:22序列的轻链可变序列,或与seq id no:22具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0408]
(xxx)具有seq id no:16序列的重链可变序列,或与seq id no:16具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:23序列的轻链可变序列,或与seq id no:23具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0409]
(xxxi)具有seq id no:16序列的重链可变序列,或与seq id no:16具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:24序列的轻链可变序列,或与seq id no:24具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0410]
(xxxii)具有seq id no:17序列的重链可变序列,或与seq id no:17具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:19序列的轻链可变序列,或与seq id no:19具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0411]
(xxxiii)具有seq id no:17序列的重链可变序列,或与seq id no:17具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:20序列的轻链可变序列,或与seq id no:20具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0412]
(xxxiv)具有seq id no:17序列的重链可变序列,或与seq id no:17具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:21序列的轻链可变序列,或与seq id no:21具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0413]
(xxxv)具有seq id no:17序列的重链可变序列,或与seq id no:17具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:22序列的轻链可变序列,或与seq id no:22具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0414]
(xxxvi)具有seq id no:17序列的重链可变序列,或与seq id no:17具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:23序列的轻链可变序列,或与seq id no:23具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0415]
(xxxvii)具有seq id no:17序列的重链可变序列,或与seq id no:17具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:24序列的轻链可变序列,或与seq id no:24具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0416]
(xxxviii)具有seq id no:26序列的重链可变序列,或与seq id no:26具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:105序列的轻链可变序列,或与seq id no:105具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0417]
(xxxix)具有seq id no:27序列的重链可变序列,或与seq id no:27具有至少
70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:105序列的轻链可变序列,或与seq id no:105具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0418]
(xl)具有seq id no:28序列的重链可变序列,或与seq id no:28具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:105序列的轻链可变序列,或与seq id no:105具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0419]
(xli)具有seq id no:29序列的重链可变序列,或与seq id no:29具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:105序列的轻链可变序列,或与seq id no:105具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0420]
(xlii)具有seq id no:30序列的重链可变序列,或与seq id no:30具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:106序列的轻链可变序列,或与seq id no:106具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0421]
(xliii)具有seq id no:31序列的重链可变序列,或与seq id no:31具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:105序列的轻链可变序列,或与seq id no:105具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0422]
(xliv)具有seq id no:32序列的重链可变序列,或与seq id no:32具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:105序列的轻链可变序列,或与seq id no:105具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0423]
(xlv)具有seq id no:30序列的重链可变序列,或与seq id no:30具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:107序列的轻链可变序列,或与seq id no:107具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0424]
(xlvi)具有seq id no:33序列的重链可变序列,或与seq id no:33具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:105序列的轻链可变序列,或与seq id no:105具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0425]
(xlvii)具有seq id no:34序列的重链可变序列,或与seq id no:34具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:105序列的轻链可变序列,或与seq id no:105具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0426]
(xlviii)具有seq id no:30序列的重链可变序列,或与seq id no:30具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:108序列的轻链可变序列,或与seq id no:108具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0427]
(xlix)具有seq id no:30序列的重链可变序列,或与seq id no:30具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:109序列的轻链可变序列,或与seq id no:109具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0428]
(l)具有seq id no:35序列的重链可变序列,或与seq id no:35具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:105序列的轻链可变序列,或与seq id no:105具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0429]
(li)具有seq id no:36序列的重链可变序列,或与seq id no:36具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:105序列的轻链可变序列,或与seq id no:105具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0430]
(lii)具有seq id no:37序列的重链可变序列,或与seq id no:37具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:105序列的轻链可变序列,或与seq id no:105具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0431]
(liii)具有seq id no:26序列的重链可变序列,或与seq id no:26具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:107序列的轻链可变序列,或与seq id no:107具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0432]
(liv)具有seq id no:38序列的重链可变序列,或与seq id no:38具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:105序列的轻链可变序列,或与seq id no:105具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0433]
(lv)具有seq id no:31序列的重链可变序列,或与seq id no:31具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:110序列的轻链可变序列,或与seq id no:110具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0434]
(lvi)具有seq id no:39序列的重链可变序列,或与seq id no:39具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:105序列的轻链可变序列,或与seq id no:105具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0435]
(lvii)具有seq id no:40序列的重链可变序列,或与seq id no:40具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:105序列的轻链可变序列,或与seq id no:105具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0436]
(lviii)具有seq id no:34序列的重链可变序列,或与seq id no:34具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:111序列的轻链可变序列,或与seq id no:111具有至少70%、80%、90%、95%、96%、
no:117序列的轻链可变序列,或与seq id no:117具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0447]
(lxix)具有seq id no:45序列的重链可变序列,或与seq id no:45具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:105序列的轻链可变序列,或与seq id no:105具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0448]
(lxx)具有seq id no:46序列的重链可变序列,或与seq id no:46具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:105序列的轻链可变序列,或与seq id no:105具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0449]
(lxxi)具有seq id no:36序列的重链可变序列,或与seq id no:36具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:118序列的轻链可变序列,或与seq id no:118具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0450]
(lxxii)具有seq id no:47序列的重链可变序列,或与seq id no:47具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:115序列的轻链可变序列,或与seq id no:115具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0451]
(lxxiii)具有seq id no:48序列的重链可变序列,或与seq id no:48具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:109序列的轻链可变序列,或与seq id no:109具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0452]
(lxxiv)具有seq id no:49序列的重链可变序列,或与seq id no:49具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:105序列的轻链可变序列,或与seq id no:105具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0453]
(lxxv)具有seq id no:50序列的重链可变序列,或与seq id no:50具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:105序列的轻链可变序列,或与seq id no:105具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0454]
(lxxvi)具有seq id no:51序列的重链可变序列,或与seq id no:51具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:106序列的轻链可变序列,或与seq id no:106具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0455]
(lxxvii)具有seq id no:52序列的重链可变序列,或与seq id no:52具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:119序列的轻链可变序列,或与seq id no:119具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0456]
(lxxvii)具有seq id no:53序列的重链可变序列,或与seq id no:53具有至少
70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:108序列的轻链可变序列,或与seq id no:108具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0457]
(lxxix)具有seq id no:54序列的重链可变序列,或与seq id no:54具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:105序列的轻链可变序列,或与seq id no:105具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0458]
(lxxx)具有seq id no:55序列的重链可变序列,或与seq id no:55具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:116序列的轻链可变序列,或与seq id no:116具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0459]
(lxxxi)具有seq id no:56序列的重链可变序列,或与seq id no:56具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:116序列的轻链可变序列,或与seq id no:116具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0460]
(lxxxii)具有seq id no:57序列的重链可变序列,或与seq id no:57具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:120序列的轻链可变序列,或与seq id no:120具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0461]
(lxxxiii)具有seq id no:58序列的重链可变序列,或与seq id no:58具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:121序列的轻链可变序列,或与seq id no:121具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0462]
(lxxxiv)具有seq id no:59序列的重链可变序列,或与seq id no:59具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:122序列的轻链可变序列,或与seq id no:122具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0463]
(lxxxv)具有seq id no:60序列的重链可变序列,或与seq id no:60具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:108序列的轻链可变序列,或与seq id no:108具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0464]
(lxxxvi)具有seq id no:61序列的重链可变序列,或与seq id no:61具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:123序列的轻链可变序列,或与seq id no:123具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0465]
(lxxxvii)具有seq id no:62序列的重链可变序列,或与seq id no:62具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:114序列的轻链可变序列,或与seq id no:114具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0466]
(lxxxviii)具有seq id no:63序列的重链可变序列,或与seq id no:63具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:124序列的轻链可变序列,或与seq id no:124具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0467]
(lxxxix)具有seq id no:64序列的重链可变序列,或与seq id no:64具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:105序列的轻链可变序列,或与seq id no:105具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0468]
(xc)具有seq id no:65序列的重链可变序列,或与seq id no:65具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:125序列的轻链可变序列,或与seq id no:125具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0469]
(xci)具有seq id no:66序列的重链可变序列,或与seq id no:66具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:105序列的轻链可变序列,或与seq id no:105具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0470]
(xcii)具有seq id no:67序列的重链可变序列,或与seq id no:67具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:125序列的轻链可变序列,或与seq id no:125具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0471]
(xciii)具有seq id no:68序列的重链可变序列,或与seq id no:68具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:126序列的轻链可变序列,或与seq id no:126具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0472]
(xciv)具有seq id no:69序列的重链可变序列,或与seq id no:69具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:127序列的轻链可变序列,或与seq id no:127具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0473]
(xcv)具有seq id no:70序列的重链可变序列,或与seq id no:70具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:128序列的轻链可变序列,或与seq id no:128具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0474]
(xcvi)具有seq id no:71序列的重链可变序列,或与seq id no:71具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:117序列的轻链可变序列,或与seq id no:117具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0475]
(xcvii)具有seq id no:72序列的重链可变序列,或与seq id no:72具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:129序列的轻链可变序列,或与seq id no:129具有至少70%、80%、90%、95%、96%、
no:138序列的轻链可变序列,或与seq id no:138具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0486]
(cviii)具有seq id no:81序列的重链可变序列,或与seq id no:31具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:139序列的轻链可变序列,或与seq id no:139具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0487]
(cix)具有seq id no:82序列的重链可变序列,或与seq id no:82具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:105序列的轻链可变序列,或与seq id no:105具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0488]
(cx)具有seq id no:83序列的重链可变序列,或与seq id no:83具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:126序列的轻链可变序列,或与seq id no:126具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0489]
(cxi)具有seq id no:84序列的重链可变序列,或与seq id no:84具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:140序列的轻链可变序列,或与seq id no:140具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0490]
(cxii)具有seq id no:85序列的重链可变序列,或与seq id no:85具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:141序列的轻链可变序列,或与seq id no:141具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0491]
(cxiii)具有seq id no:86序列的重链可变序列,或与seq id no:86具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:141序列的轻链可变序列,或与seq id no:141具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0492]
(cxiv)具有seq id no:87序列的重链可变序列,或与seq id no:87具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:117序列的轻链可变序列,或与seq id no:117具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0493]
(cxv)具有seq id no:88序列的重链可变序列,或与seq id no:88具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:142序列的轻链可变序列,或与seq id no:142具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0494]
(cxvi)具有seq id no:89序列的重链可变序列,或与seq id no:89具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:143序列的轻链可变序列,或与seq id no:143具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0495]
(cxvii)具有seq id no:90序列的重链可变序列,或与seq id no:90具有至少
70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:144序列的轻链可变序列,或与seq id no:144具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0496]
(cxviii)具有seq id no:91序列的重链可变序列,或与seq id no:91具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:109序列的轻链可变序列,或与seq id no:109具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0497]
(cxix)具有seq id no:92序列的重链可变序列,或与seq id no:92具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:145序列的轻链可变序列,或与seq id no:145具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0498]
(cxx)具有seq id no:93序列的重链可变序列,或与seq id no:93具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:146序列的轻链可变序列,或与seq id no:146具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0499]
(cxxi)具有seq id no:94序列的重链可变序列,或与seq id no:94具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:147序列的轻链可变序列,或与seq id no:147具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0500]
(cxxii)具有seq id no:95序列的重链可变序列,或与seq id no:95具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:148序列的轻链可变序列,或与seq id no:148具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0501]
(cxxiii)具有seq id no:96序列的重链可变序列,或与seq id no:96具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:149序列的轻链可变序列,或与seq id no:149具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0502]
(cxxiv)具有seq id no:97序列的重链可变序列,或与seq id no:97具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:150序列的轻链可变序列,或与seq id no:150具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0503]
(cxxv)具有seq id no:98序列的重链可变序列,或与seq id no:98具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:151序列的轻链可变序列,或与seq id no:151具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0504]
(cxxvi)具有seq id no:99序列的重链可变序列,或与seq id no:99具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:152序列的轻链可变序列,或与seq id no:152具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0505]
(cxxvii)具有seq id no:100序列的重链可变序列,或与seq id no:100具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:136序列的轻链可变序列,或与seq id no:136具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0506]
(cxxviii)具有seq id no:91序列的重链可变序列,或与seq id no:91具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:153序列的轻链可变序列,或与seq id no:153具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0507]
(cxxix)具有seq id no:101序列的重链可变序列,或与seq id no:101具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:154序列的轻链可变序列,或与seq id no:154具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0508]
(cxxx)具有seq id no:102序列的重链可变序列,或与seq id no:102具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:155序列的轻链可变序列,或与seq id no:155具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;
[0509]
(cxxxi)具有seq id no:36序列的重链可变序列,或与seq id no:36具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:156序列的轻链可变序列,或与seq id no:156具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列;或
[0510]
(cxxxii)具有seq id no:103序列的重链可变序列,或与seq id no:103具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的重链可变序列;和/或具有seq id no:157序列的轻链可变序列,或与seq id no:157具有至少70%、80%、90%、95%、96%、97%、98%或99%相同性的轻链可变序列。
[0511]
在一个实施方式中,本文还提供了单克隆抗体或抗体片段,其竞争结合与根据本实施方式中任一所述的单克隆抗体和抗体片段相同的hsp70上的表位。在一个实施方式中,本文提供的是单克隆抗体或抗体片段,其结合或能够结合由本实施方式中任一抗体或抗体片段识别的hsp70上的表位。
[0512]
在一个实施方式中,本文提供的是单克隆抗体或抗体片段,其中所述单克隆抗体或者抗体片段结合由对应于seq id no:11的k573-q601的肽定义的hsp70表位。在一些方面,当与hsp70结合时,单克隆抗体或抗体片段与以下残基中的一个或两个结合:seq id no:11的h594、k595和q601。在一些方面,当与hsp70结合时,单克隆抗体或抗体片段与以下残基中的全部结合:seq id no:11的h594、k595和q601。在一些方面,当与hsp70结合时,单克隆抗体或抗体片段还与以下残基中的至少一个结合:seq id no:11的k573、e576、w580、r596和e598。在一些方面,当与hsp70结合时,所述单克隆抗体或抗体片段还与以下残基中的至少两个、三个、四个或五个结合:seq id no:11的k573、e576、w580、r596和e598。在一些方面,当与hsp70结合时,单克隆抗体或抗体片段与以下残基中的全部结合:seq id no:11的k573、e576、w580、h594、k595、r596、e598和q601。
[0513]
在本发明任一实施方式的一些方面中,抗体结合或能够结合hsp70。在本发明任一
实施方式的一些方面中,抗体结合或能够结合adp结合形式的hsp70。在本发明任一实施方式的一些方面中,抗体结合或能够结合肽结合形式的hsp70。在本发明任一实施方式的一些方面中,抗体结合或能够结合adp结合和肽结合形式的hsp70。在本发明任一实施方式的一些方面中,抗体不诱导抗体依赖性细胞毒性。在本发明任一实施方式的一些方面中,抗体不诱导补体依赖性细胞毒性。在本发明任一实施方式的某些方面,抗体增强免疫效应细胞(例如,单核细胞/巨噬细胞和树突细胞)对hsp70的摄取。在一些方面,摄取由人fcγr2a和/或人fcγr2b介导。
[0514]
在一些方面,抗体结合或能够结合hsp70。在一些方面,抗体以以下kd结合人hsp70(例如adp结合和/或肽结合形式的hsp70):小于约20,10,9,8,7,6,5,4,3,2,1,0.9,0.85,0.8,0.75,0.7,0.6,0.5,0.1,0.05nm,或20,10,9,8,7,6,5,4,3,2,1,0.9,0.85,0.8,0.75,0.7,0.6,0.5,0.1,或0.05pm,如用octet生物层干涉测量法测定。在一些方面,抗体以以下kd结合人hsp70(例如adp结合和/或肽结合形式的hsp70):从约20nm到约0.05nm,从约20nm到约0.075nm,从约20nm到约0.1nm,从约20nm到约0.5nm,从约20nm到约1nm,从约10nm到约0.05nm,从约10nm到约0.075nm,从约10nm到约0.1nm,从约10nm到约0.5nm,从约10nm到约1nm,从约5nm到约0.05nm,从约5nm到约0.075nm,从约5nm到约0.1nm,从约5nm到约0.5nm,从约5nm到约1nm,从约3nm到约0.05nm,从约3nm到约0.075nm,从约3nm到约0.1nm,从约3nm到约0.5nm,从约3nm到约1nm,从约3nm到约2nm,从约2nm到约0.05nm,从约2nm到约0.075nm,从约2nm到约0.1nm,从约2nm到约0.5nm,从约2nm到约1nm,从约1nm到约0.05nm,从约1nm到约0.075nm,从约1nm到约0.1nm,从约1nm到约0.5nm,从约0.5nm到约0.05nm,从约0.5nm到约0.075nm,从约0.5nm到约0.1nm,从约0.1nm到约0.05nm,从约0.1nm到约0.075nm,或从约0.075nm到约0.05nm,如用octet生物层干涉测量法测定。在一些方面,抗体以以下kd结合人hsp70(例如adp结合和/或肽结合形式的hsp70):从约20pm到约0.05pm,从约20pm到约0.075pm,从约20pm到约0.1pm,从约20pm到约0.5pm,从约20pm到约1pm,从约10pm到约0.05pm,从约10pm到约0.075pm,从约10pm到约0.1pm,从约10pm到约0.5pm,从约10pm到约1pm,从约5pm到约0.05pm,从约5pm到约0.075pm,从约5pm到约0.1pm,从约5pm到约0.5pm,从约5pm到约1pm,从约3pm到约0.05pm,从约3pm到约0.075pm,从约3pm到约0.1pm,从约3pm到约0.5pm,从约3pm到约1pm,从约3pm到约2pm,从约2pm到约0.05pm,从约2pm到约0.075pm,从约2pm到约0.1pm,从约2pm到约0.5pm,从约2pm到约1pm,从约1pm到约0.05pm,从约1pm到约0.075pm,从约1pm到约0.1pm,从约1pm到约0.5pm,从约0.5pm到约0.05pm,从约0.5pm到约0.075pm,从约0.5pm到约0.1pm,从约0.1pm到约0.05pm,从约0.1pm到约0.075pm,或从约0.075pm到约0.05pm,如用octet生物层干涉测量法测定。
[0515]
在一些方面,预期重链可变区序列,例如,seq id no:7、12-17和26-103中任一vh序列或其任何变体,可与本领域已知的多种重链恒定区序列共价连接。类似地,预期轻链可变区序列,例如,seq id no:8、19-24和105-157中任一vl序列或其任何变体,可与本领域已知的多种轻链恒定区序列共价连接。
[0516]
例如,抗体或抗体片段可具有重链恒定区,选自例如:igg1、igg2、igg3、igg4、igm、iga1、iga2、igd和ige的重链恒定区;具体而言,选自例如igg1、igg2、igg3和igg4的(例如人的)重链恒定区。在另一个实施方式中,抗体或抗体片段具有轻链恒定区,选自例如κ或λ(例如人的)轻链恒定区。可改变(例如突变)恒定区以修饰该抗体或抗体片段的性能(例如以增
加或减少如下一项或多项:fc受体结合、抗体糖基化、半胱氨酸残基数、效应细胞功能和/或补体功能)。在一个实施方式中,抗体或抗体片段具有效应功能;且能够固定补体。在其他实施方式中,抗体或抗体片段不募集效应细胞或固定补体。在另一个实施方式中,抗体或抗体片段结合fc受体的能力降低或不具备该能力。例如,抗体是不支持与fc受体结合的同种型或亚型、片段或其他突变体,例如其具有经诱变的fc受体结合区或缺失的fc受体结合区。
[0517]
在一些方面,抗体或抗体片段重链恒定区是人igg1同种型,具有氨基酸序列:
[0518][0519]
在一些方面,人igg1恒定区在氨基酸asn297(在前一段中的seq id no:217中加框)处修饰以阻止抗体糖基化,例如asn297ala(n297a)。在一些方面,抗体的恒定区在氨基酸leu235(在前一段中的seq id no:217中加框)处被修饰以改变fc受体相互作用,例如leu235glu(l235e)或leu235ala(l235a)。在一些方面,抗体的恒定区在氨基酸leu234(在前一段中的seq id no:217中加框)处被修饰以改变fc受体相互作用,例如leu234ala(l234a)。在一些方面,抗体恒定区在氨基酸glu233(在前段中的seq id no:217中加框)处修饰,例如glu233pro(e233p)。在一些方面,抗体的恒定区在氨基酸234和235处均发生改变,例如leu234ala和leu235ala(l234a/l235a)。在一些方面,抗体的恒定区在氨基酸233、234和234处改变,例如glu233pro、leu234ala和leu235ala(e233p l234a/l235a)(armour kl.等人(1999)eur.j.immonl。29(8):2613-24)。所有残基编号根据eu编号(kabat,e.a.等,(1991)《免疫学感兴趣的蛋白质的序列》
[0520]
(sequences of proteins of immunological interest),第五版,美国卫生与公共服务部,nih出版号91-3242)。
[0521]
在一些方面,抗体重链恒定区是人igg1同种型,具有氨基酸序列:
[0522][0523]
在一些方面,人igg1恒定区在氨基酸asn297(在前段中的seq id no:218中加框)处修饰以阻止抗体糖基化,例如asn297ala(n297a)。在一些方面,抗体的恒定区在氨基酸leu235(在前段中的seq id no:218中加框)处被修饰以改变fc受体相互作用,例如leu235glu(l235e)或leu235ala(l235a)。在一些方面,抗体的恒定区在氨基酸leu234(在前一段中的seq id no:218中加框)处被修饰以改变fc受体相互作用,例如leu234ala(l234a)。在一些方面,抗体恒定区在氨基酸glu233(在前段中的seq id no:218中加框)处
修饰,例如glu233pro(e233p)。在一些方面,抗体的恒定区在氨基酸234和235处均发生改变,例如leu234ala和leu235ala(l234a/l235a)。在一些方面,抗体的恒定区在氨基酸233、234和234处改变,例如glu233pro、leu234ala和leu235ala(e233p l234a/l235a)(armour kl.等人(1999)eur.j.immonl。29(8):2613-24)。所有残基编号根据eu编号(kabat,e.a.等,见上)。
[0524]
在一些方面,人igg1恒定区被修饰为包含“杵”突变(例如t366y)或“臼”突变(如y407t),用于与第二恒定区异二聚(残基编号根据eu编号(kabat,e.a.等,上文))。
[0525]
在一些方面,抗体重链的恒定区是人igg1同种型,例如,人igg1同种型的同种异型,如igg1 g1m3同种异型。示例性人igg1同种异型在magdelaine-beuzelin等人(2009)pharmacogenet.genomics 19(5):383-7中描述。
[0526]
在一些方面,抗体重链恒定区是人igg2同种型,具有氨基酸序列:
[0527][0528]
在一些方面,人igg2恒定区在氨基酸asn297(在前段中的seq id no:219中加框)处修饰以阻止抗体糖基化,例如asn297ala(n297a),其中残基编号根据eu编号(kabat,e.a.等,见上文)。
[0529]
在一些方面,抗体重链恒定区是人igg3同种型,具有氨基酸序列:
[0530][0531]
在一些方面,人igg3恒定区在氨基酸asn297(在前一段中的seq id no:220中加框)处修饰以阻止抗体糖基化,例如asn297ala(n297a)。在一些方面,人igg3恒定区在氨基酸arg435处修饰(在前段中的seq id no:220中加框)以延长半衰期,例如arg435h(r435h)。所有残基编号根据eu编号(kabat,e.a.等,见上)。
[0532]
在一些方面,抗体重链恒定区是人igg4同种型,具有氨基酸序列:
[0533][0534]
在一些方面,在铰链区内修饰人igg4恒定区以防止或减少链交换,例如,在一些方面中,人igg 4恒定区在ser228处修饰(在前段中的seq id no:221中加框),例如ser228pro(s228p)。在其他实施方式中,人igg4恒定区在氨基酸leu235处修饰(在前段中的seq id no:221中加框)以改变fc受体相互作用,例如,leu235glu(l235e)。在一些方面,人igg4恒定区在ser228和leu335(例如,ser228pro和leu235glu)处修饰(s228p/l235e)。在一些方面,人igg4恒定区在氨基酸asn297(在前一段中的seq id no:221中加框)处修饰以阻止抗体糖基化,例如asn297ala(n297a)。所有残基编号根据eu编号(kabat,e.a.等,见上)。
[0535]
在一些方面,人igg恒定区被修饰以增强fcrn结合。增强与fcrn结合的fc突变的例子有met252tyr、ser254thr、thr256glu(分别为m252y、s254t、t256e)(dall’acqua等人(2006)j.biol.chem.281(33):23514-23524),或met428leu和asn434ser(m428l,n434s)(zalevsky等人(2010)nature biotech.28(2):157-159)。所有残基编号根据eu编号(kabat,e.a.等,见上)。
[0536]
在一些方面,修饰人igg恒定区以改变抗体依赖性细胞毒性(adcc)和/或补体依赖性细胞毒性(cdc),例如如下所述的氨基酸修饰:natsume等人(2008)cancer res.68(10):3863-72;idusogie等人(2001)j.immunol.166(4):2571-5;moore等人(2010)mabs 2(2):181-189;lazar等人(2006)proc.natl.acad.sci.usa 103(11):4005-4010,shields等人(2001)j.biol.chem.276(9):6591-6604;stavenhagen等人(2007)cancer res.67(18):8882-8890;stavenhagen等人(2008)advan.enzyme regul.48:152-164;alegre等人(1992)j.immunol.148:3461-3468。
[0537]
在一些方面,人igg恒定区被修饰以诱导异二聚。例如,在ch3结构域内thr366处具有氨基酸修饰的重链,例如,体积较大的氨基酸取代,如tyr(t366w),能够优先与具有ch3结构域的第二重链配对,所述第二重链在thr36、leu368和tyr407处分别具有氨基酸修饰成体积较小的氨基酸,例如,ser、ala和val(t366s/l368a/y407v)。通过ch3修饰的异二聚化可以通过引入二硫键进一步稳定,例如通过在相对ch3结构域上将ser354改变为cys(s354c),将y349改变为cys(y349c)(参见carter(2001)j.immunol.methods 248:7-15)。
[0538]
在一些方面,抗体轻链恒定区是人κ恒定区,例如,具有以下氨基酸序列的人κ恒定区:
[0539]
tvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seq id no:222),
[0540]
在一些方面,抗体轻链恒定区是人κ恒定区,例如,具有以下氨基酸序列的人κ恒定区:
[0541]
rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec(seq id no:223)。
[0542]
在一些方面,抗体轻链恒定区是人λ恒定区,例如,具有以下氨基酸序列的人λ恒定区:
[0543]
gqpkanptvtlfppsseelqankatlvclisdfypgavtvawkadgspvkagvettkpskqsnnkyaassylsltpeqwkshrsyscqvthegstvektvaptec(seq id no:224)。
[0544]
iii.嵌合抗原受体
[0545]
嵌合抗原受体(car)分子是重组融合蛋白,其特征在于它们能够结合抗原,并通过存在于其胞质尾部的免疫受体活化基序(itam)传递活化信号,从而活化基因修饰的免疫效应细胞,用于杀伤、增殖和细胞因子产生。利用抗原结合部分(例如,由单链抗体(scfv)产生的)受体构建物具有“通用性”的额外优势,因为它们以hla非依赖性方式结合靶细胞表面的天然抗原。
[0546]
本文所述car的实施方式包括编码抗原特异性car多肽的核酸,其包含胞内信号转导结构域、跨膜结构域和包含抗原结合域的胞外结构域。car可识别由一个或多个抗原之间的共享空间构成的表位。任选地,car可包括位于跨膜结构域和抗原结合结构域之间的铰链结构域。car可进一步包含将car的表达指引到细胞表面的信号肽。例如,car可包含来自gm-csf的信号肽。car也可以与膜结合细胞因子共同表达,以提高持久性。例如,car可以与膜结合的il-15共表达。
[0547]
根据car结构域的排列和结构域中使用的特定序列,表达car的免疫效应细胞可能对靶细胞具有不同水平的活性。可将不同的car序列引入免疫效应细胞以生成工程化的细胞,选择具有提高的src的工程化细胞和测试活性以鉴定预测具有最大治疗功效的car构建物的所选细胞。
[0548]
嵌合抗原受体可通过本领域已知的任何方法制备,但优选使用重组dna技术制备。通过分子克隆的标准技术(基因组文库筛选、pcr、引物辅助连接、酵母和细菌的scfv文库、定点突变等),可以制备编码嵌合抗原受体多个区域的核酸序列,并将其组装成完整的编码序列。产生的编码区可插入表达载体并用于转化合适的表达宿主同种异体或自体免疫效应细胞,例如t细胞或nk细胞。
[0549]
嵌合构建体可以作为裸dna或在合适的载体中引入免疫效应细胞。本领域已知使用裸dna通过电穿孔稳定转染细胞的方法。参见例如美国专利号6,410,319。裸dna通常是指编码嵌合受体的dna,该嵌合受体以适当表达方向包含在质粒表达载体中。或者,可使用病毒载体(例如,逆转录病毒载体、腺病毒载体、腺相关病毒载体或慢病毒载体)将嵌合构建体引入免疫效应细胞。根据本发明方法使用的合适载体在免疫效应细胞中不复制。已知大量基于病毒的载体,其中病毒在细胞中的拷贝数低到足以维持细胞生存,例如,基于hiv、sv40、ebv、hsv或bpv的载体。
[0550]
抗原结合结构域
[0551]
抗原结合结构域可包括单克隆抗体的互补决定区、单克隆抗体的可变区和/或其抗原结合片段。抗原结合区或结构域可包含源自特定小鼠或人或人源化单克隆抗体的单链可变片段(scfv)的vh和vl链片段。该片段也可以是抗原特异性抗体的任意数量的不同抗原结合结构域。该片段可以是针对人密码子用途进行优化以在人类细胞中表达的序列编码的抗原特异性scfv。在某些方面中,car的vh和vl结构域由接头序列(例如whitlow接头)分隔。
[0552]
原型car编码包含源自一种单克隆抗体(mab)的vh和vl结构域的scfv,其与跨膜结
构域和一个或多个胞质信号传导结构域(例如,共刺激结构域和信号传导结构域)偶联。因此,car可包含与hsp70结合的抗体的lcdr1-3序列和hcdr1-3序列。然而,在其它方面中,识别了与感兴趣的抗原结合的多种抗体中的两种,并且构建了一种car,其包括:(1)与抗原结合的第一抗体的hcdr1-3序列;和(2)与抗原结合的第二抗体的lcdr1-3序列。这种包含来自两种不同抗原结合性抗体的hcdr和lcdr序列的car可能具有优先结合抗原的特定构型(例如,与正常组织相比优先与癌细胞结合的构型)的优势。
[0553]
或者,可以使用从不同mab衍生的vh和vl链来工程改造car,以生成一组car 免疫效应细胞。car的抗原结合域可包含第一抗体的lcdr1-3序列和第二抗体的hcdr1-3序列的任意组合。
[0554]
b.铰链结构域
[0555]
car多肽可包括位于抗原结合结构域和跨膜结构域之间的铰链结构域。在某些情况下,铰链结构域可包含在car多肽中,以在抗原结合结构域和细胞表面之间提供足够的距离,或减轻可能对car修饰的免疫效应细胞的抗原结合或效应功能产生不利影响的空间位阻。铰链结构域可包含与fc受体(例如fcγr2a或fcγr1a)结合的序列。例如,铰链序列可包含来自与fc受体结合的人免疫球蛋白(例如,igg1、igg2、igg3、igg4、iga1、iga2、igm、igd或ige)的fc结构域。
[0556]
car铰链结构域可衍生自人免疫球蛋白(ig)恒定区或其包括ig铰链的一部分,或衍生自人cd8α跨膜结构域和cd8a-铰链区。car铰链结构域可包含抗体同种型igg4的铰链-ch2-ch3区。铰链结构域(和/或car)可不包含野生型人igg4 ch2和ch3序列。可以在抗体重链ch2结构域中引入点突变,以减少car-修饰免疫效应细胞的糖基化和非特异性fcγ受体结合。
[0557]
car铰链结构域包含ig fc结构域,其包含相对于野生型ig fc结构域的至少一个减少fc受体结合的突变。例如,car铰链结构域可包含igg4-fc结构域,该结构域包含相对于野生型igg4-fc结构域的至少一个减少fc-受体结合的突变。car铰链结构域可包含在相对于野生型igg4-fc序列对应于l235和/或n297的位置处具有突变(例如氨基酸缺失或取代)的igg4-fc结构域。例如,car铰链结构域可包含具有相对于野生型igg4-fc序列的l235e和/或n297q突变的igg4-fc结构域。car铰链结构域可包含igg4-fc结构域,该结构域在l235位置处具有氨基酸取代,以取代亲水性氨基酸,例如r、h、k、d、e、s、t、n或q,或具有与“e”类似的性质的氨基酸,例如d。car铰链结构域可包含在位置n297处具有氨基酸取代的igg4-fc结构域,该氨基酸具有类似于“q”的性质,例如s或t。
[0558]
铰链结构域可包含与igg4铰链结构域、cd8a铰链结构域、cd28铰链结构域或工程化铰链结构域约85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的序列。
[0559]
c.跨膜结构域
[0560]
抗原特异性胞外结构域和胞内信号传导结构域可通过跨膜结构域连接。可用作跨膜结构域部分的多肽序列包括但不限于人cd4跨膜结构域、人cd28跨膜结构域、跨膜人cd3ζ结构域,半胱氨酸突变的人cd3ζ结构域,或来自其他人跨膜信号传导蛋白,如cd16、cd8以及促红细胞生成素受体的其他跨膜结构域。例如,跨膜结构域可包含至少85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%与美国专利公开号2014/0274909(例
如cd8和/或cd28跨膜结构域)或美国专利号8,906,682(例如cd8α跨膜结构域)中提供的序列之一相同的序列,两者均通过引用并入本文。跨膜区可衍生自(即,至少包括以下的跨膜区)t细胞受体、cd3ε、cd45、cd4、cd5、cd8、cd9、cd16、cd22、cd33、cd37、cd64、cd80、cd86、cd134、cd137、cd154的α、β或ζ链的跨膜区。在某些特定方面中,跨膜结构域可与cd8a跨膜结构域或cd28跨膜结构域85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同。
[0561]
d.胞内信号传导结构域
[0562]
car的胞内信号传导结构域负责活化经工程改造以表达嵌合抗原受体的免疫细胞的至少一种正常效应功能。术语“效应功能”是指分化的细胞的专门功能。例如,t细胞的效应功能可以是细胞溶解活性或辅助活性,包括细胞因子的分泌。原初、记忆或记忆型t细胞中的效应功能包括抗原依赖性增殖。因此,术语“胞内信号传导结构域”是指蛋白质中传导效应功能信号并指导细胞执行特定功能的部分。细胞内信号传导结构域可衍生自天然受体的胞内信号传导结构域。此类天然受体的例子包括t细胞受体的ζ链或其任何同系物(例如,η、δ、γ或ε)、mb1链、b29、fc riii、fc ri以及信号传导分子的组合,例如cd3ζ和cd28、cd27、4-1bb/cd137、icos/cd278、il-2rβ/cd122、il-2rα/cd132、dap10、dap12、cd40、ox40/cd134及其组合,以及其他类似分子和片段。可以使用活化蛋白家族的其他成员的细胞内信号传导部分。
[0563]
虽然可使用整个胞内信号传导结构域,但在许多情况下,不需要使用完整胞内多肽。在可使用胞内信号传导结构域的截短部分的范围内,只要该截短部分仍能传递效应功能信号,则可使用该截短部分代替完整链。因此,术语“胞内信号传导结构域”指包括胞内信号传导结构域的截短部分,其足以在car结合到靶标时传导效应功能信号。可使用一个或多个胞质结构域,因为所谓的第三代car具有至少两个或三个融合在一起的信号传导结构域以产生叠加或协同效应,例如,cd28和4-1bb可以组合在car构建物中。在某些特定方面,胞内信号传导结构域包含与cd3ζ胞内结构域、cd28胞内结构域、cd137胞内结构域或包含融合到4-1bb胞内结构域的cd28胞内结构域的结构域85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%相同的序列。
[0564]
e.免疫效应细胞
[0565]
免疫效应细胞可以是t细胞(例如调节性t细胞、cd4 t细胞,cd8 t细胞,或γδt细胞);自然杀伤(nk)细胞;不变nk细胞;或nkt细胞。本文还提供了产生和工程改造免疫效应细胞的方法以及使用和给予细胞用于过继细胞治疗的方法,在这种情况下,细胞可以是自体或同种异体的。因此,免疫效应细胞可用于免疫治疗,例如靶向癌细胞。
[0566]
免疫效应细胞可分离自对象,特别是人对象。免疫效应细胞可从感兴趣的对象获得,例如怀疑患有特定疾病或病症的对象、怀疑患有特定疾病或病症倾向的对象、正在接受特定疾病或疾病治疗的对象、健康志愿者或健康捐献者的对象,或从血库获得。免疫效应细胞可从其存在的对象体内的任何组织或器官中收集、富集和/或纯化,包括但不限于血液、脐带血、脾脏、胸腺、淋巴结、骨髓、手术过程中移除和/或暴露的组织,以及通过活检手术获得的组织。分离的免疫效应细胞可直接使用,也可以例如通过冷冻储存一段时间。
[0567]
富集、分离和/或纯化免疫效应细胞的组织/器官可从活体和非活体对象中分离,其中非活体对象为器官捐赠者。从脐带血中分离的免疫效应细胞可能具有增强的免疫调节
能力,例如通过cd4或cd8阳性t细胞抑制来测量。为了增强免疫调节能力,免疫效应细胞可以从合并的血液,特别是合并的脐带血中分离出来。合并的血液可来自2个或更多来源,例如3、4、5、6、7、8、9、10或更多来源(例如,供体对象)。
[0568]
免疫细胞群可从需要治疗或患有与免疫效应细胞活性降低相关疾病的对象获得。因此,这些细胞将是需要治疗的对象的自体细胞。或者,免疫效应细胞群可从供体获得,优选同种异体供体。同种异体供体细胞可能与人白细胞抗原(hla)相容,也可能不相容。为了使对象相容,可以对同种异体细胞进行处理以降低免疫原性。
[0569]
1.t细胞
[0570]
免疫效应细胞可以是t细胞。t细胞可能来源于血液、骨髓、淋巴、脐带或淋巴器官。t细胞可以是人t细胞。t细胞可以是原代细胞,例如直接从对象分离和/或从对象分离并冷冻的细胞。细胞可包括t细胞或其他细胞类型的一个或多个亚组,如全t细胞群、cd4 细胞、cd8 细胞及其亚群,如由功能、活化状态、成熟、分化潜力、扩增、再循环、定位,和/或持续能力、抗原特异性、抗原受体类型、特定器官或区室中的存在、标志物或细胞因子分泌概况,和/或分化程度限定的那些。关于待治疗的对象,细胞可以是同种异体和/或自体的。对于现成技术,细胞可衍生自多潜能和/或多能的细胞,例如干细胞,例如诱导的多潜能干细胞(ipsc)。
[0571]
t细胞(例如cd4
和/或cd8
t细胞)的亚型和亚群包括:原初t(tn)细胞、效应t细胞(teff)、记忆t细胞及其亚型,如干细胞记忆t(tscm)、中心记忆t(tcm)、效应记忆t(tem)、或终末分化的效应记忆t细胞、肿瘤-浸润性淋巴细胞(til)、不成熟t细胞、成熟t细胞、辅助t细胞、细胞毒性t细胞、粘膜相关的非变体t(mait)细胞、天然产生的和过继性调节t(treg)细胞、辅助t细胞,如th1细胞、th2细胞、th3细胞、th17细胞、th9细胞、th22细胞、滤泡辅助t细胞、α/βt细胞,和δ/γt细胞。
[0572]
针对一个或多个t细胞群体可富集或耗竭对特定标志物(例如表面标记物)呈阳性或对特定标志物呈阴性的细胞。在某些情况下,此类标志物是在某些t细胞群体(例如,非记忆细胞)上缺失或表达水平相对较低,但在某些其他t细胞群体(例如,记忆细胞)上存在或表达水平相对较高的标志物。
[0573]
通过对非t细胞(如b细胞、单核细胞或其它血液白细胞)上表达的标志物(如cd14)进行负选择可从pbmc样品分离t细胞。在一些方面,cd4
或cd8
选择步骤用于分离cd4
辅助细胞和cd8
细胞毒性t细胞。通过针对一种或多种未免疫的、记忆和/或效应t细胞亚群上表达或以相对高表达的标志物进行正或负选择,可将此类cd4
和cd8
群进一步分选成亚群。
[0574]
cd8
t细胞可进一步富集或耗尽原初、中央记忆、效应记忆和/或中央记忆干细胞,例如通过基于与各亚群相关的表面抗原的阳性或阴性选择。对中央记忆t(tcm)细胞可进行富集以提高功效,例如在给药后改善长期存活、扩增和/或植入,其在一些方面在此类亚群中特别强健。
[0575]
t细胞可以是自体t细胞。在这种方法中,从患者获取肿瘤样本,并获得单细胞悬液。单细胞悬液可以以任何合适的方式获得,例如,机械法(使用例如gentlemacs
tm
dissociator,美天旎生物技术公司(miltenyi biotec),加利福尼亚州奥本)或酶法(如胶原酶或dna酶)。肿瘤酶消化物的单细胞悬液在白细胞介素-2(il-2)中培养。培养细胞直到汇合(例如,约2
×
106淋巴细胞),例如,从约5天到约21天,优选从约10天到约14
天。
[0576]
培养的t细胞可合并并迅速扩增。快速扩增使抗原特异性t细胞的数量在大约10到14天的时间内增加至少约50倍(例如,50倍、60倍、70倍、80倍、90倍或100倍以上)。更优选地,快速扩增在约10至约14天期间提供至少约200倍(例如,200-、300-、400-、500-、600-、700-、800-、900-或更多倍)的增加。
[0577]
扩增可以通过本领域已知的许多方法中的任何一种来实现。例如,在饲养淋巴细胞和白细胞介素-2(il-2)或白细胞介素-15(il-15)(优选il-2)存在下,使用非特异性t细胞受体刺激可快速扩增t细胞。非特异性t细胞受体刺激物可包括约30ng/ml okt3,一种用于人抗cd3的小鼠单克隆抗cd3抗体(可从新泽西州拉瑞坦的购得)。或者,t细胞可通过在存在t细胞生长因子的情况下,例如300iu/ml il-2或il-15(优选il-2)情况下用一种或多种癌症抗原(包括其抗原部分,例如表位或细胞)在体外刺激外周血单核细胞(pbmc)而快速扩增,抗原可任选地从载体表达,例如人白细胞抗原a2(hla-a2)结合肽。体外诱导的t细胞通过用相同的癌抗原脉冲到表达hla-a2的抗原递呈细胞上而迅速扩增。或者,例如可使用经辐照的自体淋巴细胞或经辐照的hla-a2 同种异体淋巴细胞和il-2再刺激t细胞。
[0578]
可修饰自体t细胞以表达促进自体t细胞生长和活化的t细胞生长因子。合适的t细胞生长因子包括例如白细胞介素(il)-2、il-7、il-15和il-12。合适的修饰方法是本领域已知的。参见例如,sambrook等,《分子克隆:实验室手册》(molecular cloning:a laboratory manual)(第2版,冷泉港实验室出版社(cold spring harbor laboratory press),纽约冷泉港(1989))和ausubel等的current protocols in molecular biology(《新编分子生物学实验指南》),纽约州纽约的格林出版联合公司(greene publishing associates)和约翰威利父子出版公司(john wiley&sons)(1994)。具体而言,修饰的自体t细胞高水平表达t细胞生长因子。t细胞生长因子编码序列(例如il-12的序列)在本领域中是容易获得的,如启动子,其与t细胞生长因子编码序列的可操作连接促进高水平表达。
[0579]
2.nk细胞
[0580]
免疫效应细胞可以是自然杀伤(nk)细胞。自然杀伤(nk)细胞是一种淋巴细胞亚群,对多种肿瘤细胞、病毒感染细胞以及骨髓和胸腺中的一些正常细胞具有自发的细胞毒性。nk细胞是对转化细胞和病毒感染细胞的早期先天免疫反应的关键效应细胞。nk细胞约占人外周血淋巴细胞的10%。当淋巴细胞在白细胞介素2(il-2)存在下培养时,会产生强烈的细胞毒性反应。nk细胞是效应细胞,被称为大颗粒淋巴细胞,因为其较大的尺寸和细胞质中存在特征性嗜天青颗粒。nk细胞在骨髓、淋巴结、脾脏、扁桃体和胸腺中分化和成熟。nk细胞可以通过特定的表面标志物检测,例如人中的cd16、cd56和cd8。nk细胞不表达t细胞抗原受体、泛t标志物cd3或表面免疫球蛋白b细胞受体。
[0581]
nk细胞的刺激通过来自细胞表面活化和抑制受体的信号串扰实现。nk细胞的活化状态由从种系编码的活化和抑制受体阵列接收的细胞内信号的平衡来调节。当nk细胞遇到异常细胞(例如肿瘤或病毒感染细胞)且活化信号占主导地位时,nk细胞可通过定向分泌含有穿孔素和颗粒酶的细胞溶解颗粒或与含有死亡结构域的受体结合,快速诱导靶细胞凋亡。活化的nk细胞还可分泌i型细胞因子,如,活化先天性和适应性免疫细胞的干扰素-γ、肿瘤坏死因子-α和粒细胞-巨噬细胞集落刺激因子(gm-csf)以及其他细胞因子。nk细胞在
早期先天免疫反应中产生这些可溶性因子显著影响其他造血细胞的募集和功能。此外,通过物理接触和细胞因子的产生,nk细胞在与树突细胞和中性粒细胞的调节性串扰网络中起着核心作用,以促进或抑制免疫反应。
[0582]
nk细胞可通过本领域公知的方法从人外周血单核细胞(pbmc)、非刺激性白细胞去除术产物(pbsc)、人胚胎干细胞(hesc)、诱导性多潜能干细胞(ipsc)、骨髓或脐带血中衍生。在某些方面,nk细胞在体外分离和扩增。例如,cb单核细胞可通过ficoll密度梯度离心分离,并与il-2和人工抗原递呈细胞(aapc)一起在生物反应器中培养。7天后,细胞培养物可耗竭任何表达cd3的细胞,并再培养7天。细胞可再次耗竭cd3并表征以确定cd56
/cd3-细胞或nk细胞的百分比。在其他方法中,脐带cb可用于通过分离cd34
细胞和在含有scf、il-7、il-15和il-2的培养基中培养分化为cd56
/cd3-细胞来获得nk细胞。
[0583]
f.免疫效应细胞的工程改造
[0584]
免疫效应细胞(例如,自体或同种异体t细胞(例如调节性t细胞、cd4
t细胞、cd8
t细胞或γ-δt细胞)、nk细胞、不变nk细胞或nkt细胞)可通过基因工程改造表达抗原受体,例如嵌合抗原受体(car)。例如,宿主细胞(例如,自体或同种异体t细胞)可被修饰以表达对hsp70具有抗原特异性的car。在特定实施方式中,工程改造nk细胞以表达car。可在单个细胞类型,例如t细胞或nk细胞添加多种car,例如针对不同抗原。
[0585]
细胞可包含通过编码一种或多种抗原受体的基因工程改造引入的一种或多种核酸以及这种核酸的基因工程改造的产物。核酸可以是异源的,即,通常不存在于细胞或从细胞获得的样品中,例如,从另一生物体或细胞获得的核酸,例如,在被工程改造的细胞和/或从中衍生出该细胞的生物体中通常不存在。核酸可能不是天然存在的,例如自然界中未发现的核酸(例如嵌合体)。
[0586]
iv.药物制剂
[0587]
本公开提供了包含选择性靶向hsp70的抗体的药物组合物。此类组合物包含预防或治疗有效量的抗体或其片段以及药学上可接受的运载体。本文还提供包含表达car的免疫细胞(例如,t细胞或nk细胞)和药学上可接受的运载体的药物组合物和制剂。
[0588]
短语“药学上或药理学上可接受的”是指当适当地给予动物(如人)时不会产生不良、过敏或其他不良反应的分子实体和组合物。根据本公开的启示,本领域技术人员将知道包含抗体或附加活性成分的药物组合物的制备。此外,对于动物(如人)给药,应了解制剂应符合fda生物标准办公室所要求的无菌性、热原性、一般安全性和纯度标准。
[0589]
如本文所用,“药学上可接受的运载体”包括任何及所有水性溶剂(例如,水、酒精/水溶液、盐水溶液、胃肠外运载体,例如氯化钠、林格葡萄糖等)、非水溶剂(如丙二醇、聚乙二醇、植物油和可注射有机酯,如油酸乙酯)、分散介质、包衣、表面活性剂、抗氧化剂、防腐剂(如抗菌剂或抗真菌剂、抗氧化剂、螯合剂和惰性气体),等渗剂、吸收延迟剂、盐、药物、药物稳定剂、凝胶、粘合剂、赋形剂、崩解剂、润滑剂、甜味剂、调味剂、染料、液体和营养补充剂,如本领域普通技术人员已知的相似材料及其组合。根据熟知的参数常规调节药物组合物的各种组分的ph和确切浓度。
[0590]
活性成分可以配制用于胃肠外给药,例如配制用于通过静脉内,肌肉内,皮下或甚至腹膜内途径注射。通常,这种组合物可以制成液体溶液形式或悬浮液形式;也可以制备适合用于在注射前加入液体制备溶液或悬浮液的固体形式;并且,制剂也可以经乳化。
[0591]
本实施方式的治疗组合物有利地以可注射组合物的形式作为液体溶液或悬浮液给药;也可制备适于在注入前溶解于或悬浮于液体中的固体形式。这些制剂也可被乳化。
[0592]
适于注射使用的药物形式包括无菌水溶液或分散液;包括芝麻油,花生油或丙二醇水溶液制剂;和用于临时制备无菌可注射溶液或分散液的无菌粉末。在所有情况下,该形式必须是无菌的,并且必须为易于注射的程度的流体。其也应该在制造和储存条件下稳定,并且必须在保存过程中能够抵抗微生物如细菌和真菌的污染作用。
[0593]
蛋白质组合物可配制成中性或盐形式。药学上可接受的盐包括酸加成盐,例如,与蛋白质的游离氨基团形成的那些,或由无机酸例如盐酸或磷酸,或有机酸诸如乙酸、草酸、酒石酸或扁桃酸形成的盐。由游离羧基基团形成的盐还可以衍生自无机碱,例如,钠,钾,铵,钙或铁氢氧化物;或有机碱诸如异丙胺,三甲胺,组氨酸或普鲁卡因等。
[0594]
药学上可接受的组合物可包含溶剂或分散介质,包括例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇等)及其合适的混合物以及植物油。可维持合适的流动性,例如通过使用诸如卵磷脂的包衣、分散情况下通过保持所需粒度以及通过使用表面活性剂来实现。可以通过各种抗菌剂和抗真菌剂来预防微生物的作用,例如对羟基苯甲酸酯类、氯丁醇、苯酚、山梨酸、硫柳汞等。在很多情况中,优选包括等渗剂,例如糖类或氯化钠。可通过将延迟吸收的试剂例如单硬脂酸铝和明胶用于组合物中来延长可注射组合物的吸收。
[0595]
如果需要,组合物也可含有少量润湿剂或乳化剂或ph缓冲剂。这些组合物可以采取溶液、悬浮液、乳液、片剂、丸剂、胶囊、粉末、持续释放制剂等的形式。口服制剂可包括标准运载体,例如药品级甘露糖醇,乳糖,淀粉,硬脂酸镁,糖精钠,纤维素,碳酸镁等。合适的药物制剂的示例述于《雷明顿药物科学》。这类组合物将包含预防或治疗有效量的抗体或其片段,诸如以纯化的形式,以及合适量的运载体,从而提供用于向患者适当给药的形式。
[0596]
抗体的被动转移通常涉及静脉注射或肌肉注射。由此产生的免疫通常只持续很短一段时间,而且还存在超敏反应和血清病的潜在风险,特别是非人类来源的丙种球蛋白。抗体可在适合注射的运载体中配制,即无菌和可注射的运载体。
[0597]
通常,本文所提供的组合物的成分可以单独提供或者也可以以单位剂型混合在一起,例如,密封容器如安瓿或药囊中干燥的冻干粉末或无水浓缩物,指明活性剂的量。通过输液给予该组合物时,可用含有无菌药物级水或盐水的输液瓶分配该组合物。通过注射给予该组合物时,可提供无菌注射用水或盐水的安瓿,以便在给药前与药物成分混合。
[0598]
在某些实施方式中,药物组合物可包含,例如,至少约0.1%的活性成分。在其他实施方式中,活性成分可包含约2%至约75%的单位重量,或约25%至约60%的单位重量,以及其中可衍生的任何范围。
[0599]
术语“单位剂量”或“剂量”指适用于对象使用的物理上离散的单元,每个单元包含预定量的治疗组合物,该治疗组合物经计算可产生上述与其给药相关的期望反应,即,适当的路线和治疗方案。根据治疗次数和单位剂量,待给予的量取决于期望的效果。给予患者或对象的本实施方式组合物的实际剂量可由物理和生理因素确定,例如对象的体重、年龄、健康和性别、正在治疗的疾病类型、疾病侵入程度、先前或同时进行的治疗干预、患者的自发病、给药途径以及特定治疗物质的效力、稳定性和毒性。例如,剂量也可能包括每次给药约1μg/kg/体重至约1000mg/kg/体重(该范围包括干预剂量)或更多,以及其中可衍生的任何范围。在本文所列数字衍生范围的非限制性示例中,可给予约5μg/kg/体重至约100mg/kg/体
重,约5μg/kg/体重至约500mg/kg/体重等。在任何事件中,负责给予的医师将确定组合物中活性成分的浓度,以及对于个体对象合适的剂量。
[0600]
v.治疗方法
[0601]
本实施方式的某些方面可用于预防或治疗与hsp70水平升高相关的疾病或紊乱,例如癌症,例如肺癌、前列腺癌、胃癌、甲状腺癌或乳腺癌。可用任何合适药物降低hsp70功能。优选地,这些物质将是抗hsp70抗体、hsp70特异性car t细胞或hsp70特异性car nk细胞。
[0602]“治疗”和“进行治疗”是指对对象给予或应用治疗剂,或对对象实施程序或方式,以获得疾病或健康相关疾病的治疗效果。例如,治疗可包括单独或与化疗、免疫治疗或放射治疗、手术或其任何组合一起给予药物有效量的靶向hsp70的抗体。
[0603]
本文使用的术语“对象/对象”是指被实施主题方法的任何个体或患者。一般而言,对象是人类,尽管如本领域技术人员所理解的,对象可以是动物。因此,其他动物,包括哺乳动物,如啮齿类动物(包括小鼠、大鼠、仓鼠和豚鼠)、猫、狗、兔子、农场动物(包括牛、马、山羊、绵羊、猪等)和灵长类动物(包括猴子、黑猩猩、红毛猩猩和大猩猩),也包括在对象的定义中。
[0604]
本技术中通篇使用的术语“治疗益处”或“治疗有效性”是指促进或增强对象在该疾病的医疗治疗方面的健康的任何物质。这包括但不限于降低疾病体征或症状的频率或严重程度。例如,癌症的治疗可能涉及例如减小肿瘤的大小、降低肿瘤的侵袭性、降低癌症的生长速率或预防转移。癌症的治疗也可涉及延长癌症对象的生存期。
[0605]
本文使用的术语“癌症”可用于描述实体瘤、转移癌或非转移癌。在某些实施方式中,癌症可起源于膀胱、血液、骨、骨髓、脑、乳腺、结肠、食管、十二指肠、小肠、大肠、结肠、直肠、肛门、牙龈、头部、肾脏、肝脏、肺、鼻咽、颈部、卵巢、胰腺、前列腺、皮肤、胃、睾丸、舌头或子宫。
[0606]
癌症可具体为以下组织学类型,但不限于:肿瘤,恶性;癌;癌,未分化;巨细胞和梭形细胞癌;小细胞癌;乳头状癌;鳞状细胞癌;淋巴上皮癌;基底细胞癌;毛基质癌;移行细胞癌;乳头状移行细胞癌;腺癌;胃泌素瘤,恶性;胆管癌;肝细胞癌;肝细胞癌和胆管癌合并;小梁腺癌;腺样囊性癌;腺瘤性息肉腺癌;腺癌、家族性大肠息肉病;实体癌;类癌,恶性;鳃肺泡腺癌;乳头状腺癌;嗜色细胞癌;嗜酸细胞癌;嗜氧腺癌;嗜碱性细胞癌;透明细胞腺癌;颗粒细胞癌;滤泡腺癌;乳头状和滤泡状腺癌;非包膜硬化性癌;肾上腺皮质癌;子宫内膜癌;皮肤附件癌;顶泌腺癌;皮脂腺癌;宫颈腺癌;粘液表皮样癌;囊腺癌;乳头状囊腺癌;乳头状浆液性囊腺癌;粘液性囊腺癌;粘液腺癌;印戒细胞癌;浸润性导管癌;髓样癌;小叶癌;炎性癌;佩吉特病,乳腺;腺泡细胞癌;腺鳞癌;腺癌伴鳞状化生;胸腺瘤,恶性;卵巢间质瘤,恶性;卵泡膜瘤,恶性;颗粒细胞瘤,恶性;男性母细胞瘤,恶性;支持细胞癌;间质细胞瘤,恶性;脂质细胞瘤,恶性;副神经节瘤,恶性;乳腺外副神经节瘤,恶性;嗜铬细胞瘤;血管肉瘤;恶性黑色素瘤;无色素黑色素瘤;浅表性黑色素瘤;巨大色素痣中的恶性黑色素瘤;上皮样细胞黑色素瘤;蓝色痣,恶性;肉瘤;纤维肉瘤;纤维组织细胞瘤,恶性;粘液肉瘤;脂肪肉瘤;平滑肌肉瘤;横纹肌肉瘤;胚胎性横纹肌肉瘤;肺泡横纹肌肉瘤;基质肉瘤;混合瘤,恶性;米勒混合瘤;肾母细胞瘤;肝母细胞瘤;癌肉瘤;间充质瘤,恶性;brenner肿瘤,恶性;叶状肿瘤,恶性;滑膜肉瘤;间皮瘤,恶性;无性细胞瘤;胚胎癌;畸胎瘤,恶性;卵巢甲状腺肿,恶性;
绒毛膜癌;恶性中肾瘤;血管肉瘤;血管内皮瘤,恶性;卡波西肉瘤;血管外皮细胞瘤,恶性;淋巴管肉瘤;骨肉瘤;皮质旁骨肉瘤;软骨肉瘤;软骨母细胞瘤,恶性;间充质软骨肉瘤;骨巨细胞瘤;尤因肉瘤;牙源性肿瘤,恶性;成釉细胞性牙本质肉瘤;成釉细胞瘤,恶性;成釉细胞性纤维肉瘤;松果体瘤,恶性;脊索瘤;胶质瘤,恶性;室管膜瘤;星形细胞瘤;原生质星形细胞瘤;纤维状星形细胞瘤;星形细胞瘤;胶质母细胞瘤;少突胶质瘤;少突胶质母细胞瘤;原始神经外胚层;小脑肉瘤;神经节神经母细胞瘤;神经母细胞瘤;视网膜母细胞瘤;嗅神经源性肿瘤;脑膜瘤,恶性;神经纤维肉瘤;神经鞘瘤,恶性;颗粒细胞瘤,恶性;恶性淋巴瘤;霍奇金病;霍奇金氏;副肉芽肿;恶性淋巴瘤,小淋巴细胞;恶性淋巴瘤,大细胞,弥漫性;滤泡性恶性淋巴瘤;蕈样肉芽肿;其他特定非霍奇金淋巴瘤;恶性组织细胞增生;多发性骨髓瘤;肥大细胞肉瘤;免疫增殖性小肠疾病;白血病;淋巴细胞白血病;浆细胞白血病;红白血病;淋巴肉瘤细胞白血病;髓系白血病;嗜碱性白血病;嗜酸性粒细胞白血病;单核细胞白血病;肥大细胞白血病;巨核细胞白血病;髓样肉瘤;和毛细胞白血病。然而,还认识到,本公开还可用于治疗非癌症疾病(例如,真菌感染、细菌感染、病毒感染、神经退行性疾病和/或遗传疾病)。
[0607]
在某些实施方式中,本实施方式的组合物和方法涉及针对hsp70的抗体或抗体片段,结合第二或附加治疗,例如化疗或免疫治疗。这种疗法可用于治疗与hsp70升高相关的任何疾病。例如,这种疾病可为癌症。
[0608]
所述方法和组合物,包括组合疗法,能增强治疗或保护效果,和/或能增加另一种抗癌或抗过度增殖疗法的治疗效果。可以以有效实现期望效果(例如杀死癌细胞和/或抑制细胞过度增殖)的组合量提供治疗和预防方法和组合物。该过程可能涉及用抗体或抗体片段与细胞接触以及第二治疗。组织、肿瘤或细胞可与包含一种或多种试剂(即抗体或抗体片段或抗癌剂)的一种或多种组合物或药理学制剂接触,或使组织、肿瘤和/或细胞与具有两种或更多种不同组合物或制剂接触,其中一种组合物提供1)抗体或抗体片段,2)抗癌剂,或3)抗体或抗体片段和抗癌剂两者。同时,预期这种组合疗法可与化疗、放疗、手术治疗或免疫治疗结合使用。
[0609]
当应用于细胞时,术语“接触”和“暴露”在本文中用于描述将治疗性构建体和化疗剂或放疗剂递送至靶细胞或与靶细胞直接并置的过程。例如,为了实现细胞杀死,将有效杀死细胞或防止其分裂的组合量的两种药剂递送到细胞。
[0610]
抗体可在抗癌治疗之前、期间、之后或以与抗癌治疗相关的各种组合给予。给药的时间间隔可以从同时到几分钟到几天到几周不等。在将抗体或抗体片段与抗癌剂分开提供给患者的实施方式中,通常将确保在每次递送之间的有效时间段不会过期,从而两种化合物仍能够对患者施加有利的组合效应。在此类情况中,预期可在彼此之间约12至24或72小时内,更具体地,在彼此之间约6至12小时内,向患者提供抗体治疗和抗癌治疗。在某些情况下,如果各次给药间隔数天(2、3、4、5、6或7天)至数周(1、2、3、4、5、6、7或8周),则可能需要显著延长治疗时间。
[0611]
在某些实施方式中,一个疗程将持续1-90天或更长时间(该范围包括间隔天数)。预计一种药剂可在第1天至第90天(该范围包括间隔天数)或其任何组合的任何一天提供,而另一种药剂可在第1天至第90天(该范围包括间隔天数)或其任何组合的任何一天提供。在一天内(24小时内),可给予患者一次或多次药剂。此外,在一个疗程后,预期有一段时间
不进行抗癌治疗。该时间段可持续1-7天和/或1-5周和/或1-12个月或更长时间(该范围包括间隔天数),具体取决于患者的病情,如其预后、体力、健康状况等。预计治疗周期将在必要时重复。
[0612]
可以采用各种组合。在如下示例中,抗体疗法为“a”,抗癌疗法为“b”:
[0613]
a/b/a b/a/b b/b/a a/a/b a/b/b b/a/a a/b/b/b b/a/b/b
[0614]
b/b/b/a b/b/a/b a/a/b/b a/b/a/b a/b/b/a b/b/a/a
[0615]
b/a/b/a b/a/a/b a/a/a/b b/a/a/a a/b/a/a a/a/b/a
[0616]
将该实施方式的任何化合物或疗法给予患者将遵循给予该化合物的一般方案,(必要时)考虑药剂的毒性。因此,在一些实施方式中,存在对联合治疗导致的毒性的监测步骤。
[0617]
a.化疗
[0618]
根据本实施方式,可使用多种化学治疗剂。术语“化疗”是指使用药物治疗癌症。“化学治疗剂”是指在癌症治疗中给予的化合物或组合物。这些药剂或药物根据其在细胞内的活性方式进行分类,例如,它们是否影响细胞周期以及在何阶段影响细胞周期。或者,可基于其直接交联dna、插入dna或通过影响核酸合成诱导染色体和有丝分裂畸变的能力来表征药剂。
[0619]
化疗剂的例子包括烷基化剂例如噻替哌和环磷酰胺;烷基磺酸盐,如白消安、英丙舒凡(improsulfan)和哌泊舒凡(piposulfan);氮杂环丙烷,例如苯并多巴(benzodopa)、卡波醌(carboquone)、米得哌(memredopa)和乌瑞替哌(uredopa);乙烯亚胺和甲基三聚氰胺(methylamelamine),包括六甲蜜胺(altretamine)、三乙烯三聚氰胺(triethylenemelamine)、三吖啶基氧化磷(trietylenephosphoramide)、三亚乙基硫代磷酰胺(triethiylenethiophosphoramide)和三羟甲基三聚氰胺(trimethylolomelamine);聚乙酰精宁(acetogenins)(特别是膨松素(bullatacin)和布鲁啉酮(bullatacinone));喜树碱(包括合成类似物拓扑替康);苔藓抑素(bryostatin);卡利他汀(callystatin);cc1065(包括其阿多来新(adozelesin)、卡折来新(carzelesin)和比折来新(bizelesin)合成类似物);念珠藻素(cryptophycin)(特别是自念珠藻环肽1和自念珠藻环肽8);多拉他汀;杜卡霉素(包括合成类似物kw-2189和cb1-tm1);艾榴塞洛素(eleutherobin);水鬼蕉碱(pancratistatin);匍枝珊瑚醇(sarcodictyin);海绵抑制素(spongistatin);氮芥类,例如苯丁酸氮芥(chlorambucil)、萘氮芥(chlornaphazine)、氯磷酰胺(cholophosphamide)、雌氮芥(estramustine)、异环磷酰胺(ifosfamide)、氮芥(mechlorethamine)、盐酸甲氧氮芥、美法仑、新氮芥(novembichin)、苯乙酸氮芥胆甾醇酯(phenesterine)、泼尼莫司汀(prednimustine)、曲磷胺(trofosfmaide)和尿嘧啶芥(uracil mustard);亚硝基脲类(nitrosureas),例如卡莫司汀、氯脲菌素(chlorozotocin)、福莫司汀(fotemustine)、洛莫司汀(lomustine)、尼莫司汀(nimustine)和雷莫司汀(ranimnustine);抗生素,例如烯二炔类抗生素(如加利车霉素(calicheamicin)、尤其加利车霉素γ1i和加利车霉素ωi1);达尼霉素(dynemicin),包括达尼霉素a;二膦酸盐,例如氯屈膦酸(clodronate);埃斯培拉霉素(esperamicin);和新抑癌蛋白(neocarzinostatin)发色团和相关的色蛋白烯二炔抗生素发色团、阿克拉霉素(aclacinomysins)、放线菌素、安曲霉素(authrarnycin)、偶氮丝氨酸、博莱霉素、放线菌素c(cactinomycin),卡拉比星(carabicin),洋红霉素(carminomycin),
嗜癌素(carzinophilin),色霉素(chromomycinis),放线菌d(dactinomycin),道诺霉素,地托比星(detorubicin),6-重氮-5-氧-l-正亮氨酸)、阿霉素(包括吗啉代-阿霉素,氰基吗啉代-阿霉素,2-吡咯啉-阿霉素,阿霉素hcl脂质体注射液和脱氧阿霉素),表柔比星,伊索比星,伊达比星,麻西罗霉素(marcellomycin),丝裂霉素例如丝裂霉素c,霉酚酸,诺加霉素(nogalamycin),橄榄霉素(olivomycins),培洛霉素(peplomycin),博替罗霉素(potfiromycin),嘌呤霉素(puromycin),奎拉霉素(quelamycin),罗多比星(rodorubicin),链黑菌素(streptonigrin),链脲菌素(streptozocin),杀结核菌素(tubercidin),乌苯美司(ubenimex),净司他汀(zinostatin)和佐柔比星(zorubicin);抗代谢药,例如甲氨蝶呤和5-氟尿嘧啶(5-fu);叶酸类似物,如迪诺特宁(denopterin),甲氨蝶呤,蝶罗呤(pteropterin)和三甲曲沙(trimetrexate);嘌呤类似物,例如氟达拉滨(fludarabine),6-巯基嘌呤,硫咪嘌呤(thiamiprine)和硫鸟嘌呤(thioguanine);嘧啶类似物,例如安西他滨(ancitabine),阿扎胞苷(azacitidine),6-氮尿苷(6-azauridine),卡莫氟(carmofur),阿糖胞苷(cytarabine),二脱氧尿苷(dideoxyuridine),去氧氟尿苷(doxifluridine),依诺他滨(enocitabine),和氟尿苷(floxuridine);雄激素类,例如卡普睾酮(calusterone)、丙酸甲雄烧酮(dromostanolone propionate)、环硫雄醇(epitiostanol)、美雄烷(mepitiostane)和睾内酯(testolactone);抗肾上腺素,例如米托坦(mitotane)和曲洛司坦(trilostane);叶酸补充剂,例如叶酸;乙酰葡醛酯(aceglatone),醛磷酰胺糖苷(aldophosphamide glycoside);氨基乙酰丙酸;恩尿嘧啶(eniluracil);安吖啶(amsacrine);贝曲布辛(bestrabucil);比生群(bisantrene);依达曲塞(edatraxate);德弗法明(defofamine);秋水仙胺(demecolcine);亚丝醌(diaziquone);伊弗尼辛(elfornithine);依利醋铵(elliptinium acetate);埃博霉素;依托格鲁(etoglucid);硝酸镓;羟基脲;香菇多糖(lentinan);洛尼达宁(lonidainine);美登木素生物碱,例如美登素和安托霉素(ansamitocins);米托胍腙(mitoguazone);米托蒽醌(mitoxantrone);莫口比丹莫(mopidanmol);尼曲吖啶(nitraerine);喷司他汀(pentostatin);蛋氨氮芥(phenamet);吡柔比星(pirarubicin);洛索蒽醌(losoxantrone);2-乙基酰肼(2-ethylhydrazide);丙卡巴肼(procarbazine);psk聚多糖复合物;雷佐生(razoxane);根霉素(rhizoxin);司佐弗兰锗螺胺(spirogermanium);细交链孢菌酮酸(tenuazonic acid);三亚胺醌(triaziquone);2,2',2"-三氯三乙胺;单端孢霉烯族毒素类(trichothecenes)(尤其,t-2毒素,疣孢漆斑霉素a(verracurin a),漆斑菌素a(roridin a)和蛇形菌素(anguidine);尿烷;长春地辛(vindesine);达卡巴嗪(dacarbazine);甘露醇氮芥(mannomustine);二溴甘露醇(mitobronitol);二溴卫矛醇(mitolactol);哌泊溴烷(pipobroman);瓜西托辛(gacytosine);阿拉伯糖苷("ara-c");环磷酰胺;紫杉烷类(例如紫杉醇、多西它赛);吉西他滨;6-硫鸟嘌呤;巯基嘌呤;铂配合物,如顺铂、奥沙利铂和卡铂;长春花碱;铂;依托泊苷(vp-16);异环磷酰胺;米托蒽醌;长春新碱;长春瑞滨;诺肖林(novantrone);替尼泊苷;依达曲沙;道诺霉素;氨基蝶呤;希罗达(xeoloda);伊班膦酸钠;伊立替康(例如,cpt-il);拓扑异构酶抑制剂rfs 2000;二氟甲基鸟氨酸(dmfo);视黄醇,例如视黄酸;卡培他滨(capecitabine);卡铂、丙卡巴嗪、普利康霉素、吉西他滨、诺维苯、法尼基转移酶抑制剂、反-铂和任意上述的药学上可接受的盐、酸或衍生物。
[0620]
b.放疗(rt)
[0621]
导致dna损伤并被广泛使用的其他因素包括通常所知的γ射线、x射线和/或定向递送到肿瘤细胞的放射性同位素。还涵盖了其他形式的dna损伤因素,如微波、质子束辐照(美国专利5,760,395和4,870,287)以及uv辐照。所有这些因素都极可能对dna、dna前体、dna复制和修复以及染色体的组装和维持造成各种损害。x射线的剂量范围从每天50到200伦琴,持续较长时间(3到4周),到单剂2,000到6,000伦琴。放射性同位素的剂量范围变化很大,取决于同位素的半衰期、辐射强度和类型以及肿瘤细胞的吸收。
[0622]
c.免疫治疗
[0623]
本领域技术人员将理解,免疫疗法可结合或合并本实施方式的方法使用。在癌症治疗的背景下,免疫疗法通常依赖于使用免疫效应细胞和分子来靶向和破坏癌细胞。利妥昔单抗就是这样一个例子。例如,免疫效应物可为肿瘤细胞表面某些标志物的特异性抗体。抗体本身可作为治疗效应物,或者可招募其他细胞来实际影响细胞杀伤。抗体也可与药物或毒素(化疗、放射性核素、蓖麻毒素a链、霍乱毒素、百日咳毒素等)偶联并仅作为靶向剂。或者,效应物可以是携带表面分子的淋巴细胞,该表面分子可直接或间接与肿瘤细胞靶标相互作用。各种效应细胞包括细胞毒性t细胞和nk细胞。
[0624]
在免疫治疗的一个方面中,肿瘤细胞必须具有能够被靶向(即,在大多数其他细胞上不存在)的某些标志物。存在许多肿瘤标志物,并且其中任何一种可适合在本实施方式的背景下被靶向。常见的肿瘤标志物包括b-细胞成熟抗原、cd20、癌胚抗原、酪氨酸酶(p97)、gp68、gprc5d、tag-72、hmfg、唾液酸lewis抗原、muca、mucb、plap、层粘连蛋白受体、erb b和p155。免疫治疗的另一个方面是将抗癌作用与免疫刺激作用结合起来。免疫刺激分子也存在,包括:细胞因子,如il-2、il-4、il-12、gm-csf、γ-ifn,趋化因子,如mip-1、mcp-1、il-8,和生长因子,如flt3配体。
[0625]
目前正在研究或使用的免疫疗法的实例包括免疫佐剂,例如牛分枝杆菌(mycobacterium bovis)、恶性疟原虫(plasmodium falciparum)、二硝基氯苯和芳香化合物(美国专利5,801,005和5,739,169;hui和hashimoto,1998;christodoulides等,1998);细胞因子疗法,例如干扰素α、β及γ、il-1、gm-csf和tnf(bukowski等,1998;davidson等,1998;hellstrand等,1998);基因治疗,例如tnf、il-1、il-2和p53(qin等,1998;austin ward和villaseca,1998;美国专利5,830,880和5,846,945);以及单克隆抗体,例如抗cd20、抗神经节苷脂gm2和抗p185(hollander,2012;hanibuchi等,1998;美国专利5,824,311)。预期一种或多种抗癌疗法可与本文所述的抗体疗法一起使用。
[0626]
在一些方面,本文描述的组合包括降低肿瘤免疫抑制的试剂,例如趋化因子(c-x-c基序)受体2(cxcr2)抑制剂。在一些实施方式中,cxcr2抑制剂是达尼利辛(danirixin)(cas登记号:954126-98-8)。达尼利辛也称为gsk1325756或1-(4-氯-2-羟基-3-哌啶-3-基磺酰基苯基)-3-(3-氟-2-甲基苯基)脲。达尼利辛公开于例如miller等人eur j drug metab pharmackinet(2014)39:173-181;和miller等人,bmc pharmacology and toxicology(2015),16:18中。在一些实施方式中,cxcr2抑制剂是瑞帕利辛(riparixin)(cas登记号:266359-83-5)。瑞帕利辛也称为瑞帕他辛(repertaxin)或(2r)-2-[4-(2-甲基丙基)苯基]-n-甲基磺酰基丙酰胺。瑞帕利辛是cxcr1/2的非竞争性变构抑制剂。瑞帕利辛公开于例如zarbock等人british journal of pharmacology(2008),1-8。在一些实施方式
中,cxcr2抑制剂是纳瓦利辛(navarixin)。纳瓦利辛也称为mk-7123、sch527123、ps291822或2-羟基-n,n-二甲基-3-[[2-[[(1r)-1-(5-甲基呋喃-2-基)丙基]氨基]-3,4-二氧代环丁烯-1-基]氨基]苯甲酰胺。纳瓦利辛公开于例如ning等人,mol cancer ther。2012;11(6):1353-64。在一些实施方式中,cxcr2抑制剂为azd5069,也称为n-[2-[[(2,3-二氟苯基)甲基]硫]-6-{[(1r,2s)-2,3-二羟基-1-甲基丙基]氧基}-4-嘧啶基]-1-氮杂环丁烷磺酰胺。在一些实施方式中,cxcr2抑制剂是抗cxcr2抗体,例如wo2020/028479中公开的那些。
[0627]
在一些方面,本文所述的组合包括活化树突细胞的试剂,例如tlr激动剂。本文定义的“tlr激动剂”是任何激活toll样受体的分子,如bauer等人,2001,,proc.natl.acad.sci.usa 98:9237-9242所述。tlr激动剂可以是小分子、重组蛋白、抗体或抗体片段、核酸或蛋白质。在某些实施方式中,tlr激动剂是重组的、天然配体、免疫刺激核苷酸序列、小分子、纯化的细菌提取物或灭活的细菌制剂。
[0628]
已经描述了几种源自微生物的tlr激动剂,例如脂多糖、肽聚糖、鞭毛蛋白和脂磷壁酸(aderem等人,2000,nature 406:782-787;akira等人,2001,nat.immunol.2:675-680)。这些配体中的一些可以活化表达不同tlr模式的不同树突细胞亚群(kadowaki等人,2001,j.exp.med.194:863-869)。因此,tlr激动剂可以是任何具有tlr激动剂特性的微生物制剂。某些类型的未翻译dna已被证明通过活化tlr来刺激免疫反应。特别是,含有cpg基序的免疫刺激性寡核苷酸已被广泛公开并报道可活化淋巴细胞(参见美国专利第6,194,388号)。本文所用的“cpg基序”定义为非甲基化胞嘧啶鸟嘌呤(cpg)二核苷酸。根据本发明的方法,含有cpg基序的免疫刺激性寡核苷酸也可用作tlr激动剂。免疫刺激性核苷酸序列可以通过结构修饰(例如硫代磷酸酯修饰)来稳定,或者可以包封在阳离子脂质体中,以促进体内药代动力学和肿瘤靶向。
[0629]
在一些实施方式中,免疫治疗包括免疫检查点抑制剂。免疫检查点打开信号(例如,共刺激分子)或关闭信号。免疫检查点打开信号(例如,共刺激分子)或关闭信号。免疫检查点靶向阻断可针对的免疫检查点蛋白包括腺苷a2a受体(a2ar)、b7-h3(也称为cd276)、b和t淋巴细胞弱化子(btla)、ccl5、cd27、cd38、cd8a、cmklr1、细胞毒性t淋巴细胞相关蛋白4(ctla-4,也称为cd152)、cxcl9、cxcr5、糖皮质激素诱导的肿瘤坏死因子受体相关蛋白(gitr)、hla-drb1、icos(还称为cd278)、hla-dqa1、hla-e、吲哚胺2,3-双加氧酶(ido)、杀手细胞免疫球蛋白(kir)、淋巴细胞激活基因-3(lag-3,也称为cd223)、mer酪氨酸激酶(mertk)、nkg7、ox40(也称作cd134)、程序性死亡1(pd-1)、程序性死亡配体1(pd-l1,也称为cd274)、pdcd1lg2、psmb10、stat1、具有ig和itim结构域的t细胞免疫受体(tigit)、t细胞免疫球蛋白结构域和粘蛋白结构域3(tim-3),和t细胞活化的v域ig抑制物(vista,也称为c10orf54)。特别是,免疫检查点抑制剂靶向pd-1轴和/或ctla-4。
[0630]
免疫检查点抑制剂可以是药物,例如小分子、配体或受体的重组形式,或者抗体,例如人类抗体(例如,国际专利公开wo2015/016718;pardoll,nat rev cancer,12(4):252-264,2012;两者通过引用纳入本文)。可以使用已知的免疫检查点蛋白抑制剂或其类似物,特别是可以使用嵌合、人源化或人类形式的抗体。本领域技术人员将知道,对于本公开中提到的某些抗体,可使用别名和/或等同名称。在本公开的上下文中,此类别名和/或等同名称可以互换。例如,众所周知,兰姆单抗(lambrolizumab)也以别名和等同名称mk-3475和派姆单抗(pembrolizumab)为人所知。
[0631]
在一些实施方式中,pd-1结合拮抗剂是抑制pd-1与其配体结合伴侣结合的分子。在特定方面中,pd-1配体结合伴侣为pd-l1和/或pd-l2。在一些实施方式中,pd-l1结合拮抗剂是抑制pd-l1与其结合伴侣结合的分子。在特定方面中,pd-l1结合伴侣为pd-1和/或b7-1。在一些实施方式中,pd-l2结合拮抗剂是抑制pd-l2与其结合伴侣结合的分子。在特定方面中,pd-l2结合伴侣是pd-1。拮抗剂可以是抗体、其抗原结合片段、免疫粘附素、融合蛋白或寡肽。示例性抗体在美国专利号8,735,553、8,354,509和8,008,449中描述,所有这些专利均通过引用纳入本文。本领域已知用于本文所提供方法的其他pd-1轴拮抗剂,例如美国专利申请公开号2014/0294898、2014/022021和2011/0008369中所述,所有这些均通过引用纳入本文。
[0632]
在一些实施方式中,pd-1结合拮抗剂是抗pd-1抗体(例如,人抗体、人源化抗体或嵌合抗体)。在一些实施方式中,抗pd-1抗体选自纳武单抗、派姆单抗和ct-011。在一些实施方式中,pd-1结合拮抗剂是免疫粘附素(例如,包含与恒定区(例如,免疫球蛋白序列的fc区)融合的pd-l1或pd-l2胞外或pd-1结合部分的免疫粘附素)。在一些实施方式中,pd-1结合拮抗剂是amp-224。纳武单抗,也称mdx-1106-04、mdx-1106、ono-4538、bms-936558和是wo2006/121168中描述的抗pd-1抗体。派姆单抗,也称mk-3475、merck 3475、兰姆单抗、和sch-900475,是wo2009/114335中描述的抗pd-1抗体。ct-011,也称hbat或hbat-1,是wo2009/101611中描述的抗pd-1抗体。amp-224,也称b7-dcig,是wo2010/027827和wo2011/066342中描述的pd-l2-fc融合可溶受体。.
[0633]
可在本文提供的方法中被靶向的另一免疫检查点蛋白是细胞毒性t淋巴细胞相关蛋白4(ctla-4),也称为cd152。人类ctla-4的完整cdna序列的genbank登录号为l15006。ctla-4存在于t细胞表面,当与抗原呈递细胞表面的cd80或cd86结合时,ctla-4起到“关闭”开关的作用。ctla-4类似于t细胞共刺激蛋白cd28,这两种分子都与抗原呈递细胞上的cd80和cd86(也分别称为b7-1和b7-2)结合。ctla-4向t细胞传递抑制信号,而cd28向t细胞传递刺激信号。细胞内ctla-4也存在于调节性t细胞中,可能对其功能很重要。通过t细胞受体和cd28激活t细胞导致ctla-4表达增加,ctla-4是b7分子的抑制性受体。
[0634]
在一些实施方式中,免疫检查点抑制剂是抗ctla-4抗体(例如,人抗体、人源化抗体或嵌合抗体)、其抗原结合片段、免疫粘附素、融合蛋白或寡肽。可使用本领域公知的方法生成适于在本公开方法中使用的抗人ctla-4抗体(或从其衍生的vh和/或vl结构域)。或者,可以使用本领域认可的抗ctla-4抗体。可用于本文所述方法中的抗-ctla-4抗体公开于例如:美国专利第8,119,129号;pct公开第wo 01/14424号、第wo 98/42752号、第wo 00/37504号(cp675,206,也称作特姆单抗(tremelimumab);原称替西单抗(ticilimumab));美国专利第6,207,156号;hurwitz等,(1998)proc natl acad sci usa,95(17):10067-10071;camacho等,(2004)j clin oncology,22(145):摘要号2505(抗体cp-675206);以及mokyr等,(1998)cancer res,58:5301-5304。各前述公开物中的教导通过引用纳入本文。也可使用与这些本领域认可的抗体中的任何一种竞争以结合ctla-4的抗体。例如,在国际专利申请号wo2001/014424、wo2000/037504和美国专利号8,017,114中描述了人源化ctla-4抗体;所有内容通过引用纳入本文。
[0635]
示例性抗ctla-4抗体为伊普利单抗(ipilimumab,也称为10d1、mdx-010、mdx-101
和)或其抗原结合片段及变体(例如,参见wo 01/14424)。在其他实施方式中,抗体包含伊普利单抗的重链和轻链cdr或vr。因此,在一个实施方式中,抗体包含伊普利单抗vh区的cdr1、cdr2和cdr3结构域,以及伊普利单抗的vl区的cdr1、cdr2和cdr3结构域。在另一实施方式中,抗体竞争结合和/或结合到与上述抗体相同的ctla-4表位。在另一个实施方式中,抗体与上述抗体具有至少约90%的可变区氨基酸序列相同性(例如,与伊普利单抗具有至少约90%、95%或99%的可变区相同性)。用于调节ctla-4的其他分子包括ctla-4配体和受体,如美国专利号5,844,905、5,885,796和国际专利申请号wo1995001994和wo1998042752中所述;全部通过引用纳入本文,以及美国专利号8329867中所述的免疫粘附素,通过引用纳入本文。
[0636]
可在本文提供的方法中被靶向的另一免疫检查点蛋白是淋巴细胞激活基因3(lag-3),也称为cd223。人类lag-3完整蛋白质序列的genbank登录号为np-002277。lag-3存在于活化的t细胞、天然杀伤细胞、b细胞和浆细胞样树突细胞的表面。当lag-3与抗原呈递细胞表面上的ii类mhc结合时,lag-3充当“关闭”开关。抑制lag-3同时激活效应t细胞和抑制调节t细胞。在一些实施方式中,免疫检查点抑制剂是抗lag-3抗体(例如,人抗体、人源化抗体或嵌合抗体)、其抗原结合片段、免疫粘附素、融合蛋白或寡肽。可使用本领域公知的方法生成适于在本公开方法中使用的抗人lag-3抗体(或从其衍生的vh和/或vl结构域)。或者,可以使用本领域认可的抗lag-3抗体。示例性抗lag-3抗体为瑞拉特利单抗(relatlimab,也称bms-986016)或其抗原结合片段和变体(参见例如wo 2015/116539)。其他示例性抗lag-3抗体包括tsr-033(参见,例如,wo 2018/201096)、mk-4280和regn3767。mgd013是wo 2017/019846中描述的抗lag-3/pd-1双特异性抗体。fs118是wo 2017/220569中描述的抗lag-3/pd-l1双特异性抗体。
[0637]
可在本文提供的方法中被靶向的另一免疫检查点蛋白是t细胞激活的v域ig抑制物(vista),也称为c10orf54。人类vista完整蛋白质序列的genbank登录号为np_071436。vista存在于白细胞上,抑制t细胞效应物功能。在一些实施方式中,免疫检查点抑制剂是抗vista3抗体(例如,人抗体、人源化抗体或嵌合抗体)、其抗原结合片段、免疫粘附素、融合蛋白或寡肽。可使用本领域公知的方法生成适于在本公开方法中使用的抗人vista抗体(或从其衍生的vh和/或vl结构域)。或者,可以使用本领域认可的抗vista抗体。示例性抗vista抗体为jnj-610588(也称为奥瓦利单抗(onvatilimab,参见,例如,wo 2015/097536、wo 2016/207717、wo 2017/137830、wo 2017/175058)。小分子ca-170也可抑制vista,该小分子选择性靶向pd-l1和vista(参见,例如,wo 2015/033299、wo 2015/033301)。
[0638]
可在本文提供的方法中被靶向的另一免疫检查点蛋白是吲哚胺2,3-双加氧酶(ido)。人类ido完整蛋白质序列的genbank登录号为np_002155。在一些实施方式中,免疫检查点抑制剂是小分子ido抑制剂。示例性小分子包括bms-986205、依帕司他(epacadostat,incb24360)和纳沃西莫德(navoximod,gdc-0919)。
[0639]
可在本文提供的方法中被靶向的另一免疫检查点蛋白是cd38。人类cd38完整蛋白质序列的genbank登录号为np_001766。在一些实施方式中,免疫检查点抑制剂是抗cd38抗体(例如,人抗体、人源化抗体或嵌合抗体)、其抗原结合片段、免疫粘附素、融合蛋白或寡肽。可使用本领域公知的方法生成适于在本公开方法中使用的抗人cd38抗体(或从其衍生的vh和/或vl结构域)。或者,可以使用本领域认可的抗cd38抗体。示例性抗cd38抗体为达雷
姆单抗(daratumumab,参见例如美国专利第7,829,673号)。
[0640]
在本文提供的方法中可以靶向的另一种免疫检查点蛋白是icos,也称为cd278。人类icos完整蛋白质序列的genbank登录号为np_036224。在一些实施方式中,免疫检查点抑制剂是抗icos抗体(例如,人抗体、人源化抗体或嵌合抗体)、其抗原结合片段、免疫粘附素、融合蛋白或寡肽。可使用本领域公知的方法生成适于在本公开方法中使用的抗人icos抗体(或从其衍生的vh和/或vl结构域)。或者,可以使用本领域认可的抗icos抗体。示例性抗icos抗体包括jtx-2011(参见,例如,wo 2016/154177、wo 2018/187191)和gsk3359609(参见,例如,wo 2016/059602)。
[0641]
可在本文提供的方法中被靶向的另一免疫检查点蛋白是具有ig和itim结构域的t细胞免疫受体(tigit)。人类tigit完整蛋白质序列的genbank登录号为np_776160。在一些实施方式中,免疫检查点抑制剂是抗tigit抗体(例如,人抗体、人源化抗体或嵌合抗体)、其抗原结合片段、免疫粘附素、融合蛋白或寡肽。可使用本领域公知的方法生成适于在本公开方法中使用的抗人tigit抗体(或从其衍生的vh和/或vl结构域)。或者,可以使用本领域认可的抗tigit抗体。示例性抗tigit抗体为mk-7684(参见例如wo 2017/030823、wo 2016/028656)。
[0642]
在本文提供的方法中可以靶向的另一种免疫检查点蛋白是ox40,也称为cd134。人类ox40完整蛋白质序列的genbank登录号为np_003318。在一些实施方式中,免疫检查点抑制剂是抗-ox40抗体(例如,人抗体、人源化抗体或嵌合抗体)、其抗原结合片段、免疫粘附素、融合蛋白或寡肽。可使用本领域公知的方法生成适于在本公开方法中使用的抗人ox40抗体(或从其衍生的vh和/或vl结构域)。或者,可以使用本领域认可的抗ox40抗体。示例性抗ox40抗体为pf-04518600(例如,参见wo 2017/130076)。ator-1015是一种针对ctla4和ox40的双特异性抗体(参见,例如,wo 2017/182672、wo 2018/091740、wo 2018/202649、wo 2018/002339)。
[0643]
在本文提供的方法中可以靶向的另一种免疫检查点蛋白是糖皮质激素诱导的肿瘤坏死因子受体相关蛋白(gitr),也称为tnfrsf18和aitr。人类gitr完整蛋白质序列的genbank登录号为np_004186。在一些实施方式中,免疫检查点抑制剂是抗-gitr抗体(例如,人抗体、人源化抗体或嵌合抗体)、其抗原结合片段、免疫粘附素、融合蛋白或寡肽。可使用本领域公知的方法生成适于在本公开方法中使用的抗人gitr抗体(或从其衍生的vh和/或vl结构域)。或者,可以使用本领域认可的抗gitr抗体。示例性抗gitr抗体为trx518(例如,参见wo 2006/105021)。
[0644]
在一些实施方式中,免疫治疗可以是过继免疫治疗,其涉及转移体外产生的自体抗原特异性t细胞。用于过继免疫治疗的t细胞可以通过抗原特异性t细胞的扩增或通过基因工程重新定向t细胞来产生(park,rosenberg等,2011)。分离和转移肿瘤特异性t细胞已被证明是治疗黑色素瘤的成功方法。通过转基因t细胞受体或嵌合抗原受体(car)的遗传转移,已经成功地在t细胞中产生了新的特异性(jena,dotti等,2010年)。car是合成受体,由与单个融合分子中的一个或多个信号传导结构域相关的靶向部分组成。一般而言,car的结合部分由单链抗体(scfv)的抗原结合结构域组成,该scfv包含通过柔性接头连接的单克隆抗体轻链可变片段。基于受体或配体结构域的结合部分也得到了成功的应用。第一代car的信号传导结构域来自cd3ζ或fc受体γ链的细胞质区域。car已成功地使t细胞重定向针对各
种恶性肿瘤(包括淋巴瘤和实体瘤)的肿瘤细胞表面表达的抗原(jena,dotti等,2010)。
[0645]
在一个实施方式中,本技术提供用于治疗癌症的组合疗法,其中该组合疗法包括过继性t细胞疗法和检查点抑制剂。在一个方面,过继性t细胞疗法包括自体和/或同种异体t细胞。在另一方面,自体和/或同种异体t细胞靶向性针对肿瘤抗原。
[0646]
d.手术
[0647]
大约60%的癌症患者将接受某种类型的手术,包括预防性、诊断性或分期性、治疗性和姑息性手术。治疗性手术包括切除,其中全部或部分癌组织被物理移除、切除和/或破坏,并且可以与其他治疗结合使用,例如与本实施方式的治疗、化疗、放疗、激素治疗、基因治疗、免疫治疗和/或替代治疗结合。肿瘤切除术是指物理切除至少部分肿瘤。除了肿瘤切除,手术治疗还包括激光手术、冷冻手术、电外科和显微镜控制手术(莫氏手术)。
[0648]
切除部分或全部癌细胞、组织或肿瘤后,可在体内形成空洞。治疗可以通过在该区域灌注、直接注射或局部应用其他抗癌治疗来完成。例如,可每1、2、3、4、5、6或7天,或每1、2、3、4和5周,或每1、2、3、4、5、6、7、8、9、10、11或12个月重复进行此类治疗。这些治疗也可能有不同的剂量。
[0649]
e.其他药剂
[0650]
预期其他药剂可与本实施方式的某些方面结合使用以提高治疗的治疗效果。这些其他药剂包括影响细胞表面受体和gap连接上调的药剂、细胞抑制剂和分化试剂、细胞粘附抑制剂、增加过度增殖细胞对凋亡诱导物敏感性的试剂或其他生物试剂。通过增加gap连接的数量来增加细胞间信号传导,将增加对邻近过度增殖细胞群的抗过度增殖作用。在其他实施方式中,细胞抑制剂或分化剂可与本实施方式的某些方面结合使用,以提高治疗的抗过度增殖功效。预期细胞粘附的抑制剂可提高本实施方式的功效。细胞粘附抑制剂的例子有粘着斑激酶(faks)抑制剂和洛伐他汀。进一步设想,可结合本实施方式的某些方面使用增加过度增殖细胞对凋亡的敏感性的其他药剂,例如抗体c225,以提高治疗效果。
[0651]
vi.检测方法
[0652]
在一些方面,本公开提供了用于检测hsp70表达的免疫检测方法。考虑了用于检测蛋白质产物的各种分析实验,包括免疫组织化学、酶联免疫吸附分析(elisa)、放射免疫分析(ria)、免疫放射分析、荧光免疫分析、化学发光分析、生物发光分析、斑点印迹、facs分析和western印迹等。科学文献中描述了各种有用的免疫检测方法的步骤。一般来说,免疫结合法包括获得样品,并在有效允许形成免疫复合物的条件下使样品与待检测蛋白特异性的抗体接触(视情况而定)。通常,免疫复合物形成的检测在本领域中是众所周知的,并且可以通过应用多种方法来实现。这些方法通常基于对标记或标志物的检测,例如放射性、荧光、生物和酶标签任一。当然,通过使用第二结合配体,如本领域已知的第二抗体和/或生物素/亲和素配体结合布置,可以发现额外的优点。
[0653]
用于检测的抗体本身可与可检测标记连接,其中可简单地检测该标记,从而确定组合物中的初级免疫复合物的量。或者,可通过对抗体具有结合亲和力的第二结合配体检测结合在初级免疫复合物内的第一抗体。在这些情况下,第二结合配体可以与可检测的标记物连接。第二结合配体本身通常是抗体,因此可以称为“二”抗。初级免疫复合物在有效条件下与标记的二级结合配体或抗体接触,接触时间足以形成二级免疫复合物。然后通常洗涤二级免疫复合物以去除任何非特异性结合的标记的二抗或配体,然后检测二级免疫复合
体中的剩余标记。
[0654]
如本文所用,术语“样品”是指适用于本发明提供的检测方法的任何样品。样品可以是包括适合于检测或分离的物质的任何样品。样品来源包括血液、胸腔液、腹腔液、尿液、唾液、恶性腹水、支气管肺泡灌洗液、滑液和支气管冲洗液。在一个方面,样品是血液样品,包括例如全血或其任何部分或组分。适用于本发明的血液样品可从包括血细胞或其组分的任何已知来源提取,例如静脉、动脉、外周、组织、脐带等。例如,可以使用众所周知的常规临床方法(例如,抽取和处理全血的程序)获取和处理样品。在一个方面,示例性样品可以是从患有癌症的对象抽取的外周血。在一些方面,生物样品包括多个细胞。在某些方面,生物样品包括新鲜或冷冻组织。在特定方面,生物样品包括福尔马林固定的石蜡包埋组织。在一些方面,生物样品是组织活检、细针抽吸、血液、血清、血浆、脑脊液、尿液、粪便、唾液、循环肿瘤细胞、外泌体或抽吸物和身体分泌物,如汗液。在一些方面,生物样品含有无细胞dna。
[0655]
vii.试剂盒
[0656]
在实施方式的各个方面中,涵盖了包含治疗剂和/或其他治疗剂和递送剂的试剂盒。在一些实施方式中,提供了用于制备和/或给予实施方式治疗的试剂盒。试剂盒可包括一个或多个密封小瓶,其中包含本实施方式的任何药物组合物。试剂盒可包括,例如,至少一种hsp70抗体或hsp70-特异性car构建体以及用于制备、配制和/或给予实施方式的组分或执行本公开方法的一个或多个步骤的试剂。在一些实施方式中,试剂盒还可以包括合适的容器,该容器是不会与试剂盒的成分反应的容器,例如eppendorf管、分析板、注射器、瓶子或管。容器可由可消毒材料制成,如塑料或玻璃。
[0657]
该试剂盒还可包括概述本文所述方法的程序步骤的说明书,并将遵循与本文所述或本领域普通技术人员已知的基本相同的程序。指令信息可以在包含机器可读指令的计算机可读介质中,当使用计算机执行该指令时,导致显示递送药物有效量的治疗剂的真实或虚拟过程。
[0658]
viii.实施例
[0659]
包括以下实施例以演示本发明的优选实施方式。本领域技术人员应当理解,在下面的实施例中公开的技术代表发明人发现的在本公开的实践中发挥良好作用的技术,因此可以被视为构成其实践的优选模式。在本文基础上,本领域技术人员应懂得,在本文要旨和范围内可对本文所述具体实施方式进行多种改变而仍然得出相同或相近结果。
[0660]
实施例1
–
产生靶向hsp70的治疗性抗体
[0661]
为了产生抗-hsp70 mab,与md anderson单克隆抗体核心设施合作,产生表达与绿色荧光蛋白(gfp)融合的人hsp70的鼠成纤维细胞l-细胞(willert等人,2003),并将其注射到balb/c小鼠的足垫中。最初每三天注射四次,第13天和第15天加强注射两次,然后将鼠脾细胞与sp2/0-ag14鼠骨髓瘤细胞融合(shulman等人,1978年),以产生杂交瘤。单细胞克隆将混合培养中最初输出的96个克隆缩小到46个克隆,然后用干细胞elisa筛选以鉴定识别表达hsp70-gfp但不携带载体的野生型l细胞或表达gfp的l细胞的单克隆抗体。接着,其余28个杂交瘤克隆制备的mab通过以下表征:通过流式细胞术识别完整mm1.s骨髓瘤细胞上的hsp70,通过蛋白质印迹在mm1.s细胞提取物中识别hsp70,表明17个克隆具有感兴趣特性。使用rpmi 8226人骨髓瘤细胞和使用crispr/cas9介导的基因组编辑敲除了hsp70的8226细胞,进一步筛选其与hsp70的结合,与密切同源的hsp70家族成员(daugaard等人,2007)的结
合比对,从而得出结论,六个mab对人hsp70具有最高的特异性。作为最终筛选,在注射了表达荧光素酶(luc)的mopc315.bm鼠骨髓瘤细胞的免疫活性balb/c小鼠中评估抗体的抗肿瘤活性,该模型大致再现人骨髓瘤自然史,包括溶骨性骨病的发展(hofgaard等人,2012年)。这是可能的,因为鼠和人hsp70在氨基酸水平上有非常接近的95%同源性(hunt&calderwood,1990),并且发现mab结合了这两种蛋白质。克隆77a在试验研究中显示抗肿瘤活性(图1),并且克隆77a(下文称为77a)被选择用于进一步研究,因为2/5治疗小鼠在100天时显示骨髓瘤完全消退而无复发。
[0662]
表1-3中提供了77a抗体的互补决定区(cdr)和可变区。
[0663]
表1. 77a抗体的重链和轻链可变序列的cdr。
[0664][0665]
表2.编码77a抗体可变区的氨基酸序列。
[0666][0667]
表3.编码77a抗体可变区的核苷酸序列。
[0668][0669][0670]
实施例2
–
mab 77a显示出对人hsp70的强亲和力
[0671]
进行octet分析以研究77a结合的亲和力和动力学(图2a)。在大肠杆菌中制备的鼠
hsp70和人hsp70的解离常数(kd)分别为9.88x 10-7
和8.50x 10-10
,而在真核昆虫sf9细胞中制备的hsp70则低于检测限(1.0x 10-12
)。为了提供一些背景,77a的0.85nm亲和力与抗cd20 mab利妥昔单抗(5.2nm)(malviay等人,2012年)和抗-cd38 mab达雷姆单抗(4.36nm)的亲和力(van de donk等人,2016年)有利相当,后者分别用于b细胞淋巴瘤和骨髓瘤的临床应用。因此,77a尤其对人hsp70有很强的亲和力,而在原核细胞和真核细胞中产生的人hsp70之间的差异表明,77a可能针对不同折叠或翻译后修饰的表位。
[0672]
迄今为止的研究通过在adp-琼脂糖上纯化hsp70关注adp-hsp70,因为这是对肽具有更高亲和力且更具免疫原性的形式(greene等人,2018;peng等人,1997)。事实上,77a显示出与adp-hsp70复合物的优先结合,该复合物将包含肿瘤衍生肽抗原(图2b)。此外,当存在adp和肽底物(nrl)时,77a与hsp70-gfp结合的elisa研究显示出最大的亲和力(图2c)。这种以adp-/肽结合形式与hsp70的优先结合可能增强肿瘤微环境中肿瘤相关抗原的递送。
[0673]
实施例3
–
使用hsp70缺失突变体映射77a表位
[0674]
为了更好地理解77a与hsp70的结合,使用crispr/cas9编辑产生hsp70 ko人胚胎肾(hek)293t细胞,然后用n-末端gfp融合或各种hsp70缺失突变体表达全长hsp70(图3a)。用77a对细胞提取物进行免疫沉淀(ip),然后用α-gfp抗体进行蛋白质印迹,表明77a与641个氨基酸(aa)的全长hsp70和17个氨基酸(aas)从c末端缺失的624个氨基酸蛋白结合,但结合随着额外的30个氨基酸缺失而减少(图3b)。这些发现通过77a与表达这些突变体的293t细胞结合的流式细胞术研究得到证实。较小的缺失显示当aa 604-614缺失时,77a识别细胞培养上清液分泌的hsp70的能力降低(图3c)。有趣的是,当将细胞裂解物中的hsp70用作靶标时,594-604缺失与识别能力下降相关。这些发现表明77a识别氨基酸594-614(图3d)中的表位,该表位不是先前描述的mab的靶标,并且可能存在影响77a识别的分泌型hsp70的差异翻译后修饰,或者77a在共同伴侣的背景下结合hsp70。进行丙氨酸扫描分析以鉴定77a与之相互作用的hsp70中的关键氨基酸(图3e)。该分析确定77a识别hsp70的构象表位,其包括k573、e576、w580、r596和e598作为次要关键位点,h594、k595和q601作为主要关键位点(图3f),其位点对应于seq id no:11中的氨基酸。这些数据支持这样一个模型,即当hsp70处于adp-结合形式以及抗原肽结合形式时,77a与新的hsp70结构域结合,从而锁定底物结合并增加摄取。
[0675]
实施例4
–
免疫缺陷性骨髓瘤模型中77a的差异活性
[0676]
由于77a与来自真核细胞的人hsp70强结合(图2a),因此在体内研究了其对人骨髓瘤细胞的活性。在裸鼠中luc标记的mm1.s细胞的模型中,77a显示出剂量依赖性抗肿瘤活性(图4a),当以50μg注射每周两次时,肿瘤生长有所减少,而在100和200μg剂量时,活性更强。这伴随着通过elisa测定的人轻链水平的降低。值得注意的是,当在scid小鼠和非肥胖重症糖尿病并免疫缺陷il-2受体γ-无(nod/scid/il-2rγ-无(nsg))小鼠中用mm1.s细胞重复该研究时,77a未通过体内成像(图4b)或轻链定量显示活性。这些对比结果表明,77a依赖于裸鼠保留但在nsg小鼠中不存在的免疫效应细胞。此外,利用mm1.s细胞和77a进行的体外试验没有显示出直接的细胞毒性活性,77a也没有诱导抗体或补体依赖性细胞毒性(adcc,cdc)。
[0677]
实施例5-77a增强树突细胞对hsp70的摄取
[0678]
dc、巨噬细胞和自然杀伤(nk)细胞在nsg小鼠中存在缺陷(shultz等人,1995),而
这些细胞在裸鼠中存在并发挥功能。尽管nsg和裸鼠之间存在其他差异,但由于已知肿瘤细胞分泌的hsp70有助于将抗原递送至dc,因此首先关注dc(shevtsov和multhoff,2016;binder,2008)。因此,使用在sf9细胞中制备的纯化的六(6x)-组氨酸标记的人hsp70,用alexa fluor 488-标记的α-6x-his-标记的mab研究dc2.4未成熟dc对6x-his-hsp70的摄取,该细胞是通过用表达鼠粒细胞-巨噬细胞csf(gm-csf)和myc和raf癌基因的逆转录病毒载体转导c57bl/6小鼠的骨髓分离物而产生的永生化鼠系(shen等人,1997)。与针对鸡蛋溶菌酶的对照同种型mab(称为igg2b)相比,77a在4℃和37℃下显著增加hsp70摄取(图5),而其他α-hsp70 mab不具有这种活性。在77a存在下增强的hsp70摄取也可以通过dc2.4细胞的免疫荧光染色来证明(图6)。最后,通过电子显微镜(em)使用与15nm金颗粒偶联的77a检测hsp70在dc中的摄取。通过em,77a相对于igg2b增强了hsp70摄取,如在先前实验中所示(图5和6),并且hsp70在类似吞噬溶酶体的胞内质膜结合体中发现(图7;红色箭头)。
[0679]
鉴于77a对鼠和人hsp70的亲和力存在实质性差异(图5),使用定点突变来表达人hsp7,对两个变体之间不同的每个氨基酸进行单一改变(k-》e,q-》r,n-》s)(图14a),可能的两个氨基酸中的每一个都发生了改变,并且一个对所有三个氨基酸都进行改变。这些在hsp70 ko 293t细胞中表达,在ip研究中检测77a的结合能力(如图3所示)。dc2.4细胞在igg2b和77a存在下摄取这些突变体的能力将通过facs进行研究(如图5所示)。在594-614区域中突变人hsp70序列以匹配鼠序列降低了77a对hsp70的亲和力及其诱导dc2.4细胞摄取的能力(图14b)。
[0680]
确定使77a/hsp70复合物被dc摄取的受体有助于识别其他可能受到类似影响的免疫效应物。发现表达鼠fcγr2b的hsp70敲除hek 239t细胞摄取77a结合的hsp70。同样地,发现表达人fcγr2a或人fcβr2b的hsp70敲除的hek 239t细胞摄取77a结合的hsp70,而其他fc受体的表达不产生这种效应(图13)。人fcγr2a和fcγr2b在单核细胞/巨噬细胞和树突细胞中表达(bruhns,2012)。
[0681]
实施例6
–
hsp70的dc摄取促进成熟
[0682]
为了研究dc摄取hsp70的功能后果,dc2.4细胞在igg2b或77a存在下与hsp70接触。收获rna,将其转化为cdna,并将其与包含384个基因的biorad免疫应答tier 1-4qpcr阵列杂交。使用与对照相比2倍或更多变化的阈值,与阴性对照相比,igg2b活化的基因相对较少(图8a;上图),而77a活化了大得多的基因组的转录(图8b;下图)。ingenuity通路分析指出,最为活化的途径是代表树突细胞成熟的途径(图8b),部分反映为一些最高基因在dc功能中发挥关键作用的发现,包括cd70(bourque&hawiger,2018)、腺苷脱氨酶(casanova等人,2012)、组织蛋白酶s(kim等人,2017)和cc趋化因子配体5(wang等人,2002)。其他活化的途径包括神经炎症信号转导途径、th1和th2信号转导以及toll样受体(tlr)信号转导。此外,收集这些实验的细胞培养上清液并使用细胞因子阵列进行分析。hsp70在77a存在下,相对于igg2b作为对照时诱导显著变化,包括在dc生物学中起关键作用的细胞因子的增加(turner等人,2014),包括肿瘤坏死因子(tnf)-α、粒细胞集落刺激因子(g-csf)和白细胞介素(il)-1(图8c)等。
[0683]
实施例7
–
肿瘤模型中77a的活性
[0684]
77a影响与许多肿瘤相关的一般免疫机制的潜力促使对其在黑色素瘤模型和4t1细胞中的活性进行检测,4t1是一种鼠三阴性乳腺癌(tnbc)(chen等人,2019)模型,该模型
已被很好地表征,被认为是免疫性“冷”的(kim等人,2014),并且不表达表面hsp70。将luc标记的4t1细胞注射到免疫活性balb/c小鼠的乳腺脂肪垫中,并用77a处理,显示出与igg2b相比较慢的原发性肿瘤生长(图9a)。值得注意的是,77a强烈抑制了向肺(图9b)以及向脾脏和肝脏转移疾病的发展。在第32天从存活小鼠收集外周血并通过多参数流分析t细胞亚群,其显示cd4 t细胞的显著增加,cd8 t细胞稍有增加(图9c)。此外,外周血中的mhc ii 类细胞(图9d)以及同时是ii 类和cd11c 类的细胞均有增加,这与77a治疗后鼠dc的增加一致。77a被发现(a)诱导hsp70摄取到人原发性cd4 和cd8 t细胞中(图9e),(b)增强t细胞增殖和成熟标志物的表达,包括cd69和hla-dr,以及(c)在许多肿瘤模型中刺激mhc非依赖性细胞溶解性cd4 t-细胞活性,包括a549人肺癌细胞(图9f)。
[0685]
对于黑色素瘤模型,使用裸鼠中的a375黑色素瘤模型。第一剂77a在第23天给药,最后一剂在第39天给药。在77a治疗的小鼠中肿瘤体积较慢(图9g)。
[0686]
实施例8
–
77a用于增强基于4t1的疫苗策略的效力
[0687]
dc作为专门的抗原递呈细胞,长期以来一直被认为是疫苗策略开发的有吸引力的目标(gornati等人,2018年)。因此,77a可能通过其增强hsp70肽抗原复合物摄取的能力来提高疫苗效力。为了测试这一点,使用表达hsp70-gfp的4t1细胞在adp琼脂糖柱上纯化adp-hsp70肽复合物,并用pbs或带有igg2b或77a的adp-hsp70-肽疫苗注射balb/c小鼠。重点在于adp-hsp70,因为与atp-hsp70相比,adp-hsp 70是对底物(包括肿瘤衍生肽)具有更高亲和力的形式,因此更具有免疫原性(greene等人,1995;peng等人,1997;craig&marszalek,2017)(参见图10,了解hsp70机制的基本原理)。第0天,小鼠原位注射有活力的4t1-luc标记的hsp70-gfp表达细胞,并通过全动物成像监测肿瘤的发展。与pbs对照相比,在存在igg2b的情况下用adp-hsp肽复合物进行疫苗接种在用活4t1细胞攻击后没有减缓小鼠中的肿瘤生长(图11a),但用77a进行疫苗接种确实显著减缓了肿瘤生长。然后将在第37天从这些小鼠分离的脾细胞暴露于经辐照的4t1细胞7天,并显示cd4 增加和较少程度上cd8 t细胞的增加(图11b和c;左图)。此外,这些细胞在7天后对表达hsp70-gfp的4t1细胞或不含hsp70-ffp的4t1细胞表现出增强的细胞毒性(图11b和c;右图),支持可能发生识别hsp70-gfp-衍生抗原和其他肿瘤衍生抗原的细胞毒性t淋巴细胞(ctl)。通过评估这些t细胞分泌干扰素(ifn)-γ和il2的能力,也测试了这种可能性。与igg2b对照相比,来自77a接种小鼠的推定cd4 ctl在暴露于4t1或4t1-hps70-gfp细胞时显示出ifnγ和il2分泌增加(图12a)。在cd8 ctl的情况下(图12b),在用adp-hsp70复合物和77a接种后,当它们暴露于4t1或4t1-hsp70-gfp细胞时,这些细胞也显示出ifnγ分泌增加,但对于il-2的产生,结果不太明显。综上所述,这些数据表明77a可以增强dc对抗原的摄取,并产生更强的下游cd4 和cd8 t细胞应答。
[0688]
实施例9
–
克隆77a hsp70 mab的肿瘤靶点的鉴定
[0689]
聚乙二醇化脂质体阿霉素(pld;)被选为第一种与77a联合使用的药物,因为它已获得乳腺癌治疗的监管批准(lao等人,2013年),对其他恶性肿瘤具有活性(lyseng williamson等人,2013),并导致icd(kroemer等人,2013)。在原位注射4t1细胞的balb/c小鼠中评估具有igg2b或77a的pld。与pld igg2b相比,pld 77a诱导了更大的肿瘤生长减少和延迟(图15a),4/5小鼠用pld 77a治愈(定义为第100天无复发),而只有1/5pld igg2b对照组的情况如此。此外,该组合在基于ct26的免疫活性结肠癌模型中进行了评估,在该模型中,肿瘤生长的减少和延迟更多再次出现。值得注意的是,到第81天,3/5pld 77a小鼠仍然
存活,没有肿瘤复发,而只有1/5igg2b pld小鼠存活,并且该个体有可测量的疾病(图15b)。
[0690]
实施例10
–
抗-hsp70抗体表位分箱(binning)
[0691]
进行表位分箱实验以确定不同的非相关抗hsp70抗体干扰或阻断77a与hsp70结合的程度。
[0692]
为了进行分箱实验,将抗体设置成分箱对。使用夹心构象的octet平台。使用数据分析ht软件进行分析。将每对抗体的第一抗体加载到浸渍-读取传感器表面,然后将传感器浸渍到hsp70溶液中以加载抗原。最后,将传感器浸入每对抗体的第二抗体中,并测量反应。每对的结果被制成成对矩阵。
[0693]
结果如图16所示。图16中的数字反映了可能的竞争性抗体存在下的最大结合百分比。如预期的,所有抗体与其自身竞争。如图所示,77a不与c92f3-5(fisher scientific)或n15f2-5(enzo life sciences)竞争。
[0694]
实施例11
–
adp对atp-结合的hsp70的结合动力学
[0695]
77a与atp或adp-结合形式的hsp70的结合使用生物层干涉(bli)仪器和elisa进行表征。
[0696]
hsp70在sf9细胞中表达。使用对adp或atp-结合蛋白具有选择性的树脂亲和层析,富集相应结合的hsp70重组蛋白的批料制备物。测定洗脱后测定的蛋白质浓度,以便在后续测定中使用相同浓度。对于基于bli的分析,将抗体和试剂稀释到微孔板上并装载入仪器中。将测试的抗体固定在浸渍-读取传感器上,然后在与atp或adp富集的hsp70结合期间观察动力学。对于elisa,将相对富集的hsp70蛋白直接涂覆在elisa板孔上过夜。然后在平板孔中系列稀释测试抗体,并使用适当的二抗-hrp偶联物进行检测。使用tmb底物对板进行显影,使用酸停止溶液使od稳定。bli传感图轨迹数据示于图17中。如所示,与atp富集的hsp70相比,adp富集的hsp7在抗原缔合步骤中有更好的反应(nm偏移)。结合动力学如表4所示。如所示,77a结合的adp-富集的hsp70比atp富集的hsp70亲和力(kd)高大于等于4倍。
[0697][0698]
图18所示的elisa数据描绘了相同的趋势,其中77a与adp富集的hsp70相比atp富集的hsp70具有更高的最大吸光度。77a在adp富集的hsp70下的ec50值(0.7372nm)也低于
atp富集的hsp70(1.774nm)。
[0699]
这些结果表明,相对于atp-hsp70蛋白,77a优先结合adp-hsp70蛋白。
[0700]
实施例12-77a在鼠ct-26肿瘤模型中的活性
[0701]
本实施例描述了在鼠ct-26结直肠腺癌恶病质模型中单独和与抗ctla4抗体组合的77a抗体的测试。
[0702]
将ct26细胞皮下接种在裸鼠balb/c小鼠中。当肿瘤达到约80mm3平均体积时开始治疗。在第14、17和21天,给予小鼠10mg/kg 77a、同种型对照(igg2b)和/或抗ctla4抗体。肿瘤体积如图19所示。如图所示,77a和抗ctla-4抗体的组合对肿瘤体积的影响最大,与同种型对照相比,该组合显著降低了肿瘤体积。联合治疗完全根除了所有5只治疗动物的肿瘤。
[0703]
实施例13-人源化
[0704]
本实施例描述了77a抗体的人源化变体的产生。
[0705]
确定了77a抗体的鼠免疫球蛋白家族亚群,然后对抗原结合序列进行建模,并将其移植到相关人类免疫球蛋白重链和轻链兼容的可能框架中。必要时采用回复突变。产生了五种人源化重链变体(hvh-1至hvh-5,如表5所示)和五种人源化轻链变体(hvl-1至hvl-5,如表5中所示)。hvh-1至hvh-5的序列比对如图20a所示,hvl-1至hvl-5的序列比对如图20b所示。
[0706]
表5人源化可变区序列
[0707]
[0708][0709]
制备包括每个人源化重链和轻链组合的抗体并对其进行表征。这些抗体被称为h77a-1至h77a-25,相应的氨基酸序列如表6所示。
[0710]
表6.人源化77a变体
[0711]
[0712][0713]
使用生物层干涉法(bli)表征人源化变体的结合。还测试了包括鼠77a抗原结合区和人fc区的嵌合抗体。将抗体和试剂稀释到微孔板上并装入仪器中。稀释的抗体首先固定在浸渍-读取传感器上,然后获取基线测量值。随后,将传感器浸入含有溶液中抗原或单独缓冲液的孔中。结合到传感器的分子数量变化通过在方案的每个步骤期间测量光的干涉图案的偏移来定量。基于这些值和测定中使用的试剂浓度进行数学建模,并用于计算动力学值。
[0714]
结果如表7所示。如所示,所有测试的人源化变体的亲和力测量值均在亲代鼠抗体的2-5倍以内。
[0715]
表7.人源化77a抗体结合动力学
[0716][0717]
实施例14
–
人源化77a变体介导的hsp70摄取
[0718]
本实施例描述了fc受体参与人源化77a变体介导的hsp70摄取的评估。
[0719]
用编码一组小鼠fc受体或人fc受体的载体转染293hsp70ko细胞24小时。使用jetprime在10cm培养皿中进行转染,每种载体为2.5μg(小鼠fc受体)或1.42μg(人fc受体)。
[0720]
接下来,在37℃下单独或与抗体(1μg/ml)组合添加hsp70gfp(无bme;5μg/ml)和gfp-纳米体alexa-488(1:1000)1小时。然后用facs分析细胞。
[0721]
测试的抗体为:igg2同种型对照、77a(小鼠)、具有人igg1-fc结构域的嵌合77a、具有人igg2-fc结构域的嵌合77a、具有人igg4结构域的嵌合77a、以及人源化变体h77a-1(包括hvh-1和hvl-1)、h77a-6(包括hvh-2和hvl-1)和h77a-11(包括hvh-3和hvl-1),每一种如
实施例12中所述。人源化抗体h77a-1、h77a-6和h77a-11分别用人igg2-fc结构域进行测试。
[0722]
测试的小鼠fc受体是:fcγr1(origene目录号mr225268),fcγr2b(origene目录号mr204036),fcγr3(origene目录号mr203404),和fcγr4(origene目录号mr203178)。
[0723]
测试的人fc受体是:fcγr1a(origene目录号rc207487),fcγr1b(origene目录号rc219204),fcγr2a(origene目录号rc205786),fcγr2b(origene目录号rc211982),fcγr2c(origene目录号rc213460),fcγr3a(origene目录号sc124061),和fcγr3b(origene目录号rc204749)。
[0724]
结果如图21-24所示。人fcγr的结果总结如表8所示。结果表明,所有三种人源化抗体以及嵌合和亲代小鼠77a抗体都能够通过fcγr2a和fcγr2b受体介导hsp70的摄取。嵌合igg1和igg4抗体还通过fcγr1a受体介导hsp70的摄取。鼠fcγr的结果总结如表9所示。实验证明,所有三种人源化抗体都能够通过鼠fcγr2b受体介导hsp70的摄取。嵌合igg1抗体促进通过fcγr1、fcγr2b和fcγr4受体的摄取,而igg4嵌合物利用fcγr1和fcγr2b受体进行hsp70摄取。亲代鼠抗体通过受体fcγr2b和fcγr4促进摄取。
[0725]
表8用人fcγr的摄取实验总结
[0726]
抗体fcγr1afcγr1bfcγr2afcγr2bfcγr2cfcγr3afcγr3bigg1嵌合 -
‑‑‑
igg2嵌合
‑‑
‑‑‑
igg4嵌合 -
‑‑‑
h77a-1
‑‑
‑‑‑
h77a-6
‑‑
‑‑‑
h77a-11
‑‑
‑‑‑
77a
‑‑
‑‑‑
[0727]
表9.用小鼠fcγr的摄取实验总结
[0728][0729][0730]
实施例15
–
人源化77a变体介导的hsp70树突细胞摄取
[0731]
本实施例描述了由人源化77a变体介导的树突细胞(dc)对hsp70的摄取。
[0732]
使用血液树突细胞分离试剂盒ii(miltenyi biotec)从人血沉棕黄层中分离树突细胞。简言之,使用cd19和cd14微珠的混合物对b细胞和单核细胞进行磁性标记和耗竭。随后,使用针对树突细胞标志物cd304(bdca-4/神经纤毛蛋白-1)、cd141(bdca-3)和cd1c
(bdca-1)的抗体混合物,对非磁性流穿级分中预富集的树突细胞进行磁性标记和富集。收集的级分包括浆细胞样树突细胞、1型髓样树突细胞(mdc1)、2型髓样树突细胞(mdc2)和代表非dc级分的未标记的流穿级分。高纯度富集细胞部分包括:浆细胞样树突细胞、1型髓样树突细胞(mdc1)和2型髓样树突细胞(mdc2)。
[0733]
在4℃下细胞与hsp70gfp(无bme;5μg/ml)孵育1小时,单独加入gfp-纳米体alexa-488(1:1000)或与抗体(1μg/ml)组合。然后用幽灵紫450、cd11c、cd19、cd14、cd80、cd86、cd141、cd1c和cd303对细胞进行染色。
[0734]
测试的抗体为:igg2同种型对照、77a(小鼠)、具有人igg1-fc结构域的嵌合77a、具有人igg2-fc结构域的嵌合77a、具有人igg4结构域的嵌合77a、以及人源化变体h77a-1(包括hvh-1和hvl-1)、h77a-6(包括hvh-2和hvl-1)和h77a-11(包括hvh-3和hvl-1),每一种如实施例12中所述。人源化抗体h77a-1、h77a-6和h77a-11分别用人igg2-fc结构域进行测试。
[0735]
结果如图25-28所示。总之,结果表明77a的人igg2同种型介导hsp70被原代人dc摄取,优先靶向浆细胞和2型外周血dc。观察到1型外周血dc的摄取较少。此外,igg1嵌合物仅诱导摄取到未标记的流穿级分(图25)。
[0736]
实施例16-其它77a变体
[0737]
选择包括hvh-1和hvl-1的组合(如实施例12中所述)的h77a-1用于进一步优化。
[0738]
为了优化这些序列,生成了一个包含hvh-1和hvl-1变体的大型文库。随后,生成了抗体-抗原结合的电子模型,并对整个文库的抗体-抗原的结合进行了计算模拟。前95种抗体被称为h77a-1.1至h77a-1.95,并在表10(kabat cdr序列)和表11(imgt cdr序列)中描述。表12中提供了h77a-1.1至h77a-1.95中包含的cdr变体的氨基酸序列,表13中提供了包括在h77a-1.1至h77a-1.95中的可变区变体的氨基酸序列。还制备并测试了额外的抗体变体h77a-1.96、h77a-1.97、h77a-1.98(也在表10和11中描述)。
[0739]
表10.h77a-1变体(kabat cdr序列)
[0740]
[0741]
[0742][0743]
表11.h77a-1变体(imgt cdr序列)
[0744]
[0745]
[0746][0747]
表12.cdr氨基酸序列
[0748]
[0749]
[0750][0751]
表13.可变区氨基酸序列
[0752]
[0753]
[0754]
[0755]
[0756]
[0757]
[0758]
[0759]
[0760]
[0761]
[0762][0763]
人源化变体hvh-1.1至hvh-1.78的序列比对如图29a-f中所示,hvl-1.1至hvl-1.53如图29g-j所示。
[0764]
合成编码变体氨基酸序列的dna并克隆到哺乳动物瞬时表达质粒中。使用基于cho的瞬时表达系统表达变体,并通过离心和过滤澄清所得含抗体的细胞培养上清液。通过亲和层析从细胞培养上清液中纯化变体。将纯化的抗体缓冲液交换到磷酸缓冲盐水溶液中。通过还原和变性sds-page凝胶判断,所得抗体的纯度大于95%。通过在280nm处测量吸光度来测定抗体浓度。
[0765]
结合试验如下进行。使用抗人fc将抗体变体以0.15μg/ml固定在一系列生物传感器的表面上。将100nm抗原通过表面以产生结合反应。在25℃下在生物传感器上收集抗体:抗原相互作用的结合数据。表14显示了选择抗体变体的结果。在表14中,x=610表示在解离阶段开始时捕获抗原值(nm)(在生物传感器最初与抗原接触后的610秒测量),x=1495表示解离阶段结束时的捕获抗原值(nm)(生物传感器最初接触抗原后的1495秒测量)。x=610值大于0.2且解离率小于10%的抗体以粗体显示。
[0766]
表14.结合分析
[0767]
[0768]
[0769][0770]
对所选抗体变体进行其它动力学测试。如下进行测试。使用抗-人fc将抗体变体固定在一系列生物传感器表面上。抗原通过表面以产生结合反应。在25℃下在生物传感器上收集抗体:抗原相互作用的结合数据。在缔合步骤中使用抗原的稀释系列,以全局拟合结果并获得ka、kd和kd的最佳值。将抗原与表面固定化抗体结合的反应数据拟合为1:1结合模型。表15中总结了动力学参数。
[0771]
表15.结合动力学
[0772]
dendritic cells and t cells.crit rev immunol.2018;38(5):379-401.
[0786]
bruhns,blood,119:5640,2012.
[0787]
casanova v,naval-macabuhay i,massanella m,等人adenosine deaminase enhances the immunogenicity of human dendritic cells from healthy and hiv-infected individuals.plos one.2012;7(12):e51287.
[0788]
chacon ja,sarnaik aa,chen jq,等人manipulating the tumor microenvironment ex vivo for enhanced expansion of tumor-infiltrating lymphocytes for adoptive cell therapy.clin cancer res.2015;21(3):611-621.
[0789]
chatterjee m,andrulis m,stuhmer t,等人the pi3k/akt signaling pathway regulates the expression of hsp70,which critically contributes to hsp90-chaperone function and tumor cell survival in multiple myeloma.haematologica.2013;98(7):1132-1141.
[0790]
chatterjee s,burns tf.targeting heat shock proteins in cancer:a promising therapeutic approach.int j mol sci.2017;18(9).
[0791]
chen n,ritsma lma,vrisekoop n.in vivo characteristics of human and mouse breast tumor cell lines.exp cell res.2019.
[0792]
chen ds,mellman i.oncology meets immunology:the cancer-immunity cycle.immunity.2013;39(1):1-10.
[0793]
craig ea,marszalek j.how do j-proteins get hsp70 to do so many different things trends biochem sci.2017;42(5):355-368.
[0794]
dabaghian m,latify am,tebianian m,等人vaccination with recombinant 4x m2e.hsp70c fusion protein as a universal vaccine candidate enhances both humoral and cell-mediated immune responses and decreases viral shedding against experimental challenge of h9n2 influenza in chickens.vet microbiol.2014;174(1-2):116-126.
[0795]
daugaard m,rohde m,jaattela m.the heat shock protein 70family:highly homologous proteins with overlapping and distinct functions.febs lett.2007;581(19):3702-3710.
[0796]
davidson e,doranz bj.a high-throughput shotgun mutagenesis approach to mapping b-cell antibody epitopes.immunology.2014;143(1):13-20.
[0797]
demaria o,de gassart a,coso s,等人sting activation of tumor endothelial cells initiates spontaneous and therapeutic antitumor immunity.proc natl acad sci u s a.2015;112(50):15408-15413.
[0798]
dodd等人,oncogene,34:1312,2015.
[0799]
duffield js,forbes sj,constandinou cm,等人selective depletion of macrophages reveals distinct,opposing roles during liver injury and repair.j clin invest.2005;115(1):56-65.
[0800]
fu c,jiang a.dendritic cells and cd8 t cell immunity in tumor microenvironment.front immunol.2018;9:3059.
[0801]
fukaya t,murakami r,takagi h,等人conditional ablation of cd205 conventional dendritic cells impacts the regulation of t-cell immunity and homeostasis in vivo.proc natl acad sci u s a.2012;109(28):11288-11293.
[0802]
gornati l,zanoni i,granucci f.dendritic cells in the cross hair for the generation of tailored vaccines.front immunol.2018;9:1484.
[0803]
greene le,zinner r,naficy s,eisenberg e.effect of nucleotide on the binding of peptides to70-kda heat shock protein.j biol chem.1995;270(7):2967-2973.
[0804]
guzhova iv,margulis ba.hsp70-based anti-cancer immunotherapy.hum vaccin immunother.2016;12(10):2529-2535.
[0805]
hofgaard po,jodal hc,bommert k,等人a novel mouse model for multiple myeloma(mopc315.bm)that allows noninvasive spatiotemporal detection of osteolytic disease.plos one.2012;7(12):e51892.
[0806]
hossain mk,wall ka.use of dendritic cell receptors as targets for enhancing anti-cancer immune responses.cancers(basel).2019;11(3).
[0807]
huang ay,gulden ph,woods as,等人the immunodominant major histocompatibility complex class i-restricted antigen of a murine colon tumor derives from an endogenous retroviral gene product.proc natl acad sci u s a.1996;93(18):9730-9735.
[0808]
huarte e,cubillos-ruiz jr,nesbeth yc,等人depletion of dendritic cells delays ovarian cancer progression by boosting antitumor immunity.cancer res.2008;68(18):7684-7691.
[0809]
hunt c,calderwood s.characterization and sequence of a mouse hsp70 gene and its expression in mouse cell lines.gene.1990;87(2):199-204.
[0810]
johnsen g,elsayed s.antigenic and allergenic determinants of ovalbumin
‑‑
iii.mhc ia-binding peptide(oa 323-339)interacts with human and rabbit specific antibodies.mol immunol.1990;27(9):821-827.
[0811]
joly al,wettstein g,mignot g,ghiringhelli f,garrido c.dual role of heat shock proteins as regulators of apoptosis and innate immunity.j innate immun.2010;2(3):238-247.
[0812]
jung s,unutmaz d,wong p,等人in vivo depletion of cd11c dendritic cells abrogates priming of cd8 t cells by exogenous cell-associated antigens.immunity.2002;17(2):211-220.
[0813]
kandasamy g,andreasson c.hsp70-hsp110 chaperones deliver ubiquitin-dependent and-independent substrates to the 26s proteasome for proteolysis in yeast.j cell sci.2018;131(6).
[0814]
karttunen j,sanderson s,shastri n.detection of rare antigen-presenting cells by the lacz t-cell activation assay suggests an expression cloning strategy for t-cell antigens.proc natl acad sci u s a.1992;89(13):
stimulation drives local and abscopal antitumor effects in an anti-pd1-resistant lung tumor model.clin cancer res.2018;24(22):5735-5743.
[0842]
nollen ea,brunsting jf,song j,kampinga hh,morimoto ri.bag1 functions in vivo as a negative regulator of hsp70 chaperone activity.mol cell biol.2000;20(3):1083-1088.
[0843]
park hj,qin h,cha sc,等人induction of tlr4-dependent cd8 t cell immunity by murine betadefensin2 fusion protein vaccines.vaccine.2011;29(18):3476-3482.
[0844]
peng p,menoret a,srivastava pk.purification of immunogenic heat shock protein 70-peptide complexes by adp-affinity chromatography.j immunol methods.1997;204(1):13-21.piva l,tetlak p,claser c,karjalainen k,renia l,ruedl c.cutting edge:clec9a dendritic cells mediate the development of experimental cerebral malaria.j immunol.2012;189(3):1128-1132.
[0845]
ralph p,nakoinz i.antibody-dependent killing of erythrocyte and tumor targets by macrophage-related cell lines:enhancement by ppd and lps.j immunol.1977;119(3):950-954.
[0846]
rampelt h,mayer mp,bukau b.nucleotide exchange factors for hsp70 chaperones.methods mol biol.2018;1709:179-188.
[0847]
raschke wc,baird s,ralph p,nakoinz i.functional macrophage cell lines transformed by abelson leukemia virus.cell.1978;15(1):261-267.
[0848]
rios-doria j,durham n,wetzel l,等人doxil synergizes with cancer immunotherapies to enhance antitumor responses in syngeneic mouse models.neoplasia.2015;17(8):661-670.
[0849]
robertson jd,datta k,biswal ss,kehrer jp.heat-shock protein 70antisense oligomers enhance proteasome inhibitor-induced apoptosis.biochem j.1999;344pt 2(1):477-485.
[0850]
rotzschke o,falk k,stevanovic s,jung g,walden p,rammensee hg.exact prediction of a natural t cell epitope.eur j immunol.1991;21(11):2891-2894.
[0851]
santema w,rutten v,segers r,等人postexposure subunit vaccination against chronic enteric mycobacterial infection in a natural host.infect immun.2013;81(6):1990-1995.
[0852]
sharpless ne,depinho ra.the mighty mouse:genetically engineered mouse models in cancer drug development.nat rev drug discov.2006;5(9):741-754.
[0853]
shen z,reznikoff g,dranoff g,rock kl.cloned dendritic cells can present exogenous antigens on both mhc class i and class ii molecules.j immunol.1997;158(6):2723-2730.
[0854]
shvetsov等人philos.trans.r.soc.lond.b.biol.sci.,373:1738,2018.
[0855]
shevtsov m,multhoff g.heat shock protein-peptide and hsp-based immunotherapies for the treatment of cancer.front immunol.2016;7:171.
peptide binding fragment of heat shock protein 70.j immunol.2002;169(5):2422-2429.
[0871]
wesolowski r,duggan mc,stiff a,等人circulating myeloid-derived suppressor cells increase in patients undergoing neo-adjuvant chemotherapy for breast cancer.cancer immunol immunother.2017;66(11):1437-1447.
[0872]
willert k,brown jd,danenberg e,等人wnt proteins are lipid-modified and can act as stem cell growth factors.nature.2003;423(6938):448-452.
[0873]
wu等人,trends pharmacol.sci.,38:226,2017.
[0874]
wu c.systemic therapy for colon cancer.surg oncol clin n am.2018;27(2):235-242.
[0875]
ying h,kimmelman ac,lyssiotis ca,等人oncogenic kras maintains pancreatic tumors through regulation of anabolic glucose metabolism.cell.2012;149(3):656-670.
[0876]
zaheed m,wilcken n,willson ml,o'connell dl,goodwin a.sequencing of anthracyclines and taxanes in neoadjuvant and adjuvant therapy for early breast cancer.cochrane database syst rev.2019;2:cd012873.
[0877]
zhang xd,baladandayuthapani v,lin h,等人tight junction protein 1modulates proteasome capacity and proteasome inhibitor sensitivity in multiple myeloma via egfr/jak1/stat3 signaling.cancer cell.2016;29(5):639-652.
[0878]
zhang x,lee hc,shirazi f,等人protein targeting chimeric molecules specific for bromodomain and extra-terminal motif family proteins are active against pre-clinical models of multiple myeloma.leukemia.2018.
[0879]
zhuang j,shirazi f,singh rk,等人ubiquitin-activating enzyme inhibition induces an unfolded protein response and overcomes drug resistance in myeloma.blood.2019;133(14):1572-1584.
[0880]
zininga t,ramatsui l,shonhai a.heat shock proteins as immunomodulants.molecules.2018;23(11):e2846.
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。