1.本发明属于生物防治技术领域,具体地说,涉及一种枯草芽孢杆菌、菌剂和生物制剂及其应用。
2.
背景技术:
3.随着农业产业结构调整和种植制度变革,重楼种植业发展迅猛,但随之而来的重楼病害也日益突出,严重影响产业的持续健康发展。重楼病害在田间一旦发生,重楼将面临大面积绝收,造成无法挽回的损失。因此,研发针对重楼病害的有效的防治措施对于我国和世界的重楼安全生产都有着重要意义。
4.现代农业种植体系中,由于过度依赖化肥和化学农药,以及采用单一作物连作的生产模式,长期高量肥施用和不平衡施肥造成土壤污染和其他养分元素的不均衡,部分元素富营养化,土壤酸化加剧,致使土壤理化性质恶化,微生物群落结构失衡,最终导致土壤质量退化,重楼抵抗力下降,从而导致重楼病害的爆发。现有技术中,对于重楼病害的防治方法比较单一,仍然是大面积使用化学药剂,有些化学药剂的使用还可能对环境造成进一步破坏。因此目前并没有可持续有效,并且经济环保的防控重楼病害的方法。因此,亟待开发一种新型的、绿色、经济并且能够持续有效防控重楼病害的产品,实现重楼产业可持续发展的方法。
5.花粉多糖是基于绿色提取工艺、是由许多相同或不同的单糖以α-或β-糖苷键所组成的化合物,普遍存在于自然界植物体中,包括淀粉、纤维素、多聚糖、果胶等。花粉多糖具有抗肿瘤、降血糖、调节免疫、抗氧化、影响消化系统、抗菌、止血、利尿方面等多种功能。
6.虽然现有技术已经报道了采用微生物菌剂对重楼病虫害进行防治,但是,现有的微生物菌剂的防治效果仍然有进一步改进的空间。
7.
技术实现要素:
8.为了克服现有技术中存在的问题,本发明提供了一株枯草芽孢杆菌,其能有效提高对重楼病害的防治效果、调节土壤养分结构、促进植株生长以及增产增收。此外,本发明还提出将花粉多糖与本发明的枯草芽孢杆菌制剂混合施用,利用花粉多糖的抑菌作用、抗氧化等作用,把花粉多糖作为菌剂中的一种成分,既可以提高菌剂对病害的防治效果,提高菌剂的抑菌活性,同时,不仅不会对枯草芽孢杆菌制剂本身产生副作用,还对枯草芽孢杆菌起到一定的保护作用,降低枯草芽孢杆菌的储藏损失率,延长枯草芽孢杆菌菌剂的货架期具有深远的意义,同时,还能有效提高对重楼病害的防治效果、调节土壤养分结构以及增产增收。
9.为了实现上述目的,本发明第一方面提供一株枯草芽孢杆菌(bacillus subtilis),所述枯草芽孢杆菌的保藏编号为cctcc no. m20221207。本发明的枯草芽孢杆
菌(代号:sh-52)具有产srfa、fenb、itua、itud、byma等抗生素合成基因,对多种病原真菌具有极强的抑制作用,可通过使病原真菌菌丝弯曲变细、菌丝量减少、菌丝缩短、断裂出现泡囊结构等抑制菌丝生长,还可降低病原真菌孢子萌发率,从而抑制病原真菌的生长;此外,本发明的枯草芽孢杆菌sh-52具有强解磷、固氮活性,可调节土壤营养结构,转化土壤中植物难以利用的物质,从而促进植物生长,提高植物的抗逆性。
10.本发明第二方面提供一种菌剂,其中含有第一方面所述的枯草芽孢杆菌和任选的辅料。
11.本发明第三方面提供第一方面所述的枯草芽孢杆菌,和/或,第二方面所述的菌剂在生物制剂制备中的应用。
12.本发明第四方面提供一种生物制剂,所述生物制剂包括花粉多糖和任选的枯草芽孢杆菌。利用花粉多糖的强抗氧化等性质,将其与本发明的枯草芽孢杆菌sh-52制成生物制剂,可降低枯草芽孢杆菌sh-52的氧化率,进而降低菌株损失率。此外,花粉多糖中的活性物质可与枯草芽孢杆菌sh-52起到协同增效的效果,对提高菌株活性具有重要作用。
13.在本发明的一个优选实施方式中,所述生物制剂中,枯草芽孢杆菌与花粉多糖的重量比为12:0.5-3;优选为12:1-2。
14.在本发明的一个优选实施方式中,所述生物制剂中,枯草芽孢杆菌也可以是本发明第二方面的枯草芽孢杆菌剂。
15.本发明第五方面提供第一方面所述的枯草芽孢杆菌、第二方面所述的菌剂,或者,第四方面所述的生物制剂在土壤养分改良中的应用。
16.本发明第六方面提供第一方面所述的枯草芽孢杆菌、第二方面所述的菌剂,或者,第四方面所述的生物制剂在促进植物生长中的应用。
17.本发明第七方面提供第一方面所述的枯草芽孢杆菌、第二方面所述的菌剂,或者,第四方面所述的生物制剂在防治植物病害中的应用。
18.在本发明的一个优选实施方式中,所述植物为重楼属植物。
19.在本发明的一个优选实施方式中,所述植物包括但不限于:滇重楼、华重楼、毛重楼等。
20.在本发明的一个优选实施方式中,所述植物病害为重楼病害。
21.在本发明的一个优选实施方式中,所述重楼病害的病原体包括尾孢霉菌(cercospora polyphylla)、拟盘多毛孢(pestalotiopsis oryzae)、灰霉菌(botrytis cinerea)、炭疽菌(colletotrichum brisbanense)中的至少一种。
22.在本发明的一个优选实施方式中,所述重楼病害的防治对象为重楼属植物的病害。
23.在本发明的一个优选实施方式中,所述重楼属植物包括但不限于:滇重楼、华重楼、毛重楼等。
24.本发明第八方面提供一种促进重楼属植物生长和/或防治重楼属植物病害的方法,包括将第一方面所述的枯草芽孢杆菌、第二方面所述的菌剂,或第四方面所述的生物制剂施用于土壤中。
25.通过上述技术方案,本发明至少能够取得如下有益效果:(1)本发明的枯草芽孢杆菌sh-52具有很好的解磷、固氮的能力,同时,该菌株对于
subtilis),命名为sh-52,于2022年8月1日保藏于中国典型培养物保藏中心,保藏编号为cctcc no. m20221207。经研究发现,该菌株具有较好的解磷、解钾、固氮以及抗病的能力,能很好地拮抗病害菌。经过进一步研究,发明人巧妙地发现,将该枯草芽孢杆菌单独或与特定配方的生物制剂一同施用于种植重楼树的土壤中时,能够改善土壤营养环境,提高土壤肥力,促进重楼植株对土壤中营养物质的吸收,有效促进重楼树生长,较为持久地提高重楼树对病害(尤其是真菌造成的病害)等病害的抵抗力,且防治效果较好。
40.基于上述发现,本发明一方面提供一株枯草芽孢杆菌(bacillus subtilis),所述枯草芽孢杆菌的保藏编号为cctcc no. m20221207。
41.本发明第二方面提供一种菌剂,所述菌剂中含有第一方面所述的枯草芽孢杆菌和任选的辅料。
42.本发明中,对于所述菌剂的具体剂型没有特别限制,任意本领域常用的菌剂类型均可适用于本发明。例如可以为固体菌剂、液体菌剂或是半固体(浓缩)菌剂等常见的菌剂类型。
43.优选地,所述菌剂中,枯草芽孢杆菌的含量不低于2-4.5
×
109cfu/g(固体菌剂)或2-4.5
×
10
8 cfu/ml(液体菌剂或浓缩菌剂)。例如可以为2
×
10
9-4.5
×
10
13 cfu/g或2
×
10
9-4.5
×
10
13 cfu/ml。
44.本发明第三方面提供第一方面所述的枯草芽孢杆菌,和/或,第二方面所述的菌剂在生物制剂制备中的应用。
45.本发明的发明人出人意料地发现,将花粉多糖与枯草芽孢杆菌菌剂按照一定比例混合后制成的生物制剂,可有效减少枯草芽孢杆菌的损失率,施用于土壤中,可有效提高土壤有效氮、磷、钾素含量,提升土壤肥力,促进植物根际氮、磷、钾素转化及对氮、磷、钾素的吸收,降低化学肥料的使用量。此外,该生物制剂的施用能够促进重楼植株生长,提高重楼的产量和品质。进一步地,该生物制剂对于重楼病害,尤其是真菌引起的重楼病害具有良好的防治效果。
46.基于上述发现,本发明第四方面提供一种生物制剂,所述生物制剂包括花粉多糖和任选的枯草芽孢杆菌菌剂;优选地,本发明提供的生物制剂配方为:重量比为12:0.5-2的花粉多糖以及枯草芽孢杆菌菌剂。
47.本发明中,对于用作上述生物制剂的原料(如花粉多糖)没有特别限制,其可以是本领域任意能够用于制备生物制剂的相关产品,既可以是商购获得的相关产品,也可以是按照现有技术自行制备的相关产品。
48.根据本发明的优选实施方式,其中,所述花粉多糖中水分含量为2-4重量%。
49.优选地,所述花粉多糖中,以干物质计,糖含量为90-95重量%,其他物质含量为3-6重量%。
50.本发明第五方面提供第一方面所述的枯草芽孢杆菌、第二方面所述的菌剂,或者,第四方面所述的生物制剂在土壤养分改良,和/或,促进植物生长,和/或,防治重楼病害中的应用。
51.根据本发明的优选实施方式,所述植物为重楼属植物。
52.本发明中,土壤养分改良是指提高土壤中有效营养成分含量(即可被植物直接吸
收和利用的营养成分,如n、p、k等)、提高土壤生物学指标(例如提高土壤微生物多样性、提高土壤中的酶活性等)、改善土壤微环境使其更利于植物生长等。
53.本发明中,促进植物生长是指提高作物生长速度(例如一定时间内的株高、径长增长量、叶片生长量等),产量以及提高作物的品质(例如提高农产品的质量等)。
54.本发明中,防治植物病害是指预防或减少植物病害的发生,或在病害发生后减少病害产生的损失等。
55.优选地,所述植物病害选自重楼病害。
56.优选地,造成所述重楼病害的病原体包括尾孢霉菌(cercospora polyphylla)、拟盘多毛孢(pestalotiopsis oryzae)、灰霉菌(botrytis cinerea)、炭疽菌(colletotrichum brisbanense)中的至少一种,优选为尾孢霉菌和/或灰霉菌。
57.本发明第六方面提供一种促进重楼属植物生长和/或防治重楼属植物病害的方法,包括将第一方面所述的枯草芽孢杆菌、第二方面所述的菌剂,或第四方面所述的生物制剂施用于土壤中。
58.也即,上述方法可以包括以下方式:将枯草芽孢杆菌或枯草芽孢杆菌菌剂直接施用于土壤中;本发明中,所述重楼属植物可以为任意本领域中用于重楼生产的重楼植株。
59.优选地,造成所述重楼病害的病原体包括尾孢霉菌(cercospora polyphylla)、拟盘多毛孢(pestalotiopsis oryzae)、灰霉菌(botrytis cinerea)、炭疽菌(colletotrichum brisbanense)中的至少一种,优选为尾孢霉菌和/或灰霉菌。
60.本发明提供的方法中采用的枯草芽孢杆菌、菌剂以及生物制剂的具体特征如前所述,在此不再赘述。
61.本发明中,对于枯草芽孢杆菌、菌剂以及生物制剂的具体用量没有特别限制,只要能够起到促进重楼植株生长的作用即可。
62.根据本发明的一种优选实施方式,所述枯草芽孢杆菌、菌剂或生物制剂的用量使得枯草芽孢杆菌施用于土壤中的用量不低于2-4.5
×
10
11
cfu/株/次,优选可以为2
×
10
11-4
×
10
11
cfu/株/次。例如可以为2
×
10
11
cfu/株/次、3
×
10
11
cfu/株/次、4
×
10
11
cfu/株/次、4.5
×
10
11
cfu/株/次,或者也可以为上述任意两个数值的任意中间值。枯草芽孢杆菌的用量为按照菌剂或生物制剂的施用量以及其中所含枯草芽孢杆菌的数量计算获得,其中液体菌剂按照1g/ml进行换算。
63.根据本发明的一种优选实施方式,所述生物制剂施用于土壤中的用量可以为100 g/株/次。
64.优选地,所述枯草芽孢杆菌、菌剂或生物制剂的施用频率可以为每年施肥3-4次。
65.以下将通过实施例对本发明进行详细描述。应当能够理解的是,以下实施例仅用于进一步解释和说明本发明,而不用于限制本发明。
66.实施例1本发明的枯草芽孢杆菌sh-52的分离、纯化、鉴定以及保藏。
67.(1)菌株分离和纯化发明人在研究过程中,采用稀释涂布平板法从云南省丽江市长期轮作的健康烟草根际土壤分离获得一株编号为sh-52的菌株。
68.(2)菌株鉴定(2.1)参照《伯杰氏系统分类手册》和《常见细菌系统鉴定手册》对菌株sh-52进行菌株形态学及生理生化特征鉴定。
69.结果如下:菌株sh-52为革兰氏阳性细菌,中心呈乳白色,边缘半透明,不产色素,菌落形状不规则,边缘整齐,较规整,菌落表面粘稠,略微凸起;接触酶、蛋白酶、纤维素酶、淀粉水解、硝酸还原反应、吲哚反应、柠檬酸反应、精氨酸双水解、蔗糖发酵反应、葡萄糖发酵反应、解磷、固氮作用及明胶反应等均为阳性,分泌果胶酶、解钾及mr反应和尿素酶反应为阴性。
70.(2.2)采用以下方法对菌株sh-52进行分子生物学鉴定:将菌株sh-52接种至纯化液体培养基中,37 ℃恒温摇床中180 r/min 振荡培养过夜,无菌条件下取样于紫外分光光度计下读取培养菌液od
600
值,当od
600
值近似于1(约1
×
10
9 cfu/ml)时停止培养。采用takara minibest bacteria genomic dna extraction kit ver.3.0试剂盒提取菌株基因组dna。采用细菌16s rdna通用引物27f(5
’‑
agagtttgatcctggctcag-3’)和1492r(5
’‑
tacggy taccttgttacgactt-3’)进行pcr扩增。pcr 反应程序:94 ℃预变性5 min;94 ℃变性60 s;53℃退火60 s;72 ℃延伸2 min;35个循环;最后72 ℃延伸7 min,4℃保存。反应结束后,取5 μl反应产物,经1%琼脂糖凝胶电泳,在凝胶成像系统中观察。扩增产物经琼脂糖凝胶电泳纯化回收后,送至北京擎科生物科技有限公司测序。测序结果经blast 搜索(https://blast.ncbi.nlm.nih.gov/blast.cgi)后与genbank数据库中相关种属的基因序列进行比较分析,选用同源性较高的模式菌株序列作为参比对象,用clustal x 1.8软件进行多序列比对,计算供试菌株与参比菌株序列的相似性。系统发育分析时排除碱基缺失位点,采用邻接法(neighbor-joining analysis)用mega 7.0构建供试菌株与参比菌株之间的系统发育树。其中,bootstrap值设定为1 000,其余均为默认值。
71.分子生物学鉴定鉴定结果如下:经ncbi blast分析,菌株sh-52的16s rdna序列与枯草芽胞杆菌abql01000001相似度为99.71%,图1示出利用邻接法(neighbour-joining)构建的系统发育树。
72.结合形态学生理生化特征及分子生物学鉴定结果,菌株sh-52为枯草芽孢杆菌(bacillus subtilis)。
73.(3)菌株特征研究溶磷效果检测:将纯化的菌株sh-52接种至溶无机磷细菌选择培养基(葡萄糖10.0 g/l,硫酸铵0.5 g/l,酵母浸粉0.5 g/l,氯化钠0.3 g/l,氯化钾0.3 g/l,硫酸镁0.3 g/l,硫酸亚铁0.03 g/l,硫酸锰0.03 g/l,磷酸钙5.00 g/l,ph 7-7.5)上,置于30℃培养箱中培养72h,观察记录溶磷圈产生情况。
74.采用上述溶磷检测方法,将其中的菌株替换为等量的枯草芽孢杆菌(bacillus subtilis,购自中国工业微生物菌种保藏管理中心,菌种号为cicc 24713)。
75.结果详见图2。能够看出菌株sh-52具有较好的溶磷能力,溶磷圈平均直径为18.39 mm;而枯草芽孢杆菌cicc 24713的溶磷圈平均直径为10.22mm。
76.固氮活性检测:将纯化的菌株sh-52接种至固氮菌选择培养基(kh
2 po
4 0.2 g/l、mgso
4 0.2 g/l、nacl 0.2 g/l、caco
3 5.0 g/l、甘露醇10.0 g/l、caso
4 0.1 g/l、琼脂18.0 g/l、ph6.8-7),置于30℃培养箱中培养72h,观察记录透明圈产生情况。
77.采用上述固氮活性检测方法,将其中的菌株替换为等量的枯草芽孢杆菌(bacillus subtilis,购自中国工业微生物菌种保藏管理中心,菌种号为cicc 24713)。
78.结果详见图3。能够看出菌株sh-52可在固氮菌选择培养基上产生透明圈,且透明圈直径较大,说明菌株sh-52具有较好的固氮活性;而枯草芽孢杆菌cicc 24713固氮活性较低。
79.拮抗病原物检测:平板对峙法实验:在pda培养基中心接种3 mm的病原菌菌饼,并按照十字形在其距离其25 mm处接种拮抗菌株,未接种的平板作为对照,每菌株3个重复,置于25-28℃的恒温培养箱黑暗条件培养5-7 d,计算抑菌率,选用活性强的菌株作为待测菌株。
80.将尾孢霉菌(cercospora polyphylla)、拟盘多毛孢(pestalotiopsis oryzae)、灰霉菌(botrytis cinerea)、炭疽菌(colletotrichum brisbanense)作为指示病原物,培养结束后计算平均值及抑制率。
81.抑制率(%)=(对照组菌落直径-处理组菌落直径)/(对照组菌落直径-0.3 cm)
×
100。
82.采用上述拮抗活性检测方法,将其中的菌株替换为等量的枯草芽孢杆菌(bacillus subtilis,购自中国工业微生物菌种保藏管理中心,菌种号为cicc 24713)。
83.进行平板对峙实验结果如图4。结果表明菌株sh-52对尾孢霉菌(cercospora polyphylla)、拟盘多毛孢(pestalotiopsis oryzae)、灰霉菌(botrytis cinerea)、炭疽菌(colletotrichum brisbanense)均具有拮抗作用,抑制率分别为92.2%、91.5%、88.9%、90.1%;而枯草芽孢杆菌cicc 24713仅对其抑制率仅为82.1%、79.2%、73.6%、75.5%、78.5%。
84.脂肽类抗生素合成基因检测检测:取斜面保藏的纯化菌株,平板划线法接种于na培养基上,37℃黑暗条件下培养24 h,挑取单菌落分别接种于nb培养基中,37℃ 180 r/min震荡培养24 h,培养结束后取1.5 ml菌液,10000 r/min离心处理5 min,去除上清液,用200 μl dd h2o重悬,95℃沸水处理10 min,冰浴处理5 min,10000 r/min离心处理5 min,取上清液为菌株dna模板。将材料中的10对引物分别对菌株进行pcr扩增。扩增体系为20 μl,具体的:10
×
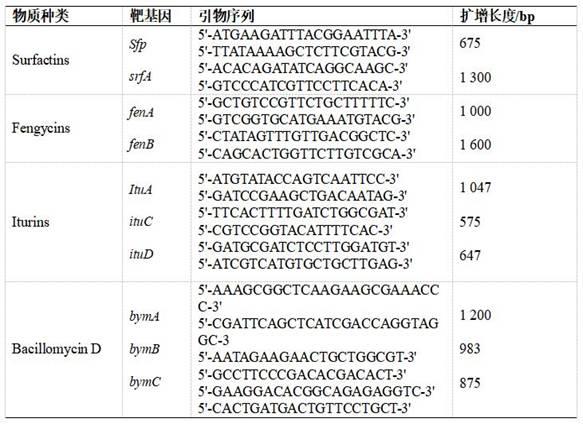
buffer 2.0 μl、dntps 1.6 μl、dna模板1.0 μl、taq dna聚合酶0.2 μl、前引物1.0 μl、后引物1.0 μl、dd h2o补满体系。扩增条件:98℃ 2 min,98℃ 10 s,52℃ 15 s(ituc)或54℃ 15 s(fend、bymc)或58℃ 15 s(srfa、b),72℃ 10 s,35个循环,72℃ 5 min,4℃条件下保存备用。使用1.0%琼脂糖凝胶电泳检测扩增产物,在凝胶成像系统中观察检测结果。本研究中用于相关抗生素合成基因pcr检测的10对特异性引物均由北京擎科生物科技有限公司合成,详见表1。
85.表 1:用于功能基因检测引物
pcr结果如图5所示。结果表明:枯草芽孢杆菌sh-52具有产srfa、fenb、itua、itud、byma等抗生素合成基因。
86.(4)菌株保藏发明人于2022年8月1日将采用上述方法分离获得的枯草芽孢杆菌sh-52保藏于中国典型培养物保藏中心,保藏编号为cctcc m 20221207。
87.实施例2本发明的枯草芽孢杆菌菌剂及干粉制剂的制备。
88.包括如下步骤:(1)将上述的枯草芽孢杆菌在固体培养基中进行固体培养获得试管种;(2)制备液体种子培养基,并接种试管种进行液体培养制得液体种子;(3)配制液体发酵培养基,并接种液体种子进行发酵。
89.步骤(1)中,枯草芽孢杆菌采用斜面接种的方式进行接种,所述固体培养在温度为25-30℃培养40-50h;所述固体培养基包括:葡萄糖10-12g/l,琼脂15-20g/l,牛肉浸膏3-5g/l,酵母浸膏1-3g/l,蛋白胨10-15g/l,ph=6.5-7.5。
90.步骤(2)中,试管种接种到液体种子培养基中,所述液体培养在温度为25-30℃、转速为200-250r/min的条件下处理45-50h;所述液体种子培养基包括:蛋白胨10-15g/l,牛肉浸膏3-5g/l,氯化钠10-12g/l,ph=6.5-7.5。
91.该步骤中,液体种子培养基优选在120-125℃下灭菌20-30min,冷却后在100ml液体种子培养基中接入0.5-1.5cm2的试管种,并在28-30℃下在转速为220-250r/min的摇床上培养45-50h得液体种子。
92.步骤(3)中,液体种子在液体发酵培养基中按照体积比为0.05-0.1:1的接种量接种,并在温度为25-30℃、转速为200-250r/min的条件下处理45-50h;所述液体发酵培养基
包括:蔗糖20-23g/l,蛋白胨10-15g/l,酵母浸膏5-8g/l,磷酸二氢钾3-5g/l,硫酸铵5-8g/l,碳酸钙2-4g/l,ph=6.5-7.5。
93.该步骤中,液体发酵培养基优选在120-125℃灭菌20-30min,冷却后接种液体种子,并优选在28-30℃下于转速为220-250r/min的摇床上培养45-50h制得发酵液。
94.(4)培养结束后采用适量新鲜nb培养基将获得的培养液进行稀释,获得活菌数约为2-3
×
108cfu/ml的枯草芽孢杆菌液体菌剂。将液体菌剂干燥处理获得干粉菌剂,活菌数约为2-3
×
108cfu/g。
95.实施例3取枯草芽孢杆菌sh-52干粉剂(含量2
×
108cfu/g)12重量份与1重量份花粉多糖粉末(购自陕西森元生物科技有限公司)混合均匀,至于真空密封袋中常温保存。
96.3个月后检测其中枯草芽孢杆菌sh-52的数量,为1.7
×
108cfu/g,死亡率为7.9%。单独的枯草芽孢杆菌sh-52干粉剂储存3个月后的死亡率为16%。由此说明花粉多糖对于枯草芽孢杆菌的活性没有显著的影响,并且还具有一定的保护作用。
97.实施例4取枯草芽孢杆菌sh-52干粉剂(含量2
×
108cfu/g)12重量份与2重量份花粉多糖粉末混合均匀,至于真空密封袋中常温保存。
98.3个月后检测其中枯草芽孢杆菌的数量,为1.59
×
108cfu/g,死亡率为7.5%,由此说明花粉多糖的量对于枯草芽孢杆菌的保护作用有实质性的影响。
99.实施例5取枯草芽孢杆菌sh-52干粉剂(含量2
×
108cfu/g)12重量份与3重量份花粉多糖粉末混合均匀,至于真空密封袋中常温保存。
100.3个月后检测其中枯草芽孢杆菌的数量,为1.33
×
108cfu/g,死亡率为16.3%,由此说明过量的花粉多糖对于枯草芽孢杆菌的活性有一定的影响,保护作用不明显。
101.实施例6本发明的枯草芽孢杆菌、菌剂和生物制剂在防治重楼病害田间防效、土壤养分含量调节以及促生长的应用。
102.实验设计:选取一批初始高度基本一致,除施药设置不同水平外,其他田间管理同常规生产的重楼植株。在春季萌芽期开始试验,试验设5个处理,3次重复,共15个小区。随机排列,四周高保护行。并按照实验组ⅰ、实验组ⅱ、实验组ⅲ、实验组ⅳ及测试方法进行重楼病害防治效果(表2)、重楼植株根际土壤养分含量(表3)以及重楼幼苗生长情况(表4)调查。
103.病害调查方法:0级:无症状1级:病斑面积占整个叶面积5%以下。
104.3级:病斑面积占整个叶面积6-10%。
105.5级:病斑面积占整个叶面积11-20%。
106.7级:病斑面积占整个叶面积21-50%。
107.9级:病斑面积占整个叶面积50%以上。
108.计算发病率和病情指数。
109.发病率=发病株数/调查总株数*100病情指数=(∑(各级病株*该病级数)/调查总株数*最高级数)*100土壤养分含量测定方法:全氮、碱解氮:凯氏定氮法。
110.全磷、有效磷:hcio
4-h2so4。
111.全钾、速效钾:火焰光度计法。
112.有机质含量:烧失量法。
113.ph:点位法。
114.重楼皂苷含量测定方法:高效液相色谱法。
115.实验组i:将枯草芽孢杆菌培养液(2-3
×
108cfu/ml),100 ml/株/次,浇淋至重楼植株根际(每个试验组10株),使得所述枯草芽孢杆菌菌剂的用量不低于1
×
108cfu/株/次;间隔70-90天浇1次,于重楼采收期进行重楼病害防治效果(表2)、重楼植株根际土壤养分含量(表3)调查。(具体检测指标和检测方法与测试例1中相同,下同)。
116.实验组ii:将实施例2中的枯草芽孢杆菌干粉制剂(活菌数约为2
×
108cfu/g),100 g/株/次,施用于重楼植株根际土壤中(每个试验组10株),使得所述枯草芽孢杆菌菌剂的用量不低于1
×
108cfu/株/次;间隔70-90天浇1次,于重楼采收期进行重楼病害防治效果(表2)、重楼植株根际土壤养分含量(表3)调查。
117.实验组iii:将实施例2中的枯草芽孢杆菌干粉制剂(活菌数约为2
×
108cfu/g)15重量份与1重量份花粉多糖粉末混合均匀即得枯草芽孢杆菌生物制剂,100 g/株/次,施至重楼植株根际(每个试验组10株),使得所述枯草芽孢杆菌菌剂的用量不低于1
×
108cfu/株/次;间隔70-90天施1次,于重楼采收期进行重楼病害防治效果(表2)、重楼植株根际土壤养分含量(表3)调查。
118.实验组ⅳ:采用实施例2中菌剂的制备方法,将其中的枯草芽孢杆菌替换为等量的枯草芽孢杆菌(bacillus subtilis,购自中国工业微生物菌种保藏管理中心,菌种号为cicc 10732,获得菌株培养液。
119.实验组
ⅴ
:采用实施例2中的干粉制剂的制备方法,制得枯草芽孢杆菌(菌种号为cicc 10732)生物制剂,100 g/株/次,使得所述枯草芽孢杆菌(菌种号为cicc 10732)菌剂的用量不低于1
×
108cfu/株/次;频率为50-60天/次,于重楼采收期调查中药材软腐病防治效果(表2)、重楼植株根际土壤养分含量(表3)。
120.实验组ⅵ:将实验组ⅰ、实验组ⅱ、实验组ⅲ、实验组ⅳ、实验组
ⅴ
的供试药剂分别施至重楼植株根际(每个试验组10株),于施用后采收期调查检测重楼皂苷物质的含量,如表4所示。
121.对照组:既不施用枯草芽孢杆菌菌剂,也不施用枯草芽孢杆菌生物制剂。
122.表2:枯草芽孢杆菌制剂对重楼病害田间防治效果
表3:枯草芽孢杆菌制剂对重楼根际土壤养分含量的影响表4:枯草芽孢杆菌制剂对重楼中皂苷含量的影响
由表2的数据可知,实验组的枯草芽孢杆菌、菌剂和生物制剂对重楼病害的防治效果明显优于空白对照组和阳性对照组以及实验组ⅳ、实验组
ⅴ
,其中以实施例实验组ⅲ的制剂效果最佳。
123.由表3的数据可知,实验组的枯草芽孢杆菌制剂对重楼根际土壤养分的调节明显优于空白对照组和阳性对照组以及实验组ⅳ、实验组
ⅴ
,其中以实验组ⅲ的制剂效果最佳。
124.由表4的数据可知,实验组的枯草芽孢杆菌制剂对重楼的促生效果明显优于空白对照组和阳性对照组以及实验组ⅳ、实验组
ⅴ
,其中以实验组ⅲ的制剂效果最佳。
125.本发明提出将花粉多糖与枯草芽孢杆菌制剂混合施用,利用花粉多糖的抑菌作用、抗氧化等作用,把花粉多糖作为菌剂中的一种成分,既可以提高菌剂对病害的防治效果,提高菌剂的抑菌活性,同时,不仅不会对枯草芽孢杆菌制剂本身产生副作用,还对枯草芽孢杆菌起到一定的保护作用,降低枯草芽孢杆菌的储藏损失率,延长枯草芽孢杆菌菌剂的货架期具有深远的意义,同时,还能有效提高对重楼病害的防治效果、调节土壤养分结构以及增产增收。
126.最后需说明的是,以上优选实施例仅用以说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。