1.本发明涉及化学合成技术领域,具体为一种连续流法制备安非他酮中间体的方法。
背景技术:
2.手性α-羟基酮(酰基酮)是重要的构筑体,由于其既有羰基又有羟基,因而可以很容易的转化为各种官能团,手性α-羟基酮可以用于合成具有生物活性的化合物。
3.其中,手性α-羟基酮中的s-1-(3-氯苯基)-2-羟基-1-丙酮是合成抗抑郁药物安非他酮的中间体,而s-1-(3-氯苯基)-2-羟基-1-丙酮通常是在脂肪酶的催化下通过釜式反应制备得到,由于釜式反应法的制备过程中搅拌会使得脂肪酶的固定化骨架磨损,形成难以去除的粉状颗粒,导致脂肪酶的回收率低、寿命短。
技术实现要素:
4.基于此,有必要提供一种连续流法制备安非他酮中间体的方法,旨在解决现有技术中存在的催化酶的回收率低、寿命短的技术问题。
5.为实现上述目的,本发明提供一种技术方案:
6.一种连续流法制备安非他酮中间体的方法,包括步骤:
7.将1-(3-氯苯基)-2-羟基-1-丙酮溶于第一溶剂,得到第一混合物;
8.将丁酸乙烯酯溶于第二溶剂,得到第二混合物;
9.用注射泵将所述第一混合物和所述第二混合物泵入填充有酶催化剂的填充床反应器内反应,反应结束得到所述安非他酮中间体;
10.所述1-(3-氯苯基)-2-羟基-1-丙酮与所述丁酸乙烯酯的反应式如下:
[0011][0012]
其中,为所述安非他酮中间体。
[0013]
优选地,所述第一溶剂包括正己烷,所述第二溶剂包括正己烷。
[0014]
优选地,所述酶催化剂包括novozyme 435。
[0015]
优选地,填充床反应器的反应体积为1~2ml。
[0016]
优选地,第一混合物和所述第二混合物反应的反应时间为15~30min。
[0017]
优选地,所述1-(3-氯苯基)-2-羟基-1-丙酮与所述丁酸乙烯酯的摩尔比为1:(1.2~2)。
[0018]
优选地,所述1-(3-氯苯基)-2-羟基-1-丙酮的制备步骤包括:
[0019]
将2-溴-3'-氯苯丙酮和甲酸钠置于第一反应器内反应,反应结束得到所述1-(3-氯苯基)-2-羟基-1-丙酮;
[0020]
所述2-溴-3'-氯苯丙酮和所述甲酸钠的反应式如下:
[0021][0022]
优选地,将2-溴-3'-氯苯丙酮和甲酸钠置于第一反应器内反应的具体步骤包括:
[0023]
将所述2-溴-3'-氯苯丙酮置于所述第一反应器内,并加入甲醇溶解,待溶解完全,向所述第一反应器中加入所述甲酸钠,加热回流反应,反应结束得到所述1-(3-氯苯基)-2-羟基-1-丙酮。
[0024]
优选地,所述2-溴-3'-氯苯丙酮的制备步骤包括:
[0025]
将3-氯苯丙酮与液溴置于第二反应器内反应,反应结束得到所述2-溴-3'-氯苯丙酮;
[0026]
所述3-氯苯丙酮与液溴的反应式如下:
[0027][0028]
优选地,将3-氯苯丙酮与液溴置于第二反应器内反应的具体步骤包括:
[0029]
将所述3-氯苯丙酮置于所述第二反应器内,并加入二氯甲烷溶解,待溶解完全,通过恒压滴液漏斗将所述液溴加入所述第二反应器内,搅拌反应,反应结束得到所述2-溴-3'-氯苯丙酮。
[0030]
本发明的有益效果:
[0031]
本发明将反应物置于填充床反应器内,使用连续流法制备安非他酮的中间体(s-1-(3-氯苯基)-2-羟基-1-丙酮),与传统的釜式反应法相比,本发明将酶催化剂填充于填充床反应器内,使得酶催化剂能反复使用,避免了传统的釜式反应搅拌回收带来的损失,延长了酶催化剂的使用寿命。
附图说明
[0032]
图1为2-溴-3'-氯苯丙酮的核磁共振氢谱图;
[0033]
图2为2-溴-3'-氯苯丙酮的核磁共振碳谱图;
[0034]
图3为1-(3-氯苯基)-2-羟基-1-丙酮的核磁共振氢谱图;
[0035]
图4为1-(3-氯苯基)-2-羟基-1-丙酮的核磁共振碳谱图;
[0036]
图5为s-1-(3-氯苯基)-2-羟基-1-丙酮的高效液相色谱谱图;
[0037]
图6为停留时间为15min时,s-1-(3-氯苯基)-2-羟基-1-丙酮的高效液相色谱谱图;
[0038]
图7为溶剂为乙腈时,s-1-(3-氯苯基)-2-羟基-1-丙酮的高效液相色谱谱图;
[0039]
图8为溶剂为四氢呋喃时,s-1-(3-氯苯基)-2-羟基-1-丙酮的高效液相色谱谱图;
[0040]
图9为溶剂为二氯甲烷时,s-1-(3-氯苯基)-2-羟基-1-丙酮的高效液相色谱谱图;
[0041]
图10为釜式法中,酶催化剂(novozym 435)五次使用后,s-1-(3-氯苯基)-2-羟基-1-丙酮的高效液相色谱谱图;
[0042]
图11为稳定性试验结果图。
具体实施方式
[0043]
为了更好的说明本发明的目的、技术方案和优点,下面将结合具体实施例对本发明作进一步说明。
[0044]
实施例中,所使用的试验方法如无特殊说明,均为常规方法,所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0045]
一种连续流法制备安非他酮中间体的方法,包括步骤:
[0046]
将1-(3-氯苯基)-2-羟基-1-丙酮溶于第一溶剂,得到第一混合物;
[0047]
将丁酸乙烯酯溶于第二溶剂,得到第二混合物;
[0048]
用注射泵将第一混合物和第二混合物泵入填充有酶催化剂的填充床反应器内反应,反应结束得到安非他酮中间体;
[0049]
1-(3-氯苯基)-2-羟基-1-丙酮与丁酸乙烯酯的反应式如下:
[0050][0051]
其中,为安非他酮中间体。
[0052]
具体地,本发明将反应物置于填充床反应器内,使用连续流法制备安非他酮的中间体(s-1-(3-氯苯基)-2-羟基-1-丙酮),与传统的釜式反应法相比,本发明将酶催化剂填充于填充床反应器内,使得酶催化剂能反复使用,避免了传统的釜式反应搅拌回收带来的损失,延长了酶催化剂的使用寿命。
[0053]
此外,填充床反应器具有操作简单、连续生产、维护成本低的优点。
[0054]
在一实施例中,第一溶剂包括正己烷,第二溶剂包括正己烷。
[0055]
在一实施例中,酶催化剂包括novozyme 435。
[0056]
在一实施例中,填充床反应器的反应体积为1~2ml。
[0057]
在一实施例中,第一混合物和第二混合物反应的反应时间为15~30min,作为优选地,第一混合物和第二混合物反应的反应时间为15~30minmin。
[0058]
具体地,第一混合物和所述第二混合物分开两路泵入填充床反应器内,泵入的流速为0.02~0.06ml/min。
[0059]
在一实施例中,1-(3-氯苯基)-2-羟基-1-丙酮与丁酸乙烯酯的摩尔比为1:(1.2~2)。
[0060]
在一实施例中,1-(3-氯苯基)-2-羟基-1-丙酮的制备步骤包括:
[0061]
将2-溴-3'-氯苯丙酮和甲酸钠置于第一反应器内反应,反应结束得到1-(3-氯苯基)-2-羟基-1-丙酮;
[0062]
2-溴-3'-氯苯丙酮和甲酸钠的反应式如下:
[0063][0064]
在一实施例中,将2-溴-3'-氯苯丙酮和甲酸钠置于第一反应器内反应的具体步骤包括:
[0065]
将2-溴-3'-氯苯丙酮置于第一反应器内,并加入甲醇溶解,待溶解完全,向第一反应器中加入甲酸钠,加热回流反应,反应结束得到1-(3-氯苯基)-2-羟基-1-丙酮。
[0066]
在一实施例中,2-溴-3'-氯苯丙酮的制备步骤包括:
[0067]
将3-氯苯丙酮与液溴置于第二反应器内反应,反应结束得到2-溴-3'-氯苯丙酮;
[0068]
3-氯苯丙酮与液溴的反应式如下:
[0069][0070]
在一实施例中,将3-氯苯丙酮与液溴置于第二反应器内反应的具体步骤包括:
[0071]
将3-氯苯丙酮置于第二反应器内,并加入二氯甲烷溶解,待溶解完全,通过恒压滴液漏斗将液溴加入第二反应器内,搅拌反应,反应结束得到2-溴-3'-氯苯丙酮。
[0072]
实施例1
[0073]
(1)制备2-溴-3'-氯苯丙酮
[0074]
称取2.5g 3-氯苯丙酮(14.82mmol)于250ml的双口瓶中,并加入60ml二氯甲烷(dcm)溶解,待溶解完全后,然后通过恒压滴液漏斗将液2.61g溴(16.31mmol)缓慢滴加到双口瓶中,在室温下搅拌1h反应,待反应反应完成后,加入20ml饱和nahco3溶液猝灭反应,并用二氯甲烷萃取,有机相用水和饱和食盐水洗涤,洗涤完用无水硫酸钠干燥,再经浓缩,得到产物2-溴-3'-氯苯丙酮(产率:99%)。
[0075]
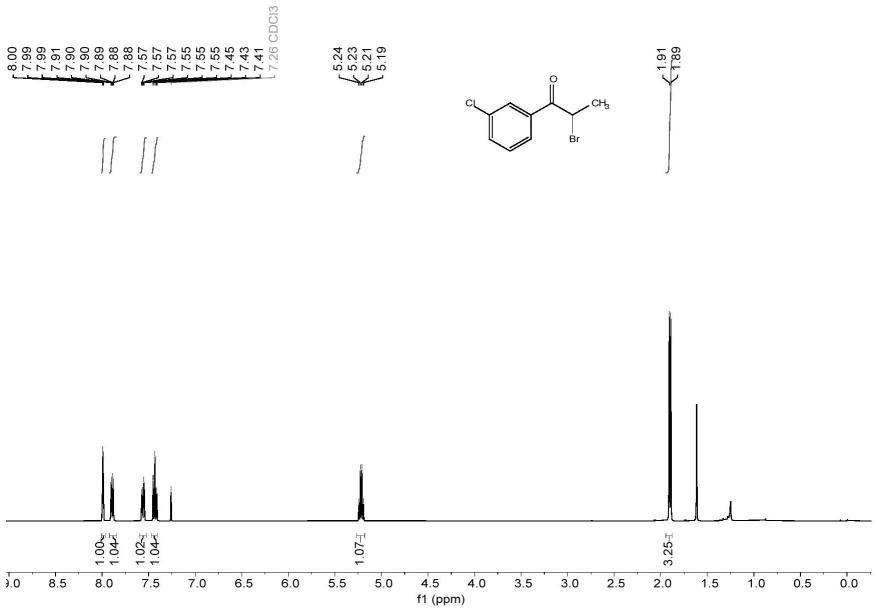
2-溴-3'-氯苯丙酮的核磁共振氢谱图如图1所示,2-溴-3'-氯苯丙酮的核磁共振碳谱图如图2所示,核磁共振氢谱数据如下:
[0076]1h nmr(400mhz,chloroform-d)δ7.99(t,j=1.8hz,1h),7.89(d,j=7.9hz,1h),7.56(d,j=7.9hz,1h),7.43(t,j=7.9hz,1h),5.22(q,j=6.6hz,1h),1.90(d,j=6.6hz,3h).
[0077]
核磁共振碳谱数据如下:
[0078]
13
c nmr(101mhz,chloroform-d)δ192.00,135.53,135.01,133.50,129.94,128.90,126.87,41.16,19.87.
[0079]
(2)制备1-(3-氯苯基)-2-羟基-1-丙酮
[0080]
称取2.03g 2-溴-3'-氯苯丙酮(8.20mmol)于50ml反应瓶中,并加入10ml甲醇溶解,待溶解完全,向反应瓶中加入2.2g甲酸钠(32.4mmol),加热回流反应12h,待反应结束后,使用真空浓缩法除去甲醇溶剂,再用乙酸乙酯萃取,萃取出的有机相用水和饱和食盐水交替洗涤,洗涤后再用无水硫酸钠干燥过滤浓缩得到粗产物。粗产物通过硅胶柱(石油醚/乙酸乙酯=10:1)分离提纯得到产物1-(3-氯苯基)-2-羟基-1-丙酮(产率:80%)。
[0081]
1-(3-氯苯基)-2-羟基-1-丙酮的核磁共振氢谱图如图3所示,1-(3-氯苯基)-2-羟基-1-丙酮的核磁共振碳谱图如图4所示,核磁共振氢谱数据如下:
[0082]1h nmr(400mhz,chloroform-d)δ7.89(s,1h),7.77(d,j=7.8hz,1h),7.62
–
7.53(m,1h),7.43(t,j=7.9hz,1h),5.17
–
5.05(m,1h),3.64(s,1h),1.44(d,j=8.0hz,3h).
[0083]
核磁共振碳谱数据如下:
[0084]
13
c nmr(101mhz,chloroform-d)δ201.34,135.32,135.00,133.94,130.26,128.72,126.73,69.55,22.14.
[0085]
(3)制备安非他酮中间体(s-1-(3-氯苯基)-2-羟基-1-丙酮)
[0086]
将147.7mg 1-(3-氯苯基)-2-羟基-1-丙酮(0.8mmol)用3ml正己烷溶解,作为一股进料流路;182.60mg丁酸乙烯酯(1.6mmol)用3ml正己烷溶解,作为另外一股进料流路。两股流路用注射泵以0.05ml/min的流速泵入装填好100mg酶催化剂(novozym 435)和玻璃珠的填充床中(即填充床反应器)填充床反应器中的反应体积为1.2ml,停留时间为20min,流出液经过萃取干燥、真空浓缩,再通过硅胶柱(石油醚/乙酸乙酯=10:1)分离提纯得到产物s-1-(3-氯苯基)-2-羟基-1-丙酮(产率:42%,ee=99%)。
[0087]
ee值通过高效液相色谱测得,测量方法:
[0088]
手性柱:chiralcel ad-h;
[0089]
流动相:异丙醇/己烷=9:1;
[0090]
流速:1.0ml/min;
[0091]
波长:215nm;
[0092]
出峰位置:tr1=7.743min,tr2=8.343min。
[0093]
停留时间为20min,产物s-1-(3-氯苯基)-2-羟基-1-丙酮的高效液相色谱谱图如图5所示。
[0094]
为考察反应中溶剂、停留时间对反应的影响,优化反应条件,现设置实施例2~6。
[0095]
实施例2
[0096]
其他操作与实施例1相同,将停留时间改为15min。产物产率:36%,ee值:78%。
[0097]
停留时间为15min时,s-1-(3-氯苯基)-2-羟基-1-丙酮的高效液相色谱谱图如图6所示。
[0098]
出峰位置:tr1=7.623min,tr2=8.253min。
[0099]
实施例3
[0100]
其他操作与实施例1相同,将停留时间改为30min。产物产率:42%,ee值:99%。
[0101]
实施例4
[0102]
其他操作与实施例1相同,将溶剂改为乙腈。产物产率:21%,ee值:19%。
[0103]
溶剂为乙腈时,s-1-(3-氯苯基)-2-羟基-1-丙酮的高效液相色谱谱图如图7所示。
[0104]
出峰位置:tr1=7.623min,tr2=8.253min。
[0105]
实施例5
[0106]
其他操作与实施例1相同,将溶剂改为四氢呋喃。产物产率:26%,ee值:24%。
[0107]
溶剂为四氢呋喃时,s-1-(3-氯苯基)-2-羟基-1-丙酮的高效液相色谱谱图如图8所示。
[0108]
出峰位置:tr1=7.773min,tr2=8.437min。
[0109]
实施例6
[0110]
其他操作与实施例1相同,将溶剂改为二氯甲烷。产物产率:28%,ee值:38%。
[0111]
溶剂为二氯甲烷时,s-1-(3-氯苯基)-2-羟基-1-丙酮的高效液相色谱谱图如图9所示。
[0112]
出峰位置:tr1=7.623min,tr2=8.247min。
[0113]
对比例1
[0114]
其他操作与实施例1相同,将步骤(3)制备s-1-(3-氯苯基)-2-羟基-1-丙酮改为传统釜式法制备:
[0115]
称取147.7mg1-(3-氯苯基)-2-羟基-1-丙酮(0.8mmol)、182.60mg丁酸乙烯酯(1.6mmol)和20mg酶催化剂(novozym 435)于反应管中,加入2ml正己烷溶解,在室温下搅拌反应7h(转速为200rpm)。反应结束后,过滤洗涤回收酶催化剂,滤液真空浓缩,通过硅胶柱(石油醚/乙酸乙酯=10:1)分离提纯得到产物s-1-(3-氯苯基)-2-羟基-1-丙酮(产物产率:42%,ee:99%)。
[0116]
对比例2
[0117]
过滤洗涤回收对比例1中的酶催化剂,并将酶催化剂按照对比例1中的反应步骤继续使用第二次,产物产率:42%,ee:99%。
[0118]
对比例3
[0119]
过滤洗涤回收对比例2中的酶催化剂,并将酶催化剂按照对比例1中的反应步骤继续使用第三次,产物产率:42%,ee:99%。
[0120]
对比例4
[0121]
过滤洗涤回收对比例3中的酶催化剂,并将酶催化剂按照对比例1中的反应步骤继续使用第四次,产物产率:41%,ee:98%。
[0122]
对比例5
[0123]
过滤洗涤回收对比例4中的酶催化剂,并将酶催化剂按照对比例1中的反应步骤继续使用第五次,产物产率:34%,ee:75%。
[0124]
酶催化剂(novozym 435)五次使用后,s-1-(3-氯苯基)-2-羟基-1-丙酮的高效液相色谱谱图如图10所示。
[0125]
出峰位置:tr1=7.753min,tr2=8.347min。
[0126]
由对比例1~5的数据可知,传统的釜式法制备安非他酮中间(s-1-(3-氯苯基)-2-羟基-1-丙酮),在酶催化剂(novozym 435)使用五次后,产物产率明显下降,反应ee也明显下降,说明传统的釜式法中酶催化剂在回收使用五次之后的效果明显下降。
[0127]
在完成实施例2~6中的实验条件的优化工作后,对连续流法制备安非他酮中间的反应进行放大实验,以验证实验结果的稳定性(反应步骤及条件与实施例1相同)。在经过一个小时稳定流路后,每隔10h监测一次生成产物s-1-(3-氯苯基)-2-羟基-1-丙酮的产率和ee值,其中,酶催化剂在填充床内不需要更换,稳定性试验结果图如图11所示。
[0128]
由图11可知,在运行的100h过程中,目标产物s-1-(3-氯苯基)-2-羟基-1-丙酮的产率维持在42%左右,对映选择性保持在98%-99%左右,稳定性较强,基本无明显波动,说明本发明中酶催化剂能够多次反复使用,连续流法制备安非他酮中间体有效延长了酶催化剂的使用寿命。
[0129]
以上仅为本发明的优选实施例,并非因此限制本发明的专利范围,凡是在本发明的发明构思下,利用本发明说明书及附图内容所作的等效结构变换,或直接/间接运用在其他相关的技术领域均包括在本发明的专利保护范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。