1.本发明属于细胞培养技术领域,特别涉及一种诱导细胞分泌细胞外基质的方法及其应用。
背景技术:
2.细胞外基质(extracellular matrix,ecm)是由细胞分泌到细胞外间质中的大分子物质,其可以构成复杂的网架结构,从而支持并连接组织结构、调节组织的发生和细胞的生理活动。细胞外基质主要由5类物质组成,包括胶原蛋白、非胶原蛋白、弹性蛋白、蛋白聚糖与氨基聚糖,按分布部位划分主要分为基底膜(basement membrane)和间质基质(interstitial matrix)。
3.诱导性多能干细胞(induced pluripotent stem cell,ipsc),又称人诱导性多能干细胞,常简称为ips细胞(ipsc),是一种由哺乳动物成体细胞经转入转录因子等手段脱分化形成的多能干细胞。
4.目前,诱导细胞分泌ecm的方法相对单一,无法脱离诱导剂(如抗坏血酸)的使用,而且ecm的产出量和产出效率较低,难以满足工业化生产需求,还有现有技术获得的ecm品质普遍较差,蛋白含量,尤其是胶原蛋白含量较少,在利用emc制备胶原蛋白等方面不具有可应用性。
技术实现要素:
5.本发明旨在解决诱导细胞分泌emc,其emc产量少,蛋白含量低的技术问题。为此,本发明提出一种诱导细胞分泌细胞外基质的方法及其应用。本发明中的方法基于特定的诱导剂组合和诱导步骤,能够高效诱导人源干细胞分泌细胞外基质,其分泌量大,分泌效率高,且得到的ecm中富含大量的蛋白和其他活性物质,包括但不限于胶原蛋白、层粘连蛋白和蛋白聚糖。
6.本发明的第一个方面,提供一种诱导干细胞分泌细胞外基质的方法,包括如下步骤:
7.(1)在基质胶包被细胞培养容器中使用tesr1培养基培养细胞;
8.(2)更换为含有gsk-3α/β抑制剂的细胞培养基培养20~48h;
9.(3)更换为含有维a酸和成纤维生长因子2的细胞培养基培养20~48h;
10.(4)更换为含有激活素a和成纤维生长因子9和的细胞培养基培养至少1d,即得细胞外基质。
11.在本发明的一些实施方式中,所述干细胞包括人源干细胞。
12.在本发明中,术语“人源干细胞”是指人体干细胞,包括从人类骨髓、脂肪、脐带、胎盘中提取,通过体外提纯、增殖、培养等到的相关干细胞。
13.在本发明的一些实施方式中,所述干细胞为人源多能干细胞。
14.在本发明的一些实施方式中,所述干细胞为人多能干细胞(ipsc)或人胚胎干细胞
(esc)。
15.在本发明的一些实施方式中,步骤(2)中,所述gsk-3α/β抑制剂为chir99021,其在干细胞培养基中的终浓度为5~15μm。
16.在本发明的一些实施方式中,步骤(3)中,所述维a酸在细胞培养基中的终浓度为1~10μm。
17.在本发明的一些实施方式中,步骤(3)中,所述成纤维生长因子2在细胞培养基中的终浓度为50ng~200ng/ml。
18.在本发明的一些实施方式中,步骤(4)中,所述激活素a在细胞培养基中的终浓度为1~10ng/ml。
19.在本发明的一些实施方式中,步骤(4)中,所述成纤维生长因子9在细胞培养基中的终浓度为50ng~200ng/ml。
20.在本发明的一些实施方式中,所述细胞培养基包括rpmi 1640培养基。
21.在本发明的一些实施方式中,所述rpmi 1640培养基为w/l-glut rpmi 1640培养基。当然,本领域技术人员可以根据实际使用需求,合理选择其他细胞培养基进行替代,包括但不限于w/l-glut rpmi 1640培养基。
22.在本发明的一些实施方式中,所述基质胶为干细胞基质胶。
23.在本发明的一些实施方式中,所述基质胶为vitronectin xf胶(胚胎干细胞培养贴壁基质)。当然,本领域技术人员可以根据实际使用需求,合理选择其他干细胞基质胶进行替代,包括但不限于vitronectin xf胶。
24.在本发明的一些实施方式中,所述方法具体为:
25.(1)在vitronectin xf胶包被细胞培养容器中使用tesr1培养基培养细胞18~24h;
26.(2)更换为含有5~15μm的chir99021的rpmi 1640培养基培养20~48h;
27.(3)更换为含有1~10μm的维a酸和50ng~200ng/ml的成纤维生长因子2的rpmi 1640培养基培养20~48h;
28.(4)更换为含有1~10ng/ml的激活素a和50ng~200ng/ml的成纤维生长因子9的rpmi 1640培养基培养至少7d,即得细胞外基质。
29.在本发明的一些实施方式中,在步骤(4)中,培养液每0.8~1.5天更换1次。
30.在本发明的一些实施方式中,在步骤(4)中,培养液每1天更换1次。
31.在本发明的一些实施方式中,所述方法还包括在步骤(4)后进行过筛除杂。
32.在本发明的一些实施方式中,所述过筛除杂的步骤为:过40μm细胞筛,除去滤液。
33.在本发明中,发明人发现使用本发明中的方法处理干细胞,能够相比常规方法获得更多的细胞,且细胞产生的细胞外基质的量也显著增加(平均每1000万个细胞生产至少18mg细胞外基质),从而有效提高了细胞外基质的产出效率并提高了经济价值。
34.本发明的第二个方面,提供本发明第一个方面所述的方法诱导分泌得到的细胞外基质,所述细胞外基质中,其每毫克基质的蛋白含量≥0.15mg。
35.在本发明中,发明人发现使用本发明中的方法处理干细胞,其获得的细胞外基质能够相比常规方法获得的细胞外基质分泌更多的蛋白,从而极大地增强了该细胞外基质的实用价值和使用效果。
36.在本发明的一些实施方式中,所述细胞外基质中的蛋白浓度大于≥1.60mg/ml。
37.在本发明的一些实施方式中,所述细胞外基质中含有胶原蛋白、层粘连蛋白(laminin)和蛋白聚糖(gag)。
38.在本发明的一些实施方式中,所述胶原蛋白包括i型胶原蛋白、ⅱ型胶原蛋白、ⅲ型胶原蛋白和ⅳ型胶原蛋白。
39.在本发明中,发明人发现使用本发明中的方法处理干细胞,其获得的细胞外基质中的活性物质丰富,其不仅含有各种胶原蛋白,还含有层粘连蛋白(laminin)和蛋白聚糖(gag),具有极高的应用价值。
40.本发明的第三个方面,提供本发明第二个方面所述的细胞外基质在制备含有胶原蛋白、层粘连蛋白和蛋白聚糖中至少一种的产品中的应用。
41.在本发明的一些实施方式中,所述胶原蛋白包括i型胶原蛋白、ⅱ型胶原蛋白、ⅲ型胶原蛋白和ⅳ型胶原蛋白。
42.在本发明中,发明人发现使用本发明中的方法处理干细胞,其获得的细胞外基质中的活性物质丰富,其不仅含有各种胶原蛋白,还含有层粘连蛋白(laminin)和蛋白聚糖(gag),因此,可基于该细胞外基质进一步深加工相关产品,从而提高其应用价值。
43.在本发明的一些实施方式中,所述产品包括药品、食品和化妆品。
44.本发明的有益效果是:
45.(1)本发明提供了一种诱导细胞分泌细胞外基质的方法,该方法能够高效诱导人源多能干细胞分泌细胞外基质,诱导时间短,诱导效果好,细胞外基质产量高,产率超过常规方法。
46.(2)本发明中获得细胞外基质相较于常规方法中得到的细胞外基质的蛋白含量更高,且富含的蛋白及其他活性物质种类更丰富,活性更强,包括但不限于i型胶原蛋白、ⅱ型胶原蛋白、ⅲ型胶原蛋白、ⅳ型胶原蛋白、层粘连蛋白和蛋白聚糖,具有更广泛的应用前景和更好的实用性。
附图说明
47.图1为本发明实施例1中的方法诱导ipsc分泌细胞外基质的显微镜下图片。
48.图2为本发明实施例1中的方法在6孔板中诱导ipsc分泌细胞外基质的宏观图片。
49.图3为本发明实施例2中的方法诱导esc分泌细胞外基质的显微镜下图片。
50.图4为本发明对比例1中的方法诱导ipsc分泌细胞外基质的显微镜下图片。
51.图5为本发明对比例2中的方法诱导ipsc分泌细胞外基质的显微镜下图片。
52.图6为本发明对比例3中的方法诱导ipsc分泌细胞外基质的显微镜下图片。
53.图7为本发明实施例1中的细胞外基质的western blot相关结果。
具体实施方式
54.为了使本发明的发明目的、技术方案及其技术效果更加清晰,以下结合具体实施方式,对本发明进行进一步详细说明。应当理解的是,本说明书中描述的具体实施方式仅仅是为了解释本发明,并非为了限定本发明。
55.所使用的实验材料和试剂,若无特别说明,均为常规可从商业途径所获得的耗材
和试剂。
56.实施例1
57.本实施例中的诱导细胞分泌ecm方法包括如下步骤:
58.(1)基质胶包被:
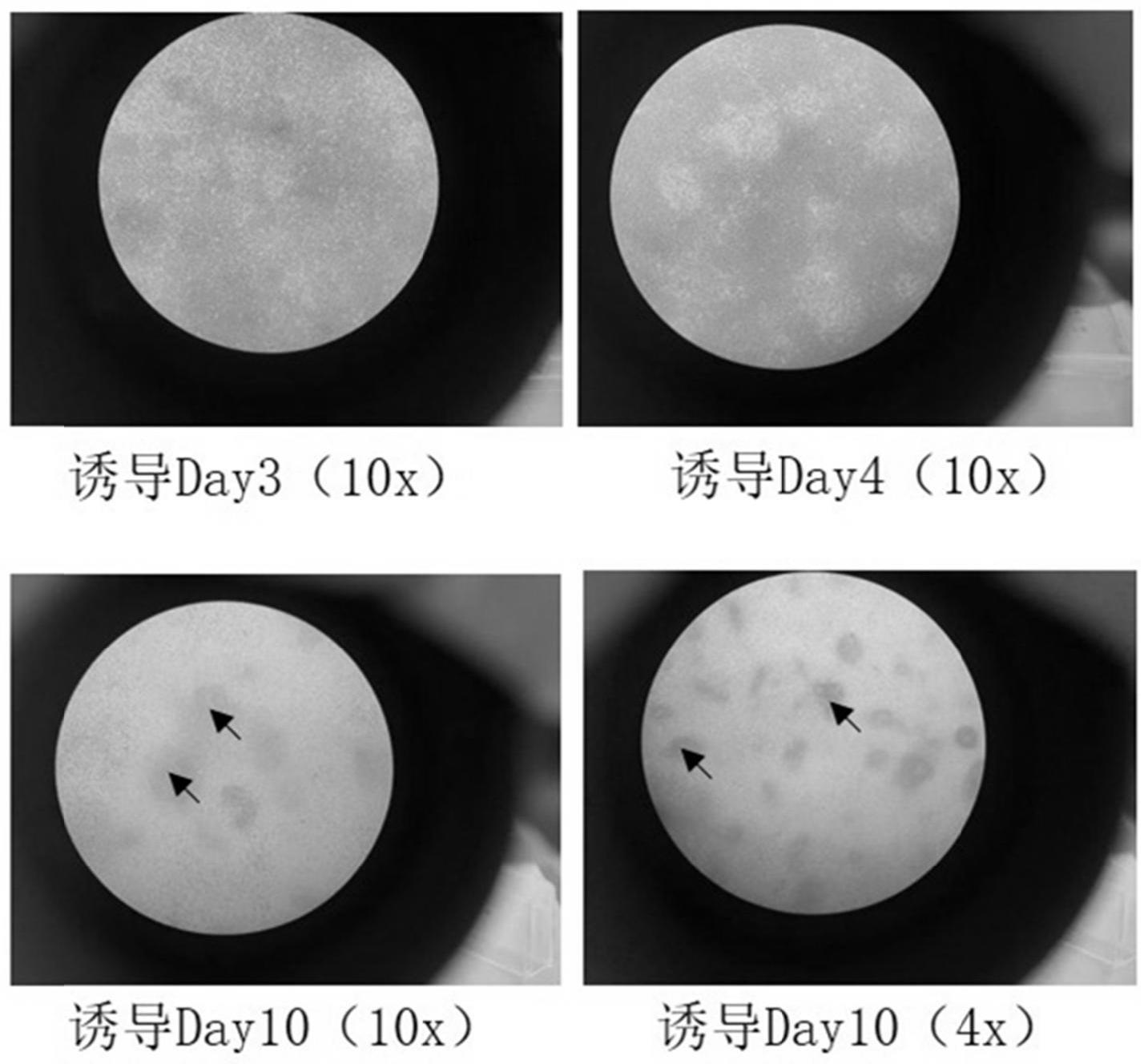
59.使用基质胶包被t75培养瓶,具体为:每400μl的vitronectin xf胶用10ml vitronectin xf buffer稀释后,取6ml稀释的基质胶至t75培养瓶中进行包被。
60.(2)将人多能干细胞(ipsc)接种于基质胶包被的培养瓶中,细胞接种量为3.0
×
106个细胞。加入tesr1培养基,于37℃,5%co2培养箱培养细胞24小时。
61.(3)更换新鲜的1
×
w/l-glut rpmi 1640培养基,加入chir99021(gsk-3α/β抑制剂,在培养基中的终浓度为5μm),于37℃,5%co2培养箱培养诱导细胞36小时。
62.(4)更换新鲜的1
×
w/l-glut rpmi 1640培养基,加入维a酸(ra)和成纤维生长因子2(fgf2)。其中,ra在培养基中的终浓度为1μm,fgf2在培养基中的终浓度为100ng/ml。诱导培养时间36小时。
63.(5)更换新鲜的1
×
w/l-glut rpmi 1640培养基,加入激活素a(activin-a)和成纤维生长因子9(fgf9)。其中,激活素a在培养基中的终浓度为10ng/ml,fgf9在培养基中的终浓度为100ng/ml,诱导培养7天(day,d),也即是至开始培养起算的第11天,诱导分泌细胞外基质。在此期间,每天按照步骤(5)换液一次。
64.不同诱导培养阶段(天数,诱导培养从第(3)步开始起算)的培养情况如图1所示。
65.可以发现,在诱导培养开始的第1~3天中,细胞上没有覆盖任何基质。在第4天开始(即加入激活素a和fgf9后),细胞上慢慢开始覆盖基质。第10天,基质基本覆盖细胞表面,呈山丘状隆起。
66.在开始培养的第11天收集细胞,过40μm细胞筛,取筛上物(滤渣),即细胞外基质。
67.在本实施例中,通过对培养后的物质进行分析,发现共收集得到细胞3.5
×
107个,细胞外基质73mg(湿重,取筛上物称重)。即平均每1000万个细胞生产约20.86mg细胞外基质。
68.发明人将t75培养瓶使用6孔板进行替代培养ipsc,发现同样可以获得相同的效果,收集得到的细胞外基质如图2所示。
69.实施例2
70.本实施例中的诱导细胞分泌ecm方法包括如下步骤:
71.(1)基质胶包被:
72.使用基质胶包被t75培养瓶,具体为:每400μl的vitronectin xf胶用10ml vitronectin xf buffer稀释后,取6ml稀释的基质胶至t75培养瓶中进行包被。
73.(2)将人胚胎干细胞(esc)接种于基质胶包被的培养瓶中,细胞接种量为3.0
×
106个细胞。加入tesr1培养基,于37℃,5%co2培养箱培养细胞24小时。
74.(3)更换新鲜的1
×
w/l-glut rpmi 1640培养基,加入chir99021(培养基中的终浓度为10μm),于37℃,5%co2培养箱培养诱导细胞38小时。
75.(4)更换新鲜的1
×
w/l-glut rpmi 1640培养基,加入维a酸(ra)和成纤维生长因子2(fgf2)。其中,ra在培养基中的终浓度为5μm,fgf2在培养基中的终浓度为50ng/ml。诱导培养时间36小时。
76.(5)更换新鲜的1
×
w/l-glut rpmi 1640培养基,加入激活素a(activin-a)和成纤维生长因子9(fgf9)。其中,激活素a在培养基中的终浓度为5ng/ml,fgf9在培养基中的终浓度为50ng/ml,诱导培养7天,诱导分泌细胞外基质。在此期间,每天按照步骤(5)换液一次。
77.不同诱导培养阶段(天数,诱导培养从第(3)步开始起算)的培养情况如图3所示。
78.可以发现,在诱导培养开始的第1~3天中,细胞上没有覆盖任何基质。在第4天开始(即加入激活素a和fgf9后),细胞上慢慢开始覆盖基质。第10天,基质基本覆盖细胞表面,呈山丘状隆起。
79.在开始培养的第11天收集细胞,过40μm细胞筛,取筛上物(滤渣),即细胞外基质。
80.在本实施例中,通过对培养后的物质进行分析,发现共收集得到细胞2.8
×
107个,细胞外基质53mg(湿重,取筛上物称重)。即平均每1000万个细胞生产约18.90mg细胞外基质。
81.对比例1
82.对比例1中的诱导细胞分泌ecm方法同实施例1,区别在于:对比例1中不使用任何诱导剂。
83.具体步骤为:
84.(1)基质胶包被:
85.使用基质胶包被t75培养瓶,具体为:每400μl的vitronectin xf胶用10ml vitronectin xf buffer稀释后,取6ml稀释的基质胶至t75培养瓶中进行包被。
86.(2)将人多能干细胞(ipsc)接种于基质胶包被的培养瓶中,细胞接种量为3.0
×
106个细胞。加入tesr1培养基,于37℃,5%co2培养箱中对细胞进行长期培养(培养周期同实施例1,期间培养环境和培养基更换情况按照本领域常规进行)。
87.结果如图4所示。
88.可以发现,在未使用诱导剂的情况下,即便长期培养ipsc(10天),也并不会诱导细胞分泌细胞外基质。
89.对比例2
90.对比例2中的诱导细胞分泌ecm方法同实施例1,区别在于:不加入维a酸。
91.具体步骤为:
92.(1)基质胶包被:
93.使用基质胶包被t75培养瓶,具体为:每400μl的vitronectin xf胶用10ml vitronectin xf buffer稀释后,取6ml稀释的基质胶至t75培养瓶中进行包被。
94.(2)将人多能干细胞(ipsc)接种于基质胶包被的培养瓶中,细胞接种量为3.0
×
106个细胞。加入tesr1培养基,于37℃,5%co2培养箱培养细胞24小时。
95.(3)更换新鲜的1
×
w/l-glut rpmi 1640培养基,加入chir99021(培养基中的终浓度为5μm),于37℃,5%co2培养箱培养诱导细胞36小时。
96.(4)更换新鲜的1
×
w/l-glut rpmi 1640培养基,加入成纤维生长因子2(fgf2)。其中,fgf2在培养基中的终浓度为100ng/ml。诱导培养时间36小时。
97.(5)更换新鲜的1
×
w/l-glut rpmi 1640培养基,加入激活素a(activin-a)和成纤维生长因子9(fgf9)。其中,激活素a在培养基中的终浓度为10ng/ml,fgf9在培养基中的终浓度为100ng/ml,诱导培养7天(至开始培养的第11天),诱导分泌细胞外基质。在此期间,每
天按照步骤(5)换液一次。
98.不同诱导培养阶段(天数,诱导培养从第(2)步开始起算)的培养情况如图5所示。
99.可以发现,在诱导培养开始的第1~3天中,细胞上没有覆盖任何基质。在第4天开始(即加入激活素a和fgf9后),细胞依然未产出任何基质。第7天,部分细胞表面可见基质。第10天,细胞表面覆盖少量基质。
100.在开始培养的第11天收集细胞,过40μm细胞筛,取筛上物(滤渣),即细胞外基质。
101.在本实施例中,通过对培养后的物质进行分析,发现共收集得到细胞2.0
×
107个,细胞外基质21mg(湿重,取筛上物称重)。即平均每1000万个细胞生产约10.50mg细胞外基质。
102.可以发现,在缺乏维a酸的使用的情况下,细胞产出细胞外基质效率发生了显著下降。说明维a酸可以协同fgf9增强细胞产出细胞外基质的效率。
103.对比例3
104.对比例3中的诱导细胞分泌ecm方法同实施例1,区别在于:不加入fgf2(步骤(4))。
105.具体步骤为:
106.(1)基质胶包被:
107.使用基质胶包被t75培养瓶,具体为:每400μl的vitronectin xf胶用10ml vitronectin xf buffer稀释后,取6ml稀释的基质胶至t75培养瓶中进行包被。
108.(2)将人多能干细胞(ipsc)接种于基质胶包被的培养瓶中,细胞接种量为3.0
×
106个细胞。加入tesr1培养基,于37℃,5%co2培养箱培养细胞24小时。
109.(3)更换新鲜的1
×
w/l-glut rpmi 1640培养基,加入chir99021(培养基中的终浓度为5μm),于37℃,5%co2培养箱培养诱导细胞36小时。
110.(4)更换新鲜的1
×
w/l-glut rpmi 1640培养基,加入维a酸(ra)。其中,ra在培养基中的终浓度为1μm。诱导培养时间36小时。
111.(5)更换新鲜的1
×
w/l-glut rpmi 1640培养基,加入激活素a(activin-a)和成纤维生长因子9(fgf9)。其中,激活素a在培养基中的终浓度为10ng/ml,fgf9在培养基中的终浓度为100ng/ml,诱导培养7天(至开始培养的第11天),诱导分泌细胞外基质。在此期间,每天按照步骤(5)换液一次。
112.不同诱导培养阶段(天数,诱导培养从第(2)步开始起算)的培养情况如图6所示。
113.可以发现,在培养结束后,镜下仅能观察到极少量的细胞外基质。发明人认为其原因可能是因为在诱导时仅单独使用了ra,而单独使用ra在一定程度上会抑制多能干细胞的细胞外基质的表达。目前也有文献报道ra会抑制细胞分泌细胞外基质。
114.对收集得到的细胞过40μm细胞筛,取筛上物(滤渣),即细胞外基质。发现共收集得到细胞1.9
×
107个,细胞外基质10mg(湿重,取筛上物称重)。即平均每1000万个细胞生产约5.2mg细胞外基质。
115.测试例
116.分别取10mg(湿重)的实施例1、实施例2、对比例2和对比例3中收集到的细胞外基质作为检测样品进行检测。
117.具体检测步骤为:将检测样品用预冷的pbs缓冲液漂洗2~3次后,随机剪成小块置于匀浆器中,加入1000μl组织蛋白抽提试剂(购自thermo scientific,根据使用说明,在使
用前数分钟内加入蛋白酶抑制剂),冰浴,彻底匀浆。将匀浆液转移至离心管中,振荡,冰浴30min,期间用移液器反复吹打,确保匀浆液完全裂解。在4℃,12000rpm离心5min,收集上清,即得到总蛋白溶液。采用bca试剂盒检测总蛋白含量。
118.结果如表1所示。
119.表1
120.组别实施例1实施例2对比例2对比例3检测总蛋白浓度(mg/ml)1.651.691.211.25
121.由上述结果可以发现,采用ra与fgf2配合后的诱导剂组合诱导分泌得到的细胞外基质的蛋白分泌效果要远高于单一性使用某一种诱导剂,从各组比较结果可以反映出ra与fgf2的协同促进细胞分泌蛋白效果。
122.进一步对实施例1中的细胞外基质分泌的蛋白的类型进行检测,检测步骤如下:
123.(1)总蛋白提取:取10mg(湿重)实施例1收集到的细胞外基质,将细胞外基质用预冷的pbs缓冲液漂洗2~3次,随机剪成小块置于匀浆器中,加入100μl组织蛋白抽提试剂(购自thermo scientific,根据使用说明,在使用前数分钟内加入蛋白酶抑制剂),冰浴,彻底匀浆。将匀浆液转移至离心管中,振荡,冰浴30min,期间用移液器反复吹打,确保匀浆液完全裂解。在4℃,12000rpm离心5min,收集上清,得到总蛋白溶液。
124.(2)western blot检测:
125.制样:取40μl步骤(1)得到的总蛋白溶液,加入10μl的5
×
loading buffer,涡旋混匀,98℃加热10min。
126.制胶:将干净的玻璃板固定好,然后加入预先配制好的分离胶(10%的分离胶),并加水液封除去气泡。待胶凝固后,用滤纸吸干玻璃板中水分,然后加入浓缩胶(5%的浓缩胶胶)并插入梳子,待胶再次凝固后浸没于电泳液,轻轻拔出梳子。
127.电泳:浓缩胶电压为80v,分离胶电压为130v,待条带到达玻璃板底部时结束电泳。
128.转膜:pvdf膜于甲醇中活化1min,将夹子的黑色面放入装有转移液的玻璃平皿中,从下到上依次放入一层海绵垫,三层滤纸,分离胶,pvdf膜,三层滤纸,最后盖上一层海绵垫,排掉气泡,夹紧夹子,加入预冷的转膜液,设定电流为250ma,于冰浴中转膜1.0h。
129.封闭:将上一步转好的pvdf膜放入适量5%脱脂奶粉中,于脱色摇床上振荡封闭1h。
130.裁剪:根据检测蛋白的分子量,裁剪pvdf膜。
131.一抗孵育:分别将一抗(人源collagen i、collagenⅱ、collagenⅲ、collagenⅳ、laminin、gag和gapdh)按照试剂说明书的比例用一抗稀释液稀释,将封闭后的pvdf膜装入杂交袋中4℃孵育过夜。用tbst洗5次,每次5min。
132.二抗孵育:二抗按照试剂说明书用5%脱脂奶粉稀释。将膜在二抗中孵育1h。用tbst洗5次,每次5min。
133.发光检测:滴加新鲜配制的ecl混合溶液到膜的蛋白面侧,发光检测。根据不同的光强度调整曝光条件,显影、保存图片。
134.结果如图7所示。
135.可以发现,由于已知的部分蛋白来源是确定的(如matrigel matrix康宁基质胶等的蛋白来源于鼠,western blot所用胶原蛋白、laminin和gag均为人源),因此,可以对比发
现检测样品(实施例1中的细胞外基质)中的蛋白是必然来源于细胞分泌的细胞外基质。从而可以说明实施例1中的ecm具有极好的蛋白分泌效果。
136.上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。