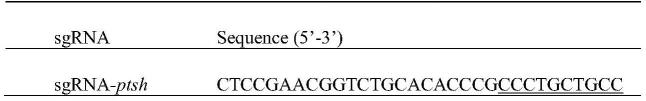
1.本发明涉及生物工程技术领域,更确切的说,本发明涉及一种生物生产乙酸苄酯的方法,另外还涉及一种通过将工程菌的葡萄糖转运系统改变为辅助扩散系统,提高了乙酸苄酯的产量的方法。
背景技术:
2.乙酸苄酯(benzyl acetate)是一种有馥郁茉莉花香气的无色液体。化学式为c9h
10
o2,不溶于水,溶于乙醇、乙醚,不溶于甘油。存在于烤烟烟叶、白肋烟烟叶、香料烟烟叶、主流烟气中。纯品用于配制茉莉型等花香香精和皂用香精,也用作醋酸纤维素、印刷油墨、硝基漆、油脂、染料的溶剂。年需求量》1000t,并且售价为2.3万元/t。
3.目前乙酸苄酯主要通过化学的方式合成,以氯苯和乙酸钠为原料在吡啶和二甲基苯胺的催化下生成乙酸苄酯,再经过后续多步处理得到成品。该过程涉及的原材料和催化剂的成本都较为昂贵,且收率《80%。因此采用生物的方式替代化学合成乙酸苄酯是非常有必要的。目前,乙酸苄酯可以由多种不同来源的脂肪酶催化生成,如商用的tlim和435以及荧光假单胞菌来源的脂肪酶b。采用酶催化的方式虽然可以避免化学生产中的一系列问题,但是酶催化的原料价格普遍较高且催化效率较低,酶回收率较差,导致其在大规模生产中仍然具有一定的局限性。因此开发一种生物合成乙酸苄酯的方法具有十分重要的意义。
4.本发明的主要目的在于实现生物法制备乙酸苄酯的高效合成。筛选了催化效率较高的转酰酶来实现乙酸苄酯的生产,同样人工途径设计了新的代谢途径实现了乙酸苄酯的从头合成。另外本发明还公开了一种通过将工程菌的葡萄糖转运系统改变为辅助扩散系统,提高了乙酸苄酯的产量的方法。实验结果表明,在优化条件下,工程菌株利用苯甲醇或者葡萄糖在摇瓶中可以生产1062mg/l和117mg/l的乙酸苄酯
技术实现要素:
5.1.本发明的目的是提供了高产乙酸苄酯的宿主,通过在原始或改造过的细菌,真菌中过表达生产乙酸苄酯途径中的酶,优选来自于细菌,真菌或蛋白质工程改造的乙醇氧乙酰转移酶1(atf1),乙醇氧乙酰转移酶2(atf2)以及中链脂肪酸乙酯合酶(eht1),通过这些酶在宿主中的高效表达,实现乙酸苄酯从苯甲醇的转化。
6.2.本发明的另一个目的是通过接入苯甲醇的合成路径,进而实现乙酸苄酯从葡萄糖这一简单碳源的高效从头生物合成。
7.3.本发明的又一个目的是通过将工程菌的葡萄糖转运系统改变为辅助扩散系统,减缓宿主生长,提供更多的乙酰coa供应,从而提高乙酸苄酯从头合成产量。
8.4.为了实现上述目的,本发明提供了能够生产乙酸苄酯的宿主,在原始或改造过的细菌,真菌细胞中过表达乙酸苄酯的合成途径基因,制备所述的乙酸苄酯的转化宿主。
9.5.本发明还提供了生物生产乙酸苄酯的方法:第一种是外源添加苯甲醇,从原始
或改造过的细菌,真菌细胞中导入编码乙醇氧乙酰转移酶1(atf1),乙醇氧乙酰转移酶2(atf2)以及中链脂肪酸乙酯合酶(eht1)的基因,并进行发酵。从发酵液中取样,利用高效液相色谱对前体和目标产物的浓度进行分析;第二种是乙酸苄酯的从头合成,首先实现前体苯甲醇的高效从头合成,然后实现乙酸苄酯的从头合成。将生产乙酸苄酯的工程宿主菌过夜培养后,从发酵液中取样,利用高效液相色谱对中间产物及目标产物的浓度进行分析。
10.6.基于上述,所述的发酵培养基包括20g/l葡萄糖,5g/l酵母粉,2g/l mops,5g/l nahpo4,1g/l nacl,3g/l kh2po4,1g/l nh4cl,250mg/l mgso4,15mg/l cacl2,溶剂为水。
11.7.本发明还提供了微生物高产乙酸苄酯的方法,具体有以下几种:第一种通过解除莽草酸途径的反馈抑制,提高前体苯甲醇的供应,从而提高乙酸苄酯的产量;第二种是将宿主天然的葡萄糖转运系统替换为辅助扩散系统,以延缓细胞生长从而提供更多的合成前体乙酰coa,解决前体供应不足的问题。最终乙酸苄酯体外添加实验及从头合成的产量分别为:950mg/l至1062mg/l和90mg/l至117mg/l。
12.8.如上文所述,本发明涉及乙酸苄酯的高效生物合成方法,所述方法的特征在于:通过在原始或改造的细菌,真菌细胞中过表达高效生产乙酸苄酯途径中的相关酶,采用辅助扩散系统泵送葡萄糖,从而实现乙酸苄酯的高效从头合成。
附图说明
13.图1利用基因工程菌生产乙酸苄酯的作用机理示意图;
14.图2atf1催化合成乙酸苄酯bw3:bw(pze-atf1);
15.图3atf2催化合成乙酸苄酯bw4:bw(pze-atf2);
16.图4eht1催化合成乙酸苄酯bw5:bw(pze-eht1);
17.图5乙酸苄酯合成前体苯甲醇的从头生物合成:bw6:bw1(pze-phea-hmas-mdlb-mdlc,pcs-arog
fbr
);
18.图6未改造葡萄糖转运系统从头合成乙酸苄酯:bw7:bw1(pze-phea-hmas-mdlb-mdlc,pcs-atf2-arog
fbr
);
19.图7采用辅助扩散系统从头合成乙酸苄酯:bw8:bw2(pze-phea-hmas-mdlb-mdlc,pcs-atf2-arog
fbr
);
20.图8bw6发酵液中苯甲醇质谱检测结果;
21.图9bw8发酵液中乙酸苄酯质谱检测结果;
具体实施方式
22.以下结合附图与实施实例对本发明做进一步说明:
23.本发明中,对表达质粒的种类没有特殊要求,可认为在大肠杆菌中表达目的基因的构建方法可以采用本领域常用的各种方法,如将目的基因经过酶切处理后连接至载体,之后不再赘述。
24.以下实施实例中,大肠杆菌菌株trans5α,bw25113(f’),bw1和bw2均为常用大肠杆菌菌株,均可市售获得,其中trans5α用于载体构建,bw25113(f’)则用于发酵用菌株。
25.具体实施例1
26.添加实验合成乙酸苄酯
27.1.选择酿酒酵母来源的乙醇氧乙酰转移酶1(atf1),乙醇氧乙酰转移酶2(atf2)以及中链脂肪酸乙酯合酶(eht1),pcr获得基因片段,接着用核酸内切酶对片段和载体进行双酶切,将酶切后的片段进行胶回收或柱回收,之后将目的基因分别插入到质粒pze12-luc(高拷贝)上。获得pze-atf1,pze-atf2和pze-eht1重组质粒(表1)。
28.2.电转法制备bw25113(f’)的感受态细胞,并将90μl感受态细胞分装于1.5ml的ep管中用于转化。分别将构建好的重组质粒pze-atf1,pze-atf2和pze-eht1 1.5μl加入到含有90μl感受态细胞的离心管中,混合均匀。接着利用电转仪将质粒电转进入感受态细胞中。电转完成后,加入lb培养基,并将混合物转移到1.5ml离心管中,复苏60min。之后将菌液涂在含有氨苄青霉素的平板上,37℃过夜培养。制备成生产乙酸苄酯的菌株bw3:bw(pze-atf1);bw4:bw(pze-atf2);bw5:bw(pze-eht1)。
29.3.工程菌株的发酵,在生产乙酸苄酯的菌株bw3,bw4和bw5的平板上分别挑取3个单菌落,接到4ml带有氨苄青霉素抗性的液体lb培养基中,37℃下培养12h,之后分别将菌液转移到50ml的发酵培养基中,加入0.25-1mm的iptg进行诱导。之后在每隔12h取样一次,并使用高效液相色谱测定乙酸苄酯和苯甲醇的浓度。最终产量如图2所示,质谱结果如图5所示。
30.具体实施例2
31.乙酸苄酯合成前体苯甲醇的从头生物合成
32.1.选择使用东方木霉来源的4-羟基扁桃酸合酶(hmas),恶臭假单胞菌atcc12633来源的s-扁桃酸脱氢酶(mdlb)和苯甲酰甲酸脱羧酶(mdlc)以及大肠杆菌来源的分支酸变位酶(phea),pcr获得基因片段,接着用核酸内切酶对片段和载体进行双酶切,将酶切后的片段进行胶回收或柱回收,之后将目的基因分别插入到质粒pze12-luc(高拷贝)上。同时将解除反馈抑制的磷酸-2-脱氢-3-脱氧庚酸醛缩酶(arog
fbr
)插入到质粒pcs27(中拷贝)上。获得pze-phea-hmas-mdlb-mdlc,pcs-arog
fbr
重组质粒(表1)。
33.2.电转法制备bw1的感受态细胞,并将90μl感受态细胞分装于1.5ml的ep管中用于转化。将构建好的重组质粒pze-phea-hmas-mdlb-mdlc 1.5μl以及pcs-arog
fbr
2μl加入到含有90μl感受态细胞的离心管中,混合均匀。接着利用电转仪将质粒电转进入感受态细胞中。电转完成后,加入lb培养基,并将混合物转移到1.5ml离心管中,复苏60min。之后将菌液涂在含有氨苄青霉素和卡那霉素的平板上,37℃过夜培养。制备成生产苯甲醇的菌株bw6:bw1(pze-phea-hmas-mdlb-mdlc,pcs-arog
fbr
)。
34.3.bw6工程菌株的发酵,在生产苯甲醇的菌株bw6的平板上分别挑取3个单菌落,接到4ml带有氨苄青霉素和卡那霉素抗性的液体lb培养基中,37℃下培养12h,之后分别将菌液转移到50ml的发酵培养基中,加入0.25-1mm的iptg进行诱导。之后在每隔12h取样一次,并使用高效液相色谱测定苯甲醇浓度。最终产量如图3所示,质谱结果如图6所示。
35.具体实施例3
36.未改造葡萄糖转运系统从头合成乙酸苄酯
37.1.选择使用东方木霉来源的4-羟基扁桃酸合酶(hmas),恶臭假单胞菌atcc12633来源的s-扁桃酸脱氢酶(mdlb),苯甲酰甲酸脱羧酶(mdlc),大肠杆菌来源的分支酸变位酶(phea)以及酿酒酵母来源的乙醇氧乙酰转移酶2(atf2),pcr获得基因片段,接着用核酸内切酶对片段和载体进行双酶切,将酶切后的片段进行胶回收或柱回收,之后将生产苯甲醇
的目的基因插入到质粒pze12-luc(高拷贝)上。同时将乙醇氧乙酰转移酶2(atf2)和解除反馈抑制的磷酸-2-脱氢-3-脱氧庚酸醛缩酶(arog
fbr
)插入到质粒pcs27(中拷贝)上。获得pze-phea-hmas-mdlb-mdlc,pcs-atf2-arog
fbr
重组质粒(表1)。
38.2.电转法制备bw1的感受态细胞,并将90μl感受态细胞分装于1.5ml的ep管中用于转化。将构建好的重组质粒pze-phea-hmas-mdlb-mdlc 1.5μl以及pcs-atf2-arog
fbr
2μl加入到含有90μl感受态细胞的离心管中,混合均匀。接着利用电转仪将质粒电转进入感受态细胞中。电转完成后,加入lb培养基,并将混合物转移到1.5ml离心管中,复苏60min。之后将菌液涂在含有氨苄青霉素和卡那霉素的平板上,37℃过夜培养。制备成生产乙酸苄酯的菌株bw7:bw1(pze-phea-hmas-mdlb-mdlc,pcs-atf2-arog
fbr
)
39.3.工程菌株bw7的发酵,在生产乙酸苄酯的菌株bw7的平板上分别挑取3个单菌落,接到4ml带有氨苄青霉素和卡那霉素抗性的液体lb培养基中,37℃下培养12h,之后分别将菌液转移到50ml的发酵培养基中,加入0.25-1mm的iptg进行诱导。之后在每隔12h取样一次,并使用高效液相色谱测定乙酸苄酯和苯甲醇的浓度。最终产量如图4所示,质谱结果如图7所示。
40.具体实施例4
41.将bw1宿主的葡萄糖转运系统改造为辅助扩散系统
42.应用crispr cas9技术将编码葡萄糖辅助扩散蛋白的基因glf插入到基因ptsh位置,具体的实施方法
43.1.电转化法将载体pcas 9导入大肠杆菌bw1中,在壮观霉素平板上30度培养20小时筛选阳性克隆转化子命名为bw1-pcas 9,挑取平板上所长的bw1-pcas 9单克隆,接种到1.5ul/ml壮观霉素的lb液体培养基中30度培养。
44.2.基因ptsh位点sgrna质粒的构建
45.1)本研究中sgrna使用的靶向序列,如表2所示
46.表2基因pgi位点sgrna使用的靶向序列
[0047][0048][0049]
2)本研究中应用的引物序列,如表3所示
[0050]
表3引物序列表
[0051][0052]
3.整合片段的构建
[0053]
1)本研究中应用的引物序列,如表4所示
[0054]
表4引物序列表
[0055][0056]
2)以大肠杆菌为模板,p3和p4及p7和p8为引物,pcr扩增得到基因ptsh两段同源臂,以基因glf为模板,以p5和p6为引物,pcr扩增得到基因glf片段;接着以这三段片段为模板,p3和p8为引物,应用pcr重叠延伸的方法得到一个整合片段,进行琼脂糖凝胶电泳,然后采用凝胶回收试剂盒对pcr产物进行纯化和回收
[0057]
4.电转化法将sgrna质粒和整合片段导入1中bw1-cas9菌株中,在菌体中sgrna指引cas9蛋白识别整合位点序列对其切割,菌体自身的修复功能使整合片段同源重组替换假义位点,得到带有壮观霉素和氨苄青霉素的基因工程菌株,在相应抗性的平板上30度培养24小时。
[0058]
5.将sgrna质粒和pcas质粒消掉以得到不需要抗生素地基因工程菌
[0059]
1)消除sgrna质粒,在带有壮观霉素液体lb中培养上述基因工程菌株,同时加入10mmol/l的阿拉伯糖,30度培养24小时,诱导cas9蛋白表达降解sgrna质粒。
[0060]
2)消除pcas质粒,在无抗生素液体lb中培养上述已消掉sgrna质粒的基因工程菌,42度培养48小时,使温敏型pcas质粒降解。
[0061]
6.得到不需抗生素实现稳定遗传生产对羟基苯甲酸的基因工程菌株bw2。
[0062]
具体实施例5
[0063]
采用辅助扩散系统从头合成乙酸苄酯
[0064]
1.选择使用东方木霉来源的4-羟基扁桃酸合酶(hmas),恶臭假单胞菌atcc12633来源的s-扁桃酸脱氢酶(mdlb),苯甲酰甲酸脱羧酶(mdlc),大肠杆菌来源的分支酸变位酶(phea)以及酿酒酵母来源的乙醇氧乙酰转移酶2(atf2),pcr获得基因片段,接着用核酸内切酶对片段和载体进行双酶切,将酶切后的片段进行胶回收或柱回收,之后将生产苯甲醇的目的基因插入到质粒pze12-luc(高拷贝)上。同时将乙醇氧乙酰转移酶2(atf2)和解除反馈抑制的磷酸-2-脱氢-3-脱氧庚酸醛缩酶(arog
fbr
)插入到质粒pcs27(中拷贝)上。获得pze-phea-hmas-mdlb-mdlc,pcs-atf2-arog
fbr
重组质粒(表1)。
[0065]
2.电转法制备bw2的感受态细胞,并将90μl感受态细胞分装于1.5ml的ep管中用于
转化。将构建好的重组质粒pze-phea-hmas-mdlb-mdlc 1.5μl以及pcs-atf2-arog
fbr
2μl加入到含有90μl感受态细胞的离心管中,混合均匀。接着利用电转仪将质粒电转进入感受态细胞中。电转完成后,加入lb培养基,并将混合物转移到1.5ml离心管中,复苏60min。之后将菌液涂在含有氨苄青霉素和卡那霉素的平板上,37℃过夜培养。制备成生产乙酸苄酯的菌株bw8:bw2(pze-phea-hmas-mdlb-mdlc,pcs-atf2-arog
fbr
)
[0066]
3.工程菌株bw8的发酵,在生产乙酸苄酯的菌株bw8的平板上分别挑取3个单菌落,接到4ml带有氨苄青霉素和卡那霉素抗性的液体lb培养基中,37℃下培养12h,之后分别将菌液转移到50ml的发酵培养基中,加入0.25-1mm的iptg进行诱导。之后在每隔12h取样一次,并使用高效液相色谱测定乙酸苄酯和苯甲醇的浓度。最终产量如图5所示。
[0067]
表1菌株和质粒
[0068]
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。