一株高生物量酿酒酵母菌株enhsa-13及其选育方法与应用
技术领域
1.本公开涉及生物工程和酵母生物量技术领域,尤其涉及一株高生物量酿酒酵母菌株enhsa-13及其选育方法与应用。
背景技术:
2.酵母菌具有许多应用,其广泛用于生物医药、食品、轻工业和生物能源等领域,生产重组蛋白、天然活性物质、有机酸和燃料乙醇等产品。尤其在饲料行业其被视为极好的蛋白质、核酸和维生素。随着动物“无抗”和健康养殖的观念深入,酵母培养物作为饲料原料和饲料添加剂,在提高免疫力并减少抗生素使用以及缓解全球蛋白质饲料资源不足方面具有巨大的开发潜力,已成为当前国内外的研究重点。当前影响酵母培养物产品质量的三个关键因素为菌种、工艺与培养基,其中具有高生物量的酿酒酵母菌株是最基础、最重要的因素。因此,筛选具有高生物量的酿酒酵母菌株对提升酵母培养物产品品质,节约生产成本意义重大。
3.增加酵母生物量可以通过通过改造菌株来实现,当前对于菌株改造的方法主要有诱变筛选和基因改造。最常用的诱变方法有紫外诱变、化学诱变及两者的结合,然而常见的诱变方法存着操作复杂、时间长、效率低、毒副作用大的缺点。
技术实现要素:
4.有鉴于此,本公开的目的在于提出一株高生物量酿酒酵母菌株enhsa-13 及其选育方法与应用,以提高筛选效率、节约成本、提升酵母培养物产品品质。
5.基于上述目的,本公开提供一株高生物量酿酒酵母菌株(saccharomyces cerevisiae)enhsa-13,于2022年05月23日保藏于中国微生物菌种保藏管理委员会普通微生物中心,中国北京,保藏编号为cgmcc no.24946。
6.在本发明的一些实施例中,所述高生物量酿酒酵母菌株enhsa-13的选育方法为将所述菌株以酿酒酵母菌株sa-10(菌株保藏号:cgmcc no.6120) 作为出发生产菌,经硫酸二乙酯和常温常压等离子体诱变筛选获得,其主要操作步骤如下:
7.(1)菌种活化
8.将酿酒酵母菌株sa-10接种至装有yepd液体培养基中活化,得到活化菌种的菌液后,并将活化菌种的菌液接种至糖蜜培养基进行培养;
9.(2)制备对数生长期菌液
10.测定步骤(1)得到的活化菌种其生长曲线,找到其对数生长期,并接种步骤(1)中活化菌种培养至对数生长期,得到对数生长期菌液;
11.(3)硫酸二乙酯诱变
12.取不同体积分量的硫酸二乙酯分别加入多份对数生长期菌液,得到菌液中菌株的致死率曲线,选择合适的硫酸二乙酯诱变浓度;
13.(4)制备菌悬液
14.用加入合适浓度硫酸二乙酯的菌液获得培养液,稀释后制备成菌悬液;
15.(5)常温常压等离子体(artp)诱变与筛选
16.将多个均匀涂布所述菌悬液的金属载片放入等离子体发生器中,并分别选择不同的诱变照射时间处理所述菌悬液,测定并筛选相对于出发菌株其单菌落发酵生物量提高10%以上的菌株,得到初筛菌株;优选地,所述涂有菌悬液的金属载片在经过artp照射后,选取致死率在85%-95%的培养液进行筛选。
17.(6)菌株复筛与传代培养
18.培养初筛菌株,对初筛菌株的生物量进行筛选,筛选出相对于出发菌株其单菌落发酵生物量提高20%以上的菌株,获得高生物量酿酒酵母菌株 enhsa-13;
19.再对所述菌株enhsa-13进行传代培养。
20.进一步,步骤(1)中,酿酒酵母菌株sa-10在yepd液体培养基中活化,其活化培养条件为170~190r/min,25~35℃,培养时间11~13h;再将活化好的液体菌液接种至糖蜜培养基,接种量为1%~3%,培养条件为170~190r/min,25~35℃,培养时间11~13h。
21.进一步,步骤(3)中,加入对数生长期菌液的硫酸二乙酯为摇瓶中培养基总体积的0~20%,作用时间为25~35min。
22.进一步,步骤(4)中,将上述加入致死率在75%~85%的硫酸二乙酯的菌液接种至糖蜜培养基,接种量为1~3%,培养条件为170~190r/min,25~35 ℃,培养11~13h后获得培养液,稀释培养液,将培养液的菌浓度调整到 100~110个/ml,制备出菌悬液。
23.进一步,步骤(5)中,所述等离子体发生器的功率为110~130w,气量为8~15slm,所述金属载片与等离子体发生器出口距离2mm,操作温度在 25~35℃;每个金属载片上均匀涂布8~12μl的菌悬液,诱变时间范围为 0~150s。
24.本发明还提供一种上述高生物量酿酒酵母菌株enhsa-13在制备酵母培养物中的应用。
25.在本发明的一些实施例中,高生物量酿酒酵母菌株enhsa-13在生产酵母培养物中的应用包括对所述菌株enhsa-13进行发酵培养获得酵母培养物;
26.进一步,酵母培养物的具体制备方法可以参考cn201711191568.6《一种酿酒酵母培养物及其发酵工艺》,主要工艺步骤为:1)摇瓶种子培养;2)液态深层有氧发酵;3)液态低温无氧发酵;4)固态酶解有氧发酵;5)固态无氧发酵;6)固态高温破壁自溶,得到酿酒酵母培养物。
27.在本发明的一些实施例中,所述酵母培养物包括核苷酸、多肽和氨基酸。所述的核苷酸、多肽和氨基酸等成分均对动物有益,使用本发明的高生物量酿酒酵母菌株enhsa-13能够提升用于动物饲料的酵母培养物产品品质,节约生产成本。
28.本发明通过利用artp和硫酸二乙酯进行复核诱变提供的菌株其采用的诱变方法操作简单安全、筛选效率高,所述的菌株enhsa-13能够有效地提升酵母培养物的生物量和产品品质,节约生产成本。
附图说明
29.为了更清楚地说明本公开或相关技术中的技术方案,下面将对实施例或相关技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本公开的
实施例。
30.图1为实施例1中菌株sa-10和菌株enhsa-13的生长曲线图;
31.图2为实施例1中加入硫酸二乙酯的致死率曲线图;
32.图3为实施例1中使用artp诱变的致死率曲线图。
具体实施方式
33.为使本公开的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本公开进一步详细说明。
34.需要说明的是,除非另外定义,本公开实施例使用的技术术语或者科学术语应当为本公开所属领域内具有一般技能的人士所理解的通常意义。
35.如背景技术所述,现有的菌株改造方法主要有诱变筛选和基因改造。诱变育种通常操作方便,但是诱变方向难以掌控、后期的筛选工作难度大、经过诱变后的菌株生长性能和遗传稳定性都相对较差。诱变筛选常用的方法有紫外诱变、化学诱变以及将两者结合的方法,其中化学诱变的效果较好,但作用时间长,毒副作用大;紫外诱变虽然安全,但是操作复杂,而且诱变效率低;基因改造的手段来提高酵母生物量涉及复杂的代谢通路,遗传特征不清晰,改造难度很大。
36.在实现本技术的过程中发现,可以采用常温常压等离子体和化学联合复合诱变的方法选育高生物量的酿酒酵母菌株。常温常压等离子体(artp) 是利用射频辉光放电原理,在常温常压状态下产生高能量的等离子体,其富含的高能化学活性粒子能够对菌株细胞产生高强度遗传物质损伤,进而利用细胞启动的sos高容错率修复机制,产生种类多样的错配位点,并最终经稳定遗传进而形成突变多样库。artp的构造精巧,易于运输,其成本较低且操作简便;和传统的诱变方法相比获得突变型的多样性的可能性增大;对环境无污染,能够保证操作者的人身安全。本发明采用硫酸二乙酯对准据进行化学诱变,但使用的硫酸二乙酯用量低,在空气中暴露时间短,不仅保证了化学诱变的高效性,同时增加了操作人员的安全性。
37.这种artp和硫酸二乙酯复合诱变的方法既省时、节约成本、又能提高筛选效率和选育出目标菌株的概率,从而提升酵母培养物产品品质,节约生产成本。
38.经过硫酸二乙酯和artp联合诱变筛选得到的菌株enhsa-13为高生物量酿酒酵母菌株,其在相同条件下培养所得的生物量明显高于出发菌株sa-10,菌株enhsa-13发酵培养获得的酵母培养物中的核苷酸、多肽和氨基酸等成分含量也有明显增加。为使本发明的目的、技术方案和优点更加清楚明白,以下通过具体的实施例并结合附图1至附图3对本发明进一步详细说明。
39.实施例1:菌种的选育
40.(1)菌种活化
41.将斜面保藏的酿酒酵母菌株sa-10(菌株保藏号:cgmcc no.6120)接一环至装有100mlyepd液体培养基的摇瓶中活化,培养条件为180r/min, 30℃,培养12h,再将活化好的液体菌液接种装有100ml糖蜜培养基的摇瓶中,接种量为2%,培养条件为180r/min,温度30℃,培养时间12h。
42.(2)制备对数生长期菌液
43.测定步骤(1)得到的活化菌种在不同时间段下的菌体细胞密度(od600),即溶液在600nm波长处的吸光值,得到其生长曲线如图1所示。找到其对数生长期,然后再次从步骤(1)中装有100ml糖蜜培养基的摇瓶中接种,再次摇瓶培养至对数生长期,培养条件为180r/min,温度30℃,得到对数生长期菌液。
44.(3)硫酸二乙酯诱变
45.加入对数生长期菌液的摇瓶培养基总体积的0%、2%、4%、6%、8%、 10%、12%的硫酸二乙酯,得到菌液中菌株的致死率曲线,如图2所示。选择致死率在75%-85%的生长期菌液,选择其对应的硫酸二乙酯浓度为适合该菌株的硫酸二乙酯诱变浓度,在本发明实施例中合适的硫酸二乙酯诱变浓度在 4%,用量较低,对操作人员的影响较小。
46.(4)制备菌悬液
47.选取上述致死率75%-85%的菌液,重新接种至糖蜜培养基,接种量为2%,培养条件为180r/min,30摄氏度,培养12h后获得培养液,将培养液的菌浓度调整到106~108个/ml,再采用无菌生理盐水稀释培养液,制备成菌悬液。
48.(5)artp诱变与筛选
49.在多个金属载片上均匀涂布10μl的菌悬液,所述金属载片与等离子体发生器的出口距离2mm,功率为120w,气量为10slm,操作温度为30℃,诱变时间分别为0、20、30、40、50、60、80、100、120s,根据实验结果绘制致死率曲线,如图3所示,选取致死率为85%-95%的诱变时间为最佳诱变时间点进行筛选处理(本发明实施例中最佳诱变时间点在50s~60s之间),测定并筛选相对于出发菌株其单菌落发酵生物量提高10%以上的菌株,得到初筛菌株。
50.(6)菌株复筛与传代培养
51.将初筛菌株挑到摇瓶培养,培养条件为180r/min,30℃,测其生物量,再次对菌株的生物量进行3轮筛选,获得一株高生物量酿酒酵母菌株 enhsa-13,摇瓶发酵生物量湿重为110g/l,与出发菌株相比提高了28.5%。
52.该enhsa-13菌株经连续10代传代培养,性能稳定。
53.进一步地,在得到菌株enhsa-13后,也测得了其在不同时间段下的菌体细胞密度(od600),得到了菌株enhsa-13的生长曲线,与出发菌株sa-10 的对比如图1所示。由图1可以看出,菌株enhsa-13和菌株sa-10的对数生长期基本一致,且菌株enhsa-13的菌体细胞密度(od600)明显高于菌株sa-10的菌体细胞密度(od600)。
54.实施例2:菌株enhsa-13和菌株sa-10在30l和300l发酵罐的发酵试验
55.(1)设备仪器:30l与300l机械搅拌发酵罐、离心机、电子天平
56.(2)材料与方法
57.菌株:诱变筛选得到的酿酒酵母菌株enhsa-13。
58.培养基:甘蔗糖蜜14%,硫酸铵1.0%,酵母膏0.16%,硫酸镁0.15%,无水氯化钙0.008%,磷酸二氢钾0.15%,消泡剂0.03%。
59.方法:采用出发菌株sa-10与菌株enhsa-13,均分别在30l和300l机械搅拌发酵罐中进行发酵,发酵罐装液量分别为20l和200l。
60.采用上述液体发酵培养基,发酵温度30℃,接种量为10%(v/v),调节培养基的初始ph为6.2,培养时间22h,采用溶氧仪持续测量其溶氧值,当溶氧曲线开始直线上升时即为
发酵结束,再分别测定两菌株得到的菌体生物量,结果见表1。
61.表1酿酒酵母enhsa-13在30l和300l罐发酵生物量数据统计
[0062] 30l发酵罐300l发酵罐出发菌株sa-10(g/l)98101诱变菌株enhsa-13(g/l)135132
[0063] 由表1可看出,在30l和300l发酵罐的逐级放大发酵结束时,诱变菌株enhsa-13的菌体生物量均相对于同条件下的出发菌株sa-10提高了30%左右。
[0064]
实施例3:菌株enhsa-13和菌株sa-10在30t发酵罐高密度发酵的试验
[0065]
(1)设备仪器
[0066]
30t机械搅拌发酵罐、离心机、电子天平。
[0067]
(2)材料与方法
[0068]
菌株:菌株enhsa-13与sa-10。
[0069]
基础底糖培养基:甘蔗糖蜜15%,硫酸铵1.0%,酵母膏0.16%,硫酸镁0.15%,无水氯化钙0.008%,磷酸二氢钾0.15%,消泡剂0.03%;
[0070]
补料培养基:甘蔗糖蜜90%,硫酸铵3.5%,酵母膏0.15%,硫酸镁0.2 %,氯化钙0.012%,磷酸二氢钾0.2%,消泡剂0.03%。
[0071]
方法:采用菌株sa-10和筛选得到的菌株enhsa-13,分别在两个30t 机械搅拌发酵罐中进行发酵。发酵罐装液量分为20t,采用上述液体发酵培养基,发酵温度30℃,接种量为10%(v/v),调节培养基的初始ph为6.2。培养时间22h,当溶氧开始直线上升时即为底糖发酵结束开始流加补料培养基,采用溶氧仪持续测量其溶氧值,溶氧曲线再次开始直线上升高密度发酵结束,再分别测定两菌株得到的菌体生物量,结果见表2。
[0072]
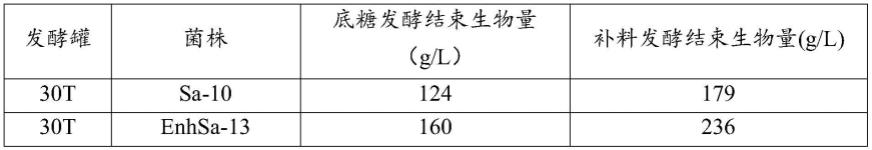
表2酿酒酵母enhsa-13在30t发酵罐高密度发酵数据统计
[0073][0074]
由表2可看出,菌株enhsa-13和菌株sa-10在30t发酵罐的高密度发酵条件下,在底糖发酵结束和补料发酵结束后,菌株enhsa-13的菌体生物量均相对于菌株sa-10提高了30%左右,实验结果表明菌株enhsa-13的高生物量优势在高密度发酵培养过程中依旧稳定。
[0075]
实施例4:采用菌株sa-10与菌株enhsa-13分别进行酵母培养物的制备
[0076]
(1)酵母培养物的制备
[0077]
主要步骤为为:1)摇瓶种子培养;2)液态深层有氧发酵;3)液体低温无氧发酵;4)固态酶解有氧发酵;5)固态无氧发酵;6)固态高温破壁自溶。主要步骤及参数均参考cn201711191568.6《一种酿酒酵母培养物及其发酵工艺》,此处不再赘述。
[0078]
出发菌株sa-10制备的产品为酵母培养物1,诱变筛选得到的菌株 enhsa-13制备的产品为酵母培养物2。
[0079]
(2)测定两种酵母培养物的核苷酸含量:
13酿酒酵母菌株生产的酵母培养物,其核苷酸含量、多肽含量以及氨基酸含量明显高于出发菌株sa-10生产的酵母培养物,有效提高了酿酒酵母培养物的品质。
[0091]
需要说明的是,上述对本公开的一些实施例进行了描述。其它实施例在所附权利要求书的范围内。在一些情况下,在权利要求书中记载的动作或步骤可以按照不同于上述实施例中的顺序来执行并且仍然可以实现期望的结果。另外,在说明书中描述的过程不一定要求示出的特定顺序或者连续顺序才能实现期望的结果。在某些实施方式中,多任务处理和并行处理也是可以的或者可能是有利的。
[0092]
所属领域的普通技术人员应当理解:以上任何实施例的讨论仅为示例性的,并非旨在暗示本公开的范围(包括权利要求)被限于这些例子;在本公开的思路下,以上实施例或者不同实施例中的技术特征之间也可以进行组合,步骤可以以任意顺序实现,并存在如上所述的本公开实施例的不同方面的许多其它变化,为了简明它们没有在细节中提供。
[0093]
在阐述了具体细节(例如,摇瓶培养)以描述本公开的示例性实施例的情况下,对本领域技术人员来说显而易见的是,可以在没有这些具体细节的情况下或者这些具体细节有变化的情况下实施本公开实施例。因此,这些描述应被认为是说明性的而不是限制性的。
[0094]
尽管已经结合了本公开的具体实施例对本公开进行了描述,但是根据前面的描述,这些实施例的很多替换、修改和变型对本领域普通技术人员来说将是显而易见的。例如,其它化学诱变剂(例如,甲基磺酸乙酯(ems)) 可以使用所讨论的实施例。
[0095]
本公开实施例旨在涵盖落入所附权利要求的宽泛范围之内的所有这样的替换、修改和变型。因此,凡在本公开实施例的精神和原则之内,所做的任何省略、修改、等同替换、改进等,均应包含在本公开的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。