一种检测tet酶氧化能力的方法
技术领域
1.本发明专利涉及一种检测tet酶氧化能力的方法,属于生物技术领域。
背景技术:
2.dna胞嘧啶甲基化(5mc)是dna中最常见的碱基修饰方式,约占所有胞嘧啶的1%-8%,被称为“第五种碱基”。dna甲基化与染色质状态和基因转录活跃程度具有明显的相关性,是预测基因表达水平的有效依据。在肿瘤初期通常会发生抑癌基因甲基化水平升高或者原癌基因甲基化水平降低的现象,因此,dna甲基化水平检测是临床疾病诊断的有效手段。近年来,酶转化法甲基化检测技术因为具备dna损伤小、背景噪音低、准确性高和数据质量好等优点而成为dna甲基化检测领域的重要关注点。tet蛋白家族作为一种重要的双加氧酶,在dna去甲基化过程中发挥了重要作用,目前,也已经被广泛应用于各种酶转化法甲基化检测技术中,包括em-seq及taps等。但tet酶涉及的中间氧化产物比较多(5hmc、5fc及5cac),如何快速高效地筛选出我们所需要的高效tet酶及高效反应buffer,是我们的一个技术瓶颈。常规的方法主要是基于质谱检测,但质谱检测要求样本足够多,样本的后续处理很复杂,同时需要购买各种标准品和酶,检测周期也比较长。本发明提供了一种检测tet酶氧化5mc产物的方法,通过高通量测序手段即可鉴别,与以往通过质谱的方法相比,节约了经费和时间,简便快捷,并且实验结果重复性及准确性高,具有重要的应用价值。
技术实现要素:
3.本发明的目的是提供一种检测tet酶氧化能力的方法,具有精度高、操作简单的优点。
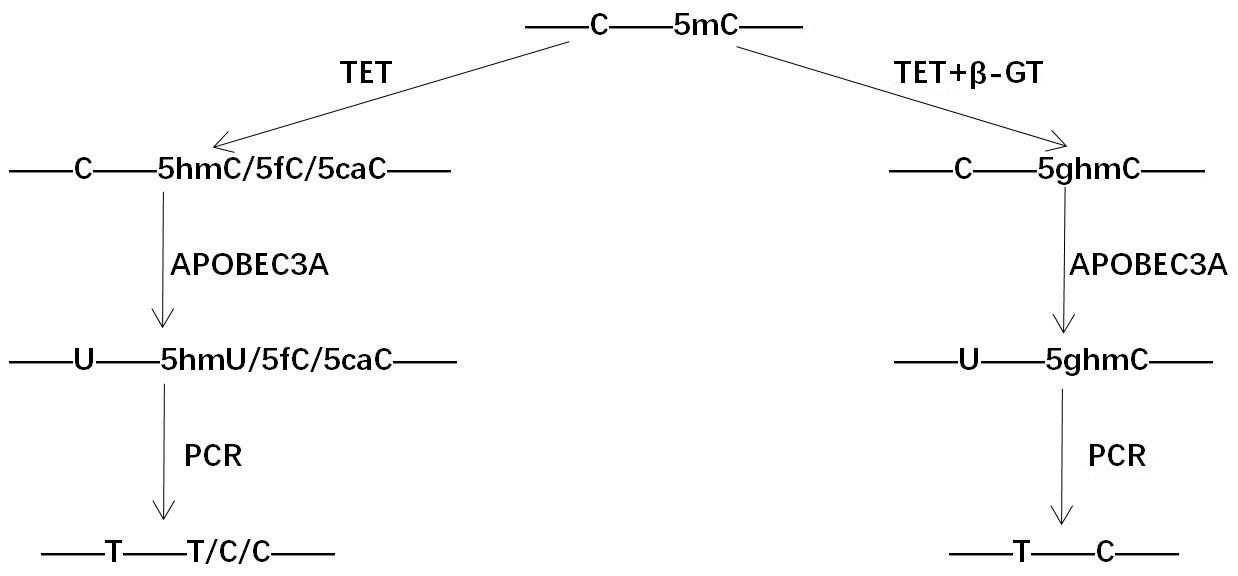
4.一种检测tet酶氧化能力的方法,其步骤包括:(1)将已知5mc位点的dna样本进行如下处理;a、在β-葡糖基转移酶及udp-glucose存在的情况下,加入待测tet酶或tet酶 待测反应buffer进行氧化反应,然后加入胞苷脱氨酶处理,反应产物回收,进行dna甲基化单链建库并测序,根据测序结果,统计已知5mc位点中扩增后仍为c的位点百分数,记为α;b、直接加入待测tet酶或tet酶 待测反应buffer进行氧化反应,然后加入胞苷脱氨酶处理,反应产物回收,进行dna甲基化单链建库并测序,根据测序结果,统计已知5mc位点中扩增后仍为c的位点百分数,记为β;(2)计算待测tet酶的氧化能或待测反应buffer对tet酶氧化能力的影响力,具体为:tet酶无法氧化的5mc位点的百分比为100%-α;tet酶将5mc位点氧化为5hmc的百分比为α-β;tet酶将5mc位点氧化为5fc/5cac的百分比为β;β-葡糖基转移酶及udp-glucose,以及胞苷脱氨酶相较于tet酶而言均应当过量添加,以使反应完全。
5.优选的,步骤(1)中待待测tet酶反应后,将dna通过热变性、碱变性或甲酰胺变性成单链dna,再将单链dna加入胞苷脱氨酶反应体系进行脱氨反应。
6.优选的,所述胞苷脱氨酶为apobec3a。
7.优选的,采用dna甲基化单链建库试剂盒进行dna甲基化单链建库。
8.本发明提供了一种检测tet酶氧化dna cpg双核苷酸位点5mc产物的方法。使用tet酶(甲基胞嘧啶双加氧酶)对dna进行氧化,tet酶在不存在β-葡糖基转移酶(β-gt)的情况下将dna cpg双核苷酸位点上的5mc氧化至5hmc/5fc/5cac(5-羟甲基胞嘧啶/5-醛基胞嘧啶/5-羧基胞嘧啶);在存在β-葡糖基转移酶(β-gt)的情况下,将dna cpg双核苷酸位点上的5mc氧化至5ghmc(β-葡糖基-5羟甲基胞嘧啶)。tet氧化完成后再利用胞苷脱氨酶apobec3a对胞嘧啶核苷酸进行脱氨基,apobec3a能够将c/5mc/5hmc脱氨基生成u/t/5hmu,apobec3a对5ghmc/5fc/5cac不能脱氨。通过pcr将u/t/5hmu识别为t,5ghmc/5fc/5cac识别为c,最后通过测序及生物信息学分析可以判断5mc、5hmc、5fc/5cac的占比,从而检测出tet酶氧化cpg双核苷酸位点5mc的能力,对tet酶的氧化性能的理解及应用具有重要的意义。本发明可用于用未知氧化能力的tet酶中筛选出高活性的tet酶,或者用于评价新的buffer体系对tet酶氧化能力的影响。本发明利用ngs实验技术对tet酶氧化5mc产物进行评估,与以往通过质谱的方法相比,节约了经费和时间,简便快捷,并且实验结果重复性及准确性高,具有重要的应用价值。
附图说明
9.图1 emss流程图。
10.图2 添加β-gt对tet氧化5mc产物的影响。
11.图3 不添加β-gt对tet氧化5mc产物的影响。
12.图4 emss法检测ngtet1、mtet1、mtet2氧化5mc产物示意图。
13.图5 质谱法检测ngtet1、mtet1、mtet2氧化5mc产物示意图。
14.图6 emss法和质谱法检测ngtet1氧化5mc产物结果对比。
具体实施方式
15.下面结合附图对本发明的具体实施方式做进一步说明。
16.实施例1:添加β-gt对tet氧化产物的影响。
17.使用甲基化λdna为模板进行tet酶氧化,添加β糖基化转移酶和udp-glucose,37℃ 60min-120min,使5mc转化为5ghmc,如表1所示。甲基化λdna是指dna5
’‑3’
方向的5mcg位点被甲基化,其余所有的c未被甲基化,购自zymo。反应结束后,加入0.3-3 μl 10 mg/ml 蛋白酶k,50℃反应10-30 min。使用磁珠法或者qiaquick nucleotide removal kit (qiagen)回收dna。回收的dna变性成单链后进行胞苷脱氨酶处理,所加体系如表2,37℃ 3h,4℃ hold。使用磁珠法或者qiaquick nucleotide removal kit (qiagen)回收dna。采用市面上任一款dna甲基化单链建库试剂盒建库,测序,分析。
18.表1组分用量甲基化λdna1-100ng
10
×
tetbuffer3μl3mmfe(nh4)2(so4)21-10μl10μmtet酶4μlβ-gt1μludp-glucose40
µ
m补ddh2o至30μl其中10
×ꢀ
tet buffer的配比为:组分用量hepes-koh(ph6.0-8.0)50-100mmnacl50-150mmα-酮戊二酸1-5mml-抗坏血酸2-10mmatp1-5mmdtt2-5mm表2组分用量胞苷脱氨酶20u单链dna20ul胞苷脱氨酶buffer10ulnuclease-freewaterto100ul表3结果见表3和图2,甲基化λ标准品经ngtet1、mtet1、mtet2氧化及脱氨后,分别有98.5%、98.3%、98.0%的5mc位点经pcr扩增后还是c,表明ngtet1、mtet1、mtet2能将甲基化λ标准品上98.5%、98.3%、98.0%的5mc位点氧化至5hmc,进而葡糖基化为5ghmc,不能被apobec3a脱氨,从而通过测序识别为c。甲基化λ标准品经ngtet1、mtet1、mtet2氧化及脱氨处理之后,分别有1.5%、1.7%、2.0%的5mc位点经pcr转化为t,意味着1.5%、1.7%、2.0%的5mc位点没有被tet酶氧化,5mc脱氨为t。
19.实施例2:不添加β-gt对tet氧化产物的影响。
20.使用甲基化λdna为模板进行tet酶氧化,不添加β糖基化转移酶和udp-glucose,37℃ 60min-120min,如表4所示。甲基化λdna是指dna5
‘‑3’
方向的5mcg位点被甲基化,其余所有的c未被甲基化,购自zymo。反应结束后,加入0.3-3 μl 10 mg/ml 蛋白酶k,50℃反应10-30 min。使用磁珠法或者qiaquick nucleotide removal kit (qiagen)回收dna。回收的dna变性成单链后进行胞苷脱氨酶处理,所加体系如表2,37℃ 3h,4℃ hold。使用磁珠法或者qiaquick nucleotide removal kit (qiagen)回收dna。采用市面上任一款dna甲基化单链建库试剂盒建库,测序,分析。
21.表4组分用量甲基化λdna1-100ng10
×
tetbuffer3μl3mmfe(nh4)2(so4)21-10μl10μmtet酶4μl补ddh2o至30μl表5结果见表5和图3,甲基化λ标准品经ngtet1、mtet1、mtet2氧化及脱氨处理后,分别有68.7%、68.0%、66.9%的5mc位点经pcr扩增后还是c,表明ngtet1、mtet1、mtet2分别能将甲基化λ标准品上68.7%、68.0%、66.9%的5mc位点氧化至5fc/5cac,不能被脱氨,通过测序识别为c。甲基化λ标准品经ngtet1、mtet1、mtet2氧化及脱氨处理后,分别有31.3%、32.0%、33.1%的5mc位点经pcr扩增后转化为t,意味着甲基化λ标准品上仍分别含有31.3%、32.0%、33.1%的5mc/5hmc位点,5mc/5hmc进一步被脱氨为t。
22.实施例3:本发明的检测tet酶氧化能力的方法(emss法)对ngtet1、mtet1、mtet2氧化5mc效率的检测。
23.使用甲基化λdna为模板进行tet酶氧化,添加和不添加β-gt、udp-glucose作为对比,37℃ 60min-120min,如表6所示。反应结束后,加入0.3-3 μl 10 mg/ml 蛋白酶k,50℃反应10-30 min。使用磁珠法或者qiaquick nucleotide removal kit (qiagen)回收dna。回收的dna变性成单链后进行胞苷脱氨酶处理,所加体系如表2,37℃ 3h,4℃ hold。使用磁珠法或者qiaquick nucleotide removal kit (qiagen)回收dna。采用市面上任一款dna甲基化单链建库试剂盒建库,测序,分析。
24.表6组分用量甲基化λdna1-100ng10
×
tetbuffer3μl3mmfe(nh4)2(so4)21-10μl10μmtet酶4μl添加和不添加β-gt1μl添加和不添加udp-glucose40
µ
m补ddh2o至30μl表7
表8结果见表7、表8和图4,对于甲基化λ标准品,表7是添加β-gt和udp-glucose的结果,可以看出ngtet1、mtet1、mtet2氧化及脱氨处理后,分别有1.1%、1.3%、2.0%的5mc位点没有被氧化,5mc脱氨为t。表8是不添加β-gt和udp-glucose的结果,可以看出ngtet1、mtet1、mtet2氧化及脱氨处理后,分别将30.3%、31.2%、33.4%的5mc位点转化为t,表明5mc 5hmc产物占比分别为30.3%、31.2%、33.4%,而表7表明5mc占比分别为1.1%、1.3%、2.0%,相应的5hmc产物占比分别为29.2%、29.9%、31.4%;同时从表8可以看出ngtet1、mtet1、mtet2分别能将甲基化λ标准品上69.7%,68.8%,66.6%的5mc位点氧化至5fc/5cac,不能被脱氨,通过测序识别为c,进而得出5fc 5cac产物占比分别为69.7%,68.8%,66.6%。三种tet酶氧化5mc产物占比的结果具体见图4,可见三种tet酶的氧化性能比较接近。
25.实施例4:质谱法对ngtet1、mtet1、mtet2氧化5mc效率的检测。
26.在本实施例中,使用质谱测定了三种tet酶对5mc的氧化产物占比,具体实施方式如表9:表9组分用量甲基化λdna1-100ng10
×
tetbuffer3μl3mmfe(nh4)2(so4)21-10μl10μmtet酶4μl补ddh2o至30μl37℃反应60-120 min。反应结束后,加入0.3-3 μl 10 mg/ml 蛋白酶k,50℃反应10-30 min。使用磁珠法或者qiaquick nucleotide removal kit (qiagen)回收dna进行lc-ms/ms分析。5mc、5hmc、5fc和5cac含量占比分析流程见hideharu hashimoto et al(nature,2013)。
27.表10
实验结果如表10和图5所示,对于甲基化λ标准品,质谱法检测ngtet1、mtet1、mtet2氧化5mc的产物中,5mc占比分别为1.0%、1.5%、1.9%,5hmc占比分别为29.5%、30.2、31.2%,5fc 5cac产物占比分别为69.5%、68.3%、66.9%,其中5fc产物占比分别为31.2%,31.8%,32.6%,5cac产物占比分别为38.3%,36.5%,34.3%。可见质谱法检测结果与emss方法检测结果比较一致,如图6所示。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。