1.本技术涉及生物材料技术领域,特别是涉及一种交联生物瓣膜材料的制备方法。
背景技术:
2.人的心脏具有四个心脏瓣膜,通过其正常开启、闭合,配合心肌的收缩使血液循环全身,维持正常的生命活动。瓣膜性心脏病是最常见的心脏病,全球每年确诊病人可多达1亿左右。该疾病的首选治疗方法是瓣膜置换术;全球每年约有150万患者需要手术治疗,预计到2050年,手术患者数量会达到500万以上。
3.目前,有两种主要类型的商业瓣膜替代品:机械心脏瓣膜(mhv)和生物心脏瓣膜(bhv)。机械心脏瓣膜由于需要长期抗凝和血流动力学差的缺点,并不适合所有人,但术后是使用寿命较长。而生物心脏瓣膜除了具有更好的生物相容性和血流动力学外,还可用于经导管心脏瓣膜置换术,临床应用范围更广。但生物心脏瓣膜一直存在体内免疫反应和钙化两个困难,免疫反应和钙化会导致瓣膜成分缓慢降解,最终引起瓣膜失去功能性。
4.尽管在过去的20年里,交联技术的改进已经提高了瓣膜的耐久性,但目前临床的生物瓣膜最长使用期限仍只有12到15年左右,在年轻患者的体内使用寿命更短。因此,对延长生物心脏瓣膜寿命和安全性的研究一直是业内热点。
5.目前临床可用的生物心脏瓣膜都是通过戊二醛交联的,但戊二醛只能交联胶原纤维,不能交联弹力纤维,并且戊二醛残醛基团会作为晶体成核的结合位点,是瓣膜钙化的主要因素之一。
6.因此,如何提供一种新的交联方法,提供满足使用需要的生物瓣膜,是本领域技术人员亟待解决的技术问题。
技术实现要素:
7.为解决上述技术问题,本发明的目的为提供一种交联生物瓣膜材料的制备方法;本技术提供的制备方法,先后使用新霉素、聚乙二醇二缩水甘油醚、单宁酸对生物材料进行交联,使制备的生物瓣膜材料具有无毒性,且生物力学性能更优,生物相容性好,组织结构稳定并有良好的抗钙化性能,同时交联的瓣膜还具有较好的抗炎效果。
8.本发明提供的技术方案如下:
9.一种交联生物瓣膜材料的制备方法,包括以下步骤:
10.1)使用新霉素、edc/nhs溶液先后处理生物材料;
11.2)使用聚乙二醇二缩水甘油醚处理步骤1)所得生物材料;
12.3)在避光条件下,使用单宁酸处理步骤2)所得生物材料;
13.4)在避光条件下,对步骤3)所得生物材料梯度脱水,即得。
14.生物瓣叶组织主要包括胶原纤维,弹力纤维,糖胺聚糖等成分,戊二醛通过可逆的席夫碱与胶原蛋白交联,因而在体内随着席夫碱基团的水解,出现胶原蛋白三螺旋结构的降解,瓣叶的力学性能会发生变化。另一方面,戊二醛只交联胶原蛋白,对弹性蛋白和糖胺
聚糖等成分没有交联的作用。植入体内后,糖胺聚糖的的丢失和胶原、弹性蛋白的变性和降解会进一步导致了生物心脏瓣膜的沉积钙化从而导致较差的生物力学性能。此外,戊二醛交联生物心脏瓣膜的另一个问题是残留的醛基也可能对宿主细胞有毒,导致钙化并诱导炎症。这些都可能会降低生物瓣膜的耐久性和使用寿命。
15.针对现有技术存在的问题,本技术提供一种交联生物瓣膜材料的制备方法,先后使用新霉素、聚乙二醇二缩水甘油醚、单宁酸对生物材料进行交联,上述三种试剂效果明确,分别交联生物材料的胶原纤维、弹力纤维和糖胺聚糖;并且本技术优化交联顺序和反应条件,使制备的生物瓣膜材料具有无毒性,且生物力学性能更优,生物相容性好,组织结构稳定并有良好的抗钙化性能,同时交联的瓣膜还具有较好的抗炎效果。
16.具体而言,生物材料首先经新霉素对氨基聚糖(gags)的反应,再经过edc/nhs的催化作用,加强新霉素和氨基聚糖的结合,促进新霉素与gags形成稳定的共价键,防止在后续的交联过程中导致gags的丢失。然后由聚乙二醇二缩水甘油醚稳定胶原纤维,再利用单宁酸稳定弹力纤维和胶原纤维,到达充分交联生物材料的三种主要成分,提高材料的力学、稳定性和抗钙化能力。并且,单宁酸交联在聚乙二醇二缩水甘油醚处理之后,还可以促进聚乙二醇二缩水甘油醚与胶原纤维的反应,显著提高生物材料的生物力学和热稳定性。
17.优选地,步骤2)中所用聚乙二醇二缩水甘油醚分子量为500-800。
18.更优选步骤2)中所用聚乙二醇二缩水甘油醚分子量为500-800。此分子量的聚乙二醇二缩水甘油醚含有合适长度的碳链和环氧活性基团,有利于交联组织时形成稳定的交联网络,提高固定效果。
19.优选地,步骤2)具体为:使用缓冲液溶解聚乙二醇二缩水甘油醚,分别配制质量百分浓度为2-4%、ph为4.0-4.5的第一溶液;以及质量百分浓度为2-4%、ph为9.5-10.0的第二溶液;
20.使用第一溶液依次在4-6℃、20-25℃下孵育生物材料1-2d,然后使用第一溶液依次在37-39℃、50-56℃孵育生物材料0.5-1d,期间摇床速率30-60次/min,且改变温度同时更换第一溶液;然后使用第二溶液在50-56℃孵育生物材料0.5-1d,漂洗。
21.优选使用聚乙二醇二缩水甘油醚(pe)处理生物材料时,先使用聚乙二醇二缩水甘油醚配制的ph为4.0-4.5的第一溶液处理,再使用ph为9.5-10.0的第二溶液处理,提供先酸后碱性的反应环境。具体而言,先在低温酸性条件下促进聚乙二醇二缩水甘油醚分子在组织的浸润分布,再逐步提高温度,在酸性条件下,加强生物材料中氨基和聚乙二醇二缩水甘油醚的反应,最后再调整ph为碱性,促进材料中羧基和聚乙二醇二缩水甘油醚的反应。通过优化反应条件和温度,可以提高聚乙二醇二缩水甘油醚的交联程度,更好的稳定胶原纤维。
22.优选地,步骤1)具体为:使用缓冲液配制浓度为0.5-1mmol/l、ph为5.5-6.0的新霉素溶液;使用缓冲液配制edc浓度为30-40mmol/l、nhs为6-8mmol/l的edc/nhs溶液;
23.使用新霉素溶液,室温孵育生物材料1-2h,摇床速率30-60次/min;更换edc/nhs溶液继续孵育12-24h,漂洗。
24.生物材料的糖胺聚糖成分(gag)是维持组织功能的重要物质,但是在我们处理心包的过程中,后续的存储阶段及植入体内后,都可以引起gag成分的丢失和降解。而新霉素可以和gag成分结合,通过edc/nhs介导的交联作用,进一步稳定gag的成分,防止心包在处理和储存的过程损失gag。此外,新霉素可以占据gag酶解的位点,抑制gag水解酶的作用,降
低gag的体内水解。
25.其中,所用的edc/nhs溶液需要在这个弱酸性环境下作用,即在ph4-6的环境下作用。
26.优选地,步骤3)具体为:使用缓冲液配制质量百分浓度为0.3-0.6%的单宁酸溶液,单宁酸溶液经超声处理后,调节ph至5.5-6.0使用;
27.避光条件下,使用单宁酸溶液在20-25℃下孵育生物材料2-3d,摇床速率20-30次/min,漂洗。
28.优选地,单宁酸溶液经600w、20khz超声处理20-30min。
29.优选所配置的单宁酸溶液经超声处理后使用。更优选单宁酸溶液经600w、20khz超声处理20-30min。使用超声处理可以充分溶解单宁酸,并且在避光的条件下可以避免单宁酸氧化分解而引起组织结构僵硬,损失材料的生物力学性能。
30.在ph值为5.5-6.0的情况下,0.3-0.6%的单宁酸溶液的稳定性、结合动力学和有效性最好。更优选单宁酸浓度为0.4-0.8%,稳定弹力蛋白的效果最佳。制备过程中可以根据生物材料弹力蛋白的含量和分布,选取不同的单宁酸浓度和反应时间。
31.优选地,步骤4)中,依次使用低浓度到高浓度的乙醇溶液对步骤3)所得生物材料梯度脱水,乙醇溶液浓度范围为30-75%。
32.优选地,乙醇溶液的体积为生物材料体积的20-25倍,不同浓度的乙醇溶液分别处理生物材料8-12h。
33.单宁酸反应过程中,会使组织的含水量明显增加,导致组织的柔韧性受损,因此,在单宁酸处理后,通过依次使用低浓度到高浓度的酒精进行梯度脱水,降低组织的含水量,恢复材料的性能。例如,采用50%的酒精脱水第一次,再提高酒精的浓度到60%继续脱水,然后再提高酒精的浓度,最后保存的酒精浓度是70%左右。也可从30%的酒精开始进行梯度脱水,并依次选取比上一次浓度更高的酒精进行脱水。
34.实际制备中,根据生物材料组织含量水量的不同,控制反应时间,防治脱水过度。此外,酒精还可以加强单宁酸和组织的交联,进一步改善组织的稳定性和生物相容性。
35.梯度脱水在单宁酸处理之后,因此也需要在避光条件下进行。
36.优选地,在步骤1)之前,还包括前处理步骤:
37.从哺乳动物体内取出心生物材料,热缺血时间30min内,分离脂肪和外膜,使用含抗生素无菌缓冲液清洗,裁剪,浸入新洁尔灭30-40min,再使用含抗生素无菌缓冲液冲洗,低温保存。
38.优选地,步骤4)所得交联生物瓣膜材料保存在无菌的0.1mol/l缓冲液或60%的乙醇溶液中。
39.本技术中,所用的缓冲液可以是pbs缓冲液、nhs缓冲液、hepes缓冲液等。
40.本技术中,pe是指聚乙二醇二缩水甘油醚;pbs缓冲液是指磷酸盐缓冲液;nhs是指n-羟基琥珀酰亚胺;mes缓冲液是指吗啉乙磺酸缓冲液。hepes缓冲液是指4-羟乙基哌嗪乙磺酸缓冲液。
附图说明
41.为了更清楚地说明本技术实施例或现有技术中的技术方案,下面将对实施例或现
有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本技术中记载的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
42.图1为本发明实施例1中组织学染色结果;
43.图2为本发明实施例1中扫描电镜结果;
44.图3为本发明实施例1中力学性能数据结果;
45.图4为本发明实施例1中细胞相容性和血液相容性测试结果;
46.图5为本发明实施例1中体外抗酶解实验结果;
47.图6为本发明实施例1中体内植入实验结果;
48.图7为皮下植入1周和3周后不同样本的宿主反应的特征图像;
49.图8为本发明实施例3中热稳定性的比较结果;
50.图9为本发明实施例3中厚度的比较结果;
51.图10为本发明实施例3中力学性能的比较结果;
52.图11为本发明实施例3中抗酶解能力的比较结果。
具体实施方式
53.为了使本领域的技术人员更好地理解本技术中的技术方案,下面将对本技术实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本技术的一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本技术保护的范围。
54.实施例1牛心包制备生物瓣膜材料
55.一、前期处理:从屠宰场的黄牛(体重约400-500kg)体内取出心包,热缺血时间30分钟内,充分分离脂肪和外膜,用含抗生素无菌pbs液(青霉素和链霉素,浓度分别为100u/ml,100ug/ml)清洗多次,挑选合适厚度的部位,裁剪成相应大小的形状,浸入0.1%新洁尔灭30min,含抗生素无菌pbs冲洗材料10min
×
3次,低温4℃保存。
56.二、交联方法的具体流程和参数
57.1)使用固定装置将生物材料固定在支架上,保证材料的两面充分展开并全部能接触到反应试剂。
58.2)硫酸新霉素的处理:配置1mmol/l的三硫酸新霉素在50mmol/l的吗啉乙磺酸(mes)缓冲溶液中,ph为5.5,在室温下,摇床速率60次/分钟震荡反应2小时。
59.然后将溶液倒出,配置30mmol/l的1-乙基3-(3-二甲氨基丙基)碳二亚胺(edc)和6mmol/l的n-羟基琥珀酰亚胺(nhs)在50mmol/l mes缓冲盐水(ph 5.5),将生物材料置于edc/nhs溶液中孵育继续24小时,再用pbs溶液漂洗组织5min/次
×
3次。
60.3)聚乙二醇二缩水甘油醚(pe)的处理:配置4%的pe 0.1mol/l的pbs缓冲液,调节ph为4.0,4℃中孵育2天,摇床速率60次/分钟;所用聚乙二醇二缩水甘油醚的分子量为500;
61.再更换相同浓度的pe溶液,提升温度至25℃,相同速度摇床孵育2天;
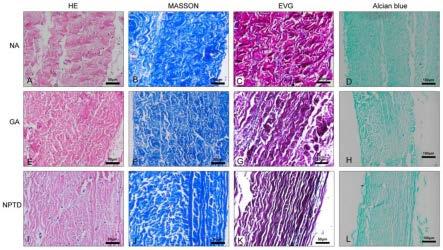
62.再次更换相同浓度的pe溶液,提升温度至37℃,相同速度摇床孵育1天;
63.再提升温度至56℃,相同速度摇床孵育1天;
64.更换液体,配置ph为9.8的4%左右的pe溶液,相同速度摇床孵育1天;
65.再用pbs溶液漂洗组织5min/次
×
5次,彻底清洗掉表面未反应的pe溶液。
66.4)单宁酸的处理:配置0.6%的单宁酸0.1mol/l的pbs缓冲液,溶液需用超声600w,20khz处理20分钟,调节ph为5.5左右;
67.在25℃温度下,摇床速率30次/分钟反应3天;反应过程需全程避光;再用pbs溶液漂洗组织5min/次
×
3次。
68.5)乙醇梯度处理:配置60%乙醇溶液,20倍体积溶液对生物材料脱水12h,再更换70%乙醇溶液,20倍体积溶液继续梯度脱水12小时,反应过程需全程避光。
69.6)储存:制备好的生物瓣膜材料可以储存在无菌的0.1mol/lpbs缓冲液或60%的乙醇溶液中。
70.对所制备的牛心包生物瓣膜材料进行检测,并使用新鲜牛心包、戊二醛交联牛心包作为对比。图中,na为新鲜牛心包组;ga为戊二醛交联牛心包组;ntpd为实施例1交联牛心包组。
71.其中,戊二醛交联牛心包是先用0.625%戊二醛(50mm的hepes溶液)处理1天,在用0.2%的戊二醛(50mm的hepes溶液)处理6天。温度都是室温。
72.图1为组织学染色结果。图1显示he染色(a、e、i)、masson三色染色(b、f、j)、弹性van-gieson染色(c、g、k)和alcian蓝染色(d、h、l)。从图1可以看出,与天然心包相比,ga和nptd交联后,小叶的结构保持完整和致密。
73.图2为扫描电镜结果。从图2可以看出,牛心包表面和横切面的扫描电镜显微照片。na的组织特征是多孔疏松且粗糙(a、b、c)。nptd组(g、h、i)的平坦而紧凑的结构特征与ga组(d、e、f)相似。
74.图3为力学性能数据。从图3可以看出,牛心包的水接触角(contact angle)、热变性温度(dsc)和生物力学性能。与na组和ga组(a).相比,nptd交联后小叶的水接触角显著降低与na和ga样品(b).相比,nptd样品的td明显提高nptd交联后,小叶薄度下降,与ga组(c).接近与ga组(d).组相比,nptd组的杨氏模量(young’s modulus)显著改善。三组的最大拉伸应力(maximum tensile stress)和最大负荷(maximum load)差异无统计学意义。图中,p<0.05有统计学意义。
75.图4为细胞相容性和血液相容性测试结果。从图4可以看出,人脐静脉内皮细胞(huvecs)的增殖和形态通过6-cdcfda活细胞荧光染色(a、b、c)进行评估,huvecs几乎完全覆盖na和nptd组的表面,而只有少数细胞在ga组(a、b、c)。采用mtt法测定小叶的细胞毒性,ga组的相对生长率明显低于na组和nptd组(g)。采用扫描电镜成像(d、e、f)和ldh检测(i)评价样品表面的血小板粘附情况。红色箭头表示血小板粘附。nptd组乳酸脱氢酶(ldh)的定量明显低于na组和ga组。nptd组和na组的ldh溶血率(hemolysis ratio)显著低于ga组(h)。p<0.05有统计学意义。
76.图5为体外抗酶解实验。从图5可以看出,交联心包酶解后的组织学特征及定量分析。胶原酶水解后的masson三色染色图像(a,d)。弹性蛋白酶水解后的弹性van-gieson染色图像(b,e),红色箭头显示nptd组中保留的弹性纤维。透明质酸酶水解后的阿利新蓝染色图像(c,f)。各组酶解后的质量损失情况(g/h/i),nptd组对胶原酶、弹力蛋白酶、透明质酸酶的抵抗力显著优于ga组和新鲜组,p<0.05有统计学意义。
77.图6为体内植入实验结果。皮下植入90天后的大体标本、组织学特征及定量分析。
na组的心包在体内严重降解,而ga组和nptd组的心包保存良好(f)。图像显示he染色(a),马森三色染色(b),弹性范-吉森染色(c)和阿利新蓝染色(d),红色箭头表示保留的弹性纤维。茜素红染色显示ga组比nptd组有更多的钙沉积(e),红色箭头表示钙化的位置。钙定量分析显示,nptd组的钙含量明显低于ga组(g)。弹性蛋白和gags定量分析结果显示,nptd组的保存含量显著高于ga组(h,i),p<0.05有统计学意义。
78.图7为皮下植入1周和3周后不同样本的宿主反应的特征图像。图像右侧为cd68和cd3(a、b、c、d)的免疫组化染色,对应图像右侧为半定量结果。结果显示,与ga组和na组相比,nptd组在1周和3周时cd68 炎症细胞浸润减少。
79.实施例2猪心包制备生物瓣膜材料
80.一、前期处理:从屠宰场的外三元猪(体重约100-150kg)体内取出心包,热缺血时间30分钟内,充分分离脂肪和外膜,用含抗生素无菌pbs液(青霉素和链霉素,浓度分别为100u/ml,100ug/ml)清洗多次,挑选合适厚度的部位,裁剪成相应大小的形状,浸入0.1%新洁尔灭30min,含抗生素无菌pbs冲洗材料10min
×
3次,低温4℃保存。
81.二、交联方法的具体流程
82.1)使用固定装置将生物材料固定在支架上,保证材料的两面充分展开并全部能接触到反应试剂。
83.2)硫酸新霉素的处理:配置0.8mmol/l的三硫酸新霉素在50mmol/l的吗啉乙磺酸(mes)缓冲溶液中,ph为5.5,在室温下,摇床速率40次/分钟震荡反应1小时。
84.将溶液倒出,配置30mmol/l的1-乙基3-(3-二甲氨基丙基)碳二亚胺(edc)和6mmol/l的n-羟基琥珀酰亚胺(nhs)在50mmol/l mes缓冲盐水(ph5.5),将生物材料置于edc/nhs溶液中中孵育12小时,再用pbs溶液漂洗组织5min/次
×
3次。
85.3)聚乙二醇二缩水甘油醚(pe)的处理:配置3%的pe 0.1mol/l的pbs缓冲液,调节ph为4.5,4℃中孵育2天,摇床速率40次/分钟;所用聚乙二醇二缩水甘油醚的分子量为500;
86.再更换相同浓度的pe溶液,提升温度至25℃,相同速度摇床孵育1.5天;
87.再次更换相同浓度的pe溶液,提升温度至37℃,相同速度摇床孵育0.5天;
88.再提升温度至50℃,相同速度摇床孵育0.5天;
89.更换液体,配置ph为9.5的3%的pe溶液,相同速度摇床孵育1天。
90.再用pbs溶液漂洗组织5min/次
×
5次,彻底清洗掉表面未反应的pe溶液。
91.4)单宁酸的处理:配置0.4%的单宁酸0.1mol/l的pbs缓冲液,溶液需用超声600w,20khz处理20分钟,调节ph为5.5左右;
92.在25℃温度下,摇床速率20转/分反应2天;反应过程需全程避光;再用pbs溶液漂洗组织5min/次
×
3次。
93.5)乙醇梯度处理:配置60%乙醇溶液,20倍体积溶液对生物材料脱水8h,再次更换70%乙醇溶液,20倍体积溶液继续梯度脱水8h,反应过程需全程避光。
94.6)储存:制备好的生物瓣膜材料可以储存在无菌的0.1mol/lpbs缓冲液或60%的乙醇溶液中。
95.实施例3对比试验
96.将实施例1制备的牛心包生物材料,与现有公开专利cn113425910a实施例2所制备材料的性能对比。图中,cg为对比专利中复合交联牛心包组;ntpd为实施例1制备的新型交
联牛心包组。
97.图8为二者热稳定性的比较。图7中,nptd组(92.6
±
2.75℃)比cg组(82.62
±
3.27℃)的热皱缩稳定显著提升,进一步说明了新型交联的方法对胶原的交联稳定作用更优,可以获得更好的热稳定性,p<0.05有统计学意义。
98.图9为二者厚度的比较。图8中,nptd组(4.7
±
0.06mm)比cg组(5.4
±
0.08mm)的厚度更薄,表示生物材料可塑性更好。生物心脏瓣膜对材料的厚度的有要求,越薄表明临床应用范围更广,p<0.05有统计学意义。
99.图10为二者力学性能的比较。图9中,两组在杨氏模量(young’s modulus)和最大拉伸应力(maximum tensile stress)上无明显差异,但nptd组的最大载荷显(maximum load)著高于cg组。表明新型交联组的胶原纤维交联更紧密,抗拉强度更大,p<0.05有统计学意义。
100.图11为二者抗酶解能力的比较。图10中,cg组和nptd组对胶原酶、弹力酶、透明质酸酶的抵抗性能测试。各组材料经过酶解48小时后,测量各组的质量损失。如图所示,nptd组对胶原酶、弹力酶、透明质酸酶的抵抗能力均优于cg组。这些数据表明,新型交联对生物材料的成分稳定性更好,p<0.05有统计学意义。
101.对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。