1.本发明属于植物保护领域,涉及一种用于抗病品种筛选及用于关联分析挖掘甘蔗抗scsmv基因的甘蔗抗scsmv精准评价方法。
背景技术:
2.甘蔗是世界上重要的经济作物,主要用于生产白糖及燃料乙醇。同其他作物一样,甘蔗的生产受到了一些生物及非生物的胁迫,降低了甘蔗的产量与品质。生物胁迫中细菌性病害、真菌性病害、病毒性病害及植原体病害占据甘蔗减产的20%以上。其中甘蔗病毒性病害可以显著的降低甘蔗产量及糖分,严重影响甘蔗产业的健康发展。甘蔗花叶病是甘蔗生产上发生的主要病毒性病害,是导致甘蔗产量和糖分降低的主要因素。引起甘蔗花叶病的几种病原如scmv、srmv和scsmv均属于马铃薯y病毒科病毒。在甘蔗种质资源中栽培种及野生种甘蔗花叶病的发生率几乎为100%,能使甘蔗的产量降低30-80%。因而需要挖掘抗病基因及筛选抗病品种来防控这种化学防治难以奏效的病害。
3.病害调查表明甘蔗条纹花叶病毒(scsmv)已超越甘蔗花叶病毒(scmv)和高粱花叶病毒(srmv)成为导致甘蔗产生花叶病的重要病原物,其发病时可以导致甘蔗叶片产生坏死病斑(图1),严重影响甘蔗的株高(图2)及产量。甘蔗花叶病为非致死性病害,部分已感染scsmv的甘蔗种质中较低的scsmv载量可以实现较轻的花叶病症状,对植株的生长发育及产量的影响较低,是一种理想的抗病种质。scsmv甘蔗体内复制、运输及积累需要与甘蔗内源基因进行互作来实现,通过抗病性精准评价及全基因组关联分析有望从该甘蔗种质资源中挖掘抑制scsmv在甘蔗体内复制、运输及积累的相关基因。
4.建立甘蔗种质资源抗scsmv精准评价方法是挖掘抗病品种及通过全基因组关联分析挖掘抗性相关基因的基础前提。传统的甘蔗抗花叶病评价方法主要是通过采集已感染的病叶通过磷酸缓冲液制作病原液并通过人工接种后肉眼观察症状统计发病率或通过田间调查统计自然发病率等进行评价。但是通过该方法很难实现精准评价的目的,比如对关联分析所需的300份以上的种质进行抗病评价时,存在制备的病原液在长时间的接种过程中前后病毒浓度不一致、摩擦接种的力度不一致、发病时间不一致、受环境影响极大肉眼难以完全准确判定花叶病症状等缺陷。
技术实现要素:
5.本发明的目的在于规避了上述缺陷,通过对感染了scsmv的甘蔗种质进行精准接种、精准采样及精准病毒载量检测实现了抗病性精准评价,适用于通过关联分析挖掘抗病甘蔗种质中抑制scsmv在甘蔗体内复制、运输及积累的相关基因。
6.本发明的第一个方面是提供一种甘蔗抗条纹花叶病毒的精准评价方法,包括以下步骤:
7.(1)筛选感染单一scsmv株系甘蔗材料(作为甘蔗种质抗病性接种鉴定的病原来源);
8.(2)待评价甘蔗种质无毒植株制备:截取待评价的甘蔗种质植株顶端生长点处的幼叶组织为外植体,消毒后,通过愈伤诱导及脱分化培养获得组培苗,室温练苗后,温室培养,选取长势较一致的植株,通过病毒检测最终获得长势一致的甘蔗种质无毒幼嫩植株;
9.(3)scsmv病原液制备:从感染单一scsmv株系甘蔗材料中提取获得scsmv病原液;
10.(4)甘蔗种质无毒植株scsmv病原接种:将等量scsmv病原液分别接种至步骤(2)获得的无毒幼嫩植株上;
11.(5)筛选出感染scsmv的甘蔗植株;
12.(6)scsmv荧光定量pcr标准曲线构建
13.对含scsmv病毒的cdna模板进行扩增,将pcr产物克隆至pmd19-t载体,转化dh5α感受态细胞,构建重组质粒pmd19t-scsmv。提取pmd19t-scsmv质粒,测定浓度并计算其拷贝数;将梯度稀释的重组质粒标准品作为模板,进行实时荧光定量pcr反应,通过质粒模板不同浓度梯度的扩增曲线,得到扩增ct值与单位体积样品的病毒载量线性关系的标准曲线;
14.(7)不同甘蔗种质scsmv定量检测
15.采集步骤(5)筛选出感染scsmv的甘蔗植株叶片组织,分别提取总rna,逆转录为cdna,并以cdna为模板进行实时荧光定量pcr检测,并通过构建的标准曲线,精准测定不同甘蔗种质甘蔗叶片单位体积scsmv积累量,形成对不同甘蔗种质对scsmv的抗感差异精准比较分析。
16.优选地,荧光定量pcr所用引物对为:scsmv-qf:ctcacgccaaagtaagtcaa和scsmv-qr:tgctgttcgagttacgattc。
17.优选地,标准曲线方程为y=-3.392
×
log(x) 40.19,其中,y为荧光定量pcr扩增的ct值,代表pcr扩增的循环数,单位cycles,log(x)为以10为底x的对数,x为质粒的拷贝数,单位copies。
18.优选地,步骤(1)为:采集花叶病症状明显的甘蔗植株叶片,提取叶片总rna,通过甘蔗花叶病毒(scmv)、高粱花叶病毒(srmv)和甘蔗条纹花叶病毒(scsmv)的特异性检测引物进行检测鉴定,筛选出只感染scsmv的甘蔗植株。
19.更优选地,还对只感染scsmv的甘蔗植株pcr检测产物进行高通量测序,确保无不同scsmv株系混合感染的情况。
20.进一步优选地,用防虫网保护只感染scsmv的甘蔗植株。
21.优选地,步骤(2)中通过甘蔗花叶病毒(scmv)、高粱花叶病毒(srmv)和甘蔗条纹花叶病毒(scsmv)的特异性检测引物进行检测鉴定最终获得长势一致的甘蔗种质无毒幼嫩植株。
22.优选地,步骤(4)接种时采取对甘蔗最靠近芯叶能看见肥厚带的叶片(下文简称“ 1叶片”)进行多个位点的擦伤接种。
23.更优选地,在病原液中加入等量石英砂,拇指和食指蘸取病原液,搓揉植株 1叶片基部至表皮擦伤,接种完后覆膜或套塑料袋保湿。
24.进一步优选地,间隔7天左右对新长出的完整的 1叶片进行擦伤接种,接种2-4次。
25.采用本发明的上述方法对37种甘蔗种质进行精准评价,不同甘蔗种质对scsmv的抗性大致如下文表4所示。
26.最优选地,所述精准评价方法包括以下步骤:
27.(1)筛选感染单一scsmv株系甘蔗材料
28.采集花叶病症状明显的甘蔗植株叶片,提取叶片总rna,通过甘蔗花叶病毒(scmv)、高粱花叶病毒(srmv)和甘蔗条纹花叶病毒(scsmv)的特异性检测引物进行检测鉴定,筛选出只感染scsmv的甘蔗植株;优选地,还对只感染scsmv的甘蔗植株pcr检测产物进行高通量测序,确保无不同scsmv株系混合感染的情况;进一步优选地,用防虫网保护只感染scsmv的甘蔗植株;
29.(2)待评价甘蔗种质无毒植株制备
30.截取待评价的甘蔗种质植株顶端生长点处的幼叶组织为外植体,经酒精及升汞消毒、无菌水冲洗后,通过愈伤诱导及脱分化培养获得组培苗;将不同甘蔗种质组培苗室温练苗后移栽入花盆并转移至温室进行培养;温室培养一个月后,选取长势较一致的植株,通过甘蔗花叶病毒(scmv)、高粱花叶病毒(srmv)和甘蔗条纹花叶病毒(scsmv)的特异性检测引物进行检测鉴定,最终获得长势一致的甘蔗种质无毒幼嫩植株;
31.(3)scsmv病原液制备
32.采集感染单一scsmv病原植株的幼嫩叶片,剪碎放入烧杯,并以重量与体积比1:3的比例加入磷酸缓冲液,通过匀浆机打磨成泛白的匀浆,通过纱网过滤并通过澄清获得病原液;
33.(4)甘蔗种质无毒植株scsmv病原接种
34.采用一份甘蔗病原液对应一份甘蔗种质进行接种;在病原液中加入等量石英砂(优选为500-600目),上下颠倒混匀,拇指和食指蘸取病原液,搓揉植株 1叶片基部至表皮擦伤,接种完后覆膜或套塑料袋保湿;间隔7天左右对新长出的完整的 1叶进行擦伤接种,总计重复接种三次;
35.(5)不同甘蔗种质感病植株检测
36.接种scsmv病原2个月后,采集甘蔗植株 1叶叶片组织,trizol法提取叶片总rna,通过scsmv的特异性检测引物进行检测鉴定,筛选出感染scsmv的甘蔗植株;
37.(6)scsmv荧光定量pcr标准曲线构建
38.对含scsmv病毒的cdna模板进行扩增,将pcr产物克隆至pmd19-t载体,转化dh5α感受态细胞,构建重组质粒pmd19t-scsmv;提取pmd19t-scsmv质粒,测定浓度并计算其拷贝数;将10倍倍比稀释的重组质粒标准品作为模板,进行实时荧光定量pcr反应,反应结束后由系统自动生成标准曲线,得到荧光强度与单位体积样品的病毒载量的标准曲线;
39.(7)不同甘蔗种质scsmv定量检测
40.分别采集步骤(5)筛选出感染scsmv的甘蔗植株叶片组织,提取总rna,逆转录为cdna,并以cdna为模板进行实时荧光定量pcr检测,并通过构建的标准曲线,精准测定不同甘蔗种质甘蔗叶片单位体积scsmv积累量,形成对不同甘蔗种质对scsmv的抗感差异精准比较分析。
41.本发明的第二个方面是提供一种引物对,所述引物对为:scsmv-qf:ctcacgccaaagtaagtcaa和scsmv-qr:tgctgttcgagttacgattc。
42.本发明的第三个方面是提供一种如本发明第二个方面所述的引物对在筛选甘蔗抗scsmv品种、和/或精准评价甘蔗抗条纹花叶病毒能力中的应用。
43.本发明的有益效果如下:
44.1、本发明方法采用的对接种了单一scsmv病原的甘蔗种质进行scsmv积累量的定量精准评价方法,克服了传统人工接种统计发病率受环境干扰严重、病原物接种量不一致及接种成功率低等,导致甘蔗种质抗病性评价不精准的缺点,可为通过关联分析从抗病甘蔗种质资源中挖掘抑制scsmv在甘蔗体内复制、运输及积累的相关基因提供精准的抗病性评价数据。
45.2、本发明方法首先对疑似感染花叶病的甘蔗进行pcr检测,获得确认感染scsmv的植株,并通过pcr产物高通量测序,获得感染单一scsmv株系的甘蔗植株,用于制备scsmv病原液,克服了不同scsmv株系致病力不一致,导致不同甘蔗种质抗scsmv评价不准确的缺点。
46.3、本发明方法通过愈伤诱导脱分化方式,可以对大批量甘蔗种质资源进行无毒苗制备,获得生长一致的甘蔗种质无毒组培苗,且移栽温室的组培苗叶片幼嫩,提高了scsmv的接种成功率,可以加大关联分析所需的样本量。
47.4、本发明方法接种时采取对甘蔗 1叶叶脉两侧叶肉细胞进行多个位点的擦伤接种,不擦伤叶脉,叶片可保持直立生长,接种后用塑料带套住花盆保湿,隔一周左右对新长出的 1叶叶片进行重复接种三次,可以大大提高接种效率。
48.5、本发明方法通过构建scsmv荧光定量pcr标准曲线,可以对感染scsmv的甘蔗植株进行scsmv拷贝数精准定量检测,进而精准评价不同甘蔗种质资源对scsmv的抗病性。
附图说明
49.图1为感染scsmv甘蔗叶片病症,a:健康植株叶片;b:感病植株叶片。
50.图2为感染甘蔗条纹花叶病甘蔗植株生长情况,感染条纹花叶病甘蔗植株生长受抑制显著。
51.图3为17份甘蔗种质资源花叶病病原检测结果。其中,a:甘蔗花叶病毒scmv检测;b:高粱花叶病毒srmv检测;d:甘蔗条纹花叶病毒scsmv检测。1宾川竹蔗、2云蔗01-1413、3河塘竹蔗、4罗汉蔗、5古果果蔗、6闽糖69-421、7云蔗03-258、8米易果蔗、9roc21、10连江果蔗、11roc10、12guana、13拔地拉、14华南54-11、15蒲城果蔗、1628ng251、17文山竹蔗、ck-脱毒健康种苗、ck scsmv cdna模板。
52.图4为不同甘蔗种质无毒组培苗scsmv检测结果。
53.图5为甘蔗植株叶片分布图。
54.图6为 1叶病原接种示意图。
55.图7为不同甘蔗种质感染scsmv阳性植株pcr检测。
56.图8为pmd19t-scsmv质粒模板浓度梯度qpcr扩增结果;a:qpcr扩增曲线;b:qpcr溶解曲线;c:qpcr标准曲线;图a中1-10分别为模板171.0
×
10-1
~171.0
×
10-10
ng/ul 10不同浓度梯度的扩增曲线。图c中1-7分别为5.40
×
107~5.40
×
101copies/ul的扩增模板。
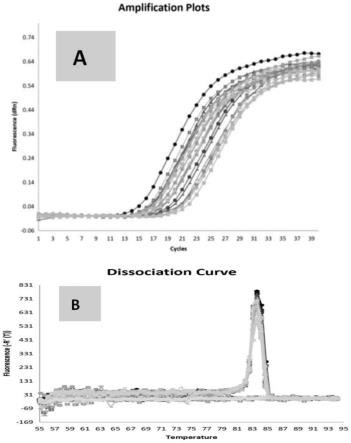
57.图9为37份甘蔗种质scsmv qpcr检测结果;a:qpcr扩增曲线;b:qpcr溶解曲线。
具体实施方式
58.下面参照附图,结合具体的实施例对本发明作进一步的说明,以更好地理解本发明。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产
品。
59.1、感染单一scsmv株系甘蔗植株材料鉴定
60.采集17份源于云南开远甘蔗种质资源圃带疑似花叶病症状(图1)的甘蔗种质植株叶片10mg,置于1.5ml无酶离心管中加入1ml trizol试剂(invitrogen,美国),通过高效样品制备仪(mm400,德国)进行破碎处理,加入200ul氯仿颠倒混匀,12000转/min离心获得上清液。将上清液转移至另一1.5ml无酶离心管加入预冷的无水乙醇进行rna沉淀。12000转/min离心,去掉上清液用1ml 75%乙醇洗涤沉淀,离心后弃掉洗涤上清液,于超净台吹干,加入40ul depc h2o溶解获得总rna。合成甘蔗花叶病毒(scmv)、高粱花叶病毒(srmv)和甘蔗条纹花叶病毒(scsmv)的特异性检测引物(甘蔗重要病害分子检测技术,李文凤,2016)对所有疑似样本进行pcr检测,特异性引物和目的片段长度见表1。用transscript one-step gdna removal and cdna synthesis supermix试剂盒进行反转录。反转录程序:10μl rt体系中含2
×
ts reaction mix 5μl、depc水1.5μl、0.5μg/μl oligod(t)180.5μl、rt/ri enzyme mix 0.5μl、gdna remover 0.5μl、rna 2.0μl;rt反应条件是:25℃10min,42℃30min。pcr程序:20μl pcr体系中含ddh2o 7.2μl、2
×
pcr taq mix 10μl,cdna模板2μl,上、下游引物(20μg/μl)各0.4μl;pcr扩增程序都为:94℃预变性5min;94℃变性30s,60℃退火30s,72℃延伸1min,35个循环;72℃延伸10min。
61.获得只感染scsmv的植株样本11份(图3)。最后通过对扩增产物进行回收及高通量测序,选取感染单一scsmv病原的甘蔗种质材料2份(roc10和拔地拉),分别种植于防虫网内,作为甘蔗种质抗病性接种鉴定的病原来源。
62.表1特异性引物和目的片段长度
[0063][0064]
2、甘蔗种质无毒苗制备
[0065]
将来自广西省农业科学院甘蔗研究所保育的37份甘蔗种质(表2)资源种植于中国热带农业科学院内,截取4个月龄的甘蔗植株顶端生长点处的幼叶组织为外植体,经酒精及升汞消毒、无菌水冲洗后,于无菌滤纸上吸干其表面的水分后,切成1mm左右厚度的薄片接种于诱导培养基上(ms 30g/l蔗糖 8g/l agar 1-3mg/l 2.4-d),于28
°
避光条件下进行脱分化培养30天左右至诱导出愈伤组织,期间更换诱导培养基一次。将脱分化的愈伤组织转移至分化培养基(ms 30g/l蔗糖 8g/l agar 2mg/l 6-ba)上光照培养20天左右直至获得不定芽。将不定芽转移至生根培养基(1/2ms 20g/l蔗糖 4g/l agar 2mg/l naa)上光照培养60天左右获得不同甘蔗种质的可移栽的甘蔗单株,期间更换两生根培养基两次,更换培养基过程中去除小分蘖,进行单株培养直至可以移栽。将不同甘蔗种质植株室温练苗后移栽入花盆并转移至温室进行培养,保证不同甘蔗种质植株的培养环境区域一致。温室培养一
个月后,每份甘蔗种质选取10株长势较一致的植株进行编号,剪取叶片组织提取叶片总rna,通过甘蔗条纹花叶病毒(scsmv)的特异性检测引物进行检测鉴定,最终获得长势一致的37份甘蔗种质无毒幼嫩植株(图4)。
[0066]
3、scsmv病原液制备
[0067]
采集保存于防虫网内感染单一scsmv病原的甘蔗种质拔地拉植株幼嫩叶片-1, 1及 2叶(靠近芯叶能看见肥厚带的叶片为 1, 1往芯叶一侧的叶片为-1, 1往外一侧的叶片为 2叶)(图5),去除叶脉并剪碎放入烧杯,并以重量与体积比1:3的比例加入磷酸缓冲液,通过高效生物样品制备仪(mm400,德国)打磨成泛白的匀浆,再通过纱网过滤并澄清获得病原液。对制备的所有病原液进行混合后再进行等量分装,分装时通过定速搅拌器进行不停搅拌处理,使分装的病原液浓度趋于一致,每1ml病原液分装于1.5ml离心管中备用。
[0068]
4、37份甘蔗种质接种scsmv病原液
[0069]
将37份甘蔗种质的370个单株放置于阴凉的温室内,选择较为阴凉的傍晚进行scsmv接种,一份病原液接种一棵独立植株。在每份病原液中加入适量的石英砂(500-600目),上下颠倒混匀,拇指和食指蘸取病原液,搓揉植株 1叶片基部一侧至表皮擦伤,单个叶片两侧各做2个交替擦伤接种点(图6),接种完后花盆套塑料袋保湿,于第二天掀开。间隔7天左右对新长出的完整 1叶进行擦伤接种,总计重复接种三次。
[0070]
5、感病植株检测
[0071]
接种scsmv病原物2个月后,采集所有植株 1叶叶片组10mg于1.5ml无酶离心管中,加入trizol试剂,参照步骤1提取植株总rna。通过反转录试剂盒(revertaid first strand cdna synthesis kit,thermo fisher,美国)反转录获得cdna模板。通过甘蔗条纹花叶病毒(scsmv)的特异性检测引物(甘蔗重要病害分子检测技术,李文凤,2016)进行检测,统计不同甘蔗种质感病率,并各挑取3株感染scsmv的阳性植株用于病毒载量比较分析(图7)。
[0072]
6、scsmv荧光定量pcr标准曲线构建
[0073]
根据scsmv基因组序列,利用primer premier 5.0设计特异性qpcr检测引物(scsmv-qf:ctcacgccaaagtaagtcaa;scsmv-qr:tgctgttcgagttacgattc,扩增产物206bp,tm 58℃)。以步骤5中scsmv检测阳性的cdna为模板进行pcr扩增pcr扩增体系如表2所示,扩增程序为:94℃预变性5min;94℃变性30s,58℃退火30s,72℃延伸1min,35个循环;72℃延伸10min。并对扩增产物进行胶回收纯化。将pcr产物通过t-a克隆连接至pmd19-t载体,转化dh5α感受态细胞,构建重组质粒pmd19t-scsmv。提取dh5a中的pmd19t-scsmv质粒,浓度测定为171.0ng/ul,换算成拷贝数为5.40
×
108copies/ul。将标准质粒以10倍倍比稀释后(171.0
×
10-1
~171.0
×
10-10
ng/ul)进行qpcr扩增,扩增体系如表2,反应条件:50℃udg酶激活2min;95℃预变性2min;95℃变性30s,58℃退火30s,72延伸1min,共40个循环。熔解曲线条件:95℃15s,55℃1min,95℃15s。得到质粒模板不同浓度梯度在不同循环次数时的扩增曲线(图8a)。扩增产物熔解曲线显示,在熔解温度为83.8
±
0.1℃时具有单一特异性峰,说明无非特异性扩增和引物二聚体(图8b)。经拷贝数换算,其在模板量为5.40
×
107~5.40
×
101copies/ul时,呈现良好的qpcr扩增线性关系,相关系数(r2)为0.999,斜率为-3.392,标准曲线方程为标准曲线方程为y=-3.392
×
log(x) 40.19(图8c),y为荧光定量pcr扩增的ct值,代表pcr扩增的循环数,单位cycles,log(x)为以10为底x的对数,x为质粒的拷贝数,单位copies。
[0074]
表2 qpcr扩增体系
[0075][0076]
7、37份甘蔗种质scsmv定量检测及抗性等级划分
[0077]
37份不同甘蔗种质各选取3株已成功接种了scsmv的植株,每棵植株分别采集-1, 1及 2叶中部叶片组织10mg于1.5ml无酶离心管中,参照步骤1提取植株总rna,通过反转录试剂盒(revertaid first strand cdna synthesis kit,thermo fisher,美国)反转录获得cdna模板。利用步骤6的qpcr检测引物scsmv-qf/scsmv-qr对所有样品进行pcr检测(图9),并通过步骤6的标准曲线换算出单位体积样品的病毒载量。每棵植株-1, 1及 2叶单位体积病毒载量的平均值作为该植株叶片单位体积的病毒载量,每份甘蔗种质的3棵植株的病毒载量作为3个生物学重复进行统计,得到不同甘蔗种质单位体积scsmv的扩增曲线(图9和表3),计算病毒载量,通过不同甘蔗种质单位体积scsmv的病毒载量,依据关联分析的不同实际需求进行不同抗病等级的划分,如表4,病毒载量≥1
×
108copies
·
μl-1为高感,病毒载量<1
×
108,≥1
×
106为感病,病毒载量<1
×
106为中抗。
[0078]
表3不同甘蔗种质单位体积scsmv扩增曲线ct值
[0079]
[0080][0081]
表4 37份甘蔗种质scsmv抗性评价
[0082]
[0083][0084]
以上对本发明的具体实施例进行了详细描述,但其只作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对该实用进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。