1.本发明属于有机合成技术领域,具体涉及一种具有荧光特性的五配位磷杂环化合物及其合成方法。
背景技术:
2.磷杂环化合物在有机发光二极管(oleds)、有机场效应晶体管(ofets)、有机光伏电池(opvs)和光学传感器等领域具有广泛应用。然而该杂环分子的应用基本都集中在四配位磷的磷酰化合物,而关于具有独特电子结构的五配位磷杂环骨架的发展较为罕见。相关研究表明,由于五配位磷具有特殊的化学与电子特性,该类磷杂环分子有望在功能材料领域展现出特殊的应用。然而五配位磷杂环化合物合成方法的非常匮乏导致该类分子的多样性严重不足,目前关于五配位磷杂环结构与合成的报道只有以下两个工作:
3.(1)在1991年,vedejs和steck教授首次报道了通过邻乙酰氧基-邻二苯基磷酰甲苯的酰基转移合成了第一个稠环的五配位的磷杂环化合物骨架的合成方法,但是这一报道并没有引起广泛的关注。(angewandte chemie international edition.1999,38(18),2788-2791)。
[0004][0005]
(2)duan课题组在2017年进一步报道了类似五配位磷杂环化合物的合成方法。该合成方法,仅仅合成了5种不同取代的目标化合物,因此该合成方法底物适用性不够广泛,无法满足大量合成此类化合物的需求。除此之外,这个目标化合物的光学和物理性质没有被探索。(org lett.,2017,19(21),5814-5817)。
[0006][0007]
从晶体学分析来看,稠环的五配位磷杂环化合物具有高度的平面性和刚性,其中分子结构的平面性与刚性一般是导致优异的光物理性质的关键参数。因此稠环的五配位磷杂环化合物可能具有较好的荧光特性,有望在有机光电材料领域具有潜在的应用。然而,目前关于五配位磷杂环化合物的结构与合成的报道非常匮乏,而且上述的两种合成方法具有明显的不足(如底物适用性差、原料合成困难、反应温度较高等),因此,发展简单实用的合成方法制备一种具有特殊荧光特性的新型五配位磷杂环化合物具有重要的实际意义。
技术实现要素:
[0008]
本发明的目的是提供一种具有荧光特性的五配位磷杂环化合物及其合成方法。本发明利用两种缺电子磷试剂与炔的三组分反应来制备具有五配位磷中心的双磷环化合物。
[0009]
本发明提供一种具有荧光性质的双磷杂环化合物,其结构如下:
[0010][0011]
双磷杂环化合物的结构式中,ar为芳烃;r1~r5各自独立为h、d、(ch2)nch3、c(ch3)3、ar、ph、x、o(ch2)nr、ocor、osir3、(ch2)no(ch2)mr、coor的任意一种;其中x为f、cl、br、i中的一种,r为h、(ch2)ych3、c(ch3)3、ar中的一种,n、m、y各自独自为0~8的数值。
[0012]
本发明进一步提供上述双磷杂环化合物的合成方法,包括如下合成步骤:步骤1,以2-(炔基)芳香酚(i)、二取代基磷氧(ii)、一取代基次磷酸(iii)、酸酐以及碱为原料,在室温下加入有机溶剂充分溶解;步骤2,在25~100℃的条件下反应0.5~1小时;步骤3,反应结束后反应液经氧化剂处理,再分离纯化得到具有荧光特性的目标化合物双磷杂环化合物(iv)。
[0013]
所述反应的反应式如下:
[0014][0015]
上述反应式中,ar为芳烃;r1~r5各自独立为h、d、ch3、(ch2)nch3、c(ch3)3、ar、ph、x、o(ch2)nr、ocor、osir3、(ch2)no(ch2)mr、coor的任意一种;其中x为f、cl、br、i中的一种,r为h、ch3、(ch2)ych3、c(ch3)3、ar中的一种,n、m、y各自独自为0~8的数值。
[0016]
优选的,步骤1中所述的有机溶剂为:选自c1~c4的卤代烃、乙腈、四氢呋喃、苯、甲苯、dmf、二氧六环中的一种或几种混合。
[0017]
优选的,步骤1中所述的酸酐为:选自三氧化硫、五氧化二氮、五氧化二磷、乙酸酐、三氟乙酸酐、丙酸酐、甲磺酸酐、三氟甲磺酸酐、苯磺酸酐、对甲基苯磺酸酐中的一种或几种。
[0018]
进一步的,步骤1所述的有机溶剂的质量(重量)为化合物(i)质量的10~50倍。
[0019]
优选的,步骤1中所述的碱为:选自k2co3、na2co3、dabco、dbu、三乙胺、叔丁醇钾、叔丁醇钠、乙醇钠、吡啶、2,6-二甲基吡啶中的一种或几种。
[0020]
优选的,步骤3中所述的氧化剂为:选自间氯过氧苯甲酸、过氧苯甲酸、过氧化二叔丁基、过乙酸、过氧化氢、过氧化钠、过氧化钾、过氧化钙、过氧化镁、过氧化锌中的一种或多种。
[0021]
进一步的,步骤3中的分离纯化包括以下步骤:用乙酸乙酯萃取,有机层用饱和食盐水洗涤、无水硫酸钠干燥,蒸除乙酸乙酯溶剂后,经硅胶柱层析分离得到目标化合物双磷
杂环化合物(iv)。
[0022]
反应结束后反应液经氧化剂处理后,再用乙酸乙酯萃取,有机层用饱和食盐水洗涤、无水硫酸钠干燥,蒸除乙酸乙酯溶剂后,经硅胶柱层析分离纯化得到目标化合物(iv)。
[0023]
本发明的有益效果为:本发明以2-(炔基)芳香酚、二取代基磷氧、一取代基次磷酸为原料,通过直接的三组分一锅法合成一种新型双磷杂环化合物。该新型磷杂环化合物具有优异的荧光性质,在有机功能材料领域具有潜在的应用价值。
附图说明
[0024]
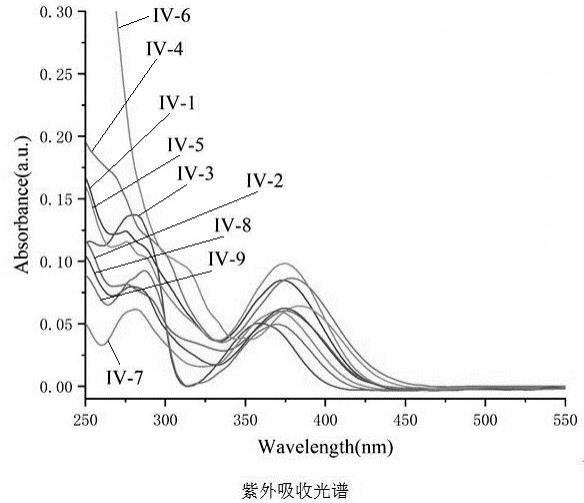
图1为实施例10中的紫外吸收光谱;
[0025]
图2为实施例10中的荧光发射光谱。
具体实施方式
[0026]
通过以下实施例进一步详细说明本发明,但是保护范围并不仅限于此。
[0027]
实施例1:
[0028]
2,3,9,9-四苯基-2-氧代-1,8-二氧杂-2,9-二磷杂-苯并[e]勿搭烯的制备
[0029][0030]
代表性的实施过程:室温下,依次向反应瓶中加入2-(苯乙炔基)苯酚化合物i-1(0.3881g,2mmol)、二苯基磷氧ii-1(0.4852g,2.4mmol)和10ml 1,2-二氯乙烷,在氩气环境下向反应瓶中加入吡啶(0.4853ml,6mmol)、三氟甲磺酸酐(1.3459ml,8mmol)和苯基次磷酸iii-1(0.5684g,4mmol)80℃反应1小时。tlc跟踪反应进度,反应结束后经双氧水氧化后用乙酸乙酯萃取,收集有机相,用饱和食盐水洗涤、无水硫酸钠干燥;蒸除乙酸乙酯溶剂,其后经硅胶柱层析分离纯化得到目标化合物iv-1 0.67g,反应总收率65%。
[0031]
黄色固体;
31
p nmr(162mhz,chloroform-d)δ22.02,-35.54;1h nmr(400mhz,chloroform-d)δ8.29
–
8.21(m,2h),7.89
–
7.81(m,2h),7.54-7.21(m,13h),7.13
–
7.06(m,4h),6.96
–
6.85(m,2h),6.59(t,j=7.6hz,1h);
13
c nmr(101mhz,chloroform-d)δ159.93(s,c),148.25(dd,j
c-p
=108.9,21.0hz,c),138.30(dd,j
c-p
=138.4,10.4hz,c),136.71(dd,j
c-p
=174.7,4.0hz,c),134.49(d,j
c-p
=163.6hz,c),133.77(d,j
c-p
=12.9hz,2ch),133.34(s,ch),133.15(dd,j
c-p
=29.3,8.6hz,c),132.10(d,j
c-p
=2.8hz,2ch),131.99(d,j
c-p
=3.7hz,2ch),131.84(d,j
c-p
=2.9hz,ch),131.35(dd,j
c-p
=20.0,3.7hz,2ch),130.08(dd,j
c-p
=144.8,2.3hz,c),129.07(s,2ch),128.87(d,j
c-p
=1.6hz,ch),128.45(d,j
c-p
=35.3hz,2ch),128.45(s,ch),128.44(s,ch),127.98(d,j
c-p
=14.0hz,2ch),127.76(d,j
c-p
=2.5hz,2ch),124.84(d,j
c-p
=17.4hz,ch),119.96(dd,j
c-p
=27.3,15.8hz,c),119.81(s,ch),113.21(d,j
c-p
=1.7hz,ch).
[0032]
实施例2:
[0033]
2,9,9-三苯基-3-(对甲苯基)-2-氧代-1,8-二氧杂-2,9-二磷杂-苯并[e]勿搭烯
的制备
[0034][0035]
代表性的实施过程:室温下,依次向反应瓶中加入2-(4
’‑
甲苯乙炔基)苯酚化合物i-2(0.4162g,2mmol)、二苯基磷氧ii-2(0.4852g,2.4mmol)和10ml 1,2-二氯乙烷,在氩气环境下向反应瓶中加入吡啶(0.4853ml,6mmol)、三氟甲磺酸酐(1.3459ml,8mmol)和苯基次磷酸iii-2(0.5684g,4mmol)80℃反应1小时。tlc跟踪反应进度,反应结束后经双氧水氧化后用乙酸乙酯萃取,收集有机相,用饱和食盐水洗涤、无水硫酸钠干燥;蒸除乙酸乙酯溶剂,其后经硅胶柱层析分离纯化得到目标化合物iv-2 0.49g,反应总收率46%。
[0036]
黄色固体;
31
p nmr(162mhz,chloroform-d)δ22.22,-35.56;1h nmr(400mhz,chloroform-d)δ8.29
–
8.19(m,2h),7.90
–
7.78(m,2h),7.57
–
7.38(m,6h),7.33
–
7.01(m,11h),6.87(d,j=8.1hz,1h),6.61(t,j=7.4hz,1h),2.35(s,3h);
13
c nmr(101mhz,chloroform-d)δ159.89(s,c),148.38(dd,j
c-p
=109.1,21.0hz,c),138.97(d,j
c-p
=1.6hz,c),137.79(dd,j
c-p
=138.4hz,10.6hz,c),136.82(dd,j
c-p
=173.7hz,2.9hz,c),135.43(s,c),133.75(d,j
c-p
=12.8hz,2ch),133.22(s,ch),132.12(s,2ch),132.00(d,j
c-p
=2.3hz,2ch),131.80(d,j
c-p
=2.0hz,ch),130.03(dd,j
c-p
=19.5,3.5hz,2ch),130.20(dd,j
c-p
=145.4hz,2.0hz,c),130.03(dd,j
c-p
=26.3,8.8hz,c),129.80(s,2ch),128.61(s,ch),128.44(s,2ch),128.26(s,ch),127.98(d,j
c-p
=14.0hz,2ch),127.71(d,j
c-p
=3.3hz,2ch),124.84(d,j
c-p
=17.6hz,ch),130.03(dd,j
c-p
=29.6,16.1hz,c),119.76(s,ch),113.19(d,j
c-p
=1.2hz,ch),21.43(s,ch3).
[0037]
实施例3:
[0038]
2,9,9-三苯基-3-(4-氟苯基)-2-氧代-1,8-二氧杂-2,9-二磷杂-苯并[e]勿搭烯的制备
[0039][0040]
代表性的实施过程:室温下,依次向反应瓶中加入2-(4
’‑
氟苯乙炔基)苯酚化合物i-3(0.4241g,2mmol)、二苯基磷氧ii-3(0.4852g,2.4mmol)和10ml 1,2-二氯乙烷,在氩气环境下向反应瓶中加入吡啶(0.4853ml,6mmol)、三氟甲磺酸酐(1.3459ml,8mmol)和苯基次磷酸iii-3(0.5684g,4mmol)80℃反应1小时。tlc跟踪反应进度,反应结束后经双氧水氧化
后用乙酸乙酯萃取,收集有机相,用饱和食盐水洗涤、无水硫酸钠干燥;蒸除乙酸乙酯溶剂,其后经硅胶柱层析分离纯化得到目标化合物iv-3 0.83g,反应总收率77%。
[0041]
黄色固体;
31
p nmr(162mhz,chloroform-d)δ21.88,-35.33(d,j=3.9hz);1h nmr(400mhz,chloroform-d)δ8.30
–
8.18(m,2h),7.89
–
7.78(m,2h),7.56
–
7.38(m,7h),7.32
–
7.21(m,3h),7.13
–
7.02(m,6h),6.98(d,j=7.8hz,1h),6.89(d,j=8.1hz,1h),6.63(t,j=7.6hz,1h);
13
c nmr(101mhz,chloroform-d)δ163.02(dd,j
c-f
=249.2,1.8hz,c),159.98(s,c),146.98(dd,j
c-p
=109.5,21.7hz,c),138.64(dd,j
c-p
=137.2,10.4hz,c),136.57(dd,j
c-p
=173.8,3.2hz,c),134.32(d,j
c-p
=163.6hz,c),133.77(d,j
c-p
=12.9hz,2ch),133.54(s,ch),132.08(d,j
c-p
=4.3hz,2ch),131.97(d,j
c-p
=3.2hz,2ch),131.95(s,ch),131.42(dd,j
c-p
=19.2,3.7hz,2ch),129.92(dd,j
c-p
=145.44,2.3hz,c),129.83(s,2ch),128.97(ddd,j
c-p j
c-f
=26.8,9.0,3.5hz,c),128.63(s,ch),128.46(s,2ch),128.29(s,ch),128.06(d,j
c-p
=14.0hz,2ch),124.62(d,j
c-p
=17.3hz,ch),119.89(s,ch),119.69(dd,j
c-p
=27.3,15.7hz,c),116.41(s,ch),116.30(d,j
c-p
=21.7hz,2ch),113.37(d,j
c-p
=1.7hz,ch).
[0042]
实施例4:
[0043]
2,9,9-三苯基-3-(4-氰苯基)-2-氧代-1,8-二氧杂-2,9-二磷杂-苯并[e]勿搭烯的制备
[0044][0045]
代表性的实施过程:室温下,依次向反应瓶中加入4-((2-羟基苯基)乙炔基)苄腈化合物i-4(0.4381g,2mmol)、二苯基磷氧ii-4(0.4852g,2.4mmol)和10ml 1,2-二氯乙烷,在氩气环境下向反应瓶中加入吡啶(0.4853ml,6mmol)、三氟甲磺酸酐(1.3459ml,8mmol)和苯基次磷酸iii-4(0.5684g,4mmol)80℃反应1小时。tlc跟踪反应进度,反应结束后经双氧水氧化后用乙酸乙酯萃取,收集有机相,用饱和食盐水洗涤、无水硫酸钠干燥;蒸除乙酸乙酯溶剂,其后经硅胶柱层析分离纯化得到目标化合物iv-4 0.81g,反应总收率75%。
[0046]
黄色固体;
31
p nmr(162mhz,chloroform-d)δ21.09,-34.78;1h nmr(400mhz,chloroform-d)δ8.31
–
8.19(m,2h),7.91
–
7.80(m,2h),7.66(d,j=7.5hz,2h),7.58
–
7.38(m,8h),7.37
–
7.27(m,2h),7.16
–
7.04(m,4h),6.91(d,j=8.2hz,1h),6.81(d,j=7.8hz,1h),6.64(t,j=7.6hz,1h);
13
c nmr(101mhz,chloroform-d)δ160.17(s,c),145.53(dd,j
c-p
=108.3,22.5hz,c),140.04(dd,j
c-p
=136.8,9.5hz,c),138.42(dd,j
c-p
=26.8,8.8hz,c),136.07(dd,j
c-p
=173.4,3.4hz,c),134.20(s,ch),136.07(d,j
c-p
=163.62hz,c),133.80(d,j
c-p
=12.9hz,2ch),132.82(s,2ch),132.26(d,j
c-p
=2.8hz,ch),132.06(d,j
c-p
=25.2hz,2ch),132.05(s,2ch),131.64(dd,j
c-p
=18.3,3.7hz,2ch),130.16(d,j
c-p
=2.3hz,c),128.72(s,ch),128.72(s,2ch),128.56(s,2ch),128.28(d,j
c-p
=14.1hz,2ch),128.17
(s,ch),124.58(d,j
c-p
=17.4hz,ch),120.18(s,ch),119.16(dd,j
c-p
=29.0,15.2hz,c),118.34(s,c),113.64(d,j
c-p
=1.8hz,ch),112.65(d,j
c-p
=1.8hz,c).
[0047]
实施例5:
[0048]
3-丁基-2,9,9-三苯基-2-氧代-1,8-二氧杂-2,9-二磷杂-苯并[e]勿搭烯的制备
[0049][0050]
代表性的实施过程:室温下,依次向反应瓶中加入2-(己炔基)苯酚化合物i-5(0.3482g,2mmol)、二苯基磷氧ii-5(0.4852g,2.4mmol)和10ml1,2-二氯乙烷,在氩气环境下向反应瓶中加入吡啶(0.4853ml,6mmol)、三氟甲磺酸酐(1.3459ml,8mmol)和苯基次磷酸iii-5(0.5684g,4mmol)80℃反应1小时。tlc跟踪反应进度,反应结束后经双氧水氧化后用乙酸乙酯萃取,收集有机相,用饱和食盐水洗涤、无水硫酸钠干燥;蒸除乙酸乙酯溶剂,其后经硅胶柱层析分离纯化得到目标化合物iv-5 0.23g,反应总收率23%。
[0051]
无色固体;
31
p nmr(162mhz,chloroform-d)δ24.23(d,j=6.4hz),-36.27(d,j=6.5hz);1h nmr(400mhz,chloroform-d)δ8.18
–
8.09(m,1h),7.81
–
7.72(m,1h),7.68(d,j=7.6hz,1h),7.51
–
7.30(m,3h),7.25
–
7.13(m,1h),6.94(dd,j=12.5,7.9hz,1h),3.02
–
2.65(m,1h),1.74
–
1.27(m,1h),0.86(t,j=7.1hz,1h);
13
c nmr(101mhz,chloroform-d)δ159.56(s,c),150.68(dd,j
c-p
=107.9,18.2hz,c),136.97(dd,j
c-p
=173.7,3.6hz,c),136.68(dd,j
c-p
=139.4,10.9hz,c),135.11(d,j
c-p
=166.65hz,c),133.36(d,j
c-p
=12.8hz,2ch),132.64(s,ch),132.13(d,j
c-p
=4.9hz,2ch),132.13(d,j
c-p
=18.2hz,2ch),131.91(d,j
c-p
=2.7hz,ch),131.13(t,j
c-p
=4.2hz,2ch),130.75(dd,j
c-p
=142.4,2.4hz,c),128.48(s,ch),128.31(s,2ch),128.13(s,ch),128.13(d,j
c-p
=14.0hz,2ch),124.97(d,j
c-p
=18.9hz,ch),120.64(dd,j
c-p
=30.6,17.3hz,c),120.17(s,ch),113.16(d,j
c-p
=1.5hz,ch),29.50(s,ch2),28.50(dd,j
c-p
=22.7,9.9hz,ch2),23.15(s,ch2),13.65(s,ch3).
[0052]
实施例6:
[0053]
2,9,9-三苯基-2-氧代-1,8-二氧杂-2,9-二磷杂-苯并[e]勿搭烯的制备
[0054][0055]
代表性的实施过程:室温下,依次向反应瓶中加入2-((三甲基硅基)乙炔基)苯酚化合物i-6(0.3802g,2mmol)、二苯基磷氧ii-6(0.4852g,2.4mmol)和10ml 1,2-二氯乙烷,在氩气环境下向反应瓶中加入吡啶(0.4853ml,6mmol)、三氟甲磺酸酐(1.3459ml,8mmol)和苯基次磷酸iii-6(0.5684g,4mmol)80℃反应1小时。tlc跟踪反应进度,反应结束后经双氧水氧化后用乙酸乙酯萃取,收集有机相,用饱和食盐水洗涤、无水硫酸钠干燥;蒸除乙酸乙酯溶剂,其后经硅胶柱层析分离纯化得到目标化合物iv-6 0.36g,反应总收率41%。
[0056]
黄色固体;
31
p nmr(162mhz,chloroform-d)δ21.98(d,j=4.3hz),-32.74(d,j=4.2hz);1h nmr(400mhz,chloroform-d)δ8.26
–
8.11(m,1h),7.76(dd,j=16.0,8.0hz,1h),7.57(d,j=8.7hz,1h),7.51
–
7.33(m,1h),7.28
–
7.14(m,1h),6.92(t,j=8.8hz,1h);
13
c nmr(101mhz,chloroform-d)δ159.83(s,c),147.07(dd,j
c-p
=133.6,5.0hz,c),135.76(dd,j
c-p
=170.9,3.5hz,c),134.29(s,ch),133.80(d,j
c-p
=165.6hz,c),133.71(d,j
c-p
=12.9hz,2ch),132.22(d,j
c-p
=1.9hz,c),132.13(s,ch),131.99(d,j
c-p
=3.6hz,2ch),131.80(d,j
c-p
=11.5hz,2ch),131.51(dd,j
c-p
=15.6,3.6hz,2ch),130.09(dd,j
c-p
=114.1,19.1hz,ch),128.63(s,ch),128.47(s,2ch),128.30(s,2ch),128.16(s,ch),123.98(d,j
c-p
=16.9hz,ch),120.44(s,ch),119.49(dd,j
c-p
=29.4,16.4hz,c),113.45(s,ch).
[0057]
实施例7:
[0058]
6-溴-2,3,9,9-四苯基-2-氧代-1,8-二氧杂-2,9-二磷杂-苯并[e]勿搭烯的制备
[0059][0060]
代表性的实施过程:室温下,依次向反应瓶中加入5-溴-2-(苯乙炔基)苯酚化合物i-7(0.5439g,2mmol)、二苯基磷氧ii-7(0.4852g,2.4mmol)和10ml 1,2-二氯乙烷,在氩气环境下向反应瓶中加入吡啶(0.4853ml,6mmol)、三氟甲磺酸酐(1.3459ml,8mmol)和苯基次磷酸iii-7(0.5684g,4mmol)80℃反应1小时。tlc跟踪反应进度,反应结束后经双氧水氧化后用乙酸乙酯萃取,收集有机相,用饱和食盐水洗涤、无水硫酸钠干燥;蒸除乙酸乙酯溶剂,其后经硅胶柱层析分离纯化得到目标化合物iv-7 0.75g,反应总收率63%。
[0061]
黄色固体;
31
p nmr(162mhz,chloroform-d)δ21.93,-34.39;1h nmr(400mhz,chloroform-d)δ8.27
–
8.15(m,2h),7.86
–
7.75(m,2h),7.57
–
7.28(m,13h),7.14
–
6.98(m,5h),6.77(d,j=8.7hz,1h);
13
c nmr(101mhz,chloroform-d)δ158.81(s,c),150.10(dd,j
c-p
=107.6,20.8hz,c),136.92(dd,j
c-p
=139.4,10.8hz,c),136.36(dd,j
c-p
=174.7,3.3hz,c),135.88(s,ch),134.13(d,j
c-p
=164.6hz,c),133.68(d,j
c-p
=13.0hz,2ch),132.49(dd,j
c-p
=25.7,8.5hz,c),132.07(d,j
c-p
=2.9hz,ch),132.01(d,j
c-p
=1.7hz,2ch),132.01(d,j
c-p
=25.3hz,2ch),131.55(dd,j
c-p
=18.4,3.7hz,2ch),129.70(dd,j
c-p
=146.5,2.3hz,c),129.38(d,j
c-p
=1.4hz,ch),129.26(s,2ch),128.72(s,ch),128.55(s,2ch),128.38(s,ch),128.10(d,j
c-p
=14.0hz,2ch),127.53(s,2ch),127.35(d,j
c-p
=17.7hz,ch),121.57(dd,j
c-p
=30.4,15.9hz,c),115.00(s,ch),111.63(s,c).
[0062]
实施例8:
[0063]
9,9-二甲基-2,3-二苯基-2-氧代-1,8-二氧杂-2,9-二磷杂-苯并[e]勿搭烯的制备
[0064][0065]
代表性的实施过程:室温下,依次向反应瓶中加入2-(苯乙炔基)苯酚化合物i-8(0.5439g,2mmol)、二甲基氧化膦ii-8(0.1873g,2.4mmol)和10ml 1,2-二氯乙烷,在氩气环境下向反应瓶中加入吡啶(0.4853ml,6mmol)、三氟甲磺酸酐(1.3459ml,8mmol)和苯基次磷酸iii-8(0.5684g,4mmol)80℃反应1小时。tlc跟踪反应进度,反应结束后经双氧水氧化后用乙酸乙酯萃取,收集有机相,用饱和食盐水洗涤、无水硫酸钠干燥;蒸除乙酸乙酯溶剂,其后经硅胶柱层析分离纯化得到目标化合物iv-8 0.24g,反应总收率31%。
[0066]
黄色固体;
31
p nmr(162mhz,chloroform-d)δ20.92(d,j=1.2hz),-19.46;1h nmr(400mhz,chloroform-d)δ7.67
–
7.60(m,2h),7.50
–
7.44(m,1h),7.41
–
7.33(m,5h),7.29
–
7.19(m,3h),6.85(d,j=7.7hz,1h),6.75(d,j=8.1hz,1h),6.55(t,j=7.6hz,1h),2.28(d,j=16.2hz,3h),2.22(d,j=16.3hz,3h);
13
c nmr(101mhz,chloroform-d)δ159.95(s,c),146.36(dd,j
c-p
=109.4,21.2hz,c),138.85(dd,j
c-p
=132.5,10.2hz,c),133.27(dd,j
c-p
=25.3,8.5hz,c),133.22(s,ch),132.03(d,j
c-p
=2.7hz,2ch),131.94(s,ch),130.90(dd,j
c-p
=144.1,1.3hz,c),129.09(s,2ch),128.74(d,j
c-p
=1.7hz,ch),128.39(d,j
c-p
=13.7hz,2ch),127.68(dd,j
c-p
=4.4,1.6hz,2ch),124.70(d,j
c-p
=17.1hz,ch),119.38(s,ch),119.26(dd,j
c-p
=30.3,15.8hz,c),113.17(d,j
c-p
=0.7hz,ch),22.80(d,j
c-p
=115.8hz,ch3),21.33(dd,j
c-p
=121.9,4.2hz,ch3).
[0067]
实施例9:
[0068]
9,9-双(3,5-二甲基苯基)-2,3-二苯基-2-氧代-1,8-二氧杂-2,9-二磷杂-苯并[e]勿搭烯的制备
[0069][0070]
代表性的实施过程:室温下,依次向反应瓶中加入2-(乙炔基)苯酚化合物i-9(0.4178g,2mmol)、双(3,5-二甲基苯基)氧化膦ii-9(0.6199g,2.4mmol)和10ml 1,2-二氯乙烷,在氩气环境下向反应瓶中加入吡啶(0.4853ml,6mmol)、三氟甲磺酸酐(1.3459ml,8mmol)和苯基次磷酸iii-9(0.5684g,4mmol)80℃反应1小时。tlc跟踪反应进度,反应结束后经双氧水氧化后用乙酸乙酯萃取,收集有机相,用饱和食盐水洗涤、无水硫酸钠干燥;蒸除乙酸乙酯溶剂,其后经硅胶柱层析分离纯化得到目标化合物iv-9 0.4592g,反应总收率40%。
[0071]
黄色固体;
31
p nmr(162mhz,chloroform-d)δ21.76,-33.86;1h nmr(400mhz,chloroform-d)δ7.83(d,j=16.2hz,2h),7.46
–
7.30(m,7h),7.29
–
7.20(m,2h),7.17
–
7.06
(m,6h),6.96(d,j=7.7hz,1h),6.88(d,j=8.2hz,1h),6.59(t,j=7.6hz,1h),2.38(s,6h),2.29(s,6h);
13
c nmr(101mhz,chloroform-d)δ160.02(s,c),147.91(dd,j
c-p
=108.9,20.8hz,c),138.43(dd,j
c-p
=137.4,10.3hz,c),138.11(s,2c),137.94(s,2c),136.18(dd,j
c-p
=170.9,3.2hz,c),134.17(d,j
c-p
=161.6,hz,c),133.37(dd,j
c-p
=25.3,8.6hz,c),133.24(d,j
c-p
=3.7hz,2ch),132.86(d,j
c-p
=3.7hz,ch),132.18(d,j
c-p
=11.2hz,2ch),131.73(d,j
c-p
=2.7hz,ch),131.12(d,j
c-p
=12.8hz,2ch),129.74(d,j
c-p
=2.2hz,c),129.40(d,j
c-p
=12.0hz,2ch),129.04(s,2ch),128.83(d,j
c-p
=1.0hz,ch),127.99(s,ch),127.92(s,ch),127.85(s,2ch),124.84(d,j
c-p
=17.2hz,ch),119.98(dd,j
c-p
=29.1,15.8hz,c),119.60(s,ch),113.34(s,ch),21.56(d,j
c-p
=0.7hz,2ch3),21.44(s,2ch3).
[0072]
实施例10:本实例为光物理性质实施实例
[0073]
1)将化合物iv-1~iv-9分别配置浓度为1
×
10-5
mol/l的二氯甲烷溶液;
[0074]
2)移取3ml化合物iv-1~iv-9的二氯甲烷溶液至比色皿中,在200~800nm的波长范围内测试化合物iv-1~iv-9的紫外吸收光谱并得出化合物iv-1~iv-9的最大吸收波长;
[0075]
3)重复上述步骤,分别在374nm、375nm、379nm、375nm、359nm、369nm、384nm、370nm、374nm波长下测试化合物iv-1~iv-9的荧光发射光谱,扫描范围为380~800nm。
[0076]
表一目标产物的紫外吸收与荧光发射数据
[0077][0078][0079]
上述的结果表明:这类五配位双磷杂环化合物不仅表现出优异的荧光特性,而且发光颜色分布广泛(从浅蓝色到橙色都有分布),是非常具有潜在应用价值的一类有机功能分子。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
