乙烯醇中间体的合成
1.背景
2.相关申请的交叉引用
3.本技术要求于2020年5月6日提交的美国临时申请号63/020,888的权益,将该申请以其全文并出于所有目的通过援引并入本文,如同在本文中完全阐述一样。
技术领域
4.本披露涉及用于合成中间体的方法,这些中间体可用于制备(1s,3'r,6'r,7's,8'e,11's,12'r)-6-氯-7'-甲氧基-11',12'-二甲基-3,4-二氢-2h,15'h-螺[萘-1,22'[20]氧杂[13]硫杂[1,14]二氮杂四环[14.7.2.0
3,6
.0
19,24
]二十五碳[8,16,18,24]四烯]-15'-酮13',13'-二氧化物(化合物a1;amg 176)、其盐或溶剂化物,以及可用于制备(1s,3'r,6'r,7'r,8'e,11's,12'r)-6-氯-7'-甲氧基-11',12'-二甲基-7'-((9ar)-八氢-2h-吡啶并[1,2-a]吡嗪-2-基甲基)-3,4-二氢-2h,15'h-螺[萘-1,22'-[20]氧杂[13]硫杂[1,14]二氮杂四环[14.7.2.0
3,6
.0
19,24
]二十五碳[8,16,18,24]四烯]-15'-酮13',13'-二氧化物(化合物a2;amg 397)、其盐或溶剂化物。这些化合物是髓细胞白血病1蛋白(mcl-1)的抑制剂。
背景技术:
[0005]
化合物(1s,3'r,6'r,7's,8'e,11's,12'r)-6-氯-7'-甲氧基-11',12'-二甲基-3,4-二氢-2h,15'h-螺[萘-1,22'[20]氧杂[13]硫杂[1,14]二氮杂四环[14.7.2.0
3,6
.0
19,24
]二十五碳[8,16,18,24]四烯]-15'-酮13',13'-二氧化物(化合物a1)可用作髓细胞白血病1(mcl-1)的抑制剂:
[0006][0007]
化合物(1s,3'r,6'r,7'r,8'e,11's,12'r)-6-氯-7'-甲氧基-11',12'-二甲基-7'-((9ar)-八氢-2h-吡啶并[1,2-a]吡嗪-2-基甲基)-3,4-二氢-2h,15'h-螺[萘-1,22'-[20]氧杂[13]硫杂[1,14]二氮杂四环[14.7.2.0
3,6
.0
19,24
]二十五碳[8,16,18,24]四烯]-15'-酮13',13'-二氧化物(化合物a2)可用作髓细胞白血病1(mcl-1)的抑制剂:
[0008][0009]
人类癌症的一个共同特征是mcl-1的过表达。mcl-1过表达阻止癌细胞经历程序性细胞死亡(细胞凋亡),使得这些细胞尽管存在广泛遗传损伤但仍存活。
[0010]
mcl-1是bcl-2蛋白质家族的成员。bcl-2家族包括促细胞凋亡成员(诸如bax和bak),这些促细胞凋亡成员在活化后在线粒体外膜中形成同源寡聚物,这导致孔形成以及线粒体内容物的逸出,这是触发细胞凋亡的步骤。bcl-2家族的抗细胞凋亡成员(诸如bcl-2、bcl-xl和mcl-1)阻断bax和bak的活性。其他蛋白质(诸如bid、bim、bik和bad)表现出另外的调节功能。研究已示出,mcl-1抑制剂可以用于治疗癌症。mcl-1在许多癌症中过表达。
[0011]
以其全文通过援引并入本文的美国专利号9,562,061披露了作为mcl-1抑制剂的化合物a1并且提供了一种用于制备其的方法。然而,需要产生更大产率和纯度的化合物a1的改进的合成方法,特别是对于商业生产化合物a1来说。
[0012]
以其全文通过援引并入本文的美国专利号10,300,075披露了作为mcl-1抑制剂的化合物a2并且提供了一种用于制备其的方法。然而,需要产生更大产率和纯度的化合物a2的改进的合成方法,特别是对于商业生产化合物a2来说。
技术实现要素:
[0013]
本文提供了用于合成化合物e、或其盐或溶剂化物的方法:
[0014][0015]
包括在有机溶剂中混合化合物c、化合物d、和zn(x3)2以形成化合物e:
[0016][0017]
其中r1是c
1-6
烷基;r2是h或c
1-3
烷氧基;x1是mgcl、mgbr、mgi、li、culi、znx2、in(i)、或in(x2)2;每个x2独立地是cl、br、或i;并且每个x3独立地是cl、br、i、otf、ots、oac、或
acac。
[0018]
在不同实施例中,r1是甲基、乙基、丙基、正丁基、或叔丁基。在一些情况下,r1是甲基、乙基、或叔丁基。
[0019]
在不同实施例中,r2是h。在不同实施例中,r2是c
1-3
烷氧基。在一些情况下,r2是甲氧基。
[0020]
在不同实施例中,x1是mgcl。在不同实施例中,x1是mgbr或mgi。在不同实施例中,x1是li。在不同实施例中,x1是culi。在不同实施例中,x1是in(i)或in(x2)2。在不同实施例中,x1是zncl或znbr。
[0021]
在不同实施例中,zn(x3)2是zncl2。在不同实施例中,zn(x3)2是znbr2。在不同实施例中,zn(x3)2是zni2。在不同实施例中,zn(x3)2是zn(otf)2或zn(ots)2。在不同实施例中,zn(x3)2是zn(oac)2或zn(acac)2。
[0022]
在不同实施例中,在混合之前将有机溶剂脱气。在不同实施例中,有机溶剂包括醚溶剂或乙腈。在一些情况下,有机溶剂选自由以下组成的组:四氢呋喃(thf)、2-甲基四氢呋喃(2-methf)、二乙醚、乙腈、1,2-二甲氧基乙烷(1,2-dme)、甲基叔丁基醚(mtbe)、环戊基甲基醚(cpme)、及其组合。在一些情况下,有机溶剂是乙腈。
[0023]
在不同实施例中,混合在10℃至35℃的温度下进行。
[0024]
在不同实施例中,混合包括(a)在有机溶剂中混合化合物c和zn(x3)2以形成悬浮液:(b)将添加到该悬浮液中以形成溶液;以及(c)将化合物d添加到该溶液中以形成化合物e。在一些情况下,在添加之前将步骤(a)的悬浮液冷却至-15℃至-5℃的温度。在一些情况下,将作为醚溶剂中的溶液添加到悬浮液中。在一些情况下,醚溶剂是thf。在一些情况下,在-10℃至0℃的温度下将添加到悬浮液中。在一些情况下,在添加化合物d之前使步骤(b)的溶液达到10℃至35℃的温度。在一些情况下,化合物d作为有机溶剂中的溶液添加,该有机溶剂选自由以下组成的组:thf、2-methf、二乙醚、乙腈、1,2-dme、mtbe、cpme、及其组合。在一些情况下,有机溶剂包括乙腈。
[0025]
在不同实施例中,化合物d和以1:2.5至1:4.5的摩尔比存在。在一些情况下,化合物d与的摩尔比是1:3.2。
[0026]
在不同实施例中,化合物d和zn(x3)2以1:2.5至1:4.0的摩尔比存在。在不同情况下,化合物d与zn(x3)2的摩尔比是1:3.1。
[0027]
在不同实施例中,化合物d和化合物c以1:1至1:2的摩尔比存在。在一些情况下,化合物d与化合物c的摩尔比是1:1.4。
[0028]
在不同实施例中,化合物d是通过在氧化剂和有机溶剂存在下氧化化合物b:制备的。在一些情况下,氧化在惰性气氛下进行。
[0029]
在不同实施例中,化合物b作为有机溶剂中的溶液提供,该有机溶剂选自由以下组
成的组:二甲基亚砜(dmso)、二氯甲烷(dcm)、二甲基甲酰胺(dmf)、thf、2-methf、乙腈甲苯、1,2-dme、mtbe、1,2-二氯乙烷(dce)、氯仿、及其组合。在一些情况下,有机溶剂是dcm。
[0030]
在不同实施例中,氧化剂选自由以下组成的组:草酰氯、漂白剂、so3/吡啶、二乙酸碘苯、三氟乙酸酐、n-氯代琥珀酰亚胺(ncs)、2-碘氧基苯甲酸(ibx)、n-甲基吗啉n-氧化物(nmo)、硝酸铈铵(can)、戴斯-马丁(dess-martin)高碘烷、氯铬酸吡啶鎓(pcc)、重铬酸吡啶鎓(pdc)、四丙基过钌酸铵(tpap)/nmo、ncs/二甲基硫醚、ncs/十二烷基硫醚、及其组合。在一些情况下,氧化剂是草酰氯。
[0031]
在不同实施例中,氧化在碱存在下进行,该碱选自由以下组成的组:三乙胺、二异丙基乙醇胺、n-甲基吡咯烷、n-乙基哌啶、吡啶、2,2,6,6-四甲基哌啶(tmp)、五甲哌啶、2,6-二甲基吡啶、及其组合。在一些情况下,碱是三乙胺。
[0032]
在不同实施例中,化合物b和氧化剂以1:1至1:3的摩尔比存在。在一些情况下,化合物b与氧化剂的摩尔比是1:1.5。
[0033]
在不同实施例中,化合物b和碱以1:3至1:10的摩尔比存在。在一些情况下,化合物b与碱的摩尔比是1:5。
[0034]
在不同实施例中,氧化在有机溶剂中进行,该有机溶剂选自由以下组成的组:二甲基亚砜(dmso)、二氯甲烷(dcm)、二甲基甲酰胺(dmf)、thf、2-methf、乙腈、mtbe、1,2-dme、甲苯、dce、cpme、及其组合。在一些情况下,有机溶剂是dmso。
[0035]
在不同实施例中,氧化在-80℃至-20℃的温度下进行。在一些情况下,氧化在-40℃的温度下进行。
[0036]
在不同实施例中,该方法进一步包括水解化合物e以形成化合物f:或其盐。
[0037]
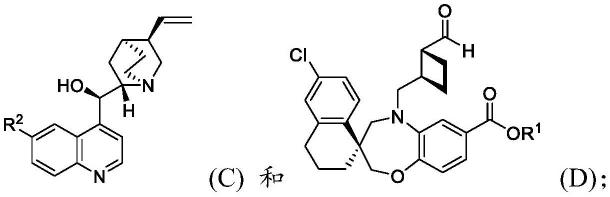
在不同实施例中,水解包括将化合物e在有机溶剂中的溶液和氢氧化物碱在水中混合以形成化合物f。
[0038]
在不同实施例中,氢氧化物碱选自由以下组成的组:naoh、koh、lioh、三甲基硅烷醇钾(tmsok)、及其组合。
[0039]
在不同实施例中,化合物e和氢氧化物碱以1:1至1:100的摩尔比存在。在一些情况下,化合物e与氢氧化物碱的摩尔比是1:3。
[0040]
在不同实施例中,有机溶剂选自由以下组成的组:甲醇、乙醇、丙醇、异丙醇、丁醇、thf、二乙醚、丙酮、乙腈、2-methf、仲丁醇、及其组合。在一些情况下,有机溶剂是乙醇。
[0041]
在不同实施例中,水解在20℃至60
°
f的温度下进行。
[0042]
在不同实施例中,化合物f呈盐形式。在一些情况下,化合物f的盐包含铵阳离子或碱金属阳离子。在一些情况下,铵阳离子选自由以下组成的组:苄铵、甲基苄铵、三甲铵、三乙铵、吗啉鎓、吡啶鎓、哌啶鎓、甲基吡啶鎓、二环己基铵、质子化的n,n'-二苄基乙二胺、2-羟乙基铵、双-(2-羟乙基)铵、三-(2-羟乙基)铵、质子化的普鲁卡因、二苄基哌啶鎓、脱氢枞
铵、n,n'-双脱氢枞铵、质子化的葡糖胺、质子化的n-甲基葡糖胺、质子化的可力丁、质子化的奎宁、质子化的喹啉、质子化的赖氨酸、质子化的精氨酸、质子化的1,4-二氮杂双环[2.2.2]辛烷(dabco)、n,n-二异丙基乙铵、及其组合。在一些情况下,铵阳离子是在一些情况下,碱金属阳离子选自由以下组成的组:锂、钠、钾、及其组合。
[0043]
在不同实施例中,化合物f的盐是通过在非极性有机溶剂中将呈其游离酸形式的化合物f(化合物f游离酸)与胺碱或碱金属碱混合以形成化合物f的盐制备的。
[0044]
在不同实施例中,化合物f游离酸和胺碱或碱金属碱以1:1至1:2的摩尔比存在。在一些情况下,化合物f游离酸与胺碱或碱金属碱的摩尔比是1:1.2。
[0045]
在不同实施例中,非极性有机溶剂选自由以下组成的组:乙酸乙酯、甲苯、乙酸异丙酯、mtbe、及其组合。在一些情况下,非极性有机溶剂是乙酸乙酯。
[0046]
在不同实施例中,(化合物f游离酸和胺碱或碱金属碱的)混合在50℃至60℃的温度下进行。在一些情况下,混合在惰性气氛中进行。
[0047]
在不同实施例中,该方法进一步包括使用化合物e合成化合物a1或其盐或溶剂化物:
[0048][0049]
在不同实施例中,该方法进一步包括使用化合物e合成化合物a2或其盐或溶剂化物:
[0050][0051]
通过阅读以下详细说明,其他方面和优点对于本领域普通技术人员将显而易见。之后的描述包括具体实施例,应理解,本披露是说明性的,并且不旨在将本发明限于本文描述的具体实施例。
具体实施方式
[0052]
本文提供了用于合成mcl-1抑制剂和相应乙烯醇中间体的方法。具体地,提供了用
于以下的方法:合成(1s,3'r,6'r,7's,8'e,11's,12'r)-6-氯-7'-甲氧基-11',12'-二甲基-3,4-二氢-2h,15'h-螺[萘-1,22'[20]氧杂[13]硫杂[1,14]二氮杂四环[14.7.2.0
3,6
.0
19,24
]二十五碳[8,16,18,24]四烯]-15'-酮13',13'-二氧化物(化合物a1)、或其盐或溶剂化物,以及合成(1s,3'r,6'r,7'r,8'e,11's,12'r)-6-氯-7'-甲氧基-11',12'-二甲基-7'-((9ar)-八氢-2h-吡啶并[1,2-a]吡嗪-2-基甲基)-3,4-二氢-2h,15'h-螺[萘-1,22'-[20]氧杂[13]硫杂[1,14]二氮杂四环[14.7.2.0
3,6
.0
19,24
]二十五碳[8,16,18,24]四烯]-15'-酮13',13'-二氧化物(化合物a2)、或其盐或溶剂化物:
[0053][0054]
以其全文通过援引并入本文的美国专利号9,562,061披露了作为mcl-1抑制剂的化合物a1、或其盐或溶剂化物并且提供了一种用于制备其的方法。该专利还披露了一种合成以下所示的用于合成化合物a1的乙烯醇中间体化合物的方法。
[0055]’061专利的乙烯醇中间体
[0056]
以其全文通过援引并入本文的美国专利号10,300,075披露了作为mcl-1抑制剂的化合物a2、或其盐或溶剂化物并且提供了一种用于制备其的方法。美国专利号10,300,075中化合物a2盐和溶剂化物的披露内容以其全文通过援引并入。该专利还披露了一种合成以上所示的用于合成化合物a2的乙烯醇中间体化合物的方法。
[0057]’061专利总体上描述了用于制备乙烯醇中间体的程序,如下面方案1中所示,其改编自’061专利第49栏的披露内容。’061专利描述了在低于室温优选0℃的温度下在溶剂中将环丁烷甲醛(中间体ii)与氧氮杂卓(中间体i)组合。添加氰基硼氢化钠,并将混合物添加到氢氧化钠溶液中,从而提供中间体iii。有利地,与’061专利的通用程序1相比,本文描述的方法提供了一种改进的合成路线,因为它可以在环境条件(例如,室温)下进行并使用更
温和的试剂。
[0058]
方案1
‑’
061专利的通用程序1
[0059][0060]’061专利进一步描述了用于合成乙烯醇中间体的方法,其包括在醛中间体至乙烯醇中间体的转化中使用二乙烯基锌试剂。以下方案2表示了合成乙烯醇的通用方法,如’061专利中描述的。
[0061]
方案2
‑’
061专利的乙烯醇中间体的合成
[0062][0063]’061专利的方法具有若干个缺点。重要地,二乙烯基锌试剂不是可商购的,并且因此必须在反应中使用之前合成。二乙烯基锌的制备需要过滤步骤以去除无机盐,由于细料堵塞,这是不可扩展的。另外,配体,也必须在反应中使用之前合成。此外,反应需要不利的低温温度并且对空气和水敏感。
[0064]
有利地,本文描述的方法利用更有利的反应条件(即可以在室温或接近室温下进行)并且试剂是更加可商购的。例如,辛可尼丁和乙烯基格氏试剂从天然和/或商业来源可获得。此外,这些方法可以在单个反应容器中进行,不需要在各步骤之间分离中间体。与’061专利的方法相比,因为消除了与制备和储存二乙烯基锌和配体有关的挑战,以及不利的反应条件,也可以获得更高的最终产物的可扩展产量。
[0065]
本文描述了用于合成化合物e或其盐或溶剂化物的方法:包括在有机溶剂中混合化合物c、化合物d、和zn(x3)2以形成化合物e:
[0066][0067]
如下面详细讨论的。如将理解的,所披露的方法涉及通过在相应的醛中间体的羰基上添加乙烯基来形成乙烯醇中间体。本文披露的形成中间体化合物(例如,化合物d、e和f,在下文中更详细地描述)的方法可以在单个反应容器中依次进行,不需要在各步骤之间分离中间体。
[0068]
本文描述的方法的通用反应方案在以下方案3中提供:
[0069]
方案3-乙烯醇中间体的合成的通用方法
[0070][0071]
氧化
[0072]
本披露的方法可以包括氧化化合物b以提供化合物d。具体地,化合物b的伯醇可以被氧化以形成化合物d的醛。在一些实施例中,氧化在惰性气氛下,例如,在氮气或氩气下进行。在一些实施例中,氧化在氮气下进行。
[0073]
如本文提供的,化合物b具有结构并且化合物d具有结构
其中r1是c
1-6
烷基。如本文所用,术语“烷基”是指直链和支链的饱和烃基。术语cn意指基团具有“n”个碳原子。例如,c3烷基是指具有3个碳原子的烷基。c
1-6
烷基是指具有涵盖整个范围(即,1至6个碳原子)以及所有子组(例如,2-6、1-5、1-4、3-6、3-5、1、2、3、4、5和6个碳原子)的碳原子数的烷基。烷基的非限制性实例包括甲基、乙基、正丙基、异丙基、正丁基、仲丁基(2-甲基丙基)、叔丁基(1,1-二甲基乙基)、正戊基和正己基。在一些实施例中,r1是甲基、乙基、正丙基、或叔丁基。在一些实施例中,r1是甲基、乙基、或叔丁基。在一些实施例中,r1是甲基。在一些实施例中,r1是乙基。在一些实施例中,r1是叔丁基。
[0074]
在一些实施例中,化合物b作为有机溶剂中的溶液提供,例如,当添加到用于氧化反应的反应容器中时。有机溶剂通常是本领域已知的。在本文描述的整个方法中可以使用的有机溶剂的非限制性实例包括乙腈、甲苯、苯、二甲苯、氯苯、氟苯、萘、三氟甲苯、四氢呋喃(thf)、四氢吡喃、二甲基甲酰胺(dmf)、四氢糠醇、二乙醚、二丁醚、二异丙醚、甲基叔丁基醚(mtbe)、2-甲基四氢呋喃(2-methf)、二甲基亚砜(dmso)、1,2-二甲氧基乙烷(1,2-dme)、1,2-二氯乙烷(1,2-dce)、1,4-二噁烷、环戊基甲基醚(cpme)、氯仿、四氯化碳、二氯甲烷(dcm)、甲醇、乙醇、丙醇和2-丙醇。
[0075]
在一些实施例中,化合物b作为有机溶剂中的溶液提供,该有机溶剂选自由以下组成的组:二甲基亚砜(dmso)、二氯甲烷(dcm)、二甲基甲酰胺(dmf)、thf、2-methf、乙腈、甲苯、1,2-dme、mtbe、1,2-二氯乙烷(1,2-dce)、氯仿、及其组合。在一些实施例中,有机溶剂是dcm。即,在一些实施例中,化合物b作为dcm中的溶液提供。
[0076]
化合物b的氧化是用氧化剂进行的。能够将伯醇氧化为醛的氧化剂通常是本领域已知的。非限制性的氧化剂包括但不限于基于铬的试剂,诸如柯林斯(collins)试剂(cro3·
py2)、氯铬酸吡啶鎓(pcc)、重铬酸吡啶鎓(pdc);锍物质(“活化的dmso”,由dmso与亲电体诸如草酰氯、碳二亚胺、或so3·
py的反应产生);高价碘化合物,诸如戴斯-马丁高碘烷(dmp)或2-碘氧基苯甲酸(ibx);在n-甲基吗啉n-氧化物(nmo)存在下催化四丙基过钌酸铵(tpap);以及在naocl(漂白剂)存在下催化2,2,6,6-四甲基哌啶-1-基)氧自由基(tempo)。
[0077]
在一些实施例中,氧化剂选自由以下组成的组:草酰氯、漂白剂、so3/吡啶、二乙酸碘苯、三氟乙酸酐、n-氯代琥珀酰亚胺(ncs)、2-碘氧基苯甲酸(ibx)、n-甲基吗啉n-氧化物(nmo)、硝酸铈铵(can)、戴斯-马丁高碘烷(dmp)、氯铬酸吡啶鎓(pcc)、重铬酸吡啶鎓(pdc)、四丙基过钌酸铵(tpap)/nmo、ncs/二甲基硫醚、ncs/十二烷基硫醚、及其组合。在一些实施例中,氧化剂是草酰氯。
[0078]
化合物b和氧化剂可以以1:1至1:3的摩尔比存在,例如,至少1:1、1:1.25、1:1.5、1:1.75、1:2、或1:2.25和/或高达1:3、1:2.75、1:2.5、1:2.25、1:2、或1:1.75,诸如1:1至1:2.5、1:1至1:2、1:1至1:1.5、1:1.25至1:2、或1:1.25至1:1.75的摩尔比。在一些实施例中,化合物b与氧化剂的摩尔比是1:1.5。
[0079]
化合物b的氧化在有机溶剂存在下进行。有机溶剂可以与化合物b的溶液中使用的有机溶剂相同或不同。在一些实施例中,氧化在有机溶剂存在下进行,该有机溶剂选自由以
下组成的组:二甲基亚砜(dmso)、二氯甲烷(dcm)、二甲基甲酰胺(dmf)、thf、2-methf、乙腈、mtbe、1,2-dme、甲苯、1,2-dce、cpme、及其组合。在一些实施例中,氧化在dmso存在下进行。在一些实施例中,氧化在dmso和dcm存在下进行。
[0080]
有机溶剂可以以5l/kg化合物b至50l/kg化合物b的量存在,例如,至少5、10、15、20、25、或30l/kg化合物b和/或高达50、45、40、35、30、25、或20l/kg化合物b,诸如10至40l/kg化合物b、15至30l/kg化合物b、或15l/kg至20l/kg化合物b。
[0081]
化合物b的氧化可以在碱存在下进行,例如,胺碱(例如,单烷基胺、二烷基胺或三烷基胺、取代或未取代的哌啶、取代或未取代的吡啶等)。在一些实施例中,碱选自由以下组成的组:三乙胺、二异丙基乙醇胺、n-甲基吡咯烷、n-乙基哌啶、吡啶、2,2,6,6-四甲基哌啶(tmp)、五甲哌啶、2,6-二甲基吡啶、及其组合。在一些实施例中,碱是三乙胺。
[0082]
当在化合物b的氧化中存在碱时,化合物b和碱可以以1:3至1:10的摩尔比存在,例如,至少1:3、1:4、1:5、1:6、或1:7,和/或高达1:10、1:9、1:8、1:7、或1:6,诸如1:3至1:9、1:5至1:10、1:4至1:8、或1:4至1:6。在一些实施例中,化合物b与碱的摩尔比是1:5。
[0083]
化合物b的氧化可以在-80℃至-20℃的温度下进行,例如至少-80℃、-70℃、-60℃、-55℃、-50℃、-45℃、或-40℃和/或高达-20℃、-25℃、-30℃、-35℃、-40℃、-50℃、或-60℃,诸如-70℃至-25℃、-60℃至-30℃、-50℃至-30℃、或-45℃至-35℃。在一些实施例中,氧化在-40℃的温度下进行。
[0084]
在一些实施例中,化合物b和/或化合物d是盐。本文描述的化合物b、化合物d、或任何其他化合物的盐可以例如通过使呈其游离酸形式(例如,当r1是h时)的化合物与合适的有机或无机碱反应,并任选地分离如此形成的盐来制备。合适的盐的非限制性实例包括碱金属阳离子,诸如锂、钠、钾、及其组合,或铵阳离子,诸如苄铵、甲基苄铵、三甲铵、三乙铵、吗啉鎓、吡啶鎓、哌啶鎓、甲基吡啶鎓、二环己基铵、质子化的n,n'-二苄基乙二胺、2-羟乙基铵、双-(2-羟乙基)铵、三-(2-羟乙基)铵、质子化的普鲁卡因、二苄基哌啶鎓、脱氢枞铵、n,n'-双脱氢枞铵、质子化的葡糖胺、质子化的n-甲基葡糖胺、质子化的可力丁、质子化的奎宁、质子化的喹啉、质子化的赖氨酸、质子化的精氨酸、质子化的1,4-二氮杂双环[2.2.2]辛烷(dabco)、n,n-二异丙基乙铵、氨基酸盐等。在一些实施例中,本文描述的化合物b、化合物d、或任何其他化合物可以例如通过使呈其游离形式的化合物与合适的有机或无机酸反应,并任选地分离如此形成的盐来制备。合适的酸盐的非限制性实例包括氢溴酸盐、盐酸盐、硫酸盐、硫酸氢盐、磺酸盐、樟脑磺酸盐、磷酸盐、硝酸盐、乙酸盐、戊酸盐、油酸盐、棕榈酸盐、硬脂酸盐、月桂酸盐、苯甲酸盐、乳酸盐、磷酸盐、甲苯磺酸盐、柠檬酸盐、马来酸盐、富马酸盐、琥珀酸盐、酒石酸盐、萘酸盐、甲磺酸盐、葡庚糖酸盐、乳糖酸盐、月桂基磺酸盐和氨基酸盐等。
[0085]
化合物b的氧化提供了化合物d,该化合物可直接进入下一步骤,不需要分离。
[0086]
乙烯醇形成
[0087]
本披露的方法包括在有机溶剂中混合化合物c、化合物d(例如,如在步骤1中制备的)、和zn(x3)2以形成化合物e:其中r1是如以上描述的,x1是
mgcl、mgbr、mgi、li、culi、znx2、in(i)、或in(x2)2;每个x2独立地是cl、br、或i;并且,每个x3独立地是cl、br、i、三氟甲磺酸酯(otf)、甲苯磺酸酯(ots)、乙酸酯(oac)、或2,4-乙酰丙酮酸酯(acac)。
[0088]
有利地,本披露的方法可以在从相应的醛(例如,化合物d)合成乙烯醇中间体(例如,化合物e)时使用可商购的试剂,从而排除了例如在美国专利号9,562,061的方法中使用的二乙烯基锌的额外的和单独的合成。
[0089]
如本文提供的,化合物c具有结构其中r2是h或c
1-3
烷氧基。在一些实施例中,r2是h(即,化合物c是辛可尼丁)。在一些实施例中,r2是c
1-3
烷氧基。如本文所用,术语“烷氧基”定义为-or,其中r是烷基。例如,r2可以是甲氧基(-och3)、乙氧基(-och2ch3)、正丙氧基(-och2ch2ch3)、或异丙氧基(-och(ch3)2)。在一些实施例中,r2是甲氧基(即,化合物c是奎宁)。
[0090]
乙烯试剂,可以是格氏试剂、有机锂试剂、有机铜酸盐试剂、有机锌试剂、或有机铟试剂中的任一种,其适合于在化合物d的醛上添加乙烯基。
[0091]
在一些实施例中,是格氏试剂。“格氏试剂”意指x1包括镁与卤素,诸如cl、br、或i。在一些实施例中,x1是mgcl。在一些实施例中,x1是mgbr或mgi。
[0092]
在一些实施例中,是有机锂试剂。例如,在一些实施例中,x1是li。在一些实施例中,是有机铜酸盐试剂。例如,在一些实施例中,x1是culi。在一些实施例中,是有机铟试剂。例如,在一些实施例中,x1是in(i)或in(x2)2。在一些实施例中,x1是in(i)。在一些实施例中,x1是in(x2)2,其中每个x2独立地是cl、br、或i。在一些实施例中,x1是incl2。在一些实施例中,x1是inbr2。在一些实施例中,x1是ini2。在一些实施例中,是有机锌试剂。例如,在一些实施例中,x1是znx2,其中x2是如本文描述的。在一些实施例中,x1是zncl或znbr。在一些实施例中,x1是zncl。在一些实施例中,x1是znbr。
[0093]
化合物d和可以以1:2.5至1:4.5的摩尔比存在,例如至少1:2.5、1:2.75、1:3、1:3.25、1:3.5、或1:3.75和/或高达1:4.5、1:4.0、1:3.75、1:3.5、1:3.25、或1:3,诸如1:2.5至1:4、1:3至1:4.5、1:3至1:4、或1:3至1:3.5。在一些实施例中,化合物d与的摩尔比是1:3.2。
[0094]
如本文提供的,这些方法包括混合zn(x3)2与化合物c、化合物d和在一些实施例中,zn(x3)2是zncl2。在一些实施例中,zn(x3)2是znbr2。在一些实施例中,zn(x3)2是zni2。在一些实施例中,zn(x3)2是zn(otf)2。在一些实施例中,zn(x3)2是zn(ots)2。在一些实施例中,zn(x3)2是zn(oac)2。在一些实施例中,zn(x3)2是zn(acac)2。
[0095]
化合物d和zn(x3)2可以以1:2.5至1:4的摩尔比存在,例如至少1:2.5、1:2.75、1:3、或1:3.25和/或高达1:4、1:3.75、1:3.5、1:3.25或1:3,诸如1:2.5至1:3.5、1:2.75至1:3.5、1:3至1:4、或1:3至1:3.5。在一些实施例中,化合物d与zn(x3)2的摩尔比是1:3.1。
[0096]
化合物c、化合物d、和zn(x3)2的混合在有机溶剂中进行。在一些实施例中,有机溶剂是醚溶剂或乙腈。醚溶剂的非限制性实例包括例如四氢呋喃(thf)、2-甲基四氢呋喃(2-methf)、四氢吡喃、四氢糠醇、二乙醚、二丁醚、二异丙醚、甲基叔丁基醚(mtbe)、1,2-二甲氧基乙烷、1,4-二噁烷、2-甲基-thf和环戊基甲基醚。在一些实施例中,有机溶剂选自由以下组成的组:四氢呋喃(thf)、2-甲基四氢呋喃(2-methf)、二乙醚、1,2-二甲氧基乙烷(1,2-dme)、甲基叔丁基醚(mtbe)、环戊基甲基醚(cpme)、及其组合。在一些实施例中,有机溶剂是乙腈。
[0097]
混合可以在10℃至35℃的温度下进行,例如至少10℃、15℃、20℃、或25℃和/或高达35℃、30℃、25℃、或20℃,例如15℃至30℃、或20℃至25℃。
[0098]
在一些实施例中,混合包括(a)在有机溶剂中混合化合物c和zn(x3)2以形成悬浮液,(b)将添加到该悬浮液中以形成溶液,以及(c)将化合物d添加到该溶液中以形成化合物e。
[0099]
在一些实施例中,在添加之前将步骤(a)的悬浮液冷却至-15℃至-5℃的温度。例如,可以将步骤(a)的悬浮液冷却至-12℃至-7℃、或-10℃至-8℃的温度。在一些实施例中,在添加之前将步骤(a)的悬浮液冷却至-10℃的温度。
[0100]
在一些实施例中,将作为醚溶剂中的溶液添加到悬浮液中,例如,四氢呋喃(thf)、2-甲基四氢呋喃(2-methf)、四氢吡喃、四氢糠醇、二乙醚、二丁醚、二异丙醚、甲基叔丁基醚(mtbe)、1,2-二甲氧基乙烷、1,4-二噁烷、2-甲基-thf、或环戊基甲基醚。在一些实施例中,将作为thf中的溶液添加到悬浮液中。
[0101]
在一些实施例中,在-10℃至0℃的温度下将添加到悬浮液中,例如至少-10℃、-9℃、-8℃、-7℃、-6℃、-5℃、或-4℃和/或高达0℃、-1℃、-2℃、-3℃、-4℃、-5℃、或-6℃,诸如-8℃至0℃、-6℃至-2℃、或-6℃至-4℃。在一些实施例中,在-5℃的温度下将添加到悬浮液中。在添加化合物d之前(例如,在添加之后)可以使步骤(b)的溶液达到10℃至35℃的温度。例如,在添加化合物d之前,可以使步骤(b)的溶液达到10℃、15℃、20℃、25℃、或30℃和/或高达35℃、30℃、25℃、20℃或15℃的温度,诸如15℃至30℃、15℃至25℃、或20℃至25℃。在一些实施例中,在添加化合物d之前使步骤(b)的溶液达到20℃的温度。
[0102]
在步骤(c)中,化合物d可以作为有机溶剂中的溶液添加。例如,化合物d可以作为有机溶剂中的溶液添加,该有机溶剂选自由以下组成的组:thf、2-methf、二乙醚、乙腈、1,2-dme、mtbe、cpme、及其组合。在一些实施例中,化合物d作为乙腈中的溶液添加。
[0103]
有机溶剂可以以5l/kg化合物d至30l/kg化合物d的量存在,例如,至少5、7、10、12、15、17、20或22l/kg化合物d和/或高达30、27、25、22、20、或15l/kg化合物d,诸如10至30l/kg化合物d、15至30l/kg化合物d、或10l/kg至20l/kg化合物d。
[0104]
在一些实施例中,化合物e是盐。化合物e的盐可以类似于如本文描述的针对化合物b或d的盐。
[0105]
化合物e:其中r1是如本文描述的,可直接进入下一步骤,不需要分离。
[0106]
酯水解和盐形成
[0107]
本披露的方法可以进一步包括水解酯化合物e以形成化合物f:或其盐。
[0108]
在一些实施例中,水解包括使用酶(例如,酶促水解)。在一些实施例中,水解包括将化合物e在有机溶剂中的溶液和氢氧化物碱在水中混合以形成化合物f。氢氧化物碱的非限制性实例包括氢氧化钠、氢氧化钾、氢氧化锂、三甲基硅烷醇钾(tmsok)。在一些实施例中,氢氧化物碱选自由以下组成的组:naoh、koh、lioh、tmsok、及其组合。在一些实施例中,氢氧化物碱是naoh。
[0109]
化合物e和氢氧化物碱可以以1:1至1:100的摩尔比存在,例如至少1:1、1:5、1:10、1:15、1:20、1:25、1:30、1:40、1:50或1:60和/或高达1:100、1:95、1:90、1:80、1:75、1:70、1:60、1:50、1:45、或1:40,诸如1:1至1:75、1:1至1:50、1:1至1:25、1:1至1:10、或1:1至1:5。在一些实施例中,化合物e与氢氧化物碱的摩尔比是1:3。
[0110]
水解可以在有机溶剂存在下进行,例如如本文描述的任何有机溶剂,诸如醚溶剂、醇溶剂(例如,甲醇、乙醇、丙醇、丁醇等)、或任何与水混溶的溶剂(例如,thf、乙腈等)。在一些实施例中,有机溶剂选自由以下组成的组:甲醇、乙醇、丙醇、异丙醇、丁醇、thf、二乙醚、丙酮、乙腈、2-methf、仲丁醇、及其组合。在一些实施例中,有机溶剂是乙醇。
[0111]
水解可以在20℃至60
°
f的温度下进行,例如,至少20℃、25℃、30℃、35℃、40℃、或45℃和/或高达60℃、55℃、50℃、45℃、40℃或35℃,诸如25℃至60℃、30℃至60℃、40℃至60℃、或50℃至60℃。在一些实施例中,水解在55℃的温度下进行。
[0112]
一旦水解完成,溶液可以冷却或以其他方式达到环境室温(例如,15℃、20℃、或25℃),此时可以用酸,诸如磷酸将反应中和到6-7的ph。
[0113]
水解可以提供呈其游离酸形式的化合物f:(f游离酸)。
[0114]
本披露的方法可以进一步包括提供呈盐形式的化合物f。例如,呈盐形式的化合物f可以具有以下结构:
[0115][0116]
在一些实施例中,化合物f的盐可以包含铵阳离子或碱金属阳离子。在一些实施例中,化合物f的盐包含碱金属阳离子,诸如锂、钠、钾、及其组合。在一些实施例中,化合物f的盐包括铵阳离子,诸如苄铵、甲基苄铵、三甲铵、三乙铵、吗啉鎓、吡啶鎓、哌啶鎓、甲基吡啶鎓、二环己基铵、质子化的n,n'-二苄基乙二胺、2-羟乙基铵、双-(2-羟乙基)铵、三-(2-羟乙基)铵、质子化的普鲁卡因、二苄基哌啶鎓、脱氢枞铵、n,n'-双脱氢枞铵、质子化的葡糖胺、质子化的n-甲基葡糖胺、质子化的可力丁、质子化的奎宁、质子化的喹啉、质子化的赖氨酸、质子化的精氨酸、质子化的1,4-二氮杂双环[2.2.2]辛烷(dabco)、n,n-二异丙基乙铵、及其组合。在一些实施例中,铵阳离子是
[0117]
化合物f的盐可以是通过在非极性有机溶剂中将呈其游离酸形式的化合物f(化合物f游离酸)与胺碱或碱金属碱混合以形成化合物f的盐(化合物f盐形式)制备的。
[0118]
胺碱的非限制性实例包括烷基胺,诸如单烷基胺、二烷基胺或三烷基胺(例如,一乙胺、二乙胺、三乙胺和n,n-二异丙基乙胺),吡啶,诸如可力丁和4-二乙基氨基吡啶(dmap),以及咪唑,诸如n-甲基咪唑,以及苄胺、甲基苄胺、吗啉、哌啶、甲基吡啶、二环己胺、n,n'-二苄基乙二胺、2-羟乙基胺、双-(2-羟乙基)胺、三-(2-羟乙基)胺、普鲁卡因、二苄基哌啶、脱氢枞胺、n,n'-双脱氢枞胺、葡糖胺、n-甲基葡糖胺、奎宁、喹啉、赖氨酸、精氨酸、1,4-二氮杂双环[2.2.2]辛烷(dabco)和n,n-二异丙基乙胺。碱金属碱的非限制性实例包括naoh、lioh和koh。
[0119]
化合物f游离酸和胺碱或碱金属碱可以以1:1至1:2的摩尔比存在,例如至少1:1、1:1.1、1:1.2、1:1.3、1:1.4、1:1.5、或1:1.6和/或高达1:2、1:1.9、1:1.8、1:1.7、1:1.6、1:1.5、或1:1.4,诸如1:1至1:7、1:1至1:5、或1:1至1:1.3。在一些实施例中,化合物f游离酸与胺碱或碱金属碱的摩尔比是1:1.2。
[0120]
化合物f游离酸可以在非极性有机溶剂中与胺碱或碱金属碱混合。在一些实施例中,非极性有机溶剂选自由以下组成的组:乙酸乙酯、甲苯、乙酸异丙酯、mtbe、及其组合。在一些实施例中,非极性有机溶剂是乙酸乙酯。
[0121]
化合物f游离酸和胺碱或碱金属碱可以在50℃至60℃的温度下混合,例如,至少50℃、52℃、55℃、或57℃和/或高达60℃、57℃、55℃、或52℃,诸如52℃至60℃、55℃至60℃、或57℃至60℃。在一些实施例中,混合在60℃的温度下进行。
[0122]
混合可以在惰性气氛中,例如,在氮气或氩气下进行。在一些实施例中,混合在氮气下进行。
[0123]
化合物f游离酸与胺碱或碱金属碱在非极性有机溶剂中的混合提供了化合物f盐
形式,其可以结晶以供以后使用,例如在化合物a1或a2的合成中。
[0124]
用于合成化合物e和f的方法可用于从化合物e和f合成化合物a1和a2。如以下方案4所示,化合物e和f可用于合成化合物a1及其盐和溶剂化物,并且如方案5所示,化合物e和f也可用于合成化合物a2及其盐和溶剂化物。
[0125]
方案4-化合物e至化合物a1的转化
[0126][0127]
如方案4所示以及美国专利号9,562,061中描述,化合物e和f可用于合成化合物a1及其盐和溶剂化物。磺酰胺ee22的合成披露于美国专利号9,562,061中。如本文描述,化合物e可用于通过将酯e转化为羧酸f来制备化合物f。如美国专利号9,562,061中所述,化合物ee22和化合物f可以反应形成化合物g。化合物g的环化可以提供羟基化合物h,然后可以将其甲基化以提供化合物a1,如美国专利号9,562,061中描述。
[0128]
方案5-化合物e至化合物a2的转化
[0129][0130]
如方案5所示以及美国专利号10,300,075中描述,化合物e和f可用于合成化合物
a2及其盐和溶剂化物。如以上关于方案4中描述,磺酰胺ee22的合成披露于美国专利号9,562,061中。同样如以上描述以及美国专利号9,562,061中所述,磺酰胺ee22和化合物f可以反应形成化合物g,该化合物可以环化以产生羟基化合物h。化合物h然后可以被氧化以提供环状烯酮i,如美国专利号10,300,075中披露的。可替代地,化合物g可以被氧化以提供化合物g的未环化的烯酮形式并且然后环化以提供环状烯酮i。然后可以使用美国专利号10,300,075中披露的程序将烯酮i转化为环氧化物j。然后环氧化物j可以与双环化合物k反应以提供羟基化合物l。最后,化合物l的甲基化可以提供化合物a2,如美国专利号10,300,075中披露的。
[0131]
在一些实施例中,这些方法进一步包括使用化合物d合成化合物a1或其盐或溶剂化物:
[0132][0133]
在一些实施例中,这些方法进一步包括使用化合物d合成化合物a2或其盐或溶剂化物:
[0134][0135]
应理解,虽然本披露结合其详细描述来阅读,但是前述描述和以下实例旨在说明且不限制本披露的范围,该范围通过所附权利要求的范围来限定。其他方面、优点和修改在以下权利要求的范围内。
[0136]
实例
[0137]
提供以下实例用于说明而不意欲限制本发明的范围。
[0138]
实例1:氧化
[0139]
根据以下反应方案制备甲基-(s)-6'-氯-5-(((1r,2r)-2-甲酰基环丁基)甲基)-3',4,4',5-四氢-2h,2'h-螺[苯并[b][1,4]氧氮杂卓-3,1'-萘]-7-甲酸酯):
[0140]
[0141]
在氮气下向1200l反应器中装入二氯甲烷(125l,15l/kg)和二甲基亚砜(dmso)(4.265kg,3当量)。将所得混合物冷却至-40℃,并在1小时内添加草酰氯(3.465kg,1.5当量),保持温度低于-35℃。将所得溶液在-35℃下搅拌30分钟,然后在0.7小时内添加化合物b(8.3kg,18.2mol,1.0当量)在二氯甲烷(38l,4.6l/kg)中的溶液,保持温度在-35℃。搅拌30分钟后,在0.7小时的时间段内在-35℃下引入三乙胺(9.20kg,5当量)。将悬浮液在-35℃下搅拌0.8小时,然后通过hplc监测反应。在-35℃下搅拌保持0.6小时,然后在18min内在-35℃下添加额外的草酰氯(462g,0.2当量)并确认完全转化。允许反应混合物温热至-13℃,并在16分钟内添加去离子水(41.5l,5l/kg),保持温度低于0℃。将所得双相溶液搅拌20min,然后允许沉降。分离各层并将有机层转移到250l搪瓷反应器中。将溶液用1n hcl(5l/kg),然后用碳酸氢钠溶液(5l/kg)并且然后氯化钠溶液(5l/kg)洗涤。将有机层经硫酸钠(8.3kg,1当量w/w%)干燥,过滤并将固体用二氯甲烷(2
×
25l,2
×
3l/kg)洗涤。在40℃下通过常压蒸馏除去二氯甲烷至最小搅拌体积并且添加乙腈(120l,15l/kg)。在40℃下在真空下继续浓缩以便除去剩余的水和二氯甲烷。化合物d以定量产量作为乙腈中的溶液获得并直接进入下一步骤。
[0142]
实例2:乙烯醇形成
[0143]
根据以下反应方案制备(s)-6'-氯-5-(((1r,2r)-2-((s)-1-羟基烯丙基)环丁基)甲基)-3',4,4',5-四氢-2h,2'h-螺[苯并[b][1,4]氧氮杂卓-3,1'-萘]-7-甲酸甲酯(化合物e):
[0144][0145]
向250l搪瓷反应器中装入乙腈(54l,13.1l/kg)。通过氮气鼓泡对溶剂进行脱气,然后向其中装入辛可尼丁(3.75kg,1.4当量),并在1至1.5小时内向悬浮液中添加氯化锌(384g,3.1当量),保持温度低于28℃。将所得溶液冷却至-10℃,并在0.8至1.2小时的时间段内在-5℃
±
5℃下添加thf中的乙烯基氯化镁溶液(15.10kg,3.2当量)。将反应混合物在0.8小时内温热至20℃,然后在20℃下在5min内添加化合物d在乙腈中的溶液(23.30kg,4.12kg纯,1.0当量)。将反应混合物在该温度下搅拌0.5小时。通过hplc监测反应。添加甲苯(26l,6.4l/kg)和1.5m柠檬酸溶液。将双相溶液搅拌20min,然后允许各层沉降。分离后,将有机层用额外的1.5m柠檬酸溶液洗涤,然后用盐水洗涤。将溶液在大气压下浓缩到80l的剩余溶液。将溶液冷却至35℃,然后转移到清洁的250l搪瓷反应器中。继续浓缩到20l的剩余体积,并且添加乙醇(85l)。继续浓缩以便除去剩余的乙腈和甲苯。化合物e作为乙醇中的溶液获得并直接进入下一步骤。
[0146]
实例3:酯水解
[0147]
根据以下反应方案制备(s)-6'-氯-5-(((1r,2r)-2-((s)-1-羟基烯丙基)环丁基)甲基)-3',4,4',5-四氢-2h,2'h-螺[苯并[b][1,4]氧氮杂卓-3,1'-萘]-7-甲酸(化合物f自
由酸):
[0148][0149]
在氮气下向250l搪瓷反应器中装入化合物e(9kg)在乙醇中的溶液。将混合物在55℃
±
5℃下加热并添加去离子水(9l,1l/kg)。在15分钟内在55℃
±
5℃下添加30.5%w/w氢氧化钠溶液(7.1kg,2.9当量)和去离子水(9l,1l/kg)的混合物。将所得溶液在55℃
±
5℃下搅拌1.7小时。通过hplc确认完全转化后,将溶液冷却至20℃
±
5℃,并在15min内在20℃
±
5℃下添加磷酸(74.7%,1.9kg,0.8当量)直到ph为6-7。添加乙酸乙酯(41l,4.7l/kg)并继续搅拌15min。允许双相混合物沉降并分离各层。将有机层用盐水洗涤两次,然后在大气压下浓缩到25l的剩余体积。添加乙酸乙酯(130l)并继续共沸蒸馏到25l的剩余体积。将混合物在氮气压力下通过厚纸过滤器过滤以除去沉淀物。将反应器和过滤器用乙酸乙酯(2
×
10l,2
×
1.1l/kg)冲洗。合并滤液并在氮气下储存在桶中。获得化合物f游离酸,直接进入下一步骤。
[0150]1h nmr(400mhz,dmso-d6)δ1.36-2.15(m,9h),2.37-2.55(m,1h)2.61-2.83(m,2h)3.16-3.35(m,2h)3.44(br s,2h)4.00(br d,j=4.15hz,3h)4.52-4.86(m,1h)4.90-5.03(m,1h)5.09-5.26(m,1h)5.63-5.85(m,1h)6.89(br d,j=8.09hz,1h)7.02
ꢀ‑
7.33(m,3h)7.40(br s,1h)7.62(br d,j=8.50hz,1h)12.13-12.98(m,1h)。lrms(esi):c
27h30
clno4 h的计算值:468.2,实测值:468.2。
[0151]
实例4:盐形成
[0152]
根据以下反应方案制备(s)-6'-氯-5-(((1r,2r)-2-((s)-1-羟基烯丙基)环丁基)甲基)-3',4,4',5-四氢-2h,2'h-螺[苯并[b][1,4]氧氮杂卓-3,1'-萘]-7-甲酸酯,(r)-1-苯基乙-1-铵盐(化合物f盐形式):
[0153][0154]
在氮气下向250l搪瓷反应器中装入乙酸乙酯中的化合物f(游离酸)溶液(44.1kg,7.88kg纯,1当量)和乙酸乙酯(39l,调整为10l/kg)。将所得溶液加热至60℃并在该温度下在13分钟内添加(r)-( )-α-甲基苄胺(2448g,1.2当量)。当反应混合物变得略微浑浊时(在添加胺的4/5之后),用化合物f盐形式作为晶种来结晶。将所得溶液在60℃
±
5℃下搅拌1小时,然后在45min内冷却至22℃
±
3℃。在真空下过滤之前,将混合物保持至少45min。将反应器和滤饼用乙酸乙酯(2
×
8l,2
×
1l/kg)洗涤并将固体在45℃下在真空下干燥过夜。筛分
后,获得化合物f盐形式。
[0155]1h nmr(400mhz,dmso-d6)δ7.60-7.69(m,3h),7.46-7.53(m,3h),7.32-7.39(m,2h),7.29(s,2h),7.20(dd,j=8.50,2.28hz,1h),7.15(d,j=2.28hz,1h),6.82(d,j=8.09hz,1h),5.78(ddd,j=17.21,10.47,5.49hz,1h),5.14-5.21(m,1h),4.94-4.99(m,1h),4.30(q,j=6.63hz,1h),3.91-4.06(m,3h),3.57(br d,j=12.02hz,1h),3.41(br d,j=14.10hz,1h),3.14-3.26(m,2h),2.65-2.81(m,2h),2.41-2.50(m,1h),1.88-2.07(m,3h),1.75-1.86(m,2h),1.68-1.77(m,1h),1.50-1.65(m,3h),1.44-1.50(m,3h);
13
c nmr(100mhz,dmso-d6)δ169.9,150.9,142.5,140.6,140.4,139.6,139.4,131.6,130.8,129.6,128.4,128.2,127.5,126.5,126.0,120.3,119.4,117.6,113.4,78.8,75.1,61.3,59.0,50.0,45.0,41.5,36.9,29.7,28.3,25.5,22.4,20.8,18.3。lrms(esi):c
27h30
clno4 h的计算值:468.2,实测值:468.2。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。