可切断的dna编码化文库
技术领域
1.本发明涉及在dna链中包含可切断的部位的dna编码化文库。
背景技术:
2.所谓化合物文库,是将医药品候选化合物等有可能具有特定活性的化合物系统性地集合而成的化合物衍生物组。该化合物文库在大多情况下是基于组合化学合成技术和方法论而合成的。所谓组合化学,是用于将基于组合论列举并设计出的一系列化合物文库通过系统性的合成途径而高效地合成出多种的实验方法及与其相关的研究领域。
3.作为基于组合化学的化合物文库的一种,有dna编码化文库。以下,将dna编码化文库适当省略为del。在del中,对经文库化的各化合物附加dna的标签。dna的标签以能鉴定各化合物的各结构的方式设计了序列,作为化合物的标记而发挥功能(专利文献1至3)。
4.就以往已知的del的dna链结构而言,双链和发夹链这两种是代表性的。
5.以下,对双链del和发夹链del的概要及优点缺点进行概述。
6.(1)发夹链del
7.采用发夹链dna的del是使用发夹型dna作为起始原料(头片段)合成的,所述发夹型dna是互补的2条dna链连接而成的单链结构,并且具有用于导入各种构筑单元(building block)的官能团(专利文献3、非专利文献1及2)。
8.(a)优点
9.(a)可使用短的dna标签。
10.本方法中,在大多情况下,使用了具有2mer的粘性末端的9~13mer程度的较短的双链dna标签,双链dna标签可通过基于dna连接酶的连接反应来导入。这样的短的dna标签的使用可通过发夹链dna在分子内牢固地形成双股链、粘性末端以外的dna部位不干扰dna标签来达成。短的双链dna标签的使用在del合成中具有若干优点。作为一个优点,可举出dna标签的合成所耗费的成本低。另外,作为另一个优点,可举出:在编码相同的反应循环数的情况下,更短的dna标签的使用可将del的全长抑制得较短。即,即使编码更多的循环数,也可将del的全长抑制至能利用新一代测序仪高效地读取dna序列的范围。实际上,在非专利文献3中,通过采用发夹链dna,构建成了采用编码多达6个循环的反应的发夹链dna的del。
11.(b)化学稳定性高
12.与双链不同,对于发夹链而言,即使双股链结构在加热反应中熔解,在后续的再退火条件下也不会发生链交换,而再度形成原本的分子内的双股链。因此,采用发夹链dna的del具有可在更广泛的化学条件下使用这样的优点(非专利文献2)。另外,通常,核酸链若为相同的链长,则发夹链比双链更牢固地形成双股链(tm值高)。因此,在导入构筑单元时的各种化学条件下,发夹链dna的各化学结构、特别是碱基部的结构与双链相比应该能抵抗结构转化。
13.(b)缺点
14.发夹链dna由于其强的双股链形成能力,因此具有下述这样的课题:难以使双股链熔解并使引物寡核苷酸结合而开始聚合酶反应,pcr效率低(专利文献4)。
15.(2)双链del
16.采用双链dna的del以具有用于导入各种构筑单元的官能团的单链dna(并非发夹链的单链dna)或双链dna为起始原料(头片段)来合成。
17.(a)缺点
18.与采用发夹链dna的del相对比,在大多情况下使用了具有4~10mer的粘性末端的20~30mer程度的较长的单链或双链dna标签(专利文献2、非专利文献4),通常是编码3个循环左右的反应的del。
19.(b)优点
20.采用双链dna的del从pcr效率的观点考虑不具有发夹链dna那样的课题。此外,与发夹链dna不同,双链dna可以通过变性而制成单链dna、或者实施链交换反应,具有可以通过转化成适合各种用途的dna结构而适应于广泛的评价方法这样的优点。例如已开发出利用了dna的双链形成能力的灵敏度比高的评价方法(非专利文献5及6)。
21.如上所述,发夹链dna和双链dna虽然各自在del的合成时、评价时具有优点,但同时实现优点的技术是未知的。
22.现有技术文献
23.专利文献
24.专利文献1:国际公开第93/20243号
25.专利文献2:国际公开第2004/039825号
26.专利文献3:国际公开第2005/058479号
27.专利文献4:国际公开第2010/094036号
28.非专利文献
29.非专利文献1:自然化学生物学(nature chemical biology),2009年,第5卷,647-654页
30.非专利文献2:dna编码化学手册(a handbook for dna-encoded chemistry),robert a.goodnow,jr.编著,john wiley&sons,inc.
31.非专利文献3:acs化学生物学(acs chemical biology),2018年,第13卷,53-59页
32.非专利文献4:自然化学(nature chemistry),2018年,第10卷,441-448页
33.非专利文献5:生物化学年鉴(annual review of biochemistry),2018年,第87卷,479-502页
34.非专利文献6:acs组合科学(acs combinatorial science),2020年,第22卷,204-212页
技术实现要素:
35.发明所要解决的课题
36.本发明提供在dna链中包含可切断的部位的del、及del的制造方法。
37.用于解决课题的手段
38.作为dna等的核酸化学中的一种,有核酸的切断技术。例如,若在dna链中导入脱氧
尿苷,则可以利用user(注册商标)酶选择性地切断。
39.本技术的发明人进行了深入研究,结果发现,通过在dna链中导入例如脱氧尿苷这样的可切断的部位,能够同时实现发夹链dna和双链dna的优点,从而完成了本发明。
40.因此,本发明如下所述。
41.[1]式(i)表示的化合物,
[0042]
[化学式1]
[0043][0044]
(式中,
[0045]
e及f各自独立地为由核苷酸或核酸类似物构成的寡聚物,
[0046]
其中,e与f包含彼此互补的碱基序列,形成双股链寡核苷酸,
[0047]
lp为环部位,
[0048]
l为接头,
[0049]
d为反应性官能团。)
[0050]
所述化合物在e、f或lp中的至少任意1个部位具有至少1个可选择性地切断的部位。
[0051]
[2]用于制备化合物文库的头片段的组合物,其包含[1]所述的化合物。
[0052]
[3]用于制备dna编码化文库的头片段的组合物,其包含[1]所述的化合物。
[0053]
[4]式(i)表示的化合物,
[0054]
[化学式2]
[0055][0056]
(式中,
[0057]
e及f各自独立地为由核苷酸或核酸类似物构成的寡聚物,
[0058]
其中,e与f包含彼此互补的碱基序列,形成双股链寡核苷酸,
[0059]
lp为环部位,
[0060]
l为接头,
[0061]
d为反应性官能团。)
[0062]
所述化合物在e、f或lp中的至少任意1个部位具有至少1个可选择性地切断的部位,
[0063]
并且,所述化合物用作化合物文库的头片段。
[0064]
[5]式(i)表示的化合物,
[0065]
[化学式3]
[0066][0067]
(式中,
[0068]
e及f各自独立地为由核苷酸或核酸类似物构成的寡聚物,
[0069]
其中,e与f包含彼此互补的碱基序列,形成双股链寡核苷酸,
[0070]
lp为环部位,
[0071]
l为接头,
[0072]
d为反应性官能团。)
[0073]
所述化合物在e、f或lp中的至少任意1个部位具有至少1个可选择性地切断的部位,
[0074]
并且,所述化合物用作dna编码化文库的头片段。
[0075]
[6]化合物文库的头片段,其为式(i)表示的化合物,
[0076]
[化学式4]
[0077][0078]
(式中,
[0079]
e及f各自独立地为由核苷酸或核酸类似物构成的寡聚物,
[0080]
其中,e与f包含彼此互补的碱基序列,形成双股链寡核苷酸,
[0081]
lp为环部位,
[0082]
l为接头,
[0083]
d为反应性官能团。)
[0084]
并且,在e、f或lp中的至少任意1个部位具有至少1个可选择性地切断的部位。
[0085]
[7]dna编码化文库的头片段,其为式(i)表示的化合物,
[0086]
[化学式5]
[0087][0088]
(式中,
[0089]
e及f各自独立地为由核苷酸或核酸类似物构成的寡聚物,
[0090]
其中,e与f包含彼此互补的碱基序列,形成双股链寡核苷酸,
[0091]
lp为环部位,
[0092]
l为接头,
[0093]
d为反应性官能团。)
[0094]
并且,在e、f或lp中的至少任意1个部位具有至少1个可选择性地切断的部位。
[0095]
[8]式(ii)表示的化合物,
[0096]
[化学式6]
[0097][0098]
(式中,
[0099]
x及y为寡核苷酸链,
[0100]
e及f各自独立地为由核苷酸或核酸类似物构成的寡聚物,
[0101]
其中,e与f包含彼此互补的碱基序列,形成双股链寡核苷酸,
[0102]
lp为环部位,
[0103]
l为接头,
[0104]
d为来自反应性官能团的2价基团,
[0105]
sp为键或2官能性间隔基团,
[0106]
an为由至少1个构筑单元构成的部分结构。)
[0107]
所述化合物中,
[0108]
x与y具有至少一部分能形成双股链的序列,
[0109]
x以5
‘
末端与e结合,
[0110]
y以3
‘
末端与f结合,
[0111]
在e、f或lp中的至少任意1个部位具有至少1个可选择性地切断的部位。
[0112]
[9]如[8]所述的化合物,其由式(iii)表示,
[0113]
an-sp-c-bn(iii)
[0114]
(式中,
[0115]
an及sp表示与[8]相同的含义,
[0116]
bn表示由寡核苷酸链x和寡核苷酸链y形成的双链寡核苷酸标签,
[0117]
c为式(i),
[0118]
[化学式7]
[0119][0120]
(式中,e、lp、l、d及f表示与[8]相同的含义,其中,d与sp结合,e和f结合于双链寡核苷酸标签bn的各个对应的末端侧。)
[0121]
[10]如[8]或[9]所述的化合物,其中,an与[8]相同,并且为由n个构筑单元α1~αn(n为1~10的整数)构建的部分结构,
[0122]
bn为由寡核苷酸链x和寡核苷酸链y形成的双链寡核苷酸标签,并且为含有包含能鉴定an的结构的碱基序列的寡核苷酸的部分结构。
[0123]
[11]如[1]、[4]、[5]、[8]~[10]中任一项所述的化合物,其中,lp为由(lp1)p-ls-(lp2)q表示的环部位,
[0124]
ls为选自以下的(a)至(c)所记载的化合物组中的部分结构,
[0125]
(a)核苷酸
[0126]
(b)核酸类似物
[0127]
(c)可具有取代基的c1~14的3价基团
[0128]
lp1为从以下的(1)及(2)所记载的化合物组中单独或不同地选择p个的各部分结构,
[0129]
(1)核苷酸
[0130]
(2)核酸类似物
[0131]
lp2为从以下的(1)及(2)所记载的化合物组中单独或不同地选择q个的各部分结构,
[0132]
(1)核苷酸
[0133]
(2)核酸类似物
[0134]
p与q的总数为0~40。
[0135]
[12]如[11]所述的化合物,其中,p与q的总数为2~20。
[0136]
[13]如[11]所述的化合物,其中,p与q的总数为2~10。
[0137]
[14]如[11]所述的化合物,其中,p与q的总数为2~7。
[0138]
[15]如[11]所述的化合物,其中,p与q的总数为0。
[0139]
[16]如[11]~[15]中任一项所述的化合物,其中,lp1、lp2及ls各自为从以下的结构中单独或不同地选择的结构,
[0140]
(a)核苷酸
[0141]
或者
[0142]
(b)将以下的(b11)至(b15)作为必要条件的核酸类似物
[0143]
(b11)具有磷酸(或相当部位)及羟基(或其相当部位),
[0144]
(b12)由碳、氢、氧、氮、磷或硫构成,
[0145]
(b13)分子量为142至1500,
[0146]
(b14)残基间原子数为3~30,
[0147]
(b15)残基间的原子的结合方式全部为单键,或者,包含1至2个双键且其余为单键。
[0148]
[17]如[11]~[16]中任一项所述的化合物,其中,lp1、lp2及ls各自为从以下的结构中单独或不同地选择的结构,
[0149]
(a)核苷酸
[0150]
或者
[0151]
(b)将以下的(b21)至(b25)作为必要条件的核酸类似物
[0152]
(b21)具有磷酸及羟基,
[0153]
(b22)由碳、氢、氧、氮或磷构成,
[0154]
(b23)分子量为142至1000,
[0155]
(b24)残基间原子数为3~15,
[0156]
(b25)残基间的原子的结合方式全部为单键。
[0157]
[18]如[11]~[17]中任一项所述的化合物,其中,lp1、lp2及ls各自为从以下的结构中单独或不同地选择的结构,
[0158]
(a)核苷酸
[0159]
或者
[0160]
(b)将以下的(b31)至(b35)作为必要条件的核酸类似物
[0161]
(b31)具有磷酸及羟基,
[0162]
(b32)由碳、氢、氧、氮或磷构成,
[0163]
(b33)分子量为142至700,
[0164]
(b34)残基间原子数为4~7,
[0165]
(b35)残基间的原子的结合方式全部为单键。
[0166]
[19]如[11]~[18]中任一项所述的化合物,其中,lp1及lp2各自为以下的任一者,
[0167]
(b41)d-spacer,
[0168]
(b5)聚亚烷基二醇磷酸酯。
[0169]
[20]如[11]~[19]中任一项所述的化合物,其中,lp1及lp2各自为二乙二醇磷酸酯或三乙二醇磷酸酯。
[0170]
[21]如[11]~[20]中任一项所述的化合物,其中,lp1及lp2各自为三乙二醇磷酸酯。
[0171]
[22]如[11]~[19]中任一项所述的化合物,其中,lp1及lp2各自为d-spacer。
[0172]
[23]如[11]~[18]中任一项所述的化合物,其中,lp1及lp2各自为核苷酸。
[0173]
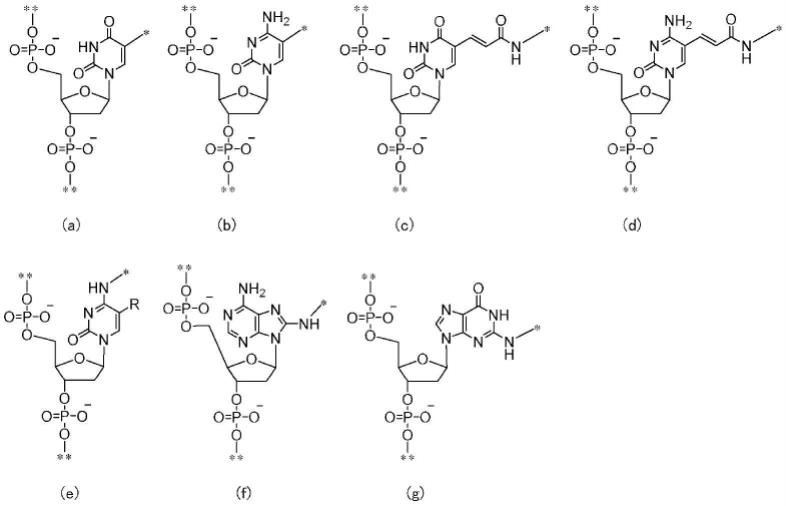
[24]如[11]~[23]中任一项所述的化合物,其中,ls为式(a)~式(g)中的任一者。
[0174]
[化学式8]
[0175][0176]
(式中,*是指与接头的结合位置,**是指与lp1或lp2的结合位置,r为氢原子或甲基。)
[0177]
[25]如[11]~[23]中任一项所述的化合物,其中,ls为式(h):
[0178]
[化学式9]
[0179][0180]
(式中,*是指与接头的结合位置,**是指与lp1或lp2的结合位置)。
[0181]
[26]如[11]~[23]中任一项所述的化合物,其中,ls为聚亚烷基二醇磷酸酯。
[0182]
[27]如[11]~[23]中任一项所述的化合物,其中,ls为式(i)~式(k):
[0183]
[化学式10]
[0184][0185]
(式中,n1、m1、p1及q1各自独立地为1~20的整数,*是指与接头的结合位置,**是指与lp1或lp2的结合位置)。
[0186]
[28]如[11]~[23]中任一项所述的化合物,其中,ls为式(l):
[0187]
[化学式11]
[0188][0189]
(式中,*是指与接头的结合位置,**是指与lp1或lp2的结合位置)。
[0190]
[29]如[11]~[23]中任一项所述的化合物,其中,ls为(b42)、(b43)或(b44)中的任一者,
[0191]
(b42)amino c6 dt
[0192]
(b43)mdc(teg-amino)
[0193]
(b44)uni-link(商标注册)氨基改性剂(amino modifier)。
[0194]
[30]如[11]~[23]中任一项所述的化合物,其中,ls为核苷酸。
[0195]
[31]如[11]~[15]及[19]~[23]中任一项所述的化合物,其中,ls为(c)可具有取代基的c1~14的3价基团,(c)为以下的结构中的任一者,
[0196]
(1)可具有取代基且可被1~3个杂原子取代的c1~10脂肪族烃,
[0197]
(2)可具有取代基的c6~14芳香族烃,
[0198]
(3)可具有取代基的c2~9芳香族杂环,或
[0199]
(4)可具有取代基的c2~9非芳香族杂环。
[0200]
[32]如[11]~[15]及[19]~[23]中任一项所述的化合物,其中,ls为(c)可具有取代基的c1~14的3价基团,(c)为以下的结构中的任一者,
[0201]
(1)可具有取代基的c1~6脂肪族烃,
[0202]
(2)可具有取代基的c6~10芳香族烃,或
[0203]
(3)可具有取代基的c2~5芳香族杂环。
[0204]
[33]如[11]~[15]及[19]~[23]中任一项所述的化合物,其中,ls为(c)可具有取代基的c1~14的3价基团,(c)为以下的结构中的任一者,
[0205]
(1)c1~6脂肪族烃,
[0206]
(2)苯,或
[0207]
(3)c2~5含氮芳香族杂环
[0208]
其中,前述(1)~(3)是未经取代的,或者可以被从取代基组st1中单独或不同地选择的1~3个取代基取代,取代基组st1为由c1~6烷基、c1~6烷氧基、氟原子及氯原子构成的组,其中,在取代基组st1对脂肪族烃进行取代的情况下,不从取代基组st1中选择烷基。
[0209]
[34]如[11]~[15]及[19]~[23]中任一项所述的化合物,其中,ls为(c)可具有取代基的c1~14的3价基团,(c)为以下的结构中的任一者,
[0210]
(1)c1~6烷基,或
[0211]
(2)未经取代或者被1个或2个c1~3烷基或c1~3烷氧基取代的苯。
[0212]
[35]如[11]~[15]及[19]~[23]中任一项所述的化合物,其中,ls为(c)可具有取代基的c1~14的3价基团,(c)为以下的结构:
[0213]
(1)c1~6烷基。
[0214]
[36]如[1]、[4]、[5]、[8]~[35]中任一项所述的化合物,其中,e及f各自独立地为
由核苷酸或核酸类似物构成的寡聚物,
[0215]
e及f的链长各自为3至40。
[0216]
[37]如[1]、[4]、[5]、[8]~[36]中任一项所述的化合物,其中,e及f各自独立地为由核苷酸或核酸类似物构成的寡聚物,
[0217]
e及f的链长各自为4至30。
[0218]
[38]如[1]、[4]、[5]、[8]~[37]中任一项所述的化合物,其中,e及f各自独立地为由核苷酸或核酸类似物构成的寡聚物,
[0219]
e及f的链长各自为6至25。
[0220]
[39]如[1]、[4]、[5]、[8]~[38]中任一项所述的化合物,其中,e及f各自独立地为由核苷酸或核酸类似物构成的寡聚物,
[0221]
e与f包含彼此互补的碱基序列,形成双股链寡核苷酸,
[0222]
e与f的双股链寡核苷酸为突出末端。
[0223]
[40]如[39]所述的化合物,其中,前述突出末端的突出部为2个碱基以上的长度。
[0224]
[41]如[1]、[4]、[5]、[8]~[38]中任一项所述的化合物,其中,e及f各自独立地为由核苷酸或核酸类似物构成的寡聚物,
[0225]
e与f包含彼此互补的碱基序列,形成双股链寡核苷酸,
[0226]
e与f的双股链寡核苷酸为平滑末端。
[0227]
[42]如[1]、[4]、[5]、[8]~[41]中任一项所述的化合物,其中,e与f中包含的、彼此互补的碱基序列的链长各自为3个碱基以上。
[0228]
[43]如[1]、[4]、[5]、[8]~[42]中任一项所述的化合物,其中,e与f中包含的、彼此互补的碱基序列的链长各自为4个碱基以上。
[0229]
[44]如[1]、[4]、[5]、[8]~[43]中任一项所述的化合物,其中,e与f中包含的、彼此互补的碱基序列的链长各自为6个碱基以上。
[0230]
[45]如[1]、[4]、[5]、[8]~[44]中任一项所述的化合物,其中,e及f各自独立地为由核苷酸构成的寡聚物。
[0231]
[46]如[1]、[4]、[5]、[8]~[45]中任一项所述的化合物,其中,核苷酸为核糖核苷酸或脱氧核糖核苷酸。
[0232]
[47]如[1]、[4]、[5]、[8]~[46]中任一项所述的化合物,其中,核苷酸为脱氧核糖核苷酸。
[0233]
[48]如[1]、[4]、[5]、[8]~[47]中任一项所述的化合物,其中,核苷酸为脱氧腺苷、脱氧鸟苷、胸苷、或脱氧胞苷。
[0234]
[49]如[1]、[4]、[5]、[8]~[44]中任一项所述的化合物,其中,e及f各自独立地为由核酸类似物构成的寡聚物。
[0235]
[50]如[1]、[4]、[5]、[8]~[49]中任一项所述的化合物,其中,l为:
[0236]
(1)可具有取代基且可被1~3个杂原子取代的c1~20脂肪族烃,或者
[0237]
(2)可具有取代基的c6~14芳香族烃。
[0238]
[51]如[1]、[4]、[5]、[8]~[50]中任一项所述的化合物,其中,l为可具有取代基的c1~6脂肪族烃、可被1个或2个氧原子取代的c1~6脂肪族烃、或者可具有取代基的c6~10芳香族烃。
[0239]
[52]如[1]、[4]、[5]、[8]~[51]中任一项所述的化合物,其中,l为可经取代基组st1取代的c1~6脂肪族烃、或可经取代基组st1取代的苯,其中,取代基组st1为由c1~6烷基、c1~6烷氧基、氟原子及氯原子构成的组(其中,在取代基组st1对脂肪族烃进行取代的情况下,不从取代基组st1中选择烷基。)。
[0240]
[53]如[1]、[4]、[5]、[8]~[52]中任一项所述的化合物,其中,l为:c1~6烷基;或者,未经取代或者被1个或2个c1~3烷基或c1~3烷氧基取代的苯。
[0241]
[54]如[1]、[4]、[5]、[8]~[53]中任一项所述的化合物,其中,l为c1~6烷基。
[0242]
[55]如[1]、[4]、[5]、[8]~[54]中任一项所述的化合物,其中,d的反应性官能团为能构成c-c、氨基、醚、羰基、酰胺、酯、脲、硫醚、二硫醚、亚砜、磺酰胺、或磺酰基键的反应性官能团。
[0243]
[56]如[1]、[4]、[5]、[8]~[55]中任一项所述的化合物,其中,d的反应性官能团为具有离去基团的c1烃、氨基、羟基、羰基的前体、硫醇基、或醛基。
[0244]
[57]如[1]、[4]、[5]、[8]~[56]中任一项所述的化合物,其中,d的反应性官能团为具有卤素原子的c1烃、具有磺酸系离去基团的c1烃、氨基、羟基、羧基、卤代羧基、硫醇基、或醛基。
[0245]
[58]如[1]、[4]、[5]、[8]~[57]中任一项所述的化合物,其中,d的反应性官能团为-ch2cl、-ch2br、-ch2oso2ch3、-ch2oso2cf3、氨基、羟基、或羧基。
[0246]
[59]如[1]、[4]、[5]、[8]~[58]中任一项所述的化合物,其中,d的反应性官能团为伯氨基。
[0247]
[60]如[1]、[4]、[5]、[8]~[59]中任一项所述的化合物,其中,可选择性地切断的部位是并非脱氧腺苷、脱氧鸟苷、胸苷、及脱氧胞苷中的任一者的脱氧核糖核苷。
[0248]
[61]如[1]、[4]、[5]、[8]~[60]中任一项所述的化合物,其中,可选择性地切断的部位为脱氧尿苷、溴脱氧尿苷、脱氧肌苷、8-羟基脱氧鸟苷、3-甲基-2
’‑
脱氧腺苷、n6-桥亚乙烯基-2
’‑
脱氧腺苷、7-甲基-2
’‑
脱氧鸟苷、2
’‑
脱氧黄苷、或5,6-二羟基-5,6二氢脱氧胸苷。
[0249]
[62]如[1]、[4]、[5]、[8]~[61]中任一项所述的化合物,其中,可选择性地切断的部位为脱氧尿苷或脱氧肌苷。
[0250]
[63]如[1]、[4]、[5]、[8]~[62]中任一项所述的化合物,其中,可选择性地切断的部位为脱氧尿苷。
[0251]
[64]如[1]、[4]、[5]、[8]~[62]中任一项所述的化合物,其中,可选择性地切断的部位为脱氧肌苷。
[0252]
[65]如[1]、[4]、[5]、[8]~[59]中任一项所述的化合物,其中,可选择性地切断的部位为从脱氧肌苷起往3
‘
方向的第2个磷酸二酯键。
[0253]
[66]如[1]、[4]、[5]、[8]~[59]中任一项所述的化合物,其中,可选择性地切断的部位为核糖核苷。
[0254]
[67]如[1]、[4]、[5]、[8]~[66]中任一项所述的化合物,其中,可选择性地切断的部位为1个。
[0255]
[68]如[1]、[4]、[5]、[8]~[66]中任一项所述的化合物,其中,e或(lp1)p中包含至少1个可切断的部位,并且f或(lp2)q中包含至少1个可切断的部位。
[0256]
[69]如[68]所述的化合物,其中,e或(lp1)p中包含的可切断的部位、与f或(lp2)q中包含的可切断的部位能够以不同的条件切断。
[0257]
[70]如[8]~[69]中任一项所述的化合物,其中,an为由n个构筑单元α1~αn(n为1~10的整数。)构建的部分结构。
[0258]
[71]如[8]~[70]中任一项所述的化合物,其中,an为低分子有机化合物。
[0259]
[72]如[8]~[71]中任一项所述的化合物,其中,an的构筑单元是分子量为500以下的化合物。
[0260]
[73]如[8]~[72]中任一项所述的化合物,其中,an的构筑单元是分子量为300以下的化合物。
[0261]
[74]如[8]~[73]中任一项所述的化合物,其中,an的构筑单元是分子量为150以下的化合物。
[0262]
[75]如[8]~[74]中任一项所述的化合物,其中,an是由从下述元素组中单独或不同地选择的元素构成的有机化合物,所述元素组由h、b、c、n、o、si、p、s、f、cl、br及i组成。
[0263]
[76]如[8]~[75]中任一项所述的化合物,其中,an为具有从由芳基、非芳香族环基、杂芳基及非芳香族杂环基组成的取代基组中单独或不同地选择的取代基的低分子有机化合物。
[0264]
[77]如[8]~[76]中任一项所述的化合物,其中,an的分子量为5000以下。
[0265]
[78]如[8]~[77]中任一项所述的化合物,其中,an的分子量为800以下。
[0266]
[79]如[8]~[78]中任一项所述的化合物,其中,an的分子量为500以下。
[0267]
[80]如[8]~[70]中任一项所述的化合物,其中,an为多肽。
[0268]
[81]如[8]~[80]中任一项所述的化合物,其中,sp为键。
[0269]
[82]如[8]~[80]中任一项所述的化合物,其中,sp为2官能性间隔基团,
[0270]
该2官能性间隔基团为spd-spl-spx,
[0271]
spd为来自能构成c-c、氨基、醚、羰基、酰胺、酯、脲、硫醚、二硫醚、亚砜、磺酰胺、或磺酰基键的反应性基团的2价基团,
[0272]
spl为聚亚烷基二醇、聚乙烯、可任选地被杂原子取代的c1~20脂肪族烃、肽、寡核苷酸、或它们的组合,
[0273]
spx为来自形成酰胺、氨基、或磺酰胺键的反应基团的2价基团。
[0274]
[83]如[8]~[81]中任一项所述的化合物,其中,sp为2官能性间隔基团,
[0275]
该2官能性间隔基团为spd-spl-spx,
[0276]
spd为来自伯氨基的2价基团,
[0277]
spl为聚乙二醇或聚乙烯,
[0278]
spx为来自羧基的2价基团。
[0279]
[84]如[8]~[83]中任一项所述的化合物,其中,寡核苷酸链x与寡核苷酸链y为能形成双股链的序列。
[0280]
[85]如[8]~[84]中任一项所述的化合物,其中,寡核苷酸链x与寡核苷酸链y包含互补的碱基序列。
[0281]
[86]如[8]~[85]中任一项所述的化合物,其中,寡核苷酸链x和寡核苷酸链y各自为1~200个碱基的长度。
[0282]
[87]如[8]~[86]中任一项所述的化合物,其中,寡核苷酸链x和寡核苷酸链y各自为3~150个碱基的长度。
[0283]
[88]如[8]~[87]中任一项所述的化合物,其中,寡核苷酸链x和寡核苷酸链y各自为30~150个碱基的长度。
[0284]
[89]如[8]~[88]中任一项所述的化合物,其中,寡核苷酸链x和寡核苷酸链y具有平滑末端。
[0285]
[90]如[8]~[88]中任一项所述的化合物,其中,寡核苷酸链x和寡核苷酸链y具有突出末端。
[0286]
[91]如[90]所述的化合物,其中,突出末端的突出部为1~30个碱基的长度。
[0287]
[92]如[90]或[91]所述的化合物,其中,突出末端的突出部为2~5个碱基的长度。
[0288]
[93]如[90]~[92]中任一项所述的化合物,其中,寡核苷酸链x和寡核苷酸链y具有突出末端,在该突出末端进一步结合特定分子识别序列。
[0289]
[94]如[8]~[93]中任一项所述的化合物,其中,在x及y中的任一者上结合有功能性分子。
[0290]
[95]如[8]~[93]中任一项所述的化合物,其中,在x及y中的任一者上结合有生物素。
[0291]
[96]化合物文库,其包含[1]、[4]、[5]、[8]~[95]中任一项所述的化合物。
[0292]
[97]dna编码化文库,其包含[1]、[4]、[5]、[8]~[95]中任一项所述的化合物。
[0293]
[98]如[96]或[97]所述的文库,其由1000种以上的不同的化合物构成。
[0294]
[99]化合物an-sp-c-bn的制造方法,
[0295]
an为由n个构筑单元α1~αn(n为2~10的整数)构建的部分结构,
[0296]
sp为键或2官能性间隔基团,
[0297]
c为具有至少一个“可选择性地切断的部位”的发夹型的头片段,
[0298]
bn为含有包含能鉴定an的结构的碱基序列的寡核苷酸的部分结构,
[0299]
所述方法包括:
[0300]
针对c,通过以下的工序得到化合物a1-sp-c-b1,
[0301]
工序(a),使α1-sp结合、或者使sp及α1结合,以及
[0302]
工序(b),使包含能鉴定α1的结构的碱基序列的寡核苷酸标签结合;
[0303]
接着,针对a(m-1)-sp-c-b(m-1)(m为2~n的整数),以m由2至n的升序重复实施以下的工序(c)及(d),由此得到化合物am-sp-c-bm,
[0304]
工序(c),使αn结合于a部分,以及
[0305]
工序(d),使包含能鉴定αn的结构的碱基序列的寡核苷酸标签结合于b部分的末端;
[0306]
所述方法中,工序(a)及(b)、工序(c)及(d)可以按任意的顺序进行。
[0307]
[100]an-sp-c-bn的制造方法,所述an-sp-c-bn为[9]~[95]中任一项所述的化合物,
[0308]
an为由n个构筑单元α1~αn(n为2~10的整数)构建的部分结构,
[0309]
sp为键或2官能性间隔基团,
[0310]
c为具有至少一个“可选择性地切断的部位”的发夹型的头片段,
[0311]
bn为含有包含能鉴定an的结构的碱基序列的寡核苷酸的部分结构,
[0312]
所述方法包括:
[0313]
针对c,通过以下的工序得到化合物a1-sp-c-b1,
[0314]
工序(a),使α1-sp结合、或者使sp及α1结合,以及
[0315]
工序(b),使包含能鉴定α1的结构的碱基序列的寡核苷酸标签结合;
[0316]
接着,针对a(m-1)-sp-c-b(m-1)(m为2~n的整数),以m由2至n的升序重复实施以下的工序(c)及(d),由此得到化合物am-sp-c-bm,
[0317]
工序(c),使αn结合于a部分,以及
[0318]
工序(d),使包含能鉴定αn的结构的碱基序列的寡核苷酸标签结合于b部分的末端;
[0319]
所述方法中,工序(a)及(b)、工序(c)及(d)可以按任意的顺序进行。
[0320]
[101]an-sp-c-bn(an、sp、c及bn表示与前述相同的含义)的制造方法,所述an-sp-c-bn为[9]~[95]中任一项所述的化合物,
[0321]
所述方法包括:
[0322]
针对c,通过以下的工序得到化合物a1-sp-c-b1,
[0323]
工序(a),使α1-sp结合、或者使sp及α1结合,以及
[0324]
工序(b),使包含能鉴定α1的结构的碱基序列的寡核苷酸标签结合;
[0325]
接着,针对a(m-1)-sp-c-b(m-1)(m为2~n的整数),以m由2至n的升序重复实施以下的工序(c)及(d),由此得到化合物am-sp-c-bm,
[0326]
工序(c),使αn结合于a部分,以及
[0327]
工序(d),使包含能鉴定αn的结构的碱基序列的寡核苷酸标签结合于b部分的末端;
[0328]
所述方法中,工序(a)及(b)、工序(c)及(d)可以按任意的顺序进行。
[0329]
[102]化合物文库的评价方法,所述化合物文库包含至少1个由式(iii)表示的化合物,
[0330]
an-sp-c-bn(iii)
[0331]
(式中,
[0332]
an为由n个构筑单元α1~αn(n为1~10的整数)构建的部分结构,
[0333]
sp为键或2官能性间隔基团,
[0334]
c为具有至少一个“可选择性地切断的部位”的发夹型的头片段,
[0335]
bn为含有包含能鉴定an的结构的碱基序列的寡核苷酸的部分结构。)
[0336]
所述方法由以下的步骤构成:
[0337]
(1)使化合物文库与生物学靶标在适合于化合物文库的至少1个文库分子与靶标结合的条件下接触,
[0338]
(2)将不与靶标结合的文库分子除去从而选出对生物学靶标具有亲和性的文库分子,
[0339]
(3)将可选择性地切断的部位切断,
[0340]
(4)对构成bn的寡核苷酸的序列进行鉴定,
[0341]
(5)使用在(4)中确定的序列对与生物学靶标结合的1种以上的化合物的结构进行
鉴定。
[0342]
[103]化合物文库的评价方法,所述化合物文库包含至少1个由式(iii)表示的[8]~[92]中任一项所述的化合物,
[0343]
an-sp-c-bn(iii)
[0344]
(式中,
[0345]
an为由n个构筑单元α1~αn(n为1~10的整数)构建的部分结构,
[0346]
sp为键或2官能性间隔基团,
[0347]
c为具有至少一个“可选择性地切断的部位”的发夹型的头片段,
[0348]
bn为含有包含能鉴定an的结构的碱基序列的寡核苷酸的部分结构。)
[0349]
所述方法由以下的步骤构成:
[0350]
(1)使化合物文库与生物学靶标在适合于化合物文库的至少1个文库分子与靶标结合的条件下接触,
[0351]
(2)将不与靶标结合的文库分子除去从而选出对生物学靶标具有亲和性的文库分子,
[0352]
(3)将可选择性地切断的部位切断,
[0353]
(4)对构成bn的寡核苷酸的序列进行鉴定,
[0354]
(5)使用在(4)中确定的序列对与生物学靶标结合的1种以上的化合物的结构进行鉴定。
[0355]
[104]如[102]或[103]所述的方法,其包括在步骤(3)与(4)之间对构成bn的寡核苷酸进行扩增的步骤。
[0356]
[105]如[102]~[104]中任一项所述的方法,其中,将可选择性地切断的部位切断的步骤是利用酶将可选择性地切断的部位切断的步骤。
[0357]
[106]如[102]~[104]中任一项所述的方法,其中,将可选择性地切断的部位切断的步骤是利用酶与化学条件变化的组合而将可选择性地切断的部位切断的步骤。
[0358]
[107]如[105]或[106]所述的方法,其中,酶选自糖基化酶及核酸酶中的至少1种。
[0359]
[108]如[107]所述的方法,其中,酶为尿嘧啶dna糖基化酶。
[0360]
[109]如[107]所述的方法,其中,酶为核酸内切酶viii。
[0361]
[110]如[107]所述的方法,其中,酶为尿嘧啶dna糖基化酶与核酸内切酶viii的组合。
[0362]
[111]如[107]所述的方法,其中,酶为烷基腺嘌呤dna糖基化酶。
[0363]
[112]如[107]所述的方法,其中,酶为核酸内切酶v。
[0364]
[113]如[106]~[112]中任一项所述的方法,其中,化学条件变化是包含水的溶液中的50~100℃的加热。
[0365]
[114]如[103]~[113]中任一项所述的方法,其中,化学条件变化是包含水的溶液中的80~95℃的加热。
[0366]
[115]如[106]~[114]中任一项所述的方法,其中,化学条件变化是ph8~13的碱性条件。
[0367]
[116]如[106]~[115]中任一项所述的方法,其中,化学条件变化是ph8~11的碱性条件。
[0368]
[117]如[106]~[116]中任一项所述的方法,其中,化学条件变化是ph9~10的碱性条件。
[0369]
[118]如[102]~[117]中任一项所述的方法,其中,在dna标签的末端附近设置可切断的部位,根据需求而将该部位切断,生成新的突出末端,在该粘性末端连接特定分子识别序列,对构成bn的寡核苷酸的序列进行鉴定。
[0370]
[119]如[118]所述的方法,其中,在dna标签的末端附近设置的可切断的部位、与c中包含的可切断的部位以不同的条件被切断。
[0371]
[120]使用与具有可切断部位及发夹结构的化合物结合的核酸、将可切断部位切断从而制成双链核酸来利用的方法。
[0372]
[121]如[120]所述的方法,其中,使用与具有可切断部位及发夹结构的化合物结合、且在化学上比双链核酸稳定的核酸,将可切断部位切断从而制成双链核酸来利用。
[0373]
[122]如[120]或[121]所述的方法,其中,使用与具有可切断部位及发夹结构的化合物结合的核酸,对前述化合物实施化学结构转化之后,将可切断部位切断从而制成双链核酸来利用。
[0374]
[123]如[120]~[122]中任一项所述的方法,其中,使用与具有可切断部位及发夹结构的化合物结合的核酸,进一步对前述核酸实施化学结构转化之后,将可切断部位切断从而制成双链核酸来利用。
[0375]
[124]如[120]~[123]中任一项所述的方法,其中,使用与具有可切断部位及发夹结构的化合物结合的核酸,进一步对前述核酸实施核酸延伸反应之后,将可切断部位切断从而制成双链核酸来利用。
[0376]
[125]如[120]~[124]中任一项所述的方法,其中,使用与具有可切断部位及发夹结构的化合物结合的核酸,将可切断部位切断从而使其可作为双链核酸来利用,实施pcr反应。
[0377]
[126]如[120]~[125]中任一项所述的方法,其用于化合物的功能性评价。
[0378]
[127]如[120]~[126]中任一项所述的方法,其用于化合物的生物活性评价。
[0379]
[128]如[120]~[127]中任一项所述的方法,其用于del。
[0380]
[129]如[120]~[124]中任一项所述的方法,其用于del的制造。
[0381]
[130]一种方法,其中,针对使用与具有可切断部位及发夹结构的化合物结合的核酸合成的del化合物,将可切断的部位切断而转化成具有单链dna的del。
[0382]
[131]一种方法,其中,针对使用与具有可切断部位及发夹结构的化合物结合的核酸合成的del化合物,将可切断的部位切断而转化成具有单链dna的del,使其与交联剂修饰dna形成双链。
[0383]
[132]一种方法,其中,针对使用与具有可切断部位及发夹结构的化合物结合的核酸合成的del化合物,将可切断的部位切断,赋予交联剂修饰引物,使所赋予的引物延伸,从而合成交联剂修饰双链del化合物。
[0384]
发明效果
[0385]
本发明中,提供在dna链中包含可切断的部位的del、及其合成用组合物,能进行便利性比以往高的del的制造。
del2、i-del3、r-del1、及bio-del)的合成步骤的概略图。将各自所对应的头片段作为原料,通过与双链寡核苷酸pr_tag及cp的2个阶段的双链连接而达成发夹del的合成。
[0398]
[图12]为示出实施例2中通过8种发夹del(u-del1、u-del2、u-del4、u-del7、u-del8、u-del9、u-del10、及h-del)、及双链del(ds-del)的实时pcr而测定的ct值的、各样品量下的曲线图。将利用user(注册商标)酶对各种del进行处理而得到的试样显示为“user( )”,将未处理的试样显示为“user(-)”。包含脱氧尿苷的可切断的发夹del(u-del1、u-del2、u-del4、u-del7、u-del8、u-del9、及u-del10)在user(注册商标)酶处理后显示出与双链del(ds-del)等同的ct值。
[0399]
[图13]为示出实施例3中6种包含脱氧尿苷的发夹del(u-del5、u-del7、u-del9、u-del11、u-del12及u-del13)的基于user(注册商标)酶的切断反应的进展的、通过变性聚丙烯酰胺凝胶电泳得到的凝胶图像。需要说明的是,图中的数字表示各泳道的编号。
[0400]
[图14]为示出实施例4中4种包含脱氧肌苷的发夹del(i-del1、i-del2、i-del3及i-del4)的基于核酸内切酶v的切断反应的进展的、通过变性聚丙烯酰胺凝胶电泳得到的凝胶图像。需要说明的是,图中的数字表示各泳道的编号。
[0401]
[图15]为示出实施例5中包含核糖核苷的发夹del(r-del1)的基于rnasehii的切断反应的进展的、通过变性聚丙烯酰胺凝胶电泳得到的凝胶图像。需要说明的是,图中的数字表示各泳道的编号。
[0402]
[图16]为示出以u-del9-hp为原料的、包含3
×3×
3(27)种化合物的模型文库的合成步骤的概略图。实施例6中,以u-del9-hp为原料,通过3次(循环a、b、c)的拆分与合并(split and pool)工序而达成模型文库的合成。另外,各循环中包括双链寡核苷酸标签的连接反应、和用于导入构筑单元的化学反应。
[0403]
[图17]为示出实施例6的模型文库合成中的各循环的连接反应的进展的、通过琼脂糖凝胶电泳得到的凝胶图像。需要说明的是,图中的数字表示各泳道的编号。
[0404]
[图18]图18的a为实施例6的模型文库合成中的、由循环c结束后的样品得到的色谱图。图18的b为实施例6的模型文库合成中的、由循环c结束后的样品得到的ms波谱的反卷积结果。
[0405]
[图19]为示出实施例6中模型文库的基于user(注册商标)酶的切断反应的进展的、通过变性聚丙烯酰胺凝胶电泳得到的凝胶图像。需要说明的是,图中的数字表示各泳道的编号。
[0406]
[图20]为示出实施例7中在3’末端具有生物素的del化合物“bio-del”的基于user(注册商标)酶的切断反应的进展的、通过变性聚丙烯酰胺凝胶电泳得到的凝胶图像。需要说明的是,图中的数字表示各泳道的编号。
[0407]
[图21]为示出实施例7中使用具有单链dna的del化合物“ss-del”及光反应性交联剂修饰引物“pxl-pr”实施引物延伸反应的结果的、通过聚丙烯酰胺凝胶电泳得到的凝胶图像。需要说明的是,图中的数字表示各泳道的编号。
具体实施方式
[0408]
如前文所述,虽然又是本领域技术人员公知的概念,但在本发明中,所谓化合物文库,是指将医药品候选化合物等有可能具有特定活性的化合物系统性地集合而成的化合物
衍生物组。该化合物文库在大多情况下是基于组合化学合成技术和方法论而合成的。所谓组合化学,是用于将基于组合论列举并设计出的一系列化合物文库通过系统性的合成途径而高效地合成出多种的实验方法及与其相关的研究领域。
[0409]
如前文所述,虽然又是本领域技术人员公知的,但作为基于组合化学的化合物文库的一种,有dna编码化文库。dna编码化文库被适当省略为del。另外,del与dna编码化化合物文库的含义也本质上相同。
[0410]
本发明中,dna编码化文库是指对经文库化的各化合物附加了dna的标签的文库。dna的标签以能鉴定各化合物的各结构的方式设计了序列,作为化合物的标记而发挥功能。
[0411]
所谓核苷酸,通常理解为在核苷上结合磷酸基而得到的物质。核苷酸、核苷是本领域技术人员公知的术语,对于核苷而言,作为一种通常的方式,理解为在五碳糖等糖的1位以糖苷键结合嘌呤碱基或嘧啶碱基等核酸碱基而得到的物质。核苷、核苷酸还是构成dna、rna等核酸的单元。
[0412]
另外,核酸也是本领域技术人员公知的概念,作为通常的方式,理解为核苷酸的聚合物。
[0413]
作为一种方式,本发明的核酸是指由后述的核苷酸及核酸类似物构成的聚合物。
[0414]
另外,本说明书中,除了由核苷酸、核酸类似物构成的核酸聚合物之外,核苷酸、核酸类似物等核酸单体有时也简单记载为核酸。后者的用法也是符合技术常识的用法,只要是本领域技术人员,就可以适宜地根据文章的前后关系来理解。
[0415]
在广义的核苷酸中,除了天然核苷酸(原本的核苷酸)之外,也包括人工核苷酸(各种核酸类似物)。
[0416]
本发明中的广义的核苷酸包括以下方式。
[0417]
(a)天然的核苷的核苷酸
[0418]
(作为该核苷的例子,可举出腺苷、胸苷、鸟苷、胞苷、尿苷、脱氧腺苷、脱氧尿苷、脱氧鸟苷、脱氧胞苷、肌苷或二氨基嘌呤脱氧核苷。)
[0419]
(b)具有核酸碱基的类似物的核苷的核苷酸
[0420]
(作为具有该核酸碱基类似物的核苷的例子,可举出2-氨基腺苷、2-硫代胸苷、吡咯并嘧啶脱氧核苷、3-甲基腺苷、c5-丙炔基胞苷、c5-丙炔基尿苷、c5-溴尿苷、c5-氟尿苷、c5-碘尿苷、c5-甲基胞苷、7-脱氮腺苷、7-脱氮鸟苷、8-氧代腺苷、8-氧代鸟苷、6-o-甲基鸟苷或2-硫代胞苷。)
[0421]
(c)具有嵌入的核酸碱基的核苷酸
[0422]
(d)具有核糖或2
’‑
脱氧核糖的非天然的核苷酸
[0423]
(e)在糖部分具有经修饰的糖的核苷酸
[0424]
(作为该经修饰的糖的例子,可举出经修饰的核糖、经修饰的2
’‑
脱氧核糖、2
’‑
o-甲基核糖、2
’‑
氟核糖、d-苏氨醇、阿拉伯糖、六碳糖、失水己糖醇、阿卓糖醇或甘露糖醇。)
[0425]
(f)核酸类似体
[0426]
(作为该核酸类似体的例子,可举出环己烷基核酸、环己烯基核酸、吗啉代核酸(pmo)、锁核酸(lna)、乙二醇核酸(gna)、苏糖核酸(tna)、丝氨醇核酸(sna)、无环苏氨醇核酸(atna)或核糖中的氧被取代而成的核酸。)
[0427]
以下,对各核酸类似体进行详细说明。
[0428]
(f1)pmo
[0429]
pmo是在糖部具有吗啉环、在磷酸二酯部位具有没有电荷的磷二酰胺结构的核酸类似体。
[0430]
(f2)lna
[0431]
lna是在糖部分具有交联结构的核酸类似体,作为最典型的例子,核糖的2
’‑
羟基通过c1~6亚烷基或c1~6杂亚烷基而与同一核糖糖的4
’‑
碳交联。作为交联结构的例子,可举出亚甲基、亚丙基、醚或氨基交联结构。
[0432]
作为典型的lna,可举出2’,4
’‑
bna(2
’‑
o,4
’‑
c-甲桥交联核酸)。
[0433]
(f3)gna
[0434]
乙二醇核酸也称为gna。例如可举出r-gna或s-gna。在该情况下,核糖被结合于磷酸二酯键的乙二醇单元取代。
[0435]
(f4)tna
[0436]
苏糖核酸也称为tna。在该情况下,核糖被α-l-苏氨酸呋喃酰基(threofuranosyl)-(3
’→2’
)取代。
[0437]
(f5)sna
[0438]
丝氨醇核酸也称为sna。在该情况下,核糖被结合于磷酸二酯键的丝氨醇单元取代。
[0439]
(f6)atna
[0440]
无环苏氨醇核酸也称为atna。例如,可举出d-atna或l-atna。在该情况下,核糖被结合于磷酸二酯键的苏氨醇单元取代。
[0441]
(f7)核糖中的氧被取代而成的糖
[0442]
作为具体例,可举出氧与s、se、或亚烷基(例如,可举出亚甲基或亚乙基)的取代物。
[0443]
(g)骨架经修饰的核苷酸
[0444]
(作为该骨架经修饰的核苷酸的例子,可举出肽核酸(该肽核酸也称为pna。在该情况下,2-氨基乙基-甘氨酸链取代核糖及磷酸二酯骨架)。)
[0445]
(h)磷酸基经修饰的核苷酸
[0446]
(作为该磷酸基经修饰的核苷酸的例子,可举出硫代磷酸酯、5
’‑
n-亚磷酰胺、硒代磷酸酯、硼烷磷酸、硼烷磷酸酯、膦酸氢酯、氨基磷酸酯(phosphoramidate)、磷二酰胺、烷基或芳基膦酸酯、磷酸三酯、交联氨基磷酸酯、交联硫代磷酸酯或交联亚甲基-膦酸酯等。)
[0447]
以下说明中的、本发明的寡核苷酸、寡核苷酸链、双链寡核苷酸、双链寡核苷酸链、及双链dna为上述定义的核苷酸。
[0448]
本发明中,在没有特别限定地记载为核苷酸的情况下,是指天然核苷酸。天然核苷酸是本领域技术人员公知的术语,只要本质上为天然存在的核苷酸,就没有特别限定。作为一种方式,本发明中的天然核苷酸为前述(a)中记载的核苷酸。
[0449]
(核酸类似物)
[0450]
所谓核酸类似物,是本领域技术人员公知的术语,对于本发明中的核酸类似物的结构而言,只要具有本发明的效果,就没有限定。
[0451]
作为一种方式,所谓核酸类似物,是前述(b)至(h)的方式的化合物。
[0452]
作为一种方式,本发明中的核酸类似物是指具有相当于核酸单体中的磷酸的部位和相当于羟基的部位的化合物。核酸类似物更优选为具有磷酸部位和羟基的化合物。
[0453]
作为一种方式,本发明中的核酸类似物是指可在核酸合成仪中作为单体来利用的化合物。虽然是本领域技术人员公知的,但在核酸合成仪中,将核酸类似物的磷酸(或相当部位)进行亚磷酰胺化,制成用保护基保护了羟基(或其相当部位)的单体来利用,由此能够合成核酸寡聚物。
[0454]
另外,核酸类似物中的除磷酸部位(或相当部位)及羟基(或相当部位)以外的部分结构可以称为核酸类似物残基。对于核酸类似物残基的结构而言,只要具有本发明的效果,就没有限定,此处,作为参照,可举出:对天然核酸(脱氧腺苷、胸苷、脱氧胞苷、脱氧鸟苷)各自的结构的特征进行确认时,分子量为322(胸苷一磷酸)至347(脱氧鸟苷一磷酸)程度,并且构成核酸链的3
‘
位的羟基氧原子至5’位的磷原子之间的原子数(包含氧原子及磷原子。以下也称为残基间原子数)为6个。另外,作为可用于核酸合成仪的核酸类似物,已知有以下核酸类似物。
[0455]
amino c6 dt分子量:476,残基原子数:6
[0456]
mdc(teg-amino)分子量:526,残基原子数:6
[0457]
uni-link(商标注册)氨基改性剂分子量:227,残基原子数:6
[0458]
(参见文献核酸研究(nucleic acids research),1992年,第20卷,6253-6259页)
[0459]
d-spacer分子量:198,残基原子数:6
[0460]
三乙二醇磷酸酯(spacer9)分子量:230,残基原子数:11
[0461]
作为参考,以下记载各核酸类似物的结构。
[0462]
[化学式12]
[0463][0464]
因此,作为一种方式,核酸类似物是特征如下的化合物(b1)。
[0465]
(b11)具有磷酸(或相当部位)及羟基(或其相当部位)。
[0466]
(b12)由碳、氢、氧、氮、磷或硫构成。
[0467]
(b13)分子量为142至1500。
[0468]
(b14)残基间原子数为5~30。
[0469]
(b15)残基间的原子的结合方式全部为单键,或者,包含1至2个双键且其余为单
键。
[0470]
作为一种方式,核酸类似物是特征如下的化合物(b2)。
[0471]
(b21)具有磷酸及羟基。
[0472]
(b22)由碳、氢、氧、氮或磷构成。
[0473]
(b23)分子量为142至1000。
[0474]
(b24)残基间原子数为5~20。
[0475]
(b25)残基间的原子的结合方式全部为单键。
[0476]
作为一种方式,核酸类似物是特征如下的化合物(b3)。
[0477]
(b31)具有磷酸及羟基。
[0478]
(b32)由碳、氢、氧、氮或磷构成。
[0479]
(b33)分子量为142至700。
[0480]
(b34)残基间原子数为5~12。
[0481]
(b35)残基间的原子的结合方式全部为单键。
[0482]
作为一种方式,核酸类似物为以下的化合物(b41)、(b42)、(b43)、(b44)、(b5)、(b51)、或(b52)。
[0483]
(b41)d-spacer
[0484]
(b42)amino c6 dt
[0485]
(b43)mdc(teg-amino)
[0486]
(b44)uni-link(商标注册)氨基改性剂
[0487]
(b5)聚亚烷基二醇磷酸酯
[0488]
(b51)二乙二醇磷酸酯或三乙二醇磷酸酯
[0489]
(b52)三乙二醇磷酸酯
[0490]
本发明中,所谓寡核苷酸及寡核苷酸链,是指在5’末端和3’末端、及5’末端与3’末端之间的内部位置具有1个以上核苷酸的核苷酸的聚合物。
[0491]
所谓彼此互补的碱基序列,是指:能够在核酸的2条寡核苷酸之间产生腺嘌呤与胸腺嘧啶(或尿嘧啶)、或鸟嘌呤与胞嘧啶这样的既定组合、形成以氢键连接的所谓的互补碱基对的核苷酸的序列。互补碱基对的形成也被称为杂交。
[0492]
需要说明的是,互补碱基对是通常被称为“沃森-克里克型碱基对”、“天然型碱基对”的概念。其中,碱基对可以为沃森-克里克型,也可以为胡斯坦型碱基对、或通过形成其他氢键基序(例如,二氨基嘌呤与t、5-甲基c与g、2-硫代胸腺嘧啶与a、6-羟基嘌呤与c、假异胞嘧啶与g)而得到的碱基对等。2条寡核苷酸是能组合成双链的序列,只要能用于本发明的目的,则对“彼此互补的碱基序列”的序列没有限制,对2个序列的同源性也没有限制。同源性按较优选的顺序优选为99%以上、98%以上、95%以上、90%以上、85%以上、80%以上、70%以上、60%以上或50%以上。
[0493]
虽然重复提及,但本发明中所谓进行杂交,是指:使包含彼此互补的碱基序列的寡核苷酸或寡核苷酸链彼此形成双链的行为、及包含互补序列的寡核苷酸或寡核苷酸链彼此形成双股链的现象。
[0494]
本发明中所谓双股链,是指2个核酸链形成了互补碱基对(进行了杂交)的状态。2个核酸链可以来自2条核酸链,也可以来自1条核酸链分子内的2个核酸序列。
[0495]
本发明中所谓双链寡核苷酸及双链寡核苷酸链,是指通过2个以上的不同的寡核苷酸链进行杂交而形成的二次结构体。2个寡核苷酸的链长可以不同,也可以具有未杂交的区域。
[0496]
需要说明的是,双链进行了杂交的区域为双股链。
[0497]
本发明中所谓双链dna,是指通过2个不同的dna链进行杂交而形成的二次结构体。各个dna链的链长可以不同,也可以具有未杂交的区域。dna链不限于天然存在的脱氧核糖核苷酸,而是指可利用dna聚合酶来扩增的所有寡核苷酸链。
[0498]
本发明中所谓“形成双股链”,在例如4~40℃的温度、水性溶剂、ph4~10这样的对寡核苷酸进行处理时的标准条件下形成双股链即可。例如,即使存在根据特定的溶剂、条件而不形成双股链的情况,只要该核酸在标准条件下形成双股链,则该核酸就是形成双股链的核酸。
[0499]
本发明中所谓tm值,是指半数的dna分子与互补链退火时的温度。
[0500]
本发明中所谓平滑末端,是指双链寡核苷酸的末端中的任一者均不突出而成对。
[0501]
本发明中所谓突出末端,是指双链寡核苷酸的末端中的一条链具有突出部。突出末端的突出部可以为任意的长度,优选为1~50个碱基的长度,更优选为1~30个碱基的长度,进一步优选为1~15个碱基的长度,最优选为2~6个碱基的长度。特定的方式中,前述突出部可作为实施粘性末端的连接时的杂交区域来使用。
[0502]
所谓pcr,是指聚合酶链式反应。pcr为寡核苷酸链的扩增手段,是本领域技术人员公知的技术。对pcr的工艺的概略进行说明时,在pcr中,(1)通过加热处理等而使扩增对象的双链寡核苷酸链解离成2条单链,(2)调整为适合于酶反应的温度之后,利用存在于反应体系中的酶(dna聚合酶等),合成与各单链互补的链。即,能够将1个双链寡核苷酸扩增为2个。在pcr中,通过温度调整而重复实施(1)和(2)的工艺,由此能够以高效率对寡核苷酸链进行扩增。
[0503]
本发明中所谓引物,是指与成为模板的寡核苷酸链进行退火、并且能模板依赖性地利用聚合酶进行延伸的寡核苷酸。
[0504]
本发明中所谓pcr用的引物序列,是指在寡核苷酸链中供引物退火的部分的序列,优选为本领域中已知的那样的适合于pcr的序列,优选存在于寡核苷酸链的末端。
[0505]
本发明中所谓切口(nick),是指在双链寡核苷酸链中、核苷酸间的结合有欠缺而寡核苷酸链发生了断裂的部分。该欠缺部的5’侧可以具有磷酸基,也可以不具有磷酸基。
[0506]
本发明中所谓空位(gap),是指在双链寡核苷酸链中缺失1个以上的连续的核苷酸、而寡核苷酸链发生分离的部分。在缺失部的5’侧可以具有磷酸基,也可以不具有磷酸基。
[0507]
本发明中所谓发夹链,是互补的2条核酸链连接而成的单链结构,发夹链、发夹链del的特征如上所述。本发明中使用的术语“发夹部位”、“发夹结构”、“发夹型”可理解为来自与前述的“发夹链”相同概念的发夹的术语。
[0508]
本发明中所谓核酸连接反应及连接,是指将核酸的末端彼此连接的反应。
[0509]
所谓基于酶的核酸连接反应及酶的连接,是指使用酶将核酸的末端彼此连接的反应。
[0510]
核酸连接反应中可使用的酶例如为dna连接酶、rna连接酶、dna聚合酶、rna聚合
酶、或拓扑异构酶。
[0511]
作为一种方式,dna连接酶是通过磷酸二酯键将dna链的末端彼此连接的酶。作为一种方式,dna连接酶可理解为属于ec编号:6.5.1.1或6.5.1.2的连接酶。dna连接酶也被称为多脱氧核糖核苷酸合酶或多核苷酸连接酶等。作为dna连接酶的例子,可举出dna连接酶i、ii、iii、iv、t4dna连接酶等。
[0512]
作为一种方式,rna连接酶是通过磷酸二酯键将rna链的末端彼此连接的酶。作为一种方式,rna连接酶可理解为属于ec编号:6.5.1.3的连接酶。另外,作为一种方式,rna连接酶属于多(核糖核苷酸):多(核糖核苷酸)连接酶的系统。rna连接酶也被称为多核糖核苷酸合酶或多核糖核苷酸连接酶。
[0513]
本发明中所谓化学连接,是指以不使用酶的方式使核酸的末端彼此结合的反应。
[0514]
在化学连接中,通过使具有化学反应上成对的官能团的核酸的末端彼此反应而形成连接部。化学反应上成对的官能团例如为:可经取代的炔基与可经取代的叠氮基的对、具有4π电子体系的可经取代的二烯(例如,可举出可经取代的1,3-不饱和化合物,例如可经取代的1,3-丁二烯、1-甲氧基-3-三甲基甲硅烷基氧基-1,3-丁二烯、环戊二烯、环己二烯或呋喃)与具有2π电子体系的可经取代的亲双烯体或可经取代的杂亲双烯体(heterodienophile)(例如,可举出可经取代的链烯基或可经取代的炔基)的对、可经取代的氨基与羧酸基的对、硫代磷酸酯基与碘基(例如,可举出3’末端的硫代磷酸酯基与5’末端的碘基)的对或磷酸基与羟基的对(例如,可举出5’末端的磷酸基与3’末端的羟基的对或5’末端的羟基与3’末端的磷酸基的对)。
[0515]
化学连接是本领域技术人员公知的概念,本领域技术人员可以基于技术常识而适宜地达成化学连接。除上述之外,也可参照人工dna(artificial dna),pna&xna,2014年,第5卷,e27896;当代化学生物学观点(current opinion in chemical biology),2015年,第26卷,80-88页等。
[0516]
本发明中所谓“可选择性地切断”,是指:在某化合物中,能够在不对化合物的其他的分子结构施加变化的情况下,以规定的条件仅将特定的部位选择性地切断。
[0517]
本发明中所谓“可选择性地切断的部位”,是指某化合物中能够以规定的条件选择性地切断的部位。
[0518]
作为一种方式,本发明中的“可选择性地切断的部位”的优选的结构为“可选择性地切断的核酸”。该部位可以是由多个核酸构成、特定的序列发挥功能而被切断的部位,也可以是由单一的核酸形成的部位。可切断的部位为核酸的情况下,从下述观点考虑是优选的:(1)可以利用核酸合成仪等已确立的制造方法,制造效率良好;(2)del的构筑单元构建的反应条件中,dna标签部分的核酸不会分解是必须的,因此,可切断的部位为核酸时仍旧不会分解;等等。
[0519]
前述“可选择性地切断的核酸”的更优选的结构为含有del的dna标签的序列中不包含的核苷酸的核酸。可切断的部位为dna标签的序列中不包含的核苷酸时,避免dna标签部分的切断,因此可不限定dna标签的序列地利用。
[0520]
作为dna标签的序列中使用的核酸,优选为脱氧腺苷、脱氧鸟苷、胸苷、及脱氧胞苷。因此,可选择性地切断的部位的优选的结构是并非脱氧腺苷、脱氧鸟苷、胸苷、及脱氧胞苷中的任一者的核酸。
[0521]
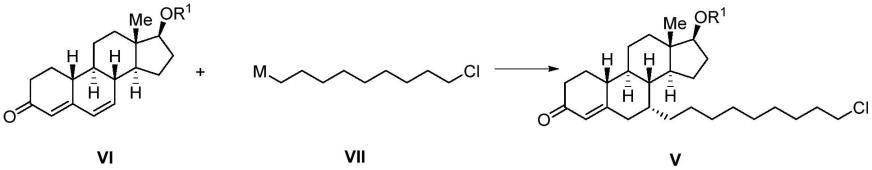
作为“可选择性地切断的部位”的例子,可举出“具有可切断的碱基的核苷酸”。例如,对于del中的“具有可切断的碱基的核苷酸”而言,通过dna糖基化酶的作用,碱基部与糖部之间的n-糖苷键被切断,留下脱碱基部位。与脱碱基部位邻接的磷酸二酯键通过化学条件变化(例如温度上升、碱性水解等)、或具有脱嘌呤/脱嘧啶(ap)核酸内切酶活性、ap裂解酶活性的酶(例如,核酸内切酶iii、核酸内切酶iv、核酸内切酶v、核酸内切酶vi、核酸内切酶vii、核酸内切酶viii、ape1(来自人的ap核酸内切酶)、fpg(甲酰胺吡啶-dna糖基化酶)等)而被切断,形成1个碱基份的空位、或切口。
[0522]
作为“具有可切断的碱基的核苷酸”的例子,可举出脱氧尿苷、溴脱氧尿苷、脱氧肌苷、8-羟基脱氧鸟苷、3-甲基-2
’‑
脱氧腺苷、n6-桥亚乙烯基-2
’‑
脱氧腺苷、7-甲基-2
’‑
脱氧鸟苷、2
’‑
脱氧黄苷、5,6-二羟基脱氧胸苷等。其他的具有可切断的碱基的核苷酸对本领域技术人员而言是清楚的。通过在del中组入这些“具有可切断的碱基的核苷酸”,并使用特异性地识别其结构的dna糖基化酶,从而可将del选择性地脱碱基。
[0523]
本发明中所谓dna糖基化酶,是具有糖基化酶活性的任意的酶,并且是识别寡核苷酸中的任意的核酸碱基部、将该碱基部与糖部之间的n-糖苷键切断而制成脱碱基部位的酶。例如,可举出尿嘧啶dna糖基化酶(识别脱氧尿苷)、烷基腺嘌呤dna糖基化酶(识别3-甲基-2
’‑
脱氧腺苷、7-甲基-2
’‑
脱氧鸟苷、及脱氧肌苷)、fpg(识别8-羟基脱氧鸟苷)、核酸内切酶viii(识别5,6-二羟基脱氧胸苷、尿嘧啶二醇等分解而成的嘧啶碱基)、sumg1(单链选择性尿嘧啶dna糖基化酶的简称,识别脱氧尿苷)等。
[0524]
本发明中,作为“可选择性地切断的部位”的更优选的例子,可举出脱氧肌苷、脱氧尿苷。
[0525]
本发明中,作为“可选择性地切断的部位”的特别优选的例子,可举出脱氧尿苷。
[0526]
作为一种方式,本发明中的“可选择性地切断的部位”优选使用酶来切断。酶通常底物特异性高,不会将del的dna标签部分、及由多个构筑单元构建的化合物部分识别成底物,而仅识别“可选择性地切断的部位”来发挥作用,因此是优选的。另外,使用前述酶的切断也可以通过在利用酶使“可选择性地切断的部位”发生结构变化之后使化学条件变化而达成。作为该酶的例子,可举出糖基化酶及核酸酶。
[0527]
本发明中所谓糖基化酶,是具有将糖苷键(糖分子与其他的有机化合物发生脱水缩合而形成的共价键)水解的功能的酶。其中,如前文所述,dna糖基化酶是识别寡核苷酸中的核酸碱基部并将其糖苷键水解的酶。
[0528]
本发明中所谓核酸酶,是具有将核酸的糖与磷酸之间的磷酸二酯键水解的功能的酶。核酸酶包括例如ap核酸内切酶、切口核酸内切酶、核糖核酸酶。
[0529]
如前文所述,ap核酸内切酶将与通过任意的dna糖基化酶的作用而生成的脱碱基部位邻接的磷酸二酯键切断。因此,本发明中,优选并用dna糖基化酶和ap核酸内切酶。
[0530]
切口核酸内切酶(例如,nb.bbvci、nb.bsmi、nb.bsrdi等)识别特定的dna序列,仅使双链中的一条链产生磷酸二酯键被切断而成的切口。另外,核酸内切酶v能够产生从脱氧肌苷起往3
‘
方向的第2个磷酸二酯键被切断而成得到切口,在本发明的实施中是有用的。
[0531]
核糖核酸酶是将rna分解的酶。本发明中,可以将核糖核苷用作“可选择性地切断的部位”,通过使核糖核酸酶起作用而加以利用。作为核糖核酸酶中的一种的rnasehii能产生组入至dna序列中的核糖核苷酸的5’侧的磷酸二酯键被切断而成的切口,在本发明的实
施中是有用的。
[0532]
本发明中所谓user(注册商标),是指“uracil-specific excision reagent”酶(enzyme)。user是将尿嘧啶除去的核酸内切酶混合物,其包含尿嘧啶dna糖基化酶(udg)和核酸内切酶viii。user将双链dna中的尿嘧啶除去而产生1个碱基的空位,将dna链切断。在利用user的工艺中,首先,udg将尿嘧啶碱基除去而形成脱碱基部位。接着,核酸内切酶将磷酸二酯键分解而游离出无碱基的脱氧核糖,形成1个碱基份的空位。
[0533]
本说明书的说明中的user(注册商标)酶、及user(注册商标)酶为上述定义的user(注册商标)。
[0534]
本发明中所谓构筑单元,为具有官能团、能构成化合物的一部分的部分,也可以为化合物的形态。
[0535]
本发明中所谓能鉴定各个构筑单元的碱基序列,是指以与各个构筑单元的结构对应的方式设计出的特定的碱基序列。所谓设计序列,是指例如以使构筑单元结构a为核酸碱基序列aaa、结构b为核酸碱基序列ttt、结构c为核酸碱基序列cgc这样的方式向各个结构分配核酸碱基序列。对于序列而言,只要能达到本发明的目的,就可以自由地设计。例如,可以将任意数目的碱基序列分配在1个构筑单元中。
[0536]
本发明中所谓寡核苷酸标签,是含有包含能鉴定由构筑单元构建的部分结构的结构的碱基序列的寡核苷酸的部分结构。本发明中所谓寡核苷酸标签,可以是与各构筑单元对应的寡核苷酸,也可以是含有与多个构筑单元对应的寡核苷酸的、更长链的寡核苷酸。
[0537]
构成本发明的寡核苷酸标签的核苷酸只要达成本发明的效果,就没有限制,从基于pcr的扩增、基于测序仪的解析的容易性这样的观点考虑,优选为适合于这些操作的核苷酸。作为这样的优选的核苷酸的例子,可举出具有前述的天然的核酸碱基作为碱基部、具有前述的核糖或2
’‑
脱氧核糖作为糖部的核苷酸,作为更优选的例子,可举出脱氧腺苷、胸苷、脱氧胞苷或脱氧鸟苷。
[0538]
(头片段)
[0539]
本发明中所谓头片段,是指用于制造del等化合物文库的起始化合物。对于本发明的头片段的结构而言,只要达成本发明的目的,就不受限定,作为最典型的方式,具有可连接构筑单元的至少1个部位、和可连接寡核苷酸标签的至少1个部位,进一步在结构中包含至少一个可选择性地切断的部位。
[0540]
如后文所述,dna标签优选为双链寡核苷酸链,可连接寡核苷酸标签的部位优选为2个。
[0541]
作为一种方式,头片段为下述的示意图所示的化合物。
[0542]
[化学式13]
[0543][0544]
作为一种方式,头片段优选是化学稳定的。
[0545]
另外,作为一种方式,头片段优选为能够在适当的空间中配置dna标签和构筑单元的结构。
[0546]
作为一种方式,头片段优选具有适度的挠性。
[0547]
此处,进一步对适度的空间配置、挠性(头片段的结构特性)进行说明。需要说明的是,此处说明的头片段的结构特性可以利用头片段单体达成,也可以通过使头片段与2官能性间隔基团结合来达成。
[0548]
作为一种方式,优选的头片段的结构特性为如下结构特性:头片段、dna标签不阻碍构筑单元的形成反应,反之,头片段、构筑单元不阻碍dna标签的延伸反应。
[0549]
作为一种方式,优选的头片段的结构特性为如下结构特性:头片段、dna标签部分不会对构筑单元化合物(文库化合物)与靶(靶标蛋白质等)的相互作用造成影响。
[0550]
作为一种方式,优选的头片段的结构特性为如下结构特性:dna标签和构筑单元部位向相反侧(例如90度以上的相反侧)取向。
[0551]
作为一种方式,优选的头片段的结构特性为如下结构特性:将头片段的环部位与构筑单元以按有机化合物的骨架换算计为几个原子至十几个原子的程度隔开。
[0552]
作为一种方式,头片段优选与dna标签部分、构筑单元部分具有适度的亲和性。所谓适度的亲和性,是指例如可以为了实施本发明而在所期望的条件下形成、维持、切断键这样的化学反应性及稳定性。
[0553]
需要说明的是,本发明中,所谓2官能性间隔基团,是指能使构筑单元部位与头片段结合的、具有至少2个反应基团的间隔基团部分。
[0554]
本发明的说明中,术语“头片段”、“头片段化合物”、“用于头片段的化合物”是表示相同概念的化合物的术语。
[0555]
本发明的说明中,“用作头片段的化合物”从使用的观点考虑时可以与“化合物作为头片段的使用”在本质上同样地理解,从方法的观点考虑时可以与“将化合物用作头片段的方法”在本质上同样地理解。对于化合物文库而言也是同样的。
[0556]
以下,对优选的头片段的结构进行说明,但头片段的结构没有限定,只要达成本发明的效果即可。
[0557]
作为一种方式,头片段由下述结构构成:
[0558]
(d)具有能与构筑单元直接连接、或者介由2官能性间隔基团而间接地连接的至少1个部位的反应性官能团,
[0559]
(l)从反应性官能团延伸的接头,
[0560]
(e)具有能与寡核苷酸标签的一条链连接的1个结合部位的第1寡核苷酸链,
[0561]
(f)具有能与寡核苷酸标签的另一条链连接的1个结合部位的第2寡核苷酸链,及
[0562]
(lp)与前述接头和2条寡核苷酸链结合的环部位;
[0563]
在e、f或lp中的至少任意1个部位具有至少1个可选择性地切断的部位。
[0564]
作为一种方式,头片段为下式(i)表示的化合物。
[0565]
其为下式表示的化合物,
[0566]
[化学式14]
[0567][0568]
(式中,e及f各自独立地为由核苷酸或核酸类似物构成的寡聚物,
[0569]
其中,e与f包含彼此互补的碱基序列,形成双股链寡核苷酸,
[0570]
lp为环部位,
[0571]
l为接头,
[0572]
d为反应性官能团。)
[0573]
所述化合物在e、f或lp中的至少任意1个部位具有至少1个可选择性地切断的部位。
[0574]
需要说明的是,本发明中,有时将环部位中的、与接头结合的部位的部分结构称为连接部位或(ls)。
[0575]
另外,本发明中,有时将e-lp-f统称为发夹部位。
[0576]
(第1及第2寡核苷酸链)
[0577]
以下,对第1寡核苷酸链(e)及第2寡核苷酸链(f)的优选方式进行说明。
[0578]
第1寡核苷酸链(e)和第2寡核苷酸链(f)优选介由环部位(lp)而在分子内形成双股链,头片段形成发夹结构。对分子内的双股链的形成而言优选的链长为3个碱基以上,更优选为4个碱基以上,进一步优选为6个碱基以上。
[0579]
作为一种方式,e及f的链长各自为3至40。
[0580]
作为一种方式,e及f的链长各自为4至40。
[0581]
作为一种方式,e及f的链长各自为6至25。
[0582]
连接寡核苷酸标签的部位优选为适合于酶式连接或化学连接的结构。作为一种方式,头片段与寡核苷酸标签的连接通过使用酶的双链连接来实施。在该情况下,第1及第2寡核苷酸链优选形成用于连接的突出末端。前述该突出末端的链长优选为2个碱基以上,更优
选为2至10个碱基,进一步优选为2至5个碱基。因此,优选第1及第2寡核苷酸链中的一者较之另一者的链而言长出突出末端的链长部分。另外,为了利用dna连接酶进行连接,优选第1及第2寡核苷酸链中的、具有头片段的5
‘
末端的链的5
‘
末端被磷酸化。
[0583]
另外,第1及第2寡核苷酸链可以包含用于pcr的引物结合序列的一部分或全部。作为引物结合序列而言适当的链长为17至25个碱基。
[0584]
(接头)
[0585]
以下,对接头(l)的优选方式进行说明。
[0586]
如前文所述,接头是从反应性官能团延伸并与连接部位结合的部位。典型而言,接头为来自以下方式的2价基团(-l-)。
[0587]
作为一种方式,接头为以下方式(l1)。
[0588]
(l1)可具有取代基且可被1~3个杂原子取代的c1~20脂肪族烃、或(2)可具有取代基的c6~14芳香族烃。
[0589]
作为其他方式,l为以下方式(l2)、(l3)、(l4)或(l5)。
[0590]
(l2)
[0591]
可具有取代基的c1~6脂肪族烃、可被1个或2个氧原子取代的c1~6脂肪族烃、或者可具有取代基的c6~10芳香族烃。
[0592]
(l3)
[0593]
可经取代基组st1取代的c1~6脂肪族烃、或可经取代基组st1取代的苯。其中,取代基组st1为由c1~6烷基、c1~6烷氧基、氟原子及氯原子构成的组。其中,在取代基组st1对脂肪族烃进行取代的情况下,不从取代基组st1中选择烷基。
[0594]
(l4)
[0595]
c1~6烷基;或者,未经取代或者被1个或2个c1~3烷基或c1~3烷氧基取代的苯。
[0596]
(l5)
[0597]
c1~6烷基。
[0598]
(反应性官能团)
[0599]
以下,对反应性官能团(d)的优选方式进行说明。
[0600]
如前文所述,反应性官能团具有能与构筑单元直接连接、或者介由2官能性间隔基团而间接地连接的至少1个部位,并且是与接头基团结合的部位。典型而言,反应性官能团在头片段中成为一价基团(d-),在del中成为基于前述(d-)的“来自反应性官能团的2价基团”(-d-)。
[0601]
例如,在d为氨基的情况下,(d-)的具体结构为(r-hn-)(r为以下说明的取代基)。例如,与活化羧基、反应性磺酰基、或异氰酸酯基反应,分别形成酰胺键、磺酰胺键、或脲键。此时,(-d-)的具体结构成为(-nr-)。
[0602]
对于r而言,只要达成本发明的效果,就没有限定,在以下的(d1)~(d5)的方式中,r优选为:(1)氢原子;或者,(2)未经取代或者被从由c1~6烷氧基、氟原子及氯原子组成的取代基组中单独或不同地选择的1~3个取代基取代的c1~6烷基。
[0603]
r更优选为氢原子或c1~3烷基,进一步优选为氢原子。
[0604]
另外,例如,在(d-)为具有离去基团(x-)的亚甲基的情况下,(d-)的具体结构为(x-ch
2-),例如,与氨基、羟基、或硫醇基这样的亲核试剂反应,形成碳-氮键、碳-氧键、或
碳-硫键。此时,(-d-)的具体结构成为(-ch
2-)。另外,例如,在(d-)为醛基的情况下,(d-)的具体结构为(hoc-)。醛基通过例如与氨基的还原氨基化反应而形成碳-氮键,此时,(-d-)成为-ch
2-,通过例如与磷叶立德基的反应而形成碳-碳双键,此时,(-d-)成为-ch=,通过例如与α-重氮膦酸酯基的反应而形成碳-碳三键,此时,(-d-)成为-c≡。
[0605]
作为一种方式,部位(d-)为以下方式(d1)。
[0606]
(d1)
[0607]
能构成c-c、氨基、醚、羰基、酰胺、酯、脲、硫醚、二硫醚、亚砜、磺酰胺、或磺酰基键的官能团。
[0608]
(如字义那样,在该情况下,(-d-)成为c-c、氨基、醚、羰基、酰胺、酯、脲、硫醚、二硫醚、亚砜、磺酰胺、或磺酰基键。)
[0609]
作为其他方式,(d-)为以下方式(d2)、(d3)、(d4)或(d5)。
[0610]
(d2)
[0611]
具有离去基团的c1烃、氨基、羟基、羰基的前体、硫醇基、或醛基。
[0612]
需要说明的是,在该情况下,(-d-)会成为-(c1烃)-、-nr-、-o-、-(c=o)-、-s-、-ch
2-、-ch=、或-c≡等。
[0613]
(d3)
[0614]
具有卤素原子的c1烃、具有磺酸系离去基团的c1烃、氨基、羟基、羧基、卤代羧基、硫醇基、或醛基。
[0615]
需要说明的是,在该情况下,(-d-)会成为-(c1烃)-、-nr-、-o-、-(c=o)-、-s-、-ch
2-、-ch=、或-c≡等。
[0616]
(d4)
[0617]-ch2cl、-ch2br、-ch2oso2ch3、-ch2oso2cf3、氨基、羟基、或羧基。
[0618]
需要说明的是,在该情况下,(-d-)分别成为-ch
2-、-nr-、-o-、或-(c=o)-。
[0619]
(d5)
[0620]
伯氨基。
[0621]
需要说明的是,在该情况下,(-d-)成为-nh-。
[0622]
以下,对环部位(lp)的优选方式进行说明。
[0623]
环部位(lp)优选以第1寡核苷酸链(e)与第2寡核苷酸链(f)在分子内形成双股链、头片段能形成发夹结构的方式设计。即,环部位(lp)优选具有环结构在热力学上稳定的链长、及结合的柔软性。
[0624]
因此,作为一种方式,环部位(lp)为以下部位。
[0625]
lp为由(lp1)p-ls-(lp2)q表示的环部位,
[0626]
ls为选自以下的(a)至(c)所记载的化合物组中的部分结构,
[0627]
(a)核苷酸
[0628]
(b)核酸类似物
[0629]
(c)可具有取代基的c1~14的3价基团
[0630]
lp1为从以下的(1)及(2)所记载的化合物组中单独或不同地选择p个的各部分结构,
[0631]
(1)核苷酸
[0632]
(2)核酸类似物
[0633]
lp2为从以下的(1)及(2)所记载的化合物组中单独或不同地选择q个的各部分结构,
[0634]
(1)核苷酸
[0635]
(2)核酸类似物
[0636]
p与q的总数为0~40。
[0637]
环部位的进一步优选的方式如前文说明的那样。
[0638]
以下,进一步对环部位的结构进行补充。
[0639]
此处,核苷酸为前文说明的天然核苷酸,核酸类似物如前文说明的那样。
[0640]
此处,lp1为从以下的(1)及(2)所记载的化合物组中单独或不同地选择p个的各部分结构,lp2为从以下的(1)及(2)所记载的化合物组中单独或不同地选择q个的各部分结构。
[0641]
(1)核苷酸
[0642]
(2)核酸类似物
[0643]
所谓单独或不同地选择p个,例如,在p为4的情况下,lp1可以以aatg、atcg、tc(d-spacer)g或a(d-spacer)(d-spacer)c这样的方式从(1)和(2)所记载的化合物组中单独或不同地选择。lp2也同样。
[0644]
另外,环部位可以包含用于pcr的引物结合序列的一部分或全部。
[0645]
(关于ls)
[0646]
作为一种方式,ls为(a)核苷酸或(b)核酸类似物。
[0647]
在ls为(a)核苷酸或(b)核酸类似物的情况下,环部位成为核酸寡聚物。本发明的核酸寡聚物是指将核苷酸或核酸类似物作为单体进行连接而成的寡聚物。寡聚物也可以称为链状化合物。
[0648]
因此,本发明的核酸寡聚物是指寡核苷酸链、核酸类似物链、或核苷酸与核酸类似物的混合链中的任一者。
[0649]
在ls为(a)核苷酸或(b)核酸类似物的情况下,环部位成为核酸寡聚物。在该情况下,头片段变得可以利用核酸合成仪来制造,在实务上显著优选。
[0650]
在ls为(a)核苷酸或(b)核酸类似物的情况下,在头片段的制造中,作为一种方式,可以制备接头部位(l)及反应性官能团部位(d)已与ls结合的核酸合成用单体,其后合成核酸寡聚物。
[0651]
作为这样的核酸合成单体的例子,可举出前述的amino c6 dt、mdc(teg-amino)、uni-link(商标注册)氨基改性剂等。
[0652]
在该方式的情况下,例如作为该单体的mdc(teg-amino)的结构中,核苷酸部分相当于连接部位(ls),从碱基延伸的侧链部分相当于接头部位(l)及反应性官能团部位(d)。
[0653]
在制备中,反应性官能团(d)可以被保护基保护。
[0654]
在该情况下,作为一种方式,核酸类似物为以下的化合物(b6)。
[0655]
(b6)在核苷酸的碱基部结合前述(-l-d)而成的化合物。
[0656]
作为一种方式,核酸类似物为以下的化合物(b61)、(b62)、(b63)、(b64)或(b65)。
[0657]
(b61)(-l-d)为(-l1-d1)的(b6)
[0658]
(b62)(-l-d)为(-l2-d2)的(b6)。
[0659]
(b63)(-l-d)为(-l3-d3)的(b6)。
[0660]
(b64)(-l-d)为(-l4-d4)的(b6)。
[0661]
(b65)(-d)为(-d5)的(b61)~(b64)中任一项所述的化合物。
[0662]
在ls为(a)核苷酸或(b)核酸类似物的情况下,在头片段的制造中,作为一种方式,可以先合成核酸寡聚物,其后使前述接头部位(l)及反应性官能团部位(d)结合。
[0663]
在该情况下,优选预先将接头部位结合的对象的“特定的核酸类似物”作为连接部位(ls)加入发夹部位(核酸类似物寡聚物)中。作为该“特定的核酸类似物”的例子,可以举出前述的amino c6dt、mdc(teg-amino)、uni-link(商标注册)氨基改性剂。
[0664]
在该方式的情况下,例如mdc(teg-amino)本身相当于连接部位(ls),从碱基侧链进一步结合的附加部位相当于接头部位(l)及反应性官能团部位(d)。
[0665]
(关于p和q)
[0666]
如前文所述,前述环部位的链长优选为第1寡核苷酸链(e)与第2寡核苷酸链(f)在分子内形成双股链、头片段形成发夹结构的链长。
[0667]
作为一种方式,p与q的总数为1~40。
[0668]
作为一种方式,p与q的总数为2~20。
[0669]
作为一种方式,p与q的总数为2~10。
[0670]
作为一种方式,p与q的总数为2~7。
[0671]
作为一种方式,本发明的环部位由(a)核苷酸、及以下的核酸类似物(b41)、(b42)、(b43)、(b44)或(b52)构成。
[0672]
(b41)d-spacer
[0673]
(b42)amino c6 dt
[0674]
(b43)mdc(teg-amino)
[0675]
(b44)uni-link(商标注册)氨基改性剂
[0676]
(b52)三乙二醇磷酸酯
[0677]
作为一种方式,ls优选为b42、b43或b44。
[0678]
另外,作为一种方式,lp1及lp2优选为a、b41或b52。
[0679]
作为一种方式,环部位为由以下的(x1)至(x9)记载的序列形成的核酸寡聚物。
[0680]
(x1)a-b41-b42-b41-a
[0681]
(x2)a-b41-b43-b41-a
[0682]
(x3)a-b41-b44-b41-a
[0683]
(x4)b41-b41-b42-b41-b41
[0684]
(x5)b41-b41-b43-b41-b41
[0685]
(x6)b41-b41-b44-b41-b41
[0686]
(x7)b52-b42-b52
[0687]
(x8)b52-b43-b52
[0688]
(x9)a52-a44-a52
[0689]
前述的头片段中,可切断的部位的数目优选为5个以内,更优选为1至2个。
[0690]
前述的头片段中,可切断的部位为2个以上的情况下,优选的是,至少1个可切断的
部位在第1寡核苷酸链中、或者在第1寡核苷酸链与接头结合部位之间,并且至少1个可切断的部位在第2寡核苷酸链中、或者在第2寡核苷酸链与接头结合部位之间。
[0691]
作为一种方式,前述的头片段中,对于可切断的部位的位置而言,以环部位、与第1寡核苷酸链或第2寡核苷酸链的结合部分为起点,优选为20个碱基以内,更优选为10个碱基以内,进一步优选为3个碱基以内。
[0692]
为了慎重起见而说明,“可选择性地切断的部位”的优选方式、与例如e、f或lp等的优选方式是各自不同的概念。即,即使在“可选择性地切断的部位”的位置被包含于e中的情况下,e的优选方式也不一定适用于“可选择性地切断的部位”。
[0693]
作为一种方式,构成本发明的del的化合物为下式(ii)表示的化合物。
[0694]
其为下式表示的化合物,
[0695]
[化学式15]
[0696][0697]
(式中,
[0698]
x及y为寡核苷酸链,
[0699]
e及f各自独立地为由核苷酸或核酸类似物构成的寡聚物,
[0700]
其中,e与f包含彼此互补的碱基序列,形成双股链寡核苷酸,
[0701]
lp为环部位,
[0702]
l为接头,
[0703]
d为来自反应性官能团的2价基团,
[0704]
sp为键或2官能性间隔基团,
[0705]
an为由至少1个构筑单元构成的部分结构。)
[0706]
所述化合物中,
[0707]
x与y具有至少一部分能形成双股链的序列,
[0708]
x以5
‘
末端与e结合,
[0709]
y以3
‘
末端与f结合,
[0710]
在e、f或lp中的至少任意1个部位具有至少1个可选择性地切断的部位。
[0711]
作为一种方式,前述的式(ii)表示的化合物中的e、f、lp、l及d的优选方式与关于前述的式(i)而说明的e、f、lp、l及d的优选方式同样。
[0712]
x、y、sp及an的优选方式另行说明。
[0713]
(2官能性间隔基团)
[0714]
如前文所述,2官能性间隔基团是能使化合物文库的部分结构an与头片段结合的、具有至少2个反应基团的间隔基团部分。作为一种方式,2官能性间隔基团为spd-spl-spx。
[0715]
spx为与头片段的反应性官能团形成共价键的反应基团。
[0716]
spd为与化合物文库的部分结构an形成共价键的反应基团。
[0717]
spl是化学上非活性的间隔部分。
[0718]
需要说明的是,与反应性官能团(d)同样地,反应基团(spx)在2官能性间隔基团单体(与头片段结合之前的试剂的状态)中成为一价基团(-spx),在del(已与头片段结合的状态)中成为基于前述(-spx)的“来自反应基团的2价基团”(-spx-)。
[0719]
另外,同样地,反应基团(spd)在与an结合之前的状态下成为一价基团(spd-),在del(已与an结合的状态)中成为基于前述(spd-)的“来自反应基团的2价基团”(-spd-)。
[0720]
spx的优选方式为形成氨基、羰基、酰胺、酯、脲、或磺酰胺键的反应性基团。作为一种方式,spx是作为适合于头片段的反应性官能团为氨基的情况的反应性基团的、以下的(spx1)、(spx2)或(spx3)的结构。
[0721]
(spx1):羧基、卤代羧基、醛基、或卤代磺酰基
[0722]
(spx2):羧基、或卤代磺酰基
[0723]
(spx3):羧基
[0724]
spd的优选方式与前述的d相同。
[0725]
作为一种方式,spd为前述的(d1)、(d2)、(d3)、(d4)或(d5)。
[0726]
spl的优选方式为下述的方式。
[0727]
作为一种方式,spl为前述的(l1)、(l2)、(l3)、(l4)或(l5)。
[0728]
作为一种方式,spl为以下的(spl1)、(spl2)或(spl3)。
[0729]
(spl1)聚亚烷基二醇、聚乙烯、可任选地被杂原子取代的c1~20脂肪族烃、肽、寡核苷酸、或它们的组合。
[0730]
(spl2)聚亚烷基二醇、聚乙烯、c1~10脂肪族烃、或肽
[0731]
(spl3)聚乙二醇、或聚乙烯
[0732]
作为一种方式,2官能性间隔基团如下所述。
[0733]
(sp1):(d4)-(spl1)-(spx1)
[0734]
(sp2):(d4)-(spl2)-(spx2)
[0735]
(sp3):(d4)-(spl3)-(spx3)
[0736]
(sp4):(d5)-(spl1)-(spx1)
[0737]
(sp5):(d5)-(spl2)-(spx2)
[0738]
(sp6):(d5)-(spl3)-(spx3)
[0739]
作为一种方式,构成del的化合物的(sp-d-l)部分如以下的(spdl1)、(spdl2)、(spdl3)(spdl4)、(spdl5)、(spdl6)、(spdl7)、(spdl8)、(spdl9)、或(spdl10)这样构成。
[0740]
(spdl1):(d4)-(l1)
[0741]
(spdl2):(d5)-(l1)
[0742]
(spdl3):(d4)-(l2)
[0743]
(spdl4):(d5)-(l2)
[0744]
(spdl5):(sp1)-(d5)-(l5)
[0745]
(spdl6):(sp2)-(d5)-(l5)
[0746]
(spdl7):(sp3)-(d5)-(l5)
[0747]
(spdl8):(sp4)-(d5)-(l5)
[0748]
(spdl9):(sp5)-(d5)-(l5)
[0749]
(spdl10):(sp6)-(d5)-(l5)
[0750]
需要说明的是,(spdl1)、(spdl2)、(spdl3)、(spdl4)中,sp是指键。
[0751]
在本发明的实施中,头片段能利用核酸合成装置来合成时是有利的。该实施中,如前文所述,作为一种方式,可以制备接头部位(l)及反应性官能团部位(d)已与ls结合的核酸合成用单体,其后合成核酸寡聚物。作为这样的核酸合成单体的例子,可举出前述的amino c6 dt、mdc(teg-amino)、uni-link(商标注册)氨基改性剂等。
[0752]
另一方面,采用如上所述的市售的核酸合成单体或核酸合成仪中可使用的核酸类似物的情况下,接头部位的长度有可能受到限制。在这样的情况下,作为一种方式,通过导入适当的2官能性间隔基团,能调整头片段与an的距离,在发明的实施中变得有利。
[0753]
本发明的说明中,“c1~c6的烷基”、“c1~6烷基”这样的术语中的“c1~c6的”、“c1~6”是指:碳原子数为1至6个。同样地,在m、n为整数的情况下,出现“cm~cn的”、“cm~n”这样的记载时,该记载是指碳原子数为m~n个。因此,“c1~c6的烷基”、“c1~6烷基”是指碳原子数为1至6个的烷基,“c1~c6的亚烷基”、“c1~6亚烷基”是指碳原子数为1至6个的亚烷基。
[0754]
本发明中所谓“c1~6烷基”,是指碳原子数为1至6个的直链或支链状的烷基。作为具体例,可举出甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、戊基、己基等。
[0755]
本发明中所谓“c1~3烷基”,是指碳原子数为1至3个的直链或支链状的烷基。具体例为甲基、乙基、丙基、异丙基。
[0756]
本发明中所谓“c1~6烷氧基”,是指碳原子数为1至6个的直链或支链状的烷氧基。作为具体例,可举出甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基、异丁氧基、仲丁氧基、叔丁氧基、戊基氧基、己基氧基等。
[0757]
本发明中所谓“c1~3烷氧基”,是指碳原子数为1至3个的直链或支链状的烷氧基。具体例为甲氧基、乙氧基、丙氧基、异丙氧基。
[0758]
本发明中所谓“烃”,是指仅由碳原子及氢原子构成的链状、支链状或环状的饱和或不饱和的化合物。
[0759]
本发明中所谓“脂肪族烃”,是指烃中的非芳香族的烃。“脂肪族烃”可以为链状、支链状或环状,另外也可以为饱和或不饱和。作为结构的具体例,可举出烷基、链烯基、炔基、环烷基或环烯基、或由它们的组合形成的结构。
[0760]
本发明中所谓“c1~20脂肪族烃”,是指碳原子数为1至20个的脂肪族烃。
[0761]
本发明中所谓“c1~10脂肪族烃”,是指碳原子数为1至10个的脂肪族烃。
[0762]
本发明中所谓“c1~6脂肪族烃”,是指碳原子数为1至6个的脂肪族烃。
[0763]
本发明中所谓“芳香族烃”,是指烃中的芳香族的烃。
[0764]
本发明中所谓“c6~14芳香族烃”,是指碳原子数为6至14个的芳香族烃。作为具体例,可举出苯、萘、蒽。
[0765]
本发明中所谓“c6~10芳香族烃”,是指碳原子数为6至10个的芳香族烃。具体例为苯或萘。
[0766]
本发明的芳香族杂环是在环结构内具有从由氮、氧及硫组成的组中单独或不同地选择的元素作为杂原子的芳香族的杂环。
[0767]
作为一种方式,芳香族杂环为具有1~9个碳原子的“c1~9芳香族杂环”,作为一种方式,“c1~9芳香族杂环”为5~10元的芳香族杂环”。
[0768]
作为一种方式,芳香族杂环为具有1~5个碳原子的“c1~5芳香族杂环”,作为一种方式,“c1~5芳香族杂环”为5~6元的芳香族杂环”。
[0769]
作为一种方式,芳香族杂环为具有2~9个碳原子的“c2~9芳香族杂环”,作为一种方式,“c2~9芳香族杂环”为5~10元的芳香族杂环”。
[0770]
作为一种方式,芳香族杂环为具有2~5个碳原子的“c2~5芳香族杂环”,作为一种方式,“c2~5芳香族杂环”为5~6元的芳香族杂环”。
[0771]
本发明的含氮芳香族杂环是在环结构内具有氮作为杂原子的芳香族的杂环。
[0772]
作为一种方式,含氮芳香族杂环为具有1~5个碳原子的“c1~5含氮芳香族杂环”,作为一种方式,“c1~5含氮芳香族杂环”为5~6元的芳香族杂环”。
[0773]
作为一种方式,含氮芳香族杂环为具有2~5个碳原子的“c2~5含氮芳香族杂环”,作为一种方式,“c2~5含氮芳香族杂环”为5~6元的芳香族杂环”。
[0774]
本发明的非芳香族杂环是在环结构内具有从由氮、氧及硫组成的组中单独或不同地选择的元素作为杂原子的非芳香族的杂环。
[0775]
非芳香族杂环可以包含部分不饱和键。
[0776]
作为一种方式,非芳香族杂环为具有2~9个碳原子的“c2~9非芳香族杂环”,作为一种方式,“c2~9非芳香族杂环”为5~10元的非芳香族杂环”。
[0777]
本发明中所谓“c1~14的3价基团”,是指来自碳原子数为1至14个的化合物的3价基团。只要达成本发明的效果,结构就没有限定。
[0778]
本发明中出现“可被杂原子取代”这样的记载时,所谓杂原子,是指除碳及氢以外的原子。
[0779]
该杂原子优选为氧原子、氮原子、硅原子、磷原子、或硫原子,更优选为氧原子、氮原子或硫原子。
[0780]
因此,例如作为烃的例子而列举丙基(-ch
2-ch
2-ch3)时,所谓“可被杂原子取代的丙基”,其概念包含烷基中的亚甲基(-ch
2-)被氧取代而成的醚((-ch
2-o-ch3)或(-o-ch
2-ch3))、被氮取代而成的胺((-ch
2-nh-ch3)或(-nh-ch
2-ch3))等结构。
[0781]
本发明中出现“可具有取代基”这样的记载时,对于该取代基而言,只要达成本发明的目的,就没有限定。
[0782]
该取代基优选为c1~6烷基、c1~6烷氧基、氨基、羟基、硝基、氰基、氧代基或卤素原子。
[0783]
该取代基更优选为c1~6烷基、c1~6烷氧基、氟原子或氯原子。
[0784]
本发明中所谓多肽及肽,是指氨基酸连接而形成的化合物或部分结构。所谓氨基酸,是具有氨基和羧基这两种官能团的有机化合物的总称。构成本发明的多肽及肽的氨基酸没有特别限定,包括修饰氨基酸等。按照生命科学领域中的通常用法,在本发明中,脯氨酸(被分类为亚氨基酸)也包括在氨基酸中。构成本发明的多肽及肽的氨基酸优选为α氨基酸,更优选为“构成蛋白质的氨基酸”。
[0785]
本发明的,卤素原子可举出氟原子、氯原子、溴原子及碘原子。
[0786]
所谓c-c、氨基、醚、羰基、酰胺、酯、脲、硫醚、二硫醚、亚砜、磺酰胺、及磺酰基键,是
具有根据各自的名称所理解的化学结构的化学键。本领域技术人员理解,例如,醚键通常是可由
“‑o‑”
表示的键,羰基键通常是可由
“‑
c(=o)
‑”
表示的键。氨基、酰胺及脲键在氮原子上具有氢原子或其他取代基,但只要具有本发明的效果即可,氮原子上的结构没有限定。前述氮原子上的取代基优选为c1~6烷基或氢原子,更优选为氢原子。另外,虽然不必提及,但c-c键是指碳-碳键。c-c键包括单键、双键、及三键。作为一种方式,在本发明的制造方法的工序a及/或c中,构建从上述11种中适宜地选择的键。这11种键是有机化学中的特别基本的结合方式,用于构建它们的反应也是本领域技术人员公知的。因此,在设计
·
构建本发明的化合物文库的部分结构an时,只要是本领域技术人员,就可以适宜地组合使用这11种键。
[0787]
所谓由从由h、b、c、n、o、si、p、s、f、cl、br及i组成的元素组中单独或不同地选择的元素构成的有机化合物,是通过前述12种元素的结合而构建的有机化合物。
[0788]
作为一种方式,本发明的化合物文库的部分结构an利用上述12种元素来构建。这12种元素是有机化合物中的特别基本的元素,用于构建它们的反应也是本领域技术人员公知的。因此,在设计
·
构建本发明的化合物文库的部分结构an时,只要是本领域技术人员,就可以适宜地组合使用这12种元素。
[0789]
所谓具有从由芳基、非芳香族环基、杂芳基及非芳香族杂环基组成的取代基组中单独或不同地选择的取代基的低分子有机化合物,是具有根据各自的名称所理解的化学结构的低分子有机化合物。低分子化合物是本领域技术人员公知的概念,本发明中的低分子化合物的优选的分子量的例子会另外提及。
[0790]
本发明的芳基优选为c6~10芳基,更优选为苯基。
[0791]
本发明的非芳香族环基优选为5元至8元的非芳香族环基,更优选为5元或6元的非芳香族环基。该非芳香族环基可以包含部分不饱和键。
[0792]
本发明的杂芳基及非芳香族杂环基是在环结构内具有从由氮、氧及硫组成的组中单独或不同地选择的元素作为杂原子的基团。本发明的杂芳基、非芳香族杂环基优选为5元至8元的基团,更优选为5元或6元的基团,非芳香族杂环基可以包含部分不饱和键。
[0793]
作为一种方式,本发明的化合物文库的部分结构an具有上述4种基团。这4种基团是有机化合物中的特别基本的部分结构,用于在化合物中构建这些基团的反应也是本领域技术人员公知的。因此,在设计
·
构建本发明的化合物文库的部分结构an时,只要是本领域技术人员,就可以适宜地组合使用这4种基团。
[0794]
前述的优选方式、即利用11种键、12种元素、及/或4种基团构建的化合物文库具有特别核心的价值。因此,本领域技术人员应该理解,将这些优选方式除外而构建的化合物文库通常用途受限,在大多情况下商业价值也受限。
[0795]
所谓an的合成历程,是指到合成出an为止所实施的全部操作的记录,尤其是指到合成出an为止所使用的构筑单元的结构及其顺序。例如,在2个以上的不同的反应容器中使用各不相同的构筑单元、以及/或者采用不同的反应条件执行反应的情况下,通过在反应之前或之后,使预先确定的序列的寡核苷酸链与各个反应容器中的产物连接,从而以寡核苷酸的序列信息的形式赋予合成历程。通过在到构建成an为止的期间重复实施这样的操作,从而构建成具有an的合成历程的bn的寡核苷酸。
[0796]
所谓拆分与合并合成,是geysen等人在组合化学的创始期作为利用了固相合成法的肽文库的组合化学构建法而开发出的合成法。拆分与合并合成也被称为拆分混合
(split-mix)法等。
[0797]
按照上述原委,以利用了固相合成法的肽文库的合成为例进行说明时,在拆分与合并合成中,不需要在每个肽末端增长的阶段从以肽键结合了氨基酸的固相担载体切出样品,而是暂时使n种担载体混合均匀化,然后进行均分,利用接下来的n种氨基酸使末端增长。
[0798]
即,每个担载体会生成1种肽链,只要在各阶段应用全部20种天然氨基酸,就能针对特定长度的肽来构建所有可能组合的肽文库。
[0799]
该肽文库若通过抗原提呈、受体结合来筛选,则只要利用elisa法等,就可以利用固相担载体上的肽来实施分析。即,无需从担载体切出试样的肽,而是挑出在试验中发生了反应的担载体粒子(例如,利用光学显微镜挑出0.1mm左右的经荧光标记的担载体粒子)。然后,可以针对该粒子的肽,利用机器分析装置(肽分析仪等)来确定目标肽序列,或者利用其他的组合化学鉴定方法(例如标签法)等来间接地确定成为筛选的候选的肽序列。
[0800]
进而,在本发明的制造方法中,以通过拆分与合并合成的方式在m为2时合成v种结构、在m为3时合成w种结构的情况为例进行说明。需要说明的是,本说明中,按(c)、(d)的顺序重复实施工序。
[0801]
(m=2)
[0802]
m=2的步骤中,针对a1-sp-c-b1,分别在工序(c)中附加α2,在工序(d)中附加β2,从而制造a2-sp-c-b2。
[0803]
此处,准备v种结构的α2(α2(a-v))和与之对应的v种β2(β2(a-v)),若对各结构分别进行工序(c)、(d),则可得到v种a2-sp-c-b2(a2(a)-sp-c-b2(a)、a2(b)-sp-c-b2(b)...a2(v)-sp-c-b2(v):即a2(a-v)-sp-c-b2(a-v))。在拆分与合并合成中,将v种a2-sp-c-b2混合之后,分割成w个。所谓分割,最具体而言,是指细分至w个反应容器中。
[0804]
(m=3)
[0805]
m=3的步骤中,针对a2-sp-c-b2,分别在工序(c)中附加α3,在工序(d)中附加β3,从而制造a3-sp-c-b3。
[0806]
此处,准备w种结构的α3(α3(a-w))和与之对应的w种β3(β2(a-w)),针对w个(a2(a-v)-sp-c-b2(a-v)混合物),分别实施工序(c)、(d)。于是,通过n=2和3的步骤,经由(v w)次的合成,能够高效地合成(v
×
w)种a3-sp-c-b3。
[0807]
(生物评价)
[0808]
若将所得到的w个产物混合,则可得到(v
×
w)种a3-sp-c-b3化合物文库的混合物。例如,若对该混合物进行药物受体的结合试验,则可1次进行(v
×
w)种化合物的筛选。通过将未与药物受体结合的化合物洗掉,能够仅将所结合的化合物分离。在本发明这样的del中,将分离出的a3-sp-c-b3化合物的dna扩增至能解读序列的量,可以根据其序列信息来掌握a3的结构。
[0809]
需要说明的是,化合物文库、构筑单元、拆分与合并等在组合化学等领域中是本领域技术人员公知的术语,可以参考以下的文献等而适时地进行。
[0810]
(1)高桥孝志,土井隆行“组合化学”,有机合成化学协会志,2002年,第60卷,426-433页
[0811]
(2)组合化学研究会编著,“组合化学”,化学同人
[0812]
所谓dna编码化文库(或del),是包含被dna或与dna具有实质上等同的功能的寡核苷酸标记的化合物(dna编码化化合物)的组的化合物文库。通过上文中记载的那样的拆分与合并合成,可将各化合物的结构、或合成历程以序列信息的形式赋予至标记dna。从这样的特性来看,dna编码化文库能以102~10
20
种化合物的混合物的形态进行筛选,利用该技术领域中已知的方法(例如,新一代测序仪的使用及/或微阵列的使用)对所取得的化合物中包含的dna序列进行鉴定,由此鉴定化合物的结构。作为前述筛选方法的一种方式,可选择如下方法:使蛋白质等靶标与dna编码化文库接触,分选出已与靶标结合的化合物。
[0813]
所谓“生物学靶标”,是本领域技术人员公知的术语,作为一种方式,在本发明中,所谓“生物学靶标”,是指在以医农药为代表的药剂等的开发中能成为靶标的生物学物质组,例如包括酶(例如,激酶、磷酸酶、甲基化酶、去甲基化酶、蛋白酶、及dna修复酶)、蛋白质:与蛋白质相互作用有关的蛋白质(例如,受体的配体)、受体靶标(例如,gpcr)、离子通道、细胞、细菌、病毒、寄生虫、dna、rna、朊病毒、或糖类。
[0814]
所谓“生物活性评价”,是本领域技术人员公知的术语,作为一种方式,在本发明中,所谓“生物活性评价”,是指对化合物所具有的生物活性(例如,与生物学靶标的结合能力、酶活性的抑制功能、酶活性的促进功能等)的有无、或强弱进行评价。作为生物活性评价的具体例,也可以参照前述的专利文献2及3、非专利文献1~6等。
[0815]
所谓“功能性评价”,是本领域技术人员公知的术语,作为一种方式,在本发明中,所谓“功能性评价”,是指对化合物所具有的特定的功能(例如,结合能力、生物活性、发光特性等)的有无、或强弱进行评价。
[0816]
本发明通过使用具有可切断的部位的dna链,关于del及del的制造方法,提供具有若干优点的多种方法。以下详细地记述方式1至7。
[0817]
方式1
[0818]
本发明提供使用前述的“具有可切断的部位的发夹型的头片段”的del。
[0819]
如图1中例示的那样,方式1中,将包含在dna链中包含可切断的部位的第1寡核苷酸链、环部位及第2寡核苷酸链的头片段作为起始原料,重复实施构筑单元的结合、和与该构筑单元对应的寡核苷酸标签的双链连接(图1中为3次),进一步根据需求进行包含引物区的寡核苷酸标签的双链连接,由此达成del的制造。
[0820]
如图2中例示的那样,方式1中,针对在头片段的第1寡核苷酸链中包含可切断的部位的del,使用酶等切断手段将可切断的部位切断,诱导成在环部位没有结合的双链寡核苷酸,由此能够以高效率进行pcr。
[0821]
(关于方式2)
[0822]
如图3中例示的那样,使用“具有可切断的部位的发夹型的头片段”的del中,可切断的部位也可以存在于第2寡核苷酸链中。方式2的特征除了可切断的部位以外,与方式1是同样的。
[0823]
(关于方式3)
[0824]
如图4中例示的那样,使用“具有可切断的部位的发夹型的头片段”的del中,可切断的部位也可以存在于第1和第2寡核苷酸链这两者中。本方式中,通过将环部位从两个寡核苷酸链切断,可期待pcr效率进一步提高。
[0825]
(关于方式4)
[0826]
如图5中例示的那样,本发明中,可切断的部位可以存在于第1寡核苷酸链(e)和第2寡核苷酸链(f)这两者中,进而可切断的部位的结构也可以不同。在这样的情况下,可以利用2个(或2个以上的)可切断的部位的特性的差异来控制切断部位。
[0827]
例如,可以使用脱氧尿苷作为第1寡核苷酸链(e)中的可切断的部位,使用脱氧肌苷作为第2寡核苷酸链(f)中的可切断的部位。
[0828]
在该情况下,若使用user酶,则可以将第1寡核苷酸链(e)的脱氧尿苷选择性地切断。
[0829]
[化学式16]
[0830][0831]
另一方面,若使用烷基腺嘌呤dna糖基化酶和核酸内切酶viii,则在第2寡核苷酸链(f)中,能够将以脱氧肌苷为起点的切断部位选择性地切断。
[0832]
[化学式17]
[0833][0834]
如上所述,通过根据需求而选择切断部位,能进行更广泛的del的修饰,其后的评价也能适应更广泛的方法。这是可以期待的。
[0835]
(关于方式5)
[0836]
如图6中例示的那样,本发明中,也可以在dna标签部分(例如寡核苷酸链(y))具有可切断的部位。在dna标签的末端附近设置可切断的部位,根据需求而将该部位切断,由此能够生成新的突出末端。
[0837]
[化学式18]
[0838][0839]
该突出末端可以用作粘性末端而将所期望的核酸序列、例如umis(特定分子识别序列)等连接。
[0840]
[化学式19]
[0841][0842]
在生物评价之后,针对选出的del化合物,如上述那样赋予umis区域,进行dna测序,由此能实现由pcr导致的扩增偏差得以减少的解析。
[0843]
如上所述,本发明中,通过在核酸序列中具有可选择性地切断的部位,从而在del化合物的制造、使用的情形中,能够赋予前所未有的性能。
[0844]
此处,所谓umis(特定分子识别序列),是指通过赋予至某个样品中包含的dna从而向dna分子逐一赋予各个dna序列的分子识别子(参见文献自然方法(nature methods),2012年,第9卷,72-74页)。通过在pcr扩增前赋予这样的分子识别子,从而在对样品中的具有特定序列的dna分子数进行定量时,能识别pcr重复(来自相同分子的序列),能实现减少了pcr扩增偏差的定量。
[0845]
(关于方式6)
[0846]
如图7中例示的那样,本发明中,可以将可切断的部位与修饰基团、功能性分子组合使用,例如,可制备将发夹链dna转化成单链dna而得到的del。
[0847]
按照图7,举出使用在e部分具有可切断的部位的头片段的del化合物为例。
[0848]
(步骤a)针对所合成的del化合物,连接在3
‘
末端具有可固相担载除去的修饰基团(例如生物素)的双链寡核苷酸链。
[0849]
(步骤b)将可切断的部位切断。
[0850]
(步骤c)施加与修饰基团的功能相应的处理。例如在生物素的情况下,使用具有生
物素亲和性的链霉亲和素珠等,将结合有生物素的寡核苷酸链选择性地从体系中除去。由此,能取得具有单链dna的del。
[0851]
此处,所谓功能性分子,是指具有特定的化学功能或生物学功能(例如,溶解性、光反应性、底物特异性的反应性、靶蛋白分解诱导特性)的分子,通过赋予至del,能进行与功能对应的del的评价、纯化。
[0852]
此处,所谓生物素,是指与亲和素结合的全部生物素类,不仅包括维生素b7,而且也包括例如脱硫生物素。
[0853]
如图8中例示的那样,使具有单链dna的del与具有所期望的功能部位的修饰寡核苷酸(例如光反应性交联剂等交联剂修饰dna)形成双链,由此能赋予新功能。
[0854]
(关于方式7)
[0855]
如图9中例示的那样,本发明中,可以利用可切断的部位将交联剂导入。
[0856]
按照图9,举出使用在e部分具有可切断的部位的头片段的del化合物为例。
[0857]
(步骤a)针对所合成的del化合物,将可切断的部位切断。
[0858]
(步骤b)赋予具有所期望的功能部位的修饰引物(例如光反应性交联剂等交联剂修饰引物)。
[0859]
(步骤c)使所赋予的引物延伸,合成交联剂修饰双链del化合物。
[0860]
在del评价的情况下,交联剂修饰双链del化合物在构筑单元化合物(文库低分子化合物)与靶蛋白结合时,能够进一步使交联结构与靶蛋白结合,从而能够显著地提高检测灵敏度(参见非专利文献5、6等)。在对非常大量的文库化合物进行评价的del技术的实务上,增强文库化合物的亲和性从而提高检测灵敏度是非常有用的。
[0861]
本发明提供新颖且高效的交联剂修饰双链del化合物的制造方法,是非常有用的。
[0862]
以下示出实施例,对本发明进行更详细的说明,但本发明并不限定于这些实施例。
[0863]
需要说明的是,实施例中的各种序列的核酸例如可以利用核酸自动合成仪、按照常规方法来制备。作为核酸自动合成仪的例子,可举出ns-8ii(genedesign公司制)等。另外,在核酸的制备中,也可以利用委托合成、合约实验室等。作为本领域技术人员公知的合约实验室,可举出genedesign公司、lgc biosearch technologies公司等。通常,这些合约实验室基于保密协议而制备委托人所指定的序列的核酸,并交付给委托人。
[0864]
实施例1
[0865]
[包含脱氧尿苷的发夹型del的部分结构的基于user(注册商标)酶的切断反应的检验]
[0866]
使用核酸自动合成仪ns-8ii(genedesign公司制),制备表1所示的序列的化合物。需要说明的是,在表1中的序列表述中,虽然对于本领域技术人员而言是明确的,但各序列单元间通过磷酸二酯键进行结合,“a”是指脱氧腺苷,“t”是指胸苷,“g”是指脱氧鸟苷,“c”是指脱氧胞苷,“(du)”是指脱氧尿苷,“(p)”是指磷酸,“(amino-c6-dt)”是指下式(1)表示的修饰核酸,
[0867]
[化学式20]
[0868][0869]“(amino-nc6-dt)”是指下式(2)表示的修饰核酸,
[0870]
[化学式21]
[0871][0872]“(dspacer)”是指下式(3)表示的基团,
[0873]
[化学式22]
[0874][0875]“(aminoc7)”是指下式(4)表示的基团。
[0876]
[化学式23]
[0877][0878]
另外,amino-nc6-dt使用按照(美国化学会志,1993年,第115卷,7128-7134页)中记载的方法合成的下式(5)的核酸合成试剂来导入。
[0879]
[化学式24]
[0880][0881]
表1中,左列的“no.”表示序列号,右列的“seq.”表示序列。序列中,左侧表示5
‘
侧,右侧表示3’侧。另外,与各序列号(no.)对应的化合物的名称如下所述。
[0882]
no.1:u-del1-sh no.2:u-del2-sh
[0883]
no.3:u-del3-sh no.4:u-del4-sh
[0884]
no.5:u-del5-hp no.6:u-del6-hp
[0885]
no.7:u-del7-hp no.8:u-del8-hp
[0886]
no.9:u-del9-hp no.10:u-del10-hp
[0887]
[表1]
[0888]
no.seq.1catcgatttgggagtca(du)t(am ino-c 6-dt)tttgactcccaaatcgatgtg2catcgatttgggagtcatt(am ino-c 6-dt)t(du)tgactcccaaatcgatgtg3catcgatttgggagtcatt(am ino-c 6-dt)tttgactcccaaatcga(du)gtg4catcgatttgggagtca(du)t(am ino-c 6-dt)t(du)tgactcccaaatcgatgtg5(p)gagtcatt(am ino-nc 6-dt)t(du)tgactccc6(p)gagtca(du)t(am ino-nc 6-dt)t(du)tgactccc7(p)gagtca(du)t(ds pacer)(ds pacer)(am inoc7)(ds pacer)(ds pacer)tttgactccc8(p)gagtcatt(ds pacer)(ds pacer)(am inoc 7)(ds pacer)(ds pacer)t(du)tgactccc9(p)gagtcaa(ds pacer)(ds pacer)(am inoc 7)(ds pacer)(ds pacer)(du)tgactccc10(p)gagtcat(ds pager)(am inoc 7)(ds pager)(du)tgactccc
[0889]
制备表1所示的序列的化合物各自的0.1mm水溶液,通过以下的步骤进行基于user(注册商标)酶的切断反应的研究。
[0890]
向pcr管中加入:1μl的表1所示的序列的化合物的0.1mm水溶液;10μl的cutsmart(注册商标)缓冲液(new england biolabs制,商品目录编号b7204s)及79μl的去离子水。向溶液中加入10μl的user(注册商标)酶(new england biolabs制,商品目录编号m5505s),于37℃开始对所得到的溶液进行孵育。
[0891]
开始对各反应溶液进行孵育后,在经过1小时及3小时后分别取样20μl。u-del1-sh、u-del5-hp、u-del6-hp、u-del7-hp、u-del8-hp、u-del9-hp、及u-del10-hp在经过20小时后也分别取样20μl。u-del8-hp及u-del9-hp在进一步于90℃孵育1小时后分别取样20μl。
[0892]
取样得到的溶液中,u-del1-sh、u-del2-sh、u-del3-sh、及u-del4-sh采用以下所示的分析条件1进行分析,u-del5-hp、u-del6-hp、u-del7-hp、u-del8-hp、u-del9-hp、及u-del10-hp采用以下所示的分析条件2进行分析。
[0893]
分析条件1:
[0894]
装置:maxis(bruker制),ultimate 3000(dionex制)
[0895]
柱:acquity uplc oligonucleotide beh c18 column(1.7μm,2.1
×
50mm)
[0896]
柱温:50℃
[0897]
溶剂:
[0898]
a液:水(0.75%v/v六氟异丙醇;0.038%v/v三乙胺;5μm乙二胺四乙酸)
[0899]
b液:90%v/v甲醇水溶液(0.75%v/v六氟异丙醇;0.038%v/v三乙胺;5μm乙二胺四乙酸)
[0900]
梯度条件:
[0901]
流速为0.36ml/min,将a液与b液的混合比固定为95/5(v/v)并开始测定,在0.56分钟后,经5.5分钟将a液与b液的混合比直线性地改变成40/60(v/v)。
[0902]
检测波长:260nm
[0903]
分析条件2:
[0904]
装置:waters acquity uplc/sq detector
[0905]
柱:acquity uplc oligonucleotide beh c18 column(1.7μm,2.1
×
50mm)
[0906]
柱温:50℃
[0907]
溶剂:
[0908]
a液:水(0.75%v/v六氟异丙醇;0.038%v/v三乙胺;5μm乙二胺四乙酸)
[0909]
b液:90%v/v甲醇水溶液(0.75%v/v六氟异丙醇;0.038%v/v三乙胺;5μm乙二胺四乙酸)
[0910]
梯度条件:
[0911]
流速为0.36ml/min,将a液与b液的混合比固定为95/5(v/v)并开始测定,在0.56分钟后,经5.5分钟将a液与b液的混合比直线性地改变成40/60(v/v)。
[0912]
检测波长:260nm
[0913]
将各反应溶液中设想到的产物(脱氧尿苷部分的脱碱基体、及被切断而得到的片段)的序列和理论分子量、及各反应溶液中检测到的分子量示于表2、表3。需要说明的是,表2、表3中的各列的表述如下所述。
[0914]“entry”(最左侧):
[0915]
表示实验编号,与各实验编号(entry)对应的底物如下所述。
[0916]
entry.1:u-del1-sh entry.2:u-del2-sh
[0917]
entry.3:u-del3-sh entry.4:u-del4-sh
[0918]
entry.5:u-del5-hp entry.6:u-del6-hp
[0919]
entry.7:u-del7-hp entry.8:u-del8-hp
[0920]
entry.9:u-del9-hp entry.10:u-del10-hp
[0921]“no.”(左起第2列):
[0922]
表示序列号。需要说明的是,各序列号(no.)中,no.1、2、3、4、5、6、7、8、9、及10为各反应溶液的底物,no.11、14、17、20、22、25、29、31、33、及35为各底物的脱氧尿苷部分的脱碱基体,其余的序列号为各底物被切断而得到的片段。
[0923]“seq.”(左起第3列):
[0924]
表示序列,左侧表示5
‘
侧,右侧表示3’侧。
[0925]
需要说明的是,在序列表述中,“(b)”是指下式(6)表示的基团(脱碱基部位),其他表述与表1相同。
[0926]
[化学式25]
[0927][0928]“expected mw.”(左起第4列):
[0929]
表示各序列的理论分子量(da)的数值。
[0930]“observed mw.”(最右侧):
[0931]
表示作为各序列进行鉴定后所检测到的分子量(da)的数值。需要说明的是,表述
“‑”
表示未检测到。
[0932]
[表2]
[0933]
[0934]
[表3]
[0935][0936]
根据与检测到的各序列对应的峰的面积比,算出脱碱基反应及切断反应的转化率。对于脱碱基反应而言,在全部底物中,于37℃在1h的阶段中转化了99%以上(底物的峰小于1%,其余的峰仅为脱碱基体和被切断而得到的片段)。
[0937]
另外,将表示切断反应的转化率的曲线图示于图10。如曲线图所示,在除u-del8-hp和u-del9-hp之外的全部底物中,于37℃,到20h为止切断反应进行了95%以上,即使在u-del8-hp和u-del9-hp中,通过追加90℃、1h的孵育,切断反应也100%完成。
[0938]
由以上的结果表明,各种包含脱氧尿苷的发夹型del的部分结构在脱氧尿苷部位进行基于user(注册商标)酶的脱碱基反应,接着进行切断反应。
[0939]
实施例2
[0940]
[现有型发夹del与可切断的发夹del(包含脱氧尿苷的发夹型del)的pcr效率的比较]
[0941]
如图11所示的概略图那样,通过以下的步骤合成表4所示的序列的化合物(发夹del)。需要说明的是,在表4中的序列表述中,“s”是指下式(7)表示的基团,其他表述与表1相同。
[0942]
[化学式26]
[0943][0944]
与各序列号(no.)对应的化合物的名称如下所述。
[0945]
no.37:u-del1 no.38:u-del2
[0946]
no.39:u-del4 no.40:u-del7
[0947]
no.41:u-del8 no.42:u-del9
[0948]
no.43:u-del10 no.44:h-del
[0949]
[表4]
[0950][0951]
需要说明的是,用于合成各发夹del的原料头片段的化合物名称分别如下所述。
[0952]
发夹del:原料头片段
[0953]
u-del1:u-del1-hp
[0954]
u-del2:u-del2-hp
[0955]
u-del4:u-del4-hp
[0956]
u-del7:u-del7-hp
[0957]
u-del8:u-del8-hp
[0958]
u-del9:u-del9-hp
[0959]
u-del10:u-del10-hp
[0960]
h-del:h-del-hp
[0961]
此外,u-del1-hp、u-del2-hp、u-del4-hp、及h-del-hp的序列号“no.”及序列“seq”如以下的表5所示。
[0962]
[表5]
[0963] no.seq.u-del1-hp45(p)gagtca(du)t(am ino-c6-dt)tttgactcccu-del2-hp46(p)gagtcatt(am ino-c6-dt)t(du)tgactcccu-del4-hp47(p)gagtca(du)t(am ino-c 6-dt)t(du)tgactccch-del-hp48(p)gagtcas(am inoc 7)stgactccc
[0964]
与实施例1同样地使用核酸自动合成仪ns-8ii(genedesign公司制)来制备表5所示的原料头片段。
[0965]
向pcr管中加入:2.0μl的各种原料头片段的1mm水溶液;2.4μl的pr_tag的1mm水溶液(使与实施例1同样地合成的pr_tag_a和pr_tag_b进行退火而制备,在表6中示出序列);0.8μl的10x连接酶缓冲液(500mm tris盐酸,ph7.5;500mm氯化钠;100mm氯化镁;100mm二硫苏糖醇;20mm腺苷三磷酸)及2.0μl的去离子水。向溶液中加入0.8μl的t4dna连接酶(thermo fisher制,商品目录编号el0013)的10倍稀释水溶液,将所得到的溶液于16℃孵育24小时。需要说明的是,表6中的序列表述与表1相同。另外,与各序列号(no.)对应的化合物的名称如下所述。
[0966]
no.49:pr_tag_a no.50:pr_tag_b
[0967]
[表6]
[0968]
no.seq.49(p)gactgcttctggaaccaccatcgcacttcctgaccacatcgatttgg50(p)aaatcgaigiggtcaggaagtgcgatggiggttccagaagcagictt
[0969]
利用0.8μl的5m的氯化钠水溶液及17.6μl的经冷却的(-20℃)乙醇对反应溶液进行处理,于-78℃静置2小时。离心分离后,除去上清液,将所得到的颗粒风干。向各颗粒中加入2.0μl去离子水,从而制备溶液。
[0970]
向所得到的各溶液中加入:2.4μl的cp的1mm水溶液(使与实施例1同样地合成的cp-a和cp-b进行退火而制备,在表7中示出序列);0.8μl的10x连接酶缓冲液(500mm tris盐酸,ph7.5;500mm氯化钠;100mm氯化镁;100mm二硫苏糖醇;20mm腺苷三磷酸)及2.0μl的去离子水。向溶液中加入0.8μl的t4dna连接酶(thermo fisher制,商品目录编号el0013)的10倍稀释水溶液,将所得到的溶液于16℃孵育24小时。需要说明的是,表7中的序列表述与表1相同。另外,与各序列号(no.)对应的化合物的名称如下所述。
[0971]
no.51:cp_a no.52:cp_b
[0972]
[表7]
[0973]
no.seq.51gcaggtgaagcttgtctgaa52(p)cagacaagcttcacctgc
[0974]
利用0.8μl的5m的氯化钠水溶液及17.6μl的经冷却的(-20℃)乙醇对反应溶液进行处理,于-78℃静置2小时。离心分离后,除去上清液,将所得到的颗粒风干。向颗粒中加10μl去离子水而制成溶液。
[0975]
从所得到的溶液中取样1.0μl,用去离子水稀释之后,在实施例1的分析条件2的条件下进行基于esi-ms的质谱分析,对目标物进行鉴定(将各序列的理论分子量、及所检测到的分子量示于表4中)。将其余的溶液冷冻干燥后,分别加入去离子水,制备成20μm。
[0976]
上文中得到的8种发夹型del中,h-del为现有型发夹del,其余的7种为包含脱氧尿苷的可切断的发夹del。为了对各种发夹型del的基于user(注册商标)酶的处理前的pcr效率、和处理后的pcr效率进行比较,实施了实时pcr分析。另外,作为比较对象的双链del,使用表7所示的ds-del(使序列no.47和no.48的化合物进行退火而制备)。需要说明的是,在表8中的序列表述中,“(amino-c6-l)”是指下式(8)表示的基团,其他表述与表1相同。
[0977]
[化学式27]
[0978][0979]
[表8]
[0980][0981]
《基于user(注册商标)酶的处理工序》
[0982]
通过以下的步骤进行8种发夹del、及双链del(ds-del)的基于user(注册商标)酶的处理。
[0983]
向pcr管中加入:1μl的各种del的20μm水溶液;1μl的cutsmart(注册商标)缓冲液(new england biolabs制,商品目录编号b7204s)及7μl的去离子水。向溶液中加入1μl的user(注册商标)酶(new england biolabs制,商品目录编号m5505s),将所得到的溶液于37℃孵育1小时。
[0984]
《del试样的制备》
[0985]
分别用去离子水对各种del的user(注册商标)酶处理前的样品、及处理后的反应溶液进行稀释,制备0.05pm、0.5pm、及5pm的del试样。
[0986]
《基于实时pcr的ct值的测定》
[0987]
针对上文中得到的各种del试样,利用实时pcr测定ct值,对pcr效率进行比较。条
件如下所述,将结果示于图12。需要说明的是,所谓ct值,是在实时pcr中伴随着dna的扩增而产生的荧光信号达到任意的阈值的循环数。即,在初始的dna分子数等同的情况下,pcr效率越高,则ct值越低。
[0988]
装置:7500实时pcr系统(applied biosystems公司制)
[0989]
板:microamp 96孔板(applied biosystems公司制,商品目录编号n8010560)
[0990]
pcr反应溶液:
[0991]
·
tb green premix ex taqii(takara bio公司制,商品目录编号rr820):10μl
[0992]
·
正向引物(表9,序列号55):0.80μl
[0993]
·
反向引物(表9,序列号56):0.80μl
[0994]
·
rox refference dyeii(takara bio公司制,商品目录编号rr39lr):0.40μl
[0995]
·
各种del试样的水溶液(0.05pm、0.5pm、5pm)*1:2.0μl
[0996]
·
去离子水:6.0μl
[0997]
*1:del试样的摩尔数成为0.1amol、1amol、10amol。
[0998]
温度条件:
[0999]
·
于95℃保持2分钟后,将以下的循环重复实施35个循环。
[1000]
·
95℃,5秒种
[1001]
·
52℃,30秒种
[1002]
·
72℃,30秒种
[1003]
[表9]
[1004]
no.seq.55tgactcccaaatcga56gcaggtgaagcttgtc
[1005]
需要说明的是,表9中的序列表述与表1相同。
[1006]
如图12所示,对于现有型发夹del(h-del)而言,ct值在user(注册商标)酶处理的前后没有变化,但对于包含脱氧尿苷的可切断的发夹del(u-del1、u-del2、u-del4、u-del7、u-del8、u-del9、及u-del10)而言,在user(注册商标)酶处理后,ct值降低至与作为双链del的ds-del等同。
[1007]
本结果表明:被user(注册商标)酶切断的del与切断前相比,pcr效率提高;以及,包含脱氧尿苷的可切断的发夹del被user(注册商标)酶高效且高选择性地切断。
[1008]
实施例3
[1009]
[包含脱氧尿苷的发夹del的基于user(注册商标)酶的切断反应的检验]
[1010]
《4种发夹del(u-del5、u-del11、u-del12、及u-del13)的合成》
[1011]
通过以下的步骤合成表10所示的序列的化合物(发夹del)。需要说明的是,在表10中的序列表述中,“[mdc(teg-amino)]”是指下式(9)表示的基团,其他表述与表4相同。
[1012]
[化学式28]
[1013][1014]
与各序列号(no.)对应的化合物的名称如下所述。
[1015]
no.57:u-del5 no.58:u-del11
[1016]
no.59:u-del12 no.60:u-del13
[1017]
[表10]
[1018][1019]
需要说明的是,用于合成各发夹del的原料头片段的化合物名称分别如下所述。
[1020]
发夹del:原料头片段
[1021]
u-del5:u-del5-hp
[1022]
u-del11:u-del11-hp
[1023]
u-del12:u-del12-hp
[1024]
u-del13:u-del13-hp
[1025]
此外,u-del11-hp、u-del12-hp、及u-del13-hp的序列号“no.”及序列“seq”如以下的表11所示。需要说明的是,表11中的表述与表10相同。
[1026]
[表11]
[1027]
no.seq.u-del11-hp61(p)gagtcaas(am inoc 7)s(du)tgactcccu-del12-hp62(p)gagtcaa[mdc(teg-am ino)](du)tgactcccu-del13-hp63(p)gagtcatt[mdc(teg-am ino)](du)ttgactccc
[1028]
对于表11所示的原料头片段中的u-del12-hp及u-del13-hp而言,与实施例1同样地使用核酸自动合成仪ns-8ii(genedesign公司制)来制备。u-del11-hp也同样地按照常规
方法制备。
[1029]
与实施例2同样地,使用各种原料头片段,实施与双链寡核苷酸pr-tag及cp的2个阶段的双链连接。
[1030]
取样所得到的溶液的一部分,用去离子水稀释之后,在以下所示的分析条件3下进行基于esi-ms的质谱分析,对目标物进行鉴定(将各序列的理论分子量、及所检测到的分子量示于表10中)。将其余的溶液冷冻干燥后,分别加入去离子水,制备成20μm。
[1031]
分析条件3:
[1032]
装置:waters acquity uplc/sq detector
[1033]
柱:acquity uplc oligonucleotide beh c18 column(1.7μm,2.1
×
50mm)
[1034]
柱温:60℃
[1035]
溶剂:
[1036]
a液:水(0.75%v/v六氟异丙醇;0.038%v/v三乙胺;5μm乙二胺四乙酸)
[1037]
b液:90%v/v甲醇水溶液(0.75%v/v六氟异丙醇;0.038%v/v三乙胺;5μm乙二胺四乙酸)
[1038]
梯度条件:
[1039]
流速为0.36ml/min,将a液与b液的混合比固定为95/5(v/v)并开始测定,在0.56分钟后,经5.5分钟将a液与b液的混合比直线性地改变成40/60(v/v)。
[1040]
检测波长:260nm
[1041]
反卷积:
[1042]
使用promass for masslynx software(waters制)对离子信号进行分析。
[1043]
《基于user(注册商标)酶的切断反应》
[1044]
通过以下的步骤进行6种包含脱氧尿苷的发夹del(u-del5、u-del7、u-del9、u-del11、u-del12、及u-del13)的基于user(注册商标)酶的切断反应的研究。
[1045]
向pcr管中加入:2μl的各种发夹del的20μm水溶液;2μl的cutsmart(注册商标)缓冲液(new england biolabs制,商品目录编号b7204s)及14μl的去离子水。向溶液中加入2μl的user(注册商标)酶(new england biolabs制,商品目录编号m5505s),将所得到的溶液于37℃孵育16小时后,进一步于90℃孵育1小时。
[1046]
《基于lc-ms测定的切断后的产物的确认》
[1047]
从所得到的反应溶液中取样5.0μl,用去离子水稀释之后,在分析条件3下进行基于esi-ms的质谱分析。将各反应溶液中设想到的切断后的产物的序列和理论分子量、及各反应溶液中检测到的分子量示于表12。需要说明的是,与各实验编号(entry)对应的底物如下所述,其他表述与表10相同。
[1048]
entry.1:u-del5 entry.2:u-del7
[1049]
entry.3:u-del9 entry.4:u-del11
[1050]
entry.5:u-del12 entry.6:u-del13
[1051]
[表12]
[1052][1053]
在任意样品中均未检测到底物的ms,切断后的产物的ms作为主峰而被观测到。
[1054]
《基于凝胶电泳的切断反应的确认》
[1055]
另外,从所得到的反应溶液中取样一部分,在以下所示的条件下进行基于变性聚丙烯酰胺凝胶电泳的分析。由图13所示的结果确认到,在任意底物中均以高收率进行了切断反应。需要说明的是,图13的各泳道的样品如下所述。
[1056]
泳道1:20bp dna梯状条带(lonza制,lonza 20bp dna ladder,商品目录编号50330)
[1057]
泳道2:u-del5
[1058]
泳道3:u-del5的切断反应实施后的样品
[1059]
泳道4:u-del7
[1060]
泳道5:u-del7的切断反应实施后的样品
[1061]
泳道6:u-del9
[1062]
泳道7:u-del9的切断反应实施后的样品
[1063]
泳道8:u-del11
[1064]
泳道9:u-del11的切断反应实施后的样品
[1065]
泳道10:u-del12
[1066]
泳道11:u-del12的切断反应实施后的样品
[1067]
泳道12:u-del13
[1068]
泳道13:u-del13的切断反应实施后的样品
[1069]
变性聚丙烯酰胺凝胶电泳:
[1070]
凝胶:novex(商品商标)10%tbe-脲凝胶(invitrogen by thermofisher scientific制,商品目录编号ec68755box)
[1071]
上样缓冲液:novex(商品商标)10%tbe-尿素样品缓冲液(2
×
)(invitrogen by thermofisher scientific制,商品目录编号lc6876)
[1072]
温度:60℃
[1073]
电压:180v
[1074]
电泳时间:30分钟
[1075]
染色试剂:syber(商品商标)绿色ii核酸凝胶染液(greenii nucleic acid gel stain)(takara bio公司制,商品目录编号5770a)
[1076]
由以上的结果表明,各种包含脱氧尿苷的发夹型del在脱氧尿苷部位进行基于user(注册商标)酶的切断反应。
[1077]
实施例4
[1078]
[包含脱氧肌苷的发夹del的基于核酸内切酶v的切断反应的检验]
[1079]
《4种包含脱氧肌苷的发夹del(i-del1、i-del2、i-del3、及i-del4)的合成》
[1080]
通过以下的步骤合成表13所示的序列的化合物(发夹del)。需要说明的是,在表13中的序列表述中,“i”是指脱氧肌苷,其他表述与表2相同。
[1081]
与各序列号(no.)对应的化合物的名称如下所述。
[1082]
no.73:i-del1 no.74:i-del2
[1083]
no.75:i-del3 no.76:i-del4
[1084]
[表13]
[1085][1086]
需要说明的是,用于合成各发夹del的原料头片段的化合物名称分别如下所述。
[1087]
发夹del:原料头片段
[1088]
i-del1:i-del1-hp
[1089]
i-del2:i-del2-hp
[1090]
i-del3:i-del3-hp
[1091]
i-del4:i-del4-hp
[1092]
此外,i-del1-hp、i-del2-hp、i-del3-hp、及i-del4-hp的序列号“no.”及序列“seq”如以下的表14所示。需要说明的是,表14中的表述与表13相同。
[1093]
[表14]
[1094] nosea.hd el1-hp77(p)gagtcaa(dspacer)(ds pacer)(am inoc 7)(dspacer)(dspacer)tttgactccchd el2-hp78(p)gagtcat(ds pacer)(ds pacer)(am inoc 7)(dspacer)(dspacer)iigactccc
hd el3-hp79(p)6agtcaat(ds pacer)(ds pacer)(am inoc 7)(ds pacer)(ds pacer)iitgactccchd el4-hp80(p)gagtcata(ds pacer)(ds pacer)(am inoc 7)(ds pacer)(ds pacer)tiigactccc
[1095]
表14所示的原料头片段按照常规方法来制备。
[1096]
与实施例2同样地,使用各种原料头片段,实施与双链寡核苷酸pr_tag及cp的2个阶段的双链连接。
[1097]
取样所得到的溶液的一部分,用去离子水稀释之后,在分析条件3下进行基于esi-ms的质谱分析,对目标物进行鉴定(将各序列的理论分子量、及所检测到的分子量示于表13中)。将其余的溶液冷冻干燥后,分别加入去离子水,制备成20μm。
[1098]
《基于核酸内切酶v的切断反应》
[1099]
通过以下的步骤进行4种包含脱氧肌苷的发夹del(i-del1、i-del2、i-del3、i-del4)的基于核酸内切酶v的切断反应的研究。
[1100]
向pcr管中加入:1μl的各种发夹del的20μm水溶液;2μl的nebuffer(注册商标)4(new england biolabs制,商品目录编号b7004)及15μl的去离子水。向溶液中加入2μl的endnuclease v(new england biolabs制,商品目录编号m0305s),将所得到的溶液于37℃孵育24小时。
[1101]
《基于lc-ms测定的切断后的产物的确认》
[1102]
从所得到的反应溶液中取样8.0μl,用去离子水稀释之后,在分析条件3下进行基于esi-ms的质谱分析。将各反应溶液中设想到的切断后的产物的序列和理论分子量、及各反应溶液中检测到的分子量示于表15。需要说明的是,与各实验编号(entry)对应的底物如下所述,其他表述与表13相同。
[1103]
entry.1:i-del1 entry.2:i-del2
[1104]
entry.3:i-del3 entry.4:i-del4
[1105]
[表15]
[1106][1107]
在任意样品中均未检测到底物的ms,切断后的产物的ms作为主峰而被观测到。
[1108]
《基于凝胶电泳的切断反应的确认》
[1109]
另外,从所得到的反应溶液中取样一部分,在与实施例3相同的条件下进行基于变性聚丙烯酰胺凝胶电泳的分析。由图14所示的结果确认到,在任意底物中均以高收率进行了切断反应。需要说明的是,图14的各泳道的样品如下所述。
[1110]
泳道1:20bp dna梯状条带(lonza制,lonza 20bp dna ladder,商品目录编号50330)
[1111]
泳道2:i-del1
[1112]
泳道3:i-del1的切断反应实施后的样品
[1113]
泳道4:i-del2
[1114]
泳道5:i-del2的切断反应实施后的样品
[1115]
泳道6:i-del3
[1116]
泳道7:i-del3的切断反应实施后的样品
[1117]
泳道8:i-del4
[1118]
泳道9:i-del4的切断反应实施后的样品
[1119]
由以上的结果表明,对于各种包含脱氧肌苷的发夹型del而言,从脱氧肌苷起往3
‘
方向的第2个磷酸二酯键被核酸内切酶v切断。
[1120]
实施例5
[1121]
[包含核糖核苷的发夹del的基于rnasehii的切断反应的检验]
[1122]
《包含核糖核苷的发夹del(r-del1)的合成》
[1123]
通过以下的步骤合成表16所示的序列的化合物(发夹del)。需要说明的是,在表16中的序列表述中,“u”是指尿苷,其他表述与表2相同。
[1124]
与序列号(no.)对应的化合物的名称如下所述。
[1125]
no.87:r-del1
[1126]
[表16]
[1127][1128]
需要说明的是,用于合成各发夹del的原料头片段的化合物名称如下所述。
[1129]
发夹del:原料头片段
[1130]
r-del1:r-del1-hp
[1131]
此外,r-del1-hp的序列号“no.”及序列“seq”如以下的表17所示。需要说明的是,表17中的表述与表16相同。
[1132]
[表17]
[1133] noseq.r-del1-hp88(p)gagtcaaa(ds pacer)(ds pacer)(am inoc 7)(ds pacer)(ds pacer)tutgactccc
[1134]
表17所示的原料头片段按照常规方法来制备。
[1135]
与实施例2同样地,使用原料头片段,实施与双链寡核苷酸pr-tag及cp的2个阶段的双链连接。
[1136]
取样所得到的溶液的一部分,用去离子水稀释之后,在分析条件3下进行基于esi-ms的质谱分析,对目标物进行鉴定(将各序列的理论分子量、及所检测到的分子量示于表16中)。将其余的溶液冷冻干燥后,分别加入去离子水,制备成200μm。
[1137]
《基于rnasehii的切断反应》
[1138]
通过以下的步骤进行包含核糖核苷的发夹del(r-del1)的基于rnasehii的切断反
应的研究。
[1139]
向pcr管中加入:0.5μl的发夹del200μm水溶液;4.9μl的thermopol(注册商标)反应缓冲包(reaction buffer pack)(new england biolabs制,商品目录编号b9004)及43.6μl的去离子水。向溶液中加入1μl的rnase hii(new england biolabs制,商品目录编号m0288s),将所得到的溶液于37℃孵育8小时。
[1140]
《基于lc-ms测定的切断后的产物的确认》
[1141]
从所得到的反应溶液中取样10μl,在分析条件3下进行基于esi-ms的质谱分析。将设想到的切断后的产物的序列和理论分子量、及所检测到的分子量示于表18。需要说明的是,与实验编号(entry)对应的底物如下所述,其他表述与表16相同。
[1142]
entry.1:r-del1
[1143]
[表18]
[1144][1145]
在任意样品中均未检测到底物的ms,切断后的产物的ms作为主峰而被观测到。
[1146]
《基于凝胶电泳的切断反应的确认》
[1147]
另外,从所得到的反应溶液中取样一部分,在与实施例3相同的条件下进行基于变性聚丙烯酰胺凝胶电泳的分析。由图15所示的结果确认到,在任意底物中均以高收率进行了切断反应。需要说明的是,图15的各泳道的样品如下所述。
[1148]
泳道1:20bp dna梯状条带(lonza制,lonza 20bp dna ladder,商品目录编号50330)
[1149]
泳道2:r-del1
[1150]
泳道3:r-del1的切断反应实施后的样品
[1151]
由以上的结果表明,对于包含核糖核苷的发夹型del而言,核糖核苷酸的5’侧的磷酸二酯键被rnasehii切断。
[1152]
实施例6
[1153]
[以u-del9-hp为原料的模型文库的制作]
[1154]
如图16所示的概略图那样,以u-del9-hp为原料,通过拆分与合并合成的方式,使用以下的试剂实施包含3
×3×
3(27)种化合物的模型文库的合成。
[1155]
·
u-del9-hp
[1156]
·
3种构筑单元(bb1、bb2、及bb3):
[1157]
[化学式29]
[1158][1159]
·
10种双链寡核苷酸标签(表19的标签编号:pr、a1、a2、a3、b1、b2、b3、c1、c2、及c3)
del9-hp的溶液(2.5ml,1mm)。向各管中加入40当量的n-fmoc-15-氨基-4,7,10,13-四氧杂十八烷酸(250μl,0.4m n,n-二甲基乙酰胺溶液),接着加入40当量的氯化4-(4,6-二甲氧基[1.3.5]三嗪-2-基)-4-甲基吗啉鎓水合物(dmtmm)(200μl,0.5m水溶液),于10℃对所得到的溶液进行5小时振荡。
[1171]
利用295μl的5m的氯化钠水溶液及9.7ml的经冷却的(-20℃)乙醇分别对上述溶液进行处理,于-78℃静置一整夜。离心分离后,除去上清液,将所得到的颗粒风干。向颗粒中分别加入2.75ml的去离子水来进行溶解,于0℃加入306μl的哌啶,于10℃进行3小时振荡。对混合物进行离心分离后,通过过滤将沉淀物除去,利用1.47ml的去离子水清洗2次。利用600μl的5m的氯化钠水溶液及19.8ml的经冷却的(-20℃)乙醇分别对所得到的滤液进行处理,于-78℃静置一整夜。离心分离后,除去上清液,将所得到的颗粒风干。
[1172]
向所得到的颗粒中加入10ml的去离子水而制成溶液。从所得到的溶液中取样一部分,用去离子水稀释后,在实施例1的分析条件2的条件下进行基于esi-ms的质谱分析,对目标物进行鉴定(将化合物的理论分子量、及所检测到的分子量示于表20中)。将其余的溶液冷冻干燥后,加入去离子水,制备成5mm。
[1173]
《双链寡核苷酸标签“pr”的导入》
[1174]
将化合物“aop-u-del9-hp”与双链寡核苷酸标签“pr”连接,由此,通过以下的步骤合成表21中所示的序列的化合物“aop-u-del9-hp-pr”。需要说明的是,表21中的序列表述与表20相同。
[1175]
[表21]
[1176][1177]
向violamo离心管中加入:40μl的化合物“aop-u-del9-hp”的5mm水溶液;160μl的100mm碳酸氢钠水溶液水;240μl的双链寡核苷酸标签“pr”的1mm水溶液;80μl的10x连接酶缓冲液(500mm tris盐酸,ph7.5;500mm氯化钠;100mm氯化镁;100mm二硫苏糖醇;20mm腺苷三磷酸)及272μl的去离子水。向溶液中加入8.0μl的t4dna连接酶(thermo fisher制,商品目录编号el0013),将所得到的溶液于16℃孵育24小时。
[1178]
利用80μl的5m的氯化钠水溶液及2640μl的经冷却的(-20℃)乙醇对反应溶液进行处理,于-78℃静置2小时。离心分离后,除去上清液,向所得到的颗粒中加入400μl的去离子水。利用amicon(注册商标)超离心过滤器(ultra centrifugal filter)(30kd截留分子量(cut-off))对所得到的溶液进行浓缩。取样所得到的溶液的一部分,在分析条件2的条件下进行基于esi-ms的质谱分析,对目标物进行鉴定(将化合物的理论分子量、及所检测到的分子量示于表21中)。通过以上的工序,得到纯度为84.5%的化合物“aop-u-del9-hp-pr”133nmol。向所得到的化合物“aop-u-del9-hp-pr”中加入100mm碳酸氢钠水溶液水,制备成1mm。
[1179]
《循环a》
[1180]
向3支各pcr管中加入:20μl的上文中得到的化合物“aop-u-del9-hp-pr”的1mm溶液;30μl的双链寡核苷酸标签a1~a3中的一者的1mm水溶液;8.0μl的10x连接酶缓冲液(500mm tris盐酸,ph7.5;500mm氯化钠;100mm氯化镁;100mm二硫苏糖醇;20mm腺苷三磷酸)
及21.6μl的去离子水。向溶液中加入0.4μl的t4dna连接酶(thermo fisher制,商品目录编号el0013),将所得到的溶液于16℃孵育18小时。
[1181]
利用8.0μl的5m的氯化钠水溶液及264μl的经冷却的(-20℃)乙醇分别对反应溶液进行处理,于-78℃静置30分钟。离心分离后,除去上清液,使所得到的颗粒分别溶解于20μl的150mm硼酸钠缓冲液(ph9.4)中。
[1182]
向各管中加入40当量的构筑单元bb1~bb3(4.0μl,200mm n,n-二甲基乙酰胺溶液)中的一者,接着加入40当量的氯化4-(4,6-二甲氧基[1.3.5]三嗪-2-基)-4-甲基吗啉鎓水合物(dmtmm)(4.0μl,200mm水溶液),于10℃进行2小时振荡。进一步地,向各管中加入20当量的构筑单元(2.0μl,200mm n,n-二甲基乙酰胺溶液),接着加入20当量的dmtmm(2.0μl,200mm水溶液),于10℃进行30分钟振荡。
[1183]
利用3.2μl的5m的氯化钠水溶液及106μl的经冷却的(-20℃)乙醇分别对反应溶液进行处理,于-78℃静置30分钟。离心分离后,除去上清液,向所得到的颗粒中分别加入18μl的去离子水之后,将3种溶液混合在1支pcr管中。
[1184]
于0℃向混合得到的溶液中加入6.0μl的哌啶,于室温进行1小时振荡。利用6.0μl的5m的氯化钠水溶液及198μl的经冷却的(-20℃)乙醇对反应溶液进行处理,于-78℃静置18小时。离心分离后,除去上清液,向所得到的颗粒中加入400μl的去离子水。利用amicon(注册商标)超离心过滤器(30kd截留分子量)对所得到的溶液进行浓缩,加入100mm碳酸氢钠水溶液,制备成1mm,作为下一工序的起始原料来使用。
[1185]
《循环b》
[1186]
向3支各pcr管中加入:13.7μl的由循环a得到的起始原料的1mm溶液;20.6μl的双链寡核苷酸标签b1~b3中的一者的1mm水溶液;5.5μl的10x连接酶缓冲液(500mm tris盐酸,ph7.5;500mm氯化钠;100mm氯化镁;100mm二硫苏糖醇;20mm腺苷三磷酸)及14.8μl的去离子水。向溶液中加入0.3μl的t4dna连接酶(thermo fisher制,商品目录编号el0013),将所得到的溶液于16℃孵育16小时。
[1187]
利用5.5μl的5m的氯化钠水溶液及181μl的经冷却的(-20℃)乙醇分别对反应溶液进行处理,于-78℃静置30分钟。离心分离后,除去上清液,使所得到的颗粒分别溶解于13.7μl的150mm硼酸钠缓冲液(ph9.4)中。
[1188]
向各管中加入80当量的构筑单元bb1~bb3(5.5μl,200mm n,n-二甲基乙酰胺溶液)中的一者,接着加入80当量的dmtmm(5.5μl,200mm水溶液),于10℃进行1小时振荡。进一步地,向各管中加入40当量的构筑单元(2.3μl,200mm n,n-二甲基乙酰胺溶液),接着加入40当量的dmtmm(2.3μl,200mm水溶液),于10℃进行2小时振荡。
[1189]
利用2.5μl的5m的氯化钠水溶液及81.4μl的经冷却的(-20℃)乙醇分别对反应溶液进行处理,于-78℃静置30分钟。离心分离后,除去上清液,向所得到的颗粒中分别加入12.3μl的去离子水之后,将3种溶液混合在1支pcr管中。
[1190]
于0℃向混合得到的溶液中加入4.1μl的哌啶,于室温进行3小时振荡。利用4.1μl的5m的氯化钠水溶液及136μl的经冷却的(-20℃)乙醇对反应溶液进行处理,于-78℃静置3小时。离心分离后,除去上清液,向所得到的颗粒中加入400μl的去离子水。利用amicon(注册商标)超离心过滤器(30kd截留分子量)对所得到的溶液进行浓缩,加入100mm碳酸氢钠水溶液,制备成0.48mm,作为下一工序的起始原料来使用。
[1191]
《循环c》
[1192]
向3支各pcr管中加入:14.5μl的由循环b得到的起始原料的0.48mm溶液;10.5μl的双链寡核苷酸标签c1~c3中的一者的1mm水溶液;及2.8μl的10x连接酶缓冲液(500mm tris盐酸,ph7.5;500mm氯化钠;100mm氯化镁;100mm二硫苏糖醇;20mm腺苷三磷酸)。向溶液中加入0.14μl的t4dna连接酶(thermo fisher制,商品目录编号el0013),将所得到的溶液于16℃孵育16小时。
[1193]
利用2.8μl的5m的氯化钠水溶液及92μl的经冷却的(-20℃)乙醇分别对反应溶液进行处理,于-78℃静置30分钟。离心分离后,除去上清液,使所得到的颗粒分别溶解于7.0μl的150mm硼酸钠缓冲液(ph9.4)中。
[1194]
向各管中加入80当量的构筑单元bb1~bb3(2.8μl,200mm n,n-二甲基乙酰胺溶液)中的一者,接着加入80当量的dmtmm(2.8μl,200mm水溶液),于10℃进行1小时振荡。进一步地,向各管中加入40当量的构筑单元(1.4μl,200mm n,n-二甲基乙酰胺溶液),接着加入40当量的dmtmm(1.4μl,200mm水溶液),于10℃进行2小时振荡。
[1195]
利用1.3μl的5m的氯化钠水溶液及41.4μl的经冷却的(-20℃)乙醇分别对反应溶液进行处理,于-78℃静置30分钟。离心分离后,除去上清液,向所得到的颗粒中分别加入6.3μl的去离子水之后,将3种溶液混合在1支pcr管中。
[1196]
于0℃向混合得到的溶液中加入2.1μl的哌啶,于室温进行2小时振荡。利用2.1μl的5m的氯化钠水溶液及69μl的经冷却的(-20℃)乙醇对反应溶液进行处理,于-78℃静置3小时。离心分离后,除去上清液,向所得到的颗粒中加入400μl的去离子水。利用amicon(注册商标)超离心过滤器(30kd截留分子量)对所得到的溶液进行浓缩,加入100mm碳酸氢钠水溶液,制备成0.41mm,作为下一工序的起始原料来使用。
[1197]
《cp的连接》
[1198]
向pcr管中加入:12.2μl的由循环c得到的起始原料的0.41mm溶液;6.0μl的cp的1mm水溶液(与实施例2中使用的水溶液相同);2.1μl的10x连接酶缓冲液(500mm tris盐酸,ph7.5;500mm氯化钠;100mm氯化镁;100mm二硫苏糖醇;20mm腺苷三磷酸)及0.7μl的去离子水。向溶液中加入0.1μl的t4dna连接酶(thermo fisher制,商品目录编号el0013),将所得到的溶液于16℃孵育16小时。
[1199]
利用2.1μl的5m的氯化钠水溶液及69.6μl的经冷却的(-20℃)乙醇对反应溶液进行处理,于-78℃静置30分钟。离心分离后,除去上清液,向所得到的颗粒中加入400μl的去离子水。利用amicon(注册商标)超离心过滤器(30kd截留分子量)对所得到的溶液进行浓缩,加入去离子水而制备成20μm。
[1200]
《结果》
[1201]
对于各循环的双链寡核苷酸标签的连接后的样品,使用2.2%琼脂糖凝胶(lonza制,flashgel(注册商标)盒,商品目录编号57031),通过电泳进行分析。由图17所示的结果确认到,在各循环中,以高效率达成了基于双链寡核苷酸标签的编码化。需要说明的是,图17的各泳道的样品如下所述。
[1202]
泳道1:aop-u-del9-hp-pr
[1203]
泳道2:循环a的双链寡核苷酸标签a1连接后的样品
[1204]
泳道3:循环a的双链寡核苷酸标签a2连接后的样品
[1205]
泳道4:循环a的双链寡核苷酸标签a3连接后的样品
[1206]
泳道5:循环b的双链寡核苷酸标签b1连接后的样品
[1207]
泳道6:循环b的双链寡核苷酸标签b2连接后的样品
[1208]
泳道7:循环b的双链寡核苷酸标签b3连接后的样品
[1209]
泳道8:循环c的双链寡核苷酸标签c1连接后的样品
[1210]
泳道9:循环c的双链寡核苷酸标签c2连接后的样品
[1211]
泳道10:循环c的双链寡核苷酸标签c3连接后的样品
[1212]
泳道11:cp连接后的样品
[1213]
泳道12:20bp dna梯状条带(lonza制,lonza 20bp dna ladder,商品目录编号50330)
[1214]
在分析条件3下对循环c结束后的样品进行分析。图18示出色谱图和质谱的结果。通过所得到的质谱的反卷积,作为平均分子量,观测到35532.4。该结果与在循环c结束后预测的平均分子量(35514.2)一致,表明以高效率达成了用于合成文库的反应(双链寡核苷酸标签的连接、及构筑单元的导入)。
[1215]
从以上内容来看,通过上述合成步骤达成了以u-del9-hp为原料的包含3
×3×
3(27)种化合物的模型文库的合成。
[1216]
《所得到的模型文库的基于user(注册商标)酶的切断》
[1217]
通过以下的步骤实施上文中得到的模型文库的基于user(注册商标)酶的切断反应。
[1218]
向pcr管中加入:2.0μl的模型文库20μm水溶液;2μl的cutsmart(注册商标)缓冲液(new england biolabs制,商品目录编号b7204s)及14μl的去离子水。向溶液中加入2μl的user(注册商标)酶(new england biolabs制,商品目录编号m5505s),将所得到的溶液于37℃孵育16小时后,进一步于90℃孵育1小时。
[1219]
从所得到的反应溶液中取样一部分,在与实施例3相同的条件下进行基于变性聚丙烯酰胺凝胶电泳的分析。由图19所示的结果确认到,对于以u-del9-hp为原料的模型文库而言,可利用user(注册商标)酶以高效率进行切断反应。需要说明的是,图19的各泳道的样品如下所述。
[1220]
泳道1:20bp dna梯状条带(lonza制,lonza 20bp dna ladder,商品目录编号50330)
[1221]
泳道2:模型文库
[1222]
泳道3:模型文库的基于user(注册商标)酶的切断反应实施后的样品
[1223]
实施例7
[1224]
[从del化合物的发夹dna向单链dna的转化、及新功能的赋予]
[1225]
《在3’末端具有生物素的del化合物“bio-del”的合成》
[1226]
与实施例2同样地,通过以下的步骤合成表22所示的序列的del化合物“bio-del”。需要说明的是,在表22中的序列表述中,“(bio)”是指下式(11)表示的基团,其他表述与表20相同。
[1227]
[化学式31]
[1228][1229]
[表22]
[1230][1231]
向pcr管中加入:20μl的aop-u-del9-hp(在实施例6中合成)的1mm水溶液;24μl的pr_tag2的1mm水溶液(使与实施例1同样地合成的pr_tag2_a和pr_tag2_b进行退火而制备,在表23中示出序列);8μl的10x连接酶缓冲液(500mm tris盐酸,ph7.5;500mm氯化钠;10mm氯化镁;100mm二硫苏糖醇;20mm腺苷三磷酸)及20μl的去离子水。向溶液中加入8μl的t4dna连接酶(thermo fisher制,商品目录编号el0013)的10倍稀释水溶液,将所得到的溶液于16℃孵育22小时。需要说明的是,表23中的序列表述与表1相同。另外,与各序列号(no.)对应的化合物的名称如下所述。
[1232]
no.114:pr_tag2_a no.115:pr_tag2_b
[1233]
[表23]
[1234]
no.seq.114(p)tactcggtcacttgccactgccttgcttcctgaccacatcgatttgg115(p)aaatcgatgtggtcaggaagcaaggcagtggcaagtgaccgagtatt
[1235]
利用8μl的5m的氯化钠水溶液及264μl的经冷却的(-20℃)乙醇对反应溶液进行处理,于-78℃静置一整夜。离心分离后,除去上清液,将所得到的颗粒风干。使颗粒溶解于去离子水中,通过使用phenomenex gemini c18柱的反相hplc来进行纯化。采用二元流动相梯度分布,使用50mm乙酸三乙基铵缓冲液(ph7.5)及乙腈/50mm乙酸三乙基铵缓冲液(9∶1,v/v),将目标物洗脱。收集包含目标物的级分,进行混合并浓缩。利用amicon(注册商标)超离心过滤器(3kd截留分子量)将所得到的溶液脱盐,实施乙醇沉淀后,向颗粒中加入25μl的去离子水而制成溶液。
[1236]
从所得到的溶液中取样一部分,用去离子水稀释之后,在实施例1的分析条件2的条件下进行基于esi-ms的质谱分析,对目标物进行鉴定(将化合物的理论分子量、及所检测到的分子量示于表d中)。将其余的溶液冷冻干燥后,分别加入100mm碳酸氢钠水溶液,制备成1mm。
[1237]
向上文中得到的溶液6.2μl中加入:7.4μl的cp-bio的1mm水溶液(使与实施例1同样地合成的cp_a和cp-bio_b进行退火而制备,在表24中示出序列);2.5μl的10x连接酶缓冲液(500mm tris盐酸,ph7.5;500mm氯化钠;10mm氯化镁;100mm二硫苏糖醇;20mm腺苷三磷酸)及6.2μl的去离子水。向溶液中加入2.47μl的t4dna连接酶(thermo fisher制,商品目录编号el0013)的10倍稀释水溶液,将所得到的溶液于16℃孵育16小时。需要说明的是,表24
中的序列表述与表23相同。另外,与各序列号(no.)对应的化合物的名称如下所述。
[1238]
no.51:cp_a no.116:cp-bio_b
[1239]
[表24]
[1240]
no.seq.51gcaggtgaagcttgtctgaa116(p)cagacaagcttcacctgc(8d)
[1241]
利用2.5μl的5m的氯化钠水溶液及81.5μl的经冷却的(-20℃)乙醇对反应溶液进行处理,于-78℃静置30分钟。离心分离后,除去上清液,将所得到的颗粒风干,使颗粒溶解于去离子水中。利用amicon(注册商标)超离心过滤器(3kd截留分子量)将所得到的溶液脱盐。
[1242]
从所得到的上清液中取样一部分,用去离子水稀释之后,在实施例3的分析条件3下进行基于esi-ms的质谱分析,对目标物进行鉴定(将理论分子量、及所检测到的分子量示于表22中)。将其余的溶液冷冻干燥后,加入去离子水,制备成120μm,得到bio-del。
[1243]
《bio-del的基于user(注册商标)酶的切断》
[1244]
通过以下的步骤进行上文中得到的del化合物“bio-del”的基于user(注册商标)酶的切断反应,合成具有表25所示的序列的双链核酸的del化合物“ds-bio-del”。需要说明的是,表25中的序列表述与表22相同,ds-bio-del是指由序列号118和序列号119的寡核苷酸链这2条链形成。
[1245]
[表25]
[1246][1247]
向3支pcr管中分别加入10μl的del化合物“bio-del”120μm水溶液;100μl的cutsmart(注册商标)缓冲液(new england biolabs制,商品目录编号7240s)及860μl的去离子水。向溶液中加入各自30μl的user(注册商标)酶(new england biolabs制,商品目录编号5505s),将所得到的溶液于37℃孵育24小时。
[1248]
利用amicon(注册商标)超离心过滤器(3kd截留分子量)分别将所得到的反应溶液脱盐,加入去离子水,制备成60μl的溶液。然后,利用6μl的5m的氯化钠水溶液及198μl的经冷却的(-20℃)乙醇对各溶液进行处理,于-78℃静置30分钟。离心分离后,除去上清液,向所得到的颗粒中加入去离子水而制成溶液,并汇集到一个管中。
[1249]
取样所得到的溶液的一部分,用去离子水稀释之后,在实施例3的分析条件3下进行基于esi-ms的质谱分析,对具有目标双链核酸的del化合物“ds-bio-del”进行鉴定(将化合物的理论分子量、及所检测到的分子量示于表25中)
[1250]
另外,从所得到的反应溶液中取样一部分,在与实施例3相同的条件下进行基于变
性聚丙烯酰胺凝胶电泳的分析。由图20所示的结果确认到,bio-del以高收率被切断而转化成ds-bio-del。需要说明的是,图20的各泳道的样品如下所述。
[1251]
泳道1:bio-del(浓度1:以bio-del成为约40ng的方式制备)
[1252]
泳道2:bio-del(浓度2:以bio-del成为约80ng的方式制备)
[1253]
泳道3:bio-del的基于user(注册商标)酶的切断反应实施后的样品(浓度1:以目标物成为约40ng的方式制备)
[1254]
泳道4:bio-del的基于user(注册商标)酶的切断反应实施后的样品(浓度2:以目标物成为约80ng的方式制备)
[1255]
泳道5:20bp dna梯状条带(lonza制,lonza 20bp dna ladder,商品目录编号50330)
[1256]
《使用链霉亲和素珠的、具有单链dna的del的制备》
[1257]
利用链霉亲和素珠对上文中得到的具有双链核酸的del化合物“ds-bio-del”进行处理,通过以下的步骤制备成具有单链dna的del化合物“ss-del”。需要说明的是,ss-del为表25中的序列号119的寡核苷酸链。
[1258]
向2支pcr管中分别加入450μl的magnosphere(商品商标)ms160/链霉亲和素(streptavidin)(jsr life sciences,商品目录编号j-ms-s160s),通过磁性分离而将上清液除去后,加入900μl的1
×
结合缓冲液(10mm tris盐酸,ph7.5;0.5mm乙二胺四乙酸;1m氯化钠;0.05%v/v吐温20),通过磁性分离而将上清液除去。向所得到的粒子中分别加入ds-bio-del水溶液k(700pmol,450μl)、及450μl的2
×
结合缓冲液(20mm tris盐酸,ph7.5;1mm乙二胺四乙酸;2m氯化钠;0.1%v/v吐温20),进行混合,于室温进行20分钟振荡。
[1259]
通过磁性分离而从混合物中除去上清液,将使用900μl的1
×
结合缓冲液(10mm tris盐酸,ph7.5;0.5mm乙二胺四乙酸;1m氯化钠;0.05%v/v吐温20)的粒子的清洗及基于磁性分离的上清液的除去各自重复实施3次。然后,分别加入900μl的水溶液(0.1m氢氧化钠;0.1m氯化钠),通过磁性分离而回收上清液。
[1260]
向所得到的上清液中分别加入900μl的3-(n-吗啉代)丙磺酸缓冲液(1.0m,ph7.0),利用amicon(注册商标)超离心过滤器(3kd截留分子量)进行脱盐。将所得到的上清液汇集到一个管中,利用13.6μl的5m的氯化钠水溶液及448μl的经冷却的(-20℃)乙醇进行处理,于-78℃静置60分钟。离心分离后,除去上清液,将所得到的颗粒风干。向颗粒中加入60μl的去离子水而制成溶液。
[1261]
从所得到的溶液中取样一部分,用去离子水稀释之后,在实施例3的分析条件3的条件下进行基于esi-ms的质谱分析,结果,观测到分子量23984.8,鉴定出目标的具有单链dna的del化合物“ss-del”。
[1262]
《光反应性交联剂修饰引物的合成》
[1263]
通过以下的步骤合成26所示的序列的光反应性交联剂修饰引物“pxl-pr”。需要说明的是,在表26中的序列表述中,“(x)”是指下式(12)表示的基团,其他表述与表2相同。
[1264]
[化学式32]
[1265][1266]
[表26]
[1267][1268]
向pcr管中加入已冷却至10℃的硼酸钠缓冲液(150mm,ph9.4)的l-pr(与实施例1同样地合成,在表27中示出序列)的溶液(200μl,1mm)。向管中加入40当量的n-fmoc-15-氨基-4,7,10,13-四氧杂十八烷酸(20μl,0.4m n,n
‑‑
二甲基乙酰胺溶液),接着加入40当量的氯化4-(4,6-二甲氧基[1.3.5]三嗪-2-基)-4-甲基吗啉鎓水合物(dmtmm)(16μl,0.5m水溶液),于10℃对所产生的混合物进行5小时振荡。需要说明的是,表27中的序列表述与表8相同。
[1269]
[表27]
[1270]
noseq.l-pr120(am ino-c6-l)ttgactcccaaatcgatgtg
[1271]
利用23.6μl的5m的氯化钠水溶液及778.8μl的经冷却的(-20℃)乙醇对反应液进行处理,于-78℃静置一整夜。离心分离后,除去上清液,将所得到的颗粒风干。向颗粒中加入180μl的去离子水而制成溶液后,加入20μl的哌啶,于10℃进行3小时振荡。
[1272]
利用20μl的5m的氯化钠水溶液及660μl的经冷却的(-20℃)乙醇对所得到的溶液进行处理,于-78℃静置30分钟。离心分离后,除去上清液,向所得到的颗粒中加入200μl的去离子水而制成1mm的溶液。
[1273]
向上文中得到的溶液100μl中加入75μl的三乙胺盐酸缓冲液(500mm,ph10),接着加入50当量的1-((3-(3-甲基-3h-二氮丙啶-3-基)丙酰基)氧基)-2,5-二氧代吡咯烷-3-磺酸钠(sulfo-sda)(25μl,200mm水溶液),于37℃进行2小时振荡。
[1274]
利用20μl的5m的氯化钠水溶液及660μl的经冷却的(-20℃)乙醇对所得到的溶液进行处理,于-78℃静置30分钟。离心分离后,除去上清液,向所得到的颗粒中加入100μl的去离子水,接着加入75μl的三乙胺盐酸缓冲液(500mm,ph 10)、50当量的sulfo-sda(25μl,200mm水溶液),于37℃进行1小时20分钟的振荡。进一步加入50当量的sulfo-sda(25μl,200mm水溶液),于37℃进行40分钟振荡。
[1275]
利用22.5μl的5m的氯化钠水溶液及743μl的经冷却的(-20℃)乙醇对所得到的溶液进行处理,于-78℃静置一整夜。离心分离后,除去上清液,向所得到的颗粒中加入100μl的去离子水,接着加入75μl的三乙胺盐酸缓冲液(500mm,ph 10),接着加入50当量的sulfo-sda(25μl,200mm水溶液),于37℃进行3小时振荡。
[1276]
利用20μl的5m的氯化钠水溶液及660μl的经冷却的(-20℃)乙醇对所得到的溶液进行处理,于-78℃静置一整夜。离心分离后,除去上清液,将所得到的颗粒风干。使颗粒溶解于50mm乙酸三乙基铵缓冲液(ph7.5)中,通过使用phenomenex gemini c18柱的反相hplc
来进行纯化。采用二元流动相梯度分布,使用50mm乙酸三乙基铵缓冲液(ph7.5)及乙腈/水(100:1,v/v),将目标物洗脱。收集包含目标物的级分,进行混合并浓缩。利用amicon(注册商标)超离心过滤器(3kd截留分子量)将所得到的溶液脱盐,实施乙醇沉淀后,向颗粒中加入100μl的去离子水而制成溶液。
[1277]
从所得到的溶液中取样一部分,用去离子水稀释之后,在实施例3的分析条件3的条件下进行基于esi-ms的质谱分析,对目标物光反应性交联剂修饰引物“pxl-pr”进行鉴定(将化合物的理论分子量、及所检测到的分子量示于表26中)。
[1278]
《光反应性交联剂修饰双链del的合成》
[1279]
使用上文中得到的ss-del及pxl-pr,通过以下的步骤进行引物延伸反应,合成表28所示的序列的光反应性交联剂修饰双链del“pxl-ds-del”。需要说明的是,表28中的序列表述与表26相同,pxl-ds-del是指由序列号122和序列号119的寡核苷酸链这2条链形成。
[1280]
[表28]
[1281][1282]
向pcr管中加入:50μl的“ss-del”8μm水溶液;0.673μl的“pxl-pr”594μm水溶液;80μl的10
×
nebuffer(商品商标)2(new england biolabs制,商品目录编号b7002s)及645μl的去离子水。向溶液中加入8μl的dna聚合酶i、大(klenow)片段(dna polymerase i、large(klenow)fragment)(new england biolabs制,商品目录编号m0210)及16μl的脱氧核苷酸(dntp)混合液(deoxynucleotide(dntp)solution mix)(new england biolabs制,商品目录编号n0447),将所得到的溶液于25℃孵育90分钟。
[1283]
利用amicon(注册商标)超离心过滤器(3kd截留分子量)将所得到的溶液脱盐。向所得到的上清液中加入17μl的去离子水,然后,利用6μl的5m的氯化钠水溶液及198μl的经冷却的(-20℃)乙醇进行处理,于-78℃静置60分钟。离心分离后,除去上清液,将所得到的颗粒风干。向颗粒中加入40μl的去离子水而制成溶液。
[1284]
从所得到的溶液中取样一部分,用去离子水稀释之后,在实施例3的分析条件3的条件下进行基于esi-ms的质谱分析,对目标物光反应性交联剂修饰双链del“pxl-ds-del”进行鉴定(将化合物的理论分子量、及所检测到的分子量示于表28中)。
[1285]
另外,从所得到的反应溶液中取样一部分,在以下所示的条件下进行基于聚丙烯酰胺凝胶电泳的分析。由图21所示的结果确认到,通过引物的延伸反应,以高收率生成了pxl-ds-del。需要说明的是,图21的各泳道的样品如下所述。
[1286]
泳道1:20bp dna梯状条带(lonza制,lonza 20bp dna ladder,商品目录编号50330)
[1287]
泳道2:ds-bio-del
[1288]
泳道3:ss-del
[1289]
泳道4:ss-del的引物延伸反应实施后的样品(pxl-ds-del)
[1290]
聚丙烯酰胺凝胶电泳:
[1291]
凝胶:supersep(商品商标)dna15%tbe凝胶(fujifilm wako pure chemical制,商品目录编号190-15481)
[1292]
上样缓冲液:6
×
上样缓冲液(loading buffer)(takara bio公司制,商品目录编号9156)
[1293]
温度:室温
[1294]
电压:200v
[1295]
电泳时间:50分钟
[1296]
染色试剂:syber(商品商标)绿色ii核酸凝胶染液(takara bio公司制,商品目录编号5770a)
[1297]
产业上的可利用性
[1298]
本发明中,可以利用包含可选择性地切断的部位的核酸化合物。此外,本发明中,提供包含可选择性地切断的部位的dna编码化文库、其合成用组合物及其使用方法,能进行便利性比以往高的dna编码化文库的制造。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。