1.本发明属于生物技术领域,涉及一种人类口腔放线菌来源的防御素、 及其编码基因和其用于治疗细菌引发的系统性感染的用途。
背景技术:
2.传统抗生素的广泛使用导致了细菌耐药性的出现。研究发现,这种耐药 性的传播速度相比于治疗系统性感染的新型抗生素的研发速度更快,成为21 世纪人类面临的巨大医学挑战。因此,急需寻找新的抗生素来源。
3.作为多细胞生物天然免疫的效应分子,抗菌肽构成了应对微生物感染的 第一道防御体系,长期以来一直被认为是一类颇具前途的传统抗生素的替代 品。抗菌肽是一类阳离子分子,通常具有少于100个氨基酸。它们广泛存在 于植物、真菌和动物中。大部分抗菌肽的抗菌活性与其静电吸附细菌细胞膜 的强负电荷表面有关。少数被发现能够与其他细菌成分(例如膜载脂质ii 或细胞内靶点)结合。来源于脊椎动物的抗菌肽(也称为宿主防御肽)除了 作为内源性抗生素外,还能作为调节分子参与先天和适应性免疫反应。
4.虽然作为多细胞生物防御武器的抗菌肽在18亿年的进化历史中获得了 成功,但是人类几十年的密集研究却很少将此类分子应用于治疗系统性感染。 一个主要的内源性因素是大多数抗菌肽的类去垢剂的结构往往带来普遍的 细胞膜毒性。此外,积累的数据也凸显了人和其他脊椎动物来源的抗菌肽作 为抗感染药物模板的缺点。因为这些肽内在的多功能性调节特性,当系统给 药时,往往会干扰人体免疫系统的功能。进化上,抗菌肽在大多数多细胞生 物中是为了保护微环境而不是被输送到系统循环中,致使其在系统性治疗中 存在内在的缺陷。
5.防御素是一类由多个分子内二硫键稳定的阳离子抗菌肽。根据二硫键桥 的连接性和方向,防御素分为两个不同的结构类型:顺式和反式防御素。前 者包括半胱氨酸稳定的α-螺旋和β-片(csαβ)基序的肽,是植物、真菌和 动物所共有的唯一的抗菌肽类型,并可进一步分为三个主要亚类,即古典无 脊椎动物型防御素、经典昆虫型防御素和植物/昆虫型防御素。后者包括脊椎 动物衍生的α-、β-、θ-防御素和无脊椎动物(软体动物、节肢动物和脊索动 物)的大防御素。在进化上,它们都可能起源于一个共同的祖先。
6.但是,现有技术中对抗菌肽的研究多集中于各种昆虫、两栖动物、鱼类 或植物等,而对于与人类进化距离最远的单细胞原生生物中的抗菌肽或防御 素的研究鲜有报道。
技术实现要素:
7.针对现有技术的不足,本发明的目的是提供一种源于人类口腔放线菌的 防御素。本发明人发现,该防御素可用于系统性治疗各种细菌感染。
8.本发明通过如下的发明构思实现:本发明人发现,细菌来源的抗菌肽因 为其主要功能在于中间拮抗,这可能排除了其固有的干扰人类免疫系统的特 性。基于此,本发明人证实了细菌来源的抗菌肽可以用于系统性治疗,而不 会干扰人体免疫系统的功能。本发明
人经过大量的研究,在人类口腔放线菌 基因组中发现了一个防御素的基因,将其编码产物命名为actinomycesin(简 称为amsin)。通过化学合成和氧化折叠,本发明人获得了高纯度的amsin 产物(即amsin、amsin-1、amsin-2和amsin-3),完成了系统的抗菌 实验,阐明了它的抗菌机制,并评估了它的治疗潜能。
9.一方面,本发明提供了一种人类口腔放线菌来源的防御素或其生物活性 功能片段、变体或衍生物,所述防御素具有如seq id no:1-4之一所示的 氨基酸序列。
10.优选地,所述防御素的氨基酸序列为:
11.seq id no:1gfgcpwnayecdrhcvskgytggncrgkirqtchcy (amsin);
12.seq id no:2cfacpfnehqchnhclskgyrggfcggfaaatcrch (amsin-1);
13.seq id no:3dlscpwapsvcnrhclshgyrggycagpiklvchcy (amsin-2);或
14.seq id no:4yncptdespcdrhcrysgyrggycggilktscrcy (amsin-3)。
15.另一方面,本发明提供了编码所述防御素的核酸序列,其具有如seq idno:5-8之一所示的核酸序列。
16.优选地,编码所述防御素的核酸序列为:
17.seq id no:5
18.ggcttcggctgcccctggaacgcctacgagtgcgaccgccattgcgtc agcaagggatacaccggtggaaactgccgcggcaagatccgccagac ctgccactgctac(amsin);
19.seq id no:6
20.tgcttcgcctgccctttcaacgaacatcagtgccacaaccactgc ttgagcaaaggatatcgcggagggttctgcggaggattcgctgccgcc acctgccgctgccac(amsin-1);
21.seq id no:7
22.gaccttagctgcccctgggccccatccgtatgtaaccgccactgcc ttagtcacggttacaggggaggctattgcgccggccccatcaagctcg tgtgtcactgctac(amsin-2);或
23.seq id no:8
24.tacaactgccctactgacgagtctccgtgcgaccgtcactgcagg tactccggataccggggcggctactgcggaggaatactcaagacctcc tgccgctgttac(amsin-3)。
25.再一方面,本发明还提供了一种用于制备编码所述防御素的核酸序列 的引物,其包括正向引物和反向引物;其中,所述正向引物的序列如seq idno:9所示,并且所述反向引物的序列如seq id no:10所示。
26.本发明还提供了一种编码所述防御素的核酸序列的制备方法,其包括 通过pcr从人类口腔放线菌扩增获得所述核酸序列;其中,所述扩增使用 的正向引物和反向引物的序列分别如seq id no:9和seq id no:10所示。
27.本发明还提供了一种所述防御素的制备方法,所述方法包括以下步骤: 合成所述防御素的直线肽,再利用反相高效液相色谱法进行分离纯化。
28.优选地,本发明所述的防御素制备方法还包括在利用反相高效液相色 谱法进行分离纯化之前将合成的防御素的直线肽复性的步骤。
29.优选地,所述复性包括将合成的防御素的直线肽溶于水中,然后加入二 甲基亚砜至终浓度5-20%(体积比),混匀后加入磷酸盐缓冲液并温育过夜。
30.还一方面,本发明提供了一种抑制或杀灭细菌的药物组合物,其包含 本发明所述
的防御素和药学上可接受的稀释剂、赋形剂和/或载体。
31.优选地,所述防御素的致死浓度为0.01~5μμ。
32.又一方面,本发明还提供了所述防御素或药物组合物在制备用于抑制 或杀灭细菌、或治疗细菌引发的系统性感染的药物中的应用。
33.优选地,所述细菌为革兰氏阳性菌。更优选地,所述革兰氏阳性菌选 自肺炎链球菌(streptococcus pneumoniae(菌株d39、r6、st556和tigr4)) 及其链霉素抗性株;变形链球菌(streptococcus mutans);唾液链球菌 (streptococcus salivarius);血链球菌(streptococcus sanguinis);链霉菌属, 包括灰色链霉菌和阿氟曼链霉菌;梭形赖氨酸芽孢杆菌(lysinibacillusfusiformis);葡萄球菌属(staphylococcus)菌株,包括耐青霉素和耐甲氧西 林的金黄色葡萄球菌;和屎肠球菌(enterococcus faecium)。
34.又一方面,本发明还提供了所述防御素或药物组合物在制备广谱抗菌 药物中的应用。
35.又一方面,本发明还提供了所述防御素或药物组合物在制备用于治疗 菌血症、心内膜炎、腹膜炎、肺炎和中枢神经系统感染或呼吸道感染药物 中的应用。
36.本发明所述的防御素或药物组合物适用于研发抗耐甲氧西林金黄色 葡萄球菌(mrsa)各种药物。mrsa是主要的人类条件致病菌,能够引 起菌血症、心内膜炎、肺炎和中枢神经系统的感染,被称为“超级细菌”, 缺乏高选择性的特效药物。从发现至今,mrsa的感染已经几乎遍及全世 界。本发明所述的防御素为临床开发治疗感染,特别是mrsa感染的药物 提供了可能,具有十分广阔的应用前景。
37.另一方面,本发明提供了所述防御素或所述药物组合物在制备用于抑制 细菌细胞壁合成的药物中的用途。
38.本发明还提供了一种筛选药物的方法,其中所述药物为抑制细菌细胞壁 合成的药物,所述方法使用尿嘧啶二磷酸-n-乙酰胞壁酰-五肽作为测试靶标。
39.优选地,待筛选的药物为抗生素或抗微生物肽。
40.在一个具体的实施方案中,所述方法包括以下步骤:
41.1.培养用于测试的细菌;
42.2.在培养的细菌中加入待筛选的药物和/或对照品,并继续培养;
43.3.处理菌体后,收集尿嘧啶二磷酸-n-乙酰胞壁酰-五肽并检测。
44.本发明的发明人发现,对于靶向细菌细胞壁合成的抗生素和抗微生物肽 的机制研究,现有研究技术大多数采用膜定位的水不溶的lipid ii作为测试 靶标。但是由于lipid ii的人工合成需要多个繁琐的酶促反应,得率较低, 而从菌体直接提取需要大量的有机溶剂,对人体毒性较大。而本发明的发明 人发现,可以用水溶性的细胞壁合成前体尿嘧啶二磷酸-n-乙酰胞壁酰-五肽 取代细菌细胞膜锚定的水不溶性的lipid ii来研究细菌与抗生素的相互作用, 其合理性在于,存在于lipid ii分子中参与大多数抗生素结合的基本单元在 尿嘧啶二磷酸-n-乙酰胞壁酰-五肽中完全一致。与现有技术相比,本发明具 有以下优点:
45.本发明提供了一种人类口腔放线菌来源的防御素(amsin),其能够 选择性靶向细菌细胞壁合成而致细菌裂解。amsin具有高效低毒的药物 特性,能够治疗小鼠活体模型中系统性细菌感染。完整的离体和活体数据 表明amsin结构稳定、靶标明确、无毒并具有治疗
系统性感染的潜能,是 一个具有治疗前途的抗生素药物,其作用靶标为抑制敏感细菌的细胞壁合成。
附图说明
46.以下,结合附图来详细说明本发明的实施方案,其中:
47.图1为获得本发明的防御素amsin的流程图。a.编码amsin及其 旁系同源基因的口腔源放线菌(actinomyces sp.oral taxon 171str.f0337)的 环状基因组示意图。其中,amsin簇(amsin以及amsin-1到amsin-3) 及其邻位基因被标示。此基因组的bioproject数据库编号为prjna43131。 b.pcr扩增含有amsin的基因簇。c.放线菌源防御素与多种细胞生物源 防御素的序列比对。6个完全保守的半胱氨酸用阴影标示,其形成的三对二 硫键用线条标示。非半胱氨酸的保守性残基加灰色阴影。蛋白质二级结构元 件来自于amsin的nmr结构数据(见图3)。
48.图2为化学合成本发明的防御素amsin的氧化折叠产物鉴定。a. hp-hplc纯化氧化折叠的目标产物(用信号标示);b.maldi-tof质谱 鉴定。单电荷和双电荷峰被标示。
49.图3为本发明的防御素amsin抑制细菌细胞壁的生物合成的示意图。 a.比较本发明的防御素amsin和三个临床用抗生素(利福平(rif)、卡 拉霉素(kan)和万古霉素(van))对敏感细菌的生长动力学影响;b.荧 光染料法测定本发明的防御素amsin对细菌细胞膜的损伤效应。万古霉素 和蝎毒液裂解肽meucin-18分别用作阴性和阳性对照;c.扫描电镜观察本 发明的防御素amsin处理的细菌细胞形态的变化;d.本发明的防御素 amsin处理细菌细胞导致细胞内可溶性细胞壁合成前体物的累积;e.水溶 性和水不溶性细胞壁前体物(ump、脂质i和脂质ii)结构示意图比较;f.圆 二色谱(cd)分析本发明的防御素amsin和ump混合物;g.esi-ms检 测本发明的防御素amsin和ump非共价键复合物形成。在图c和d中, 万古霉素被用作阳性对照。图d中的小图显示增加本发明的防御素amsin 浓度能够诱导更多的复合物的形成。
50.图4为本发明的防御素amsin的治疗潜能评估。a.抑菌圈实验测定 本发明的防御素amsin在水和血清中的稳定性。横坐标为处理时间(小 时),纵坐标为抑菌圈大小(毫米);b.本发明的防御素amsin的溶血性 测定,蝎毒液来源的裂解肽meucin-18用作阳性对照;c.抑菌圈实验测定 本发明的防御素amsin的dna结合特性;d.卵母细胞电压钳技术测定 本发明的防御素amsin对异源表达的离子通道的阻断效应。e.小鼠肺炎 模型测定本发明的防御素amsin对肺炎链球菌(streptococcus pneumoniae) 引发的肺部感染的活体治疗效果;f.小鼠腹膜炎模型用于测定本发明的防 御素amsin对甲氧西林耐药性的金黄色葡萄球菌(methicillin-resistantstaphylococcus aureus)引发的系统性感染的活体治疗效果。
具体实施方式
51.下面结合具体实施例对本发明作进一步的说明,本发明的实施例及试验 例是为了使本领域的技术人员能够更好地理解本发明,但并不对本发明作任 何限制。
52.实施例1抗菌防御肽amsin的发现和鉴定
53.本发明人发现,放线菌actinomyces sp.oral taxon 171str.f0337基因组 编码一个串联的防御素基因簇。该簇由4个基因组成,其编码产物分别命 名为actinomycesin
(缩写为amsin)以及amsin-1到amsin-3(图1a 所示)(氨基酸序列如seq id no:1-4所示,核酸序列如seq id no:5-8所 示)。从该物种基因组dna中,本发明人进行pcr扩增并测序证实了该基 因簇的存在(图1b)。所用正向引物如seq id no:9所示,反向引物如seqid no:10所示。
54.seq id no:9 5
’‑
tcctcaccccacacagaact-3’;
55.seq id no:10 5
’‑
acaggccccgtgttacgtct-3’。
56.这4个细菌防御素与真核生物(真菌和动物)防御素一样,含有6个保 守的半胱氨酸,形成三对分子内二硫键。另外,它们还共享其它5个保守性 氨基酸,包括3个甘氨酸、1个组氨酸和1个脯氨酸(图1c),其中甘氨酸 和脯氨酸为常见的结构性残基。在这4个细菌防御素中,amsin与一组被 称为古典无脊椎动物型防御素具有高度的序列相似,其中与蜘蛛防御素smdefensin达到了64%的序列一致性。与真菌来源的孢子霉素序列一致性达到 了54%(图1c)。
57.实施例2 amsin的化学合成、氧化折叠和鉴定
58.为了研究amsin的抗菌活性、机制以及治疗潜能,本发明人首先化学 合成了它的直线肽。利用传统的氧化复性方法,本发明人获得了高纯度的 amsin复性产物(图2a)。所用氧化折叠方法如下:先将1毫克多肽溶于 0.2毫升无菌水,然后补加二甲基亚砜(dmso)至终浓度10%(v/v)。混 匀后室温孵育30分钟,加入0.8ml磷酸缓冲液(140mm nacl、2.7mm kcl、 10mm na2hpo4和1.8mm kh2po4,ph 7.5),25℃温育过夜。利用rp-hplc 纯化氧化复性产物。利用基质辅助激光解析电离飞行时间质谱(maldi-tofms),本发明人确定了amsin的质荷比(m/z)为4065.9(图2b),与氧化 型产物的理论分子量4065.6da高度吻合。maldi-tof分析在中国科学院 生物物理所完成。
59.实施例3 amsin抗菌活性测定
60.经典的抑菌圈法用于测定amsin的抗菌活性。针对不同的细菌株,本 发明人采用了不同的细菌培养基,包括luria-bertani(lb)培养基、thy 培养基(每升含有30g todd hewitt液体培养基和5g酵母抽提物)、胰蛋白 大豆肉汤(tsb)培养基(oxoid,basingstoke,uk)、普通肉汤培养基和 脑心浸出液肉汤(bhi)(北京陆桥技术股份有限公司)、马铃薯葡萄糖(pd) 培养基。具体方法如下:
61.1.将细菌平板置于37℃或30℃/28℃下培养过夜,取单克隆接种到 液体培养基,培养至晚对数生长期;
62.2.取10μl新鲜的细菌培养液加入6ml含有0.8%(v/v)琼脂的预热 的固体培养基,充分混匀后倒入一个ф90mm平皿中;
63.3.待培养基凝固后,用胶头滴管打孔ф2mm,设置倍比稀释的浓度梯 度,每孔2μl上样,相应温度培养过夜;
64.4.测量抑菌圈直径,以多肽用量的对数值为自变量,抑菌圈直径的平 方为因变量绘制散点图,计算致死浓度c
l
=2.93/(ak10
m/k
),m代表截距(intercept),k代表斜率(slope),a为打孔的深度为1mm。
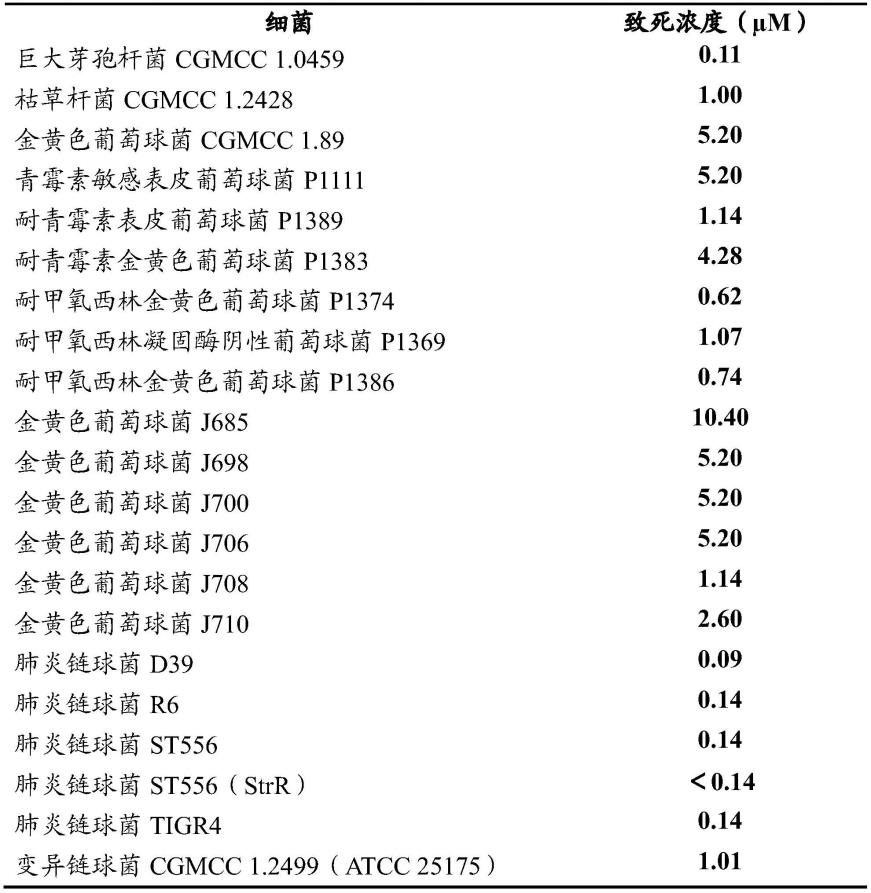
65.利用该技术,本发明人定量地评估了amsin的抗菌活性。结果表明, amsin对多种革兰氏阳性细菌具有广泛的抗菌活性(表1)。其中对肺炎链 球菌(streptococcus pneumoniae(菌株d39、r6、st556和tigr4))及其 链霉素抗性株的致死浓度在0.10μm左右;
对三种人类口腔来源的变形链球 菌(streptococcus mutans)、唾液链球菌(streptococcus salivarius)和血链球 菌(streptococcus sanguinis)的致死浓度范围在0.5-1.4μm之间;对葡萄球 菌属staphylococcus菌株,包括一些耐青霉素和耐甲氧西林的金黄色葡萄球 菌的临床分离株的致死浓度在0.6-5.0μm之间;对屎肠球菌(enterococcusfaecium)的致死浓度为4.65μm。
66.表1 amsin对各种敏感细菌的致死浓度值
[0067][0068][0069]
说明:strr指链霉素抗性(streptomycin-resistant)。
[0070]
实施例4 amsin抗菌机制研究
[0071]
为了研究amsin的抗菌机制,本发明人首先评估了它对细菌生长动力 学的影响,并选用三种具有不同抗菌机制的临床用抗生素作为对照,包括抑 制细菌细胞壁合成的万古霉素,抑制细菌rna合成的利福平以及干扰细菌 蛋白质合成的卡拉霉素。所用方法如下:
[0072]
1.将培养过夜的变形链球菌(streptococcus mutans)单克隆接种到普通 肉汤培养基,在37℃条件下培养至0.25-0.3od
600
;
[0073]
2.用含有amsin或抗生素的培养基稀释1倍至0.125-0.15od
600
。
[0074]
3.每孔加入200μl药物处理的细菌培养物,在bioscreen c仪器(labsystems,helsinki,finland)上37℃振荡培养并记录药物对细菌生长曲线 的影响。
[0075]
结果发现,amsin与万古霉素具有一致的杀菌动力学行为(图4a), 而与卡拉霉素和利福平的效应不同,提示它可能是一个细菌细胞壁合成的抑 制剂。
[0076]
为了验证amsin是否与万古霉素一样缺乏对细菌细胞膜的损伤效应, 本发明人利用荧光染料技术比较了它们对巨大芽孢杆菌细胞膜的影响。所用 方法如下:
[0077]
1.将悬浮于500μl磷酸盐缓冲液(ph 7.3)的巨大芽孢杆菌细胞(5
×
105) 与1μm特异性结合dna分子的荧光染料碘化丙啶(pi)混合,在黑暗中室 温温育5分钟。
[0078]
2.利用f-4500fl型荧光分光度计(hitachi high-technology company, japan)实时测量细胞的基础荧光值(λexc=525nm;λems=595nm)。当荧光 达到恒定值后加入amsin持续测定药物处理对荧光强度的影响。万古霉素 和来自蝎毒液的细胞裂解肽meucin-18分别倍用作阴性和阳性对照。该测定 显示amsin和万古霉素对于细菌细胞膜没有造成明显的损伤(图4b)。
[0079]
为了比较amsin和万古霉素对细菌形态的影响,本发明人完成了扫描 电镜观察。方法如下:巨大芽孢杆菌与10倍c
l
浓度的amsin在37℃下 孵育1.5小时,2.5%戊二醛固定1小时,然后pbs(ph7.3)洗涤三次。细 胞经乙醇梯度脱水,然后由全自动临界点干燥仪bal-tec cpd-030干燥, 再用溅射镀膜机bal-tec scd005喷金处理。图像由fei quanta 450扫描 电子显微镜拍摄。结果发现两者能够显著改变巨大芽孢杆菌的形态特征,相 对于没有经过药物处理的细胞,药物处理后细胞长度发生了明显的改变(图 4c)。
[0080]
细胞壁前体累积实验测定表明,与万古霉素类似,amsin处理细菌导 致其细胞质可溶性的细胞壁合成前体尿嘧啶二磷酸-n-乙酰胞壁酰-五肽 (udp-murnac-pentapeptide,简称ump)的表达量显著增加(图4d),进 一步支持amsin的靶点在于抑制细胞壁合成前体物质。所用方法如下:
[0081]
1)金黄色葡萄球菌(s.aureus)进行复壮后,接种到40ml的肉汤(broth) 液体培养基,使od至达到0.5。
[0082]
2)加终浓度为130μg/ml氯霉素,培养15min。
[0083]
3)分别加入amsin和万古霉素及等体积的培养基,继续培养30min, 12000rpm,离心1min。
[0084]
4)500μl ddh2o重悬菌体,滴加至13ml的100℃的h2o中,磁力搅拌 30min。
[0085]
5)继续搅拌,至室温,离心20000rpm,4℃,1h。rvc2-18cd plus christ (德国)台式离心机浓缩仪冻干样品。
[0086]
6)加450μl的50mm nh4ac(ph 5.2)溶解复合物。
[0087]
7)加50μl冰醋酸,颠倒混匀,12000rpm,4℃,1h。
[0088]
8)rp-hplc检测和收集尿嘧啶二磷酸-n-乙酰胞壁酰-五肽(出峰时间 在11分钟左右)。柱子为thermoscientific hypersil ods(4.6
×
150mm,5μm), 流动相a:50mm nh4ac(ph 5.2),b:甲醇。采用线性梯度洗脱方法收集 蛋白,流速为1ml/min。待样品被洗脱后,冻干并利用maldi-tof进行检 测。
[0089]
先前一些已知抑制细菌细胞壁合成的肽类抗生素主要靶点是膜锚定的 磷脂类ii(lipid ii)分子的焦磷酸基团以及与n-乙酰胞壁酰连接的五肽残 基。因为这些组件来自于ump(图4e),本发明人分析了amsin与ump 之间的相互作用。首先,利用圆二色谱(cd)技术,本发明人发现amsin 与ump混合物的cd谱发现了改变,出现了新的吸收峰(图4f),提示它 们之间可能形成了非共价键复合物。利用电喷雾质谱(esi-ms)技术,本发 明人证实了该复合物的存在(图4g),证实了amsin的抗菌活性在于其与 细胞壁前体物的结合抑制了细胞壁的合成效率。
[0090]
实施例5 amsin治疗潜力评估
[0091]
因为靶向细胞壁合成的肽类抗生素可以显著延缓抗药性的产生,本发明 人因此评估了amsin作为抗感染药物的治疗潜能。本发明人发现在37℃ 条件下水中温浴48小时或在小鼠血清中温浴24小时,amsin的抗菌活性 完全保持(图4a),表明它的高度稳定性。不同于经典的溶血肽,amsin 在远高于抗菌所用浓度的剂量下表现出相当低的溶血性(图4b)。在存有高 剂量鲑鱼精dna的条件下,amsin保持了全部的抗菌活性(图4c),提示 它缺乏结合dna的能力,可能不会对人体遗传物质的稳定性产生影响。另 外,虽然amsin与蝎毒素的空间结构相似,均为csαβ结构类型,但是在 高浓度下(100μm)它对多种存在于人体中枢神经系统和心脏的离子通道(如 nav1.5、kv1.4、kv1.5、kv2.1、kv4.3和herg)没有任何效应(图4d)。因 为nav1.5、kv1.5、kv4.3和herg主要负责心肌细胞动作电位的产生和传导, 本发明人获得的结果表明amsin对于人体的心脏缺乏毒性。利用 streptococcus pneumoniae d39建立的小鼠肺炎模型,本发明人发现amsin 显著减少了感染小鼠肺部的细菌载量,下降幅度达到了4.6-6.7log10数量级, 其效率与青霉素相当(图4e)。在methicillin-resistant staphylococcus aureusp1374诱发的腹膜炎模型中,amsin能够治愈活体感染的小鼠(图4f)。
[0092]
尽管已经对本发明的具体实施方式进行了详细说明和描述,但应当认 识到,本发明不受所述具体实施方式的限制。在不脱离本发明主旨和范围 的情况下,可以对本发明做出各种改进、修饰和变化,而这些改进、修饰 和变化均在本发明的范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。