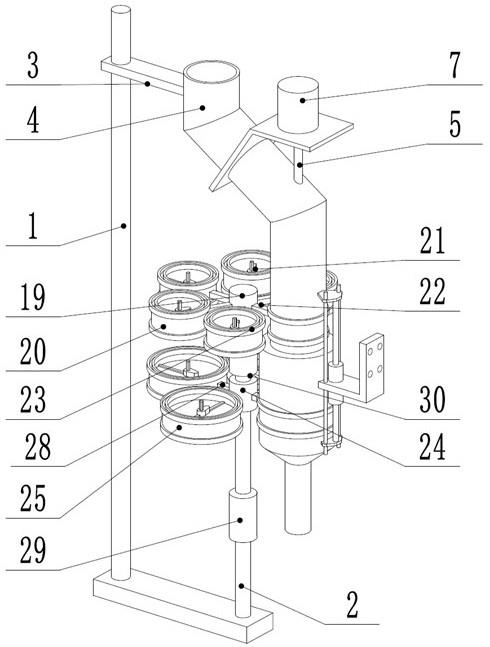
本发明属于有机合成技术领域,具体涉及一种2,3,5-三取代-2,3-二氢-氧杂三氮唑衍生物及其制备方法。
背景技术:
杂环骨架广泛存在于药物分子及具有生物活性的天然产物中,是许多化合物表现生物活性的分子基础和关键结构。作为一种五元杂环骨架,氧杂三氮唑也存在于一些生物活性分子中,具有降血压、抗抑郁、抗癫痫等等多种生物活性(参见美国专利us005403851,日本专利jp45020904b)。但氧杂三氮唑衍生物的合成方法较少,目前文献报道的方法主要是用重氮化合物和硝基化合物加成合成含氧杂三氮唑-5-酮衍生物(参见chemistry
–
a european journal,2020,26,14530-14535)。该方法需以重氮化合物为原料,反应条件苛刻,且存在一定的安全隐患,并且只能合成得到氧杂三氮唑-5-酮的内盐,不能合成多取代的氧杂三氮唑衍生物。
技术实现要素:
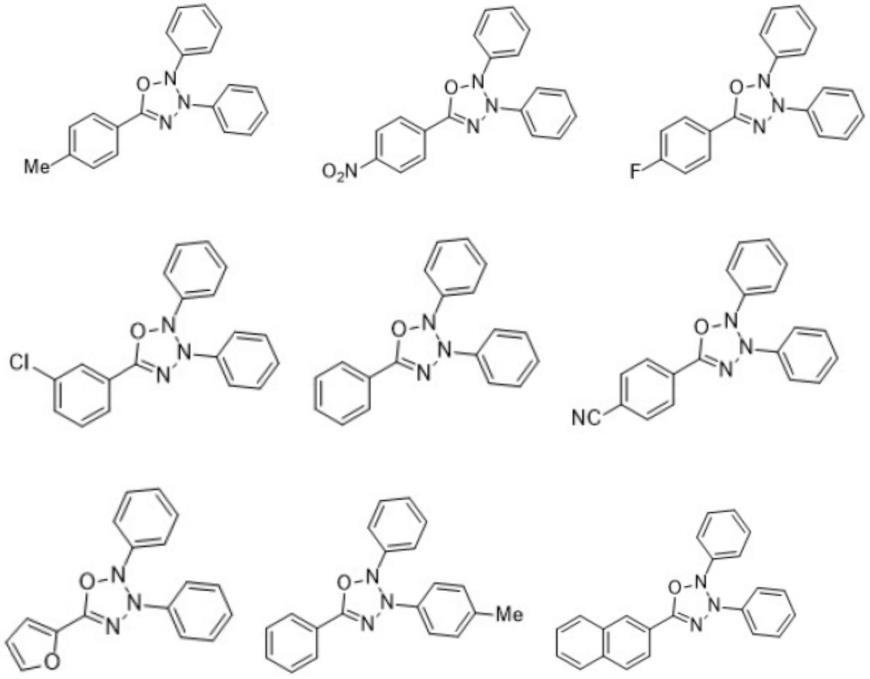
为了解决现有技术的上述不足,本发明的目的在于提供一种2,3,5-三取代-2,3-二氢-氧杂三氮唑衍生物及其制备方法。本发明操作简便、反应条件温和、后处理方便。本发明的目的通过以下技术方案得到:一种2,3,5-三取代-2,3-二氢-氧杂三氮唑衍生物,其具有如下的化学结构:其中,ar1为苯基、对氟苯基、对氯苯基、对溴苯基、对甲基苯基、对甲氧基苯基、对硝基苯基、对氰基苯基、2-呋喃基和2-噻吩基中的一种;ar2为苯基或对甲基苯基,ar3为苯基、对氯苯基和对乙氧酰基苯基中的一种。优选的,所述2,3,5-三取代-2,3-二氢-氧杂三氮唑衍生物,其具有如下的化学结构之一:
上述2,3,5-三取代-2,3-二氢-氧杂三氮唑衍生物的制备方法,包括如下步骤:取α-氯代芳基腙和芳基亚硝基化合物,在碱和溶剂存在的情况下进行反应,反应结束后,先蒸发出去溶剂,再柱层析,得到所述2,3,5-三取代-2,3-二氢-氧杂三氮唑衍生物;所述α-氯代芳基腙具有如下的化学结构:其中,ar1为苯基、对氟苯基、对氯苯基、对溴苯基、对甲基苯基、对甲氧基苯基、对硝基苯基、对氰基苯基、2-呋喃基和2-噻吩基中的一种;ar2为苯基或对甲基苯基;所述芳基亚硝基化合物具有如下的化学结构:其中,ar3为苯基、对氯苯基和对乙氧酰基苯基中的一种。
优选的,α-氯代芳基腙、芳基亚硝基化合物和碱的摩尔比为1:1.3:1。优选的,α-氯代芳基腙在反应体系中的浓度(以n-取代靛红计)为0.1~0.2mol/l。优选的,碱为有机碱和无机碱中的至少一种;所述有机碱为三乙胺、二异丙基乙基胺和4-二甲氨基吡啶(dmap)中的至少一种;所述无机碱为碳酸钠、碳酸钾和乙醇钠中的至少一种。优选的,溶剂为四氢呋喃、二氯甲烷、三氯甲烷、乙酸乙酯、丙酮、乙腈、二氧六环和甲苯中的至少一种。优选的,反应的温度为25~80℃。优选的,反应的时间为1~5天。优选的,柱层析洗脱的方式为:以石油醚:乙酸乙酯的体积比为10:1~6:1组成的混合溶剂作为洗脱剂进行柱层析洗脱,所述洗脱的流速为5-6ml/min,所述洗脱的时间为30~40min。与现有技术相比,本发明的有益效果包括:(1)本发明可高效制备2,3,5-三取代-2,3-二氢-氧杂三氮唑衍生物,目前未见合成此类化合物的文献报道。(2)本发明制备2,3,5-三取代-2,3-二氢-氧杂三氮唑衍生物的原料容易制备,反应条件温和,操作简便,产物收率较高。
附图说明
图1为实施例3制备的终产物的c谱图。图2为实施例3制备的终产物的h谱图。图3为实施例4制备的终产物的c谱图。图4为实施例4制备的终产物的h谱图。图5为实施例5制备的终产物的c谱图。图6为实施例5制备的终产物的h谱图。图7为实施例6制备的终产物的c谱图。图8为实施例6制备的终产物的h谱图。图9为实施例7制备的终产物的c谱图。图10为实施例7制备的终产物的h谱图。图11为实施例8制备的终产物的c谱图。图12为实施例8制备的终产物的h谱图。图13为实施例9制备的终产物的c谱图。图14为实施例9制备的终产物的h谱图。图15为实施例10制备的终产物的c谱图。图16为实施例10制备的终产物的h谱图。图17为实施例11制备的终产物的c谱图。图18为实施例11制备的终产物的h谱图。图19为实施例12制备的终产物的c谱图。图20为实施例12制备的终产物的h谱图。
图21为实施例13制备的终产物的c谱图。图22为实施例13制备的终产物的h谱图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。实施例所述对氯亚硝基苯按照如下文献制备得到:(defoin,a.synthesis.2004,5,706
–
710.)。所述对亚硝基苯甲酸乙酯按照如下文献制备得到:(defoin,a.synthesis.2004,5,706
–
710.)。所述n-苯基-4-氟苯甲肼酰氯按照如下文献制备得到:(wang,g.;liu,x.-h.;huang,t.-y.;kuang,y.-l.;lin,l.-l.;feng,x.-m.org.lett.2013,15(1),76
–
79.)。所述n-苯基-3-氯苯甲肼酰氯按照如下文献制备得到:(wang,g.;liu,x.-h.;huang,t.-y.;kuang,y.-l.;lin,l.-l.;feng,x.-m.org.lett.2013,15(1),76
–
79.)。所述n-苯基-4-甲基苯甲肼酰氯按照如下文献制备得到:(guo,z.-y.;jia,h.;liu,h.-l.;wang,q.-j.;huang,j.-x.;guo,h.-c.org.lett.2018,20(10),2939
–
2943.)。所述n-苯基-4-硝基苯甲肼酰氯按照如下文献制备得到:(shi,t.;wu,z.-x.;jia,t.-t.;zhang,c.;zeng,l.-h.;zhuang,r.-x.;zhang,j.-k.;liu,s.-r.;shao,j.-a.;zhu,h.-j.chem.commun.2021,57(68),8460
–
8463.)。所述n-苯基-4-氰基苯甲肼酰氯按照如下文献制备得到:(yavari,i.;khaledian,o.chem.commun.2020,56(64),9150
–
9153)。所述n-苯基-1-萘甲肼酰氯按照如下文献制备得到:(wang,g.;liu,x.-h.;huang,t.-y.;kuang,y.-l.;lin,l.-l.;feng,x.-m.org.lett.2013,15(1),76
–
79.)。所述n-苯基-2-呋喃甲肼酰氯按照如下文献制备得到:(wang,g.;liu,x.-h.;huang,t.-y.;kuang,y.-l.;lin,l.-l.;feng,x.-m.org.lett.2013,15(1),76
–
79.)。所述n-(4-甲基苯基)苯甲肼酰氯按照如下文献制备得到:(wang,g.;liu,x.-h.;huang,t.-y.;kuang,y.-l.;lin,l.-l.;feng,x.-m.org.lett.2013,15(1),76
–
79.)。实施例1:亚硝基苯的制备称取对氯苯胺1.16g(12.5mmol)溶于甲醇4ml中。冰浴下将h2o2(30%,aq)7.2ml(76.2mmol)溶于5ml水中配成溶液,再缓慢滴入,即有白色固体析出。滴加完毕后,搅拌15min,再加入moo3粉末0.175g(1.25mmol),最后将1.25ml1m koh溶液缓慢滴入。反应室温下搅拌过夜。待原料消失后,加水稀释,过滤,用水洗涤固体4~5次,再用冷甲醇洗涤2次。收集固体,干燥得粗品亚硝基苯1.12g,产率84%,可直接用于后续反应。实施例2:n-苯基苯甲肼酰氯(α-氯代芳基腙)的制备称取苯甲醛2.12g(20mmol),溶于10ml的甲醇中,将苯肼2.16g(20mmol)缓慢的滴入,滴加完毕后即出现浅黄色沉淀。待薄层色谱监测到原料消失(对应反应完全)后,抽滤得苯腙固体。n-氯代丁二酰亚胺(ncs)2.67g(20mol)溶于20ml二氯甲烷,冰浴下缓慢加入二甲硫醚(22mol),搅拌30min,再缓慢加入所得到的苯腙,反应完全后,反应液倒入冰水,二氯甲
烷萃取3次,合并有机相后用饱和食盐水洗涤一次,无水硫酸钠干燥,减压蒸馏除去溶剂,柱层析法(石油醚/乙酸乙酯=10/1,流速10-12ml/min,洗脱时间60-70min。)得到产物n-苯基苯甲肼酰氯(α-氯代芳基腙)3.15g,黄色粉末,收率68%。实施例3:n-苯基苯甲肼酰氯(α-氯代芳基腙)与亚硝基苯的反应在干燥的schlenk管中加入n-苯基苯甲肼酰氯(115.0mg,0.5mmol),亚硝基苯(69.6mg,0.65mmol),三乙胺(50.6mg,0.5mmol),四氢呋喃(5ml),室温搅拌2天。反应完毕后,减压蒸馏除去溶剂得粗产品,再经硅胶柱柱层析(石油醚/乙酸乙酯=10/1,流速5-6ml/min,洗脱时间30-40min。)分离得到产物129.6mg,黄色固体,产率86%。m.p.104
–
106℃,1h nmr(400mhz,cdcl3,tms):δ=8.05
–
8.03(m,2h),7.86
–
7.84(m,2h),7.57
–
7.53(m,1h),7.50
–
7.40(m,5h),7.26
–
7.22(m,2h),7.07
–
7.01ppm(m,3h);
13
c nmr(100mhz,cdcl3,tms):δ=156.1,147.1,145.0,131.6,130.4,128.0,127.7,127.6,126.3,123.7,121.4,118.6ppm.实施例4:n-苯基苯甲肼酰氯与对氯亚硝基苯的反应在干燥的schlenk管中加入n-苯基苯甲肼酰氯(115.0mg,0.5mmol),对氯亚硝基苯(92.0mg,0.65mmol),三乙胺(50.6mg,0.5mmol),四氢呋喃(5ml),室温搅拌3天。反应完毕后,减压蒸馏除去溶剂得粗产品,再经硅胶柱柱层析(石油醚/乙酸乙酯=10/1,流速5-6ml/min,洗脱时间30-40min。)分离得到产物137.7mg,褐色固体,产率82%。m.p.105
–
107℃,1h nmr(400mhz,cdcl3,tms):δ=8.08
–
8.06(m,2h),7.86
–
7.83(m,2h),7.61
–
7.57(m,1h),7.49
–
7.40(m,5h),7.21
–
7.18(m,2h),6.96
–
6.94ppm(m,2h);
13
c nmr(100mhz,cdcl3,tms):δ=157.7,146.6,145.8,133.0,132.4,131.7,130.0,129.2,128.8,128.7,127.4,122.4,121.1ppm.实施例5:n-苯基苯甲肼酰氯与对亚硝基苯甲酸乙酯的反应在干燥的schlenk管中加入n-苯基苯甲肼酰氯(115.0mg,0.5mmol),对亚硝基苯甲酸乙酯(116.5mg,0.65mmol),三乙胺(50.6mg,0.5mmol),四氢呋喃(5ml),室温搅拌3天。反应完毕后,减压蒸馏除去溶剂得粗产品,再经硅胶柱柱层析(石油醚/乙酸乙酯=10/1,流速5-6ml/min,洗脱时间30-40min。)分离得到产物151.2mg,黄色固体,产率81%。m.p.115
–
117℃,1h nmr(400mhz,cdcl3,tms):δ=8.04(d,j=8.0hz,2h),7.94(d,j=8.8hz,2h),7.87
–
7.85(m,2h),7.58
–
7.42(m,6h),7.05(d,j=8.4hz,2h),4.31(q,j=7.2hz,2h),1.35ppm(t,j=7.2hz,3h);
13
c nmr(100mhz,cdcl3,tms):δ=166.4,157.8,152.6,145.8,133.1,132.2,131.9,130.4,129.2,128.9,127.6,126.6,122.4,119.3,60.8,14.4ppm.实施例6:n-苯基-4-氟苯甲肼酰氯与亚硝基苯的反应在干燥的schlenk管中加入n-苯基-4-氟苯甲肼酰氯(124.3mg,0.5mmol),亚硝基苯(69.6mg,0.65mmol),三乙胺(50.6mg,0.5mmol),四氢呋喃(5ml),室温搅拌3天。反应完毕后,减压蒸馏除去溶剂得粗产品,再经硅胶柱柱层析(石油醚/乙酸乙酯=10/1,流速5-6ml/min,洗脱时间30-40min。)分离得到产物130.9mg,棕褐色固体,产率82%。m.p.103
–
105℃,1h nmr(400mhz,cdcl3,tms):δ=8.05
–
8.03(m,2h),7.87
–
7.84(m,2h),7.60
–
7.55(m,1h),7.47
–
7.43(m,2h),7.26
–
7.22(m,2h),7.13
–
7.04(m,3h),7.01
–
6.99ppm(m,2h);
13
c nmr(100mhz,cdcl3,tms):δ=163.7(j
c-f
=249.4hz),155.0,146.9,
144.9,131.9,128.6(j
c-f
=9.6hz),128.1,127.8(j
c-f
=3.3hz),127.7,123.8,121.4,118.6,114.9ppm(j
c-f
=21.9hz).实施例7:n-苯基-3-氯苯甲肼酰氯与亚硝基苯的反应在干燥的schlenk管中加入n-苯基-3-氯苯甲肼酰氯(132.6mg,0.5mmol),亚硝基苯(69.6mg,0.65mmol),三乙胺(50.6mg,0.5mmol),四氢呋喃(5ml),室温搅拌3天。反应完毕后,减压蒸馏除去溶剂得粗产品,再经硅胶柱柱层析(石油醚/乙酸乙酯=10/1,流速5-6ml/min,洗脱时间30-40min。)分离得到产物122.6mg,棕色固体,产率73%。m.p.99
–
101℃,1h nmr(400mhz,cdcl3,tms):δ=8.05(d,j=8.0hz,2h),7.89(s,1h),7.68(d,j=8.0hz,1h),7.61
–
7.57(m,1h),7.48
–
7.44(m,3h),7.35(t,j=8.0hz,1h),7.25(t,j=8.0hz,2h),7.07(t,j=7.6hz,1h),7.00ppm(d,j=7.6hz,2h);
13
c nmr(100mhz,cdcl3,tms):δ=155.9,147.7,145.9,134.9,134.6,133.0,131.4,130.0,129.1,128.7,127.5,125.4,125.1,122.5,119.7ppm.实施例8:n-苯基-4-甲基苯甲肼酰氯与亚硝基苯的反应在干燥的schlenk管中加入n-苯基-4-甲基苯甲肼酰氯(122.4mg,0.5mmol),亚硝基苯(69.6mg,0.65mmol),三乙胺(50.6mg,0.5mmol),四氢呋喃(5ml),室温搅拌3天。反应完毕后,减压蒸馏除去溶剂得粗产品,再经硅胶柱柱层析(石油醚/乙酸乙酯=10/1,流速5-6ml/min,洗脱时间30-40min。)分离得到产物121.4mg,褐色固体,产率77%。m.p.108
–
110℃,1h nmr(400mhz,cdcl3,tms):δ=8.04
–
8.02(m,2h),7.74(d,j=8.0hz,2h),7.57
–
7.53(m,1h),7.45
–
7.41(m,2h),7.25
–
7.21(m,4h),7.06
–
6.99(m,3h),2.39ppm(s,3h);
13
c nmr(100mhz,cdcl3,tms):δ=157.2,148.2,146.0,141.9,132.8,129.8,129.5,129.0,128.6,127.3,124.6,122.4,119.7,21.6ppm.实施例9:n-苯基-4-硝基苯甲肼酰氯与亚硝基苯的反应在干燥的schlenk管中加入n-苯基-4-硝基苯甲肼酰氯(137.8mg,0.5mmol),亚硝基苯(69.6mg,0.65mmol),三乙胺(50.6mg,0.5mmol),四氢呋喃(5ml),室温搅拌3天。反应完毕后,减压蒸馏除去溶剂得粗产品,再经硅胶柱柱层析(石油醚/乙酸乙酯=10/1,流速5-6ml/min,洗脱时间30-40min。)分离得到产物128.1mg,棕褐色固体,产率74%。m.p.112
–
114℃,8.28
–
8.26(m,2h),8.06
–
8.00(m,4h),7.62(t,j=8.0hz,1h),7.51
–
7.47(m,2h),7.30
–
7.24(m,2h),7.14
–
7.10(m,1h),7.02
–
7.00ppm(m,2h);
13
c nmr(100mhz,cdcl3,tms):δ=155.2,149.4,147.4,145.8,138.8,133.5,129.4,129.0,128.5,125.8,124.1,122.6,120.0ppm.实施例10:n-苯基-4-氰基苯甲肼酰氯与亚硝基苯的反应在干燥的schlenk管中加入n-苯基-4-氰基苯甲肼酰氯(127.9mg,0.5mmol),亚硝基苯(69.6mg,0.65mmol),三乙胺(50.6mg,0.5mmol),四氢呋喃(5ml),室温搅拌3天。反应完毕后,减压蒸馏除去溶剂得粗产品,再经硅胶柱柱层析(石油醚/乙酸乙酯=10/1,流速5-6ml/min,洗脱时间30-40min。)分离得到产物150.1mg,淡黄色固体,产率92%。m.p.96
–
98℃,1h nmr(400mhz,cdcl3,tms):δ=8.07
–
8.05(m,2h),7.95
–
7.93(m,2h),7.71(d,j=8.4hz,2h),7.63
–
7.59(m,1h),7.50
–
7.46(m,2h),7.29
–
7.25(m,2h),7.12
–
7.08(m,1h),7.01
–
6.99ppm(m,2h);
13
c nmr(100mhz,cdcl3,tms):δ=155.4,147.4,145.7,137.0,133.3,132.5,129.2,128.8,127.9,125.5,122.4,119.8,118.3,114.6ppm.
实施例11:n-苯基-1-萘甲肼酰氯与亚硝基苯的反应在干燥的schlenk管中加入n-苯基-1-萘甲肼酰氯(140.4mg,0.5mmol),亚硝基苯(69.6mg,0.65mmol),三乙胺(50.6mg,0.5mmol),四氢呋喃(5ml),室温搅拌5天。反应完毕后,减压蒸馏除去溶剂得粗产品,再经硅胶柱柱层析(石油醚/乙酸乙酯=10/1,流速5-6ml/min,洗脱时间30-40min。)分离得到产物151.1mg,棕褐色固体,产率86%。
40.m.p.94
–
96℃,1h nmr(400mhz,cdcl3,tms):δ=8.22(s,1h),8.09
–
8.06(m,3h),7.89(d,j=8.8hz,1h),7.83(d,j=8.8hz,2h),7.57
–
7.42(m,5h),7.27
–
7.21(m,2h),7.08
–
7.04ppm(m,2h);
13
c nmr(100mhz,cdcl3,tms):δ=157.2,148.2,146.0,134.9,132.9,132.8,130.8,129.1,129.0,128.7,127.8,127.7,127.5,126.5,124.8,124.0,122.5,119.7ppm.实施例12:n-苯基-2-呋喃甲肼酰氯与亚硝基苯的反应在干燥的schlenk管中加入n-苯基-2-呋喃甲肼酰氯(110.3mg,0.5mmol),亚硝基苯(69.6mg,0.65mmol),三乙胺(50.6mg,0.5mmol),四氢呋喃(5ml),室温搅拌5天。反应完毕后,减压蒸馏除去溶剂得粗产品,再经硅胶柱柱层析(石油醚/乙酸乙酯=10/1,流速5-6ml/min,洗脱时间30-40min。)分离得到产物123.8mg,黄色固体,产率85%。m.p.96
–
98℃,1h nmr(400mhz,cdcl3,tms):δ=8.08
–
8.05(m,2h),7.59
–
7.56(m,2h),7.47
–
7.43(m,2h),7.25
–
7.21(m,2h),7.07
–
7.02(m,3h),6.92(d,j=3.2hz,1h),6.52
–
6.50ppm(m,2h);
13
c nmr(100mhz,cdcl3,tms):δ=148.4,147.3,146.9,146.1,145.4,133.0,132.9,129.0,128.7,125.1,122.5,120.2,114.1,112.0,111.9ppm.实施例13:n-(4-甲基苯基)苯甲肼酰氯亚硝基苯的反应在干燥的schlenk管中加入n-(4-甲基苯基)苯甲肼酰氯(122.4mg,0.5mmol),亚硝基苯(69.6mg,0.65mmol),三乙胺(50.6mg,0.5mmol),四氢呋喃(5ml),室温搅拌3天。反应完毕后,减压蒸馏除去溶剂得粗产品,再经硅胶柱柱层析(石油醚/乙酸乙酯=10/1,流速5-6ml/min,洗脱时间30-40min。)分离得到产物126.2mg,棕褐色固体,产率80%。m.p.112-114℃,1h nmr(400mhz,cdcl3,tms):δ=7.95
–
7.93(m,2h),7.85
–
7.83(m,2h),7.47
–
7.39(m,3h),7.25
–
7.21(m,4h),7.06
–
7.00(m,3h),2.40ppm(3h);
13
c nmr(100mhz,cdcl3,tms):δ=157.3,148.1,143.8,143.7,132.8,131.4,129.6,128.7,128.6,127.4,124.7,122.4,119.7,21.4ppm.本发明利用α-氯代芳基腙和芳基亚硝基化合物为原料,在碱的催化下发生环化反应,制备目前文献报道中不易合成的2,3,5-三取代-2,3-二氢-氧杂三氮唑衍生物。本发明所涉及的制备方法具有条件温和,操作简便,收率较高,后处理操作方便等优点。可为2,3,5-三取代-2,3-二氢-氧杂三氮唑衍生物提供一种新的合成方法。以上所述本发明的具体实施方式,并不构成对本发明保护范围的限定。任何根据本发明的技术构思所做出的各种其他相应的改变与变形,均应包含在本发明权利要求的保护范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。