1.本发明属于党参植物的种苗育种技术领域,尤其涉及一种党参再生体系的种子灭菌方法。
背景技术:
2.党参为桔梗科campanulaceae党参属codonopsis素花党参c.pilosula nannf. var,modesta(nannf.)l.t.shen或川党参c.tangshen oliv的干燥根,是我国重点保护的珍稀濒危药用植物之一。味甘、平,归脾、肺经。有补中益气,健脾益肺,是常用的传统补益药有增强免疫力、扩张血管、降压、改善微循环、增强造血功能等作用。此外对化疗放疗引起的白细胞下降有提升作用。党参已被列入药食同源名录,随着经济的发展和人民生活水平的提高,党参除了作药用外,已大量用于各种保健品和功能食品,今后国内党参的需求量将会大幅度增长。为适应消费结构升级的需要,增加优质特色党参的供给,品种培优、品质提升成为党参育种的重点。
3.党参的生产方式为种子直播和育苗移栽。种子直播时,因党参种子细小,幼苗喜阴,怕热,怕阳光直晒。因此党参苗期的常见问题为出苗、保苗、齐苗困难。育苗移栽时,育苗周期为1-2年方可移栽,周期较长且除草困难、费工费时。党参的育种工作现在仍处于常规育种阶段,多采用混合选择法和系统选育法进行育种,这2种方法不仅育种周期长,对品种的改良能力也有限。随着生物技术的发展,党参在生物技术育种方面有所突破。
4.利用组织培养手段进行种苗快繁,不仅周期短,繁殖系数高,还可很大程度降低党参苗期风险,解决出苗、保苗、齐苗的难题。建立党参再生体系对党参植物的种苗快繁、遗传转化,生物育种技术或者分子生物学方面的研究将具有重要意义。
5.党参种子作为再生体系稳定的外植体来源,质量较小,千粒重仅为0.349g,在组织培养中进行灭菌时,常出现以下问题:1、将种子直接浸入灭菌液中时,因种子质量太小,时常漂浮在液面上,不仅导致灭菌不彻底,污染率较高,还使灭完菌的种子从液体中分离十分困难。2、将种子进行隔离、包裹处理后,种子量少时,仍会漂浮在液面上;种子量多时,虽然会沉入液面下,但会出现与水流同速旋转相对速度为0的情况,冲洗、灭菌效果依然较差。
技术实现要素:
6.为了解决以上问题,本发明提供了一种党参再生体系的种子灭菌方法。
7.本发明是这样实现的:一种党参再生体系的种子灭菌方法,包括以下步骤:(1)挑选颗粒饱满,无病虫害的党参种子,用纱布包裹后,用自来水清洗3-5遍,清洗结束后,自然风干备用;(2)将党参种子包裹于细纱布中,用木夹子收口,用细绳一端系在木夹子上;(3)党参种子隔离、包裹处理好后用无菌水浸洗2遍,每次2min,种子浸入无菌水中时,细绳外漏于盛装无菌水的容器外,浸洗后提细绳将党参种子从液体中拉出;(4)用酒精浸泡过的镊子,在酒精灯上灼烧冷却后,挤压纱布包的多余水分,至无
水滴渗出;(5)将党参种子转入盛装有灭菌液的容器中,迅速做好密封,细绳外漏于盛装灭菌液的容器外,顺时针、逆时针反复摇晃盛装有灭菌液容器进行灭菌;(6)灭菌液处理过的党参种子将转入无菌水浸洗,(7)无菌水浸洗过的党参种子放在无菌滤纸上吸干水份,播种备用。
8.进一步的,所述的灭菌液为质量百分浓度为10%的naclo溶液。
9.进一步的,所述盛装有灭菌液的容器为磨口试剂瓶,使用瓶塞密封。
10.进一步的,步骤(5)中顺时针、逆时针反复摇晃盛装有灭菌液容器60~120s 进行灭菌。
11.进一步的,步骤(6)中党参种子用无菌水浸洗3-5遍,每次2min。
12.本发明采用细纱布包裹党参种子易于通过挤压掠去多余水分。用木夹子收口,利用木夹的重力牵引纱布沉入液面以下,即使种子量极少时,也不会漂浮在液面;灭菌结束后,易于解扣打开纱布,取出种子;振荡时,木夹将纱布牵引固定,整体与水流转速不一致,存在相对速度,冲刷充分,灭菌彻底。采用长细绳牵引,灭菌结束后,便于从灭菌液中拉出,而且使用细绳不影响灭菌容器密封,防止升汞挥发,导致灭菌效果变差。本发明方法方法操作简单,成本低廉,灭菌效果极好,对种子的损伤程度低,可获得生长健壮的无菌实生苗,是一种高效的灭菌技术。且该方法下制备的外植体愈伤组织形成率高,为党参再生体系的建立奠定了良好的关键的技术基础。
附图说明
13.图1为本发明的细纱布包裹党参种子浸泡示意图。
14.图中:1-烧杯,2-木夹子,3-夹子弹性紧固件,4-纱布,5-无菌水,6-细绳。
具体实施方式
15.下面结合具体实施方式对本发明做进一步的详细说明,以使本领域技术人员参照说明书文字能够据以实施。实施例
16.灭菌实验1材料与方法1.1供试材料,试验用党参种子来源于山西农业大学经济作物研究所药用植物资源圃,为当年收获的新种子,发芽率为97%以上。
17.1.2试验方法1.2.1种子隔离、包裹处理挑选颗粒饱满,无病虫害的党参种子,称取8g(约22860粒),平分成36份,每份约0.22g, 用纱布包裹后,用自来水清洗3-5遍,清洗结束后,自然风干备用。灭菌前对种子进行隔离、包裹处理,灭菌时采用以下4种方法将种子置于灭菌液中进行冲洗灭菌:(1) 将种子置于能合拢闭口的铁过滤网,冲洗灭菌时,连同铁过滤网浸入无菌水和灭菌液中。(2)将种子用细纱布包裹,短细绳扎口后,完全浸入无菌水和灭菌液中。(3)将种子用细纱布包裹,用长细绳扎口,包裹的种子浸入无菌水和灭菌液中,细绳外漏于灭菌容器外,用于牵引包
裹。(4)将种子包裹于细纱布中,用木夹子收口,再用8-10cm 长的细绳系在木夹子上,木夹收口包裹后的种子浸入无菌水和灭菌液中,细绳外漏于灭菌容器外,用于牵引包裹,如图1所示,用木夹子收口,所述的木夹子包括弹性紧固件3,整个木夹子的平均密度大于水,分析如下:木夹子2长时间在水中浸泡,本身与水的密度相当,夹子弹性紧固件3为金属,大于水的密度,使整个木夹子的平均密度大于水(木夹子可从市面直接购得),利用木夹的重力牵引纱布沉入液面以下,即使种子量极少时,也不会漂浮在液面,具体实施时夹子弹性紧固件不与无菌水(浸泡液)接触。
18.1.2.2不同灭菌剂和灭菌方法采用0.1%升汞和10%nacio两种灭菌液进行灭菌,种子隔离、包裹处理好后用无菌水浸洗2遍,每次2min,然后提细线或用镊子,将种子从液体中拉出或夹出,用酒精浸泡过的镊子,在酒精灯上灼烧冷却后,挤压纱布包的多余水分,至无水滴渗出,随后将种子转入250ml磨口试剂瓶内(内装60-70ml0.1%氯化汞溶液或10%nacio),迅速塞好瓶塞。顺时针、逆时针反复摇晃进行灭菌,接着转入无菌水浸洗3-5遍,每次2min最后将浸洗过的种子放在无菌滤纸上吸干水份,随即进行播种。
19.1.2.3不同灭菌处理种子4种不同隔离、包裹方法为1.2.1所述,分别记为a、b、c、d;灭菌液分为0.1%升汞和10%naclo两种,分别记为1、2;0.1%升汞灭菌时长分为5个时间间隔,分别为30s、60s、120s、180s、240s;10%nacio灭菌时长分为4个时间间隔,分别为5min、 10min、15min、20min;共36个处理。3次重复。
20.验证实验1.3培养条件灭菌后的种子接种于ms空白培养基中,每皿播种40粒。光照12小时,光照强度2000lx。
21.1.4愈伤组织的诱导及继代1.4.1愈伤组织诱导取生长35天的党参无菌实生苗的叶片和茎段,叶片沿叶缘剪1圈,茎段切成0.7-1.0cm 的长度,接种在ms 6-ba(0.3mg/l) 2,4-d(0.6mg/l) kt(0.3mg/l)的培养基上,暗培养,温度25
±
1℃。3周后开始出现愈伤组织,30天后统计愈伤组织诱导率。
22.1.4.2愈伤组织继代将不同外植体诱导的愈伤组织转入原培养基上进行继代培养,光/暗周期为16/8h,温度25
±
1℃。
23.1.5测定项目一周后种子开始破皮,20天后统计种子成活率,死亡率,污染率。
24.成活率(%)=发芽的种子数/接种的种子数
×
100%;死亡率(%)=未发芽的种子数/接种的种子数100%;污染率(%)=污染的种子数/接种的种子数
×
100%,愈伤组织形成率(%)=形成愈伤组织的外植体数/接种的外植体总数
×
100%。
25.试验数据采用spss.18进行统计和分析。
26.2结果
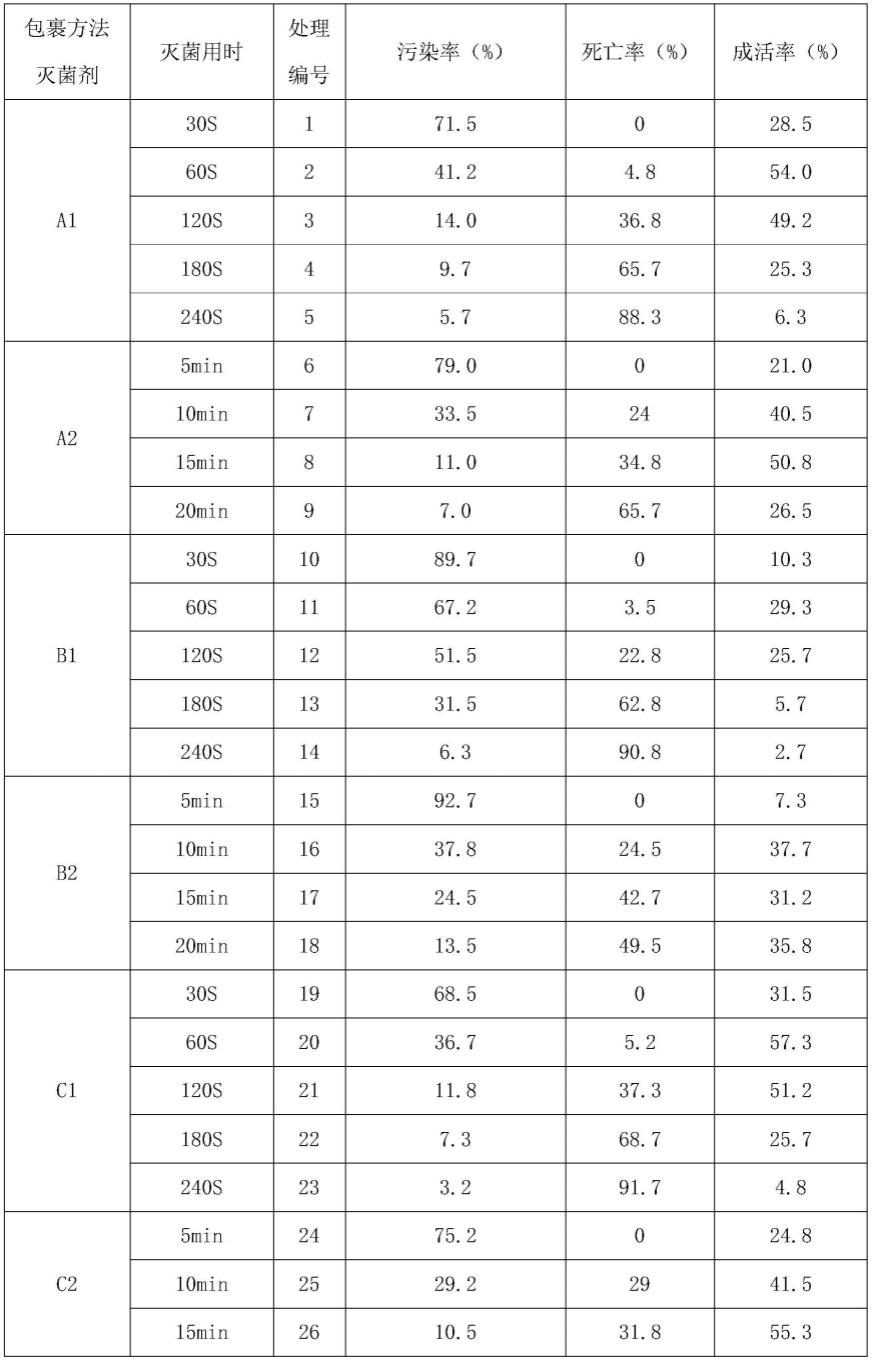
2.1不同灭菌处理对种子污染率、成活率的影响表1不同灭菌处理对种子污染率、成活率的影响
由表1可知污染率范围为0~92.7%,处理编号31、32的污染率最低,且为0%。此外污染率小于5%的处理有编号30、36、23、29、35,分别为2.17%、2.67%、3.17%、3.83%、 4.33%,其他处理的污染率均高于5%。成活率范围为0.8~91.3%,处理编号29的成活率最高,且为91.33%;处理编号30的成活率次之,且为82.00%;处理编号28的成活率为60.83%,居第3;其它处理的成活率均小于60%。本试验目的在于筛选污染率低,成活率高的灭菌方法,因此结合污染率、成活率筛选出处理编号31、32、30、 36、23、29、35、28为初步研究结果,对以上8个处理采用spss18进行方差分析结果见表2:表2 8个不同处理对种子污染率、成活率的显著性影响处理灭菌用时处理编号污染率(%)成活率(%)d1180s310.00
±
0.00
aa
4.33
±
0.29
fe
d1240s320.00
±
0.00
aa
0.83
±
0.76
ge
d1120s302.17
±
1.89
abab
82.00
±
0.87
bb
d220min362.67
±
2.36
abab
33.67
±
3.88
ed
c1240s233.17
±
0.76
bab
4.83
±
0.76
fe
d160s293.83
±
2.08
bb
91.33
±
2.75
aa
d215min354.33
±
0.76
bb
56.50
±
2.00
dc
d130s2839.00
±
1.32
cc
60.83
±
1.26
cc
由表2可知,8个处理中污染率范围为0.00~39.00%,处理31、32污染率最低且极显著低于其它处理。其它处理污染率由低到高依次为处理编号30、36、23、29、35、 28,处理30、36、23、29、35之间差异不显著,但这5个处理显著低于处理28。
27.由表2还可知,7个处理中成活率范围为0.83~91.33%,处理编号29的成活率最高且极显著高于其它处理。其它处理成活率由高到低依次为处理编号30、28、35、 36、23、31、32,处理30的成活率极显著高于处理28、35、36、23、31、32,处理 28和35之间差异显著。处理3编号5、36、23、31、32的成活率低于56.5%,于实验目的而言,意义不大。因此结合污染率与成活率,筛选出处理29为最佳结果,处理编号30次之。处理编号29成活率可达到91.33%,处
理编号30的成活率可达到82.00%。
28.2.2不同灭菌处理对愈伤组织的影响采用处理29、30获得无菌实生苗,分别取实生苗的叶片和茎段进行愈伤组织诱导。 叶片每个处理接种65个外植体,茎段每个处理接种45个外植体,3次重复。愈伤组织 诱导率结果见表3:表3不同灭菌处理对愈伤组织诱导的影响由表3可知,2种处理下叶片和茎段的愈伤组织诱导率为72.3~94.8%,处理29下以 茎段为外植体的愈伤诱导率最高,处理编号30下以叶片为外植体的诱导率最低。处 理编号29的诱导率略高于处理编号30的诱导率,但诱导率均高于70%。茎段接种约 10d后,外植体两端逐渐膨大、变白,接种约18d后,开始从膨大处长出淡黄色、 疏松易碎的愈伤组织,经继代培养2周后,愈伤组织淡黄色、质地紧密、长势良好。 叶片接种约14d后,外植体开始卷曲、膨大,约20d后,叶片边缘逐渐形成淡黄绿 色、质地紧密的愈伤组织,经继代培养2周后,愈伤组织淡黄色、质地紧密、长势良 好。因此处理编号29、30下的无菌实生苗,其叶片和茎段均可诱导出长势良好的外 植体,且诱导率比较高。
29.通过本发明实验最终得出建立党参再生体系时,种子灭菌的最佳方法为:挑选颗粒饱满,无病虫害的党参种子,称取0.35g(约1000粒),用纱布包裹后,用自来水清洗3-5遍,清洗结束后,自然风干备用。灭菌前将备好的种子包裹于细纱布中,用木夹子收口,再用8-10cm长的细绳系在木夹子上。包裹好种子后用无菌水浸洗2遍,每次2min,然后提细线,将种子从液体中拉出,用酒精浸泡过的镊子,在酒精灯上灼烧冷却后,挤压纱布包的多余水分,至无水滴渗出,随后将种子转入250ml磨口试剂瓶内 (内装60-70ml0.1%氯化汞溶液),迅速塞好瓶塞。顺时针、逆时针反复摇晃60~120s 进行灭菌,接着转入无菌水浸洗3-5遍,每次2min,最后将浸洗过的种子放在无菌滤纸上吸干水份,随即播种。该方法操作简单,成本低廉,灭菌效果极好,对种子的损伤程度低,该方法下制备的外植体愈伤组织诱导率高、长势良好,为党参再生体系的建立奠定了良好的技术基础。
30.本发明实验研究结论为采用方法4进行包裹种子后升汞灭菌60s效果最佳,成活率达到91.3%。污染率为3.8%。灭菌30s发芽率95%以上,15天后污染率50%以上。 120s发芽率50%。180s发芽率20%。240s发芽率0%,杀死种子或种子损伤推迟出苗,出苗率仅为2~3%。
31.1、随着升汞灭菌时间加长,污染率降低,但种子死亡率也升高,180s时,种子死亡率接近98%,240s时几乎全部死亡。
32.2、同等条件下(相同灭菌剂、相同灭菌时长),处理d的种子包裹方法下,灭菌效果最优。
33.3、无论哪种处理下,升汞灭菌达到180s时,死亡率都接近98%,240s时几乎全部死亡,处理a除外,因升汞与铁发生置换反应,将无机汞转换为单质汞,毒性降低,灭菌效果变差。
34.4、处理d显著由于处理c的原因为:摇晃灭菌容器时,木夹在液体中与器壁发生碰撞,引起震荡,使包裹的种子冲洗更彻底。
35.5、处理a接近于处理c,仅次于处理d,但处理a因升汞对铁有腐蚀作用,灭菌后接种的种子周围出现疑似铁锈的物质,虽然没有细菌,真菌等污染出现,但致使种子出苗延迟,生长极其缓慢。
36.以上所述仅是本发明的较佳实施方式,故凡依本发明专利申请范围所述的构造、特征及原理所做的等效变化或修饰,均包括于本发明专利申请范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。